Спосіб одержання [1-алкіл-2-оксо-4-(трифторметил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот
Номер патенту: 120099
Опубліковано: 25.10.2017
Автори: Мельников Сергій Володимирович, Вовк Михайло Володимирович, Сукач Володимир Андрійович
Формула / Реферат
Спосіб одержання [1-алкіл-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот загальної формули:
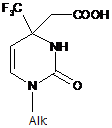 ,
,
де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, СН2=СН-СН2, PhCH2, 4-МеОС6Н4СН2,
який відрізняється тим, що 1-алкіл-4-(трифторометил)-2(1H)-піримідинони вводять у реакцію із малоновою кислотою при нагріванні в толуені при 75-80 °C в присутності органічної основи з наступним виділенням цільових продуктів звичайними методами.
Текст
Реферат: Спосіб одержання [1-алкіл-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот загальної формули: F3 C COOH NH N Alk O , де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, СН2=СН-СН2, PhCH2, 4-МеОС6Н4СН2, причому 1-алкіл-4-(трифторометил)-2(1H)-піримідинони вводять у реакцію із малоновою кислотою при нагріванні в толуені при 75-80 °C в присутності органічної основи з наступним виділенням цільових продуктів звичайними методами. UA 120099 U (12) UA 120099 U UA 120099 U Корисна модель належить до органічної хімії, а саме до способу отримання нових функціональних похідних гетероциклічної системи 1,2,3,4-тетрагідропіримідину загальної формули: F3 C COOH NH N O Alk 5 10 , де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, СН2=СН-СН2, PhCH2, 4-МеОС6Н4СН2. Сполуки даного типу можуть знайти застосування для дизайну та раціонального пошуку нових біологічно активних речовин. Названі сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчими структурними аналогами сполук, які заявляються, є етилові естери 6фторовмісних (2-оксо-1,2,3,4-тетрагідро-4-піримідиніл)оцтових кислот: RF NH O EtO N O R 15 20 25 30 35 40 , де R=Et, Ph, 2,4,6-Cl3C6H2, Ph(Me)CH, C10H7(Me)CH, CH2C(O)OEt. RF=PhCF2, CH2=CHCH2CF2, Представники вказаної гетероциклічної системи в останні роки привертають значну увагу дослідників, що обумовлено широким спектром їх терапевтичних і фармакологічних властивостей. Серед 3,4-дигідропіримідин-2(1H)-онів знайдені ефективні блокатори кальцієвих каналів [1-5], антигіпертензивні [6], протипухлинні [7], протизапальні [8] агенти, а також селективні антагоністи 1а-адренорецепторів [9]. В медико-біологічному аспекті важливими видаються 1,2,3,4-тетрагідропіримідин-2(1H)-они, додатково функціоналізовані фрагментами оцтової кислоти. Зокрема, 3-піримідинілоцтові кислоти та їх похідні є селективними інгібіторами нетрофільної еластази, що робить їх перспективними субстанціями для лікування хронічної обструктивної легеневої хвороби, гострого респіраторного дистресу, бронхоестази та легеневої артеріальної гіпертензії [10-12]. Структурно споріднені до них 1-піримідиніл- та 4піримідинілоцтові кислоти досліджені в значно меншій мірі, хоча видаються цікавими платформами для конструювання потенційно біоактивних сполук. При цьому на особливу увагу заслуговують похідні 4-піримідинілоцтових кислот, у яких гетероциклічне ядро додатково функціоналізоване фторовмісними замісниками, які можуть суттєво позначатись на їх біологічних властивостях [13]. Етилові естери 6-фторовмісних (2-оксо-1,2,3,4-тетрагідро-4-піримідиніл)оцтових кислот зазвичай отримують взаємодію етилового естеру алілкарбонової кислоти із фторованими нітрилами та ізоціанатами [14]. В той же час для синтезу їх 6-незаміщених аналогів знайшла використання реакція Реформатського 1-арил-2(1Н)піримідин-2-онів із алкіловими естерами бромоцтової кислоти [15]. Попри те, що перший метод дозволяє отримувати оригінальні поліфункціональні піримідинони, він відзначається низкою недоліків, до яких належить використання металоорганічних реагентів, зокрема, діізопропіламіду літію. При цьому, утворений в результаті взаємодії останнього із етиловим естером алілкарбонової кислоти єнолят відзначається амбідентним характером і неселективно реагує із фторовмісними нітрилами, що приводить до суміші ізомерних єнаміноестерів, продуктами подальшої взаємодії яких із ізоціанатами поруч із естерами (тетрагідро-4-піримідиніл)оцтових кислот є відповідні похідні урацилів. В результаті виходи цільових продуктів коливаються в межах 35-60 %. Другий метод (реакція Реформатського) також характеризується низькою селективністю і приводить до суміші продуктів приєднання алкоксикарбонілметильних фрагментів по положеннях 4 та 6піримідинового циклу, в якій вміст цільових сполук становить 33-52 %. 1 UA 120099 U Задачею корисної моделі є спосіб отримання нових похідних [2-оксо-4-(трифторометил)1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот загальної формули: F3 C COOH NH N O Alk 5 , де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, СН2=СН-СН2, PhCH2, 4-МеОС6Н4СН2. Спосіб отримання сполук, які заявляються, полягає в тому, що 1-алкіл-4-(трифторометил)2(1H)-піримідинони піддають взаємодії із малоновою кислотою при нагріванні в толуені при 7580 °C в присутності органічної основи. Цільові продукти виділяють із реакційної суміші стандартними методами. Виходи складають 57-73 %. CF3 F3C N + HOOC N O толуен, 75-80 oC COOH -CO2 Alk 10 15 20 25 30 35 40 45 COOH NH N Alk O , де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, CH2=CH-CH2, PhCH2, 4-MeOC6H4CH2. Запропонований спосіб є реалізацією нового підходу до частково гідрованих трифторометилвмісних піримідинових систем, які, завдяки наявності екзоциклічних карбоксиметильних функціональних груп, можуть знайти застосування як оригінальні синтетичні блоки для конструювання біоактивних сполук. Метод є ефективним для синтезу похідних [2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4піримідиніл]оцтових кислот із різноманітними замісниками в положенні 3 піримідинового циклу на основі доступних 1-алкіл-4-(трифторометил)-2(1H)-піримідинонів [16], що вирішує проблему одержання цільових сполук в необхідних як для випробовувань, так і для впровадження об'ємах. З урахуванням того факту, що в літературі описані тільки реакції декарбоксилювального приєднання до ізольованих електрофільних зв'язків [17-19], отриманий результат не був заздалегідь передбачуваним. 1-Заміщені 4-(трифторометил)-2(1H)-піримідинони належать до електрофільних азадієнових систем із спряженими С=С та C=N зв'язками, які можуть бути центрами перебігу органокаталітичної реакції декарбоксилювального приєднання малонової 4 6 кислоти за участю атомів С та С піримідинового ядра. Це, в свою чергу, не виключало формування двох типів продуктів [2-оксо-6-(трифторометил)-1,2,3,4-тетрагідро-4піримідиніл]оцтових кислот та ізомерних до них [2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4піримідиніл]оцтових кислот. Насправді ж реакція відзначається високою регіоселективністю і при використанні як розчинника слабополярного толуену реалізується за схемою декарбоксилювального приєднання за Манніхом, що приводить до [2-оксо-4-(трифторометил)1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот. Індивідуальність та склад синтезованих проміжних та цільових продуктів доведені 1 19 13 результатами хроматомас-спектрометрії, а будова - ІЧ, ЯМР Н, F та С спектрами. Корисна модель ілюструється загальним способом одержання [1-R-2-oкco-4(трифторометил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот та фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання [1-алкіл-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4піримідиніл]оцтових кислот. До розчину 0.01 моль 1-заміщеного 4-(трифторометил)піримідин-2(1H)-ону в 25 мл толуену додавали 0.01 моль триетиламіну (N, N-дiiзопропіл-N-етиламіну або діазабіциклоундекану) та 0.05 моль малонової кислоти і нагрівали при перемішуванні при 75-80 °C впродовж 18-20 год. Із реакційної суміші відганяли розчинник, залишок обробляли 30 мл 0.5 М соляної кислоти та 30 мл дихлорометану. Органічний шар відділяли, промивали 30 мл води та сушили над безводним сульфатом натрію. Розчинник відганяли, залишок кристалізували із 80 %-вого водного ізопропанолу. 2 UA 120099 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 1. 2-[1-Метил-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. Вихід -1 68 %, т. пл. 156-157 °C. ІЧ спектр, , см : 1638, 1706 (С=О), 2501-2640 (СООН), 3276 (N-H). 1 Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 2.64-2.50 м (2Н, СН2), 4.70 с (1Н, СН), 5.46 с (1Н, СН), 13 7.63 с (1Н, СН), 12.52 с (1Н, СООН). Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 33.77, 39.30, 2 1 60.45 кв ( JCF=29.00 Гц, С-4), 63.60, 125.01 кв ( JCF=284.00 Гц, CF3), 134.02, 151.91, 169.40. 19 Спектр ЯМР F (188 МГц, DMSO-d6, м.д.): -82.41 с (CF3). Знайдено, %: С 49.23; Н 3.73; N 11.63. + [М+1] 239. C8H9F3N2O3 Вирахувано, %: С 49.34; Н 3.81; N 11.76. М 238.16. Приклад 2. 2-[1-Етил-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. Вихід -1 62 %, т. пл. 154-155 °C. ІЧ спектр, , см : 1639, 1704 (С=О), 2507-2641 (СООН), 3272 (N-H). 1 3 Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 1.01 т (3Н, JHH=6.8 Гц, СН3), 2.50-2.60 м (2Н, СН2), 3 3 3.68 м (2Н, СН2), 4.71 д (1Н, JHH=7.6 Гц, СН), 6.50 д (1Н, JHH=7.2 Гц, СН), 7.55 с (1Н, NH), 12.45 13 с (1Н, СООН). Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 14.20, 38.88, 40.92, 60.36 кв 2 1 ( JCF=35.00 Гц, С-4), 94.07, 125.11 кв ( JCF=356.25 Гц, CF3), 132.86, 151.48, 169.50. Спектр 19 + ЯМР Р(188 МГц, DMSO-d6, м.д.): -82.43 с (CF3). Знайдено, %: С 42.65; Н 4.47; N 11.03. [М+1] 253. C9H11F3N2O3. Вирахувано, %: С 42.86; Н 4.40; N 11.11. М 252.07. Приклад 3. 2-[1-Ізобутил-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. -1 Вихід 57 %, т. пл. 159-160 °C. ІЧ спектр, , см : 1642, 1704 (С=О), 2503-2638 (СООН), 3270 (N1 3 H). Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 0.80 т (6Н, JHH=5.6 Гц, СН3), 1.81 м (1Н, СН), 2.503 2.70 м, (2Н, СН2), 3.01 м (1Н, СН2), 3.32 м (3Н, СН2), 4.65 д (1Н, JHH=8.0 Гц, СН), 6.47 д (1Н, 3 13 JHH=8.0 Гц, СН), 7,58 с (1Н, NH), 12.46 с (1Н, СООН). Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 2 1 19.38, 27.78, 38.65, 52.89, 60.15 кв ( JCF=28.75 Гц, С-4), 93.14, 125.14 кв ( JCF=331.25 Гц, CF3), 19 133.60, 151.51, 169.26.Спектр ЯМР F (188 МГц, DMSO-d6, м.д.): -82.43 с (CF3). Знайдено, %: С + 47.27; Н 5.24; N 10.13. [М+1] 281. C11H15F3N2O3. Вирахувано, %: С 47.14; Н 5.39; N 10.00. М 280.10. Приклад 4. 2-[1-Метоксиетил-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. -1 Вихід 59 %, т. пл. 109-110 °C. ІЧ спектр, , см : 1640, 1707 (С=О), 2503-2640 (СООН), 3274 (N1 H). Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 2.50-2.70 м (2Н, СН2), 3.23-3.57 м (7Н, СН2, СН3), 3 3 4.68 д (1Н, JHH=8.0 Гц, СН), 6,47 д (1Н, JHH=8.4 Гц, СН), 7.63 с (1Н, NH), 12.46 с (1Н, СООН). 13 2 Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 38.74, 45.46, 58.11, 60.13 кв ( JCF=28.75 Гц, С-4), 1 19 70.40, 93.33, 124.98 кв ( JCF=286.25 Гц, CF3), 133.62, 151.45, 169.29. Спектр ЯМР F(188 МГц, + DMSO-d6, м.д.): -82.34 с (CF3). Знайдено, %: С 42.38; Н 4.53; N 10.01. [М+1] 283. C10H13F3N2O4. Вирахувано, %: С 42.56; Н 4.64; N 9.93. М 282.08. Приклад 5. 2-[1-Аліл-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. Вихід -1 73 %, т. пл. 162-163 °C. ІЧ спектр, , см : 1638, 1704 (С=О), 2505-2638 (СООН), 3270 (N-H). 1 Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 2.56-2.70 м (2Н, СН2), 3.99 м (2Н, СН2), 4.73 д (1Н, 3 3 JHH=7.6 Гц, СН2), 5.10 м (2Н, СН, СН2), 5.76 м (1H, СН), 6.40 д (1Н, JHH=8.0 Гц, СН), 7.67 с (1Н, 13 NH), 12.47 с (1H, СООН). Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 38.73, 47.70, 60.40 кв 2 1 ( JCF=28.75 Гц, С-4), 94.05, 115.61, 125.01 кв ( JCF=286.25 Гц, CF3), 132.93, 134.20, 151.33, 19 169.39. Спектр ЯМР F (188 МГц, DMSO-d6, м.д.): -82.37 с (CF3). Знайдено, %: С 45.32; Н 4.28; N + 10.55. [М+1] 265. C10H11F3N2O3. Вирахувано, %: С 45.46; Н 4.20; N 10.60. М 264,07. Приклад 6. 2-[1-Бензил-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова кислота. -1 Вихід 68 %, т. пл. 200-202 °C. ІЧ спектр, , см : 1639, 1707 (С=О), 2510-2642 (СООН), 3271 (N1 3 H). Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 2.56-2.77 м (2Н, СН2), 4.60 кв (2Н, JHH=24.0 Гц, 3 3 СН2), 4.754 д (1Н, JHH=6.4 Гц, CH), 6.52 д (1Н, JHH=7.6 Гц, СН), 7.23-7.32 м (5Н, СН), 7.77 с (1Н, 13 NH), 12.56 с (1Н, СООН). Спектр ЯМР С (125 МГц, DMSO-d6, м.д.): 38.65, 48.74, 6.45 кв 2 1 ( JCF=36.25 Гц, С-4), 94.37, 125.01 кв ( JCF=353.75 Гц, CF3), 126.74, 127.04, 128.45, 133.22, 19 138.43, 151.70, 169.46. Спектр ЯМР F (188 МГц, DMSO-d6, м.д.): -82.31 с (CF3). Знайдено, %: С + 53.68; Н 4.14; N 8.98. [М+1] 315. C14H13F3N2O3. Вирахувано, %: С 53.51; Н 4.17; N 8.91. М 314,26. Приклад 7. 2-[1-(4-Метоксибензил)-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідропіримідин-4-іл]оцтова -1 кислота. Вихід 59 %, т. пл. 159-160 °C. ІЧ спектр, , см : 1636, 1709 (С=O), 2508-2639 (СООН), 1 3271 (N-H). Спектр ЯМР Н (400 МГц, ДМСО-d6, м.д.): 2.55-2.72 м (2Н, СН2), 3.73 с (3Н, СН3), 3 3 3 4.51 м (2Н, СН2), 4.74 д (1Н, JHH=8.0 Гц, СН), 6.49 д (1Н, JHH=8.0 Гц, СН), 6.88 д (2Н, JHH=8.0 3 13 Гц, СН), 7,16 д (2Н, JHH=8.4 Гц, СН), 7.71 с (1Н, NH), 12.45 с (1Н, СООН). Спектр ЯМР С (125 3 UA 120099 U 2 5 10 15 20 25 30 35 40 45 50 55 60 МГц, DMSO-d6, м.д.): 38.63, 48.03, 55.01, 60.32 кв ( JCF=27.50 Гц, С-4), 94.20, 113.77, 124.92 кв 1 19 ( JCF=285.00 Гц, CF3), 128.23, 130.15, 132.93, 151.58, 158.36, 169.30. Спектр ЯМР F (188 МГц, + DMSO-d6, м.д.): -82.32 с (CF3). Знайдено, %: С 52.45; Н 4.30; N 8.23. [М+1] 345. C15H15F3N2O4. Вирахувано, %: С 52.33; Н 4.39; N 8.14. М 344,29. Джерела інформації: 1. Huang Y., Yang F., Zhu C. Higly enantioselective Biginelly reaction using a new chiral ytterbium catalysts: asymmetric synthesis of dihydropyrimidines //J. Amer. Chem. Soc. - 2005. - Vol. 127. - P. 16386-16387. 2. Kappe C.O. Recent advances in the Biginelly dihydropyrimidines synthesis. New trick from an old dog // Ace.Chem. Res. - 2000. - Vol. 33 № 2. - P. 879-888. 3. Kappe C.O. Biologically active dihydropyrimidones of the Biginelli-type-a literature survey // Eur. J. Med. Chem. - 2000. - Vol.35, № 12. - P. 1043-1045. 4. Uray G., Verdino P., Belay F., Kappe C.O., Fabian W.M.F. Absolute configuration in 4-alkyl-and 4-aryl-3,4-dihydro-2(1H)-pyrimidones: a combined theoretical and experimental investigation // J. Org. Chem. – 2001-Vol. 66, № 20. - P. 6685-6694. 5. Kagu В., Tian D., Chin G., Nagarathnam D., Fang J., Chen Q., Forray C, Ranson R.W., Chang R.S.L., Vyas K.P., Zhang K., Gluchowski С Synthesis and evaluation of furo[3.4-d]pyrimidinones as selective α1a-adrenergic receptor antagonists // Bioorg. Med. Chem. Lett. - 2000. - Vol.10, № 2. - P. 175-178. 6. Rovnyak G.C., Atwal K.S., Hedberg A., Kimball S.D., Moreland S., Gouyoutas J.Z., O" Reilly B.C., Schwatz J., Molley M.F. Digidropyrimidine calcium channol blockers. 4. Basic 3-substituted-4aryl-1,4-dihydropyrimidine-5-carboxyc acid esters. Potent antihypertensive agents // J. Med. Chem. 1992. - Vol. 35, № 17. - P. 3254-3263. 7. Mayer T.U., Kapoor T.M., Haggarty S.J., King R.W., Schreiber S.L., Mitchinson T.J. Small molecule inhibitor of mitotic spindle bipolarity identified in a phenotype-based screen // Science. 1999. - № 5441. - P. 971-974. 8. Sanakandam Y.S., Shetty M.M., Diwan P.V. Synthesis and biological evaluation of new 3,4dihydro-6-methyl-5-N-methylcarbamoyl-4-substituted phenyl)-2H-pirimidones and pyrimidinethiones // Bioorg. Med. Chem. Lett. 1992. - Vol. 27, № 1. - P. 87-92. 9. Nagarathnam D., Miao S.W., Lagu В., Chiu G., Fang J., Dhar T.G.M., Zhang J., Tyagarajan S., Marzabadi M.R., Zhang F., Woug W.C., Sun W., Tian D., Wetzel J. M., Forray C, Chang R. S. L., Broten T. P., Ranson R. W., Schort T.W., Chen Т. В., О" Malley S., Kling P., Shenk K., Bendersky R., Harrell С.М., Vyas K. P., Gluckowski С Design and synthesis of novel α-1a adrenoreceptor Selective Antagonists. 1. Structure-activity Relationship in Dihydropyrimidinones // J. Med. Chem. - 1999. - Vol. 42, № 23. - P. 4764-4777. 10. Von Nussbaum F., Li V.M.-L, Allerheilgen S., Anlauf S., Bartacker L., Bechem M., Delbeck M., Fitzgerald M.F., Gerisch M., Gielen-Haertwig H., Haning H., Karthous D., Lang D., Lustig K., Meibom D., Mittendorf J., Rosentreter U., Schafer M., Schafer S., Schamberger J., Telan L.A., Tersteegen A. Freezing the bioactive conformation to boost potency: the identification of BAY 85-8501, a selective and potent inhibitor of human neutrophil for pulmonary deases // Chem. Med. Chem. - 2015. - Vol. 10. - P. 1163-1173. 11. Пат. 20100010024 (A1) US. Use of 1,4-diaryl-dihydropyrimidine-2-ones for treating pulmonary arterial pulmonary hypertension / F. Von Nussbaum, H. Gielen-Haertwig, M. Klein, W.M.-J. Li, D. Meibom, P. Sander, L. Klemens, S. Schafer; заявл. 25.07.2007; опубл. 14.01.2010 [Електронний ресурс]. - Режим доступу: http://patentscope.wipo.int/search/en/. 12. Пат. 20110034433 (A1) US. 4-(4-Cyano-2-thioaryl)dihydropyrimidones and their use/ F. Von Nussbaum, D. Karthaus, S. Anlauf S., M. Delbeck, W.M.-J. Li, D. Meibom, K. Lustig, J. Schomberger; заявл. 09.12.2008; опубл. 10.02.2011 [Електронний ресурс]. - Режим доступу: http://patentscope.wipo.int/search/en/. 13. Hagmann W.K… The many roles for fluorine in medicinal chemistry // J. Med. Chem. - 2008. Vol. 51, № 15. - P. 4359-4369. 14. Fustero S., Catalan S., Acena J.L., del Pozo C. A new strategy for the synthesis of fluorinated 3,4-dihydropyrimidones // J. Fluor. Chem. - 2009. - Vol. 130. - P. 1145-1150. 15. Katon A., Omote Y., Kashima C. The Reformatsky Reaction of 1-Aryl-2(1H)-pyrimidones // J. Heterocycl. Chem. - 1984, Vol. 21. - P. 53-55. 16. Zanatta N., Faoro D., Fernandes L. da S., Brondani P., Flores D.C., Flores A.F.C., Bonacorso H.G., Martins M.A.P. Comperative Study of the Chemoselectivity and Yields of the Synthesis of NAlkyl-4-(trihalomethyl)-1H-pyrimidin-2-ones // Eur. J. Org. Chem. - 2008. - P.5832-5836. 17. Nakamura S. Catalytic enantioselective decarboxylative reactions using organocatalysts // Org. Biomol. Chem. - 2014. - Vol. 12. - P. 394-405. 4 UA 120099 U 5 18. Fujii M., Terao Y., Sekiya M. Decarboxylation Reactions. II. Reaction of Conjugated Unsaturated Ketons // Chem. Pharm. Bull. - 1974. - Vol. 22, № 11. - P. 2675-2679. 19. Maison W., Kosten M., Charpy A., Kintscher-Langenhagen J., Schlemminger I., Lutzen A., Westerhoff O., Martens J. The synthesis of Novel Cyclic β-amino Acids as Intermediates for the Preparation of Bicyclic β-Lactams // Eur. J. Org. Chem. - 1999. - № 9. - P. 2433-2441. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 Спосіб одержання [1-алкіл-2-оксо-4-(трифторометил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот загальної формули: F3 C COOH NH N O Alk 15 , де Alk=Me, Et, CH2CH(CH3)2, MeOCH2CH2, СН2=СН-СН2, PhCH2, 4-МеОС6Н4СН2, який відрізняється тим, що 1-алкіл-4-(трифторометил)-2(1H)-піримідинони вводять у реакцію із малоновою кислотою при нагріванні в толуені при 75-80 °C в присутності органічної основи з наступним виділенням цільових продуктів звичайними методами. Комп’ютерна верстка О. Рябко Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 239/10, C07B 53/00
Мітки: одержання, кислот, 1-алкіл-2-оксо-4-(трифторметил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових, спосіб
Код посилання
<a href="https://ua.patents.su/7-120099-sposib-oderzhannya-1-alkil-2-okso-4-triftormetil-1234-tetragidro-4-pirimidiniloctovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання [1-алкіл-2-оксо-4-(трифторметил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот</a>
Попередній патент: Спосіб одержання [3-алкіл-2-оксо-6-(трифторметил)-1,2,3,4-тетрагідро-4-піримідиніл]оцтових кислот
Наступний патент: 4-арил-1-феноксиметил-5,6,7,8-тетрагідро-2,2a,8a-триазациклопента[cd]азулени, що мають протипухлинну активність
Випадковий патент: Кабель волоконно-оптичний пожежостійкий











