Комбінований гіпотензивний засіб
Номер патенту: 47532
Опубліковано: 10.02.2010
Формула / Реферат
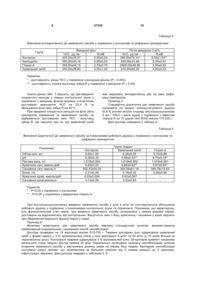
1. Комбінований гіпотензивний засіб, що містить амлодипін, лізиноприл та допоміжні формоутворюючі речовини, який відрізняється тим, що додатково містить індапамід при наступному співвідношенні компонентів на одну дозовану форму (мг):
амлодипін
4,5-5,5
лізиноприл
4,5-5,5
індапамід
2,25-2,75
допоміжні формоутворюючі речовини
решта.
2. Засіб за п. 1, який відрізняється тим, що виконаний у твердій дозованій формі для перорального застосування.
3. Засіб за пп. 1, 2, який відрізняється тим, що допоміжні формоутворюючі речовини необов'язково можуть бути вибрані з переліку:
целюлоза мікрокристалічна, лактози моногідрат, крохмаль картопляний, кальцію стеарат або інші фармацевтично прийнятні речовини.
Текст
1. Комбінований гіпотензивний засіб, що містить амлодипін, лізиноприл та допоміжні формоутворюючі речовини, який відрізняється тим, що додатково містить індапамід при наступному співвідношенні компонентів на одну дозовану форму (мг): амлодипін 4,5-5,5 3 Пороте наявність атенололу у складі амлодаку-АТ до побічних ефектів амлодипіну додає небажаної побічної дії, такої як, підвищення концентрації печінкових ферментів та/або білірубіну у сироватці крові, психози, діарея, псоріазоформний сип, тромбоцитопенія, порушення зору, розвиток вовчаночного синдрому тощо. Відомий гіпотензивний засіб лізиноприл [3] у таблетованій формі з вмістом діючої речовини 5 мг або 10 мг або 20 мг. Лізиноприл є інгібітором ангіотензинперетворюючого ферменту (АПФ). Препарат знижує артеріальний систолічний та діастолічний тиск, опір ниркових судин, поліпшує кровообіг у нирках. Проте даний препарат не може бути засобом мототерапії внаслідок вузької спрямованості фармакологічної дії. Лізиноприл має широкий перелік дозозалежних побічних ефектів з боку серцево-судинної, кровоутворюючої, лімфатичної, сечостатевої, дихальної систем та кишковошлункового тракту. Препарат може провокувати порушення функції нирок і викликати шкірні, алергічні та імунопатологічні реакції. Існує комбінований засіб лізоретик [4] у формі таблеток, який містить лізиноприл (10 мг) у сполученні з тіазидним діуретиком гідрохлортіазидом (12,5 мг). Останній є сульфонамідним похідним і проявляє салуретичну гіпотензивну дію, підвищує виведення з сечею натрію та води з організму, інгібує реабсорбцію іонів натрію та хлору переважно у дистальних ниркових канальцях. Поряд з позитивною дією гідрохлортіазид, що входить до складу лізоретику, додатково підсилює негативну побічну дію відомого засобу, внаслідок чого можливі диспепсичні явища, панкреатит, шкірні прояви алергічних реакцій, порушення зору та вуглеводного обміну тощо. Підвищений вміст лізиноприлу також посилює побічний ефект препарату в цілому. В якості прототипу і препарату порівняння заявленого засобу вибрано комбінований гіпотензивний препарат гіприл-А [5] у формі таблеток, до складу якого входять по 5 мг амлодипіну і лізиноприлу. Виходячи з відомої вищенаведеної дії цих компонентів, гіприл-А призначають у комплексній терапії АГ. Проте дія відомого препарату обмежується сумарною дією його компонентів (блокатор кальцієвих каналів та інгібітор АПФ) і є недостатньою для використання гіприлу-А в якості засобу мототерапії АГ. Побічна дія гіприлу-А складається з відомих побічних дій його компонентів: амлодипіну та лізиноприлу. Завдання корисної моделі полягає у створенні нового гіпотензивного засобу, в якому завдяки введенню в якості додаткового компонента діуретика нового покоління - індапаміду - при заданому співвідношенні всіх компонентів, досягається оптимальна низькодозова комбінація активних речовин з різною спрямованістю дії, що охоплює найбільший діапазон критеріїв стратифікації ризику і дозволяє рекомендувати заявлений засіб як ефективний монозасіб при терапії АГ, який відрізняється низькою 47532 4 токсичністю, відсутністю виражених алергічних реакцій та є нешкідливим при тривалому застосуванні. Поставлене завдання вирішується таким чином, що комбінований гіпотензивний засіб, що містить амлодипін, лізиноприл та допоміжні формоутворюючі речовини, у відповідності з корисною моделлю додатково містить індапамід при наступному співвідношенні компонентів на одну дозовану форму (мг): амлодипін 4,5 - 5,5 лізиноприл 4,5 - 5,5 індапамід 2,25 - 2,75 допоміжні формоутворюючі ререшта човини Корисною моделлю передбачено, що заявлений засіб виконаний у твердій лікарській формі для перорального застосування. Згідно з корисною моделлю допоміжні формоутворюючі речовини заявленого засобу необов'язково можуть бути вибрані з переліку: целюлоза мікрокристалічна, лактози моногідрат, крохмаль картопляний, кальцію стеарат. Якісний та кількісний вміст компонентів заявленого засобу визначений експериментальним шляхом. Згідно з корисною моделлю до заявленого засобу введено індапамід - перший представник нового класу антигіпертензивних / діуретичних засобів - індолів. Індапамід [6] є сульфонамідним похідним, який фармакологічно близький до тіазидних діуретиків і призначається для лікування АГ. Завдяки багатобічному механізмові дії індапамід знижує артеріальний тиск, але не викликає суттєвого підвищення діурезу. Препарат діє на рівні нирок і судин. Судинний механізм дії обумовлений зниженням скорочуваності гладких м'язів у зв'язку з впливом на трансмембранний іонний обмін (зокрема, зниженням внутрішньоклітинного транспорту кальцію) та стимуляцією синтезу простагландіну Е2 який має судиннорозширюючу і гіпотензивну дію. Препарат проявляє помірний діуретичний та салуретичний ефект. Проте поряд з позитивними властивостями індапамід має досить широкий перелік побічних ефектів: вертиго, парестезії, головний біль, втомлюваність, слабкість, болі у м'язах, нудота, сухість у роті, алергічні дерматологічні реакції тощо. Вибір індапаміду в якості додаткового діючого компонента заявленого засобу обумовлений його здатністю у новій сукупності компонентів підсилювати гіпотензивну дію амлодипіну та лізиноприлу, не мати негативного впливу на метаболізм ліпідів і вуглеводний обмін, сприяти неочевидному зниженню токсичності та побічної дії заявленого засобу в цілому. Заявлена комбінація трьох антигіпертензивних засобів є раціональною і дозволяє підвищити ефективність лікування за рахунок використання різних механізмів дії, дозволяє досягти потенціювання дії компонентів, збільшення тривалості дії засобу та зниження частоти побічних ефектів і токсичності як за рахунок 5 47532 неочевидної взаємодії, так і в результаті використання кожного з компонентів у низьких дозах. Згідно з корисною моделлю амлодипін та лізиноприл використовують у дозі [4,5- 5,5] мг на одну дозовану форму. Переважно 5,0 мг. Зменшення вмісту цих компонентів від 4,5 мг на прийом призводить до зниження фармакологічної дії, а збільшення дози понад 5,5 мг може призвести до посилення сумарної побічної дії та є нераціональним з економічних міркувань. Заявлений засіб може містити індапамід у кількості [2,25 - 2,75] мг на дозовану форму. Переважно 2,5 мг. Така добова доза є необхідною і достатньою для досягнення вираженого і пролонгованого гіпотензивного та слабкого діуретичного ефектів засобу. Окремі компоненти засобу відомі і дозволені до використання у фармації та медицині. Проте заявлене сполучення вибраних компонентів з відповідним кількісним вмістом в одній лікарській формі є новим, не відомим з джерел інформації. Авторами доведено неочевидний ефект мінімізації токсичності та побічної дії заявленого засобу при поєднанні у ньому компонентів, кожен з яких має негативну побічну дію. Доклінічні дослідження заявленого засобу довели, що він є малотоксичним препаратом, в умовах гострого і хронічного досліду не викликає патоморфологічних змін у внутрішніх органах дослідних тварин, не має місцевої подразнюючої та алергізуючої дії, проявляє виражену антигіпертензивну та протиаритмічну активність і може безпечно застосовуватися протягом тривалого часу. Заявлений засіб може бути виконаний у будьякій твердій дозованій формі для перорального застосування з фіксованим вмістом ефективних добових доз діючих компонентів. Це забезпечує зручність вживання лікувального засобу, запобігає передозуванню, дозволяє здійснювати монотерапію АГ. Вибір допоміжних формоутворюючих речовин здійснюють, виходячи з умов їх фармацевтичної придатності, безпечності, відсутності взаємодії між собою та з діючими речовинами, здатності сприяти підвищенню біодоступності засобу, забезпечення очікуваних фізико-хімічних та органолептичних властивостей лікарської форми, її стабільності та терміну зберігання. Заявлений засіб у твердій лікарській формі для перорального застосування (таблетки, капсули тощо) може бути одержаний за стандартними технологіями у відповідності з вимогами ДФУ. Корисна модель ілюструється прикладами. 6 Приклад 1. Для одержання заявленого засобу у формі таблеток відважили діючі речовини: по 5 г амлодипіну у формі амлодипіну бензилату і лізиноприлу у формі лізиноприлу дигідрату та 2,5 г індапаміду. Додали допоміжні речовини: 14,0 мг целюлози мікрокристалічної, 84,1 г лактози моногідрату (67,3 г - M80, 16,8 г - М200), 28 г крохмалю картопляного та 1,4 г кальцію стеарату. Збільшення маси компонентів на технологічні втрати не наведено. З ретельно перемішаної таблеткової маси методом прямого пресування на таблетковому пресі одержали 1000 таблеток масою 140 мг наступного складу (мг): амлодипін 5,0 лізиноприл 5,0 індапамід 2,5 целюлоза мікрокристалічна 14,0 лактози моногідрат 84,1 крохмаль картопляний 28,0 кальцію стеарату 1,4 Одержані таблетки за своїми фізико-хімічними та ергономічними властивостями відповідають вимогам ДФУ. Приклад 2. Гостру токсичність заявленого засобу при одноразовому внутрішньошлунковому введенні вивчали на двох видах статевозрілих тварин -42 білих мишах масою 23-37 г та 9 білих щурах масою 200-340 г. У дослідах використовували порошкоподібний склад всіх компонентів таблетки заявленого засобу у вигляді 0,1-20 % завису на 3 % свіжоприготованому крохмальному слизу. Одержаний слиз через зонд вводили до шлунку мишей у зростаючих дозах від максимально переносимої до абсолютно смертельної. За показником загибелі мишей визначали максимально переносиму, середньосмертельну (ДЛ50) та абсолютно смертельну (ДЛ100) дозу. Вивчення гострої токсичності заявленого засобу на щурах при внутрішньошлунковому введенні проводили за експресним методом І.В. Саноцького [7], який дозволяє провести дослідження на обмеженій кількості тварин. При цьому кожна зі зростаючих доз засобу вводиться одному щуру одноразово внутрішньошлунково. За ДЛ50 приймається найменша доза, що викликає загибель тварин. Великі дози, які перевищували максимальний об'єм рідини для внутрішньошлункового введення мишам (0,5 мл) та щурам (5 мл), вводили дрібно з інтервалом 1 год. Дані досліду наведенні у таблиці 1. Таблиця 1 Дослідження гострої токсичності заявленого засобу Умови досліду Миші Щурі Токсикометричні параметри Максимально-переносима доДЛ50, г/кг за, г/кг 0,05 1,3 5,00 6,0 ДЛ100, г/кг 3,5 Термін загибелі тварин 1-24 години 12-24 години 7 47532 У відповідності з ДЛ50 заявлений засіб відноситься до IV класу токсичності для мишей (ДЛ50 в інтервалі 0,5-5,0 г/кг), тобто до малотоксичних речовин, і до V класу токсичності для щурів (ДЛ50 в інтервалі 5,0-15,0 г/кг), тобто до практично нешкідливих речовин, згідно класифікації Сидорова К.К. [8]. Дослід свідчить про наявність у тварин видової чутливості до заявленого засобу (миші > щури), що є підставою для безпечної екстраполяції одержаних даних на більш високоорганізованих тварин і на людину. Проведено також вивчення хронічної токсичності заявленого засобу у дослідах на 20 щурах протягом 6 місяців. В умовах 180-денного введення заявленого засобу загальний стан, у тому числі поведінка, дослідних тварин не змінився. Не виявлено негативних реакцій з боку центральної нервової системи. Проведені після завершення досліду морфологічні дослідження внутрішніх органів дослідних тварин свідчать про відсутність будь-яких значних відхилень від норми. Дослідження встановили позитивний вплив заявленого засобу на стан печінки, відсутність порушень функціонального стану нирок, відсутність змін з боку серцево-судинної системи, відсутність гематоксичної дії. 8 Таким чином, експериментально доведено низьку токсичність заявленого засобу, як при короткому, так і при тривалому застосуванні, в той час, як кожен з активних компонентів, що входить до складу заявленого засобу, має широкий спектр побічних ефектів. Приклад 3. Специфічну антигіпертензивну дію заявленого засобу у терапевтичній дозі 4 мг/кг вивчали на 18 щурах лінії WAG масою 200-350 г. В якості препарату порівняння було обрано гіпотензивний засіб гіприл-А у дозі 0,6 мг/кг. Модельну гіпертензію викликали внутрішньочеревною ін'єкцією розчину кофеїнбензоату натрію у дозі 24 мг/кг. Дослідних тварин було поділено на групи: контроль та дві групи тварин, які до введення кофеїн-бензоату натрію одержали відповідно заявлений засіб та препарат порівняння. Артеріальний тиск (AT) вимірювали шляхом реєстрації вихідного пульсу на хвостовій артерії щурів у момент перетискання судин та у момент відновлення кровотоку, що відповідає рівню систолічного артеріального тиску. Результати досліду наведені у таблиці 2. Таблиця 2 Вивчення антигіпертензивної дії заявленого засобу у порівнянні з контролем та референс-препаратом Група Контроль Гіприл-А Заявлений засіб Вихідний фон 106,67±6,05 110,83±4,92 111,67±4,08 Артеріальний тиск, мм.рт.ст. Після введення кофеїн-бензоату натрію 155,83±4,91* 128,33±8,16*,** 130,83±6,64*,** Примітки: * - Р £ 0,05 достовірно у порівнянні з вихідним фоном. ** - Р £ 0,05 достовірно у порівнянні з контролем. Введення кофеїн-бензоату натрію тваринам контрольної групи викликало статистичне достовірне збільшення AT у порівнянні з вихідним фоном на 46 %. У тварин, які попередньо одержали заявлений засіб або препарат порівняння, ін'єкція кофеїнбензоату натрію викликала достовірне зростання AT на 16-17 %. Дані досліду свідчать, що заявлений засіб має виражену антигіпертензивну дію на рівні препарату порівняння. Приклад 4. Специфічну антиаритмічну дію заявленого засобу вивчали на 30 щурах лінії WAG масою 170210 г на моделі хлоридкальцієвої аритмії шляхом внутрішньочеревного введення 10% розчину хлориду кальцію у дозі 200 мг/кг. Після введення аритмогену відмічали на електрокардіограмі (ЕКГ) частоту серцевих скорочень (ЧСС), екстрасистоли, фібриляції шлуночків та їх зміни після введення досліджуваних препаратів. Антиаритмічну дію заявленого засобу у дозі 4 мг/кг вивчали у порівнянні з амлодипіном (0,3 мг/кг) та гіприлом-А (06, мг/кг). Дані досліду наведені у таблиці 3. 9 47532 10 Таблиця 3 Вивчення антиаритмічної дії заявленого засобу у порівнянні з контролем та референс-препаратами Група Контроль Амлодипін Гіприл-А Заявлений засіб Вихідний фон ЧСС, уд./хв R,мВ 335,00±35,07 5,50±0,54 350,00±45,16 2,50±0,54 355,00±44,15 2,33±0,75 300,00±26,83 4,50±1,04 Після введення СаСl2 ЧСС, уд./хв R,мВ 260,00±70,14* 8,00±1,54** 345,00±31,46 2,33±0,51 3500,00±48,98 3,50±0,83 315,00±62,20 4,00±0,б3 Примітки: * - достовірність різнці ЧСС у порівнянні з вихідним фоном (Р £ 0,050). ** - достовірність різниці вольтажу зубця R у порівнянні з вихідним (Р £ 0,05). Аналіз даних табл. 3 свідчить, що при введенні хлористого кальцію у тварин контрольної групи у порівнянні з вихідним фоном виникає статистичне достовірне зменшення ЧСС на 22,4 % та збільшення вольтажу зубця R на 45 %. При введенні хлористого кальцію на фоні обох препаратів порівняння та заявленого засобу не відбувається достовірних змін ЧСС і вольтажу зубця R. Це свідчить про те, що заявлений засіб має виражену антиаритмічну дію на рівні референс-препаратів. Приклад 5. Специфічну діуретичну дію заявленого засобу оцінювали на моделі хлорид-натрієвого діурезу (0,9 % розчин натрію хлориду внутрішньошлунково 5 мл / 100,0 г маси щура) у порівнянні з ефектом гіприлу-А на 15 щурах лінії WAG масою 170-220 г. Дані досліду наведенні у таблиці 4. Таблиця 4 Вивчення діуретичної дії заявленого засобу за показниками добового діурезу у порівнянні з контролем та референс-препаратом Показники Об'єм сечі, мл рН Питома вага, г/л Креатинін сечі, ммоль/доб. Сечовина сечі, ммоль/л Білок, г/л Креатинін крові, ммоль/доб. Сечовина крові,ммоль/л Контроль 9,50±1,00 6,26±0,35 1,019±0,004 6,65±0,52 352,43±50,35 0,21±0,08 0,03±0,004 4,12±0,58 Групи тварин Заявлений засіб 9,26±0,50 5,98±0,34** 1,019±0,002 6,66±0,62** 360,59±61,18 0,19±0,02 0,03±0,007 4,20±0,83 Гіприл-А 9,70±0,86 6,70±0,18* 1,019±0,001 5,67±0,60* 394,78±15,52 0,26±0,06 Примітки: * - Р
ДивитисяДодаткова інформація
Назва патенту англійськоюCombined hypotensive composition
Автори англійськоюTrutaiev Ihor Viktorovych, Strilets Oksana Petrivna
Назва патенту російськоюКомбинированное гипотензивное средство
Автори російськоюТрутаев Игорь Викторович, Стрелец Оксана Петровна
МПК / Мітки
МПК: A61K 31/215, A61P 9/02, A61P 9/12, A61K 31/7042, A61K 31/18
Мітки: комбінований, засіб, гіпотензивний
Код посилання
<a href="https://ua.patents.su/7-47532-kombinovanijj-gipotenzivnijj-zasib.html" target="_blank" rel="follow" title="База патентів України">Комбінований гіпотензивний засіб</a>
Попередній патент: Фармацевтична композиція з гіпотензивною дією
Наступний патент: Спосіб готування жєлє гранульованого “ікра альгінова” (солодкого смаку)
Випадковий патент: Спосіб ультрасонографічного визначення лікувальних позицій-укладань для хворих із вертебро-базилярною недостатністю