Спосіб і проміжні сполуки для одержання піридин-2,3-дикарбоксилатів та імідазолінових гербіцидів
Формула / Реферат
1. Спосіб одержання сполуки формули І
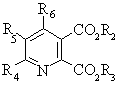 , (I)
, (I)
де:
R4 та R6 незалежно означають водень, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл;
R5 означає водень, галоген та С1-С6алкіл, необов'язково заміщений однією або кількома С1-С4алкоксигрупами, С1-С6алкеніл, феніл або заміщений феніл;
R2 та R3 незалежно означають С1-С6алкіл, феніл або заміщений феніл,
який включає взаємодію сполуки формули II або її солі лужного металу
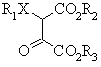 , (II)
, (II)
де:
Х означає кисень або сірку;
R1 означає С1-С6алкіл, феніл або заміщений феніл;
R2 та R3 мають ті самі значення, як описано для формули І,
принаймні з одним молярним еквівалентом сполуки формули III
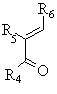 , (III)
, (III)
де R4, R5 та R6 мають ті самі значення, як описано для формули І,
з джерелом аміаку в присутності розчинника.
2. Спосіб за п. 1, який відрізняється тим, що джерелом аміаку є сіль амонію.
3. Спосіб за п. 1, який відрізняється тим, що температура становить близько 25-185°С.
4. Спосіб одержання сполуки формули І
 , (I)
, (I)
де:
R4 та R6 незалежно означають водень, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл;
R5 означає водень, галоген та С1-С6алкіл, необов'язково заміщений однією або кількома С1-С4алкоксигрупами, С1-С6алкеніл, феніл або заміщений феніл;
R2 та R3 незалежно означають С1-С6алкіл, феніл або заміщений феніл,
який включає взаємодію сполуки формули IV
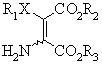 , (IV)
, (IV)
де:
X означає кисень або сірку;
R1 означає С1-С6алкіл, феніл або заміщений феніл;
R2 та R3 мають ті самі значення, як описано для формули І,
принаймні з одним молярним еквівалентом сполуки формули III
 , (III)
, (III)
де R4, R5 та R6 мають ті самі значення, як описано для формули І,
в присутності розчинника.
5. Спосіб за п. 1 або 4, який відрізняється тим, що Х означає кисень, R1 означає метил, етил або феніл, R4 та R6, незалежно означають водень, R5 означає водень, метил, етил або метоксиметил.
6. Спосіб за п. 1 або 4, який відрізняється тим, що розчинником є ароматичний вуглеводень, алканол або їх суміш.
7. Спосіб за п. 6, який відрізняється тим, що розчинником є толуол, етанол або їх суміш.
8. Сполука формули IV
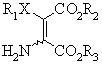 , (IV)
, (IV)
де:
X означає кисень або сірку;
R1 означає С1-С6алкіл, феніл або заміщений феніл;
R2 та R3 незалежно означають С1-С6алкіл, феніл або заміщений феніл.
9. Сполука за п. 8, яка відрізняється тим, що Х означає кисень та R1 означає метил, етил або феніл.
10. Спосіб одержання сполуки формули V
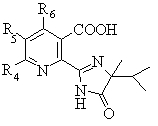 , (V)
, (V)
де:
R4 та R6 незалежно означають водень, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл;
R5 означає водень, галоген та С1-С6алкіл, необов'язково заміщений однією чи кількома С1-С4 алкоксигрупами, С1-С6алкеніл, феніл або заміщений феніл,
який включає:
взаємодію сполуки формули II або її солі лужного металу
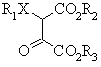 , (II)
, (II)
де:
X означає кисень або сірку;
R1 означає С1-С6алкіл, феніл або заміщений феніл;
R2 та R3 незалежно означають С1-С6алкіл, феніл або заміщений феніл;
принаймні з одним молярним еквівалентом сполуки формули III
 , (III)
, (III)
де R4, R5 та R6 мають ті самі значення, як описано для формули V;
з джерелом аміаку в присутності розчинника, з одержанням сполуки формули І
 , (I)
, (I)
де R2, R3, R4, R5 і R6 описані вище;
взаємодію зазначеної сполуки формули І з аміноамідом формули VI
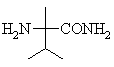 (VI)
(VI)
в присутності інертного розчинника і сильної основи з одержанням солі карбонової кислоти бажаної сполуки формули V;
та підкислення зазначеної солі карбонової кислоти з одержанням бажаної вільної карбонової кислоти формули V.
Текст
Похідні піридин-2,3-дикарбоксилатів є проміжними продуктами, що застосовуються для синтезу гербіцидів - 2(2-імідазолін-2-іл)нікотинових кислот, їх ефірів і солей, таких як ті, що їх описано в патентах США 5334576 і 4798619. Наведені в літературі методи одержання заміщених піридин-2,3-дикарбоксилатів включають деструктивні методики, які вимагають застосування небезпечних окислювальних методів, таких як окислення азотною кислотою або окислення пероксидами в лужному середовищі 2,3-діалкильних або хінолінових попередників. Звичайні de novo синтези піридин-2,3-дикарбоксилатів, в яких використовуються, діефіри оксалоацетату або їх солі з металами, такі як ті, що їх описано в патенті США 5047542 і в патенті Японії 01125768А, як правило дають продукти з низьким виходом і низьким степенем чистоти. Використання галогенованих діефірів оксалоацетату для одержання похідних піридин-2,3-дикарбоксилатів, хоча і є ефективним, але вимагає утворення нестабільних a-галоген-b-кетоефірів, таких як діетилхлороксалоацетат, про які відомо, що вони термічно розкладаються з виділенням НСl, що створює потенційно небезпечні і токсичні умови. Несподівано у цій роботі було виявлено, що похідні піридин-2,3-дикарбоксилатів можна ефективно і економічно одержувати з використанням діефірів аміноалкокси (чи аміноалкілтіо) оксалоацетату або як вихідні речовини, або як проміжні продукти, що утворюються in situ. Тому мета цього винаходу полягає в тому, щоб да ти безпечний, ефективний, економічний і екологічно прийнятний спосіб одержання похідних піридин-2,3-дикарбоксилатів. Інша мета цього винаходу полягає в тому, щоб дати наявне : легко доступне джерело вихідних речовин, які використовуються у названому способі. Відмітною ознакою способу цього винаходу є те, що основними побічними продуктами є спирти та тіоли, які можна легко виділити з реакційної суміші шляхом дистиляції або екстракції. Іншою ознакою способу цього винаходу є те, що виділені спирти та тіоли можна повернути у процес, щоб отримати додаткову кількість вихідної речовини, внаслідок чого кількість відходів зводиться до мінімуму. Перевагою є те, що сполуки цього винаходу термічно та хімічно стабільні у всьому підхожому діапазоні умов і тому не потребують будь-яких спеціальних методів поводження з ними та не представляють жодного особливого ризику для працюючих з ними людей і для довкілля. Інші ознаки і цілі цього винаходу стануть очевидними при їх докладному описі, що його наведено тут нижче. Цей винахід стосується способу одержання сполуки формули І де R4 і R6, кожен, незалежно, являють собою Н, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл; R5 являє собою Н; галоген; С1-С6алкіл, необов'язково заміщений однією або кількома С 1-С4алкоксигрупами; С1С6алкеніл; феніл або заміщений феніл; і R2 та R3, кожен, незалежно, являє собою С 1-С6алкіл, феніл або заміщений феніл; який включає взаємодію сполуки формули II або її солі лужного металу де X являє собою 0 або S; R1 являє собою С1-С6алкіл, феніл або заміщений феніл; і R 2 та R3 ті ж самі, що описано для формули І; принаймні з одним молярним еквівалентом сполуки формули III де R4, R5 та R6 ті самі, що описано для формули І; і з джерелом аміаку в присутності розчинника, необов'язково за підвищеної температури. Цей винахід, крім того, стосується способу одержання сполуки формули І де R4 і R6 кожен незалежно являє собою Н, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл; R5 являє собою Н, галоген, С1-С6алкіл, необов'язково заміщений однією або кількома С 1-С4алкоксигрупами, С1С6алкеніл, феніл або заміщений феніл; і R2 і R3, кожен, незалежно являють собою С 1-С6алкіл, феніл або заміщений феніл; який включає взаємодію сполуки формули IV де X являє собою 0 або S; R1 являє собою С 1-С6алкіл, феніл або заміщений феніл; і R2 та R3 ті ж самі, що описано для формули І; принаймні з одним мольним еквівалентом сполуки формули III або її солі з лужним металом. де R4, R5 та R6 ті самі, що описано для формули І, в присутності розчинника, необов'язково за підвищеної температури. Цей винахід, крім того, стосується проміжної сполуки формули IV де X являє собою 0 або S; R1 являє собою С1-С6алкіл, феніл або заміщений феніл; і R2 та R3, кожен, незалежно, являє собою С 1-С6алкіл, феніл або заміщений феніл. Піридин-2,3-дикарбоксилати формули І можна використовувати як проміжні продукти у виробництві високоактивних, екологічно безпечних імідазолінових гербіцидів формули V де R4 і R6 кожен незалежно являє собою Н, С1-С6алкіл, С1-С6алкеніл, феніл або заміщений феніл; та R5 являє собою Н, галоген, С1-С6алкіл, необов'язково заміщений однією або кількома С 1-С4 алкоксигрупами, С1-С6алкеніл, феніл або заміщений феніл. Докладний опис винаходу Досі синтези de novo похідних піридин-2,3-дикарбоксилатів мали такі недоліки, як низький вихід та низький степінь чистоти одержаних продуктів або застосування нестабільних проміжних продуктів - галогенованих оксалоацетатів. У цій праці було виявлено, що похідні піридин-2,3-дикарбоксилатів формули І можуть бути ефективно і з високим виходом одержані шляхом взаємодії аміноалкокси (або аміноалкілтіо)малеату або фумарату формули IV принаймні з одним молярним еквівалентом a,b-ненаси-ченого кетону формули III в присутності розчинника, необов'язково за підвищеної температури. Спосіб відповідно до винаходу ілюстр ується схемою реакції І, де X, R1, R 2, R3 , R4 , R5 і R6 мають такі самі значення, як описано тут ви ще. Схема реакції І Термін "заміщений феніл", який вживається в описі і формулі винаходу, означає фенільне кільце, заміщене одним чи кількома замісниками, які можуть бути однаковими чи різними, включаючи галоген, NО2, CN, ОН, С1С4алкіл, С1-С4галогеналкіл, С1-С4алкокси, С1-С4алкілтіо, С1-С4галогеналкокси, С1-С4алкіламіно, ді(С1-С4)-алкіламіно і/або С 1-С4алкілсульфоніл. Галоген означає СІ, Вr, І або F. Галогеналкіл означає алкільну гр упу, заміщену одним чи кількома галогенами, які можуть бути однаковими чи різними, і галогенокси означає алкоксигрупу, заміщену одним чи більше галогенами, які можуть бути однаковими або різними. Розчинниками, підхожими для використання у способі винаходу, може бути будь-який органічний розчинник, який буде частково або повністю розчиняти реагенти, і який не братиме участь у реакції. Прикладами органічних розчинників, що можуть використовуватись, є алканоли, хлоровані вуглеводні, вуглеводні, ароматичні вуглеводні, прості ефіри, карбонові кислоти і складні ефіри, нітрили, карбоксаміди тощо, або їх суміші. Більш прийнятними розчинниками є алканоли, такі як метанол, етанол, пропанол, ізопропанол, бутанол тощо, більш прийнятно етанол; і ароматичні вуглеводні, такі як бензол, толуол, ксилол, нафталін тощо, більш прийнятно толуол, або суміші алканолів та ароматичних вуглеводнів, більш прийнятними є суміші етанолу і толуолу. Як правило реакційна температура знаходиться в оберненій залежності від часу реакції, тобто збільшення температури веде до зменшення часу реакції. Однак надто високі реакційні температури можуть спричинити небажані побічні реакції і розклад. Взагалі, підхожі реакційні температури можуть знаходитися в межах від 25°С до 185°С; більш прийнятною є реакційна температура вище 40°С; особливо прийнятним є інтервал температур від 80°С до 100°С. Таким чином, згідно з способом цього винаходу, піридин-2,3-дикарбоксилати, які містять замісники в положеннях 4, 5 і 6, можна зручно отримати шляхом змішування зазвичай еквімолярних кількостей аміноалкокси (або аміноалкілтіо)діефіру формули IV і a, b-ненасиченого кетону формули III в присутності підхожого розчинника в температурному інтервалі від кімнатної температури до температури кипіння розчинника, більш прийнятно при температурах кипіння, до завершення реакції. Одержаний таким чином продукт формули І можна виділити звичайними методами, які застосовуються в хімічних процесах, такими як екстракція, фільтрування, дистиляція, хроматографія тощо. Альтернативно, піридин-2,3-дикарбоксилат формули І можна ввести в те хнологічний потік без подальших стадій очищення і виділення. Даний винахід також стосується сполук формули IV де X являє собою О або S; R1 являє собою С 1-С6алкіл, феніл або заміщений феніл; і R2 і R3, кожен, незалежно, являє собою С 1-С6алкіл, феніл або заміщений феніл. Сполуки відповідно до винаходу можуть існувати у вигляді цис- і транс-ізомерів, IVa і IVa, відповідно. В описі і формулі винаходу сполуки формули IV,. .як показано тут вище, означає цис-ізомер (IVa), транс-ізомер (IVa) або їх суміші. Більш прийнятними сполуками формули IV. є ті сполуки, де X являє собою 0, і R1 являє собою метил, етил або феніл. Сполуки відповідно до винаходу легко одержують взаємодією алкокси-(або алкілтіо)оксалоацетату формули II з джерелом аміаку в присутності розчинника. Позитивним моментом є те, що сполук у формули IV цього винаходу може бути утворено іn situ, і без подальшого виділення може реагувати з a, b--ненасиченим кетоном формули III з утворенням бажаного продукту піридин-2,3-дикарбоксилату формули І. Цей ще один спосіб даного винаходу показано на схемі реакції II. Джерела аміаку, що придатні для використання у способі цього винаходу, включають, але не обмежуються ними, газоподібний аміак або солі амонію, такі як ацетат амонію, бікарбонат амонію, сульфамат амонію, форміат амонію тощо. Більш прийнятними солями амонію є ацетат амонію, сульфамат амонію та бікарбонат амонію. Розчинники і температури, що підходять для використання у цьому способі даного винаходу, такі самі, як ті, що їх описано тут вище для схеми реакції І. Оксалоацетати формули II можна також використовувати у способі цього винаходу у вигляді їх солей з лужними металами, як показано нижче, де М означає лужний метал, такий як натрій або калій. В описі і формулі винаходу сполуки формули II являють собою вільні оксалоацетати формули II та їх солі з лужними металами формули На. Більш прийнятними сполуками формули II є ті сполуки, в яких R4 і R6 являють собою Н, та R5 являє собою Н або С1-С4алкіл, необов'язково заміщений однією С 1-С4алкоксигрупою. Ще більш прийнятними сполуками формули II є ті сполуки, в яких R4 і R6 являють собою Н, і R5 являє собою Н, метил, етил або метоксиметил. Таким чином, згідно з ще одним способом винаходу піридин-2,3-дикарбоксилати, які містять замісники в положенні 4, 5 і 6, можна зручно одержувати шля хом змішування в основному еквімолярних кількостей алкокси (або алкілтіо)оксалоацетату формули II або його солі лужного металу, a, b-ненасиченого кетону формули III та джерела аміаку в присутності, підхожого розчинника в інтервалі температур від кімнатної температури до точки кипіння розчинника, більш прийнятно при температурах кипіння суміші, аж доки реакція в основному закінчиться. Одержаний та ким чином продукт І можна виділити звичайними методами, такими як екстракція, фільтрування, хроматографія тощо. Альтернативно, піридин-2,3-дикарбоксилат формули І може бути введений в технологічний потік у тому виді як є, без додаткових стадій очищення та виділення. Піридин-2,3-дикарбоксилати формули І є проміжними продуктами, що їх можна використовувати для одержання 2-(2-імідазо-лін-2-іл)нікотинових кислот, їх складних ефірів і солей формули V, що мають гербіцидні властивості. Наприклад, піридин-2,3-дикарбоксилат формули І, що утворюється, як подано на схемі реакції І або на схемі реакції II, може взаємодіяти з підхожим амінокарбоксамідом формули VI в присутності інертного розчинника і сильної основи, даючи імідазолінову сполуку формули V, як подано на схемі реакції III. Схема реакції III Альтернативно, діефір формули І, одержаний у спосіб цього винаходу, як показано на схемах реакції І і II, може бути гідролізовано до відповідної дикарбонової кислоти і використано у будь-якому з шляхів здійснення процесу, описаних в патентній літературі для одержання імідазолінонів, таких як імідазолінони, описані в патенті США 4798619. Для того, щоб полегшити надалі розуміння винаходу, нижче наведено приклади, в першу чергу з метою ілюстрації деяких більш специфічних деталей винаходу, і не слід вважати, що винахід обмежено цими прикладами. Терміни "ЯМР 13С" і "ЯМР 1Н" означають ядерний магнітний резонанс на ядрах вуглецю-13 і на протонах відповідно. Терміни ВРГХ і ВЕРХ означають газову хроматографію високого розділення та високоефективну рідинну хроматографію, відповідно. Всі частини є масовими частинами, якщо це не зазначено особливо. Приклад 1 Одержання етилетоксіацетату Розчин етилхлорацетату (100г, чистота 99%, 0,81моль) в етанолі обробляли етанольним розчином етоксиду натрію (282,9г, 20,6%-ний розчин, 0,86моль NaOC2H5), протягом 1 години при 20°С-30°С, нагрівали при 40°С-45°С 0,5 години, охолоджували до кімнатної температури, обробляли діатомовою землею, перемішували 0,25 годин і фільтрували. Осад на фільтрі промивали етанолом. Об'єднані фільтрати переганяли; отримали цільовий продукт у вигляді безбарвної рідини, 75,78г, з чистотою 98,8% (вихід 71%), температура кипіння 87°С-88°С при 59мм Hg, ідентифікований методами ЯМР 13С, Я МР 1Н і мас-спектрометричним аналізом. Приклад 2 Одержання діетилетоксіоксалоацетату (метод ступеневого додання) Суміш з розплавленого металевого натрію (24,15г, 1,05моль) в толуолі при перемішуванні обробляли етанолом (55,2г, 1,2моль) протягом 1 години при 100°С-110°С, нагрівали із зворотним холодильником при температурі кипіння 0,5 години, охолоджували до 30°С, обробляли діетилоксалатом (160,6г, 1,1моль) протягом 10 хвилин при 30°С-45°С, обробляли етилетоксіацетатом (132г, 98%, 0,98моль) протягом 0,5 години при 45°С-50°С, нагрівали при 55°С-60°С 1,5 години і виливлли в 328г 14%-ної НСl при охолоджуванні. Одержану суміш поділяли. Цільовий, продукт отримали в органічній фазі у вигляді 40,9%-ного розчину, ідентифікували методом ГХ високого розділення; загальний вихід становить 204,2г (вихід 90%). Приклад 3 Одержання діетилетоксіоксалоацетату (метод попереднього змішування) Суміш, що складається з розплавленого металевого натрію (24,15г, 1,05моль) у толуолі, при перемішуванні обробляли етанолом (55,2г, 1,2моля) протягом 1 години при 100°С-110°С, нагрівали із зворотним холодильником при температурі кипіння 0,5 години, охолоджували до 45°С, обробляли сумішшю діетилоксалату (160,6г, 1,1моль) і етилетоксіацетату (132г, 98%, 0,98моль) протягом 1 години при 45-50°С, нагрівали при 55°С-60°С 1,5 години і виливали в 328г 14%-ної НСl при охолоджуванні. Одержану суміш поділяли. Отримали цільовий продукт у вигляді 32%-ного розчину в органічній фазі, ідентифікований методом ГХ високого розділення, загальний вихід 198,2г (вихід 87%). Приклад 4 Одержання діетил-5-метилпіридин-2,3-дикарбоксилату через діетилетоксіоксалоацетат Розчин діетилетоксіоксалоацетату (120,1г, 82,9%, 0,43моль) в етанолі обробляли сумішшю метакролеїну (38,9г, 97,1%, 0,54моля) і оцтової кислоти (42г, 0,70моля) при кімнатній температурі, потім обробляли безводним аміаком (9,2г, 0,54моля) протягом 1 години при 25°С-45°С, нагрівали із зворотним холодильником при температурі кипіння 2 години, охолоджували до кімнатної температури і концентрували у вакуумі, одержуючи залишок; залишок Обробляли толуолом, промивали 2н. НСl і потім концентрували у вакуумі. Одержаний залишок переганяли у вакуумі; отримали 74,06г цільового продукту у вигляді жовтого масла, з чистотою 100% (вихід 73%), з температурою кипіння 150°С при 6,5мм Hg і 170°С при 2,5мм Hg, який ідентифікували методом ЯМР 13C, ЯМР 1Н. Приклад 5 Одержання діетил-5-метилпіридин-2,3-дикарбоксилату через натрієву сіль діетилетоксіоксалоацетату Суміш, що складається з розплавленого металевого натрію (24,15г, 1,05моля) у толуолі, обробляли етанолом (55,2г, 1,2моль) протягом 1 години при 100°С-110оС, нагрівали із зворотним холодильником при температурі кипіння 15 хвилин, охолоджували до кімнатної температури, обробляли діетилоксалатом (160,6г, 1,1моль) при 24°С-45°С, потім обробляли етилетоксіацетатом (132г, 98%, 0,98моль) протягом 0,5 години при 45°С-50°С і нагрівали при 50°С-55°С 2 години, одержуючи гомогенний розчин. Половину цього гомогенного розчину обробляли оцтовою кислотою (75г, 1,25моль) при 25°С-40°С, потім обробляли метакролеїном (38,4г, 91,4%, 0,50моль), далі обробляли безводним аміаком (11г, 0,65моль) протягом 0,5 години при 40°С-60°С, нагрівали із зворотним холодильником 2 години, охолоджували до кімнатної температури і обробляли послідовно водою і концентрованою НСІ (65г). Одержану суміш поділяли; отримали цільовий продукт у ви гляді 20,4%-ного розчину в органічній фазі, 88,6г (вихід 76%), який ідентифікували методом ГХ високого розділення. Приклад 6 Одержання диметил-5-метилпіридин-2,3-дикарбоксилату через натрієву сіль диметилметоксіоксалоацетату Суміш 25%-ного метанольного розчину метоксиду натрію (237,6г, 1,1моль NаОСН3) і толуолу обробляли сумішшю диметилоксалату (129,8г, 1,1моль) і метилметоксіацетату (104г, 1моль) при 40°С-45°С протягом 1 години, нагрівали при 45°С-50°С 2 години, обробляли послідовно оцтовою кислотою (150г, 2,5моль) і метакролеїном (93г, 95%, 1,26моль), обробляли безводним аміаком (18,2г, 1,07моль) протягом 1 години при 40°С-60°С, нагрівали із зворотним холодильником 2 години, охолоджували до кімнатної температури і розбавляли водою. Фази поділяли, і водну фаз у екстрагували толуолом. Органічну фазу і толуолові екстракти об'єднували та концентрували у вакуумі; одержали цільовий продукт у вигляді 45,8%-ного розчину у толуолі, 91,6г (вихід 44%), який ідентифікували методом ВЕРХ. Використовуючи в основному ту саму методику, що описано тут ви ще і замінивши метилметоксіацетат на метилметилтіоацетат, отримали цільовий продукт у вигляді 12%-ного розчину в толуолі з виходом 54,9%, який ідентифікували методом ГХ високого розділення. Приклад 7 Одержання диметил-5-метилпіридин-2,3-дикарбоксдшату через метилтіоацетат і сіль амонію Суміш метилметилтіоацетату (25г, 0,21моль) і диметилоксалату (24,6г, 0,21моль) у толуолі додавали до суспензії метоксиду натрію (12,4г, 0,23моль) у толуолі. Одержану реакційну суміш нагрівали при 80°С 5 годин, обробляли додатковою кількістю метоксиду натрію (4,5г, 0,08моль), потім нагрівали при 80°С 5 годин, охолоджували до кімнатної температури і виливали в розбавлену водну НСl. Суміш поділяли, і водну фазу екстрагували толуолом. Органічні фази об'єднували і концентрували у вакуумі, одержуючи залишок. Залишок розчиняли в метанолі, обробляли сульфаматом амонію (47,5г, 0,42моль) і метак-ролеїном (30,7г, 95%, 0,42моль), нагрівали із зворотним холодильником при температурі кипіння 20 годин і концентрували у вакуумі, одержуючи залишок. Цей залишок розподіляли між толуолом і водою. Водну фазу екстрагували толуолом. Органічні фази об'єднували і концентрували; отримали 5,7г цільового продукту (ви хід 13%) у вигляді 4,8-ного розчину у толуолі, який ідентифікували методом ВЕРХ. Приклад 8 Одержання діетил-5-метилпірилин-2,3-дикарбоксилату через діетилетоксіоксалоацетат і сіль амонію Розчин діетилетоксіоксалоацетату (4,1г, 96%, 17ммоль) в етанолі обробляли метакролеїном (1,4г, 95%, 19ммоль) і сульфаматом амонію (2,3г, 20ммоль), нагрівали із зворотним холодильником при температурі кипіння 15 годин, охолоджували до кімнатної температури і концентрували у вакуумі, одержуючи залишок. Залишок диспергували в суміші толуолу та води. Одержану суміш поділяли. Водну фазу потім екстрагували толуолом. Органічні фази об'єднували і концентрували, одержуючи цільовий продукт у вигляді 7,8%-ного розчину у толуолі; отримали 2,95г продукту (ви хід 74%), який ідентифікували методом ВЕРХ. Приклад 9 Одержання діетил-5-етилпіридин-2,3-дикарбоксилату через діетилетоксіоксалоацетат і сіль амонію Розчин діетилетоксіоксалоацетату (2,05г, 96%, 8,5ммоль) в етанолі обробляли етакролеїном (0,82г, 9,8ммоль) і сульфаматом амонію (1,16г, 10,2ммоль), нагрівали із зворотним холодильником при температурі кипіння суміші 15 годин та концентрували у вакуумі, одержуючи залишок. Залишок обробляли сумішшю толуолу і води 1:1. Суміш поділяли. Водну фазу екстрагували толуолом. Органічні фази об'єднували і концентрували; отримали цільовий продукт у вигляді 4,5%-ного розчину у толуолі (вихід 78%) за даними ВЕРХ. Приклад 10 Одержання діетиламіноетоксималеату (а) та діетиламіноетоксифумарату (b) Розчин діетилетоксіоксалоацетату (2,1г, 96%, 8,7ммоль) в етанолі обробляли сульфаматом амонію (1,2г, 10,5ммоль), кип'ятили із зворотним холодильником до закінчення реакції, що визначається методом ГХ (7 годин) та концентрували у вакуумі, одержуючи залишок. Залишок розподіляли між метиленхлоридом і водою. Водну фазу екстрагували метиленхлоридом. Органічні фази об'єднували, сушили на Na2SO4 і концентрували у вакуумі; отримали цільовий продукт у вигляді жовтого масла, кількістю 1,93г (вихід 92%), який згідно ідентифікації методами ЯМР 1Н, Я МР 1ЗС, мас-спектрометрії і ГХ високого розділення, являли собою суміш а:b при співвідношенні 1:1,5. Приклад 11 Одержання діетил-5-метилпіридин-2,3-дикарбоксилату через діетиламіноетоксималеат і діетиламіноетоксифумарат Суміш діетиламіноетоксималеату і діетиламіноетоксифумарату (1,93г, 8,3ммоль) в етанолі обробляли метакролеїном (0,7г, 95%, 9,5ммоль) кип'ятили із зворотним холодильником 15 годин і концентрували у вакуумі, одержуючи залишок. Залишок розподіляли між толуолом і водою. Фази поділяли, і водну фазу екстрагували толуолом. Органічні фази об'єднували і концентрували; отримали цільовий продукт у вигляді 7,1%-ного розчину у толуолі. Приклад 12 Одержання діалкіл-5-алкіл-піридин-2,3-дикарбоксилатів через діалкілалкоксіоксалоацетах Використовуючи в основному таку саму методику, що її описано в прикладах, наведених тут ви ще, отримали і охарактеризували за допомогою ВЕРХ такі продукти - діефіри 5-алкілпіридиндикарбонових кислот. Умови реакції і вихід продуктів наведені нижче в таблиці 1. Таблиця 1 R5 С2Н5 СН3 С2Н5 СН3 С2Н5 СН3 R2 R3 С2Н5 С2Н5 С2Н5 С2Н5 С2Н5 С2Н5 Співвідношення II:III 1:1,3 1:1,2 1:1,4 Еквівалент NH4+X1,2 СН3СО21,2 СН3СО21,2 СН3СО2 (І) Розчинник Температура, Час реакції, °С (годин) Вихід,% Толуол Темп. кип. 12 70 Етанол Темп. кип. 6 86 Етанол Темп. кип. 4 100 С2Н5 С2Н5 СН3 СН3 С2Н5 С6Н5 С2Н5 СН3 СН3 СН3 СН3 СН3 СН3 СН3 С2Н5 С2Н5 СН3 СН3 С2Н5 СН3 С2Н5 С2Н5 С2Н5 СН3 СН3 С2Н5 СН3 С2Н5 20% етанолу в толуолі 1:1,2 1:1,3 1:1,5 1:1,5 1:1,5 1:1,2 1:1,5 1,2 NH 2SO31,1 NH 2SO31,2 СН3СО21,5 NH 2SO31,2 НСО31,2 СН3СО21,2 СН3СО2 Етанол Етанол Метанол Метанол Етанол Метанол Смесь 1 120 120 Темп. кип. Темп. кип. Темп. кип. Темп. кип. Темп. кип. 3 5 7,5 6 б 10 6 85 83 62 48 69 82 89
ДивитисяДодаткова інформація
Назва патенту англійськоюA method and intermediate compounds for preparing pyridine-2,3-dicarboxylates
Назва патенту російськоюСпособ и промежуточные соединения для получения пиридин-2,3-дикарбоксилатов
МПК / Мітки
МПК: C07C 323/58, C07C 69/52, C07D 213/803, C07C 229/30, C07D 401/04, C07D 213/80, C07D 213/79
Мітки: сполуки, імідазолінових, спосіб, проміжні, одержання, гербіцидів, піридин-2,3-дикарбоксилатів
Код посилання
<a href="https://ua.patents.su/7-70293-sposib-i-promizhni-spoluki-dlya-oderzhannya-piridin-23-dikarboksilativ-ta-imidazolinovikh-gerbicidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб і проміжні сполуки для одержання піридин-2,3-дикарбоксилатів та імідазолінових гербіцидів</a>
Попередній патент: Спосіб лікування тикозних гіперкінезів
Наступний патент: Застосування інгібіторів циклооксигенази-2 як протиангіогенних засобів
Випадковий патент: Портативна електромагнітна установка для дефектоскопії кінцевих ділянок бурильних труб











