Спосіб визначення типу цитоплазми кукурудзи
Номер патенту: 73707
Опубліковано: 10.10.2012
Автори: Сиволап Юрій Михайлович, Сліщук Георгій Іванович, Волкова Наталія Едуардівна
Формула / Реферат
Спосіб визначення типу цитоплазми кукурудзи включає ПЛР-аналіз регіонів мітохондріонів у зразках кукурудзи, який відрізняється тим, що проводять ідентифікацію химерної відкритої рамки зчитування Orf355, atp6/atp9-регіону та химерного гену T-urf мітохондріонів S-, О- та Т-типу цитоплазми, відповідно.
Текст
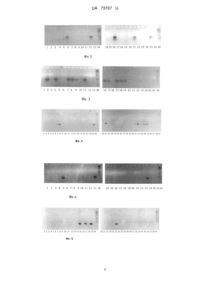
Реферат: Спосіб визначення типу цитоплазми кукурудзи, при якому проводять ідентифікацію химерної відкритої рамки зчитування Orf355, atp6/atp9-регіону та химерного гена T-urf мітохондріонів S-, О- та Т-типу цитоплазми, відповідно. UA 73707 U (54) СПОСІБ ВИЗНАЧЕННЯ ТИПУ ЦИТОПЛАЗМИ КУКУРУДЗИ UA 73707 U UA 73707 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить сільському господарству і може бути використана в селекції та насінництві кукурудзи для встановлення типу цитоплазми (нормальна чи стерильна) та типу стерильної цитоплазми. Використання цитоплазматичної чоловічої стерильності (ЦЧС) є необхідною умовою організації промислового насінництва гібридного насіння кукурудзи в Україні. Порівняльний аналіз різних методів кастрації волотей показав, що найбільшу ефективність має метод ЦЧС. Виробництво гібридного насіння до недавнього часу в Україні базувалось на використанні техаського (Т), молдавського (М або S) та парагвайського (С) типів ЦЧС. Першим етапом переведення гібридів кукурудзи на стерильну основу є вивчення реакції нових самозапилених ліній - потенційних батьківських форм - на стерильну цитоплазму (на різні типи стерильності). Ідентифікацію та класифікацію типів стерильної цитоплазми традиційно проводять в системі тестерних схрещувань з аналогами ліній на М-, С-, Т-типах ЦЧС та ліній аналізаторів. Процедура тест-кросингу потребує значних часових та трудових витрат. Молекулярні маркери, що розроблено на основі унікальних послідовностей химерної мітохондріальної ДНК, можуть бути використано для значно швидшого визначення типів ЦЧС кукурудзи, ніж за традиційною тест-крос-процедурою (з двох років до декількох днів). Найбільш близьким до запропонованого способу є процедура, що розроблена для ідентифікації нормальної та стерильної цитоплазми у кукурудзи за допомогою полімеразної ланцюгової реакції (ПЛР) (Сао М., Rong Т., Zhu Y. The discovery of a specific DNA fragment associated with maize cytoplasmic male sterility and its differential display // Yi Chuan.-2005. - Vol. 27, N 5. - P. 747-752). З використанням праймерів Р1-Р2, дизайн яких розроблений на основі послідовностей мітохондріальної ДНК, при ПЛР-ампліфікації тотальної ДНК для чоловічостерильних зразків кукурудзи отримують специфічний фрагмент, який відсутній при ампліфікації ДНК зразків з нормальною цитоплазмою. Даний спосіб вибрано як прототип. До недоліків цього способу слід віднести можливість відрізнити тільки нормальну та стерильну цитоплазму кукурудзи. З метою усунення недоліків пропонується спосіб визначення типу цитоплазми за ДНКідентифікацією нормального мітохондріону дикого типу та специфічних послідовностей мітохондріонів різних типів ЦЧС. Поставлена задача вирішується тим, що дослідження проводять методом ПЛР-ампліфікації тотальної ДНК кукурудзи з використанням пар праймерів, які фланкують специфічні ділянки мітохондріонів, електрофорезу ампліфікованих фрагментів ДНК у агарозному гелі та реєстрації наявності/відсутності цитоплазмоспецифічних ампліконів з певною молекулярною масою у парах нуклеотидів (п.н.), що свідчить про певний тип цитоплазми. Відмінними від прототипу ознаками у корисній моделі, що заявляється, є: спосіб підготовки зразків до аналізу; показник, за яким ідентифікують тип цитоплазми; ідентифікація нормальної та трьох типів стерильної цитоплазми. Спосіб забезпечує високу точність та можливість оцінки великої кількості зразків за короткий час (один робочий день), не потребує наявності дорогого обладнання та реактивів. Спосіб пояснюється фіг. 1-5. На фіг.1 - електрофореграма продуктів ампліфікації локусу cms-S у ліній кукурудзи W8 (1), W8T (2), W8M (3), W8E (4), W8C (5), W8MB (6), W8TBB (7), W8BTB (8), W8BB (9), P502 (10), P502T (11), P502M (12), P502 (13), P502C (14), P502TB (15), P502MB (16), Р502БВ (17), Р502ТБВ (18), Р502БТВ (19), CK32 (20), CK32T (21), CK32M (22), СК32Б (23), CK32C (24), CK32TB (25), СК32БВ (26). М - маркер молекулярної маси GeneRuler 100bp DNA Ladder Plus. На фіг.2 - електрофореграма продуктів ампліфікації локусу cms-T у ліній кукурудзи (нумерація ліній відповідає такій на фіг.2) На фіг.3 - електрофореграма продуктів ампліфікації локусу cms-T у ліній кукурудзи С736А (1), С736АВ (2), С736В (3), С736ВА (4), С736С (5), С736СА (6), С736СВ (7), С736Е (8), С736ЕА (9), C736F (10), C736FA (11), C736G (12), С736Н (13), СХ36А (14), СХ36В (15), СХ36С (16), CX36D (17), СХ36Е (18), С836А (19), С836В (20), С836С (21), C836D (22), С836Е (23), C836F (24), С836Н (25), C836G (26), C936D (27), C936DA (28), C936F (29), C936FA (ЗО), С936Н (31), C936G (32), С9361 (33), C936J (34), С936К (35), С936М (36), С229А (37), С229С (38). М – маркер молекулярної маси GeneRuler 100bp DNA Ladder Plus. На фіг. 4 - електрофореграма продуктів ампліфікації локусу cms-C у ліній кукурудзи (нумерація ліній відповідає такій на фіг. 1) На фіг.5 - електрофореграма продуктів ампліфікації локусу cms-C у ліній кукурудзи (нумераціяліній відповідає такій на фіг. 3) Спосіб здійснюється таким чином. 1 UA 73707 U 5 10 15 Виділення ДНК. Гомогенізувати 50-100 мг рослинного матеріалу (насіння, паростки, листя) у 1,5 мл мікропробірці та додати з 1 мл буфера, що лізує (0,1 М Na 3EDTA; 0,1 М трис-НСІ рН 8,5; 0,1 М NaCl; 1,0 % додецилсульфат Na; 0,1 % Тритон Х-100; 100 мкг/мл протеїназа К). Інкубувати 1 год. при 55 °C. Додати РНКазу А до кінцевої концентрації 1 мкг/мл та інкубувати 1 год. при 37 °C. Лізат обробити рівним об'ємом суміші хлороформ-ізоаміловий спирт (24:1 за об'ємом), перемішати до утворення білої емульсії. Одержану суміш центрифугувати 5 хв. при 14000 об./хв. у мікроцентрифузі, водну фазу перенести в іншу мікропробірку. До водної фази додати рівний об'єм ізопропілового спирту, перемішати. Центрифугувати при 14000 об./хв. протягом 4 хв. у мікроцентрифузі, надосадову рідину злити. Осад промити двічі 500 мкл охолодженого 70,0 % етанолу центрифугуванням при 14000 об./хв. протягом 2 хв. у мікроцентрифузі. Надосадову рідину злити, осад підсушити за кімнатної температури 20 хв. і розчинити в 300 мкл ТЕ-буфера (0,01 М трис-НСl рН 8,0; 0,001 М Na3EDTA). Розчин ДНК зберігати в холодильнику за температури 4 °C протягом проведення дослідження. Постановка полімеразної ланцюгової реакції. Стерильні пробірки (залежно від типу термоциклера 0,2; 0,5; 1,5 мл пробірки чи планшети) необхідної кількості з урахуванням негативного контроля підписати та розмістити в штативі, який знаходиться на льоду. В окремій 1,5 мл пробірці зформувати ПЛР-суміш для необхідної кількості зразків. Перелік компонентів ПЛР-суміші, їх концентрація та послідовність додавання наведено в табл. 1. Таблиця 1 Приготування ПЛР-суміші Кінцева концентрація 1-кратний 0,2 мМ 0,25 мкМ 0,25 мкМ 1 од/акт. Компонент Бідистильована стерильна вода 10-кратний ПЛР-буфер 1 мМ суміш дНТФ 5 мкМ прямий праймер 5 мкМ зворотній праймер 3 5 од/мм ДНК-полімераза Taq Всього Кількість на 1 реакцію, мкл 12,0 2,5 4,0 1,0 1,0 0,2 20,7 20 25 Для запобігання забрудненню приготування ПЛР-суміші проводити в одноразових гумових рукавичках в боксі. Під час приготування ПЛР-суміші всі розчини повинні знаходитись на льоду. ПЛР-суміш перемішати на встряхувачі типу вортекс та центрифугувати за 1500 об./хв. 10 сек для видалення повітряних бульбашок. Утворення піни або бульбашок під час перемішування не допускається. В табл. 2 наведено інформацію про регіони мітохондріонів та послідовності праймерів, що їх фланкують (дизайн праймерів - Liu et al. Crop Science, 2002, vol. 42, p. 566569). Таблиця 2 Нуклеотидні послідовності праймерів Праймер Довжина Регіон мітохондріону амплікона, послідовність (3' → 5') назва п.н. прямого зворотного химерна відкрита рамка зчитування 799 cms-S F/R caacttattacgaggctgatgc agttcgtcccatatacccgtac Orf355 atp6/atp9-регіон 398 cms-C F/R atgctaatggtgttccgattcc agcatcatccacattcgctag химерний ген T-urf 440 cms-T F/R catgaaatgggtgaagtctctttc aagagaaagggagactttggtccc 30 Аліквоти ПЛР-суміші об'ємом 20,5 мкл розлити у підготовлені пробірки. Додати 4,5 розчину ДНК. В пробірку негативного контроля замість розчину ДНК додати 4,5 бідистильованої стерильної води. Поверх реакційного розчину нанести 20 мл мінеральної для запобігання википанню компонентів реакції. Центрифугувати за 1500 об./хв. 10 сек. видалення повітряних бульбашок. 2 мкл мкл олії для UA 73707 U 5 10 15 20 25 30 35 40 Підготовлені проби перенести в штатив термоциклера. Температурний режим ампліфікації такий: початкова денатурація - 2 хв. за 94 °C, далі 1 хв. за 94 °C; відпал праймерів - 1 хв. за 55 °C; елонгація - 2 хв. за 72 °C, фінальна елонгація - 10 хв. Кількість циклів - 35. Електрофоретичний розподіл продуктів ПЛР. Продукти ПЛР-ампліфікації (10 мкл-аліквоту ПЛР-суміші) змішати з 2 мкл буфера для нанесення (0,25 % (в/о) бромфеноловий синій, 0,25 % (в/о) бромфеноловий синій, 40 % (в/о) цукроза у воді). Одна лунка гелевої пластини повинна містити маркер молекулярної маси ДНК (наприклад, 100 п.н.-ледер, ДНК pUC19/MspI). Фракціонувати в горизонтальному "підводному" 2,0 % агарозному гелі в 1 × ТВЕ-буфері (89 mМ трис-НСІ (рН 8,2), 89 мМ борна кислота; 2 mM Na3EDTA) при постійній напрузі 100 В за кімнатної температури. Електрофорез припинити згідно з довжиною пробігу бромфенолового синього, рух якого у 2,0 % агарозному гелі співпадає з рухом фрагментів ДНК розмірами 400500 п.н. Візуалізація продуктів ПЛР. Гелеву пластину промити деіонізованою водою та покласти на 10 хв. у розчин 1 × ТВЕ-буферу з бромистим етидієм концентрацією 1 мкг/мл. Відеозображення електрофореграм отримати за допомогою цифрової системи гель-документації та аналізу. Документування результатів. Після електрофорезу на доріжках, що відповідають аналізованим пробам, повинно бути по одній чіткій смузі, які відповідають дослідженим регіонам мітохондріонів, або не повинно бути ніякихсмуг. На доріжці, що відповідає негативній контрольній пробі, не повинно бути ніяких смуг. Поява смуги в електрофоретичному спектрі негативної контрольної проби свідчить про наявність у робочих розчинах ДНК. У таких випадках повторюють ПЛР з використанням нових робочих розчинів. Опрацювання результатів. Облік результатів ПЛР-аналізу проводити за наявністю чи відсутністю на доріжках електрофореграми специфічних смуг ампліфікованої ДНК. Визначити розміри фрагментів ампліфікації у п.н. на підставі порівняння зі смугами маркера молекулярної маси за допомогою програмного забезпечення до цифрової системи гель-документації. Довжини специфічних фрагментів ампліфікації регіонів мітохондріонів вказано в табл. 2. Наявність фрагменту ампліфікації довжиною 799 п.н. свідчить про S-тип стерильної цитоплазми, довжиною 398 п.н. - С-тип, довжиною 440 п.н. - Т-тип. Відсутність будь-яких фрагментів ампліфікації свідчить про нормальну цитоплазму. Приклад використання способу. Проведено ПЛР-аналіз 86 фертильних ліній кукурудзи, стерильних аналогів, закріплювачів та ліній-відновлювачів фертильності української та світової селекції з використанням пар праймерів cms-S F/R, cms-C F/R та cms-T F/R. При ПЛР-аналізi ліній кукурудзи за регіоном, що асоційований з ЦЧС молдавського типу, за допомогою пари праймерів cms-S детектовано фрагмент ампліфікації довжиною 799 п.н. Даний амплікон характерний лише для ліній кукурудзи з цитоплазмою S-типу (фіг. 1) і не генерувався у реакційних сумішах з використанням тотальної ДНК як ліній з нормальною цитоплазмою, так і ліній кукурудзи з Т- та С-типом. При ПЛР-аналізі ліній з цитоплазмою Т-типу з використанням пари праймерів cms-T отримано амплікон довжиною 440 п.н. (фіг. 2-3). При ПЛР-аналізі ДНК ліній з іншими типами цитоплазми даний продукт не ампліфікувався. При ПЛР-аналізі ліній кукурудзи за локусом, асоційованим з ЦЧС С-типу, з використанням пари праймерів cms-C отримано амплікон довжиною 398 п.н. (рис. 4-5). При ПЛР-аналізі ДНК ліній з іншими типами цитоплазми даний продукт не ампліфікувався. При ПЛР-аналізі ДНК ліній з нормальною цитоплазмою жоден з вищенаведених продуктів не ампліфікувався (фіг. 1-5). 45 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 50 Спосіб визначення типу цитоплазми кукурудзи включає ПЛР-аналіз регіонів мітохондріонів у зразках кукурудзи, який відрізняється тим, що проводять ідентифікацію химерної відкритої рамки зчитування Orf355, atp6/atp9-регіону та химерного гена T-urf мітохондріонів S-, О- та Ттипу цитоплазми, відповідно. 3 UA 73707 U 4 UA 73707 U Комп’ютерна верстка Л. Купенко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 5
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod to determine maize cytoplasm type
Автори англійськоюSyvolap Yurii Mykhailovych, Volkova Natalia Eduardivna, Slishchuk Heorhii Ivanovych
Назва патенту російськоюСпособ определения типа цитоплазмы кукурузы
Автори російськоюСиволап Юрий Михайлович, Волкова Наталья Эдуардовна, Слищук Георгий Иванович
МПК / Мітки
МПК: A01H 5/00
Мітки: цитоплазми, типу, визначення, кукурудзи, спосіб
Код посилання
<a href="https://ua.patents.su/7-73707-sposib-viznachennya-tipu-citoplazmi-kukurudzi.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення типу цитоплазми кукурудзи</a>
Попередній патент: Ківш екскаватора драглайна
Наступний патент: Спосіб контролю втомного пошкодження за допомогою структурно-чутливого сенсора
Випадковий патент: Композиція емульсійна-ек