Спосіб одержання фармацевтичної композиції, що включає венлафаксин, та композиція
Номер патенту: 83437
Опубліковано: 10.07.2008
Автори: Сегула Закель Мойца, Жупанчіч Сілво, Пісек Роберт
Формула / Реферат
1. Спосіб одержання фармацевтичної композиції, що містить венлафаксин або його фармацевтично прийнятну сіль, що включає наступні стадії:
(1) одержання дисперсії венлафаксину або солі венлафаксину в розчиннику, у якому венлафаксин або сіль венлафаксину мають розчинність менше 25 г/літр при кімнатній температурі;
(2) перетворення дисперсії, одержаної на стадії (1), у форму частинок;
(3) покривання частинок, одержаних на стадії (2), шаром полімеру, що забезпечує уповільнене вивільнення діючої речовини.
2. Спосіб за п. 1, де венлафаксину гідрохлорид застосовують як активний компонент.
3. Спосіб за п. 2, де венлафаксину гідрохлорид застосовують у вигляді, по суті, чистої поліморфної форми.
4. Спосіб за будь-яким із пп. 1-3, де дисперсія, одержана на стадії (1), додатково містить зв'язувальну речовину.
5. Спосіб за п. 4, де застосовують зв'язувальну речовину, розчинну в застосовуваному розчиннику.
6. Спосіб за п. 5, де зв'язувальну речовину вибирають із групи, що складається з похідних целюлози, полівінілпіролідону (ПВП), полівінілового спирту (ПВС) та їхніх сумішей.
7. Спосіб за будь-яким із пп. 4-6, де венлафаксин або його сіль і зв'язувальну речовину застосовують у масовому співвідношенні від 2:1 до 20:1, з розрахунку за основою венлафаксину.
8. Спосіб за будь-яким із пп. 1-7, де дисперсія, що одержується на стадії (1), додатково містить речовину, що перешкоджає злипанню.
9. Спосіб за п. 8, де речовиною, що перешкоджає злипанню, є тальк.
10. Спосіб за будь-яким із пп. 1-9, де на стадії (2) дисперсію перетворюють у форму частинок шляхом нанесення дисперсії, одержаної на стадії (1), на інертні ядра.
11. Спосіб за п. 10, де інертні ядра складаються в основному із сахарози, крохмалю, мікрокристалічної целюлози або їхньої суміші, зокрема із суміші сахарози і крохмалю.
12. Спосіб за п. 10 або 11, де інертними ядрами є частинки з цукру і крохмалю (нонпарель).
13. Спосіб за будь-яким із пп. 1-12, де полімером, що забезпечує уповільнене вивільнення діючої речовини, є гідрофобний полімер, що забезпечує уповільнене вивільнення.
14. Спосіб за п. 13, де полімер, що забезпечує уповільнене вивільнення діючої речовини, вибирають із групи, що складається з полівінілацетату (ПВА), полівінілпіролідону (ПВП), полі(мета)крилатів, таких як співполімери акрилової кислоти і/або метакрилової кислоти з триметиламонійетилметакрилатом, полімерів і співполімерів метакрилової і акрилової кислоти, етицелюлози, метилцелюлози та їхньої суміші.
15. Спосіб за п. 14, де суміш полімерів, застосовувана на стадії (3), містить суміш полівінілацетату (ПВА) і полівінілпіролідону (ПВП).
16. Спосіб за будь-яким із пп. 1-15, де на стадії (3) застосовують суміш полімеру, що забезпечує уповільнене вивільнення, із пластифікатором.
17. Спосіб за п. 16, де пластифікатор вибирають із групи, що складається з 1,2-пропіленгліколю, триетилцитрату, поліетиленгліколю, триацетину, дибутилсебацинату та їх суміші.
18. Спосіб за будь-яким із пп. 1-17, що включає додаткову стадію створення розділювального шару на частинках, одержаних на стадії (2).
19. Спосіб за п. 18, де розділювальний шар формують з водної суспензії або органічного розчину полімеру, вибраного із групи, що складається з целюлози і похідних целюлози, полівінілпіролідону, полівінілового спирту й їх сумішей.
20. Спосіб за будь-яким із пп. 1-19, що додатково включає стадію висушування частинок, одержаних на стадії (2), частинок в оболонці, одержаних на стадії (3), і/або частинок, одержаних способом за пп. 18 і 19.
21. Спосіб за будь-яким із пп. 1-20, де спосіб виконують у ванночці з псевдозрідженим шаром.
22. Спосіб за будь-яким із пп. 10-21, що включає процес нанесення дисперсії, одержаної на стадії (1), на інертні ядра для одержання партії частинок, що мають шар, утворений при осадженні дисперсії, одержаної на стадії (1), першої товщини, процес нанесення дисперсії, одержаної на стадії (1), на інертні ядра для одержання щонайменше однієї партії частинок, що мають шар, утворений при осадженні дисперсії, одержаної на стадії (1), з різною товщиною, і процес змішування одержаних партій частинок для одержання партії частинок, що розрізняються товщиною шару, утвореного при осадженні дисперсії, одержаної на стадії (1).
23. Спосіб за будь-яким із пп. 1-22, де частинки, одержані на стадії (3), поміщають у капсули або з них формують таблетки.
24. Фармацевтична композиція, яку одержують способом за будь-яким із пп. 1-23.
25. Композиція за п. 24, що містить від 15 до 50 мас. % венлафаксину або солі венлафаксину, з розрахунку за основою венлафаксину, від загальної маси композиції.
26. Композиція за п. 24 або 25, що містить від 2 до 35 мас. % полімеру, що забезпечує уповільнене вивільнення, від загальної маси композиції.
27. Композиція за будь-яким із пп. 24-26, що містить від 20 до 55 мас. % інертних ядер від загальної маси композиції.
28. Композиція за будь-яким із пп. 24-27, де шар, що містить венлафаксин або сіль венлафаксину, містить від 2 до 5 мас. % зв'язувальної речовини від загальної маси композиції.
29. Композиція за будь-яким із пп. 24-28, де полімер розділяючого шару складає від 1 до 5 мас. % від загальної маси композиції.
Текст
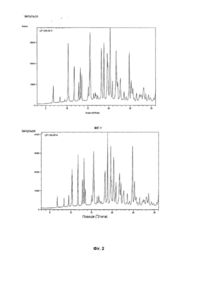
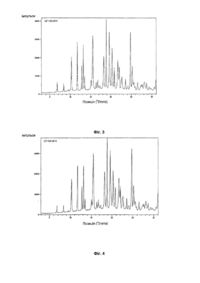
Даний винахід спрямований на розробку способу одержання фармацевтичної композиції з уповільненим вивільненням, що включає венлафаксин або його сіль. Винахід також спрямований на створення фармацевтичної композиції з уповільненим вивільненням, що включає венлафаксин або його сіль, що може бути у формі пігулок або капсул в оболонці для однократного перорального прийому на день. Сполука 1-[2-диметиламіно-1-(4-метоксифеніл)-етил]-циклогексанол, далі венлафаксин, була описана в [ЕР 0112669]. Гідрохлорид цієї речовини доступний під торговою назвою Ефексор Ò, що продається у вигляді рацемічної суміші, тобто як суміш у співвідношенні 1:1 (+) і (-) енантіомерів венлафаксину. Даний препарат застосовується для лікування депресії. Зараз венлафаксину гідрохлорид призначається дорослим у вигляді звичайних таблеток негайного вивільнення або у вигляді мультикорпускулярних капсул пролонгованої дії протягом 24 годин. Венлафаксину гідрохлорид добре розчиняється у воді. Відомо, що дуже важко розробити фармацевтичну композицію, що забезпечувала б повільну швидкість розчинення лікарського засобу, що має високу розчинність у воді. Крім того, венлафаксину гідрохлорид є поліморфним. Важливі властивості поліморфних форм лікарських засобів, такі як швидкість розчинення, біодоступність і хімічна стабільність, можуть істотно розрізнятися. Тому поліморфні форми сполуки звичайно розрізняються за характеристиками розчинності й об'ємних властивостей. Це в значній мірі впливає на спосіб розробки твердого лікарського препарату і може також негативно впливати на біодоступність лікарського засобу. Саме тому у випадку венлафаксину гідрохлориду, одна його поліморфна форма, що відокремлюється в процесі синтезу і застосовується при готуванні препарату, повинна мати визначену і переважно бажану кристалічну модифікацію. Лікарські форми з уповільненим вивільненням часто бажані для оптимізації лікування не тільки через зменшення частоти прийому, але також через зменшення коливань концентрації речовини в крові. Зменшення максимальної концентрації препарату в крові може зменшити можливість появи побічних ефектів, пов'язаних із прийомом великої дози речовини, і, таким чином, поліпшити переносність препарату. Іншою перевагою режимів зниженої дози препарату є поліпшена зручність для пацієнтів і краща гарантія відповідності, оскільки порції лікарської речовини, що вивільняються, підтримують постійний рівень його концентрації в крові і не допускають коливань концентрації, як це буває при прийомі звичайних препаратів негайного вивільнення більш одного разу в день. Лікарська форма венлафаксину гідрохлориду з уповільненим вивільненням відома з попереднього рівня техніки. [Європейські патенти ЕР 0797911 і ЕР 1028718] описують сфероїди венлафаксину гідрохлориду в оболонці, де сфероїдне ядро, отримане шляхом видавлювання і сферонізації суміші лікарської речовини з мікрокристалічною целюлозою і гідроксипропілметилцелюлозою (ГПМЦ), покрито сумішшю етилцелюлози з гідроксипропілметилцелюлозою. У [WO 03/041692] описана композиція з уповільненим вивільненням, у якій венлафаксину гідрохлорид був об'єднаний зі зв'язувальною речовиною і розпилений на інертні ядра з цукру і крохмалю (nonpareil). Такі ядра в оболонці потім додатково покривали шаром полімеру, що дозволяє відбуватися контрольованому вивільненню гідрохлориду венлафаксину. Придатними покриваючими полімерами є сополімери метакрилової кислоти (ЕудрагітÒ) і похідні целюлози. У [WO 02/102129] описується спосіб одержання капсул пролонгованого вивільнення, наповнених мікрогранулами в потрійній оболонці, що містять венлафаксин. Сферичні мікрогранули з цукру і крохмалю спочатку змочуються розчином повідону, посилаються венлафаксину гідрохлоридом, а потім покриваються розчином етилцелюлози. Етилцелюлоза може бути замінена полімером ЕудрагітÒ, ефіром або складним ефіром целюлози. Даним способом одержується негомогенний шар активного інгредієнта, що негативно впливає на процес вивільнення речовини. У [US 2003/0190354] описується композиція продовженого вивільнення, що містить як активну речовину венлафаксину гідрохлорид, що випускається у формі матричних таблеток, де венлафаксин змішаний з комбінацією гідрофільних, наприклад, гідроксипропілметилцелюлоза (ГПМЦ), і гідрофобних, наприклад, етилцелюлоза, компонентів, що утворюють матрицю. КолідонÒ СР, ексципієнт на основі полівінілацетату, можна застосовувати як зв'язувальну речовину або в сухій формі, або у вигляді суспензії. Основною проблемою попередніх способів одержання венлафаксину гідрохлориду є зміна поліморфної форми активного компоненту. Жоден з попередніх документів не розглядає проблему збереження бажаної поліморфної форми венлафаксину гідрохлориду в процесі готування фармацевтичних препаратів. Збереження визначеної поліморфної форми лікарської речовини дуже важливо, зокрема, для поліпшення біодоступностi речовини, як було сказано вище. Тому, об'єктом даного винаходу є спосіб одержання фармацевтичної композиції з уповільненим вивільненням, що включає венлафаксину гідрохлорид, де форма венлафаксину не змінюється протягом процесу, навіть якщо лікарська речовина знаходиться в контакті з розчинниками, наприклад, з водою, що викликає поліморфну зміну венлафаксину гідрохлориду. Крім того, починаються спроби по зменшенню числа стадій способу, що дозволить зменшити вартість виробництва. Крім того, величезною перевагою могло б стати одержання композиції з такою пластичністю, що незначний вплив різних факторів не приводило б до її руйнування, що, у свою чергу, не приводило б до небажаного негайного вивільнення добре розчинного венлафаксину, і при цьому композиція мала б механізм самовідновлення при ушкодженні. Також бажано, щоб композиції забезпечували гомогенне вивільнення лікарської речовини. Всі описані проблеми несподівано вирішуються способом одержання фармацевтичної композиції, що містить венлафаксин або його фармацевтично прийнятну сіль, що включає наступні стадії: (1) одержання дисперсії (суспензії) венлафаксину або солі венлафаксину в розчиннику, у якому венлафаксин або солі венлафаксину мають розчинність менше 25г/літр при кімнатній температурі; (2) перетворення дисперсії, отриманої на стадії (1), у форму часток; (3) покривання часток, отриманих на стадії (2), шаром полімеру, що забезпечує уповільнене вивільнення діючої речовини. Розчинник, застосовуваний на стадії (1), є переважно одним, обраним із групи: 1-пропанол, 2-пропанол, бутанол, циклогексан, діетиловий ефір, гептан, ізопропілацетат, пропілацетат і толуол. Переважно, щоб розчинник не містив воду або етанол, тому що було встановлено, що ці розчинники сприяють поліморфним перетворенням. Переважно, щоб композиція містила венлафаксин у формі солі, переважно гідрохлориду, і більш переважно, у вигляді, власне кажучи, чистої або чистої поліморфної модифікації. Форма І венлафаксину гідрохлориду визначена в [статті Acta Crystallographica (2000) 356, 1009-101], різні поліморфні модифікації описані в [WO 02/45658, WO 02/36542, WO 02/46140, WO 03/042161, WO 03/048082, WO 03/050075 і WO 03/050074]. Поліморфна форма вважається, власне кажучи, чистою, якщо вона містить менше 5мас.%, переважно менше 2мас.% і більш переважно менше 1мас.% інших поліморфних форм. Найбільш краща форма - поліморфна форма І. Більш того, переважно, щоб дисперсія венлафаксину або його солі в розчиннику також містила зв'язувальну речовину, що переважно повинна бути розчинною в цьому розчиннику. Зв'язувальна речовина, яку застосовують на стадії (1), переважно може бути обрана з групи, що складається з целюлози, похідних целюлози, полівінілпіролідону (ПВП) та їхніх сумішей. Кращими похідними целюлози є гідроксипропілметилцелюлоза і/або гідроксипропілцелюлоза. Зокрема, на стадії (1) як зв'язувальна речовина застосовується гідроксипропілцелюлоза. Переважно, щоб співвідношення за масою венлафаксину або солі венлафаксину і зв'язувальної речовини в дисперсії на стадії (1) було щонайменше від 2:1 до 20:1 і навіть більш переважно, щоб співвідношення за масою знаходилося в межах від 8:1 до 14:1, з розрахунку за основою венлафаксину. Дисперсія, що одержується на стадії (1), може також містити речовину, що запобігає злипанню. Застосування такої речовини рекомендується у випадку, коли застосовується більш висока концентрація зв'язувальної речовини. Речовина, що запобігає злипанню, наприклад, така як тальк, зменшує злипання і, таким чином, запобігає укрупненню кульок, а також прилипання до стінок судини в процесі готування. На стадії (2) дисперсія переважно переводиться у форму часток шляхом нанесення дисперсії, отриманої на стадії (1), на інертні частки-ядра. Таким чином, одержувана фармацевтична композиція з уповільненим вивільненням містить інертні ядра, покриті першим шаром діючої речовини венлафаксину або його солі, і другим шаром полімеру, що забезпечує уповільнене вивільнення діючої речовини. Композиції можуть містити і додаткові розділяючі шари, що буде пояснено нижче. Інертні ядра переважно складаються в основному із сахарози, крохмалю, мікрокристалічної целюлози або їхньої суміші, переважно із суміші сахарози і крохмалю. Краще застосування часток nonpareil. На швидкість розчинення фармацевтичної композиції відповідно до винаходу несподівано не впливає ні природа, ні кількість матеріалу, що утворює інертне ядро. Полімер, що забезпечує уповільнене вивільнення діючої речовини, що застосовується на стадії (3), є переважно гідрофобним полімером, більш переважно обраним із групи: полівінілацетат (ПВА) і полівінілпіролідон (ПВП), полі(мета)акрилати, такі як сополімери метакрилової кислоти і/або акрилової кислоти з (мета)акрилатами, що містять функціональні групи, такі як триметил-амонійетилметакрилат, нейтральні полімери і сополімери метакрилової кислоти й акрилової кислоти, етилцелюлоза, метилцелюлоза та їхні суміші. Кожний з цих полімерів може застосовуватися окремо, два або більше цих полімерів можуть застосовуватися у вигляді окремих полімерних шарів або можуть застосовуватися у вигляді суміші. Полімери, що забезпечують уповільнене вивільнення діючої речовини, застосовуються у формі водяної суспензії або у формі розчину в органічному розчиннику. Особливо переважно, щоб полімер, що забезпечує уповільнене вивільнення діючої речовини, що застосовується! на стадії (3), був комбінацією ПВА і ПВП, або у формі окремих полімерних шарів, або у формі суміші цих полімерів. Було встановлено, що комбінація ПВА і ПВП забезпечує утворення композицій з високою пластичністю. В результаті одержувана композиція і, зокрема, другий шар є стійким до механічного впливу і має механізм самовідновлення, особливо коли частка, покрита другим шаром, попадає у водяне середовище. Завдяки механізму самовідновлення й абсолютної стабільності, можливість негайного вивільнення венлафаксину зменшується, тому безпека фармацевтичної композиції відповідно до винаходу збільшується. Додатковою вигодою є відсутність стадії затвердження цих полімерів. Більш того, на стадії (3) може бути застосована суміш, що містить полімер, що забезпечує уповільнене вивільнення діючої речовини, і пластифікатор для подальшого утворення плівки та її гнучкості. Придатні пластифікатори являють собою 1,2-пропіленгліколь, триетилцитрат, поліетиленгліколь, дибутилсебацинат і триацетин, найбільш краще застосування триетилцитрату як пластифікатора. Полімер, що забезпечує уповільнене вивільнення діючої речовини, і необов'язковий пластифікатор, що застосовуються на стадії (3), можна надалі об'єднати з речовиною, що запобігає злипанню, наприклад з тальком. Переважно, щоб співвідношення за масою речовини, що запобігає злипанню, і полімеру, що забезпечує уповільнене вивільнення діючої речовини, було щонайменше від 1:1 до 1:10, переважно від 1:2 до 1:5. Спосіб за винаходом може надалі переважно містити в собі додаткову стадію застосування поділяючого шару на композиціях, отриманих на стадії (2). Поділяючий шар переважно утворюється при застосуванні водяної суспензії або органічного розчину придатного полімеру, що переважно вибирається з групи, що включає в себе целюлозу і похідні целюлози, полівінілпіролідон, полівініловий спирт (ПВС) та їхні суміші. Кращі похідні целюлози являють собою гідроксипропілцелюлозу і гідроксипропілметилцелюлозу. Крім полімерів, що застосовуються для створення поділяючого шару або суспензії розчини можуть переважно містити речовини, що перешкоджають злипанню, наприклад тальк. У кращому втіленні спосіб за винаходом, таким чином, приводить до утворення фармацевтичної композиції, що містить: (а) інертні ядра, (б) перший шар, що містить венлафаксин і необов'язково також сполучну речовину, що наноситься на інертні ядра (а), і (в) другий шар, що містить полімер, що забезпечує уповільнене вивільнення діючої речовини, і необов'язково зв'язувальну речовину і пластифікатор, що наноситься на шар (б) або необов'язковий шар (г), і (г) необов'язковий поділяючий шар, що наноситься на шар (б), тобто міститься між шарами (б) і (в). Таким чином, композиція застосовується переважно у формі часток, таких як кульки, сфероїди або гранули. Дискретні частки в оболонці можуть міститися в більших, таких як капсули, або з них можуть формувати таблетки. Перед нанесенням наступного шару попередній шар переважно повинен бути висушений. Інертні ядра можуть бути покриті першим і другим шарами і необов'язковим поділяючим шаром із застосуванням ванночки з псевдоожиженим шаром або ванночки з розчином. Переважно використовується апарат для нанесення рідких покриттів, наприклад донний, тангенціальний або розпорошуючий зверху речовину оболонки. Апарат для нанесення рідких покриттів, наприклад від Вурстера або Хьюттліна, являє собою систему, у якій повітряний струмінь, що подається з-під інертних ядер, змочує й у той же час забезпечує висушування першого і другого шару після їхнього нанесення на ядра. Кращий спосіб виробництва даної композиції має ряд переваг, тому що обидві фази способу, тобто покривання, висушування й утворення першого і другого шарів, може проходити в одній ємності. Завдяки цьому факту, відтворюваність способу і, таким чином, якість одержуваної фармацевтичної композиції є високими. Необов'язково, частки, що розрізняються товщиною першого і/або другого шару, з'єднуються перед формуванням з них великих одиниць або таблеток. Шляхом комбінування часток, таких як кульки, що розрізняються товщиною їхнього другого шару, можна регулювати до бажаного рівня швидкість вивільнення діючої речовини. Було несподівано встановлено, що поліморфні форми венлафаксину гідрохлориду не змінюються в процесі одержання способом за винаходом, навіть якщо при нанесенні полімеру, що забезпечує уповільнене вивільнення діючої речовини, або при нанесенні поділяючого шару застосовується водомістка дисперсія. Більш того, спосіб за винаходом приводить до утворення дуже однорідного шару, що містить активний компонент. Фармацевтична композиція, що одержується способом за винаходом, також є об'єктом винаходу. Ці композиції переважно мають форму часток, кульок, сфероїдів, гранул, таблеток або капсул. Композиція переважно містить венлафаксин або сіль венлафаксину в кількості від 15 до 50мас.%, переважно від 20 до 45мас.%, і більш переважно від 22 до 37мас.%, з розрахунку за формою основи. Під визначенням «з розрахунку за формою основи» мається на увазі, що кількість венлафаксину, що не знаходиться у вільній формі основи, наприклад, у формі кращого гідрохлориду, повинна бути переведена у відповідну кількість вільної форми основи. Наприклад, фармацевтична композиція, що містить 50мг кращого венлафаксину гідрохлориду, що має молярну масу 330,87г/моль, відповідала б 41,92мг венлафаксину, що має молярну масу 277,40г/моль. На додаток до активного компоненту перший шар переважно також містить зв'язувальну речовину. Зв'язувальна речовина переважно додається в такій кількості, що кінцевий продукт містить від 2 до 5мас.%, як від 2 до 4,5мас.%, більш переважно від 3 до 5мас.%, як від 3 до 4,5мас.%, і більш переважно від 3 до 4мас.% зв'язувальної речовини від загальної маси фармацевтичної композиції. Композиція за винаходом переважно містить полімер, що забезпечує уповільнене вивільнення діючої речовини, у кількості від 2 до 35мас.%, переважно від 3 до 30мас.%, і більш переважно від 4 до 25мас.% від загальної маси композиції. Швидкість вивільнення венлафаксину з композиції за даним винаходом зменшується зі збільшенням товщини другого шару, що містить полімер, що забезпечує уповільнене вивільнення діючої речовини. Швидкість вивільнення є кількістю венлафаксину, що виділяється з композиції за визначений проміжок часу. На початковій стадії вода повинна проникнути через другий шар і прийти в контакт із частками або таблеткою для того, щоб щонайменше частково розчинити венлафаксин перед тим як венлафаксин дифундує через другий шар. Крім часу вивільнення, товщина другого шару також впливає на час затримки. Час затримки являє собою час між першим контактом фармацевтичної композиції з водою і першим обумовленим вивільненням венлафаксину. Зі збільшенням товщини другого шару час затримки також збільшується. Переважно, щоб кількість пластифікатора в другому шарі було в межах від 0 до 20мас.% від маси сухого полімеру, що забезпечує уповільнене вивільнення діючої речовини. Фармацевтична композиція за даним винаходом містить інертні ядра в кількості переважно від 20 до 55мас.%, більш переважно від 25 до 50мас.%, і найбільш переважно від 30 до 45мас.% від загальної маси фармацевтичної композиції. При наявності поділяючого шару, полімер, його утворюючий, переважно складає від 1 до 5мас.% у фармацевтичній композиції. Крім того, розділяючий шар може містити речовину, що перешкоджає злипанню, переважно в кількості від 0,1 до 5мас.% від загальної маси фармацевтичної композиції. Підтримування поліморфної форми^І при здійсненні способу за даним винаходом показано на Фіг.1-6. На Фіг.1 показаний спектр дифракції рентгенівських променів у порошку (ДРЛП) для кульок, отриманих за Прикладом 1, обмірюваний відразу ж після їхнього одержання; На Фіг.2 показаний спектр ДРЛП для кульок, отриманих за Прикладом 1, обмірюваний після 1 місяця збереження зразків у пластиковому контейнері з осушувачем при температурі 40°С и відносній вологості 75%; На Фіг.3 показаний спектр ДРЛП для кульок, отриманих за Прикладом 1, обмірюваний після 1 місяця збереження зразків у відкритому пластиковому контейнері при температурі 25°С и відносній вологості 60%; На Фіг.4 показаний спектр ДРЛП для кульок, отриманих за Прикладом 1, обмірюваний після 1 місяця збереження зразків в алюміній/алюмінієвому упакуванні при температурі 40°С и відносній вологості 75%; На Фіг.5 показаний спектр ДРЛП для кульок, отриманих за Прикладом 4, обмірюваний відразу після їхнього одержання, і На Фіг.6 показаний спектр ДРЛП поліморфної форми І венлафаксину. Винахід проілюстрований наступними прикладами: Приклади Приклад 1: LP-10A-B14 89,6г гідроксипропілцелюлози розчиняли в 1781,85г 1-пропанолу. До отриманого розчину додавали 1187,90г гідрохлориду венлафаксину, після чого дисперсію гомогенізували в спеціальному змішувачі до одержання, власне кажучи, гомогенної дисперсії. Потім цю дисперсію розпорошували на інертні ядра масою 1260г, тобто на зерна nonpareil, що містять суміш сахарози і крохмалю, у ванні Вурстера з псевдоожиженим шаром для одержання ядер з першим шаром. 1214,4г ядер в оболонці додатково покривали водяною дисперсією масою 568,4г, що містить 30мас.% ПВА і ПВП, триетилцитратом масою 17,2г, тальком масою 60,9г і дистильованою водою масою 568,4г у ванні Вурстера. Зразки зберігалися протягом 1 місяця при різних умовах у: - Пластикових контейнерах з осушувачем при 40°С и відносній вологості 75%; - У відкритому пластиковому контейнері при 25°С и відносній вологості 60%; - В алюміній/алюмінієвому упакуванні при 40°С и відносній вологості 75%. Приклад 2: LP-17A-NE30 124,80г гідроксипропілцелюлози розчиняли в 2481,86г 1-пропанолу. До отриманого розчину додавали 1654,58г гідрохлориду венлафаксину, після чого дисперсію гомогенізували в спеціальному змішувачі до одержання, власне кажучи, гомогенної дисперсії. Потім цю дисперсію розпорошували на інертні ядра масою 1755,00г, тобто на зерна nonpareil, що містять суміш сахарози і крохмалю, у ванні Вурстера для одержання ядер з першим шаром. 1305,00г ядер в оболонці додатково покривали у ванні Вурстера Еудрагітом НЕ 40 Д масою 978,75г, тальком масою 391,50г і дистильованою водою масою 1436,81г. Приклад 3: LP-15A-V-E30 115,20г гідроксипропілцелюлози розчиняли в 2290,95г 1-пропанолу. До отриманого розчину додавали 1527,30г гідрохлориду венлафаксину, після чого дисперсію гомогенізували в спеціальному змішувачі до одержання, власне кажучи, гомогенної дисперсії. Потім цю дисперсію розпорошували на інертні ядра масою 1620,00г, тобто на зерна nonpareil, що містять суміш сахарози і крохмалю, у ванні Вурстера для одержання ядер з першим шаром. 1540,63г ядер в оболонці додатково покривали у ванні Вурстера гідроксипропілцелюлозою масою 46,22г, тальком масою 52,30г і 1-пропанолом масою 1000,00г. 1542,73г ядер в оболонці додатково покривали у ванні Вурстера Еудрагітом PC 30 Д масою 1542,73г, триетилцитратом масою 92,56г, тальком масою 231,41г і дистильованою водою масою 2005,55г. Приклад 4: LP-01A 525г гідрохлориду венлафаксину розчиняли в 918г дистідльованої води. До отриманого розчину додавали 72г тальку, після чого дисперсію гомогенізували в спеціальному змішувачі до одержання, власне кажучи, гомогенної дисперсії. Потім цю дисперсію розпорошили у ванні Вурстера на інертні ядра масою 1225г, тобто на зерна nonpareil, що містять суміш сахарози і крохмалю, для одержання ядер з першим шаром. Приклад 5: LP-21 A-V-B7 128,00г гідроксипропілцелюлози розчиняли в 2545,50г 1-пропанолу. До отриманого розчину додавали 1697,00г гідрохлориду венлафаксину, після чого дисперсію гомогенізували в спеціальному змішувачі до одержання, власне кажучи, гомогенної дисперсії. Потім цю дисперсію розпорошували у ванні Вурстера на інертні ядра масою 1500,00г, тобто на зерна nonpareil, що містять суміш сахарози і крохмалю, для одержання ядер з першим шаром. 2992,50г ядер в оболонці додатково покривали у ванні Вурстера розчином, що містить 74,81г полівінілпіролідону в 1197,00г етанолу. 2931,00г ядер в оболонці додатково покривали у ванні Вурстера сумішшю, що містить 205,17г етилцелюлози, 20,52г дибутилсебацинату і 3385,00г етанолу.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for preparing of pharmaceutical composition, containing venlafaxine, and composition
Автори англійськоюPisek Robert, Zuppancic Silvo, Segula Zakelj Mojca
Назва патенту російськоюСпособ получения фармацевтической композиции, содержащей венлафаксин, и композиция
Автори російськоюПисек Роберт, Жупанчич Силво, Сегула Закель Мойца
МПК / Мітки
МПК: A61K 9/16, A61K 31/137
Мітки: венлафаксин, одержання, фармацевтично, включає, спосіб, композиції, композиція
Код посилання
<a href="https://ua.patents.su/7-83437-sposib-oderzhannya-farmacevtichno-kompozici-shho-vklyuchaeh-venlafaksin-ta-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фармацевтичної композиції, що включає венлафаксин, та композиція</a>
Попередній патент: Прилад для аналізу колоїдів та золів
Наступний патент: Пристрій для одержання заліза або сталі з залізооксидного матеріалу
Випадковий патент: Гідродвигун мігу-1