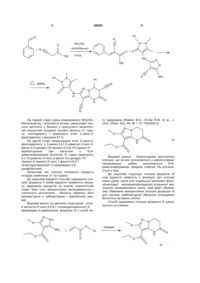
5-оксо-2,3-дизаміщені-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміди і спосіб їх одержання
Номер патенту: 96555
Опубліковано: 10.11.2011
Автори: Руденко Роман Владимирович, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Комихов Сергій Олександрович
Формула / Реферат
1. 5-Оксо-N-арил-2,3-дизаміщені-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміди загальної формули
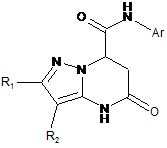 ,
,
в якій R1 = Н; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4;
R2 = СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; 2-Сl-С6Н4; 2-СН3О-С6Н4; 3,4-ди-CH3O-C6H4;
Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 3-СН3О-С6Н4; 2,4-ди-CH3O-C6H3; 3,4-OCH2O-C6H4; 3-F-C6H4; 3-Cl-C6H4; 2-F-C6H4; 4-Br-C6H4; 4-EtO2C-C6H4; 2,4-ди-CH3-C6H3; 2,5-ди-CH3-C6H3; 3,4-ди-CH3-C6H3; 3,4-ди-F-C6H3; 2,4-ди-F-C6H3; 2,4-ди-Cl-C6H3; 4-F-C6H4; 4-CF3-C6H4; 3-CF3-C6H4; 2-CH3O-C6H4; 2-CF3-C6H4; 2-CH3O-5-Cl-C6H3; 4-CH3O-3-Cl-C6H3; 2,5-CH3O-C6H3; 3,4-ди-CH3O-C6H3.
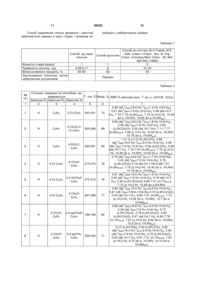
2. Спосіб одержання 5-оксо-N-арил-2,3-дизаміщених-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули
 ,
,
в якій R1 = Н; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4;
R2 = СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; 2-Сl-С6Н4; 2-СН3О-С6Н4; 3,4-ди-CH3O-C6H4;
Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 3-СН3О-С6Н4; 2,4-ди-CH3O-C6H3; 3,4-OCH2O-C6H4; 3-F-C6H4; 3-Cl-C6H4; 2-F-C6H4; 4-Br-C6H4; 4-EtO2C-C6H4; 2,4-ди-CH3-C6H3; 2,5-ди-CH3-C6H3; 3,4-ди-CH3-C6H3; 3,4-ди-F-C6H3; 2,4-ди-F-C6H3; 2,4-ди-Cl-C6H3; 4-F-C6H4; 4-CF3-C6H4; 3-CF3-C6H4; 2-CH3O-C6H4; 2-CF3-C6H4; 2-CH3O-5-Cl-C6H3; 4-CH3O-3-Cl-C6H3; 2,5-CH3O-C6H3; 3,4-ди-CH3O-C6H3,
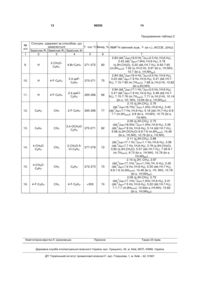
що включає конденсацію рівномолярних кількостей 5-амінопіразолу і відповідної карбонільної сполуки в органічному розчиннику при кип'ятінні, причому як 5-амінопіразол використовують 3,4-дизаміщені 5-амінопіразоли формули
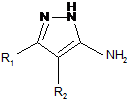 ,
,
як карбонільну сполуку - N-арилмалеіміди формули
 ,
,
як органічний розчинник - N,N-диметилформамід, конденсацію проводять протягом 5-10 хвилин до утворення цільового продукту, а його виділення здійснюють осадженням ацетоном.
Текст
1. 5-Оксо-N-арил-2,3-дизаміщені-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміди загальної формули H O N Ar І 3 96555 4 утворення цільового продукту, а його виділення здійснюють осадженням ацетоном. Винахід належить до області органічної хімії, а саме, до 5-oкco-N-арил-2,3-дизаміщених-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули І і способу їх одержання. H O N Ar ня як кардіостимулюючий препарат для лікування гострої серцевої недостатності [Altmore С. et. al., Bioorg. Med. Chem., 909 (2000)], протипухлинних і антибактеріальних лікарських засобів [Zi Q. et al., Med. Res. Rev., 20, 231, (2000)], протигрибкової активності [Gupta A.K. et al., Br. J. Dermotol., 149, 296, (2003)] і т. ін. Сполучення в одній молекулі піразольного та піримідинового фрагментів з фармакофорною карбоксамідною групою дозволить розширити асортимент нових потенційних лікарських препаратів і біологічно активних речовин з новими властивостями і практичним застосуванням. Відомий структурний аналог сполук, що заявляються,-2-(1,5-диметил-3-оксо-2-феніл-2,3дигідро-1Н-піразол-4-іламіно)-5-оксо-7-феніл4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-3,6дикарбонітрил формули II N R1 N I N H R2 O , R1 = Н; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-СН3О-С6Н4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-СвН4; R2 = СН3; С6Н5; 4-Cl-C6H4; 4-F-C6H4; 4-CH3OC6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; 2-Сl-С6Н4; 2-СН3О-С6Н4; 3,4-ди-CH3O-C6H4; Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 3-СН3О-С6Н4; 2,4-ди-CH3O-C6H3; 3,4-OCH2O-C6H4; 3-F-C6H4; 3-Cl-C6H4; 2-F-C6H4; 4-Br-C6H4; 4-EtO2C-C6H4; 2,4-ди-CH3C6H3; 2,5-ди-CH3-C6H3; 3,4-ди-CH3-C6H3; 3,4-ди-FC6H3; 2,4-ди-F-C6H3; 2,4-ди-CI-C6H3; 4-F-C6H4; 4-CF3-C6H4; 3-CF3C6H4; 2-CH3O-C6H4; 2-CF3-C6H4; 2-CH3O-5-Cl-C6H3; 4-CH3O-3-CI-C6H3; 2,5-CH3O-C6H3; 3,4-диCH3O-C6H3. Сполуки формули І є складними азотовмісними гетероциклічними системами і мають фармакофорну карбоксамідну групу, яка сприяє виявленню снотворного ефекту у потенційних лікарських препаратах. [А. Т. Солдатенков и др. "Основы органической химии лекарственных веществ", Москва: Изд. "БИНОМ", Лаборатория знаний, 2007]. Різні похідні піразолів і піримідинів використовуються як терапевтичні засоби проти гострого і хронічного запалення, ішемічних процесів, призначені для лікування патологічних станів, насамперед, ревматоїдного артриту, розсіяного склерозу, запалення кишечника, астми і т. ін. [Пат. РФ 2266901,C07D234/54, А61К31/513]. У складі багатьох лікарських препаратів піримідиновий фрагмент також знаходить застосуван Ph N Ph N N N O N H N II N H N O , і спосіб його одержання [D.A Fatalla, М.Е. Zaki, Indian J.Chem., Sec. В: Org. Chem. Including Med. Chem., 38, №5, 484-490 (1998)]. Сполука формули II розчиняється в полярних розчинниках (N,N-диметилформамід, піридин, диметилсульфоксид), малорозчинна у неполярних розчинниках (бензол, толуол), не розчиняється у воді. Недоліком структури сполуки формули II є неможливість різноманітити структуру аналога шляхом введення замісників, всі положення зайняті оксо-, нітрильними і метильними групами. Крім того, модифікація структури аналога утруднюється, оскільки є тільки один реакційний центр -NHгрупа. Спосіб одержання відомої структури II складається із двох стадій і реалізується за схемою: 5 96555 6 O Ph N N NH4OAc O AcOH/бензол + N OEt N O + O 21год HN N OEt Ph N N NH2 Ph N , ДМФА N N N O N N H N H O N . На першій стадії суміш зневодненого NH4OAc, бензальдегіду і етилового естеру ціаноцтової кислоти кип'ятять у бензолі у присутності каталітичних кількостей льодяної оцтової кислоти 21 годину, охолоджують і одержують етил 2-ціано-3фенілакрилат з виходом 67 %. На другій стадії конденсацією етил 2-ціано-3фенілакрилату з 5-аміно-3-[(1,5-диметил-3-оксо-2феніл-2,3-дигідро-1Н-піразол-4-іл)]-1Н-піразол-4карбонітрилом при кип'ятінні у N,Nдиметилформаміді протягом 10 годин одержують 2-(1,5-диметил-3-оксо-2-феніл-2,3-дигідро-1Нпіразол-4-іламіно)-5-оксо-7-феніл-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-3,6дикарбонітрил. Загальний час синтезу основного продукту складає приблизно 31-32 години. До недоліків відомого способу одержання сполуки формули II треба віднести тривалість процесу, виділення продуктів на кожній технологічній стадії. Крім того, використання легкозаймистого і токсичного розчинника - бензолу обмежує його використання у лабораторних і виробничих умовах. Відомий аналог за хімічною структурою - етил2-метилтіо-5-оксо-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-3-карбоксилат формули III і спосіб йо N го одержання [Raslan M.A., El-Aal R.M. et al., J. Chin. Chem. Soc, 48, № 1, 91-100(2001)]: N N S N H O O , Відомий аналог - безкольорова кристалічна сполука, що погано розчиняється у малополярних середовищах, добре розчиняється N,Nдиметилформаміді, піридині, спиртах. Не розчиняється у воді. До недоліків структури сполуки формули III слід віднести наявність у молекулі цієї сполуки лише однієї групи для подальшої можливої функціоналізації - малореакційноздатної вторинної аміногрупи піримідинового циклу. Цей факт обумовлює обмежене використання сполуки формули III для синтезу комбінаторних бібліотек потенційних біологічно активних сполук. Спосіб одержання сполуки формули III реалізується за схемою: NH S N NH2 O O O + піридин N S Et O III O N H O O O III . 7 96555 Суміш етилового естеру 5-аміно-3метилтіопіразол-4-карбонової кислоти і етилового естеру акрилової кислоти нагрівають у піридині 6 годин при температурі кипіння розчинника. Одержують етил-2-метилтіо-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-3-карбоксилат з виходом 62 %. Недоліком відомого способу одержання сполуки формули III є тривалий процес із застосуванням токсичного, вогненебезпечного розчинника піридину, а також низький вихід основного продукту. Сполука формули III і спосіб її одержання як найбільш близький за технічною суттю вибраний нами як прототип. В основу винаходу поставлено задачу пошуку нових сполук у низці азолопіримідинів, а також розробки простого і доступного способу одержання 5-оксо-N-арил-2,3-дизаміщених-4,5,6,7тетрагідропіразоло[1,5-а]-піримідин-7карбоксамідів загальної формули І, у якому за рахунок зміни умов синтезу можна зменшити тривалість процесу, підвищити вихід цільових продуктів, виключити застосування токсичних, вогненебезпечних розчинників. Рішення поставленої задачі забезпечується розробкою 5-оксо-N-арил-2,3-дизаміщених-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксамідів загальної формули І H O N Ar N R1 N I N H R2 O , R1 = Н; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-СН3О-С6Н4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; R2 = СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3OC6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; 2-Сl-С6Н4; 2-СН3О-С6Н4; 3,4-ди-CH3O-C6H4; Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 3-СН3О-С6Н4; 2,4-ди-CH3O-C6H3; 3,4-OCH2O-C6H4; 3-F-C6H4; 3-Cl-C6H4; 2-F-C6H4; 4-Br-C6H4; 4-EtO2CC6H4; 2,4-ди-CH3-C6H3; 2,5-ди-CH3-C6H3; 3,4-диCH3-C6H3; 3,4-ди-F-C6H3; 2,4-ди-F-C6H3; 2,4-ди-ClC6H3; 4-F-C6H4; 4-CF3-C6H4; 3-CF3-C6H4; 2-CH3OC6H4; 2-CF3-C6H4; 2-СН3О-5-Сl-С6Н3; 4-CH3O-3-ClC6H3; 2,5-CH3O-C6H3; 3,4-ди-CH3O-C6H3. Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І 8 H N O Ar N R1 N I N H O R2 , R1 = Н; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3O-C6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; R2 = СН3; С6Н5; 4-Сl-С6Н4; 4-F-C6H4; 4-CH3OC6H4; 4-СН3-С6Н4; 4-Вr-С6Н4; 3-Сl-С6Н4; 2-Сl-С6Н4; 2-СН3О-С6Н4; 3,4-ди-CH3O-C6H4; Аr = С6Н5; 4-Сl-С6Н4; 2-Сl-С6Н4; 4-СН3О-С6Н4; 3-СН3О-С6Н4; 2,4-ди-CH3O-C6H3; 3,4-OCH2O-C6H4; 3-F-C6H4; 3-Cl-C6H4; 2-F-C6H4; 4-Br-C6H4; 4-EtO2CC6H4; 2,4-ди-CH3-C6H3; 2,5-ди-CH3-C6H3; 3,4-диCH3-C6H3; 3,4-ди-F-C6H3; 2,4-ди-F-C6H3; 2,4-ди-ClC6H3; 4-F-C6H4; 4-CF3-C6H4; 3-CF3C6H4; 2-CH3OC6H4; 2-CF3-C6H4; 2-СН3О-5-Сl-С6Н3; 4-CH3O-3-ClC6H3; 2,5-CH3O-C6H3; 3,4-ди-CH3O-C6H3, що включає конденсацію рівномолярних кількостей 5-амінопіразолу і карбонільної сполуки в органічному розчиннику при кип'ятінні, згідно з винаходом, як 5-амінопіразол використовують 3,4дизаміщені 5-амінопіразоли формули H N N NH2 R1 R2 , як карбонільну сполуку - N-арилмалеіміди формули Ar O N O , як органічний розчинник використовують N,Nдиметилформамід, конденсацію проводять протягом 5-10 хвилин до утворення цільового продукту, і виділення одержаного продукту здійснюють осадженням ацетоном. Вибір компонентів і проведення реакції їх взаємодії в умовах, що заявляються, дозволяє підвищити вихід кінцевих продуктів, значно розширити їх асортимент, значно зменшити енерговитрати, забезпечити високу швидкість протікання реакції, що приводить до значного скорочення тривалості технологічного процесу. В залежності від замісників R1 та R2 у піразольному фрагменті і Аr у піримідиновій складовій, спосіб, що заявляється, дозволяє широко модифікувати хімічну структуру цільових продуктів, одержувати великий набір потенційних біологічно активних речовин. 9 96555 У способі одержання сполук формули І зменшення тривалості реакції до 5-10 хвилин є дуже суттєвим (у способі-прототипі 6 годин); виходи чистих продуктів (без застосування перекристалізації) підвищуються до 80 %. Збільшення або зменшення часу нагрівання реакційної суміші є недоцільним, оскільки реакція проходить швидко і повністю за вказаний проміжок часу з високими виходами. Чистоту цільових продуктів підтвердже1 но спектрами Н ЯМР спектроскопії. Вибір розчинника для реакції - N,Nдиметилформаміду - забезпечує не тільки високу температуру реакційної маси 153 °C (піридин у 10 способі-прототипі має Ткип = 115 °C), що сприяє швидкому проходженню реакції за 5-10 хвилин, але й забезпечує необхідну пожежонебезпечність проведення синтезу. У таблиці 1 наведено порівняльні характеристики способу, що заявляється і способів одержання сполук формули II, III. У таблиці 2 дано температури топлення, вихо1 ди основних продуктів реакції і їх спектри Н ЯМР. Спосіб одержання 5-оксо-N-арил-2,3дизаміщених-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-7-карбоксамідів здійснюється за схемою: H N O Ar N R1 NH Ar NH2 + O N N O R2 , ДМФА N R1 N H O R2 I Суміш заміщеного 5-амінопіразолу і відповідного N-арилмалеіміду (рівномолярні кількості) нагрівають у N,N-диметилформамiді протягом 5-10 хвилин. Після охолодження додають ацетон, відфільтровують осад, що випав, який промивають невеликою кількістю ацетону і сушать. Нижче наведено приклади конкретного виконання синтезу заміщених 5-оксо-N-арил-2,3заміщених-4,5,6,7-тетрагідро-піразоло[1,5а]піримідин-7-карбоксамідів. Приклад 1. Одержання 3-феніл-N-(2хлорфеніл)-5-оксо-4,5,6,7-тетрагідропіразоло[1,5а]піримідин-7-карбоксаміду. Рівномолярну суміш 0,48 г (3 ммоль) 4-феніл5-амінопіразолу і 0,63 г (3 ммоль) N-(2хлорфеніл)малеіміду у 0,5 мл ДМФА нагрівають у пробірці протягом 5 хвилини. Після охолодження додають 10 мл ацетону і залишають реакційну масу на 30 хвилин, після цього фільтрують осад, що випав, промивають невеликою кількістю ацетону, сушать. Вихід продукту складає 0,82 г (74 %). Температура топлення 240-241 °C. 1 Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J 2 3 (Hz): 2.85 (dd, JAB=16.6 Hz, JAX=1.4 Hz, 1H,6-Ha), 3 3.51 (dd, JBX=7.9 Hz, 1H,6-Hb), 5.49 (dd, 1H,7-Hx), 7.15-7.73 (m, 9Harom), 7.74 (s, 1H, 2-H), 10.04 (br.s, 1H, NH), 10.65 (br.s, 1H, NHpyr). Приклад 2. Одержання N-(4-бромфеніл)-3-(2метоксифеніл)-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміду. Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,57 г (3 ммоль) 4-(2метоксифеніл)-5-амінопіразолу і 0,76 г (3 ммоль) N-(4-бромфеніл)малеіміду. Час нагрівання 10 хвилин. Вихід продукту складає 1,06 г (80 %). Темпе1 ратура топлення 271-272 °C. Спектр Н ЯМР . (м.ч.), КССВ J (Hz): 2.83 (ДМСО-d6) 2 3 (dd, JAB=16.9 Hz, JAX=2.3 Hz, 1H,6-Ha), 3.43 3 (dd, JBX=7.9 Hz, 1H, 6-Hb), 3.78 (s, 3H, CH3O), 5.22 (dd, 1H, 7-Hx), 6.92-7.65 (m, 8Harom), 7.52 (s, 1H, 2H), 9.97 (br.s, 1H, NH), 10.7 (br.s, 1H, NHpyr). Приклад 3. Одержання 4-метил-3-(4фторфеніл)-N-(фторфеніл)-5-оксо-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміду. Реакцію проводять аналогічно прикладу 1. Для реакції беруть: 0,58 г (3 ммоль) 3-метил-4-(4фторфеніл)-5-амінопіразолу і 0,57 г (3 ммоль) N(4-фторфеніл)-малеiмiду. Час нагрівання 5 хвилин. Вихід продукту складає 0,85 г (74 %). Темпе1 ратура топлення більше 300 °C. Спектр Н ЯМР (ДМСО-d6) (м.ч.), КССВ J (Hz): 2.08 (s, 3Н, СН3), 2 3 2.79 (dd, JAB=17.1 Hz, JAX-1.0 Hz, 1H, 6-Ha), 3.41 (dd, VBX=7.5 Hz,1H,6-Hb), 5.22 (dd,1H,7-Hx), 7.1-7.7 (m,8Harom), 10.6 (br.s, 1H,NH), 10.82 (br.s, 1H,NHpyr). Решту прикладів наведено у таблиці 2. Як видно із тексту матеріалів, структура сполук, що заявляються, забезпечує одержання широкого асортименту 5-оксо-N-арил-2,3-заміщених4,5,6,7-тетрагідро-піразоло[1,5-а]піримідин-7карбоксаміду з високим ступеням чистоти, що не потребують додаткової перекристалізації. Спосіб одержання сполук формули І, що пропонується, дозволяє: - значно зменшити тривалість процесу до 5-10 хвилин; - збільшити вихід і якість сполук формули І; - широко варіювати замісники Аr, R1 і R2 в сполуках, що заявляються; - синтезувати будь-які кількості кінцевих продуктів, виходячи із кількостей вихідних речовин; - забезпечити відсутність токсичних і пожежонебезпечних розчинників. 11 96555 Спосіб одержання сполук формули І простий, здійснюється швидко в одну стадію і пройшов ап 12 робацію у лабораторних умовах. Таблиця 1 Кількість стадій реакції Тривалість синтезу, год. Вихід основного продукту, % Застосування токсичних, вогненебезпечних розчинників Спосіб за статтею (D.A Fatalla, M.E. Спосіб, що заявZaki, Indian J.Chem., Sec. В: Org. Спосіб-прототип ляється Chem. Including Med. Chem., 38, №5, 484-490 (1998)) 1 1 2 0,08-0,17 6 31-32 65-82 62 55 Піридин Таблиця 2 № п/п 1 1. 2. 3. 4. 5. 6. 7. 8. Сполуки, одержані за способом, що заявляється T. топ.°С Вихід, % ЯМР1Н хімічний зсув, (м.ч.), (KCCB, J(Hz)) Замісник R1 Замісник R2 Замісник Аr 2 3 4 5 6 7 2 3 2.85 (dd, JAB=16.6 Hz, JAX=1.4 Hz,1H,6-Ha), 3 3.51 (dd, JBX=7.9 Hz,1H,6-Hb), 5.49 (dd,1H,7Н С6Н52-Сl-С6Н4- 240-241 74 Hx), 7.15-7.73 (m,9Harom), 7.74 (s,1H,2-H), 10.04 (br.s, 1H,NH), 10.65 (br.s,1H,NHpyr). 2 3 2.83 (dd, JAB=16.6 Hz, JAX=1.8 Hz,1H,6-Ha), 3 3.45 (dd, JBX=7.8 Hz,1H,6-Hb), 3.82 4-СН3О-3Н С6Н5265-266 68 (s,3H,CH3O), 5.20 (dd,1H,7-Hx), 7.11-7.77 Сl-С6Н3(m,8Harom), 7.69 (s,1H,2-H), 10.63 (br.s, 1H,NH), 10.76 (br.s, 1H,NHpyr). 1.31 (t,J=7.0 Hz,3H,CH3), 2.88 2 3 (dd, JAB=16.5 Hz, JAX=2.0 Hz,1H,6-Ha), 3.48 4-EtO2C3 H С6Н5290-291 80 (dd, JBX=7.6 Hz,1H,6-Hb), 4-28 (q,2H,CH2), 5.28 С6Н4(dd,1H,7-Hx), 7.18-7.97 (m,9Harom), 7.70 (s,1H,2H), 10.58 (br.s, 1H,NH), 10.92 (br.s, 1H,NHpyr). 2 3 2.79 (dd, JAB=16.6 Hz, JAX=1.7 Hz,1H,6-Ha), 3 3.43 (dd, JBX=7.9 Hz,1H,6-Hb), 3.70 4-СН3ОH 4-Сl-С6Н4273-274 78 (s,3H,CH3O) 5.19 (dd,1H,7-HO,6.86-7.51 С6Н4(m,8Harom), 7.70 (s,1H,2-H), 10.42 (br.s, 1H,NH). 10.79 (br.s, 1H,NHpyr). 2 3 2.81 (dd, JAB=16.5 Hz, JAX=1.8 Hz,1H,6-Ha), 3 3,4-ОСН2О3.45 (dd, JBX=7.8 Hz,1H,6-Hb), 5.19 (dd,1H,7Н 4-Сl-С6Н4272-273 76 С6Н3Hx), 5.99 (s,2H,OCH2O) 6.85-7.51 (m,7Harom), 7.72 (s,1H,2-H), 10.48 (br.s,2H,NH). 2 3 2.82 (dd, JAB=16.5 Hz, JAX=2.0 Hz,1H,6-Ha), 3 3.47 (dd, JBX=7.6Hz,1H,6-Hb),3.72 (s,3H,CH3O), 3-СН3ОН 4-Сl-С6Н4267-268 77 5.23 (dd,1H,7-Hx), 6.65-7.51 (m,8Harom), 7.72 С6Н4(s,1H,2-H), 10.54 (br.s, 1H,NH), 10.7 (br.s, 1H,NHpyr). 2 3 2.86 (dd, JAB=16.6 Hz, JAX=2.0 Hz,1H,6-Ha), 3 3.39 (dd, JBX=7.9 Hz,1H,6-Hb), 3.73 2-СН3О- 2,4-диСН3О(s,3H,CH3O), 3.78 (s,3H,CH3O), 3.83 Н 188-189 65 С6Н4С6Н3(s,3H,CH3O), 5.47 (dd,1H,7-Hx), 6.45-7.78 (m,7Harom), 7.57 (s,1H,2-H), 9.42 (br.s, 1H,NH), 10.2 (br.s, 1H,NHpyr). 2.15 (s,3H,CH3), 2.24 (s,3H,CH3), 2.82 2 3 (dd, JAB=16.4 Hz, JAX=2.0 Hz,1H,6-Ha), 3.45 3 2-СН3О2,4-диСН3(dd, JBX=7.9 Hz,1H,6-Hb), 3.78 (s,3H,CH3O), Н 239-240 71 С6Н4С6Н35.33 (dd,1H,7-Hx), 6.91-7.31 (m,7Harom), 7.55 (s,1H,2-H), 9.70 (br.s, 1H,NH), 10.14 (br.s, 1H,NHpyr). 13 96555 14 Продовження таблиці 2 № п/п 1 9. 10. 11. 12. 13. 14. 15. 16. Сполуки, одержані за способом, що заявляється T. топ.°С Вихід, % ЯМР1Н хімічний зсув, (м.ч.), (KCCB, J(Hz)) Замісник R1 Замісник R2 Замісник Аr 2 3 4 5 6 7 2 3 2.83 (dd, JAB=16.9 Hz, JAX=2.3 Hz,1H,6-Ha), 3 3.43 (dd, JBX=7.9Hz,1H,6-Hb), 3.78 2-СН3ОН 4-Вr-С6Н4- 271-272 80 (s,3H,CH3O), 5.22 (dd,1H,7-Hx), 6.92-7.65 С6Н4(m,8Harom), 7.52 (s,1H,2-H), 9.97 (br.s, 1H,NH), 10.7 (br.s, 1H,NHpyr). 2 3 2.84 (6d, JAB=16.4 Hz, JAX=2.0 Hz,1H,6-Ha), 3 3,4-диF3.23 (dd, JBX=7.9 Hz,1H,6-Hb), 5.21 (dd,1H,7Н 4-F-С6Н4270-271 75 С6Н3Hx), 7.15-7.80 (m,7Harom), 7.68 (s,1H,2-H), 10.82 (br.s,2H,NH). 2 3 2.84 (dd, JAB=17.1 Hz, JAX=2.0 Hz,1H,6-Ha), 3 2,4-диСl3.47 (dd, JBX=7.9 Hz,1H,6-Hb), 5.48 (dd,1H,7Н 4-F-С6Н4265-266 66 С6Н3Hx), 7.15-7.76 (m,7Harom), 7.71 (s,1H,2-H), 10.14 (br.s, 1H, NH), 10.84 (br.s, 1H,NHpyr). 2.10 (s,3H,CH3), 2.76 2 3 (dd, JAB=16.7Hz, JAX=1.2Hz,1H,6-Ha), 3.40 3 С6Н5СН3 2-F-C6H4- 295-296 77 (dd, JBX=7.7 Hz,1H,6-Hb), 5.18 (dd,1H,7-НX) 6.97.7 (m,9Harom), 9.8 (br.s, 1H,NH), 10.75 (br.s, 1H,NH). 2.09 (s,3H,CH3), 2.75 2 3 (dd, JAB=16.5Hz, JAX=1.0Hz,1H,6-Ha), 3.39 3,4-ОСН2О3 С6Н5СН3 270-271 82 (dd, JBX=7.8 Hz,1H,6-Hb), 5.14 (dd,1H,7-Hx), С6Н35.98 (s,2H,OCH2O) 6.8-7.6 (m,8Harom), 10.46 (br.s, 1H,NH), 10.79 (br.s, 1H,NH). 2.11 (s,3H,CH3), 2.88 2 3 (dd, JAB=17.1 Hz, JAX=1.1 Hz,1H,6-Ha), 3.38 3 4-СН3О2-СН3О-5(dd, JBX=7.7 Hz,1H,6-Hb), 3.78 (s,3H,CH3O), СН3 277-278 72 С6Н4Сl-С6Н33.82 (s,3H,CH3O), 5.57 (dd,1H,7-Hx), 7.06-8.1 (m,7Harom), 9.73 (br.s, 1H,NH), 10.78 (br.s, 1H,NHpyr). 2.10 (s,3Н, СН3), 2.87 2 3 (dd, JAB=17,1Hz, JAX=1,1Hz,1Н, 6-На), 3.36 4-СН3О3 СН3 С6Н5272-273 70 (dd, JBX=7.6 Hz,1H,6-Hb), 5.55 (dd,1H,7-Hx), С6Н46.8-7.6 (m,9Harom), 10.46 (br.s, 1H, NH), 10.78 (br.s, 1H,NHpyr). 2.08 (s,3H,CH3), 2.79 2 3 (dd, JAB=17.1Hz, JAX=1.0Hz,1H,6-Ha), 3.41 3 4-F-С6Н4СН3 4-F-C6H4>300 74 (dd, JBX=7.5 Hz,1H,6-Hb), 5.22 (dd,1H,7-Hx), 7.1-7.7 (m,8Harom), 10.6(br.s,1H,NH), 10.82 (br.s, 1H,NHpyr). Комп’ютерна верстка Л. Ціхановська Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською5-oxo-n-aryl-2,3-disubstituted-4,5,6,7-tetrahydropyrazolo[1,5-a]pyrimidin-7-carboxamides and process for the preparation thereof
Автори англійськоюRudenko Roman Vladymyrovych, Komikhov Serhii Oleksandrovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російською5-оксо-2,3-дизамещенные-4,5,6,7-тетрагидропиразоло[1,5-а]пиримидин-7-карбоксамиды и способ их получения
Автори російськоюРуденко Роман Владимирович, Комихов Сергей Александрович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: 5-оксо-2,3-дизаміщені-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміди, одержання, спосіб
Код посилання
<a href="https://ua.patents.su/7-96555-5-okso-23-dizamishheni-4567-tetragidropirazolo15-apirimidin-7-karboksamidi-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">5-оксо-2,3-дизаміщені-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбоксаміди і спосіб їх одержання</a>
Попередній патент: Спосіб автоматичного контролю якості зображення, що створюється об’єктивами геодезичних та аерофотознімальних оптичних систем
Наступний патент: Монета-транспортир
Випадковий патент: Розкаточний верстат