6-бром-7-арил-4,7-дигідроазоло[1,5-а]піримідин-5-карбонові кислоти і спосіб їх одержання
Номер патенту: 96819
Опубліковано: 12.12.2011
Автори: Чебанов Валентин Анатолійович, Сахно Яна Ігорівна, Десенко Сергій Михайлович, Афанасіаді Людмила Михайлівна
Формула / Реферат
1. 6-Бром-7-арил-4,7-дигідроазоло[1,5-а]піримідин-5-карбонові кислоти загальної формули І
 .
.
2. Спосіб одержання сполук загальної формули І
 ,
,
який відрізняється тим, що проводять конденсацію 3-аміно-1,2,4-триазолу або 5-амінотетразолу з піровиноградною кислотою і заміщеними ароматичними альдегідами формули 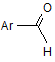 у рівномолярному співвідношенні при кипінні у оцтовій кислоті; одержаний азолопіримідин бромують бромом у середовищі оцтової кислоти при кипінні протягом 3-10 хвилин до утворення цільового продукту.
у рівномолярному співвідношенні при кипінні у оцтовій кислоті; одержаний азолопіримідин бромують бромом у середовищі оцтової кислоти при кипінні протягом 3-10 хвилин до утворення цільового продукту.
Текст
1. 6-Бром-7-арил-4,7-дигідроазоло[1,5а]піримідин-5-карбонові кислоти загальної формули І Ar 2-OCH3 - C6H4, 2,4 -ди F - C6H3, 4 - C2H5 -C6H4, 4 - OC2H5-C6H4 2. Спосіб одержання сполук загальної формули І Ar N X N де Br X = CH,N; N Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, O N H 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 ,I OH (13) 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 ,I OH 96819 N H (11) Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, O N C2 X = CH,N; 2-OCH3 - C6H4, 2,4 -ди F - C6H3, 4 - C2H5 -C6H4, 4 - OC2H5-C6H4 який відрізняється тим, що проводять конденсацію 3-аміно-1,2,4-триазолу або 5-амінотетразолу з піровиноградною кислотою і заміщеними ароматиO чними альдегідами формули Ar у рівномоH Винахід стосується галузі органічної хімії, а саме до складних азотовмісних гетероциклічних лярному співвідношенні при кипінні у оцтовій кислоті; одержаний азолопіримідин бромують бромом у середовищі оцтової кислоти при кипінні протягом 3-10 хвилин до утворення цільового продукту. UA X де Br N (19) N 3 96819 сполук 6-бром-7-арил-4,7-дигідроазоло[1,5а]піримідин-5-карбонових кислот, загальної фор 4 мули І і способу їх одержання Ar Ar N X N N N X де Br де Br N N N O N H H OH OH X = CH,N; X = CH,N; Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, O ,I ,I 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 2,4- ди CH - C H ; 2-F-C H , 2 - Cl-C H , 3 - Cl -C H 3 6 3 6 4 6 4 6 4 2-OCH3 - C66H,4,2,4 -ди F - F6- C64 -3, 24 5- -C6H45 4 - 6H42,H4-C6H4 2H5-C6H4 2,4 -ди C H3, H C H C2H , -C OC 5 - OC 2-OCH3 - CH4 Похідні 4,7-дигідроазоло[1,5-а]піримідин-5карбонової кислоти є складні азотовмісні гетероциклічні сполуки - аналоги багатьох сучасних лікарських препаратів. Тому синтез сполук подібної O структури з різними фармакофорними угрупованнями є актуальним, бо вони граютьBr важливу роль N у біологічних процесах живих організмів. N Похідні азолопіримідинів - основна субстанція N багатьох фармацевтичних препаратів,3 що успішно N CH використовуються для лікування серцево-судинної , II H системи і ангіни [Пат. Венгрии 50177, 1989; CO7D487/04]; вони проявляють протимікробні і антивірусні [Русинов В.Л. и др. // Хим-фарм. журн. - 1990. - Т.24, №1.- С.39-42; Хим-фарм. журн. 1986. - Т.20, №8. - С.947; №2. - С.178], а також протипухлинні властивості [Шварц Г.Я. // Химфарм. журн. – 1980. - Т.14, №9. - С.22]. Сполуки, що заявляються, можуть бути використані при пошуку нових медичних препаратів як індивідуальні або як напівпродукти для подальшого синтезу нових гетероциклічних систем з потенційною фізіологічною активністю. Відомий структурний аналог сполук, що заявляються, - 6-бром-5-метил-7-оксо-2-R-4,7-дигідро1,2,4-триазоло[1,5-а]піримідин, формули II O N Br R=H, CH2OH, CH2COOH, 4-NO2 - C6H4 N N N COOEt, NH2, NO2, C6H5. CH3 , II H R=H, CH2OH, CH2COOH, 4-NO2 - C6H4 COOEt, NH2, NO2, C6H5. і спосіб його одержання [Кофман Т.П. и др. // Журн. орг. химии - 1997. - Т.33, вып. 12. - С.18671876]. Усі бромпохідні формули II визначаються надто низькою розчинністю в органічних розчинниках і воді. Недоліком структури сполук формули II є те, що можливість хімічної модифікації молекули обмежена тільки введенням функціональних груп у заміснику R триазольного циклу. Електронодонорна метильна група у піразольному фрагменті зменшує реакційну здатність брому, наприклад, при заміщенні його нуклеофільними агентами. Спосіб одержання сполук формули II складається із двох стадій і здійснюється за схемою: O O N N NH2 N CH3COCH2COOEt N Br2 N R HOAc R На першій стадії до розчину (суспензії) 0,1 моль 5-аміно-3-R-1,2,4-триазолу у 60 мл льодяної оцтової кислоти додають 0,2 моль ацетооцтового ефіру, витримують суміш при кипінні протягом 8-12 годин, охолоджують, фільтрують і перекристалізовують. Одержують 5-мeтил-7-оксо-2-R-4,7-дигідро1,2,4-триазоло[1,5-а]піримідин. На другій стадії до розчину їдкого калію (0,03 моль) у 30мл води додають 0,026 моль відповідного триазолопіримідину, що одержаний на перший стадії. При перемішуванні приливають краплями 0,03 моль брому при температурі 15-20°С, витримують при кімнатній температурі 1 годину, охолоджують до 0°С. Осад, що випав, промивають водою і перекристалізовують. Загальний час тривалості реакції складає 1015 годин. Недоліком способу одержання сполук формули II є те, що при бромуванні триазолопіримідинів відомої структури кількість лугу може значно збільшуватися від еквівалентного співвідношення до . N N R KOH N H N CH3 Br N N H CH3 надлишку у 3,5 рази. За твердженням авторів джерела, при зменшенні або збільшенні кількості KОН утворюється суміш продуктів - вихідного триазолопіримідину, що не вступив у реакцію, або нової сполуки неустановленої структури. Пізніше автори установили, що це мало стабільний 4бромізомер триазолопіримідину. До недоліків способу одержання слід також віднести тривалість технологічного процесу (10-15 годин) необхідність очищення речовин на кожній стадії реакції, що значно здорожує відомий спосіб одержання сполук формули II. Відомий структурний аналог сполук, що заявляються, а саме 6-бром-2-(4-метоксифеніл)-5метил-[1,2,4]триазоло[1,5-а]піримідин-7(4H)-он формули III O N O H3 C N Br N N H CH3 , III 5 96819 і спосіб його одержання [Abdel-Fattah, Abdel-Samei Mahmoud et al., Phosphorus, Sulfur and Silicon and the Related Elements, 1992, Vol. 72, 1.4, P.145-156]. Сполука формули III малорозчинна в органічних розчинниках і воді. Недоліком структури сполуки формули III є неможливість модифікації структури, оскільки усі положення у молекулі вже зайнято замісниками. Спосіб одержання сполуки формули III складається із трьох стадій і реалізується за схемою: CH3 O 6 O HN O O O (NH2)2 HN H3C N S H HN N HN O CH3 N Br2 +HOAc N N NaOAc CH3 HN N CH3 Br N N CH3 O H2N CH3 O III CH3 На перший стадії 6-метил-2-метилтіо4(3H)піримідинон і гідразингідрат кип'ятять у пропіловому спирті 2 години. Осад відфільтровують після охолодження реакційної маси, перекристалізовують із води, сушать у вакуумі над Р2О5. Вихід 45 %. Утворений на першій стадії 2-гідразино-6метил-4(3H)піримідинон нагрівають з 4метоксибензальдегідом в етиловому спирті протягом 3 годин, одержують 6-метил-2-(4метоксифенілгідразон)-4(3H)піримідинон з виходом 54 %. На третій стадії піримідинілгідразон нагрівають 3 години у льодяній оцтовій кислоті з бромом і зневодненим ацетатом натрію. 6-Бром-2-(4метоксифеніл)-5-метил-[1,2,4]триазоло[1,5а]піримідин-7(4H)-он, що утворився, відфільтровують і сушать. Вихід технічного продукту 63 %. Недоліком відомого способу одержання сполуки формули III є тривалість реакції (8-10 годин). . Крім того використання у реакції водовід’ємних засобів для циклізації і сушіння продуктів (Р2О5, NaOAc зневоднений) також слід віднести до недоліків способу. Задача, на вирішення якої направлений винахід, полягає у розробці нових 6-бромпохідних 7арил-4,7-дигідроазоло[1,5-а]піримідин-5карбонових кислот, що мають широку можливість модифікації хімічної структури, і простого способу одержання цих сполук, за яким шляхом змінення структури компонентів реагуючої суміші та умов проведення синтезу значно зменшується тривалість процесу і підвищується якість кінцевого продукту. Поставлена задача досягається розробкою нових 6-бром-7-арил-4,7-дигідроазоло[1,5а]піримідин-5-карбонових кислот загальної формули І Ar Ar N X N де Br X = CH,N; Br NN O N X N N H N H де Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, O 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 , I,I OH OH X = CH,N; , 2-OCH3 -- C66H,4,2,4 -ди F - F 6-HC6H3,C2H- C26H5, -C-6OC,2H5- OC2H5-C6H4 2,4 -ди C 3, 4 - 4 5 -C H4 4 H4 4 -C6H4 2-OCH3 CH4 і способом їх одержання. У способі одержання сполук формули І Ar Ar N X N де Br NN X X = CH,N; Br O N NN H N H де Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, OHOH X = CH,N; Ar = C6H5, 4-Cl-C6H4; 4 - CH3O - C6H4; 4 - CH3 - C6H4, 4 - F - C6H4, O 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 2,4- ди CH3 - C6H3; 2-F-C6H4, 2 - Cl-C6H4, 3 - Cl -C6H4 , I, I , 2-OCH3 -- C6H4,4,2,4 -ди F -F 6H3,6H3-, C4H5C2H54, 4 6H4, 2H- -C6H2H5-C6H4 - -C6H -C - OC 4 5 OC 4 2-OCH 3 C6H 2,4 -ди C - C 4 2 згідно з винаходом проводять конденсацію 3аміно-1,2,4-триазолу або 5-амінотетразолу з піровиноградною кислотою і заміщеними ароматичниO Ar ми альдегідами формули у рівномолярH ному співвідношенні при кипінні у оцтовій кислоті; одержаний азолопіримідин бромують бромом у середовищі оцтової кислоти при кипінні протягом 3-10 хвилин до утворення цільового продукту. Можливість модифікації хімічної структури сполук формули І шляхом варіювання замісників в арильному радикалі дозволяє одержувати більш широкий асортимент нових перспективних біологічно активних речовин у низці заміщених азолопі 7 96819 римідинів. Крім того, наявність вільної карбоксильної групи дає можливість одержувати нові хлорангідриди, аміди, ефіри, гідразиди, аміни і інші сполуки з корисними властивостями. Електроноакцепторна карбоксильна група підвищує реакційну здатність брому при заміщенні його нуклеофільними агентами, а також стабілізує дигідросистему. Взаємодія 3-аміно-1,2,4-триазолу або 5амінотетразолу з піровиноградною кислотою і ароматичними альдегідами дозволяє відразу одержувати циклічні продукти 7-арил-4,7дигідроазоло[1,5-а]піримідин-5-карбонові кислоти, які потім легко бромуються протягом 3-10 хвилин. Реакція бромування проходить дуже швидко, у дві стадії за сприяння вдалого вибору компонентів піровиноградної кислоти, ароматичних альдегідів і бромуючої суміші. Дія брому в оцтовій кислоті на азолопіримідини звичайно приводить не до бромування цих продуктів, а до їх гетероароматизації. Розроблена нова структура та нові умови проведення синтезу, за яких карбоксильна група стабілізує дигідросистему, не викликаючи їх гетероароматизації. Взаємодією суміші брому в оцтовій кислоті одержані з високими виходами стабільні 6бромзаміщені дигідроазолопіримідини. Це значно розширює можливості модифікації структури, що заявляються, і одержання низки нових продуктів з корисними властивостями. Експериментальним шляхом було установлено, що вибір компонентів реакції дозволяє брому 8 вати азолопіримідини без використання засобів, що віднімають воду (як у другому відомому способі). Це дає можливість одержувати кінцеві продукти швидко (3-10 хвилин), виділяти їх чистими без додаткових перекристалізацій та з високими виходами. При цьому знижуються витрати робочого часу, зберігаються матеріальні і енергетичні ресурси. Використання будь-якого із компонентів реакції на першій стадії у більшому або меншому співвідношенні, ніж рівномолярні, приводить до утворення суміші відповідних вихідних реагентів і кінцевих продуктів реакції. Час протікання всієї реакції (конденсації і бромування) установлений експериментально і складає 2-2,5 години. Збільшення часу бромування азолопіримідинів (3-10 хвилин) недоцільне, оскільки за цей короткий відрізок часу реакція проходить повністю з утворенням цільових продуктів. Після 1 виділення їх із реакційної маси дані Н ЯМР спектроскопії підтверджують їх чистоту. У таблиці 1 представлено порівняльні дані способу, що заявляється, і аналогів [Кофман Т.П. и др. // Журн. орг. химии. - 1997. - Т.33, вып. 12. С.1867-1876; Abdel-Fattah, Abdel-Samei Mahmoud et al., Phosphorus, Sulfur and Silicon and the Related Elements, 1992, Vol. 72, 1.4, P.145-156]. У таблиці 2 надані характеристики сполук формули І, що заявляються, і їх спектральні дані, що підтверджують структуру і чистоту цих сполук. Спосіб одержання сполук формули І, що заявляється, здійснюється у дві стадії за схемою: Ar Ar H3C N NH X N O + Ar + NH2 O O OH N X H N Br2 N O HOAc N H OH На перший стадії, суміш, що складається із рівномолярних кількостей аміноазолу, ароматичного альдегіду і піровиноградної кислоти, нагрівають у льодяній оцтовій кислоті протягом 2-2,5 годин. При охолодженні осаджують ацетоном. Осад, що випав, відфільтровують, промивають етанолом, сушать. Одержують 7-арил-4,7-дигідроазоло[1,5а]піримідин-5-карбонові кислоти. На другій стадії рівномолярну суміш кислоти, що одержана на першій стадії, і брому розчиняють в оцтовій кислоті, нагрівають протягом 3-10 хвилин, охолоджують. Жовті кристали, що випали в осад, відфільтровують, промивають етанолом, сушать. Одержують чисті сполуки формули І - 6бром-7-арил-4,7-дигідроазоло[1,5-а]піримідин-5карбонові кислоти , які не потребують додаткових перекристалізацій. Нижче наведено приклади конкретного виконання. Приклад І. Одержання 6-бром-7-(4метоксифеніл)-4,7-дигідро-1,2,4-триазоло[1,5а]піримідин-5-карбонової кислоти. Суміш 3-аміно-1,2,4-триазолу (0,17г, 2 ммоль), 4-метоксибензальдегіду (0,2мл, 2 ммоль) і пірови N Br N X N O N H OH . ноградної кислоти (0,18г, 2ммоль) нагрівають у льодяній оцтовій кислоті (3мл) протягом 2 годин. Після охолодження реакційну суміш відфільтровують, промивають холодним етанолом, сушать. Вихід 0,29г (48%). Суміш 7-(4-метоксифеніл)-4,7-дигідро-1,2,4триазоло[1,5-а]піримідин-5-карбонової кислоти (0,3г, 1 ммоль) і 0,06мл брому розчиняють у 5мл оцтової кислоти, нагрівають 10 хвилин. Після охолодження відфільтровують жовті кристали, промивають етанолом, сушать. Вихід 0,24г (61%). Т.пл. 220-222°С. 1 Спектральні дані: Н ЯМР (ДМСО-d6, , м.ч., J/Гц): 3,72 (3Н, с, ОСН3); 6,19 (1Н, с, Аr-СН); 6,91 (2Н, д, АrН, 8,9); 7,16 (2Н, д, АrН, 8,9); 7,66 (1Н, с, СН); 10,52 (1Н, с, NH). Приклад II. Одержання 6-бром-7-феніл-4,7дигідро-1,2,4-тетразоло[1,5-а]піримідин-5карбонової кислоти. Суміш 5-амінотетразолу (0,17г, 2 ммоль), бензальдегіду (0,21мл, 2 ммоль) і піровиноградної кислоти (0,18г, 2 ммоль) нагрівають у льодяній оцтовій кислоті (3мл) протягом 2 годин. Після охолодження реакційну суміш відфільтровують, про 9 96819 мивають холодним етанолом, сушать. Вихід 0,27г (55 %). Суміш 7-феніл-4,7-дигідро-1,2,4-тетразоло[1,5а]піримідин-5-карбонової кислоти (0,24г, 1 ммоль) і 0,07мл брому розчиняють у 5мл оцтової кислоти, нагрівають 10 хвилин. Після охолодження відфільтровують жовті кристали, промивають етанолом, сушать. Вихід 0,22г (70 %). Т.пл. 194-196°С. 1 Спектральні дані: Н ЯМР (ДМСО-d6, , м.ч., J/Гц): 6,66 (1Н, с, Аr-СН); 7,25-8,15 (5Н, м, АrН); 11.1 (1Н, с, NH). Решту прикладів наведено у таблиці 2. Структуру сполук формули І, що заявляється, підтверджено спектральними даними. Спектри 1 ядерного магнітного резонансу ( Н ЯМР) виміряно на спектрометрі VARIAN Mercury VX-200 (200МГц) у розчинах дейтеродиметилсульфоксиду (ДМСОd6), внутрішній стандарт - тетраметилсилан. Як видно із тексту опису матеріалів винаходу і даних таблиць 1 і 2, технічні рішення, що пропонуються, мають такі переваги: 10 - структура, що заявляється, забезпечує більш широкий асортимент азолопіримідинів, що вміщують бром у 6-положенні азолопіримідинового фрагмента, завдяки варіації замісників в азольному і піримідиновому фрагментах. Спосіб одержання сполук формули І, що заявляється, дозволяє значно зменшити тривалість процесу одержання до 2-2,5 годин; - підвищити вихід і якість кінцевих продуктів; - широко варіювати у молекулі замісники різної електронної природи; - виключити очищення сполук, що заявляються. У зв'язку із указаними перевагами способу одержання сполук формули І, що заявляються, значно розширяються можливості використання їх у біології, медицині, фармації і т. д. Спосіб одержання сполук формули І простий, дешевий і доступний як і у лабораторних, так і в умовах промислового виробництва. Таблиця 1 Спосіб, що заявляється Кількість Тривалість Вихід цільоЧистота цільових стадій процесу, вих продуктів, продуктів реакції год. % 61-75 виходи не використовуне потребуються 2 2-2,5 чистих продуються водовідніперекриталізації ктів мні засоби Спосіб за статтею [Кофман Т.П. и др. // Журн. орг. химии. - 1997. - Т. 33, вып. 12. - С. 1867-1876] Спосіб за статтею [AbdelFattah, Abdel-Samei Mahmoud et al., Phosphorus, Sulfur and Silicon and the Related Elements, 1992, Vol. 72, 1.4, P. 145-156] 2 10-15 3 85-90 виходи технічних продуктів 8-10 63 потребуються очищення сполук на кожній стадії використовуються очищення не ука- водовіднімні зазано соби (NaOAc, Р2О5) для сушіння Таблиця 2 №№ п/п Сполуки, що заявляються X Аr Т. пл., С Вихід, % 1 CH 4-СН3О-С6Н4 220-222 61 2 CH 4-F-C6H4 241-243 64 3 N С6Н5 194-196 70 4 N 4-СН3О-С6Н4 198-200 75 5 N 4-F-C6H4 205-207 68 Комп’ютерна верстка Н. Лисенко ЯМР Н, (м.ч.) 1 3,72 (3Н, с, ОСН3); 6,19 (1H, с, Аr-СН); 6,91 (2Н, д, АrН, 8,9); 7.16 (2Н, д, АrН, 8,9); 7,66 (1H, с, СН); 10,52 (1H, c, NH) 6,31 (1Н, с, Аr-СН); 7,11-7,38 (4Н, м, АrН); 7,67 (1Н, с, СН); 10,65 (1Н, с, NH) 6,66 (1H, с, Аr-СН); 7,25-8,15 (5Н, м, АrН); 11,1 (1H, c, NH) 3,74 (3Н, с, ОСН3); 6,60 (1Н, с, Аr-СН); 6,95 (2Н, д, АrН, 8,8); 7,24 (2Н, д, АrН, 8,8); 11,0 (1Н, с, NH); 13,99 (1H, ус, СООН) 6,71 (1Н, с, Ar-CH); 7,16-7,47 (4H, M, ArH); 11,10 (1H, c, NH); 13,06 (1H, ус, СООН) Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською6-bromo-7-aryl-4,7-dihydroazolo[1,5-a]pyrimidine-5-carboxylic acids and process for the preparation thereof
Автори англійськоюSakhno Yana Ihorivna, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російською6-бром-7-арил-4,7-дигидроазоло[1,5-а]пиримидин-5-карбоновые кислоты и способ их получения
Автори російськоюСахно Яна Игоревна, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 259/00, C07D 249/16, C07D 239/70, C07D 487/04
Мітки: 6-бром-7-арил-4,7-дигідроазоло[1,5-а]піримідин-5-карбонові, одержання, кислоти, спосіб
Код посилання
<a href="https://ua.patents.su/5-96819-6-brom-7-aril-47-digidroazolo15-apirimidin-5-karbonovi-kisloti-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">6-бром-7-арил-4,7-дигідроазоло[1,5-а]піримідин-5-карбонові кислоти і спосіб їх одержання</a>
Попередній патент: Пристрій для автоматизованого підрахунку голосів ім. степана філіпчука
Наступний патент: Трифазовий низькотемпературний процес фішера-тропша
Випадковий патент: Спосіб дистиляції









