Радіомічені хінолінові та хінолінонові похідні та їхнє використання як метаботропічних лігандів глутаматних рецепторів
Номер патенту: 78548
Опубліковано: 10.04.2007
Автори: Бішофф Франсуа Поль, Лаврейсен Хільде, Лесаж Анна Симона Жозефіна, Янссен Корнелус Жерардус Марія
Формула / Реферат
1. Радіомічена сполука формули (I-А)* чи (І-В)*
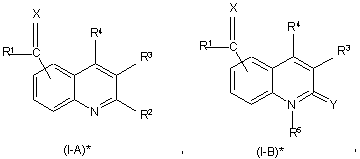
її N-оксидна форма, фармацевтично прийнятна сіль приєднання, четвертинний амін та стереохімічно ізомерна форма, де
Χ означає О, C(R6)2, де R6 означає гідроген, арил чи С1-6-алкіл, необов'язково заміщений аміногрупою або моно- чи ді-(С1-6-алкіл)аміногрупою, S чи N-R7, де R7 означає аміногрупу чи гідроксильну групу,
R1 означає С1-6-алкіл, арил, тієніл, хінолініл, цикло-С3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, у якому цикло-С3-12-алкільний фрагмент може необов'язково містити подвійний зв'язок і де один атом карбону у цикло-С1-12-алкільному фрагменті може бути заміщеним атомом оксигену чи фрагментом NR8, де R8 означає гідроген, бензил чи С1-6-алкоксикарбоніл, причому один чи кілька атомів гідрогену у С1-6-алкільному фрагменті чи у цикло-С3-12-алкільному фрагменті необов'язково можуть бути заміщені на С1-6-алкіл, гідроксі-С1-6-алкіл, галоїд-С1-6-алкіл, аміно-С1-6-алкіл, гідроксильну групу, С1-6-алкоксигрупу, арил-С1-6-алкоксигрупу, галоїд, С1-6-алкоксикарбоніл, арил, аміногруп, моно- чи ді-(С1-6-алкіл)аміногрупу, С1-6-алкоксикарбоніламіногрупу, галоїд, піперазиніл, піридиніл, морфолініл, тієніл чи бівалентний радикал формули -О-, -О-СН2-О- чи -О-СН2-СН2-О-,
або радикал формули (а-1)
 ,
,
де Z1 означає простий ковалентний зв'язок, О, ΝΗ чи СН2,
Z2 означає простий ковалентний зв'язок, О, ΝΗ чи СН2,
n означає ціле число, яке дорівнює 0, 1, 2 чи 3,
і де кожний атом гідрогену у фенільному кільці незалежно може бути необов'язково заміщений галоїдом, гідроксильною групою, С1-6-алкілом, С1-6-алкоксигрупою чи гідроксі-С1-6-алкілом,
або Χ та R1 можуть разом з атомом карбону, до якого приєднані Χ та R1, утворювати радикал формули (b-1), (b-2) чи (b-3)
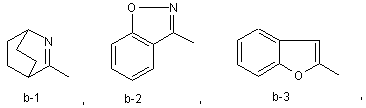
R2 означає гідроген, галоїд, ціаногрупу, С1-6-алкіл, С1-6-алкоксигрупу, С1-6-алкілтіогрупу, С1-6-алкілкарбоніл, С1-6-алкоксикарбоніл, С1-6-алкілкарбонілоксі-С1-6-алкіл, С2-6-алкеніл, гідроксі-С2-6-алкеніл, С2-6-алкініл, гідроксі-С2-6-алкініл, три-(С1-6-алкіл)силан-С2-6-алкініл, аміногрупу, моно- чи ді-(С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксі-С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкілтіо-С1-6-алкіл)аміногрупу, арил, арил-С1-6-алкіл, арил-С2-6-алкініл, С1-6-алкоксі-С1-6-алкіламіно-С1-6-алкіл, амінокарбоніл, необов'язково заміщений С1-6-алкілом, С1-6-алкоксі-С1-6-алкілом, С1-6-алкоксикарбоніл-С1-6-алкілом чи піридиніл-С1-6-алкілом, гетероцикл, вибраний з тієнілу, фуранілу, піролілу, тіазолілу, оксазолілу, імідазолілу, ізотіазолілу, ізоксазолілу, піразолілу, піридилу, піразинілу, піридазинілу, піримідинілу, піперидинілу та піперазинілу, необов'язково N-заміщений С1-6-алкоксі-С1-6-алкілом, морфолінілом, тіоморфолінілом, діоксанілом чи дитіанілом, радикал -NH-C(=O)R9, де R9 означає
С1-6-алкіл, необов'язково заміщений цикло-С3-12-алкілом, С1-6-алкоксигрупою, С1-6-алкоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6-алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою чи піримідинілтіогрупою,
цикло-С3-12-алкіл, циклогексеніл, аміногрупу, арилцикло-С3-12-алкіламіногрупу, моно- чи ді-(С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксикарбоніл-С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксикарбоніл)аміногрупу, моно- чи ді-(С2-6-алкеніл)аміногрупу, моно- чи ді(арил-С1-6-алкіл)аміногрупу, моно- чи діариламіногрупу, арил-С2-6-алкеніл, фураніл-С2-6-алкеніл, піперидиніл, піперазиніл, індоліл, фурил, бензофурил, тетрагідрофурил, інденіл, адамантил, піридиніл, піразиніл, арил, арил-С1-6-алкілтіогрупу чи радикал формули (а-1),
сульфонамід -NH-SO2-R10, де R10 означає С1-6-алкіл, моно- чи полігалоїд-С1-6-алкіл, арил-С1-6-алкіл, арил-С2-6-алкеніл, арил, хінолініл, ізоксазоліл чи ді-(С1-6-алкіл)аміногрупу,
R3 та R4 кожний незалежно означають гідроген, галоїд, гідроксильну групу, ціаногрупу, С1-6-алкіл, С1-6-алкоксигрупу, С1-6-алкоксі-С1-6-алкіл, С1-6-алкілкарбоніл, С1-6-алкоксикарбоніл, С2-6-алкеніл, гідроксі-С2-6-алкеніл, С2-6-алкініл, гідроксі-С2-6-алкініл, три-(С1-6-алкіл)силан-С2-6-алкініл, аміногрупу, моно- чи ді-(С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксі-С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкілтіо-С1-6-алкіл)аміногрупу, арил, морфолініл-С1-6-алкіл чи піперидиніл-С1-6-алкіл, або
R2 та R3 можуть разом утворювати -R2-R3-, який означає бівалентний радикал формули -(СН2)3-, -(СН2)4-, -(СН2)5-, -(СН2)6-, -СН=СН-СН=СН-, -Z4-CH=CH-, -CH=CH-Z4-, -Z4-CH2-CH2-CH2-, -CH2-Z4-CH2-CH2-, -CH2-CH2-Z4-CH2-, -СН2-СН2-CH2-Z4-, -Z4-CH2-CH2-, -CH2-Z4-CH2- чи -CH2-CH2-Z4-, де Z4 означає О, S, SO2 чи NR11, де R11 означає гідроген, С1-6-алкіл, бензил чи С1-6-алкоксикарбоніл, і де кожний бівалентний радикал необов'язково заміщений С1-6-алкілом,
або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН=СН-СН=СН- чи -СН2-СН2-СН2-СН2-,
R5 означає гідроген, цикло-С3-12-алкіл, піперидиніл, оксотієніл, тетрагідротієніл, арил-С1-6-алкіл, С1-6-алкоксі-С1-6-алкіл, С1-6-алкоксикарбоніл-С1-6-алкіл чи С1-6-алкіл, необов'язково заміщений радикалом C(=O)NRxRy, у якому Rx та Ry кожний незалежно означають гідроген, цикло-С3-12-алкіл, С2-6-алкініл чи С1-6-алкіл, необов'язково заміщений ціаногрупою, С1-6-алкоксигрупою, С1-6-алкоксикарбонілом, фуранілом, піролідинілом, бензилтіогрупою, піридинілом, піролілом чи тієнілом,
Υ означає О чи S,
або Υ та R5 можуть разом утворювати =Y-R5-, який означає радикал формули
-CH=N-N= (c-l),
-N=N-N= (с-2) чи
-N-CH=CH- (с-3),
арил означає феніл чи нафтил, необов'язково заміщений одним чи кількома замісниками, вибраними з галоїду, гідроксильної групи, С1-6-алкілу, С1-6-алкоксигрупи, феноксигрупи, нітрогрупи, аміногрупи, тіогрупи, С1-6-алкілтіогрупи, галоїд-С1-6-алкілу, полігалоїд-С1-6-алкілу, полігалоїд-С1-6-алкоксигрупи, гідроксі-С1-6-алкілу, С1-6-алкоксі-С1-6-алкілу, аміно-С1-6-алкілу, моно- чи ді-(С1-6-алкіл)аміногрупи, моно- чи ді-(С1-6-алкіл)аміно-С1-6-алкілу, ціаногрупи, -CO-R12, -CO-OR13, -NR13SO2R12, -SO2-NR13R14, -NR13C(O)R12, -C(O)NR13R14, -SOR12, -SO2R12, де кожний з R12, R13 та R14 незалежно означає С1-6-алкіл, цикло-С3-6-алкіл, феніл, феніл, заміщений галоїдом, гідроксильною групою, С1-6-алкілом, С1-6-алкоксигрупою, галоїд-С1-6-алкілом, полігалоїд-С1-6-алкілом, фуранілом, тієнілом, піролілом, імідазолілом, тіазолілом чи оксазолілом,
і коли фрагмент R1-C(=X) приєднаний в іншому положенні, ніж положення 7 чи 8, то зазначені положення 7 та 8 можуть бути заміщені R15 та R16, де будь-який один чи обидва з R15 та R16 означають С1-6-алкіл, С1-6-алкоксигрупу, або R15 та R16 разом можуть утворювати бівалентний радикал формули -СН=СН-СН=СН-.
2. Радіомічена сполука за п. 1, яка відрізняється тим, що Χ означає О, C(R6)2, де R6 означає гідроген чи арил, або N-R7, де R7 означає аміногрупу чи гідроксильну групу,
R1 означає С1-6-алкіл, арил, тієніл, хінолініл, цикло-С3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, де цикло-С3-12-алкільний фрагмент може необов'язково містити подвійний зв'язок і де один атом карбону у цикло-С3-12-алкільному фрагменті може бути заміщений атомом оксигену чи фрагментом NR8, де R8 означає бензил чи С1-6-алкоксикарбоніл, причому один чи кілька атомів гідрогену у С1-6-алкільному фрагменті чи у цикло-С3-12-алкільному фрагменті необов'язково можуть бути заміщені С1-6-алкілом, галоїд-С1-6-алкілом, гідроксильною групою, С1-6-алкоксигрупою, арил-С1-6-алкоксигрупою, галоїдом, арилом, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6-алкоксикарбоніламіногрупою, галоїдом, піперазинілом, піридинілом, морфолінілом, тієнілом, або бівалентний радикал формули -О- чи -O-СН2-СН2-O-,
або радикал формули (а-1)
 ,
,
де Z1 означає простий ковалентний зв'язок, О чи СН2,
Z2 означає простий ковалентний зв'язок, О чи СН2,
n означає ціле число, яке дорівнює 0, 1 чи 2,
і де кожний атом гідрогену у фенільному кільці незалежно може бути необов'язково заміщений галоїдом чи гідроксильною групою,
або Χ та R1 можуть разом з атомом карбону, до якого приєднані Χ та R1, утворювати радикал формули (b-1), (b-2) чи (b-3)
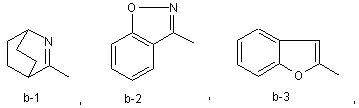
R2 означає гідроген, галоїд, ціаногрупу, С1-6-алкіл, С1-6-алкоксигрупу, С1-6-алкілтіогрупу, С1-6-алкілкарбоніл, C1-6-алкоксикарбоніл, С2-6-алкеніл, гідроксі-С2-6-алкеніл, С2-6-алкініл, гідроксі-С2-6-алкініл, три-(С1-6-алкіл)силан-С2-6-алкініл, аміногрупу, моно- чи ді-(С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксі-С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкілтіо-С1-6-алкіл)аміногрупу, арил, арил-С1-6-алкіл, арил-С2-6-алкініл, С1-6-алкоксі-С1-6-алкіламіно-С1-6-алкіл, амінокарбоніл, необов'язково заміщений С1-6-алкоксикарбоніл-С1-6-алкілом, гетероцикл, вибраний з тієнілу, фуранілу, тіазолілу та піперидинілу, необов'язково N-заміщений морфолінілом чи тіоморфолінілом,
радикал -NH-C(=O)R9, де R9 означає С1-6-алкіл, необов'язково заміщений цикло-С3-12-алкілом, С1-6-алкоксигрупою, С1-6-алкоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6-алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою чи піримідинілтіогрупою, цикло-С3-12-алкіл, циклогексеніл, аміногрупу, арилцикло-С3-12-алкіламіногрупу, моно- чи-ді-(С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксикарбоніл-С1-6-алкіл)аміногрупу, моно- чи ді-(С1-6-алкоксикарбоніл)аміногрупу, моно- чи ді-(С2-6-алкеніл)аміно групу, моно- чи ді-(арил-С1-6-алкіл)аміногрупу, моно- чи діариламіногрупу, арил-С2-6-алкеніл, фураніл-С2-6-алкеніл, піперидиніл, піперазиніл, індоліл, фурил, бензофурил, тетрагідрофурил, інденіл, адамантил, піридиніл, піразиніл, арил чи радикал формули (а-1),
сульфонамід -NH-SO2-R10, де R10 означає С1-6-алкіл, моно- чи полігалоїд-С1-6-алкіл, арил-С1-6-алкіл чи арил,
R3 та R4 кожний незалежно означають гідроген, С1-6-алкіл, С1-6-алкоксі-С1-6-алкіл, С1-6-алкоксикарбоніл, або
R2 та R3 можуть разом утворювати -R2-R3-, який означає бівалентний радикал формули -(СН2)4-, -(СН2)5-, -Z4-CH=CH-, -Z4-CH2-CH2-CH2- чи -Z4-CH2-CH2-, де Z4 означає О, S, SO2 чи NR11, де R11 означає гідроген, С1-6-алкіл, бензил чи С1-6-алкоксикарбоніл, і де кожний бівалентний радикал є необов'язково заміщеним С1-6-алкілом,
або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН=СН-СН=СН- чи -СН2-СН2-СН2-СН2-,
R5 означає гідроген, піперидиніл, оксотієніл, тетрагідротієніл, арил-С1-6-алкіл, С1-6-алкоксикарбоніл-С1-6-алкіл чи С1-6-алкіл, необов'язково заміщений радикалом C(=O)NRxRy, у якому Rx та Ry кожний незалежно означають гідроген, цикло-С3-12-алкіл, С2-6-алкініл чи С1-6-алкіл, необов'язково заміщений ціаногрупою, С1-6-алкоксигрупою чи С1-6-алкоксикарбонілом,
Υ означає О чи S,
або Υ та R5 можуть разом утворювати =Y-R5-, який означає радикал формули
-CH=N-N= (c-l) чи
-N=N-N- (c-2),
арил означає феніл чи нафтил, необов'язково заміщений одним чи кількома замісниками, вибраними з галоїду, С1-6-алкоксигрупи, феноксигрупи, моно- чи ді-(С1-6-алкіл)аміногрупи та ціаногрупи,
і коли фрагмент R1-C(=X) приєднаний в іншому положенні, ніж положення 7 чи 8, то зазначені положення 7 та 8 можуть бути заміщені R15 та R16, де будь-який один чи обидва з R15 та R16 означають С1-6-алкіл, або R15 та R16 разом можуть утворювати бівалентний радикал формули -СН=СН-СН=СН-.
3. Радіомічена сполука за будь-яким з пп. 1-2, яка відрізняється тим, що Χ означає О,
R1 означає С1-6-алкіл, цикло-С3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, де один чи кілька атомів гідрогену у С1-6-алкільному фрагменті чи у цикло-С3-12-алкільному фрагменті необов'язково можуть бути заміщені С1-6-алкоксигрупою, арилом, галоїдом чи тієнілом,
R2 означає гідроген, галоїд, С1-6-алкіл чи аміногрупу,
R3 та R4 кожний незалежно означають гідроген чи С1-6-алкіл,
або R2 та R3 можуть разом утворювати -R2-R3-, який означає бівалентний радикал формули -Z4-CH2-CH2-CH2- чи -Z4-CH2-CH2-, де Z4 означає О чи NR11, де R11 означає С1-6-алкіл, і де кожний бівалентний радикал є необов'язково заміщеним С1-6-алкілом,
або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН2-СН2-СН2-СН2-,
R5 означає гідроген,
Υ означає О, і
арил означає феніл, необов'язково заміщений галоїдом.
4. Радіомічена сполука за будь-яким з пп. 1-3, яка відрізняється тим, що фрагмент R1-C(=X) приєднаний до хінолінового чи хінолінонового фрагмента у положенні 6.
5. Радіомічена сполука за будь-яким з пп. 1-4, яка відрізняється тим, що сполука містить щонайменше один радіоактивний атом.
6. Радіомічена сполука за п. 5, яка відрізняється тим, що радіоактивний ізотоп вибирають з групи 3Н, 11С та 18F.
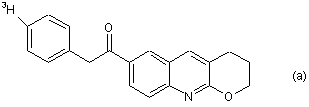
7. Радіомічена сполука за п. 6, яка відрізняється тим, що сполука є будь-якою зі сполук (a), (b), (c), (d) та (е):
 ,
,
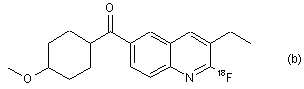 ,
,
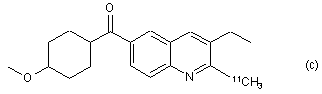 ,
,
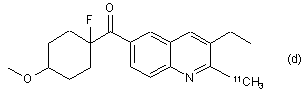 ,
,
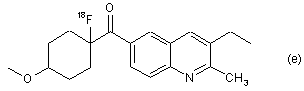 .
.
8. Радіомічена сполука за п. 6, яка відрізняється тим, що сполука є сполукою (а).
9. Радіоактивна композиція для введення ссавцям, яка містить терапевтично ефективну кількість радіоміченої сполуки за будь-яким з пп. 1-8 та фармацевтично прийнятний носій чи розріджувач.
10. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, призначена для використання у діагностичному методі.
11. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, яка відрізняється тим, що діагностичний метод включає маркування чи ідентифікування рецептора mGlu1 у біологічному матеріалі.
12. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, яка відрізняється тим, що маркування полягає у введенні радіоміченої сполуки у біологічний матеріал, а ідентифікування полягає у детектуванні емісії радіоміченої сполуки.
13. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, яка відрізняється тим, що діагностичний метод полягає у скринінгу досліджуваної сполуки на здатність займати чи зв'язувати рецептори mGlu1 у біологічному матеріалі.
14. Радіомічена сполука чи композиція за будь-яким з пп. 11-13, яка відрізняється тим, що біологічний матеріал вибирають з групи зразків тканини, рідин плазми, рідин організму, частин тіла та органів, що походять від теплокровних тварин, і власне теплокровних тварин, зокрема людей.
15. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, призначена для виробництва діагностичного засобу для маркування чи ідентифікування рецепторів mGlu1 у біологічному матеріалі.
16. Використання радіоміченої сполуки чи композиції за п. 15, яке відрізняється тим, що маркування полягає у введенні радіоміченої сполуки в біологічний матеріал, а ідентифікування полягає у детектуванні емісії радіоміченої сполуки.
17. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9, призначена для виробництва діагностичного засобу для скринінгу досліджуваної сполуки на здатність займати чи зв'язувати рецептори mGlul у біологічному матеріалі.
18. Радіомічена сполука за будь-яким з пп. 1-8 чи композиція за п. 9 для виробництва діагностичного засобу для візуалізації органа, яка відрізняється тим, що вводять достатню кількість радіоміченої сполуки за будь-яким з пп. 1-8 чи композиції за п. 9 у придатній композиції в біологічний матеріал, причому зазначена радіомічена сполука зв'язується з сайтами рецептора mGlu1 у біологічному матеріалі, та детектують емісію радіоміченої сполуки.
19. Використання радіоміченої сполуки чи композиції за п. 18 для виробництва діагностичного засобу для візуалізації органа, яке відрізняється тим, що візуалізація здійснюється методом позитронної емісійної томографії (PET).
20. Використання радіоміченої сполуки чи композиції за будь-яким з пп. 15-19, яке відрізняється тим, що біологічний матеріал вибирають з групи зразків тканин, рідин плазми, рідин організму, частин тіла та органів, що походять від теплокровних тварин, і власне теплокровних тварин, зокрема людей.
Текст
Даний винахід стосується радіомічених хінолінових та хінолінонових похідних, які виявляють антагоністичну активність по відношенню до метаботропічного глутаматного рецептора, зокрема, активність щодо рецептора mGlu1, та їхнього одержання; він далі стосується композицій, що їх містять, а також їхнього використання у діагностичному методі, зокрема, для маркування та ідентифікування сайтів метаботропічних глутаматних рецепторів та для візуалізації органа. Вступ Нейротрансмітер глутамат вважається важливим збуджувальним нейротрансмітером у центральній нервовій системі ссавців. Зв'язування цього нейротрансмітера з метаботропічними глутаматними рецепторами (mGluRs), які є підсімейством G-білок-спряжених рецепторів і включають 8 різних субтипів mGluRs, а саме, від mGluR1 до mGluR8, активує різноманітні внутрішньоклітинні системи вторинних месенджерів. mGluRs можуть бути розділені на 3 групи на основі гомологічності амінокислотної послідовності, системи вторинного месенджера, що використовується рецепторами, та фармакологічних характеристик. Група І mGluRs, яка включає субтипи 1 та 5 mGluR, зв'язується з фосфоліпазою С, і їхня активація приводить до мобілізації внутрішньоклітинних іонів кальцію. Група II mGluRs (mGluR2 та 3) і група III mGluRs (mGluR4, 6, 7 та 8) зв'язуються з аденілциклазою, і їхня активація спричинює зниження сАМР вторинного месенджера і, таким чином, пригнічення нейронної активності. Було показано, що обробка антагоністами групи 1 mGluR транслюється у парасинапсисі у знижене вивільнення нейротрансмітера глутамату та зниження глутаматмедійованого нейронного збудження через постсинаптичні механізми. Оскільки вважається, що різноманітні патофізіологічні процеси та хворобливі стани, що вражають центральну нервову систему, спричинені надлишковим глутамат-індукованим збудженням нейронів центральної нервової системи, антагоністи mGluR групи І, зокрема, антагоністи mGluR1, можуть бути терапевтично корисними при лікуванні хвороб центральної нервової системи, зокрема, психічних та неврологічних хвороб. Однак досі не було відомо жодного специфічного ліганду mGluR1, що сильно перешкоджало дослідженням рецепторів mGlu1, зокрема, авторадіографічним дослідженням чіткого розподілу та поширеності цих рецепторів у відділках мозку. Для групи 1 досі був доступним лише [3Н]глутамат. який застосовувався на рецепторах mGlu1 а пацюків [Thomsen et al., Brain Res. 619:22-28, 1993] чи людини [Kingston et al., Neuropharmacology 37:277-287, 1998]. Для рецептора mGlu1а та рецептора mGlu5 може бути використаний [3Н]квісквалат, однак, зазначений рецептор не є специфічним щодо рецептора mGlul (він також зв'язується з рецептором AMP А) і є конкурентним, тобто, він витісняє глутамат [Mutel at al., J. Neurochem. 75:2590-2601, 2000]. Метою даного винаходу було створення придатних специфічних, зокрема, неконкурентних лігандів рецептора mGlu1. Автори винаходу знайшли особливу грун у сподук, які, у радіоміченій формі, дозволяють створити придатні специфічні, зокрема, неконкурентні ліганди рецепторів mGlul, а також спосіб маркування та ідентифікування сайтів метаботропічних глутаматних рецепторів та візуалізації органів. В рамках цієї заявки термін "специфічний" означає, що ліганд зв'язується переважно із сайтом рецептора mGlu1. Термін "неконкурентний" означає, що ліганд не витісняє чи лише у незначному ступені витісняє глутамат, зв'язаний із сайтом рецептора mGlu1. WO 02/28837 розкриває нерадіоактивні сполуки за даним винаходом. WO 99/26927 розкриває антагоністи групи І mGluRs, придатні для лікування неврологічних хвороб та розладів, на основі - поміж інших - хінолінової структури. WO 99/03822 розкриває біциклічні ліганди метаботропічних глутаматних рецепторів, жодний з яких є основаним на хіноліновій чи хіноліноновій структурі. WO 94/27605 розкриває 1,2,3,4-тетрагідрохінолін-2,3,4-трион-3 чи 4-оксими та їхнє застосування для лікування та профілактики втрати нейронів, нейродегенеративних захворювань, небажаних наслідків гіперактивності збуджувальних амінокислот та тривожного стану, а також їхні радіомічені похідні. Детальний опис винаходу Даний винахід стосується радіомічених сполук формули (l-А)* чи (І-В)* їхні х N-оксидних форм, фармацевтично прийнятних солей приєднання, четвертинних амінів та стереохімічних ізомерних форм, де X позначає О; C(R6)2, де R6 позначає гідроген, арил чи С1-6-алкіл, необов'язково заміщений аміногрупою або моно- чи ді-(С1-6-алкіл)аміногрупою; S чи N-R7, де R7 позначає аміногруну чи гідроксильну гр упу; R1 позначає С1-6-алкіл; арил; тієніл; хінолініл; цикло-С 3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, де циклоС3-12-алкільний фрагмент може необов'язково містити подвійний зв'язок і де один атом карбону у цикло-С 3-12алкільному фрагменті може бути заміщений атомом оксигену чи фрагментом NR8, де R8 позначає гідроген, бензил чи С1-6-алкоксикарбоніл; причому один чи кілька атомів гідрогену у С 1-6-алкільному фрагменті чи у цикло-С 3-12-алкільному фрагменті необов'язково можуть бути заміщені С 1-6-алкілом, гідроксі-С 1-6-алкілом, галоїд-С1-6-алкілом, аміно-С1-6-алкілом, гідроксильною групою, С1-6-алкоксигрупою, арил-С 1-6-алкоксигрупою, галоїдом, С1-6-алкоксикарбонілом, арилом, аміногрупою, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6алкоксикарбоніламіногрупою, галоїдом, піперазинілом, піридинілом, морфолінілом, тієнілом чи бівалентним радикалом формули -О-, -О-СН2-О- чи -О-СН 2-СН2-О-; або радикал формули (а-1) де Ζ1 позначає простий ковалентний зв'язок, О, NH чи СН 2; Z2 позначає простий ковалентний зв'язок, О, NH чи СН 2; n позначає ціле число 0, 1, 2 чи 3; і де кожний атом гідрогену у фенільному кільці незалежно може необов'язково бути заміщеним галоїдом, гідроксильною групо, С1-6-алкілом, С1-6-алкоксигрупою чи гідроксі-С1-6-алкілом; або X та R1 можуть, разом з атомом карбону, до якого приєднані X та R 1, утворювати радикал формули (b1), (b-2) чи (b-3); R2 позначає гідроген; галоїд; ціаногрупу; С1-6-алкіл; С1-6-алкоксигрупу; С1- 6-алкілтіогрупу; С1-6алкілкарбоніл; С1-6-алкоксикарбоніл; С1-6-алкілкарбонілоксі-С1-6-алкіл; С2-6-алкеніл; гідроксі-С 2-6-алкеніл; С2-6алкініл; гідроксі-С 2-6-алкініл; три-(С1-6-алкіл)силан-С 2-6-алкініл; аміногрупу; моно- чи ді-(С1-6-алкіл)аміногрупу; моно- чи дi-(С1-6-алкоксі-С 1-6-алкіл)аміногрупу; моно- чи ді-(С1-6-алкілтіо-С 1-6-алкіл)аміногрупу; арил; арил-С1-6алкіл; арил-С2-6-алкініл; С1-6-алкоксі-С 1-6-алкіламіно-С 1-6-алкіл; амінокарбоніл, необов'язково заміщений С 1-6алкілом, С1-6-алкоксі-С 1-6-алкілом, С1-6-алкоксикарбоніл-С 1-6-алкілом чи піридиніл-С 1-6-алкілом; гетероцикл, вибраний з тієнілу, фуранілу, піролілу, тіазолілу, оксазолілу, імідазолілу, ізотіазолілу, ізоксазолілу, піразолілу, піридилу, піразинілу, піридазинілу, піримідинілу, піперидинілу та піперазинілу, необов'язково Ν-заміщених С 1-6алкоксі-С 1-6-алкілом, морфолінілом, тіоморфолінілом, діоксанілом чи дитіанілом; радикал -NH-C(=O)R 9, де R9 позначає С1-6-алкіл, необов'язково заміщений цикло-С 3-12-алкілом, С1-6-алкоксигрупою, С1-6алкоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою чи піримідинілтіогрупою; цикло-С3-12-алкіл; циклогексеніл; аміногрупу; арилцикло-С3-12-алкіламіногрупу; моно- чи ді-(С1-6-алкіл)аміногрупу; моно- чи ді-(С1-6алкоксикарбоніл-С 1-6-алкіл)аміногрупу; моно- чи ді-(С1-6-алкоксикарбоніл)аміногрупу; моно- чи ді-(С2-6алкеніл)аміногрупу; моно- чи ді(арил-С 1-6-алкіл)аміногрупу; моно- чи діариламіногрупу; арил-С2-6-алкеніл; фураніл-С 2-6-алкеніл; піперидиніл; піперазиніл; індоліл; фурил; бензофурил; тетрагідрофурил; інденіл; адамантил; піридиніл; піразиніл; арил; арил-С1-6-алкілтіогрупу чи радикал формули (а-1); сульфонамід -NH-SO2-R10, де R10 позначає С1-6-алкіл, моно- чи полігалоїд-С 1-6-алкіл, арил-С 1-6-алкіл, арилС2-6-алкеніл, арил, хінолініл, ізоксазоліл чи ді-(С1-6-алкіл)аміногрупу; R3 та R4 кожний незалежно позначають гідроген; галоїд; гідроксильну груп у; ціаногрупу; С1-6-алкіл; С1-6алкоксигрупу; С1-6-алкоксі-С 1-6-алкіл; С1-6-алкілкарбоніл; С1-6-алкоксикарбоніл; С2-6-алкеніл; гідроксі-С 2-6алкеніл; С2-6-алкініл; гідроксі-С 2-6-алкініл; три-(С1-6-алкіл)силан-С 2-6-алкініл; аміногрупу; моно-чи ді-(С1-6алкіл)аміногрупу; моно- чи ді-(С1-6-алкоксі-С 1-6-алкіл)аміногрупу; моно-чи ді-(С1-6-алкілтіо-С 1-6-алкіл)аміногрупу; арил; морфолініл-С 1-6-алкіл чи піперидиніл-С 1-6-алкіл; або R2 та R3 можуть разом утворювати -R2-R3-, який позначає бівалентний радикал формули -(СН2)3-, -(СН2)4-, -(СН2)5-, -(СН2)6-, -СН=СН-СН=СН-, -Z4-CH=CH-, -CH=CH-Z4-, -Z 4-CH2-CH2-CH2-, -CH2-Z4-CH2-CH2-, -CH2-CH2-Z4CH2-, -CH2-CH2-CH2-Z4-, -Z4-CH2-CH2-, -CH2-Z 4-CH2- чи -CH2-CH2-Z 4-, де Z4 позначає О, S, SO2 чи NR11, де R11 позначає гідроген, С1-6-алкіл, бензил чи С 1-6-алкоксикарбоніл; і де кожний бівалентний радикал є необов'язково заміщеним С1-6-алкілом, або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН=СН СН=СН- чи -СН2-СН2-СН2-СН2-; R5 позначає гідроген; цикло-С3-12-алкіл; піперидиніл; оксотієніл; тетрагідротієніл, арил-С1-6-алкіл; С1-6алкоксі-С 1-6-алкіл; С1-6-алкоксикарбоніл-С1-6-алкіл чи С1-6-алкіл, необов'язково заміщений радикалом C(=O)NRxRy, у якому Rx та R y кожний незалежно позначають гідроген, цикло-С3-12-аткіл, С2-6-алкініл чи С 1-6алкіл, необов'язково заміщений ціаногрупою, С1-6-алкоксигрупою, С1-6-алкоксикарбонілом, фуранілом, піролідинілом, бензилтіогрупою, піридинілом, піролілом чи тієнілом; Υ позначає О чи S; або Υ та R 5 можуть разом утворювати =Y-R5-, який позначає радикал формули -CH=N-N= (с-1); -N=N-N= (с-2); або -N-CH=CH- (с-3); арил позначає феніл чи нафтил, необов'язково заміщений одним чи кількома замісниками, вибраними з галоїду, гідроксильної групи, С1-6-алкілу, С1-6-алкоксигрупи, феноксигрупи, нітрогрупи, аміногрупи, тіогрупи, С16-аткілтіогрупи, галоїд-С 1-6-алкілу, полігалоїд-С 1-6-алкілу, полігалоїд-С 1-6-алкоксигрупи, гідроксі-С 1-6-алкілу, С 1-6алкоксі-С 1-6-алкілу, аміно-С 1-6-алкілу, моно- чи ді-(С1-6-алкіл)аміногрупи; моно- чи ді-(С1-6-алкіл)аміно-С 1-6алкілу, ціаногрупи, -CQ-R12, -CO-OR 13, -NR13SO2R12, -SO 2-NR13R14 , -NR13C(O)R12 , -C(O)NR13R14, -SOR 12, SO2R12 ; де кожний з R12, R13 та R14 незалежно позначає С 1-6-алкіл; цикло-С 3-6-алкіл; феніл; феніл, заміщений галоїдом, гідроксильною групою, С1-6-алкілом, С1-6-алкоксигрупою, галоїд-С 1-6-алкілом, полігалоїд-С 1-6-алкілом, фуранілом, тієнілом, піролілом, імідазолілом, тіазолілом чи оксазолілом; і коли фрагмент R1-C(=X) приєднаний в іншому положенні, ніж положення 7 чи 8, зазначені положення 7 та 8 можуть бути заміщені R15 та R16 , де будь-який один чи обидва R15 та R16 позначають С 1-6-алкіл, С1-6алкоксигруну, або R15 та R16 разом можуть утворювати бівалентний радикал формули -СН=СН-СН=СН-. У тому значенні, що використовується у наведених вище визначеннях та далі, С1-6-алкіл як група чи частина групи охоплює насичені вуглеводневі радикали з лінійним та розгалуженим ланцюгом, які містять від 1 до 6 атомів карбону, такі як, наприклад, метил, етил, пропіл, бутил, пентил чи гексил; С2-6-алкеніл як група чи частина групи охоплює вуглеводневі радикали з лінійним та розгалуженим ланцюгом, які містять від 2 до 6 атомів карбону та мають подвійний зв'язок, такі як етеніл, пропеніл, бутеніл, пентеніл, гексеніл, 3-метилбутеніл і т.п.; С2-6-алкініл як група чи частина групи позначає вуглеводневі радикали з лінійним та розгалуженим ланцюгом, які містять від 2 до 6 атомів карбону і мають потрійний зв'язок, такі як етиніл, пропініл, бутиніл, пентиніл, гексиніл, 3-метилбутиніл і т.п.; цикло-С 3-6-алкіл охоплює моноциклічні алкільні кільцеві структури, такі як циклопропіл, циклобутил, циклопентил та циклогексил; цикло-С3-12-алкіл охоплює моно-, бі- чи трициклічні алкільні кільцеві структури і є родовою назвою, наприклад, циклопропілу, циклобутилу, циклопентилу, циклогексилу, циклогептилу, циклооктилу, норборнілу, адамантилу. Термін галоїд є родовою назвою фтору, хлору, брому та йоду. В тому значенні, що використовується вище та далі, полігалоїд-С 1-6-алкіл як група чи частина групи визначається як моно- чи полігалоїд заміщений С 1-6алкіл, зокрема, метил з одним чи кількома атомами флюору, наприклад, дифлюорметил чи трифлюорметил. У тому випадку, коли до алкільної групи, що відповідає визначенню полігалоїд-С1-6-алкілу, приєднано більше одного атому галогену, вони можуть бути однаковими чи різними. Якщо будь-яка змінна, наприклад, арил, зустрічвється більше одного разу у будь-якому заміснику, то кожне її значення є незалежним від інших. Якщо будь-який зв'язок проведений усередину кільцевої структури, то це означає, що відповідний замісник може бути зв'язаний з будь-яким атомом зазначеної кільцевої структури. Це означає, наприклад, що фрагмент R1-C(=X) може бути приєднаний до хінолінового чи хінолінонового фрагмента у положеннях 5, 6, 7, 8, а також у положенні 3 чи положенні 4. Термін "радіомічена сполука" позначає будь-яку сполуку формули (І-А)* чи (І-В)*, її N-оксидну форму, фармацевтично прийнятну сіль приєднання, четвертинний амін чи стереохімічно ізомерну форму, яка містить щонайменше один радіоактивний атом. У рамках цієї заявки, сполуки, що не містять радіоактивного атома, позначаються без зірочки у номера формули, а сполуки, що містять радіоактивний атом, позначаються зірочкою у номера формули. Сполуки можуть бути мічені радіонуклідами, що випромінюють позитрони чи гамма-частинки. Для методик, у яких використовується зв'язування радіолігандів (аналізи мембранних рецепторів), кращими є атоми [3Н] чи [125І]. Для візуалізації (позитронна емісійна томографія, PET), найчастіше застосовуваними радіонуклідами, що випромінюють позітрони, є 11С, 18F, 15 O та 13N, які усі виробляються за допомогою прискорювачів і мають періоди півроз,паду 20, 100, 2 та 10 хвилин, відповідно. Оскільки періоди піврозпаду цих радіонуклідів є такими короткими, вони можуть бути використані лише в установах, що мають власний прискорювач для їхнього виробництва, що обмежує їхнє застосування. Найчастіше використовуваними з них є 18F, 99mTc, 201 Т1 та 123І. Зокрема, радіоактивний атом вибирають з групи гідрогену, карбону, нітрогену, сульфур у, оксигену та галогенів. Краще, радіоактивний атом вибирають з групи гідрогену, карбону та галогенів. Зокрема, радіоактивний атом вибирають з групи 3Н, 11С, 18F, 122І, 123 І, 125І, 131І, 75Вr, 76Вr, 77Вr та 82Вr. Краще, радіоактивний атом вибирають з групи 3Н, 11С та 18F. Термін "сполука за винаходом" позначає сполуку формули (l-А)* чи (І-В)*, її N-оксидну форму, фармацевтично прийнятну сіль приєднання, четвертинний амін та стереохімічно ізомерну форму. Для застосування in vivo, солями сполуки формули (l-А)* та (І-В)* є такі, у яких протиіон є фармацевтично прийнятним. Однак, солі кислот та основ, які не є фармацевтично прийнятними, можуть знайти використання, наприклад, у синтезі чи очищенні фармацевтично прийнятних сполук. Всі солі, будь то фармацевтично прийнятні чи ні, входять до обсягу даного винаходу. Термін "in vivo" позначає будь-яке застосування сполук за винаходом, у якому зазначені сполуки вводяться живим тваринам. Фармацевтично прийнятні солі приєднання, згадані вище, мають включати терапевтично активні нетоксичні форми солей приєднання кислот, що можуть бути утворені сполуками формули (l-А)* та (І-В)*. Останні можуть бути зручно одержані шляхом обробки основної форми такими придатними кислотами, як неорганічні кислоти, наприклад, галоїдводневі кислоти, наприклад, хлористоводнева, бромистоводнева і т.п.; сірчана кислота; азотна кислота; фосфорна кислота і т.п.; або органічні кислоти, наприклад, оцтова, пропіонова, гліколева, 2-оксипропіонова, 2-оксопропіонова, щавлева, малонова, бурштинова, малеїнова, фумарова, яблучна, винна, 2-окси-1,2,3-пропантрикарбонова, метансульфонова, етансульфоновв, бензолсульфонова, 4-метилбензолсульфонова, циклогексансульфамінова, 2-оксибензойна, 4-аміно-2гідроксибензойна і т.п. кислоти. Навпаки, сольова форма може бути перетворена шляхом обробки лугами на вільну основну форму. Сполуки формули (l-А)* та (І-В)*, що містять кислотні протони, можуть бути перетворені на їхні терапевтично активні нетоксичні форми солей приєднання металу чи аміну шляхом обробки придатними органічними та неорганічними основами. Придатні основні сольові форми включають, наприклад, солі амонію, солі лужних та лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію і т.п., солі з органічними основами, наприклад, первинними, вторинними та третинними аліфатичними та ароматичними амінами, такими як метиламін, етиламін, пропіламін, ізопропіламін, чотири ізомери бутиламіну, диметиламін, діетиламін, діетаноламін, дипропіламін, діізопропіламін, ди-н-бутиламін, піролідин, піперидин, морфолін, триметиламін, триетиламін, трипропіламін, хінуклідин, піридин, хінолін та ізохінолін, бензатин, N-метил-Оглюкамін, 2-аміно-2-(гідроксиметил)-1,3-пропандіол, солі гідрабаміну та солі з амінокислотами, такими як, наприклад, аргінін, лізин і т.п. Навпаки, сольова форма може бути перетворена на вільну кислотну форму обробкою кислотою. Термін "сіль приєднання" також включає гідрати та форми приєднання розчинника, що можуть бути утворені сполуками формули (l-А)* та (І-В)*. Прикладами таких форм є, наприклад, гідрати, алкоголяти і т.п. Термін "четвертинний амін", у тому значенні, що використовувалося вище, позначає четвертинні амонієві солі, що можуть бути утворені сполуками формули (l-А)* та (І-В)* за реакцією між основним нітрогеном сполуки формули (l-А)* чи (І-В)* та придатним кватернізуючим агентом, таким як, наприклад, необов'язково заміщений алкілгалоїд, арилгалоїд чи арилалкілгалоїд, наприклад, метилйодид чи бензилйодид. Можуть бути також використані інші реагенти з придатними відхідними групами, такі як алкілтрифлюорметансульфонати, алкілметансульфонати та алкіл-п-толуолсульфонати. Четвертинний амін має позитивно заряджений нітроген. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифлюорацетат та ацетат. Вибраний протиіон може бути введений за допомогою іонообмінних смол. Слід розуміти, що деякі сполуки за винаходом можуть містити один чи кілька центрів хіральності та існувати як стереохімічно ізомерні форми. Термін "стереохімічно ізомерні форми" у тому значенні, що використовується вище, позначає всі можливі стереоізомерні форми, які можуть бути утворені сполуками за винаходом або які можуть мати фізіологічно функціональні похідні. Якщо не вказано чи згадується інше, хімічні назви сполук позначають суміш всіх можливих стереоізомерних форм, причому зазначені суміші містять всі діастереомери та енантіомери основної молекулярної структури, а також кожну з індивідуальних ізомерних форм сполуки за винаходом, яка по суті не містить, тобто, є асоційованою з менш ніж 10%, краще, менш ніж 5%, зокрема, менш ніж 2%, і найкраще, менш ніж 1%, інших ізомерів. Стереохімічно ізомерні форми сполук за винаходом вважаються такими, що явним чином включені до обсягу даного винаходу. Те ж саме стосується описаних тут проміжних сполук, що використовуються для одержання кінцевих продуктів сполук за винаходом. Терміни цис та транс використовуються тут згідно з номенклатурою Chemical Abstracts. У деяких сполук за винаходом та у проміжних сполук, що використовуються в їхньому синтезі, абсолютна стереохімічна конфігурація не була визначена. У цих випадках, стереоізомерна форма, яку було виділено першою, позначено як "А", а др угою - як "В", без додаткових посилань на дійсну стереохімічну конфігурацію. Однак, зазначені стереоізомерні форми "А" та "В" можуть бути однозначно охарактеризовані за допомогою фізико-хімічних характеристик, таких як їхнє оптичне обертання, у тому випадку, коли "А" та "В" є енантіомерами. Фахівець в цій області техніки здатний визначити абсолютну конфігурацію такої сполуки з використанням відомих фахівцям методів, таких як, наприклад, рентгенівська дифракція. У тому випадку, коли "А" та "В" є сумішами стереоізомерів, вони можуть бути далі розділені, причому відповідні перші виділені фракції позначаються "Α1" та "В1", а другі - "А2" та "В2", без додаткового зазначення дійсної стереохімічної конфігурації. N-Оксидні форми сполук за даним винаходом мають включати сполуки формули (l-А)* та (І-В)*, у яких один чи кілька атомів нітрогену є окисненими до так званого N-оксиду. Деякі сполуки за винаходом можуть також існувати у та утомерній формі. Такі форми, хоч вони явно не зазначені у наведеній вище формулі, вважаються такими, що входять до обсягу даного винаходу. Особливий інтерес становлять сполуки формули (l-А)* та (І-В)*, які є стереохімічно чистими. Цікавою групою сполук є такі сполуки формули (l-А)* та (І-В)*, у яких X позначає О; C(R6)2, де R6 позначає гідроген чи арил; або N-R7, де R7 позначає аміногрупу чи гідроксильну груп у; R1 позначає С1-6-алкіл, арил; тієніл; хінолініл; цикло-С 3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, де циклоС3-12-алкільний фрагмент може необов'язково містити подвійний зв'язок, і де один атом карбону у цикло-С 3-12алкільному фрагменті може бути заміщений атомом оксигену чи фрагментом NR8, де R8 позначає бензил чи С1-6-алкоксикарбоніл; причому один чи кілька атомів гідрогену у С 1-6-алкільному фрагменті чи у цикло-С 3-12алкільному фрагменті необов'язково можуть бути заміщені С 1-6-алкілом, галоїд-С1-6-алкілом, гідроксильною групою, С1-6-алкоксигрупою, арил-С 1-6-алкоксигрупою, галоїдом, арилом, моно- чи ді-(С1-6-алкіл)аміногрупою, С1-6-алкоксикарбоніламіногрупою, галоїдом, піперазинілом, піридинілом, морфолінілом, тієнілом чи бівалентним радикалом формули -О- чи -О-СН2СН2-О-; або радикал формули (а-1) де Z1 позначає простий ковалентний зв'язок, О чи СН 2; Z2 позначає простий ковалентний зв'язок, О чи СН 2; n позначає ціле число 0, 1 чи 2; і де кожний атом гідрогену у фенільному кільці незалежно може бути необов'язково заміщений галоїдом чи гідроксильною групою; або X та R1 можуть разом з атомом карбону, до якого приєднані X та R1, утворювати радикал формули (b1), (b-2) чи (b-3); R2 позначає гідроген; галоїд; ціаногруну; С1-6-алкіл; С1-6-алкоксигруну; С 1-6-алкілтіогрупу; С1-6алкілкарбоніл; С1-6-алкоксикарбоніл; С2-6-алкеніл; гідроксі-С 2-6-алкеніл; С2-6-алкініл; гідроксі-С 2-6-алкініл; три-(С16-алкіл)силан-С 2-6-алкініл; аміногруну; моно- чи ді-(С 1-6-алкіл)аміногруну; моно- чи ді-(С 1-6-алкоксі-С 1-6алкіл)аміногруну; моно- чи ді-(С1-6-алкілтіо-С 1-6-алкіл)аміногруну; арил; арил-С 1-6-алкіл; арил-С 2-6-алкініл: С1-6алкоксі-С 1-6-алкіламіно-С 1-6-алкіл; амінокарбоніл, необов'язково заміщений С 1-6-алкоксикарбоніл-С 1-6-алкілом; гетероцикл, вибраний з тієнілу, фуранілу, тіазолілу та піперидинілу, необов'язково N-заміщений морфолінілом чи тіоморфолінілом; радикал -NH-C(=O)R 9, де R9 позначає С1-6-алкіл, необов'язково заміщений цикло-С 3-12-алкілом, С1-6алкоксигрупою, С1-6-алкоксикарбонілом, арилом, арилоксигрупою, тієнілом, піридинілом, моно- чи ді-(С1-6алкіл)аміногрупою, С1-6-алкілтіогрупою, бензилтіогрупою, піридинілтіогрупою чи піримідинілтіогрупою; цикло С3-12-алкіл; циклогексеніл; аміногруну; арилцикло-С3-12-алкіламіногруну; моно- чи ді-(С1-6-алкіл)аміногруну; моно- чи ді-(С1-6-алкоксикарбоніл-С 1-6-алкіл)аміногруну; моно- чи ді-(С1-6-алкоксикарбоніл)аміногруну; моно- чи ді-(С2-6-алкеніл)аміногрупу; моно- чи ді(арил-С1-6-алкіл)аміногруну; моно- чи діариламіногруну; арил-С2-6алкеніл; фураніл-С 2-6-алкеніл; піперидиніл; піперазиніл; індоліл; фурил; бензофурил; тетрагідрофурил; інденіл; адамантил; піридиніл; піразиніл; арил чи радикал формули (а-1); сульфонамід -NH-SO2-R10, де R10 позначає С1-6-алкіл, моно- чи полігалоїд-С 1-6-алкіл, арил-С1-6-алкіл чи арил; R3 та R4 кожний незалежно позначають гідроген; С1-6-алкіл; С1-6-алкоксі-С 1-6-алкіл; С1-6-алкоксикарбоніл; або R2 та R3 можуть разом утворювати -R2-R3-, який позначає бівалентний радикал формули -(СН2)4-, -(СН2)5-, -Z4-CH=CH-, -Z4-CH2-CH2-CH2- чи -Z4-CH2CH2-, де Z4 позначає О, S, SO 2 чи NR11, де R11 позначає гідроген, С1-6алкіл, бензил чи С1-6-алкоксикарбоніл; і де кожний бівалентний радикал є необов'язково заміщеним С 1-6алкілом; або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН=СН-СН=СН- чи -СН2-СН2-СН2СН2-; R5 позначає гідроген; піперидиніл; оксотієніл; тетрагідротієніл, арил-С1-6-алкіл; С1-6-алкоксикарбоніл-С 1-6-алкіл чи С1-6-алкіл, необов'язково заміщений радикалом C(=O)NRxRy, у якому Rx та Ry кожний незалежно позначають гідроген, цикло-С3-12-алкіл, С2-6-алкініл чи С1-6-алкіл, необов'язково заміщений ціаногрупою, С1-6-алкоксигрупою чи С1-6-алкоксикарбонілом; Υ позначає О чи S; або Υ та R 5 можуть разом утворювати =Y-R5-, який позначає радикал формули -CH=N-N=(c-1); aбo -N=N-N= (c-2); арил позначає феніл чи нафтил, необов'язково заміщений одним чи кількома замісниками, вибраними з галоїду, С1-6-алкоксигрупи, феноксигрупи, моно- чи ді-(С1-6-алкіл)аміногрупи та ціаногрупи; і коли фрагмент R1-C(=X) приєднаний в іншому положенні, ніж положення 7 чи 8, то зазначене положення 7 та 8 може бути заміщеним R 15 та R16, де будь-який один чи обидва з R15 та R1 позначають С1-6-алкіл, або R15 та R16 разом можуть утворювати бівалентний радикал формули -СН=СН-СН=СН-. Інша дуже цікава група сполук включає такі сполуки формули (І-А)* та (І-В)*, де X позначає О; R1 позначає С1-6-алкіл; цикло-С 3-12-алкіл чи (цикло-С3-12-алкіл)-С1-6-алкіл, де один чи кілька атомів гідрогену у С1-6-алкільному фрагменті чи у цикло-С 3-12-алкільному фрагменті необов'язково можуть бути заміщеними С 16-алкоксигрупою, арилом, галоїдом чи тієнілом; R2 позначає гідроген; галоїд; С1-6-алкіл чи аміногрупу; R3 та R4 кожний незалежно позначають гідроген чи С1-6-алкіл; або R2 та R3 можуть разом утворювати -R2-R3-, який позначає бівалентний радикал формули -Z4-CH2-CH2-CH2чи -Z4-CH2-CH2-, де Z4 позначає О чи NR11, де R11 позначає С 1-6-алкіл; і де кожний бівалентний радикал є необов'язково заміщеним С1-6-алкілом; або R3 та R4 можуть разом утворювати бівалентний радикал формули -СН2-СН2-CH2-CH2-; R5 позначає гідроген; Υ позначає О; і арил позначає феніл, необов'язково заміщений галоїдом. Ще інша цікава група сполук включає такі сполуки формули (І-А)* та (І-В)*, де фрагмент R1-C(=X) приєднаний до хінолінового чи хінолінононового фрагмента у положенні 6. Особливо цікавими є такі радіоактивні сполуки: Всі сполуки за винаходом виявляють активність щодо mGluR1 від помірної до сильної. Таку активність, поміж іншого, пояснюється специфічним зв'язуванням зазначеної сполуки з рецептором mGlu1, що робить ці сполуки корисними у діагностичному методі, наприклад, для мічення та детектування сайтів рецептора mGlu1. Винахід тому стосується також радіоміченої сполуки за винаходом, призначеної для використання у діагностичному методі. Перший кращий варіант втілення (гамма-випромінюючий радіонуклід) Згідно з першим кращим варіантом втілення, радіомічена сполука включає щонайменше один атом [3Ή] чи атом [125І]. Атом [3Н] зручно вводять шляхом часткового чи повного заміщення одного чи кількох нерадіоактивних атомів гідрогену [1Н] у молекулі на їхні радіоактивні ізотопи. Вибір, який з радіолігандів [3Н] чи [125І] буде використаний, може частково залежати від доступності рідинних сцинтиляційних лічильників (LSC), які є досить дорогими. Ліганди [125І] можуть бути підраховані за допомогою g-лічильника чи LSC, тоді як ліганди [3Н] потребують використання LSC. Радіомічена сполука, яка містить щонайменше один атом [3Н] чи [125І], зручно використовується у методах зі зв'язуванням радіоліганду, зокрема, в аналізах мембранних рецепторів in vitro для маркування чи ідентифікації рецепторів mGlu1 у біологічному матеріалі. Радіомічені сполуки, які містять щонайменше один атом [3Н] чи [125І], також краще використовуються для авторадіографії рецепторів mGlu1 мозку in vivo, оскільки сполуки за винаходом мають корисну та несподівану здатність легко проходити крізь гематоенцефалічний бар'єр. Таким чином, винахід стосується також радіоміченої сполуки за винаходом, яка використовується у діагностичному методі, що складається з маркування чи ідентифікування рецепторів mGlu1 у біологічному матеріалі, а також використання сполук за винаходом для виробництва діагностичного засобу для маркування чи ідентифікування рецепторів mGlu1 у біологічному матеріалі, будь то in vi vo чи in vitro. В рамках даної заявки термін "біологічний матеріал" має включати будь-який матеріал, що має біологічне походження. Зокрема, це стосується зразків тканин, рідин плазми, рідин організму, частин тіла та органів теплокровних тварин і власне теплокровних тварин, зокрема, людей. Основними експериментами, що проводяться з використанням системи мембранного аналізу для маркування чи ідентифікування рецепторів mGlul у біологічному матеріалі є такі: експерименти з насичення, експерименти з інгібування, експерименти з кінетики асоціації та експерименти з кінетики дисоціації. Ці методи є застосовними до більшості систем нейротрансмітерів та гормональних рецепторів, включаючи систему mGluR1 [Methods for Neurotransmitter Receptor Analysis, ed. by Henry I. Yamamura et al., Raven Press Ltd., New York, 1990]. З цією метою, радіомічену сполуку вводять до біологічного матеріалу для мічення рецепторів mGlu1s, і емісію радіоміченої сполуки детектують для ідентифікації кількості чи місцезнаходження рецепторів mGlu1s, наприклад, для авторадіографії рецепторів ex vi vo. Радіомічені сполуки за винаходом, які містять щонайменше один атом [3Н] чи [125І], є також корисними як агенти для проведення скринінгу на здатність дослідних сполук займати чи зв'язувати сайт рецептора mGlu1. Ступінь, у якому дослідна сполука буде витісняти сполуку за винаходом із сайта рецептора mGlu1, буде визначати здатність дослідної сполуки займати чи зв'язувати рецептор mGlu1 і, таким чином, діяти як агоніст, антагоніст чи змішаний агоніст/антагоніст рецептора mGlu1. Радіомічені сполуки за винаходом, які містять щонайменше один атом [3Н] чи [125І], краще одержують шляхом заміщення атома галогену атомом тритію, як описано у Експериментальному розділі далі. Другий кращий варіант втілення (позитрон-випромінюючий радіонуклід) У другому кращому варіанті втілення, радіомічена сполука включає щонайменше один радіоактивний атом карбону чи галогену. В принципі, будь-яка сполука формули (І), що містить атом карбону чи галогену, є придатною для радіомічення шляхом заміщення атома карбону чи галогену на придатний радіоактивний ізотоп чи шляхом синтезу сполуки формули (І) з використанням радіоактивно-мічених реагентів. Придатними для цього радіоізотопами галогенів є радіоактивний карбон, наприклад, [11С]; радіоактивні йодиди, наприклад, [122І], [ 123I], [ 131I]; радіоактивні броміди, наприклад, [75Br], [76Br], [ 77Br] та [ 82Вr]; і радіоактивні фториди, наприклад, [18F]. Кра щими радіоміченими сполуками є такі сполуки формул (l-А)* та (І-В)*, де R1 містить радіоактивний атом карбону чи галоїду, особливо [11С], [18F], [ 123I], [ 75Вr], [76Вr] чи [77Вr]. Синтез радіоактивних сполук Введення радіоактивного атома галогену може бути здійснене за допомогою придатної реакції, такої як зображена нижче у якій всі замісники у формулах (І-А-а) та (І-А-а)* мають значення, вказані у формулі (І-А)*, і галоїд є атом галогену. Проводять реакцію придатної сполуки (І-А-а) з Н[18F] так, щоб атом галогену, який знаходиться на хіноліновому кільці, був заміщений за реакцією нуклеофільного заміщення на радіоактивний атом [18F]. Для одержання радіомічених сполук формули (І-В)*, введення радіоактивного ізотону може бути здійснене у еквівалентний спосіб, наприклад, за схемою реакції, зображеної нижче. Очевидно, сполуки формули (І-А)* також можуть бути одержані у еквівалентний спосіб, тобто, шляхом мічення замісника R1. Інші методи мічення тритієм розкриті, наприклад, [Peng et al. Fusion Technology. American Nuclear Society, 21 (2):307-311, 1992 та Brundish et al. Journal of Labelled Compounds and Radiopharmaceuticals, 25(12): 13611369 (1988)]. Введення радіоактивного [11С] може бути здійснене за схемою реакції, наведеною нижче, у якій придатну сполуку (І-А-а) спочатку станілюють, після чого вводять радіоактивний [11С] шля хом проведення, наприклад, реакції сполучення за Штілле ("Stille-type") на паладієвому каталізаторі з використанням [11С]-метилйодиду [Scott, W.J.; Crisp, G.T.; Stille, J.K. J. Am. Chem. Soc, 1984, 106, 4630]. У формулах (I-A-a), (I-A-b) та (І-А-с)*, всі замісники мають такі саме значення, як вказано у формулі (l-А)*, галоїд позначає атом галогену і R17 позначає метил чи бутил. Через свою несподівану здатність легко проникати крізь гематоенцефалічний бар'єр, радіомічені сполуки, які містять радіоактивний атом галогену, зручно вводяться in vivo, у придатній композиції, тварині, особливо, теплокровній тварині, і місцезнаходження зазначених радіомічених сполук детектують з використанням методів візуалізації, таких як, наприклад, однофотонна емісійна комп'ютерна томографія (SPECT) чи позитронні емісійна томографія (PET) і т.п. У такий спосіб може бути виявлений розподіл сайтів рецепторів mGlu1 в організмі, і органи, що містять сайти рецепторів mGlu1, такі як, наприклад, мозок, можуть бути візуалізовані за допомогою методів візуалізації, вказаних вище. Цей процес візуалізації органа шляхом введення радіоміченої сполуки формули (l-А)* чи (l-А)*, яка зв'язується із сайтами рецепторів mGlu1, та детектування емісії радіоактивної сполуки також є аспектом даного винаходу. Застосування сполук формули (l-А)* та (І-В)* у описаних вище методах є іншим аспектом даного винаходу. Винахід, зокрема, стосується використання сполук за винаходом для виробництва діагностичного засобу для використання у PET. Найкращими для використання у PET є радіомічені сполуки за винаходом, до яких введений 18F [патент США №4931270 на ім'я Horn et al., онублікований 5 червня 1990p.]. Синтез нерадіоактивних сполук Нерадіоактивні сполуки за винаходом можуть бути одержані кількома способами. Для спрощення структурного зображення деяких сполук за даним винаходом та проміжних сполук у наведених далі процедурах синтезу, хіноліновий чи хіноліноновий фрагмент буде далі позначатися символом Q. Сполуки формули (l-А) чи (І-В), де X позначає О, які представлені формулою (ІA/B-а), можуть бути одержані шляхом окислення проміжної сполуки формули (ll) у присутності придатного окисника, такого як перманганат калію, та придатного каталізатора фазового перенесення, такого як трис(діокса-3,6-гептил)амін, у придатному інертному щодо реакції розчиннику, такому як, наприклад, дихлорметан. Сполуки формули (ІA/B-а) можуть бути також одержані шляхом проведення реакції проміжної сполуки формули (III) з проміжною сполукою формули (IV), де W1 позначає атом галоїду, наприклад, бром, у присутності бутиллітїю та придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Альтернативно, сполуки формули (ІA/B-а) можуть бути також одержані шляхом проведення реакції проміжної сполуки формули (V) з проміжною сполукою формули (IV) у присутності бутиллітію та придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Сполуки формули (ІА/B-а), де замісник R1 приєднаний до карбонільного фрагмента через атом оксигену, причому зазначений замісник R1 позначається як O-R1a і зазначені сполуки - формулою (ІА/B-а-1), можуть бути одержані шляхом проведення реакції проміжної сполуки формули (VI) з проміжною сполукою формули (VII) у присутності придатної кислоти, такої як сірчана кислота. Сполуки формули (1-А), де R2 позначає метилкарбоніл, які представлені формулою (І-А-1), можуть бути одержані шляхом проведення реакції проміжної сполуки формули (VIII) у присутності придатної кислоти, такої як хлористоводнева кислота, та придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Сполуки формули (І) можуть бути також перетворені одна на іншу з використанням відомих фаівцям методик перетворення. Сполуки формули (l-А), де R2 позначає атом галоїду, такий як хлор, можуть бути перетворені на сполуку формули (l-А), де R2 позначає інший атом галоїду, такий як флюор чи йод, за реакцією з придатним галогенувальним агентом, таким як, наприклад, фторид калію чи йодид натрію, у присутності придатного інертного щодо реакції розчинника, наприклад, диметилсульфоксиду чи ацетонітрилу і, необов'язково, у присутності ацетилхлориду. Сполуки формули (l-А), у якій R2 позначає придатну відхідну груп у, таку як атом галоїду, наприклад, хлор, йод, де відхідна група позначена як W2 і зазначена сполука - як (І-А-2), можуть бути перетворені на сполуку формули (l-А), у якій R2 позначає ціаногруну, причому ця сполука представлена формулою (І-А-3), за реакцією з придатним агентом введення ціаногрупи, таким як, наприклад, триметилсиланкарбонітрил, у присутності придатної основи, такої як Ν,Ν-діетилетанамін та придатного каталізатора, такого як, наприклад, тетракіс(трифенілфосфін)паладію. Сполуки формули (І-А-2) можуть бути також перетворені на сподуку формули (І-А-4) за реакцією з С 2-6алкінілтри-(С1-6-алкіл)силаном у присутності Cul, придатної основи, такої як, наприклад, Ν,Ν-діетилетанамін, та придатного каталізатора, такого як, наприклад, тетракіс(трифенілфосфін)паладій. Сподуки формули (І-А-4), у свою чергу, можуть бути перетворені на сполуку формули (І-А-5) за реакцією з фторидом калію у присутності придатної кислоти, такої як оцтова кислота, чи за реакцію з придатною основою, такою як гідроксид калію, у присутності придатного інертного щодо реакції розчинника, такого як спирт, наприклад, метанол і т.п. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (І-А-6) за реакцією з проміжною сполукою формули (IX) у присутності Cul, придатної основи, такої як, наприклад, Ν,Νдіетилетанамін, та придатного каталізатора, такого як тетракіс(трифенілфосфін)паладій. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку, у якій R2 позначає С1-6-алкіл, причому ця сполука представлена формулою (І-А-8), у присутності придатного алкілувального агента, такого як, наприклад, Sn(C1-6-алкіл)4, чи на сполуку, у якій R2 позначає С2-6-алкеніл, причому ця сполука представлена формулою (І-А-9), у присутності придатного алкенілювального агента, такого як, наприклад, Sn(С2-6алкеніл)(С1-6-алкіл)3, причому обидві реакції проводяться у присутності придатного каталізатора, такого як, наприклад, тетракіс(трифенілфосфін)паладій, та інертного щодо реакції розчинника, такого як, наприклад, толуол чи діоксан. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (І-А-7), де Ζ позначає О чи S, за реакцією з проміжною сполукою формули (X), необов'язково, у присутності придатної основи, такої як карбонат калію, та інертного щодо реакції розчинника, такого як Ν,Ν-диметилформамід. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (l-А), де R 2 позначає С 1-6алкоксикарбоніл, причому ця сполука представлена формулою (l-А-10), та на сполуку формули (l-А), де R2 позначає гідроген, причому ця сполука представлена формулою (l-А-11), за реакцією з придатним спиртом формули С1-6-алкіл-ОН та СО у присутності придатного каталізатора, такого як, наприклад, ацетат паладію(П), трифенілфосфін, придатної основи, такої як карбонат калію, та інертного щодо реакції розчинника, такого як Ν,Ν-диметилформамід. Сполуки формули (І-А-11) можуть бути також одержані шляхом проведення реакції сполуки формули (І-А2) з Zn у присутності придатної кислоти, такої як оцтова кислота. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (l-А), де R2 позначає амінокарбоніл, заміщений С1-6-алкоксикарбоніл-С1-6-алкілом, причому ця сполука представлена формулою (lА-12), за реакцією з проміжною сполукою формули Н 2N-С1-6-алкіл-С(=О)-О-С1-6-алкіл у присутності CO, придатного каталізатора, такого як тетракіс(трифенілфосфін)паладію, придатної основи, такої як, наприклад, Ν,Ν-діетилетанамін, та придатного інертного щодо реакції розчинника, такого як, наприклад, толуол. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (l-А), де R2 позначає арил чи гетероцикл, вибраний з групи, описаної у визначенні R2 вище, причому зазначений R2 представлений R2a, а зазначена сполука - формулою (l-А-13), за реакцією з проміжною сполукою формули (XI), (XII) чи (XIII) у присутності придатного каталізатора, такого як, наприклад, тетракіс(трифенілфосфін)паладій, та придатного інертного щодо реакції розчинника, такого як, наприклад, діоксан. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (І-В), у якій Υ та R5 разом утворюють радикал формули (b-1) чи (b-2), причому ця сполука представлена формулою (І-В-1) чи (І-В-2), за реакцією з гідразинкарбоксальдегідом чи азидом натрію у придатному інертному щодо реакції розчиннику, такому як спирт, наприклад, бутанол, чи Ν,Ν-диметилформамід. Сполуки формули (І-А-11) можуть бути перетворені на відповідний N-оксид, представлений формулою (lА-14), за реакцією з придатним пероксидом, таким як 3-хлорпербензойна кислота, у придатному інертному щодо реакції розчиннику, такому як, наприклад, метиленхлорид. Зазначена сполука формули (l-А-14) може бути далі перетворена на сполуку формули (І-В), де R5 позначає гідроген, причому ця сполука представлена формулою (І-В-3), за реакцією з 4-метилбензолсульфонілхлоридом у присутності придатної основи, такої як, наприклад, карбонат калію, та придатного інертного щодо реакції розчинника, такого як, наприклад, метиленхлорид. Сполуки формули (І-В-3) можуть бути також одержані зі сполуки формули (l-А), де R 2 позначає С1-6алкоксигруну, причому ця сполука представлена формулою (l-А-15), за реакцією з придатною кислотою, такою як хлористоводнева кислота, у присутності придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Сполуки формули (І-В-3) можуть бути перетворені на сполуку формули (І-В), де R5 позначає С 1-6-алкіл, причому ця сполука представлена формулою (І-В-4), за реакцією з придатним алкілувальним агентом, таким як, наприклад, проміжна сполука формули (XIV), де W3 позначає придатну відхідну гр уну, таку як атом галоїду, наприклад, йод, у присутності трет-бутоксиду калію та у присутності придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Сполуки формули (І-В-3) можуть бути також перетворені на сполуку формули (І-В), де R 5 позначає С1-6алкоксикарбоніл-С 1-6-алкіл чи арил-С 1-6-алкіл, причому R5 позначений R5a і ця сполука представлена формулою (І-В-5), за реакцією з проміжною сполукою формули (XV), де W 4 позначає придатну відхідну грун у, таку як атом галоїду, наприклад, бром, хлор і т.п., у присутності придатної основи, такої як, наприклад, гідрид натрію, та придатного інертного щодо реакції розчинника, такого як, наприклад, Ν,Ν-диметилформамід. Сполуки формули (І-А-2) можуть бути також перетворені на сполуку формули (І-В), де R5 позначає гідроген і Υ позначає S, причому ця сполука представлена формулою (І-В-6), за реакцією з H2N-C(=S)-NH 2 у присутності придатної основи, такої як гідроксид калію, та придатного інертного щодо реакції розчинника, такого як спирт, наприклад, етанол, чи води. Сполуки формули (І-В-6) можуть бути далі перетворені на сполуку формули (l-А), де R2 позначає С 1-6-алкілтіогрупу, причому ця сполука представлена формулою (l-А16), за реакцією з придатним С 1-6-алкілгалоїдом, таким як, наприклад, С1-6-алкілйодид, у присутності придатної основи, такої як карбонат калію, та придатного розчинника, такого як, наприклад, ацетон. Сполуки формули (ІA/B-а) можуть бути перетворені на сполуки формули (l-А) чи (І-В), де X позначає N-R7, причому ця сполука представлена формулою (lA/B-b), за реакцією з проміжною сполукою формули (XVI), необов'язково у присутності придатної основи, такої як, наприклад, Ν,Ν-діетилетанамін, та у присутності придатного інертного щодо реакції розчинника, такого як спирт, наприклад, етанол. Як вже було вказано у процедурі синтезу сполук формули (l-А-13), описаній вище, сполуки формули (І) можуть бути також перетворені на відповідні N-оксидні форми за допомогою відомих фа хівцям процедур перетворення тривалентного нітрогену на його N-оксидну форму. Зазначена реакція N-оксидації може загалом бути здійснена шляхом проведення реакції вихідного матеріалу формули (І) з придатним органічним чи неорганічним пероксидом. Придатні неорганічні пероксиди включають, наприклад, перекис водню, пероксиди лужного металу чи лужноземельного металу, наприклад, пероксид натрію, пероксид калію; придатні органічні пероксиди можуть включати пероксикислоти, такі як, наприклад, пербензойна кислота чи галоїдзаміщена пербензойна кислота, наприклад, 3-хлорпербензойна кислота, пероксоалканові кислоти, наприклад, пероцтова кислота, алкілгідропероксиди, наприклад, трет-бутилгідропероксид. Придатними розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол і т.п., вуглеводні, наприклад, толуол, кетони, наприклад, 2бутанон, галогеновані вуглеводні, наприклад, дихдорметан, та суміші таких розчинників. Деякі з проміжних сполук та вихідних матеріалів, що використовуються в описаних ви ще процедурах синтезу, є комерційно доступними чи можуть бути синтезовані за процедурами, вже описаними у літературі. Проміжні сполуки формули (II) можуть бути одержані шляхом проведення реакції проміжної сполуки формули (XVII) з проміжною сполукою формули (XVIII), де W 5 позначає придатну відхідну грун у, таку як атом галоїду, наприклад, хлор, бром і т.п., у присутності магнію, діетилового ефіру та придатного інертного щодо реакції розчинника, такого як діетиловий ефір. Проміжні сполуки формули (XVII) можуть бути одержані шляхом окиснення проміжної сполуки формули (XIX) у присутності придатного окисника, такого як МnО2, та придатного інертного щодо реакції розчинника, такого як метиленхлорид. Проміжні сполуки формули (XIX) можуть бути одержані шляхом відновлення проміжної сполуки формули (XX) у присутності придатного відновлювального агента, такого як гідрид літію-алюмінію, та придатного інертного щодо реакції розчинника, такого як тетрагідрофуран. Проміжні сполуки формули (XX), де Q позначає хіноліновий фрагмент, необов'язково заміщений у положенні 3 С1-6-алкілом, у яких карбонільний фрагмент розташований у положенні 6, представлені формулою (ХХ-а), можуть бути одержані шляхом проведення реакції проміжної сполуки формули (XXI) з проміжною сполукою формули (XXII) у присутності 3-нітробензолсульфонату натрію, придатної кислоти, такої як сірчана кислота, та придатного спирту, наприклад, метанолу, етанолу, пропанолу, бутанолу і т.п. Альтернативно, проміжні сполуки формули (II) можуть бути також одержані шляхом проведення реакції проміжної сполуки формули (XXIII) з проміжною сполукою формули (XXTV), де W6 позначає придатну відхідну грун у, таку як атом галоїду, наприклад, бром, хлор і т.п., у присутності придатного агента, такого як бутиллітій, та придатного інертного щодо реакції розчинника, такого як тетрагідрофуран. Проміжні сполуки формули (XXIII) можуть бути одержані шляхом окиснення проміжної сполуки формули (XXV) з використанням методики оксидації Моффатта (Moffatt), Пфітцнера (Pfitzner) чи Сверна (Swern) (адукти диметилсульфоксиду з дегідратуючими агентами, наприклад, дициклогексилкарбодіімідом (DCC), Ас2О, SO 3, Р4О10, СОСl2 чи Сl-СО-СОСl) у інертному розчиннику, такому як метиленхлорид. Проміжні сполуки формули (XXV) можуть бути одержані шляхом відновлення проміжної сполуки формули (XXVI) у присутності придатного відновлювального агента, такого як, наприклад, гідрид літію-алюмінію, та придатного інертного щодо реакції розчинника, такого як бензол. Проміжні сполуки формули (XXVI) можуть бути одержані з проміжної сполуки формули (XXVII) шля хом естерифікації у присутності придатного спирту, такого як метанол, етанол, пропанол, бутанол і т.п., та придатної кислоти, такої як сірчана кислота. Проміжні сполуки формули (XXVII), де R1 позначає радикал формули (а-1), у якому Z1 позначає О, Z2 позначає CF3 і n дорівнює 1, причому ці проміжні сполуки представлені формулою (XXVII-a), можуть бути одержані шляхом відновленя проміжної сполуки формули (XXVIII) у присутності придатного відновлювального агента, такого як гідроген, придатного каталізатора, такого як паладій на вугіллі, та придатної кислоти, такої як оцтова кислота. Якщо R1 у проміжній сполуці (XXVII) позначає необов'язково заміщений фенільний фрагмент, то він може бути також перетворений на необов'язково заміщений циклогексильний фрагмент шляхом відновлення у присутності придатного відновлювального агента, такого як родій на Аl2О3, та придатного інертного щодо реакції розчинника, такого як тетрагідрофуран. Проміжні сполуки формули (IV), де Q позначає хіноліновий фрагмент, заміщений у положенні 2 галоїдом, наприклад, хлором, причому ці проміжні сполуки представлені формулою (IV-a), можуть бути одержані шляхом проведення реакції проміжної сполуки формули (IV), де Q позначає хіноліноновий фрагмент, у якому R5 позначає гідроген, причому ця проміжна сполука представлена формулою (IV-b), у присутності РОСl3 . Проміжні сполуки формули (IV-a), де R4 позначає гідроген, причому ці проміжні сполуки представлені формулою (IV-a-Ι), можуть бути також одержані шляхом проведення реакції проміжної сполуки формули (XXIX) з РОСl3 у присутності Ν,Ν-диметилформаміду (реакція формілювання Вілсмейера-Хаака (VilsmeierHaack) з наступною циклізацією). Проміжні сполуки формули (XXIX) можуть бути одержані шляхом проведення реакції проміжної сполуки формули (XXX) з проміжною сполукою формули (XXXI), де W7 позначає придатну відхідну гр ун у, таку як атом галоїду, наприклад, хлор, у присутності придатної основи, такої як, наприклад, Ν,Ν-діетилетанамін, та придатного інертного щодо реакції розчинника, такого як метиленхлорид. Проміжні сполуки формули (IV-a) можуть бути перетворені на проміжну сполуку формули (IV-c) за реакцією з проміжною сполукою формули (XXXII) у присутності придатного інертного щодо реакції розчинника, такого як спирт, наприклад, метанол і т.п. Проміжні сполуки формули (IV-a) можуть бути також перетворені на проміжну сполуку формули (IV-d-Ι) за реакцією з придатним аміном формули (ХХХІll-а), де Z3 та Z 4 кожний незалежно позначають гідроген, С1-6алкіл, С1-6-алкоксі-С 1-6-алкіл, С1-6-алкілтіо-С 1-6-алкіл, або на проміжну сполуку формули (IV-d-2) за реакцією з придатним аміном формули (ХХХІІІ-b), де Z 3 та Z4 разом утворюють гетероцикл, як визначено вище у визначенні R2, за умови, що гетероцикл включає щонайменше один атом нітрогену, у присутності придатної основи, такої як, наприклад, карбонат калію, та інертного щодо реакції розчинника, такого як Ν,Νдиметилформамід. Проміжні сполуки формули (IV-a), де R3 позначає СН 2-СН2-СН2-Сl, причому ці проміжні сполуки представлені формулою (IV-a-2), можуть бути також перетворені на проміжну сполуку формули (IV), де R 2 та R3 разом утворюють бівалентний радикал формули -О-СН2-СН2-СН2-, причому ця проміжна сполука представлена формулою (IV-e-1), за реакцією з придатною кислотою, такою як хлористоводнева кислота і т.п. Проміжні сполуки формули (IV-a-2) можуть бути також перетворені на проміжну сполуку формули (IV), де R 2 та R3 разом утворюють бівалентний радикал формули -S-CH2-CH2-CH2-, причому ця проміжна сполука представлена формулою (IV-e-2), за реакцією з H 2N-C(=S)-NH2 у присутності придатного інертного щодо реакції розчинника, такого як спирт, наприклад, етанол. Проміжні сполуки формули (V) можуть бути одержані шляхом проведення реакції проміжної сполуки формули (XXVII) з проміжною сполукою формули CH3-NH-O-CH3 у присутності 1,1’-карбонілдіімідазолу та придатного інертного щодо реакції розчинника, такого як метиленхлорид. Проміжні сполуки формули (VII), де Q позначає хіноліновий фрагмент, зокрема, хіноліновий фрагмент, у якому R2 позначає етил, R3 позначає метил і R4 позначає гідроген, і карбоксильний фрагмент розташований у положенні 6, причому ці проміжні сполуки представлені формулою (VII-а), можуть бути одержані за реакцією проміжної сполуки формули (XXXIV) у присутності придатного альдегіду, такого як СН 3-СН2-СН(=О), (CH2O)n, ZnCl2, FeCl3 та придатного інертного щодо реакції розчинника, такого як спирт, наприклад, етанол. Проміжні сподуки формули (VIII) можуть бути одержані шляхом проведення реакції проміжної сполуки формули (XXXV) з проміжною сполукою формули (XXXVI) у присутності придатного каталізатора, такого як, наприклад, тетракіс(трифенілфосфін)паладій, та придатного інертного щодо реакції розчинника, такого як, наприклад, діоксан. Можуть бути розроблені ще інші методики синтезу, деякі з них розкриті далі у цій заявці у Прикладах. Чисті стереоізомерні форми сподук та проміжні сполуки за даним винаходом можуть бути одержані із застосуванням відомих фа хівцям процедур. Діастереомери можуть бути розділені за допомогою фізичних методів розділення, таких як селективна кристалізація та хроматографічні методи, наприклад, рідинна хроматографія з використанням хіральних нерухомих фаз. Енантіомери можуть бути відокремлені один від одного шляхом селективної кристалізації їхніх діастереомерних солей з оптично активними кислотами. Альтернативно, енантіомери можут бути розділені хроматографічними методами з використанням хіральних нерухомих фаз. Зазначені чисті стереоізомерні форми можуть бути також одержані з відповідних чистих стереоізомерних форм відповідних ви хідних матеріалів, за умови, що реакція відбувається стереоселективно чи стереоспецифічно. Якщо потрібний певний стереоізомер, зазначену сполуку краще синтезують стереоселективними чи стереоспецифічними методами. Ці методи краще використовують хірально чисті вихідні матеріали. Передбачається, що стереоізомерні форми сполук формули (І) входять до обсягу винаходу. Стереоізомер сполуки формули (l-А) чи (І-В), такий як циc-форма, може бути перетворений на інший стереоізомер, такий як відповідна транс-форма, шляхом проведення реакції сполуки з придатною кислотою, такою як хлористоводнева кислота, у присутності придатного інертного щодо реакції розчинника, такого як, наприклад, тетрагідрофуран. Антагоністична активність сполук за даним винаходом до mGluR1 може бути продемонстрована у тесті на трансдукцію сигналів клонованими mGluR1 пацюків у клітинах яєчників китайського хом'ячка (СНО) та тесті на холодову алодинію у пацюків з лігатурою за Беннеттом (Bennett), як описано далі. Завдяки своїй антагоністичній активності до mGluR, конкретніше, антагоністичній активності до Групи І mGluR, і ще конкретніше, антагоністичній активності до mGluR1, сполуки формули (І-А) чи (І-В), їхні N-оксиди, фармацевтично прийнятні солі приєднання, четвертинні аміни та стереохімічно ізомерні форми є придатними для лікування чи профілактики глутамат-індукованих захворювань центральної нервової системи. Захворювання, роль глутамату у яких було продемонстровано, включають звикання до лікарських засобів чи абстиненцію (залежність, толерантність до опіоїдів, припинення приймання опіоїдів), гіпоксичні, аноксичні та ішемічні ушкодження (ішемічний інсульт, зупинка серця), біль (невропатичний біль, запальний біль, гіпералгезія), гіпоглікемію, хвороби, зв'язані з ушкодженнями нейронів, мозкову травму, травму голови, ушкодження спинного мозку, мієлопатію, деменцію, тривожний стан, шизофренію, депресію, порушення пізнавальної функції, амнезію, біполярні розлади, розлади поведінки, хворобу Альцгеймера, судинну деменцію, змішану (Альцгеймера та судинну) деменцію, хворобу Льюї-Боді (Lewy Body), делірій чи сплутаність свідомості, хворобу Паркінсона, хворобу Хантінгтона, синдром Дауна, епілепсію, старіння, бічний аміотрофічний склероз, розсіяний склероз, СНІД (синдром набутого імунодефіциту) та СНІД-асоційований комплекс (ARC). Даний винахід також пропонує композиції для введення ссавцям, зокрема, людям, зокрема, в діагностичних цілях, ще конкретніше, для візуалізації органа, які включають терапевтично ефективну кількість радіоміченої сполуки формули (І-А)* чи (І-В)* та фармацевтично прийнятний носій чи розріджувач. Таким чином, сполуки за даним винаходом чи будь-яка їхня підгрупа можуть бути включені до складу різних фармацевтичних форм, призначених для введення. Як придатні композиції можуть бути перелічені усі композиції, що звичайно використовуються для системного введення лікарських засобів. Для виготовлення фармацевтичних композицій за даним винаходом, терапевтично ефективну кількість певної сполуки, у формі основи чи солі приєднання, як активний інгредієнт, ретельно змішують з фармацевтично прийнятним носієм, який може набувати різноманітних форм у залежності від форми препарату, бажаної для введення. Ці фармацевтичні композиції є, краще, дозованими разовими лікарськими формами, придатними, краще, для введення перорально, ректально, локально, черезшкірно чи шляхом парентеральної ін'єкції. Наприклад, при виготовленні композиції у вигляді дозованої форми для орального введення можуть бути використані будь-які звичайні фармацевтичні середовища, такі як, наприклад, вода, гліколі, масла, спирти і т.п., у випадку рідких препаратів для орального введення, таких як суспензії, сиропи, емільсії, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змащувальні речовини, зв'язуючі, розпушувальні агенти і т.п., у випадку порошків, пілюль, капсул та таблеток. Завдяки зручності введення, таблетки та капсули є найкращими дозованими разовими формами для орального введення, і для них, очевидно, використовуються тверді фармацевтичні носії. Для парентеральних композицій, носій буде звичайно включати стерильну воду, принаймні здебільшого, хоч можуть бути включені інші інгредієнти, наприклад, для поліпшення розчинності. Можуть бути виготовлені, наприклад, розчини для ін'єкцій, у яких носій включає сольовий розчин, розчин глюкози чи суміш сольового та глюкозного розчинів. Можуть бути також виготовлені суспензії для ін'єкцій, у яких можуть бути використані придатні рідкі носії, суспендувальні агенти і т.п. Винахід охоплює також препарати у твердій формі, які мають бути перетворені, незабаром перед використанням, на препарати у рідкій формі. Як композиції, придатні для місцевого застосування, можуть бути перелічені усі композиції, що звичайно використовуються для місцевого введення лікарських засобів, наприклад, креми, гелі, пов'язки, шамнуні, настоянки, пасти, мазі, рідкі мазі, порошки і т.п. В композиціях, придатних для черезшкірного введення, носій необов'язково включає агент посилення проникності та/або придатний змочувальний агент, необов'язково, у поєднанні з придатними домішками будь-якої природи у невеликій кількості, якщо ці домішки не спричинюють суттєвого небажаного впливу на шкіру. Зазначені домішки можуть сприяти введенню до шкіри та/або можуть бути корисними при виготовленні бажаної композиції. Ці композиції можуть бути введені різними шляхами, наприклад, у вигляді трансдермального пластира, за допомогою засобів місцевого введення, у вигляді мазі. Найкраще, вказані вище фармацевтичні композиції виготовляють як дозовані разові лікарські форми для зручності введення та забезпечення однаковості доз. Дозовані разові форми, у тому значенні, що використовується тут в опису та формулі винаходу, стосуються фізично відокремлених елементів, придатних для використання як разові дози, причому кожна доза містить попередньо визначену кількість активного інгредієнта, розраховану на створення бажаного терапевтичного ефекту, у поєднанні з потрібним фармацевтичним носієм. Прикладами таких доованих разових форм є таблетки (включаючи таблетки з надрізом чи з покриттям), капсули, пілюлі, супозиторії, порошки у пакетиках, облатки, розчини чи суспензії для ін'єкції, пакетики з 5мл рідкої композиції для орального введення (teaspoonfuls), пакетики з 15мл рідкої композиції для орального введення (tablespoonfuls) і т.п., та їхні кратні частки. Діагностично ефективна доза чи частота введення залежать від конкретної сполуки формули (І-А)* чи (ІВ)*, що використовується, та стану ссавця, лікування якого проводиться, як добре відомо фаівцям в цій області. Наведені далі приклади мають ілюструвати даний винахід, не обмежуючи його обсягу. Експериментальна частина Тут та надалі, "ДМФ" позначає Ν,Ν-диметилформамід, "DIPE" позначає діізопропіловий ефір, "ДМСО" позначає диметилсульфоксид, "ВНТ" позначає 2,6-біс(1,1-диметилетил)-4-метилфенол, і "ТГФ" позначає тетрагідрофуран. А. Синтез проміжних сполук Приклад А1 Суміш 4-(1-метилетокси)бензойної кислоти (0,083моль) та Rh/Al2O3 5% (10г) у ТГФ (220мл) гідрують при 5°С (при тиску Н2 300кПа (3 bar)) протягом 1 ночі. Суміш фільтрують крізь целіт, промивають ТГФ та випаровують. Вихід: 16г проміжної сполуки 1 (100%). Приклад А2 Синтез 2-етил-3-метил-6-хінолінкарбонової кислоти (проміжна сполука 2) Суміш 4-амінобензойної кислоти (0,299моль) в етанолі (250мл) перемішують при кімнатній температурі. Додають ZnCl2 (0,0367моль) та (СН2О)n (10г). Додають порціями FeCl3×6H2O (0,5моль) і температуру підвищують до 60-65°С. Додають по краплях пропаналь (30мл) протягом 2 годин. Суміш кип'ятять зі зворотним холодильником протягом 2 годин і витримують при кімнатній температурі протягом 12 годин. Суміш виливають у воду і фільтрують крізь целіт. Фільтрат підкислюють до рH=7 за допомогою 6Н НСl і суміш випаровують до сухого залишку. Залишок використовують без додаткової очистки. Вихід: 56,1г 2-етил-3-метил-6хінолінкарбонової кислоти (проміжна сполука 2). Приклад A3 Пентаноїлхлорид (0,2784моль) додають при 5°С до суміші 4-бромбензоламіну (0,232моль) та Ν,Νдіетилетанаміну (0,2784моль) у СН 2Сl2 (400мл). Суміш перемішують при кімнатній температурі протягом ночі, виливають у воду та екстрагують СН 2Сl2. Органічний шар відокремлюють, промивають концентрованим розчином NH4OH та водою, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (60г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Залишок (35г, 63%) розводять у СН 2Сl2. Органічний шар відокремлюють, промивають 10% розчином К2СО3, промивають водою, осушають (MgSO 4), фільтрують і розчинник випаровують. Ви хід: 30г проміжної сполуки (3) (54%). Приклад А4 Суміш 6-бром-2(1Н)-хінолінону (0,089моль) у РОСl3 (55мл) перемішують при 60°С протягом ночі, потім при 100°С протягом 3 годин і розчинник випаровують. Залишок розводять у СН 2Сl2, виливають у воду з льодом, підлуговують за допомогою конц. NH4ОН, фільтрують крізь целіт та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтр ують і розчинник випаровують. Вихід: 14,5г проміжної сполуки (4) (67%). Приклад А5 ДМФ (37мл) додають по краплях при 10°С під потоком N2 до РОСl3 (108мл). Після закінчення додавання, суміші дають нагрітися до кімнатної температури. Додають порціями N-(4-бромфеніл)бутанамід (0,33моль). Суміш перемішують при 85°С протягом ночі, потім залишають охолонути до кімнатної температури і виливають на лід (екзотермічна реакція). Осад збирають на фільтрі, промивають невеликою кількістю води та висушують (вакуум). Залишок промивають сумішшю EtOAc/діетиловий ефір та висушують. Вихід: 44,2г проміжної сполуки (5) (50%). Суміш проміжної сполуки (5) (0,162моль) у метанолі (600мл) та 35%-ний розчин натрієвої солі метанолу в метанолі (154мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі. Суміш виливають на лід. Осад збирають на фільтрі, промивають невеликою кількістю води та розводять у СН 2СІ2. Додають 10%ний К2СО3 і суміш екстрагують СН2СІ2. Органічний шар відокремлюють, промивають водою, осушають (MgSO4), фільтрують і розчинник випаровують. Ви хід: 31,9г проміжної сполуки (6) (74%). Приклад А6 1,1’-Карбоніл-біс-1H-імідазол (0,074моль) додають порціями до суміші 4-метоксициклогексанкарбонової кислоти (0,063моль) у СН2Сl2 (200мл). Суміш перемішують при кімнатній температурі протягом 1 години. Потім додають N-метоксиметанамін (0,074моль). Суміш перемішують при кімнатній температурі протягом ночі, виливають у Н2О та екстрагують СН 2Сl2. Органічний шар відокремлюють, промивають кілька разів Н 2О, осушають (MgSO 4), фільтрують і розчинник випаровують. Ви хід: 12,6г проміжної сполуки 7. Приклад А7 a) Суміш 6-флюор-4-оксо-4Н-1-бензопіран-2-карбонової кислоти (0,30моль) у оцтовій кислоті (400мл) гідрують з використанням Pd/C (3г) як каталізатора. Після поглинання Н2 (3екв.), каталізатор відокремлюють на фільтрі. Фільтрат випаровують. Залишок перемішують у петролейному ефірі. Осад відокремлюють на фільтрі та висушують (вакуум; 70°С). Після перекристалізації з СНСl3/СН3ОН, осад відокремлюють на фільтрі та висушують (вакуум, 80°С і високий вакуум, 85°С). Вихід: 8,8г 6-флюор-3,4-дигідро-2Н-1-бензопіран-2карбонової кислоти (проміжна сполука 8) (15,0%). b) Суміш проміжної сполуки (8) (0,255моль) в етанолі (400мл) та H2SO4 (5мл) перемішують та кип'я тять зі зворотним холодильником протягом 8 годин. Розчинник випаровують до сухого Залишку. Залишок розчиняють у СН 2С12. Органічний шар відокремлюють, промивають 10%-ним К2СО3, осушають (MgSO4), фільтрують і розчинник випаровують. Вихід: 45г етил-6-флюор-3,4-дигідро-2Н-1-бензопіран-2-карбоксилату (проміжна сполука 9) (79%). c) Реакція під N2. Суміш натрієвої солі біс(2-метоксіетокси)алюмінійгідриду, розчин 70% мас. у метилбензолі 3,4М (0,44моль) у бензолі (150мл) (нагрівання під зворотним холодильником), додають по краплях протягом 1 години до киплячої під зворотним холодильником суміші проміжної сполуки 9 (0,22моль) та бензолу (600мл). Після перемішування протягом 2,5 годин при температурі кипіння зі зворотним холодильником, суміш охолоджують до ±15°С. Суміш розкладають додаванням по краплях етанолу (30мл) та води (10мл). Цю суміш виливають на суміш лід/вода і цю суміш підкислюють концентрованою хлористоводневою кислотою. Цю суміш екстрагують діетиловим ефіром (500мл). Відокремлений органічний шар промивають водою, осушають, фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СНСl3). Потрібну фракцію збирають і елюент випаровують. Вихід: 34г 6флюор-3,4-дигідро-2Н-1-бензопіран-2-метанолу (проміжна сполука 10) (85%). d) Реакція під N2. До перемішуваної та охолоджуваної (-60°С; баня з сумішшю 2-пропанон/СО2) суміші етандіоїлдихлориду (0,1моль) у СН 2Сl2 (350мл) додають протягом 10 хвилин сульфінілбіс[метан] (30мл). Після перемішування протягом 10 хвилин, додають протягом 5 хвилин суміш проміжної сполуки 10 у СН 2Сl2 (90мл). Після перемішування протягом 15 хвилин, додають Ν,Ν-діетилетанамін (125мл). Коли суміш нагріється до кімнатної температури, її виливають у воду. Продукт екстрагують СН 2Сl2. Органічний шар промивають водою, НСl (1М), водою, NaHCO3 (10%) та водою, осушають та випаровують. Залишок розчиняють у діетиловому ефірі, промивають водою, осушають, фільтрують та випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СНСl3). Потрібну фракцію збирають і елюент випаровують. Вихід: 21,6г 6флюор-3,4-дигідро-2Н-1-бензопіран-2-карбоксальдегіду (проміжна сполука 11) (67%). н-Бутиллітій 1,6М (0,056моль) додають повільно при -70°С до розчину проміжної сполуки (5) (0,046моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 30 хвилин. Додають повільно суспензію проміжної сполуки 11 (0,056моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 1 години, потім доводять до кімнатної температури, виливають у Н 2О та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (21г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 80/10; 15-35мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 9,5г проміжної сполуки 12 (55%). Приклад А8 Суміш проміжної сполуки (5) (0,1127моль), 2-метоксіетанаміну (0,2254моль) та К2СО3 (0,2254моль) у ДМФ (500мл) перемішують при 120°С протягом 15 годин, а потім охолоджують. Розчинник випаровують. Залишок розводять у СН 2Сl2 та Н2О. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують до сухого залишку. Залишок (33,53г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН 99,5/0,5; 15-40мкм). Збирають дві фракції та їхні розчинники випаровують. Вихід: 5,7г проміжної сполуки 14 (38%) та проміжної сполуки 13 (34%). Суміш проміжної сполуки (5) (0,0751моль), тіоморфоліну (0,0891моль) та К2СО3 (0,15моль) у ДМФ (200мл) перемішують при 120°С протягом 12 годин. Розчинник випаровують до сухого залишку. Залишок розводять у СН2Сl2 та Н2О. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (26г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/EtOAc 80/20; 20-45мкм). Збирають дві фракції та їхні розчинники випаровують. Дві фракції об'єднують. Вихід: 9,4г проміжної сполуки 15(37%);т.пл.82°С. Приклад А9 a) 4-Амінобензойну кислоту (0,219моль) додають до розчину 3-нітробензолсульфонату натрію (0,118моль) у H2SO4 70% (230мл) і суміш перемішують та кип'ятять зі зворотним холодильником. Додають по краплях 2метил-2-пропен-1,1-діолдіацетат (0,216моль) і суміш кип'ятять зі зворотним холодильником протягом 4 годин. Додають етанол (200мл) і суміш перемішують при 80°С протягом 48 годин. Суміш випаровують, залишок виливають у воду з льодом/NН4ОН та екстрагують СН 2Сl2. Органічний шар осушають (MgSO4) та випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/2-пропанол 99/1). Чисті фракції збирають та випаровують. Вихід: 21г етил 3-метил-6-хінолінкарбоксилату (проміжна сполука 16) (45%). b) Проміжну сполуку 16 (0,098моль) у ТГФ (270мл) додають при 0°С до розчину LiAlH4 (0,098моль) у ТГФ під N2. Після закінчення додавання, додають воду (10мл). Осад збирають на фільтрі та промивають СН 2Сl2. Органічний шар осушають (MgSO4), фільтрують та випаровують. Продукт використовують без додаткової очистки. Вихід: 16,71г 3-метил-6-хінолінметанолу (проміжна сподука 17). c) Додають МnО2 (0,237моль) до розчину проміжної сполуки 17 (0,096моль) у СН2Сl2 (200мл) і суміш перемішують при кімнатній температурі протягом 12 годин. Суміш фільтрують крізь целіт і фільтрат знов перемішують з МnО2 (20г) протягом 12 годин. Знов додають МnО2 (10г). Суміш перемішують протягом 12 годин. Суміш фільтрують крізь целіт та випаровують. Продукт використовують без додаткової очистки. Вихід: 11,71г 3-метил-6-хінолінкарбоксальдегіду (71%) (проміжна сполука 18). d) Розчин бромциклогексилу (0,14моль) у 1,1’-оксибісетані (50мл) та стружку Mg (50мл) додають при 10°С до суміші ТГФ (0,14моль) у 1,1’-оксибісетані(10мл). Додають обережно при 5°С розчин проміжної сполуки 18 (0,07моль) у Mg-стр ужці (100мл), суміш виливають у воду з льодом та екстрагують EtOAc. Вихід: 11,34г (±)-ациклогексил-3-метил-6-хінолінметанолу (63%) (проміжна сполука 19). Приклад А10 Суміш сполуки (5) (0,001507моль), трибутил(1-етоксіетеніл)станану (0,00226моль) та Pd(PPh3)4 (0,000151моль) у 1,4-діоксані (5мл) перемішують при 80°С протягом 3 годин. Додають воду. С уміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO 4), фільтр ують і розчинник випаровують. Цей продукт використовують без додаткової очистки. Вихід: 1,4г проміжної сполуки 20. Приклад A11 Суміш сполуки (45) (одержаної згідно з В6) (0,00125моль) у NaOH 3Н (5мл) та iРrOН (1,7мл) перемішують при кімнатній температурі протягом ночі, потім виливають у Н 2О, підкислюють за допомогою НСl 3Н і екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO 4), фільтр ують і розчинник випаровують. Залишок розводять у діетиловому ефірі. Осад відокремлюють на фільтрі та висушують. Вихід: 0,26г проміжної сполуки 21 (56%) (т.пл.: 232°С). Приклад А12 Суміш 5-бром-1Н-індол-2,3-діону (0,221моль) у 3Н NaOH (500мл) перемішують при 80°С протягом 30 хвилин, доводять до кімнатної температури і додають 2-пентанон (0,221моль). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 1 години 30 хвилин і підкислюють за допомогою АсОН до рН=5. Осад фільтрують, промивають водою та висушують. Вихід 52,3г проміжної сполуки 22 та проміжної сполуки 23 (Загальний вихід: 80%). Додають н-BuLi 1,6М (0,0816моль) по краплях при -78°С до суспензії проміжної сполуки 22 (0,034моль) та проміжної сполуки 23 (0,034моль) у ТГФ (300мл) під потоком N2. Суміш перемішують при -78°С протягом 30 хвилин. Додають по краплях н-BuLi 1,6М (0,0816моль). Суміш перемішують протягом 1 години. Додають повільно суміш проміжної сполуки 9 (0,102моль) у ТГФ (250мл). Суміш перемішують, поки температура змінюється з -78°С до -20°С, виливають у суміш Н2О/НСl 3Н та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують до сухого залишку. Вихід: 20,89г проміжної сполуки 24 та проміжної сполуки 25 (86%). Приклад А13 Додають порціями 4-аміно-3-метоксибензойної кислоти (0,054моль) при кімнатній температурі до розчину 3-хлор-2-етил-2-бутеналю (0,065моль) у АсОН (100мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 8 годин та випаровують до сухого залишку. Залишок розводять у СН 2Сl2, додають воду і розчин підлуговують за допомогою Et3N. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок кристалізують з 2-пропанону. Осад відокремлюють на фільтрі та висушують. Вихід: 2,5г проміжної сполуки 26 (18%). Додають карбонілдіімідазол (CDI) (0,012моль) при кімнатній температурі до розчину проміжної сполуки 26 (0,011моль) у СН 2Сl2 (30мл). Суміш перемішують при кімнатній температурі протягом 1 години, додають метоксіамінометил (0,012моль) і суміш перемішують при кімнатній температурі протягом 8 годин. Додають Н2О. Осад збирають на фільтрі. Фільтрат екстрагують СН 2Сl2. Ор ганічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,95г проміжної сполуки 27 (31%) (т.пл.:148°С). Приклад А14 Додають 4-бромбензоламін (0,034моль) при кімнатній температурі до розчину 3-хлорид-2-етил-2бутаналю (0,041моль) у АсОН (60мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 8 годин, доводять до кімнатної температури та випаровують до сухого залишку. Продукт кристалізують з ЕtOАс. Осад фільтр ують, промивають 10%-ним К2СО3 та розводять у СН2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Ви хід: 4,6г проміжної сполуки 28 (54%). Приклад А15 Розчин КОН (0,326моль) у Н2О (150мл) додають повільно при 5°С до розчину 1,3-циклогександіону (0,268моль) у Н2О (150мл). Температура не повинна досягати 12°С. Додають порціями КІ (2г), а потім 2-бром1-(4-нітрофеніл)етанон (0,294моль). Суміш перемішують при кімнатній температурі протягом 48 годин. Осад збирають на фільтрі, промивають Н 2О, а потім діетиловим ефіром та висушують. Ви хід: 63г (85%). Частину цієї фракції (1г) кристалізують з ЕtOН. Осад відокремлюють на фільтрі та висушують. Вихід: 0,5г проміжної сполуки 29 (42%) (т.пл.: 100°С). Суміш проміжної сполуки 29 (0,145моль) у H2SO4 (40мл) перемішують при кімнатній температурі протягом 1 години, виливають на лід, підлуговують за допомогою NH4OH та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з ЕtOН. Осад відокремлюють на фільтрі та висушують. Вихід: 31г (58%). Частину цієї фракції (1г) кристалізують з ЕtOН.Осад відокремлюють на фільтрі та висушують. Ви хід: 0,7г проміжної сполуки 30 (58%) (т.пл.: 200°С). Суміш проміжної сполуки 30 (0,039моль), Ni Ренея (10г) у ЕtOН (100мл) гідрують при кімнатній температурі під тиском 300кПа (3 бар) протягом 1 години. Суміш фільтрують крізь целіт та промивають СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (9,5г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 4,6г (52%). Фільтрат випаровують. Залишок (2,7г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН; 99/1; 15-40мкм). Дві фракції збирають і розчинник випаровують. Вихід: 1,6г F1 і 1,2г F2. F2 кристалізують з ЕtOН. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,24г проміжної сполуки 31 (2%) (т.пл.: 202°С). Проміжну сполуку 30 (0,02моль) додають при кімнатній температурі до розчину 3-хлор-2-етил-2-бутеналю (0,04моль) у АсОН (50мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 4 годин. Розчинник випаровують до сухого залишку. Залишок кристалізують з EtOAc. Осад відокремлюють на фільтрі та висушують. Залишок розводять у СН2Сl2. Суміш підлуговують 10%-ним К2СО3 та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок кристалізують з ЕtOН. Осад відокремлюють на фільтрі та висушують. Ви хід: 2,5г проміжної сполуки 32 (40%). Приклад А16 Суміш 2-(4-нітрофеніл)-1-фенілетанону (0,083моль) та Ni Ренея (20г) у ЕtOН (200мл) гідрують при кімнатній температурі протягом 1 години під тиском 300кПа (3 bar), потім фільтрують крізь целіт, промивають СН2Сl2/СН3ОН та висушують. Вихід: 17,5г проміжної сполуки 33 (97%). Приклад А17 Додають ДМФ (12,4мл) по краплях при 5°С до РОСl3 (0,7536моль). Додають 4'-бром-5-хлорвалеранілід (0,1032моль) і суміш перемішують при 75°С протягом 6 годин, охолоджують при кімнатній температурі та виливають у воду з льодом. Нерозчинну речовину збирають на фільтрі, промивають водою та висушують. Вихід: 25,7г проміжної сполуки 34 (78%). Суміш проміжної сполуки 34 (0,094моль) у 6Н НСl (250мл) перемішують та кип'ятять зі зворотним холодильником протягом 2 днів, охолоджують, виливають у воду (100мл) і нейтралізують NH4OH (концентрований). Нерозчинну речовину збирають на фільтрі та промивають водою, а потім EtOH. Вихід: 19г. Фільтрат випаровують. Залишок (9,4г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН 99,25/0,75; 15-35мкм). Збирають одну фракцію і розчинник випаровують. Ви хід: 8г проміжної сполуки 35 (32%). В. Синтез нерадіоактивних сполук Приклад В1 Додають повільно РОСl3 (0,024моль) при 5°С до ДМФ (0,024моль). Суміш перемішують при кімнатній температурі протягом 30 хвилин, потім охолоджують до 5°С. Додають повільно етиловий складний ефір 3оксобутанової кислоти (0,024моль). Суміш перемішують при 5°С протягом 30 хвилин. Додають порціями 1-(4амінофеніл)-2-фенілетанон (0,024моль). Суміш перемішують при 90°С протягом 3 годин та розчиняють у СН2Сl2. Додають воду з льодом. Суміш підлуговують NH4OH та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтр ують і розчинник випаровують. Залишок кристалізують з суміші 2пропанон/діетиловий ефір. Осад відокремлюють на фільтрі та висушують. Вихід: 0,9г сподуки 306 (11%) (т.пл.: 136°С). Приклад В2 Додають порціями КМnО4 (10г) при кімнатній температурі до розчину сполуки (одержаної згідно з прикладом А7.е) (0,022моль) у трис(діокса-3,6-гептил)аміні (1мл) та СН 2Сl2 (100мл). Суміш перемішують при кімнатній температурі протягом 8 годин, фільтрують крізь целіт, промивають СН2Сl2 та висушують. Залишок (6г, 100%) кристалізують з суміші діетиловий ефір/петролейний ефір. Осад відокремлюють на фільтрі та висушують. Ви хід: 2г сполуки (2) (33%); т.пл. 82°С. Приклад В3 Додають повільно н-BuLi 1,6М (0,07моль) при -70°С до розчину проміжної сполуки (5) (0,058моль) у ТГФ (150мл). Суміш перемішують при -70°С протягом 30 хвилин. Додають повільно розчин 2,3-дигідро-1Н-інден-2карбонітрилу (0,07моль) у ТГФ (100мл). Суміш перемішують при -70°С протягом 1 години, доводять повільно до кімнатної температури, гідролізують за допомогою Н 2О та екстрагують ЕtOАс. Ор ганічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (22г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/циклогексан від 80/20 до 100; 15-35мкм). Чисті фракції збирають і розчинник випаровують. Другу фракцію кристалізують з суміші 2-пропанон/діетиловий ефір. Осад відокремлюють на фільтрі та висушують. Вихід: 0,11г сполуки (3). Фільтрат концентрують. Вихід: 0,55г сполуки (3); т.пл. 145°С. Додають повільно н-BuLi 1,6М (0,022моль) при -70°С до розчину проміжної сполуки (5) (0,018моль) у ТГФ (50мл). Суміш перемішують при -70°С протягом 1 години, доводять до -40°С, а потім охолоджують до -70°С. Додають повільно розчин проміжної сполуки 7 (0,018моль) у ТГФ (40мл). Суміш перемішують при -70°С протягом 1 години, а потім доводять до -20°С, гідролізують за допомогою Н 2О та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (6,5г) очищають хроматографією на колонці з силікагелем (елюент: толуол/ЕtOАс 90/10; 15-40мкм). Збирають дві фракції (F1 та F2) і розчинник випаровують. F1 (2,4г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 1,8г сполуки (4) (29%); т.пл. 123°С. F2 (0,9г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,2г сполуки (5) (3%): т.пл. 120°С. Додають по краплях н-BuLi 1.6М у гексані (0,107моль) при -78°С під потоком N 2 до суміші проміжної сполуки (6) (0,089моль) у ТГФ. Суміш перемішують при -78°С протягом 1 години. Додають суміш проміжної сполуки 7 (150мл) при -78°С під потоком N2. Суміш перемішують при -78°С протягом 2 годин, доводять до 0°С, виливають у Н2О та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (31г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 20-45мкм). Збирають дві чисті фракції та їхні розчинники випаровують. Вихід: 11г сполуки (7) (38%) та 8,2г сполуки (8) (28%). Розчин хлорметилбензолу (0,0069моль) у діетиловому ефірі (8мл) додають повільно до суспензії Mg (0,0069моль) у маленькій кількості діетилового ефіру. Суміш перемішують при кімнатній температурі протягом 30 хвилин (розчинення Mg), а потім охолоджують до 5°С. Додають повільно розчин проміжної сполуки 27 (0,0027моль) у ТГФ (8мл). Суміш перемішують при 5°С протягом 15 хвилин, а потім при кімнатній температурі протягом 2 годин, виливають у Н2О і фільтрують крізь целіт. Осад промивають EtOAc. Фільтрат екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1г) очищають хроматографією на колонці з кромасилом (елюент: від СН2Сl2 100 до СН2Сl2/СН3ОН 99/1; 1540мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,5г, 56%) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,14г сполуки 503 (15%). Приклад В4: Приклади модифікації кінцевих гр уп (одержаної згідно з прикладом В3.с) (0,018моль) у 3Н НСl (60мл) та ТГФ (60мл) перемішують при 60°С протягом ночі. Суміш підлуговують 10%-ним розчином К2СО3 та екстрагують СН 2Сl2 Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Вихід: 4,6г сполуки (156) (82%). (одержаної згідно з прикладом В3.с) (0,0122моль) у 3Н НСl (40мл) та ТГФ (40мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі, виливають у воду, підлуговують 10%-ним К2СО3 та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 40/60; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 2г сполуки (9) (52%); т.пл. 226°С. Суміш сполуки (4) (0,0015моль), 2-метоксіетанаміну (0,003моль) та К2СО3 (0,003моль) у ДМФ (5мл) перемішують при 140°С протягом 48 годин. Додають Н 2О. Суміш екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (1г) очи щають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 60/40; 15-40мкм). Дві фракції збирають і розчинник випаровують. Обидві фракції кристалізують окремо з пентану. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,05г сполуки (10) (9%; т.пл. 115°С) та 0,057г сполуки (11) (10%; т.пл. 107°С). Суміш сполуки (4) (0,0015моль) у 2-(метилтіо)етанаміні (2мл) перемішують при 120°С протягом 8 годин. Додають 10%-ний К2СО3. С уміш екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (2,2г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 70/30; 15-40мкм). Дві фракції збирають і розчинник випаровують. Першу фракцію кристалізують з суміші діетиловий ефір/петролейний ефір. Осад відокремлюють на фільтрі та висушують. Вихід: 0,08г сполуки (12) (14%); т.пл. 120°С. Другу фракцію кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,18г сполуки (13) (31%); т.пл. 125°С. Суміш сполуки (4) (0,001507моль), етинілтриметилсилану (0,003013моль), Cul (0,000151моль) та Pd(PPh3)4 (0,000151моль) у Ν,Ν-діетилетанаміні (5мл) перемішують при 100°С протягом 24 годин. Додають воду. С уміш фільтрують крізь целіт, промивають ЕtOАс і фільтрат екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1,3г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,3г) кристалізують з пентану. Осад відокремлюють на фільтрі та висушують. Вихід: 0,11г сполуки (14) (18%); т.пл. 114°С. Суміш сполуки (14) (0,013моль) та KF (0,038моль) у оцтовій кислоті (50мл) перемішують при кімнатній температурі протягом 2 годин. Додають Н 2О і суміш екстрагують діетиловим ефіром. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (4,4г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 70/30; 15-40мкм). Одну фракцію збирають і розчинник випаровують. Цю фракцію (3г, 73%) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 2,45г сполуки (15) (60%); т.пл. 132°С. Суміш (сполука 14, цис) та (сполука 16, транс) (0,0056моль), одержаних згідно з прикладом В.7.а, у КОН [1М, Н2О] (10мл) та метанолі (30мл) перемішують при кімнатній температурі протягом 1 години, виливають у воду та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (2,2г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс від 85/15 до 70/30; 15-40мкм). Дві фракції збирають і розчинник випаровують. Першу фракцію кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,2г сполуки (15) (11%); т.пл. 133°С. Другу фракцію кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,3г сполуки (17) (16%); т.пл. 128°С. Суміш сполуки (4) (0,001205моль), 2-пропін-1-олу (0,002411моль), Pd(PPh3)4 (0,000121моль) та Cul (0,000121моль) у Ν,Ν-діетилетанаміні (5мл) перемішують при 100°С протягом 2 годин. Додають воду. Суміш фільтрують крізь целіт, промивають ЕtOАс та екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (0,7г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН 98/2; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок кристалізують з петролейного ефіру та діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,1г сполуки (18) (23%); т.пл. 113°С. Суміш сполуки (4) (0,006027моль) та KF (0,024108моль) у ДМСО (20мл) перемішують при 140°С. Розчинник випаровують до сухого залишку. Залишок отверджують у воді та діетиловому ефірі. Суміш екстрагують діетиловим ефіром. Органічний шар відокремлюють, промивають діетиловим ефіром, промивають насиченим розчином NaCl, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1,7г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Збирають три фракції та їхні розчинники випаровують. Першу фракцію кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,21г сполуки (19) (11%); т.пл. 92°С. Другу фракцію кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,33г сполуки (20) (17%); т.пл. 114°С. Суміш сполуки (4) (0,003013моль), ацетилхлориду (0,003315моль) та йодиду натрію (0,006027моль) у CH3CN (10мл) перемішують та кип'ятять зі зворотним холодильником протягом 1 години. Додають 10%-ний КаСО3. Суміш екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтр ують і розчинник випаровують. Залишок (1г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 80/20; 15-40мкм). Дві фракції збирають та їхні розчинники випаровують. Першу фракцію кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,12г сполуки (21); т.пл. 110°С. Суміш сполуки (21) (0,000898моль), триметилсиланкарбонітрилу (0,001347моль) та Pd(PPh3)4 (0,00009моль) у Ν,Ν-діетилетанаміні (5мл) перемішують при 100°С протягом 2 годин. Додають воду. С уміш екстрагують EtOAc. Органічний шар відокремлюють, осушають (MgSO 4), фільтр ують і розчинник випаровують. Залишок (0,4г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 80/20; 1540мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,18г, 62%) кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,13г сполуки (22) (45%); т.пл. 138°С. Суміш сполуки (4) (0,00603моль), Pd(OAc)2 (0,000603моль), PPh3 (0,00904моль) та К2СО3 (0,012054моль) у СО (газ) та метанолі (40мл) перемішують при 90°С протягом 8 годин під тиском CO 500кПа (5 бар). Додають Н2О. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (6г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН від 100/0 до 98/2; 15-35мкм). Збирають чотири фракції (F1-F4) і розчинник випаровують. Ви хід: 0,13г (цис) F1; 0,02г F2 (цис, сполука 25); 0,05 г F3 (транс, 3%) та 0,11г F4 (транс; сполука 26). F1 кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,03г сполуки (23) (1%); т.пл. 91°С. F3 кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,035г сполуки (24) (1%); т.пл. 99°С. Суміш сполуки (4) (0,009моль) та Zn (0,027моль) у оцтовій кислоті (30мл) перемішують при 60°С протягом 4 годин, фільтрують крізь целіт, промивають СН 2Сl2, випаровують до сухого залишку, розчиняють у СН 2Сl2 та промивають 10%-ним К2СО3. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (4г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 75/25; 15-40мкм). Збирають одну фракцію і розчинник випаровують. Цю фракцію (1г, 37%) кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: сполука (25); т.пл. 88°С. Суміш сполуки (4) (0,001502моль), Sn(CH3)4 (0,003004моль) та Pd(PPh3)4 (0,00015моль) у метилбензолі (5мл) перемішують та кип'ятять зі зворотним холодильником протягом 3 годин. Додають 10%-ний К2СО3. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (0,7г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Збирають дві фракції (F1 та F2) та їхні розчинники випаровують. Вихід: 0,27г (F1, вихідний матеріал) та 0,14г (F2). F2 кристалізують з пентану та петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,08г сполуки (27) (17%); т.пл. 110°С. Суміш сполуки (4) (0,001507моль), трибутилетенілстанану (0,002260моль) та Pd(PPh3)4 (0,000151моль) у діоксані (5мл) перемішують при 80°С протягом 8 годин. Додають воду. Суміш фільтр ують крізь целіт, промивають ЕtOАс та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (0,65г) очищають хроматографією на колонці з силікагалем (елюент: циклогексан/ЕtOАс 90/10; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,07г сполуки (28) (14%); т.пл. 108°С. Суміш сполуки (5) (0,001507моль), трифеніл(фенілметил)станану (0,002260моль) та Pd(PPh3)4 (0,000151моль) у діоксані (5мл) перемішують при 80°С протягом 8 годин. Додають воду. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1,4г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/ЕtOАс 96/4; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,38г) кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,16г сполуки (29) (28%); т.пл. 112°С. Суміш сполуки (4) (0,001507моль), трибутил-2-тієнілстанану (0,00226моль) та Pd(PPh3)4 (0,0001507моль) у діоксані (5мл) перемішують при 80°С протягом 8 годин. Додають 10%-ний К2СО3. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1,7г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,65г) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,35г сполуки (30) (61%); т.пл. 142°С. Суміш сполуки (4) (0,0015моль), 3-тієнілборонової кислоти (0,00226моль), Pd(PPh3)4 (0,00015моль) та діоксану перемішують і кип'ятять зі зворотним холодильником протягом 24 годин. Додають 10%-ний К2СО3. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (0,8г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 80/20; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,4г, 70%) кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,39г сполуки (31) (68%);т.пл. 113°С. Суміш сполуки (4) (0,003моль), гліцинметилового складного ефіру моногідрохлориду (0,0066моль) та Pd(PPh)4 (0,0003моль) у Et3N (2мл) та толуолі (10мл) перемішують при 100°С під тиском СО 500кПа (5 бар) протягом 8 годин, фільтрують крізь целіт, промивають СН 2Сl2 та випаровують. Залишок (2г) очи щають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 80/20; 75-35мкм). Збирають одну фракцію і розчинник випаровують. Цю фракцію (1г, 80%) кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,46г сполуки (32) (37%). Суміш сполуки (4) (0,003моль) та гідразинкарбоксальдегіду (0,0045моль) у 1-бутанолі (15мл) перемішують та кип'ятять зі зворотним холодильником протягом ночі, виливають у воду та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 15-40мкм). Дві фракції (F1 та F2) збирають та їхні розчинники випаровують. Вихід: 0,3 г F1 і 0,3г F2. F1 кристалізують з CH3CN та діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,102г сполуки (33); т.пл. 224°С. F2 кристалізують з CH3CN та діетилового ефіру. Осад відокремлюють на фільтрі та видушують. Ви хід: 0,2г сполуки (34); т.пл. 185°С. Суміш сполуки 4 (0,015моль) та NaN3 (0,045моль) у ДМФ (50мл) перемішують при 140°С протягом 2 годин. Додають 10%-ний К2СО3 і суміш екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (6г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 60/40; 15-40мкм). Збирають першу фракцію і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 1,26г сполуки (35) (24%);тліл. 160°С. Суміш сполуки (4) (0,009моль) та тіосечовини (0,0099моль) у етиловому спирті (30мл) перемішують та кип'ятять зі зворотним холодильником протягом 12 годин і додають повільно розчин КОН (0,0149моль) у Н2О (5мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 1 години, виливають у воду та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (циклогексан/ЕtOАс 70/30; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Ви хід: 1,1г F1 (37%) та 0,4г F2 (13%). F1 кристалізують з 2пропанону. Осад відокремлюють на фільтрі та висушують. Вихід: сполука (36). F2 кристалізують з 2пропанону. Осад відокремлюють на фільтрі та висушують. Ви хід: сполука (37). Додають повільно СН 3І (0,0034моль) при кімнатній температурі до розчину сполуки (36) (0,0015моль), сполуки (37) (0,0015моль) та К2СО3 (0,0034моль) у ацетоні (15мл). Суміш перемішують при кімнатній температурі протягом 8 годин. Додають воду і суміш екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (1,2г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 0,6г F1 (57%) та 0,18г F2 (17%). F1 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,28г сполуки (38) (27%). F2 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,065г сполуки (39) (6%). Суміш (сполука (41), одержана згідно з прикладом В3.b) (0,0014моль) у 3Н НСl (5мл) та ТГФ (5мл) перемішують та кип'ятять зі зворотним холодильником протягом вихідних, а потім виливають у Н 2 О, підлуговують за допомогою К2СО3 та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Вихід: 0,5г F. Цю фракцію F кристалізують з 2-пропанону. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,35г сполуки (40) (74%). Суміш сполуки (5) (0,045моль), ацетаміду (0,90013моль) та К2СО3 (0,225моль) перемішують та кип'ятять зі зворотним холодильником при 200°С протягом 2 годин, охолоджують при кімнатній температурі, виливають у суміш Н2О/СН2Сl2 та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують до сухого залишку. Залишок (14,4г) кристалізують з СН 3ОН. Осад відокремлюють на фільтрі та висушують. Фільтрат випаровують. Залишок (11,27г) очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1; 15-35мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 4 ,2г сполуки (188) (65%). Суміш сполуки (188) (0,00032моль), бензойної кислоти (1,5екв., 0,00048моль), 1-етил-3-(3'диметиламінопропіл)карбодіімцгу ×НС1 (1:1) (1,5екв., 0,00048моль), N-гідроксибензотриазолу (1,5екв., 0,00048 моль) та Et3N (1екв., 0,00032моль) у СН2Сl2 (2мл) перемішують при кімнатній температурі протягом 15 годин. Розчинник випаровують. Залишок очищають методом ВЕРХ і фракції продукту збирають та розчинник випаровують. Вихід: 0 ,066г сполуки (205) (49,50%). Суміш проміжної сполуки 20 (0,001507моль) у 3Н НСl (10мл) та ТГФ (10мл) перемішують при кімнатній температурі протягом 8 годин, підлуговують 10%-ним К2СО3 та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (1,2г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 85/15; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Залишок (0,4г) кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,3г сполуки (6) (58%); т.пл. 108°С. Суміш сполуки 213 (одержаної згідно з В4) (0,00305моль) та CH3ONa (30% у СН3ОН) (0,00916 моль) у СН3ОН (25мл) перемішують та кип'ятять зі зворотним холодильником протягом 15 годин, а потім охолоджують до кімнатної температури, виливають у Н 2О та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують до сухого залишку. Залишок (1,1г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс; 40/60; 15-40мкм). Дві фракції збирають і розчинник випаровують. Вихід: 0,3г F1 та 0,5г F2 (50%). F2 кристалізують з суміші діетиловий ефір/петролейний ефір. Осад відокремлюють на фільтрі та висушують. Вихід: 0,26г. F1 кристалізують з пентану. Осад відокремлюють на фільтрі та висушують. Вихід: 0,19г. Цю фракцію очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН; 98/2; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 0,11 г. Цю фракцію очищають хроматографією на колонці з кромасилом (елюент: СН3ОН/Н2О; 70/30). Чисті фракції збирають і розчинник випаровують. Вихід: 0,09г (9%). Цю фракцію кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,08г сполуки 419 (8%). Приклад В5 Додають йодметан (0,00456моль) при 5°С до суміші сполуки (9) (0,0019моль), сполуки (8) (0,0019моль) та трет-ВuОК (0,00456моль) у ТГФ (30мл) під потоком N2. Суміш перемішують при кімнатній температурі протягом ночі, виливають у Н2О та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 65/35; 15-40мкм). Дві фракції збирають і розчинник випаровують. Вихід: 0,35г сполуки (42) (30%; т.пл. 125°С) та 0,35г сполуки (43) (30%; т.пл. 116°С). Приклад В6 Додають NaH 60% (0,01068моль) при 0°С під потоком N2 до суміші сполуки (8) та сполуки (9) (0,0089моль). Суміш перемішують протягом 30 хвилин. Додають етилбромацетат (0,01068моль) при 0°С. Суміш перемішують при кімнатній температурі протягом 1 години, гідролізують водою та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс 60/40; 15-40мкм). Потрібні фракції (F1F4) збирають і розчинник випаровують. Вихід: 0,11г F1; 0,13г F2; 0,75г F3 та 0,8г F4. F3 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: сполука (44); т.пл. 152°С. F4 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: сполука (45); т.пл. 147°С. Бромметилбензол (0,007моль) додають по краплях при 0°С під потоком N 2 до розчину сполуки (8) та сполуки (9) (0,0064моль) і NaH 60% (0,007моль) у ДМФ (40мл). Суміш перемішують при кімнатній температурі протягом 1 години, гідролізують водою та екстрагують EtOAc. Органічний шар відокремлюють, промивають водою, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: циклогексан/EtOAc 70/30; 15-40мкм). Потрібні фракції (F1-F4) збирають і розчинник випаровують. Ви хід: 0,15г F1, 0,1г F2, 0,6г F3 (23%) та 0,8г F4. F3 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,13г сполуки (46); т.пл. 137°С. F4 кристалізують з DIPE та петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: сполука (47); т.пл. 130°С. Приклад В7 a) Додають 3-хлорпербензойну кислоту (0,088моль) при 0°С до розчину сполуки (48) (одержаної згідно з прикладом В2) (0,044моль) у СН2Сl2 (200мл) і суміш перемішують при кімнатній температурі протягом 12 годин. Суміш промивають 10%-ним К2СО3. Органічний шар осушають (MgSO4), фільтрують та випаровують. Залишок перекристалізовують з (С2Н5)2О. Ви хід: 8,2г 1-оксиду циклогексил-(3-метил-6-хінолініл)метанону (сполука 49) (69%). b) 4-Метилбензолсульфонілхлорид (0,043моль) додають до розчину сполуки (49) (0,028моль) у К2СО3 (400мл) та СН 2Сl2 (400мл) і суміш перемішують при кімнатній температурі протягом 1 години. Суміш екстрагують СН 2Сl2. Органічний шар осушають (MgSO4), фільтрують та випаровують. Залишок перекристалізовують з (С2Н5)2О. Ви хід: 6,64г 6-(циклогексилкарбоніл)-3-метил-2(1Н)-хінолінону (сподука 50) (85%); т.пл. 256,1°С. Приклад В8 Суміш сполуки (7) (0,0229моль), гідроксиламіну (0,0252моль) та Ν,Ν-діетилетанаміну (0,0252моль) в етанолі (100мл) перемішують та кип'ятять зі зворотним холодильником протягом 6 годин, виливають у воду та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок кристалізують з CH3CN. Осад відокремлюють на фільтрі та висушують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/ЕtOАс 80/20; 15-40мкм). Дві фракції збирають ірозчинник випаровують. Вихід: 2,8г сполуки (51) (36%; т.пл. 133°С) та 3г сполуки (52) (38%; т.пл. 142°С). Додають гідразин (0,41моль) при кімнатній температурі до розчину сполуки (7) (0,015моль) в етанолі (75мл). Суміш перемішують та кип'ятять зі зворотним холодильником протягом 1 ночі, виливають у воду та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН/NH4ОН 98/2/0,1). Чисті фракції збирають і розчинник випаровують. Залишок кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,8г сполуки (53) (15%); т.пл. 110°С. Приклад В9 Процедура для сполук 400, 401, 402, 403, 404 та 405. Суміш проміжної сполуки 21 (одержаної згідно з A11) (0,000269моль), амантадину гідрохлориду (0,000404моль; 1,5екв.), N’-(етилкарбонімідоїл-N,N-диметил-1,3пропандіаміну гідрохлориду (0,000404моль; 1,5екв.), 1-гідрокси-1Н-бензотриазолу (0,000404моль; 1,5екв.) та Et3N (0,000269моль) у СН2Сl3 (2мл) перемішують при кімнатній температурі протягом 12 годин. Розчинник випаровують. Залишок очищають методом ВЕРХ. Фракції продукту збирають і розчинник випаровують. Вихід: 0,063г сполуки 520 (46,37%). Приклад В10 Суміш проміжної сполуки 27 (0,0026моль) та проміжної сполука 26 (0,0026моль) у ЕtOН (380мл) і конц.H2SO4 (19мл) перемішують та кип'ятять зі зворотним холодильником протягом 15 години, потім охолоджують до кімнатної температури, виливають у воду з льодом, підлуговують К2СО3 та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (17,9г) очищають хроматографією на колонці з силікагелем (елюент: циклогексан/ЕtOАс; 80/20; 15-35мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 0,85г F1, 1,1г F2 та 11,5г F3. F1 і F2 кристалізують окремо з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0 ,34г сполуки 233. Приклад В11 Суміш сполуки 22 (одержаної згідно з В4) (0,004моль) у НСl (3Н) (20мл) та ТГФ (20мл) перемішують та кип'ятять зі зворотним холодильником протягом 8 годин, виливають на лід, підлуговують NH 4OH і екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (1,2г) очищають хроматографією на колонці з силікагелем (елюент: CH2Cl2/CH3OH/NH4OH; 93/7/0,5; 15-40мкм). Дві фракції збирають і розчинник випаровують. Ви хід: 0,5г F1 (41%) та 0,4г F2. F1 кристалізують з петролейного ефіру. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,17г сполуки 511 (14%). Приклад В12 Суміш сполуки 524 (одержаної згідно з В9а) (0,0018моль) та 85%-ного КОН (0,0094моль) у ЕtOН (15мл) перемішують та кип'ятять зі зворотним холодильником протягом 24 годин, виливають у Н 2О та екстрагують СН2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/циклогексан 80/20; 15-40мкм). Дві фракції збирають і розчинник випаровують. Вихід: 0,35г F1 (64%) та 0,17г (вихідний матеріал). F1 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 0,33г сполуки 514 (60%) (т.пл.: 185°С). Приклад В13 Суміш проміжної сполуки 28 (0,019моль), 2-бензофуранілборонової кислоти (0,028моль), Pd(PPh3)4 (0,001моль) та бутилокситолуолу (ВНТ) (невелика кількість) у діоксані (25мл) та Na2CO3 [2] (25мл) перемішують і кип'ятять зі зворотним холодильником протягом 8 годин та екстрагують EtOAc. Водний шар підлуговують NH4OH та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO4), фільтрують і розчинник випаровують. Залишок (3,6г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/СН3ОН 99/1; 15-40мкм). Чисті фракції збирають і розчинник випаровують. Вихід: 1,8г (33%). Цю фракцію кристалізують з суміші 2-пропанон/діетиловий ефір. Осад відокремлюють на фільтрі та висушують. Вихід: 0,39г сполуки 515 (7%) (т.пл.: 134°С). Приклад В14 Триетилсилан (0,0012моль) додають повільно при кімнатній температурі до розчину проміжної сполуки 32 (0,004моль) у CF3COOH (5мл) та АсОН (10мл). Додають порціями NaBH4 (0,0012моль) під потоком N2. Суміш перемішують при кімнатній температурі протягом 8 годин, виливають на лід, підлуговують К2С О3 та екстрагують СН 2Сl2. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (1,2г) очищають хроматографію на колонці з силікагелем (елюент: СН2Сl2/СН3ОН 99/1; 15-40мкм). Дві фракції збирають і розчинник випаровують. Вихід: 0,5г F1 (43%) та 0,4г F2. F1 розчиняють у іРrOН. Додають НСІ/iРrОН (1екв.). Осад відокремлюють на фільтрі та висушують. Ви хід: 0,32г сполуки 526 (т.пл.: 248°С). Приклад В15 Суміш проміжної сполуки 33 (0,082моль) та 3-хлор-2-етил-2-бутеналю (0,098моль) у АсОН (200мл) перемішують та кип'ятять зі зворотним холодильником протягом 8 годин. Розчинник випаровують до сухого залишку. Залишок розчиняють у СН 2Сl2 та промивають 10%-ним К2СО3. Органічний шар відокремлюють, осушають (MgSO 4), фільтрують і розчинник випаровують. Залишок (27г) очищають хроматографією на колонці з силікагелем (елюент: СН2Сl2/ЕtOАс від 95/5 до 92/8; 15-35мкм). Дві фракції збирають і розчинник випаровують. Вихід: 0,7г F1 та 5,3г F2. F1 кристалізують з суміші 2-пропанон/діетиловий ефір. Осад відокремлюють на фільтрі та висушують. Ви хід: 0,25г сполуки 471 (2%) (т.пл.: 140°С). Приклад В16 Додають н-BuLi (0,0417моль) по краплях при -78°С до розчину проміжної сполуки 35 (одержаної згідно з А17.b) (0,0379моль) у ТГФ (200мл) під потоком N 2. Суміш перемішують протягом 30 хвилин. Додають по краплях розчин 4-бром-N-метокси-N-метилбензолацетаміду (0,0568моль) у ТГФ (100мл) при -78°С. Суміш перемішують, поки температура зростає з -78°С до 0°С, виливають у Н 2О та екстрагують ЕtOАс. Органічний шар відокремлюють, осушають (MgSO4). фільтрують і розчинник випаровують до сухого залишку. Залишок (20,9г) очищають хроматографією на колонці з силікагелем (елюент: толуол/ЕtOАс від 60/40 до 50/50; 15-35мкм). Дві фракції збирають і розчинник випаровують. Вихід: 4г фракції 1 та 4г фракції 2 (28%). Фракцію 2 кристалізують з діетилового ефіру. Осад відокремлюють на фільтрі та висушують. Вихід: 1г сполуки 528 (т.пл. 195°С). Таблиці 1-8 перелінують сполуки формули (l-А) та (І-В), які були одержані згідно з одним з наведених вище прикладів.
ДивитисяДодаткова інформація
Назва патенту англійськоюRadiolabelled quinoline and quinolinone derivatives and use thereof as metabotropic ligands of glutamate receptor
Автори англійськоюBischoff Francois Paul
Назва патенту російськоюРадиомеченные производные хинолина и хинолинона и их применение в качестве метаботропных лигандов глутаматных рецепторов
Автори російськоюБишофф Франсуа Поль
МПК / Мітки
МПК: A61K 51/04, A61K 101/00
Мітки: радіомічені, рецепторів, хінолінонові, лігандів, глутаматних, хінолінові, використання, похідні, метаботропічних, їхнє
Код посилання
<a href="https://ua.patents.su/72-78548-radiomicheni-khinolinovi-ta-khinolinonovi-pokhidni-ta-khneh-vikoristannya-yak-metabotropichnikh-ligandiv-glutamatnikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Радіомічені хінолінові та хінолінонові похідні та їхнє використання як метаботропічних лігандів глутаматних рецепторів</a>
Попередній патент: Світлозахисна композиція для шкіри, призначена для орального приймання
Наступний патент: Спосіб переробки радіоактивних відходів
Випадковий патент: Футляр-блістер












