Інгібітори кіназ акт та p70-s6
Номер патенту: 100190
Опубліковано: 26.11.2012
Автори: Шеперд Тімоті Алан, Даллі Роберт Дін, Джоузеф Саджан
Формула / Реферат
1. Сполука формули:
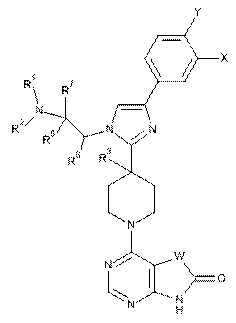 ,
,
де:
X - F, Сl, CF3, CN або Н;
Y - F, Н або Сl;
R1 та R2 незалежно один від одного є Н, С1-С4-алкіл або СН2СН2ОН; або R1 та R2 разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3, або азетидиновий цикл, заміщений гідроксилом у положенні 3;
R3 - Н або ОН;
R6 - Н; або R6 та R2 разом з атомом азоту, до якого приєднаний R2, утворюють піперидиновий цикл;
R7 та R8 незалежно один від одного є Н або СН3; або R7 та R1 разом з атомом азоту, до якого приєднаний R1, утворюють піролідиновий цикл;
W - CR4R5, NR10, С=О або C=CH-R9;
R4 та R5 незалежно один від одного є Н, СН3 або СН2СН3; R4 та R5 разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий цикл; або один із R4 або R5 - бензил, а інший - Н;
R9 - 2-тіазоліл, 4-піридил, 2-метил-4-тіазоліл, 2-імідазоліл, 5-тіазоліл або 4-імідазоліл; та
R10 - Н або С1-С3-алкіл;
або фармацевтично прийнятна сіль цієї сполуки.
2. Сполука за п. 1 або фармацевтично прийнятна сіль цієї сполуки, де Y - F.
3. Сполука за п. 1 або п. 2 або фармацевтично прийнятна сіль цієї сполуки, де X - Сl, CF3 або F.
4. Сполука за будь-яким із пп. 1-3 або фармацевтично прийнятна сіль цієї сполуки, де W - CR4R5.
5. Сполука за п. 4 або фармацевтично прийнятна сіль цієї сполуки, де R4 та R5 незалежно один від одного є Н або СН3, або R4 та R5 разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий цикл.
6. Сполука за будь-яким із пп. 1-3 або фармацевтично прийнятна сіль цієї сполуки, де W - NR10.
7. Сполука за будь-яким із пп. 1-3 або фармацевтично прийнятна сіль цієї сполуки, де W - C=CH-R9.
8. Сполука за п. 7 або фармацевтично прийнятна сіль цієї сполуки, де R9 - 5-тіазоліл.
9. Сполука за будь-яким із пп. 1-8 або фармацевтично прийнятна сіль цієї сполуки, де R1 та R2 незалежно один від одного є Н, С1-С4-алкіл або СН2СН2ОН; або R1 та R2 разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3.
10. Сполука за будь-яким із пп. 1-9 або фармацевтично прийнятна сіль цієї сполуки, де R3 - Н.
11. Сполука за п. 1, яка являє собою 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1Н-імідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]-піримідин-6-он, або фармацевтично прийнятна сіль цієї сполуки.
12. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-11 або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або наповнювач.
13. Сполука за будь-яким із пп. 1-11 або фармацевтично прийнятна сіль цієї сполуки для застосування в терапії.
14. Сполука за будь-яким із пп. 1-11 або фармацевтично прийнятна сіль цієї сполуки для застосування у лікуванні поліморфної гліобластоми.
15. Спосіб лікування поліморфної гліобластоми у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за будь-яким із пп. 1-11 або фармацевтично прийнятної солі цієї сполуки.
Текст
Реферат: Цей винахід пропонує інгібітори кіназ АКТ та р70-S6 формули: . Формула І UA 100190 C2 (12) UA 100190 C2 Цей винахід пропонує також фармацевтичні композиції, які містять сполуки формули І, застосування сполуки формули І та способи використання сполуки формули І. N N H N N W N O N W OH UA 100190 C2 5 10 15 20 25 30 Передумови створення винаходу Мішень рапаміцинового (mTOR) провідного шляху фосфотидилінозит-3-кінази (PI3K)/AKT в організмі ссавців охоплює групу сигнальних точок, які мають вирішальне значення для регулювання росту та виживання клітин. AKT, відома також як протеїнкіназа B, являє собою серин-треонінову протеїнкіназу, яка відіграє ключову роль у цьому провідному шляху. Активація AKT опосередковується PI3K. PI3K генерує фосфоліпіди, які зв'язуються з AKT. При цьому зв'язуванні AKT входить до складу плазмової мембрани і активується шляхом фосфорилування. Активація та сигнальна активність AKT сприяє виживанню, росту та проліферації клітин. Посилена активація AКТ відіграє певну роль у різних ракових захворюваннях. P70-S6-кіназа є серин-треоніновою протеїнкіназою, яка є послідовним ефектором у провідному шляху PI3K/AKT/mTOR. P70-S6-кіназа фосфорилює рибосомний протеїн S6 у клітинах та регулює рибосомний біогенез, ріст клітин та проходження клітинного циклу як реакцію на мітогенне стимулювання. P70-S6-кіназа звичайно активована у численних твердих пухлинах. Група заміщених піперидинових сполук, які мають інгібувальну дію на AKT, описана в WO 2008/075109. Ці сполуки описані як прийнятні для застосування у лікуванні захворювань або хворобливих станів, які включають аномальний ріст клітин або аномальну затримку смерті клітин, в тому числі рак, або виникають при таких розладах. Залишається потреба у забезпеченні альтернативних інгібіторів AKT, які можуть застосовуватися у лікуванні проліферативних розладів, таких як рак. Цей винахід пропонує альтернативні інгібітори AKT. Сполуки за цим винаходом, яким віддається перевага, є більш ефективними інгібіторами AKT, ніж відомі інгібітори. Крім того, існує потреба у забезпеченні альтернативних інгібіторів p70-S6-кінази, які можна застосовувати у лікуванні проліферативних розладів, таких як рак. Цей винахід пропонує альтернативні інгібітори p70-S6-кінази. Сполуки за цим винаходом, яким віддається перевага, є більш ефективними інгібіторами p70-S6-кінази, ніж відомі інгібітори. Сполуки за цим винаходом, яким віддається перевага, є інгібіторами як AKT, так і p70-S6кінази. Сполуки за цим винаходом, яким віддається більша перевага, є більш ефективними інгібіторами AKT, ніж відомі інгібітори АКТ, і більш ефективними інгібіторами p70-S6-кінази, ніж відомі інгібітори p70-S6-кінази. Деякі сполуки за цим винаходом мають нижчу ефективність стосовно до hERG, ніж відомі інгібітори AKT та/або відомі інгібітори p70-S6-кінази. Суть винаходу Цей винахід пропонує сполуки формули: Y X 1 R 7 R N 2 R N N 8 R 6 R 3 R N W N O 35 40 N N H , Формула I де: X – F, Cl, CF3, CN або H; Y – F, H або Cl; 1 2 1 2 R та R незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH; або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3, або азетидиновий цикл, заміщений гідроксилом у положенні 3; 1 UA 100190 C2 3 5 10 15 20 25 30 35 40 45 50 55 R – H або OH; 6 6 2 2 R – H; або R та R разом з атомом азоту, до якого приєднаний R , утворюють піперидиновий цикл; 7 8 7 1 R та R незалежно один від одного є H або CH3; або R та R разом з атомом азоту, до 1 якого приєднаний R , утворюють піролідиновий цикл; 4 5 10 9 W – CR R , NR , C=O або C=CH-R ; 4 5 4 5 R та R незалежно один від одного є H, CH3 або CH2CH3; R та R разом з атомом вуглецю, 4 5 до якого вони приєднані, утворюють циклопентановий цикл; або один із R або R – бензил, а другий – H; 9R 2-тіазоліл, 4-піридил, 2-метил-4-тіазоліл, 2-імідазоліл, 5-тіазоліл або 4-імідазоліл; та 10 R – H або C1-C3-алкіл; або фармацевтично прийнятні солі цих сполук. Цей винахід пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та фармацевтично прийнятні носій, розріджувач або наповнювач. Цей винахід пропонує сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки для застосування в терапії. Цей винахід пропонує сполуку за цим винаходом або фармацевтично прийнятні солі цих сполук для застосування в лікуванні поліморфної гліобластоми. Цей винахід також пропонує спосіб лікування поліморфної гліобластоми у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки. Крім того, цей винахід пропонує застосування сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки для виготовлення лікарського засобу для лікування поліморфної гліобластоми. Цей винахід також пропонує фармацевтичну композицію для застосування в терапії, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки, та пропонує фармацевтичну композицію для лікування поліморфної гліобластоми, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки. Детальний опис винаходу Загальні хімічні терміни, вжиті у наведених вище формулах, мають свої звичайні значення. Наприклад, термін "C1-C4-алкіл" означає лінійний або розгалужений одновалентний насичений аліфатичний ланцюг, який містить від одного атому до чотирьох атомів вуглецю, та охоплює, але без обмеження ними, метил, етил, пропіл, ізопропіл, бутил, ізобутил та трет-бутил. Аналогічно, термін "C1-C3-алкіл" охоплює метил, етил та ізопропіл. Метил та етил є алкільними групами, яким віддається перевага. Сполуки за цим винаходом є основами та відповідно реагують із будь-якою із численних органічних та неорганічних кислот з утворенням фармацевтично прийнятних солей, і цей винахід охоплює фармацевтично прийнятні солі сполук формули I. Термін "фармацевтично прийнятна сіль" у значенні, вживаному у цьому описі, означає солі сполук формули I, які є практично нетоксичними для живих організмів. До таких солей належать фармацевтично прийнятні солі, перелічені у Journal of Pharmaceutical Science, 66, 2-19 (1977), які є відомими фахівцю у галузі. Перевага віддається таким солям як гідрохлориди, тозилати, гемісукцинати та солі тристрифторметансульфонової кислоти. Найбільша перевага віддається вільній основі. Деякі сполуки цього винаходу містять один або декілька хіральних центрів та можуть, таким чином, існувати у різноманітних стереоізомерних конфігураціях. Як результат наявності цих хіральних центрів сполуки за цим винаходом можуть зустрічатися у вигляді рацематів, сумішей енантіомерів та індивідуальних енантіомерів, а також діастереомерів та сумішей діастереомерів. Всі такі рацемати, енантіомери та діастереомери охоплюються цим винаходом. Конкретні стереоізомери та енантіомери сполук формули I можуть бути одержані із застосуванням звичайних методик та способів, відомих у галузі, наприклад, таких як способи, описані у монографіях Жак та ін. (J. Jacques, et al., "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, Inc., 1981) і Ельєль та Уайлен (E.L. Eliel and S.H. Wilen, "Stereochemistry of Organic Compounds", Wiley-Interscience, 1994) та у Європейській патентній заявці EP-A-838448, опублікованій 29 квітня 1998 р. До прикладів способів розділення належать перекристалізація та хіральна хроматографія. Фахівцю буде також зрозуміло, що сполуки формули I існують у формі таутомерів, наприклад: 2 UA 100190 C2 N N N N W N H N W O 5 10 OH Хоча таутомери є структурно відмінними, для фахівця зрозуміло, що між ними існує рівновага, і за звичайних умов кожний з них легко та швидко перетворюється в інший. (Дивись монографії Марч – March, Advanced Organic Chemistry, Third Edition, Wiley Interscience, New York, New York (1985), pp. 66-70; та Аллінгер – Allinger, Organic Chemistry, Second Edition, Worth Publishers, New York, New York, (1976), p. 173). Таким чином, представлення сполуки формули I в одній таутомерній формі охоплює обидві таутомерні форми окремо та їх суміші. Сполуки, розкриті в цьому описі, мають назви, утворені із застосуванням програм Chem Draw Ultra версія v10 або Chem Bio Viz Ultra версія v11. За альтернативним варіантом здійснення цього винаходу запропонована сполука формули: Y X 1 R 7 R N 2 R N N 8 R 6 R 3 R N W N O N 15 20 25 30 35 N H , де: X – F, Cl, CF3, CN, H або CHF2; Y – F, H або Cl; 1 2 1 2 R та R незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH; або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3, або азетидиновий цикл, заміщений гідроксилом у положенні 3; 3 R – H або OH; 6 6 2 2 R – H; або R та R разом з атомом азоту, до якого приєднаний R , утворюють піперидиновий цикл; 7 8 7 1 R та R незалежно один від одного є H або CH3; або R та R разом з атомом азоту, до 1 якого приєднаний R , утворюють піролідиновий цикл або піперидиновий цикл; 4 5 10 9 W – CR R , NR , C=O або C=CH-R ; 4 5 4 5 R та R незалежно один від одного є H, CH3 або CH2CH3; R та R разом з атомом вуглецю, 4 5 до якого вони приєднані, утворюють циклопентановий цикл; або один із R або R – бензил, а інший – H; 9R 2-тіазоліл, 4-піридил, 2-метил-4-тіазоліл, 2-імідазоліл, 5-тіазоліл або 4-імідазоліл; та 10 R – H або C1-C3-алкіл; або фармацевтично прийнятні солі цих сполук. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де Y – F. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де X – Cl, CF3 або F. Зокрема, X – CF3. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де W – 4 5 10 9 CR R , NR або C=CH-R . За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де W – 4 5 4 5 4 5 CR R . Зокрема, R та R незалежно один від одного є H або CH 3; або R – H, та R – CH2CH3; 3 UA 100190 C2 4 5 10 15 20 25 30 35 40 5 або R та R разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий 4 5 4 5 цикл. Більш конкретно, R та R незалежно один від одного є H або CH 3; або R та R разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий цикл. Більш конкретно, 4 5 4 5 R та R незалежно один від одного є H або CH3. Ще більш конкретно, обидва з R та R є H. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де W – 10 10 NR . Зокрема, R – метил або етил. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де W – 9 9C=CH-R . Зокрема, R 5-тіазоліл. 1 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де R та 2 1 2 R незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH; або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений 1 2 гідроксиметилом у положенні 2 або гідроксилом у положенні 3. Зокрема, R та R незалежно 1 2 один від одного є H або CH3; або R та R разом з атомом азоту, до якого вони приєднані, 1 2 утворюють піролідиновий цикл. Більш конкретно, обидва з R та R є CH3. 3 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де R – H. 6 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де R – H. 7 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де R – H; 7 1 1 або R та R разом з атомом азоту, до якого приєднаний R , утворюють піролідиновий цикл. 7 Зокрема, R – H. 8 За ще одним варіантом здійснення цього винаходу запропоновані сполуки формули I, де R – H. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де Y – F, 4 5 та X – Cl, CF3 або F. Зокрема, Y – F; X – Cl, CF3 або F; та W – CR R . Більш конкретно, Y – F; X – 4 5 4 5 4 5 Cl, CF3 або F; W – CR R ; та R та R незалежно один від одного є H або CH3, або R та R разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий цикл. Ще більш 4 5 4 5 конкретно, Y – F; X – Cl, CF3 або F; W – CR R ; R та R незалежно один від одного є H або CH3, 4 5 або R та R разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий 1 2 1 2 цикл; та R та R незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH, або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де Y – F; 10 10 1 2 X – Cl, CF3 або F; та W – NR . Зокрема, Y – F; X – Cl, CF3 або F; W – NR ; і R та R незалежно 1 2 один від одного є H, C1-C4-алкіл або CH2CH2OH, або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули I, де Y – F; 9 9 9X – Cl, CF3 або F; та W – C=CH-R . Зокрема, Y – F; X – Cl, CF3 або F; W – C=CH-R ; та R 59 91 2 тіазоліл. Більш конкретно, Y – F; X – Cl, CF3 або F; W – C=CH-R ; R 5-тіазоліл; та R та R 1 2 незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH, або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули: F X 7 1 R R N 2 R N N 8 R 6 R 3 R N W N O N 45 N H , Формула II де: X – F, Cl або CF3; 4 UA 100190 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 1 2 R та R незалежно один від одного є H, C1-C4-алкіл або CH2CH2OH; або R та R разом з атомом азоту, до якого вони приєднані, утворюють піролідиновий цикл, факультативно заміщений гідроксиметилом у положенні 2 або гідроксилом у положенні 3; 3 R – H або OH; 6 6 2 2 R – H; або R та R разом з атомом азоту, до якого приєднаний R , утворюють піперидиновий цикл; 7 8 7 1 R та R незалежно один від одного є H або CH3; або R та R разом з атомом азоту, до 1 якого приєднаний R , утворюють піролідиновий цикл; 4 5 10 9 W – CR R , NR або C=CH-R ; 4 5 4 5 R та R незалежно один від одного є H або CH3; або R та R разом з атомом вуглецю, до якого вони приєднані, утворюють циклопентановий цикл; 9R 5-тіазоліл; та 10 R – H або C1-C3-алкіл; або фармацевтично прийнятні солі цих сполук. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де X – CF3. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де W – 4 5 4 5 4 5 CR R , і R та R незалежно один від одного є H або CH3. Зокрема, обидва з R та R є H. За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де W – 10 10 NR , та R – метил або етил. 1 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де R та 2 1 2 R незалежно один від одного є H або CH3; або R та R разом з атомом азоту, до якого вони 1 2 приєднані, утворюють піролідиновий цикл. Зокрема, обидва з R та R є CH3. 3 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де R – H. 6 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де R – H. 7 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де R – 7 1 1 H, або R та R разом з атомом азоту, до якого приєднаний R , утворюють піролідиновий цикл. 7 Зокрема, R – H. 8 За іншим варіантом здійснення цього винаходу запропоновані сполуки формули II, де R – H. Перевага віддається переліченим нижче сполукам за цим винаходом або фармацевтично прийнятним солям цих сполук: 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-(2-метиламіноетил)-1H-імідазол-2-іл]піперидин-1іл}-5,7-дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[1-(2-аміноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[4-(4-фтор-3-трифторметилфеніл)-1-((R)-1-метилпіперидин-3-іл)-1H-імідазол-2іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1іл}-5,5-диметил-5,7-дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[4-(3,4-дифторфеніл)-1-(2-піролідин-1-ілетил)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[4-(3-хлор-4-фторфеніл)-1-(2-піролідин-1-ілетил)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1іл}-5H-піроло[2,3-d]піримідин-6(7H)-он; 7-етил-6-{4-[4-(4-фтор-3-трифторметилфеніл)-1-(2-(піролідин-1-іл)етил)-1H-імідазол-2іл]піперидин-1-іл}-7H-пурин-8(9H)-он; 6-{4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-7етил-7H-пурин-8(9H)-он; 6-{4-[4-(3,4-дифторфеніл)-1-(2-(піролідин-1-іл)етил)-1H-імідазол-2-іл]піперидин-1-іл}-7-етил7H-пурин-8(9H)-он; 6-{4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-7ізопропіл-7H-пурин-8(9H)-он; 6-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1іл}-7-етил-7H-пурин-8(9H)-он; 6-{4-[4-(3,4-дифторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-7-етил7,9-дигідропурин-8-он; 4-{4-[4-(3,4-дифторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-5-етил 5 UA 100190 C2 5 10 15 20 25 30 35 40 45 50 55 5,7-дигідропіроло[2,3-d]піримідин-6-он; 4-{4-[4-(3,4-дифторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-5-метил5H-піроло[2,3-d]піримідин-6(7H)-он; 4-{4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-іл}-5,5диметил-5H-піроло[2,3-d]піримідин-6(7H)-он; та 4-{4-[4-(3-хлор-4-фторфеніл)-1-(2-(піролідин-1-іл)етил)-1H-імідазол-2-іл]піперидин-1-іл}-5метил-5H-піроло[2,3-d]піримідин-6(7H)-он. Особлива перевага віддається сполуці 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-он або фармацевтично прийнятній солі цієї сполуки. За одним із варіантів здійснення цього винаходу, якому віддається перевага, запропонована сполука 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-он або фармацевтично прийнятна сіль цієї сполуки – кристалічний гемігідрат 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-ону. Кристалічний гемігідрат 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1Hімідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-ону характеризується щонайменше одним із таких піків на порошковій рентгенодифрактограмі: 7,4, 14,9, 21,1, 19,8 або 10,5 (0,1 2). За варіантом, якому віддається перевага, він характеризується наявністю таких піків на порошковій рентгенодифрактограмі: 7,4, 14,9, 21,1, 19,8 та 10,5 ( 0,1 2). Кристалічний гемігідрат 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-ону може також характеризуватися спектром SSNMR, який містить щонайменше один із таких резонансів: 179,8, 156,9, 151,9, 137,5 -1 або 33,8 млн . За варіантом, якому віддається перевага, він характеризується спектром -1 SSNMR, який містить такі резонанси: 179,8, 156,9, 151,9, 137,5 та 33,8 млн . За іншим варіантом здійснення цього винаходу запропонована сполука 4-{4-[1-(2диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он або фармацевтично прийнятна сіль цієї сполуки – 4-{4-[1-(2диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он-тристрифторметансульфонова кислота. 4-{4-[1-(2диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он-трис-трифторметансульфонова кислота характеризується щонайменше одним із таких піків на порошковій рентгенодифрактограмі: 22,6, 21,7, 21,5, 21,1, 20,4, 20,2, 18,6, 18,5, 15,5, 15,0 та 13,2 (±0,1°2 ). За варіантом, якому віддається перевага, вона характеризується наявністю таких піків на рентгенодифрактограмі: 22,6, 21,7, 21,5, 21,1, 20,4, 20,2, 18,6, 18,5, 15,5, 15,0 та 13,2 (±0,1°2). Сіль тристрифторметансульфонової кислоти та 4{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}5,7-дигідропіроло[2,3-d]піримідин-6-ону може також характеризуватися спектром SSNMR, який містить щонайменше один із таких резонансів: 176,9, 155,4, 150,0, 148,0, 94,6, 57,7, 36,4, 32,0 та -1 27,4 млн . За варіантом, якому віддається перевага, вона характеризується спектром SSNMR, -1 який містить такі резонанси: 176,9, 155,4, 150,0, 148,0, 94,6, 57,7, 36,4, 32,0 та 27,4 млн . За іншим варіантом здійснення цього винаходу запропонована сполука 4-{4-[1-(2диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7дигідропіроло[2,3-d]піримідин-6-он або фармацевтично прийнятна сіль цієї сполуки – моногідрат 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}5,7-дигідропіроло[2,3-d]піримідин-6-ону. Моногідрат 4-{4-[1-(2-диметиламіноетил)-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-ону характеризується спектром SSNMR, який містить щонайменше один із таких резонансів: 164,9, -1 150,7, 138,3 та 61,6 млн . За варіантом, якому віддається перевага, він характеризується -1 спектром SSNMR, який містить такі резонанси: 164,9, 150,7, 138,3 та 61,6 млн . За альтернативним варіантом здійснення цього винаходу запропонована сполука, яка вибрана з-посеред перелічених нижче сполук: трис-гідрохлорид 5-етил-4-{4-[4-(4-фтор-3-(трифторметил)феніл)-1-((S)-піперидин-2ілметил)-1H-імідазол-2-іл]піперидин-1-іл}-5,7-дигідропіроло[2,3-d]піримідин-6-ону; 4-{4-[4-(3-дифторметил-4-фторфеніл)-1-(((R)-1-метилпіперидин-2-іл)метил)-1H-імідазол-2іл]піперидин-1-іл}-5-етил-5,7-дигідропіроло[2,3-d]піримідин-6-он; та (R)-6-{4-[4-(3-дифторметил-4-фторфеніл)-1-((1-метилпіперидин-2-іл)метил)-1H-імідазол-2іл]піперидин-1-іл}-7-етил-7H-пурин-8(9H)-он. 6 UA 100190 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуки за цим винаходом є інгібіторами AKT та p70-S6-кінази, і тому корисні при лікуванні хвороб та розладів обміну речовин, таких як ожиріння, діабет, метаболічний синдром, резистентність до інсуліну, гіперглікемія, гіпераміноацидемія та гіперліпідемія. Сполуки за цим винаходом також корисні при лікуванні раку, особливо для лікування поліморфної гліобластоми, аденокарцином ободової кишки, недрібноклітинного раку легень, дрібноклітинного раку легень, резистентного до цисплатину дрібноклітинного раку легень, раку яєчників, лейкозу, раку підшлункової залози, раку передміхурової залози, раку молочної залози, нирково-клітинного раку, множинної мієломи, саркоми Капоші (Sodhi et al., Cancer Cell, 10: 133-143 (2006)), лімфоми Ходжкіна (Dutton et al., J. Pathol., 205: 498-506 (2005)), лімфангіолейоміоматозу (Goncharova et al., J. Biol. Chem., 277:34, 30958-30967 (2002)), неходжкінської лімфоми, саркоми та нейроендокринних пухлин, зокрема, нейроендокринних пухлин підшлункової залози або тонкої кишки (Wong et al., 2009 Gastrointestinal Cancers Symposium, Abstract no. 174), у ссавців. Інгібітори AKT та p70-S6-кінази є також корисними інгібіторами ангіогенезу у ссавців. Серед ссавців, які підлягають лікуванню, перевага віддається людині. Сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можуть бути корисними у способі лікування раку, зокрема, ракових захворювань, описаних вище, у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки. Сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можна застосовувати для лікування раку, зокрема, ракових захворювань описаних вище. Крім того, сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можна застосовувати при виготовленні лікарського засобу для лікування раку, зокрема, ракових захворювань, описаних вище. Крім того, також запропонована фармацевтична композиція для лікування раку, зокрема, ракових захворювань, описаних вище, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієїсполуки. Сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можуть бути корисними у способі пригнічення ангіогенезу у ссавця, який включає введення в організм ссавця, який потребує такого лікування, ефективної кількості сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки. Сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можна застосовувати у пригніченні ангіогенезу. Крім того, сполуки за цим винаходом або фармацевтично прийнятні солі цих сполук можна застосовувати при виготовленні лікарського засобу для пригнічення ангіогенезу. Крім того, також запропонована фармацевтична композиція для пригнічення ангіогенезу, яка містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки. Сполуки за цим винаходом можна застосовувати у комбінації з іншими терапевтичними засобами, зокрема, такими засобами як інгібітори mTOR (мішень для рапаміцину в організмі ® ссавців), інгібітори EGFR (рецептор епідермального фактора росту), гемцитабін (Gemzar ), цисплатин, таcисулам (натрій-N-[(5-бромтіофен-2-іл)сульфоніл]-2,4-дихлорбензамід), ® ® ® ® пеметрексед (Alimta ), доцетаксел (Taxotere ), доксорубіцин (Doxil ) або іринотекан (Campto ; ® Camptosar ). До інгібіторів mTOR, яким віддається перевага, належать рапаміцин (також відомий як сіролімус) та його аналоги, такі як еверолімус (42-O-(2-гідроксі)етилрапаміцин; описаний у EP 1 413 581), темсиролімус (42-(3-гідрокси-2-(гідроксиметил)-2метилпропаноат)рапаміцин; Torisel; описаний у WO 95/28406) та дефоролімус (42(диметилфосфінат)рапаміцин; описаний у WO 03/64383). До інгібіторів EGFR, яким віддається перевага, належать ерлотиніб, цетуксимаб (Erbitux ; описаний у EP 0 359 282), панітумумаб (Vectibix; описаний у EP 0 359 282) та гефінітиб (Iressa; описаний у EP 0 566 226). За одним із варіантів здійснення цей винахід пропонує продукт, який містить сполуку за цим винаходом або фармацевтично прийнятну сіль цієї сполуки та терапевтичний засіб, вибраний із засобів, перелічених вище, як комбінований лікарський засіб для одночасного, окремого або послідовного застосування у терапії. Цей винахід також пропонує сполуку або фармацевтично прийнятну сіль цієї сполуки для одночасного, окремого та послідовного застосування з терапевтичним засобом, вибраним із засобів, перелічених вище, у лікуванні поліморфної гліобластоми, аденокарциноми ободової кишки, недрібноклітинного раку легень, дрібноклітинного раку легень, резистентного до цисплатину дрібноклітинного раку легень, раку яєчників, лейкозу, раку підшлункової залози, раку передміхурової залози, раку молочної залози, нирково-клітинного раку, множинної мієломи, саркоми Капоші, лімфоми Ходжкіна, лімфангіолейоміоматозу, неходжкінської лімфоми або саркоми. Цей винахід також пропонує спосіб лікування раку, вибраного з групи, яку складають поліморфна гліобластома, аденокарцинома ободової кишки, недрібноклітинний рак легень, дрібноклітинний рак легень, резистентний до цисплатину дрібноклітинний рак легень, рак яєчників, лейкоз, рак підшлункової 7 UA 100190 C2 5 10 15 20 25 30 35 40 45 залози, рак передміхурової залози, рак молочної залози, нирково-клітинний рак, множинна мієлома, саркома Капоші, лімфома Ходжкіна, лімфангіолейоміоматоз, неходжкінська лімфома та саркома, який включає введення в організм пацієнта, який потребує такого лікування, сполуки за цим винаходом або фармацевтично прийнятної солі цієї сполуки та терапевтичного засобу, вибраного із засобів, перелічених вище, в кількостях, які в комбінації є ефективними. За іншим варіантом здійснення цей винахід пропонує фармацевтичну композицію, яка містить сполуку за цим винаходом разом із фармацевтично прийнятним носієм та факультативно іншим терапевтичним засобом. Зокрема, терапевтичний засіб вибраний із засобів, перелічених вище. Перевага віддається пероральному застосуванню сполук за цим винаходом. Також віддається перевага внутрішньовенному введенню сполук за цим винаходом. Залежно від обставин, можуть застосовуватися інші шляхи введення, яким навіть може віддаватися перевага. Наприклад, для пацієнтів, які схильні забувати про лікарський засіб або не додержуються періодичності при пероральному застосуванні, дуже бажаним є черезшкірне введення. Сполуки за цим винаходом можна також за певних обставин вводити черезшкірним, внутрішньом'язовим, назальним або ректальним шляхом. Шлях введення можна варіювати будь-яким чином, з урахуванням фізичних властивостей лікарського засобу, зручності для пацієнта та особи, що здійснює нагляд, та інших релевантних обставин (дивись Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990)). Сполуки формули I можуть бути одержані фахівцем у галузі за відомими методиками та способами. Більш конкретно, сполуки формули I можуть бути одержані як показано на поданих нижче схемах та описано нижче у підготовчих синтезах та прикладах. Фахівцю в галузі буде зрозуміло, що для одержання сполук формули I окремі стадії на наведених нижче схемах можна варіювати. Реагенти та вихідні матеріали є легкодоступними для фахівця в галузі. Усі замісники, якщо не зазначено інше, відповідають наведеним вище визначенням. Заміщений імідазолпіперидин формули (1), заміщений кетон формули (2) та основу, таку як триетиламін (TEA), діізопропілетиламін (DIPEA) або 1,8-діазабіцикло[5,4,0]ундец-7-ен (DBU), у розчиннику, такому як пропанол, ізопропіловий спирт (IPA), NN-диметилформамід (DMF), метанол, N-метилпіролідин (NMP) або диметилсульфоксид (DMSO), нагрівають при підвищеній температурі з утворенням сполуки формули I. L – відщеплювана група, наприклад, хлор. Альтернативно цю реакцію можна здійснити так: спочатку об'єднують трет-бутилат калію, хлорид N, N'-біс(2,6-діізопропілфеніл)імідазол-2-іліденацетилацетонатпаладію [IPrPd(acac)Cl (J. Org. Chem. 2006, 71(10), 3816-3821)], та продувають азотом. Після цього додають безводний 1,2-диметоксіетан (DME) та сполуку (1) та сполуку (2), та нагрівають до 80C. 4 5 Сполуки формули I, де один із R або R – бензил, а інший – водень, можна одержати шляхом введення сполуки (1) в реакцію зі сполукою формули (2), яку заміщують бензиліденовою групою, а потім відновлюють бензиліденову групу до бензилової групи. Група P'c може означати бажаний кінцевий амінний фрагмент із замісниками, які відповідають наведеним вище визначенням (Pc), попередник Pc або захищений фрагмент Pc. Усі інші замісники відповідають наведеним вище визначенням. Якщо групою захисту у P' c є карбоксибензильна група, то її відщеплення з одержанням бажаного аміну можна здійснювати перед реакцією зі сполукою (2) або після такої реакції. Захисну карбоксибензильну групу можна видаляти реакцією з концентрованою HCl. Альтернативно її можна видаляти у присутності 8 UA 100190 C2 5 алюмогідриду літію у тетрагідрофурані (THF) для одержання метилзаміщеного аміну як замісника, який відповідає визначенню, що відноситься до Pc. ПРИМІТКА: в разі застосування гідрохлориду 4-(4-{4-(4-фтор-3-трифторметилфеніл)-1-[2(ізопропілметиламіно)етил]-1H-імідазол-2-іл}піперидин-1-іл)-7H-піроло[2,3-d]піримідин-5,6-діону, в умовах реакції може спостерігатися окиснення метилену в положенні 5 до кетону. Заміщені імідазолпіперидини формули (1) одержують як показано на Схемі 2, де PG – група захисту азоту, а всі інші замісники відповідають наведеним вище визначенням. Схема 2 Y X Y Y X X H N NH2 O N HN PG N 3 R Y O O H N X PG (B) (A) (C) P'c N (1) N 3 R (D) N PG Y Y Y Y X X X X (I) Br O (E) HN N P'c N N B(OH)2 (G) (F) H N Br PG N N (H) P'c 10 15 20 25 30 Сполуку формули (A) можна одержати з відповідного 2-бромфенілетанону. Для синтезу 6 2 сполук Формули I, в яких R та R утворюють піперидиновий цикл, захищений піперидиновий цикл присутній у сполуці (A) до реакції утворення сполуки (B). Амінозаміщену сполуку синтезують шляхом проведення реакції 3-амінопіперидин-1-карбонової кислоти зі сполукою формули (E) у присутності основи, такої як TEA, у розчиннику, такому як DMF. Пізніше в процесі синтезу захисну групу при піперидин-3-ілі можна видалити та замінити метильним замісником. 3 В разі, якщо R – H, амін формули (A) вводять в реакцію із захищеною при атомі азоту піперидинкарбоновою кислотою у присутності агента сполучення, такого як ізобутилхлорформіат, гідрохлорид 1-етил-3-[3-диметиламінопропіл]карбодііміду (EDC), циклічний ангідрид 1-пропанфосфонової кислоти (PPA) або тіонілхлорид, та основи, такої як Nметилморфолін (NMM), DIPEA або TEA, у розчиннику, такому як THF, дихлорметан (DCM) або DMF, при пониженій температурі, і одержують амід формули (B). Імідазолпіперидин формули (C) утворюється, коли сполуку формули (B), ацетат або хлорид амонію та основу, таку як TEA, вміщують у посудину, герметично закривають її, та піддають нагріванню в мікрохвильовій печі під тиском. Проміжну сполуку (C), в якій феніл незаміщений, можна одержати конденсацією 2-оксо-2-фенілацетальдегіду з трет-бутиловим складним ефіром 4формілпіперидин-1-карбонової кислоти в середовищі рідкого аміаку протягом ночі. 3 Сполуку формули (C) потім алкілують, одержуючи сполуку формули (D), де R – водень. Більш конкретно, від сполуки формули (C) відщеплюють протон дією основи, такої як KOH або гідрид натрію, в розчиннику, такому як DMSO, з подальшим доданням групи P' c з 9 UA 100190 C2 5 10 15 20 25 30 35 40 45 відщеплюваною групою, такою як галоген, зокрема, хлор. Більшість алкілувальних агентів є наявними на ринку або синтезуються відомими в галузі методами. Наприклад, алкілувальний агент можна одержати з відповідного спирту у присутності тіонілхлориду у водному розчині хлористоводневої кислоти або трибромистого фосфору в бензолі. Аміногрупа алкілувального агента може бути також заміщена бензильною групою. Ця бензильна група може бути в подальшому замінена карбоксибензильною групою захисту шляхом проведення реакції з бензилхлорформіатом, яку можна проводити в одну або дві стадії. Альтернативно алкілувальний агент може містити нітрильну групу, яка відновлюється, утворюючи амін. Потім одержаний амін можна захистити карбоксибензильною групою. Сполуку формули (C) можна ввести в реакцію з 2-(2-брометокси)тетрагідро-2H-піраном або з (2-брометокси)-трет-бутилдиметилсиланом, і одержати сполуку формули (D), в якій P'c є відповідно 2-(тетрагідропіран-2-ілоксі)етильною групою або 2-(третбутилдиметилсиланілоксі)етильною групою. Ці групи перетворюють у 2-гідроксіетильний замісник, а потім у 2-метансульфонілоксіетильний замісник. Метансульфонілоксигрупу (мезил, відщеплювану групу) можна потім замінити бажаною аміногрупою. Якщо бажаною групою Pc є піролідин-2-ілметил, то до сполуки формули (С) приєднують захищений карбоксибензилом піролідин-2-ілметил шляхом проведення реакції з бензиловим складним ефіром 2-(толуол-4-сульфонілоксиметил)піролідин-1-карбонової кислоти. Альтернативно 4-бромімідазол формули (H) піддають реакції сполучення із фенілборонатом (I) у присутності каталізатора на основі паладію (0) з одержанням сполуки 3 формули (D), де R – водень. Сполуку формули (H) можна одержати з трет-бутилового складного ефіру 4-(1H-імідазол-2-іл)піперидин-1-карбонової кислоти. Спочатку приєднують групу P'c, а потім одержану сполуку вводять в реакцію з N-бромсукцинімідом, одержуючи 4,5двозаміщену сполуку; нарешті, її перетворюють у 4-бромзаміщену сполуку (H) шляхом проведення реакції з н-бутиллітієм (nBuLi) при знижених температурах. Групу P' c можна перетворити в бажану групу Pc методами, описаними вище. 3 сполуку формули (D), де R – гідроксил, синтезують шляхом, показаним у середній послідовності Схеми 2. Спочатку одержують імідазольну сполуку формули (F) проведенням реакції ацилброміду формули (E) із формамідом при підвищеній температурі. Імідазол формули (F) потім алкілують в умовах алкілування, аналогічних описаним вище, і одержують сполуку формули (G). Імідазол (G) обробляють металувальним агентом, таким як nBuLi, у розчиннику, такому як THF, при знижених температурах та в інертній атмосфері, а потім 4піперидоном із захищеним азотом у циклі, і одержують сполуку формули (D). Потім групу захисту піперидину в формулі (D) видаляють, і одержують сполуку формули (1). Амін формули (A) та ацилбромід формули (E) або є наявними на ринку, або синтезуються способами, відомими у галузі. 10 Проміжні сполуки формули (2), де W – NR , або є наявними на ринку, або синтезуються 10 способами, відомими фахівцю. Наприклад, 5-аміно-4,6-дихлорпіримідин (J) алкілують R галогенідом у присутності сильної основи, і одержують N-алкілований піримідин (K). Один атом хлору в сполуці (K) замінюють аміаком шляхом нагрівання у герметично закритому реакторі, і одержують піримідиндіамін (L). Замикання циклу за допомогою фосгену, трифосгену або 10 карбонілдіімідазолу дає проміжну сполуку (2), де W – NR . Схема 4 4 5 9 Проміжні сполуки формули (2), де W – CR R або C=CH-R , синтезують способами, відомими фахівцю. Наприклад, 10 UA 100190 C2 5 10 15 20 25 30 35 40 45 Метил-2-(4,6-дихлорпіримідин-5-іл)ацетат можна одержати з метил-2-дигідроксипіримідин-5іл)ацетату. Дигідроксисполуку можна, у свою чергу, одержати шляхом додання триетилового складного ефіру 1,1,2-етантрикарбонової кислоти до метанольного розчину метилату натрію з подальшим доданням гідрохлориду формамідину. Метил-2-(4,6-дихлорпіримідин-5-іл)ацетат вводять в реакцію з 4-метоксибензиламіном або з 2,4-диметоксибензиламіном у присутності основи, наприклад, DIPEA, та розчинника, наприклад, ацетонітрилу (ACN), і одержують захищений бензилом ацетат (M). Дія на сполуку (M) водним розчином кислоти та підвищеною температурою дає захищений бензилом пуринон (N). Від сполуки (N) відщеплюють групу захисту сильною кислотою, наприклад, трифтороцтовою кислотою (TFA) або 40 % водним розчином HBr при підвищеній температурі, і одержують відому проміжну сполуку 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он. 4-хлор-5,7-дигідропіроло[2,3d]піримідин-6-он можна одержати з 5,5-дибром-4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-ону, який, у свою чергу, можна одержати з 4-хлор-7H-піроло[2,3-d]піримідину реакцією з пербромідом піридинійброміду. 4 5 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он або алкілують R /R -галогенідом та основою, 9 4 або конденсують із R -карбоксальдегідом, одержуючи сполуку (2). Сполуку формули (2), де R 5 та R спільно утворюють циклопентановий цикл, одержують із 4-хлор-5,7-дигідропіроло[2,3d]піримідин-6-ону реакцією з 1,4-дийодбутаном. За альтернативною методикою, замість сполуки (2) в реакції сполучення за Схемою 1 використовують захищену бензилом сполуку (N) з подальшим відщепленням захисної бензильної групи. Для фахівця зрозуміло, що не всі замісники у сполуках Формули I витримують певні умови реакцій, які застосовуються для синтезу цих сполук. Ці групи можна вводити на прийнятних стадіях синтезу або захистити, а потім відщепити групи захисту при необхідності або за бажанням. Для фахівця зрозуміло також, що групи захисту можна видаляти на будь-якому прийнятному етапі синтезу сполук за цим винаходом. Способи введення та видалення груп захисту азоту добре відомі в галузі. Дивись, наприклад, Гріні та Вутс, "Групи захисту в rd органічному синтезі" (Greene and Wuts, "Protective Groups in Organic Synthesis", 3 Ed., John Wiley and Sons, New York, Chapter 7 (1999)). Далі, для фахівця зрозуміло, що в багатьох випадках порядок виконання етапів, необхідних для синтезу сполук Формули I, залежить від конкретної сполуки, яка синтезується, а також від вихідних сполук та від відносної нестійкості заміщених проміжних сполук та продуктів. Підготовчий синтез 1 4-метилбензолсульфонат 2-аміно-1-(4-фтор-3-(трифторметил)феніл)етанону Додають азид натрію (1,76 г; 1,05 еквівалента (екв.)) однією порцією до розчину 2-бром-1-(4фтор-3-(трифторметил)феніл)етанону (9,19 г; 1,00 екв.) у THF (50 мл). Перемішують суміш при кімнатній температурі (к.т.) протягом ночі. Відфільтровують тверді речовини, та промивають THF. Додають неочищений азид до розчину трифенілфосфіну (1,06 екв.; 8,64 г) та птолуолсульфонової кислоти (2,2 екв.; 12,0 г) у THF (50 мл) при 20C. Перемішують суміш протягом ночі. Відфільтровують тверду речовину, після чого промивають THF, одержуючи 5,5 г вказаної в заголовку сполуки. MS(ES): m/z=217,2 [M+H]. Наведені нижче проміжні сполуки одержують за методикою, такою самою як методика, описана у підготовчому синтезі 1: 11 UA 100190 C2 Підготовчий синтез Назва сполуки Фізико-хімічні дані H ЯМР (DMSO-d6, 300 МГц): : 8,25 (m, 4H), 4-метилбензолсульфонат 2-аміно- 8,05 (ddd, J=8,7 Гц, 4,7 Гц, 2,3 Гц, 1H), 7,66 (t, 1-(3-хлор-4-фторфеніл)етанону J=8,9 Гц, 1H), 7,48-7,46 (m, 2H), 7,11 (d, J=8,0 Гц, 2H), 4,62 (s, 2H), 2,28 (s, 3H) 1 H ЯМР (DMSO-d6, 300 МГц): : 8,25 (s, 3H), 8,11 (ddd, J=11,0 Гц, 7,9 Гц, 2,3 Гц, 1H), 7,954-метилбензолсульфонат 2-аміно7,90 (m, 1H), 7,70 (dt, J=10,4 Гц, 8,4 Гц, 1H), 1-(3,4-дифторфеніл)етанону 7,47 (d, J=8,0 Гц, 2H), 7,11 (d, J=7,7 Гц, 2H), 4,60 (s, 2H), 2,28 (s, 3H) 1 2 3 5 10 15 20 25 30 Підготовчий синтез 4 Гідрохлорид 2-аміно-1-(4-фтор-3-(трифторметил)феніл)етанону До розчину 2-бром-1-(4-фтор-3-(трифторметил)феніл)етанону (60,00 г, 1,00 екв.; 210,50 ммоль) у етилацетаті (EA) (450 мл; 4,60 моль) додають 1,3,5,7-тетраазатрицикло[3,3,1,13,7]декан (гексаметилентетрамін, 1,10 екв.; 231,55 ммоль; 32,46 г), та перемішують при кімнатній температурі протягом ночі. Видаляють розчинник у вакуумі, та розтирають одержану тверду речовину з метил-трет-бутиловим ефіром (MTBE), фільтрують, та сушать у вакуумі. Додають етанол (450 мл; 7,73 моль), після чого додають хлористий водень (36,5 % (мас.) у воді) (150 мл; 8,30 екв.; 1,75 моль), та перемішують суміш протягом ночі. Видаляють розчинник у вакуумі, та сушать одержану тверду речовину у вакуумі при 50C протягом 1 тижня, одержуючи вказану в заголовку сполуку (54,23 г; вихід 100 %) у вигляді білої твердої речовини з певною 1 кількістю солі амонію. H ЯМР (300 МГц, DMSO): 8,69-8,59 (m, 4H), 8,07-8,01 (m, 1H), 4,95 (d, J=5,2 Гц, 2H). Використовують одержану тверду речовину без додаткової обробки. Підготовчий синтез 5 трет-бутиловий складний ефір 4-(2-(4-фтор-3-(трифторметил)феніл)-2оксоетилкарбамоїл)піперидин-1-карбонової кислоти До розчину моно-трет-бутилового складного ефіру піперидин-1,4-дикарбонової кислоти (1,20 екв.; 252,61 ммоль; 57,92 г) у THF (400 мл) додають NMM (3 екв.; 631,52 ммоль; 69,66 мл). Охолоджують до -10C на бані із сухого льоду з ацетоном. Додають краплями ізобутилхлорформіат (1,1 екв.; 231,56 ммоль; 30,26 мл), підтримуючи температуру нижче -5C. Через 30 хв при температурі від -5C до 10C додають гідрохлорид 2-аміно-1-(4-фтор-3(трифторметил)феніл)етанону (54,23 г; 1,00 екв.; 210,51 ммоль), суспендованого у THF (300 мл), та перемішують суміш у охолоджувальній бані при -5C протягом 20 хв, а потім 1 год. при кімнатній температурі. Розподіляють між водою та етилацетатом (EA); промивають органічний шар водою, після чого – насиченим водним розчином NaCl (розсолом), сушать безводним MgSO4, фільтрують, та концентрують у вакуумі. Суспендують неочищену речовину у MTBE, та перемішують протягом 2 год. Відфільтровують тверду речовину, та сушать у вакуумі, 1 одержуючи вказану в заголовку сполуку (64,44 г; 70,79 %). H ЯМР (300 МГц, DMSO): 8,37-8,26 (m, 3H), 7,74-7,68 (m, 1H), 4,61 (d, J=5,5 Гц, 2H), 3,91 (d, J=12,9 Гц, 2H), 2,75-2,64 (m, 2H), 2,462,37 (m, 1H), 1,69-1,60 (m, 2H), 1,39 (s, 12H). Наведені нижче проміжні сполуки одержують за методикою, такою самою як методика, описана у підготовчому синтезі 5: Підготовчий синтез 6 7 Назва сполуки трет-бутиловий складний ефір 4-(2-(3-хлор-4-фторфеніл)2-оксоетилкарбамоїл)-піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-(2-(3,4-дифторфеніл)-2оксоетилкарбамоїл)-піперидин-1-карбонової кислоти MS (ES): m/z (M+H – tBu) 343,1 327,1 35 Підготовчий синтез 8 Трет-бутиловий складний іл]піперидин-1-карбонової кислоти ефір 4-[4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2 12 UA 100190 C2 F F F F N N N O O 5 10 До розчину трет-бутилового складного ефіру 4-(2-(4-фтор-3-(трифторметил)феніл)-2оксоетилкарбамоїл)піперидин-1-карбонової кислоти (29,4 г; 1,00 екв.; 67,99 ммоль) у 1-бутанолі (150 мл; 1,64 моль) додають ацетат амонію (15 екв.; 1,02 моль; 78,61 г), після чого – TEA (1 екв.; 67,99 ммоль; 9,48 мл). Перемішують суміш при 160C у запаяній трубці. Через 3 год. охолоджують до кімнатної температури, розподіляють між EA та водою, та промивають органічний шар водою та розсолом. Концентрують у вакуумі. Розтирають одержаний залишок у MTBE, фільтрують, та сушать у вакуумі, одержуючи вказану в заголовку сполуку (18,23 г; 1 44,10 ммоль; 64,86 %) у вигляді білої твердої речовини. H ЯМР (300 МГц, DMSO): 12,01 (s, 1H), 8,08-8,04 (m, 2H), 7,70 (d, J=1,4 Гц, 1H), 7,49-7,43 (m, 1H), 3,99 (d, J=12,6 Гц, 2H), 2,92-2,85 (m, 3H), 1,91-1,87 (m, 2H), 1,64-1,51 (m, 2H), 1,41 (s, 9H). Наведені нижче проміжні сполуки одержують за методикою, такою самою як методика, описана у підготовчому синтезі 8: Підготовчий синтез 9 10 Назва сполуки трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)1H-імідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти MS(ES): m/z [M+H] 380,1 364,2 15 20 25 30 35 Підготовчий синтез 11 2-оксо-2-фенілацетальдегід Додають SeO2 (4,6 г; 0,042 моль; 1,0 екв.), оцтову кислоту (1,2 мл; 0,021 моль; 0,5 екв.), воду (1,5 мл; 0,083 моль; 2,0 екв.) у 1,4-діоксан (15 мл), та перемішують при 80C доти, доки розчин не стане прозорим. Охолоджують реакційну суміш до кімнатної температури, додають ацетофенон (5,0 г; 0,042 моль; 1,0 екв.), та перемішують при 80C протягом 18 год. ® Охолоджують реакційну суміш до кімнатної температури, фільтрують через целіт (Celite ), промивають одержаний залишок EA, та сушать безводним сульфатом натрію. Випарюють органічний шар, очищають, елююючи через 50 г діоксиду кремнію, із застосуванням розчину EA у гексані для одержання вказаної в заголовку сполуки (4,0 г, 72,7 %). MS (ES+): m/z=135 (M+H). Підготовчий синтез 12 Трет-бутиловий складний ефір 4-(4-феніл-1H-імідазол-2-іл)-піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-формілпіперидин-1-карбонової кислоти (3,8 г; 0,017 моль; 0,6 екв.) та 2-оксо-2-фенілацетальдегід (4,0 г; 0,29 моль; 1,0 екв.) у метанолі (40 мл). Охолоджують реакційну суміш від 0C до 10C. Повільно додають розчин гідроксиду амонію (25 % розчин, 40 мл). Перемішують реакційну суміш при кімнатній температурі протягом 16 год. Концентрують реакційну суміш у вакуумі, гасять водою, та екстрагують діетиловим ефіром. Концентрують органічний шар, відфільтровують тверді речовини, промивають гексаном, та сушать у вакуумі, одержуючи вказану в заголовку сполуку (3,0 г, 51,7 %). MS (ES+): m/z=328 (M+H). Підготовчий синтез 13 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти 13 UA 100190 C2 5 Додають однією порцією гідрохлорид (2-хлоретил)диметиламіну (1,10 екв.; 579 мкмоль; 83 мг) до суміші трет-бутилового складного ефіру 4-[4-(3-хлор-4-фторфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти (1 екв.; 526 мкмоль; 200 мг) та порошкоподібного KOH (2,5 екв.; 1,316 ммоль; 73,8 мг) у DMSO (3 мл). Нагрівають до 50C, та перемішують протягом 2 год. Розводять DCM, промивають водою, розсолом, сушать MgSO 4, фільтрують, випарюють, та очищають на 40 г силікагелю сумішшю 10 % метанолу з CAN, одержуючи вказану в заголовку сполуку (194 мг; 0,43 ммоль; 82 %). MS (ES+): m/z=451 (M+H). Наведені нижче проміжні сполуки одержують за методикою, такою самою як методика, описана у підготовчому синтезі 13: 10 Підготовчий синтез 14 15 16 17 18 15 20 25 Назва сполуки трет-бутиловий складний ефір 4-[1-(2-диметиламіноетил)-4-(4фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2піролідин-1-ілетил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1-(2-піролідин-1-ілетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[1-(2-диметиламіно-2метилпропіл)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-(1-(2-(диметиламіно)етил)-4феніл-1H-імідазол-2-іл)піперидин-1-карбонової кислоти MS (ES): m/z (M+H) 485 476 511 513 399 Підготовчий синтез 19 Трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2-диметиламіноетил)-1H-імідазол2-іл]піперидин-1-карбонової кислоти Додають трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин1-карбонової кислоти (500 мг; 1,38 ммоль) до розчину NaH (110 мг; 2,76 ммоль) у DMSO (50 мл) при 0C, та перемішують протягом 1 год. при кімнатній температурі. Додають гідрохлорид (N, Nдиметил)етилхлориду (238 мг; 1,65 ммоль) до одержання суміші, та залишають при перемішуванні при кімнатній температурі протягом 18 год. Хід реакції контролюють за допомогою хроматографії у тонкому шарі (ХТШ). Гасять реакційну суміш охолодженою льодом водою, та екстрагують EA. Відділяють органічний шар, промивають двічі розсолом (250 мл), сушать безводним Na2SO4, та випарюють під зниженим тиском. Очищають одержаний залишок хроматографією на колонці із силікагелем (60/120 меш), застосовуючи як елюент суміш DCM:метанол (98:2), та одержують 0,5 г (86 %) вказаної в заголовку сполуки. LCMS=484(M+H). Наведену нижче проміжну сполуку одержують за методикою, такою самою як методика, описана у підготовчому синтезі 19: Підготовчий синтез 35 MS(ES): m/z (M+H) 20 30 Назва сполуки трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2(піролідин-1-іл)етил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти 462 Підготовчий синтез 21 Трет-бутиловий складний ефір 4-{4-(3-хлор-4-фторфеніл)-1-[2-(тетрагідропіран-2ілоксі)етил]-1H-імідазол-2-іл}-піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти (5,29 г; 13,93 ммоль) та порошкоподібний KOH (111,46 ммоль; 6,95 г) у DMSO (69 мл), та нагрівають до 40C протягом 10 хв. Додають краплями 2-(2-брометокси)тетрагідро-2H-піран (34,83 ммоль; 5,48 мл) протягом 45 хв, після чого перемішують протягом 30 хв. Охолоджують, розводять EA, та промивають насиченим розчином бікарбонату натрію (3300 мл), розсолом, сушать MgSO4, фільтрують, та випарюють. Очищають шляхом пропускання через 400 г силікагелю, застосовуючи градієнт 0-10 % EA/DCM, та одержують вказану в заголовку сполуку (6,848 г, 97 %). MS (ES): m/z=508 (M+H). 14 UA 100190 C2 Наведену нижче проміжну сполуку одержують практично за методикою, описаною у підготовчому синтезі 21: Підготовчий синтез 10 15 MS (ES): m/z (M+H) 22 5 Назва сполуки трет-бутиловий складний ефір 4-{4-(4-фтор-3трифторметилфеніл)-1-[2-(тетрагідропіран-2-ілоксі)етил]-1Hімідазол-2-іл}-піперидин-1-карбонової кислоти 542 Підготовчий синтез 23 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-гідроксіетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-{4-(3-хлор-4-фторфеніл)-1-[2-(тетрагідропіран2-ілоксі)етил]-1H-імідазол-2-іл}піперидин-1-карбонової кислоти (6,85 г; 13,48 ммоль) у THF (200 мл), додають 1 M водний розчин хлористого водню (20 мл), та перемішують 18 год. при кімнатній температурі. Розводять EA, промивають насиченим розчином бікарбонату натрію, розсолом, сушать безводним MgSO4, фільтрують, та випарюють. Очищають одержаний залишок шляхом пропускання через 330 г силікагелю з елююванням сумішшю 2:1 DCM/EA, та одержують вказану в заголовку сполуку (5,07 г; 89 %) у вигляді білої кристалічної твердої речовини. MS (ES): m/z=424 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 23: Підготовчий синтез 24 25 20 25 30 27 28 40 трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1-(2-гідроксіетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2гідроксіетил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти MS (ES): m/z (M+H) 458 408 Підготовчий синтез 26 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-метансульфонілоксіетил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти Суспендують трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-гідроксіетил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (5,07 г; 11,96 ммоль) та TEA (35,88 ммоль; 5,0 мл) у DCM (50 мл), та охолоджують на льодяній бані. Додають краплями метансульфонілхлорид (14,35 ммоль; 1,1 мл) протягом 9 хв, та перемішують протягом ще 30 хв. Гасять насиченим розчином бікарбонату натрію, сушать MgSO 4, фільтрують, та випарюють, одержуючи вказану в заголовку сполуку (6,246 г; 104 %) у вигляді. MS (ES): m/z=502 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 26: Підготовчий синтез 35 Назва сполуки Назва сполуки трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1-(2-метансульфонілоксіетил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2метансульфонілоксіетил)-1H-імідазол-2-іл]піперидин-1карбонової кислоти MS (ES): m/z (M+H) 536 486 Підготовчий синтез 29 Трет-бутиловий складний ефір 4-{4-(4-фтор-3-трифторметилфеніл)-1-[2-((R)-2гідроксиметилпіролідин-1-іл)етил]-1H-імідазол-2-іл}піперидин-1-карбонової кислоти Завантажують трет-бутиловий складний ефір 4-[4-(4-фтор-3-трифторметилфеніл)-1-(2метансульфонілоксіетил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (500 мг; 1 екв.; 933 мкмоль); D-пролін (3,00 екв.; 2,80 ммоль; 283 мг); DMF (1 мл), та нагрівають при 50C протягом 18 год. у герметично закритій посудині. Розводять EA, промивають насиченим розчином бікарбонату натрію, розсолом, сушать MgSO4, фільтрують, та очищають через 40 г 15 UA 100190 C2 силікагелю, застосовуючи градієнт 1-10 % MeOH/DCM, та одержують вказану в заголовку сполуку (506,9 мг; 0,94 ммоль; 100 %). MS (ES+): m/z=541 (M+H). Наведені нижче проміжні сполуки одержують практично практично за методикою, описаною у підготовчому синтезі 29: 5 Підготовчий синтез 30 31 32 33 34 10 15 20 25 30 35 Назва сполуки трет-бутиловий складний ефір 4-{4-(4-фтор-3трифторметилфеніл)-1-[2-(ізопропіл-метиламіно)етил]-1Hімідазол-2-іл}піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-{4-(3-хлор-4-фторфеніл)-1[2-(ізопропілметиламіно)етил]-1H-імідазол-2-іл}-піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[1-(2-трет-бутиламіноетил)4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин1-карбонової кислоти трет-бутиловий складний ефір 4-[1-(2-трет-бутиламіноетил)4-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-{4-(3-хлор-4-фторфеніл)-1[2-(етилізопропіламіно)етил]-1H-імідазол-2-іл}піперидин-1карбонової кислоти MS (ES): m/z (M+H) 513 479 513 479 493 Підготовчий синтез 35 Трет-бутиловий складний ефір 4-[1-[2-(трет-бутилдиметилсиланілоксі)етил]-4-(3,4дифторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин1-карбонової кислоти (10,0 г; 0,028 моль; 1,0 екв.), (2-брометокси)-трет-бутилдиметилсилан (13,16 г; 0,055 моль; 2,0 екв.), порошкоподібний KOH (7,72 г; 0,14 моль; 5,0 екв.) у THF (100 мл), та перемішують при 40C протягом 16 год. Гасять реакцію водою, та екстрагують EA. Випарюють, одержуючи вказану в заголовку сполуку (14,3 г, неочищена). MS (ES+): m/z=522 (M+H). Підготовчий синтез 36 Трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2-гідроксіетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-[1-[2-(трет-бутилдиметилсиланілоксі)етил]-4-(3,4дифторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (18,3 г; 0,035 моль; 1,0 екв.), фторид тетрабутиламонію (20,3 г; 0,07 моль; 2,0 екв.) у THF (100 мл), та перемішують при кімнатній температурі протягом 3 год. Концентрують, гасять реакцію водою, та екстрагують EA. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (3,5 г; 24,49 %). MS (ES+): m/z=408(M+H). Підготовчий синтез 37 Трет-бутиловий складний ефір 4-(4-(3,4-дифторфеніл)-1-{2-[(2-гідроксіетил)-метиламіно]етил}-1H-імідазол-2-іл)-піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-[4-(3,4-дифторфеніл)-1-(2метансульфонілоксіетил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (3,0 г; 0,0061 моль;1,0 екв.), 2-метиламіноетанол (1,48g; 0,031 моль; 5,0 екв.) у DMF (30 мл), та перемішують при 40-50C протягом 16 год. Гасять водою, та екстрагують діетиловим ефіром. Випарюють органічний шар, очищають через 50 г силікагелю, застосовуючи градієнт 0-10 % MeOH/DCM. Збирають фракції, одержуючи вказану в заголовку сполуку (1,5 г; 52,2 %). MS (ES+): m/z=465 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 37: 16 UA 100190 C2 Підготовчий синтез Назва сполуки трет-бутиловий складний ефір 4-(4-(3,4-дифторфеніл)-1-(2(3-гідроксипіролідин-1-іл)етил)-1H-імідазол-2-іл)піперидин1-карбонової кислоти трет-бутиловий складний ефір 4-(1-(2-(3-(третбутилдиметилсиланілокси)азетидин-1-іл)етил)-4-(3,4дифторфеніл)-1H-імідазол-2-іл)піперидин-1-карбонової кислоти 38 39 5 10 477 577 Підготовчий синтез 40 Гідрохлорид бензил-(2-хлоретил)метиламіну Змішують хлористий водень (50 мл; 4 M у діоксані), N-бензил-N-метилетаноламін (61,12 ммоль; 10 г), тіонілхлорид (73,30 ммоль; 5,34 мл), та нагрівають до 90C. Перемішують протягом 2 год., випарюють, та подрібнюють утворену тверду речовину у діетиловому ефірі, обробляють ультразвуком 15 хв, фільтрують, промивають діетиловим ефіром, сушать у вакуумі, та одержують вказану в заголовку сполуку (10,75 г; 80 %). MS (ES): m/z=184 (M+H). Наведену нижче проміжну сполуку одержують практично за методикою, описаною для гідрохлориду бензил-(2-хлоретил)метиламіну з 1-фенілметил-(2R)-піролідинметанол Підготовчий синтез 41 15 MS (ES): m/z (M+H) Назва сполуки гідрохлорид (R)-1-бензил-2-хлорметилпіролідину MS (ES): m/z (M+H) 210 Підготовчий синтез 41a Гідрохлорид (R)-1-бензил-2-(бромметил)піперидину .HCl N Br 20 25 Завантажують (R)-(1-бензилпіперидин-2-іл)метанол (30,0 г, 0,146 моль, ~1,0 екв, неочищений) у 350 мл бензолу, та додають розчин триброміду фосфору (20,6 мл, 0,219 моль, 1,5 екв.) у бензолі при 0C у атмосфері азоту. Нагрівають реакційну суміш при 70C протягом 16 год. Після завершення нагрівання гасять реакцію насиченим розчином карбонату натрію (100 мл), та екстрагують сполуку у EA (3100 мл). Промивають органічний шар розсолом, та сушать безводним сульфатом натрію. Концентрують під зниженим тиском, та розчиняють одержаний твердий залишок у діетиловому ефірі. Фільтрують розчинену частину, повільно додають HCl (1,2 екв, 2-н. у діетиловому ефірі), та перемішують протягом 30 хв при кімнатній температурі. Відфільтровують осаджену сіль, та промивають EA, після чого промивають гексаном. Сушать у високому вакуумі, одержуючи 13,2 г (R)-1-бензил-2-(бромметил)піперидину у вигляді гідрохлориду. MS(ES): m/z=268, 270 (M+H). Наведену нижче проміжну сполуку одержують практично за методикою, описаною у підготовчому синтезі 41a: 30 Підготовчий синтез 41b 35 Назва сполуки гідрохлорид (S)-1-бензил-2-(бромметил)піперидину MS (ES): m/z (M+H) 268, 270 Підготовчий синтез 42 Трет-бутиловий складний ефір 4-[1-[2-(бензилметиламіно)етил]-4-(3-хлор-4-фторфеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти Додають порошкоподібний KOH (283 мг; 5,05 ммоль) та трет-бутиловий складний ефір 4-[4(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (2,02 ммоль; 768 мг) до DMSO (6 мл). Потім додають однією порцією гідрохлорид бензил-(2-хлоретил)метиламіну (2,22 ммоль; 0,49 мл), та нагрівають до 40C протягом 18 год. Охолоджують, розводять 17 UA 100190 C2 5 DCM/водою, додають розсіл, та розділяють шари. Промивають органічну фазу водою, розсолом, сушать MgSO4, фільтрують, та випарюють. Очищають шляхом пропускання через 120 г силікагелю, застосовуючи 1 % MeOH/DCM, та одержують вказану в заголовку сполуку (840,5 мг; 79 %). MS (ES): m/z=527 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 42: Підготовчий синтез Назва сполуки трет-бутиловий складний ефір 4-[1-[2-(бензилметиламіно)етил]-4-(4-фтор-3-трифторметилфеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[1-[2(бензилметиламіно)етил]-4-(3,4-дифторфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[1-((S)-1-бензилпіролідин-2ілметил)-4-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин1-карбонової кислоти трет-бутиловий складний ефір 4-[1-(R)-1-бензилпіролідин-2ілметил)-4-(3-хлор-4-фторфеніл)-1H-імідазол-2-іл]піперидин1-карбонової кислоти 43 44 45 46 10 MS (ES): m/z (M+H) 561 511 553 553 Підготовчий синтез 46a Трет-бутиловий складний ефір (R)-4-(1-((1-бензилпіперидин-2-іл)метил)-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл)піперидин-1-карбонової кислоти F F F F N N N N O 15 20 25 O До розчину трет-бутилового складного ефіру 4-[4-(4-фтор-3-трифторметилфеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (4,5 г, 0,011 моль, 1,0 екв.) у DMSO (100 мл) додають порошкоподібний KOH (3,0 г, 0,055 моль, 5,0 екв.) при кімнатній температурі у атмосфері азоту, та перемішують протягом 30 хв. До одержаного розчину додають гідрохлорид (R)-1-бензил-2-(бромметил)піперидину (5,0 г, 0,0165 моль, 1,5 екв.), та перемішують реакційну суміш при кімнатній температурі протягом 16 год. Після завершення реакції розводять реакційну суміш водою (100 мл), та екстрагують сполуку у EA (3100 мл). Промивають органічний шар розсолом (250 мл), та сушать безводним сульфатом натрію. Концентрують органічний шар під зниженим тиском, та очищають шляхом пропускання через діоксид кремнію (100-200 меш), застосовуючи суміш 2 % ацетон – DCM, та одержують 3,0 г (46 %) вказаної в заголовку сполуки. (ES+): m/z=601 (M+H). Наведену нижче проміжну сполуку одержують практично за методикою, описаною у підготовчому синтезі 46a: Підготовчий синтез Назва сполуки MS (ES): m/z (M+H) 46b трет-бутиловий складний ефір (S) 4-(1-((1-бензилпіперидин-2іл)метил)-4-(4-фтор-3-трифторметилфеніл)-1H-імідазол-2іл)піперидин-1-карбонової кислоти 601 18 UA 100190 C2 5 10 15 Підготовчий синтез 47 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-метиламіноетил)-1H-імідазол2-іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[1-[2-(бензил-метиламіно)етил]-4-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (1,47 ммоль; 775 мг); N, N,N",N’тетраметил-1,8-нафталіндіамін, (0,044 ммоль; 9,4 мг) у 1,2-дихлоретані (DCE, 20 мл), та охолоджують на льодяній бані. Додають краплями 1-хлоретилхлорформіат (4,41 ммоль; 0,48 мл) протягом двох хвилин, та одержують безбарвний розчин; перемішують 15 хв; потім відстороняють льодяну баню, та нагрівають при 70C протягом 2 год. Охолоджують до кімнатної температури, та випарюють. Розчиняють одержаний залишок у метанолі (20 мл), та нагрівають зі зворотним холодильником протягом 40 хв, випарюють, та розчиняють одержаний залишок у DCM, промивають бікарбонатом натрію, розсолом, сушать MgSO 4, фільтрують, випарюють, та одержують вказану в заголовку сполуку (681 мг; 106 %). MS (ES): m/z=437 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 47: Підготовчий синтез 48 49 50 20 25 Назва сполуки трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1-(2-метиламіноетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1(S)-1-піролідин-2-ілметил-1H-імідазол-2-іл]піперидин-1карбонової кислоти трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1(R)-1-піролідин-2-ілметил-1H-імідазол-2-іл]піперидин-1карбонової кислоти MS (ES): m/z (M+H) 471 463 463 Підготовчий синтез 51 Трет-бутиловий складний ефір 4-[1-[2-(бензилоксикарбонілметиламіно)етил]-4-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-метиламіноетил)1H-імідазол-2-іл]піперидин-1-карбонової кислоти (1,56 ммоль; 680 мг) у DCM (10 мл), та додають бензилхлорформіат (1,56 ммоль; 0,23 мл) та DIPEA (3,11 ммоль; 0,54 мл). Перемішують 15 хв, та випарюють. Очищають одержаний залишок шляхом пропускання через 120 г силікагелю, елююючи градієнтом від DCM до 20 % EA/DCM, та одержують вказану в заголовку сполуку (741 мг; 83 %). MS (ES): m/z=571 (M+H). Наведені нижче проміжні сполуки одержують практично за методикою, описаною у підготовчому синтезі 51: Підготовчий синтез 52 53 54 Назва сполуки трет-бутиловий складний ефір 4-[1-[2(бензилоксикарбонілметиламіно)етил]-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[1-((S)-1бензилоксикарбонілпіролідин-2-ілметил)-4-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-[1-((R)-1бензилоксикарбонілпіролідин-2-ілметил)-4-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти MS (ES): m/z (M+H) 605 597 597 30 35 Підготовчий синтез 55 Трет-бутиловий складний ефір 4-[1-[2-(бензилоксикарбонілметиламіно)етил]-4-(3,4дифторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Завантажують трет-бутиловий складний ефір 4-[1-[2-(бензил-метиламіно)етил]-4-(3,4дифторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (1,8 г; 0,0035 моль; 1,0 екв.) у ACN (40 мл) у атмосфері азоту, та додають краплями бензилхлорформіат при 0C. Перемішують реакційну суміш протягом 30 хв, та доводять до кімнатної температури. 19 UA 100190 C2 5 Перемішують при кімнатній температурі протягом 1,5 год. Після завершення реакції гасять реакційну суміш насиченим розчином бікарбонату натрію, та екстрагують EA. Промивають водою та розсолом, сушать безводним сульфатом натрію, та випарюють розчинник у вакуумі. Очищають на колонці із діоксидом кремнію, застосовуючи 15 % EA/гексан, та одержують вказану в заголовку сполуку (1,6 г; 82 %). (ES+): m/z=555 (M+H). Підготовчий синтез 55a (R)-бензил-2-((2-(1-(трет-бутоксикарбоніл)піперидин-4-іл)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-1-іл)метил)піперидин-1-карбоксилат F F F N Cbz F N N N O 10 15 20 O Розчиняють трет-бутиловий складний ефір (R)4-(1-((1-бензилпіперидин-2-іл)метил)-4-(4фтор-3-трифторметилфеніл)-1H-імідазол-2-іл)піперидин-1-карбонової кислоти (3,0 г, 0,005 моль, 1,0 екв.) у толуолі (15 мл), та додають бензилхлорформіат (8,5 мл, 50 % розчин у толуолі, 0,025 моль, 5,0 екв.) при 0C у атмосфері азоту. Перемішують реакційну суміш при кімнатній температурі протягом 16 год. Після завершення реакції гасять реакційну суміш водним розчином бікарбонату натрію, екстрагують EA (3100 мл), промивають органічний шар водним розчином бікарбонату натрію (350 мл), та сушать безводним сульфатом натрію. Концентрують під зниженим тиском, та очищають неочищену сполуку на колонці із силікагелем (100-200 меш), застосовуючи суміш 2,5 % ацетон-DCM як елюент, та одержують 2,6 г (81 %) вказаної в заголовку сполуки у вигляді зеленкувато-жовтої в'язкої рідини. (ES+): m/z=645 (M+H). Наведену нижче проміжну сполуку одержують практично за методикою, описаною у підготовчому синтезі 55a: Підготовчий синтез 30 35 MS (ES): m/z (M+H) 55b 25 Назва сполуки (S)-бензил-2-((2-(1-(трет-бутоксикарбоніл)піперидин-4-іл)-4-(4фтор-3-(трифторметил)феніл)-1H-імідазол-1іл)метил)піперидин-1-карбоксилат 645 Підготовчий синтез 56 Трет-бутиловий складний ефір 4-[1-(1-бензилоксикарбонілпіролідин-2-ілметил)-4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти У висушену круглодонну колбу завантажують трет-бутиловий складний ефір 4-[4-(4-фтор-3трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (1,5 г; 0,0036 моль; 1,0 екв.) у безводному DMF (30 мл), та охолоджують до 0C. Додають порціями NaH (0,26 г; 0,011 моль; 3,0 екв.) у атмосфері азоту, та перемішують при кімнатній температурі протягом 30 хв. Додають бензиловий складний ефір 2-(толуол-4-сульфонілоксиметил)-піролідин-1карбонової кислоти (2,46 г; 0,0072 моль; 2,0 екв.) при кімнатній температурі, та нагрівають при 40C протягом ночі. Гасять холодною водою, та екстрагують у EA. Промивають органічний шар водою та розсолом. Сушать безводним сульфатом натрію, та концентрують. Очищають неочищений залишок через діоксид кремнію (100-200 меш), застосовуючи градієнт 10-20 % EA/гексан, та одержують вказану в заголовку сполуку (1,14 г; 51,6 %). (ES+): m/z=631 (M+H). Наведену нижче проміжну сполуку одержують практично за методикою, описаною у підготовчому синтезі 56: 20 UA 100190 C2 Підготовчий синтез 57 5 10 Назва сполуки трет-бутиловий складний ефір 4-[1-(1-бензилоксикарбоніл-піролідин-2-ілметил)-4-(3,4-дифторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Порівняльний підготовчий синтез 58 Трет-бутиловий складний ефір 4-[1-(2-бензилоксикарбоніламіноетил)-4-(3-хлор-4фторфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[1-(2-аміноетил)-4-(3-хлор-4-фторфеніл)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (0,94 ммоль; 396,7 мг) у DCM (20 мл), та додають DIPEA (1,41 ммоль; 0,25 мл) та бензилхлорформіат (0,94 ммоль; 0,14 мл). Перемішують 20 хв, та промивають насиченим розчином бікарбонату натрію, сушать MgSO 4, фільтрують, та випарюють. Очищають пропусканням через 40 г силікагелю з елююванням градієнтом 0-40 % EA/DCM, одержуючи вказану в заголовку сполуку (222 мг; 42 %). MS (ES): m/z=557 (M+H). Наведену нижче проміжну сполуку одержують за методикою, аналогічною методиці, описаній у порівняльному підготовчому синтезі 58: Підготовчий синтез Назва сполуки 59 трет-бутиловий складний ефір 4-[1-(2-бензилоксикарбоніламіноетил)-4-(4фтор-3-трифторметилфеніл)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти 15 20 25 Порівняльний підготовчий синтез 60 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-ціанометил-1H-імідазол-2іл]піперидин-1-карбонової кислоти Змішують трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти (2,55 ммоль; 969 мг), бромід тетра-N-бутиламонію (0,26 ммоль; 82 мг), 50 % (мас.) водний розчин гідроксиду натрію (8,42 ммоль; 0,45 мл) та DCM (25 мл). Додають краплями бромацетонітрил (5,11 ммоль; 0,36 мл) протягом 10 хв. Перемішують 45 хв, розводять DCM, промивають розсолом, 50 % насиченим водним розчином хлориду натрію, сушать MgSO4, фільтрують, та випарюють. Очищають пропусканням через 150 г силікагелю з елююванням сумішшю 20 % EA/DCM, та одержують вказану в заголовку сполуку (812 мг; 76 %). MS (ES): m/z=419 (M+H). Наведену нижче проміжну сполуку одержують за методикою, аналогічною методиці, описаній у порівняльному підготовчому синтезі 60: Підготовчий синтез 61 Назва сполуки трет-бутиловий складний ефір 4-(1-(ціанометил)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-карбонової кислоти 30 35 40 Порівняльний підготовчий синтез 62 Трет-бутиловий складний ефір 4-[1-(2-аміноетил)-4-(3-хлор-4-фторфеніл)-1H-імідазол-2іл]піперидин-1-карбонової кислоти Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-ціанометил-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (0,94 ммоль; 392,9 мг) у метанолі (20 мл). Додають дихлорид нікелю (1,03 ммоль; 135 мг). Додають порціями тетрагідроборат натрію (18,8 ммоль; 717 мг). Випарюють, розподіляють між водою та DCM, та перемішують 20 хв. Додають целіт, перемішують 30 хв, та фільтрують. Промивають тверді речовини DCM, 10 % MeOH/DCM. Додають до органічного шару 2 мл 2 M NH3-MeOH, та випарюють. Розчиняють одержаний залишок у DCM, промивають розсолом, сушать MgSO4, фільтрують через целіт, та випарюють, одержуючи вказану в заголовку сполуку (498 мг; 125 %). MS (ES): m/z=423 (M+H). Наведену нижче проміжну сполуку одержують за методикою, аналогічною методиці, описаній у порівняльному підготовчому синтезі 62: 21 UA 100190 C2 Підготовчий синтез 10 MS(ES): m/z (M+H) 63 5 Назва сполуки трет-бутиловий складний ефір 4-(1-(2-аміноетил)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1карбонової кислоти 457 Підготовчий синтез 64 4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол Завантажують 2-бром-1-(4-фтор-3-трифторметилфеніл)етанон (40,0 г; 0,14 моль; 1,0 екв.) та формамід (175 мл; 4,38 моль; 31,3 екв.) у посудину високого тиску. Нагрівають до 180C, і витримують при цій температурі протягом 3 год. Гасять насиченим розчином бікарбонату натрію, та фільтрують через целіт. Екстрагують EA, та промивають органічний шар водою та розсолом. Концентрують, та очищають на колонці із діоксидом кремнію градієнтом 0-10 % MeOH-EA, одержуючи вказану в заголовку сполуку. (15,2 г; 47,0 %). (ES+): m/z=231 (M+H). Наведену нижче проміжну сполуку одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 64: Підготовчий синтез 65 15 20 25 Назва сполуки MS (ES): m/z (M+H) 4-(3-хлор-4-фторфеніл)-1H-імідазол 197 Підготовчий синтез 66 {2-[4-(3-хлор-4-фторфеніл)-імідазол-1-іл]етил}-диметиламін Завантажують у круглодонну колбу 4-(3-хлор-4-фторфеніл)-1H-імідазол (1,85 г; 1,00 екв.; 9,41 ммоль), KOH (3,00 екв.; 28,23 ммоль; 1,58 г, подрібнений у дрібний порошок) у DMSO (281,56 ммоль; 20,00 мл). Додають однією порцією гідрохлорид 2-диметиламіноетилхлориду (1,20 екв.; 11,29 ммоль; 1,63 г), одержаний розчин стає жовтим. Нагрівають до 45C, і витримують при цій температурі протягом 2 діб. Розводять реакційну суміш EA, промивають водою та розсолом, сушать одержані органічні речовини MgSO 4; фільтрують, та концентрують до одержання оранжевого масла. Очищають це неочищене масло ISCO хроматографією на колонці Biotage 40M, елююючи градієнтом від 5 % MeOH/DCM до 10 % MeOH/DCM при швидкості потоку 40 мл/хв, та одержують вказану в заголовку сполуку (1,09 г; 4,07 ммоль; 43,27 %) у вигляді світло-оранжевого масла. MS(ES): (m/z)=268,0 (M+H). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 66: Підготовчий синтез 67 68 69 Назва сполуки 4-(3-хлор-4-фторфеніл)-1-(2-піролідин-1-ілетил)-1Hімідазол 4-(4-фтор-3-(трифторметил)феніл)-1-(2-(піролідин-1іл)етил)-1H-імідазол 2-(4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-1-іл)-N, N-диметилетанамін MS(ES): (m/z) [M+H] 294 328 302 30 35 40 Підготовчий синтез 70 Трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1Hімідазол-2-іл]-4-гідроксипіперидин-1-карбонової кислоти Розчиняють {2-[4-(3-хлор-4-фторфеніл)імідазол-1-іл]етил}диметиламін (1,00 екв.; 4,07 ммоль; 1,09 г) у безводному THF (15 мл; 184,33 ммоль), та охолоджують одержану суміш до -78C. Повільно додають н-бутиллітій (1,40 екв.; 5,70 ммоль; 3,56 мл) (1,6M, Aldrich), та перемішують при -78C протягом 30 хв, після чого додають краплями розчин N-третбутоксикарбоніл-4-піперидону (1,20 екв.; 4,89 ммоль; 973,43 мг) у THF (10 мл) протягом 10 хв. Через 20 хв нагрівають реакційну суміш до кімнатної температури та перемішують 3 год. Розподіляють між EA та водою. Промивають органічний шар розсолом, водним розчином NaCl (50/50), та сушать MgSO4. Фільтрують, та концентрують. Очищають одержаний залишок ISCO хроматографією на колонці Biotage 40M, елююючи градієнтом від 100 % DCM до 10 % MeOH/DCM, та одержують 785 мг (41 %) вказаної в заголовку сполуки у вигляді білої твердої речовини. ES(MS): (m/z)=467,0 (M+H). 22 UA 100190 C2 Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 70: Підготовчий синтез 71 72 73 5 10 15 Назва сполуки трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1(2-піролідин-1-ілетил)-1H-імідазол-2-іл]-4-гідроксипіперидин1-карбонової кислоти трет-бутиловий складний ефір 4-(4-(4-фтор-3(трифторметил)феніл)-1-(2-(піролідин-1-іл)етил)-1Hімідазол-2-іл)-4-гідроксипіперидин-1-карбонової кислоти трет-бутиловий складний ефір 4-(1-(2-(диметиламіно)етил)4-(4-фтор-3-(трифторметил)феніл)-1H-імідазол-2-іл)-4гідроксипіперидин-1-карбонової кислоти MS(ES): (m/z) (M+H) 493 527 501 Підготовчий синтез 74 Дигідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2іл]піперидин-4-олу Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-(2диметиламіноетил)-1H-імідазол-2-іл]-4-гідроксипіперидин-1-карбонової кислоти (1,00 екв.; 1,68 ммоль; 785,00 мг) у 5 мл DCM, та повільно додають хлористий водень (24,00 ммоль; 6,00 мл 4 M розчину у діоксані) при кімнатній температурі. Через 5 хв одержаний розчин стає непрозорим, після чого з розчину випадає масляниста біла речовина. Додають 2 мл метанолу, та знову розчиняють одержаний твердий залишок. Через 30 хв HPLC показала 25 % вихідного матеріалу. Додають ще 1 мл розчину HCl. Перемішують загалом 2 год. при кімнатній температурі, після чого концентрують у вакуумі. Знову розчиняють у DCM, та випарюють у вакуумі до одержання твердої речовини; сушать цю білу тверду речовину у вакуум-сушильній шафі при 45C, одержуючи 900 мг вказаної в заголовку сполуки. ES(MS): (m/z)=367,0 (M+H). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 74: 20 Підготовчий синтез 75 76 77 25 30 35 40 Назва сполуки дигідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-(2-піролідин-1ілетил)-1H-імідазол-2-іл]піперидин-4-олу дигідрохлорид 4-(4-(4-фтор-3-(трифторметил)феніл)-1-(2(піролідин-1-іл)етил)-1H-імідазол-2-іл)піперидин-4-олу дигідрохлорид 4-(1-(2-(диметиламіно)етил)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-4-олу MS (ES): m/z (M+H) 393,2 427 401 Підготовчий синтез 78 Трис-гідрохлорид 2-(4-(4-хлорфеніл)-2-(піперидин-4-іл)-1H-імідазол-1-іл)-N, Nдиметилетанаміну A. Трет-бутиловий складний ефір 4-(1-(2-(тетрагідро-2H-піран-2-ілоксі)етил)-1H-імідазол-2іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-(1H-імідазол-2-іл)піперидин-1-карбонової кислоти (40 г; 0,16 моль; 1,0 екв.), порошкоподібний KOH (35,6 г; 0,64 моль; 4,0 екв.), 2-(2брометокси)тетрагідропіран (66,2 г; 0,32 моль; 2,0 екв.) у DMSO (250 мл), та перемішують при кімнатній температурі протягом 2 год. Гасять реакційну суміш водою, та екстрагують EA. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (58 г; 97 %). B. Трет-бутиловий складний ефір 4-(4,5-дибром-1-(2-(тетрагідро-2H-піран-2-ілоксі)етил)-1Hімідазол-2-іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-{1-[2-(тетрагідропіран-2-ілоксі)етил]-1H-імідазол-2іл}піперидин-1-карбонової кислоти (58,2 г; 0,15 моль; 1,0 екв.) у DCM (500 мл), та охолоджують до -10C. Додають N-бромсукцинімід (54,6 г; 0,31 моль; 2,0 екв.), та залишають реакційну суміш для нагрівання до кімнатної температури. Гасять реакційну суміш водою, та екстрагують DCM. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (78,2 г; 95 %). C. Трет-бутиловий складний ефір 4-(4-бром-1-(2-(тетрагідро-2H-піран-2-ілоксі)етил)-1Hімідазол-2-іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-{4,5-дибром-1-[2-(тетрагідропіран-2-ілоксі)етил] 23 UA 100190 C2 5 10 15 20 25 30 35 40 45 50 1H-імідазол-2-іл}піперидин-1-карбонової кислоти (39,0 г; 0,073 моль; 1,0 екв.) до THF (600 мл), та охолоджують до -78C у атмосфері аргону. Додають краплями розчин n-BuLi (1,6 M розчин у циклогексані) (53,7 мл; 0,087 моль; 1,2 екв.) протягом 1 год., та залишають для нагрівання до 30C протягом 2 год. Гасять реакційну суміш насиченим розчином хлориду амонію, та екстрагують EA. Випарюють органічний шар, та очищають одержаний залишок хроматографією на силікагелі, одержуючи вказану в заголовку сполуку (13,2 г; 39 %). D. Трет-бутиловий складний ефір 4-(4-бром-1-(2-гідроксіетил)-1H-імідазол-2-іл)піперидин-1карбонової кислоти: Додають трет-бутиловий складний ефір 4-{4-бром-1-[2-(тетрагідропіран-2-ілоксі)етил]-1Hімідазол-2-іл}піперидин-1-карбонової кислоти (13,2 г; 0,029 моль; 1,0 екв.), п-толуолсульфонову кислоту (6,5 г; 0,034 моль; 1,2 екв.) до метанолу (200 мл), та перемішують при кімнатній температурі протягом 30 хв. Концентрують, та розподіляють між насиченим водним розчином NaHCO3 та EA. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (10,0 г; 93 %). E. Трет-бутиловий складний ефір 4-(4-бром-1-(2-(метилсульфонілоксі)етил)-1H-імідазол-2іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-[4-бром-1-(2-гідроксіетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти (10,0 г; 0,027 моль; 1,0 екв.) та TEA (11,6 мл; 0,080 моль; 3,0 екв.) до DCM (150 мл), та охолоджують до 0C. Додають краплями мезилхлорид (2,6 мл; 0,032 моль; 1,2 екв.), та перемішують протягом 30 хв. Гасять реакційну суміш насиченим водним розчином NaHCO3, та екстрагують DCM. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (10,2 г; 84 %). F. Трет-бутиловий складний ефір 4-(4-бром-1-(2-(диметиламіно)етил)-1H-імідазол-2іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-[4-бром-1-(2-метансульфонілоксіетил)-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (10,2 г; 0,023 моль; 1,0 екв.), диметиламін (40 % водний розчин, 22 мл; 0,18 моль; 8,0 екв.) у ACN (100 мл), та перемішують при 100C протягом 3 год. Концентрують, гасять реакційну суміш насиченим розчином NaHCO 3, та екстрагують EA. Концентрують органічний шар; очищають через колонку із силікагелем, елююючи сумішшю EA/гексан, та одержують вказану в заголовку сполуку (7,5 г; 83,33 %). G. Трет-бутиловий складний ефір 4-(4-(4-хлорфеніл)-1-(2-(диметиламіно)етил)-1H-імідазол2-іл)піперидин-1-карбонової кислоти: Додають трет-бутиловий складний ефір 4-[4-бром-1-(2-диметиламіноетил)-1H-імідазол-2іл]піперидин-1-карбонової кислоти (1,0 г; 0,0024 моль; 1,0 екв.), 4-хлорфенілборну кислоту (0,58 г; 0,0037 моль; 1,5 екв.), 3 M розчин Na2CO3 (0,79 г; 0,0074 моль; 3,0 екв.) до етанолу (5 мл) та толуолу (5 мл), та знегажують реакційну суміш аргоном. Додають Pd(PPh3)4 (0,29 г; 0,00024 моль; 0,1 екв.), та піддають нагріванню в мікрохвильовій печі при 110C протягом 20 хв. Додають EA, та фільтрують через шар целіту. Додають насичений водний розчин NaHCO3, та екстрагують EA. Випарюють органічний шар, та очищають одержаний залишок пропусканням через колонку із силікагелем, елююючи метанолом у DCM, та одержують вказану в заголовку сполуку (0,8 г; неочищена). H. Трис-гідрохлорид 2-(4-(4-хлорфеніл)-2-(піперидин-4-іл)-1H-імідазол-1-іл)-N, Nдиметилетанаміну: Додають 4 M розчин HCl у 1,4-діоксані (2 мл) до трет-бутилового складного ефіру 4-[4-(4хлорфеніл)-1-(2-диметиламіноетил)-1H-імідазол-2-іл]піперидин-1-карбонової кислоти (0,8 г; 0,0018 моль; 1,0 екв.) у DCM, та перемішують при кімнатній температурі протягом 6 год. Концентрують реакційну суміш, кристалізують з діетилового ефіру, фільтрують, та одержують вказану в заголовку сполуку (0,6 г; 74,07 %). MS (ES+): m/z=333 (M+H). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі трис-гідрохлориду 2-(4-(4-хлорфеніл)-2-(піперидин-4-іл)-1H-імідазол-1-іл)N, N-диметилетанаміну (стадії A-H): Підготовчий синтез 79 80 81 Назва сполуки трис-гідрохлорид 2-(4-(3-хлорфеніл)-2-(піперидин-4-іл)-1Hімідазол-1-іл)-N, N-диметилетанаміну трис-гідрохлорид N, N-диметил-2-(2-(піперидин-4-іл)-4-(3(трифторметил)феніл)-1H-імідазол-1-іл)етанаміну трис-гідрохлорид 3-(1-(2-(диметиламіно)етил)-2-(піперидин-4іл)-1H-імідазол-4-іл)бензонітрилу 24 MS (ES+): m/z 333 (M+H) 367 (M+H) 324 UA 100190 C2 Підготовчий синтез 82 5 10 15 Назва сполуки дигідрохлорид 2-(4-(4-фторфеніл)-2-(піперидин-4-іл)-1Hімідазол-1-іл)-N, N-диметилетанаміну MS (ES+): m/z 317 Підготовчий синтез 83 Біс-трифторацетат [4-(3-хлор-4-фторфеніл)-2-піперидин-4-іл-імідазол-1-іл]-ацетонітрилу Розчиняють трет-бутиловий складний ефір 4-[4-(3-хлор-4-фторфеніл)-1-ціанометил-1Hімідазол-2-іл]піперидин-1-карбонової кислоти (399 мг; 0,95 ммоль) у TFA (10 мл), перемішують 15 хв, та випарюють, одержуючи вказану в заголовку сполуку (607 мг; 110 %). MS (ES): m/z=319 (M+H). Підготовчий синтез 84 Дигідрохлорид {2-[4-(3-хлор-4-фторфеніл)-2-піперидин-4-іл-імідазол-1-іл]етил}диметиламіну Розчиняють трет-бутиловий складний ефір 4-(4-(3-хлор-4-фторфеніл)-1-(2(диметиламіно)етил)-1H-імідазол-2-іл)піперидин-1-карбонової кислоти (194 мг; 0,43 ммоль) у DCM (5 мл) та метанолі (3 мл), та додають 4 M розчин хлористого водню у діоксані (5 мл; 20 ммоль). Перемішують 30 хв, та випарюють; додають DCM/MeOH, та випарюють у вакуумі, одержуючи вказану в заголовку сполуку (245 мг) у вигляді білої твердої речовини. MS (ES): m/z=351 (M+H). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 84: Підготовчий синтез 85 86 87 88 89 90 91 92 93 94 95 96 97 98 Назва сполуки дигідрохлорид {2-[4-(4-фтор-3-трифторметилфеніл)-2піперидин-4-іл-імідазол-1-іл]етил}диметиламіну дигідрохлорид 4-[4-(3-хлор-4-фторфеніл)-1-(2-піролідин-1ілетил)-1H-імідазол-2-іл]піперидину дигідрохлорид 4-[4-(4-фтор-3-трифторметилфеніл)-1-(2піролідин-1-ілетил)-1H-імідазол-2-іл]піперидину трис-гідрохлорид {2-[4-(4-фтор-3-трифторметилфеніл)-2піперидин-4-іл-імідазол-1-іл]-1,1-диметилетил}диметиламіну трис-гідрохлорид 4-(4-(3,4-дифторфеніл)-1-(2-(піролідин-1іл)етил)-1H-імідазол-2-іл)піперидину гідрохлорид бензил-2-(4-(4-фтор-3-(трифторметил)феніл)-2(піперидин-4-іл)-1H-імідазол-1-іл)етилкарбамату трис-гідрохлорид бензилового складного ефіру {2-[4-(3-хлор4-фторфеніл)-2-піперидин-4-іл-імідазол-1іл]етил}метилкарбамінової кислоти трис-гідрохлорид бензилового складного ефіру {2-[4-(3,4дифторфеніл)-2-піперидин-4-іл-імідазол-1іл]етил}метилкарбамінової кислоти бісгідрохлорид бензилового складного ефіру (S)-2-[4-(3-хлор4-фторфеніл)-2-піперидин-4-іл-імідазол-1-ілметил]піролідин1-карбонової кислоти трис-гідрохлорид бензилового складного ефіру (R)-2-[4-(3хлор-4-фторфеніл)-2-піперидин-4-ілімідазол-1ілметил]піролідин-1-карбонової кислоти дигідрохлорид бензилового складного ефіру 2-[4-(4-фтор-3трифторметилфеніл)-2-піперидин-4-іл-імідазол-1ілметил]піролідин-1-карбонової кислоти дигідрохлорид бензилового складного ефіру 2-((4-(3,4дифторфеніл)-2-(піперидин-4-іл)-1H-імідазол-1іл)метил)піролідин-1-карбонової кислоти дигідрохлорид бензилового складного ефіру {2-[4-(4-фтор-3трифторметилфеніл)-2-піперидин-4-іл-імідазол-1іл]етил}метилкарбамінової кислоти трис-гідрохлорид ((R)-1-{2-[4-(4-фтор-3-трифторметилфеніл)2-піперидин-4-іл-імідазол-1-іл]етил}піролідин-2-іл)метанолу 25 MS(ES): m/z (M+H) 385 376 411 413 361 491 471 455 497 497 531 505 441 UA 100190 C2 Підготовчий синтез Назва сполуки трис-гідрохлорид {2-[4-(4-фтор-3-трифторметилфеніл)-2піперидин-4-іл-імідазол-1-іл]етил}ізопропілметиламіну трис-гідрохлорид {2-[4-(3-хлор-4-фторфеніл)-2-піперидин-4іл-імідазол-1-іл]етил}ізопропілметиламіну трис-гідрохлорид трет-бутил-{2-[4-(4-фтор-3трифторметилфеніл)-2-піперидин-4-іл-імідазол-1іл]етил}аміну трис-гідрохлорид трет-бутил-{2-[4-(3-хлор-4-фторфеніл)-2піперидин-4-іл-імідазол-1-іл]етил}аміну трис-гідрохлорид {2-[4-(3-хлор-4-фторфеніл)-2-піперидин-4ілімідазол-1-іл]етил}етилізопропіламіну дигідрохлорид диметил-[2-(4-феніл-2-піперидин-4-іл-імідазол1-іл)етил]аміну трис-гідрохлорид 2-({2-[4-(3,4-дифторфеніл)-2-піперидин-4-ілімідазол-1-іл]етил}метиламіно)етанолу дигідрохлорид 2-(4-(3,4-дифторфеніл)-2-(піперидин-4-іл)-1Hімідазол-1-іл)-N, N-диметилетанаміну трис-гідрохлорид 1-(2-(4-(3,4-дифторфеніл)-2-(піперидин-4іл)-1H-імідазол-1-іл)етил)піролідин-3-олу трис-гідрохлорид 1-(2-(4-(3,4-дифторфеніл)-2-(піперидин-4іл)-1H-імідазол-1-іл)етил)азетидин-3-олу 99 100 101 102 103 104 105 106 107 108 MS(ES): m/z (M+H) 413 379 413 379 393 299 365 335 377 363 Підготовчий синтез 108a Тригідрохлорид (R)-бензил 2-((4-(4-фтор-3-(трифторметил)феніл)-2-(піперидин-4-іл)-1Hімідазол-1-іл)метил)піперидин-1-карбоксилату F F F N Cbz F N N .3HCl 5 10 N Розчиняють (R)-бензил-2-((2-(1-(трет-бутоксикарбоніл)піперидин-4-іл)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-1-іл)метил)піперидин-1-карбоксилат (2,6 г, 0,004 моль, 1,0 екв.) у DCM (15 мл). Охолоджують реакційну суміш до 0C, та краплями додають HCl (4,0 M розчин у діоксані, 5 мл, 0,020 моль). Витримують реакційну суміш для нагрівання до кімнатної температури, та перемішують протягом 16 год. Після завершення реакції концентрують реакційну суміш, випарюють сумісно з метанолом (520 мл) у високому вакуумі, та одержують 2,2 г (83,6 %) вказаної в заголовку сполуки. (ES+): m/z=545 (M+H). Наведену нижче проміжну сполуку одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 108a: 15 Підготовчий синтез 108b Назва сполуки тригідрохлорид (S)-бензил-2-((4-(4-фтор-3(трифторметил)феніл)-2-(піперидин-4-іл)-1H-імідазол-1іл)метил)піперидин-1-карбоксилату MS(ES): m/z (M+H) 545 Підготовчий синтез 108c (R)-2-((4-(3-(дифторметил)-4-фторфеніл)-2-(піперидин-4-іл)-1H-імідазол-1-іл)метил)-1метилпіперидин 26 UA 100190 C2 F F F N N N N 5 10 15 До суспензії алюмогідриду літію (0,638 г, 0,0168 моль, 5,0 екв.) у 20 мл THF при 0C додають невеликими порціями (R)-бензил-2-((4-(4-фтор-3-(трифторметил)феніл)-2-(піперидин-4-іл)-1Hімідазол-1-іл)метил)піперидин-1-карбоксилат (2,2 г, 0,0033 моль, 1,0 екв.). Перемішують реакційну суміш при кімнатній температурі протягом 4 год. Після завершення реакції охолоджують реакційну суміш, та гасять охолодженою льодом водою, після чого додають 10 % розчин NaOH, перемішують при кімнатній температурі, фільтрують одержану суспензію через целіт, та промивають одержаний твердий осад EA. Сушать фільтрат безводним сульфатом натрію, концентрують під зниженим тиском, та одержують 1,6 г вказаної в заголовку сполуки. (ES+): m/z 407 (M+H). Підготовчий синтез 109 4-хлор-5-(тіазол-2-ілметилен)-5H-піроло[2,3-d]піримідин-6(7H)-он Змішують 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он (0,3 г; 0,0017 моль) та тіазол-2карбальдегід (0,23 мл, 0,0026 моль) у метанолі (1,5 мл). Додають краплями піролідин (0,073 мл; 0,0008 моль). Перемішують при кімнатній температурі протягом 15 хв. Відфільтровують тверді речовини, одержуючи вказану в заголовку сполуку (0,35 г; 76,08 %). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 109: Підготовчий синтез 110 111 112 113 114 115 Назва сполуки 4-хлор-5-(піридин-4-ілметилен)-5H-піроло[2,3-d]піримідин6(7H)-он 4-хлор-5-((2-метилтіазол-4-іл)метилен)-5H-піроло[2,3d]піримідин-6(7H)-он 5-бензиліден-4-хлор-5H-піроло[2,3-d]піримідин-6(7H)-он 5-((1H-імідазол-5-іл)метилен)-4-хлор-5H-піроло[2,3d]піримідин-6(7H)-он 5-((1H-імідазол-2-іл)метилен)-4-хлор-5H-піроло[2,3d]піримідин-6(7H)-он 4-хлор-5-(тіазол-5-ілметилен)-5H-піроло[2,3-d]піримідин6(7H)-он MS (ES+): m/z 259 279 (M+1) 258 (M+1) 248 (M+1) 248 (M+1) 265 (M+1) 20 25 30 Підготовчий синтез 116 5-бензиліден-4-(4-(4-(3-хлор-4-фторфеніл)-1-(2-(диметиламіно)етил)-1H-імідазол-2іл)піперидин-1-іл)-5H-піроло[2,3-d]піримідин-6(7H)-он Змішують трис-гідрохлорид {2-[4-(3-хлор-4-фторфеніл)-2-піперидин-4-іл-імідазол-1іл]етил}диметиламіну (0,5 г; 0,0013 моль; 1,0 екв.); 5-бензиліден-4-хлор-5H-піроло[2,3d]піримідин-6(7H)-он (0,33 г; 0,0013 моль; 1,0 екв.); DIPEA (1,7 мл 0,0098 моль; 7,6 екв.); 2пропанол (10 мл), та піддають нагріванню в мікрохвильовій печі при 100C протягом 30 хв. Охолоджують, та концентрують у вакуумі. Розводять насиченим розчином бікарбонату натрію, та екстрагують DCM. Промивають органічний шар водою та розсолом, та сушать безводним сульфатом натрію. Концентрують одержану неочищену сполуку, очищають РХВЕ з оберненою фазою, та одержують вказану в заголовку сполуку у вигляді суміші ізомерів E та Z (0,09 г; 12,2 %). MS (ES+): m/z=572 (M+H). Наведені нижче проміжні сполуки одержують за методикою, аналогічною методиці, описаній у підготовчому синтезі 116: 35 27 UA 100190 C2 Підготовчий синтез 117 118 5 10 15 Назва сполуки 5-бензиліден-4-(4-(1-(2-(диметиламіно)етил)-4-(4-фтор-3(трифторметил)феніл)-1H-імідазол-2-іл)піперидин-1-іл)-5Hпіроло[2,3-d]піримідин-6(7H)-он 5-бензиліден-4-(4-(4-(3,4-дифторфеніл)-1-(2(диметиламіно)етил)-1H-імідазол-2-іл)піперидин-1-іл)-5Hпіроло[2,3-d]піримідин-6(7H)-он MS (ES+): m/z 607 557 Підготовчий синтез 119 4-хлор-5,5-диметил-5H-піроло[2,3-d]піримідин-6(7H)-он Спосіб A: Додають 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он (0,25 г; 0,0015 моль) до THF (7,5 мл). Охолоджують до 0C, та додають порціями NaH (0,12 г; 0,0029 моль). Перемішують при 0C протягом 30 хв. Додають краплями метилйодид (0,18 мл, 0,0029 моль). Перемішують при 0C протягом 30 хв, а потім – при кімнатній температурі протягом 1 год. Гасять реакційну суміш насиченим водним розчином хлориду амонію, та екстрагують EA. Випарюють органічний шар, та очищають одержаний залишок пропусканням через колонку із силікагелем, застосовуючи суміш ацетон:гексан як елюент, та одержують вказану в заголовку сполуку (172 мг; 59,03 %). MS (ES+): m/z=196 (M-H). Спосіб B: Додають 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он (1 г; 0,0058 моль), третбутилат калію (3,31 г; 0,029 моль), CuBrMe2S (0,12 г; 0,00059 моль) до THF (20 мл). Охолоджують до 0C, та додають краплями метилйодид (0,99 мл; 0,016 моль). Доводять реакційну суміш до кімнатної температури, та перемішують протягом 10 хв. Гасять насиченим водним розчином хлориду амонію, та екстрагують EA. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (0,91 г; 78,4 %). MS (ES+): m/z=196 (M-H). Підготовчий синтез 120 4-хлор-5-етил-5,7-дигідропіроло[2,3-d]піримідин-6-он Cl N O 20 25 N N Додають 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он (0,5 г; 0,0029 моль; 1,0 екв.) у THF (20 мл), та охолоджують до -78C у атмосфері аргону. Додають краплями гексаметилдисилазид літію (5,89 мл, 0,0059 моль; 2,0 екв.; 1 M у THF). Перемішують при -78C протягом 30 хв. Додають краплями етилйодид (0,48 мл; 0,0059 моль; 2,0 екв.), та витримують реакційну суміш для повільного нагрівання до 0C. Перемішують протягом 4 год. Гасять насиченим водним розчином хлориду амонію, та екстрагують EA. Випарюють органічний шар, та одержують вказану в заголовку сполуку (0,24 г; 41,38 %). Підготовчий синтез 121 4-хлор-5-метил-5,7-дигідропіроло[2,3-d]піримідин-6-он Cl N O 30 35 N N Додають 4-хлор-5,7-дигідропіроло[2,3-d]піримідин-6-он (0,4 г; 0,0023 моль; 1,0 екв.) у THF (15 мл), та охолоджують до -78C у атмосфері аргону. Додають краплями гексаметилдисилазид літію (4,7 мл; 0,0047 моль; 2,0 екв.; 1 M розчин у THF). Перемішують реакційну суміш при -78C протягом 30 хв. Додають краплями метилйодид (0,29 мл; 0,0047 моль; 2,0 екв.), витримують реакційну суміш для повільного нагрівання до -20C, та перемішують при -20C протягом 2 год. Гасять реакційну суміш насиченим водним розчином хлориду амонію, та екстрагують EA. Випарюють органічний шар, одержуючи вказану в заголовку сполуку (0,24 г; 41,38 %). Підготовчий синтез 122 4'-хлорспіро[циклопентан-1,5'-піроло[2,3-d]піримідин]-6'(7'H)-он 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAkt and p70 s6 kinase inhibitors
Автори англійськоюDally, Robert, Dean, Joseph, Sajan, Shepherd, Timothy, Alan
Назва патенту російськоюИнгибиторы киназ акт и p70-s6
Автори російськоюДалли Роберт Дин, Джоузеф Саджан, Шеперд Тимоти Алан
МПК / Мітки
МПК: A61K 31/52, C07D 473/00, A61P 35/00
Мітки: кіназ, інгібітори, акт, p70-s6
Код посилання
<a href="https://ua.patents.su/74-100190-ingibitori-kinaz-akt-ta-p70-s6.html" target="_blank" rel="follow" title="База патентів України">Інгібітори кіназ акт та p70-s6</a>
Попередній патент: Застосування суперіонної кераміки на основі нанокристалічного йодид-пентатіофосфату міді cu6ps5i як матеріалу для твердоелектролітичного джерела енергії
Наступний патент: Спосіб охорони підготовчої виробки
Випадковий патент: Спосіб прогнозування незрощення перелому












