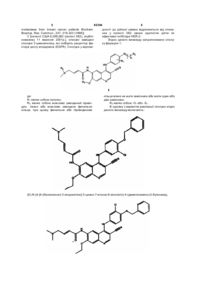
Заміщені хіноліни як інгібітори ферментів протеїнтирозинових кіназ
Номер патенту: 85394
Опубліковано: 26.01.2009
Автори: Рабіндран Срідхар Крішна, Цоу Хвей-Ру, Віснер Алан
Формула / Реферат
1. Сполука, що являє собою (Е)-N-{4-[3-хлор-4-(2-піридинілметоксі)анілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенамід або його фармацевтично припустиму сіль.
2. Сполука, що являє собою (Е)-N-(4-{3-хлор-4-[(3-фторбензил)оксі]анілін}-3-ціан-7-етокси-6-хінолініл)-4-(диметиламін)-2-бутенамід або його фармацевтично припустиму сіль.
3. Сполука, що являє собою (2Е)-N-(4-{[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)феніл]амін}-3-ціан-7-метоксі-6-хінолініл)-4-(діметиламін)-2-бутенамід або його фармацевтичено припустиму сіль.
4. Сполука, що являє собою (Е)-N-{4-[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)анілін]-3-ціан-7-метокси-6-хінолініл}-4-[(2-метоксіетил)метиламін]-2-бутенамід або його фармацевтично припустиму сіль.
5. Фармацевтичний склад, який містить сполуку за будь-яким з пп. 1-4.
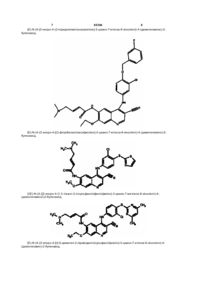
6. Спосіб лікування, інгібування росту або знищення неоплазми у ссавців, що потребують такого лікування, згідно з яким зазначеним ссавцям вводять ефективну дозу (Е)-N-{4-[4-(бензилокси)-3-хлоранілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду або (Е)-N-{4-[3-хлор-4-(2-піридинілметоксі)анілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду, або (Е)-N-(4-{3-хлор-4-[(3-фторбензил)оксі]анілін}-3-ціан-7-етокси-6-хінолініл)-4-(диметиламін)-2-бутенаміду, або (2Е)-N-(4-{[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)феніл]амін}-3-ціан-7-метоксі-6-хінолініл)-4-(діметиламін)-2-бутенаміду, або (Е)-N-{4-[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)анілін]-3-ціан-7-метокси-6-хінолініл}-4-[(2-метоксіетил)метиламін]-2-бутенаміду або їх фармацевтично припустимих солей.
7. Спосіб за п. 6, який відрізняється тим, що неоплазму вибирають з групи, що включає рак молочної залози, нирки, сечового міхура, порожнини рота, гортані, стравоходу, ободової кишки, яєчника, підшлункової залози, головного мозку, простати й легені.
8. Спосіб інгібування EGFR у ссавців, згідно з яким зазначеним ссавцям вводять ефективну дозу (Е)-N-{4-[4-(бензилокси)-3-хлоранілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду або (Е)-N-{4-[3-хлор-4-(2-піридинілметоксі)анілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду, або (Е)-N-(4-{3-хлор-4-[(3-фторбензил)оксі]анілін}-3-ціан-7-етокси-6-хінолініл)-4-(диметиламін)-2-бутенаміду, або (2Е)-N-(4-{[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)феніл]амін}-3-ціан-7-метоксі-6-хінолініл)-4-(діметиламін)-2-бутенаміду, або (Е)-N-{4-[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)анілін]-3-ціан-7-метокси-6-хінолініл}-4-[(2-метоксіетил)метиламін]-2-бутенаміду або їх фармацевтично припустимих солей.
9. Спосіб інгібування HER-2 у ссавців, згідно з яким зазначеним ссавцям вводять ефективну дозу (Е)-N-{4-[4-(бензилокси)-3-хлоранілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду або (Е)-N-{4-[3-хлор-4-(2-піридинілметоксі)анілін]-3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду, або (Е)-N-(4-{3-хлор-4-[(3-фторбензил)оксі]анілін}-3-ціан-7-етокси-6-хінолініл)-4-(диметиламін)-2-бутенаміду, або (2Е)-N-(4-{[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)феніл]амін}-3-ціан-7-метоксі-6-хінолініл)-4-(діметиламін)-2-бутенаміду, або (Е)-N-{4-[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)анілін]-3-ціан-7-метокси-6-хінолініл}-4-[(2-метоксіетил)метиламін]-2-бутенаміду або їх фармацевтично припустимих солей.
Текст
1. Сполука, що являє собою (Е)-N-{4-[3-хлор4-(2-піридинілметоксі)анілін]-3-ціан-7-етокси-6хінолініл}-4-(диметиламін)-2-бутенамід або його фармацевтично припустиму сіль. 2. Сполука, що являє собою (Е)-N-(4-{3-хлор-4-[(3фторбензил)оксі]анілін}-3-ціан-7-етокси-6хінолініл)-4-(диметиламін)-2-бутенамід або його фармацевтично припустиму сіль. 3. Сполука, що являє собою (2Е)-N-(4-{[3-хлор-4(1,3-тіазол-2-ілсульфаніл)феніл]амін}-3-ціан-7метоксі-6-хінолініл)-4-(діметиламін)-2-бутенамід або його фармацевтичено припустиму сіль. 4. Сполука, що являє собою (Е)-N-{4-[3-хлор-4(1,3-тіазол-2-ілсульфаніл)анілін]-3-ціан-7-метокси6-хінолініл}-4-[(2-метоксіетил)метиламін]-2бутенамід або його фармацевтично припустиму сіль. 5. Фармацевтичний склад, який містить сполуку за будь-яким з пп. 1-4. 6. Спосіб лікування, інгібування росту або знищення неоплазми у ссавців, що потребують такого лікування, згідно з яким зазначеним ссавцям вводять ефективну дозу (Е)-N-{4-[4-(бензилокси)-3 2 (19) 1 3 85394 4 (Е)-N-{4-[4-(бензилокси)-3-хлоранілін]-3-ціан-7N-(4-{[3-хлор-4-(1,3-тіазол-2етокси-6-хінолініл}-4-(диметиламін)-2-бутенаміду ілсульфаніл)феніл]амін}-3-ціан-7-метоксі-6або (Е)-N-{4-[3-хлор-4-(2-піридинілметоксі)анілін]хінолініл)-4-(діметиламін)-2-бутенаміду, або (Е)-N3-ціан-7-етокси-6-хінолініл}-4-(диметиламін)-2{4-[3-хлор-4-(1,3-тіазол-2-ілсульфаніл)анілін]-3бутенаміду, або (Е)-N-(4-{3-хлор-4-[(3ціан-7-метокси-6-хінолініл}-4-[(2фторбензил)оксі]анілін}-3-ціан-7-етокси-6метоксіетил)метиламін]-2-бутенаміду або їх фархінолініл)-4-(диметиламін)-2-бутенаміду, або (2Е)мацевтично припустимих солей. Дійсний винахід відноситься до деяких заміщених 3-цианхінолінових сполук, а також до їх фармацевтично припустимих солей. Сполуки згідно із даним винаходом інгібують HER-2 і фермент рецептора фактора росту епідерміса (epidermal growth factor receptor, EGFR) і тим самим інгібують аномальний ріст деяких типів клітин. Сполуки згідно із даним винаходом є протипухлинними препаратами й корисні для лікування раку в ссавців. Дійсний винахід відноситься також до застосування 3-цианхінолінів i фармацевтичних препаратів, що містять їх, для лікування раку. Протеїн-тирозинові кінази являють собою клас ферментів, які каталізують передачу фосфатної групи з ATP (adenosine triphosphate, аденозинтрифосфа т) у тирозиновий залишок, розташований у протеїновому субстраті. Очевидно що протеїнтирозинові кінази відіграють певну роль у рості клітин. Багато протеїнів рецепторів фактору росту функціонують, як тирозинові кінази, i саме таким способом впливають на сигнальну систему. Взаємодія факторів росту із цими рецепторами є необхідною подією при нормальній регуляції росту клітин. Однак за певних умов у результаті м утації або надсинтезу ці рецептори можуть стати розрегульорованими, наслідком чого є некерована проліферація клітин, що може привести до росту пухлини й в остаточному підсумку до захворювання відомому як рак [Walks, A.F., Adv. Cancer Res., 60, 43 (1993) and Parsons, J.Τ., Parsons, S.J., Important Ad vances in Oncology, DeVita, V.T. Ed., J.B. Lippincott Co., Phila, 3 (1993)]. Серед кіназ рецепторів фактору росту і їх прото-онкогенів, які ідентифіковані і є мішенями сполук, згідно із даним винаходом, є кіназа рецептора фактора росту епидерміса (кіназа EGF-R, протеїновий продукт онкогена erb) і продукт, утворений онкогеном erbВ2 (називається також neu або HER-2). Оскільки подія фосфорилювання є необхідним сигналом для клітинного поділу, і оскільки надсинтезовані або мутовані кінази пов'язані з раковим захворюванням, інгібітор цієї події, а, саме, інгібітор протеїн-тирозинових кіназ буде мати терапевтичне значення для лікування раку й інших захворювань, які характеризуються некерованим або аномальним ростом клітин. Так, наприклад надсинтез рецепторного продукту кінази онкогена erbВ-2 пов'язаний з раком молочної залози і яєчника людини [Slamon, D. J., et. al., Science, 244, 707 (1989) and Science, 235, 1146 (1987)]. Дерегуляцію кінази EGF-R пов'язують із епідермоїдними пухлинами [Reiss, Μ., et al., Cancer Res., 51, 6254 (1991)], пухлинами молочної залози [Macias, Α., et. al., Anticancer Res , 7, 459 (1987)] пухлинами інших основних органів [Gullick, W. J., Brit. Med Bull., 47, 87 (1991)]. Внаслідок важливої ролі, що відіграють розрегульовані кінази рецепторів у патогенезі раку, останнім часом з'явилася безліч досліджень, спрямованих на розробку специфічних інгібіторів РТК (protein tyrosine kinases, протеїн-тирозинові кінази) як потенційних протипухлинних терапевтичних препаратів [деякі недавні огляди: Burke. Т. R., Drugs Future, 17, 119 (1992) and Chang, С J., Geahlen, R. L., J. Nat. Prod., 55, 1529 (1992)]. Сполуки згідно даного винаходу інгібують активність кіназ EGF-R і тому є корисними для лікування певних хворобливих станів, зокрема, рака, знижуючи, щонайменше частково, дерегуляцію зазначеного рецептора. Ген HER-2 (c-erbB-2, neu) кодує трансмембранний рецептор тирозинових кіназ 185кДа, що має часткову гомологію з іншими членами сімейства рецепторів фактору росту епідерміса [Shih, С., Padhy, L. С., Murray, Μ., et al. Transforming genes of carcinomas and neuroblastomas introduced into mouse fibroblasts, Nature, 290, 261-264 (1981)]. На даний момент відомо, що нормальні клітини людини експресують невелику конститутивн у кількість протеїну HER-2 у плазматичній мембрані. Припускають, що активування онкогена HER-2 викликає зв'язування ще не ідентифікованого ліганда фактора росту в комплекс рецептора HER-2, що призводить до гетеродимеризації, запуску каскаду сигналів росту і є вищою точкою активації генів. Більш конкретно, сімейство факторів росту епідермісу можна розділити на чотири групи, виходячи з їхньої специфічності зв'язування рецептора (HER-1, HER-2, HER-3 й HER-4). HER-2 є переважним партнером по гетеродимеризації для всіх інших рецепторів HER. Показано, що надсинтез HER-2 призводить до збільшення канцерогенності, інвазивності пухлини, підвищенню метастатичного потенціалу й зміні чутливості до гормональних й хіміотерапевтичних препаратів при дослідженні трансфекції в експериментальних моделях на клітинах і тваринах [Pegram, Μ. D., Finn, R S , Arzoo, K-., et al. The effect of HER-2/neu over expression on chemotherapeutic drug sensitivity in human breast and ovarian cells Oncogene, 15, 537-547 (1997)]. Повідомляється, що надхсинтез протеїну HER2 має місце приблизно в 30% інвазивного раку молочної залози людини, при цьому ампліфікацію гена HER-2 виявили в 95% і більше зразків зі надсинтезом протеїну HER-2 [Gebhardt, F., Zanker, К., Brandt, В. Differential expression of alternatively spliced c-erbB-2 mRNA in primary tumors, lymph node metastases, and bone marrow micro 5 85394 6 metastases from breast cancer patients Biochem. дності до дійсної заявки відрізняються від описаBiophys. Res. Commun., 247, 319-323 (1998)]. них у патенті 082 своєю здатністю діяти як У [патенті США 6,288,082 (патент 082), опубліефективні інгібітори HER-2. кованому 11 вересня 2001p.], описані заміщені Згідно даного винаходу запропоновано сполусполуки 3-цианхіноліну, які інгібують рецептор факу формули 1: ктора росту епідерміса (EGFR). Сполуки у відпові де: R1 являє собою галоген, R2 являє собою можливо заміщений піримідин, тіазол або можливо заміщене фенильне кільце, при цьому фенильне або піримідинове кільце може не мати замісника або мати один або два замісники, R3 являє собою -О- або -S-, В одному з варіантів реалізації сполуки згідно даного винаходу включають: (Е)-N-{4-[4-(бензилокси)-3-хлораніліно]-3-циано-7-етокси-6-хінолініл}-4-(диметиламіно)-2-бутенамід, 7 85394 8 (Е)-N-{4-[3-хлоро-4-(2-піридинілметокси)аніліно]-3-циано-7-етокси-6-хінолініл}-4-(диметиламіно)-2бутенамід, (Е)-N-(4-{3-хлоро-4-[(3-фторбензил)окси]аніліно}-3-циано-7-етокси-6-хінолініл)-4-(диметиламіно)-2бутенамід, (2Е)-N-(4-{[3-хлоро-4-(1,3-тіазол-2-ілсульфаніл)феніл]аміно}-3-циано-7-метокси-6-хінолініл)-4(диметиламіно)-2-бутенамід, (Е)-N-(4-{3-хлоро-4-[(4,6-диметил-2-піримідиніл)сульфаніл]анілін}-3-циано-7-етокси-6-хінолініл)-4(диметиламін)-2-бутенамід, 9 85394 10 ку, яєчник, підшлункову залозу, головний мозок, простату й легеню, які мають морфологію, не виявлену в більшості клітин ссавців. В одному з варіантів реалізації даний винахід забезпечує спосіб інгібірування неоплазми. Цей спосіб включає контактування клітини з кількістю сполуки, ефективною для зменшення або запобігання функціонування HER-2. Зазначена клітина може являти собою клітину ссавця й більш конкретно - клітину людини. Клітина може являти собою також бактеріальну клітину, наприклад, Ε coli. Клітина може включати, зокрема, але без обмеження, нейронну клітину, ендотеліальну клітину, гліальну клітину, мікрогліальну клітину, гладкий міоцит, соматичну клітину, клітину кісткового мозку, клітину печінки, кишкову клітину, зародкову клітину, міоцит, мононуклеарний фагоцит, пухлинну клітину, лимфоїдну клітину, мезангіальну клітину, ретина(Е)-N-{4-[3-хлор-4-(1,3-тіазол-2льну епітеліальну клітину, ретинальну судинну ілсульфаніл)аніліно]-3-циано-7-метокси-6клітину, гангліозну клітину або стовбурну клітину. хінолініл}-4-[(2-метоксиетил)(метил)аміно]-2Клітина може являти собою нормальну клітину, бутенамід, або їх фармацевтично прийнятні солі. активовану клітину, неопластичну клітину, патолоДалі наведено докладний опис експериментів гічну клітину або інфіковану клітину. для кращого розуміння винаходу, що, однак, жодВ іншому варіанті реалізації дійсний винахід ною мірою не обмежує даний винахід, область забезпечує спосіб лікування або запобігання утвоохоплення якого визначається прикладеною форрення неоплазми в ссавця. Відповідно до цього мулою винаходу. даний винахід забезпечує ссавця фармацевтичСполука згідно даного винаходу являють соним складом, що містить сполуки згідно даного бою деякі 3-цианхіноліни, що містять заміщення. винаходу в сполученні або в з'єднанні з фармацеНумерація систем ядер хіноліну й хіназоліна, завтично припустимим носієм. Сполуки згідно даного стосовувана в даній патентній заявці, показана в винаходу можна приймати окремо або в сполученнаведеній нижче формулі: ні з іншими терапевтично ефективними сполуками або терапевтичними засобами для лікування або запобігання утворення неоплазми. Сполуки можна вводити перорально, усередину уражених тканин, інтраперитонеально, за допомогою внутрішньом'язової або внутрішньовенної ін'єкції, інфузійно, за допомогою ліпосом, топічно, назально, анально, вагінально, сублінгвально, уретрально, трансдермально, інтратекально, а також через очі або вуха. Для забезпечення посліФармацевтично припустимі солі сполук згідно довного прийому сполуки згідно даного винаходу даного винаходу являють собою солі, отримані з переважно, щоб сполука відповідно до винаходу наступних органічних і неорганічних кислот: оцтомала форму стандартної дози. Придатні стандартвої, молочної, лимонної, винної, бурштинової, мані дозовані форми включають таблетки, капсули й леїнової, малонової, глюконової, соляної, бромиспорошки в пакетиках або флаконах. Такі стандарто-водневої, фосфорної, азотної, сірчаної, тні дозовані форми можуть містити від 0,1 до метансульфонової й аналогічних відомих припус300мг сполуки відповідно до винаходу й переважтимих кислот. но - від 2 до 100мг. Ще більш переважні стандартні У контексті даного винаходу "галоген" являє дозовані форми містять від 5 до 50мг сполуки згідсобою F, СІ, Br або І. но даного винаходу. Сполуки згідно даного винаУ даній заявці на винахід термін "заміщений" ходу можна приймати перорально з дозою приозначає приєднання метильної групи до атома близно від 0,01 до 100мг/кг або переважно - з вуглецю ароматичного кільця. дозою від 0,1 до 10мг/кг. Такі сполуки можна приСполуки згідно даного винаходу можуть містиймати від 1 до 6 разів у добу. звичайно - від 1 до 4 ти один або кілька асиметричних атомів вуглецю, у разів у добу. Ефективна доза буде відома фахівцих випадках сполуки даного винаходу включають цям у даній області техніки, вона залежить також окремі діастероміри, рацемати, а також їхні окремі від форми сполуки. Фахівець у даній області техніR- i S-енантиоміри. Деякі сполуки згідно даного ки може провести традиційні емпіричні тести на винаходу можуть містити одну або кілька подвійактивність, щоб визначити біоактивність сполуки в них зв'язків, у цих випадках сполуки згідно даного біологічних пробах і визначити таким чином веливинаходу включають всі можливі конфігураційні чину дози, що підлягає введенню. ізомери, а також суміші цих ізомерів Сполуки відповідно до винаходу можна пригоУ контексті даного винаходу "неоплазма" витувати зі звичайними компонентами, включаючи значається як клітини органа, обраного з групи, що наповнювач, агент, що сприяє дезінтеграції, речовключає молочну залозу, нирку, сечовий міхур, вину, що зв'язує , сприяє ковзанню, ароматизатор, порожнину рота, гортань, стравохід, обідкову киш 11 85394 12 барвник або носій. Носій може являти собою, наСполуку згідно даного винаходу можна достаприклад, розріджувач, аерозоль, топічний носій, вляти локально за допомогою капсули, що забезводяний розчин, неводний розчин або твердий печує вповільнене вивільнення сполуки протягом носій. Носій може являти собою полімер або зубну деякого періоду часу. Склади з регульованим або пасту. Носій у контексті дійсного винаходу включає вповільненим вивільненням включають препарати всі стандартні фармацевтично припустимі носії, в ліпофільних оболонках (наприклад, жирні кислозокрема, фосфатний забуферений соляний розти, воски, масла). чин, ацетатний забуферений соляний розчин, воЗгідно даного винаходу запропоновано також ду, емульсії, наприклад, масляно-водну емульсію сполуки для застосування в якості активного тераабо триглицеридну емульсію, різні типи зволожупевтичного засобу, що запобігає утворенню неовачів, таблетки, таблетки в оболонці й капсули. плазми. У випадку перорального або топічного ввеКрім того, згідно даного винаходу запропонодення такі сполуки можуть бути доставлені за дований спосіб лікування неоплазми людини, що помогою різних носіїв. Звичайно ці носії містять включає введення інфікованому індивідуумові наповнювачі, наприклад, крохмаль, молоко, цукор, ефективної дози сполуки або фармацевтичного деякі типи глини, желатин, стеаринову кислоту, складу відповідно до винаходу. тальк, рослинні жири або масла, камеді або глікоСполуки згідно даного винаходу можна одерлі. Конкретний носій варто вибирати, виходячи з жати, як показано на схемі 1, де R 1, R2 й R3 визнабажаного способу доставки, наприклад, фосфатчені вище. Аміногрупу сполуки 1 можна захистити ний забуферений соляний розчин (phosphate у вигляді амідної групи шляхом ацетилювання за buffered saline, PBS) може бути використаний для допомогою оцтового ангідриду в розчиннику, зоквнутрішньовенної або системної доставки, а росрема, в оцтовій кислоті. Гідроксильну груп у сполулинні жири. креми, мазі, притирання або гелі мож ки 2 можна алкілювати за допомогою бромистого на використати для топічної доставки. або йодистого алкілу, тозилату або мезилату з Сполуки згідно даного винаходу можуть довикористанням карбонату калію при нагріванні з ставлятися разом з придатнними розріджувачами, розчинником, зокрема, з ацетоном, при зворотноконсервантами, солюбілізаторами, емульгатораму стіканні. Нітрогрупу сполуки 3 можна відновити ми, ад'ювантами й/або носіями, корисними для за допомогою каталітичного гідрування з одерлікування або запобігання утворення неоплазми. жанням аніліну 4. що містить заміщення. НагріванТакі склади являють собою рідини, а також субліня сполуки 4 з реактивом 5 у розчиннику або без мовані або іншим способом висушені препарати й розчинника приводить до утворення проміжної включають розріджувачі з різним змістом буфера сполуки 6. У результаті нагрівання сполуки 6 зі (наприклад, Tris-HCI, ацетат, фосфат), рН та іонзворотним стіканням в інтенсивно киплячому розною силою, добавки, зокрема, альбуміни й желачиннику, зокрема, у Да утермі (Dowtherm), відбуватин для запобігання абсорбції до різних поверється циклізація з утворенням гідроксихіноліну 7. хонь, детергенти (наприклад, TWEEN 20, TWEEN Його можна хлорувати шляхом нагрівання в окси80, PLURONIC F68, солі жовчних кислот), солюбіхлориді фосфор у з одержанням хлорного похіднолізуючі агенти, (наприклад, гліцерин, поліетиленгго 8. При конденсації сполуки 8 з аніліном формуліцерин), антиоксиданти (наприклад, аскорбінова ли 9 у розчиннику, зокрема, в етанолі, зі зворотним кислота, метабісульфат натрію), консерванти (настіканням у присутності каталітичної кількості кисприклад, тимеросал, бензиловий спирт, параамілоти утвориться проміжна сполука 10, при цьому нобензойні кислоти), наповнювачі або модифікаацетатну гр уп у сполуки 10 можна видалити за дотори тонусу (наприклад, лактоза, манітол), помогою гідролізу в кислотному або лужному сековалентні придатки полімерів, зокрема, поліетиредовищі з наступною нейтралізацією для одерленгліколь, комплексоутоворення з металевими жання сполуки 11. Проміжну сполуку11 можна іонами або введення сполук в або на дисперсні ацилювати хлоридом 12 амінокислоти (у формі препарати гідрогелів або ліпосом, мікроемульсій, гідрохлоридної солі) з одержанням сполуки згідно міцел, одношарових або багатошарових везикул, даного винаходу формули 13. Для одержання гемолізованих еритроцитів або сферобластів. Такі сполук даного винаходу можуть бути також викосклади впливають на фізичний стан, розчинність, ристані способи одержання сполук, описані в [пастабільність, швидкість виділення in vivo і швидтенті США 6.288.082 i патентних заявках WOкість виведення in vivo сполуки або складу. Вибір 9633978 й WO-9633980, які включені в даний опис складів залежить від фізичних і хімічних властивояк посилання]. стей сполуки, придатної для лікування або запобігання утворення неоплазми. 13 85394 На додаток до вищеописаного способу є ряд патентних заявок, які описують способи, придатні для одержання сполук згідно даного винаходу. Хоча ці способи описують одержання певних хіназолінів, їх можна також використати для одержання 3-цианхінолінів, що містять відповідні заміщення, і вони включені в даний опис як посилання. Хімічні операції, описані в [патентній заявці WO9633980], можна використати для одержання проміжних сполук 3-цианхіноліну, застосовуваних у дійсному винаході, при цьому замісником у позиції 6 є група аміноалкілалкокси. Хімічні операції, описані в [патентній заявці WO-9633978], можна використати для одержання проміжних сполук 3цианхіноліну, застосовуваних у дійсному винаході, при цьому замінником у позиції 6 є аміноалкіламіногрупа. Приклад 1 (Е)-N-{4-[4-(бензилокси)-3-хлоранілін]-3-циан7-етокси-6-хінолініл}-4-(диметиламін)-2-бутенамід Порцію оксалилхлориду 1,74мол (2,54г, 0,02моль) додали до 3,31г (0,02моль) гідрохлориду (Е)-4-(диметиламін)-2-бутенової кислоти в 75мол ацетонітрилу. Потім додали невелику краплю диметилформаміду. Реакційну суміш нагріли й перемішали на масляній лазні при 63° протягом 20 хвилинз одержанням жовтогарячого розчину. Цей розчин сконцентрували у вакуумі без нагрівання приблизно до половини його первинного об'єму. Розчин остудили на крижаній лазні й додали розчин 4,45г (0,01моль) 6-амін-4-[4-(бензилокси)-3хлоранілін]-7-етокси-3-хінолінкарбонітрилу в 50мол N-метилпіролідону. Реакційну суміш остудили й перемішали протягом 2 годин. Потім реакційну суміш перелили в 100мл насиченого водяного розчину бікарбонату натрію в льоді. При витримці смолистий осад, що утворився, затвер 14 дів, і тверду фазу відфільтрували. Провели хроматографію цієї твердої фази на силікагелі. Колонку промили 3 літрами суміші метанол:етилацетат 1:19, а потім елюювали продукт 3 літрами суміші триетиламін:метанол:етилацетат 1:5:94. У результаті концентрування елюату утворився осад, який відфільтрували з одержанням 2,96г сполуки, зазначеної в заголовку. З фільтрату одержали додатково 1,0г продукту. Сумарний вихід: 3,96г. Приклад 2 (Е)-N-{4-[3-хлор-4-(2-піридинілметокси)анілін]3-циан-7-етокси-6-хінолініл}-4-(диметиламін)-2бутенамід Розчин гідрохлориду (Е)-4-(диметиламін)-2бутенової кислоти в 1,2л тетрагідрофурану (тeтpahydrofuran, THF) і каталітичну кількість диметилформаміду (dimethylformamide, DMF) (1,2мл) остудили до 0-5°С. Додали по краплях оксалилхлорид (0,95екв.), нагріли суміш до 25-30°С i перемішали протягом 2 годин. За допомогою високоефективної рідинної хроматографії (ВЕРХ) перевірили жовтогарячу суспензію, що утворилася, на повноту витрати оксалилхлориду, а потім остудили до 0-5°С. Розчин 111г 4-[4-(2піридилметокси)-3-хлор]амін-6-амін-3-циан-7етоксихіноліну в 1,47л 1-метил-2-піролідинону додали по краплях і перемішували суміш доти, поки в суміші не залишилося £1,0% вихідного аніліну (316 годин). Погасили реакцію водою й нагріли суміш до 40°С. Водний гідроксид натрію додали до одержання рН 10-11. Осад, що утворився, відфільтрували в гарячому стані й промили водою. Вологий осад нагріли до зворотного стікання (70-75°С) у складі ацетонітрил:ТНF (1,5:1), а потім остудили розчин протягом 3 годин до кімнатної температури. Продукт профільтрували й промили складом ацетонітрил:TNF. Потім продукт висушили (50°C, 15 85394 16 10мм рт. ст., 24 години) з одержанням виходу 80за допомогою фільтрації й промили ізопропано85%. Температура плавлення солі малеїнової кислом, а потім диетиловим ефіром, одержавши 7,26г лоти 178-183°С. неочищеного продукту у формі гідрохлоридної Приклад 3 солі. Цей матеріал очистили за допомогою хрома(Е)-N-(4-{3-хлор-4-[(3-фторбензил)окси]анілін}тографії вільної основи на силікагелі шляхом 3-циан-7-етокси-6-хінолініл)-4-(диметиламін)-2елюювання складом метанол:метиленхлорид 1:39. бутенамід Приклад 7 Розчин 108г гідрохлориду (Е)-4-(диметиламін)6-амін-4-[4-(бензилокси)-3-хлоранілін]-72-бутенової кислоти в 1,1л тетрагідрофурану етокси-3-хінолінкарбонітріл (THF) і каталітичну кількість диметил-формаміду Розчин 298мг (0,612ммоль) очищеного N-{4-[4(DMF) (1,2мл) остудили до 0-5°. Додали по крап(бензилокси)-3-хлоранілін]-3-циан-7-етокси-6лях оксалилхлорид (0,95екв.), суміш нагріли до 25хінолініл}ацетаміду (приклад 6) і 97мг (1,73ммоль) 30°С і перемішали протягом 2 годин. Жовтогарячу гідроксиду калію в 10мл метанолу перемішали й суспензію перевірили на повноту витрати оксалинагрівали при зворотному стіканні протягом 60 лхлориду за допомогою ВЕРХ, а потім остудили годин. При охолодженні утворився осад. Цю суміш до 0-5°С. Розчин 150г 6-амін-4-[3-хлор-4-(3вилили на лід й осад, що утворився, відфільтрувафторбензилокси)]анілін-3-циан-7-етоксихіноліну в ли й промили водою. Після сушіння одержали 1,5л 1-метил-2-піролідинону додали по краплях i 242мг сполуки, зазначеної в заголовку. перемішували суміш доти, поки не залишилося Приклад 8 2-ацетамід-5-нітрофенол £1,0% вихідного аніліну (3-16 годин). Реакцію поДо 400г 2-амін-5-нітрофенолу, що знаходиться гасили водою, і нагріли суміш до 40°С. Додали в 5-літровій колбі з декількома горлечками, оснаводний гідроксид натрію (101г в 750мл), щоб довести рН до 10-11. Отриманий осад відфільтрували щеній механічною мішалкою, дефлегматором, отвором для введення азоту, лійкою ємністю в гарячому стані й промили водою. Вологий осад 500мл для додаткового введення компонентів, нагріли до зворотного стікання (70-75°С) у складі колбонагрівачем і термопарою, підключеною до ацетонітрил:THF (1,5:1). терморегулятора, додали 1,6л оцтової кислоти. Приклад 4 4-бензилокси-3-хлорнітробензол Суміш перемішали при 60°С, додаючи 398г оцтового ангідриду протягом 1,5 годин. Одну годину по Порцію 15,43г (0,275моль) твердого (гранули) тому, додали ще 37г оцтового ангідриду. Ще через гідроксиду калію додали в розчин 43,89г 1 годину суміш остудили й розбавили 2л води. (0,25моль) 3-хлор-4-фторнітробензолу та 32,34мл Осад відокремили фільтрацією й промили водою й (33,79г, 0,373моль) бензилового спирту в 220мл ацетонітрилу. Реакційну суміш інтенсивно перемігептаном. Потім осад висушили у вакуумній печі, одержавши 509г сполуки, зазначеної в заголовку. шували механічною мішалкою протягом ночі. Приклад 9 Осад, що утворився, відфільтрували. Концентру4-ацетамід-3-етоксинітробензол вання фільтрату дало другу порцію, яку також До 400г 2-ацетамід-5-нітрофенолу, що міспрофільтрували. Після витримки із цього фільтрату також утворився осад. Цю суміш обробили диетиться в 12-літровій колбі з 4 горлечками, оснащеній дефлегматором, отвором для введення азоту тиловим ефіром й відфільтрували осад. Всі осади термопарою, лійкою для додаткового введення ретельно промили водою й об'єднали, одержавши компонентів i механічною мішалкою, додали 790г 49,71г сполуки, зазначеної в заголовку. карбонату калію та 2,0л диметилформаміду. СуПриклад 5 4-бензилокси-3-хлорфеніламін міш перемішали при 60°С, додаючи 294г бромистого етилу протягом 30 хвилин. Через одну годину, Суміш 6,59г (0,025моль) 4-бензилокси-3додали ще 27г бромистого етилу й перемішували хлорнітробензолу (приклад 4), 4,19г (0,075моль) суміш при 60°С протягом наступної години. Потім залізного порошку, i 12,04г (0,225моль) хлориду суміш остудили до кімнатної температури й вилиамонію в 100мл етанолу й 25мл води механічно перемішали й нагрівали при зворотному стіканні ли в 4л води. Через 30 хвилин відокремили продукт фільтрацією й промили водою й гептаном. протягом півгодини. Реакційну суміш витримали Продукт висушили у вакуумній печі при 60°С одедля охолодження й перемішали протягом однієї ржавши 457г сполуки, зазначеної в заголовку. години. Потім суміш профільтрували й осад проПриклад 10 мили етанолом. Об'єднані фільтрати висушили у вакуумі. Отриманий осад розчинили в метиленСкладний етиловій ефір 3-(4-ацетамід-3етоксианілін)-2-цианакриловоі кислоти хлориді й пропустили через магнезол. Після видаСуспензію сполуки 4-ацетамід-3лення розчинника з фільтрату у вакуумі одержали етоксинітробензолу в тетра-гідрофурані (10 час5,60г сполуки, зазначеної в заголовку. тин) відновили до анілінової похідної за допомоПриклад 6 N-{4-[4-(бензилокси)-3-хлоранілін]-3-циан-7гою вологого 10% Pd/C під тиском водню 50 фунтів на квадратний дюйм (близько 3,5бар) при 30°С етокси-6-хінолініл}ацетамід протягом 2 годин. Отриманий розчин профільтруСуміш 4,17г (0,0149моль) N-(4-хлор-3-циан-7вали й сконцентрували до 2 частин тетрагідрофуетокси-6-хінолініл)-ацетаміду, 4,04г (0,0173моль) рану. Концентрат розбавили толуолом i провели 4-бензилокси-3-хлорфеніламіну (приклад 5) і 2,0г (0,017моль) піридинхлориду в 85мл ізопропанолу його реакцію з етил(етoксиметилен)ціан ацетатом що випускається серійно при нагріванні зі зворотперемішали й нагріли при зворотному стіканні на ним стіканямм протягом 16 годин. Після закінчення масляній лазні протягом 30 хвилин. Реакційну суреакції суміш остудили. Осаджений продукт відоміш остудили на крижаній лазні, відокремили осад 17 85394 18 кремили фільтрацією, промили й висушили. Провідокремили й промили водою. Потім органічний дукт мав ви хід 90%. шар випарили й замінили 3,8л етанолу. Додали 4Приклад 11 хлоро-3-циан-7-етокси-6-N-ацетиламін-хінолін з 3-циан-7-етокси-4-гідрокси-6-N-ацетилхінолін каталітичною кількістю метансульфонової кислоти Розчин 210г складного етилового ефіру 3-(4й нагрівали суміш при 70-75°С не менше 2 годин ацетамід-3-етоксіанілін)-2-цианакрилової кислоти до закінчення реакції. Додали 1,69л концентровав 12л даутерму перемішали в атмосфері азоту при ної НСІ при 70-75°С і витримали не менше 2 годин 250°С протягом 15-20 годин. Суміш остудили до до закінчення гідролізу. Додали воду й остудили кімнатної температури й осад відокремили фільтсуміш до 40°С, осад відокремили й промили ворацією. Осад промили толуолом і змішали з 1,2л дою. Вологий осад суспендували в 5,4л метанолу, тетрагідрофурану. Суміш нагріли при зворотному додали 10% водний карбонат калію (315г в 2,8л стіканні протягом 30 хвилин, а потім остудили до води) і перемішали суміш протягом 2,5 годин. Покімнатної температури. Осад відокремили й протім суміш профільтрували й промили складом мемили тетрагідрофураном. Після сушіння одержали танол:вода 1:1. Продукт висушили (50°С, 10мм рт. 179,4г сполуки, зазначеної в заголовку. ст., 24 години), одержавши вихід сполуки, зазнаПриклад 12 ченої в заголовку, 80-90%. 4-хлоро-3-циан-7-етокси-6-нітрохінолін Приклад 16 Перемішану суміш 300г 3-циан-7-етокси-46-амін-4-(4-(2-піридилметокси)-3-хлор)анілін-3гідрокси-6-N-ацетил-хіноліну в 2,53л 1,2циан-7-етоксихинолін диетоксиетану нагріли до 80-85°С. У суміш протяВищевказану сполуку одержали з3-хлор-4-(2гом 30-40 хвилин додали 224мл оксихлориду фопіридилметокси)-нітробензолу й 4-хлор-3-циан-7сфору. С уміш перемішали при 80-85°С протягом 2етокси-6-N-ацетиламінхіноліну способом, описа4 годин. Потім суміш остудили, профільтрували ним у прикладі 15. через целітну прокладку й промили 1,2Приклад 20 диетоксіетаном. Фільтрати протягом 1,5 годин до4-диметил-бут-2-еnоіс acid [4-(3-хлор-4дали в охолоджений (0-10°С) розчин карбонату фтор феніламін)-3-циан-7-етокси-хінолін-6-іл]-амід калію (537г в 1,5л води). Отриману жовту суміш перемішали протягом не менше 12 годин. Суміш профільтрували й промили гарячою водою. Осади висушили (50°С, 10мм рт. ст., 24 години), одержавши ви хід сполуки, зазначеної в заголовку, 3050%. Матеріал використали безпосередньо на наступній стадії. Приклад 13 3-хлоро-4-(2-піридилметокси)нітробензол Суміш 160г гідроксиду калію й 2піридилкарбінола в 8л ацетонітрила перемішали протягом 20-30 хвилин. Додали 400г 3-хлор-4фтор-нітробензолу й перемішали суміш при 40°С не менш 18 годин до закінчення реакції. Додали Приклад 21 воду, відфільтрували жовтий осад, що утворився, і N-{4-[3-хлоро-4-(1-метил-1Н-імідазол-2промили водою. Продукт висушили (40-50°С, 10мм ілсульфаніл)-феніламін]-3-циан-хінолін-6-іл}рт ст , 24 години), одержавши вихід 85-95%. акриламід Приклад 14 3-хлоро-4-(3-фторбензилокси)нітробензол Дану сполуку одержали з 3-хлор-4фторнітробензолу й 3-фтор-бензилового спирту способом, описаним у прикладі 13. Приклад 15 6-амін-4-(3-хлор-4-(3-фторбензилокси))анілін3-циан-7-етоксихінолін У суміш 400г 3-хлор-4-(3фторбензилокси)нітробензолу (приклад 14) і 464г цинкового пилу в 4л етанола при 40-50°С додали водний хлорид амонію (152г в 800мл води). Після перемішування протягом не менше 2 годин реакПриклад 22 ційну суміш профільтрували в гарячому стані че6,7-ді-4-(1Н-іndоІ-6-іламін)-хінолін-3рез целітну прокладку й промили гарячим етанокарбонітрил лом. Фільтрат випарили й додали 1,72л 2-метилTNF, води й соляного розчину. Органічний шар 19 Приклад 23 4-(2,3-дигідробензо[1,4]діоксин-6-іламін)-6,7диетоксі-хінолін-3-карбонітрил Приклад 24 4-(1Н-індазол-6-іламін)-6,7-біс-(2-метоксиетокси)-хінолін-3-карбонітрил Приклад 25 4-(1,4-діоксо-1,2,3,4-тетрагідрофталазін-6іламін)-6,7-диетокси-хінолін-3-карбонітрил 85394 20 Приклад 26 6,7-ді-4-(індан-5-іламін)-хінолін-3-карбонітрил Приклад 27 4-(2,4-диоксо-1,4-дигідро-2Нбензо[d][1,3]оксазин-6-іламін)-6,7-діетокси-хінолін3-карбонітрил Приклад 28 6,7-ди-4-(1-оксоіндан-5-іламін)-хінолін-3карбонітрил 21 Приклад 29 6,7-ді-4-(3-оксо1,3-дигідро-ізобензофуран-5іламін)-хінолін-3-карбонітрил 85394 22 Приклад 32 6-етокси-4-(1Н-індазол-6-іламін)-7-метоксіхінолін-3-карбонітрил Приклад 33 6,7-ді-4-(1-метил-2,5-диоксо-2,3,4,5-тетрагідро1Н-бензо[е][1,4]диазепін-7-іламін)-хінолін-3карбонітрил Приклад 30 4-(1,1-диоксо-1Н-1-бензо[b]тиофен-6-іламін)6,7-диетокси-хінолін-3-карбонітрил Приклад 34 4-(1Н-індазол-6-іламін)-6-метокси-7-(3морфолін-4-іл-пропокси)-хінолін-3-карбонітрил Приклад 31 7-етокси-4-(1Н-індазол-6-іламін)-6-метоксихінолін-3-карбонітрил 23 85394 24 Приклад 38 4-{[3-хлор-4-(1,3-тіазол-2ілсульфаніл)феніл]амін}-7-метокси-6-нітро-3хінолінкарбонітрил Приклад 35 4-({3-хлор-4-[(1-метил-1Н-імідазол-2іл)сульфаніл]феніл}амін)-7-метоксі-6-нитро-3хіолінкарбонітрил Приклад 39 6-амін-4-{[3-хлор-4-(1,3-тіазол-2ілсульфаніл)феніл]амін}-7-метокси-3хінолінкарбонітрил Приклад 36 6-амін-4-({3-хлор-4-[(1-метил-1Н-імідазол-2іл)сульфаніл]феніл}амін)-7-метокси-3хінолінкарбонітрил Приклад 37 (2Е)-N-[4-({3-хлор-4-[(1-метил-1Н-імідазол-2іл)сульфаніл]феніл}амін)-3-циан-7-метокси-6хінолініл]-4-(диметиламін)-2-бутенамід Приклад 40 (2Е)-N-(4-{[3-хлор-4-(1,3-тіазол-2ілсульфаніл)феніл]амін}-3-циан-7-метокси-6хінолиніл)-4-(диметиламін)-2-бутенамід 25 Приклад 41 4-[3-хлор-4-(1Н-імідазол-1-іл)анілін]-7-метоксі6-нітро-3-ідазол-1-іл)анілін]-7-метокси-6-нітро-3хінолінкарбонітрил 85394 26 Приклад 44 4-{3-хлор-4-[(4-оксоЗ,4-дигідро-2хіназолініл)сульфаніл]анілін}-7-метокси-6-гідро-2хіназолиніл)сульфаніл]анілін}-7-метокси-6-нітро-3хінолинкарбонітрил Приклад 45 6-амін-4-{3-хлор-4-[(4-оксоЗ,4-дигідро-2хіназолиніл)сульфаніл]анілін}-7-3,4-дигідро-2хіназолиніл)сульфаніл]анілін}-7-метокси-3хінолинкарбонітрил Приклад 42 6-амін-4-[3-хлор-4-(1Н-імідазол-1-іл)анілін]-7метокси-3-4-(1Н-імідазол-1-іл)анілін]-7-метокси-3хінолінкарбонітрил Приклад 46 (Е)-N-(4-{3-хлор-4-[(4-оксоЗ,4-дигідро-2хіназолиніл)сульфаніл]анілін}-3-фаніл]анілін}-3циан-7-метокси-6-хінолиніл)-4-(диметиламін)-2бутенамід Приклад 43 (Е)-N-{4-[3-хлор-4-(1Н-імідазол-1-іл)анілін]-3циан-7-метокси-6-хінолиніл}-аzoІ-1-іл)анілін]-4(диметиламін)-2-)анілін-2-бутенамід Приклад 47 (Е)-N-(4-{4-[ацетил(3-піридинілметил)амін]-3хлоранілін}-3-циан-7-метокси-]-3-хлоранілін}-3циан-7-метокси-6-хінолініл)-4-(діметиламін)-2анілін}-3-циан-7-метокси-6-хінолиніл)-4(диметиламін)-2-бутенамід 27 85394 28 Приклад 48 N-{2-хлор-4-[(3-циан-7-метокси-6-нітро-4хінолиніл)амін]феніл}-N-(3-7-метокси-6-нітро-4хінолиніл)амін]феніл}-N-(3піридинілметил)ацетамід Приклад 52 4-(3-хлор-4-{[5-(трифторметил)-1,3,4-тіадіазол2-іл]амін}анілін)-7-етокси-6-нітро-3хінолінкарбонітрил Приклад 49 N-{4-[(6-амін-3-циан-7-метокси-4хінолиніл)амін]-2-хлорфеніл}-N-(3--метокси-4хінолиніл)амін]-2-хлорфеніл}-N-(3піридинілметил)ацетамід Приклад 50 N-(4-{[6-(ацетиламін)-3-циан-7-метокси-4хінолиніл]амін}-2-хлорфеніл)-N-аnо-7-метокси-4хінолиніл]амін}-2-хлорфеніл)-N-(3піридинілметил)ацетамід Приклад 51 4-{3-хлор-4-[(1-метил-1Н-iмiдазол-2ил)сульфаніл]анілін}-6-метокси-7-[3-(4морфолиніл)пропокси]-3-хінолинкарбонітрил Приклад 53 (Е)-N-[4-(3-хлор-4-{[5-(трифторметил)-1,3,4тіадіазол-2-іл]амін}анілін)-3-циан-7-етокси-6хінолиніл]-4-(диметиламін)-2-бутенамід Приклад 54 4-[3-хлор-4-(4-піридинілокси)анілін]-7-етокси-6нітро-3-хінолінкарбонітрил 29 Приклад 55 6-амін-4-[3-хлор-4-(4-піридинілокси)анілін]-7етокси-3-хінолінкарбонітрил 85394 30 Приклад 58 (Е)-N-(4-{3-хлор-4-[(4-феніл-1,3-тіазол-2іл)сульфаніл]анілін}-3-циан-7-метокси-6хінолиніл)-4-(діметиламін)-2-бутенамід Приклад 59 6-амін-4-(3-хлор-4-{[5-(трифторметил)-1,3,4тіадіазол-2-іл]амін}анілін)-7-етокси-3хінолинкарбонітрил Приклад 56 (Е)-N-{4-[3-хлор-4-(4-піридинілокси)анілін]-3циан-7-етокси-6-хінолиніл}-4-(діметиламін)-2бутенамід Приклад 57 4-{3-хлор-4-[(3-піридинілметил)амін]анілін}-7метокси-6-нітро-3-хінолінкарбонітрил Приклад 60 4-[3-хлор-4-(1Н-імідазол-1-ілметил)анілін]-7етокси-6-нітро-3-хінолинкарбонітрил 31 Приклад 61 6-амін-4-[3-хлор-4-(1Н-імідазол-1ілметил)анілін]-7-етокси-3-хінолинкарбонітрил Приклад 62 (Е)-N-{4-[3-хлор-4-(1Н-імідазол-1ілметил)анілін]-3-циан-7-етокси-6-хінолиніл}-4(диметиламін)-2-бутенамід 85394 32 Приклад 64 6-амін-4-{3-хлор-4-[(4-метил-2піримідиніл)сульфаніл]анілін}-7-етокси-3хінолинкарбонітрил Приклад 65 (Е)-N-(4-{3-хлор-4-[(4-метил-2піримідиніл)сульфаніл]анілін}-3-циан-7-етокси-6хенолініл)-4-(діметиламін)-2-бутенамід Приклад 66 (Е)-N-(4-{3-хлор-4-[(4,6-диметил-2піримідиніл)сульфаніл]анілін}-3-циан-7-етокси-6хінолиніл)-4-(діметиламін)-2-бутенамід Приклад 67 7-етокси-6-нітро-4-[4-[(4-феніл-1,3-тіазол-2іл)сульфаніл]-3-(трифторметил)анілін]-3хінолинкарбонітрил Приклад 63 4-{3-хлор-4-[(4-метил-2піримідиніл)сульфаніл]анілін}-7-етокси-6-нітро-3хінолинкарбонітрил 33 85394 34 Приклад 68 (Е)-N-{4-[3-хлор-4-(1,3-тіазол-26-амін-7-етоксі-4-[4-(4-феніл-тіазол-2ілсульфаніл)анілін]-3-циан-7-метокси-6-хінолиніл}ілсульфаніл)-3-трифторметил-феніламін]-хінолін4-[(2-метоксиетил)(метил)амін]-2-бутенамід 3-карбонітрил Приклад 69 (Е)-N-{3-циан-7-етокси-4-[4-[(4-феніл-1,3тіазол-2-іл)сульфаніл]-3-(трифторметил)анілін]-6хінолініл}-4-(диметиламін)-2-бутенамід Приклад 70 (Е)-N-(4-{3-хлор-4-[(5-феніл-1,3-тіазол-2іл)сульфаніл]анілін}-3-циан-7-метокси-6хінолиніл)-4-(диметиламін)-2-бутенамід Приклад 71 Одержали (Е)-N-{4-[3-хлор-4-(1,3-тіазол-2ілсульфаніл)анілін]-3-циан-7-метокси-6-хінолиніл}4-[(2-метоксиетил)(метил)амін]-2-бутенамід шляхом додавання по краплях 3,43г (18,71ммоль, 1,95мл) 4-бромкротонилхлориду в 12мл THF протягом 45хв при перемішуванні в розчин 4,7г (10,69ммоль) 6-амін-4-[3-хлор-4-(тіазол-2ілсульфаніл)-феніламін]-7-метокси-хінолін-3карбонітрілу в 588 мл THF, що містить 3,73 мл (21,36ммоль) диізопропилетиламіну, при 0°С в атмосфері азоту. У результаті реакції утворилася суміш {4-[3-хлор-4-(тіазол-2-ілсульфаніл)феніламін]-3-циан-7-метокси-хінолін-6-іл}-амід 4бром-(1-хлор)-бет-2-енової кислоти. Порцію розчину 300мл остудили до 0°С і додали по краплях 2,38г (26,7ммоль) (2-метоксіетил)-метиламіну в 11мл THF. Після нагрівання реакційної суміші до кімнатної температури додали 401мг (0,5екв.) йодиду натрію й перемішали розчин протягом ночі. Розчинники випарили з утворенням червоного смолистого осаду, що розділився між EtOAc і насиченим NaHCO3. Після витримки протягом ночі шари розділили, а органічний шар висушили й випарили. У результаті хроматографії осаду в короткому стовпчику із силікагелем 60 при елююванні EtOAc, потім EtOAc/15% МеОН й, нарешті, EtOAc/15% МеОН/1% Et3N одержали 1,3г продукту (вихід 41%) у формі жовтого склоподібного матеріалу; мас-спектрометрія високого вирішення (іонізація електророзпилюванням): m/z 595,13338 (М)+1, D=-2,28 тисячних часток атомної одиниці маси. Приклад72 (Е)-N-(4-{3-хлор-4-[(4-феніл-1,3-тіазол-2іл)сульфаніл]анілін}-3-циан-7-етокси-6-хінолиніл)4-(диметиламін)-2-бутенамід 35 Приклад 73 4-{3-хлор-4-[(1-метил-1Н-імидазол-2іл)сульфаніл]анілін}-6-метокси-7-[3-(1Н-1,2,3triazol-1-іл)пропокси]-3-хінолінкарбонітрил Приклад 74 4-{3-хлор-4-[(4,6-диметил-2піримідиніл)сульфаніл]анілін}-7-етокси-6-нітро-3хінолінкарбонітрил 85394 36 Були проведені дослідження типових сполук згідно даного винаходу відповідно до декількох стандартних фармакологічних методик, результати яких показали, що сполуки згідно даного винаходу мають значну активність як інгібітори HER-2 й є антипроліферативними агентами. Відповідно до отриманих результатів, активність, виявлена при стандартних фармакологічних випробуваннях, дозволяє зробити висновок про те, що сполуки згідно даного винаходу є корисними в якості антибластомних засобів. Методики проведених випробувань й отриманих результатів представлені нижче. Дослідження кіназної активності: сполуки із приклада 1, приклада 2 і приклада 3 є сильнодіючими інгібіторами ферменту HER-2, сполука із приклада 20 - не є такою. Очищений рекомбінантний 3-кінцевий фрагмент кожного ферменту інкубували з ATP (adenosine triphosphate, аденозинтрифосфат) під час відсутності сполуки або в заданому діапазоні концентрацій відповідної сполуки. Аутофосфорилювання рецепторів оцінювали з фосфотирозиновими антитілами у форматі ELISA (твердофазний імуноферментний аналіз). У безклітинному аналізі аутофосфорилювання з використанням рекомбінантного цитоплазматичного домена HER- 2 всі три інгібітори зменшували активність ферменту на 50% (ІС50) при концентраціях у межах 33-65нМ (таблиця 1). Таблиця 1 Приклад 75 6-амін-4-{3-хлор-4-[(4,6-диметил-2піримідиніл)сульфаніл]анілін}-7-етокси-3хінолінкарбонітрил Приклад 76 (2Е)-N-{4-[3-хлор-4-(2-тіенілметоксі)анілін]-3циан-7-етокси-6-хінолиніл}-4-(диметиламін)-2бутенамід Сполука Приклад 1 Приклад 2 Приклад 3 Приклад 20 Фермент ІС50 (мкг/мл) HER-2 EGFR 0,036 0,028 0,033 0,051 0,019 0,019 0,58 0,02 Вони також інгібували EGFR при аналогічних умовах аналізу при концентрації 33-92нМ. Дослідження проліферації клітин: сполуки з прикладу 1, прикладу 2 і прикладу 3 придушували проліферацію фібробластичної клітинної лінії в мишей, трансфікованих онкогеном HER-2 (3T3/neu), на 50% (IC50) при 3-5нМ (таблиця 2). Це значення істотно нижче, ніж величина, отримана для ізогенних не трансфікованих клітин (3T3, IC50 683-906нМ), що вказує на високий ступінь селективності для даного онкогенного шляху. Клітини інкубували з різними концентраціями сполук протягом 2 діб (6 діб для клітин ВТ474). Виживання клітин визначали за допомогою аналізу зв'язування барвника протеїном (SRB), [Rubinstein LV, Shoemaker RH, Paull KD, Simon RM, Tosini S, Skehan P, Scudiero DA, Monks , Boyd MR. Comparison of в vitro anticancer-drug-screening data generated with tetrazolium assay versus protein assay against diverse panel of human tumor cell lines. J. Natl. Cancer Inst. 82(13):1113-8, 1990, Skehan P, Storeng R, Scudiero D, Monks, McMahon J, Vistica D, Warren JT, Bokesch H, Kenney S, Bo yd MR. New colorimetric cytotoxicity assay for anticancer-drug screening. J. Natl. Cancer Inst. 82(13): 1107-12, 1990]. 37 85394 38 Показана концентрація препарату (нМ), яка інменш активними в 20 клітинах MDA-MB-435 й гібує активність ферменту або проліферацію кліSW620 (клітинні лінії раку молочної залози й раку тин на 50%. Три інгібітори інгібували також дві інобідкової кишки, відповідно), тобто EGFR- і HER-2ших клітинних лінії раку молочної залози, що негативні. Сполуки придушували клітинну лінію забезпечують надсинтез HER-2, а саме, SK-Br-3 й епидермальної карциноми А431, що забезпечує ВТ474 (IC50 2-4нМ), однак, вони були набагато надсинтез EGFR (ІС50 81-120нМ) (таблиця 2). Таблиця 5 Клітинна ІС 50 (мкг/мл) EGFR Неr-2 Сполука Приклад 1 Приклад 2 Приклад 3 Приклад 20 Приклад 21 Приклад 22 Приклад 23 Приклад 24 Приклад 25 Приклад 26 Приклад 27 Приклад 28 Приклад 29 Приклад 30 Приклад 31 Приклад 32 Приклад 33 Приклад 34 Приклад 35 Приклад 36 Приклад 37 Приклад 38 Приклад 39 Приклад 40 Приклад 41 Приклад 42 Приклад 43 Приклад 44 Приклад 45 Приклад 46 Приклад 47 Приклад 48 Приклад 49 Приклад 50 Приклад 51 Приклад 52 Приклад 53 Приклад 54 Приклад 55 Приклад 56 Приклад 57 Приклад 58 Приклад 59 Приклад 60 Приклад 61 Приклад 62 Приклад 63 3T3 0,38 0,39 0,52 0,26 +++ 3T3/NEU 0,0029 0,0018 0,0023 0,0230 0,463 0,933 0,375 >5 >5 0,0198 4,616 0,0311 3,301 0,251 0,0267 4,801 >5 >5 4,09 1,06 0,02 0,262 0,333 0,002 1,09 0,53 1,46 4,54 1,88 0,15 >5 1,79 2,4 >5 0,196 1,89 0,89 >5 >5 >5 4,03 0,028 >5 >5 >5 0,99 1,49 +++ + А431 0,062 0,045 0,069 0,030 0,62 0,123 0,27 1,961 >5 0,342 >5 0,0181 >5 0,257 0,0368 0,786 >5 >5 2,88 3,04 0,02 0,148 0,663 0,017 1,79 1,63 0,51 2,28 1,22 0,34 0,646 1,6 >5 3,68 0,775 1,79 0,728 >5 >5 3,27 1,6 0,162 >5 >5 >5 0,95 1,2 +++ SKBr3 0,0015 0,001 0,0015 0,0071 0,01 0,0374 0,281 >5 >5 0,294 >5 0,0281 >5 0,336 0,022 2,094 >5 >5 0,669 0,011 0,0004 0,124 0,236 0,0007 1,48 1,73 0,32 4,54 2,15 0,06 >5 0,68 3,41 3,94 0,32 1,22 0,179 >5 >5 1,51 0,726 0,005 0,551 2,44 0,75 0,045 0,45 + +++ ВТ474 0,0014 0,0013 0,0024 0,020 І MD A-MB-435 0,47 0,44 0,51 0,34 4,57 0,365 0,235 2,045 >5 0,352 >5 0,028 3,404 0,00328 0,0359 2,626 >5 >5 1 0,39 0,43 0,35 0,65 0,33 0,95 1,27 0,57 >5 4,58 >5 1,16 2,61 3,76 >5 1,84 0,95 2,54 1,61 2,06 1,87 0,23 0,91 >5 >5 2,1 1,3 SW620 0,24 0,44 0,29 0,32 1,84 0,286 0,411 >5 >5 0,294 2,922 0,0244 1,565 0,146 0,0212 4,313 >5 >5 1,55 3,16 0,43 0,15 0,55 1,13 1,66 5,99 1,45 1,96 4,66 >5 1,64 2,57 >5 >5 2,18 2,54 1,05 >5 >5 >5 3,21 0,57 1,38 >5 >5 3,8 0,9 39 85394 40 Продовження таблиці 5 1 Приклад 64 Приклад 65 Приклад 66 Приклад 67 Приклад 68 Приклад 69 Приклад 70 Приклад 71 Приклад 72 Приклад 73 Приклад 74 Приклад 75 Приклад 76 2 0,41 3 3,03 0,003 0,01 0,68 2,52 0,42 0,12 0,002 0,02 0,973 >5 2,12 0,0039 4 1,53 0,12 0,24 0,76 >5 0,3 0,22 0,03 0,24 1,83 >5 0,76 0,066 Фосфорилювання рецептора: сполуки, які придушували проліферацію фібробластичної клітинної лінії в мишей, трансфікованих онкогеном HER-2 (3T3/neu) на 50% (ІС50)5 0,01 0,002 0,006 0,104 >5 0,98 0,004 6 0,003 7 1,8 0,3 0,2 0,4 2,5 0,3 0,08 0,09 0,18 4,1 1,3 0,77 8 2 0,2 0,32 0,4 3,1 0,6 0,5 0,4 0,54 3,69 >5 1,36 0,25 розростання цих пухлин. Сполуки наготовлювали в складі 0,5% Methocel - 0,4%полісорбат-80 (Tween-80) і вводили щодоби перорально через шлунковий зонд. Масу п ухлини [(LxW2)/2] визначали один раз у сім днів. Статистичну 5 значимість впливу сполуки оцінювали за допомогою перевірки за критерієм Стьюдента. Активність сполуки з прикладу 3 спочатку оцінили на трансплантатах клітин 3T3/neu, при цьому сполука з прикладу 3 інгібувала ріст пухлини при введенні тваринам 20мг/кг/день (інгібування 65%, 21 день), 40мг/кг/день (інгібування 97%), і 80мг/кг/день (інгібування 99%). Ці результати були майже ідентичними результатам, отриманим при лікуванні сполукою з прикладу 2 (інгібування 53%, 95% й 98% при 20, 40 й 80мг/кг/день, відповідно). У двох інши х незалежних теста х лікування сполукою з прикладу 3 викликало статистично значиме інгібування росту пухлини (2133%) при дозі 10мг/кг/день. Виходячи із цих досліджень, встановили мінімальну ефективну дозу (МЕД), рівн у 10мг/кг/день. Це - найменша доза, що забезпечує стійке статистично значиме (р
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted quinolines as protein tyrosine kinase enzyme inhibitors
Автори англійськоюWISSNER ALLAN, RABINDRAN SRIDHAR KRISHNA, TSOU HWEI-RU
Назва патенту російськоюЗамещенные хинолины в качестве ингибиторов ферментов протеинтирозиновых киназ
Автори російськоюВиснер Алан, Рабиндран Сридхар Кришна, Цоу Хвей-Ру
МПК / Мітки
МПК: A61K 31/4706, C07D 413/12, A61K 31/506, A61K 31/4709, C07D 407/12, C07D 215/54, C07D 401/12, C07D 405/12, C07D 417/12, C07D 409/12
Мітки: заміщені, ферментів, кіназ, інгібітори, протеїнтирозинових, хіноліни
Код посилання
<a href="https://ua.patents.su/21-85394-zamishheni-khinolini-yak-ingibitori-fermentiv-protentirozinovikh-kinaz.html" target="_blank" rel="follow" title="База патентів України">Заміщені хіноліни як інгібітори ферментів протеїнтирозинових кіназ</a>