2,4-діамінопіримідини як інгібітори кіназ, що беруть участь у регуляції клітинного циклу
Номер патенту: 94944
Опубліковано: 25.06.2011
Автори: Цан Штефан Карл, Гюртлер Ульріх, Райзер Ульріх, Мантоулідіс Андреас, Тонтш-Грунт Ульріке, Бьомельт Гвідо, Трой Маттіас, Золька Флавіо, Шооп Андреас, Бістер Боян
Формула / Реферат
1. Сполука загальної формули (1)
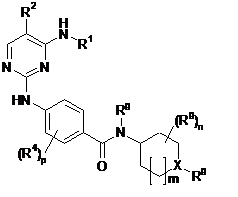 , (1)
, (1)
у якій
X означає N або CH,
R1 означає C3-С10циклоалкіл, заміщений залишком R3 й необов’язково заміщений одним або декількома залишками R4,
R2 означає залишок, вибраний з групи, що включає водень, галоген, -СN, -NO2, C1-С4алкіл, C1-С4галогеналкіл, C3-С10циклоалкіл, C4-С16циклоалкілалкіл й C7-С16арилалкіл,
R3 означає залишок, вибраний з групи, що включає -С(O)Rc, -С(O)ORc, -С(O)NRcRc, -S(O)2Rc, -N(Rf)S(O)2Rc, -N(Rf)C(O)Rc, -N(Rf)C(O)ORc та -N(Rf)C(O)NRcRc,
R4 означає залишок, вибраний з групи, що включає залишки Ra, Rb та Ra, заміщені одним або декількома однаковими або різними залишками Rc і/або Rb,
Ra у кожному випадку незалежно вибраний з групи, що включає C1-С6алкіл, C3-С10циклоалкіл, C4-С16циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл,
Rb означає залишок, у кожному випадку незалежно вибраний з групи, що включає =O, -ORc, C1C3галогеналкілоксигрупу, -OCF3, =S, -SRc, =NRc, =NORc, -NRcRc, галоген, -СF3, -СN, -NC, -OCN, -SCN, -NO2, -S(O)Rc, -S(O)2Rc, -S(O)2ORc, -S(O)NRcRc, -S(O)2NRcRc, -OS(O)Rc, -OS(O)2Rc, -OS(O)2ORc, -OS(O)2NRcRc, -С(O)Rc, -С(O)ORc, -С(O)NRcRc, -СN(Rf)NRcRc, -СN(OH)Rc, -СN(OH)NRcRc, -OC(O)Rc, -OC(O)ORc, -OC(O)NRcRc, -OCN(Rf)NRcRc, -N(Rf)C(O)Rc, -N(Rf)C(S)Rc, -N(Rf)S(O)2Rc, -N(Rf)C(O)ORc, -N(Rf)C(O)NRcRc, -[N(Rf)C(O)]2Rc, -N[C(O)]2Rc, -N[C(O)]2ORc, -[N(Rf)C(O)]2ORc й -N(Rf)CN(Rf)NRcRc,
Rc у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількома однаковими або різними залишками Rd і/або Re залишок, вибраний з групи, що включає C1-С6алкіл, C3-С10циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл,
Rd у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількома однаковими або різними залишками Re і/або Rf залишок, вибраний з групи, що включає C1-С6алкіл, C3-С8циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл,
Re означає залишок, у кожному випадку незалежно вибраний з групи, що включає =O, -ORf, C1-C3галоалкілоксигрупу, -OCF3, =S, -SRf, =NRf, =NORf, -NRfRf, галоген, -СF3, -СN, -NC, -OCN, -SCN, -NO2, -S(O)Rf, -S(O)2Rf, -S(O)2ORf, -S(O)NRfRf, -S(O)2NRfRf, -OS(O)Rf, -OS(O)2Rf, -OS(O)2ORf, -OS(O)2NRfRf, -С(O)Rf, -С(O)ORf, -С(O)NRfRf, -СN(Rg)NRfRf, -СN(OH)Rf, -С(NOH)NRfRf, -OC(O)Rf, -OC(O)ORf, -OC(O)NRfRf, -OCN(Rg)NRfRf, -N(Rg)C(O)Rf, -N(Rg)C(S)Rf, -N(Rg)S(O)2Rf, -N(Rd)C(O)ORf, -N(Rg)C(O)NRfRf й -N(Rg)CN(Rf)NRfRf,
Rf у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількома однаковими або різними залишками Rg залишок, вибраний з групи, що включає C1-С6алкіл, C3-С8циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл,
Rg у кожному випадку незалежно означає водень, C1-С6алкіл, C3-С8циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкіл, 5-12-членний гетероарил або 6-18-членний гетероарилалкіл,
m означає 0 або 1,
n означає 0, 1, 2, 3 або 4,
p означає 0, 1 або 2,
необов’язково у вигляді її таутомерів, її рацематів, її енантіомерів, її діастереомерів та їх сумішей, а також необов’язково у вигляді її фармацевтично нешкідливих кислотно-адитивних солей, за умови, що з обсягу винаходу виключені наступні сполуки:
4-[4-((1R,2S)-2-ізопропілкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-ізопропілкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-піперидин-4-ілбензамід,
2-фтор-4-[4-((1R,2S)-2-ізопропілкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
2-хлор-4-[4-((1R,2S)-2-ізопропілкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
2-фтор-4-[4-((1R,2S)-2-ізопропілкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-метилпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-нітропіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-фторпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-хлорпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-ізопропілпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[5-бром-4-((1R,2S)-2-карбамоїлциклопентиламіно)піримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-йодпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
N-метил-N-(1-метилпіперидин-4-іл)-4-{4-[(1R,2S)-2-(піролідин-1-карбоніл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}бензамід,
4-[4-((1R,2S)-2-циклопентилкарбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
4-{4-[(1R,2S)-2-(1,1-діоксотетрагідро-1λ6-тіофен-3-ілкарбамоїл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
N-метил-N-(1-метилпіперидин-4-іл)-4-{4-[(1R,2S)-2-(2,2,2-трифторетилкарбамоїл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}бензамід,
N-метил-4-{4-[(1R,2S)-2-(3-метилбутилкарбамоїл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}-N-(1-метилпіперидин-4-іл)бензамід,
4-{4-[(1R,2S)-2-(3-диметиламінопропілкарбамоїл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
4-{4-[(1R,2S)-2-(азетидин-1-карбоніл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
N-метил-4-{4-[(1R,2S)-2-(4-метилпіперидин-1-карбоніл)циклопентиламіно]-5-трифторметилпіримідин-2-іламіно}-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,3S)-3-карбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1S,3R)-3-карбамоїлциклопентиламіно)-5-трифторметилпіримідин-2-іламіно]-N-метил-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-ціанопіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід,
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-фенілетинілпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід та
4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5-циклопропілпіримідин-2-іламіно]-N-(1-метилпіперидин-4-іл)бензамід.
2. Сполука за п. 1, в якій X означає N.
3. Сполука за п. 1 або 2, в якій m означає 1.
4. Сполука за будь-яким із пп. 1-3, в якій R2 означає залишок, вибраний з групи, що включає галоген й C1-С4галогеналкіл.
5. Сполука за п. 4, в якій R2 означає -СF3.
6. Сполука за будь-яким із пп. 1-5, в якій R1 означає C4-C6циклоалкіл.
7. Сполука за п. 6, в якій R1 означає циклопентил.
8. Сполука за будь-яким із пп. 1-7 або її фармацевтично прийнятна сіль для застосування як лікарського засобу.
9. Сполука за будь-яким із пп. 1-7 або її фармацевтично прийнятна сіль для виробництва лікарського засобу, що має антипроліферативну активність.
10. Фармацевтична композиція, яка містить як діючу речовину одну або декілька сполук загальної формули (1) за будь-яким із пп. 1-7 або одну або декілька їх фармацевтично прийнятних солей, необов’язково у сполученні зі звичайними допоміжними речовинами і/або носіями.
11. Застосування сполуки загальної формули (1) за будь-яким із пп. 1-7 для виробництва лікарського засобу, призначеного для лікування і/або профілактики раку, інфекційних хвороб, запальних захворювань та аутоімунних захворювань.
12. Фармацевтичний препарат, який містить сполуку загальної формули (1) за будь-яким із пп. 1-7 й принаймні одну іншу, відмінну від сполуки формули (1) діючу речовину з цитостатичною або цитотоксичною активністю, необов’язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх суміші, а також необов’язково у вигляді їх фармацевтично прийнятних солей.
Текст
1. Сполука загальної формули (1) 2 3 b R означає залишок, у кожному випадку незалежно c вибраний з групи, що включає =O, -OR , c c C1-C3галогеналкілоксигрупу, -OCF3, =S, -SR , =NR , c c c =NOR , -NR R , галоген, -СF3, -СN, -NC, -OCN, c c c SCN, -NO2, -S(O)R , -S(O)2R , -S(O)2OR , c c c c c c S(O)NR R , -S(O)2NR R , -OS(O)R , -OS(O)2R , c c c c c OS(O)2OR , -OS(O)2NR R , -С(O)R , -С(O)OR , c c f c c c С(O)NR R , -СN(R )NR R , -СN(OH)R , c c c c СN(OH)NR R , -OC(O)R , -OC(O)OR , c c f c c f c OC(O)NR R , -OCN(R )NR R , -N(R )C(O)R , f c f c f c N(R )C(S)R , -N(R )S(O)2R , -N(R )C(O)OR , f c c f c c N(R )C(O)NR R , -[N(R )C(O)]2R , -N[C(O)]2R , c f c f f c c N[C(O)]2OR , -[N(R )C(O)]2OR й -N(R )CN(R )NR R , c R у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількоd e ма однаковими або різними залишками R і/або R залишок, вибраний з групи, що включає C1С6алкіл, C3-С10циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл, d R у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількоe f ма однаковими або різними залишками R і/або R залишок, вибраний з групи, що включає C1С6алкіл, C3-С8циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18-членний гетероарилалкіл, e R означає залишок, у кожному випадку незалежно f вибраний з групи, що включає =O, -OR , C1f f C3галоалкілоксигрупу, -OCF3, =S, -SR , =NR , f f f =NOR , -NR R , галоген, -СF3, -СN, -NC, -OCN, f f f f f SCN, -NO2, -S(O)R , -S(O)2R , -S(O)2OR , -S(O)NR R , f f f f f -S(O)2NR R , -OS(O)R , -OS(O)2R , -OS(O)2OR , f f f f f f OS(O)2NR R , -С(O)R , -С(O)OR , -С(O)NR R , g f f f f f f СN(R )NR R , -СN(OH)R , -С(NOH)NR R , -OC(O)R , f f f g f f OC(O)OR , -OC(O)NR R , -OCN(R )NR R , g f g f g f N(R )C(O)R , -N(R )C(S)R , -N(R )S(O)2R , d f g f f N(R )C(O)OR , -N(R )C(O)NR R й g f f f N(R )CN(R )NR R , f R у кожному випадку незалежно означає водень або необов’язково заміщений одним або декількоg ма однаковими або різними залишками R залишок, вибраний з групи, що включає C1-С6алкіл, C3С8циклоалкіл, C4-С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил й 6-18членний гетероарилалкіл, g R у кожному випадку незалежно означає водень, C1-С6алкіл, C3-С8циклоалкіл, C 4С11циклоалкілалкіл, C6-С10арил, C7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкіл, 5-12членний гетероарил або 6-18-членний гетероарилалкіл, m означає 0 або 1, n означає 0, 1, 2, 3 або 4, p означає 0, 1 або 2, необов’язково у вигляді її таутомерів, її рацематів, її енантіомерів, її діастереомерів та їх сумішей, а також необов’язково у вигляді її фармацевтично 94944 4 нешкідливих кислотно-адитивних солей, за умови, що з обсягу винаходу виключені наступні сполуки: 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-піперидин-4ілбензамід, 2-фтор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 2-хлор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 2-фтор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5метилпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5нітропіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5фторпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5хлорпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5ізопропілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід, 4-[5-бром-4-((1R,2S)-2карбамоїлциклопентиламіно)піримідин-2-іламіно]N-(1-метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5йодпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, N-метил-N-(1-метилпіперидин-4-іл)-4-{4-[(1R,2S)-2(піролідин-1-карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}бензамід, 4-[4-((1R,2S)-2циклопентилкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 6 4-{4-[(1R,2S)-2-(1,1-діоксотетрагідро-1λ -тіофен-3ілкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-метил-N-(1метилпіперидин-4-іл)бензамід, N-метил-N-(1-метилпіперидин-4-іл)-4-{4-[(1R,2S)-2(2,2,2-трифторетилкарбамоїл)циклопентиламіно]5-трифторметилпіримідин-2-іламіно}бензамід, N-метил-4-{4-[(1R,2S)-2-(3метилбутилкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-(1метилпіперидин-4-іл)бензамід, 4-{4-[(1R,2S)-2-(3диметиламінопропілкарбамоїл)циклопентиламіно]5-трифторметилпіримідин-2-іламіно}-N-метил-N(1-метилпіперидин-4-іл)бензамід, 5 94944 6 1 4-{4-[(1R,2S)-2-(азетидин-1карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-метил-N-(1метилпіперидин-4-іл)бензамід, N-метил-4-{4-[(1R,2S)-2-(4-метилпіперидин-1карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,3S)-3-карбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1S,3R)-3-карбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5ціанопіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5фенілетинілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід та 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5циклопропілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід. 2. Сполука за п. 1, в якій X означає N. 3. Сполука за п. 1 або 2, в якій m означає 1. 2 4. Сполука за будь-яким із пп. 1-3, в якій R означає залишок, вибраний з групи, що включає галоген й C1-С4галогеналкіл. 2 5. Сполука за п. 4, в якій R означає -СF3. 6. Сполука за будь-яким із пп. 1-5, в якій R означає C4-C6циклоалкіл. 1 7. Сполука за п. 6, в якій R означає циклопентил. 8. Сполука за будь-яким із пп. 1-7 або її фармацевтично прийнятна сіль для застосування як лікарського засобу. 9. Сполука за будь-яким із пп. 1-7 або її фармацевтично прийнятна сіль для виробництва лікарського засобу, що має антипроліферативну активність. 10. Фармацевтична композиція, яка містить як діючу речовину одну або декілька сполук загальної формули (1) за будь-яким із пп. 1-7 або одну або декілька їх фармацевтично прийнятних солей, необов’язково у сполученні зі звичайними допоміжними речовинами і/або носіями. 11. Застосування сполуки загальної формули (1) за будь-яким із пп. 1-7 для виробництва лікарського засобу, призначеного для лікування і/або профілактики раку, інфекційних хвороб, запальних захворювань та аутоімунних захворювань. 12. Фармацевтичний препарат, який містить сполуку загальної формули (1) за будь-яким із пп. 1-7 й принаймні одну іншу, відмінну від сполуки формули (1) діючу речовину з цитостатичною або цитотоксичною активністю, необов’язково у вигляді їх таутомерів, їх рацематів, їх енантіомерів, їх діастереомерів та їх суміші, а також необов’язково у вигляді їх фармацевтично прийнятних солей. Даний винахід відноситься до нових сполук загальної формули (1) ції клітинного циклу. Тим самим пропоновані у винаході сполуки можуть використатися, наприклад, для лікування захворювань, які пов'язані з активністю специфічних кіназ, що беруть участь у регуляції клітинного циклу, і для яких характерна надлишкова або аномальна проліферація клітин. Відповідно до цього в даному винаході пропонуються сполуки загальної формули (1) 1 2 4 g у якій залишки R , R , R , R і X і індекси m, n і p мають зазначені у формулі винаходу й у наступному описі значення, до їхніх ізомерів, до способу одержання цих піримідинів, а також до їхнього застосування як лікарські засоби. В основу даного винаходу було покладене завдання запропонувати нові діючі речовини, які могли б використатися для профілактики й/або лікування захворювань, для яких характерна надлишкова або аномальна проліферація клітин. Докладний опис винаходу При створенні винаходу несподівано було встановлено, що сполуки загальної формули (1), у 1 2 4 g якій залишки R , R , R , R і X і індекси m, n і p мають зазначені нижче значення, мають дію інгібіторів специфічних кіназ, що беруть участь у регуля у якій X означає N або СН, 1 R означає С3-С10циклоалкіл, заміщений за3 лишком R і необов'язково заміщений одним або 4 декількома залишками R , 2 R означає залишок, вибраний із групи, що включає водень, галоген, - CN, - ΝΟ2, С1-С4алкіл, С1-С4галоалкіл, С3-С10циклоалкіл, С 4С16циклоалкілалкіл і С7-С16арилалкіл, 7 3 R означає залишок, вибраний із групи, що c c c c включає - С(O)R , - С(O)OR , - С(O)NR R , c f c f c S(O)2R , - N(R )S(O)2R , - N(R )С(O)R , f c f c c N(R )С(O)OR і -N(R )C(O)NR R , 4 R означає залишок, вибраний із групи, що a b c включає залишки R , R і R , заміщені одним або c декількома однаковими або різними залишками R b і/або R , a R у кожному випадку незалежно вибраний із групи, що включає С1-С6алкіл, С3-С10циклоалкіл, С4-С16циклоалкілалкіл, С6-С10арил, С7 С16арилалкіл, 2-6-членний гетероалкіл, 3-8членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил і 6-18членний гетероарилалкіл, b R означає залишок, у кожному випадку незаc лежно вибраний із групи, що включає =O, -OR , С1c c С3галоалкілоксигрупу, -OCF3, =S, - SR , =NR , c c c =NOR , -NR R , галоген, -CF3, -CN, -NC, -OCN, c c c SCN, -NO2, -S(O)R , -S(O)2R , -S(O)2OR , c c c c c c S(O)NR R , -S(O)2NR R , -OS(O)R , -OS(O)2R , c c c c c OS(O)2OR , -OS(O)2NR R , -C(O)R , -C(O)OR , c c f c c c С(O)NR R , -CN(R )NR R , -CN(OH)R , c c c c CN(OH)NR R , -OC(O)R , -ОС(O)OR , c f c c f c ОС(O)NR°R , -OCN(R )NR R , -N(R )С(O)R , f c f c f c N(R )С(S)R , -N(R )S(O)2R , -N(R )С(O)OR , f c c f c c N(R )С(O)NR R , -[N(R )С(O)]2R , -N[С(O)]2R , c f c f f c c N[С(O)]2OR , -[Ν(R )С(O)]2OR і -Ν(R )CN(R )NR R , c R у кожному випадку незалежно означає водень або необов'язково заміщений одним або деd кількома однаковими або різними залишками R e і/або R залишок, вибраний із групи, що включає С1-С6алкіл, С3-С10циклоалкіл, С 4С11циклоалкілалкіл, С6-С10арил, С7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 512-членний гетероарил і 6-18-членний гетероарилалкіл, d R у кожному випадку незалежно означає водень або необов'язково заміщений одним або деe кількома однаковими або різними залишками R f і/або R залишок, вибраний із групи, що включає С1-С6алкіл, С3-С8циклоалкіл, С 4С11циклоалкілалкіл, С6-С10арил, С7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 512-членний гетероарил і 6-18-членний гетероарилалкіл, e R означає залишок, у кожному випадку незаf лежно вибраний із групи, що включає =O, -OR , С1f f С3галоалкілоксигрупу, -OCF3, =S, -SR , =NR , f f f =NOR , -NR R , галоген, -CF3, -CN, -NC, -OCN, f f f f f SCN, -NO2, -S(O)R , -S(O)2R , -S(O)2OR , -S(O)NR R , f f f f f -S(O)2NR R , -OS(O)R , -OS(O)2R , -OS(O)2OR , f f f f f f OS(O)2NR R , -C(O)R , -C(O)OR , -C(O)NR R , g f f f f f f CN(R )NR R , -CN(OH)R , -C(NOH)NR R , -ОС(O)R , f f f g f f ОС(O)OR , -ОС(O)NR R , -OCN(R )NR R , g f g f g f N(R )С(O)R , -N(R )С(S)R , -N(R )S(O)2R , d f g f f g f f f N(R )С(O)OR , -N(R )С(O)NR R і -Ν(R )CN(R )NR R , f R у кожному випадку незалежно означає водень або необов'язково заміщений одним або деg кількома однаковими або різними залишками R залишок, вибраний із групи, що включає С1С6алкіл, С3-С8циклоалкіл, С4-С11циклоалкілалкіл, С6-С10арил, С7-С16арилалкіл, 2-6-членний гетероа 94944 8 лкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкілалкіл, 5-12-членний гетероарил і 6-18-членний гетероарилалкіл, g R у кожному випадку незалежно означає водень, С1-С6алкіл, С3-С8циклоалкіл, С 4С11циклоалкілалкіл, С6-С10арил, С7-С16арилалкіл, 2-6-членний гетероалкіл, 3-8-членний гетероциклоалкіл, 4-14-членний гетероциклоалкіл, 5-12членний гетероарил або 6-18-членний гетероарилалкіл, m означає 0 або 1, n означає 0, 1, 2, 3 або 4, р означає 0, 1 або 2, необов'язково у вигляді їх таутомерів, їхніх рацематів, їх енантіомерів, їх діастереомерів і їхніх сумішей, а також необов'язково у вигляді їх фармакологічно нешкідливих кислотно-адитивних солей, за умови, що з обсягу винаходу виключені наступні сполуки: 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-піперидин-4ілбензамід, 2-фтор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 2-хлор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 2-фтор-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5метилпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5нітропіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5фторпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5хлорпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5ізопропілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід, 4-[5-бром-4-((1R,2S)-2карбамоїлциклопентиламіно)піримідин-2-іламіно]N-(1-метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5йодпіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, N-метил-N-(1-метилпіперидин-4-іл)-4-{4[(1R,2S)-2-(піролидин-1карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}бензамід, 9 4-[4-((1R,2S)-2циклопентилкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 6 4-{4-[(1R,2S)-2-(1,1-діоксотетрагідро-1 тіофен-3-ілкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-метил-N-(1метилпіперидин-4-іл)бензамід, N-метил-N-(1-метилпіперидин-4-іл)-4-{4[(1R,2S)-2-(2,2,2трифторетилкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}бензамід, N-метил-4-{4-[(1R,2S)-2-(3метилбутилкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-(1метилпіперидин-4-іл)бензамід, 4-{4-[(1R,2S)-2-(3диметиламінопропілкарбамоїл)циклопентиламіно]5-трифторметилпіримідин-2-іламіно}-N-метил-N(1-метилпіперидин-4-іл)бензамід, 4-{4-[(1R,2S)-2-(азетидин-1карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-метил-N-(1метилпіперидин-4-іл)бензамід, N-метил-4-{4-[(1R,2S)-2-(4-метилпіперидин-1карбоніл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,3S)-3-карбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1S,3R)-3-карбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5ціанопіримідин-2-іламіно]-N-(1-метилпіперидин-4іл)бензамід, 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5фенілетинілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензаміді 4-[4-((1R,2S)-2-карбамоїлциклопентиламіно)-5циклопропілпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід. В одному з варіантів здійснення винаходу в ньому пропонуються сполуки загальної формули (1), у якій X означає N. У ще одному варіанті здійснення винаходу в ньому пропонуються сполуки загальної формули (1), у якій m означає 1. У ще одному варіанті здійснення винаходу в ньому пропонуються сполуки загальної формули 2 (1), у якій R означає залишок, вибраний із групи, що включає галоген і С1-С4галоалкіл. У ще одному варіанті здійснення винаходу в ньому пропонуються сполуки загальної формули 2 (1), у якій R означає - CF3. У ще одному варіанті здійснення винаходу в ньому пропонуються сполуки загальної формули 1 (1), у якій R означає С4-С6циклоалкіл. У ще одному варіанті здійснення винаходу в ньому пропонуються сполуки загальної формули 1 (1), у якій R означає циклопентил. Об'єктом винаходу є далі сполуки загальної формули (1) або їх фармацевтично активні солі для застосування як лікарські засоби. 94944 10 Ще одним об'єктом винаходу є застосування сполук загальної формули (1) або їх фармацевтично активних солей для готування лікарського засобу, що володіє антипроліферативною активністю. Ще одним об'єктом винаходу є фармацевтична композиція, що містить як діючу речовину одну або кілька сполук загальної формули (1) або одну або більше їх фармацевтично активних солей, необов'язково в сполученні зі звичайними допоміжними речовинами й/або носіями. Об'єктом винаходу є також застосування сполук загальної формули (1) для готування лікарського засобу, призначеного для лікування й/або профілактики раку, інфекційних хвороб, запальних захворювань і аутоімунних захворювань. Іншим об'єктом винаходу є фармацевтичний препарат, що містить сполуки загальної формули (1), необов'язково у вигляді його таутомерів, його рацематів, його енантіомерів, його діастереомерів і його сумішей, а також необов'язково у вигляді його фармацевтично активних солей, і щонайменше одну діючу речовину іншого, відмінного від сполук формули (1) типу із цитостатичною або цитотоксичною активністю. Визначення Використовувані в описі даного винаходу й формулі винаходу терміни й поняття мають, якщо не зазначене інше, наступні значення. Під алкільними замісниками в кожному випадку маються на увазі насичені, ненасичені, нерозгалужені або розгалужені аліфатичні вуглеводні залишки (алкільні залишки), включаючи як насичені алкільні, так і ненасичені алкенільні й алкінільні залишки. Під алкенільними замісниками в кожному випадку маються на увазі нерозгалужені або розгалужені ненасичені алкільні залишки із щонайменше одним подвійним зв'язком. Під алкінільними ж замісниками в кожному випадку маються на увазі нерозгалужені або розгалужені ненасичені алкільні залишки із щонайменше одним потрійним зв'язком. Під гетероалкілом маються на увазі нерозгалужені або розгалужені аліфатичні вуглеводні ланцюги з 1-3 гетероатомами, при цьому кожний з наявних атомів вуглецю й гетероатомів у гетероалкільному ланцюгу необов'язково може бути заміщений незалежно від інших атомів, а гетероатоми в кожному випадку незалежно друг від друга вибрані із групи, що включає О, N, Р, РО, РО2, S, SO і SO2 (наприклад, диметиламінометил, диметиламіноетил, диметиламінопропіл, диетиламінометил, диетиламіноетил, диетиламінопропіл, 2диізопропіламіноетил, біс-2метоксиетиламіногрупа, [2(диметиламіноетил)етиламіно]метил, 3-[2(диметиламіноетил)етиламіно]пропіл, гідроксиметил, 2-гідроксиетил, 3-гідроксипропіл, метоксигрупа, етоксигрупа, пропоксигрупа, метоксиметил, 2метоксиетил). Під галоалкілом маються на увазі алкільні залишки, у яких один або кілька атомів водню замінені на атоми галогену. Поняття "галоалкіл" охоплює й насичені алкільні залишки, і ненасичені алкенільні й алкінільні залишки, як, наприклад, 11 CF3, - CHF2, -CH2F, -CF2CF3, -CHFCF3, -CH2CF3, CF2CH3, - HFCH3, -CF2CF2CF3, -CF2CH2CH3, CF=CF2, -CCl=CH2, -CBr=CH2, -CJ=CH2, -CC-CF3, CHFCH2CH3 і -CHFCH2CF3. Під галогеном маються на увазі атоми фтору, хлору, брому й/або йода. Під циклоалкілом мається на увазі моно - або поліциклічна структура, що може являти собою насичену або ж ненасичену неароматичну кільцеву систему, відповідно спіросполуку, що, відповідно яких необов'язково може також містити подвійні зв'язки, як, наприклад, циклопропіл, циклопропеніл, циклобутил, циклобутеніл, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептаніл, циклогептеніл, норборніл, норборненіл, інданіл, адамантил, біцикло[2.2.3]октаніл, спірогептаніл і спіро[4.2]гептаніл. Під циклоалкілалкілом мається на увазі зазначений вище нециклічний алкіл, у якому атом водню, пов'язаний з атомом вуглецю, звичайно з кінцевим атомом вуглецю, замінений на зазначену вище циклоалкільну групу. Під арилом маються на увазі моно- або біцикличні структури з 6-12 атомами вуглецю, як, наприклад, феніл і нафтил. Під арилалкілом мається на увазі зазначений вище нециклічний алкіл, у якому атом водню, пов'язаний з атомом вуглецю, звичайно з кінцевим атомом вуглецю, замінений на зазначену вище арильну групу. Під гетероарилом маються на увазі моно - або поліциклічні структури, які замість одного або декількох атомів водню містять один або більше однакових або різних гетероатомів, таких, наприклад, як атоми азоту, сірки або кисню. Як приклад при цьому можна назвати фурил, тієніл, піроліл, оксазоліл, тіазоліл, ізоксазоліл, ізотіазоліл, піразоліл, імідазоліл, тріазоліл, тетразоліл, оксадіазоліл, тіадіазоліл, піридил, піримідил, пиридазініл, піразініл і тріазініл. Як приклад біциклических гетероарильних залишків можна назвати індоліл, ізоіндоліл, бензофураніл, бензотієніл, бензоксазоліл, бензотіазоліл, бензоізоксазоліл, бензоізотіазоліл, бензоімідазоліл, індазоліл, ізохінолініл, хінолініл, хіноксалініл, циннолініл, фталазініл, хиназолініл, бензотріазініл, індолизініл, оксазолопиридініл, імідазопиридініл, нафтиридініл, індолініл, ізохроманіл, хроманіл, тетрагідроізохінолініл, ізоіндолініл, ізобензотетрагідрофурил, ізобензотетрагідротієніл, ізобензотієніл, бензоксазоліл, пиридопиридініл, бензотетрагідрофураніл, бензотетрагідротієніл, пурініл, бензодіоксоліл, тріазініл, феноксазініл, фенотіазініл, птеридініл, бензотіазоліл, імідазопиридініл, імідазотіазоліл, дигідробензоізоксазініл, бензоізоксазініл, бензоксазініл, дигідробенозізотіазініл, бензопіраніл, бензотіопіраніл, кумарініл, ізокумарініл, хромоніл, хроманоніл, піридил-N-оксид, тетрагідрохінолініл, дигідрохінолініл, дигідрохінолиноніл, дигідроізохінолиноніл, дигідрокумарініл, дигідроізокумарініл, ізоіндолиноніл, бензодіоксаніл, бензоксазолиноніл, піроліл-N-оксид, піримідініл-N-оксид, пиридазініл-N-оксид, піразініл-Nоксид, хінолініл-N-оксид, індоліл-N-оксид, індолініл-N-оксид, ізохіноліл-N-оксид, хиназолініл-Nоксид, хіноксалініл-N-оксид, фталазініл-N-оксид, 94944 12 імідазоліл-N-оксид, ізоксазоліл-N-оксид, оксазолілN-оксид, тіазоліл-N-оксид, індолизініл-N-оксид, індазоліл-N-оксид, бензотіазоліл-N-оксид, бензоімідазоліл-N-оксид, піроліл-N-оксид, оксадіазолілN-оксид, тіадіазоліл-N-оксид, тріазоліл-N-оксид, тетразоліл-N-оксид, бензотіопіраніл-S-оксид і бензотіопіраніл-S,S-діоксид. Под гетероарилалкілом мається на увазі зазначений вище нециклічний алкіл, у якому атом водню, пов'язаний з атомом вуглецю, звичайно з кінцевим атомом вуглецю, замінений на зазначену вище гетероарильну групу. Під гетероциклоалкілом маються на увазі утримуючі 3-12 атомів вуглецю насичені або ненасичені неароматичні моно- або поліциклічні або поліциклічні структури, що мають внутрішній місток, або спіросполуки, які замість одного або декількох атомів вуглецю містять гетероатоми, такі як азот, кисень або сірка. Як приклад подібних гетероциклоалкільних залишків можна назвати тетрагідрофураніл, піролидініл, піролініл, імідазолидініл, імідазолініл, піразолидініл, піразолініл, піперидініл, піперазініл, індолініл, ізоіндолініл, морфолініл, тіоморфолініл, гомоморфолініл, гомопіперидініл, гомопіперазініл, гомотіоморфолініл, тіоморфолініл -S-оксид, тіоморфолініл-S,S-діоксид, тетрагідропіраніл, тетрагідротієніл, гомотіоморфолініл-S,Sдіоксид, оксазолидиноніл, дигідропіразоліл, дигідропіроліл, дигідропіразініл, дигідропиридініл, дигідропіримідініл, дигідрофурил, дигідропіраніл, тетрагідротієніл-S-оксид, тетрагідротієніл-S,S-діоксид, гомотіоморфолініл-S-оксид, 2-окса-5азабіцикло[2.2.1]гептан, 8-окса-3азабіцикло[3.2.1]октан, 3,8діазабіцикло[3.2.1]октан, 2,5діазабіцикло[2.2.1]гептан, 3,8діазабіцикло[3.2.1]октан, 3,9діазабіцикло[4.2.1]нонан і 2,6діазабіцикло[3.2.2]нонан. Під гетероциклоалкілалкілом мається на увазі зазначений вище нециклічний алкіл, у якому атом водню, пов'язаний з атомом вуглецю, звичайно з кінцевим атомом вуглецю, замінений на зазначену вище гетероциклоалкільну групу. Вираження "заміщений" означає, що один атом водню, що безпосередньо пов'язаний з розглянутим атомом, замінений іншим атомом або іншою групою атомів. Двовалентні замісники, такі, наприклад, як =O, =S, =NR, =NOR, =NNRR, =NN(R)С(O)NRR, =N2 і інші, вимагають заміни на них двох атомів водню, які безпосередньо пов'язані з розглянутим атомом. Відповідно подібні двовалентні замісники не можуть бути замісниками в ароматичних систем. Скорочення екв. еквівалент (-и) Ас ацетил Вn бензил Воc трет-бутилоксикарбоніл Ви бутил ТСХ тонкошарова хроматографія ДЦК дициклогексилкарбодиімід ДХМ дихлорметан ДМАП Ν,Ν-диметиламінопіридин ДМФ Ν,Ν-диметилформамід 13 ДМА Ν,Ν-диметилацетамід ДМСО диметилсульфоксид ЕА етилацетат ESI іонізація електроспреєм Et етил ЕtOН етанол ч година (-и) ЖХВР рідинна хроматографія високого ступеню Основа Хюніга N-етилдиізопропіламін ІК інфрачервона спектроскопія tКИП температура кипіння ЖХ рідинна хроматографія ДАВ диізопропіламід літію мін хвилина (-и) Me метил MeCN ацетонітрил МС мас-спектрометрія N-МП N-метилпіролідон ЯМР ядерний магнітний резонанс Ph феніл Pr пропіл рац рацемічний Rf коефіцієнт утримання ОФ зворотна фаза КТ кімнатна температура Rt час утримання (при ЖХВР) тре третинний ТГФ тетрагідрофуран ТБТУ тетрафторборат О-(бензотріазол-1-іл)Ν,Ν,Ν',Ν'-тетраметилуронію УФ ультрафіолетова спектроскопія Нижче даний винахід проілюстрований на прикладах, які, однак, не обмежують його обсяг. Загальні пояснення Якщо не зазначене інше, всі реакції проводять у наявних у продажі апаратах загальноприйнятими в хімічних лабораторіях методами. Використовувані розчинники здобувають із чистотою для аналізу й застосовують без додаткового очищення. Всі реагенти також без додаткового очищення безпосередньо використають у синтезі. Чутливі до повітря й/або вологі вихідні речовини переважно зберігати в атмосфері захисного газу, а відповідні реакції й операції з ними переважно проводити також в атмосфері захисного газу (азоту або аргону). Хроматографія Для препаративної хроматографії середнього тиску (ЖХСД, нормальна фаза) використають силікагель фірми Мilliіроrе (Granula Silica Si - 60А, 3570 мкм) або зворотно-фазний силікагель С-18 (Оф - фаза) фірми Macherey Nagel (Polygoprep 10050С18). 94944 14 Для тонкошарової хроматографії використають готові пластини для ТСХ типу силікагелю 60 на склі (із флуоресцентним індикатором F-254) фірми Merck. Для препаративної ЖХВР використають стовпчики фірми Waters (XTerra Prep. MC С18, 5 мкм, 30100 мм, відповідно XTerra Prep. MC C18, 5 мкм, 50100 мм OBD або Symmetrie С18, 5 мкм, 19100 мм), а для аналітичної ЖХВР (контроль за реакцією) використають стовпчики фірми Agilent (Zorbax SB-38, 5 мкм, 21,250 мм). Для ЖХВР на хиральній фазі використають стовпчики фірми Daicel Chemical Industries, LTD. (Chiralpak AD - H, Chiralpak AS, Chiracel OD - RH, Chiracel OD - Η або Chiracel OJ - Η з різними розмірами й з розміром часток сорбенту 5 мкм). ЖХВР - мас-спектроскопія/УФ-спектрометрія + Час утримання/МС (ESI ) для визначення характеристик сполук із прикладів визначають за допомогою системи для ЖХВР-МС (система для рідинної хроматографії високого дозволу з масспектрометричним детектором) фірми Agilent. У такій системі до хроматографічного стовпчика (стовпчик ХTerra МС С18, 2,5 мкм, 2,130 мм, фірма Waters, кат. № 186000592) послідовно приєднані детектор на діодної матриці (G1315B фірми Agilent) і мас-спектрометричний детектор (1100 LS - MSD SL, G1946D, фірма Agilent). Виміри проводять при швидкості потоку в системі, рівної 1,1 мл/хв. Для поділу використають градієнтне елюювання зі зміною співвідношення між розчинниками протягом 3,1 хв (у якості елюента використають суміш вода/MeCN, співвідношення між якими змінюють із 95:5 на початку елюювання до 5:95 наприкінці елюювання, при цьому до обох розчинників домішують по 0,1% НСООН (мурашиної кислоти)). Вихідні сполуки, одержання яких не описується, являють собою наявні в продажі продукти або можуть бути отримані аналогічно відомим сполуками або розглянутим у даному описі способам. Описані в літературі речовини одержують опублікованими в літературі методами синтезу. Одержання пропонованих у винаході сполук Пропоновані у винаході сполуки можна одержувати відповідно до описаного нижче методами синтезу, проілюстрованими відповідними схемами, на яких замісники в загальних формулах мають зазначені вище значення. Ці методи служать винятково для пояснення винаходу, обсяг якого в частині заявлених у ньому сполук не обмежений описаними в наступних прикладах сполуками. 15 94944 16 17 94944 18 Після одержання дiамінопіримідина при необхідності можлива також трансформація однієї або декількох функціональних груп (FG1 або FG2). Сказане у відповідних випадках описано в прикладах. А-1а) 2,4-дихлор-5-трифторметилпіримідин переганяють у вакуумі (10 мбар) на короткій колоні (з температурою у верхній частині 65-70°С), одержуючи 35,3 мл рідини, що в атмосфері захисного газу розливають по ємностях і зберігають. ТСХ: Rf=0,83 (циклогексан/ЕА в співвідношенні 3:1). Бензиловий ефір 4-амінобензойної кислоти 48 г (267 ммолей) 5-трифторметилурацила в умовах, що виключають доступ вологи, суспендують в 210 мл оксихлорида фосфору (РОСІ3). До отриманої суспензії по краплях повільно додають 47,7 г (320 ммолей, 1,2 екв.) диетиланілину таким чином, щоб температура залишалася в межах від 25 до 30°С. По завершенні цієї операції додавання суміш ще протягом 5-10 хв перемішують у водяній лазні й потім протягом 5-6 год витримують при 8090°С в умовах, що виключають доступ вологи. Отриману суміш при перемішуванні додають у приблизно 1200 г сірчанокислої суміші води з льодом і водною фазою відразу ж тричі екстрагують диетиловим ефіром або трет-бутилметиловим ефіром порціями по 500 мл. Об'єднані ефірні екстракти двічі промивають сірчанокислою сумішшю води з льодом (приблизно 0,1-молярної) порціями по 300 мл, а також холодним розчином повареної солі й сушать. Після цього осушувач відфільтровують і у вакуумі видаляють розчинник. Залишок 15,01 г (89,9 ммоля) 4-нітробензойної кислоти суспендують в 500 мл MeCN і потім змішують із 15,03 г (108,7 ммоля, 1,2 екв.) карбонату калію. Після цього при перемішуванні по краплях додають 15,4 г (90,4 ммоля, 1,01 екв.) бензилброміду й реакційну суміш протягом 5 год при перемішуванні витримують при 60°С. Потім змішують із 750 мл дистильованої води, чотири рази екстрагують ЕА порціями по 250 мл і після об'єднання органічних фаз сушать над сульфатом натрію. Після видалення у вакуумі всіх летучих компонентів сирий продукт послідовно по двох разу суспендують у толуолі й концентрують у вакуумі. Таким шляхом одержують 20,6 г (80,1 ммоля) бензилового ефіру 4-нітробензойної кислоти, що без додаткового 19 очищення використають у реакції на наступній стадії. 20,6 г бензилового ефіру 4-нітробензойної кислоти розчиняють в 350 мл діоксана й отриманий розчин змішують із 6,9 г (49,9 ммоля, 0,61 екв.) нікелю Ренея. Після цього протягом 16 год при перемішуванні гідрують при тиску H2 5 бар. Потім каталізатор відфільтровують і у вакуумі видаляють всі летучі компоненти. Таким шляхом одержують 17 мл бензилового ефіру 4-амінобензойної кислоти. A-2a) Бензиловий ефір 4-(4-хлор-5трифторметилпіримідин-2-іламіно)бензойної кислоти 10 г (44 ммоля) бензилового ефіру 4амінобензойної кислоти розчиняють в 200 мл ДМА, додають 8 мл основи Хюніга (0,97 екв.) і до отриманого розчину при КТ по краплях додають 10,4 г (48,21 ммоля) 2,4-дихлор-5трифторметилпіримідина, розчиненого в 50 мл ДМА. Реакційну суміш залітають перемішуватися на ніч при 60°С, після чого змішують із 300 мл ДХМ і шляхом струшування екстрагують водою (тричі по 300 мл). Органічну фазу сушать і у вакуумі видаляють розчинник. Сирий продукт змішують із 100 мл МеОН, дигедрують і залишають стояти на 2 год. Після цього перемішують протягом 10 хв, осад відфільтровують і промивають МеОН. Потім сирий продукт знову суспендують в МеОН, тверду речовину відфільтровують, промивають невеликою кількістю МеОН і сушать у вакуумній сушильній шафі при 60°С. Таким шляхом одержують 8,5 г сполуки А-2а. Зазначені сполуки синтезують відповідно до методу, описаного в Е. Forro і F. Fueloep, "Lipase Catalyzed Enantioselective Ring Opening of Unactivated Alicyclic - Fused - Lactams in an Organic Solvent", Org. Lett. 5, 2003, cc. 1209-1212. A-4a) Бензиловий ефір 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]бензойної кислоти 94944 20 Rf=0,71 (силікагель, циклогексан/ЕА в співвід+ + ношенні 1:2). МС (ESI ): 408 (Μ+Η) . А-3а) Бензиловий ефір 4-[4-((1R,2S)-2карбоксициклопентиламіно)-5трифторметилпіримідин-2-іламіної бензойної кислоти 2,05 г (5 ммолей, 1 екв.) сполуки А-2а і 1 г гідрохлориду (1S,2R)-2-аміно-1циклопентанкарбонової кислоти (6 ммолей, 1,2 екв.) додають в 18 мл EtOH, після чого додають 7,3 мл (42,5 ммоля, 8,5 екв.) основи Хюніга й перемішують протягом 4 год при 70°С. Далі реакційну суміш при перемішуванні додають до 275 мл води, відфільтровують нерозчинні компоненти, значення рНН фільтрату встановлюють на 2 додаванням насиченого водяного розчину KHSO4, перемішують протягом 5 хв і осад, що випав, відокремлюють вакуум-фільтрацією. Сирий продукт промивають водою й сушать у вакуумі, одержуючи таким шляхом 2,37 г сполуки А-3а. + + MC( ESI ): 501 (М+Н) . Синтез із використанням (1R,2S)-2-аміно-1циклопентанкарбонової кислоти, відповідно (1R*,2S*)-(±)-2-аміно-1-циклопентанкарбонової кислоти, проводять аналогічним шляхом. Відповідні продукти позначені як сполуки А-2b (хиральне, енантіомер стосовно сполуки А-2а) і сполуки А-2с (рацемічне). Одержання гідрохлориду (1S,2R)-2аміноциклопентанкарбонової кислоти 21 2,59 г (4,9 ммоля) сполуки А-3а, 2,21 г (6,9 ммоля, 1,4 екв.) ТБТУ й 4,21 мл (24,6 ммоля, 5 екв.) основи Хюніга розчиняють в 75 мл ДМФ і перемішують протягом 20 хв при КТ. Після цього додають 0,63 мл (7,38 ммоля, 1,5 екв.) ізопропіламіна й суміш залітають перемішуватися на ніч при КТ. Потім тверду речовину відокремлюють вакуумфільтрацією через основний оксид алюмінію, промивають ДМФ, матковий розчин при перемішуванні додають в 400 мл води, перемішують протягом 30 хв і осад, що випав, відокремлюють вакуумфільтрацією. Сирий продукт промивають водою й сушать у вакуумі. Для очищення протягом 30 хв розмішують при 5°С з 50 мл MeCN, тверду речовину відокремлюють вакуум-фільтрацією, промивають невеликою кількістю холодного MeCN і залишок сушать у вакуумі. Таким шляхом одержують 2,13 г сполуки А-4а. Rf=0,53 (силікагель, циклогексан/ЕА в співвідношенні 1:1). + + МС (ESI ): 542 (Μ+Η) . Аналогічним шляхом, використовуючи етиламін, відповідно циклопропіламін, одержують сполуки А-4d і А-4е А-5d) 4-[4-((1R,2S)-2ізопропілкарбамоїлциклобутиламіно)-5 94944 22 які служать едуктами (вихідними сполуками) у послідовності синтезу сполук із прикладів 9 і 10. А-5а) 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]бензойна кислота 2,13 г (3,9 ммоля) сполуки А-4а розчиняють в 150 мл ТГФ і додають 250 мг гідроксида палладія на вугіллі як каталізатор (20 мас. % Pd на вугіллі). Після цього суміш при перемішуванні й при КТ гідрирують протягом 16 год при тиску Н2 6 бар. Потім додають 30 мл МеОН, каталізатор відфільтровують через кізельгур, після чого промивають МеОН і фільтрат концентрують. Залишок разом з 45 мл EtOH нагрівають до кипіння, повільно прохолоджують до 5°С, перемішують протягом 1 год, тверду речовину потім відокремлюють вакуумфільтрацією й промивають холодним EtOH. Таким шляхом одержують 2,46 г сполуки А-5а. Rf=0,46 (силікагель, СН2СІ2/MeОН/АсОН у співвідношенні 5:1:0,1). + + МС (ESI ): 452 (Μ+Η) . Аналогічним шляхом синтезують енантіомерну сполуку А-5b, а також рацемат А-5с трифторметилпіримідин-2-іламіно]бензойна кислота 23 250 мг (2,8 ммоля, 1 екв.) сполуки В-1а розчиняють в 1 мл ДМА й додають 0,74 мл (4,3 ммоля, 5,5 екв.) основи Хюніга. Потім додають 461 мг (2,4 ммоля, 3 екв.) аміди ще 2аміноциклобутанкарбонової кислоти й реакційну суміш нагрівають до 70°С. Через 1 год реакція повністю завершується. Реакційну суміш змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночної хроматографією на Оф-фазі (градієнтне елюювання протягом 12 хв, починаючи із суміші вода/MeCN у співвідношенні 78:22 (+0,2% НСООН) і закінчуючи сумішшю вода/MeCN у співвідношенні 58:42). Відповідний, утримуючий продукт фракції поєднують і шляхом сушіння виморожувановим видаляють розчинник, одержуючи в результаті 50 мг сполуки А-5d. Метил-(1,2,2,6,6-пентаметилпіперидин-4іл)амін (едукт для синтезу сполуки із приклада 1) 10 г 4-(Вос-аміно)піперидина, 4 мл етилброміда й 10 г карбонату калію протягом 2 год перемішують в 75 мл ДМА при 120°С. Потім реакційну суміш при перемішуванні додають в 500 мл води, тричі шляхом струшування екстрагують ΕА порціями по 150 мл, органічну фазу сушать над MgSO4, концентрують і залишок розчиняють в 300 мл диетилового ефіру. Після цього при охолодженні льодом змішують із 20 мл 4-молярної соляної кислоти в 1,4-діоксані, протягом 15 хв перемішують при 0°С, осад відокремлюють вакуум-фільтрацією, промивають диетиловим ефіром і сушать у вакуумі. Таким шляхом одержують 11,5 г гідрохлориду трет-бутилового ефіру (1-етилпіперидин-4іл)карбамінової кислоти, що без додаткового очищення використають у наступній реакції. 1 г (3,8 ммоля, 1 екв.) гідрохлориди третбутилового ефіру (1-етилпіперидин-4іл)карбамінової кислоти розчиняють в 25 мл ДМФ, додають 378 мг (9,4 ммоля, 2,5 екв.) гідриду натрію (у вигляді 60%-ний дисперсії в маслі) і після додавання 246 мкл (3,95 ммоля, 1,1 екв.) метил 94944 24 2 г (11,8 ммоля, 1 екв.) 1,2,2,6,6-пентаметил-4піперидона розчиняють в 10 мл ТГФ, додають 3,99 г (59,1 ммоля, 5 екв.) гідрохлориду метиламіну й реакційну суміш перемішують протягом 1 год при КТ. Потім додають 4,85 г (59,1 ммоля, 5 екв.) ацетату натрію й 2,78 г (11,82 ммоля, 1 екв.) трисацетоксиборогидрида натрії й реакційну суміш протягом 16 год перемішують при КТ. Після закінчення цього часу реакція, протікання якої контролюють за допомогою тонкошарової хроматографії, повністю завершується. Після цього відфільтровують нерозчинні компоненти, фільтрат змішують із силікагелем і у вакуумі видаляють летучі компоненти. Шляхом очищення колоночною хроматографією (нормальна фаза, силікагель, ДХМ/МеОН/NH3 (водн.) у співвідношенні 7:3:0,3) одержують 373 мг аміну. Rf=0,47 (силікагель, СН2СІ2/МеОН/NH3 у співвідношенні 6:4:0,4). (1-етилпіперидин-4-іл)метиламін (едукт для синтезу сполуки із приклада 5) йодида перемішують протягом 30 хв при КТ. Далі реакційну суміш при перемішуванні додають в 150 мл води, значення рН установлюють на 8 додаванням насиченого водяного розчину NaΗСО3 і тричі екстрагують ЕА порціями по 50 мл. Органічну фазу сушать над MgSO4 і у вакуумі видаляють розчинник, одержуючи 300 мг трет-бутилового ефіру (1-етилпіперидин-4-іл)метилкарбамінової кислоти. Цей ефір додають в 5 мл ДХМ, після чого додають 928 мкл соляної кислоти (4-молярної в 1,4-діоксані, 3 екв.) і перемішують протягом 4 год при КТ. Після закінчення цього часу ступінь перетворення становить лише приблизно 30%, у зв'язку із чим додають 1 мл трифтороцтової кислоти й перемішують протягом 1 год при КТ. Після цього концентрують у вакуумі й сирий (1-етилпіперидин4-іл)метиламін без додаткового очищення використають у реакції амідного сполучення. трет-Бутиловий ефір4ізопропіламінопіперидин-1-карбонової кислоти (едукт для синтезу сполуки із приклада 6) 25 500 мг (2,51 ммоля, 1 екв.) 1-Вос-4піперидинона додають в 7 мл 1,2-дихлоретана, після чого додають 214 мкл (2,51 ммоля, 1 екв.) ізопропіламіна й перемішують протягом 20 хв при КТ. Після додавання 145 мкл (2,51 ммоля, 1 екв.) 94944 26 крижані оцтові кислоти порціями додають 745 мг (3,5 ммоля, 1,4 екв.) трис-цетоксиборогидрида натрію й суміш залишають перемішуватися на ніч при КТ. Потім реакційну суміш змішують із 25 мл насиченого водяного розчину NaΗСО3, по завершенні газовиділення тричі екстрагують ДХМ порціями по 20 мл, об'єднані органічні фази сушать над MgSO4 і у вакуумі видаляють розчинник, одержуючи 527 мг аміну як продукт, що без додаткового очищення використають у наступній реакції. Амід (±)-цис-2-аміноциклобутанкарбонової кислоти 5 г (20, 1 ммоля, 1 екв.) цис-2(бензилоксикарбоніламіно)циклобутанкарбонової кислоти розчиняють в 10 мл ТГФ і додають 3,9 г (24,1 ммоля, 1, 2 екв.) карбонілдиімідазола (КДИ). Прозорий розчин перемішують протягом 40 хв при КТ і потім додають 26,6 мл водяного розчину аміаку (1,4 моля, 70 екв., 28-30%-ний). Через 30 хв після додавання цього розчину реакційну суміш зливають в 500 мл води й тричі екстрагують ЕА порціями по 150 мл. Після об'єднання органічних фаз, сушіння над MgSO4 і видалення всіх летучих компонентів у вакуумі одержують 4,05 г аміду N-Ζцис-2-аміноциклобутанкарбонової кислоти. + + ΜC (ESI ): 249 (Μ+Η) . Для видалення захисної групи 2 г (8,06 ммоля, 1 екв.) продукту при 0°С суспендують у розчині 100 мл бромистого водню в крижаній оцтовій кислоті (33%) і перемішують протягом 2 год при 0°С. Потім розчин при перемішуванні додають у приблизно 500 мл диетилового ефіру, осад відокремлюють вакуум-фільтрацією й протягом 2 год розмішують у диетиловом ефірі. Осад промивають ТГФ, одержуючи 1,27 г аміду цис-2аміноциклобутанкарбонової кислоти у вигляді гідроброміду. + + МС (ESI ): 115 (Μ+Η) . Ізопропіламід (±)-цис-2аміноциклобутанкарбонової кислоти 1 г (4 ммоля, 1 екв.) цис-2(бензилоксикарбоніламіно)циклобутанкарбонової кислоти розчиняють в 2 мл ТГФ і додають 3,22 г (10 ммолей, 2,5 екв.) ТБТУ, а також 3,43 мл (20 ммолей, 5 екв.) основи Хюніга. Суспензію перемішують протягом 30 хв при КТ і потім по краплях додають 513 мкл (6,02 ммоля, 1,5 екв.) ізопропіламіна. Після 16-годинного перемішування при КТ реакція повністю завершується, і реакційну суміш при перемішуванні додають в 200 мл води. Після цього тричі екстрагують ЕА порціями по 50 мл. Після об'єднання органічних фаз, сушіння над MgSO4 і видалення всіх летучих компонентів у вакуумі одержують 1,1 г ізопропіламіда N-Ζ-цис-2аміноциклобутанкарбонової кислоти. Rf=0,57 (силікагель, CH2СІ2/MeОH/NH3 у співвідношенні 9:1:0,1). + + МС (ESI ): 291 (М+Н) . Для видалення захисної групи 1,1 г (3,79 ммоля, 1 екв.) продукту при 0°С суспендують у розчині 100 мл бромистого водню в крижаній оцтовій кислоті (33%) і перемішують протягом 2 год при 0°С. Потім розчин при перемішуванні додають у приблизно 250 мл диетилового ефіру, осад відокрем люють вакуум-фільтрацією й протягом 2 год розмішують у диетиловому ефірі. Після промивання осаду ТГФ одержують 644 мг ізопропіламіда цис-2аміноциклобутанкарбонової кислоти у вигляді гідроброміду. + + МС (ESI ): 157 (М+Н) . В-1а) 4-(4-хлор-5-трифторметилпіримідин-2іламіно)бензойна кислота 2 г (4,91 ммоля) сполуки А-2а розчиняють в 88 мл діоксана, додають 220 мг гідроксида палладія (1,57 ммоля, 0,32 екв.) і протягом 16 год перемішують при тиску Н2 3 бари й при КТ. Потім реак 27 ційну суміш фільтрують через Celite, промивають ТГФ і від фільтрату у вакуумі видаляють розчинник, одержуючи 1,31 г сполуки В-1а, що без додаткового очищення використають у наступній реакції. + + МC (ESI ): 318 (М+Н) . В-2а) 4-(4-хлор-5-трифторметилпіримідин-2іламіно)бензилхлорид 1,31 г (4,13 ммоля) сполуки В-1а суспендують в 100 мл толуолу, при перемішуванні обережно додають 360 мкл (4,96 ммоля, 1,2 екв.) тіонілхлорида й розчин протягом 1 год нагрівають зі зворотним холодильником. Після охолодження до КТ всі летучі компоненти видаляють у вакуумі й залишок, що представляє собою сполуки В-2а, без додаткового очищення використають у наступній реакції. В-3а) 4-(4-хлор-5-трифторметилпіримідин-2іламіно)-N-метил-N-(1-метилпіперидин-4іл)бензамід 1,36 г (4,05 ммоля) сполуки В-2а розчиняють в 10 мл ТГФ і змішують із 1,04 мл (6,1 ммоля, 1,5 екв.) основи Хюніга. Після додавання 589 мкл (4,1 ммоля, 1 екв.) 1-метил-4-(метиламіно)піперидина розчин перемішують протягом 1 год при КТ. Потім реакційну суміш зливають у приблизно 100 мл дистильованої води, перемішують протягом 30 хв і водну фазу тричі екстрагують ЕА порціями по 100 мл. Після сушіння органічної фази над MgSO4, фільтрації й видалення летучих компонентів у вакуумі одержують 1,64 г сполуки В-3а. Rf=0,30 (силікагель, CH2СІ2/МеОН/NH3 у співвідношенні 5:1:0,1). + + МС (ESI ): 428 (Μ+Η) . В-4с) (±)-(1S*2R*)-2-(2-{4-[метил-(1метилпіперидин-4-іл)карбамоїл]феніламіно}-5 94944 28 трифторметилпіримідин-4іламіно)циклопентанкарбонова кислота 1 г (2,34 ммоля) сполуки В-3а розчиняють в 2,9 мл ДМА й потім додають 1,2 мл (7,01 ммоля, 3 екв.) основи Хюніга. Після додавання 465 мг (2,81 ммоля, 1,2 екв.) цис-2-аміно-1циклопентанкарбонової кислоти (рацемічної) перемішують протягом приблизно 30 хв при 120°С. Потім реакційну суміш змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночною хроматографією на Оф-фазі (градієнтне елюювання протягом 10 хв, починаючи із суміші вода/MeCN у співвідношенні 85:15 (+0,2% НСООН) і закінчуючи сумішшю вода/MeCN у співвідношенні 72:28). Відповідний, утримуючий продукт фракції поєднують і шляхом сушіння виморожувановим видаляють розчинник, одержуючи 578 мг сполуки В-4с. + + MC (ESI ): 521 (М+Н) . Аналогічним шляхом одержують зазначене нижче сполуки В-4а, використовуючи EtOH як розчинник і (1S,2R)-2-аміноциклопентанкарбонову кислоту як вихідний матеріал. В-4а) (1S,2R)-2-(2-{4-[метил-(1метилпіперидин-4-іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4іламіно)циклопентанкарбонова кислота + + MC (ESI ): 521 (М+Н) . В-4d) (1S,3R)-3-(2-{4-[метил-(1метилпіперидин-4-іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4іламіно)циклопентанкарбонова кислота 29 94944 30 76:24). Відповідний, утримуючий продукт фракції поєднують і шляхом сушіння виморожувановим видаляють розчинник, одержуючи 150 мг сполуки В-4d. Аналогічним шляхом з використанням (1R,3S)3-аміноциклопентанкарбонової кислоти можна одержати енантіомерну сполуку В-4е 200 мг (0,46 ммоля, 1 екв.) сполуки В-3а розчиняють в 750 мкл ДМА й додають 160 мкл (0,92 ммоля, 2 екв.) основи Хюніга. Потім додають 72 мг (0,56 ммоля, 1,2 екв.) (1S,3R)-3аміноциклопентанкарбонової кислоти й реакційну суміш протягом 40 хв при перемішуванні витримують при 120°С. Після цього реакційну суміш змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночною хроматографією на Оф-фазі (градієнтне елюювання протягом 20 хв, починаючи із суміші вода/MeCN у співвідношенні 85:15 (+0,2% НСООН) і закінчуючи сумішшю вода/MeCN у співвідношенні 9,7 г (99,9 ммоля, 1 екв.) малеиніміда суспендують в 100 мл бензолу й потім при 5°С повільно додають 8 г (99,9 ммоля, 1 екв.) циклогексадиєна, суспендованого в 20 мл бензолу. Далі реакційну суміш повільно нагрівають до температури перегонки й протягом 3 год перемішують при нагріванні зі зворотним холодильником. Після охолодження до 0°С осад відфільтровують і сушать у вакуумі. Таким шляхом одержують 14,7 г циклоадукту. + + M3 (ESI ): 178 (М+Н) . 12,2 г (68,6 ммоля, 1 екв.) зазначеного вище циклоадукта розчиняють в 240 мл ЕА й додають 1,2 г палладія на активованому вугіллі (20 мас. % Pd, 11,3 ммоля, 0,16 екв.). Потім реакційну суміш при КТ перемішують в атмосфері водню (5 бар) до припинення поглинання водню (20 ч). Після цього додають суміш із МеОН і ДХМ (у співвідношенні 1:1, 50 мл), каталізатор відфільтровують і летучі компоненти видаляють у вакуумі. Таким шляхом одержують 12,1 г продукту, що без додаткового очищення використають у наступній реакції. До розчину 36,6 г (652,2 ммоля, 9 екв.) гідроксида калії у воді при 0°С по краплях додають 3,7 мл (72,2 ммоля, 1 екв.) брому. Потім розчин при подальшому охолодженні до 0°С змішують із 13 г (72,7 ммоля, 1 екв.) продукту гідрування. Після нагрівання до КТ суміш протягом 2,5 год витримують при 60°С. Далі реакційну суміш прохолоджують до КТ, підкисляють водною соляною кислотою й у вакуумі видаляють всі летучі компоненти. Залишок розтирають із холодною водою, осад відфільтровують, фільтрат концентрують досуха, додають гарячий 1-бутанол, кип'ятять із ним, знову 3-амінобіцикло[2.2.2]октан-2-карбонова кислота відфільтровують нерозчинні компоненти й потім промивають гарячим 1-бутанолом. Фільтрат концентрують у вакуумі й перекристалізацією з EtОН одержують 2,4 г зазначеної в заголовку сполуки. + + MC (ESI ): 170 (М+Н) . В-4f) 3-(2-{4-[метил-(1-метилпіперидин-4іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4іламіно)біцикло[2.2.2]октан-2-карбонова кислота Сполуки В-4f одержують аналогічно сполуки В4а, використовуючи EtOH як розчинник і піддаючи 3-амінобіцикло[2.2.2]октан-2-карбонову кислоту взаємодії із сполукою В-3а. + + MC (ESI ): 561 (М+Н) . В-4g) 3-(2-{4-[метил-(1-метилпіперидин-4іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4іламіно)циклобутанкарбонова кислота 31 Сполуки В-4g одержують аналогічно сполуки В-4а, використовуючи EtOH як розчинник і піддаючи цис-3-аміноциклобутанкарбонову кислоту взаємодії із сполукою В-3а. B-4h) (±)-(1S*2R*)-2-(2-{4-[метил(1метилпіперидин-4-іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4іламіно)циклогексанкарбонова кислота Сполуки В-4h одержують аналогічно сполуки В-4а, використовуючи 1-бутанол як розчинник і піддаючи (±)-цис-2-аміноциклогексанкарбонову кислоту взаємодії із сполукою В-3а. В-4і) (±)-(1S*6R*)-6-(2-{4-[метил(1метилпіперидин-4-іл)карбамоїл]феніламіно}-5трифторметилпіримідин-4-іламіно)циклогекс-3енкарбонова кислота Сполуки В-4і одержують аналогічно сполуки В4а, використовуючи 1-бутанол як розчинник і піддаючи (±)-цис-2-аміноциклогекс-3-єнкарбонову кислоту (фірма BioBlocks) взаємодії із сполукою В3а. Ізопропіламід цис-(±)-2аміноциклопентанкарбонової кислоти 94944 32 55 мг (0,43 ммоля) цис-(±)-2аміноциклопентанкарбонової кислоти суспендують в 900 мкл (25 екв.) ізопропіламіна й додають 205 мг (0,064 ммоля, 1,5 екв.) ТБТУ й 550 мкл ДМФ. Потім реакційну суміш перемішують протягом 16 год, після чого розчиняють у суміші ДХМ/MeОН/NH3 (водн.) у співвідношенні 9:1:0,1 і змішують із 7 мл силікагелю. Після видалення всіх летучих компонентів у вакуумі хроматографують (силікагель, ДХМ/MeОН/NH3 у співвідношенні 9:1:0,1). Таким шляхом одержують 63 мг зазначеної в заголовку сполуки. Rf=0,33 (силікагель, ДХМ/МеОН/NH3 у співвідношенні 85:15:1,5). Аналогічно цьому методу з використанням (1S,2R)-2-аміноциклопентанкарбонової кислоти одержують хиральну сполуку - ізопропіламід (1S,2R)-2-аміноциклопентанкарбонової кислоти. Крім цього таким же шляхом виходячи з 2аміноциклопентанкарбонової кислоти (рацемічної або хиральної) одержують безліч амідів. Загальна методика синтезу сполук типу С-1 2 Відповідним чином заміщений замісником R 2,4-дихлорпіримідин А-1 (є в продажу, відповідно одержують хлоруванням відповідного урацила аналогічно одержанню сполуки А-1а) розчиняють у ТГФ (діоксані, ДМА, N-МП, ацетоні або ДХМ) (приблизно 2-5 мл/ммоль), додають 1-1,6 екв. основи Хюніга (триетиламіна, карбонату калію або іншої прийнятної основи) і реакційну суміш термостатують (-78°С у випадку володіючих особливо високою реакційною здатністю піримідинів, КТ або підвищена температура у випадку володіючих низькою реакційною здатністю піримідинів). Потім додають приблизно 0,75-1 екв. аміну, розчиненого у відповідному розчиннику (див. вище), і реакційну суміш протягом певного періоду часу перемішують при відповідній температурі, відповідно відтають або нагрівають залежно від реакційної здатності використовуваного піримідина. По завершенні реакції (протікання якої контролюють за допомогою ЖХВР або ТСХ) реакційну суміш змішують із силікагелем і всі летучі компоненти видаляють у вакуумі. Шляхом очищення колоночною хроматографією одержують необхідні продукти заміщення. 2 Залежно від залишку R у піримідині утворяться обоє можливих регіоізомера в різних співвідношеннях. Звичайно їх можна розділяти хроматографією. C-1c) Ізопропіламід (±)-(1S*,2R*)-2-(2-хлор-5трифторметилпіримідин-4іламіно)циклопентанкарбонової кислоти 33 2 г (9,2 ммоля) сполуки А-1а і 1,8 мл (11,2 ммоля, 1,2 екв.) основи Хюніга розчиняють в 60 мл ТГФ, прохолоджують до - 78°С, а потім при - 78°С повільно по краплях додають ізопропіламід цис(±)-2-аміноциклопентанкарбонової кислоти, розчинений в 60 мл ТГФ. Після цього реакційної суміші дають протягом ночі при перемішуванні розмерзтися до КТ. Потім змішують із 40 мл силікагелю й всі летучі компоненти видаляють у вакуумі. Обоє per іоізомерних продуктів розділяють колоночною хроматографією, при цьому необхідний регіоізомер є першим елююємим продуктом (силікагель, градієнтне елюювання сумішшю циклогексан/ЕА в співвідношенні, що за 30 хв змінюють із 85:15 до 80:20). Таким шляхом виділяють 590 мг сполуки С1с, а також 690 мг регіоізомерного продукту С-1с'. Rf (С-1c) = 0,21 (силікагель, циклогексан/ЕА в співвідношенні 3:1), [Rf (С-1c') = 0,10]. + + MC (ESI ): 351 (M+H) . УФмакс=246 нм. С-1a) Ізопропіламід (1S,2R)-2-(2-хлор-5трифторметилпіримідин-4іламіно)циклопентанкарбонової кислоти 94944 34 міда (1S,2R)-2-аміноциклопентанкарбонової кислоти й реакційну суміш перемішують протягом 1 год при 70°С. Після закінчення цього часу дані контролю за протіканням реакції за допомогою ЖХВР свідчать про повне її завершення й про утворення тільки одного регіоізомера. Реакційну суміш змішують із ОФ-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночної хроматографією на ОФ-фазі (градієнтне елюювання сумішшю вода/MeCN (+ по 0,2% НСООН) у співвідношенні, що за 15 хв змінюють із 82:18 до 60:40). Відповідний, утримуючий продукт фракції поєднують і шляхом сушіння виморожувановим видаляють розчинник, одержуючи 956 мг сполуки С-1d. Rf=0,15 (силікагель, циклогексан/ЕА в співвідношенні 1:1). + + МС (ESI ): 297/299 (Μ+Η) . С-1e) Ізопропіламід (1S,2R)-2-(2-хлор-5бромпіримідин-4-іламіно)циклопентанкарбонової кислоти Сполуки С-1e синтезують аналогічно одержанню сполуки С-1d з використанням 1-бутанола (0,7-молярного) як розчинника при 70°С і при перемішуванні протягом 2 год. Продукт виділяють шляхом концентрування у вакуумі й промивання осаду МеОН. + + МС (ESI ): 361/363 (Μ+Η) . С-1f) Ізопропіламід (1S,2R)-2-(2,5дихлорпіримідин-4-іламіно)циклопентанкарбонової кислоти Хиральну сполуку С-1а одержують аналогічним шляхом виходячи з ізопропіламіда (1S,2R)-2аміноциклопентанкарбонової кислоти. С-1d) Ізопропіламід (1S,2R)-2-(2-хлор-5метилпіримідин-4-іламіно)циклопентанкарбонової кислоти 1 г (6,1 ммоля, 1 екв.) 5-метил-2,4дихлорпіримідина (отриманого аналогічно сполуки А-1а) розчиняють в 3 мл ДМА й потім по краплях додають 5,3 мл (30,5 ммоля, 5 екв.) основи Хюніга. Далі додають 1,03 г (6,1 ммоля, 1 екв.) ізопропіла Сполуки С-1f синтезують аналогічно одержанню сполуки С-1d з використанням ДХМ (0,3молярного) як розчинника. Вихідні сполуки поєднують при 0°С і реакційну суміш перемішують протягом 6 год при КТ. Rf=0,63 (силікагель, ЕА). С-2а) 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-2етоксибензойна кислота 35 120 мг (0,34 ммоля, 1 екв.) сполуки С-1a разом з 102 мг (0,56 ммоля, 1,7 екв.) 2-етокси-4амінобензойної кислоти суспендують в 500 мкл 4,05 г (21,7 ммоля, 1 екв.) 2-гідрокси-4нітробензойної кислоти розчиняють в 40 мл MeОН і повільно по краплях додають 1,8 мл (24,8 ммоля, 1,14 екв.) тіонілхлорида. Після цього суміш перемішують протягом 2 год при 50°С і потім ще протягом 2 год при нагріванні зі зворотним холодильником. Після охолодження летучі компоненти видаляють у вакуумі, одержуючи 4,36 г сирого метилового ефіру 2-гідрокси-4-нітробензойної кислоти, що без додаткового очищення використають у наступній реакції. 1 г (5,1 ммоля, 1 екв.) цього метилового ефіру розчиняють в 25 мл ДМФ, додають 2,1 г (15,3 ммоля, 3 екв.) карбонату калію й потім по краплях додають 1,4 мл (18,8 ммоля, 3,7 екв.) брометана. Далі реакційну суміш перемішують протягом 16 год при КТ, після чого зливають в 100 мл води й значення рН установлюють на 3 додаванням концентрованої водної соляної кислоти. Потім двічі екстрагують ЕА порціями по 100 мл, сушать над MgSO4 і після видалення всіх летучих компонентів у вакуумі одержують 1,28 г метилового ефіру 2-етокси-4-нітробензойної кислоти. 1,28 г (5,06 ммоля, 1 екв.) цієї нітросполуки розчиняють в 50 мл МеОН, на кінчику шпателя додають нікель Ренея (Ra-Ni) і реакційну суміш протягом 16 год перемішують в автоклаві при тиску водню 4 бари. Потім каталізатор відфільтровують через Celite і від фільтрату у вакуумі видаляють всі летучі компоненти. Таким шляхом одержують 0,99 г аніліну + + [МС (ESI ): 351 (Μ+Н) ]. Це кількість аніліну розчиняють в 5 мл MeОН і додають розчин 0,35 г (14,6 ммоля, 2,9 екв.) гідроксида літію в 10 мл води. Після 16-годинного перемішування при КТ реакційну суміш концентрують у вакуумі, залишок розчиняють в 10 мл води й підкисляють водною соляною кислотою. Осад відфільтровують, промивають водою й сушать у ва 94944 36 ДМА (безводного), змішують із 221 мкл розчину HCl у діоксані (0,89 ммоля, 2,6 екв., 4-молярна) і струшують протягом 2,5 год при 70°С Далі реакційну суміш зливають в 10 мл води, підкисляють концентрованою водною соляною кислотою й осад відфільтровують. Після сушіння у вакуумі одержують 143 мг сполуки С-2а, що без додаткового очищення використають у наступній реакції. Аналогічним шляхом проводять реакції з іншими 2-алкоксизаміщеними бензойними кислотами (синтез вихідних сполук для одержання сполук із прикладів 131, 133 і 134). Для одержання сполуки із приклада 135 використають 2-хлор-4амінобензойну кислоту. 2-етокси-4-амінобензойна кислота куумі. Таким шляхом одержують 392 мг 2-етокси-4амінобензойної кислоти. C-2d) 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5метилпіримідин-2-іламіноїбензойна кислота 956 мг (3,2 ммоля, 1 екв.) сполуки С-1d розчиняють в 5,4 мл 1-бутанола й отриманий розчин змішують із 446 мг (3,2 ммоля, 1 екв.) 4амінобензойної кислоти. Після додавання 105 мкл (0,42 ммоля, 0,13 екв.) розчину соляної кислоти в діоксані (4-молярної) суміш протягом 2 год при перемішуванні нагрівають зі зворотним холодильником. Осад, що утворився після охолодження, відфільтровують і промивають 2 мл холодного 1бутанола. Після сушіння у вакуумі одержують 1,15 г сполуки С-2d, що без додаткового очищення використають у наступній реакції. + + МС (ESI ): 398 (Μ+Η) . С-2е) 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5хлорпіримідин-2-іламіно]бензойна кислота 37 94944 38 ють із 1,5 мл (8,76 ммоля, 10,3 екв.) основи Хюніга й протягом 20 хв витримують при перемішуванні в мікрохвильовій печі при 150°С. Після цього всі летучі компоненти видаляють у вакуумі й отриманий сирий продукт (418 мг) без додаткового очищення використають у наступній реакції. E-1) 2-метилсульфаніл-1Η-піримідин-4-он Сполуки С-2e синтезують аналогічно одержанню сполуки С-2d. D-1a) (±)-4-[4-((1R*2S*)-2аміноциклогексиламіно)-5трифторметилпіримідин-2-іламіно]-Ν-метил-Ν-(1метилпіперидин-4-іл)бензамід 500 мг (1,17 ммоля, 1 екв.) сполуки В-3 а розчиняють в 5 мл 1-бутанола й змішують із 760 мкл (4,44 ммоля, 3,8 екв.) основи Хюніга. Потім додають 165 мкл (1,40 ммоля, 1,2 екв.) цис-1,2діаміноциклогексана й реакційну суміш протягом 15 хв витримують у мікрохвильовій печі при 150°С Після цього у вакуумі видаляють всі летучі компоненти й залишок розчиняють у ДХМ. Потім двічі промивають розведеним водяним розчином хлориду амонію, органічну фазу сушать над MgSO4 і у вакуумі видаляють розчинник, одержуючи 477 мг сполуки D-1a. + + МC (ESI ): 506 (Μ+Η) . D-1b) (±)-4-[4-((1R*2S*)-2аміноциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід 364 мг (0,85 ммоля, 1 екв.) сполуки В-3 а розчиняють в 1 мл ДМА й потім додають 177 мг (1,02 ммоля, 1,2 екв.) дигідрохлорида цис-1,2діаміноциклопентана. Далі реакційну суміш змішу 20 г (153 ммоля) 2-тіоурацила суспендують в 250 мл МеОН і потім додають 8,7 г (152,9 ммоля, 1 екв.) метанолята натрію. Розчин протягом 5 хв перемішують при КТ, після чого по краплях додають 12,4 мл (198,8 ммоля, 1,3 екв.) метилйодида. Потім реакційну суміш залишають перемішуватися на ніч, після чого зливають у воду й тричі екстрагують хлороформом порціями приблизно по 150 мл. Об'єднані органічні фази сушать над MgSO4 і у вакуумі видаляють розчинник, одержуючи 16 г сполуки Е-1. Е-2) 4-(6-оксо-1,6-дигідропіримідин-2іламіно)бензойна кислота 4,1 г (28,8 ммоля) сполуки Е-1 розчиняють в 10 мл диглима (диметиловий ефір диетиленгликоля) і отриманий розчин змішують із 4,79 г (34,6 ммоля, 1,2 екв.) 4-амінобензойної кислоти. Потім реакційну суміш протягом 16 год нагрівають зі зворотним холодильником. Після охолодження до КТ осад відокремлюють вакуум-фільтрацією, промивають невеликою кількістю диглима, а потім диетиловим ефіром і сушать у вакуумі. Таким шляхом одержують 5,27 г сполуки Е-2. + + МС (ESI ): 232 (Μ+Η) . Е-3) 4-(5-бром-6-оксо-1,6-дигідропіримідин-2іламіно)бензойна кислота 9 г (38,9 ммоля) сполуки Е-2 додають в 10 мл оцтової кислоти, а потім по краплях додають розчин 2,1 мл (40,9 ммоля, 1,05 екв.) брому в 50 мл оцтової кислоти й перемішують протягом приблиз 39 но 1 год при КТ. Далі реакційну суміш при перемішуванні додають в 800 мл води, осад, що випав, відокремлюють вакуум-фільтрацією, отриманий осад промивають водою й сушать у вакуумі. Таким шляхом одержують 11,5 г сполуки Ε-3. Rf=0,27 (силікагель, ЕА/МеОН у співвідношенні 7:3). + + MC (ESI ): 309/311 (М+Н) . Е-4) 4-(4-хлор-5-бромпіримідин-2іламіно)бензойнакислота,відповідно Е-5) 4-(4хлор-5-бромпіримідин-2-іламіно)бензилхлорид 5 г (16,1 ммоля) сполуки Ε-3 суспендують в 70 мл оксихлорида фосфору й протягом 1 год при перемішуванні нагрівають зі зворотним холодильником. Далі реакційну суміш при інтенсивному перемішуванні по краплях додають в 600 мл суміші води з льодом, перемішують ще протягом 30 хв і відфільтровують сиру кислоту Е-4. Її сушать у вакуумі й без додаткового очищення використають у наступній реакції. Для одержання хлорангидрида кислоти 2,7 г (8,2 ммоля) сирі кислоти розчиняють в 20 мл толуолу й додають 715 мкл (9,9 ммоля, 1,2 екв.) тіонілхлорида. Потім реакційну суміш протягом 1 год перемішують при температурі перегонки й після цього концентрують у вакуумі. Після сушіння у вакуумі одержують 2,9 г сполуки Е-5. Ε-6) 4-(5-бром-4-хлорпіримідин-2-іламіно)-Nметил-N-(1-метилпіперидин-4-іл)бензамід 500 мг (1,44 ммоля, 1 екв.) сполуки Е-5 розчиняють в 20 мл ТГФ і змішують із 370 мкл (2,16 ммоля, 1,5 екв.) основи Хюніга, а потім з 209 мкл (1,44 ммоля, 1 екв.) 1метил-4(метиламіно)піперидина. Далі реакційну суміш перемішують протягом 16 год при КТ і після цього зливають в 250 мл води. Потім чотири рази екстрагують ЕА порціями по 100 мл. Об'єднані органічні фази сушать над MgSO4 і у вакуумі видаляють 94944 40 розчинник. Таким шляхом одержують 418 мг сполуки Ε-6. Rf=0,64 (силікагель, ДХМ/MeOH/NH3 у співвідношенні 5:1:0,1). + + МС (ESI ): 440/442 (Μ+Η) . Ε-7а) (1S,2R)-2-(5-бром-2-(4-[метил(1метилпіперидин-4іл)карбамоїліфеніламіно}піримідин-4іламіно)циклопентанкарбонова кислота 1,91 г (4.35 ммоля, 1 екв.) сполуки Ε-6 суспендують в 5 мл ДМА й змішують із 1,5 мл (8.7 ммоля, 2 екв.) основи Хюніга. До отриманого розчину додають 865 мг (5,22 ммоля, 1,2 екв.) (1S,2R)-2аміноциклопентанкарбонової кислоти й реакційну суміш протягом 120 хв перемішують при 120°С (у мікрохвильовій печі СЕМ, 100 Вт). Після цього реакційну суміш концентрують, розмішують у приблизно 200 мл води й тричі екстрагують ЕА порціями по 100 мл. Об'єднані органічні фази сушать над MgSO4 і концентрують у вакуумі. Потім змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночної хроматографією на Оф-фазі (градієнтне елюювання сумішшю вода/MeCN (+ по 0,2% НСООН) у співвідношенні, що протягом 20 хв змінюють із 92:8 до 79:21). Відповідно, утримуючий продукт фракції поєднують і шляхом сушіння виморожуваннням видаляють розчинник. Таким шляхом одержують 1,26 г сполуки Ε-7а. + + MC (ESI ): 531/533 (М+Н) . E-7b) (±)-(1S*,2R*)-2-(5-бром-2-(4-[метил(1метилпіперидин-4іл)карбамоїліфеніламіно}піримідин-4іламіно)циклопентанкарбонова кислота Сполуки Ε-7b одержують аналогічно сполуки Ε-7а з використанням рацемічної цис-2аміноциклопентанкарбонової кислоти. Приклад 1: 4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5 41 трифторметилпіримідин-2-іламіно]-N-метил-N(1,2,2,6,6-пентаметилпіперидин-4-іл)бензамід 100 мг (0,22 ммоля) сполуки А-5а розчиняють в 2 мл ДМФ і додають 190 мкл (1,11 ммоля, 5 екв.) основи Хюніга й 112 мг (0,35 ммоля, 1,6 екв.) ТБТУ. Далі реакційну суміш перемішують протягом 30 хв при КТ і потім по краплях додають 88 мг (0,38 ммоля, 1,7 екв., зміст 80%) метил (1,2,2,6,6пентаметилпіперидин-4-іл)аміни. Після цього реакційну суміш перемішують протягом 2 днів при КТ, фільтрують через основний оксид алюмінію, потім змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночної хроматографією на Оф-фазі (градієнтне елюювання сумішшю вода/MeCN (+ по 0,2% НСООН) у співвідношенні, що протягом 15 хв змінюють із 80:20 до 55:45). Відповідно, утримуючий продукт фракції поєднують, змішують із концентрованою соляною кислотою й шляхом сушіння виморожуванням видаляють розчинник, одержуючи 61 мг сполуки із приклада 1 у вигляді гідрохлориду. Аналогічним шляхом одержують сполуки із прикладів 3, 5 і 8. У випадку рацемических сполук із прикладів 2 і 7 використають сполуки А-5с, а у випадку сполуки із приклада 4 замість сполуки А5а використають сполуки А-5b. Сполуки із прикладів 9 і 10 також одержують аналогічним шляхом відповідно до загальної схеми синтезу А з використанням отриманих шляхом гідрогенолiза із сполук А-4b і А-4с (аналогічно описаному для сполуки А5а методу) бензойних кислот, а сполуки із приклада 84 одержують із використанням сполуки А-5d. Приклад 6: Ν-ізопропіл-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-(1метилпіперидин-4-іл)бензамід Зазначені сполуки синтезують аналогічно сполуки із приклада 1 шляхом амідного сполучення виходячи із сполуки А-5а. При цьому в якості амінного компонента використають трет-бутиловий ефір 4-ізопропіламінопіперидин-1-карбонової кислоти. Із продукту сполучення описаним нижче шляхом видаляють захисну групу й метилюють. 98 мг продукту сполучення сполуки А-5а і третбутилового ефіру 4-ізопропіламінопіперидин-1карбонової кислоти протягом 2 год перемішують при КТ в 2 мл ДХМ і 2 мл трифтороцтової кислоти. Потім додають 10 мл води й значення рН установлюють на 10 додаванням карбонату натрію. Далі тричі шляхом струшування екстрагують ДХМ порціями по 15 мл, органічну фазу сушать над MgSO4, летучі компоненти видаляють у вакуумі й сирий продукт (50 мг) відразу ж піддають подальшому перетворенню. Для цього 50 мг (0,08 ммоля, 1 екв.) продукту додають в 1 мл ДМА, додають 13 мкл формальдегіду (37%-ного у воді, 0,16 ммоля, 2 екв.) і перемішують протягом 20 хв при КТ. Далі по краплях додають 5 мкл крижаної оцтової кислоти, після чого порціями додають 92 мг (0,43 ммоля, 5 екв.) трис-ацетоксиборогидрида натрію й суміш залітають перемішуватися на ніч при КТ. Після цього змішують із 20 мл води, повільно додають 10 мл насиченого водяного розчину NаНСО3, тричі екстрагують ДХМ порціями по 10 мл і сушать над 94944 42 MgSO4. Потім змішують із ОФ-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночною хроматографією на ОФфазі (градієнтне елюювання сумішшю вода/MeCN у співвідношенні, що протягом 15 хв змінюють із 82:18 (+ по 0,2% НСООН) до 60:40). Відповідно, утримуючий продукт фракції поєднують, змішують із концентрованою соляною кислотою й шляхом сушіння виморожувановим видаляють розчинник, одержуючи 7 мг сполуки із приклада 6 у вигляді гідрохлориду. Пример 12: 4-(4-[(1R*2S*)-2-((R)-2-гідрокси-1метилетилкарбамоїл)циклопентиламіно]-5трифторметилпіримідин-2-іламіно}-N-метил-N-(1метилпіперидин-4-іл)бензамід 80 мг (0,15 ммоля, 1 екв.) сполуки В-4с розчиняють в 3 мл ТГФ і змішують із 264 мкл (1,54 ммоля, 10 екв.) основи Хюніга. До отриманого розчину додають 69 мг (0,22 ммоля, 1,5 екв.) ТБТУ й перемішують протягом 40 хв при КТ. Потім суспензію змішують із декількома краплями ДМФ, при цьому всі компоненти, що не розчинилися, переходять у розчин. Потім додають 17 мг (0,23 ммоля, 1,5 екв.) D-аланінола й перемішують протягом 16 год при КТ. Після цього реакційну суміш змішують із 10 мл Оф-геля й всі летучі компоненти видаляють у вакуумі. Далі очищають хроматографією на Оф-фазі (градієнтне елюювання сумішшю MeCN/вода в співвідношенні, що протягом 15 хв змінюють із 15:85 (+ по 0,2% НСООН) до 30:70). Після об'єднання утримуючий продукт фракцій, додавання соляної кислоти (4-молярної в діоксані) і сушіння виморожувановим одержують 85 мг гідрохлориду сполуки із приклада 12. Аналогічним шляхом з використанням відповідних похідних карбонової кислоти В-4 і амінних компонентів одержують сполуки із прикладів 1383, 85-108, 125, 126 і 127, при цьому в деяких випадках як агент сполучення замість ТБТУ можна використати гексафторфосфат О-(7азабензотріазол-1-іл)-Ν,Ν,Ν',Ν'-тетраметилуронію. Сполуки із прикладів 128-130 одержують відповідно до загальної схеми синтезу А, починаючи при цьому послідовність синтезу із взаємодії сполуки А-1а з бензиловим ефіром 4-аміно-3метоксибензойної кислоти. Приклад 110: (±)-4-[4-((1R*,2S*)-2ацетиламіноциклогексиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід 50 мг (0,1 ммоля, 1 екв.) сполуки D-1а (приклад 109) розчиняють в 0,5 мл N-МП, після чого додають 17 мкл (0,12 ммоля, 1,2 екв.) триетиламіна й до отриманого розчину по краплях додають 9 мкл (0,12 ммоля, 1,2 екв.) ацетилхлорида. Потім реакційну суміш перемішують протягом 16 год при КТ, після чого змішують із Оф-гелем і всі летучі компоненти видаляють у вакуумі. Далі очищають хроматографією на Оф-фазі. Таким шляхом одержують 30 мг сполуки із приклада 110. Аналогічним шляхом одержують сполуки із прикладів 112-114 виходячи із сполуки D-1а і відповідних хлорангидридов карбонових кислот. Сполуки із прикладів 120-123 одержують аналогічним шляхом виходячи із сполуки D-1b (приклад 124) 43 шляхом ацилювання в описані в прикладі 110 умовах. Цей же метод синтезу використають і для одержання сполук із прикладів 111 і 115, при цьому в цьому випадку в реакції використають відповідні хлорангідриди сульфонових кислот. При одержанні сполуки із приклада 116 - похідного сечовини - сполуки D-1а піддають в описані в прикладі 110 умовах взаємодії з Ν,Νдиметилкарбамоїлхлоридом. Приклад 117 Сполуки із приклада 117 одержують аналогічно одержанню сполуки В-4 а виходячи із сполуки В-3а і 3-ендо-амінобіцикло(2,2,1)-гепт-5-eн-2-ендокарбонової кислоти з використанням 1-бутанола як розчинник. Приклад 118 Сполуки із приклада 118 одержують аналогічно одержанню сполуки В-4 а виходячи із сполуки В-3а і гідрохлориду 2-адамантанаміна. Приклад 119 Синтез проводять аналогічно прикладу 12 з використанням сполуки із приклада 117 у якості едукта. По завершенні амідного сполучення ненасичене проміжне сполуки при перемішуванні й при КТ гидрують взаємодією з мурашиною кислотою (11 екв.) у присутності каталітичних кількостей Pd/С у ТГФ і таким шляхом одержують сполуки із приклада 119. Приклад 132: 2-етокси-4-[4-((1R,2S)-2ізопропілкарбамоїлциклопентиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід 46 мг (0,09 ммоля, 1 екв.) сполуки С-2 а розчиняють в 1,2 мл ДМФ і потім додають 81 мкл (0,47 ммоля, 5 екв.) основи Хюніга, а також 42 мг (0,13 ммоля, 1,4 екв.) ТБТУ. Потім суміш перемішують протягом 5 хв при КТ і після цього по краплях додають 21 мкл (0,14 ммоля, 1,5 екв.) 1-метил-4(метиламіно)піперидина. Далі реакційну суміш перемішують протягом 2 год при КТ і потім безпосередньо очищають хроматографією на ОФ-фазі (градієнтне елюювання сумішшю вода/MeCN (+ по 0,2% НСООН) у співвідношенні, що протягом 10 хв змінюють із 83:17 до 65:35). Після об'єднання утримуючий продукт фракцій, додавання 500 мкл соляної кислоти (4-молярної в діоксані) і сушіння виморожувановим одержують 47 мг гідрохлориду сполуки із приклада 132. Аналогічним чином шляхом амідного сполучення з відповідних похідних кислот С-2, одержуваних із сполуки С-1a і відповідним чином заміщених 4-амінобензойних кислот шляхом нуклеофільного ароматичного заміщення (як приклад вище описаний синтез сполуки С-2а), одержують сполуки із прикладів 131 і 133-135. 94944 44 Приклад 136: (±)-4-[4-((1R*,2S*)-2ізопропілкарбамоїлциклобутиламіно)-5трифторметилпіримідин-2-іламіно]-N-метил-N-(1метилпіперидин-4-іл)бензамід 150 мг (0,35 ммоля, 1 екв.) сполуки В-3а розчиняють в 1,3 мл EtOH і змішують із 150 мкл (0,88 ммоля, 2,5 екв.) основи Хюніга. Далі реакційну суміш після додавання 100 мг (0,42 ммоля, 1,2 екв.) ізопропіламіда (±)-цис-2аміноциклобутанкарбонової кислоти нагрівають до 70°С і перемішують протягом 16 год при цій температурі. Потім реакційну суміш змішують із 10 мл ОФ-геля й всі летучі компоненти видаляють у вакуумі. Далі очищають хроматографією на ОФ-фазі (градієнтне елюювання сумішшю MeCN/вода в співвідношенні, що протягом 15 хв змінюють із 10:90 до 30:70). Після об'єднання утримуючий продукт фракцій, додавання 100 мкл розчину соляної кислоти в діоксані (4-молярної) і сушіння виморожувановим одержують 86 мг гідрохлориду сполуки із приклада 136. Пример 139: (±)-4-[5-бром-4-[(1R*,2S*)-2циклопропілкарбамоїл)циклопентиламіно)піримідин-2-іламіно]-Nметил-N-(1-метилпіперидин-4-іл)бензамід 55 мг (0,10 ммоля, 1 екв.) сполуки Ε-7b розчиняють в 1 мл ДМФ і додають 88 мкл (0,5 ммоля, 5 екв.) основи Хюніга й 46 мг (0,14 ммоля, 1,4 екв.) ТБТУ. Далі реакційну суміш перемішують протягом 10 хв при КТ і потім по краплях додають 11 мг (0,15 ммоля, 1,5 екв.) циклопропіламіна. Після цього перемішують протягом 2 днів при КТ, реакційну суміш фільтрують через основний оксид алюмінію, потім змішують із Оф-гелем, летучі компоненти видаляють у вакуумі й продукт очищають і виділяють колоночною хроматографією на Оффазі (градієнтне елюювання сумішшю вода/MeCN (+ по 0,2% НСООН) у співвідношенні, що протягом 10 хв змінюють із 88:12 до 75:25). Відповідний, утримуючий продукт фракції поєднують, змішують із 100 мкл розчину соляної кислоти в діоксані (4молярної) і шляхом сушіння виморожувановим видаляють розчинник, одержуючи 25 мг сполуки із приклада 139 у вигляді гідрохлориду. Аналогічним шляхом одержують сполуки із прикладів 137, 138, 140-144 і 146, використовуючи при цьому для одержання сполук із прикладів 142, 143 і 146 хиральне вихідне сполуки Ε-7а. Приклад 145/147 Сполуки із приклада 145, відповідно 147 синтезують аналогічно одержанню сполуки із приклада 1 шляхом амідного сполучення сполуки С-2d, відповідно С-2е з 1-метил-4(метиламіно)піперидином. 45 Приклади 1-147 94944 46 47 94944 48 49 94944 50 51 94944 52 53 94944 54 55 94944 56 57 94944 58 59 94944 60
ДивитисяДодаткова інформація
Назва патенту англійською2,4-diamino pyrimidines as cell cycle kinase inhibitors
Автори англійськоюZahn Stephan Karl, Bister Bojan, Boehmelt Guido, Guertler Ulrich, Mantoulidis Andreas, Reiser Ulrich, Schoop Andreas, Solca Flavio, Tontsch-Grunt Ulrike, Treu Matthias
Назва патенту російською2,4-диаминопиримидины как ингибиторы киназ, которые принимают участие в регуляции клеточного цикла
Автори російськоюЦан Штефан Карл, Бистер Боян, Бёмельт Гвидо, Гюртлер Ульрих, Мантоулидис Андреас, Райзер Ульрих, Шооп Андреас, Золька Флавио, Тонтш-Грунт Ульрике, Трой Маттиас
МПК / Мітки
МПК: C07D 405/14, C07D 401/12, A61P 35/00, C07D 405/12, A61K 31/506, C07D 417/14, C07D 409/14, C07D 401/14
Мітки: інгібітори, циклу, участь, клітинного, регуляції, 2,4-діамінопіримідини, беруть, кіназ
Код посилання
<a href="https://ua.patents.su/52-94944-24-diaminopirimidini-yak-ingibitori-kinaz-shho-berut-uchast-u-regulyaci-klitinnogo-ciklu.html" target="_blank" rel="follow" title="База патентів України">2,4-діамінопіримідини як інгібітори кіназ, що беруть участь у регуляції клітинного циклу</a>
Попередній патент: Профіль із металевого листа для сухого способу будівництва
Наступний патент: Спосіб виділення й визначення вірусного навантаження в зразку панкреатину
Випадковий патент: Спосіб магнітокерованої електрошлакової плавки титанових сплавів