Заміщені бензімідазоли як інгібітори кіназ
Номер патенту: 94055
Опубліковано: 11.04.2011
Автори: Доув Джеффрі Х., Субраменіан Шарадха, Левайн Баррі Гаскелл, Рамурті Савітрі, Ренхоув Пол А., Стюарт Деррін, Пік Тереза Е., Макбрайд Крістофер, Амірі Пеймен, Пун Деніел Дж., Айкава Міна Е., Шафер Сінтія
Формула / Реферат
1. Сполука формули (І):
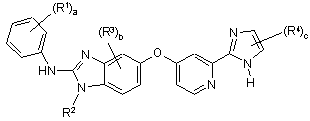 , (І)
, (І)
у якій
R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, галоген, С1-С6алкіл, С1-С6алкоксигрупу, (С1-С6алкіл)сульфаніл, (С1-С6алкіл)сульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил;
R2 являє собою С1-С6алкіл або гало(С1-С6алкіл);
R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, С1-С6алкіл та С1-С6алкоксигрупу;
R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, С1-С6алкіл, С1-С6алкоксигрупу, галоген, карбоксил, (С1-С6алкокси)карбоніл, амінокарбоніл, С1-С6алкіламінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил;
де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, С1-С6алкіл, гало(С1-С6алкіл), С1-С6алкоксигрупу та гало(С1-С6алкоксигрупу);
а являє собою 1, 2, 3, 4 або 5;
b являє собою 0, 1, 2 або 3; та
с являє собою 1 або 2;
або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків.
2. Сполука за п. 1, у якій R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, хлор, фтор, бром, метил, етил, пропіл, бутил, метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, трифторметил, трифторетил, трифторметоксигрупу, трифторетоксигрупу, піперидиніл, С1-С6алкілпіперидиніл, піперазиніл, С1-С6алкілпіперазиніл, тетрагідрофураніл, піридиніл та піримідиніл.
3. Сполука за п. 1, у якій а являє собою 1 або 2 та щонайменше один R1 являє собою гало(С1-С6алкіл).
4. Сполука за п. 3, у якій щонайменше один R1 являє собою трифторметил.
5. Сполука за п. 1, у якій R2 являє собою С1-С6алкіл.
6. Сполука за п. 1, у якій R2 являє собою метил або етил.
7. Сполука за п. 4, у якій R2 являє собою метил.
8. Сполука за п. 1, у якій b являє собою 0 та R3 відсутній.
9. Сполука за п. 1, у якій b являє собою 1 та R3 являє собою С1-С6алкоксигрупу.
10. Сполука за п. 9, у якій R3 являє собою метоксигрупу.
11. Сполука за п. 1, у якій с являє собою 1 або 2 та щонайменше один з R4 являє собою гало(С1-С6алкіл).
12. Сполука за п. 11, у якій щонайменше один R4 являє собою трифторметил.
13. Сполука за п. 1, що має формулу (II):
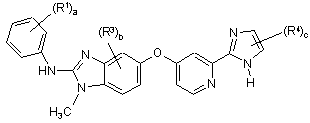 , (II)
, (II)
у якій
R1 кожен незалежно один від іншого вибраний із групи, що включає С1-С6алкіл, С1-С6алкоксигрупу, гідроксигрупу, галоген, (С1-С6алкіл)сульфаніл, (С1-С6алкіл)сульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил;
R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, С1-С6алкіл та С1-С6алкоксигрупу;
R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, С1-С6алкіл, С1-С6алкоксигрупу, галоген, карбоксил, (С1-С6алкокси)карбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил;
де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, С1-С6алкіл та С1-С6алкоксигрупу;
а являє собою 1, 2, 3, 4 або 5;
b являє собою 0, 1, 2 або 3; та
с являє собою 1 або 2;
або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків.
14. Сполука формули (III):
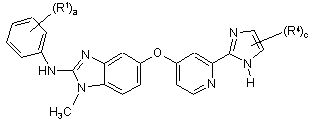 , (III)
, (III)
у якій
R1 кожен незалежно один від іншого вибраний із групи, що включає С1-С6алкіл, С1-С6алкоксигрупу, гідроксигрупу, галоген, (С1-С6алкіл)сульфаніл, (С1-С6алкіл)сульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил;
R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, С1-С6алкіл, С1-С6алкоксигрупу, галоген, карбоксил, С1-С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил;
де R1 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, С1-С6алкіл та С1-С6алкоксигрупу;
а являє собою 1, 2, 3, 4 або 5; та
с являє собою 1 або 2;
або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків.
15. Сполука за п. 14, у якій кожен R1 незалежно вибраний із групи, що включає гідроксигрупу, хлор, фтор, бром, метил, етил, пропіл, бутил, метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, трифторметил, трифторетил, трифторметоксигрупу, трифтоетоксигрупу, піперидиніл, С1-С6алкілпіперидиніл, піперазиніл, С1-С6алкілпіперазиніл, тетрагідрофураніл, піридиніл та піримідиніл.
16. Сполука за п. 15, у якій а являє собою 1 або 2 та щонайменше один з R1 являє собою гало(С1-С6алкіл).
17. Сполука за п. 16, у якій щонайменше один R1 являє собою трифторметил.
18. Сполука за п. 14, у якій а являє собою 1.
19. Сполука за п. 18, у якій R1 являє собою трифторметил.
20. Сполука за п. 14, у якій с являє собою 1 або 2 та щонайменше один з R4 являє собою гало(С1-С6алкіл).
21. Сполука за п. 20, у якій щонайменше один з R4 являє собою трифторметил.
22. Сполука за п. 21, у якій с являє собою 1.
23. Сполука, вибрана із групи, що включає:
{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилфеніл)амін,
(2-фтор-5-піридин-3-ілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-піридин-4-ілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іламін,
(4-трет-бутилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(3-трифторметилфеніл)амін,
(3-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-хлорфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-хлор-3-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-фтор-3-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметоксифеніл)амін,
(2-фтор-5-трифторметилфеніл)-(1-метил-5-{2-[5-метил-4-(3-трифторметилфеніл)-1Н-імідазол-2-іл]піридин-4-ілокси}-1Н-бензоімідазол-2-іл)амін,
(2-фтор-5-трифторметилфеніл)-(1-метил-5-{2-[5-метил-4-(4-трифторметилфеніл)-1Н-імідазол-2-іл]піридин-4-ілокси}-1Н-бензоімідазол-2-іл)амін,
етиловий ефір 2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-5-трифторметил-1Н-імідазол-4-карбонової кислоти,
(2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-5-трифторметил-1Н-імідазол-4-іл)метанол,
2-{4-[1-метил-2-(4-трифторметилфеніламіно)-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-карбонітрил,
(3-трет-бутилфеніл)-{1-метил-5-[2-(5-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилсульфанілфеніл)амін,
(3-трет-бутилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
[4-фтор-3-(тетрагідрофуран-3-іл)феніл]-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-бромфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-фтор-3-ізопропілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилсульфанілфеніл)амін,
(2-фтор-5-ізопропілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)-піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(5-трет-бутил-2-фторфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5-метил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-піридин-3-ілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-карбонітрил,
(2-хлор-4-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(5-трет-бутил-2-хлорфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-піридин-4-ілфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(4-феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(4-феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(4-феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(3-трифторметилфеніл)амін,
(3-етилфеніл)-{1-метил-5-[2-(4-феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-трет-бутилфеніл)-{1-метил-5-[2-(4-феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-трет-бутилфеніл)-{1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(3-трифторметилфеніл)амін,
(5-трет-бутил-2-фторфеніл)-{1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
[4-(4-метилпіперазин-1-іл)феніл]-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
метиловий ефір 2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-карбонової кислоти,
етиловий ефір 2-{4-[2-(2-хлор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-5-трифторметил-1Н-імідазол-4-карбонової кислоти,
(2-фтор-4-трифторметилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2-хлорфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(2,5-диметоксифеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(3,5-диметоксифеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(2-трифторметилфеніл)амін,
(2-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
(4-етилпіперазин-1-іл)-(2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-іл)метанон,
(2-гідроксіетил)амід 2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1-метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-карбонової кислоти,
{1-етил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(2-фтор-5-трифторметилфеніл)амін,
(2-фтор-5-трифторметилфеніл)-{6-метокси-1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)-піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін,
{6-метокси-1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилфеніл)амін,
(4-етилпіперазин-1-іл)-(2-{4-[1-метил-2-(4-трифторметилфеніламіно)-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-іл)метанон,
{1-етил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилфеніл)амін,
(2-гідроксіетил)амід 2-{4-[1-метил-2-(4-трифторметилфеніламіно)-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4-карбонової кислоти,
2-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іламіно}-5-трифторметилфенол та
3-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іламіно}-6-трифторметилфенол;
або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків.
24. Сполука за п. 23 або її фармацевтично прийнятна сіль, де сполука має формулу:
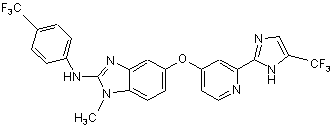 ,
,
або таутомер сполуки або фармацевтично прийнятна сіль таутомеру формули:
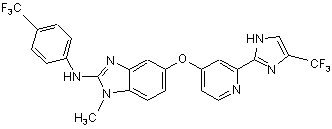 .
.
25. Композиція, що містить сполуку або таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24 у поєднанні з фармацевтично прийнятним носієм.
26. Спосіб лікування ракового захворювання у людини або тварини, який полягає в тому, що людині або тварині вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24.
27. Спосіб за п. 26, в якому композиція інгібує кіназу Raf або мутантну кіназу B-Raf.
28. Спосіб за п. 26, у якому додатково людині або тварині вводять щонайменше один додатковий агент, призначений для лікування раку.
29. Спосіб за п. 28, у якому щонайменше один додатковий агент, призначений для лікування раку, вибирають із групи, що включає іринотекан, топотекан, гемцитабін, 5-фторурацил, леуковорин, карбоплатин, цисплантин, таксани, тезацитабін, циклофосфамід, алкалоїди вінка, іматиніб, антрацикліни, ритуксимаб та трастузумаб.
30. Спосіб за п. 26, у якому ракове захворювання являє собою меланому.
31. Спосіб за п. 26, у якому ракове захворювання являє собою рак молочної залози або рак передміхурової залози.
32. Застосування сполуки або таутомеру, або фармацевтично прийнятної солі, або фармацевтично прийнятної солі її таутомеру за п. 1 або 24 для лікування раку.
33. Застосування сполуки або таутомеру, або фармацевтично прийнятної солі, або фармацевтично прийнятної солі її таутомеру за п. 1 або 24 для одержання лікарського засобу, призначеного для лікування раку.
34. Спосіб інгібування щонайменше однієї серинової/треонінової кінази в шляху передачі сигналу МАРК у індивідуума або лікування біологічного стану, опосередковуваного сериновою/треоніновою кіназою у шляху передачі сигналу МАРК у індивідуума, який полягає в тому, що індивідуумові вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24.
35. Спосіб за п. 34, у якому композиція інгібує кіназу Raf.
36. Спосіб за п. 34, у якому композиція інгібує мутантну кіназу B-Raf.
37. Спосіб за п. 34, у якому біологічний стан вибирають із групи, що включає меланому, папілярний рак щитовидної залози, рак яєчника, рак товстої кишки, рак підшлункової залози, рак легені та лейкоз.
38. Спосіб за п. 34, у якому композиція містить {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилфеніл)амін або його фармацевтично прийнятну сіль, або таутомер, або фармацевтично прийнятну сіль його таутомеру.
39. Спосіб інгібування тирозинкіназного рецептора у індивідуума або лікування біологічного стану, опосередковуваного тирозинкіназним рецептором, у індивідуума, який полягає в тому, що індивідуумові вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24, де тирозинкіназний рецептор вибирають із групи, що включає VEGFR-2, FGFR-3, с-Kit, PDGFR-b та CSF-IR.
40. Спосіб за п. 39, у якому біологічний стан, вибирають із групи, що включає лейкоз тучних клітин, еритролейкоз, пухлини зародкових клітин, дрібноклітинний рак легені, пухлини, що належать до строми шлунково-кишкового тракту, гострий мієлолейкоз, нейробластому, меланому, мієломну хворобу, рак яєчника та рак молочної залози.
41. Спосіб за п. 39, у якому композиція містить {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4-трифторметилфеніл)амін або його фармацевтично прийнятну сіль, або таутомер. або фармацевтично прийнятну сіль його таутомеру.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 94055 11. Сполука за п. 1, у якій с являє собою 1 або 2 та щонайменше один з R4 являє собою гало(С1С6алкіл). 12. Сполука за п. 11, у якій щонайменше один R4 являє собою трифторметил. 13. Сполука за п. 1, що має формулу (II): (R1)a (R3)b N (R4)c N O N HN H N N H3C , (II) у якій R1 кожен незалежно один від іншого вибраний із групи, що включає С1-С6алкіл, С1-С6алкоксигрупу, гідроксигрупу, галоген, (С1-С6алкіл)сульфаніл, (С1С6алкіл)сульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил; R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, С1-С6алкіл та С1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, С1-С6алкіл, С1С6алкоксигрупу, галоген, карбоксил, (С1С6алкокси)карбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, С1-С6алкіл та С1С6алкоксигрупу; а являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; та с являє собою 1 або 2; або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків. 14. Сполука формули (III): (R1)a (R4)c N N HN N O N N H H3C , (III) у якій R1 кожен незалежно один від іншого вибраний із групи, що включає С1-С6алкіл, С1-С6алкоксигрупу, гідроксигрупу, галоген, (С1-С6алкіл)сульфаніл, (С1С6алкіл)сульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, С1-С6алкіл, С1С6алкоксигрупу, галоген, карбоксил, С 1С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил; де R1 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає 4 гідроксигрупу, галоген, С1-С6алкіл та С1 С6алкоксигрупу; а являє собою 1, 2, 3, 4 або 5; та с являє собою 1 або 2; або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків. 15. Сполука за п. 14, у якій кожен R1 незалежно вибраний із групи, що включає гідроксигрупу, хлор, фтор, бром, метил, етил, пропіл, бутил, метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, трифторметил, трифторетил, трифторметоксигрупу, трифтоетоксигрупу, піперидиніл, С 1С6алкілпіперидиніл, піперазиніл, С 1С6алкілпіперазиніл, тетрагідрофураніл, піридиніл та піримідиніл. 16. Сполука за п. 15, у якій а являє собою 1 або 2 та щонайменше один з R1 являє собою гало(С1С6алкіл). 17. Сполука за п. 16, у якій щонайменше один R1 являє собою трифторметил. 18. Сполука за п. 14, у якій а являє собою 1. 19. Сполука за п. 18, у якій R1 являє собою трифторметил. 20. Сполука за п. 14, у якій с являє собою 1 або 2 та щонайменше один з R4 являє собою гало(С1С6алкіл). 21. Сполука за п. 20, у якій щонайменше один з R4 являє собою трифторметил. 22. Сполука за п. 21, у якій с являє собою 1. 23. Сполука, вибрана із групи, що включає: {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилфеніл)амін, (2-фтор-5-піридин-3-ілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-фтор-5-піридин-4-ілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іламін, (4-трет-бутилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(3трифторметилфеніл)амін, (3-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, (4-хлорфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, (4-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, (4-хлор-3-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (4-фтор-3-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, 5 {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметоксифеніл)амін, (2-фтор-5-трифторметилфеніл)-(1-метил-5-{2-[5метил-4-(3-трифторметилфеніл)-1Н-імідазол-2іл]піридин-4-ілокси}-1Н-бензоімідазол-2-іл)амін, (2-фтор-5-трифторметилфеніл)-(1-метил-5-{2-[5метил-4-(4-трифторметилфеніл)-1Н-імідазол-2іл]піридин-4-ілокси}-1Н-бензоімідазол-2-іл)амін, етиловий ефір 2-{4-[2-(2-фтор-5трифторметилфеніламіно)-1-метил-1Нбензоімідазол-5-ілокси]піридин-2-іл}-5трифторметил-1Н-імідазол-4-карбонової кислоти, (2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-5трифторметил-1Н-імідазол-4-іл)метанол, 2-{4-[1-метил-2-(4-трифторметилфеніламіно)-1Нбензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4карбонітрил, (3-трет-бутилфеніл)-{1-метил-5-[2-(5-феніл-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, {1-метил-5-[2-(5-феніл-1Н-імідазол-2-іл)піридин-4ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилсульфанілфеніл)амін, (3-трет-бутилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, [4-фтор-3-(тетрагідрофуран-3-іл)феніл]-{1-метил5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4ілокси]-1Н-бензоімідазол-2-іл}амін, (4-бромфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, (4-фтор-3-ізопропілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилсульфанілфеніл)амін, (2-фтор-5-ізопропілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)-піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (5-трет-бутил-2-фторфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5метил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Нбензоімідазол-2-іл}амін, (2-фтор-5-піридин-3-ілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, 2-{4-[2-(2-фтор-5-трифторметилфеніламіно)-1метил-1Н-бензоімідазол-5-ілокси]піридин-2-іл}-3Німідазол-4-карбонітрил, (2-хлор-4-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (5-трет-бутил-2-хлорфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, 94055 6 (2-фтор-5-піридин-4-ілфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(4феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4ілокси]-1Н-бензоімідазол-2-іл}амін, (2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(4феніл-5-трифторметил-1Н-імідазол-2-іл)піридин-4ілокси]-1Н-бензоімідазол-2-іл}амін, {1-метил-5-[2-(4-феніл-5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}-(3-трифторметилфеніл)амін, (3-етилфеніл)-{1-метил-5-[2-(4-феніл-5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (4-трет-бутилфеніл)-{1-метил-5-[2-(4-феніл-5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-фтор-5-трифторметилфеніл)-{1-метил-5-[2-(5метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-хлор-5-трифторметилфеніл)-{1-метил-5-[2-(5метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (4-трет-бутилфеніл)-{1-метил-5-[2-(5-метил-4феніл-1Н-імідазол-2-іл)піридин-4-ілокси]-1Нбензоімідазол-2-іл}амін, {1-метил-5-[2-(5-метил-4-феніл-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(3трифторметилфеніл)амін, (5-трет-бутил-2-фторфеніл)-{1-метил-5-[2-(5метил-4-феніл-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, [4-(4-метилпіперазин-1-іл)феніл]-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, метиловий ефір 2-{4-[2-(2-фтор-5трифторметилфеніламіно)-1-метил-1Нбензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4карбонової кислоти, етиловий ефір 2-{4-[2-(2-хлор-5трифторметилфеніламіно)-1-метил-1Нбензоімідазол-5-ілокси]піридин-2-іл}-5трифторметил-1Н-імідазол-4-карбонової кислоти, (2-фтор-4-трифторметилфеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (2-хлорфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, (2,5-диметоксифеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, (3,5-диметоксифеніл)-{1-метил-5-[2-(5трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]1Н-бензоімідазол-2-іл}амін, {1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(2трифторметилфеніл)амін, (2-етилфеніл)-{1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}амін, 7 94055 (4-етилпіперазин-1-іл)-(2-{4-[2-(2-фтор-5трифторметилфеніламіно)-1-метил-1Нбензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4іл)метанон, (2-гідроксіетил)амід 2-{4-[2-(2-фтор-5трифторметилфеніламіно)-1-метил-1Нбензоімідазол-5-ілокси]піридин-2-іл}-3Н-імідазол-4карбонової кислоти, {1-етил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(2фтор-5-трифторметилфеніл)амін, (2-фтор-5-трифторметилфеніл)-{6-метокси-1метил-5-[2-(5-трифторметил-1Н-імідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}амін, {6-метокси-1-метил-5-[2-(5-трифторметил-1Німідазол-2-іл)піридин-4-ілокси]-1Н-бензоімідазол-2іл}-(4-трифторметилфеніл)амін, (4-етилпіперазин-1-іл)-(2-{4-[1-метил-2-(4трифторметилфеніламіно)-1Н-бензоімідазол-5ілокси]піридин-2-іл}-3Н-імідазол-4-іл)метанон, {1-етил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилфеніл)амін, (2-гідроксіетил)амід 2-{4-[1-метил-2-(4трифторметилфеніламіно)-1Н-бензоімідазол-5ілокси]піридин-2-іл}-3Н-імідазол-4-карбонової кислоти, 2-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іламіно}-5трифторметилфенол та 3-{1-метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іламіно}-6трифторметилфенол; або її таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятна сіль сполуки, таутомеру, стереоізомера, поліморфу, складного ефіру, метаболіту або проліків. 24. Сполука за п. 23 або її фармацевтично прийнятна сіль, де сполука має формулу: F3 C N N O HN N H N N CF3 H3 C , або таутомер сполуки або фармацевтично прийнятна сіль таутомеру формули: F3 C N HN N HN N O N CF3 N H3 C . 25. Композиція, що містить сполуку або таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24 у поєднанні з фармацевтично прийнятним носієм. 26. Спосіб лікування ракового захворювання у людини або тварини, який полягає в тому, що людині 8 або тварині вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24. 27. Спосіб за п. 26, в якому композиція інгібує кіназу Raf або мутантну кіназу B-Raf. 28. Спосіб за п. 26, у якому додатково людині або тварині вводять щонайменше один додатковий агент, призначений для лікування раку. 29. Спосіб за п. 28, у якому щонайменше один додатковий агент, призначений для лікування раку, вибирають із групи, що включає іринотекан, топотекан, гемцитабін, 5-фторурацил, леуковорин, карбоплатин, цисплантин, таксани, тезацитабін, циклофосфамід, алкалоїди вінка, іматиніб, антрацикліни, ритуксимаб та трастузумаб. 30. Спосіб за п. 26, у якому ракове захворювання являє собою меланому. 31. Спосіб за п. 26, у якому ракове захворювання являє собою рак молочної залози або рак передміхурової залози. 32. Застосування сполуки або таутомеру, або фармацевтично прийнятної солі, або фармацевтично прийнятної солі її таутомеру за п. 1 або 24 для лікування раку. 33. Застосування сполуки або таутомеру, або фармацевтично прийнятної солі, або фармацевтично прийнятної солі її таутомеру за п. 1 або 24 для одержання лікарського засобу, призначеного для лікування раку. 34. Спосіб інгібування щонайменше однієї серинової/треонінової кінази в шляху передачі сигналу МАРК у індивідуума або лікування біологічного стану, опосередковуваного сериновою/треоніновою кіназою у шляху передачі сигналу МАРК у індивідуума, який полягає в тому, що індивідуумові вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24. 35. Спосіб за п. 34, у якому композиція інгібує кіназу Raf. 36. Спосіб за п. 34, у якому композиція інгібує мутантну кіназу B-Raf. 37. Спосіб за п. 34, у якому біологічний стан вибирають із групи, що включає меланому, папілярний рак щитовидної залози, рак яєчника, рак товстої кишки, рак підшлункової залози, рак легені та лейкоз. 38. Спосіб за п. 34, у якому композиція містить {1метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилфеніл)амін або його фармацевтично прийнятну сіль, або таутомер, або фармацевтично прийнятну сіль його таутомеру. 39. Спосіб інгібування тирозинкіназного рецептора у індивідуума або лікування біологічного стану, опосередковуваного тирозинкіназним рецептором, у індивідуума, який полягає в тому, що індивідуумові вводять композицію, що містить сполуку або її таутомер, або фармацевтично прийнятну сіль, або фармацевтично прийнятну сіль її таутомеру за п. 1 або 24, де тирозинкіназний рецептор вибирають із групи, що включає VEGFR-2, FGFR-3, с-Kit, PDGFR- та CSF-IR. 9 94055 10 40. Спосіб за п. 39, у якому біологічний стан, вибирають із групи, що включає лейкоз тучних клітин, еритролейкоз, пухлини зародкових клітин, дрібноклітинний рак легені, пухлини, що належать до строми шлунково-кишкового тракту, гострий мієлолейкоз, нейробластому, меланому, мієломну хворобу, рак яєчника та рак молочної залози. 41. Спосіб за п. 39, у якому композиція містить {1метил-5-[2-(5-трифторметил-1Н-імідазол-2іл)піридин-4-ілокси]-1Н-бензоімідазол-2-іл}-(4трифторметилфеніл)амін або його фармацевтично прийнятну сіль, або таутомер. або фармацевтично прийнятну сіль його таутомеру. Перехресне посилання на пов’язані заявки Дана заявка претендує на пріоритет попередніх заявок на патент U.S. серійний номер 60/712539, зареєстрований 30 серпня 2005 року, U.S. серійний номер 60/713108, зареєстрований 30 серпня 2005 року, U.S. серійний номер 60/731591, зареєстрований 27 жовтня 2005 року, U.S. серійний номер 60/774684, зареєстрований 17 лютого 2006 року, кожна з яких повністю включена в даний опис як посилання. Галузь техніки, до якої відноситься винахід Даний винахід відноситься до нових заміщених бензімідазольних похідних, їх таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів та проліків, до фармацевтично прийнятних солей зазначених сполук, їх таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів і проліків, до композицій, що містять кожний із зазначених вище варіантів у поєднанні з фармацевтично прийнятними носіями, і до застосування кожного з вищевказаних варіантів або окремо, або в поєднанні щонайменше з одним додатковим терапевтичним агентом для профілактики або лікування раку. Передумови створення винаходу Відомі кінази, що пов’язані з онкогенезом, до яких відносяться серінові/треонінові кінази Raf і тирозинкіназні рецептори (RTK). Серінові/треонінові кінази є основними компонентами модуля шляху передачі сигналу Ras/мітоген-активованої протеїнкінази (MAPK), що контролює комплекс програм транскрипції у відповідь на екзогенні клітинні стимули. Гени Raf кодують висококонсервативні серін-треонінспецифічні протеїнкінази, які, як відомо, зв'язуються з онкогеном ras. Вони є частиною шляху сигнальної трансдукції, що, імовірно, складається з тирозинкіназних рецепторів, p21-ras, протеїнкіназ Raf, Mek1- (активатор ERK (позаклітинна регульована кіназа) або MAPKK)-кінази та ERK- (MAPK)-кінази, які, зрештою, фосфорилюють фактори транскрипції. У цьому шляху кінази Raf активуються Ras і фосфорилюють та активують дві ізоформи кінази мітогенактивованої протеїнкінази (яку позначають також як Mek1 та Mek2), які являють собою треонінові/тирозинові кінази з подвійною специфічністю. Обидві ізоформи Mek активують мітогенактивовані кінази 1 та 2 (MAPK, які називають також регульованими позаклітинним лігандом кіназою 1 та 2 або Erk1 та Erk2). MAPK фосфорилюють цілий ряд субстратів, включаючи фактори транскрипції, і в результаті беруть участь у їх програмах транскрипції. Кіназа Raf впливає на Ras/MAPK-шлях і регулює кілька клітинних функ цій, таких як проліферація, диференціювання, виживання, онкогенна трансформація та апоптоз. У дослідженнях, у яких використовували понижуючу регуляцію та домінантне інгібування мутантів Raf у клітинах ссавців, а також у дослідженнях, у яких застосовували біохімічні та генетичні технології для створення модельних організмів, продемонстровані як важлива роль, так і місце знаходження Raf у цілому ряді шляхів передачі сигналів. У багатьох випадках активація Raf рецепторами, які симулюють фосфорилювання клітинного тирозину, залежить від активності Ras, що свідчить про те, що Ras здійснює свою функцію до Raf у шляху передачі сигналу. Після активації Raf1 фосфорилює та активує Mek1, що приводить до поширення сигналу на розташовані по його ходу ефектори, такі як MAPK (мітоген-активована протеїнкіназа; Crews та ін., Cell 74, 1993, с. 215). Серінові/треонінові кінази Raf вважаються первинними ефекторами Ras, які беруть участь у проліферації клітин тварин (Avruch та ін., Trends Biochem. Sci. 19, 1994, с. 279). Кіназа Raf має три різні ізоформи Raf-1 (c-Raf), A-Raf та B-Raf, які розрізняються за їх здатністю взаємодіяти з Ras, активувати шлях кінази MAPK, їх розподілом у тканинах і субклітинною локалізацією (Marias та ін., Biochem. J. 351,2000, стор. 289305; Weber та ін., Oncogene 19, 2000, стор. 169176; Pritchard та ін., Mo. Cell. Biol. 75, 1995, стор. 6430-6442). Активуюча мутація одного з генів Ras виявлена приблизно у 20% всіх пухлин, а активація Ras/Raf/MEK/ERK-шляхи виявлені приблизно у 30% всіх пухлин (Bos та ін., Cancer Res. 49, 1989, стор. 4682-4689; Hoshino та ін., Oncogene 18, 1999, стор. 813-822). У сучасних дослідженнях встановлено, що мутація B-Raf у невусі шкіри є стадією, що має вирішальне значення в ініціації меланоцитної неоплазії (Pollock та ін., Nature Genetics 25, 2002, стор. 1-2). Крім того, у дослідженнях, проведених в останні роки, встановлено, що активуюча мутація у кіназному домені B-Raf присутня приблизно у 66% меланом, 12% карцином товстої кишки та 14% випадків раку легені (Davies та ін., Nature 417, 2002, стор. 949-954; Yuen та ін., Cancer Research 62, 2002, стор. 6451-6455; Brose та ін., Cancer Research 62, 2002, стор. 6997-7000). Меланоми, які продовжують залишатися важливими захворюваннями, що вимагають медичного втручання, являють собою комплексне мультигенне захворювання з несприятливим прогнозом, насамперед на прогресуючій метастатичній стадії. Активуючі соматичні мутації проонкогену B-Raf у цей час описані як характерні для різних злоякісних захворювань і найбільше часто зустрічаються 11 при меланомах. Приблизно в 70% випадків меланом відбувається експресія мутантної та активованої форми B-Raf (V600E), що робить її прекрасною мішенню для розробки лікарських засобів. Крім того, в інших 10-15% випадків меланом відбувається експресія мутантної N-Ras, що додатково демонструє важливість MAPK-шляху для росту та виживання клітин меланом. Інгібітори Ras/Raf/MEK/ERK-шляху на рівні кіназ Raf можуть мати ефективність як терапевтичних агентів, призначених для лікування пухлин зі надекспресованими та мутантними тирозинкіназними рецепторами, активованими внутрішньоклітинними тирозинкіназами, пухлин з аномальною експресією Grb2 (білок-адаптер, що забезпечує стимуляцію Ras за допомогою фактора обміну Sos), а також пухлин, що несуть мутації, що активують, саму Raf. У проведених раніше клінічних дослідженнях встановлено, що інгібітори кінази Raf-1, які інгібують також B-Raf, є перспективними як терапевтичні агенти для терапії раку (Crump, Current Pharmaceutical Design 8, 2002, стор. 22432248; Sebastien та ін., Current Pharmaceutical Design 8, 2002, стор. 2249-2253). Як було встановлено, що порушення експресії Raf у клітинних лініях, вивчене із застосуванням технології антисмислової РНК, пригнічує як Ras-, так і Raf-опосередковуваний онкогенез (Kolch та ін., Nature 349, 1991, стор. 416-428; Monia та ін., Nature Medicine 2(6), 1996, стор. 668-675). Встановлено також, що введення деактивуючих антитіл до кінази Raf або коекспресія домінантнонегативної кінази Raf або домінантно-негативної MEK, що є субстратом кінази Raf, приводить до реверсії трансформованих клітин до нормального фенотипу за ознакою росту (див., Daum та ін., Trends Biochem. Sci, 19, 1994, стор. 474-80; Fridman та ін., J Biol. Chem. 269, 1994, стор. 3010530108). Описано кілька інгібіторів кінази Raf, які мають ефективність по відношенню до інгібування проліферації пухлинних клітин в аналізах in vitro та/або in vivo (див., наприклад, U.S. 6391636, 6358932, 6037136, 5717100, 6458813, 6204467 та 6268391). В інших патентах і заявках на патент запропоноване застосування інгібіторів кінази Raf для лікування лейкозу (див., наприклад, U.S. 6268391 та 6204467 та опубліковані заявки на патент США 20020137774; 20020082192; 20010016194; і 20010006975), або для лікування раку молочної залози (див., наприклад, U.S. 6358932, 5717100, 6458813, 6268391 та 6204467, і опубліковану заявку на патент США 20010014679). У рості ракових клітин велику роль грає також ангіогенез. Відомо, що, коли скупчення (гніздо) ракових клітин досягає певного розміру, приблизно 1-2 мм у діаметрі, повинна розвиватися система постачання крові до ракових клітин, необхідна для швидкого росту пухлини, оскільки дифузія виявляється недостатньою для постачання до ракових клітин необхідної кількості кисню та поживних речовин. Таким чином, інгібування ангіогенезу може інгібувати ріст ракових клітин. Тирозинкіназні рецептори (RTK) являють собою трансмембранні поліпептиди, які регулюють 94055 12 ріст і дифференціювання клітин, ремодулюючи та регулюючи тканину дорослого організму (Mustonen T. і ін., J Cell Biology 129, 1995, стор. 895-898; van der Geer P. і ін., Ann Rev. Cell Biol. 10, 1994, стор. 251-337). Відомо, що поліпептидні ліганди, такі як фактори росту та цитокіни, активують RTK. Шлях передачі сигналу RTK включає зв'язування ліганду та зміну конформації в зовнішньому домені рецептору, що приводить до димеризації рецептору (Lymboussaki A. «Vascular. Endothelial Growth Factors and their Receptors in Embryos, Adults, and in Tumors», Academic Dissertation, University of Helsinki, Molecular/Cancer Biology Laboratory and Department of Pathology, Haartman Institute, 1999; Ullrich A. і ін., Cell 61, 1990, стор. 203-212). Зв'язування ліганду з RTK приводить до трансфосфорилювання рецептору на певних залишках тирозину та наступної активації каталітичних доменів для фосфорилювання цитоплазматичних субстратів (див. там же). Для судинного ендотелію специфічними є два підсімейства RTK. До них відноситься підсімейство судинного ендотеліального фактору росту (VEGF) і підсімейство Ti-рецептору. До класу V RTK відносяться VEGFRl (FLT-I), VEGFR2 (KDR (людський), FIk-I (мишачий)) VEGFR3 (FLT-4) (Shibuya M. і ін., Oncogene 5, 1990, стор. 519-525; Terman B. і ін., Oncogene 6, 1991, стор. 1677-1683; Aprelikova O. і ін., Cancer Res. 52, 1992, стор. 746-748). Встановлено, що представники підсімейства VEGF мають здатність індукувати судинну проникність і проліферацію ендотеліальних клітин, і вони описані також як основний індуктор ангіогенезу та васкулогенезу (Ferrara N. і ін., Endocrinol. Rev. 18, 1997, стор. 4-25). Відомо, що VEGF специфічно зв'язується з RTK, у тому числі FLT-I та FIk-I (DeVries,C. і ін., Science 255, 1992, стор. 989-991; Quinn T. і ін., Proc. Natl. Acad. Sci., 90, 1993, стор. 7533-1537). VEGF стимулює міграцію та проліферацію ендотеліальних клітин та індукує ангіогенез як in vitro, так і in vivo (Connolly D. і ін., J. Biol. Chem. 264, 1989, стор. 20017-20024; Connolly D. і ін., J. Clin. Invest. 84, 1989, стор. 1470-1478; Ferrara N. і ін., Endocrinol. Rev. 18, 1997, стор. 4-25; Leung D. і ін., Science, 246, 1989, стор. 1306-1309; Plouet J. і ін., EMBO J 5, 1989, стор. 3801-3806). Вивчення різних систем культивованих ендотеліальних клітин дозволило встановити, що VEGFR2 опосередкує більшість впливів VEGF на ангіогенез, що передаються по ходу передачі сигналу (Wey S. і ін., Clinical Advances in Hematology and Oncology, 2, 2004, стор. 37-45). VEGFR2опосередковувана проліферація ендотеліальних клітин, імовірно, включає активацію Ras/Raf/Mek/Erk-шляхів (Veikkola T. і ін., Cancer Res 60, 2000, стор. 203-212). Експресія VEGFR2 виявлена при меланомі, раку молочної залози, раці сечового міхура, раці легені, раці щитовидної залози, раці передміхурової залози та раку яєчника (див. Wey та ін., вище). Встановлено, що нейтралізуючі моноклональні антитіла до VEGFR2 (KDR) мають ефективність відносно блокади ангіогенезу пухлин (див. Kim та ін., Nature 362, 1993, стор. 841; Rockwell та ін., Mo. Cell Differ. 3, 1995, стор. 315). Оскільки, як відомо, ангіогенез має ви 13 рішальне значення для росту пухлини та може контролюватися VEGF та VEGF-RTK, вживали спроби створення сполук, що інгібують і сповільнюють ангіогенез та що інгібують VEGF-RTK. Кіназний рецептор тромбоцитарного фактору росту (PDGFR) є іншим типом RTK. Експресія PDGF виявлена в деяких різних типах солідних пухлин, від гліобластом та остеосарком до карцином передміхурової залози. У цих різних типах пухлин біологічна роль передачі PDGF-сигналу може варіюватися від аутокринної стимуляції росту ракових клітин до більш тонких паракринних взаємодій, включаючи прилеглу строму та ангіогенез. PDGF взаємодіє з тирозинкіназними рецепторами PDGFR і PDGFR. Таким чином, можна чекати, що інгібування кіназної активності PDGFR невеликими молекулами буде впливати на ріст та ангіогенез пухлини. Кіназні рецептори фактору росту фібробластів (FGFR) являють собою інший тип RTK. Фактори росту фібробластів відносяться до сімейства поліпептидів факторів росту, які беруть участь у різних видах активності, включаючи мітогенез, ангіогенез і загоєння ран. До них відноситься сімейство родинних, але що мають індивідуальні розходження, тирозинкіназних рецепторів, що містять позаклітинний домен або з 2, або з 3 імуноглобулін (Ig)подібними доменами, трансмембранний домен і цитоплазматичний кіназний домен. Ідентифіковані рецептори фактору росту фібробластів включають FGFRl (Ruta M. і ін., Oncogene 3, 1988, стор. 9-15); FGFR2 (Dionne C. і ін., Cytogenet. Cell Genet. 60, 1992, стор. 34-36); FGFR3 (Keegan K. і ін., Proc. Nat. Acad. Sc 88, 1991, стор. 1095-1099); та FGFR4 (Partanen J. і ін., EMBO J. 10, 1991, стор. 13471354). Висвітлено роль рецепторів факторів росту фібробластів, насамперед FGFR3, при раку. Порушення регуляції онкогенів шляхом транслокації в локус важкого ланцюгу імуноглобуліну (Ig) 14q32 являє собою ініціюючий момент у патогенезі Bклітинних пухлин. При множинній мієломі транслокація в локус Ig зустрічається в 20-60% випадків. Для більшості транслокацій хромосома-партнер є невідомою; для інших ідентифіковане широке розмаїття хромосом-партнерів, серед яких часто зустрічається тільки одна хромосома Ilql3. Bergsagel зі співавторами ідентифікували незаконне перемикання рекомбінації фрагментів (визначені як утримуючі послідовності тільки з однієї області перемикання) як потенційні маркери випадків транслокації в областях перемикання Ig в 15 з 21 лінії мієлом, включаючи 7 з 8 каріотипованих ліній, які мали 14q32-транслокацію, що виявляється. Встановлено, що ці точкові розриви, що зачіпають 6 наступних локусів хромосоми: 4p16.3; 6; 8q24.13; 11q13.3; 16q23.1; і 21q22.1 (Bergsagel та ін., Proc. Nat. Acad. Sci. 93, 1996, стор. 13931-13936, 1996). Chesi та ін., Nature Genet. 16, 1997, стор. 260-264), утворюють каріотипово мовчазну транслокацію t(4;14)(p16.3;q32.3) в 5 лініях клітин мієлом і щонайменше в 3 з 10 первинних пухлин, пов’язаних із множинною мієломою, що приводить до підвищеного рівня експресії та активації мутацій у FGFR3. Точкові розриви на хромосомі-4 об'єднані в клас 94055 14 терну область, що складається з 70 т.п.н., центромерну відносно FGFR3, що, імовірно, є онкогеном з порушеною регуляцією. У двох ліній мієлом та однієї первинної лінії пухлини із зазначеною транслокацією вибірково експресується алель FGFR3, що містить мутації, що активують, які раніше ідентифіковані при смертельній карликовості: tyr373 на cys, lys650 на glu та lys650 на met. Для K650E векспериментах по трансфекції доведена конститутивна активація FGFR3 за відсутності ліганду. Chesi зі співавторами (1997) висловили припущення про те, що після t(4;14)-транслокації соматична мутація при прогресуванні пухлини часто приводить до одержання білку FGFR3, що має активність за відсутності ліганду. Rasmussen T. і ін. виявили частоту зустрічальності від 3 до 24% t(4;14)-транслокації при множинній мієломі (Rasmussen T. і ін., Br. J. Haematol. 117, 2002, стор. 626-628, 2002). Істотно менша частота транслокації виявлена у пацієнтів з моноклональною гамапатією невстановленої етіології (MGUS), що дозволяє припустити, що вона відіграє роль у перетворенні MGUS у множинну мієлому. t(4;14)-транслокація зачіпає 2 потенційних онкогена: FGFR3 і постійний домен множинної мієломи (MMSET). Rasmussen із співавторами (2002) визначили частоту порушення регуляції FGFR3 і його передбачувану роль при множинній мієломі. Вони виявили порушену регуляція експресії FGFR3 в 16 з 110 (14,5%) зразках множинної мієломи кісткового мозку. Крім того, отримані додаткові дані, що демонструють роль FGFR3 при карциномах (Cappellen D. і ін., (Letter) Nature Genet. 23, 1999, стор. 18-20. Cappellen із співавторами виявили, що експресію конститутивно активованого FGFR3 у великій частині двох розповсюджених типів епітеліального раку, а саме, сечового міхура та шийки матки. FGFR3, імовірно, є найбільш широко розповсюдженим мутантним онкогеном при раку сечового міхура, що є мутантним більш ніж у 30% випадків. FGFR3, імовірно, опосередковує протилежні дії, проявляючи активність як негативний регулятор росту кісткової тканини та як онкоген при деяких типах пухлини. Всі соматичні міссенс-мутації FGFR3, виявлені при таких типах раку, виявилися ідентичні ембріональним активуючим мутаціям, які викликають смертельну дисплазію (зазначені автори повідомили, наявність такої еквівалентності у двох мутаціях, оскільки ізоформа FGFR3b, що експресується у епітеліальних клітинах, містить на 2 амінокислоти більше, ніж ізоформа FGFR3c, що експресується в кістковій тканині). Із двох модифікацій FGFR3 в епітеліальних пухлинах мутація S249C виявилася найбільш широко розповсюдженою, зустрічаючись у 5 з 9 випадків раку сечового міхура та у 3 з 3 випадків раку шийки матки. Були отримані також дані, що свідчать про те, що активований FGFR3 є мішенню для розщеплення лізосомами за допомогою c-Cblопосередковуваної убіквітинізації та що активуючі мутації виявлені у пацієнтів з ахондроплазією і спорідненими хондроплазіями, порушують цей процес, приводячи до рециклізації активованих рецепторів та ампліфікації FGFR3-сигналів (Cho та 15 ін., Proc. Nat. Acad. Sci. 101, 2004, стор. 609-614). Cho із співавторами висловили припущення про те, що цей механізм бере участь у молекулярному патогенезі ахондроплазії і являє собою потенційну мішень для терапевтичного втручання. Порушення спрямованого переносу лізосом є адитивним щодо інших передбачуваних механізмів, запропонованих для пояснення патогенезу ахондроплазії. Інші результати свідчать про те, що FGFR2 та FGFR3 є важливими факторами онкогенезу (Jang J.H. і ін., «Mutations in fibroblast growth factor receptor 2 and fibroblast growth factor receptor 3 genes associated with human gastric and colorectal cancers» Cancer Res. 61(9), 2001, стор. 3541-3543). З урахуванням їх значення для множинної мієломи, раку сечового міхура та онкогенезу, розробка інгібіторів тирозинкіназних рецепторів фактору росту фібробласту, насамперед інгібіторів FGFR2 та FGFR3, повинна мати важливе значення для лікування різних типів раку. c-Kit являє собою інший тирозинкіназний рецептор, що належить до сімейства рецепторів PDGF, і він у нормі експресується в гематопоетичних клітинах-попередниках, тучних клітинах і зародкових клітинах. Експресія с-kit виявлена при декількох типах раку, включаючи лейкоз тучних клітин, пухлини зародкових клітин, дрібноклітинний рак легені, пухлини, що відносяться до строми шлунково-кишкового тракту, гострий мієлолейкоз (ОМЛ), еритролейкоз, нейробластому, меланому, карционому яєчнику, карциному молочної залози (Heinrieh M. C. і ін., J. Clin. One. 20, 6, 2002, стор. 1692-1703 (оглядова стаття); Smolich B. D. і ін., Blood, 97, 5, стор. 1413-1421). Надекспресія CSF-IR, рецептор колонієстимулюючого фактору-1 (CSF-I), виявлена при деяких людських карциномах, включаючи карциному молочної залози, яєчника, ендометрію, легені, нирки, підшлункової залози і передміхурової залози (Sapi E., Exp. Biol. Med. 229, 2004, стор. 1-11). CSF-IR являє собою тирозинкіназний рецептор, що при активації його лігандом CSF-I, запускає шляхи трансдукції сигналів, що контролюють клітинну проліферацію та диференціювання. CSF-IR експресується в молочній залозі при вагітності та лактації. Аномальна експресія CSF-IR корелювала з 58% всіх випадків раку молочної залози та 85% випадків інвазивної карциноми молочної залози (див. Sapi, вище). Продовжує зберігатися потреба в сполуках, які інгібують проліферацію капілярів, інгібують ріст пухлин, сприяють лікуванню раку, модулюють припинення клітинного циклу та/або інгібують одну або кілька таких молекул, як Ras, Raf, мутант BRaf, VEGFR2 (KDR, FIk-1), FGFR2/3, c-Kit, PDGFR, CSF-IR, і фармацевтичних композиціях і лікарських засобах, які містять такі сполуки. Зберігається також потреба в розробці способів введення таких сполук, фармацевтичних композицій і лікарських засобів пацієнтам та індивідуумам, які мають в цьому потребу. Короткий опис сутності винаходу Нові заміщені бензімідазольні похідні являють собою сполуки формули (I): 94055 16 у якій R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, галоген, C1С6алкіл, C1-С6алкоксигрупу, C1-С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R2 являє собою C1-С6алкіл або гало(С1-6алкіл); R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, C 1С6алкіламінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл, гало(С1-6алкіл), C1-С6алкоксигрупу та гало(С16алкокси)групу; а являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. В інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формули (II): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає C1-С6алкіл, C1 С6алкоксигрупу, гідроксигрупу, галоген, C 1С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, не 17 залежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1С6алкоксигрупу; a являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. В інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формули (III): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає C1-С6алкіл, C1С6алкоксигрупу, гідроксигрупу, галоген, C 1С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл та гетероарил; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1С6алкоксигрупу; a являє собою 1, 2, 3, 4 або 5; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. Винахід відноситься також до сполук формули (IV): у якій 1 R кожен незалежно один від іншого вибраний із групи, що включає C1-С6алкіл, C1С6алкоксигрупу, гідроксигрупу, галоген, C 1С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R2 являє собою C1-С6алкіл або гало(С1-6алкіл); R3 кожен незалежно один від іншого вибраний 94055 18 із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, C 1С6алкіламінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл та гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1С6алкоксигрупу; а являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; або до їх таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків або фармацевтично прийнятних солей сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. В інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(IV), у яких R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, хлор, фтор, бром, метил, етил, пропіл, бутил, метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, трифторметил, трифторетил, трифторметоксигрупу, трифторетоксигрупу, трифторметилсульфаніл, піперидиніл, C 1С6алкілпіперидиніл, піперазиніл, C 1С6алкілпіперазиніл, тетрагідрофураніл, піридиніл, піримідиніл. У інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(IV), у яких a являє собою 1 або 2, і щонайменше один R1 являє собою гало(C1-С6алкіл), такий як трифторметил. В інших варіантах здійснення винаходу, нові заміщені бензімідазольні похідні являють собою сполуки формул (I) і (IV), у яких R2 являє собою C1-С6алкіл, такий, наприклад, як метил або етил. В інших варіантах здійснення винаходу, нові заміщені бензімідазольні похідні являють собою сполуки формул (I), (II) і (IV), у яких b являє собою 0 та, отже, у цьому випадку R3 відсутній. У альтернативних варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(IV), у яких b являє собою 1 та R3 являє собою C1-С6алкоксигрупу, таку, наприклад, як метоксигрупа. Ще в одному варіанті здійснення винаходу, нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(III), у яких c являє собою 1 або 2 і щонайменше один R4 являє собою гало(C1-С6алкіл), такий, наприклад, як трифторметил. У іншому варіанті втілення даного винаходу забезпечені способи лікування пов'язаних з Raf захворювань у людини або тварини, що потребує такого лікування, що включають введення зазначеному індивідуумові сполуки, що є будь-яким варіантом даного винаходу, або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV) у кількості, ефективній для зниження або попередження росту пухлини в індивідуума. Наступними об'єктами даного винаходу є спо 19 соби лікування пов'язаних з Raf захворювань у людини або тварини, що потребує такого лікування, що включають введення зазначеному індивідуумові сполуки, що є будь-яким варіантом даного винаходу, або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV) у кількості, ефективній для зниження або попередження росту пухлини в індивідуума, у поєднанні щонайменше з одним додатковим агентом, призначеним для лікування раку. Іншими об'єктами даного винаходу є терапевтичні композиції, що містять щонайменше одну сполуку або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV) у поєднанні щонайменше з одним або декількома додатковими агентами, призначеними для лікування раку, які звичайно застосовують у терапії раку. Сполуки, запропоновані у винаході, можна застосовувати для лікування різних типів раку, включаючи карциноми (наприклад, легені, підшлункової залози, яєчника, щитовидної залози, сечового міхура або товстої кишки), меланому, мієлоїдні розлади (наприклад, мієлолейкоз, множинну мієлому та еритролейкоз), аденоми (наприклад, ворсинчаста пухлина товстої кишки) і саркоми (наприклад, остеосаркома). Іншим об'єктом даного винаходу є способи інгібування щонайменше однієї серінової/треонінової кінази в шляху передачі сигналу MAPK в індивідуума або лікування біологічного стану, опосередковуваного серіновою/треоніновою кіназою шляху передачі сигналу MAPK в індивідуума, що полягають в тому, індивідуумові вводять терапевтичну композицію, що містить щонайменше одну сполуку або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV), що має ефективність відносно інгібування шляху передачі сигналу MAPK. Терапевтичні композиції можна застосовувати для лікування пацієнтів, що потребують лікування такими інгібіторами (наприклад, що страждають від раку, що опосередковується аномальною передачею сигналу MAPK). Одним з варіантів здійснення винаходує способи інгібування кінази Raf у індивідуума, що полягають у тому, що вводять терапевтичну композицію, що містить {1метил-5-[2-(5-трифторметил-1H-імідазол-2іл)піридин-4-ілокси]-1H-бензімідазол-2-іл}-(4трифторметилфеніл)амін і його таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятну сіль сполуки, таутомеру, стереоізомеру, поліморфу, складного ефіру, метаболіту, або проліків. Наступним об'єктом даного винаходу є способи інгібування щонайменше одного тирозинкіназного рецептору, вибраного з групи, що включає VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, c-Kit та CSF-IR, у індивідуума, або лікування біологічного стану, опосередковуваного щонайменше одним з VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, c-Kit та CSF-IR, що полягають у тому, що вводять терапевтичну композицію, що містить щонайменше одну сполуку або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV), що має ефективність у відношенні інгібування тирозинкіназного рецептору у індивідуума. Терапевтичні сполуки можна застосовувати 94055 20 для лікування пацієнтів, які мають потребу у лікуванні такими інгібіторами (наприклад, пацієнтів, що страждають раком, опосередковуваним аномальною передачею сигналу тирозинкіназного рецептору). Одним з варіантів здійснення винаходу є способи інгібування тирозинкіназного рецептору, вибраного із групи, що включає VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, cKit та CSF-IR, індивідуумові, що полягають у тому, що вводять терапевтичну композицію, що містить {1-метил-5-[2-(5-трифторметил-1H-імідазол-2іл)піридин-4-ілокси]-1H-бензімідазол-2-іл}-(4трифтор-метилфеніл)амін або його таутомер, стереоізомер, поліморф, складний ефір, метаболіт або проліки або фармацевтично прийнятну сіль сполуки, таутомеру, стереоізомеру, поліморфу, складного ефіру, метаболіту або проліків. Винахід відноситься також до композицій, способів застосування та способів одержання, які більш докладно будуть описані нижче. Короткий опис малюнків Вищевикладені об'єкти та ряд супутніх переваг даного винаходу стануть більш зрозумілими з посиланням на викладений нижче докладний опис у поєднанні із прикладеними малюнками, на яких показано: на Фіг. 1 - графік, що свідчить про зниження середнього об'єму пухлин людської меланоми лінії A375M у мишей після обробки сполукою, запропонованою у винаході, що описано в прикладі 78; на Фіг. 2А и 2Б - зображення результатів, отриманих за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах людської меланоми лінії A375M у мишей через 4 год. (Фіг. 2A) і 24 год. (Фіг. 2Б) після обробки сполукою, запропонованою у винаході, наприклад, описаною у прикладі 79; на Фіг. 3 - графік, що свідчить про зниження середнього об'єму пухлин людського раку товстої кишки лінії HT29P у мишей після обробки сполукою, запропонованою у винаході, що описано в прикладі 80; на Фіг. 4А, 4Б и 4В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах людського раку товстої кишки лінії HT29P через 1 год. (Фіг. 4A), 4 год. (Фіг. 4Б) та 24 год. (Фіг. 4В) після обробки сполукою, запропонованою у винаході, що описано в прикладі 81; на Фіг. 5 - проілюстрований шлях передачі сигналу MAPK, що включає Ras, Raf, MEK та ERK, і передбачувані сайти інгібування в напрямку його поширення від кінази Raf за допомогою сполуки з прикладу 1, що описано в прикладах 82-86; на Фіг. 6А, 6Б и 6В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у клітинах лінії A375M (Фіг. 6A), клітинах лінії SK-MEL2 (Фіг. 6Б) і клітинах лінії CHL-I (Фіг. 6В) через 4 год. після інкубації культури з різними концентраціями сполуки із Прикладу 1, що описано в прикладі 83; на Фіг. 7А - графік залежності відповіді від до 21 зи у вигляді зменшення середнього об'єму пухлин людської меланоми лінії A375M (B-Raf V600E) у мишей після обробки пероральною дозою 10 мг/кг, 30 мг/кг або 100 мг/кг сполуки із Прикладу 1, що описано в прикладі 84; на Фіг. 7Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у клітинах лінії A375M у мишей через 8 год. після 14-ої обробки сполукою із Прикладу 1, що описано в прикладі 84; на Фіг. 7В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у клітинах лінії A375M у мишей через 24 год. після 14ої обробки сполукою із Прикладу 1, що описано в прикладі 84; на Фіг. 7Г - результати, отримані за допомогою ПААГ, які свідчать про модуляціюмаркерів, розташованих у напрямку його поширення від кінази Raf, у клітинах лінії A375M через 24 год. після 14ої обробки сполукою із Прикладу 1, що описано в прикладі 84; на Фіг. 8А - графік, що свідчить про зниження середнього об'єму пухлин злоякісної меланоми лінії MEXF276 (B-Raf V600E) у мишей після обробки сполукою із Прикладу 1, що описано у Прикладі 85; на Фіг. 8Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії MEXF276 у мишей через 4 год. після 20-ої обробки сполукою із Прикладу 1, що описано у Прикладі 85; на Фіг. 8В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії MEXF276 через 4 год. після 20-ої обробки сполукою із Прикладу 1, що описано у Прикладі 85; на Фіг. 9А - графічне зображення інгібування середнього об'єму пухлин злоякісної меланоми лінії MEXF1341 (N-Ras Q61K) у мишей після обробки сполукою із прикладу 1, що описано у Прикладі 85; на Фіг. 9Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії MEXF1341 у мишей через 4 год. після 20-ої обробки сполукою із Прикладу 1, що описано у Прикладі 85; на Фіг. 9В - зображення результатів, отриманих за допомогою ПААГ, які свідчать про модуляцію маркерів, розташованих у напрямку поширення сигналу від кінази Raf у пухлинних клітинах лінії MEXF 1341 через 4 год. після 20-ої обробки сполукою із Прикладу 1, що описано у Прикладі 85; на Фіг. 10А - графік, що свідчить про зниження середнього об'єму пухлин колоректальної карциноми лінії HCT-116 (K-Ras G13D) у мишей після обробки сполукою із Прикладу 1, що описано в прикладі 86; на Фіг. 10Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf 94055 22 у пухлинних клітинах лінії HCT-116 через 4 год. після 3-ої обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 10В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії HCT-116 через 8 год. після 3-ої обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 10Г - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії HCT-116 через 24 год. після 3-ої обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 11 - графік, що свідчить про зниження середнього об'єму пухлин колоректальної карциноми лінії HT-29 (B- Raf V600E) у мишей після обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 12А - графік, що свідчить про зниження середнього об'єму пухлин гострого мієлолейкозу лінії MV4-11 (FLT3 ITD) у мишей після обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 12Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії MV4-11 у мишей через 4 год. після 3-ої обробки сполукою із Прикладу 1, що описано в Прикладі 86; на Фіг. 13 - графік, що свідчить про інгібування VEGF-опосередковуваного ангіогенезу на моделі CHO-VEGF з використанням матригелю (Matrigel) після обробки 10 мг/кг, 30 мг/кг та 100 мг/кг сполуки із Прикладу 1, що описано в Прикладі 88; на Фіг. 14A - графік, що свідчить про зниження середнього об'єму пухлин меланоми лінії A375M у мишей після обробки 100 мг/кг сполуки із Прикладу 1 з використанням схеми введення лікарського засобу q2d, q3d або q4d, що описано в Прикладі 89; на Фіг. 14Б - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії A375M у мишей через 8 год., 24 год., 48 год. після 5-ої обробки сполукою із Прикладу 1 з використанням схеми введення лікарського засобу q2d, що описано в Прикладі 89; на Фіг. 14В - результати, отримані за допомогою ПААГ, які свідчать про інгібування передачі сигналу в напрямку його поширення від кінази Raf у пухлинних клітинах лінії A375M у мишей через 48 год., 72 год. та 96 год. після 3-ої обробки сполукою із Прикладу 1 з використанням схеми введення лікарського засобу q4d, що описано в Прикладі 89; та на Фіг. 15 - графік, що демонструє взаємозв'язок між обробкою пухлинних клітин лінії A375M різними концентраціями сполуки із Прикладу 1, концентрацією сполуки в сироватці через різні проміжки часу та граничною концентрацією для модуляції мішеней, що описано в Прикладі 90. Детальний опис кращого варіанта здійснення винаходу 23 Одним з об'єктів даного винаходу є заміщені бензімідазольні похідні формули (I): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, галоген, C1С6алкіл, C1-С6алкоксигрупу, C1-С6алкілсульфаніл, C1-С6алкілсульфонл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R2 являє собою C1-С6алкіл або гало(C1-6алкіл); R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, C 1С6алкіламінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл, гало(C1-6алкіл), C1-С6алкоксигрупу та галоC1С6алкоксигрупу; а являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. Іншими варіантами здійснення винаходу є нові заміщені бензімідазольні похідні формули (II): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає C1-С6алкіл, C1С6алкоксигрупу, гідроксигрупу, галоген, C 1С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкіл 94055 24 карбоніл, феніл і гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1С6алкоксигрупу; a являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. Іншими варіантами здійснення винаходу є нові заміщені бензімідазольні похідні формули (III): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає C1-С6алкіл, C1 С6алкоксигрупу, гідроксигрупу, галоген, C 1С6алкілсульфаніл, C1-С6алкілсульфоніл, циклоалкіл, гетероциклоалкіл, феніл і гетероарил; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1 С6алкоксигрупу; a являє собою 1, 2, 3, 4 або 5; та c являє собою 1 або 2; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. Об'єктами винаходу є також сполуки формули (IV): у якій R1 кожен незалежно один від іншого вибраний із групи, що включає C1-С6 алкіл, C1-С6 алкоксигрупу, гідроксигрупу, галоген, C1-С6 алкілсульфаніл, C1-С6 алкілсульфоніл, циклоалкіл, гетероциклоал 25 кіл, феніл і гетероарил; R2 являє собою C1-С6 алкіл або гало(С1-6 алкіл); R3 кожен незалежно один від іншого вибраний із групи, що включає галоген, C1-С6алкіл та C1С6алкоксигрупу; R4 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, C1-С6алкіл, C1С6алкоксигрупу, галоген, карбоксил, C 1С6алкоксикарбоніл, амінокарбоніл, C 1С6алкіламінокарбоніл, карбонітрил, циклоалкіл, гетероциклоалкіл, гетероциклоалкілкарбоніл, феніл і гетероарил; де R1, R2, R3 та R4 необов'язково можуть бути заміщені одним або декількома замісниками, незалежно один від іншого вибраними із групи, що включає гідроксигрупу, галоген, C1-С6алкіл та C1С6алкоксигрупу; а являє собою 1, 2, 3, 4 або 5; b являє собою 0, 1, 2 або 3; або їх таутомери, стереоізомери, поліморфи, складні ефіри, метаболіти або проліки або фармацевтично прийнятні солі сполук, таутомерів, стереоізомерів, поліморфів, складних ефірів, метаболітів або проліків. Іншими варіантами здійснення винаходу є нові заміщені бензімідазольні похідні формул (I)-(IV), у яких R1 кожен незалежно один від іншого вибраний із групи, що включає гідроксигрупу, хлор, фтор, бром, метил, етил, пропіл, бутил, метоксигрупу, етоксигрупу, пропоксигрупу, бутоксигрупу, трифторметил, трифторетил, трифторметоксигрупу, трифторетоксигрупу, трифторметилсульфаніл, піперидиніл, C1-С6алкілпіперидиніл, піперазиніл, C1-С6алкілпіперазиніл, тетрагідрофураніл, піридиніл, піримідиніл. В інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(IV), у яких a являє собою 1 або 2, і щонайменше один R1 являє собою гало(C1-С6алкіл), такий як трифторметил. В інших варіантах здійснення винаходу, нові заміщені бензімідазольні похідні являють собою сполуки формул (I) і (IV), у яких R2 являє собою C1-С6 алкіл, такий, наприклад, як метил або етил. В інших варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I), (II) і (IV), у яких b являє собою 0 та, отже, у цьому випадку R3 відсутній. В альтернативних варіантах здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(IV), у яких b являє собою 1 та R3 являє собою C1-С6 алкоксигрупу, таку, наприклад, як метоксигрупа. Ще в одному варіанті здійснення винаходу нові заміщені бензімідазольні похідні являють собою сполуки формул (I)-(III), у яких c являє собою 1 або 2 і щонайменше один R4 являє собою гало(С1-С6алкіл), такий, наприклад, як трифторметил. В конкретних варіантах здійснення винаходу R1, R2, R3 та R4 необов'язково можуть бути заміщені одним-п'ятьма замісниками, незалежно один від іншого вибраними з гідроксигрупи, галогену, C1-С6алкілу, гало(С1-С6алкілу), C1-С6алкоксигрупи та галоC1-С6алкоксигрупи. У конкретних варіантах здійснення винаходу 94055 26 R1, R2, R3 та R4 необов'язково можуть бути заміщені одним-трьома замісниками, незалежно один від іншого вибраними з гідроксигрупи, галогену, C1-С6алкілу, гало(С1-С6алкілу), C1-С6алкоксигрупи та галоC1-С6алкоксигрупи. У конкретних варіантах здійснення винаходу R1 незалежно вибраний із групи, що включає галоген, C1-С6алкоксигрупу, гало(С1-С6алкіл), гідроксигрупу, галоС1-С6алкоксигрупу, галоC1С6алкілсульфоніл, гетероарил, галоС1С6алкілсульфаніл, гетероциклоалкіл та C 1С6алкілгетероциклоалкіл. У деяких з таких варіантів здійснення винаходу a являє собою 1 та R1 незалежно вибраний із групи, що включає 2-хлор, 2-етил, 2-трифторметил, 3-трифторметил, 4трифторметил, 3-трет-бутил, 4-трет-бутил, 3-етил, 4-етил, 4-хлор, 4-бром, 4-трифторметоксигрупу, 4трифторметилсульфаніл, 4трифторметилсульфоніл та 4-(4метилпіперазиніл). В інших варіантах здійснення винаходу a являє собою 2 та R1 кожен незалежно один від іншого вибраний із групи, що включає 2фтор, 2-хлор, 2-гідроксигрупу, 2-метоксигрупу, 3метоксигрупу, 5-метоксигрупу, 4-хлор, 4-фтор, 3трифторметил, 4-трифторметил, 5-трифторметил, 5-піридиніл, 5-піридиніл-3-іл, 5-піридиніл-4-іл, 3тетрагідрофуран-3-іл, 3-ізопропіл, 5-ізопропіл та 5трет-бутил. У конкретних варіантах здійснення винаходу R4 вибраний із групи, що включає C1-С6алкіл, гідрокси(С1-С6алкіл), гало(С1-С6алкіл), галоС1С6алкілсульфаніл, C1-С6алкоксикарбоніл, C1 С6алкілгетероциклоалкіл, карбонітрил, феніл, галоС1-С6алкілфеніл, C1С6алкілгетероциклоалкілкарбоніл і гідроксиС1С6алкіламінокарбоніл. У деяких з таких варіантів здійснення винаходу c являє собою 1 та R4 вибраний із групи, що включає трифторметил, карбонітрил, феніл, трифторметилсульфаніл, метоксикарбоніл, 4-етилпіперазиніл, 4-етилпіперазиніл-1карбоніл або 2-гідроксиетиламінокарбоніл. В інших варіантах здійснення винаходу c являє собою 2 та R4 кожен незалежно один від іншого вибраний із групи, що включає метил, 3-трифторметилфеніл, 4-трифторметилфеніл, трифторметил, етоксикарбоніл, гідроксиметил та феніл. Іншими варіантами здійснення винаходу є сполука або її фармацевтично прийнятна сіль, де сполука має формулу: або таутомер сполуки або фармацевтично прийнятна сіль таутомеру формули: 27 Іншими об'єктами даного винаходу є способи лікування пов'язаних з Raf розладів у людини або тварини, що потребує такого лікування, які полягають у тому, що зазначеному індивідуумові вводять сполуку формули (I), (II), (III) або (IV), у кількості, що має ефективність відносно зниження або попередження росту пухлини в індивідуума. Іншими об'єктами даного винаходу є способи лікування пов'язаних з Raf захворювань у людини або тварини, що потребує такого лікування, що полягають у тому, що індивідуумові вводять сполуку формули (I), (II), (III) або (IV), у кількості, що має ефективність відносно зниження або попередження росту пухлини в індивідуума, у поєднанні щонайменше з одним додатковим агентом, призначеним для лікування раку. Наступними об'єктами даного винаходу є способи лікування пов'язаних з Raf розладів у людини або тварини, що потребує такого лікування, що полягають у тому, що зазначеному індивідуумові вводять сполуку формули (I), (II), (III) або (IV), у кількості, що має ефективність відносно зниження або попередження росту пухлини в індивідуума, у поєднанні щонайменше з одним додатковим агентом, призначеним для лікування раку. Ряд прийнятних протиракових агентів, які можна застосовувати для спільної терапії, можна використовувати в способах, запропонованих у даному винаході. Отже, згідно із даним винаходом можна застосовувати кілька протиракових агентів, таких як (але не обмежуючись ними): агенти, які індукують апоптоз; полінуклеотиди (наприклад, рибозими); поліпептиди (наприклад, ферменти); лікарські засоби; біологічні міметики; алкалоїди; алкілюючі агенти; протипухлинні антибіотики; антиметаболіти; гормони; сполуки платини; моноклональні антитіла, кон’юговані із протираковими лікарськими засобами, токсини та/або радіонукліди; модифікатори біологічної відповіді (наприклад, інтерферони [наприклад, IFN- тощо] та інтерлейкіни [наприклад, IL-2 тощо] і т.д.); агенти для адоптивної імунотерапії; гематопоетичні фактори росту; агенти, які індукують диференціювання пухлинних клітин (наприклад, повністю-транс-ретиноєва кислота і т.д.); реагенти для генної терапії; реагенти та нуклеотиди для антисмислової терапії; протипухлинні вакцини; інгібітори ангіогенезу тощо. Деякі інші приклади хіміотерапевтичних сполук та протиракових терапій, які можна застосовувати разом з описаними сполуками формули (I), (II), (III) або (IV), відомі фахівцям у даній галузі техніки. У кращих варіантах здійснення винаходу протиракові агенти, які можна застосовувати в поєднанні зі сполуками, запропонованими в даному винаході, являють собою агенти, які індукують або стимулюють апоптоз. До агентів, які індукують апоптоз, відносяться (але не обмежуючись ними) радіація; інгібітори кіназ (наприклад, інгібітор кіна 94055 28 зного рецептора епідермального фактору росту [EGFR], інгібітор кіназного рецептору судинного фактору росту [VGFR], інгібітор кіназного рецептору фактору росту фібробластів [FGFR], інгібітор кіназного рецептору тромбоцитарного фактору росту [PGFR] та інгібітори кіназ Bcr-Abl, такі як STI571, глевек (Gleevec) і глівек (Glivec)]); антисмислові молекули; антитіла [наприклад, херцептин (Herceptin) і ритуксан (Rituxan)]; антиестрогени [наприклад, ралоксифен і тамоксифен]; антиандрогени [наприклад, флутамід, бікалутамід, фінастерид, аміноглутетамід, кетоконазол і кортикостероїди]; інгібітори циклооксигенази 2 (COX-2) [наприклад, целекоксиб (Celecoxib), мелоксикам, NS-398 і нестероїдні протизапальні лікарські засоби (НСПЗЗ)]; і протиракові хіміотерапевтичні лікарські засоби [наприклад, іринотекан (Camptosar), CPT-I l, флударабін (Fludara), дакарбазин (DTIC), дексаметазон, мітоксантрон, мілотарг (Mylotarg), VP-16, цисплатина, 5-ФУ, доксирубіцин, таксотер або таксол]; молекули, що беруть участь у передачі сигналів у клітині; кераміди та цитокіни; і стауросприн тощо. Іншими об'єктами даного винаходу є фармацевтичні композиції, що містять щонайменше одну сполуку або її фармацевтично прийнятну сіль формули (I), (II), (III) або (IV) у поєднанні з фармацевтично прийнятним носієм, які можна застосовувати для введення людині або тварині, або окремо, або в поєднанні з іншими протираковими агентами. Наступними об'єктами даного винаходу є способи одержання сполук формул (I), (II), (III) або (IV), представлених у даному описі. Іншими об'єктами даного винаходу є сполуки, що являють собою інгібітори ферменту Raf-кінази. Оскільки фермент являє собою розташований по ходу шляху передачі сигналу ефектор p21ras, інгібітори, запропоновані в даному винаході, застосовують у фармацевтичних композиціях, призначених для медицини або ветеринарії, у випадках, коли показано інгібування шляху кінази Raf наприклад, для лікування пухлин та/або росту ракових клітин, опосередковуваного кіназою Raf. Зокрема, сполуки можна застосовувати для лікування раку у людини або тварини, наприклад, раку миші, оскільки розвинення цих типів раку залежить від каскаду сигнальної трансдукції білку Ras, і тому вони чутливі до лікування шляхом переривання цього каскаду за допомогою інгібування активності кінази Raf. Таким чином, сполуки, запропоновані у винаході, можна застосовувати для лікування солідних пухлин таких, наприклад, як саркоми (наприклад, рак легені, підшлункової залози, щитовидної залози, яєчника, сечового міхура, молочної залози, передміхурової залози або товстої кишки), меланоми, мієлоїдні розлади (наприклад, мієлолейкоз, множинна мієлома та еритролейкоз), аденоми (наприклад, ворсинчаста пухлина товстої кишки) і саркоми (наприклад, остеосаркома). У контексті даного опису поняття «інгібітор Raf» відноситься до сполуки, у якій значення IC50, що характеризує активність у відношенні кінази Raf, не перевищує приблизно 100 мкМ та, як правило, не перевищує приблизно 50 мкМ, при оцінці за допомогою аналізу з використанням фільтрації 29 Raf/Mek, що описаний у цілому нижче. Кращими ізоформами кінази Raf, які інгібують сполуки, запропоновані в даному винаході, є A-Raf, B-Raf та C-Raf (Raf-1). Поняття «IC50» являє собою концентрацію інгібітору, що знижує активність ферменту (наприклад, кінази Raf) наполовину від максимального рівня. Встановлено, що репрезентативні сполуки, запропоновані в даному винаході, мають інгібуючу активність по відношенню до Raf. Сполуки, запропоновані в даному винаході, переважно характеризуються значенням IC50 у відношенні Raf, що не перевищує приблизно 10 мкМ, більш переважно не перевищує приблизно 5 мкМ, ще більш переважно не перевищує приблизно 1 мкМ і найбільш переважно не перевищує приблизно 200 нМ, при оцінці кіназної активності Raf за допомогою аналізів, зазначених у даному описі. У контексті даного опису поняття «шлях сигнальної трансдукції MAPK» є скороченим позначенням шляху сигнальної трансдукції мітогенактивованої протеїнкінази в модулі, що складається з молекул Ras-Raf-MEKl-ERK, що передають сигнал. Поняття «алкіл» відноситься до насичених вуглеводневих груп, які не містять гетероатомів, і воно включає алкільні групи із прямим ланцюгом, такі як метил, етил, пропіл, бутил, пентил, гексил, гептил, пропіл, ноніл, децил, ундецил, додецил тощо. Поняття «алкіл» відноситься також до ізомерів прямоланцюгових алкільних груп з розгалуженим ланцюгом, включаючи (але не обмежуючись ними) наступні, наведені як приклад групи: CH(CH3)2, -CH(CH3)(CH2CH3), -CH(CH2CH3)2, C(CH3)3, -C(CH2CH3)3, CH2CH(CH3)2, CH2CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, CH2C(CH3)3, CH2C(CH2CH3)3, CH(CH3)CH(CH3)(CH2CH3), -CH2CH2CH(CH3)2, CH2CH2CH(CH3)(CH2CH3), -CH2CH2CH(CH2CH3)2, CH2CH2C(CH3)3, CH2CH2C(CH2CH3)3, CH(CH3)CH2CH(CH3)2, -CH(CH3)CH(CH3)CH(CH3)2, H(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) та ін. Отже, алкільні групи включають первинні, вторинні та третинні алкільні групи. Поняття «C1-С12алкіл» відноситься до алкільних груп, що мають від одного до дванадцяти атомів вуглецю. Поняття «C1С6алкіл» відноситься до алкільних груп, що мають від одного до шести атомів вуглецю. Поняття «алкеніл» відноситься до вуглеводневих груп із прямим або розгалуженим ланцюгом, що має від 2 до 6 атомів вуглецю та переважно від 1 до 2 ненасичених вінільних зв'язків (>C=C
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted benzimidazoles and methods of preparation
Автори англійськоюAikawa Mina E., Amiri Payman, Dove Jeffrey H., Levine Barry Haskell, Mcbride Christopher, Pick Teresa E., Poon Daniel J., Ramurthy Savithri, Renhowe Paul A., Shafer Cynthia, Stuart Darrin, Subramanian Sharadha
Назва патенту російськоюЗамещеные бензимидазолы в качестве ингибиторов киназ
Автори російськоюАйкава Мина Э., Амири Пеймен, Доув Джеффри Х., Левайн Барри Гаскелл, Макбрайд Кристофер, Пик Тереза Э., Пун Дениэл Дж., Рамурти Савитри, Ренхоув Пол А., Шафер Синтия, Стюарт Деррин, Субрамениан Шарадха
МПК / Мітки
МПК: C07D 401/14, A61P 35/00, A61K 31/435
Мітки: кіназ, бензимідазоли, заміщені, інгібітори
Код посилання
<a href="https://ua.patents.su/71-94055-zamishheni-benzimidazoli-yak-ingibitori-kinaz.html" target="_blank" rel="follow" title="База патентів України">Заміщені бензімідазоли як інгібітори кіназ</a>
Попередній патент: Похідні нітрокатехолу як комт-інгібітори
Наступний патент: Застосування специфічних молочнокислих бактерій для одержання імуномодулюючих композицій
Випадковий патент: Пристрій для розвитку графічних навичок письма з контролем натиску












