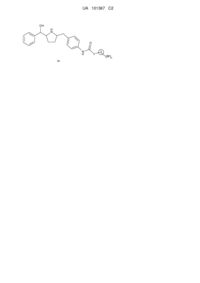
Гідроксиметилпіролідини як агоністи адренергічних рецепторів b3
Номер патенту: 101367
Опубліковано: 25.03.2013
Автори: Ван Ліпін, Бергер Річард, Мойз Кріс Р., Ха Соокхеє Ніколь, Едмондсон Скотт Д., Кар Нам Фунг, Копка Іхор Е., Чжу Чен, Моріелло Грегорі Дж., Лі Бін, Гобле Стефен Д., Чан Лехуа, Шень Дун-Мін
Формула / Реферат
1. Сполука формули Іа

або її фармацевтично прийнятна сіль, або її стереоізомер, або фармацевтично прийнятна сіль її стереоізомера,
в якій
n дорівнює 0, 1, 2, 3, 4 або 5;
Y вибирають з групи, яка складається з
(1) (С1-С5)-алкандіїлу, (С2-С5)-алкендіїлу і (С2-С5)-алкіндіїлу, де кожний з алкандіїлу, алкендіїлу і алкіндіїлу необов'язково заміщений однією-трьома групами, незалежно вибраними з галогену, -ORa і -S(О)р-(С1-С3)-алкілу, де р дорівнює 0, 1 або 2;
(2) -(CRaRa)j-Q-(CRaRa)k, де j і k рівні цілим числам, незалежно вибраним з 0, 1 і 2,
(3) зв'язку і
(4) фенілену, необов'язково заміщеного однією-трьома групами, незалежно вибраними з R1;
Z вибирають з групи, яка складається з
(1) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з 5- або 6-членним гетероциклом з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і
(2) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з (С5-С10)-карбоциклом;
R1 вибирають з групи, яка складається з
(1) (С1-С5)-алкілу, необов'язково заміщеного 1-5 атомами галогену,
(2) (С3-С6)-циклоалкілу,
(3) галогену,
(4) нітро,
(5) ціано,
(6) -C(O)Ra,
(7) -C(O)2Ra,
(8) -C(O)NRaRb і
(9) -QRb;
R3 вибирають з групи, яка складається з
(1) (С1-С6)-алкілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з галогену, -ORa, CO2Ra і CONRaRb,
(2) -(СН2)t-фенілу або -(СН2)t-О-фенілу, де t дорівнює 0, 1, 2, 3, 4 або 5, і де вказаний феніл в кожному випадку необов'язково заміщений 1-3 групами, незалежно вибраними з галогену, (С1-С5)-алкілу, необов'язково заміщеного 1-5 атомами галогену, і -ORa,
(3) оксо,
(4) тіоксо,
(5) галогену,
(6) -CN,
(7) (С3-С6)-циклоалкілу,
(8) -(СН2)t-гетероциклу або -(СН2)t-О-гетероциклу, де t дорівнює 0, 1, 2, 3, 4 або 5, і де гетероцикл в кожному випадку являє собою 5- або 6-членний гетероцикл з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і де вказаний гетероцикл необов'язково орто-конденсований з бензольним циклом і необов'язково заміщений 1-3 групами, незалежно вибраними з галогену, (С1-С5)-алкілу, необов'язково заміщеного 1-5 атомами галогену, і -ORa,
(9) -ORa,
(10) -C(O)ORa,
(11) -C(O)Ra,
(12) -C(O)NRaRb,
(13) -NRaRb,
(14) -NRaC(O)Rb,
(15) -NRaC(O)ORb i
(16) -NRaC(O)NRaRb;
Ra вибирають з групи, яка складається з водню і (С1-С6)-алкілу, необов'язково заміщеного 1-5 атомами галогену;
Rb вибирають з групи, яка складається з
(1) водню,
(2) (С1-С6)-алкілу, необов'язково заміщеного 1-5 групами, вибраними з групи, яка складається з
(а) гідрокси,
(b) галогену,
(c) -CO2Ra,
(d) -S(О)р-(С1-С3)-алкілу, де р дорівнює 0, 1 або 2,
(e) (С3-С8)-циклоалкілу,
(f) (С1-С6)-алкокси, необов'язково заміщеного 1-5 атомами галогену, і
(g) фенілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з групи, яка складається з галогену, нітро, -NRaRa, трифторметилу, трифторметокси, (С1-С5)-алкілу і -ORa,
(3) (С3-С8)-циклоалкілу і
(4) фенілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з групи, яка складається з
(a) галогену,
(b) нітро,
(c) -NRaRa,
(d) -ОН,
(e) (С1-С6)-алкокси, необов'язково заміщеного 1-5 атомами галогену,
(f) -S(О)р-(С1-С6)-алкілу, де р дорівнює 0, 1 або 2, і
(g) (С1-С6)-алкілу, необов'язково заміщеного групами до 5, вибраними з гідрокси, галогену, трифторметилу, ціано, -CO2Ra, (С3-С8)-циклоалкілу і QRc;
Rc вибирають з групи, яка складається з
(1) Z, необов'язково заміщеного групами до 5, вибраними з групи, яка складається з галогену, трифторметилу, ціано, (С1-С5)-алкілу і (С1-С5)-алкокси, і
(2) (С1-С6)-алкілу; і
Q вибирають з групи, яка складається з
(1) -N(Ra),
(2) -О- і
(3) -S(O)p-, де р дорівнює 0, 1 або 2.
2. Сполука за п. 1, де Y являє собою метилен, -СН(СH3)- або зв'язок.
3. Сполука за п. 1, де Z вибирають з групи, яка складається з
(1) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з 5- або 6-членним гетероциклом з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і
(2) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з (С5-С10)-карбоциклом.
4. Сполука за п. 3, де Z вибирають з групи, яка складається з
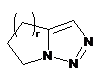 ,
, 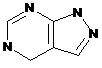 ,
,  ,
, 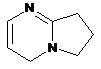 ,
, 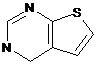 ,
, 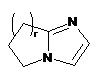 ,
, 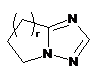 ,
, 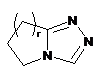 ,
, 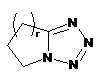 ,
, 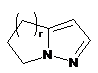 ,
, 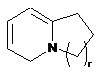 ,
, 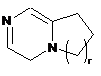 ,
, 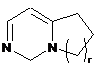 ,
, 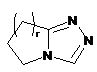 ,
, 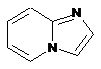 ,
, 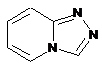 ,
, 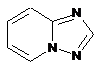 ,
, 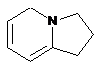 ,
, 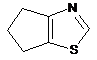 ,
, 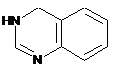 і
і 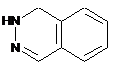 ;
;
де r дорівнює 1 або 2.
5. Сполука за п. 1, де R3 вибирають з групи, яка складається з
(1) (С1-С6)-алкілу, необов'язково заміщеного галогеном або -ORa,
(2) оксо,
(3) галогену,
(4) -ORa,
(5) -C(O)NRaRa і
(6) NRaRa;
де Ra має значення, вказані в п. 1.
6. Сполука формули Іа

або її фармацевтично прийнятна сіль, або її стереоізомер, або фармацевтично прийнятна сіль її стереоізомера,
в якій
n дорівнює 0, 1 або 2,
Y вибирають з групи, яка складається з метилену, -СН(СН3)- і зв'язку,
Z вибирають з групи, яка складається з
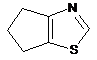 ,
, 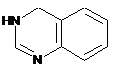 ,
,  ,
, 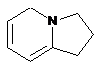 і
і 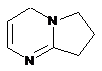 ;
;
і R3 вибирають з групи, яка складається з
(1) метилу,
(2) оксо і
(3) -NH2.
7. Сполука, вибрана з групи, яка складається з
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 ,
,
 і
і
 ,
,
або її фармацевтично прийнятна сіль, або її фармацевтично прийнятний стереоізомер, або фармацевтично прийнятна сіль її стереоізомера.
8. Сполука за п. 7, вибрана з групи, яка складається з
 ,
,
 ,
,
 і
і
 ;
;
або її фармацевтично прийнятна сіль, або її фармацевтично прийнятний стереоізомер, або фармацевтично прийнятна сіль її стереоізомера.
9. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
10. Спосіб лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3, за яким вводять пацієнту, потребуючому цього, терапевтично ефективну кількість сполуки за п. 1.
11. Спосіб за п. 10, де захворювання або розлад вибирають з групи, яка складається з (1) підвищеної активності сечового міхура, (2) нетримання сечі, (3) невідкладності сечовипускання з нетриманням сечі і (4) невідкладності сечовипускання.
12. Застосування сполуки за п. 1 при одержанні лікарського засобу для лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3.
13. Спосіб лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3, за яким вводять пацієнту, потребуючому цього, терапевтично ефективну кількість сполуки за п. 1 і антагоніста мускаринового рецептора.
14. Спосіб за п. 13, де захворювання або розлад вибирають з групи, яка складається з (1) підвищеної активності сечового міхура, (2) нетримання сечі, (3) невідкладності сечовипускання з нетриманням сечі і (4) невідкладності сечовипускання.
15. Застосування сполуки за п. 1 і другого активного засобу при одержанні лікарського засобу для лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3.
16. Сполука за п.6, де
n дорівнює 1;
Y вибирають з групи, яка складається з метилену, -СН(СН3)- і зв'язку;
Z являє собою
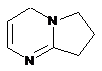 ; і
; і
R3 являє собою оксо.
17. Сполука формули

або її фармацевтично прийнятна сіль, або її фармацевтично прийнятний стереоізомер, або фармацевтично прийнятна сіль її стереоізомера.
18. Сполука формули

або її фармацевтично прийнятна сіль, або її фармацевтично прийнятний стереоізомер, або фармацевтично прийнятна сіль її стереоізомера.
19. Сполука формули

або її фармацевтично прийнятна сіль, або її фармацевтично прийнятний стереоізомер, або фармацевтично прийнятна сіль її стереоізомера.
Текст
Реферат: Даний винахід належить до сполук формули (Іа), фармацевтичних композицій з вказаними сполуками і їх застосування при лікуванні або попередженні захворювань, опосередкованих активацією адренорецептора β3. UA 101367 C2 (12) UA 101367 C2 OH H N O N H Ia Y Z (Ra)n UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 Функцією нижнього відділу сечових шляхів є накопичення і періодичне виділення сечі. Для цього потрібне гармонічне поєднання накопичення і рефлексів сечовипускання, в які залучається ряд аферентних і еферентних нервових трактів, призводячи до модуляції центральних і периферичних нейроефекторних механізмів, і як результат - координована регуляція симпатичних і парасимпатичних компонентів автономної нервової системи, а також соматичних моторних трактів. Вони безпосередньо регулюють скорочувальний стан сечового міхура (стискач) і гладкого м'яза сечового міхура і поперечно-смугастого м'яза уретрального сфінктера. У гладкому м'язі стискача різних видів, в тому числі, людини, щура, морської свинки, кролика, тхора, собаки, кішки, свині і примату, що не є людиною, присутні β-адренергічні рецептори (βAR). Однак фармакологічні дослідження показують існування помітних видових відмінностей в підтипах рецепторів, опосередковуючих релаксацію ізольованого стискача; у кішок і морських свинок переважає β1AR, у кролика переважає β2AR, і β3AR вносить внесок або переважає в стискачі собаки, щура, тхора, свині, мавпи і людини. Експресія підтипів βAR в стискачі людини і щура перевірена різними методами, і присутність β3AR підтверджена з використанням гібридизації in situ і/або полімеразної ланцюгової реакції із зворотною транскрипцією (ЗТ-ПЛР, RT-PCR). Кількісні ПЛР-аналізи в реальному часі мРНК β1AR, β2AR і β3AR в тканині сечового міхура хворих, що зазнають радикальної цистектомії, показують переважання мРНК β3AR (97 %, порівняйте з 1,5 % мРНК β1AR і 1,4 % мРНК β2AR). Більш того експресія мРНК β3AR рівнозначна в контрольних і закупорених сечових міхурах людей. Такі дані передбачають, що обструкція виходу з сечового міхура не призводить до даун-регуляції β3AR або до зміни релаксації стискача, опосередкованої β3AR. Також порівнювали реактивність β3AR в смужках сечового міхура, одержаних під час цистектомії або ентероцистопластики від пацієнтів, що вирішили мати нормальну функцію сечового міхура, і від пацієнтів з гіпорефлексією або гіперрефлексією стискача. Не спостерігали відмінностей між ступенем або силою релаксації, опосередкованої агоністом β3AR, що узгоджується з концепцією, що активація β3AR є ефективним шляхом релаксації стискача в здоровому і хворобливому станах. Офіційне свідчення в підтримку важливої ролі β3AR в накопиченні сечі випливає з досліджень in vivo. Після внутрішньовенного введення щурам селективний агоніст β3AR гризуна CL316243 знижує тиск в сечовому пузирі і в цистометричних дослідженнях підвищує місткість сечового міхура, що призводить до пролонгації інтервалу між сечовипусканнями без підвищення залишкового об'єму сечі. Сечовий міхур з підвищеною активністю (ОАВ) характеризується симптомами невідкладності сечовипускання з нетриманням сечі або без нього, як правило, пов'язаними з частотою і ніктурією. Поширеність ОАВ в Сполучених Штатах і Європі оцінюється в 16-17 % як серед жінок, так і серед чоловіків у віці старше за 18 років. Сечовий міхур з підвищеною активністю найчастіше класифікується як ідіопатичний, але також може бути вторинним при неврологічному стані, обструкції виходу з сечового міхура і в інших випадках. З патофізіологічної перспективи комплекс симптомів сечового міхура з підвищеною активністю, коли пов'язаний з нетриманням сечі, передбачає підвищену активність стискача. Показано, що невідкладність сечовипускання з нетриманням сечі або без нього негативно впливає як на соціальне, так і на медичне здоров'я і представляє суттєве навантаження в значенні щорічних витрат на медико-санітарну допомогу. Більш того існуюча лікарська терапія проти невідкладності (з нетриманням або без нього) є субоптимальною, оскільки багато пацієнтів або не показують адекватної реакції на існуюче лікування і/або не здатні переносити існуюче лікування (наприклад, сухість у роті, пов'язану з антихолінергічною терапією). Тому існує потреба в нових добре переносимих способах лікування, які ефективно лікують від частоти сечовипускання, невідкладності і нетримання, або у вигляді монотерапії, або в поєднанні з доступними видами терапії. Очікується, що засоби, які релаксують гладкий м'яз сечового міхура, такі як агоністи β3AR, будуть ефективними для лікування таких розладів сечовипускання. Суть винаходу Даний винахід належить до нових агоністів β3AR, фармацевтичних композицій, що містять їх, а також до способів лікування або профілактики опосередкованих через β3AR розладів з використанням таких нових сполук. Опис винаходу Даний винахід належить до сполук структурної формули Ia 1 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 , де n дорівнює 0, 1, 2, 3, 4 або 5; Y вибирають з групи, яка складається з (1) (С1-С5)-алкандіілу, (С2-С5)-алкендіілу і (С2-С5)-алкіндіілу, де кожний з алкандіілу, алкендіілу і алкіндіілу необов'язково заміщений однією-трьома групами, незалежно вибраними з a галогену, -OR і S(O)p-(C1-C3)-алкілу, де р дорівнює 0, 1 або 2; a a a a (2) -(CR R )j-Q-(CR R )k, де j і k рівні цілим числам, незалежно вибраним з 0, 1 і 2, (3) зв'язку і 1 (4) фенілену, необов'язково заміщеного однією-трьома групами, незалежно вибраними з R ; Z вибирають з групи, яка складається з (1) фенілу, (2) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, (3) бензольного циклу, конденсованого з (С5-С10)-карбоциклом, (4) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з 5- або 6-членним гетероциклом з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і (5) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з (С5-С10)-карбоциклом; 1 R вибирають з групи, яка складається з (1) (C1-C5)-алкілу, необов'язково заміщеного 1-5 атомами галогену, (2) (C3-C6)-циклоалкілу, (3) галогену, (4) нітро, (5) ціано, a (6) -C(O)R , a (7) -C(O)2R , a b (8) -C(O)NR R і b (9) -QR ; 3 R вибирають з групи, яка складається з (1) (C1-C6)-алкілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з галогену, a a a b OR , -CO2R і -CONR R , (2) -(CH2)t-фенілу або -(CH2)t-О-фенілу, де t дорівнює 0, 1, 2, 3, 4 або 5, і де вказаний феніл в кожному випадку необов'язково заміщений 1-3 групами, незалежно вибраними з галогену, (C1a C5)-алкілу, необов'язково заміщеного 1-5 атомами галогену, і -OR , (3) оксо, (4) тіоксо, (5) галогену, (6) -CN, (7) (C3-C6)-циклоалкілу, (8) -(CH2)t-гетероциклу або (CH2)t-О-гетероциклу, де t дорівнює 0, 1, 2, 3, 4 або 5, і де гетероцикл в кожному випадку являє собою 5- або 6-членний гетероцикл з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і де вказаний гетероцикл необов'язково ортоконденсований з бензольним циклом і необов'язково заміщений 1-3 групами, незалежно a вибраними з галогену, (C1-C5)-алкілу, необов'язково заміщеного 1-5 атомами галогену, і -OR , a (9) OR , a (10) -С(O)ОR , a (11) -С(O)R , a b (12) -С(O)NR R , a b (13) -NR R , a b (14) -NR С(O)R , a b (15) -NR С(O)ОR і 2 UA 101367 C2 a 5 10 15 20 25 30 35 40 45 50 55 60 a b (16) -NR C(O)NR R ; а R вибирають з групи, яка складається з водню і (C 1-C6)-алкілу, необов'язково заміщеного 15 атомами галогену; b R вибирають з групи, яка складається з (1) водню, (2) (C1-C6)-алкілу, необов'язково заміщеного 1-5 групами, вибраними з групи, яка складається з (а) гідрокси, (b) галогену, a (с) -CO2R , (d) -S(O)p-(C1-C3)-алкілу, де р дорівнює 0, 1 або 2; (е) (C3-C8)-циклоалкілу, (f) (C1-C6)-алкокси, необов'язково заміщеного 1-5 атомами галогену, і (g) фенілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з групи, яка a a складається з галогену, нітро, -NR Rа, трифторметилу, трифторметокси, (C1-C5)-алкілу і -OR , (3) (C3-C8)-циклоалкілу і (4) фенілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з групи, яка складається з (а) галогену, (b) нітро, a (с) -NR Rа, (d) -ОН, (е) (C1-C6)-алкокси, необов'язково заміщеного 1-5 атомами галогену, (f) -S(O)p-(C1-C6)-алкілу, де р дорівнює 0, 1 або 2; і (g) (C1-C6)-алкілу, необов'язково заміщеного 1-5 групами, вибраними з гідрокси, галогену, a c трифторметилу, ціано, -CO2R , (C3-C8)-циклоалкілу і -QR ; с R вибирають з групи, яка складається з (1) Z, необов'язково заміщеного групами до 5, вибраними з групи, яка складається з галогену, трифторметилу, ціано, (C1-C5)-алкілу і (C1-C5)-алкокси, і (2) (C1-C6)-алкілу; і Q вибирають з групи, яка складається з a (1) -N(R ), (2) -О- і (3) -S(O)p-, де р дорівнює 0, 1 або 2; або їх фармацевтично прийнятних солей. В одному втіленні сполуки формули Ia являють собою сполуки, де n дорівнює 0, 1, 2 або 3. В одній підмножині даного втілення n дорівнює 0. В іншій підмножині n дорівнює 1. В ще одній підмножині n дорівнює 2. В одному втіленні сполуки формули Ia являють собою сполуки, де Y являє собою метилен, СН(СН3)- або зв'язок. В одній їх підмножині Y являє собою метилен або -СН(СН3)-. В іншій їх підмножині Y являє собою зв'язок. В іншому втіленні сполуки формули Ia являють собою сполуки, де Z вибирають з групи, яка складається з (1) 5-членного гетероциклу з одним атомом азоту і 0-3 іншими гетероатомами, незалежно вибраними з атомів азоту, кисню і сірки, (2) 6-членного гетероциклу з 1, 2 або 3 атомами азоту або 1 атомом азоту і одним атомом кисню або сірки, (3) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з 5- або 6-членним гетероциклом з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і (4) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, конденсованого з (С5-С10)-карбоциклом. В іншому втіленні сполуки формули Ia являють собою сполуки, де Z вибирають з групи, яка складається з тіазолілу, оксазолілу, піридилу, дигідропіридилу, триазолілу (включаючи 1,2,4триазоліл і 1,2,3-триазоліл), тетразолілу, піримідинілу, дигідропіримідинілу, тетрагідропіримідинілу, піразинілу, дигідропіразинілу, піридазинілу, дигідропіридазинілу, піролідинілу, імідазолілу, піразолілу і оксадіазолілу (включаючи 1,2,4-оксадіазоліл і 1,2,5оксадіазоліл). В одній підмножині даного втілення Z вибирають з групи, яка складається з тіазолілу, піридилу, дигідропіридилу, 1,2,4-триазолілу, піримідинілу, дигідропіримідинілу, піридазинілу, дигідропіридазинілу і піразолілу. 3 UA 101367 C2 В іншому втіленні сполуки формули Ia являють собою сполуки, де Z вибирають з групи, яка складається з 5 10 15 де r дорівнює 1 або 2. Такі і будь-які інші придатні конденсовані цикли можуть приєднуватися до іншої частини молекули через атом вуглецю або атом азоту в будь-якому циклі. 3 В іншому втіленні сполуки формули Ia являють собою сполуки, де R вибирають з групи, яка складається з a (1) (C1-C6)-алкілу, необов'язково заміщеного галогеном або -OR , (2) оксо, (3) галогену, a (4) -OR , a a (5) -С(О)NR R і a a (6) -NR R ; a де R має значення, вказані вище. 3 3 В одній підмножині даного втілення R являє собою метил або етил. В іншій підмножині R 3 являє собою оксо. В іншій підмножині R являє собою -NH2. В іншому втіленні сполуки формули Ia являють собою сполуки зі специфічною стереоконфігурацією при вказаному хіральному центрі: 20 В іншому втіленні сполуки формули Ia являють собою сполуки зі специфічною стереоконфігурацією при вказаних хіральних центрах, причому хіральний центр, помічений зірочкою, являє собою R або S: 25 S. В одній підмножині конфігурація при хіральному центрі, поміченому зірочкою, являє собою 30 35 40 45 50 Термін "алкіл", що використовується в даному описі, призначений для позначення як розгалужених, так і лінійних насичених аліфатичних вуглеводневих груп з певною кількістю атомів вуглецю, наприклад, метилу (Ме), етилу (Et), н-пропілу (Pr), н-бутилу (Bu), н-пентилу, нгексилу, і їх ізомерів, таких як ізопропіл (ізо-Pr), 1-ізобутил (ізо-бут), втор-бутил (втор-Bu), третбутил (трет-Bu), ізопентил, ізогексил і т.п. Термін "циклоалкіл" означає моноциклічний насичений карбоцикл з певною кількістю атомів вуглецю, наприклад, 3, 4, 5 або 6 атомами вуглецю. Приклади циклоалкілу включають циклопропіл, циклобутил, циклопентил і циклогексил. Термін "алкандііл" належить до лінійного або розгалуженого двовалентного вуглеводневого радикала з певною кількістю атомів вуглецю. Терміни "алкендііл" і "алкіндііл" належать до лінійних або розгалужених ненасичених двовалентних вуглеводневих радикалів. "Алкендііл" характеризується подвійним вуглець-вуглецевим зв'язком, і "алкіндііл" характеризується потрійним вуглець-вуглецевим зв'язком. Приклади "алкандіілу" включають, але не обмежуються перерахованим, метилен (-СН2-), етилен (-СН2СН2-), 1,1-етандііл(-СН(СН3)-), 1,2пропандііл(-СН(СН3)СН2-), 2-метил-1,1-пропандііл(-CH[С(CH3)2])-); приклади "алкендіілу" включають, але не обмежуються перерахованим, 1,1-етендііл(-С(=СН2)-), 1,2-етендііл (-СН=СН-) і 2-пропен-1,1-дііл (-СН(СН=СН2)-); приклади "алкіндіілу" включають, але не обмежуються перерахованим, 1,2-етиндііл (-С≡С-) і 3-бутин-1,1-дііл (-СН(СН2С≡СН)-). Прикладом галогензаміщеного алкандіілу є -С(CH3)(F)-. Термін "необов'язково заміщений" означає "незаміщений або заміщений", і, отже, загальні структурні формули, описані в даному описі, охоплюють сполуки, що містять певний необов'язковий замісник, а також сполуки, які не містять необов'язковий замісник. Кожна змінна визначається незалежно кожний раз, коли має місце у визначеннях загальних структурних формул. Терміни "гало" або "галоген" призначені для включення фтору, хлору, брому і йоду, якщо не вказане інше. Переважними є фтор і хлор. Терміни "карбоцикл" або "карбоциклічний" належать до насичених, частково ненасичених і 4 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 60 ароматичних циклів, що мають в циклі тільки атоми вуглецю. Приклади включають, але не обмежуються перерахованим, циклопентил, циклогексил, циклогептил, циклооктил, цилопентеніл, циклогексеніл, циклогексадієніл і феніл. Термін "арил" належить до ароматичного карбоциклу. У межах визначення Z термін "бензольний цикл, конденсований з(С5-С10)карбоциклом" включає, але не обмежуються перерахованим, нафтил, дигідронафтил, тетрагідронафтил, інданіл, інденіл, бензоциклогептен, тетрагідробензоциклогептен і т.п.; переважно, бензол конденсований з (С5-С6)-карбоциклом. Такий конденсований цикл може приєднуватися до іншої частини молекули через атом вуглецю в будь-якому циклі. Терміни "гетероцикл" або "гетероциклічний" належать до насичених, частково ненасичених і ароматичних циклів, що мають щонайменше один циклічний гетероатом і щонайменше один циклічний атом вуглецю; гетероцикл може приєднуватися до іншої частини молекули через циклічний атом вуглецю або циклічний атом азоту. Терміни "гетероарил" або "гетероарильний" належать до ароматичного гетероциклу. У межах визначення Z термін "5- або 6-членний гетероцикл з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту" включає, але не обмежується перерахованим, піроліл, тієніл, фураніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіазоліл, триазоліл, тетразоліл, оксадіазоліл, тіадіазоліл, піролідиніл, тетрагідрофураніл, піридиніл, дигідропіридиніл, тетрагідропіридиніл, піримідиніл, дигідропіримідиніл, тетрагідропіримідиніл, піразиніл, дигідропіразиніл, тетрагідропіразиніл, піридазиніл, дигідропіридазиніл, тетрагідропіридазиніл, піперидиніл, піперазиніл, морфолініл, піраніл, дигідропіраніл, тетрагідропіраніл і т.п. 3 У випадку терміну (R )n, а також будь-яких інших подібних позначень, коли n дорівнює 0, тоді 3 3 R являє собою водень; коли n більше 1, тоді при кожній появі R незалежно вибирають з всіх 3 відповідних або вказаних для R груп. Оптичні ізомери діастереомери геометричні ізомери таутомери Сполуки, описані в даному описі, можуть містити асиметричний центр і, таким чином, можуть існувати у вигляді енантіомерів. Коли сполуки за винаходом мають два або велику кількість асиметричних центрів, вони також можуть існувати у вигляді діастереомерів. Коли в формулах у винаході зв'язки хірального вуглецю відображаються у вигляді прямих ліній, це розуміється як те, що в формулах укладаються обидві конфігурації хірального вуглецю (R) і (S), і, отже, обидва енантіомери і їх суміші. Даний винахід включає всі такі можливі стереоізомери як, по суті, чисті розщеплені енантіомери, їх рацемічні суміші, а також суміші діастереомерів. Наведена вище формула Ia показана без відмітної стереохімії в деяких положеннях. Даний винахід включає всі стереоізомери сполук формули Ia і їх фармацевтично прийнятні солі. Діастереомерні пари енантіомерів можна розділити, наприклад, фракційною кристалізацією з відповідного розчинника, і одержану таким чином пару енантіомерів можна розділити на окремі стереоізомери звичайними способами, наприклад, з використанням оптично активної кислоти або основи як розщеплюючого агента або ВЕРХ на хіральній колонці. Також будь-який енантіомер або діастереомер сполуки загальної формули Ia може бути одержаний стереоспецифічним синтезом з використанням оптично чистих вихідних матеріалів або реагентів відомої конфігурації. Коли сполуки, описані в даному описі, містять олефінові подвійні зв'язки, якщо не вказане інше, такі подвійні зв'язки означають включення як Е, так і Z геометричних ізомерів. Деякі зі сполук, описаних в даному описі, можуть існувати з різними точками приєднання водню, і такі сполуки називають таутомерами. Наприклад, сполуки, що включають карбонільні групи -СН2С(О)- (кетогрупи), можуть зазнавати таутомеризм з утворенням гідроксилвмісних груп -СН=С(ОН)- (енольні форми). Як кетоформи, так і енольні форми по окремості, а також їх суміші включені в обсяг даного винаходу. Солі Термін "фармацевтично прийнятні солі" належить до солей, одержаних з фармацевтично прийнятних нетоксичних основ або кислот. Коли сполука за даним винаходом являє собою кислоту, її відповідну сіль можна зазвичай одержати з фармацевтично прийнятною нетоксичною основою, в тому числі, неорганічними основами і органічними основами. Солі, одержані з такими неорганічними основами, включають солі алюмінію, амонію, кальцію, міді (одно- і двовалентної), заліза(3), заліза(2), літію, магнію, марганцю (двох- і тривалентного), калію, натрію, цинку, і подібні солі. Переважними є солі амонію, кальцію, магнію, калію і натрію. Солі, одержані з фармацевтично прийнятними нетоксичними органічними основами, включають солі первинних, вторинних і третинних амінів, одержаних як з тих, що зустрічаються в природі, так і синтетичних джерел. Фармацевтично прийнятні органічні нетоксичні основи, з якими можна одержати солі, включають, наприклад, аргінін, бетаїн, кофеїн, холін, N, N’дибензилетилендіамін, діетиламін, 2-діетиламіноетанол, 2-диметиламіноетанол, етаноламін, 5 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 60 етилендіамін, N-етилморфолін, N-етилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, дициклогексиламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і т.п. Коли сполука за даним винаходом являє собою основу, її відповідну сіль можна зазвичай одержати з фармацевтично прийнятною нетоксичною неорганічною і органічною кислотою. Такі кислоти включають, наприклад, оцтову, бензолсульфонову, бензойну, камфорсульфонову, лимонну, етансульфонову, фумарову, глюконову, глутамінову, бромводневу, хлороводневу, ізетіонову, молочну, малеїнову, яблучну, мигдалеву, метансульфонову, слизову, азотну, памову, пантотенову, фосфорну, бурштинову, сірчану, винну, п-толуолсульфонову кислоту і подібні кислоти. Переважними є лимонна, бромводнева, хлорводнева, малеїнова, фосфорна, сірчана і винна кислоти. Сольвати Даний винахід включає в свій обсяг сольвати сполук формули Ia. Термін "сольват", що використовується в даному описі, належить до комплексу змінної стехіометрії, утвореного розчиненими речовиною (тобто сполукою формули Ia) або її фармацевтично прийнятною сіллю і розчинником, що не впливає на біологічну активність розчиненої речовини. Приклади розчинників включають, але не обмежуються перерахованим, воду, етанол і оцтову кислоту. Коли розчинником є вода, сольват відомий як гідрат; гідрати включають, але не обмежуються перерахованим, гемі-, моно-, сескві-, ди- і тригідрати. Проліки Даний винахід включає в свій обсяг застосування проліків сполук за даним винаходом. Взагалі, такі проліки будуть являти собою функціональні похідні сполук за даним винаходом, які можуть легко перетворюватися in vivo на необхідну сполуку. Таким чином, в способах лікування за даним винаходом термін "введення" буде охоплювати лікування різних описаних станів сполукою формули Ia або сполукою, яка може не бути сполукою формули Ia, але яка перетворюється на сполуку формули Ia in vivo після введення пацієнту. Звичайні процедури відбору і одержання відповідних пролікарських похідних описані, наприклад, в "Design of Prodrugs", ed. Н. Bundgaard, Elsevier, 1985. Використання Сполуки за даним винаходом є сильними агоністами адренорецептора β3 і як такі застосовні при лікуванні або попередженні захворювань, розладів або станів, опосередкованих активацією адренорецептора β3. Таким чином, один аспект даного винаходу належить до способу лікування, регуляції або попередження таких захворювань, розладів або станів у ссавця, який включає введення такому ссавцеві терапевтично ефективної кількості сполуки формули Ia. Термін "ссавець" включає людину і тварин, що не належать до людини, таких як собаки і кішка і т.п. Захворювання, розлади або стани, у випадку яких сполуки за даним винаходом застосовні для лікування або попередження, включають, але не обмежуються перерахованим, (1) сечовий міхур з підвищеною активністю, (2) нетримання сечі, (3) невідкладність з нетриманням сечі, (4) невідкладність сечовипускання, (5) цукровий діабет, (6) гіперглікемію, (7) ожиріння, (8) гіперліпідемію, (9) гіпертригліцеридемію, (10) гіперхолестеринемію, (11) атеросклероз коронарної, мозкової і периферичних артерій, (12) шлунково-кишкові розлади, що включають пептичну виразку, езофагіт, гастрит і дуоденіт (в тому числі, що викликається Н. pylori), кишкові укривання виразками (в тому числі, запальне захворювання кишечнику, неспецифічний виразковий коліт, хвороба Крона і проктит) і шлунково-кишкові укривання виразками, (13) нейрогенне запалення дихальних шляхів, включаючи кашель, астму, (14) депресію, (15) захворювання передміхурової залози, такої як доброякісна гіперплазія передміхурової залози, (16) синдром подразненої товстої кишки і інші розлади, що потребує знижену рухливість кишок, (17) діабетичну ретинопатію, (18) передчасні роди і (19) підвищений внутрішньоочний тиск і глаукому. Будь-який придатний спосіб введення можна використовувати для надання ссавцеві, особливо, людині, ефективного дозування сполуки за даним винаходом. Наприклад, можна використовувати пероральний, ректальний, місцевий, парентеральний, очний, легеневий, назальний і подібні шляхи. Лікарські форми включають таблетки, пастилки, дисперсії, суспензії, розчини, капсули, креми, мазі, аерозолі і т.п. Переважно, сполуки формули Ia вводять перорально. Ефективне дозування активного інгредієнта може змінюватися залежно від певної сполуки, що використовується, способу введення, стану, який лікують, і тяжкості стану, який лікують. Таке дозування може бути легко встановлене фахівцем в даній галузі техніки. При лікуванні сечового міхура з підвищеною активністю (ОАВ) одними сполуками за даним 6 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом або в поєднанні з іншими засобами проти ОАВ, як правило, задовільні результати одержують, коли сполуки за даним винаходом вводять в добовому дозуванні від 0,01 мг до приблизно 100 мг на кг масу тіла тварини, переважно, що дається в однократній дозі або роздільних дозах два-шість разів на добу, або в формі з відстроченим вивільненням. У випадку 70-кг дорослої людини загальна добова доза, як правило, буде складати від приблизно 0,7 мг до приблизно 3500 мг, або специфічніше, від приблизно 0,7 мг до приблизно 2000 мг. Така схема прийому може бути відрегульована для одержання оптимального терапевтичного відгуку. При лікуванні одного ожиріння або в поєднанні з діабетом і/або гіперглікемією, як правило, задовільні результати одержують, коли сполуки за даним винаходом вводять в добовому дозуванні від 0,01 мг до приблизно 100 мг на кг масу тіла тварини, переважно, що дається в однократній дозі або роздільних дозах два-шість разів на добу, або в формі з відстроченим вивільненням. У випадку 70-кг дорослої людини загальна добова доза, як правило, буде складати від приблизно 0,7 мг до приблизно 3500 мг. Така схема прийому може бути відрегульована для одержання оптимального терапевтичного відгуку. При лікуванні цукрового діабету і/або гіперглікемії, а також інших захворювань або розладів, для яких застосовні сполуки формули Ia, як правило, задовільні результати одержують, коли сполуки за даним винаходом вводять в добовому дозуванні від 0,001 мг до приблизно 100 мг на кг маси тіла тварини, переважно, що дається в однократній дозі або роздільних дозах два-шість разів на добу, або в формі з відстроченим вивільненням. У випадку 70-кг дорослої людини загальна добова доза, як правило, буде складати від приблизно 0,07 мг до приблизно 350 мг. Така схема прийому може бути відрегульована для одержання оптимального терапевтичного відгуку. В одному втіленні сполуку за даним винаходом використовують для одержання лікарського засобу для лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3. Інший аспект даного винаходу належить до фармацевтичних композицій, що включають сполуки формули Ia і фармацевтично прийнятний носій. Фармацевтичні композиції за даним винаходом включають сполуку формули Ia або її фармацевтично прийнятну сіль як активний інгредієнт, і також можуть містити фармацевтично прийнятний носій і, необов'язково, інші терапевтичні інгредієнти. Термін "фармацевтично прийнятні солі" належить до солей, одержаних з фармацевтично прийнятними нетоксичними основами або кислотами, включаючи неорганічні основи або кислоти і органічні основи або кислоти. Композиції включають композиції, придатні для перорального, внутрішньоміхурового, ректального, місцевого, парентерального (в тому числі, підшкірного, внутрішньом'язового і внутрішньовенного), очного (офтальмічного), легеневого (назальної або трансбукальної інгаляції) або назального введення, хоча найбільш придатний шлях в будь-якому даному випадку буде залежати від характеру і тяжкості станів, які лікують, і природи активного інгредієнта. Вони зазвичай можуть надаватися в стандартній лікарській формі, і їх одержують будь-яким зі способів, добре відомих в галузі фармації. При практичному використанні сполуки формули Ia як активного інгредієнта можна об'єднувати при рівномірному перемішуванні з фармацевтичним носієм згідно із звичайними методами одержання фармацевтичних препаратів. Носій може приймати самі різні форми, залежно від форми препарату, потрібного для введення, наприклад, перорального або парентерального (включаючи внутрішньовенне). При одержанні композицій для пероральної лікарської форми можна використовувати будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти, коригенти, консерванти, барвники і т.п. для рідких пероральних препаратів, таких як, наприклад, суспензії, еліксири і розчини; або такі носії, як крохмаль, цукор, мікрокристалічна целюлоза, наповнювачі, агенти грануляції, мастильні речовини, зв'язуючі речовини, речовини, сприяючі розсипанню, і т.п. у випадку пероральних твердих препаратів, таких як, наприклад, порошки, тверді і м'які капсули і таблетки, причому тверді пероральні препарати переважніше рідких препаратів. Через легкість введення таблетки і капсули представляють найбільш вигідну пероральну лікарську форму, і в такому випадку, зрозуміло, використовують тверді фармацевтичні носії. За необхідності на таблетки може бути нанесене покриття стандартними водними і неводними методами. Такі композиції і препарати повинні містити щонайменше 0,1 % активної сполуки. Процентний вміст активної сполуки в таких композиціях може, звичайно, змінюватися і зазвичай може складати від приблизно 2 % мас. до приблизно 60 % мас. на одиницю. Кількість активної сполуки в таких терапевтично застосовних композиціях є такою, що буде виходити ефективне дозування. Активні сполуки також можна вводити інтраназально, у вигляді, наприклад, рідких крапель або спрею. 7 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таблетки, пілюлі, капсули і т.п. також можуть містити зв'язуючу речовину, таку як трагакантова смола, аравійська камедь, кукурудзяний крохмаль або желатин; ексципієнти, такі як дикальційфосфат; речовина, сприяюча розсипанню, така як кукурудзяний крохмаль, картопляний крохмаль, альгінова кислота; мастильна речовина, така як стеарат магнію; і підсолоджуючий засіб, такий як сахароза, лактоза або сахарин. Коли стандартна лікарська форма являє собою капсулу, вона може містити, крім матеріалів вказаних вище типів, рідкий носій, такий як жирне масло. Можуть бути присутніми різні інші матеріали як покриття або модифікуючі фізичну форму стандартної лікарської форми. Наприклад, таблетки можуть бути покриті шелаком, цукром або тим і іншим. Сироп або еліксир можуть містити, крім активного інгредієнта, сахарозу як підсолоджуючу речовину, метил- і пропілпарабени як консерванти, барвник і коригент, такі як вишнева або апельсинова віддушка. Сполуку формули Ia також можна вводити парентерально. Розчини або суспензії вказаних активних сполук можна одержати у воді, відповідним чином змішаної з поверхнево-активною речовиною, такою як гідроксипропілцелюлоза. Дисперсії також можна одержати в гліцерині, рідких поліетиленгліколях і їх сумішах в маслах. При звичайних умовах зберігання і застосування такі препарати містять консервант для запобігання зростанню мікроорганізмів. Фармацевтичні форми, придатні для застосування як ін'єкції, включають стерильні водні розчини або дисперсії і стерильні порошки для приготування стерильних розчинів або дисперсій для ін'єкцій для негайного застосування. У всіх випадках форма повинна бути стерильною і повинна бути текучою до такої міри, щоб могла легко застосовуватися за допомогою шприца. Вона повинна бути стійка в умовах одержання і зберігання і повинна бути захищена від забруднюючої дії мікроорганізмів, таких як бактерії і гриби. Носій може являти собою розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь і рідкий поліетиленгліколь), їх придатні суміші і рослинні олії. Сполуки формули Ia можна використовувати в поєднанні з іншими лікарськими засобами, які використовують при лікуванні/попередженні/пригніченні або полегшенні захворювань або станів, для яких застосовують сполуки формули Ia. Такі інші лікарські засоби можна вводити способом і в кількості, що зазвичай використовуються для них, одночасно або послідовно зі сполукою формули Ia. Коли сполуку формули Ia використовують одночасно з одним або декількома іншими лікарськими засобами, переважна фармацевтична стандартна лікарська форма, що містить такі інші лікарські засоби на додаток до сполуки формули Ia. Відповідно, фармацевтичні композиції за даним винаходом включають композиції, які крім сполуки формули Ia також містять один або декілька інших активних інгредієнтів. Приклади інших активних інгредієнтів, які можна комбінувати зі сполукою формули Ia, що вводяться або роздільно, або в єдиних фармацевтичних композиціях, включають, але не обмежуються перерахованим, (а) лікарські засоби проти підвищеної активності сечового міхура, що включають (i) антагоністи мускаринових рецепторів (наприклад, толтеродин, оксибутинін, в тому числі, Sоксибутинін, гіосціамін, пропантелін, пропіверин, троспій, включаючи хлорид троспію, соліфенацин, дарифенацин, імідафенацин, фезотеродин, теміверин, SVT-40776, 202405 від GlaxoSmithKline, TD6301, RBX9841, DDP200, PLD179 і інші антихолінергетики; див., наприклад, US 5382600, US 3176019, US 3480626, US 4564621, US 5096890, US 6017927, US 6174896, US 5036098, US 5932607, US 6713464, US 6858650 і DD 106643. Див. також US 6103747, US 6630162, US 6770295, US 6911217, US 5164190, US 5601839, US 5834010, US 6743441, WO 2002000652, WO 200400414853; як буде зрозуміло фахівцям в даній галузі техніки, такі лікарські засоби можна вводити перорально або місцево в стандартних формах або формах з відстроченим вивільненням, таких як форми з відстроченим вивільненням толтеродину, з відстроченим вивільненням оксибутиніну і трансдермального оксибутиніну), (ii) антагоністи NK-1 або NK-2 (наприклад, апрепітант, цизоліртин, сполуки, розкриті в WO 2005/073191, WO 2005/032464, і інші описані антагоністи NK-1), (iii) антагоністи альфа-адренергічних рецепторів (наприклад, альфузозин, доксазозин, празозин, тамсулозин, теразозин і інші), (iv) засоби, що відкривають калієві канали (наприклад, кромакалім, пінациділ і інші), (v) ванілоїди і інші модулятори аферентних нервів - агоністи і антагоністи (наприклад, капсаїцин, резиніфератоксин і інші), (vi) агоністи дофамінових рецепторів D1 (наприклад, перголінд), (vii) інгібітори повторного поглинання серотоніну і/або норепінефрину (наприклад, дулоксетин), (viii) інгібітори нервовом'язової сполуки вивільнення ацетилхоліну (наприклад, ботулінічний токсин), (ix) блокатори кальцієвих каналів (наприклад, дилітазем, ніфедипін, верапаміл і інші), (х) інгібітори синтезу простагландину (наприклад, флурбіпрофен), (xi) антагоністи рецепторів гамма-аміномасляної кислоти (наприклад, баклофен), (xii) вагінальні естрогенні препарати, (xiii) селективні інгібітори повторного поглинання норепінефрину, (xiv) агоністи 5-НТ2С, (xv) потенціалозалежний блокатор 8 UA 101367 C2 5 10 15 20 25 30 35 40 45 50 55 60 натрієвих каналів, (xvi) антагоністи пуринергічних рецепторів Р2Х (наприклад, антагоністи Р2 × 1 або Р2 × 3), (xvii) інгібітори PAR2, (xviii) інгібітори фосфодіестерази (наприклад, інгібітори PDE1, PDE4 і PDE5) і (xix) АТФ-чутливі речовини, що відкривають калієві канали; (b) сенсибілізатори інсуліну, в тому числі (i) агоністи PPARγ, такі як глітазони (наприклад, троглітазон, піоглітазон, енглітазон, МСС-555, BRL49653 і т.п.), і сполуки, розкриті в WO 97/27857, 97/28115, 97/28137 і 97/27847; (ii) бігуаніди, такі як метформін і фенформін; (с) інсулін або міметики інсуліну; (d) сульфонілсечовини, такі як толбутамід і гліпізид; (е) інгібітори α-глюкозидази (такі як акарбоза); (f) засоби, що знижують рівень холестерину, такі як (i) інгібітори HMG-CoA-редуктази (ловастатин, симвастатин і правастатин, флувастатин, аторвастатин і інші статини), (ii) речовини, що посилюють секрецію (холестирамін, колестипол і діалкіламіноалкільні похідні зшитого декстрану), (ii) нікотиніловий спирт, нікотинілова кислота або її сіль, (iii) агоністи рецепторів проліфератора-активатора α, такі як похідні фенофібринової кислоти (гемфіброзил, клофібрат, фенофібрат і бензафібрат), (iv) інгібітори поглинання холестерину, наприклад, бетаситостерин і езетімід, і інгібітори ацил-СоА (холестерин-ацетилтрансферази), наприклад, метиламід, (v) пробукол, (vi) вітамін Е і (vii) тироміметики; (g) агоністи PPARγ, такі як розкриті в WO 97/28149; (h) сполуки проти ожиріння, такі як фенфлурамін, дексфенфлурамін, фентермін, сибутрамін, орлістат і інші агоністи адренергічних рецепторів β3; (i) засоби, що модифікують харчову поведінку, такі як антагоністи нейропептидів Y (наприклад, нейропептиду Y5), такі як розкриті в WO 97/19682, WO 97/20820, WO 97/20821, WO 97/20822 і WO 97/20823; (j) агоністи PPARα, такі як описані в WO 97/36579, Glaxo; (k) агоністи PPARγ, такі як описані в WO 97/10813; і (l) інгібітори повторного поглинання серотоніну, такі як флуоксетин і сертралін. В одному втіленні сполука за даним винаходом і другий активний засіб, описаний вище, використовують при одержанні лікарського засобу для лікування або попередження захворювання або розладу, опосередкованого активацією адренорецептора β3. Сполуку формули Ia за даним винаходом можна одержати згідно з процедурами, показаними на схемах, що ідуть далі, і в прикладах, з використанням відповідних матеріалів, і також наведеними як приклади в конкретних прикладах, що ідуть далі. Крім того, використовуючи процедури, описані в даному описі, фахівець в даній галузі техніки може легко одержати інші сполуки за даним винаходом, що заявляються в даному описі. Однак сполуки, наведені в прикладах, не повинні розглядатися як утворюючі єдиний вид, який розглядається як винахід. Приклади також ілюструють деталі одержання сполук за даним винаходом. Фахівці в даній галузі техніки легко зрозуміють, що для одержання вказаних сполук можна використовувати різні зміни умов і процесів описаних далі процедур одержання. Сполуки за даним винаходом, як правило, виділяють в формі їх фармацевтично прийнятних солей, таких як солі, описані в даному описі вище. Вільні основи аміни, що відповідають виділеним солям, можна одержати нейтралізацією відповідною основою, такою як водний розчин гідрокарбонату натрію, карбонату натрію, гідроксиду натрію і гідроксиду калію, і екстрагуванням вільного аміну органічним розчинником з подальшим випарюванням. Вільну основу амін, виділену таким способом, потім можна перетворити на іншу фармацевтично прийнятну сіль розчиненням в органічному розчиннику з подальшим додаванням відповідної кислоти і подальшими випарюванням, осадженням або кристалізацією. Всі температури наводяться в градусах за Цельсієм, якщо не вказане інше. Мас-спектри (МС) вимірюють мас-спектроскопією з іонізацією електронним розпиленням. Різні хроматографічні методи можна використовувати при одержанні сполук. Такі методи включають, але не обмежуються перерахованим, високоефективну рідинну хроматографію (ВЕРХ), включаючи ВЕРХ з нормальною, оберненою фазою і хіральною фазою; рідинну хроматографію середнього тиску (РХСД), надкритичну рідинну хроматографію; препаративну тонкошарову хроматографію (преп. ТШХ); флеш-хроматографію на силікагелі або на силікагелі з оберненою фазою; іонообмінну хроматографію і радіальну хроматографію. Всі температури наводяться в градусах за Цельсієм, якщо не вказане інше. Вираз "стандартні умови реакції пептидного поєднання" означає поєднання карбонової кислоти з аміном з використанням кислотного активуючого агента, такого як EDC, DCC і ВОР, в інертному розчиннику, такому як дихлорметан, в присутності каталізатора, такого як НОВТ і НОАТ. Використання захисних груп для функціональних груп аміну і карбонової кислоти для полегшення потрібної взаємодії і мінімізації небажаних взаємодій добре описане в документах. 9 UA 101367 C2 5 10 Умови, необхідні для видалення захисних груп, описані у відомому керівництві, такому як Greene T. and Wuts P.G.M., Protective Groups in Organic Synthesis, John Wiley & Sons, Inc., New York. NY, 1991. Групи MOZ і ВОС є захисними групами, що зазвичай використовуються в органічному синтезі, і умови їх видалення відомі фахівцям в даній галузі техніки. Наприклад, MOZ можна видалити каталітичним гідруванням в присутності благородного металу або його оксиду, такого як платина на активованому вугіллі, в протонному розчиннику, такому як метанол або етанол. У випадках, коли каталітичне гідрування протипоказане через присутність інших потенційно реакційноздатних функціональних груп, видалення груп MOZ також можна досягнути обробкою розчином трифтороцтової кислоти, хлороводневої кислоти або газоподібним хлороводнем в розчиннику, такому як дихлорметан, метанол або етилацетат. Видалення захисних груп ВОС здійснюють за допомогою сильної кислоти, такої як трифтороцтова кислота, хлорводнева кислота, або газоподібним хлороводнем в розчиннику, такому як дихлорметан, метанол або етилацетат. У заявці терміни, наведені далі, мають вказані значення, якщо не відмічається інше. Термін Значення Ас Ацил (СН3С(О)-) Водн. Водний Bn Бензил ВОС (Вос) трет-Бутилоксикарбоніл Гексафторфосфат бензотриазол-1ВОР ілокситрис(диметиламіно)фосфонію о С Градус за Цельсієм Обчисл. або обно Обчислено Целіт Діатомова земля целіт™ DCC Дициклогексилкарбодіімід DCM Дихлорметан DIEA N, N-Діізопропілетиламін DMAP 4-Диметиламінопіридин ДМФА N, N-Диметилформамід 1-Етил-3-(3EDC диметиламінопропіл)карбодіімід Екв. або еквів. Еквівалент(и) ES-MC і Мас-спектрометрія з іонізацією ESI-МC електронним розпиленням Et Етил EtOAc Етилацетат г Грам(и) год. Година(и) Гексафторфосфат О-(7HATU азабензотриазол-1-іл)-N, N,N",N’тетраметилуронію НOAc Оцтова кислота НОАТ 1-Гідроксі-7-азабензотриазол НОВТ 1-Гідроксибензотриазол Високоефективна рідинна ВЕРХ хроматографія РХ/МС або РХМас Рідинна хроматографія - мас-спектр л Літр(и) М Молярний(і) Ме Метил МеОН Метанол МФ (MF) Молекулярна формула 10 UA 101367 C2 хв мг мл ммоль МОZ (Moz) Т.пл. МС нМ OTf Ph Преп. Ref. r.t. або rt Насич. SCF CO2S TBAF TBAI TBDPS TBS, TBDМS ТЕА або Et3N 5 10 15 20 25 Хвилина(и) Міліграм(и) Мілілітр(и) Мілімоль(и) п-Метоксибензилоксикарбоніл Температура плавления Мас-спектр Наномолярний Трифторметансульфоніл Феніл Препративний(а) Посилання Кімнатна температура Насичений Рідкий діоксид вуглецю в надкритичному стані Фторид тетрабутиламонію Йодид тетрабутиламонію трет-Бутилдифенілсиліл трет-Бутилдиметилсиліл Триетиламін Трифлат або Tf трифторметансульфонат TФК Трифтороцтова кислота TГФ Тетрагідрофуран TШХ Тонкошарова хроматографія TМS Триметилсиліл Наведені нижче схеми реакцій ілюструють способи, що використовуються при синтезі сполук формули Ia за даним винаходом. Всі замісники мають значення, вказані вище, якщо не вказане інше. Синтез нових сполук формули Ia, які є предметом даного винаходу,можна здійснювати одним або декількома схожими шляхами. За схемою I комерційно доступний I-1 обробляють 1-2 М розчином вінілвмісного реактиву Гріньяра або в безводному ТГФ або в ефірі при температурі 0ºС, і нагрівають до кімнатної температури протягом періоду часу від 1 до 4 години. Реакцію зазвичай здійснюють в інертному органічному розчиннику, такому як ТГФ, і в атмосфері інертного газу, такого як азот. Продукт реакції являє собою аліловий спирт структурної формули I-2. Конверсії I-2 в I-3 можна досягнути, підбираючи потрібний силілзахисний агент, такий як трет-бутилдиметилхлорид, і слабку органічну основу, таку як імідазол, і змішуючи їх при кімнатній температурі від 4 до 16 годин. Окиснення подвійного зв'язку за допомогою барботування газу озону протягом періоду часу до появи стійкого синього кольору і подальше відновлення озоніду за допомогою додавання надлишку метилсульфіду дають альдегід I-4. Потім I-4 обробляють або R-(+)-, або S(-)-2-метил-2-пропансульфінамідом в присутності кислоти Льюїса, такої як сульфат міді або тетрахлорид титану, яка також діє як осушувач. Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як дихлорметан, при температурі від кімнатної до 40ºС протягом 6-36 годин, і продукт реакції являє собою сульфінамід структурної формули I-5. Як і I1, I-5 обробляють вінілвмісним реактивом Гріньяра в схожих умовах і протягом схожего часу, і одержують алілсульфінамід I-6. Для того щоб селективно видалити сульфінамід, I-6 обробляють безводним 4 М розчином HCl в діоксані протягом не більше 15 хв. Потім реакційну суміш розбавляють толуолом і концентрують досуха, і одержують I-7. Нарешті, I-7 перетворюють в I-8 обробкою бензилхлорформіатом в присутності безводної органічної основи, такої як триетиламін або діізопропілетиламін, в інертному органічному розчиннику, такому як DCM, при 0ºС з нагріванням до кімнатної температури протягом періоду часу від 1 до 3 годин. Схема I 11 UA 101367 C2 5 10 15 20 25 30 35 40 З іншого боку, альдегід I-4 можна одержати так, як показано на схемі II. Обробка I-3 тетраоксидом осмію в присутності N-оксиду N-метилморфоліну дає діол I-9. Взаємодію зазвичай здійснюють в суміші води і ацетону, і суміш ретельно обробляють для видалення токсичного тетраоксиду осмію перед концентруванням розчину. Потім залишок I-9 розчиняють в суміші ацетон/вода (8:1) і обробляють перйодатом натрію протягом періоду часу від 8 до 24 годин при кімнатній температурі, і одержують альдегід I-4 як на схемі I. Потім його доводять до кінцевої потрібної проміжної сполуки I-8 з використанням тих самих процедур, які описані на схемі I. Схема II Схема III описує синтез піролідинового каркаса з використанням захищеного CBz аліламіду I-8, описаного на схемах I і II. Вінілову сполуку I-8 можна ввести в реакцію метатезису олефінів з проміжним вінілкетоном I-10 з використанням відповідних каталізаторів, застосовних при метатезисі олефінів, відомих фахівцям в даній галузі техніки. Відповідні каталізатори для одержання сполуки структурної формули I-11 включають, але не обмежуються перерахованим, каталізатори як "Grabbs", так і "Zhan" і типу, відомого як Grabbs-II і Zhan I або II. Гідрування такої проміжної сполуки I-11 за допомогою обробки в атмосфері водню з каталізатором 10 % паладієм-на-вугіллі в розчиннику, такому як етилацетат або етанол, протягом 2-16 годин призводить до гідрування олефіну разом з видаленням захисних CBz-груп на додаток до замикання циклу через внутрішньомолекулярне утворення іміну між вільним аміном і кетоном і відновлення іміну з утворенням піролідинового циклу загальної структури I-12. Залежно від вибору розчинника галогензамісники арилу можуть або залишитися, або бути видаленими в той самий час, залежно від переважної кінцевої проміжної сполуки. Селективний захист піролідину Вос можна виконати шляхом додавання до I-12 одного еквівалента трет-бутилдикарбонату (Вос2О) в присутності безводної органічної основи, такої як триетиламін (ТЕА). Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як ТГФ, і в інертній атмосфері, такій як азот, і одержують продукт структурної формули I-13. Залежно від вибору аміду, сульфонаміду або сечовини, I-13 можна перетворити на кожну вказану сполуку, використовуючи відповідний спосіб, відомий фахівцям в даній галузі техніки для одержання таких потрібних сполук. У випадку сульфонамідів I-13 можна обробити потрібним сульфонілхлоридом, що 6 містить R , в присутності відповідної основи, такої як піридин. 6 Використовуваний в даному описі R вибирають з (1) водню, (2) (С1-С10)-алкілу, необов'язково заміщеного 1-5 групами, незалежно вибраними з галогену, a a a b -OR , -CO2R CONR R , (3) фенілу, необов'язково заміщеного 1-3 групами, незалежно вибраними з галогену, (С 1-С5)a алкілу, необов'язково заміщеного 1-5 атомами галогену, і -OR , і (4) 5- або 6-членного гетероциклу з 1-4 гетероатомами, вибраними з атомів кисню, сірки і азоту, і де вказаний гетероцикл необов'язково орто-конденсований з бензольним циклом і необов'язково заміщений 1-3 групами, незалежно вибраними з галогену, (С 1-С5)-алкілу, a необов'язково заміщеного 1-5 атомами галогену, і -OR . Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як ДМФА, при температурі від кімнатної до 80ºС протягом періоду 12-24 годин, і продукт реакції являє собою 12 UA 101367 C2 5 10 15 20 25 30 сульфонамід структурної формули I-14. У випадку амідів I-13 можна обробити потрібним 6 ацетилхлоридом, що містить R , в присутності відповідної основи, такої як ТЕА або DIEA. Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як ДМФА, при кімнатній температурі протягом періоду 12-24 годин, і продукт реакції являє собою амід структурної формули I-15. Нарешті, сечовину можна одержати, обробляючи I-13 CDI або 6 фосгеном в присутності аміну, що містить R , протягом періоду часу від 1 до 24 годин при кімнатній температурі і одержати сечовину структурної формули I-16. Видалення Вос і силілзахисної груп з I-14, I-15 і I-16 одночасно за допомогою обробки 6 М HCl у водному метанолі при кімнатній температурі протягом періоду 12-24 години дає кінцеві потрібні продукти 6 амід, сульфонамід і сечовину, що містять R , показані в загальних структурних формулах I-17, I18 і I-19. Можна включити додаткові стадії видалення захисних груп, якщо для полегшення протікання 6 хімічних процесів необхідні захисні групи для групи R , відомі фахівцям в даній галузі техніки. Такі захисні групи можуть включати тритильні групи, трет-бутилкарбаматні групи або інші групи, 6 придатні для захисту гетероциклічних сполук або функціональних груп, приєднаних до групи R , таких як аміногрупи, гідроксильні групи, карбоксильні групи, відомих фахівцям в даній галузі техніки. Схема III Альтернативний шлях, показаний на схемі IV, описує синтез, який дає як цис-, так і транспіролідини, які розділяють перед одержанням кінцевої сполуки. Вихідний 2-аміноарилпропан-1,3-діол (I-20) спочатку захищають як напівацеталь з використанням ацетону у відповідному розчиннику, такому як толуол, в присутності кислоти, такої як п-толуолсульфонова кислота, і потім захищають амін обробкою третбутилдикарбонатом, і одержують проміжну сполуку I-21. З використанням стандартних умов окиснення за Сверном вільний первинний гідроксил перетворюють на альдегід I-22. Потім реакцією Віттіга з (трифенілфосфораніліден)ацетальдегідом альдегід подовжують на два атоми вуглецю, і одержаний подвійний зв'язок відновлюють гідруванням з паладієм-на-вугіллі, і одержують I-23. Потім одержану проміжну сполуку піддають другій реакції Віттіга з бромідом (4нітробензил)трифенілфосфонію, і одержують проміжну сполуку I-24, що створює можливість циклізації сполуки через приєднання за Міхаелем за подвійним зв'язком після видалення 13 UA 101367 C2 5 10 15 20 25 30 35 захисної групи. Захист аміногрупи трет-бутилдикарбонатом сприяє очищенню і відділенню субстрату для одержання як цис-, так і транс-ізомерів I-25a і I-25b, відповідно. Гідрування нітрогрупи до вільного аміну дає потрібні проміжні сполуки I-26a і I-26b. Проміжні сполуки I-26a і I-26b можна використовувати для стандартних амідних поєднань з використанням EDC, однак може бути потрібен селективний захист гідроксильної групи перед обробкою або ацил- або сульфонілхлоридами або фосгеном, коли йде перетворення на сечовину. Схема IV Схема V відображає в загальних рисах синтез піролідинового каркаса, який зв'язує шляхи на схемах I, III і IV, і дає піролідиновий каркас з діастереоселективністю для піролідину цис 2S, 5R. Реакцію Віттіга використовують для перетворення альдегіду I-22 зі схеми IV на вініловий аналог I-27 через обробку бромідом метилтрифенілфосфонію. Після маніпуляції із захисною групою, видною на проміжній сполуці I-28, схема стає конвергентною схемі III через проміжну сполуку I-8. Потім з використанням процедур, схожих з процедурами, описаними на схемі III, можна одержати проміжну сполуку I-11. Оптимізація гідрування за рахунок введення хлороводневої кислоти і показника розбавлення до концентрації 0,15-0,30 М дає переважно піролідиновий каркас I-13а цис 2S, 5R. Схема V Схема VI відображає в загальних рисах спосіб синтезу проміжного ацетилену методами хімії альдолей для встановлення хіральності як гідроксильної групи, так і лівої частини піролідину. З вказаної схеми випливає, що такий екв. проміжний ацетилен можна використовувати для синтезу як цис-, так і транс-піролідинів. Комерційно доступний I-29 спочатку обробляють триметилацетилхлоридом в присутності слабкої органічної основи, такої як триетиламін, при -25ºС протягом 2 годин. Послідовне додавання до суміші безводного хлориду літію і або (S)-(-)-4- бензил-, або (S)-(-)-4-феніл-2оксазолідинону і подальше поступове нагрівання до кімнатної температури протягом періоду часу від 12 до 24 годин дають імід I-30. Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як ТГФ, в інертній атмосфері, такій як азот. Спирт I-32 одержують згідно з процедурами, описаними в літературі (див. Evans et al., J. Am. Chem. Soc., 2002, 124, 392-394). Наприклад, обробка I-30 безводним хлоридом магнію, триетиламіном і відповідним альдегідом I-31, таким як 3-хлорбензальдегід або бензальдегід, і хлортриметилсиланом при кімнатній температурі протягом періоду 72 години дає триметилсиліловий ефір альдольного продукту I32. Взаємодію зазвичай здійснюють в інертному органічному розчиннику, такому як етилацетат, в інертній атмосфері, такій як азот. Обробка проміжної сполуки триметилсилілового ефіру 14 UA 101367 C2 5 10 15 20 25 30 35 40 сумішшю трифтороцтової кислоти і метанолу дає потрібний спирт I-32. Гідроліз іміду I-32 досягається обробкою пероксидом літію при 0ºС протягом 15-18 годин. Потім надкислоту відновлюють водним розчином сульфіту натрію, і одержують карбонову кислоту I-33. Взаємодію зазвичай здійснюють в суміші інертного органічного розчинника, такого як ТГФ, і води в інертній атмосфері, такій як азот. Конверсії I-33 в I-34 можна досягнути вибором потрібного силілвмісного захисного агента, такого як трет-бутилдиметилсилілтрифторметансульфонат, і його реакцією в присутності слабкої органічної основи, такої як DBU, при 0ºС протягом періоду від 12 до 16 годин. Потім I-34 можна обробити дифенілфосфорилазидом в присутності слабкої органічної основи, такої як триетиламін, протягом 6 годин при кімнатній температурі. Додавання відповідного спирту, такого як 4-метоксибензиловий спирт, з нагріванням при 100ºС протягом періоду від 12 до 16 годин дає відповідний карбамат I-35. Взаємодію зазвичай здійснюють в інертному органічному розчиннику, подібному толуолу, в інертній атмосфері, такій як азот. Матеріал утворює основу, на якій можна синтезувати піролідиновий каркас. Схема VI Схема VII відображає в загальних рисах використання I-35 для конверсії піролідинового каркаса. Піролідин одержують замиканням циклу через внутрішньомолекулярне відновне амінування з утворенням як цис-, так і транс-піролідину. Розділення цис- і транс-піролідину з подальшим відновленням нітрогрупи до аміну дає кінцевий потрібний піролінанілін, що використовується для синтезу аналогів. Алкін I-35 можна ввести у взаємодію в реакції типу перехресного поєднання за Сонагашира з відповідним комерційно доступним арилгалогенідом I-36 з утворенням I-37 з використанням відповідних умов реакції, відомих фахівцям в даній галузі техніки. Умови реакції можуть включати використання каталізаторів, таких як тетракис(трифенілфосфін)паладій(0), з йодидом міді(I) або без нього в присутності органічної основи, такої як триетиламін, або ацетат паладію(II), з органічною основою, такою як ацетат тетрабутиламонію, в органічному розчиннику, такому як ацетонітрил або ДМФА, в інертній атмосфері, такій як азот. Кетон I-38 можна одержати взаємодією алкіну I-37 з піролідином при температурі 80ºС в розчиннику, такому як ДМФА, протягом періоду від 3 до 6 годин. Подальша обробка 10 % водним розчином оцтової кислоти протягом періоду 15-60 хв при кімнатній температурі дає кетон I-38. Захисну групу в карбаматі I-38 можна видалити з використанням відповідних умов реакції, відомих фахівцям в даній галузі техніки, і одержати відповідний амін, який потім піддають внутрішньомолекулярному замиканню циклу з кетоном, і одержати імін I-39. Умови реакції можуть включати трифтороцтову кислоту в органічному розчиннику, такому як дихлорметан, і хлороводневу кислоту в органічному розчиннику, такому як ефір. Відновлення іміну I-39 можна досягнути обробкою ціаноборгідридом натрію в органічному розчиннику, такому як метанол, при температурі 0ºС в інертній атмосфері, такій як азот, протягом періоду 18-24 годин. Це дає проміжні сполуки цис-піролідин (I-40a) і транс-піролідин (I-40b), які можна розділити хроматографією на силікагелі. I-40a є основним діастереомером, що утворився в реакції, і він є першим діастереомером, який елююється з колонки. Захисту атома азоту піролідину I-40a або I-40b групою Вос досягають обробкою трет-бутилдикарбонатом в присутності слабкої органічної основи, такої як триетиламін. Взаємодію зазвичай здійснюють в органічному розчиннику, такому як дихлорметан, в інертній атмосфері, такій як азот, і одержують продукт реакції структурної формули I-41a або I-41b. Гідрування проміжної сполуки I41a або I-41b шляхом обробки з 10 % паладієм-на-вугіллі в присутності хлороводню при тиску 15 UA 101367 C2 2 5 10 15 20 25 водню від ~103,4 до ~344,7 кПа (15 50 ф/д ) в розчиннику, такому як етилацетат або етанол, протягом періоду часу 8-12 годин дає I-42a або I-42b. Залежно від вибору умов галогензамісники Х в цей час можуть або залишатися, або видалятися, залежно від переважної кінцевої проміжної сполуки. Схема VII У деяких випадках порядок здійснення реакційних схем може змінюватися для полегшення взаємодії або для того, щоб уникнути небажаних продуктів реакції. Наведені далі приклади даються для того, щоб винахід можна було зрозуміти більш повно. Наведені приклади є тільки пояснювальними і не повинні розглядатися як такі, що обмежують винахід будь-яким чином. Проміжна сполука 1 Бензил[3-(2-оксобут-3-ен-1-іл)феніл]карбамат (i-1) Стадія А. Етил(3-{[бензилокси)карбоніл]аміно}феніл)ацетат До розчину метил(3-амінофеніл)ацетату (25 г, 140 ммоль) в 250 мл безводного DCM додають DIEA (28,5 мл, 155 ммоль), і одержаний розчин охолоджують до 0ºС і поміщують в атмосферу азоту. Потім до такого охолодженого розчину додають бензилхлорформіат (21,1 мл, 148 ммоль), і одержану суміш перемішують протягом ночі, дозволяючи нагріватися до кімнатної температури. Реакційну суміш промивають 1 М HCL, водою і потім сольовим розчином. Органічний шар сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. У додатковому очищенні немає необхідності, і матеріал (44 г, 99 %) використовують як він є на + + наступній стадії реакції. РХ-МС: m/z (ES) 314 (MH) , 336 (MNa) . Стадія В. (3-{[Бензилокси)карбоніл]аміно}феніл)оцтова кислота До розчину 44,0 г (140 ммоль) етил(3-{[бензилокси)карбоніл]аміно}феніл)ацетату (зі стадії А) 16 UA 101367 C2 5 10 15 20 25 30 35 40 45 в ТГФ, етанолі і воді (1:1:1, 1500 мл) додають твердий LiOH (16,8 г, 700 ммоль), і одержаний розчин гріють при 60ºС на масляній бані протягом 3 годин. Суміш охолоджують до кімнатної температури протягом ночі, і потім поступово додають 40 мл концентрованої HCl, підтримуючи температуру нижче 25ºС, доти, поки рН розчину не стане приблизно 2-3. Екстрагують суміш етилацетатом (3×750 мл), потім екстракти об'єднують, і органічну фазу промивають водою і потім сольовим розчином. Органічну фазу сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Вказану в заголовку сполуку (24,7 г, 87 %) використовують на наступній + + стадії реакції без додаткового очищення. РХ-МС: m/z (ES) 286 (MH) , 308 (MNa) . Стадія С. Бензил(3-{2-[метокси(метил)аміно]-2-оксоетил}феніл)карбамат До суспензії 24,7 г (87 ммоль) (3-{[бензилокси)карбоніл]аміно}феніл)оцтової кислоти (зі стадії В) в 200 мл дихлорметану додають триетиламін (30,2 мл, 173 ммоль), що призводить до деякого виділення тепла (+5ºС), і суспензія стає розчином. Після охолодження протягом 10 хв до розчину додають HOBt (13,2 г, 87 ммоль) і гідрохлорид N, О-диметилгідроксиламіну (8,5 г, 87 ммоль) і потім EDC (16,6 г, 87 ммоль), і одержану суміш перемішують при кімнатній температурі протягом ночі в атмосфері азоту. Розчин переносять в ділильну лійку і промивають 1 М HCl, що спричиняє утворення емульсії. Додають метанол для руйнування емульсії, і водну фазу відділяють. Органічну фазу сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Перекристалізація залишку з 1000 мл 70 % гексану в етилацетаті (нагрівання до температури утворення флегми і подальше охолодження до кімнатної температури протягом ночі) дає вказану в заголовку сполуку (21 г, 74 %) у вигляді білої твердої речовини. РХ-МС: m/z (ES) 329 + (MH) . Стадія D. Бензил[3-(2-оксобут-3-ен-1-іл)феніл]карбамат (i-1) До охолодженого до 0ºС на бані зі сумішшю води і льоду розчину 15 г (45,7 ммоль) бензил(3-{2-[метокси(метил)аміно]-2-оксоетил}феніл)карбамату (зі стадії С) в 1000 мл безводного ТГФ в атмосфері азоту додають по краплях через канюлю 1,0 М розчин вінілмагнійброміду (100 мл в ТГФ, 100 ммоль), і одержаний розчин перемішують протягом 1 години при 0ºС. Реакцію гасять поступовим додаванням 500 мл 1 М HCl, підтримуючи температуру нижче 5ºС, і суміш перемішують протягом 30 хв. Потім суміш екстрагують етилацетатом, і об'єднані органічні шари промивають водою, а потім сольовим розчином. Потім органічні шари сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Залишок очищують флеш-хроматографією на Biotage 75M з елююванням сумішшю 30 % етилацетату в гексані, і одержують вказану в заголовку сполуку (11 г, 78 %) у вигляді світло-жовтої твердої + + 1 речовини. РХ-МС: m/z (ES) 310 (MH) , 332 (MNa) , H ЯМР (500 МГц, CDCl3) δ: 7,44-7,36 (м, 7H), 7,18 (д, J=8,4 Гц, 2H), 6,70 (ушир.с, 1H), 6,44 (дд, J=10,5, 17,6 Гц, 1H), 6,32 (дд, J=1,1, 17,6 Гц, 1H), 5,85 (дд, J=1,1, 10,5 Гц, 1H), 5,22 (с, 2H), 3,86 (с, 2H). Проміжна сполука 2 ((1R)-1-[(R)-{[трет-Бутил(диметил)силіл]окси)(3-хлорфеніл)метил]проп-2-ен-1-іл}карбамат (i2) Стадія А. 1-(3-Хлорфеніл)проп-2-ен-1-ол До охолодженого розчину 3-хлорбензальдегіду (22,5 г, 160 моль) в 100 мл безводного ТГФ в інертній атмосфері азоту поступово через шприц додають 1,6 М розчин вінілмагнійхлориду в ТГФ (100 мл, 160 ммоль), і розчин перемішують протягом трьох годин, залишаючи нагріватися до кімнатної температури. Реакцію гасять насиченим розчином хлориду амонію, і органічний шар відділяють, суміш екстрагують етилацетатом (2×200 мл), і органічні шари об'єднують, сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Очищення РХСД Horizon з колонкою з силікагелім 40М+ з використанням елюювання з градієнтом сумішами 0-40 % 17 UA 101367 C2 + 5 10 15 20 25 30 35 40 етилацетату в гексані дає вказану в заголовку сполуку (22,4 г, 44 %). m/z (ES) 168, 170 (м, M+2) , + 1 190, 192 (MNa, MNa+2) . H ЯМР (500 МГц, CDCl3) δ: 7,38 (с, 1H), 7,35-7,22 (м, 3H), 5,90 (ддд, J=7,3, 10,0, 17,4 Гц, 1H), 5,38 (д, J=17,5 Гц, 1H), 5,18 (д, J=7,2 Гц, 1H), 5,15 (д, J=10,1 Гц, 1H), 0,96 (с, 9H), 0,18 (с, 3H), 0,08 (с, 3H). Стадія В. трет-Бутил{[1-(3-хлорфеніл)проп-2-ен-1-іл]окси}диметилсилан До розчину 22,4 г (133 ммоль) 1-(3-хлорфеніл)проп-2-ен-1-олу (зі стадії А) в 90 мл безводного ДМФА додають трет-бутилдиметилсилілхлорид (20,0 г, 133 ммоль) і імідазол (18,1 г, 266 ммоль), і одержаний розчин перемішують протягом ночі в атмосфері азоту при кімнатній температурі. Суміш промивають водою і екстрагують етилацетатом. Органічний шар відділяють, сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Залишок очищують колонковою флеш-хроматографією на силікагелі з елююванням з градієнтом сумішами 0-15 % етилацетату в гексані, і одержують вказану в заголовку сполуку (16,6 г, 46 %). m/z (ES) 282, 284 + + (M, M+2) ; 151, 153 (M-OTBS, M-OTBS+2) . Стадія С. {[трет-Бутил(диметил)силіл]окси}(3-хлорфеніл)ацетальдегід Через розчин 4,0 г (14,2 ммоль) трет-бутил{[1-(3-хлорфеніл)проп-2-ен-1іл]окси}диметилсилану (зі стадії В) в дихлорметані, охолодженому до -78ºС на бані сухий лід/ацетон, барботують газ озон доти, поки розчин не буде зберігати світло-синій колір. Потім через розчин барботують газ азот доти, поки він не стане знову прозорим. До розчину додають метилсульфід, і одержану суміш перемішують протягом ночі при кімнатній температурі. Матеріал концентрують у вакуумі, залишок очищують РХСД Horizon на колонці з силікагелім 40М+ з елююванням з градієнтом сумішами 0-50 % етилацетату в гексані, і одержують продукт реакції (3,57 г, 89 %). Стадія D. N-[(1E)-2-{[трет-Бутил(диметил)силіл]окси}-2-(3-хлорфеніл)етиліден]-2метилпропан-2-сульфінамід До розчину 3,0 г (10,6 ммоль) {[трет-бутил(диметил)силіл]окси}(3-хлорфеніл)ацетальдегіду (зі стадії С) і 1,3 г (10,6 ммоль) (R або S)-2-метил-2-пропансульфінаміду в 50 мл безводного дихлорметану додають сульфат міді(II) (3,4 г, 21,2 ммоль), і одержану суміш перемішують при кімнатній температурі в атмосфері азоту протягом 16 годин. Реакційну суміш промивають водою і екстрагують дихлорметаном. Органічний шар сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Залишок очищують РХСД Horizon на колонці з силікагелім 40М+ з елююванням елююючою системою з градієнтом сумішами 0-25 % етилацетату в гексані, + і одержують вказану в заголовку сполуку (3,26 г, 80 %). m/z (ES) 387, 390 (M, M+2) . Стадія Е. N-{1-[{[трет-Бутил(диметил)силіл]окси}(3-хлорфеніл)метил]проп-2-ен-1-іл}-2метилпропан-2-сульфінамід До розчину 2,4 г (6,20 ммоль) N-[(1E)-2-{[трет-бутил(диметил)силіл]окси}-2-(3хлорфеніл)етиліден]-2-метилпропан-2-сульфінаміду (зі стадії D) в 20 мл безводного ТГФ, охолодженого до 0ºС, в атмосфері азоту додають через шприц 1,6 М розчин вінілмагнійхлориду в ТГФ (3,90 мл, 6,2 ммоль), і одержану суміш перемішують протягом 1 години. Суміш нагрівають до кімнатної температури і перемішують ще протягом години. Реакцію гасять насиченим 18 UA 101367 C2 5 розчином хлориду амонію, і суміш екстрагують етилацетатом. Об'єднані органічні шари сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Залишок очищують РХСД Horizon на колонці з силікагелім 40М+ з елююванням елююючою системою з градієнтом сумішами 035 % етилацетату в гексані, і одержують всі чотири діастереомери у вигляді окремих ізомерів. За даними ЯМР чотири одержаних продукти є діастереомерами один одного. Ізомери мітять за мірою їх елюювання з колонки на силікагелі. Ізомер, який елюйований першим, називають ізомером 1, потім ідуть ізомери 2, 3 і останній називають ізомером 4. + 10 15 20 25 30 35 40 45 + 1 Ізомер 1: m/z (ES) 416, 418 (м, M+2) , 438, 440 (MNa, MNa+2) . H ЯМР (500 МГц, CDCl3) δ: 7,32 (с, 1H), 7,30 (ушир.д, J=7,5, 1H), 7,26 (ушир.д, J=6,2 Гц, 2H), 7,22-7,18 (м, 1H), 5,60 (ддд, J=7,3, 10,3, 17,4 Гц, 1H), 5,15 (д, J=10,3 Гц, 1H), 5,00 (д, J=17,3 Гц, 1H), 4,57 (д, J=7,4 Гц, 1H), 3,98-3,94 (м, 2H), 1,64 (ушир.с, 1H), 1,23 (с, 9H), 0,91 (с, 9H), 0,08 (с, 3H),-0,18 (с, 3H). + + 1 Ізомер 2: m/z (ES) 416, 418 (м, M+2) , 438, 440 (MNa, MNa+2) . H ЯМР (500 МГц, CDCl3) δ: 7,33-7,31 (м, 2H), 7,26 (ушир.д, J=5,0 Гц, 2H), 7,20-7,16 (м, 1H), 5,44 (ддд, J=7,2, 10,0, 17,4 Гц, 1H), 5,26 (д, що перекривається, J=7,3 Гц, 1H), 5,25 (д, що перекривається, J=17,3 Гц, 1H), 4,84 (д, J=4,4 Гц, 1H), 4,02 (дт, J=4,4, 7,8 Гц, 1H), 3,80 (д, J=4,4 Гц, 1H), 1,20 (с, 9H), 0,94 (с, 9H), 0,14 (с, 3H),-0,12 (с, 3H). + + 1 Ізомер 3: m/z (ES) 416, 418 (м, M+2) , 438, 440 (MNa, MNa+2) . H ЯМР (500 МГц, CDCl3) δ: 7,32-7,29 (м, 2H), 7,26-7,24 (м, 2H), 7,22-7,20 (м, 1H), 6,04 (ддд, J=7,1, 10,4, 17,4 Гц, 1H), 5,40 (д, J=10,2 Гц, 1H), 5,32 (д, J=17,3 Гц, 1H), 4,80 (д, J=4,0 Гц, 1H), 3,88-3,80 (м, 1H), 3,55 (д, J=9,4 Гц, 1H), 1,09 (с, 9H), 0,95 (с, 9H), 0,09 (с, 3H),-0,10 (с, 3H). + + 1 Ізомер 4: m/z (ES) 416, 418 (м, M+2) , 438, 440 (MNa, MNa+2) . H ЯМР (500 МГц, CDCl3) δ: 7,32 (с, 1H), 7,30 (ушир.д, J=7,5, 1H), 7,27-7,25 (м, 2H), 7,21-7,18 (м, 1H), 5,92 (ддд, J=7,1, 10,3, 17,4 Гц, 1H), 5,23 (д, J=10,4 Гц, 1H), 5,18 (д, J=17,4 Гц, 1H), 4,75 (д, J=4,2 Гц, 1H), 3,88-3,82 (м, 1H), 3,33 (д, J=9,4 Гц, 1H), 1,19 (с, 9H), 0,94 (с, 9H), 0,09 (с, 3H),-0,14 (с, 3H). Стадія F. ((1R)-1-[(R)-{[трет-Бутил(диметил)силіл]окси)(3-хлорфеніл)метил]проп-2-ен-1іл}карбамат (i-2) До ізомеру 1 (510 мг, 2,22 ммоль) N-{1-[{[трет-бутил(диметил)силіл]окси}(3хлорфеніл)метил]проп-2-ен-1-іл}-2-метилпропан-2-сульфінаміду (зі стадії Е) додають 5 мл безводного 4 М розчину HCl в діоксані, і розчин перемішують протягом 15 хв при кімнатній температурі. Реакційну суміш концентрують досуха, і додають толуол (2×5 мл) для азеотропного видалення надлишку HCl. Потім залишок розчиняють в безводному дихлорметані, створюють інертну атмосферу азоту, розчин охолоджують до 0ºС на бані зі сумішшю води з льодом, і потім поступово через шприц додають бензилхлорформіат (0,32 мл, 2,22 ммоль) і потім діізопропілетиламін (1,19 мл, 6,66 ммоль), і одержаний розчин перемішують протягом 2 годин при 0ºС. Розчин концентрують у вакуумі досуха, залишок очищують на препаративних пластинках (4×1000 мкм) з елююванням сумішшю 20 % етилацетату в гексані, і одержують + + вказану в заголовку сполуку (703 мг, 71 %). m/z (ES) 446, 448 (м, M+2) , 468, 470 (MNa, MNa+2) . 1 H ЯМР (500 МГц, CDCl3) δ: 7,32 (с, 1H), 7,30 (ушир.д, J=7,5, 1H), 7,27-7,25 (м, 2H), 7,21-7,18 (м, 1H), 5,92 (ддд, J=7,1, 10,3, 17,4 Гц, 1H), 5,23 (д, J=10,4 Гц, 1H), 5,18 (д, J=17,4 Гц, 1H), 4,75 (д, J=4,2 Гц, 1H), 3,88-3,82 (м, 1H), 3,33 (д, J=9,4 Гц, 1H), 1,19 (с, 9H), 0,94 (с, 9H), 0,09 (с, 3H),-0,14 (с, 3H). Проміжні сполуки різної стереохімії, споріднені описаним вище, можна одержати з відповідних вихідних речовин з використанням процедури, описаної вище. Проміжна сполука 3 трет-Бутил-(5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-3) 19 UA 101367 C2 Стадия А. Бензил{4-[(3E, 5R, 6R)-5-{[(бензилокси)карбоніл]аміно-6-{[третбутил(диметил)силіл]окси}-6-(3-хлорфеніл)-2-оксогекс-3-ен-1-іл]феніл}карбамат 5 10 15 20 25 30 35 40 До розчину бензил[3-(2-оксобут-3-ен-1-іл)феніл]карбамату (i-1) (820 мг, 2,80 ммоль) і ((1R)-1[(R)-{[трет-бутил(диметил)силіл]окси)(3-хлорфеніл)метил]проп-2-ен-1-іл}карбамату (i-2) (500 мг, 1,12 ммоль) в 7 мл безводного дихлорметану додають каталізатор Zhan I (740 мг, 1,12 ммоль), і одержаний зелений розчин гріють при 40ºС протягом в атмосфері азоту. Реакційну суміш концентрують досуха, залишок очищують на препаративних пластинках (4×1000 мкм) з елююванням сумішшю 40 % етилацетату в гексані, і одержують вказану в заголовку сполуку + + (348 мг, 50 %). m/z (ES) 713, 715 (M, M+2) , 735, 737 (MNa, MNa+2) . Стадія В. 4-({(5R)-5-[(R)-{[трет-Бутил(диметил)силіл]окси}(феніл)метил]піролідин-2іл}метил)анілін До розчину 328 мг (0,46 ммоль) бензил{4-[(3E, 5R, 6R)-5-{[(бензилокси)карбоніл]аміно-6{[трет-бутил(диметил)силіл]окси}-6-(3-хлорфеніл)-2-оксогекс-3-ен-1-іл]феніл}карбамату (зі стадії А) в 25 мл етанолу додають 10 % паладій-на-вугіллі, і суспензію поміщують в атмосферу водню при подачі водню з балона. Реакційну суміш перемішують в атмосфері водню протягом 1 години при кімнатній температурі. ТШХ показує, що реакція пройшла повністю. Каталізатор відфільтровують з використанням шприца з фільтром з ПТФЕ, 0,45 мкм, Gilmen, і промивають етанолом (4×5 мл). Фільтрат концентрують у вакуумі досуха, залишок очищують на препаративній пластинці (3×1000 мкм) з елююванням сумішшю 5 % метанолу в дихлорметані, і + одержують вказану в заголовку сполуку (121 мг, 66 %). m/z (ES) 397 (МН) . Стадія C. трет-Бутил-(5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-3) До розчину 121 мг (0,315 ммоль) 4-({(5R)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-2-іл}метил)аніліну (зі стадії В) в 5 мл безводного ТГФ додають трет-бутилкарбонат (69 мг, 0,315 ммоль), а потім ТЕА (44 мкл, 0,315 ммоль), і одержаний розчин перемішують при кімнатній температурі в атмосфері азоту протягом ночі. Реакційну суміш наносять безпосередньо на препаративну пластинку (1500 мкм) і елююють сумішшю 30 % етилацетату в гексані, і одержують вказану в заголовку сполуку (100 + + 1 мг, 64 %). m/z (ES) 497 (MH) , 397 (M-Boc) . H ЯМР (500 МГц, CDCl3) δ: 7,40-7,30 (м, 5H), 6,756,68 (м, 2H), 6,56-6,51 (м, 2H), 5,52-5,48 (м, 1H), 5,32-5,28 (м, 1H), 4,16-4,06 (м, 2H), 3,88-3,82 (м, 1H), 3,76-3,70 (м, 1H), 3,55-3,48 (м, 2H), 2,74 (ушир.д, J=11,8 Гц, 1H), 2,44 (ушир.д, J=11,8 Гц, 1H), 2,05-1,94 (м, 1H), 1,90-1,82 (м, 1H), 1,60 (с, 9H), 1,50-1,42 (м, 1H), 1,32-1,22 (м, 2H), 1,10-1,02 (м, 1H), 0,95 (с, 9H), 0,08 (с, 3H),-0,15 (с, 3H). Розділення проміжних сполук 4а і 4b трет-Бутил-(2S,5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4а) трет-Бутил-(2R,5R)-2-(4-амінобензил)-5-[(R)-{[трет 20 UA 101367 C2 бутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4b) 5 10 15 20 25 30 Стадія А. трет-Бутил-(2S,5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4а) і трет-бутил-(2R, 5R)-2(4-амінобензил)-5-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i4b) Проміжну сполуку i-3 (трет-бутил-(5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (суміш цис і транс, 4:1) розчиняють в метанолі і очищують методом SFC (надкритична), Berger Multigram, з використанням елюенту суміші 30 % метанолу:60 % діоксиду вуглецю, і два стереоізомери розділяють. Перший ізомер, елюйований з колонки, називають мінорним ізомером 1 і другий ізомер називають основним ізомером 2. + + 1 i-4a: m/z (ES) 497 (MH) , 397 (M-Boc) , H ЯМР (500 МГц, CDCl3) δ: 7,40-7,30 (м, 5H), 6,756,68 (м, 2H), 6,56-6,51 (м, 2H), 5,52-5,48 (м, 1H), 5,32-5,28 (м, 1H), 4,16-4,06 (м, 2H), 3,88-3,82 (м, 1H), 3,76-3,70 (м, 1H), 3,55-3,48 (м, 2H), 2,74 (ушир.д, J=11,8 Гц, 1H), 2,44 (ушир.д, J=11,8 Гц, 1H), 2,05-1,94 (м, 1H), 1,90-1,82 (м, 1H), 1,60 (с, 9H), 1,50-1,42 (м, 1H), 1,32-1,22 (м, 2H), 1,10-1,02 (м, 1H), 0,95 (с, 9H), 0,92 (д, J=11,8 Гц, 1H), 0,12 (ушир.д, J=14,0 Гц, 3H),-0,04 (с, 3H). Елююється 8,70 хв на SFC, ізомер 2. + + 1 i-4b: m/z (ES) 497 (MH) , 397 (M-Boc) , H ЯМР (500 МГц, CDCl3) δ: 7,40-7,30 (м, 5H), 6,766,68 (м, 2H), 6,56-6,51 (м, 2H), 5,52-5,48 (м, 1H), 5,32-5,28 (м, 1H), 4,16-4,06 (м, 2H), 3,88-3,82 (м, 1H), 3,76-3,70 (м, 1H), 3,60-3,46 (м, 2H), 2,72 (ушир.д, J=12,0 Гц, 1H), 2,44 (ушир.д, J=12,2 Гц, 1H), 2,05-1,94 (м, 1H), 1,90-1,82 (м, 1H), 1,64 (с, 9H), 1,50-1,42 (м, 1H), 1,32-1,22 (м, 2H), 1,10-1,02 (м, 1H), 0,95 (с, 9H), 0,14 (ушир.д, J=13,8 Гц, 3H), 0,09 (с, 3H). Елююється 7,78 хв на SFC, ізомер 1. Синтез проміжної сполуки 4а і проміжної сполуки 4b трет-Бутил-(2S, 5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4а); трет-бутил-(2R, 5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4b) Стадія А. (4S)-3-Гекс-5-иноїл-4-феніл-1,3-оксазолідин-2-он 35 40 До розчину 69,0 г (615 ммоль) 5-гексинової кислоти і 214 мл (1540 ммоль) триетиламіну в 1,0 л безводного тетрагідрофурану при -25ºС в атмосфері азоту протягом 20 хв додають 83,0 мл (677 ммоль) триметилацетилхлориду. Після додавання утворюється білий осад, і одержану суспензію перемішують протягом 2 годин. Потім послідовно додають 28,7 г (677 ммоль) безводного хлориду літію і 100,0 г (615,0 ммоль) (4S)-4-феніл-1,3-оксазолідин-2-ону, і суміш поступово нагрівають до температури навколишнього середовища протягом 12 годин. Всі леткі речовини видаляють у вакуумі, і залишок розбавляють водою (1 л) і екстрагують етилацетатом (3×300 мл). Об'єднані органічні шари промивають сольовим розчином (250 мл), сушать над сульфатом магнію, фільтрують і концентрують у вакуумі. Сирий залишок очищують 21 UA 101367 C2 5 10 15 20 25 30 35 40 хроматографією на силікагелі з елююванням з градієнтом сумішами 5-50 % етилацетату в гексані, і одержують вказану в заголовку сполуку у вигляді безбарвної твердої речовини (135 г, 1 85,4 %). H ЯМР (500 МГц, CDCl3): δ 7,40-7,37 (м, 2H), 7,36-7,32 (м, 1H), 7,31-7,28 (м, 2H), 5,42 (дд, J=8,9, 3,7 Гц, 1H), 4,69 (т, J=8,9 Гц, 1H), 4,28 (дд, J=9,2, 3,7 Гц, 1H), 3,13-3,02 (м, 2H), 2,24+ 2,21 (м, 2H), 1,94 (т, J=2,6 Гц, 1H), 1,84 (квінтет, J=7,1 Гц, 2H). РХ-МС: m/z (ES) 258,2 (MH) . Стадія В. (4S)-3-{(2R)-2-[(S)-Гідрокси(феніл)метил]гекс-5-иноїл}-4-феніл-1,3-оксазолідин-2-он До розчину 56,8 г (221 ммоль) (4S)-3-гекс-5-иноїл-4-феніл-1,3-оксазолідин-2-ону з описаної вище стадії А в 265 мл безводного етилацетату при перемішуванні при температурі навколишнього середовища в атмосфері азоту додають 6,31 г (66,2 ммоль) безводного хлориду магнію, 61,5 мл (442 ммоль) триетиламіну, 26,9 мл (265 ммоль) бензальдегіду і 42,3 мл (331 ммоль) хлортриметилсилану, і одержану суміш перемішують протягом 72 годин. Неоднорідну реакційну суміш фільтрують через 300-мл шар силікагелю з елююванням ще 1 л етилацетату. Фільтрат упарюють у вакуумі досуха, і залишок суспендують в 265 мл метанолу і 10 мл трифтороцтової кислоти. Одержану суміш перемішують при температурі навколишнього середовища в атмосфері азоту протягом 5 годин, протягом яких реакційна суміш стає однорідною. Потім всі леткі речовини видаляють у вакуумі, залишок очищують хроматографією на силікагелі з елююванням з градієнтом сумішами 5-15 % етилацетату в гексані, і одержують 1 вказану в заголовку сполуку у вигляді білої твердої речовини (65,0 г, 81,2 %). H ЯМР (500 МГц, CDCl3): δ 7,30-7,28 (м, 8H), 7,09-7,07 (м, 2H), 5,42 (дд, J=8,7, 3,7 Гц, 1H), 4,76-4,72 (м, 1H), 4,724,67 (м, 1H), 4,65 (т, J=8,7 Гц, 1H), 4,18 (дд, J=8,7, 3,7 Гц, 1H), 3,05 (д, J=7,8 Гц, 1H), 2,24 (тд, + J=7,1, 2,5 Гц, 2H), 2,00-1,93 (м, 2H), 1,67-1,61 (м, 1H). РХ-МС: m/z (ES) 346,1 (MH-H2O) , 386,0 + (MNa) . Стадія С. (2R)-2-[(S)- Гідрокси(феніл)метил]гекс-5-инова кислота До розчину 65,0 г (179 ммоль) (4S)-3-{(2R)-2-[(S)-гідрокси(феніл)метил]гекс-5-иноїл}-4-феніл1,3-оксазолідин-2-ону з описаної вище стадії В в 1050 мл суміші безводного тетрагідрофурану з водою, 20: 1, при перемішуванні при 0ºС в атмосфері азоту додають 77,0 мл (894 ммоль) 35 % водного розчину пероксиду водню зі швидкістю, досить повільною для того, щоб підтримувати внутрішню температуру нижче 3ºС. Потім додають 395 мл (395 ммоль) 1,0 М водного розчину гідроксиду літію зі швидкістю, досить повільною для того, щоб підтримувати внутрішню температуру реакційної суміші нижче 5ºС, і одержану суміш перемішують протягом 3 годин при 0ºС. Реакцію гасять 755 мл (984 ммоль) 1,3 М водного розчину сульфіту натрію зі швидкістю, досить повільною для того, щоб підтримувати внутрішню температуру суміші нижче 5ºС. Всі леткі речовини видаляють у вакуумі, і водну фазу, що залишилася, екстрагують етилацетатом (3×200 мл). Потім водну фазу охолоджують до 0ºС і підкислюють 6 М соляною кислотою доти, поки не досягнуть рН 3. Потім водну фазу екстрагують етилацетатом (3×300 мл), і об'єднані органічні шари промивають сольовим розчином (100 мл), сушать над сульфатом магнію, фільтрують і упарюють у вакуумі. Залишок очищують хроматографією на силікагелі з елююванням з градієнтом сумішами 5-10 % етилацетату і 3 % оцтової кислоти в гексані, і 1 одержують вказану в заголовку сполуку у вигляді безбарвної смоли (32,0 г, 82,0 %). H ЯМР (500 МГц, CDCl3): δ 7,39-7,28 (м, 5H), 4,85 (д, J=8,2, 1H), 3,03-2,97 (м, 1H), 2,29-2,15 (м, 2H), 1,97 + (т, J=2,5 Гц, 1H), 1,93-1,82 (м, 1H), 1,62-1,55 (м, 1H). РХ-МС: m/z (ES) 201,0 (MH-H2O) . Стадія D. (2R)-2-[(S)-{[трет-Бутил(диметил)силіл]окси}(феніл)метил]гекс-5-инова кислота 45 22 UA 101367 C2 5 10 15 20 25 30 35 40 45 До розчину 32,0 г (147 ммоль) (2R)-2-[(S)-гідрокси(феніл)метил]гекс-5-инової кислоти з описаної вище стадії С в 500 мл безводного ацетонітрилу при перемішуванні при температурі навколишнього середовища в атмосфері азоту додають 77,0 мл (513 ммоль) 1,8діазабицикло[5.4.0]ундец-7-ену і потім 66,3 г (440 ммоль) трет-бутилдиметилсилілхлориду в три прийоми протягом 10 хв. Реакційну суміш перемішують протягом 4 годин і потім упарюють у вакуумі для видалення всіх летких речовин. Залишок розбавляють 300 мл дихлорметану і 100 мл води. До суміші додають 1,0 М водного розчину соляну кислоту доти, поки не досягнуть рН 3. Фази розділяють, і водну фазу екстрагують дихлорметаном (2×100 мл). Об'єднані органічні шари промивають водою (50 мл) і сольовим розчином (50 мл) і потім сушать над сульфатом магнію. Після фільтрації і упарювання у вакуумі залишок розчиняють в 350 мл метанолу, і додають 350 мл (280 ммоль) 0,8 М водного розчину карбонату калію. Одержану суміш перемішують протягом 1,5 години і потім упарюють у вакуумі для видалення всіх летких речовин. Залишок розбавляють 300 мл дихлорметану, і водну фазу підкислюють 5,0 М водного розчину соляною кислотою доти, поки не досягнуть рН 3. Фази розділяють, і водну фазу екстрагують дихлорметаном (2×100 мл). Об'єднані органічні шари промивають водою (50 мл) і сольовим розчином (50 мл), потім сушать над сульфатом магнію, фільтрують і упарюють у вакуумі. Залишок очищують хроматографією на силікагелі з елююванням з градієнтом сумішами 3-15 % етилацетату в гексані, і одержують вказану в заголовку сполуку у вигляді безбарвної 1 твердої речовини (42,3 г, 86,6 %). H ЯМР (500 МГц, CDCl3): δ 7,36-7,27 (м, 5H), 4,78 (д, J=8,7, 1H), 2,90-2,86 (м, 1H), 2,19-2,11 (м, 1H), 2,10-2,03 (м, 1H), 1,90 (т, J=2,6 Гц, 1H), 1,75-1,67 (м, 1H), + 1,41-1,34 (м, 1H), 0,83 (с, 9H), 0,02 (с, 3H), -0,27 (с, 3H). РХ-МС: m/z (ES) 333,2 (MH) . Стадія Е. 4-Метоксибензил-{(1R)-1-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]пент4-ин-1-іл}карбамат До розчину 40,0 г (120 ммоль) (2R)-2-[(S)-{[третбутил(диметил)силіл]окси}(феніл)метил]гекс-5-инової кислоти з описаної вище стадії D і 33,5 мл (241 ммоль) триетиламіну в 400 мл безводного толуолу при температурі навколишнього середовища в атмосфері азоту додають 37,5 мл (132 ммоль) дифенілфосфорилазиду. Суміш перемішують протягом 5 годин, і потім додають 37,5 мл (301 ммоль) 4-метоксибензилового спирту. Одержану суміш гріють при 105ºС протягом 16 годин, охолоджують до температури навколишнього середовища і потім розбавляють 250 мл насиченого водного розчину бікарбонату натрію. Фази розділяють, і водну фазу екстрагують етилацетатом (2×150 мл). Об'єднані органічні шари промивають водою (100 мл) і сольовим розчином (100 мл), потім сушать над сульфатом магнію, фільтрують і упарюють у вакуумі. Сирий залишок очищують хроматографією на силікагелі з елююванням з градієнтом сумішами 3-10 % етилацетату в гексані, і одержують вказану в заголовку сполуку у вигляді безбарвного масла (50,9 г, 90,5 %). 1 H ЯМР (500 МГц, CDCl3): 7,28-7,21 (м, 7H), 6,87 (д, J=8,4 Гц, 2H), 4,92 (с, 2H), 4,77-4,59 (м, 2H), 3,89-3,84 (м, 1H), 3,81 (с, 3H), 2,30-2,22 (м, 2H), 1,95 (м, 1H), 1,91-1,85 (м, 1H), 1,57-1,50 (м, 1H), + + 0,89 (с, 9H), 0,06 (с, 3H),-0,15 (с, 3H). РХ-МС: m/z (ES) 468,1 (MH) , 490,0 (MNa) . Стадія F. 4-Метоксибензил-[(1R)-1-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітрофеніл)пент-4-ин-1-іл]карбамат До розчину ацетилену (зі стадії Е, 40 г, 80 ммоль) і 4-йоднітробензолу (21,8 г, 88 ммоль) в безводному ДМФА (500 мл) додають триетиламін (111 мл, 797 ммоль). Додають Pd(dppf)Cl 2 (1,95 г, 2,39 ммоль) і йодид міді(I) (910 мг, 4,78 ммоль), і суміш знегажують азотом (барботування 15 хв), і одержаний розчин перемішують при кімнатній температурі протягом 5 годин. Суміш виливають у воду (1200 мл) і екстрагують EtOAc (3×300 мл). Потім об'єднані органічні шари промивають водою (2×500 мл) і насиченим розчином NaCl (200 мл), сушать над 23 UA 101367 C2 5 10 15 20 25 30 35 40 сульфатом магнію, фільтрують і упарюють у вакуумі. Залишок очищують РХСД (Horizon Biotage 2x Flash 65i) з елююванням з градієнтом сумішами 0-30 % етилацетату в гексані, і одержують 41 1 г (84 %) темно-червоного масла. H ЯМР (500 МГц, CDCl3): 8,11-8,04 (м, 2H), 7,94-8,01 (м, 1H), 7,38-7,21 (м, 8H), 6,87 (д, J=8,4 Гц, 2H), 4,98 (с, 2H), 4,77-4,59 (м, 2H), 4,00-3,95 (м, 3H), 3,81 (с, 3H), 2,56 (т, J=7,1 Гц, Н = 2H), 2,00-1,95 (м, 1H), 1,66-1,61 (м, 1H), 0,93 (с, 9H), 0,10 (с, 3H),-0,10 + + (с, 3H). РХ-МС: m/z (ES) 589,3 (MH) , 611,2 (MNa) . Стадія G. 4-Метоксибензил-[(1R)-1-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітрофеніл)-4-оксопентил]карбамат До розчину нітрофенілацетилену (зі стадії F, 41 г, 65,5 ммоль) в ДМФА (40 мл) додають піролідин (14 мл, 196,5 ммоль), і одержану суміш гріють при 80ºС протягом 3 годин. Суміш охолоджують до кімнатної температури, додають 10 % розчин оцтової кислоти у воді (110 мл), і одержаний розчин перемішують при кімнатній температурі ще протягом 3 годин. Суміш виливають у воду (300 мл) і екстрагують EtOAc (3×250 мл); об'єднані EtOAc шари промивають водою (2×250 мл) і насиченим розчином NaCl (100 мл), сушать над MgSO 4, фільтрують і упарюють. Залишок очищують Horizon Flash 75 з елююванням з градієнтом з підвищенням від 100 % гексану до суміші 50 % EtOAc в гексані, і одержують 34 г (81 %) темно-оранжевого масла. 1 H ЯМР (500 МГц, CDCl3): 8,17-8,14 (м, 2H), 7,32-7,23 (м, 9H), 6,87 (д, J=8,4 Гц, 2H), 4,96 (д, J=12,2 Гц, 1H), 4,90 (д, J=12,1 Гц, 1H), 4,72 (д, J=3 Гц, 1H), 4,16-4,13 (м, 1H), 3,81 (с, 3H), 3,713,77 (м, 2H), 2,65-2,52 (м, 2H), 1,97-1,92 (м, 1H), 1,72-1,60 (м, 1H), 0,93 (с, 9H), 0,05 (с, 3H),-0,13 (с, 3H). Стадія Н. (2R, 5S)-2-[(R)-{[трет-Бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідин і (2R, 5R)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідин До розчину кетоаміну із захисною групою MOZ (зі стадії G, 34 г, 56 ммоль) в DCM (350 мл) додають ТФК (256 мл), і одержану суміш перемішують при кімнатній температурі протягом 1,5 години. Розчин упарюють у вакуумі, і залишок обробляють DCM і насиченим розчином NaHCO3. Органічний шар сушать над MgSO4, фільтрують і упарюють. Залишок розчиняють в МеОН (750 мл) і охолоджують до 0ºС на бані зі сумішшю води з льодом. Потім додають ціаноборгідрид натрію (21,2 г, 337 ммоль), і одержану суміш перемішують протягом ночі, дозволяючи нагріватися до кімнатної температури. Реакцію гасять, додаючи воду, і органічні леткі речовини видаляють у вакуумі. Потім водний шар екстрагують EtOAc (×2), і об'єднані EtOAc шари промивають насиченим розчином NaCl, сушать над MgSO4, фільтрують і упарюють у вакуумі. Залишок очищують колонковою хроматографією на силікагелі (елюент: градієнт з підвищенням від 100 % гексану до суміші 35 % EtOAc в гексані), і одержують 16,4 г (63,4 %) першого ізомеру (2R, 5S)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4-нітробензил)піролідину і 3,1 г (12 %) другого ізомеру (2R, 5R)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідину. + Ізомер 1 - РХ-МС: m/z (ES) 427,3 (МН) + Ізомер 2 - РХ-МС: m/z (ES) 427,3 (МН) Стадія I. трет-Бутил-(2R, 5S)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідин-1-карбоксилат 24 UA 101367 C2 5 10 15 20 25 30 35 До розчину (2R, 5S)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідину (12 г, 42,5 ммоль) в безводному ТГФ додають Вос-ангідрид (9,3 г, 42,5 ммоль), а потім ТЕА (17,76 мл, 127,4 ммоль), і одержаний розчин перемішують при кімнатній температурі в атмосфері азоту протягом 2 годин. Суміш промивають водою (100 мл) і екстрагують етилацетатом (2×200 мл). Органічну фазу сушать над сульфатом натрію, фільтрують і концентрують у вакуумі. Залишок очищують РХСД Horizon Biotage (колонка з силікагелім 65i) з елююванням з градієнтом сумішами 20-75 % етилацетату в гексані, і + + одержують потрібний продукт. РХ-МС: m/z (ES) 527,3 (МН) , 549,2 (МNa) . Стадія J. трет-Бутил-(2R, 5R)-2-[(R)-{[трет-бутил(диметил)силіл]окси}(феніл)метил]-5-(4нітробензил)піролідин-1-карбоксилат Вказану в заголовку сполуку одержують таким самим способом, як на стадії I, але замінюючи цис-ізомер піролідину на транс-ізомер (2R, 5R)-2-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]-5-(4-нітробензил)піролідину. РХ-МС: m/z (ES) 527,3 + + (МН) , 549,2 (МNa) . Стадія K. трет-Бутил-(2S, 5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4a) У 500-мл качалочну колбу Парра завантажують 10 % Pd/С (4,75 г, і до нього додають 100 мл метанолу, щоб він закрив каталізатор. Потім до суспензії додають розчин проміжної нітросполуки зі стадії I (8,5 г, 18,5 ммоль) в метанолі (80 мл) і потім 15,4 мл 1,0 М розчину 2 хлороводню в метанолі. У реакційній судині створюють тиск водню ~344,7 кПа (50 ф/д ), і суміш перемішують протягом ночі. Беруть аліквоту і аналізують РХ-МС, яка показує, що реакція завершена. Каталізатор відфільтровують з використанням целіту, який промивають метанолом (2×100 мл). Фільтрат концентрують досуха, і продукт реакції очищують РХСД Horizon (колонка з силікагелім 65i) з елююванням з градієнтом, що підіймається від 0 % до 30 % етилацетату в + + гексані, і одержують вказану в заголовку сполуку (6,2 г, 72 %). m/z (ES) 497 (MH) , 397 (M-Boc) . 1 H ЯМР (500 МГц, CDCl3) δ: 7,38-7,29 (м, 5H), 6,76-6,68 (м, 2H), 6,55-6,50 (м, 2H), 5,52-5,49 (м, 1H), 5,30-5,27 (м, 1H), 4,15-4,05 (м, 2H), 3,86-3,81 (м, 1H), 3,76-3,71 (м, 1H), 3,55-3,47 (м, 2H), 2,74 (ушир.д, J=11,7 Гц, 1H), 2,44 (ушир.д, J=11,7 Гц, 1H), 2,05-1,93 (м, 1H), 1,90-1,83 (м, 1H), 1,60 (с, 9H), 1,50-1,42 (м, 1H), 1,31-1,21 (м, 2H), 1,10-1,02 (м, 1H), 0,95 (с, 9H), 0,92 (д, J=11,8 Гц, 1H), 0,13 (ушир.д, J=14,0 Гц, 3H),-0,05 (с, 3H). Стадія L. трет-Бутил-(2R, 5R)-2-(4-амінобензил)-5-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]піролідин-1-карбоксилат (i-4b) 25 UA 101367 C2 5 10 Вказану в заголовку сполуку одержують таким самим способом, як на стадії K, але замінюючи цис-ізомер піролідину на транс-ізомер трет-бутил-(2R, 5R)-2-[(R)-{[третбутил(диметил)силіл]окси}(феніл)метил]-5-(4-нітробензил)піролідин-1-карбоксилату. m/z (ES) + + 1 497 (MH) , 397 (M-Boc) . H ЯМР (500 МГц, CDCl3) δ: 7,41-7,30 (м, 5H), 6,73-6,67 (м, 2H), 6,566,50 (м, 2H), 5,52-5,48 (м, 1H), 5,33-5,28 (м, 1H), 4,15-4,06 (м, 2H), 3,86-3,81 (м, 1H), 3,76-3,70 (м, 1H), 3,59-3,46 (м, 2H), 2,72 (ушир.д, J=12,0 Гц, 1H), 2,44 (ушир.д, J=12,0 Гц, 1H), 2,05-1,93 (м, 1H), 1,90-1,82 (м, 1H), 1,64 (с, 9H), 1,49-1,42 (м, 1H), 1,32-1,20 (м, 2H), 1,10-1,02 (м, 1H), 0,95 (с, 9H), 0,14 (ушир.д, J=13,7 Гц, 3H), 0,10 (с, 3H). Вказані далі проміжні сполуки одержують з відповідних вихідних речовин з використанням процедур, описаних вище для проміжної сполуки i-4a. Таблиця 1 15 Вказані далі проміжні сполуки одержують з відповідних вихідних речовин з використанням процедур, описаних вище для проміжної сполуки i-4b. Таблиця 2 26 UA 101367 C2 Проміжна сполука 5 трет-Бутил-(5R)-2-(4-амінобензил)-5-[(R)-{[трет-бутил(диметил)силіл]окси}(3хлорфеніл)метил]піролідин-1-карбоксилат (i-5) 5 10 15 20 25 30 35 Стадія А. 4-({(5R)-5-[(R)-{[трет-Бутил(диметил)силіл]окси}(3-хлорфеніл)метил]піролідин-2іл}метил)анілін До розчину 100 мг (0,15 ммоль) бензил{4-[(3E, 5R, 6R)-5-{[(бензилокси)карбоніл]аміно-6{[трет-бутил(диметил)силіл]окси}-6-(3-хлорфеніл)-2-оксогекс-3-ен-1-іл]феніл}карбамату (зі стадії А, i-3) в 8 мл етилацетату додають 10 % паладій-на-вугіллі, і над суспензією створюють атмосферу водню воднем з балона. Реакційну суміш перемішують в атмосфері водню протягом 8 годин при кімнатній температурі. Каталізатор відфільтровують з використанням шприца з ПТФЕ фільтром Gilmen 0,45 мкм і промивають його етилацетатом (4×2 мл). Фільтрат концентрують у вакуумі досуха, залишок очищують на препаративній пластинці (1000 мкм) з елююванням сумішшю 5 % метанолу в дихлорметані, і одержують вказану в заголовку сполуку + (33 мг, 51 %). m/z (ES) 430, 432 (M, M+2) . Стадія В. трет-Бутил-(5R)-2-(4-амінобензил)-5-[(R)-{[трет-бутил(диметил)силіл]окси}(3хлорфеніл)метил]піролідинкарбоксилат (i-5) До розчину 33 мг (0,07 ммоль) 4-({(5R)-5-[(R)-{[трет-бутил(диметил)силіл]окси}(3хлорфеніл)метил]піролідин-2-іл}метил)аніліну (зі стадії А) в 1 мл безводного ТГФ додають третбутилкарбонат (15,3 мг, 0,07 ммоль), а потім ТЕА (13 мкл, 0,07 ммоль), і одержану суміш перемішують при кімнатній температурі в атмосфері азоту протягом ночі. Реакційну суміш вміщують безпосередньо на препаративну пластинку (500 мкм) і елююють сумішшю 30 % етилацетату в гексані, і одержують вказану в заголовку сполуку (25 мг, 78 %). m/z (ES) 530, 532 + + (M, M+2) , 430, 432 (M-Вос, M-Вос+2) . Проміжна сполука 6 4-{4-[4-(Трифторметил)феніл]-1,3-тіазол-2-іл}бензолсульфонілхлорид (i-6) Проміжну сполуку 6 можна одержати згідно з процедурами, описаними в літературі, наприклад, в Ikemoto et al., Tetrahedron, 2003, 59, 1317-1325. Проміжна сполука 7 2-Метил-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4-карбонова кислота (i-7) Стадія А. Етил-2-метил-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4-карбоксилат 27 UA 101367 C2 5 10 15 20 25 30 35 40 45 До розчину етил-2-оксоциклопентан-2-карбоксилату (56 г, 359 ммоль) в хлороформі (500 мл), охолодженому до 0ºС, додають бром (18,5 мл, 359 ммоль) протягом ~20 хв. Після завершення додавання суміші дозволяють нагріватися до кімнатної температури і перемішують протягом ночі. Газ азот барботують через суміш протягом 90 хв для видалення більшої частини HBr. Суміш промивають водою (500 мл), насиченим розчином NaHCO 3 (200 мл), сушать над MgSO4, фільтрують і упарюють. Залишок розчиняють в EtOH (500 мл), додають тіоацетамід (26,9 г, 359 ммоль), суміш перемішують при кімнатній температурі протягом 1 години і потім кип'ятять із зворотним холодильником протягом ночі. Суміш охолоджують і упарюють, залишок обробляють DCM і насиченим розчином NaHCO 3, органічний шар промивають насиченим розчином NaCl, сушать над MgSO4, фільтрують і упарюють. Залишок очищують РХСД (Biotage Horizon: 2x FLASH 65i), елюент: 100 % гексану (450 мл), градієнт з підвищенням від 100 % гексану до суміші 25 % етилацетату в гексані (1400 мл), потім суміш 25 % етилацетату в гексані, 1 і одержують вказану в заголовку сполуку (32 г, 42 %) у вигляді темного масла. H ЯМР (500 МГц, CDCl3) δ: 4,22 (кв., J=7,0 Гц, 2H), 3,96 (м, 1H), 3,04 (м, 1H), 2,88 (м, 1H), 2,76 (м, 2H), 2,70 (с, 3H), 1,30 (т, J=7,0 Гц, 3H). Стадія В. 2-Метил-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4-карбонова кислота (i-7) До розчину 31,5 г (149 ммоль) етил-2-метил-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4карбоксилату (зі стадії А) в ТГФ (450 мл) і метанолі (100 мл) додають розчин гідроксиду літію (149 мл 1М розчину, 149 ммоль), і одержану суміш перемішують при кімнатній температурі протягом 3 годин. Органічні леткі речовини видаляють випарюванням, водний залишок екстрагують Et2O (2×250 мл) і підкислюють до рН 3, додаючи 1 М HCl (~170 мл), і насичують твердим NaCl. Суміш екстрагують DCM (3×250 мл), об'єднані DCM шари сушать над MgSO 4, фільтрують і упарюють. Залишок розтирають в ацетонітрилі, тверду речовину відфільтровують і сушать, і одержують вказану в заголовку сполуку (7,1 г, 26 %) у вигляді не зовсім білої твердої 1 речовини. H ЯМР (500 МГц, CDCl3) δ: 11,75 (ушир.с, 1H), 4,02 (м, 1H), 3,00 (м, 1H), 2,90-2,66 (м, 6H). Проміжна сполука 8 2-[(Бутоксикарбоніл)аміно]-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4-карбонова кислота (i-8) Стадія А. Етил-2-аміно-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4-карбоксилат Вказану в заголовку сполуку одержують таким самим способом, як проміжну сполуку (i-7), 1 замінюючи на стадії А тіоацетамід на тіосечовину. H ЯМР (500 МГц, CDCl3) δ: 5,30 (ушир.с, 2H), 4,21 (кв., J=7,0, 2H), 3,81 (м, 1H), 2,91 (м, 1H), 2,78 (м, 1H), 2,66 (м, 2H), 1,30 (т, J=7,0, 3H). Стадія В. Етил-2-[(трет-бутоксикарбоніл)аміно]-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4карбоксилат До розчину 230 мг (1,08 ммоль) етил-2-аміно-5,6-дигідро-4Н-циклопента[α][1,3]тіазол-4карбоксилату (зі стадії А) в дихлорметані (5 мл) додають ди-трет-бутилдикарбонат (236 мг, 1,08 ммоль), триетиламін (0,15 мл, 1,08 ммоль) і DMAP (13 мг, 0,11 ммоль), і одержану суміш перемішують при кімнатній температурі протягом 2 годин. Суміш промивають 1н HCl (10 мл), насиченим розчином NaCl (5 мл), сушать над MgSO4, фільтрують і упарюють. Залишок очищують РХСД (Biotage Horizon: FLASH 25+S), елюент: 100 % гексану (100 мл), градієнт суміші 0-15 % EtOAc в гексані (900 мл), потім суміш 15 % EtOAc в гексані (500 мл), і одержують вказану 1 в заголовку сполуку (160 мг, 47 %) у вигляді білої піни. H ЯМР (500 МГц, CDCl3) δ: 9,23 (ушир.с, 1H), 4,17 (кв., J=7,1 Гц, 2H), 3,95 (т, J=6,6 Гц, 1H), 3,04 (м, 1H), 2,86 (м, 1H), 2,76 (м, 2H), 1,55 (с, 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;hydroxymethyl pyrrolidines as beta 3 adrenergic receptor agonists
Автори англійськоюBerger, Richard, Chang, Lehua, Edmondson, Scott, D., Goble, Stephen, D., Ha, Sookhee, Nicole, Kar, Nam, Fung, Kopka, Ihor, E., Li, Bing, Morriello, Gregori, J., Moyes, Chris, R., Shen, Dong-Ming, Wang, Liping, Zhu, Cheng
Назва патенту російськоюNormal;heading 1;heading 2;heading 3;гидроксиметилпирролидины как агонисты адренергических рецепторов b3
Автори російськоюБергер Ричард, Чан Лехуа, Эдмондсон Скотт Д., Гобле Стефен Д., Ха Соокхее Николь, Кар Нам Фунг, Копка Ихор Э., Ли Бин, Мориэлло Грегори Дж., Мойз Крис Р., Шень Дун-Мин, Ван Липин, Чжу Чен
МПК / Мітки
МПК: C07D 401/12, C07D 417/12, C07D 487/04, C07D 471/04, A61P 13/00, A61K 31/506, A61K 31/4178, C07D 403/12
Мітки: агоністи, адренергічних, рецепторів, гідроксиметилпіролідини
Код посилання
<a href="https://ua.patents.su/75-101367-gidroksimetilpirolidini-yak-agonisti-adrenergichnikh-receptoriv-b3.html" target="_blank" rel="follow" title="База патентів України">Гідроксиметилпіролідини як агоністи адренергічних рецепторів b3</a>
Попередній патент: Виготовлення виробу, зв’язаного переважно карбонатом, шляхом карбонізації лужних матеріалів
Наступний патент: Спосіб і пристрій для контролю рівня рідини у гідрорезервуарі
Випадковий патент: Вертикальна піч для прямого відновлення заліза