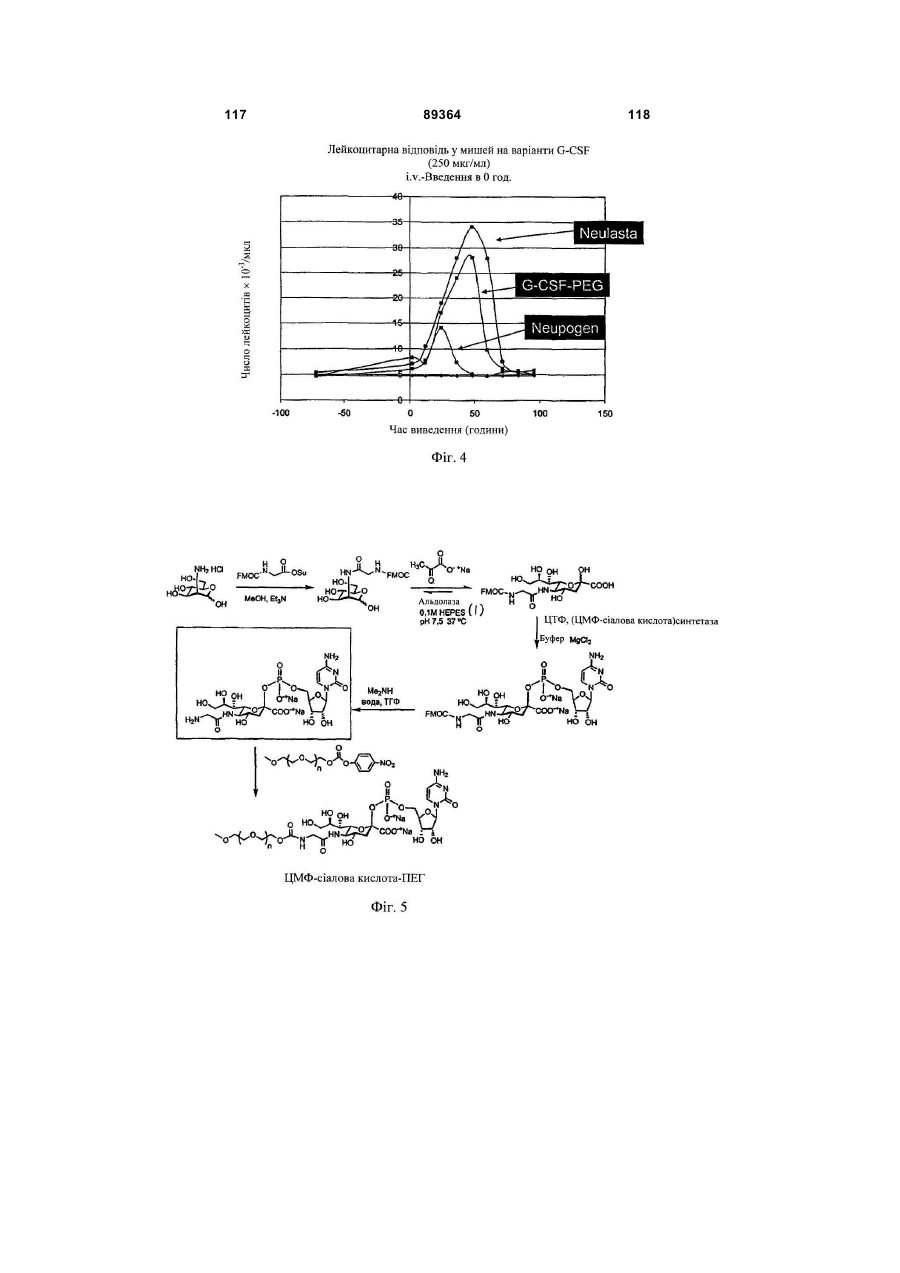
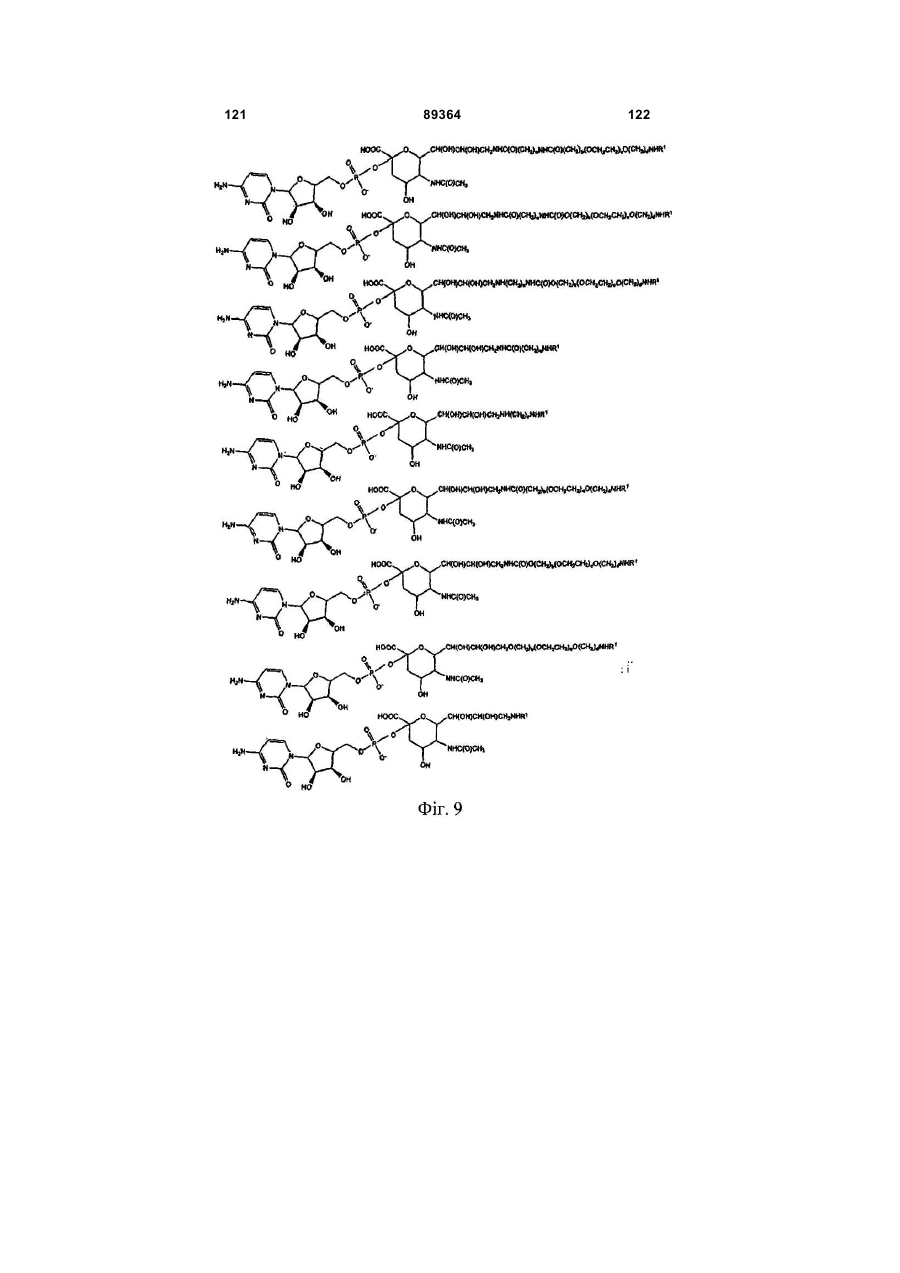
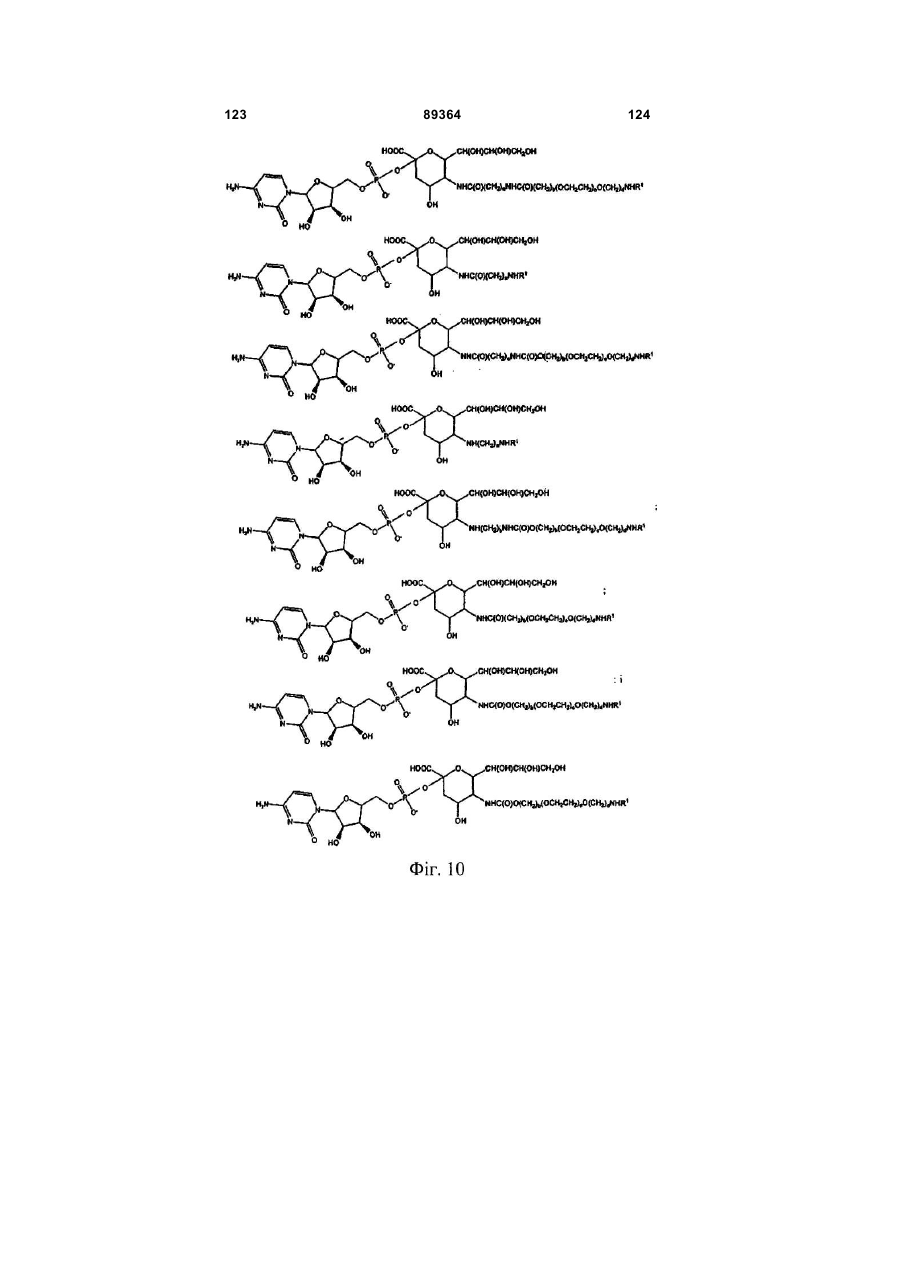
Кон’югат пептиду гранулоцитарного колонієстимулюючого фактора (g-csf)
Номер патенту: 89364
Опубліковано: 25.01.2010
Автори: Клаусен Хенрік, Дефріз Шон, Шварц, Марк, Цопф Девід А., Бауе Керін, Ванг Чжи-Гуан, Ву, Бінюань
Формула / Реферат
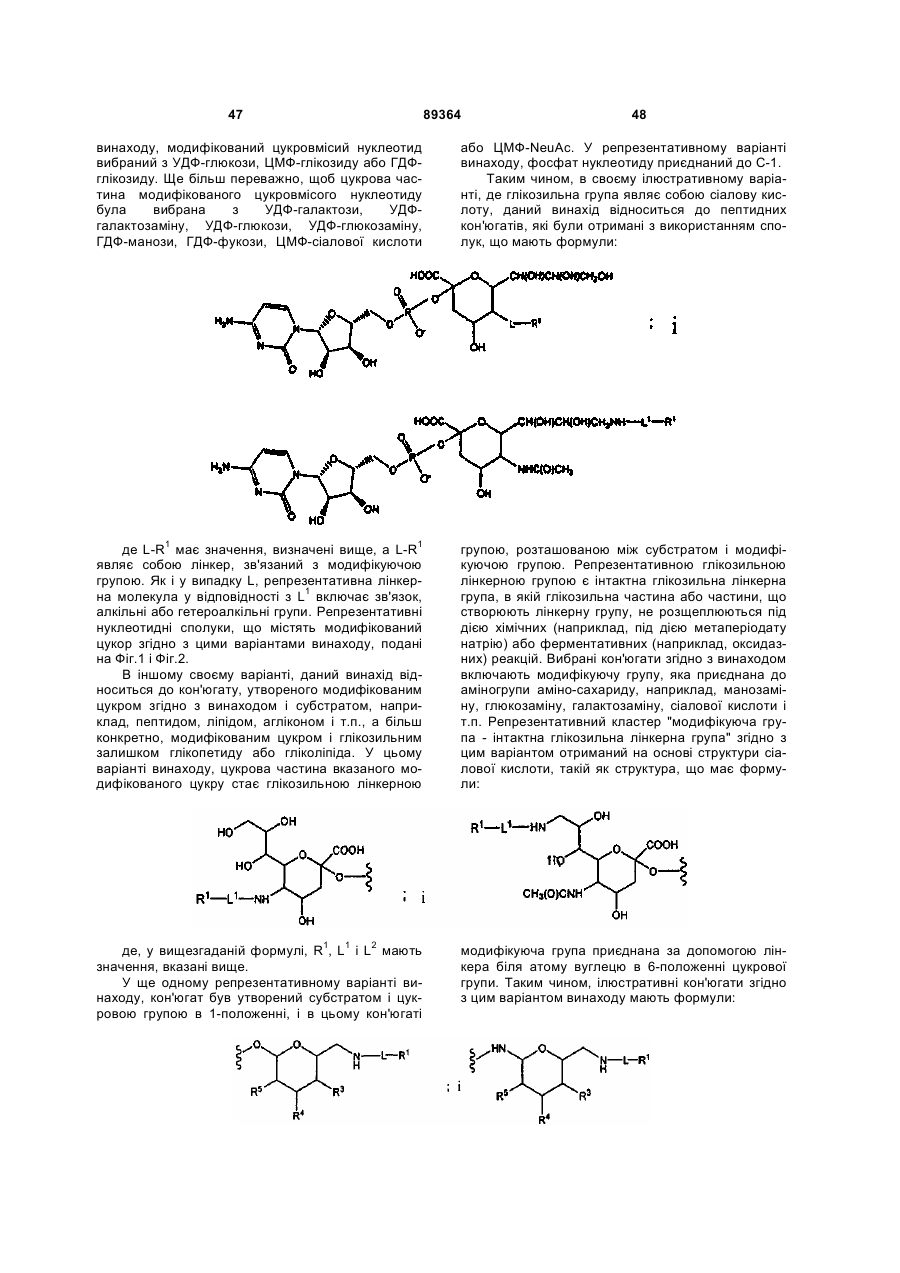
1. Кон’югат пептиду гранулоцитарного колонієстимулюючого фактора (G-CSF), що містить наступний цукровий фрагмент, який включає залишок ПЕГ:
,
де D вибраний з -ОН і R1-L-НN;
G вибраний з R1-L і С(О)(С1-С6)алкілу;
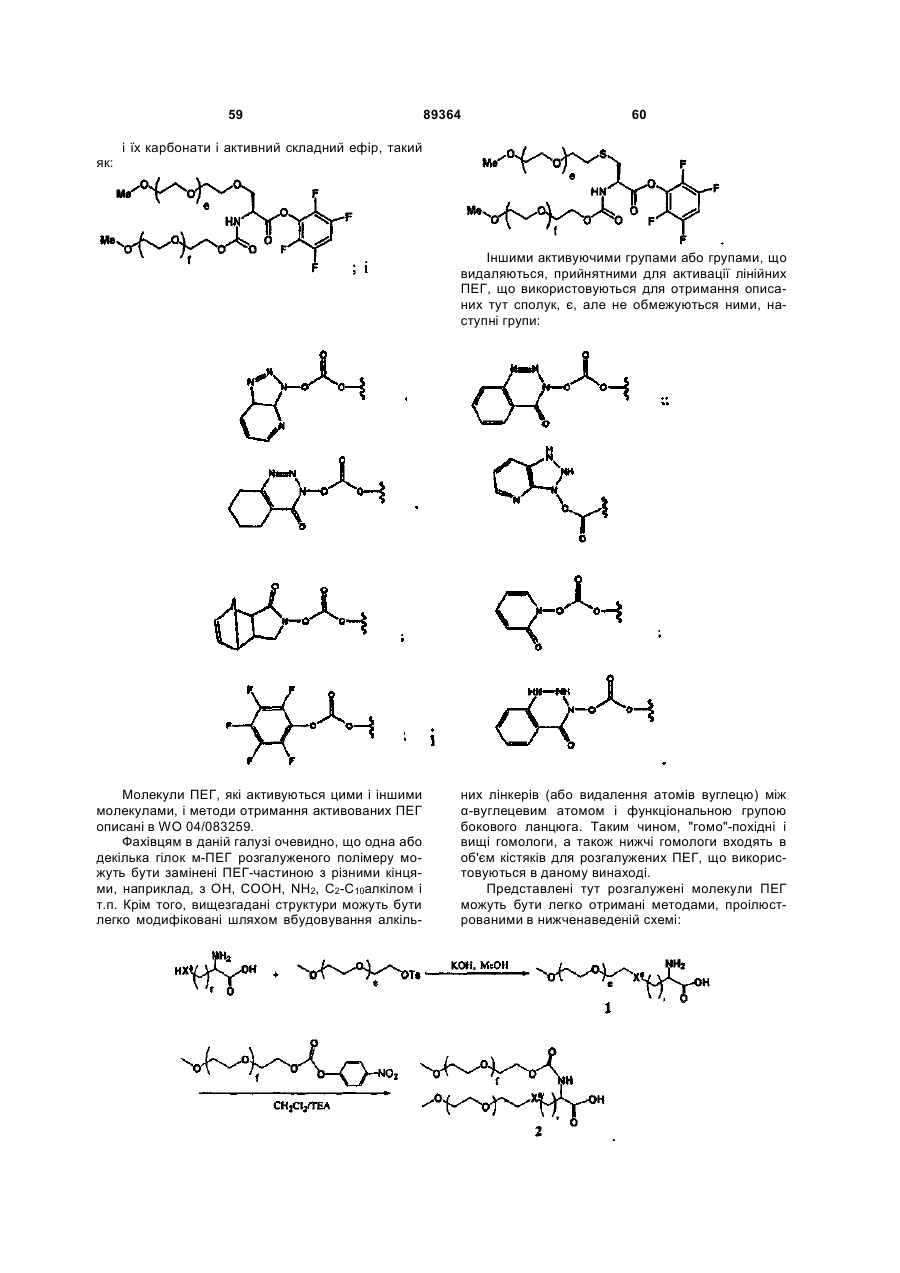
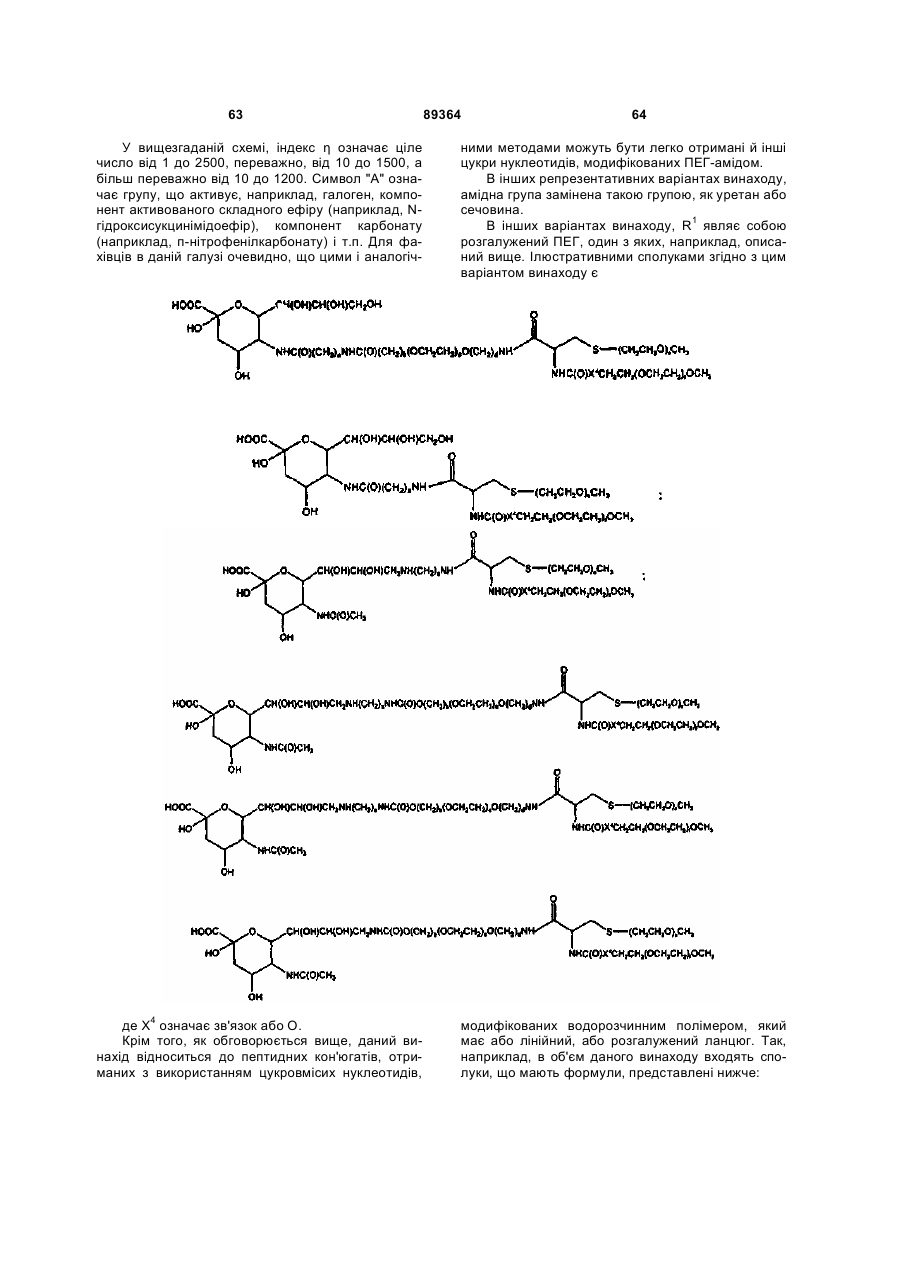
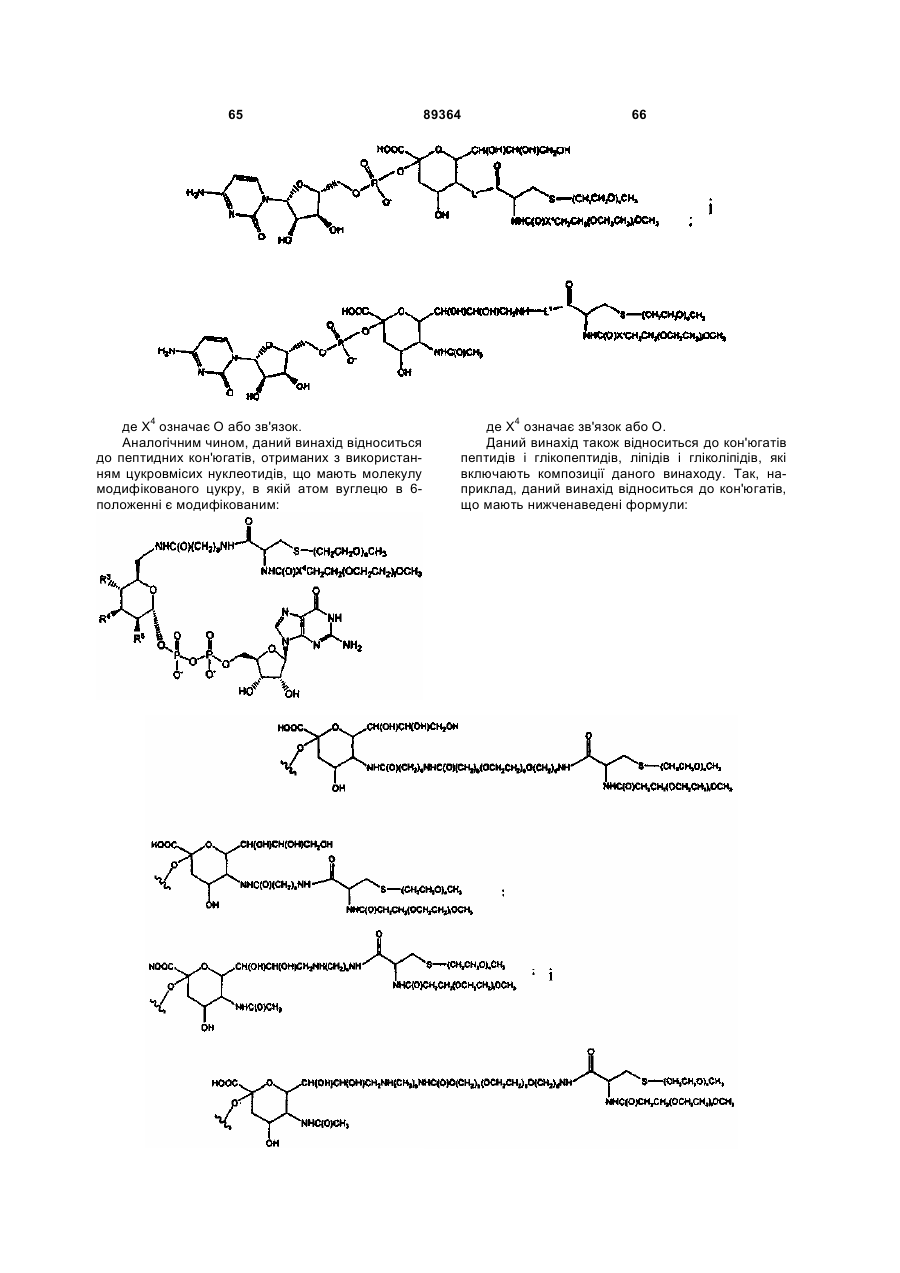
R1 являє собою групу, вибрану з фрагментів, що включають лінійний або розгалужений залишок поліетиленгліколю; і
L означає лінкер, вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу,
при умові, що, якщо D являє собою ОН, то G являє собою R1-L, а, якщо G являє собою С(О)(С1-С6)алкіл, то D являє собою R1-L-NН-.
2. Пептид за п. 1, де R1-L має формулу:
,
де а дорівнює цілому числу від 0 до 20.
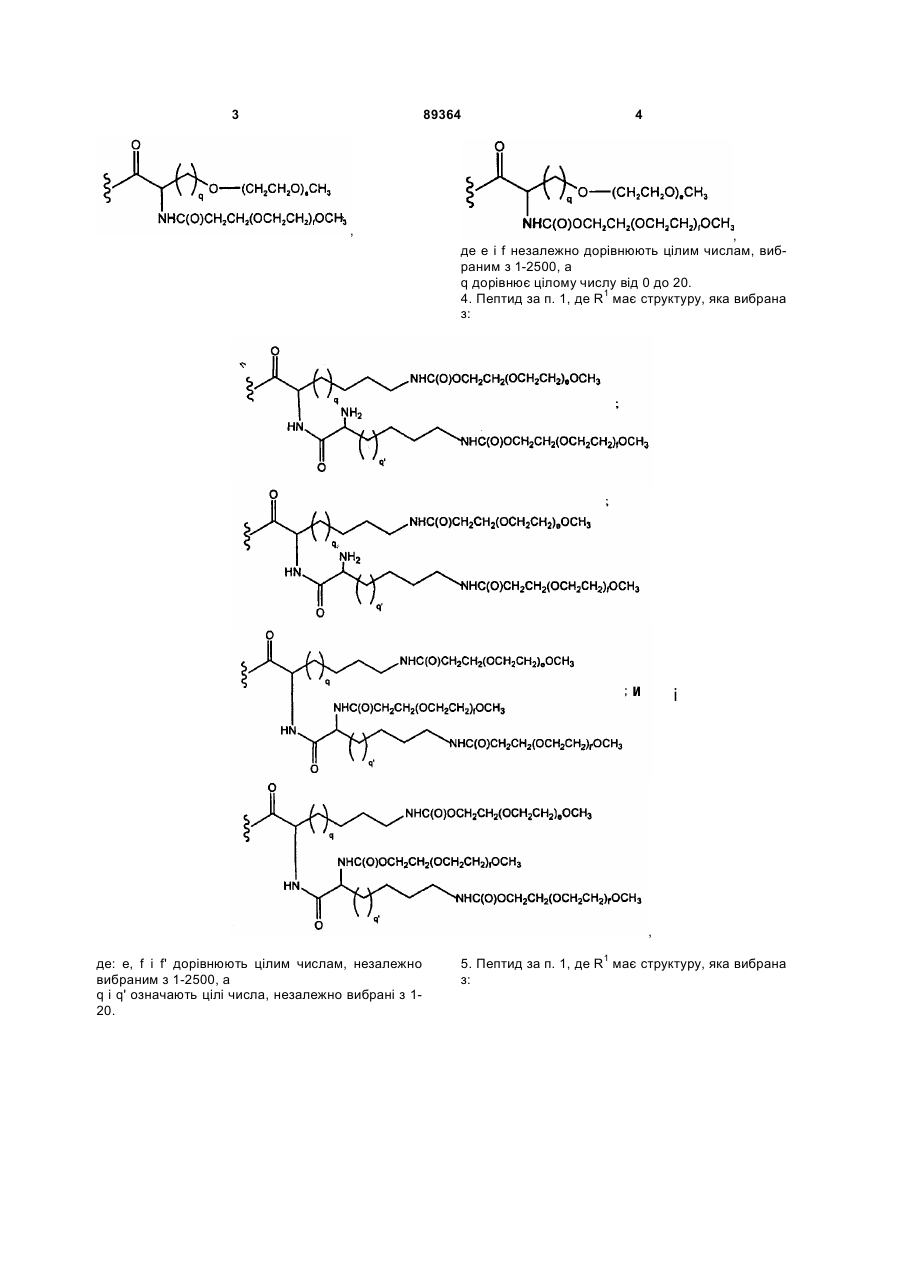
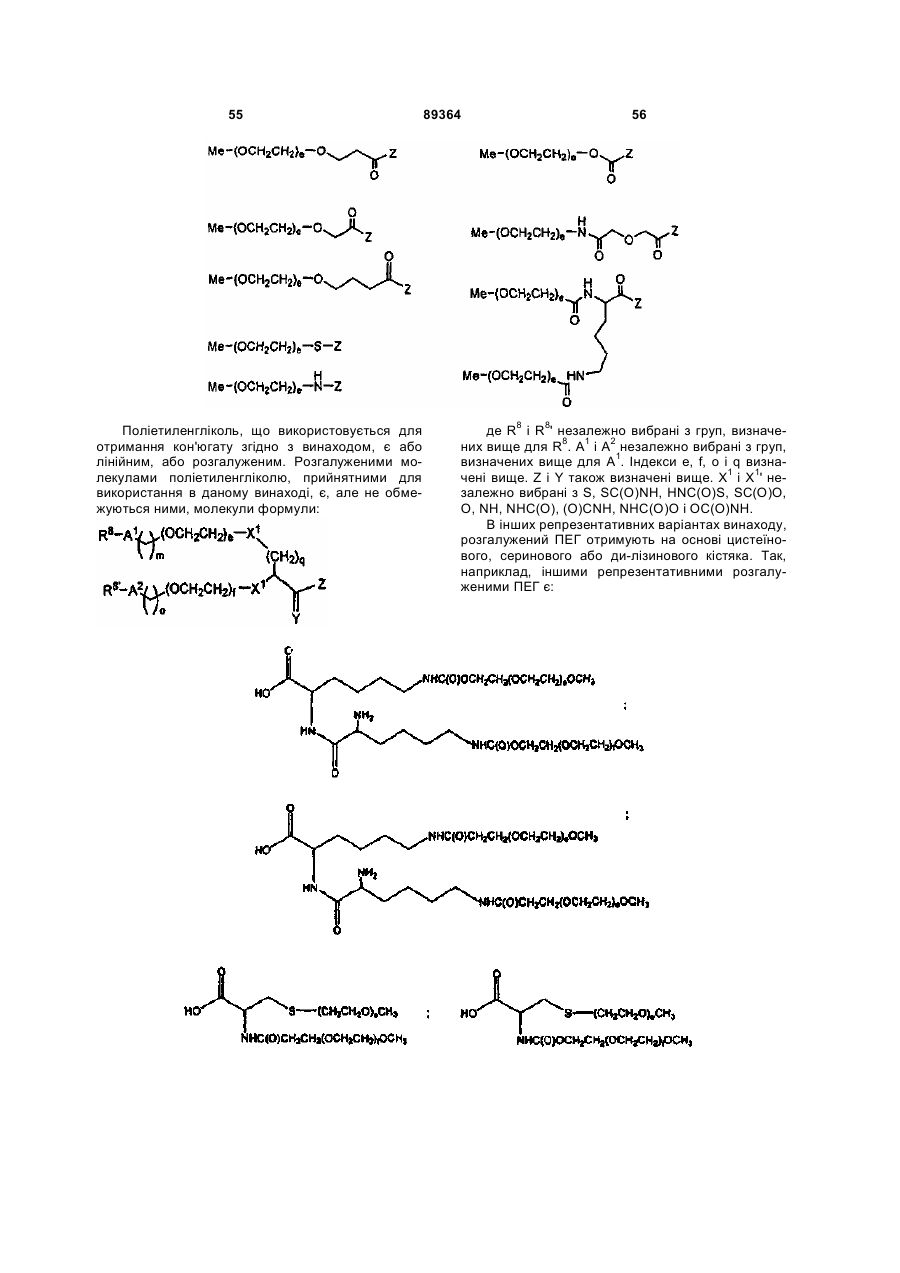
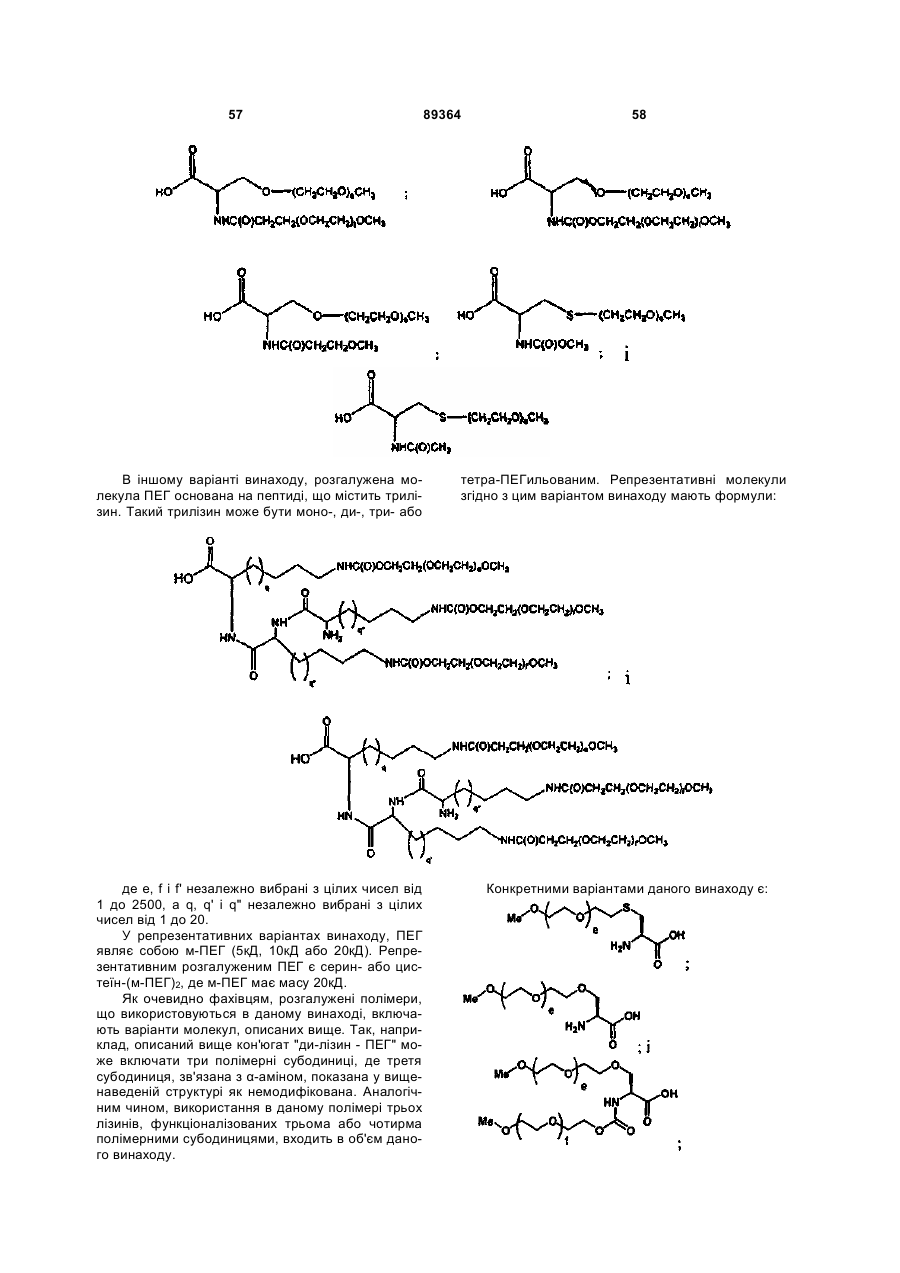
3. Пептид за п. 1, де R1 має структуру, яка вибрана з:
,,
,,
де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500, а
q дорівнює цілому числу від 0 до 20.
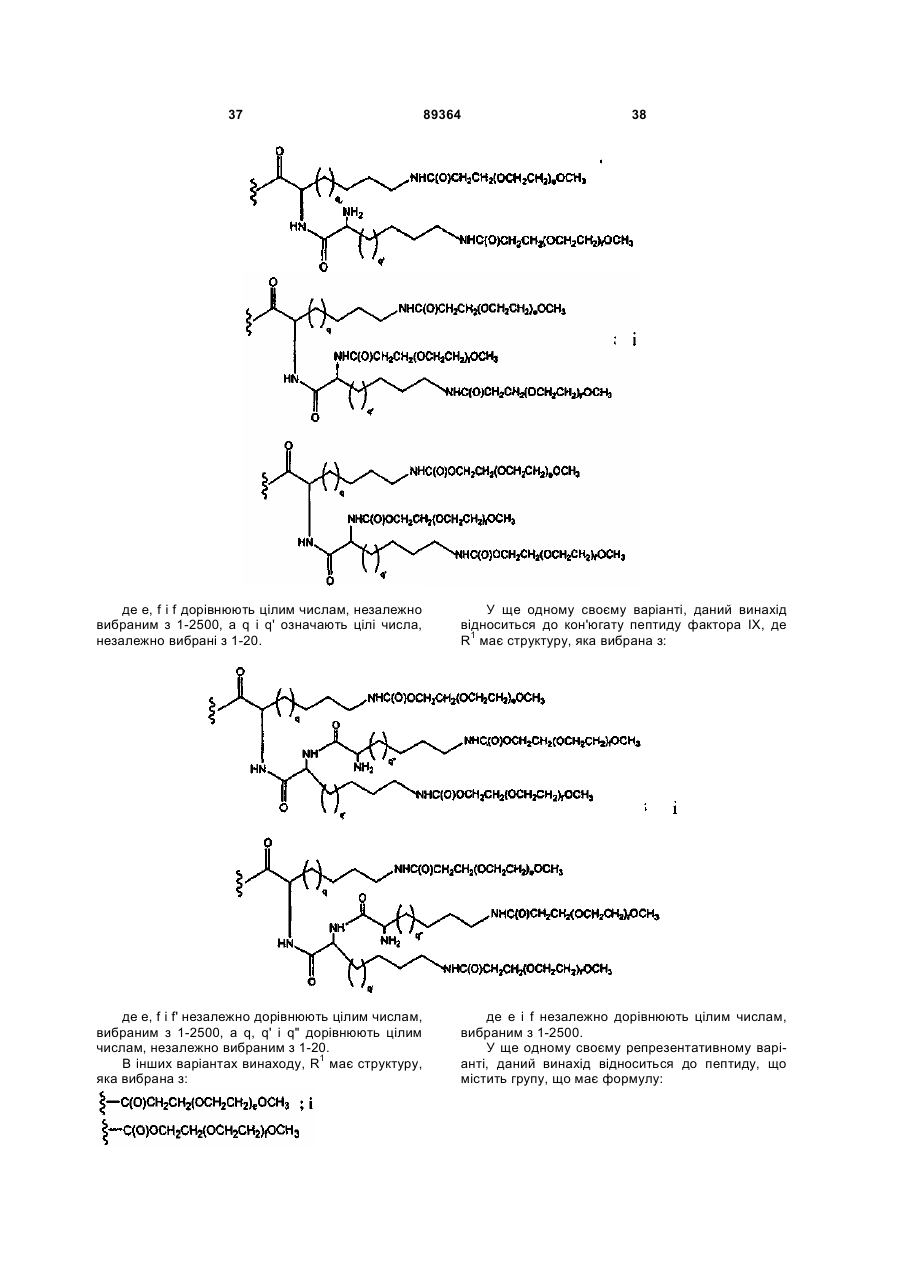
4. Пептид за п. 1, де R1 має структуру, яка вибрана з:
і
,
де: е, f і f' дорівнюють цілим числам, незалежно вибраним з 1-2500, а
q і q' означають цілі числа, незалежно вибрані з 1-20.
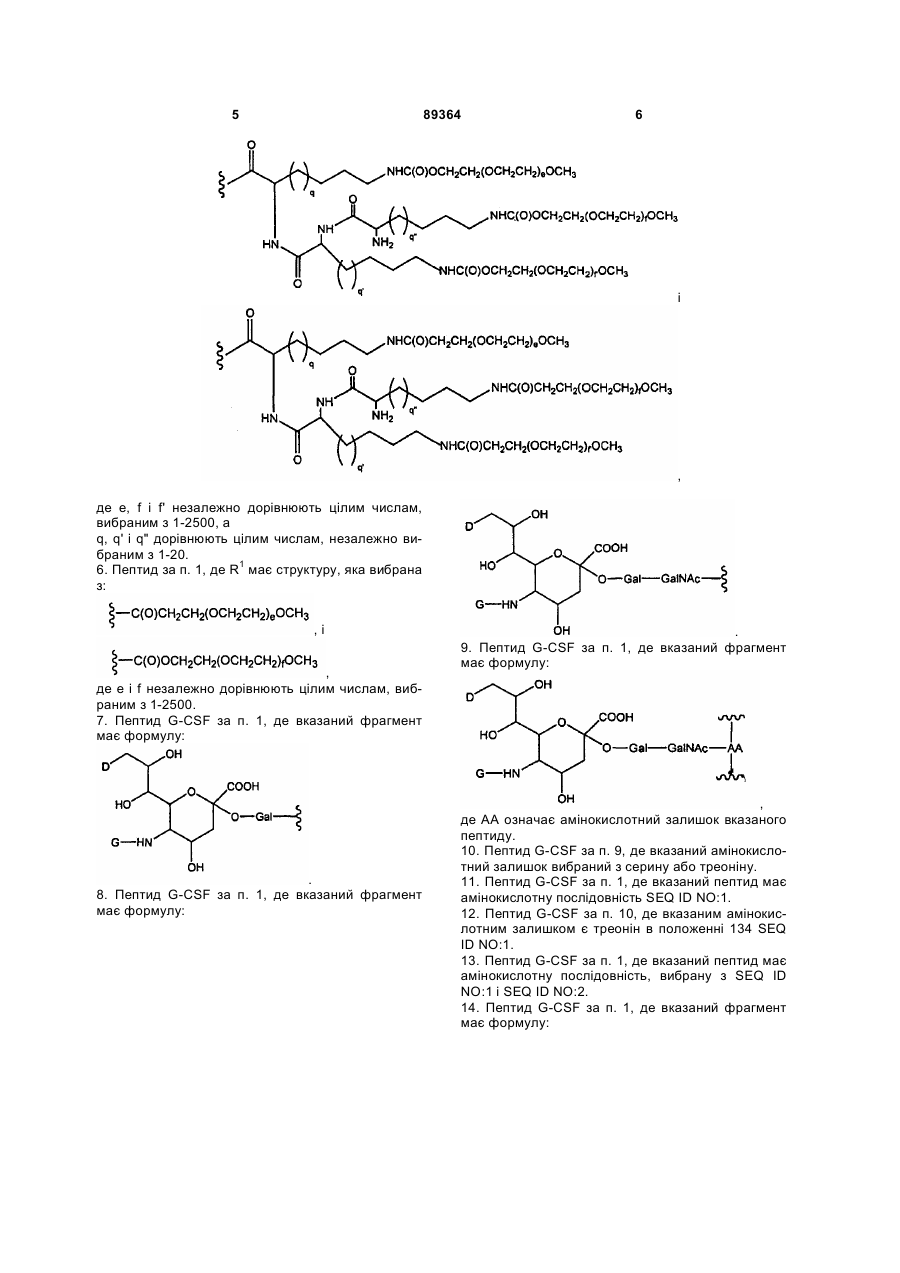
5. Пептид за п. 1, де R1 має структуру, яка вибрана з:
і
,
де е, f і f' незалежно дорівнюють цілим числам, вибраним з 1-2500, а
q, q' і q" дорівнюють цілим числам, незалежно вибраним з 1-20.
6. Пептид за п. 1, де R1 має структуру, яка вибрана з:
, і
,
де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500.
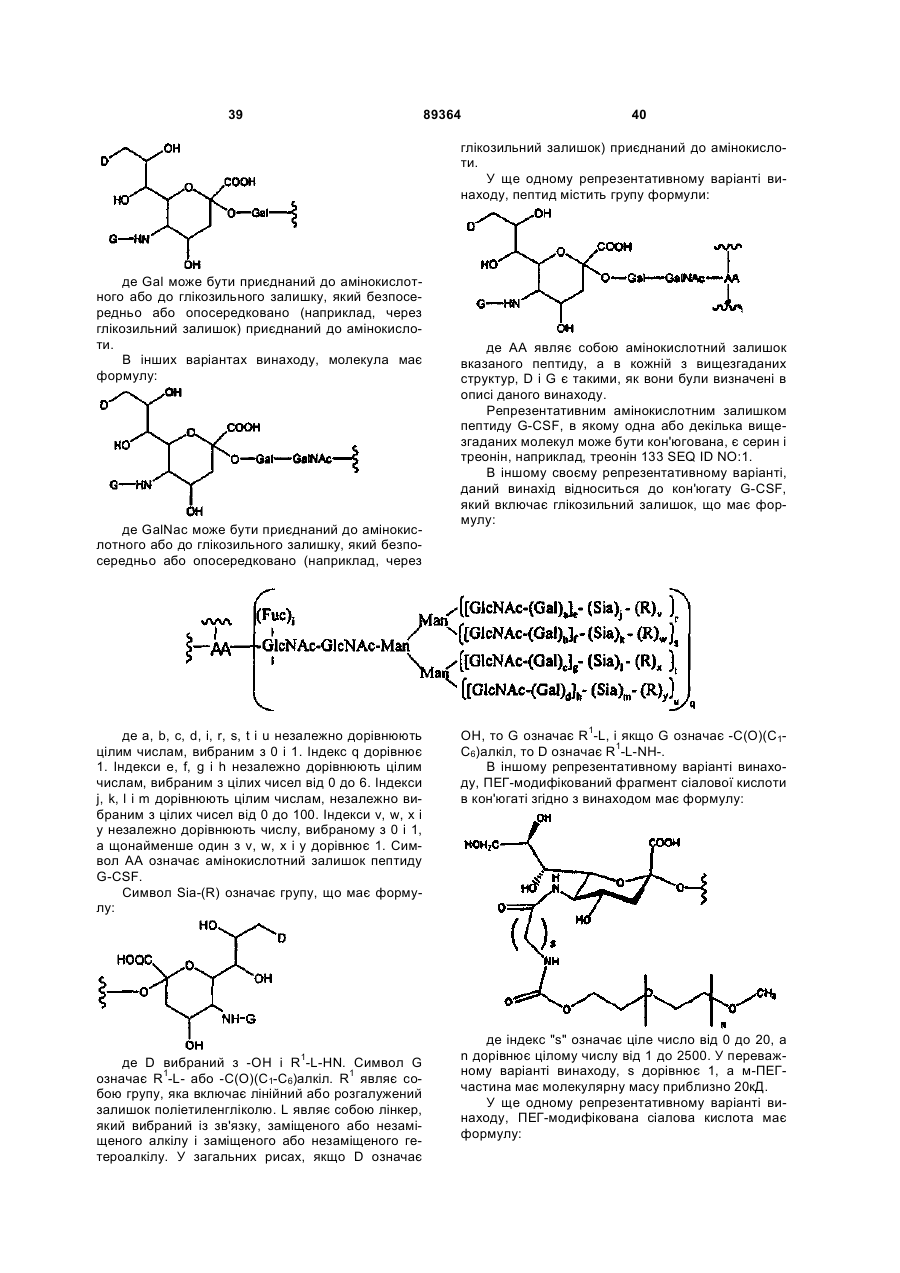
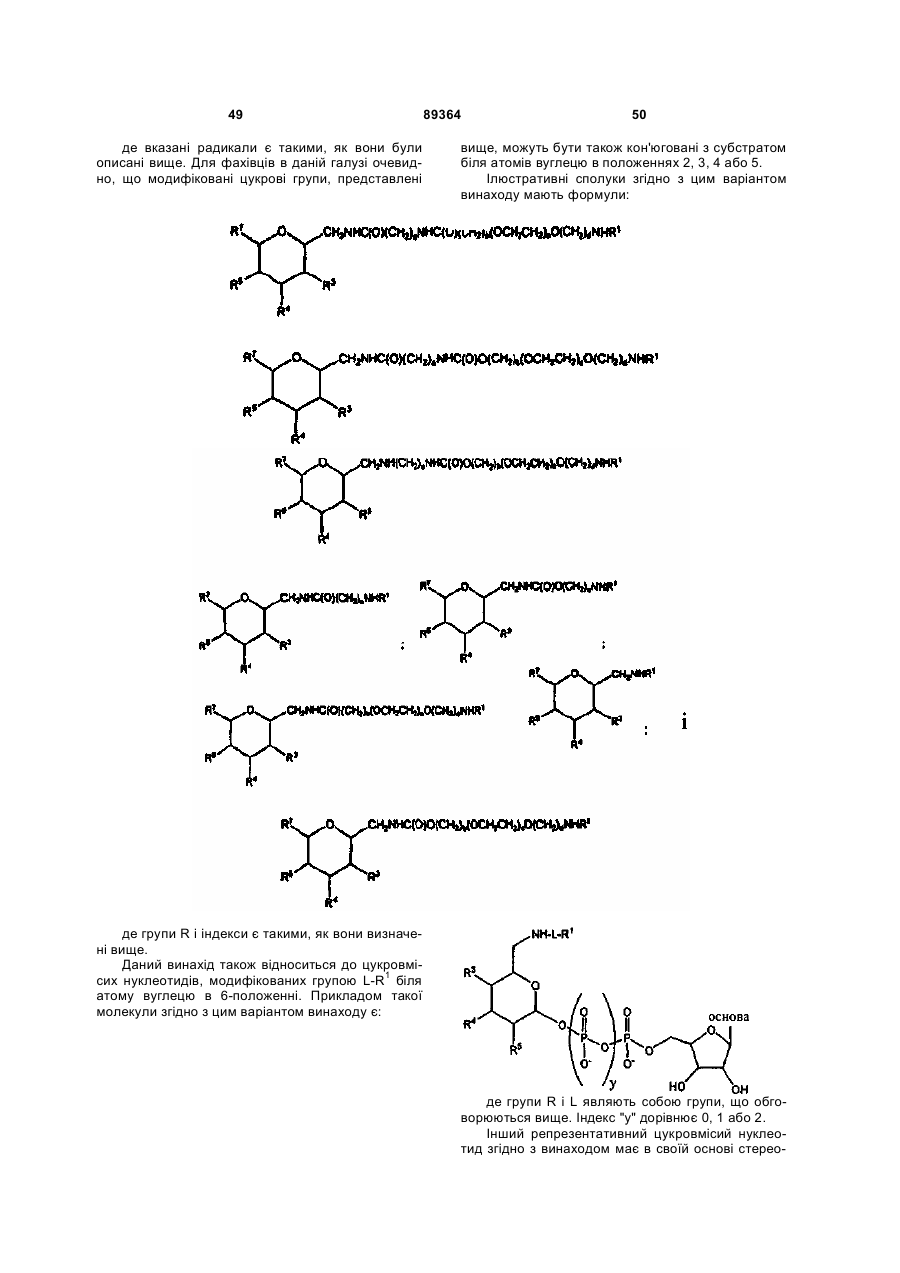
7. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу:
.
8. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу:
.
9. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу:
,
де АА означає амінокислотний залишок вказаного пептиду.
10. Пептид G-CSF за п. 9, де вказаний амінокислотний залишок вибраний з серину або треоніну.
11. Пептид G-CSF за п. 1, де вказаний пептид має амінокислотну послідовність SEQ ID NO:1.
12. Пептид G-CSF за п. 10, де вказаним амінокислотним залишком є треонін в положенні 134 SEQ ID NO:1.
13. Пептид G-CSF за п. 1, де вказаний пептид має амінокислотну послідовність, вибрану з SEQ ID NO:1 і SEQ ID NO:2.
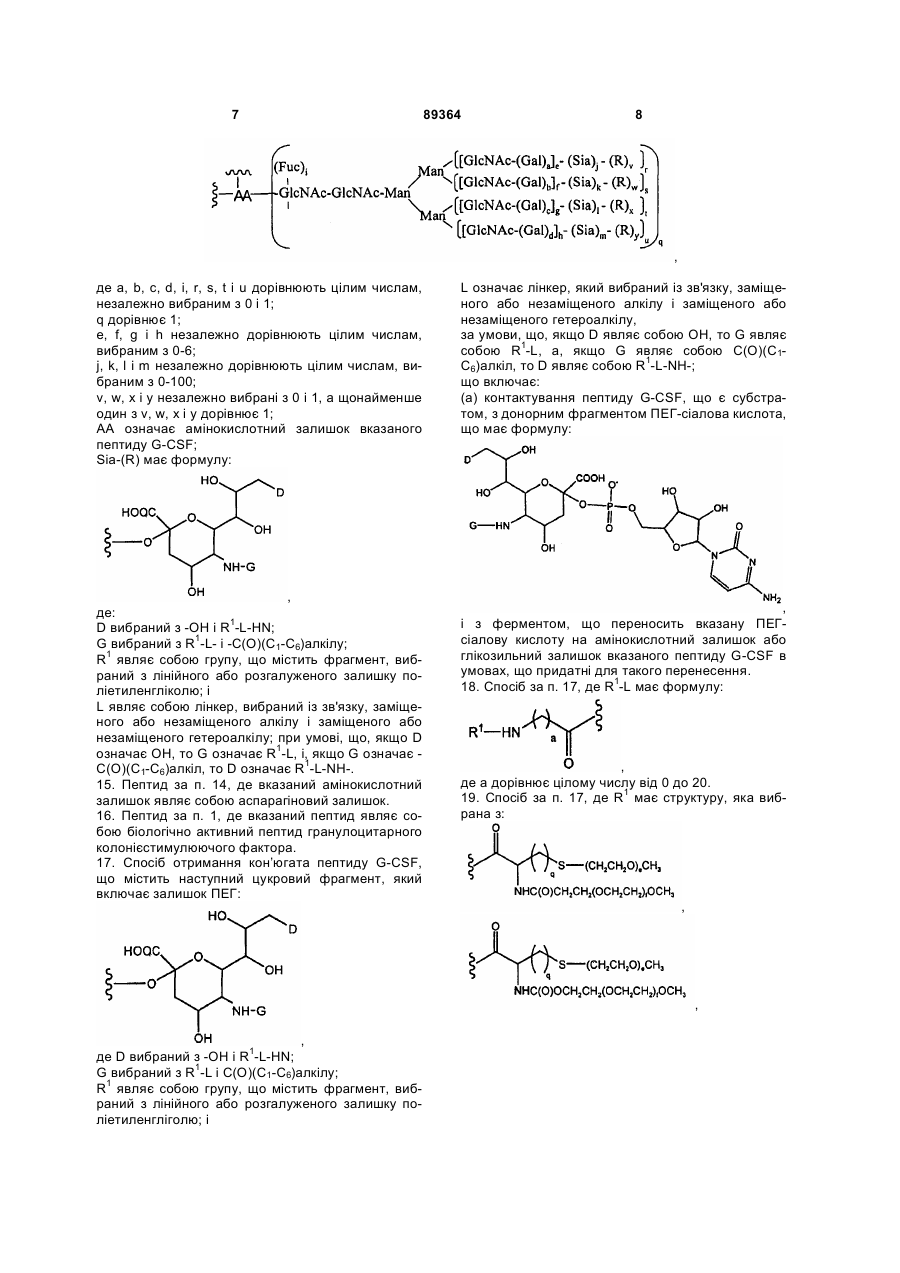
14. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу:
,
де а, b, с, d, i, r, s, t і u дорівнюють цілим числам, незалежно вибраним з 0 і 1;
q дорівнює 1;
е, f, g і h незалежно дорівнюють цілим числам, вибраним з 0-6;
j, k, l і m незалежно дорівнюють цілим числам, вибраним з 0-100;
v, w, х і у незалежно вибрані з 0 і 1, а щонайменше один з v, w, х і у дорівнює 1;
AA означає амінокислотний залишок вказаного пептиду G-CSF;
Sia-(R) має формулу:
,
де:
D вибраний з -ОН і R1-L-HN;
G вибраний з R1-L- і -С(О)(С1-С6)алкілу;
R1 являє собою групу, що містить фрагмент, вибраний з лінійного або розгалуженого залишку поліетиленгліколю; і
L являє собою лінкер, вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу; при умові, що, якщо D означає ОН, то G означає R1-L, і, якщо G означає -С(О)(С1-С6)алкіл, то D означає R1-L-NH-.
15. Пептид за п. 14, де вказаний амінокислотний залишок являє собою аспарагіновий залишок.
16. Пептид за п. 1, де вказаний пептид являє собою біологічно активний пептид гранулоцитарного колонієстимулюючого фактора.
17. Спосіб отримання кон’югата пептиду G-CSF, що містить наступний цукровий фрагмент, який включає залишок ПЕГ:
,
де D вибраний з -ОН і R1-L-НN;
G вибраний з R1-L і С(О)(С1-С6)алкілу;
R1 являє собою групу, що містить фрагмент, вибраний з лінійного або розгалуженого залишку поліетиленгліголю; і
L означає лінкер, який вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу,
за умови, що, якщо D являє собою ОН, то G являє собою R1-L, а, якщо G являє собою С(О)(С1-С6)алкіл, то D являє собою R1-L-NН-;
що включає:
(а) контактування пептиду G-CSF, що є субстратом, з донорним фрагментом ПЕГ-сіалова кислота, що має формулу:
,
і з ферментом, що переносить вказану ПЕГ-сіалову кислоту на амінокислотний залишок або глікозильний залишок вказаного пептиду G-CSF в умовах, що придатні для такого перенесення.
18. Спосіб за п. 17, де R1-L має формулу:
,
де а дорівнює цілому числу від 0 до 20.
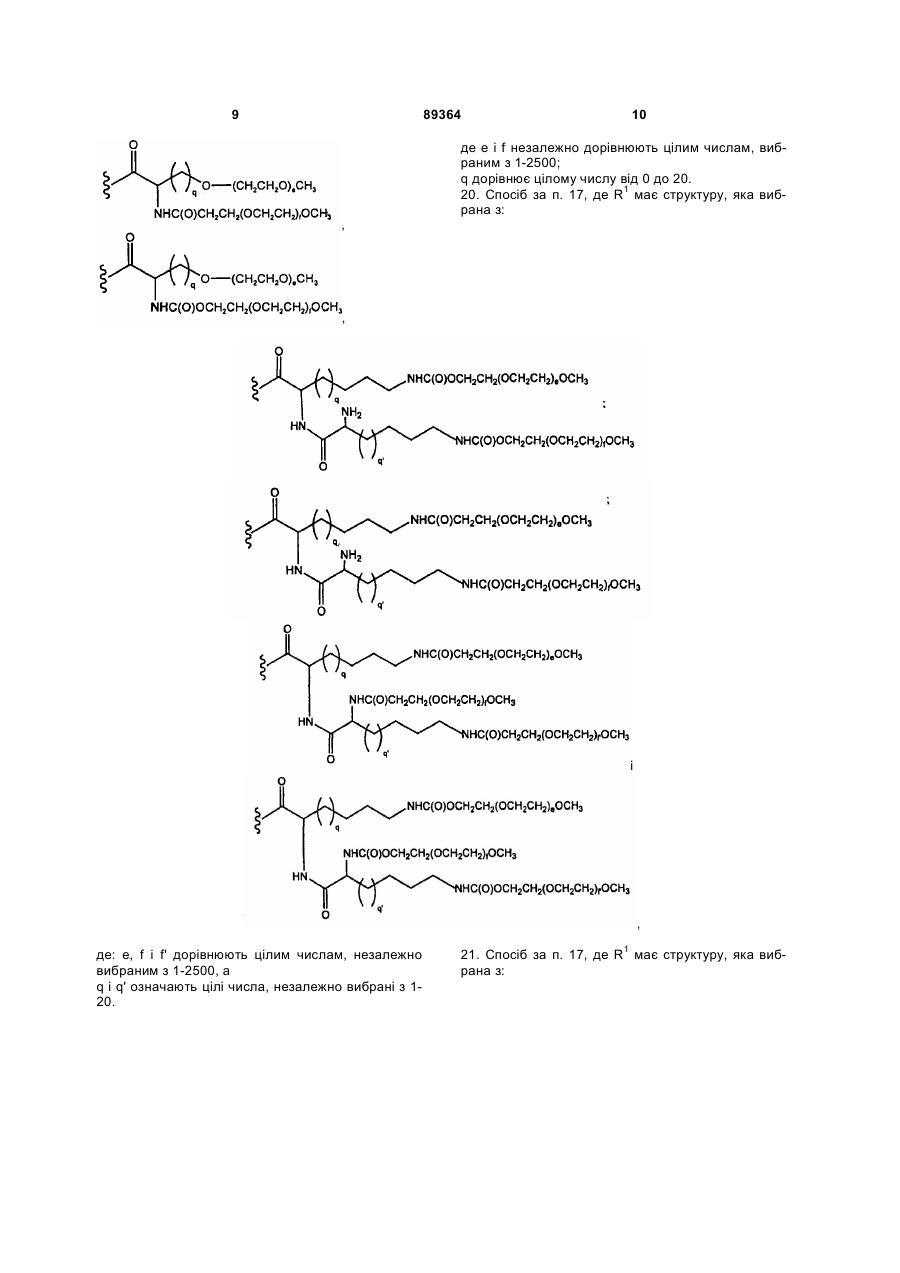
19. Спосіб за п. 17, де R1 має структуру, яка вибрана з:
,,
,,
де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500;
q дорівнює цілому числу від 0 до 20.
20. Спосіб за п. 17, де R1 має структуру, яка вибрана з:
і
,
де: е, f і f' дорівнюють цілим числам, незалежно вибраним з 1-2500, а
q і q' означають цілі числа, незалежно вибрані з 1-20.
21. Спосіб за п. 17, де R1 має структуру, яка вибрана з:
і
,
де е, f і f' незалежно дорівнюють цілим числам, вибраним з 1-2500, а
q, q' і q" дорівнюють цілим числам, незалежно вибраним з 1-20.
22. Спосіб за п. 17, де R1 має структуру, яка вибрана з:
і
,
де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500.
23. Спосіб за п. 17, який, перед проведенням стадії (а), включає:
(b) експресію вказаного пептиду гранулоцитарного колонієстимулюючого фактора, що використовується як субстрат, у відповідному хазяїні.
24. Спосіб за п. 17, де вказаний хазяїн вибраний з клітини комахи і клітини ссавця.
25. Спосіб стимуляції продукування запальних лейкоцитів у ссавця, що включає введення вказаному ссавцеві пептиду за п. 1.
26. Спосіб лікування інфекції у пацієнта, що потребує цього, який включає стадію введення вказаному пацієнту кількості пептиду за п. 1, ефективної для полегшення вказаного стану у вказаного пацієнта.
27. Фармацевтична композиція, що містить пептид гранулоцитарного колонієстимулюючого фактора за п. 1 і фармацевтично прийнятний носій.
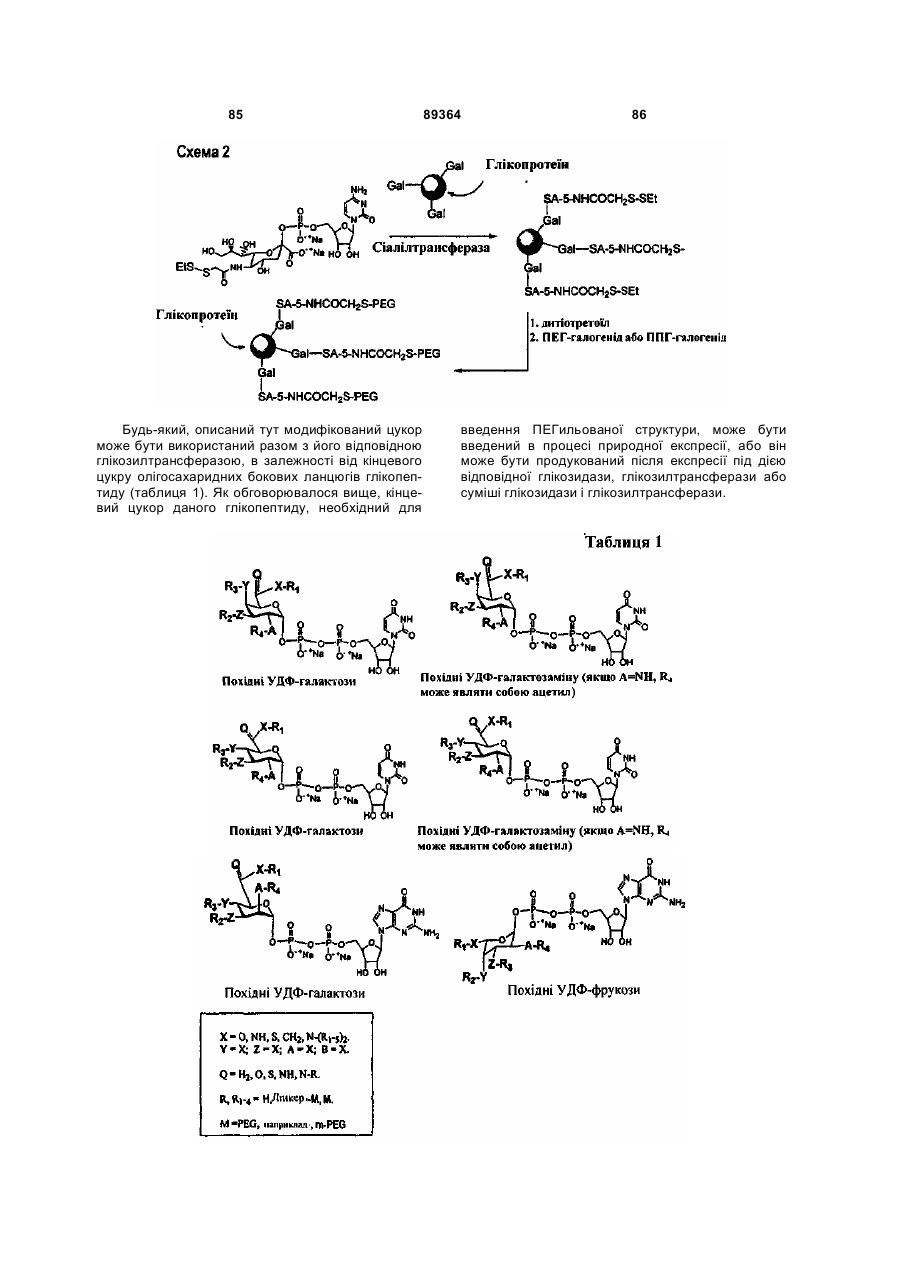
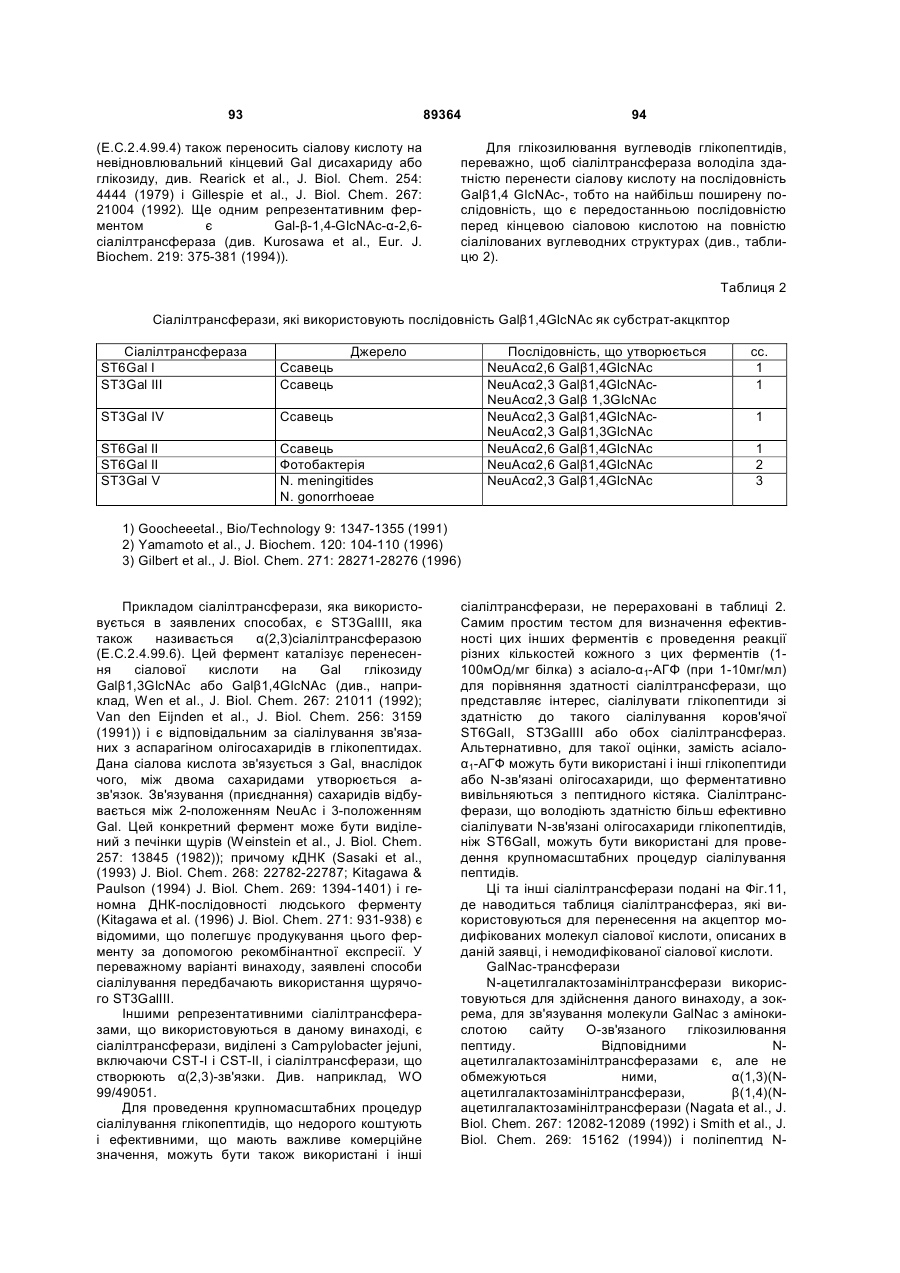
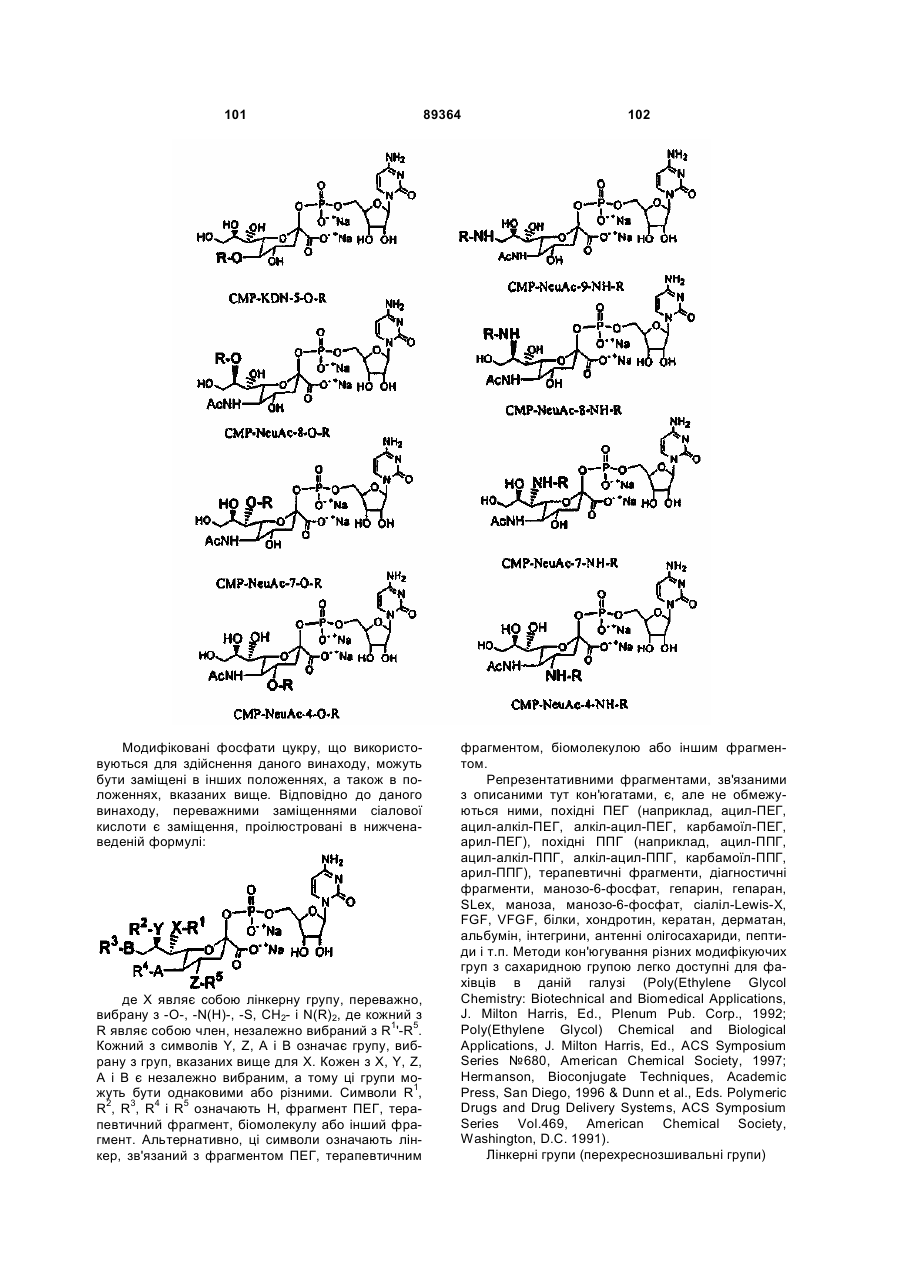
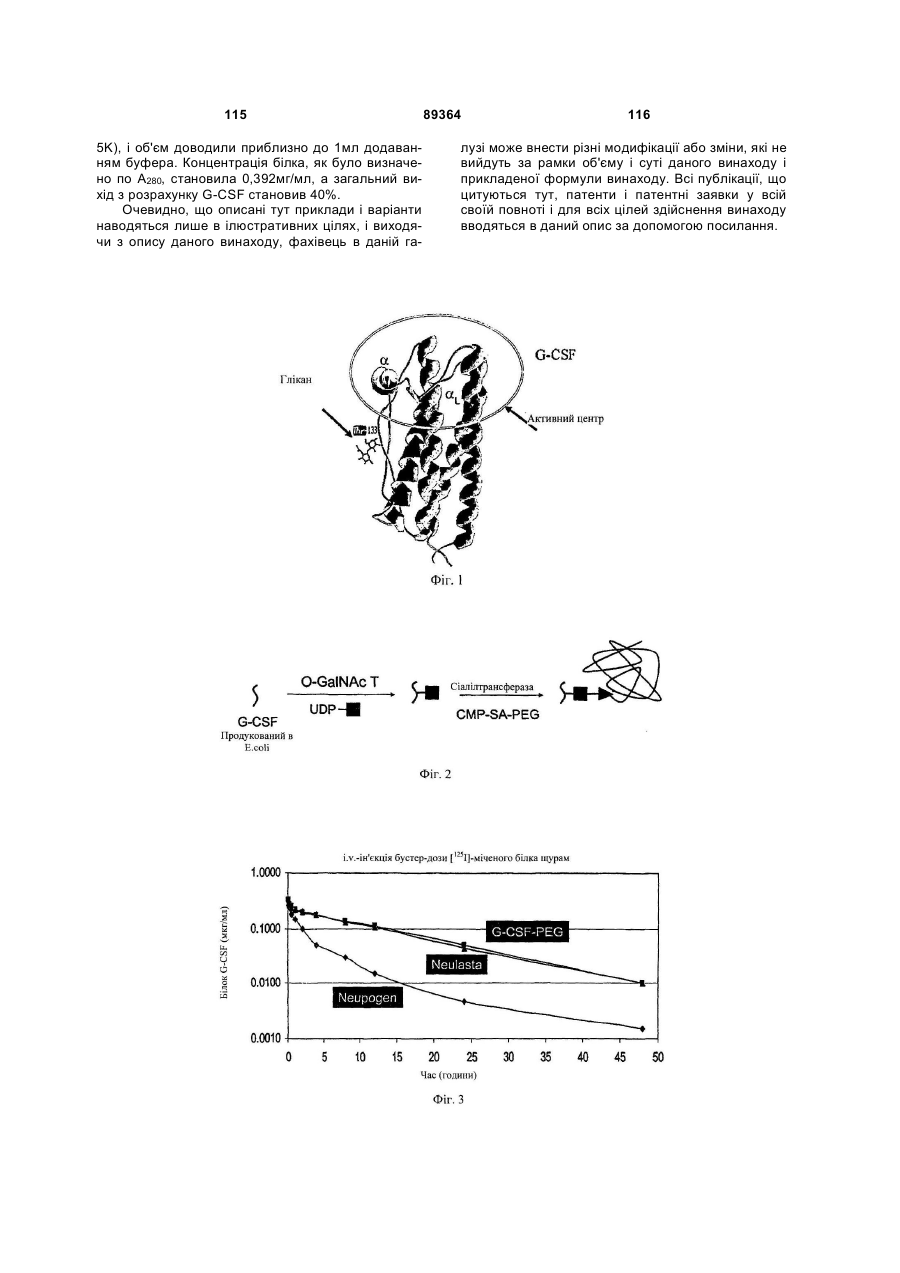
Текст
1. Кон’югат пептиду гранулоцитарного колонієстимулюючого фактора (G-CSF), що містить наступний цукровий фрагмент, який включає залишок ПЕГ: 2 , (19) 1 , 3 89364 , 4 , де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500, а q дорівнює цілому числу від 0 до 20. 4. Пептид за п. 1, де R1 має структуру, яка вибрана з: і , де: е, f і f' дорівнюють цілим числам, незалежно вибраним з 1-2500, а q і q' означають цілі числа, незалежно вибрані з 120. 5. Пептид за п. 1, де R1 має структуру, яка вибрана з: 5 89364 6 і , де е, f і f' незалежно дорівнюють цілим числам, вибраним з 1-2500, а q, q' і q" дорівнюють цілим числам, незалежно вибраним з 1-20. 6. Пептид за п. 1, де R1 має структуру, яка вибрана з: ,і , де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500. 7. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу: . 8. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу: . 9. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу: , де АА означає амінокислотний залишок вказаного пептиду. 10. Пептид G-CSF за п. 9, де вказаний амінокислотний залишок вибраний з серину або треоніну. 11. Пептид G-CSF за п. 1, де вказаний пептид має амінокислотну послідовність SEQ ID NO:1. 12. Пептид G-CSF за п. 10, де вказаним амінокислотним залишком є треонін в положенні 134 SEQ ID NO:1. 13. Пептид G-CSF за п. 1, де вказаний пептид має амінокислотну послідовність, вибрану з SEQ ID NO:1 і SEQ ID NO:2. 14. Пептид G-CSF за п. 1, де вказаний фрагмент має формулу: 7 89364 8 , де а, b, с, d, i, r, s, t і u дорівнюють цілим числам, незалежно вибраним з 0 і 1; q дорівнює 1; е, f, g і h незалежно дорівнюють цілим числам, вибраним з 0-6; j, k, l і m незалежно дорівнюють цілим числам, вибраним з 0-100; v, w, х і у незалежно вибрані з 0 і 1, а щонайменше один з v, w, х і у дорівнює 1; AA означає амінокислотний залишок вказаного пептиду G-CSF; Sia-(R) має формулу: , де: D вибраний з -ОН і R1-L-HN; G вибраний з R1-L- і -С(О)(С1-С6)алкілу; R1 являє собою групу, що містить фрагмент, вибраний з лінійного або розгалуженого залишку поліетиленгліколю; і L являє собою лінкер, вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу; при умові, що, якщо D означає ОН, то G означає R1-L, і, якщо G означає С(О)(С1-С6)алкіл, то D означає R1-L-NH-. 15. Пептид за п. 14, де вказаний амінокислотний залишок являє собою аспарагіновий залишок. 16. Пептид за п. 1, де вказаний пептид являє собою біологічно активний пептид гранулоцитарного колонієстимулюючого фактора. 17. Спосіб отримання кон’югата пептиду G-CSF, що містить наступний цукровий фрагмент, який включає залишок ПЕГ: L означає лінкер, який вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу, за умови, що, якщо D являє собою ОН, то G являє собою R1-L, а, якщо G являє собою С(О)(С1С6)алкіл, то D являє собою R1-L-NН-; що включає: (а) контактування пептиду G-CSF, що є субстратом, з донорним фрагментом ПЕГ-сіалова кислота, що має формулу: , і з ферментом, що переносить вказану ПЕГсіалову кислоту на амінокислотний залишок або глікозильний залишок вказаного пептиду G-CSF в умовах, що придатні для такого перенесення. 18. Спосіб за п. 17, де R1-L має формулу: , де а дорівнює цілому числу від 0 до 20. 19. Спосіб за п. 17, де R1 має структуру, яка вибрана з: , , , де D вибраний з -ОН і R1-L-НN; G вибраний з R1-L і С(О)(С1-С6)алкілу; R1 являє собою групу, що містить фрагмент, вибраний з лінійного або розгалуженого залишку поліетиленгліголю; і 9 89364 , 10 де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500; q дорівнює цілому числу від 0 до 20. 20. Спосіб за п. 17, де R1 має структуру, яка вибрана з: , і , де: е, f і f' дорівнюють цілим числам, незалежно вибраним з 1-2500, а q і q' означають цілі числа, незалежно вибрані з 120. 21. Спосіб за п. 17, де R1 має структуру, яка вибрана з: 11 89364 12 і , де е, f і f' незалежно дорівнюють цілим числам, вибраним з 1-2500, а q, q' і q" дорівнюють цілим числам, незалежно вибраним з 1-20. 22. Спосіб за п. 17, де R1 має структуру, яка вибрана з: і , де е і f незалежно дорівнюють цілим числам, вибраним з 1-2500. 23. Спосіб за п. 17, який, перед проведенням стадії (а), включає: У даній заявці вимагається пріоритет за попередньою заявкою на патент США №60/526796, поданою 3 грудня 2003; попередньою заявкою на патент США №60/555813, поданою 23 березня 2004; попередньою заявкою на патент США №60/570282, поданою 11 травня 2004; попередньою заявкою на патент США №60/539387, поданою 26 січня 2004; попередньою заявкою на патент США №60/592744, поданою 29 липня 2004; попередньою заявкою на патент США №60/614518, поданою 29 вересня 2004 і попередньою заявкою на патент США №60/623387, поданою 29 жовтня 2004, кожна з яких у всій своїй повноті і для всіх цілей здійснення винаходу вводиться в даний опис за допомогою посилання. Гранулоцитарний колонієстимулюючий фактор (G-CSF) являє собою глікопротеїн, який стимулює виживання, проліферацію, диференціювання і здійснення функцій клітин-попередників нейтрофілів-гранулоцитів і зрілих нейтрофілів. У клінічних цілях використовуються дві форми рекомбінантного людського G-CSF, які є сильними стимулятора (b) експресію вказаного пептиду гранулоцитарного колонієстимулюючого фактора, що використовується як субстрат, у відповідному хазяїні. 24. Спосіб за п. 17, де вказаний хазяїн вибраний з клітини комахи і клітини ссавця. 25. Спосіб стимуляції продукування запальних лейкоцитів у ссавця, що включає введення вказаному ссавцеві пептиду за п. 1. 26. Спосіб лікування інфекції у пацієнта, що потребує цього, який включає стадію введення вказаному пацієнту кількості пептиду за п. 1, ефективної для полегшення вказаного стану у вказаного пацієнта. 27. Фармацевтична композиція, що містить пептид гранулоцитарного колонієстимулюючого фактора за п. 1 і фармацевтично прийнятний носій. ми гранулопоезу нейтрофілів і мають продемонстровану ефективність в попередженні інфекційних ускладнень при деяких нейтропеніях. Вони можуть бути використані для прискорення відновлення нейтрофілів після лікування мієлодепресантами. G-CSF сприяє зниженню тяжкості ускладнень, що викликаються протираковою хіміотерапією, завдяки зменшенню випадків розвитку фебрильної нейтропенії, і тяжкості ускладнень, що викликаються високодозовою хіміотерапією, що проводиться в поєднанні з трансплантацією кісткового мозку, а також сприяє зменшенню випадків виникнення і тривалості інфекційних захворювань у пацієнтів з важкою хронічною нейтропенією. Недавно було продемонстровано, що G-CSF має терапевтичну дію при його введенні після початку інфаркту міокарда. Людська форма G-CSF була клонована дослідниками Японії і США в 1986 (див., наприклад, Nagata et al., Nature 319: 415-418, 1986). Природний людський глікопротеїн присутній в двох формах: одна з них складається з 175 амінокислот, а 13 інша - з 178 амінокислот. Переважна і більш активна форма, що складається з 175 амінокислот, була використана в продукуванні фармацевтичних продуктів методом рекомбінантних ДНК. Рекомбінантний людський G-CSF, синтезований в експресійній системі Е.соіі, був названий філграстимом. Структура філграстиму дещо відрізняється від структури природного глікопротеїну. Інша форма рекомбінантного людського G-CSF називається ленограстимом і була синтезована в клітинах яєчника китайського хом'яка (СНО). hG-CSF являє собою мономерний білок, який димеризує рецептор G-CSF за допомогою утворення комплексу 2:2 з 2 молекул G-CSF і двох рецепторів (Horan et al., Biochemistry 35(15): 4886-96 (1996)). У дослідженнях, що проводяться за допомогою рентгенівської кристалографії, нижченаведені залишки hG-CSF були ідентифіковані як частина контактних областей, що зв'язуються з рецептором, а саме, такі залишки, як G4, Р5, А6, S7, S8, L9, Р10, Q11, S12, L15, K16, Е19, Q20, L108, D109, D112, Т115, Т116, Q119, Е122, Е123 і L124 (див. наприклад, Aritomi et al. (1999) Nature 401: 713). Комерційно доступні форми rhG-CSF мають короткочасний фармакологічний ефект, і в більшості випадків, вони повинні бути введені більше за один раз в день протягом всього курсу лікування лейкопенії. Використання молекули з більш тривалим часом напівжиття в кровотоці дозволяє зменшити число введень, необхідних для ослаблення лейкопенії і попередження подальших можливих інфекцій. Іншою проблемою, пов'язаною з використанням продуктів rG-CSF, що існують в цей час, є виникнення дозозалежного болю в кістках. Оскільки біль в кістках, що виникає у пацієнтів, є серйозним побічним ефектом, що викликається лікуванням із застосуванням rG-CSF, то було б бажано отримати такий продукт rG-CSF, який не викликав би болю в кістках, або використовувати такий продукт, який за своєю природою не має такого ефекту або є ефективним в досить малих дозах, що не викликають болю в кістках. Таким чином, необхідність в поліпшенні властивостей рекомбінантних молекул G-CSF є абсолютно очевидною. В літературі повідомлялося про отримання сконструйованих на основі білка варіантів hG-CSF (патенти США №№5581476, 5214132, 5362853, 4904584 і Riedhaar-Olson et al., Biochemistry 35: 9034-9041, 1996). Була також описана модифікація hG-CSF і інших поліпептидів, яка полягає у введенні щонайменше одного додаткового вуглеводного ланцюга в порівнянні з природним поліпептидом (патент США №5218092). Крім того, були описані і досліджені полімерні модифікації природного hG-CSF, включаючи приєднання груп ПЕГ (див. наприклад, Satake-Ishikawa et al. (1992) Cell Structure and Function 17: 157; Bowen et al. (1999) Experimental Hematology 27: 425; патент США №5824778; патент США №5824784, WO 96/11953, WO 95/21629 і WO 94/20069)). Приєднання синтетичних полімерів до пептидного кістяка з метою поліпшення фармакокінетичних властивостей терапевтичного глікопротеїну відоме фахівцям. Репрезентативним полімером, 89364 14 який був кон'югований з пептидами, є поліетиленгліколь ("ПЕГ"). Було продемонстроване використання ПЕГ в цілях дериватизації терапевтичних пептидів для зниження імуногенності даних пептидів. Так, наприклад, в патенті США №4179337 (Davis et al.) описані неімуногенні поліпептиди, такі як ферменти і пептидні гормони, приєднані до поліетиленгліколю (ПЕГ) або до поліпропіленгліколю. Збільшення розміру ПЕГ-кон'югату поліпептидів, що розглядаються, крім зниження імуногенності, також приводить до збільшення часу виведення з кровотоку. Основним способом приєднання ПЕГ і його похідних до пептидів є неспецифічне зв'язування за допомогою амінокислотного залишку пептиду (див. наприклад, патент США №4088538, патент США №4496689, патент США №4414147, патент США №4055635 і РСТ WO 87/00056). Іншим способом приєднання ПЕГ до пептидів є неспецифічне окислення глікозильних залишків на глікопептиді (див. наприклад, WO 94/05332). Ці неспецифічні методи передбачають рандомізоване неспецифічне приєднання поліетиленгліколю до реакційноздатних залишків на пептидному кістяку. Очевидно, що рандомізоване приєднання молекул ПЕГ має свої недоліки, включаючи відсутність гомогенності кінцевого продукту і можливе зниження біологічної або ферментативної активності такого пептиду. Тому, для продукування терапевтичних пептидів, найкращою стратегією є дериватизація, яка приводить до утворення специфічно міченого по суті гомогенного продукту, що легко характеризується. І такі методи були розроблені. Специфічно мічені гомогенні пептиди з терапевтичними властивостями можуть бути продуковані in vitro під дією ферментів. На відміну від стандартних неспецифічних методів приєднання синтетичного полімеру або іншої мітки до пептиду, ферментативний синтез має ті переваги, що він є регіоселективним і стереоселективним. Двома основними класами ферментів, що використовуються в синтезі мічених пептидів, є глікозилтрансферази (наприклад, сіалілтрансферази, олігосахарилтрансферази, Nацетилглюкозамінілтрансферази) і глікозидази. Ці ферменти можуть бути використані для специфічного приєднання цукрів, які можуть бути потім модифіковані так, щоб вони містили терапевтичний фрагмент. Альтернативно, глікозилтрансферази і модифіковані глікозидази можуть бути використані для прямого перенесення модифікованих цукрів на пептидний кістяк (див. наприклад, патент США №6399336 і публікації заявок на патенти США 20030040037, 20040132640, 20040137557, 20040126838 і 20040142856, кожна з яких вводиться в даний опис за допомогою посилання). Методи комбінування елементів, отриманих хімічним і ферментативним синтезом, також відомі фахівцям (див. наприклад, роботу Yamamoto et al. Carbohydr. Res. 305: 415-422 (1998) і публікацію заявки на патент США 20040137557, які вводяться в даний опис за допомогою посилання). Для розв'язання проблеми, пов'язаної з необхідністю створення більш ефективного терапевти 15 чного G-CSF, даний винахід був направлений на отримання глікопегильованого G-CSF, який є терапевтично активним і має поліпшені фармакокінетичні параметри і властивості в порівнянні з ідентичними або близькоспорідненими аналогами неглікопегильованого пептиду G-CSF. Крім того, даний винахід відноситься до способу високоефективного і промислового синтезу пептидів G-CSF з поліпшеними властивостями. Було виявлено, що регульована модифікація гранулоцитарного колонієстимулюючого фактора (G-CSF) однією або декількома поліетиленгліколевими групами дозволяє отримати нові похідні GCSF з поліпшеними фармакокінетичними властивостями в порівнянні з відповідним природним (неПЕГильованим) G-CSF (Фіг.3). Крім того, фармакологічна активність глікопегильованого G-CSF є приблизно такою ж, як активність комерційно доступного моно-ПЕГильованого філграстиму (Фіг.4). У репрезентативному варіанті винаходу, "глікопегильовані" молекули G-CSF згідно з винаходом отримують шляхом опосередкованого ферментом утворення кон'югату, що містить глікозильований або неглікозильований пептид GCSF і ферментативно переносимий цукровий фрагмент, в структуру якого входить залишок поліетиленгліколю. Залишок ПЕГ приєднаний до цукрового фрагмента безпосередньо (тобто за допомогою однієї групи, утвореної внаслідок взаємодії двох реакційноздатних груп) або за допомогою лінкера, наприклад, заміщеного або незаміщеного алкілу, заміщеного або незаміщеного гетероалкілу і т.п. Приклад переносимої ПЕГ-цукрової структури наводиться на Фіг.5. Таким чином, в одному з своїх аспектів, даний винахід відноситься до кон'югату, що містить залишок ПЕГ, наприклад, ПЕГ і пептид, який має in vivo активність, аналогічну або майже аналогічну активності відомого G-CSF. В кон'югаті згідно з винаходом, залишок ПЕГ ковалентно приєднаний до пептиду за допомогою інтактної глікозильної лінкерної групи. Репрезентативними інтактними глікозильними лінкерними групами є молекули сіалової кислоти, дериватизовані поліетиленгліколем (ПЕГ). В одному з своїх репрезентативних аспектів, даний винахід відноситься до пептиду G-CSF, який включає фрагмент: У вищезгаданій формулі, D являє собою -ОН або R1-L-HN-. Символ G означає R1-L або С(О)(С|С6)алкіл. R1 являє собою групу, що містить лінійний або розгалужений залишок поліетиленгліколю, a L означає лінкер, який вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу. У загальних рисах, якщо D являє собою ОН, то G являє собою R1-L, a 89364 16 якщо G являє собою -С(О)(С1-С6)алкіл, то D являє собою R1-L-NH-. В модифікованих структурах сіалової кислоти, описаних в даній заявці, СООН також являє собою COO- і/або його сіль. В іншому своєму аспекті, даний винахід відноситься до способу отримання ПЕГильованого GCSF, що містить фрагмент, описаний вище. Спосіб згідно з винаходом включає (а) контактування субстрату пептиду G-CSF з донорним фрагментом "ПЕГ-сіалова кислота" і з ферментом, що переносить ПЕГ-сіалову кислоту на амінокислотний або глікозильний залишок G-CSF в умовах, відповідних для такого перенесення. Репрезентативний донорний фрагмент "ПЕГ-сіалова кислота" має формулу: В одному з варіантів винаходу, вказаним хазяїном є клітина ссавця. В інших варіантах здійснення винаходу, клітиною-хазяїном є клітина комахи, рослини, бактерій або грибів. Фармакокінетичні властивості сполук згідно з винаходом можуть бути легко змінені шляхом зміни структури, числа або положень сайту(ів) глікозилювання пептиду. Таким чином, об'єм даного винаходу включає спосіб додавання однієї або декількох мутацій, які вводять сайт О- або Nзв'язаного глікозилювання в пептид G-CSF, і які відсутні в молекулі дикого типу. Антитіла проти цих мутантів і їх глікозильованих кінцевих продуктів і проміжних сполук також входять в об'єм даного винаходу. В іншому своєму аспекті, даний винахід відноситься до G-CSF-кон'югату, що містить набір залишків ПЕГ, наприклад, ПЕГ, ковалентно зв'язаного з G-CSF за допомогою інтактної глікозильної лінкерної групи. В кон'югаті згідно з винаходом, по суті, кожен член даного набору зв'язаний за допомогою глікозильної лінкерної групи з глікозильним залишком пептиду, і кожний глікозильний залишок має ідентичну структуру. У своєму репрезентативному варіанті, даний винахід відноситься до G-CSF-кон'югату, що містить набір залишків ПЕГ, наприклад, ПЕГ, ковалентно зв'язаного з G-CSF за допомогою інтактної глікозильної лінкерної групи. В кон'югаті згідно з винаходом, по суті, кожен член даного набору зв'язаний з амінокислотним залишком пептиду, і кожний амінокислотний залишок, до якого приєднаний даний полімер, має ідентичну структуру. Так, наприклад, якщо один з пептидів включає зв'язаний з Thr глікозильний залишок, то щонайменше приблизно 70%, 80%, 90%, 95%, 97%, 99%, 99,2%, 99,4%, 99,6%, або, більш переважно, 99,8% пептидів в даному наборі будуть мати однакове число глікозильних залишків, ковалентно зв'язаних 17 з одним і тим же залишком Thr. Наведене вище обговорення в рівній мірі відноситься до сайтів Оглікозилювання і N-глікозилювання. Даний винахід також відноситься до фармацевтичної композиції. Така композиція включає фармацевтично прийнятний носій і ковалентний кон'югат, що містить неприродний залишок ПЕГ і глікозильований або неглікозильований пептид GCSF. Інші цілі і переваги даного винаходу будуть очевидні з нижченаведеного докладного опису винаходу. Опис графічного матеріалу На Фіг.1 представлена структура G-CSF, яка ілюструє наявність і локалізацію потенційного глікозилювання у залишку Thr 133 (Thr 134, якщо присутній метіонін). На Фіг.2 представлена схема, що ілюструє репрезентативний варіант даного винаходу, в якому вуглеводний залишок на пептиді CGS ремодельований шляхом ферментативного приєднання групи GalNac до глікозидьного залишку у Thr 133 (Thr 134, якщо присутній метіонін) з подальшим приєднанням ПЕГ-дериватизованого цукрового фрагмента. На Фіг.3 представлені графіки, що ілюструють порівняння часу перебування in vivo неглікозильованого G-CSF, NeulastaTM і ферментативно глікопегильованого G-CSF. На Фіг.4 представлені графіки, що ілюструють порівняння активності різних молекул,вказаних на Фіг.3. На Фіг.5 представлена схема синтезу для продукування репрезентативного попередника "ПЕГглікозильована лінкерна група" (модифікованого цукру) згідно з винаходом з метою отримання кон'югатів згідно з винаходом. На Фіг.6 представлені репрезентативні амінокислотні послідовності G-CSF. SEQ ID NО:1 являє собою варіант, що складається з 175 амінокислот, де першою амінокислотою є метіонін, і де треоніновий залишок присутній в положенні 134. SEQ ID NО:2 являє собою варіант, який містить 174 амінокислоти і має таку ж послідовність, як і послідовність, що складається з 175 амінокислот, за винятком того, що в ній відсутній ініціюючий метіонін, а тому, ця послідовність починається з Т, а треоніновий залишок знаходиться в положенні 133. На Фіг.7 проілюстровані деякі репрезентативні нуклеотиди, що містять модифікований цукор, що використовуються для здійснення даного винаходу. На Фіг.8 проілюстровані інші репрезентативні нуклеотиди, що містять модифікований цукор, що використовуються для здійснення даного винаходу. На Фіг.9 продемонстровано продукування рекомбінантного G-CSF в бактеріях, вирощених в різних середовищах і індукованих IPTG. На Фіг.10 проілюстрований Вестерн-блотаналіз підданого рефолдингу G-CSF після хроматографії на SP-сефарозі. На Фіг.11 представлена таблиця сіалілтрансфераз, які використовуються для перенесення описаних тут модифікованої молекули сіалової 89364 18 кислоти і немодифікованої сіалової кислоти на акцептор. Скорочення ПЕГ - поліетиленгліколь; PPG (ППГ) - поліпропіленгліколь; Аrа - арабінозил; Fru - фруктозил; Fuc - фукозил; Gal - галактозид; GalNac - Nацетилгалактозамініл; Glc - глюкозил; GlcNAc - Nацетилглюкозамініл; Man - манозил; ManAc манозамінілацетат; Ху1 - ксилозил; NeuAc - сіаліл(N-ацетилнейрамініл); М6Р - манозо-6-фосфат; Sia - сіалова кислота, N-ацетилнейрамініл і їхні похідні і аналоги. Визначення Якщо це не визначено особливо, то всі технічні і наукові терміни, що використовуються тут, мають загальноприйняте значення, відоме фахівцям в галузі, до якої відноситься даний винахід. У загальних рисах, номенклатура, що використовується тут і лабораторні процедури, що застосовуються в культивуванні клітин, молекулярній генетиці, органічній хімії і хімії синтезу нуклеїнових кислот, а також в методі гібридизації, є добре відомими і детально описані в літературі. Для синтезу нуклеїнових кислот і пептидів застосовуються стандартні методи. Такі методи і процедури звичайно здійснюють стандартними способами, описаними в літературі і в різних загальних керівництвах (в загальних рисах, див. керівництво Sambrook et al., Molecular Cloning: A Laboratory Manual, 2d ed. (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., яке вводиться в даний опис за допомогою посилання), і ці способи також описані в даному документі. Номенклатура, що використовується тут, і лабораторні процедури, що застосовуються в аналітичній хімії і в хімії органічного синтезу і описані нижче, добре відомі і детально описані в літературі. Для хімічного синтезу і хімічних аналізів застосовуються стандартні методи або їх модифікації. Всі описані тут олігосахариди мають назви або скорочення, прийняті для невідновлювального сахариду (тобто Gal) і відповідні конфігурації глікозидного зв'язку (α або β), зв'язку в кільці (1 або 2) і положенню відновлювального сахариду в кільці, що бере участь в утворенні зв'язку (2, 3, 4, 6 або 8), а також назви або скорочення, прийняті для відновлювального сахариду (тобто GlcNAc). Кожний з сахаридів переважно є піранозою. Опис стандартної номенклатури, що використовується в біології глікозилювання, можна знайти в керівництві Essentials of Glycobiology Varki et al., eds. CSHL Press (1999). Вважається, що олігосахариди повинні мати відновлювальний кінець і невідновлювальний кінець, незалежно від того, чи є сахарид, що знаходиться у відновлювального кінця, дійсно відновлювальним цукром, чи ні. Відповідно до загальноприйнятої номенклатури, описані тут олігосахариди зліва мають невідновлювальний кінець, а справа - відновлювальний кінець. Термін "сіалова кислота" означає будь-який член сімейства карбоксильованих цукрів з дев'яти атомів вуглецю. Наібільш поширеним членом сімейства сіалових кислот є N-ацетил-нейрамінова кислота (2-кето-5-ацетамідо-3,5-дидезокси-D 19 гліцеро-D-галактононулопірано-1-онова кислота (що часто скорочено називається Neu5Ac, NeuAc або ΝΑΝΑ). Другим членом такого сімейства є Nгліколіл-нейрамінова кислота (Neu5Gc або NeuGc), в якій N-ацетильна група NeuAc є гідроксильованою. Третім членом сімейства сіалових кислот є 2-кето-3-дезокси-нонулозонова кислота (KDN) (Nadano et al., (1986) J. Biol. Chem. 261: 11550-11557; Kanamori et al. J. Biol. Chem. 265: 21811-21819 (1990)). В об'єм даного винаходу також входять 9-заміщені сіалові кислоти, такі як 9О-С1-C6ацил-Neu5Ас, наприклад, 9-О-лактилNeu5Ас або 9-О-ацетил-Neu5Ас, 9-дезокси-9фтор-Neu5Ас і 9-азидо-9-дезокси-Neu5Ас. Описання сімейства сіалових кислот можна знайти, наприклад, в публікації Varki, Glycobiology 2: 25-40 (1992) Sialic Acids: Chemistry, Methabolism and Function, R. Schauer Ed. (Springer-Verlag, New York (1992)). Синтез і використання сполук сіалової кислоти в процедурі сіалілування описані в Міжнародній заявці WO 92/16640, опублікованій 1 жовтня 1992. Термін "сіалова кислота" означає будь-який член сімейства карбоксильованих цукрів із дев'яти атомів вуглецю. Найбільш поширеним членом сімейства сіалових кислот є N-ацетил-нейрамінова кислота (2-кето-5-ацетамідо-3,5-дидезокси-Dгліцеро-D-галактононулопірано-1-онова кислота (що часто скорочено називається Neu5Ac, NeuAc або ΝΑΝΑ). Другим членом такого сімейства є Nгліколіл-нейрамінова кислота (Neu5Gc або NeuGc), в якій N-ацетильна група NeuAc є гідроксильованою. Третім членом сімейства сіалових кислот є 2-кето-3-дезокси-нонулозонова кислота (KDN) (Nadano et al., (1986) J. Biol. Chem. 261: 11550-11557; Kanamori et al. J. Biol. Chem. 265: 21811-21819 (1990)). В об'єм даного винаходу також входять 9-заміщені сіалові кислоти, такі як 9О-С1-С6ацил-Neu5Ас, наприклад, 9-О-лактилNeu5Ас або 9-О-ацетил-Neu5Ас, 9-дезокси-9фтор-Neu5Ас і 9-азидо-9-дезокси-Neu5Ас. Описання сімейства сіалових кислот можна знайти, наприклад, в публікації Varki, Glycobiology 2: 25-40 (1992) Sialic Acids: Chemistry, Methabolism and Function, R. Schauer Ed. (Springer-Verlag, New York (1992)). Синтез і використання сполук сіалової кислоти в процедурі сіалілування описані в Міжнародній заявці WO 92/16640, опублікованій 1 жовтня 1992. Термін "гранулоцитарний колоні єстимулюючий фактор" або "пептид гранулоцитарного колонієстимулюючого фактора", або "G-CSF" або "пептид G-CSF" відноситься до будь-якого пептиду дикого типу або до мутованого пептиду, до рекомбінантного або нативного G-CSF або будь-якого його фрагмента, що має активність, аналогічну активності нативного G-CSF або що імітує цю активність. Звичайно, цей термін також охоплює непептидні міметики G-CSF. У репрезентативному варіанті винаходу, пептид G-CSF має амінокислотну послідовність, представлену в SEQ ID NО:1. В інших репрезентативних варіантах винаходу, пептид G-CSF має послідовність, вибрану з SEQ ID NO:3-11. 89364 20 Термін "активність гранулоцитарного колонієстимулюючого фактора" означає будь-яку активність, включаючи, але не обмежуючись ними, зв'язування з рецептором і активація рецептора, інгібування зв'язування з рецептором або будь-яку біохімічну або фізіологічну реакцію, яка звичайно відбувається під дією гранулоцитарного колонієстимулюючого фактора дикого типу. Активність гранулоцитарного колонієстимулюючого фактора може бути індукована під дією будь-якого пептиду гранулоцитарного колонієстимулюючого фактора, визначеного вище. Термін "пептид" означає полімер, в якому мономери являють собою амінокислоти і сполучені один з одним амідними зв'язками, і який, альтернативно, називається поліпептидом. Крім того, цей термін також охоплює неприродні амінокислоти, наприклад, β-аланін, фенілгліцин і гомоаргінін. У даному винаході можуть бути також використані амінокислоти, які не кодуються генами. Крім того, в даному винаході можуть бути також використані амінокислоти, які були модифіковані шляхом включення реакційноздатних груп, сайтів глікозилювання, полімерів, терапевтичних молекул, біомолекул і т.п. Всі амінокислоти, що використовуються в даному винаході, можуть бути або Dізомерами, або L-ізомерами. Звичайно, переважним є L-ізомер. Крім того, в даному винаході можуть бути також використані інші пептидоміметики. Використовуваний тут термін "пептид" означає глікозильовані і неглікозильовані пептиди. Можуть бути також використані пептиди, які є неповністю глікозильованими в системі, що експресує даний пептид. Загальний огляд можна знайти у Spatola A.F. Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p.267 (1983). Термін "пептидний кон'югат" означає молекулу згідно з винаходом, в якій пептид кон'югований з описаним тут модифікованим цукром. Термін "амінокислота" означає природні і синтетичні амінокислоти, а також аналоги і міметики амінокислот, які мають такі самі функції, як і природні амінокислоти. Природними амінокислотами є амінокислоти, що кодуються генетичним кодом, а також амінокислоти, які були потім модифіковані, наприклад, гідроксипролін, g-карбоксиглутамін і Офосфосерин. "Амінокислотні аналоги" означають сполуки, які мають таку ж основну хімічну структуру, як і природні амінокислоти, тобто містять αвуглець, зв'язаний з воднем, карбоксильною групою, аміногрупою і R-групою, наприклад, гомосерин, норлейцин, метіонінсульфоксид, метіонінметилсульфоній. Ці аналоги мають модифіковані Rгрупи (наприклад, норлейцин) або модифіковані пептидні кістяки, але, при цьому, зберігають основну хімічну структуру, властиву природній амінокислоті. Термін "амінокислотні міметики" означає хімічні сполуки, які мають структуру, відмінну від загальної хімічної структури амінокислот, але що має функцію, аналогічну функції природної амінокислоти. Використовуваний тут термін "амінокислота", незалежно від того, чи присутня вона в лінкері або в компоненті пептидної послідовності, 21 означає D- і L-ізомер амінокислоти, а також суміші цих двох ізомерів. Використовуваний тут термін "модифікований цукор" означає природний або неприродний вуглевод, який ферментативно приєднаний до амінокислоти або до глікозильного залишку пептиду способом згідно з винаходом. Модифікований цукор вибирають з ряду субстратів ферменту, включаючи, але не обмежуючись ними, цукровмісі нуклеотиди (моно-, ди- і трифосфати), активовані цукри (наприклад, глікозилгалогеніди, глікозилмезилати) і цукор, які не є активованими і не містяться в нуклеотидах. "Модифікований цукор" ковалентно зв'язаний з функціональною "модифікуючою" групою. Відповідними модифікуючими групами є, але не обмежуються ними, молекули ПЕГ, терапевтичні молекули, діагностичні молекули, біомолекули і т.п. Модифікуюча група, переважно, не є природним або немодифікованим вуглеводом. Положення функціональної модифікуючої групи вибирають так, щоб ця група не перешкоджала утворенню "модифікованого цукру" внаслідок ферментативного приєднання цієї групи до пептиду. Термін "водорозчинний" відноситься до молекул, які мають певний ступінь розчинності у воді, що можна визначити. Методи детекції і/або оцінки розчинності у воді добре відомі фахівцям. Репрезентативними ПЕГ-частинами є пептиди, сахариди, поліефіри, поліаміни, полікарбонові кислоти і т.п. Пептиди можуть мати змішані послідовності або можуть складатися з однієї амінокислоти, наприклад, полілізину. Аналогічним чином, сахариди можуть мати змішані послідовності або можуть складатися з однієї сахаридної субодиниці, наприклад, декстрану, амілози, хітозану і полісіалової кислоти. Прикладом поліефіру є поліетиленгліколь. Прикладом поліаміну є поліетиленамін, а репрезентативною полікарбоновою кислотою є поліакрилова кислота. Використовуваний тут термін "глікозильна лінкерна група" означає глікозильний залишок, до якого ковалентно приєднаний агент (наприклад, залишок ПЕГ, терапевтична молекула, біомолекула). У способах згідно з винаходом, "глікозильна лінкерна група" ковалентно приєднується до глікозильованого або до неглікозильованого пептиду, і тим самим зв'язує даний агент з амінокислотою і/або глікозильним залишком пептиду. "Глікозильна лінкерна група" звичайно утворюється з "модифікованого цукру" внаслідок ферментативного приєднання "модифікованого цукру" до амінокислоти і/або до глікозильного залишку даного пептиду. Термін "інтактна глікозильна лінкерна група" означає лінкерну групу, що утворюється з глікозильної частини, в якій окремі сахаридні мономери, зв'язувальні елементи кон'югату, не розкладаються, наприклад, не окислюються, наприклад, під дією метаперіодату натрію. "Інтактні глікозильні лінкерні групи" згідно з винаходом можуть утворюватися з природного олігосахариду шляхом приєднання глікозильної(их) одиниці(одиниць) або видалення однієї або декількох глікозильних одиниць з початкової сахаридної структури. Використовуваний тут термін "націлююча молекула" означає молекулу, яка може селективно 89364 22 локалізуватися в конкретній тканині або області організму. Така локалізація опосередковується специфічним розпізнаванням молекулярних детермінант, розміром молекули вказаного націлюючого агента або кон'югату, іонними взаємодіями, гідрофобними взаємодіями і т.п. Інші механізми доставки агента в конкретну тканину або область відомі фахівцям. Прикладами націлюючих молекул є антитіла, фрагменти антитіл, трансферин, HSглікопротеїн, фактори зсідання крові, сироваткові білки, β-глікопротеїн, G-CSF, GM-CSF, M-CSF, ЕРО і т.п. Використовуваний тут термін "фармацевтично прийнятний носій" включає будь-який матеріал, який, при його об'єднанні з кон'югатом, зберігає активність даного кон'югату і не реагує з імунною системою пацієнта. Прикладами таких носіїв є, але не обмежуються ними, будь-який стандартний фармацевтичний носій, такий як забуферений фосфатом фізіологічний розчин, вода, емульсії, такі як емульсії типу "масло у воді", і змочувальні агенти різних типів. Іншими носіями можуть бути також стерильні розчини, таблетки, включаючи таблетки з покриттями і капсули. Звичайно, такі носії містять наповнювачі, такі як крохмаль, молоко, цукор, глини деяких типів, желатин, стеаринова кислота або її солі, стеарат магнію або кальцію, тальк, рослинні жири або масла, смоли, гліколі або інші відомі наповнювачі. Такими носіями можуть бути також ароматизатори, барвники або інші інгредієнти. Композиції, що містять такі носії, приготовляють добре відомими стандартними методами. Використовуваний тут термін "введення" означає пероральне введення, введення у вигляді супозиторіїв, введення шляхом місцевого контакту, внутрішньовенне введення, внутрішньочеревинне введення, внутрішньом'язове введення, введення в уражену ділянку, інтраназальне введення або підшкірне введення, або імплантацію індивідууму пристрою пролонгованого вивільнення, наприклад, мініосмотичного насоса. Введення може бути здійснене будь-яким способом, включаючи парентеральне і трансмукозальне введення (наприклад, пероральне, інтраназальне, вагінальне, ректальне або трансдермальне введення). Парентеральне введення включає, наприклад, внутрішньовенне, внутрішньом'язове, інтраартеріолярне, внутрішньошкірне, підшкірне, внутрішньочеревинне, інтравентрикулярне і внутрішньочерепне введення. Крім того, якщо ін'єкцію вводять з метою знищення пухлини, наприклад, з метою індукування апоптозу, то таке введення може бути здійснене безпосередньо в пухлину і/або в тканини, що оточують пухлину. Іншими способами введення є, але не обмежуються ними, використання ліпосомних препаратів, внутрішньовенне вливання, використання черезшкірних пластирів і т.п. Термін "полегшення" або "полегшувати" означає будь-яку ознаку позитивної динаміки в лікуванні патології або стану, включаючи об'єктивні або суб'єктивні параметри, такі як ослаблення, ремісія або зменшення симптомів захворювання, або поліпшення фізичного або психічного стану пацієнта. Полегшення симптомів може бути основане на об'єктивних або суб'єктивних параметрах, 23 включаючи результати обстеження фізичного і/або психічного стану пацієнта. Термін "терапія" означає "лікування" або "усунення" захворювання або стану, включаючи попередження даного захворювання або стану у тварини, яка може мати схильність в розвитку даного захворювання, але у якої ще відсутні або поки не виявлені симптоми захворювання, (профілактичне лікування), пригнічення розвитку захворювання (сповільнення або припинення його розвитку), ослаблення симптомів або побічних ефектів захворювання (включаючи паліативне лікування), і поліпшення динаміки захворювання (що приводить до регресії, тобто до зворотного розвитку захворювання). Термін "ефективна кількість" або "кількість, ефективна для..." або "терапевтично ефективна кількість" або будь-який граматично еквівалентний термін означає кількість, яка, при її введенні тварині для лікування захворювання, є достатньою для ефективного лікування такого захворювання. Термін "виділений" відноситься до матеріалу, який, по суті, або, в основному, не містить компонентів, що використовуються для отримання такого матеріалу. Що стосується пептидних кон'югатів згідно з винаходом, то термін "виділений" відноситься до матеріалу, який, по суті або в основному, не містить компонентів, які звичайно присутні разом з цим матеріалом в суміші, що використовується для отримання пептидного кон'югату. Терміни "виділений" і "чистий" є взаємозамінними. Виділені пептидні кон'югати згідно з винаходом звичайно мають рівень чистоти, що виражається, переважно, у вигляді інтервалу значень. Нижня межа інтервалу значень чистоти для пептидних кон'югатів становить приблизно 60%, приблизно 79% або приблизно 80%, а верхня межа інтервалу значень чистоти для пептидних кон'югатів становить приблизно 70%, приблизно 80%, приблизно 90% або більше, ніж приблизно 90%. Якщо пептидні кон'югати мають чистоту більш, ніж приблизно 90%, то їх чистота також, переважно, виражена у вигляді інтервалу значень. Нижня межа цього інтервалу значень чистоти для пептидних кон'югатів становить приблизно 90%, приблизно 92%, приблизно 94%, приблизно 96% або приблизно 98%. Верхня межа інтервалу значень чистоти для пептидних кон'югатів становить приблизно 92%, приблизно 94%, приблизно 96%, приблизно 98% або приблизно 100%. Чистоту визначають добре відомими аналітичними методами (наприклад, за інтенсивністю смуги на забарвленому сріблом гелі, з допомогою електрофорезу в поліакриламідному гелі, з допомогою ВЕРХ або аналогічними методами). Використовуваний тут термін "в основному, кожний член популяції" описує властивості популяції пептидних кон'югатів згідно з винаходом, в яких безліч ідентичних акцепторних сайтів на пептиді містить вибраний процент модифікованого цукру, приєднаного до пептиду. Термін "в основному, кожний член популяції", що згадується в зв'язку з "гомогенністю" цих сайтів на пептиді, кон'югованому з модифікованим цукром, відноситься до кон'югатів згідно з винаходом, які є гомо 89364 24 генними щонайменше приблизно на 80%, переважно, приблизно щонайменше на 90%, а більш переважно, приблизно щонайменше на 95%. Термін "'гомогенність" відноситься до структурного складу всієї популяції акцепторних фрагментів, з якими кон'юговані модифіковані цукри. Так, наприклад, кажуть, що пептидний кон'югат згідно з винаходом, в якому кожний фрагмент модифікованого цукру кон'югований з акцепторним сайтом, що має таку ж структуру, як і акцепторний сайт, з яким кон'югований будь-який інший модифікований цукор, є гомогенним приблизно на 100%. Гомогенність звичайно виражена у вигляді інтервалу значень. Нижня межа інтервалу гомогенності для пептидних кон'югатів становить приблизно 60%, приблизно 70% або приблизно 80%, а верхня межа інтервалу частоти для пептидних кон'югатів становить приблизно 70%, приблизно 80%, приблизно 90% або більш, ніж приблизно 90%. Якщо пептидні кон'югати мають гомогенність, що дорівнює або складає приблизно більше 90%, то їх гомогенність також, переважно, виражена у вигляді інтервалу значень. Нижня межа інтервалу гомогенності для пептидних кон'югатів становить приблизно 90%, приблизно 92%, приблизно 94%, приблизно 96% або приблизно 98%. Верхня межа інтервалу гомогенності для пептидних кон'югатів становить приблизно 92%, приблизно 94%, приблизно 96%, приблизно 98% або приблизно 100%. Чистоту пептидних кон'югатів звичайно визначають одним або декількома методами, відомими фахівцям, наприклад, з допомогою рідинної хроматографії-мас-спектрометрії (РХ-МС), лазерної десорбційної часопролітної мас-спектрометрії (MALDITOF), капілярного електрофорезу і т.п. Терміни "по суті, однорідна глікозильована форма" або "по суті, однорідна картина глікозилювання", якщо вони відносяться до глікопептидів, означають процент акцепторних фрагментів, глікозильованих під дією глікозилтрансферази, що представляє інтерес (наприклад, фукозилтрансферази). Так, наприклад, у випадку α-1,2фукозилтрансферази, по суті, однорідна картина фукозилювання спостерігається в тому випадку, коли в пептидному кон'югаті згідно з винаходом фукозильовані майже всі (як визначено нижче) фрагменти Galβ1,4-GlcNac-R і їх сіаліловані аналоги. Для фахівців в цій галузі очевидно, що початковий матеріал може містити глікозильовані акцепторні фрагменти (наприклад, фукрозильовані молекули Galβ1,4-GlcNac-R). Таким чином, обчислений процент глікозилювання означає число акцепторних фрагментів, глікозильованих способами згідно з винаходом, а також число акцепторних фрагментів, які вже були глікозильовані в початковому матеріалі. Слово "по суті", що входить у вищезгадане визначення терміну "по суті, однорідний" звичайно означає, що акцепторні фрагменти для конкретної глікозилтрансферази глікозильовані щонайменше приблизно на 40% щонайменше приблизно на 70% щонайменше приблизно на 80% або, переважно щонайменше приблизно на 90%, а ще більш переважно щонайменше приблизно на 95%. 25 Якщо групи-замісники визначаються їх стандартними хімічними формулами, записаними зліва направо, то вони в рівній мірі включають хімічно ідентичні замісники, що мають структурну формулу, яка повинна бути записана справа наліво, наприклад, -СН2О- також означає -ОСН2-. Термін "алкіл", сам по собі або що становить частину іншого замісника, якщо це не обумовлено особливо, означає радикал з лінійним або розгалуженим ланцюгом або циклічний вуглеводневий радикал, або їх комбінацію, які можуть бути повністю насиченими, моно- або поліненасиченими і можуть включати ди- і полівалентні радикали, що мають вказане число атомів вуглецю (тобто С1-С10 має від одного до десяти атомів вуглецю). Прикладами насичених вуглеводневих радикалів є, але не обмежуються ними, такі групи, як метил, етил, н-пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил, втор-бутил, циклогексил, (циклогексил)метил, циклопропілметил і їх гомологи і ізомери, наприклад, н-пентил, н-гексил, н-гептил, ноктил і т.п. Ненасиченою алкільною групою є алкільна група, що має один або декілька подвійних або потрійних зв'язків. Прикладами ненасичених алкільних груп є, але необмежуються ними, вініл, 2-пропеніл, кротил, 2-ізопентеніл, 2-(бутадієніл), 2,4-пентадієніл, 3-(1,4-пентадієніл), етиніл, 1- і 3пропініл, 3-бутиніл і вищі гомологи і ізомери. Термін "алкіл", якщо це не обумовлено особливо, також означає похідні алкілу, більш детально визначені нижче, такі як "гетероалкіл". Алкільні групи, обмежені вуглеводневими групами, називаються "гомоалкілами". Термін "алкілен" сам по собі або що складає частину іншого замісника, якщо це не обумовлено особливо, означає двовалентний радикал, що походить від алкану, прикладами якого є, але не обмежуються ними, -СН2СН2СН2СН2-, і який, крім того, включає групи, визначені нижче як "гетероалкілен". Звичайно, алкільна (або алкіленова) група має від 1 до 24 атомів вуглецю, однак, згідно з даним винаходом, переважними є групи, що мають 10 або менше атомів вуглецю. "Нижчий алкіл" або "нижчий алкілен" являє собою алкільну або алкіленову групу з більш коротким ланцюгом, що звичайно має вісім або менше атомів вуглецю. Терміни "алкокси", "алкіламіно" або "алкілтіо" (або тіоалкокси) використовуються в їхньому загальноприйнятому значенні і означають алкільні групи, приєднані до іншої частини молекули за допомогою атома кисню, аміногрупи або атома сірки, відповідно. Термін "гетероалкіл", сам по собі або в комбінації з іншим терміном, означає, якщо це не обумовлено особливо, стабільний радикал з лінійним або розгалуженим ланцюгом або циклічний вуглеводневий радикал, або їх комбінації, що складаються з вказаного числа атомів вуглецю і щонайменше одного гетероатома, вибраного з групи, що складається з О, N, Si і S, де атоми азоту і сірки можуть бути, але необов'язково, окисленими, а гетероатом азоту може бути, але необов'язково, кватернізований. Гетероатом(и) О, N, S і Si може (можуть) знаходитися в будь-якому внутрішньому положенні гетероалкільної групи або в положенні, 89364 26 в якому алкільна група приєднана до іншої частини молекули. Прикладами таких груп є, але не обмежуються ними, -СН2-СН2-О-СН3, -CH2-CH2NH-СН3, -CH2-CH2-N(CH3)-CH3, -СН2-S-СН3-СН3, СН2-СН2, -S(O)-CH3, -СН2-СН2-S(O)2-CH3, -CH-CHO-CH3, -Si(CH3)3, -CH2-CH=N-OCH3 і -CH=CHN(CH3)-CH3. Два гетероатоми можуть бути розташовані один за одним, наприклад, -CH2-NH-ОСН3 і -CH2-O-Si(CH3)3. Аналогічним чином, термін "гетероалкілен", сам по собі або як частина іншого замісника, означає двовалентний радикал, що походить від гетероалкілу, прикладами якого є, але не обмежуються ними, -CH2-CH2-S-CH2-CH2- і -CH2-SCH2-CH2-NH-CH2-. У разі гетероалкіленових груп, гетероатоми можуть також бути присутніми на будь-якому кінці або на обох кінцях ланцюга (наприклад, в алкіленокси-, алкілендіокси-, алкіленаміно-, алкілендіаміногрупах і т.п.). Крім того, у випадку алкіленових і гетероалкіленових лінкерних груп, орієнтація лінкерних груп не повинна обов'язково відповідати напряму, в якому записана формула такої лінкерної групи. Так, наприклад, формула -C(O)2R' представляє структуру, яка може бути записана формулами -C(O)2R' і -R'C(O)2-. Терміни "циклоалкіл" і "гетероциклоалкіл", самі по собі або в комбінації з іншими термінами, означають, якщо це не обумовлено особливо, циклічні варіанти "алкілу" і "гетероалкілу", відповідно. Крім того, у випадку гетероциклоалкілу, гетероатом може знаходитися в положенні, в якому вказаний гетероцикл приєднаний до іншої частини молекули. Прикладами циклоалкілу є, але не обмежуються ними, циклопентил, циклогексил, 1циклогексеніл, 3-циклогексеніл, циклогептил і т.п. Прикладами гетероциклоалкілів є, але не обмежуються ними, 1-(1,2,5,6-тетрагідропіридил), 1піперидиніл, 2-піперидиніл, 3-піперидиніл, 4морфолініл, 3-морфолініл, тетрагідрофуран-2-іл, тетрагідрофуран-3-іл, тетрагідротієн-2-іл, тетрагідротієн-3-іл, 1-піперазиніл, 2-піперазиніл і т.п. Терміни "галогено" або "галоген" самі по собі або як частина іншого замісника означають, якщо це не обумовлено особливо, атом фтору, хлору, брому або йоду. Крім того, терміни, такі як "галогеналкіл" означають моногалогеналкіл і полігалогеналкіл. Так, наприклад, термін "галоген(С1С4)алкіл" включає, але не обмежується ними, трифторметил, 2,2,2-трифторетил, 4-хлорбутил, 3бромпропіл і т.п. Термін "арил" означає, якщо це не обумовлено особливо, поліненасичений ароматичний замісник, який може являти собою одиночне кільце або множину кілець (переважно, від 1 до 3 кілець), які є або конденсованими, або ковалентно зв'язаними один з одним. Термін "гетероарил" означає арильні групи (або кільця), що містять від одного до чотирьох гетероатомів, вибраних з Ν, Ο і S, де атоми азоту і сірки можуть бути, але необов'язково, окисленими, а атом(и) азоту є, але необов'язково, кватернізованим(ими). Гетероарильна група може бути приєднана до іншої частини молекули за допомогою гетероатома. Необмежувальними прикладами арильних і гетероарильних груп є феніл, 1-нафтил, 2-нафтил, 4-біфеніл, 1-піроліл, 2піроліл, 3-піроліл, 3-піразоліл, 2-імідазоліл, 4 27 імідазоліл, піразиніл, 2-оксазоліл, 4-оксазоліл, 2феніл-4-оксазоліл, 5-оксазоліл, 3-ізоксазоліл, 4ізоксазоліл, 5-ізоксазоліл, 2-тіазоліл, 4-тіазоліл, 5тіазоліл, 2-фурил, 3-фурил, 2-тієніл, 3-тієніл, 2піридил, 3-піридил, 4-піридил, 2-піримідил, 4піримідил, 5-бензотіазоліл, пуриніл, 2бензімідазоліл, 5-індоліл, 1-ізохіноліл, 5-ізохіноліл, 2-хіноксалініл, 5-хіноксалініл, 3-хіноліл, тетразоліл, бензо[b]фураніл, бензо[b]тієніл, 2,3дигідробензо[1,4]діоксин-6-іл, бензо[1,3]діоксол-5іл і 6-хіноліл. Замісники для кожної з вищеописаних арильних і гетероарильних циклічних систем вибрані з групи прийнятних замісників, описаних нижче. Скорочено, термін "арил", якщо він використовується в комбінації з іншими термінами (наприклад, арилокси, арилтіокси, арилалкіл), включає арильні і гетероарильні кільця, визначені вище. Так, наприклад, термін "арилалкіл" означає радикали, в яких арильна група приєднана до алкільної групи (наприклад, бензил, фенетил, піридилметил і т.п.), включаючи алкільні групи, в яких атом вуглецю (наприклад, метиленова група) замінений, наприклад, на атом кисню (наприклад, феноксиметил, 2-піридилоксиметил, 3-(1нафтилокси)пропіл і т.п.). Кожний з вищезгаданих термінів (наприклад, "алкіл", "гетероалкіл", "арил" і "гетероарил") означає як заміщені, так і незаміщені форми вказаного радикала. Переважні замісники для кожного типу радикала описані нижче. Замісники для алкільних і гетероалкільних радикалів (включаючи такі групи, які часто називаються алкіленом, алкенілом, гетероалкіленом, гетероалкенілом, алкінілом, циклоалкілом, гетероциклоалкілом, циклоалкенілом і гетероциклоалкенілом) мають загальну родову назву "замісники алкільних груп" і ці замісники можуть являти собою одну або декілька різних груп, вибраних з груп, але що не обмежуються ними, -OR', =O, =NR', =N-OR', -NR'R", -SR', галоген, -SiR'R"R'", -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R"-, NR'C(O)R', -NR'C(O)NR'R"', -NR"C(O)2R', -NR-C(NR'R'R"')=NR"", NR-C(NR'R")=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R", NRSO2R', -CN і -NO2, де число замісників складає від 0 до 2m'+1, а m' означає загальне число атомів вуглецю в такому радикалі. Кожен з R', R", R'" і R"" незалежно і переважно означає водень, заміщений або незаміщений гетероалкіл, заміщений або незаміщений арил, наприклад, арил, заміщений 13 галогенами, заміщеною або незаміщеною алкільною, алкокси або тіоалкоксигрупами, або арилалкільними групами. Якщо сполука згідно з винаходом, наприклад, включає більш, ніж одну групу R, то кожна група R незалежно вибрана з груп R', R", R'" і R"", якщо присутня більше, ніж одна з цих груп. Якщо R' і R" приєднані до одного і того ж атома азоту, то ці групи, разом з атомом азоту, утворюють 5-, 6- або 7-членне кільце. Так, наприклад, -NR'R" включає, але не обмежується ними, 1-піролідиніл і 4-морфолініл. Виходячи з вищезазначеного обговорення замісників очевидно, що термін "алкіл" означає групи, що включають атоми вуглецю, зв'язані з групами, що не є водневими групами, такі як галогеналкіл (наприклад, -CF3 і 89364 28 CH2CF3) і ацил (наприклад, -С(О)СН3, -C(O)CF3, С(О)СН2ОСН3 і т.п.). Аналогічно замісникам, описаним для алкільного радикала, замісники для арильних і гетероарильних радикалів мають загальну родову назву "замісники арильних груп". Такі замісники вибрані, наприклад, з галогену, -OR1, =O, =NR', =N-OR', NR'R", -SR', -галогену, -SiR'R"R'", -OC(O)R, C(O)R', -CO2R', -CONR'R", -OC(O)NR'R"-, NR'C(O)R', -NR'-C(O)NR'R''', -NR"C(O)2R', -NRC(NR'R'R"')=NR"", -NR-C(NR'R")=NR"', -S(O)R', S(O)2R', -S(O)2NR'R", -NRSO2R', -CN і -NO2, -R', -N3, -CH(Ph)2, фтор(С1-C4)алкокси і фтор(С1-С4)алкілу, де число замісників складає в межах від 0 до загального числа вільних валентностей на ароматичній системі, де R', R", R'" і R"" переважно і незалежно вибрані з водню, заміщеного або незаміщеного алкілу, заміщеного або незаміщеного гетероалкілу, заміщеного або незаміщеного арилу, і заміщеного або незаміщеного гетероарилу. Якщо сполука згідно з винаходом, наприклад, включає більш, ніж одну групу R, то кожна група R незалежно вибрана з груп R', R", R"' і R"", якщо присутня більш, ніж одна з цих груп. У наведених нижче схемах, символ X являє собою "R", визначений вище. Два замісники на суміжних атомах арилу або гетероарилу можуть бути, але необов'язково, замінені замісником формули -T-C(O)-(CRR')q-U, де Τ і U незалежно являють собою -NR-, -О, -CRR' або простий зв'язок, a q дорівнює цілому числу від О до 3. Альтернативно, два замісники на суміжних атомах арильного або гетероарильного кільця можуть бути, але необов'язково, замінені замісником формули А-(СН2)r-В-, де А і В незалежно являють собою -CRR'-, -О-, -NR-, -S-, -S(O)-, -S(O)2-, S(O)2NR' або простий зв'язок, а г дорівнює цілому числу від 1 до 4. Один з простих зв'язків утвореного таким чином нового кільця може бути, але необов'язково, замінений подвійним зв'язком. Альтернативно, два замісники на суміжних атомах арильного або гетероарильного кільця можуть бути, але необов'язково, замінені замісником формули (CRR')s-X-(R'R"')d де s і d незалежно дорівнюють цілому числу від 0 до 3, а X являє собою О-, -NR'-, -S-, -S(O)-, -S(O)2-або S(O)2NR'-. Замісники R, R', R" і R'", переважно, незалежно вибрані з водню або заміщеного або незаміщеного (С1C6)алкілу. Використовуваний тут термін "гетероатом" означає кисень (О), азот (N), сірку (S) і кремній (Si). Вступ Даний винахід відноситься до способу модифікації гліканової структури на G-CSF. G-CSF добре відомий фахівцям як цитокін, що продукується активованими Т-клітинами, макрофагами, ендотеліальними клітинами і стромальними фібробластами. G-CSF діє, головним чином, на кістковий мозок і підвищує рівень продукування запальних лейкоцитів, і, крім того, цей цитокін функціонує як ендокринний гормон, ініціюючи поповнення нейтрофілів, витрачених в процесі запальних реакцій. G-CSF також знаходить клінічне застосування у відновленні кісткового мозку після хіміотерапії. 29 Даний винахід відноситься до кон'югату гранулоцитарного колонієстимулюючого фактора (GCSF). Даний винахід також відноситься до кон'югатів глікозильованих і неглікозильованих пептидів, що мають гранулоцитарну колонієстимулюючу активність. Такі кон'югати можуть бути також модифіковані шляхом додаткового кон'югування з іншими молекулами, такими як терапевтичні молекули, діагностичні молекули, молекули для націленої доставки і т.п. Даний винахід також відноситься до способу ремоделювання і/або модифікації G-CSF. G-CSF є цінним засобом для лікування різних захворювань, але як було вказано вище, його клінічна ефективність обмежена його відносно поганою фармакокінетикою. У репрезентативних варіантах винаходу, пептид G-CSF згідно з винаходом може бути введений для попередження інфекції у ракових пацієнтів, що зазнають променевої терапії певного типу, хіміотерапії і трансплантації кісткового мозку, з метою мобілізації клітин-попередників для збору трансплантованих клітин-попередників периферичної крові, для лікування важкої хронічної або відносної лейкопенії, незалежно від причини, що її викликала, і для підтримуючої терапії пацієнтів з гострим мієлоїдним лейкозом. Крім того, поліпептидний кон'югат або композиція згідно з винаходом можуть бути використані для лікування СНІД'у або інших імунодефіцитних захворювань, а також бактерійних інфекцій. G-CSF був клонований і секвенований. У репрезентативному варіанті винаходу, G-CSF має амінокислотну послідовність, представлену в SEQ ID NО:1. Для будь-якого фахівця абсолютно очевидно, що даний винахід не обмежується описаними тут послідовностями, а також варіантами GCSF, що обговорюються вище. Так, наприклад, даний винахід також охоплюють варіанти G-CSF, добре відомі фахівцям. Як приклад, що не обмежує даний винахід, може служити варіант G-CSF, що розглядається в патенті США №6166183, в якому описаний G-CSF, що містить природний комплемент лізинових залишків і приєднаний до однієї молекули або до двох молекул поліетиленгліколю. Крім того, в патентах США №№6004548, 5580755, 5582823 і 5676941 описаний варіант G-CSF, в якому один або декілька цистеїнових залишків в положенні 17, 36, 42, 64 і 74 замінені на аланін або, альтернативно, на серии. У патенті США №5416195 описана молекула G-CSF, в якій цистеїн в положенні 17, аспарагінова кислота в положенні 27 і серини в положеннях 65 і 66 замінені на серии, серии, пролін і пролін, відповідно. Фахівцям добре відомі й інші варіанти, і ці варіанти описані, наприклад, в патенті США №5399345. Інші варіанти мають амінокислотну послідовність, вибрану з SEQ ID NО:3-11. Експресія і активність модифікованої молекули G-CSF згідно з винаходом може бути проаналізована методами, добре відомими фахівцям, і описаними, наприклад, в патенті США №4810643. Так, наприклад, активність може бути виміряна за допомогою аналізів на поглинання радіоактивно міченого тимідину. Коротко, кістковий мозок, взятий 89364 30 від здорової людини, розрізають в градієнті щільність фікола-гіпака (1,077г/мл, Pharmacia Piscataway, NJ), і клітини з низькою щільністю суспендують в середовищі Ісков (GIBCO, La Jolla, CA), що містить 10% фетальну бичачу сироватку, глутамін і антибіотики. Приблизно 2´104 клітин людського кісткового мозку інкубують або з контрольним середовищем, або з G-CSF згідно з винаходом в 96-ямковому плоскодонному планшеті приблизно при 37°С в атмосфері повітря з 5% СО2 протягом приблизно 2 днів. Потім, на культури протягом приблизно 4 годин подають імпульси 0,5мкКі/ямку 3Н-тимідину (New England Nuclear, Boston, Mass.) і вимірюють рівень поглинання, як описано, наприклад, в роботі Ventua et al. (1983, Blood 61: 781). Збільшення рівня включення 3Нтимідину в клітини кісткового мозку людини, в порівнянні з клітинами кісткового мозку, обробленого контрольною сполукою, є показником активності і стабільності сполуки G-CSF. Як описано вище, кон'югати згідно з винаходом утворюються за допомогою ферментативного приєднання модифікованого цукру до глікозильованого або неглікозильованого пептиду G-CSF. Модифікований цукор, якщо він знаходиться між пептидом G-CSF і модифікуючою групою на цукрі, буде утворювати групу, яка може називатися тут, наприклад, "інтактною глікозильною лінкерною групою". Із застосуванням способу згідно з винаходом, в якому передбачається використання у високому ступені селективних ферментів, таких як глікозилтрансферази, можна отримати пептиди, що несуть потрібну групу в одному або декількох специфічних положеннях. Крім того, за даним винаходом, модифікований цукор приєднують безпосередньо у вибраному сайті пептидного ланцюга G-CSF, або, альтернативно, модифікований цукор приєднують до вуглеводної частини глікопептиду. Пептиди, в яких модифіковані цукри зв'язані з вуглеводом глікопептиду і безпосередньо зв'язані з амінокислотним залишком пептидного кістяка GCSF, також входять в об'єм даного винаходу. На відміну від відомих стратегій хімічного і ферментативного синтезу пептидів, способи згідно з винаходом дають можливість отримувати пептиди і глікопептиди, які мають, по суті, гомогенний характер дериватизації; причому, ферменти, що використовуються в даному винаході, є, по суті, селективними до конкретного амінокислотного залишку або до комбінації амінокислотних залишків пептиду G-CSF. Такі способи також дозволяють здійснювати крупномасштабне продукування модифікованих пептидів і глікопептидів. Таким чином, способи згідно з винаходом можуть знайти практичне застосування в крупномасштабному синтезі глікопептидів, що мають заздалегідь вибраний однорідний характер дериватизації. Ці способи є особливо прийнятними для модифікації терапевтичних пептидів, включаючи, але не обмежуючись ними, глікопептиди, які не повністю глікозилюються в процесі їх синтезу в клітинних культурах (наприклад, в клітинах ссавців, комах, рослин, грибів, дріжджів або прокаріотів) або в трансгенних рослинах або тваринах. 31 89364 32 Даний винахід також відноситься до кон'югатів глікозильованих і неглікозильованих пептидів GCSF з підвищеним терапевтичним часом напівжиття, що зумовлено, наприклад, зниженою швидкістю кліренсу або зниженою швидкістю поглинання імунною або ретикулоендотеліальною системою (РЕС). Крім того, способи згідно з винаходом дозволяють здійснювати маскування антигенних детермінант на пептидах, що приводить до зниження або запобігання виробленню імунної відповіді хазяїна проти даного пептиду. Селективне приєднання агентів для націленої доставки може також застосовуватися для доставки пептиду в конкретну тканину або на рецептор клітинної поверхні, який є специфічним по відношенню до конкретного націлюючого агента. Кон'югати У першому своєму аспекті, даний винахід відноситься до кон'югату, що складається з селективної модифікуючої групи і пептиду G-CSF. Зв'язок між пептидом G-CSF і вибраним фрагментом включає інтактну глікозильну лінкерну групу, розташовану між пептидом і вибраним фрагментом. Як обговорюється в даному описі, вибраним фрагментом може бути, по суті, будьякий фрагмент, який здатний приєднуватися до сахаридної ланки, внаслідок чого утворюється "модифікований цукор", розпізнаваний відповідним ферментом трансферазою, який приєднує модифікований цукор до пептиду G-CSF. Сахаридний компонент модифікованого цукру, якщо він розташований між пептидом G-CSF і вибраним фрагментом, стає "інтактною глікозильною лінкерною групою". Така глікозильна лінкерна група утворюється з будь-якого моно- або олігосахариду, який, після модифікації вибраним фрагментом, являє собою субстрат для відповідної трансферази. Кон'югати згідно з винаходом звичайно відповідають загальній структурі: в якій символи а, b, с, d і s означають позитивне ціле число, що не дорівнює нулю, а t дорівнює 0 або є позитивним цілим числом. Термін "агент" звичайно означає водорозчинний фрагмент, наприклад, залишок ПЕГ. Термін "лінкер" може включати широкий набір будь-яких зв'язувальних груп, див. нижче. Альтернативно, лінкер може являти собою простий зв'язок або "лінкер нульового порядку". У репрезентативному варіанті винаходу, вибраною модифікуючою групою є водорозчинний полімер, наприклад, м-ПЕГ. Такий водорозчинний полімер ковалентно пов'язаний з пептидом G-CSF за допомогою глікозильної лінкерної групи, яка ковалентно приєднана до амінокислотного залишку або до глікозильного залишку пептиду G-CSF. Даний винахід також відноситься до кон'югатів, в яких амінокислотний залишок і глікозильний залишок модифіковані глікозильною лінкерною групою. Репрезентативним водорозчинним полімером є поліетиленгліколь, наприклад, метоксиполіетиленгліколь. Поліетиленгліколь, що використовується в даному винаході, не обмежений якоюнебудь конкретною формою або молекулярною масою. Для нерозгалужених молекул поліетиленгліколю, молекулярна маса, переважно, становить 500-100000. Переважна молекула має молекулярну масу 2000-60000, а більш переважна, приблизно від 5000 до 30000. В іншому варіанті винаходу, вказаний поліетиленгліколь являє собою розгалужений ПЕГ, що має більш, ніж один приєднаний залишок ПЕГ. Приклади розгалужених ПЕГ описані в патентах США №№5932462, 5342940, 5643575, 5919455, 6113906, 5183660; в WO 02/09766 і у Kodera Y, Bioconjugate Chemistry 5:283-288 (1994) і Yamasaki et al., Agric. Biol. Chem., 52:2125-2127, 1998. Інші відповідні розгалужені структури ПЕГ описані в даній заявці. У репрезентативних варіантах винаходу, молекулярна маса кожного розгалуженого поліетиленгліколю (ПЕГ) дорівнює або перевищує приблизно 2000, 5000, 10000, 15000, 20000, 40000 або 60000 дальтон. Пептиди згідно з винаходом включають щонайменше сайт Ν- або О-зв'язаного глікозилювання. Крім кон'югатів, які утворюються за допомогою глікозильної лінкерної групи, що приєднується ферментативно, даний винахід відноситься до кон'югатів, які є у високій мірі гомогенними за своїм характером заміщення. Із застосуванням способів згідно з винаходом можуть бути отримані пептидні кон'югати, в яких майже всі модифіковані цукрові групи по всій популяції кон'югатів згідно з винаходом приєднані до множини копій структурно ідентичних амінокислотних або глікозильних залишків. Таким чином, у другому своєму аспекті, даний винахід відноситься до пептидного кон'югату, що має сукупність водорозчинних полімерних фрагментів, які ковалентно зв'язані з пептидом G-CSF за допомогою інтактної глікозильної лінкерної групи. У переважному кон'югаті згідно з винаходом, по суті, кожен член такої групи зв'язаний через глікозильну лінкерну групу з глікозильним залишком пептиду G-CSF, а кожен глікозильний залишок пептиду GCSF, до якого приєднана глікозильна лінкерна група, має ідентичну структуру. Даний винахід також відноситься до пептидного кон'югату, що має групу водорозчинних полімерних фрагментів, ковалентно зв'язаних один з одним за допомогою глікозильної лінкерної групи. У переважному варіанті винаходу, по суті, кожен член групи водорозчинних полімерних фрагментів зв'язаний з амінокислотним залишком пептиду G 33 CSF за допомогою глікозильної лінкерної групи, а кожний амінокислотний залишок, що містить приєднану глікозильну лінкерну групу, має ідентичну структуру. Даний винахід також відноситься до кон'югатів, аналогічних кон'югатам, описаним вище, в яких пептид G-CSF кон'югований з терапевтичною молекулою, діагностичною молекулою, націлюючою молекулою, молекулою токсину або т.п. за допомогою інтактної глікозильної лінкерної групи. Кожна з вищезгаданих молекул може являти собою невелику молекулу, природний полімер (наприклад, поліпептид) або синтетичний полімер. По суті, будь-який пептид гранулоцитарного колонієстимулюючого фактора або агент, що має будь-яку послідовність, може бути використаний як пептидний компонент кон'югатів згідно з винаходом. Був клонований і секвенований гранулоцитарний колонієстимулюючий фактор. У репрезентативному варіанті винаходу, пептид G-CSF має послідовність, представлену в SEQ ID NО:1: В іншому репрезентативному варіанті винаходу, пептид G-CSF має послідовність, представлену в SEQ ID NО:2: В іншому репрезентативному варіанті винаходу, пептид G-CSF має послідовність, представлену нижче в SEQ ID NО:3-11: 89364 34 35 Даний винахід не обмежується представленими тут послідовностями. У репрезентативному варіанті винаходу, пептиди G-CSF згідно з винаходом включають щонайменше один сайт О-зв'язаного глікозилювання, який глікозильований глікозильним залишком, що включає фрагмент ПЕГ. ПЕГ ковалентно зв'язаний з пептидом G-CSF за допомогою інтактної глікозильної лінкерної групи. Така глікозильна лінкерна група ковалентно зв'язана або з амінокислотним залишком, або з глікозильним залишком пептиду G-CSF. Альтернативно, глікозильна лінкерна група приєднана до одного або декількох глікозильних ланок глікопептиду. Даний винахід також відноситься до кон'югатів, в яких глікозильна лінкерна група приєднана до амінокислотного залишку і до глікозильного залишку. ПЕГ-частина приєднана до інтактного глікозильного лінкера безпосередньо або за допомогою неглікозильного лінкера, наприклад, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу. У переважному варіанті винаходу, пептид GCSF містить групу, що має формулу І. 89364 36 де D вибраний з -ОН і R1-L-HN; G вибраний з R1-L або С(О)(С1-С6)алкілу; R1 являє собою групу, що містить фрагмент, вибраний з лінійних або розгалужених залишків поліетиленгліколю, a L означає лінкер, який вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу, за умови, що якщо D являє собою ОН, то G являє собою R1-L, а якщо G являє собою С(О)(С1-С6)алкіл, то D являє собою R1'-LNH-. В описаних тут модифікованих структурах сіалової кислоти, СООН також являє собою СООі/або його сіль. В одному з варіантів винаходу, R1-L має формулу: де а дорівнює цілому числу від 0 до 20. У репрезентативному варіанті винаходу, R1 має структуру, яка вибрана з: де e і f незалежно дорівнюють цілим числам, вибраним з 1-2500, a q дорівнює цілому числу від 1 до 20. В інших варіантах винаходу, R1 має структуру, яка являє собою член, вибраний з: 37 89364 38 де e, f i f дорівнюють цілим числам, незалежно вибраним з 1-2500, a q і q' означають цілі числа, незалежно вибрані з 1-20. У ще одному своєму варіанті, даний винахід відноситься до кон'югату пептиду фактора IX, де R1 має структуру, яка вибрана з: де e, f і f' незалежно дорівнюють цілим числам, вибраним з 1-2500, a q, q' і q" дорівнюють цілим числам, незалежно вибраним з 1-20. В інших варіантах винаходу, R1 має структуру, яка вибрана з: де e і f незалежно дорівнюють цілим числам, вибраним з 1-2500. У ще одному своєму репрезентативному варіанті, даний винахід відноситься до пептиду, що містить групу, що має формулу: 39 89364 40 глікозильний залишок) приєднаний до амінокислоти. У ще одному репрезентативному варіанті винаходу, пептид містить групу формули: де Gal може бути приєднаний до амінокислотного або до глікозильного залишку, який безпосередньо або опосередковано (наприклад, через глікозильний залишок) приєднаний до амінокислоти. В інших варіантах винаходу, молекула має формулу: де GalNac може бути приєднаний до амінокислотного або до глікозильного залишку, який безпосередньо або опосередковано (наприклад, через де a, b, c, d, i, r, s, t і u незалежно дорівнюють цілим числам, вибраним з 0 і 1. Індекс q дорівнює 1. Індекси e, f, g і h незалежно дорівнюють цілим числам, вибраним з цілих чисел від 0 до 6. Індекси j, k, l і m дорівнюють цілим числам, незалежно вибраним з цілих чисел від 0 до 100. Індекси v, w, x і у незалежно дорівнюють числу, вибраному з 0 і 1, а щонайменше один з v, w, x і у дорівнює 1. Символ АА означає амінокислотний залишок пептиду G-CSF. Символ Sia-(R) означає групу, що має формулу: 1 де D вибраний з -ОН і R -L-HN. Символ G означає R1-L- або -С(О)(С1-С6)алкіл. R1 являє собою групу, яка включає лінійний або розгалужений залишок поліетиленгліколю. L являє собою лінкер, який вибраний із зв'язку, заміщеного або незаміщеного алкілу і заміщеного або незаміщеного гетероалкілу. У загальних рисах, якщо D означає де АА являє собою амінокислотний залишок вказаного пептиду, а в кожній з вищезгаданих структур, D і G є такими, як вони були визначені в описі даного винаходу. Репрезентативним амінокислотним залишком пептиду G-CSF, в якому одна або декілька вищезгаданих молекул може бути кон'югована, є серин і треонін, наприклад, треонін 133 SEQ ID NО:1. В іншому своєму репрезентативному варіанті, даний винахід відноситься до кон'югату G-CSF, який включає глікозильний залишок, що має формулу: ОН, то G означає R1-L, і якщо G означає -С(О)(С1С6)алкіл, то D означає R1-L-NH-. В іншому репрезентативному варіанті винаходу, ПЕГ-модифікований фрагмент сіалової кислоти в кон'югаті згідно з винаходом має формулу: де індекс "s" означає ціле число від 0 до 20, а n дорівнює цілому числу від 1 до 2500. У переважному варіанті винаходу, s дорівнює 1, а м-ПЕГчастина має молекулярну масу приблизно 20кД. У ще одному репрезентативному варіанті винаходу, ПЕГ-модифікована сіалова кислота має формулу: 41 де L являє собою заміщену або незаміщену алкільну або заміщену або незаміщену гетероалкільну лінкерну групу, що з'єднує молекулу сіалової кислоти і молекулу ПЕГ. У переважному варіанті винаходу щонайменше два, більш переважно, три, а ще більш переважно, чотири вищезазначених аспарагінових залишки фунціоналізовані вищезгаданим Nзв'язаним глікановим ланцюгом. Кон'югати згідно з винаходом включають інтактні глікозильні лінкерні групи, які є одновалентними або полівалентними (наприклад, "антенні" структури). Так, наприклад, кон'югати згідно з винаходом включають обидві молекули, в яких вибрана група приєднана до пептиду за допомогою одновалентної глікозильної лінкерної групи і полівалентної лінкерної групи. Даний винахід також включає кон'югати, в яких більш, ніж одна вибрана молекула приєднана до пептиду за допомогою полівалентної лінкерної групи. Модифікований цукор Даний винахід відноситься до модифікованого цукру, до модифікованих цукровмісих нуклеотидів і до кон'югатів модифікованого цукру. У модифікованих цукровмісих сполуках згідно з винаходом, цукрова група, переважно, являє собою сахарид, дезокси-сахарид, аміно-сахарид або Nацилсахарид. Термін "сахарид" і його еквіваленти, "сахарил", "цукор" і "глікозил" означають мономери, димери, олігомери і полімери. Така цукрова група також функціоналізована модифікуючою групою. Ця модифікуюча група кон'югована з цукровою групою, звичайно, за допомогою кон'югування з аміном, сульфгідрилом або гідроксилом, наприклад, з первинним гідроксилом на вказаному цукрі. У репрезентативному варіанті винаходу, модифікуюча група приєднана до цукру за допомогою аміногрупи, наприклад, за допомогою аміду, уретану або сечовини, яка утворюється внаслідок реакції аміну з реакційноздатним похідним модифікуючої групи. Як цукровий "кістяк" кон'югатів згідно з винаходом може бути використаний будь-який цукор. Репрезентативними цукрами, які можуть бути використані для отримання композицій згідно з винаходом, є, але не обмежується ними, глюкоза, галактоза, маноза, фукоза і сіалова кислота. Іншими відповідними цукрами є аміноцукри, такі як глюкозамін, галактозамін, манозамін, 5-аміновий аналог сіалової кислоти і т.п. Вказаний цукровий кістяк може мати структуру, що виявляється в природі, або він може бути модифікований з утворенням 89364 42 сайту для кон'югування з модифікуючою групою. Так, наприклад, в одному з своїх варіантів, даний винахід відноситься до пептидного кон'югату, що містить похідне сіалової кислоти, в якому 9гідроксигрупа замінена на амін. Цей амін легко дериватизується активованим аналогом вибраної модифікуючої групи. В обговоренні даного винаходу проілюстроване використання вибраних похідних сіалової кислоти. Фахівцям в даній галузі очевидно, що таке обговорення наводиться лише в ілюстративних цілях, і що описані тут структури і композиції, по суті, можуть бути застосовані до всіх видів сахаридних груп, модифікованих сахаридних груп, активованих модифікованих сахаридних груп і кон'югатів модифікованих сахаридних груп. У своєму репрезентативному варіанті, даний винахід відноситься до пептидного кон'югату, що містить аміно-модифікований цукор, що має формулу: де G являє собою глікозильну групу, L являє собою зв'язок або лінкер, a R1 являє собою модифікуючу групу. Репрезентативним зв'язком є зв'язок, який утворюється між NH2 на глікозильній частині і групою з відповідною реактивністю на модифікуючій групі. Таким чином, репрезентативними зв'язками є, але не обмежуються ними, NHR1, OR1, SR1 і т.п. Так, наприклад, якщо R1 включає групу карбонової кислоти, то ця група може бути активована і зв'язана з групою NIV на глікозильному залишку з утворенням зв'язку, що має структуру NHC(O)R1. Аналогічним чином, групи ОН і SH можуть бути перетворені у відповідні ефірні або тіоефірні похідні, відповідно. Репрезентативними лінкерами є алкільні і гетероалкільні групи. Такими лінкерами є зв'язувальні групи, наприклад, ацил-зв'язувальні групи, наприклад, -C(O)NH-, -OC(O)NH- і т.п. Лінкерні групи являють собою зв'язки, утворені між компонентами молекули згідно з винаходом, наприклад, між глікозильною групою і лінкером (L), або між лінкером і модифікуючою групою (R1). Іншими лінкерними групами є ефіри, тіоефіри і аміни. Так, наприклад, в одному з варіантів винаходу, вказаним лінкером є амінокислотний залишок, такий як гліциновий залишок. Групу карбонової кислоти гліцину перетворюють у відповідний амід шляхом взаємодії з аміном на глікозильному залишку, а амін гліцину перетворюють у відповідний амід або уретан шляхом взаємодії з активованою карбоновою кислотою або карбонатом модифікуючої групи. Іншим репрезентативним лінкером є молекула ПЕГ або молекула ПЕГ, функціоналізована амінокислотним залишком. Такий ПЕГ зв'язаний з глікозильною групою за допомогою амінокислотного залишку на одному кінці ПЕГ і з R1 на іншому кінці ПЕГ. Альтернативно, цей амінокислотний залишок зв'язаний з R1, а кінець ПЕГ, не зв'язаний з амінокислотою, приєднаний до глікозильної групи. 43 89364 44 Репрезентативна молекула NH-L-R1 має формулу: NH{C(O)(CH2)aNH}s{C(O)(CH2)b(OCH2CH2)c(CH2)dN H}tR1, де індекси s і t незалежно дорівнюють 0 або 1. Індекси a, b і d незалежно дорівнюють цілим числам від 0 до 20, а с дорівнює цілому числу від 1 до 2500. Інші аналогічні лінкери отримують на основі молекул, в яких група -NH замінена, наприклад, на -S, -О і -СН2. Більш конкретно, даний винахід відноситься до пептидного кон'югату, що містить сполуки, в яких NH-L-R1 являє собою: NHC(O)(CH2)aNHC(O)(CH2)b(OCH2CH2)c(CH2)dN HR1', NHC(O)(CH2)b(OCH2CH2)c(CH2)dNHR1, NHC(O)O(CH2)b(OCH2CH2)c(CH2)dNHR1, NHC(O)(CH2)aNHC(O)(CH2)b(OCH2CH2)c(CH2)dN HR1, NHC(O)(CH2)aNHR1, NH(CH2)aNHR1 і NHR1. У цих формулах, індекси a, b і d незалежно вибрані з цілих чисел від 0 до 20, а переважно, від 1 до 5. Індекс с дорівнює цілому числу від 1 до 2500. В ілюстративному варіанті винаходу, G являє собою сіалову кислоту, а вибрані сполуки згідно з винаходом мають формули: Як очевидно для фахівців в даній галузі, молекула сіалової кислоти в описаних вище репрезентативних сполуках може бути замінена на будьякий інший аміно-сахарид, включаючи, але не обмежуючись ними, глюкозамін, галактозамін, манозамін, їх N-ацетильні похідні і т.п. В іншому ілюстративному варіанті винаходу, первинна гідроксильна група цукру функціоналізована модифікуючою групою. Так, наприклад, 9гідроксил сіалової кислоти може бути перетворений у відповідний амін і функціоналізований з отриманням сполук згідно з винаходом. Сполуки згідно з цим варіантом винаходу мають формули: 45 В іншому своєму репрезентативному варіанті, даний винахід відноситься до пептидного кон'югату, що містить модифіковані цукри, в яких гідроксигрупа в 6-положенні перетворена у відповідну аміногрупу, що несе кластер "лінкер - модифікуюча група", такий як кластер, описаний вище. Репрезентативними цукровими групами, які можуть бути використані як кістяк цього модифікованого цукру, є Gal, GalNac, Glc, GlcNac, Fuc, Xyl, Man і т.п. Репрезентативний модифікований цукор згідно з цим варіантом винаходу має формулу: В іншому своєму репрезентативному варіанті, даний винахід відноситься до описаних вище сполук, які були активовані у вигляді відповідного цукру, що міститься в нуклеотидах. Репрезентатив 89364 46 де R3-R5 і R7 являють собою члени, незалежно вибрані з Н, ОН, С(О)СН3, NH і NHC(O)CH3, a R6 являє собою OR1, NHR1 або NH-L-R1, визначені вище. Вибрані кон'югати згідно з винаходом отримані на основі манози, галактози або глюкози, або на основі молекул, що мають стереохімічну структуру манози, галактози або глюкози. Ці кон'югати мають загальні формули: ними цукровмісими нуклеотидами, що використовуються в даному винаході в їх модифікованій формі, є моно-, ди- або трифосфати нуклеотидів або їх аналоги. У переважному варіанті 47 89364 48 винаходу, модифікований цукровмісий нуклеотид вибраний з УДФ-глюкози, ЦМФ-глікозиду або ГДФглікозиду. Ще більш переважно, щоб цукрова частина модифікованого цукровмісого нуклеотиду була вибрана з УДФ-галактози, УДФгалактозаміну, УДФ-глюкози, УДФ-глюкозаміну, ГДФ-манози, ГДФ-фукози, ЦМФ-сіалової кислоти або ЦМФ-NeuAc. У репрезентативному варіанті винаходу, фосфат нуклеотиду приєднаний до С-1. Таким чином, в своєму ілюстративному варіанті, де глікозильна група являє собою сіалову кислоту, даний винахід відноситься до пептидних кон'югатів, які були отримані з використанням сполук, що мають формули: де L-R1 має значення, визначені вище, a L-R1 являє собою лінкер, зв'язаний з модифікуючою групою. Як і у випадку L, репрезентативна лінкерна молекула у відповідності з L1 включає зв'язок, алкільні або гетероалкільні групи. Репрезентативні нуклеотидні сполуки, що містять модифікований цукор згідно з цими варіантами винаходу, подані на Фіг.1 і Фіг.2. В іншому своєму варіанті, даний винахід відноситься до кон'югату, утвореного модифікованим цукром згідно з винаходом і субстратом, наприклад, пептидом, ліпідом, агліконом і т.п., а більш конкретно, модифікованим цукром і глікозильним залишком глікопетиду або гліколіпіда. У цьому варіанті винаходу, цукрова частина вказаного модифікованого цукру стає глікозильною лінкерною групою, розташованою між субстратом і модифікуючою групою. Репрезентативною глікозильною лінкерною групою є інтактна глікозильна лінкерна група, в якій глікозильна частина або частини, що створюють лінкерну групу, не розщеплюються під дією хімічних (наприклад, під дією метаперіодату натрію) або ферментативних (наприклад, оксидазних) реакцій. Вибрані кон'югати згідно з винаходом включають модифікуючу групу, яка приєднанадо аміногрупи аміно-сахариду, наприклад, манозаміну, глюкозаміну, галактозаміну, сіалової кислоти і т.п. Репрезентативний кластер "модифікуюча група - інтактна глікозильна лінкерна група" згідно з цим варіантом отриманий на основі структури сіалової кислоти, такій як структура, що має формули: де, у вищезгаданій формулі, R1, L1 і L2 мають значення, вказані вище. У ще одному репрезентативному варіанті винаходу, кон'югат був утворений субстратом і цукровою групою в 1-положенні, і в цьому кон'югаті модифікуюча група приєднана за допомогою лінкера біля атому вуглецю в 6-положенні цукрової групи. Таким чином, ілюстративні кон'югати згідно з цим варіантом винаходу мають формули: 49 де вказані радикали є такими, як вони були описані вище. Для фахівців в даній галузі очевидно, що модифіковані цукрові групи, представлені 89364 50 вище, можуть бути також кон'юговані з субстратом біля атомів вуглецю в положеннях 2, 3, 4 або 5. Ілюстративні сполуки згідно з цим варіантом винаходу мають формули: де групи R і індекси є такими, як вони визначені вище. Даний винахід також відноситься до цукровмісих нуклеотидів, модифікованих групою L-R1 біля атому вуглецю в 6-положенні. Прикладом такої молекули згідно з цим варіантом винаходу є: де групи R і L являють собою групи, що обговорюються вище. Індекс "у" дорівнює 0, 1 або 2. Інший репрезентативний цукровмісий нуклеотид згідно з винаходом має в своїй основі стерео 51 89364 52 хімічну структуру ГДФ-манози. Репрезентативна молекула згідно з цим варіантом винаходу має структуру: У ще одному своєму репрезентативному варіанті, даний винахід відноситься до кон'югату, основаному на стереохімічній структурі УДФгалактози. Репрезентативна сполука згідно з цим варіантом винаходу має структуру: В іншому репрезентативному варіанті винаходу, цукровмісий нуклеотид має в своїй основі стереохімічну структуру глюкози. Репрезентативна молекула згідно з цим варіантом винаходу має формули: Модифікуюча група R1 являє собою будь-яку групу, включаючи, але не обмежуючись ними, водорозчинні полімери, не розчинні у воді полімери, терапевтичні агенти, діагностичні агенти і т.п. Природа репрезентативних модифікуючих груп більш детально обговорюється нижче. Модифікуючі групи Водорозчинні полімери Багато які водорозчинні полімери відомі фахівцям і можуть бути використані для здійснення даного винаходу. Термін "водорозчинний" полімер охоплює такі молекули, як сахариди (наприклад, декстран, амілозу, гіалуронову кислоту, полісіалову кислоту, гепарани, гепарини і т.п.); поліамінокислоти, наприклад, поліаспарагінову кислоту і поліглутамінову кислоту; нуклеїнові кислоти; синтетичні полімери, наприклад, поліакрилову кислоту, поліефіри, наприклад, поліетиленгліколь; пептиди, білки і т.п. Даний винахід може бути здійснено із застосуванням будь-якого водорозчинного полімеру, однак, з однією лише умовою, що такий полімер повинен мати положення, у якого може бути приєднана інша частина кон'югату. Опис методів активації полімерів можна також знайти в WO 94/17039, в патенті США №5324844, в WO 94/18247, в WO 94/04193, в патенті США №5219564, в патенті США №5122614, в WO 90/13540, в патенті США №5281698, а також в WO 93/15189, і в літературі також описані методи кон'югування активованих полімерів з пептидами, наприклад, фактором зсідання крові VIII (WO 94/15625), гемоглобіном (WO 94/09027), молекулою, що несе кисень (патент США №4412989), рибонуклеазою і супероксид-дисмутазою (Veronese et al., App. Biochem. Biotech. 11: 141-45 (1985)). Переважними водорозчинними полімерами є полімери, в яких основна частина полімерних молекул в зразку полімеру має приблизно ідентичну молекулярну масу, і такі полімери називаються "гомодисперсними". 53 Даний винахід також проілюстрований на кон'югаті поліетиленгліколю. Існує ряд статей і монографій, в яких описані функціоналізація і кон'югування ПЕГ. Див. наприклад, Harris, Macronol. Chem. Phys. C25: 325-373 (1985); Scouten, Methods in Enzymology 135: 30-65 (1987); Wong et al., Enzyme Microb. Technol. 14: 866-874 (1992); Delgado et al., Critical Reviews in Therapeutic Drug Carrier Systems 9: 249-304 (1992); Zalipsky, Bioconjugate Chem. 6: 150-165 (1995) and Bhadra et al., Pharmazie, 57: 5-29 (2002). Методи отримання реакційноздатних молекул ПЕГ і кон'югатів з використанням таких реакційноздатних молекул відомі фахівцям. Так, наприклад, в патенті США №5672662 описаний водорозчинний і такий, що виділяється, кон'югат активного складного ефіру полімерної кислоти, вибраної з лінійних або розгалужених поліалкіленоксидів, поліоксіетильованих поліолів, поліолефінових спиртів і поліакриломорфоліну. У патенті США №6376604 описаний метод отримання водорозчинного складного ефіру 1бензотриазолілкарбонової кислоти водорозчинного і не-пептидного полімеру шляхом взаємодії кінцевого гідроксила даного полімеру з ди(1бензотриазоліл)карбонатом в органічному розчиннику. Активний складний ефір використовується для отримання кон'югатів з біологічно активним агентом, таким як білок або пептид. У WO 99/45964 описаний кон'югат, що містить біологічно активний агент і активований водорозчинний полімер, що включає полімерний кістяк, який щонайменше у одного свого кінця зв'язаний з іншим полімерним кістяком за допомогою стабільного зв'язку, де щонайменше один кінець містить розгалужувальну групу, що має проксимальні реакційноздатні групи, приєднані до такої розгалужувальної групи, і де вказаний біологічно активний агент зв'язаний щонайменше з однією з проксимальних реакційноздатних груп. Інші розгалужені поліетиленгліколі описані в WO 96/21469. У патенті США №5932462 описаний кон'югат, утворений розгалуженою молекулою ПЕГ, яка має розгалужений кінець, що містить реакційноздатні функціональні групи. Вільні реакційноздатні групи можуть реагувати з біологічно активною молекулою, такою як білок або пептид, з утворенням кон'югатів поліетиленгліколю і біологічно активної молекули. У патенті США №5446090 описаний біфункціональний лінкер ПЕГ і описано його використання для 89364 54 отримання кон'югатів, що містять пептид на кожному кінці лінкера ПЕГ. Кон'югати, що включають ПЕГ-зв'язки, що розкладаються, описані в WO 99/34883 і в WO 99/14259, а також в патенті США №6348558. Такі лінкери, що розкладаються, можуть бути використані в даному винаході. Добре відомі методи активації полімерів, описані вище, використовуються в контексті винаходу для отримання описаних тут розгалужених полімерів, а також для кон'югування цих розгалужених полімерів з іншими молекулами, наприклад, цукрами, цукровмісими нуклеотидами і т.п. Репрезентативними молекулами поліетиленгліколю, що використовуються в даному винаході, є, але не обмежуються ними, молекули, що мають формулу: де R8 являє собою Н, ОН, NH2, заміщений або незаміщений алкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероарил, заміщений або незаміщений гетероциклоалкіл, заміщений або незаміщений гетероалкіл, наприклад, ацеталь, -ОНС-, H2N-(CH2)q-, HS-(CH2)q або (CH2)qC(Y)Z1. Індекс "e" дорівнює цілому числу від 1 до 2500. Індекси b, d і q незалежно дорівнюють цілим числам від 0 до 20. Символи Ζ і Ζ1 незалежно являють собою ОН, ΝΗ2, групи, що видаляються, наприклад, імідазол, п-нітрофеніл, НОВТ, тетразол, галогенід, -S-R9, спиртову частину активованого складного ефіру; -(CH2)pC(Y1)V або (CH2)pU(CH2)sC(Y1)v. Символ Υ являє собою Н(2), =O, =S, =N-R10. Символи Χ, Υ, Υ1, А1 і U незалежно являють собою О, S, N-R11. Символ V являє собою ОН, ΝΗ2, галоген, S-R12, спиртовий компонент активованого складного ефіру, аміновий компонент активованих амідів, цукровмісих нуклеотидів і білків. Індекси р, q, s і ν дорівнюють цілим числам, незалежно вибраним з 0-20. Символи R9, R10, R11 і R12 незалежно являють собою Н, заміщений або незаміщений алкіл, заміщений або незаміщений гетероалкіл, заміщений або незаміщений арил, заміщений або незаміщений гетероциклоалкіл і заміщений або незаміщений гетероарил. В інших репрезентативних варіантах винаходу, молекула поліетиленгліколю вибрана з: 55 Поліетиленгліколь, що використовується для отримання кон'югату згідно з винаходом, є або лінійним, або розгалуженим. Розгалуженими молекулами поліетиленгліколю, прийнятними для використання в даному винаході, є, але не обмежуються ними, молекули формули: 89364 56 де R8 і R8' незалежно вибрані з груп, визначених вище для R8. А1 і А2 незалежно вибрані з груп, визначених вище для А1. Індекси e, f, о і q визначені вище. Ζ і Υ також визначені вище. X1 і X1' незалежно вибрані з S, SC(O)NH, HNC(O)S, SC(O)O, О, NH, NHC(O), (O)CNH, NHC(O)O і OC(O)NH. В інших репрезентативних варіантах винаходу, розгалужений ПЕГ отримують на основі цистеїнового, серинового або ди-лізинового кістяка. Так, наприклад, іншими репрезентативними розгалуженими ПЕГ є: 57 89364 58 В іншому варіанті винаходу, розгалужена молекула ПЕГ основана на пептиді, що містить трилізин. Такий трилізин може бути моно-, ди-, три- або тетра-ПЕГильованим. Репрезентативні молекули згідно з цим варіантом винаходу мають формули: де e, f і f' незалежно вибрані з цілих чисел від 1 до 2500, a q, q' і q" незалежно вибрані з цілих чисел від 1 до 20. У репрезентативних варіантах винаходу, ПЕГ являє собою м-ПЕГ (5кД, 10кД або 20кД). Репрезентативним розгалуженим ПЕГ є серин- або цистеїн-(м-ПЕГ)2, де м-ПЕГ має масу 20кД. Як очевидно фахівцям, розгалужені полімери, що використовуються в даному винаході, включають варіанти молекул, описаних вище. Так, наприклад, описаний вище кон'югат "ди-лізин - ПЕГ" може включати три полімерні субодиниці, де третя субодиниця, зв'язана з α-аміном, показана у вищенаведеній структурі як немодифікована. Аналогічним чином, використання в даному полімері трьох лізинів, функціоналізованих трьома або чотирма полімерними субодиницями, входить в об'єм даного винаходу. Конкретними варіантами даного винаходу є: 59 89364 60 і їх карбонати і активний складний ефір, такий як: Іншими активуючими групами або групами, що видаляються, прийнятними для активації лінійних ПЕГ, що використовуються для отримання описаних тут сполук, є, але не обмежуються ними, наступні групи: Молекули ПЕГ, які активуються цими і іншими молекулами, і методи отримання активованих ПЕГ описані в WO 04/083259. Фахівцям в даній галузі очевидно, що одна або декілька гілок м-ПЕГ розгалуженого полімеру можуть бути замінені ПЕГ-частиною з різними кінцями, наприклад, з ОН, СООН, NH2, С2-С10алкілом і т.п. Крім того, вищезгадані структури можуть бути легко модифіковані шляхом вбудовування алкіль них лінкерів (або видалення атомів вуглецю) між α-вуглецевим атомом і функціональною групою бокового ланцюга. Таким чином, "гомо"-похідні і вищі гомологи, а також нижчі гомологи входять в об'єм кістяків для розгалужених ПЕГ, що використовуються в даному винаході. Представлені тут розгалужені молекули ПЕГ можуть бути легко отримані методами, проілюстрованими в нижченаведеній схемі:
ДивитисяДодаткова інформація
Назва патенту англійськоюGranulocyte colony stimulating factor peptide conjugate (g-csf)
Автори англійськоюDefrees Shawn, Clausen Henrik, Zopf David A., Wang Zhi-Guang, Bowe Caryn, Schwartz Marc, Wu Bingyuan
Назва патенту російськоюКоньюгат пептида гранулоцитарного колониестимулирующего фактора (g-csf)
Автори російськоюДефриз Шон, Клаусен Хенрик, Цопф Девид А., Ванг Чжи-Гуан, Бауэ Керин, Шварц, Марк, Ву, Бинюань
МПК / Мітки
МПК: C07K 14/535, C07K 1/06, A61K 38/18, A61P 31/00
Мітки: колонієстимулюючого, фактора, гранулоцитарного, g-csf, кон'югат, пептиду
Код посилання
<a href="https://ua.patents.su/76-89364-konyugat-peptidu-granulocitarnogo-koloniehstimulyuyuchogo-faktora-g-csf.html" target="_blank" rel="follow" title="База патентів України">Кон’югат пептиду гранулоцитарного колонієстимулюючого фактора (g-csf)</a>