Похідні піримідинсульфонаміду як модулятори рецепторів хемокіну
Номер патенту: 92463
Опубліковано: 10.11.2010
Автори: Кокс Роуна Джейн, Чешір Дейвід Рейналф, Меґані Премджі, Стоунгаус Джеффрі Пол, Престон Черілін Френсіс, Сміт Ніл Майкл
Формула / Реферат
1. Сполука формули (1)
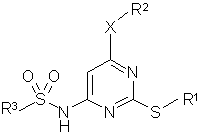 , (1)
, (1)
де R1 вибрано із групи: С3-7карбоцикліл, С1-8алкіл, С2-6алкеніл та С2-6алкініл; які, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: флуор, нітрил, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, феніл або гетероарил; де феніл та гетероарил, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, С1-6алкіл та трифлуорометил;
X - -СН2-, зв'язок, оксиген, сульфур, сульфоксид або сульфон;
R2 - С3-7карбоцикліл, як варіант, заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: флуор, -OR4, -NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9;
або R2 - 3-8-членне кільце, що містить, як варіант, 1, 2 чи 3 атоми, вибрані з О, S, -NR8, де кільце, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: С1-3алкіл, флуор, -OR4, -NR5R6 -CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9;
або R2 - феніл або гетероарил, кожний з яких, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -NR8COR9, -SO2NR5R6, -NR8SO2R9, С1-6алкіл та трифлуорометил;
або R2 вибрано із групи: С1-8алкіл, С2-6алкеніл або С2-6алкініл, які є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: гідроксил, амін, С1-6алкоксил, С1-6алкіламін, ді(С1-6алкіл)амін, N-(С1-6aлкіл)-N-(феніл)амін, N-С1-6алкілкарбамоїл, N,N-ді(С1-6алкіл)карбамоїл, N-(С1-6aлкіл)-N-(феніл)карбамоїл, карбоксил, феноксикарбоніл, -NR8COR9, -SO2R10, -SO2NR5R6,-NR8SO2R9 та -CONR5R6;
R3 - трифлуорометил або група -NR5R6,
або R3 - феніл, нафтил, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим, та один або більше кільцевих атомів карбону можуть утворювати карбонільну групу, і де кожний феніл або гетероарил, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, феніл, гетероарил, -OR4, -NR5R6, -CONR5R6, -COR7-, -COR20, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, трифлуорометил або С1-6алкіл [як варіант, крім того, заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR20, -COOR20, -COR20, -NR18R19, -CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, NR18SO2R19, феніл, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим; і де кожний феніл або гетероарил, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR20, -NR5R6, -CONR5R6, -COR7, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, гетероарил, С1-6алкіл (як варіант, крім того, заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR20, -COOR20, -COR20, -NR18R19, -CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, NR18SO2R19)],
або R3 вибрано із групи: С3-7карбоцикліл, С1-8алкіл, С2-6алкеніл та С2-6алкініл, які, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, -OR4, -NR5R6, -CONR5R6, -COR7,-COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, феніл, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим; і де кожний феніл, моноциклічний або біциклічний гетероарил, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR4, -NR5R6, -CONR5R6, -COR7, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9, С1-6алкіл, або трифлуорометил;
R4 - гідроген або група, вибрана із С1-6алкілу та фенілу, які, як варіант, є заміщеними 1 або 2 замісниками, незалежно вибраними із галогену, фенілу, -OR11 та -NR12R13;
R5 та R6, незалежно, - гідроген або вибрані із групи: С1-6алкіл та феніл, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим; де група, як варіант, є заміщеною 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, феніл, -OR14,-NR15R16, -COOR14, -CONR15R16, -NR15COR16, -SO2R10, -SO2NR15R16 та NR15SO2R16;
або R5 та R6 разом з атомом нітрогену, до якого вони приєднані, утворюють 4-7-членну насичену гетероциклічну кільцеву систему, що містить, як варіант, додатковий гетероатом, вибраний із оксигену, -SO(n)- (де n=0, 1 або 2) та нітрогену, в якій кільце, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: феніл, гетероарил, -OR14, -COR20, -COOR14, -NR15R16, -CONR15R16, -NR15COR16, -SO2R10, -SO2NR15R16, NR15SO2R16 або С1-6алкіл (як варіант, крім того, заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, -NR15R16 та -OR17 або ціано, нітро, -OR20 -COOR20, -COR20, -NR18R19, -CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, NR18SO2R19);
R10 - гідроген або група, вибрана із С1-6алкілу або фенілу, які, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, феніл, -OR17 та -NR15R16;
а кожний із R7, R8, R9, R11, R12, R13, R14 R15, R16, R17, незалежно, - гідроген, С1-6алкіл або феніл;
R18, R19 та R20 - гідроген або група, вибрана із С1-6алкілу або гетероарилу (де гетерокільце може бути частково або повністю насиченим), або фенілу, які, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, нітро, -CN, -OR4, -NR8R9, -CONR8R9, -COR7, -COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR8R9, -NR8SO2R9, С1-6алкіл або гетероарил,
або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер.
2. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за п. 1, де R1 - С1-8алкіл, заміщений фенілом, який, як варіант, є заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: флуор, хлор, бром, метоксил, метил та трифлуорометил.
3. Сполука або фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo її естер за п. 1, де X вибрано із групи: -СН2-, зв'язок, оксиген та сульфур.
4. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за п. 1, де R2 - С1-8алкіл, як варіант, заміщений 1, 2 або 3 замісниками, незалежно вибраними з групи: С1-6алкоксил, гідроксил та флуор; або
R2 - 5-6-членне кільце, що містить, як варіант, 1, 2 або 3 гетероатоми, вибрані з О, S, -NR8, де кільце, як варіант, є заміщеним -OR4.
5. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за п. 1, де R3 - С3-7карбоцикліл, С1-8алкіл, -NR5R6, феніл, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим, а один або більше кільцевих атомів карбону можуть утворювати карбонільну групу, де кожний феніл або гетероарил, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: ціано, гетероарил, -OR4, -NR5R6, -CONR5R6, -COR7, -COR20, -NR8COR9, -SO2R10, -SO2NR5R6, С1-6алкіл (як варіант, крім того, заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: -OR20, -COR20, -NR18R19, -CONR18R19, феніл, моноциклічний або біциклічний гетероарил, де гетерокільце може бути частково або повністю насиченим; та де кожний феніл або гетероарил, як варіант, є заміщеним 1, 2 або 3 замісниками, незалежно вибраними із групи: нітро, -OR20, -NR5R6, -NR8COR9, гетероарил, С1-6алкіл (як варіант, крім того, заміщений 1, 2 або 3 замісниками, незалежно вибраними із ціано, -OR20)).
6. Сполука, вибрана із групи:
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2-гідрокси-1-(гідроксиметил)етокси]-4-піримідиніл]-1-азетидинсульфонамід,
(R,S)-N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3,4-дигідроксибутил]піримідин-4-іл]азетидин-1-сульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3-гідрокси-2-(гідроксиметил)пропіл]піримідин-4-іл]азетидин-1-сульфонамід
N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1R,2R)-2-гідрокси-1-метилпропіл]окси}піримідин-4-іл)азетидин-1-сульфонамід,
N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1S,2S)-2-гідрокси-1-метилпропіл]окси}піримідин-4-іл)азетидин-1-сульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2S)-2,3-дигідроксипропіл]окси]-4-піримідиніл]-1-азетидинсульфонамід,
N-[2-[[(2,3-дифлуорофенiл)метил]тiо]-6-[2-гідрокси-1-(гідроксиметил)-1-метилетокси]-4-піримідиніл]-1-азетидинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-2-тіазолсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тiо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-4-піридинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-1-піперазинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-1,6-дигідро-1-метил-6-оксо-3-піридинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-1-азетидинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-метансульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-4-морфолінсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-1-піролідинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-циклопропансульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1-метилетокси]-4-піримідиніл]-1-метил-1Н-імідазол-4-сульфонамід
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-метоксипіримідин-4-іл]азетидин-1-сульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-метоксипіримідин-4-іл]піперазин-1-сульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-метоксипіримідин-4-іл]-1-метил-1Н-імідазол-4-сульфонамі,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-{[(1R,2R)-2,3-дигідрокси-1-метилпропіл]окси}-4-піримідиніл]-1-азетидинсульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(1R,2R)-2,3-дигідрокси-1-метилпропіл]окси]-4-піримідиніл]-метансульфонамід,
N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-{[(1R,2S)-2,3-дигідрокси-1-метилпропіл]окси}-4-піримідиніл]-1-піперазинсульфонамід,
5-(азетидин-1-ілкарбоніл)-N-{2-[(2,3-дифлуоробензил)тіо]-6-[(1R)-2-гідрокси-1-метилетокси]піримідин-4-іл}фуран-2-сульфонамід,
або її фармацевтично прийнятна сіль, сольват, або здатний до гідролізу in vivo естер.
7. Сполука N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-{[(1R,2S)-2,3-дигідрокси-1-метилпропіл]окси}-4-піримідиніл]-1-азетидинсульфонамід або її фармацевтично прийнятна сіль.
8. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за будь-яким пп. 1-7 для застосування як медикаменту.
9. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за будь-яким пп. 1-7 для застосування як медикаменту для лікування астми, алергічного риніту, ХОЛХ, запальної хвороби кишечнику, остеоартриту, остеопoрозу, ревматоїдного артриту або псоріазу.
10. Сполука або її фармацевтично прийнятна сіль, сольват або здатний до гідролізу in vivo естер за будь-яким пп. 1-7 для застосування як медикаменту для лікування раку.
11. Застосування сполуки або її фармацевтично прийнятної солі, сольвату або здатного до гідролізу in vivo естеру за будь-яким пп. 1-7 у виготовленні медикаменту для лікування хвороб людини або станів, в яких є корисним модулювання активності рецептора хемокіну.
12. Застосування сполуки або її фармацевтично прийнятної солі, сольвату або здатного до гідролізу in vivo естеру за будь-яким пп. 1-7 у виготовленні медикаменту для лікування астми, алергічного риніту, ХОЛХ, запальної хвороби кишечнику, синдрому подразненої товстої кишки, остеоартриту, остеопорозу, ревматоїдного артриту або псоріазу.
13. Застосування сполуки або її фармацевтично прийнятної солі, сольвату або здатного до гідролізу in vivo естеру за будь-яким пп. 1-7 у виготовленні медикаменту для лікування раку.
14. Фармацевтична композиція, яка містить сполуку або її фармацевтично прийнятну сіль, сольват або здатний до гідролізу in vivo естер за будь-яким пп. 1-7 та фармацевтично прийнятний розріджувач або носій.
15. Спосіб отримання сполуки за п. 1 або її фармацевтично прийнятної солі, сольвату або здатного до гідролізу in vivo естеру, при якому:
(а) сполуку формули (2а):
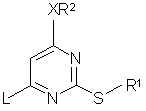 , (2а)
, (2а)
де R1, R2, R3 та X є такими, як описано для сполуки формули (1), a L - відщеплювана група,
піддають реакції з сульфонамідом формули
R3SO2NH2,
де R3 є таким, як описано у формулі (1);
та потім, як варіант, здійснюють одну або більше зі стадій (і), (іі), (ііі), (iv) або (v) у будь-якому порядку:
і) видаляють будь-які захисні групи;
іі) перетворюють сполуку формули (1) в іншу сполуку формули (1);
ііі) утворюють сіль;
iv) утворюють проліки;
v) утворюють здатний до гідролізу in vivo естер;
або
(b) сполуку формули (2b):
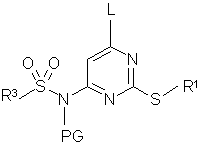 , (2b)
, (2b)
де R1 та R3 є такими, як описано для сполуки формули (1), L - відщеплювана група, PG - захисна груп або гідроген,
піддають реакції із спиртом HOR2 або тіолом HSR2, відповідно,
де R2 є таким, як описано у формулі (1),
у присутності придатної основи та розчинника,
та, як варіант, потім здійснюють одну або більше зі стадій (і), (іі), (ііі), (iv) або (v) у будь-якому порядку:
і) видаляють будь-які захисні групи;
іі) перетворюють сполуку формули (1) в іншу сполуку формули (1);
ііі) утворюють сіль;
iv) утворюють проліки;
v) утворюють здатний до гідролізу in vivo естер.
16. Сполука формули (2а)
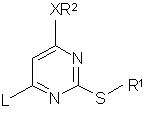 , (2a)
, (2a)
де R1, R2 та X описано у формулі (1), a L - відщеплювана група, за умови, якщо R1 - бензил, X - оксиген, R2 - метил, тоді L не є хлором, або, коли R1 - бензил, X - зв'язок, R2 - пропіл, тоді L не є хлором.
17. Спосіб комбінованого лікування, згідно з яким застосовують сполуку формули (1) або її фармацевтично прийнятну сіль, сольват або здатний до гідролізу in vivo естер, або фармацевтичну композицію чи рецептуру, яка містить сполуку формули (1), одночасно або послідовно з іншим лікуванням та/або іншим фармацевтичним засобом.
18. Спосіб комбінованого лікування за п. 17 для лікування астми, алергічного риніту, ХОЛХ, запальної хвороби кишечнику, синдрому подразненої товстої кишки, остеоартриту, остеопорозу, ревматоїдного артриту або псоріазу.
19. Спосіб комбінованого лікування за п. 17 для лікування раку.
20. Фармацевтична композиція, яка містить сполуку формули (1) або її фармацевтично прийнятну сіль, сольват або здатний до гідролізу in vivo естер, у поєднанні з іншими фармацевтичним засобом.
21. Фармацевтична композиція за п. 20 для лікування астми, алергічного риніту, ХОЛХ, запальної хвороби кишечнику, синдрому подразненої товстої кишки, остеоартриту, остеопорозу, ревматоїдного артриту або псоріазу.
22. Фармацевтична композиція за п. 20 для лікування раку.
Текст
1. Сполука формули (1) R2 X C2 2 (19) 1 3 92463 4 -CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR8R9, NR18SO2R19, феніл, моноциклічний або біциклічний NR8SO2R9, С1-6алкіл або гетероарил, гетероарил, де гетерокільце може бути частково або її фармацевтично прийнятна сіль, сольват або або повністю насиченим; і де кожний феніл або здатний до гідролізу in vivo естер. гетероарил, як варіант, є заміщеним 1, 2 або 3 2. Сполука або її фармацевтично прийнятна сіль, замісниками, незалежно вибраними із групи: галосольват або здатний до гідролізу in vivo естер за п. ген, ціано, нітро, -OR20, -NR5R6, -CONR5R6, -COR7, 1, де R1 - С1-8алкіл, заміщений фенілом, який, як 7 8 9 10 10 5 6 -COOR , -NR COR , -SR , -SO2R , -SO2NR R , варіант, є заміщений 1, 2 або 3 замісниками, незаNR8SO2R9, гетероарил, С1-6алкіл (як варіант, крім лежно вибраними із групи: флуор, хлор, бром, метого, заміщений 1, 2 або 3 замісниками, незалежно токсил, метил та трифлуорометил. вибраними із групи: галоген, ціано, нітро, -OR20, 3. Сполука або фармацевтично прийнятна сіль, COOR20, -COR20, -NR18R19, -CONR18R19, сольват або здатний до гідролізу in vivo її естер за NR18COR19, -SO2R20, -SO2NR18R19, NR18SO2R19)], п. 1, де X вибрано із групи: -СН2-, зв'язок, оксиген або R3 вибрано із групи: С3-7карбоцикліл, С1-8алкіл, та сульфур. С2-6алкеніл та С2-6алкініл, які, як варіант, є заміще4. Сполука або її фармацевтично прийнятна сіль, ними 1, 2 або 3 замісниками, незалежно вибранисольват або здатний до гідролізу in vivo естер за п. ми із групи: галоген, -OR4, -NR5R6, -CONR5R6, 1, де R2 - С1-8алкіл, як варіант, заміщений 1, 2 або COR7,-COOR7, -NR8COR9, -SR10, -SO2R10, 3 замісниками, незалежно вибраними з групи: С1SO2NR5R6, -NR8SO2R9, феніл, моноциклічний або 6алкоксил, гідроксил та флуор; або біциклічний гетероарил, де гетерокільце може буR2 - 5-6-членне кільце, що містить, як варіант, 1, 2 ти частково або повністю насиченим; і де кожний або 3 гетероатоми, вибрані з О, S, -NR8, де кільце, феніл, моноциклічний або біциклічний гетероарил, як варіант, є заміщеним -OR4. як варіант, є заміщеними 1, 2 або 3 замісниками, 5. Сполука або її фармацевтично прийнятна сіль, незалежно вибраними із групи: галоген, ціано, нітсольват або здатний до гідролізу in vivo естер за п. ро, -OR4, -NR5R6, -CONR5R6, -COR7, -COOR7, 1, де R3 - С3-7карбоцикліл, С1-8алкіл, -NR5R6, феніл, 8 9 10 10 5 6 8 9 NR COR , -SR , -SO2R , -SO2NR R , -NR SO2R , моноциклічний або біциклічний гетероарил, де С1-6алкіл, або трифлуорометил; гетерокільце може бути частково або повністю R4 - гідроген або група, вибрана із С1-6алкілу та насиченим, а один або більше кільцевих атомів фенілу, які, як варіант, є заміщеними 1 або 2 замікарбону можуть утворювати карбонільну групу, де сниками, незалежно вибраними із галогену, фенікожний феніл або гетероарил, як варіант, є замілу, -OR11 та -NR12R13; щеним 1, 2 або 3 замісниками, незалежно вибраR5 та R6, незалежно, - гідроген або вибрані із груними із групи: ціано, гетероарил, -OR4, -NR5R6, 5 6 7 20 8 9 10 пи: С1-6алкіл та феніл, моноциклічний або біцикліCONR R , -COR , -COR , -NR COR , -SO2R , 5 6 чний гетероарил, де гетерокільце може бути частSO2NR R , С1-6алкіл (як варіант, крім того, заміщеково або повністю насиченим; де група, як варіант, ний 1, 2 або 3 замісниками, незалежно вибраними є заміщеною 1, 2 або 3 замісниками, незалежно із групи: -OR20, -COR20, -NR18R19, -CONR18R19, фе14 вибраними із групи: галоген, феніл, -OR ,ніл, моноциклічний або біциклічний гетероарил, де NR15R16, -COOR14, -CONR15R16, -NR15COR16, гетерокільце може бути частково або повністю SO2R10, -SO2NR15R16 та NR15SO2R16; насиченим; та де кожний феніл або гетероарил, як або R5 та R6 разом з атомом нітрогену, до якого варіант, є заміщеним 1, 2 або 3 замісниками, невони приєднані, утворюють 4-7-членну насичену залежно вибраними із групи: нітро, -OR20, -NR5R6, гетероциклічну кільцеву систему, що містить, як NR8COR9, гетероарил, С1-6алкіл (як варіант, крім варіант, додатковий гетероатом, вибраний із окситого, заміщений 1, 2 або 3 замісниками, незалежно гену, -SO(n)- (де n=0, 1 або 2) та нітрогену, в якій вибраними із ціано, -OR20)). кільце, як варіант, є заміщеним 1, 2 або 3 замісни6. Сполука, вибрана із групи: ками, незалежно вибраними із групи: феніл, гетеN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2-гідроксироарил, -OR14, -COR20, -COOR14, -NR15R16, 1-(гідроксиметил)етокси]-4-піримідиніл]-1CONR15R16, -NR15COR16, -SO2R10, -SO2NR15R16, азетидинсульфонамід, NR15SO2R16 або С1-6алкіл (як варіант, крім того, (R,S)-N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3,4заміщений 1, 2 або 3 замісниками, незалежно вибдигідроксибутил]піримідин-4-іл]азетидин-1раними із групи: галоген, -NR15R16 та -OR17 або сульфонамід, ціано, нітро, -OR20 -COOR20, -COR20, -NR18R19, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3-гідроксиCONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, 2-(гідроксиметил)пропіл]піримідин-4-іл]азетидин-1NR18SO2R19); сульфонамід R10 - гідроген або група, вибрана із С1-6алкілу або N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1R,2R)-2фенілу, які, як варіант, є заміщеними 1, 2 або 3 гідрокси-1-метилпропіл]окси}піримідин-4замісниками, незалежно вибраними із групи: галоіл)азетидин-1-сульфонамід, ген, феніл, -OR17 та -NR15R16; N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1S,2S)-2а кожний із R7, R8, R9, R11, R12, R13, R14 R15, R16, R17, гідрокси-1-метилпропіл]окси}піримідин-4незалежно, - гідроген, С1-6алкіл або феніл; іл)азетидин-1-сульфонамід, R18, R19 та R20 - гідроген або група, вибрана із С1N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2S)-2,3дигідроксипропіл]окси]-4-піримідиніл]-16алкілу або гетероарилу (де гетерокільце може бути частково або повністю насиченим), або феніазетидинсульфонамід, лу, які, як варіант, є заміщеними 1, 2 або 3 замісN-[2-[[(2,3-дифлуорофенiл)метил]тiо]-6-[2-гідроксиниками, незалежно вибраними із групи: галоген, 1-(гідроксиметил)-1-метилетокси]-4-піримідиніл]-1нітро, -CN, -OR4, -NR8R9, -CONR8R9, -COR7, азетидинсульфонамід, 5 92463 6 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-210. Сполука або її фармацевтично прийнятна сіль, гідрокси-1-метилетокси]-4-піримідиніл]-2сольват або здатний до гідролізу in vivo естер за тіазолсульфонамід, будь-яким пп. 1-7 для застосування як медикаменN-[2-[[(2,3-дифлуорофеніл)метил]тiо]-6-[(1R)-2ту для лікування раку. гідрокси-1-метилетокси]-4-піримідиніл]-411. Застосування сполуки або її фармацевтично піридинсульфонамід, прийнятної солі, сольвату або здатного до гідроліN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2зу in vivo естеру за будь-яким пп. 1-7 у виготовгідрокси-1-метилетокси]-4-піримідиніл]-1ленні медикаменту для лікування хвороб людини піперазинсульфонамід, або станів, в яких є корисним модулювання активN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2ності рецептора хемокіну. гідрокси-1-метилетокси]-4-піримідиніл]-1,6-дигідро12. Застосування сполуки або її фармацевтично 1-метил-6-оксо-3-піридинсульфонамід, прийнятної солі, сольвату або здатного до гідроліN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2зу in vivo естеру за будь-яким пп. 1-7 у виготовгідрокси-1-метилетокси]-4-піримідиніл]-1ленні медикаменту для лікування астми, алергічазетидинсульфонамід, ного риніту, ХОЛХ, запальної хвороби кишечнику, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2синдрому подразненої товстої кишки, остеоартригідрокси-1-метилетокси]-4-піримідиніл]ту, остеопорозу, ревматоїдного артриту або псоріметансульфонамід, азу. N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-213. Застосування сполуки або її фармацевтично гідрокси-1-метилетокси]-4-піримідиніл]-4прийнятної солі, сольвату або здатного до гідроліморфолінсульфонамід, зу in vivo естеру за будь-яким пп. 1-7 у виготовN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2ленні медикаменту для лікування раку. гідрокси-1-метилетокси]-4-піримідиніл]-114. Фармацевтична композиція, яка містить сполупіролідинсульфонамід, ку або її фармацевтично прийнятну сіль, сольват N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2або здатний до гідролізу in vivo естер за будь-яким гідрокси-1-метилетокси]-4-піримідиніл]пп. 1-7 та фармацевтично прийнятний розріджувач циклопропансульфонамід, або носій. N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-215. Спосіб отримання сполуки за п. 1 або її фаргідрокси-1-метилетокси]-4-піримідиніл]-1-метилмацевтично прийнятної солі, сольвату або здатно1Н-імідазол-4-сульфонамід го до гідролізу in vivo естеру, при якому: N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6(а) сполуку формули (2а): XR2 метоксипіримідин-4-іл]азетидин-1-сульфонамід, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6метоксипіримідин-4-іл]піперазин-1-сульфонамід, (2а) N N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-61 R метоксипіримідин-4-іл]-1-метил-1Н-імідазол-4N S L , сульфонамі, де R1, R2, R3 та X є такими, як описано для сполуN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-{[(1R,2R)ки формули (1), a L - відщеплювана група, 2,3-дигідрокси-1-метилпропіл]окси}-4-піримідиніл]піддають реакції з сульфонамідом формули 1-азетидинсульфонамід, R3SO2NH2, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(1R,2R)де R3 є таким, як описано у формулі (1); 2,3-дигідрокси-1-метилпропіл]окси]-4-піримідиніл]та потім, як варіант, здійснюють одну або більше зі метансульфонамід, стадій (і), (іі), (ііі), (iv) або (v) у будь-якому порядку: N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-{[(1R,2S)і) видаляють будь-які захисні групи; 2,3-дигідрокси-1-метилпропіл]окси}-4-піримідиніл]іі) перетворюють сполуку формули (1) в іншу спо1-піперазинсульфонамід, луку формули (1); 5-(азетидин-1-ілкарбоніл)-N-{2-[(2,3ііі) утворюють сіль; дифлуоробензил)тіо]-6-[(1R)-2-гідрокси-1iv) утворюють проліки; метилетокси]піримідин-4-іл}фуран-2-сульфонамід, v) утворюють здатний до гідролізу in vivo естер; або її фармацевтично прийнятна сіль, сольват, або або здатний до гідролізу in vivo естер. (b) сполуку формули (2b): 7. Сполука N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6L {[(1R,2S)-2,3-дигідрокси-1-метилпропіл]окси}-4піримідиніл]-1-азетидинсульфонамід або її фармацевтично прийнятна сіль. N O O 8. Сполука або її фармацевтично прийнятна сіль, (2b) сольват або здатний до гідролізу in vivo естер за S R1 R3 N N S будь-яким пп. 1-7 для застосування як медикаменту. PG 9. Сполука або її фармацевтично прийнятна сіль, , сольват або здатний до гідролізу in vivo естер за де R1 та R3 є такими, як описано для сполуки фобудь-яким пп. 1-7 для застосування як медикаменрмули (1), L - відщеплювана група, PG - захисна ту для лікування астми, алергічного риніту, ХОЛХ, груп або гідроген, запальної хвороби кишечнику, остеоартриту, остепіддають реакції із спиртом HOR2 або тіолом опoрозу, ревматоїдного артриту або псоріазу. HSR2, відповідно, де R2 є таким, як описано у формулі (1), 7 92463 8 у присутності придатної основи та розчинника, гідролізу in vivo естер, або фармацевтичну компота, як варіант, потім здійснюють одну або більше зі зицію чи рецептуру, яка містить сполуку формули стадій (і), (іі), (ііі), (iv) або (v) у будь-якому порядку: (1), одночасно або послідовно з іншим лікуванням і) видаляють будь-які захисні групи; та/або іншим фармацевтичним засобом. іі) перетворюють сполуку формули (1) в іншу спо18. Спосіб комбінованого лікування за п. 17 для луку формули (1); лікування астми, алергічного риніту, ХОЛХ, запаііі) утворюють сіль; льної хвороби кишечнику, синдрому подразненої iv) утворюють проліки; товстої кишки, остеоартриту, остеопорозу, ревмаv) утворюють здатний до гідролізу in vivo естер. тоїдного артриту або псоріазу. 16. Сполука формули (2а) 19. Спосіб комбінованого лікування за п. 17 для лікування раку. XR2 20. Фармацевтична композиція, яка містить сполуку формули (1) або її фармацевтично прийнятну (2a) N сіль, сольват або здатний до гідролізу in vivo естер, у поєднанні з іншими фармацевтичним засо1 R бом. N S L , 21. Фармацевтична композиція за п. 20 для лікуде R1, R2 та X описано у формулі (1), a L - відщепвання астми, алергічного риніту, ХОЛХ, запальної 1 лювана група, за умови, якщо R - бензил, X - оксихвороби кишечнику, синдрому подразненої товстої ген, R2 - метил, тоді L не є хлором, або, коли R1 кишки, остеоартриту, остеопорозу, ревматоїдного 2 бензил, X - зв'язок, R - пропіл, тоді L не є хлором. артриту або псоріазу. 17. Спосіб комбінованого лікування, згідно з яким 22. Фармацевтична композиція за п. 20 для лікузастосовують сполуку формули (1) або її фармавання раку. цевтично прийнятну сіль, сольват або здатний до Заявлений винахід стосується деяких гетероциклічних сполук, способів та інтермедіатів, застосованих для їхнього отримання, фармацевтичних композицій, що їх містять та їх застосування у терапії. Хемокіни грають важливу роль в імунних та запальних реакціях у різних хворобах та розладах, охоплюючи астму та алергічні хвороби, а також автоімунні патології, як-то ревматоїдний артрит та атеросклероз. Ці малі секретовані молекули представляють зростаюче надсімейство білків 8-14 кДа, охарактеризоване збереженим цистеїновим мотифом. Зараз надсімейство хемокінів містить три групи, що виявляють характеристичні структурні мотифи, сімейства С-Х-С, С-С та С-Х3-С. Сімейства С-Х-С та С-С мають подібність послідовностей та відрізняються один від другого вставкою одиничної амінокислоти між NH-проксимальною парою залишків цистеїну. Сімейство С-Х3-С відрізняється від інших двох сімейств потрійною амінокислотною вставкою між NH-проксимальною парою залишків цистеїну. Хемокіни С-Х-С охоплюють кілька потужних хемоатрактантів та активаторів нейтрофілів, як-то інтерлейкін-8 (IL-8) та активуючий нейтрофіли пептид 2 (NAP-2). Хемокіни С-С охоплюють потужні хемоатрактанти моноцитів та лімфоцитів, але не нейтрофілів. Приклади охоплюють хемотактичні білки моноцитів людини 1-3 (МСР-1, МСР-2 та МСР-3), RANTES (регульовані на активацію, нормальні Текспресовані та секретовані), еотаксин та запальні білки макрофагу 1 та 1 (ΜΙΡ-1 та ΜΙΡ-1 ). Хемокін С-Х3-С (також відомий як фракталкін) є потужним хемоатрактантом та активатором мікроглії в центральній нервовій системі (ЦНС) а також моноцитів, Т-клітин, ΝΚ клітин та стовбурових клітин. Дослідження показали, що дія хемокінів опосередкується підсімействами спряжених з Gбілком рецепторів, серед яких є рецептори, позначені CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 та CCR11 (для сімейства С-С); CXCR1, CXCR2, CXCR3, CXCR4 та CXCR5 (для сімейства С-Х-С) та CX3CR1 для сімейства С-Х3-С. Ці рецептори представляють гарні мішені для розробки ліків, оскільки засоби, які модулюють ці рецептори, повинні бути корисними в лікуванні розладів та хвороб, як-то вищенаведених. В нашій заявці на патент РСТ WO 2004/011443 ми розкрили амінозаміщені сульфонаміди піримідину для застосування як модуляторів рецепторів хемокіну. Заявлений винахід стосується сполуки формули (1) або її фармацевтично прийнятної солі, сольвату або здатного до гідролізу in vivo естеру: де R1 вибрано із групи: С3-7карбоцикліл, С18алкіл, С2-6алкеніл та С2-балкініл; де група, як варіант, є заміщеною 1, 2 або 3 замісниками, незалежно вибраними із групи: флуор, нітрил, -OR4, NR5R6, -CONR5R6, -COOR7, -NR8COR9, -SR10, SO2R10, -SO2NR5R6, -NR8SO2R9, феніл або гетероарил; де феніл та гетероарил, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно вибраними із групи: галоген, ціано, нітро, -OR4, -NR5R6, CONR5R6, -COOR7, -NR8COR9, -SR10, -SO2R10, 9 92463 10 SO2NR5R6, -NR8SO2R9, С1-6алкіл та трифлуорометероарил, як варіант, є заміщеними 1, 2 або 3 затил; місниками, незалежно вибраними із групи: галоген, Х - -СН2-, зв'язок, оксиген, сульфур, сульфокціано, нітро, -OR4, -NR5R6, -CONR5R6, -COR7, сид, або сульфон; COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR5R6, 2 R - С3-7карбоцикліл, як варіант, заміщений 1, 2 NR8SO2R9, С1-6алкіл, або трифлуорометил; 4 або 3 замісникам, незалежно вибраними із групи: R - гідроген або група, вибрана із С1-6алкілу та 4 5 6 5 6 7 флуор, -OR , -NR R -CONR R , -COOR , фенілу, які, як варіант, є заміщеними 1 або 2 заміNR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9; сниками, незалежно вибраними із галогену, феніабо R2 - 3-8-членне кільце, що містить, як валу, -OR11 та -NR12R13; 8 ріант, 1, 2 або 3 атоми, вибрані із О, S, -NR , і де R5 та R6, незалежно, - гідроген або їх вибрано кільце, як варіант, є заміщеним 1,2 або 3 замісниіз групи: С1-6алкіл та феніл, моноциклічний або ками, незалежно вибраними із групи: С1-3алкіл, біциклічний гетероарил, де гетерокільце може буфлуор, -OR4, -NR5R6 -CONR5R6, -COOR7, ти частково або повністю насиченим; де група, як NR8COR9, -SR10, -SO2R10, -SO2NR5R6, -NR8SO2R9; варіант, є заміщеною 1, 2 або 3 замісниками, неабо R2 - феніл або гетероарил, кожен з яких, залежно вибраними із групи: галоген, феніл, -OR14, як варіант, є заміщеним 1, 2 або 3 замісниками, -NR15R16, -COOR14, -CONR15R16, -NR15COR16, незалежно вибраними із групи: галоген, ціано, нітSO2R10, -SO2NR15R16 та NR15SO2R16; ро, -OR4, -NR5R6, -CONR5R6, -NR8COR9, або SO2NR5R6, -NR8SO2R9, С1-6алкіл та трифлуоромеR5 та R6 разом з атомом нітрогену, до якого тил; вони приєднані, утворюють 4-7-членну насичену або R2 вибрано із групи: С1-8алкіл, С2-6алкеніл гетероциклічну кільцеву систему, що містить, як або С2-6алкініл, які є заміщеними 1, 2 або 3 замісваріант, додатковий гетероатом, вибраний із оксиниками, незалежно вибраними із групи: гідроксил, гену, -SO(n)- (де n=0, 1 або 2) та нітрогену, в якій амін, С1-6алкоксил, С1-6алкіламін, дi(С1-6алкіл)aмін, кільце, як варіант, є заміщеним 1, 2 або 3 замісниN-(С1-6алкіл)-N -(феніл)амін, N-С1-6алкілкарбамоїл, ками, незалежно вибраними із групи: феніл, гетеΝ,Ν-ді(С1-6алкіл)карбамоїл, N-(С1-6алкіл)-Nроарил, -OR14, -COR20, -COOR14, -NR15R16, (феніл)карбамоїл, карбоксил, феноксикарбоніл, CONR15R16, -NR15COR16, -SO2R10, -SO2NR15R16, NR8COR9, -SO2R10, -SO2NR5R6,-NR8SO2R9 та NR15SO2R16 або С1-6алкіл (як варіант, крім того 5 6 CONR R ; заміщений 1, 2 або 3 замісниками, незалежно вибR3 - трифлуорометил або rpyna-NR5R6, раними із групи: галоген, -NR15R16 та -OR17 або 3 або R - феніл, нафтил, моноциклічний або біціано, нітро, -OR20, -COOR20, -COR20, -NR18R19, циклічний гетероарил, де гетерокільце може бути CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, та 18 19 частково або повністю насиченим та один або біNR SO2R ). 10 льше атомів карбону кільця можуть утворювати R - гідроген або група, вибрана із С1-6алкілу карбонільну групу, і де кожний феніл або гетероаабо фенілу, які, як варіант, є заміщеними 1, 2 або рил, як варіант, є заміщеним 1, 2 або 3 замісника3 замісниками, незалежно вибраними із групи: гами, незалежно вибраними із групи: галоген, ціано, логен, феніл, -OR17 та -NR15R16; та кожний із R7, 4 5 6 5 6 нітро, феніл, гетероарил, -OR , -NR R , -CONR R , R8, R9, R11, R12, R13, R14 R15, R16, R17, незалежно, 720 7 8 9 10 -COR , -COR , -COOR , -NR COR , -SR , гідроген, С1-6алкіл або феніл. SO2R10, -SO2NR5R6, -NR8SO2R9, трифлуорометил R18, R19, та R20 - гідроген або група, вибрана із або С1-6алкіл (як варіант, крім того заміщений 1, 2 С1-6алкілу або гетероарилу (де гетерокільце може або 3 замісниками, незалежно вибраними із групи: бути частково або повністю насиченим) або фенігалоген, ціано, нітро, -OR20, -COOR20, -COR20, лу, які, як варіант, є заміщеними 1, 2 або 3 замісNR18R19, -CONR18R19, -NR18COR19, -SO2R20, никами, незалежно вибраними із групи: галоген, SO2NR18R19, NR18SO2R19, феніл, моноциклічний нітро, -CN, -OR4, -NR8R9, -CONR8R9, -COR7, або біциклічний гетероарил, де гетерокільце може COOR7, -NR8COR9, -SR10, -SO2R10, -SO2NR8R9, бути частково або повністю насиченим; і де кожNR8SO2R9, С1-6алкіл або гетероарил. ний феніл або гетероарил, як варіант, є заміщеним Деякі сполуки формули (1) є здатними існува1, 2 або 3 замісниками, незалежно вибраними із ти в стереоізомерних формах. Зрозуміло, що вигрупи: галоген, ціано, нітро, -OR20, -NR5R6, нахід охоплює усі геометричні та оптичні ізомери CONR5R6, -COR7 -COOR7, -NR8COR9, -SR10, сполук формули (1) та їхні суміші, охоплюючи раSO2R10, -SO2NR5R6, -NR8SO2R9, гетероарил, С1цемати. Синтез оптично активних форм можна викону6алкіл (як варіант, крім того заміщений 1, 2 або 3 замісниками, незалежно вибраними із групи: галовати стандартними способами органічної хімії, ген, ціано, нітро, -OR20, -COOR20, -COR20, -NR18R19, добре відомими у рівні техніки, наприклад, синте-CONR18R19, -NR18COR19, -SO2R20, -SO2NR18R19, зом із оптично активних вихідних речовин або розNR18SO2R19. діленням рацемічної форми. Подібним чином виабо R3 вибрано із групи: С3-7карбоцикліл, С2щенаведену активність можна оцінювати, застосовуючи нижченаведені стандартні лабора6алкіл, С2-6алкеніл та С2-6алкініл, які, як варіант, є заміщеними 1, 2 або 3 замісниками, незалежно торні способи. вибраними із групи: галоген, -OR4, -NR5R6, В межах заявленого винаходу зрозуміло, що CONR5R6, -COR7, -COOR7, -NR8COR9, -SR10, сполука формули (1) або її сіль, сольват, або здаSO2R10, -SO2NR5R6, -NR8SO2R9, феніл, моноциклітний до гідролізу in vivo естер можуть виявляти чний або біциклічний гетероарил, де гетерокільце таутомерію, і що схеми формул у межах цього може бути частково або повністю насиченим; і де опису можуть представляти тільки одну з можликожний феніл, моноциклічний або біциклічний гевих таутомерних форм. Зрозуміло, що винахід 11 92463 12 охоплює будь-які таутомерні форми та їхні суміші Придатні фармацевтично прийнятні естери та не обмежується будь-якою одною таутомерною стосовно карбоксилу охоплюють С1формою, застосованою у схемах формул. Схеми 6алкоксиметил-естери наприклад, метоксиметил-, формул у межах цього опису можуть представляти С1-6алканоїлоксиметил-естери, наприклад, півалотільки одну з можливих таутомерних форм, та зроїлоксиметил-, фталідил-естери, С3зуміло, що опис охоплює усі можливі не зображені 8циклоалкоксикарбонтоксиС1-6алкіл-естери, напритаутомерні форми сполук, які тут можна зобразити клад, 1-циклогексилкарбонілоксіетил-; 1,3схематично. діоксолен-2-онілметил-естери наприклад, 5-метилТакож зрозуміло, що деякі сполуки формули 1,3-діоксолен-2-онілметил-; та С1(1) та їхні солі можуть існувати в со-льватованих а наприклад, 16алкоксикарбонілоксіетил-естери, також несольватованих формах як-то, наприклад, метоксикарбонілоксіетиловий, та їх можна утвогідратованих формах. Зрозуміло, що винахід охорювати при будь-якій карбоксильній групі в сполуплює усі такі сольватовані форми. ках цього винаходу. Заявлений винахід стосується сполук формуПридатні фармацевтично прийнятні естери ли (1), які визначено вище, а також їхніх солей. для гідроксилу охоплюють неорганічні естери, якСолі для застосування в фармацевтичних компото фосфатні естери (охоплюючи фосфорамідні зиціях повинні бути фармацевтично прийнятними циклічні естери) та -ацилоксіалкіл-етери та спорісолями, але інші солі можуть бути корисними в днені сполуки, які є результатом гідролітичного отриманні сполук формули (1) та їх фармацевтичрозкладу естеру in vivo, що дає вихідний гідроксил. но прийнятних солей. Фармацевтично прийнятні Приклади -ацилоксіалкіл-етерів охоплюють ацесолі винаходу, наприклад, можуть охоплювати токсиметоксилові та 2,2кислотно-адитивні солі сполук формули (1), які диметилпропіонілоксиметоксилові. Вибір здатних визначено вище, які є достатньо основними для до гідролізу in vivo утворюючих естери груп для утворення таких солей. Такі кислотно-адитивні гідроксилу, охоплюють С1-10алканоїл, наприклад, солі охоплюють наприклад, солі з неорганічними ацетил; бензоїл; фенілацетил; заміщені бензоїл та або органічними кислотами, які надають фармафенілацетил, С1-10алкоксикарбоніл (що дає алкіл цевтично прийнятні аніони, як-то з галогенідними карбонати і естери), наприклад, етоксикарбоніл; кислотами (особливо хлоридною або бромідною ді-(С1-4)алкілкарбамоїл та N-(ді-(С1кислотою, з яких хлоридна кислота є особливо 4)алкіламіноетил)-N-(С1-4)алкілкарбамоїл (що дає переважною) або з сульфатною або фосфатною карбамати); ді-(С1-4)алкіламіноацетил та карбоксікислотою, або з трифлуороцтовою, лимонною або ацетил. Приклади кільцевих замісників на феніламалеїновою кислотою. Придатні солі охоплюють цетилі та бензоїлі охоплюють амінометил, (С1хлориди, броміди, фосфати, сульфати, гідросуль4)алкіламінометил та ді-((С1-4)алкіл)амінометил, та фати, алкілсульфонати, арилсульфонати, ацетати, морфоліно- або піперазиногрупи, приєднані кільбензоати, цитрати, малеати, фумарати, сукцинати, цевим атомом нітрогену через метиленову групу лактати, тартрати, оксалати, метансульфонати до 3- або 4- позиції бензоїльного кільця. Інші цікаві або п-толуолсульфонати. Фармацевтично прийняздатні до гідролізу in vivo естери охоплюють, натні солі винаходу також можуть охоплювати осноприклад, РАС(О)О(С1-6)алкіл-СО-, де RA, напривно-адитивні солі сполук формули (1), які визначеклад, представляє бензилокси-(С1-4)алкіл, або фено вище, які є достатньо кислотними для ніл). Придатні замісники на фенілі в таких естерах утворення таких солей. Такі солі можна утворюваохоплюють, наприклад, 4-(С1-4)піперазино-(С1ти з неорганічною або органічною основою, яка 4)алкіл, піперазино-(С1-4)алкіл та морфоліно-(С1надає фармацевтично прийнятний катіон. Такі солі 4)алкіл. з неорганічними або органічними основами охопВ цьому описі термін "алкіл" охоплює алкіли з люють, наприклад, солі лужних металів, як-то лінерозгалуженим та розгалуженим ланцюгом. Одтію, натрію або калію, солі лужноземельних метанак посилання на окремі алкілгрупи, як-то "пропіл", лів, як-то кальцію або магнію, сіль амонію або сіль є характерними тільки для варіанту нерозгалужеорганічного аміну, наприклад, сіль метиламіну, ного ланцюгу, та посилання на окремі алкіли з роздиметиламіну, триметиламіну, триетиламіну, піпегалуженим ланцюгом як-то т-бутил є характерними ридину, морфоліну або трис-(2-гідроксіетил)аміну. тільки для варіанту з розгалуженим ланцюгом. Інші основно-адитивні солі містять алюміній, цинк, Наприклад, "С1-3алкіл" охоплює метил, етил, пробензатин, хлорпрокаїн, холін, діетаноламін, етанопіл та ізопропіл, а приклади "С1-6алкілу" охоплюламін, етилендіамін, меглумін, трометамін або ють приклади "С1-3алкілу", а крім того т-бутил, пенпрокаїн. тил, 2,3-диметилпропіл, 3-метилбутил та гексил. Подалі заявлений винахід стосується здатного Приклади "С1-8алкілу" охоплюють приклади "С1до гідролізу in vivo естеру сполуки формули (1). 6алкілу", а крім того гептил, 2,3-диметилпентил, 1Здатний до гідролізу in vivo естер сполуки формупропілбутил та октил. Аналогічні умови стосуються ли (1), який містить карбоксил або гідроксил, наінших термінів, наприклад, "С2-6алкеніл" охоплює приклад, є фармацевтично прийнятним естером, вініл, аліл, 1-пропеніл, 2-бутеніл, 3-бутеніл, 3який розщеплюється в організмі людини або тваметилбут-1-еніл, 1-пентеніл та 4-гексеніл, а прикрини, що продукує вихідну кислоту або спирт. Такі лади "С2-6алкінілу" охоплюють етиніл, 1-пропініл, естери можна ідентифікувати застосуванням тест3-бутиніл, 2-пентиніл та 1-метилпент-2-иніл. сполуки, наприклад, внутрішньовенно до тестова"С3-7карбоцикліл" - насичене, частково насиченої тварини та а потім дослідженням рідини з орне або ненасичене моноциклічне кільце, що місганізму тестованої тварини. тить 3-7 кільцевих атомів карбону де група -СН2може, як варіант, бути заміненою -С(О)-. Придатні 13 92463 14 приклади "карбоциклілу" - циклопропіл, циклопентіоморфолініл-1-оксид, тіоморфолініл-1,1-діоксид, тил, цикло-бутил, циклогексил, циклогексеніл, 4оксазинаноніл, хінуклідиніл та морфолініл. оксоциклогекс-1-ил та 3-оксоциклогепт-5-ен-1-іл. Зрозуміло, якщо довільні замісники вибрано із Термін "галоген" стосується флуору, хлору, "1, 2 або 3" груп, це визначення охоплює усі замісброму та йоду. ники, вибрані з одної з конкретних груп, або замісПриклади "С1-6алкоксилу" охоплюють метокники, вибрані з двох з більшої кількості конкретних сил, етоксил, пропоксил, ізопропоксил, бутилокгруп. Подібне правило стосується замісників, вибсил, пентилоксил, 1-етилпропоксил та гексилокраних із "1 або 2" груп. сил. Приклади "С1-6алкіламіно" охоплюють Прийнятні R1, R2, R3, та X такі: метиламіно, етиламіно, пропіламіно, бутиламіно та R1 - С1-8алкіл, де групу заміщено фенілом, як 2-метилпропіламіно. Приклади "ді(С1-6алкіл)аміно" варіант, заміщено 1, 2 або 3 замісниками, незалеохоплюють диметиламіно, N-метил-N-етиламіно, жно вибраними із групи: флуор, хлор, бром, методіетиламіно, N-пропіл-N-3-метилбутиламіно. Прикксил, метил та трифлуорометил. лади "N-(С1-6алкіл)-N-(феніл)аміно" охоплюють NХ - -СН2-, зв'язок, оксиген, сульфур, сульфокметил-N-феніламіно, N-пропіл-N-феніламіно та Nсид, або сульфон; (2-метилбутил)-N-феніламіно. Приклади "N-(С1R2 - С1-8алкіл, який, як варіант, заміщено 1, 2 N-метилкарбамоїл, Nабо 3 замісниками, незалежно вибраними з групи: 6алкіл)карбамоїлу" етилкарбамоїл та N-(2-етилбутилкарбамоїл. ПрикС1-6алкоксил, гідроксил та флуор; або лади "N-(С1-6алкіл)-N-(феніл)карбамоїл" охоплюR2 - 5-6-членне кільце, що містить, як варіант, ють N-метил-N-фенілкарбамоїл, N-бутил-N1,2 або 3 гетероатоми, вибрані з О, S, -NR8, і де фенілкарбамоїл та N-(3-метилпентил)-Nкільце, як варіант, є заміщеним -OR4. (феніл)карбамоїл. Приклади "N,N-дi(С1R3 - С3-7карбоцикліл, С1-8алкіл, -NR5R6, феніл, алкіл)карбамоїлу" охоплюють Ν,Νмоноциклічний або біциклічний гетероарил, де 6 диметилкарбамоїл, N-метил-N-етилкарбамоїл та гетерокільце може бути частково або повністю N-пропіл-N-(2-метилбутил)карбамоїл. Приклади насиченим, та один або більше кільцевих атомів "С1-6алкілтіо" охоплюють метилтіо, етилтіо, пропілкарбону можуть утворювати карбонільну групу, і тіо, бутилтіо та 2-метилбутилтіо. де кожний феніл або гетероарил, як варіант, є за"Гетероарил" - моноциклічне або біциклічне міщеним 1, 2 або 3 замісниками, незалежно вибарильне кільце, що містить 5-10 кільцевих атомів, раними із групи: ціано, гетероарил, -OR4, -NR5R6, з яких 1, 2, 3 або 4 кільцеві атоми вибрано із нітроCONR5R6, -COR7-, -COR20, -NR8COR9, -SO2R10, гену, сульфуру або оксигену. Приклади гетероаSO2NR5R6, С1-6алкіл (як варіант, крім того заміщерилу охоплюють піроліл, фураніл, тієніл, тіазоліл, ний 1, 2 або 3 замісниками, незалежно вибраними 20 20 18 19 18 19 ізотіазоліл, оксазоліл, ізоксазоліл, імідазоліл, піраіз групи: -OR , -COR , -NR R , -CONR R , фезоліл, триазоліл, тетразоліл, ізоксадіазоліл, оксаніл, моноциклічний або біциклічний гетероарил, де діазоліл, ізотіадіазоліл, тіадіазоліл, піридил, піригетерокільце може бути частково або повністю мідиніл, піразиніл, піридазиніл, триазиніл, насиченим; і де кожний феніл або гетероарил, як піридиноніл, піримідиндіоніл, бензфураніл, бензтіваріант, є заміщеним 1, 2 або 3 замісниками, неєно, індоліл, бензімідазоліл, бензоксазоліл, бензтізалежно вибраними із групи: нітро, -OR20, -NR5R6, азоліл, індазоліл, бензізоксазоліл, бензізотіазоліл, NR8COR9, гетероарил, С1-6алкіл (як варіант, крім бензтриазоліл, хінолініл, ізохінолініл, 4Н-хромен-4того заміщений 1, 2 або 3 замісниками, незалежно оніл, тетрагідрохінолініл, тетрагідроізохінолініл, та вибраними із групи: ціано, -OR20). нафтиридиніл. Гетероарил легко вибрано із групи: Прийнятні R4-R17 такі: імідазоліл, піразоліл, тіазоліл, ізоксазоліл, фураR4 - гідроген або С1-6алкіл; ніл, тієніл, ізоксазоліл або індазоліл. Повністю наR5 та R6 вибрано із групи: С1-6алкіл, або R5 та сичені гетероциклічні кільця охоплюють приклади, R6 разом з атомом нітрогену, до якого вони приєдяк-то оксетаніл, азетидиніл, піролідиніл, тетрагіднані, утворюють 4 - 7-членне насичене гетероцикрофураніл, ізоксазолідиніл, тетрагідропіраніл, пілічне кільце, що містить, як варіант, додатковий перидиніл, піперазиніл, піперазиноніл, морфолініл, гетероатом, вибраний із оксигену та нітрогену. тіоморфолініл, тіоморфолініл-1-оксид, тіоморфоліR7, R8, R9, R11, R12, R13, R14 R15, R16, R17, незаніл-1,1-діоксид, оксазинаноніл, хіноклідиніл, гомолежно, - гідроген, С1-6алкіл або феніл. піперидиніл та гомопіперазиніл, 9-метил-3,9Прийнятні R18-R20 такі: діазабіцикло[4,2,1]нонаніл та тетрагідропіридиніл. R18, R19 та R20 - гідроген, феніл, гетероарил, Приклади "3-8-членного кільця, що містить, як або С1-6алкіл (як варіант, крім того заміщений варіант, 1, 2 або 3 атоми, вибрані із О, S та NR8", NR8R9). охоплюють оксетаніл, азетидиніл, бензодіазоліл, Переважні R1, R2, R3, та X такі: піролідиніл, тетрагідрофураніл, ізоксазолідиніл, R1 - С1-3алкіл (як-то -СН2-, -(СН2)2-, -(СН2)3-, тетрагідротіофеніл, тетрагідропіраніл, піперидиніл, СН2(СН3)- або -СН2(СН3)СН2-), де групу заміщено піперазиніл, піперазиноніл, морфолініл, тіоморфофенілом, як варіант, заміщено 1, 2 або 3 заміснилініл, тіоморфолініл-1-оксид, тіоморфолініл-1,1ками, незалежно вибраними із групи: флуор та діоксид, оксазинаноніл, хінуклідиніл, гомопіперихлор. Бензил є особливо переважним. диніл та гомопіперазиніл тетрагідро-діоксаніл. X - -СН2-, зв'язок, оксиген, або сульфур. ОксиПриклади "4-7-членної насиченої гетероциклічної ген є особливо переважним. кільцевої системи" охоплюють азетидиніл, піроліR2 - С1-8алкіл, як-то С1-4алкіл, де група, як варідиніл, ізоксазолідиніл, піперидиніл, піперазиніл, ант, є заміщеною 1 або 2 замісниками, незалежно піперазиноніл, гомопіперазиніл, тіоморфолініл, вибраними із групи: С1-3алкоксил (як-то метоксил, етоксил, циклопропілоксил або ізопропілоксил), 15 92463 16 гідроксил та флуор, гідроксил є особливо переваN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2жним; або гідрокси-1-метилетокси]-4-піримідиніл]-1R2 - 5-членне кільце, що містить, як варіант, азетидинсульфонамід гетеро атом, вибраний із О або -NR8, і де кільце, як N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2варіант, є заміщеним -OR4. гідрокси-1-метилетокси]-4-піримідиніл]3 R - С1-3алкіл (як-то метил, етил, ізопропіл або метансульфонамід циклопропіл) або -NR5R6 (як-то азетидиніл, піроліN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2диніл, морфолініл, піперидиніл, піперазиніл), фегідрокси-1-метилетокси]-4-піримідиніл]-4ніл, моноциклічний або біциклічний гетероарил морфолінсульфонамід (як-то 1-метилімідазоліл або 1,2N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2диметилімідазоліл). гідрокси-1-метилетокси]-4-піримідиніл]-1Переважні R4-R17 такі: піролідинсульфонамід R4 - гідроген, або С1-3алкіл (як-то метил, етил, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2циклопропіл або ізопропіл) гідрокси-1-метилетокси]-4-піримідиніл]R5 та R6 вибрано із групи: С1-2алкіл (як-то мециклопропансульфонамід тил та етил) або R5 таR6 разом з атомом нітрогеN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2ну, до якого вони приєднані, утворюють 4- -- 6гідрокси-1-метилетокси]-4-піримідиніл]-1-метилчленне насичене гетероциклічне кільце (як-то азе1Н-імідазол-4-сульфонамід тидиніл, піролідиніл, піперидиніл) або, що містить, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6як варіант, додатковий гетероатом, вибраний із метоксипіримідин-4-іл]азетидин-1-сульфонамід оксигену (як-то морфолініл) або нітрогену (як-то N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6піперазиніл). метоксипіримідин-4-іл]піперазин-1-сульфонамід R7, R8, R9, R11, R12, R13, R14 R15, R16, R17, незаN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6лежно, - гідроген або С1-2алкіл (як-то метил або метоксипіримідин-4-іл]-1-метил-1Н-імідазол-4етил). сульфонамід Переважні R18-R20 такі: N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6R18, R19 та R20 - гідроген або С1-6алкіл (як варі{[(1R,2R)-2,3-дигідрокси-1-метилпропіл]окси}-4ант, крім того заміщений NR8R9). піримідиніл]-1-азетидинсульфонамід Такі позначення можна застосовувати там, де N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6вони прийнятні з будь-якими визначеннями, фор[[(1R,2R)-2,3-дигідрокси-1-метилпропіл]окси]-4мулою винаходу або втіленнями, описаними вище піримідиніл]-метансульфонамід або нижче. N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6Конкретні сполуки винаходу охоплюють: {[(1R,2S)-2,3-дигідрокси-1-метилпропіл]окси}-4N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2піримідиніл]-1-азетидинсульфонамід гідрокси-1-(гідроксиметил)етокси]-4-піримідиніл]-1N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6азетидинсульфонамід {[(1R,2S)-2,3-дигідрокси-1-метилпропіл]окси}-4(R,S)-N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6піримідиніл]-1-піперазинсульфонамід [3,4-дигідроксибутил]піримідин-4-іл]азетидин-15-(азетидин-1-ілкарбоніл)-N-{2-[(2,3сульфонамід; та дифлуоробензил)тіо]-6-[(1R)-2-гідрокси-1N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3метилетокси]піримідин-4-іл}фуран-2-сульфонамід гідрокси-2-(гідроксиметил)пропіл]піримідин-4Кожна з вищезазначених сполук та фармацевіл]азетидин-1-сульфонамід тично прийнятних солей, сольватів або їхніх здатN-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1R,2R)-2них до гідролізу in vivo естерів, узятих окремо, є гідрокси-1-метилпропіл]окси}піримідин-4конкретним аспектом винаходу. іл)азетидин-1-сульфонамід: та Заявлений винахід подалі стосується способу N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1S,2S)-2отримання сполук формули (1) як описано вище, гідрокси-1-метилпропіл]окси}піримідин-4який полягає у: іл)азетидин-1-сульфонамід (а) обробці сполуки формули (2а): N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2S)2,3-дигідроксипропіл]окси]-4-піримідиніл]-1азетидинсульфонамід N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2гідрокси-1-(гідроксиметил)-1-метилетокси]-4піримідиніл]-1-азетидинсульфонамід N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2гідрокси-1-метилетокси]-4-піримідиніл]-2тіазолсульфонамід де R1, R2 та X описано у формулі (1), a L - відN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2щеплювана група, як-то галоген, з сульфонамідагідрокси-1-метилетокси]-4-піримідиніл]-4ми (R3SO2NH2), де R3 описано у формулі (1). піридинсульфонамід та, як варіант, потім - (і), (іі), (ііі), (iv), або (ν) у N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2будь-якому порядку: гідрокси-1-метилетокси]-4-піримідиніл]-1і) видалення будь-яких захисних груп; піперазинсульфонамід іі) перетворення сполуки формули (1) в іншу N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2сполуку формули (1) гідрокси-1-метилетокси]-4-піримідиніл]-1,6-дигідроііі) утворення солі 1-метил-6-оксо-3-піридинсульфонамід 17 92463 18 iv) утворення проліків етери, як-то анізол, тетрагідрофуран, 1,4-діоксан, ν) утворення здатного до гідролізу in vivo естеглім та диглім. ру. Також, сполуки формули (1), де R1 та R3 опи1 2 Реакцію сполуки формули (2а), де R , R та X сано у формулі (1), L - відщеплювана група, як-то описано у формулі (1), з сульфона-мідами галоген, PG - прийнятна захисна група або гідро3 3 (R SO2NH2), де R описано у формулі (1), можна ген, а X - -СН2- або зв'язок, можна отримати з спопроводити у присутності придатної основи, розлуки формули (2b), де R2 описано у формулі (1) чиннику та каталізатору при термальному або мікобробкою придатним алкеном згідно умов реакції рохвильовому нагріванні. Приклади придатної остипу "сполучення Хека" (Synlett, 2003, no 8 рр. нови охоплюють метал карбонати, як-то цезію, 1133-1136) або з придатною бороновою кислотою калію, літію або натрію. Найкращим є застосуванабо естером згідно умов реакції типу "сполучення ня цезій карбонату. Придатні розчинники охоплюСузукі" (JACS, 1999, по 121, рр. 9550-9561, JACS ють толуол та етери, як-то анізол, тетрагідрофу2001, по 123, рр. 10099-10100) у присутності приран, 1,4-діоксан, глім та диглім. Переважним є датного паладієвого каталізатору, ліганду, солі, застосування 1,4-діоксану. Температура реакції основи та розчиннику при термальному або мікроможе бути між 10°С та 120°С, переважно дорівнює хвильовому нагріванні. 100°С. Приклади придатних каталізаторів охопПриклади придатних паладієвих каталізаторів, люють придатне джерело паладію(0), як-то палалігандів, солей, основ та розчинників для сполудій трис(дибензиліденацетон)дипаладій(0) чень типу "Хека" охоплюють (Pd2(dba)3), або тетракістрифенілфосфінпаладій трис(дибензиліденацетон)дипаладій(0) (Pd2(dba)3), (Pd(Ph3)4) (кожний в 0,01-0,5 моль еквівалентах) у або паладій діацетат (Pd(OAc)2); додаткові солі присутності придатного ліганду, як-то (9,9охоплюють калій хлорид, тетра-N-бутиламоній диметил-9Н-ксантен-4,5-діїл)біс[дифенілфосфін хлорид; основи охоплюють три-Ν-бутиламін або (Ксантфос), або 2-дициклогексил-фосфіно-2'-(N,Nди-ізопропілетиламін; а розчинники охоплюють диметиламіно)біфеніл або 2-дициклогексилΝ,Ν-диметилформамід або N-метил-піролідин-2фосфіно-2',4',6'-три-ізопропіл,1,1'-біфеніл (XPHOS) он. (кожний в 0,01-0,5 моль еквівалентах). ПереважПриклади придатних паладієвих каталізаторів, ною комбінацією каталізатору є лігандів, солей, основ та розчинників для сполутрис(дибензиліденацетон)дипаладій(0) (Pd2(dba)3) чень типу "Сузукі" охоплюють паладій діацетат; з з 2-дициклогексил-фосфіно-2',4',6'-трилігандами три-циклогексилфосфін, або 2,2'бісізопропіл,1,1'-біфенілом (Xphos) в 0,01-0,5 моль дициклогексил-фосфіно-1,1'-біфеніл або ди-теквівалентах 1,4-діоксану при 100°С з цезій карбобутил-фосфіно-1,1'-біфеніл або три-тнатом, як основою; бутилфосфін; з калій фосфатом (K3РО4) або калій або (b) обробці сполуки формули (2b): флуоридом у тетрагідрофурані або 1,4-діоксані. Сполуки формули (2а), де R1, та R2 описано у формулі (1), а X - оксиген або сульфур, можна отримати з сполуки формули (3), де R1 описано у формулі (1), a L - відщеплювана група, як-то галоген, обробкою спиртами HOR2 або тіолами HSR2, де R2 описано у формулі (1), у присутності придатної основи та розчиннику. де R1 та R3 описано у формулі (1), L - відщеплювана група, як-то галоген, PG - прийнятна захисна група або гідроген, і де X - оксиген або сульфур, спиртами HOR2 або тіолами HSR2, відповідно, де R2 описано у формулі (1), у присутності придатної основи та розчиннику, та, як варіант, потім - (і), (іі), (ііі), (iv), або (ν) у будь-якому порядку: і) видалення будь-яких захисних груп; іі) перетворення сполуки формули (1) в іншу сполуку формули (1) ііі) утворення солі iv) утворення проліків ν) утворення здатного до гідролізу in vivo естеру. Приклади придатних основ охоплюють гідриди лужних металів, як-то Na або K, або алкоксиди металів, як-то Li, Na або K-трет-бутоксид, гексаметилдисилазиди лужних металів, як-то Li, Na або Kгексаметилдисилазид, або карбонати металів, якто Na, K, Cs. Придатні розчинники охоплюють Ν,Νдиметиламіди, 1-метил-2-піролідинон, толуол та Приклади придатних основ охоплюють гідриди лужних металів, як-то Na або K, або алкоксиди металів, як-то Li, Na або K-трет-бутоксид, гексаметилдисилазиди лужних металів, як-то Li, Na або Kгексаметилдисилазид, або карбонати металів, якто Na, K, Cs. Придатні розчинники охоплюють Ν,Νдиметиламіди, 1-метил-2-піролідинон, етери, як-то тетрагідрофуран, 1,4-діоксан, глім та диглім. Переважно застосовується натрій гідрид у тетрагідрофурані при температурі від помірної до температури кипіння під зворотним холодильником. Також сполуки формули (2а), де R1 та R2 описано у формулі (1), а X - -СН2- або зв'язок, можна отримати зі сполуки формули (3), де R1 описано у формулі (1), a L - відщеплювана група, як-то галоген, обробкою придатним алкеном згідно умов реакції типу "сполучення Хека" (Synlett, 2003, no 8 19 92463 20 pp. 1133-1136) або придатною бороновою кислоСполуки формули (3), де R1 описано у формутою, або естером згідно умов реакції типу "сполулі (1), a L - галоген, можна отримувати з сполуки чення Сузукі" (JACS, 1999, по 121, pp. 9550-9561, формули (3), де R1 описано у формулі (1), a L JACS 2001, по 123, pp. 10099-10100) у присутності ОН, реакцією з засобом галогенування, як-то фопридатного паладіевого каталізатору, ліганду, сосфористим оксихлоридом. Реакцію можна виконулі, основи та розчиннику при термальному або вати у присутності Ν,Ν-диметиланіліну при нагрімікрохвильовому нагріванні. ванні зі зворотним холодильником. Для сполучень типу "Хека" приклади придатСполуки формули (3), де R1 описано у формуних паладієвих каталізаторів, солей, основ та розлі (1), a L - ОН; чинників охоплюють трис(дибензиліденацетон)дипаладій(0) (Pd2(dba)3 ), або паладій діацетат (Pd(OAc)2); адитивні солі охоплюють калій хлорид, тетра-N-бутиламоній хлорид; основи охоплюють τρπ-Ν-бутиламін або ди-ізопропілетиламін; розчинники охоплюють Ν,Νдиметилформамід або N-метил-піролідин-2-он. Переважно застосовується паладій діацетат з тетможна отримувати з сполуки формули (4), де L ра-N-бутиламоній хлоридом, з основою три-N- ОН, реакцією з алкіл галогенідами (R1A), де R1 бутиламін у Ν,Ν-диметилформаміді при 95°С. описано у формулі (1), та А є галогеном, у присутПриклади придатних паладієвих каталізаторів, ності придатної основи та розчиннику. лігандів, солей, основ та розчинників для сполуПриклади придатних основ охоплюють гідрокчень типу "Сузукі" охоплюють паладій діацетат; з сиди лужних металів, як-то Li, Na, або K, або карлігандами три-циклогексилфосфін, або 2,2'бісбонати металів, як-то Li, Na, K або Cs, або металдициклогексил-фосфіно-1,1'-біфеніл або ди-тацетати, як-то Li, Na, K або Cs, або алкоксиди мебутил-фосфіно-1,1'-біфеніл або три-тталів, як-то Li, Na, K трет-бутоксид. Придатні розбутилфосфін; з калій фосфатом (K3РО4) або калій чинники охоплюють воду, Ν,Ν-диметиламіди, 1флуо-ридом у тетрагідрофурані або 1,4-діоксані. метил-2-піролідинон, етери, як-то тетрагідрофуПереважно застосовується паладій діацетат з ліран, 1,4-діоксан, глім та диглім, та спирти, як-то гандом 2,2'біс-дициклогексил-фосфіно-1,1'-біфеніл метанол, етанол та трет-бутанол або ацетонітрил. з калій фосфатом (K3РО4) у тетрагідрофурані при Переважно застосовано натрій ацетат в ацетоніттемпературі дефлегмації. рилі та воді при температурі 40°С. Сполуки формули (2b), де R1 та R3 описано у Сполуки формули (4) - комерційно доступні, формулі (1), L - відщеплювана група, як-то галодобре відомі в літературі, або їх можна легко ген, a PG є придатною захисною групою або галоотримувати, застосовуючи відомі способи. геном, можна отримувати реакцією сполук формуВ кожних описаних вище варіантах отримання ли (3), де R1 описано у формулі (1), a L сполуки формули 1 або її фармацевтично прийнявідщеплювана група, як-то галоген, з сульфонамітної солі, сольвату, або здатного до гідролізу in дами (R3SO2NHPG), де R3 описано у формулі (1), vivo естеру, кожна з визначених прийнятних або та PG є придатною захисною групою або гідрогепридатних речовин або умов реакції представляє ном, у присутності придатної основи, розчиннику окремий та відмінний аспект заявленого винаходу. та каталізатору при термальному або мікрохвиСлід добре розуміти спеціалістам у рівні технільовому нагріванні. ки, що в способах заявленого винаходу деякі фунта, як варіант, потім - (і) або (іі) у будь-якому кціональні групи, як-то гідроксили або аміногрупи у порядку: вихідних реагентах або інтермедіатах можуть поті) додавання будь-яких захисних груп; ребувати захисту захисними групами. Таким чином іі) перетворення сполуки формули (2b) в іншу отримання сполук формули (1) на відповідній стасполуку формули (2b). дії може охоплювати видалення одної або більше Приклади придатних основ охоплюють гідриди захисних груп. Захист та зняття захисту функціолужних металів, як-то Na або K, або алкоксиди нальних груп повністю описано в 'Protective Groups металів, як-то Li, Na або K-трет-бутоксид, гексамеin Organic Chemistry', edited by J. W. F. McOmie, тилдисилазиди лужних металів, як-то Li, Na або KPlenum Press (1973), та 'Protective Groups in гексаметилдисилазид, або карбонати металів, якOrganic Chemistry Synthesis', 2nd edition, T. W. то Na, K, Cs. Придатні розчинники охоплюють ацеGreene & P. G. M. Wuts, Wiley-lnterscience (1991). тонітрил, тетрагідрофуран, 1,4-діоксан, глім та Приклади прийнятних відщеплюваних груп надиглім. Температура реакції може бути 10°Сведено у звичайних хімічних посібниках, як-то 120°С. Приклади придатних каталізаторів охоп"Organic Chemistry" by Jonathan Clayden et al, люють придатне джерело паладію(0), як-то тетраpublished by Oxford University Press (3rd Edn 2005) кістрифенілфосфінпаладій (Pd(Ph3)4) або Вони охоплюють галоген, мезилат та тозилат. Гатрис(дибензиліденацетон)дипаладіи(0) (Pd2(dba)3) логен, як-то хлор - переважна відщеплювана груу присутності придатного ліганду, як-то (9,9па. диметил-9Н-ксантен-4,5-діїл)біс[дифенілфосфін Сполуку формули (1) можна отримувати з ін(Ксантфос), або 2-дициклогексил-фосфіно-2'-(N,Nшої сполуки формули (1), а сполуку формули (2b) диметиламіно)біфеніл або 2-дициклогексилможна отримувати з сполуки формули (2b) хімічфосфіно-2',4',6'-три-ізопропіл,1,1'-біфеніл ними модифікуваннями. Приклади хімічних моди(XPHOS). фікувань охоплюють звичайне алкілування, ари 21 92463 22 лування, гетероарилування, ацилування, сульфомоліз, кропив'янка, ангіодерміт, васкуліт, еритема, нілування, фосфорилування, ароматичне галогешкіряна еозо-нофілія, увеїт, осередкове облисіння нування та реакції сполучення. Ці реакції можна та весняний кон'юнктивіт; проводити додаванням нових замісників або мо(4) шлунково-кишковий тракт - хвороба чередифікуванням існуючих замісників. Альтернативно ревної порожнини, проктит, еозинофільні гастроеіснуючі замісники в сполуках формули (1) та форнтерити, мастоцитоз, хвороба Крона, виразковий мули (2b) можна модифікувати, наприклад, окисколіт, сумнівний коліт, мікроскопічний коліт, запаненням, відновленням, елімінуванням, гідролізом льна хвороба кишечнику, синдром подразненої або іншими реакціями розкладу, що дає інші спотовстої кишки, незапальна діарея, харчові алергії, луки формули (1) та формули (2b) відповідно. котрі мають ефекти віддалені від кишок, наприСполуки формули (2а) клад, мігрень, риніт та екзема; (5) центральна та периферійна нервова система - нейродегенеративні хвороби та деменційні розлади, наприклад хвороба Альцгеймера, бічний аміотрофічний склероз та інші хвороби моторних нейронів, хвороба Крейтцфельдта-Якобса та інші пріонні хвороби, енцефалопатія ВІЛ (Комплекс слабоумства при СНІД), хвороба Хантінгтона, лобно-скроневе слабоумство та судинне слабоумство; поліневропатії, наприклад, інфекційний полінев1 2 де R , R та X описано у формулі (1), a L - відрит, хронічна запальна демієлінізувальний поліра1 щеплювана група, як-то галоген, за умови, якщо R дикулоневрит, мультифокальна рухова невропа2 - бензил, X - оксиген, R - метил, тоді L не є хлотія, плексопатії; демієлінізація ЦНС, наприклад, 1 2 ром, або коли R - бензил, X - зв'язок, R - пропіл, розсіяний склероз, гострий розсіяний /геморагічний тоді L не є хлором, представляють подальший енцефаломієліт, та підгострий склерозуючий пааспект винаходу. ненцефаліт; нейром'язові розлади, наприклад, Вищенаведені сполуки формули (1) можна пезлоякісна міастенія та синдром Ламберта-Ітона; ретворити у фармацевтично прийнятну сіль, сольспинальні розлади, наприклад, тропічний спастичват, або здатний до гідролізу in vivo їх естер, розгний парапарез, та синдром задубіння людини; палянуто вище. Сіль - переважно основно-адитивна ранеопластичні синдроми, наприклад, мозочкова сіль. дегенерація та енцефаломієліт; травма ЦНС; мігСполуки формули (1) мають активність фаррень; та інсульт. мацевтичних препаратів, особливо як модулятори (6) інша хвороба тканин та системна хвороба активності рецептору хемокіну (особливо CXCR2), атеросклероз, синдром набутого імунодефіциту та їх можна застосовувати в лікуванні (терапевти(СНІД), червоний вовчак, системний вовчак, еричному або профілактичному) станів/хвороб у лютематоз, тиреоїдит Хашимото, діабет І типу, нефдини та тварин, які підсилюються або спричинюротичний синдром, еозинофілія фасцит, гіпер-ІgЕються надлишковим або нерегульованим синдром, лепроматозна лепра та геморагічна пурпродукуванням хемокінів. Приклади таких стапура; післяопераційне рубцеве зрощення та сепнів/хвороб охоплюють (кожний взято незалежно): сис. (1) дихальний тракт - обструктивні хвороби ди(7) відторгнення алотрансплантату - гостре та хальних шляхів, охоплюючи хронічну обструктивну хронічне, наприклад, після трансплантації нирок, легеневу хворобу (ХОЛХ); астму, як-то бронхіальсерця, печінки, легенів, кісткового мозку, шкіри та ну, алергічну, інфекційно-алергічну, екзогенну асрогівки; та хронічна хвороба трансплантат проти тму та пилову астму, особливо хронічну або захазяїна; старілу астму (наприклад, пізню астму та (8) ракові пухлини - особливо недрібноклітингіперчутливість дихальних шляхів); бронхіт; гостний рак легень (NSCLC), злоякісна меланома, рак рий, алергічний, атрофічний риніт та хронічний простати та луската саркома та пухлинні метастариніт, охоплюючи казеозний риніт, гіпертрофічний зи, немеланомний рак шкіри та хемозапобігання риніт, гнійний риніт, сухий риніт та медикаментозметастазів; ний риніт; мембранний риніт, охоплюючи крупоз(9) хвороби, в яких ангіогенез асоційовано з ний, фібринозний та псевдомембранний риніт та підвищеними рівнями хемокіну CXCR2 (наприклад, золотушний риніт; сезонний риніт, охоплюючи неNSCLC, діабетична ретинопатія); рвову нежить (сінна пропасниця) та вазомоторний (10) кістозний фіброз; риніт; саркоїдоз, легені фермера та споріднені (11) рана від опіків та хронічні виразки шкіри; хвороби, фіброїдні легені та ідіопатична інтерсти(12) реппродуктивні хвороби - наприклад, розціальна пневмонія; лади овуляції, менструації та імплантації, перед(2) кістки та суглоби - ревматоїдний артрит, часні пологи, ендометріоз; серонегативні спондилоартропатії (охоплюючи (13) травма від повторної перфузії - у серці, анкілозуючий спондиліт, псоріатичний артрит та мозку, периферійних кінцівках та інших органах, хворобу Рейтера), хвороба Бекхета, синдром Шегінгібування атеросклерозу. рена та системний склероз; Таким чином, заявлений винахід стосується (3) шкіра - псоріаз, атопічний дерматит, контасполуки формули (1), або її фармацевтично приктний дерматит та інші екзематозний дерматит, йнятної солі, сольвату або здатного до гідролізу in себорейний дерматит, лишайникова платиподія, vivo естеру, які визначено вище, для застосування пемфігус, бульозний пемфігус, бульозний епідеру терапії. 23 92463 24 Переважно сполуки винаходу застосовують Згідно з ще одним аспектом заявлений винахід для лікування хвороб, де рецептор хемокіну налестосується застосування сполуки формули (1), або жить до надсімейства СХС-рецепторів хемокіну, її фармацевтично прийнятної солі, сольвату, або більш переважно, цільовим рецептором хемокіну є здатного до гідролізу in vivo естеру, які визначено рецептор CXCR2. вище, у виготовленні медикаменту для лікування Конкретними станами, які можна лікувати споастми, алергічного риніту, раку, ХОЛХ, ревматоїдлуками винаходу є рак, хвороби, в яких ангіогенез ного артриту, псоріазу, запальних кишкових хвоасоційовано з підвищеними рівнями хемокіну роб, остеоартриту або остеопорозу. CXCR2, та запальні хвороби, як-то астма, алергічУ контексті заявленого опису, термін "терапія" ний риніт, ХОЛХ, ревматоїдний артрит, псоріаз, також охоплює "профілактику" якщо немає особзапальні хвороби кишечнику, остеоартрит або ливих показань супроти. Терміни "терапевтичний" остеопороз. та "терапевтично" слід тлумачити відповідно. Згідно з подальшим аспектом заявленого виТакож згідно з винаходом запропоновано спонаходу сполуки формули (1) можуть бути кориссіб лікування опосередкованої хемокіном хвороби, ними як антагоністи рецептору CX3CR1. Очікуєтьде хемокін зв'язується з рецептором хемокіну ся, що такі сполуки особливо корисні в лікуванні (особливо CXCR2), який полягає у застосуванні розладів центральної та периферійної нервової пацієнту терапевтично ефективної кількості сполусистеми та інших станів, для яких характерна акки формули, або фармацевтично прийнятної солі, тивація мікроглії та/або інфільтрація лейкоцитів сольвату, або здатного до гідролізу in vivo естеру, (наприклад, інсульт/ішемія та травма голови). Зокякі визначено вище. рема, сполуки показані для застосування в лікуЗгідно з винаходом також запропоновано спованні нейродегенаративних розладів або демієлісіб лікування запальних хвороб, головним чином нізуючої хвороби ссавців, охоплюючи людину. астми, алергічного риніту, ХОЛХ, ревматоїдного Особливо сполуки показані для застосування в артриту, псоріазу, запальних кишкових хвороб, лікуванні розсіяного склерозу. Також показано, що остеоартриту або остеопорозу у пацієнта, потерсполуки корисні в лікуванні болю, ревматоїдного паючого від названих хвороб або при ризику наартриту, остеоартриту, інсульту, атеросклерозу та званих хвороб, який полягає у застосуванні пацієлегеневої артеріальної гіпертензії. нтом терапевтично ефективної кількості сполуки Сполуки винаходу також можна застосовувати формули (1), або її фармацевтично прийнятної для лікування хвороб, в яких рецептор хемокіну солі, сольвату, або здатного до гідролізу in vivo належить до надсімейства CCR-рецепторів хемоестеру, які визначено вище. кіну, більш переважно, цільовим рецептором хеДля вищенаведених терапевтичних застосумокіну є рецептор CCR2b. вань призначене дозування слід, кінцево, змінюваЗгідно з наступним аспектом заявлений винати залежно від застосованої сполуки, способу захід стосується сполуки формули (1) або її фармастосування, бажаного лікування та вказаного цевтично прийнятної солі, сольвату або здатного розладу. до гідролізу in vivo естеру, які визначено вище, для Сполуки формули (1) та їхні фармацевтично застосування як медикаменту. прийнятні солі, сольвати або здатні до гідролізу in Згідно з ще одним аспектом заявлений винахід vivo естери можна застосовувати як такі, але звистосується застосування сполуки формули (1), або чайно слід застосовувати у вигляді фармацевтичїї фармацевтично прийнятної солі, сольвату, або ної композиції, у якій сполука/сіль/сольват/естер здатного до гідролізу in vivo естеру, як визначено формули (1) (активна складова) є в асоціації з фавище, для застосування як медикаменту для лікурмацевтично прийнятним ад'ювантом, розріджувавання хвороб людини або станів, в яких є корисчем або носієм. Залежно від способу застосуванним модулювання активності рецептору хемокіну. ня, фармацевтична композиція переважно Згідно з ще одним аспектом заявлений винахід повинна містити 0,05-99 мас.%, переважніше 0,05стосується застосування сполуки формули (1), або 80 мас.%, ще переважніше 0,10-70 мас.%, та наїї фармацевтично прийнятної солі, сольвату, або віть переважніше 0,10-50 мас.% активної складоздатного до гідролізу in vivo естеру, які визначено вої. вище, для застосування як медикаменту для лікуЗгідно із заявленим винаходом також запрованні астми, алергічного риніту, раку, ХОЛХ, ревпоновано фармацевтичну композицію, яка містить матоїдного артриту, псоріазу, запальних кишкових сполуку формули (1), або її фармацевтично прихвороб, остеоартриту або остеопорозу. йнятну сіль, сольват, або здатний до гідролізу in Згідно з наступним аспектом заявлений винаvivo її естер, які визначено вище, у поєднанні з хід стосується застосування сполуки формули (1), фармацевтично прийнятним ад'ювантом, розріабо її фармацевтично прийнятної солі, сольвату, джувачем або носієм. або здатного до гідролізу in vivo естеру, які визнаЗгідно з винаходом подалі запропоновано спочено вище, у виготовленні медикаменту для засіб отримання фармацевтичної композиції винахостосування у терапії. ду, яка містить суміш сполуки формули (1), або її Згідно з ще одним аспектом заявлений винахід фармацевтично прийнятної солі, сольвату, або стосується застосування сполуки формули (1), або здатного до гідролізу in vivo естеру, які визначено її фармацевтично прийнятної солі, сольвату, або вище, з фармацевтично прийнятним ад'ювантом, здатного до гідролізу in vivo естеру, які визначено розріджувачем або носієм. Фармацевтичні комповище, у виготовленні медикаменту для лікування зиції можна застосовувати місцево (наприклад, до хвороб людини або станів, у якому є корисним легенів та/або дихальних шляхів або шкіри) у вимодулювання активності рецептору хемокіну. гляді розчинів, суспензій, аерозолів гептафлуоро 25 92463 26 алкану та сухих порошкових композицій; або сисціанохіноліну, як-то L-746,530; сполуки індолу та темно, наприклад, пероральним застосуванням у хіноліну, як-то МK-591, МK-886, та BAY х 1005. вигляді таблеток, капсул, сиропів, порошків або Заявлений винахід крім того стосується комгранул, або парентеральним застосуванням у випозиції сполуки винаходу з речовиною з групи: гляді розчинів або суспензій, або підшкірним заантагоніст рецептору лейкотриєнів LTB.sub4., стосуванням або ректальним застосуванням у виLTC.sub4., LTD.sub4., та LTE.sub4. вибрано із гругляді супозиторіїв або трансдермально. пи: фенотіазин-3-они, як-то L-651,392; амідиноПереважно сполуки винаходу застосовано перосполуки, як-то CGS-25019c; бензоксаламіни, як-то рально. онтазоласт; бензолкарбоксімідаміди, як-то BIIL Крім їх застосування як терапевтичних меди284/260; та сполуки, як-то зафірлукаст, аблукаст, каментів, сполуки формули (1) та їх фармацевтичмонтелукаст, пранлукаст, верлукаст (МK-679), RGно прийнятні солі, сольвати або здатні до гідролізу 12525, Ro-245913, іралукаст (CGP 45715А), та BAY in vivo естери є також корисними як фармакологічx 7195. ні засоби в розвитку та стандартизації тест-систем Заявлений винахід крім того стосується комin vitro та in vivo для визначення ефекту модулюпозиції сполуки винаходу з інгібітором PDE4, охопвання активності хемокіну на лабораторних тварилюючи інгібітори ізоформи PDE4D. нах, як-то котах, собаках, кролях, мавпах, пацюках Заявлений винахід крім того стосується комта мишах, як частина пошуку нових терапевтичних позиції сполуки винаходу з антагоністами антигісзасобів. тамінного рецептору H.sub1., як-то цетиризин, лоВинахід подалі стосується комбінованих лікуратадин, деслоратадин, фексофенадин, вань, де сполуку формули (1) або фармацевтично астемізол, азеластин та хлорфенірамін. прийнятні солі, сольват, або здатний до гідролізу Заявлений винахід крім того стосується комin vivo її естер, або фармацевтичну композицію позиції сполуки винаходу з антагоністом гастрозаабо композицію, яка містить сполуку формули (1) хисного рецептору H.sub2. застосовано одночасно або послідовно з лікуванЗаявлений винахід крім того стосується комням та/або засобом для лікування будь-якої одної позиції сполуки винаходу з судинозвужуючим симхвороби з групи: астма, алергічний риніт, рак, патоміметичним засобом .sub1.- та .sub2.ХОЛХ, ревматоїдний артрит, псоріаз, запальна адреноміметиком, як-то пропіл-гекседрин, фенікишкова хвороба, синдром подразненої товстої лефрин, фенілпропаноламін, псевдоефедрин, кишки, остеоартриту або остеопорозу. нафазолін гідрохлорид, оксиметазолін гідрохлоЗокрема, для лікування запальних хвороб рерид, тетрагідрозолін гідрохлорид, ксилометазолін вматоїдного артриту, псоріазу, запальної кишкової гідрохлорид та етилнорепінефрин гідрохлорид. хвороби, синдрому подразненої товстої кишки, Заявлений винахід крім того стосується комХОЛХ, астми та алергічного риніту сполуки винапозиції сполуки винаходу з холінергічними засобаходу можна комбінувати з засобами, як-то інгібітоми, як-то іпратропіум бромід; тіотропіум бромід; ри TNF- , як-то анти-TNF моноклональні антитіла окситропіум бромід; пірензепін; та телензепін. (як-то ремікад, CDP-870 та D.sub2.E.sub7.) та моЗаявлений винахід крім того стосується комлекули рецептору TNF імуноглобуліну (як-то позиції сполуки винаходу з .sub1.- -- .sub4.Enbrel.reg.), неселективні інгібітори СОХ-1/СОХ-2 адреноміметиками, як-то метапротеренол, ізопро(як-то піроксикам, диклофенак, пропіонові кислоти, теренол, ізопреналін, альбутерол, салбутамол, як-то напроксен, флубіпрофен, фенопрофен, кеформотерол, сальметерол, тербуталін, орципаретопрофен та ібупрофен, фенамати, як-то мефенаналін, бутолтерол мезилат та пірбутерол; або мемінова кислота, індометацин, суліндак, апазон, тилксантанінами, охоплюючи офілін та амінофілін; піразолон, як-то фенілбутазон, саліцилати, як-то натрій хромоглікатом; або антагоністом мускариаспірин), інгібітори СОХ-2 (як-то мелоксикам, ценового рецептору (М1, М2, та М3). лекоксиб, рофекоксиб, валдекоксиб та еторикокЗаявлений винахід крім того стосується комсиб) низькодозовий метотрексат, лефуномід; цикпозиції сполуки винаходу з міметиком і інсулінополезонід; гідроксихлорохін, d-пеніциламін, дібного фактору росту типу І (IGF-1). ауранофін, парентеральне або пероральне золоЗаявлений винахід крім того стосується комто. Для запальної хвороби кишечнику та розладу позиції сполуки винаходу з дихальним глюкокортиподразненої кишки подальші прийнятні засоби коїдом зі зниженою системною бічною дією, як-то охоплюють сульфалазин та 5-ASAs, місцеві та преднізон, преднізолон, флунізолід, триамцинолон системні стероїди, імуномодулятори та імуносупацетонід, беклометазон дипропіонат, будезонід, ресанти, антибіотики, пробіотики та антифлутиказон пропіонат, та мометазон фуроат. інтегрини. Заявлений винахід крім того стосується комЗаявлений винахід крім того стосується композиції сполуки винаходу з інгібітором матриксних позиції сполуки винаходу з речовиною з групи: металопртеаз (ММР), як-то, стромелізини, колагеінгібітор біосинтезу лейкотрієну, інгібітор 5нази, та желатинази, а також агреканаза; особлиліпоксигенази (5-LO) або антагоніст активуючого 5во колагеназа-1 (ММР-1), колагеназа-2 (ММР-8), ліпоксигеназу білку (FLAP), як-то зилейтон; АВТколагеназа-3 (ММР-13), стромелізин-1 (ММР-3), 761; фенлейтон; тепок-салін; AbbotT-79175; стромелізин-2 (ММР-10), та стромелізин-3 (ММРAbbotT-85761; N-(5-заміщені)-тіофен-211) таММР-12. алкілсульфонаміди; 2,6-ди-трет-бутилфенол гідраЗаявлений винахід крім того стосується комзони; метокситетрагідропірани, як-то Zeneca ZDпозиції сполуки винаходу з іншими модуляторами 2138; сполука SB-210661; піридинілзаміщені спофункції рецептору хемокіну, як-то CCR1, CCR2, луки 2-ціанонафталіну, як-то L-739,010; сполуки 2CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, 27 92463 28 CCR7, CCR8, CCR9, CCR10 та CCR11 (для сімейяк-то напроксен, флубіпрофен, фенопрофен, кества С-С); CXCR1, CXCR3, CXCR4 та CXCR5 (для топрофен та ібупрофен, фенамати, як-то мефенасімейства С-Х-С) та CX3CR1 для сімейства С-Х3мінова кислота, індометацин, суліндак, апазон, С. піразолони, як-то фенілбутазон, саліцилати, як-то Заявлений винахід крім того стосується комаспірин, інгібітори СОХ-2, як-то целекоксиб, валпозиції сполуки винаходу з антивірусними засобадекоксиб, рофекоксиб та еторикоксиб, аналгезуми, як-то вірацепт, AZT, ацикловір та фамцикловір, вальні та внутрішньосуглобові ліки, як-то кортикота антисептичними сполуками, як-то валант. стероїди та гіалуронові кислоти, як-то гіалган та Заявлений винахід крім того стосується комсунвіск, та антагоністи рецептору Р2Х7. позиції сполуки винаходу з серцево-судинними Сполуки винаходу також можна застосовувати засобами, як-то блокатори кальцієвого каналу, в композиції з існуючими терапевтичними засобаліпідознижувальними засобами, як-то статини, ми для лікування раку. Придатні засоби, застософібрати, бета-блокатори, інгібітори Асе, антагонісвані в композиції, охоплюють: ти рецептору ангіотензину-2 та інгібітори агрегації (і) антипрофілеративні/протпухлинні ліки та їх тромбоцитів. комбінації, як застосовано в медичній онкології, якЗаявлений винахід крім того стосується комто алкілувальні засоби (наприклад, цис-платин, позиції сполуки винаходу з засобами ЦНС, як-то карбоплатин, циклофосфамід, нітроген-мустард, антидепресанти (як-то сертралін), ліками проти мелфалан, хлорамбуцил, бусульфан та нітрозосепаркінсонізму (як-то депреніл, L-допа, рекуїп, мічовини); антиметаболіти (наприклад, антифолати, рапекс, інгібітори МАОВ, як-то селегін та расагілін, як-то подібний флуоропіримідинам 5інгібітории соmР, як-то тасмар, інгібітори А-2, інгіфлуороурацил та тегафур, ралтитрексед, метотбітори ресорбції допаміну, антагоністи NMDA, агорексат, цитозин арабінозид, гідрокси-сечовина, ністи нікотину, агоністи допаміну та інгібітори сингемцитабін та паклітаксел (Таксол ); протипухтази оксиду азоту нейроналу), та ліками проти линні антибіотики (наприклад, подібні антрацикліхвороби Альцгеймера, як-то донепезил, такрин, нам адріаміцин, блеоміцин, доксорубіцин, дауноінгібітори СОХ-2, пропентофулін або метрифонат. міцин, епірубіцин, ідарубіцин, мітоміцин-С, Заявлений винахід крім того стосується комдактиноміцин та мітраміцин); антимітотичні засоби позиції сполуки винаходу з речовинами з групи: (і) (наприклад, подібні алкалоїдам вінка вінкристин, інгібітори триптази; (іі) антагоністи фактору активінбластин, віндезин, вінорелбін, та подібні таксоївації тромбоциту (PAF); (ііі) інгібітори перетворендам таксол та таксотер); та інгібітори топоізомераня інтерлейкіну ферменту (ICE); (iv) інгібітори зи (наприклад, подібні епіподофілотоксинам етоIMPDH; (ν) антагоністи інгібіторів злипання молепозид та теніпозид, амсакрин, топотекан та кул, охоплюючи VLA-4; (vi) капсини; (vii) інгібітори камптоцин); МАР кінази; (viii) інгібітори глюкоза-6 фосфатдегід(іі) цитостатичні засоби, як-то антіоестрогени рогенази; (іх) антагоністи кінін-B.sub1. - та B.sub2. (наприклад, тамоксифен, тореміфен, ралоксифен, рецептору; (х) засоби проти подагри, наприклад, дролоксифен та іодоксифен), регулятори зниженколхіцин; (хі) інгібітори ксантиноксидази, наприня оесторогену (наприклад, фулвестрант), антиаклад, алопуринол; (хіі) урикозуричні засоби, наприндрогени (наприклад, бікалутамід, флутамід, нілуклад, пробенецид, сульфінпіразон, та бензброматамід та ципротерон ацетат), антагоністи LHRH рон; (хііі) сокогінні гормони росту; (xiv) або агоністи LHRH (наприклад, госерелін, лейпротрансформувальний фактор росту (TGF ); (xv) релін та бусерелін), прогестогени (наприклад, метромбоцитарний фактор росту (PDGF); (xvi) факгестрол ацетат), інгібітори ароматази (наприклад, тор росту фібробласту, наприклад, базовий фібяк анастрозол, летрозол, воразол та ексеместан) робласту фактор росту (bFGF); (xvii) стимулювата інгібітори 5 -редуктази, як-то фінастерид; льний фактор колонії гранулоциту макрофагу (GM(ііі) Засоби, які інгібують інвазію клітин раку CSF); (xviii) крем капсаїцину; (хіх) антагоністи ре(наприклад, подібний інгібіторам металопротеїнацептору тахікініну NK.sub1. та NK.sub3., вибрані із зи маримастат та інгібітори функції рецептору акNKP-608C; SB-233412 (талнетант); та D-4418; (хх) тиватору плазміногену урокінази); інгібітори еластази, вибрані із UT-77 та ZD-0892; (iv) інгібітори функції фактору росту, напри(ххі) інгібітори TNFD-перетворювального ферменклад, так інгібітори охоплюють антитіла фактору ту (ТАСЕ); (ххіі) інгібітори індукованого оксид азоту росту, антитіла рецептору фактор росту (наприсинтази (iNOS) або (ххііі) молекула рецепторклад, анти-егб2 антитіло трастузумаб [Герцепгомологічного хемоатрактанту, експресованого на тин ] та анти-еrbb1 антитіло цетуксимаб [С225]), клітинах ТН2, (антагоністи CRTH2). інгібітори фарнезилтрансферази, інгібітори тироСполуки заявленого винаходу також можна зинкінази та інгібітори серин/треонінкінази, напризастосовувати в композиції із засобами проти клад, інгібітори сімейства епідермального фактору остеопорозу, як-то ролоксифен, дролоксифен, росту (наприклад, інгібітори EGFR-сімейства тиролозофоксифен або фосомакс та імуносупресивзинкінази, як-то N-(3-хлор-4-флуорофеніл)-7ними засобами, як-то FK-506, рапаміцин, циклосметокси-6-(3-морфолінопропокси)хіназолін-4-амін порин, азатіоприн та метотрексат;. (гефітиніб, AZD1839), N-(3-етинілфеніл)-6,7-біс(2Сполуки винаходу також можна застосовувати метоксіетокси)хіназолін-4-амін (еролотиніб, OSIв композиції з існуючими терапевтичними засоба774) та 6-акриламідо-N-(3-хлор-4-флуорофеніл)-7ми для лікування остеоартриту. Придатні засоби, (3-морфолінопропокси)хіназолін-4-амін (СІ 1033)), застосовані в композиції, охоплюють звичайні ненаприклад, інгібітори сімейства тромбоцитарного стероїдні протизапальні засоби (нижче - NSAID), фактору росту та, наприклад, інгібітори сімейства як-то піроксикам, диклофенак, пропіонові кислоти, фактору росту гепатоциту; 29 92463 30 (ν) антиангінальні засоби, як-то такі, що інгібупептину та 100 мг/мл бацитрацину)] та клітини ють дії судинного ендотеліального фактору росту, залишали набухати протягом 10 хвилин. Препарат (наприклад, антитіло антисудинного ендотеліальклітин деструктурували, застосовуючи ручний ного фактору росту клітин бевацизумаб [Авасскляний ступковий/PTFE пестиковий гомогенізатор та клітинні мембрани збирали центрифугуванням тин ], сполуки, як-то розкриті в міжнародних заяв(45 хвилин, 100000 g, 4°С). Препарат мембран ках на патенти WO 97/22596, WO 97/30035, WO зберігали при -70°С у гомогенізаційному буфері, 97/32856 та WO 98/13354) та сполуки, що працюдоповненому розчином солі Тироде (137 ммоль ють за іншими механізмами (наприклад, ліномід, NaCI, 2,7 ммоль KСІ, 0,4 ммоль NaH2PO4), інгібітори функції інтегрину ν 3 та ангіостатин); 0,1%мас./об. желатином та 10 об.% гліцерином. (vi) засоби, що ушкоджують судини, як-то комУсі аналізи виконували в 96-коміркових фільтбретастатин А4 та сполуки, розкриті в міжнародраційних планшетах MultiScreen 0,45 мкм них заявках на патенти WO 99/02166, (Millipore, U.K.). Кожний аналіз містив приблизно WO00/40529, WO 00/41669, WO01/92224, 50 пмоль [125l]IL-8 та мембран (еквівалентно прибWO02/04434 та WO02/08213; лизно 200000 клітин) в буфері для аналізу [розчин (vii) антисенсорні лікування, наприклад, спрясолі Тироде, доповнений 10 ммоль ГЕПЕС (рН мовані на цілі, наведені вище, як-то ISIS 2503, ан7,4), 1,8 ммоль СаСІ2, 1 ммоль МgСІ2, 0,125 мг/мл ти-ras антисенс; бацитрацину та 0,1%мас./об.) желатину]. Крім то(viii) підходи генної терапії, охоплюючи наприго, сполуку формули (І) згідно з прикладами попеклад, підходи до заміщення аберантних генів, якредньо розчиняли в ДМСО та додавали ДМСО до то аберантний р53, аберантний BRCA1 або кінцевої концентрації 1 об.%. аналіз ініціювали BRCA2, підходи GDEPT (пролікова терапія генспдодаванням мембран та після 1,5 годин при кімнарямованого ферменту), зі застосуванням цитозинтній температурі мембрани збирали фільтрацією, деамінази, тимідин-кінази або бактеріального фезастосовуючи вакуумний колектор Millipore рменту нітроредуктази та підходи до підвищення MultiScreen та промивали двічі буфером для анатолерантності пацієнта до хіміотерапії або радіолізу (без бацитрацину). Допоміжний планшет витерапії, як-то генна терапія мультирезистентності даляли з планшетного комплекту MultiScreen, фідо ліків; та льтри сушили при кімнатній температурі, вибивали (іх) імунотерапевтичні підходи, охоплюючи ната тоді підраховували на -лічильнику Cobra. приклад, підходи ex-vivo та in vivo до підвищення Знайдено, що сполуки формули (І) згідно з імуногенності пухлинних клітин пацієнта, як-то прикладами 1-156 мають величини рІК50 більше трансфекція цитокінами, як-то інтерлейкіном 2, 5,0. інтерлейкіном 4 або фактором стимулювання коАналіз мобілізації внутрішньоклітинного кальлоній гранулоцитів-макрофагів, підходи до зницію ження Т-клітинної анергії, підходи із застосуванНейтрофіли людини отримували з ЕДТАням трансфектованих імунних клітин, як-то обробленої периферійної крові, як описано раніше цитокін-трансфектованих дендритних клітин, під(Baly et al. (1997) Methods in Enzymology 287 pp. ходи із застосуванням ліній цитокін70-72), в буфері збереження [розчин солі Тироде трансфектованих пухлинних клітин та підходи із (137 ммоль NaCI, 2,7 ммоль KСІ, 0,4 ммоль застосуванням антиідіотипичних антитіл. NaH2PO4), доповненому 5,7 ммоль глюкози та 10 Фармакологічні дані ммоль ГЕПЕС (рН 7,4)]. Аналіз зв'язування ліганду [125l]IL-8 (людини, рекомбінантний) з особлиХемокін GRO (людини, рекомбінантний) завою активністю 2000 Кі/ммоль закупали в купали в R&D Systems (Abingdon, U.K.). Усі інші Amersham, U.K.. Усі інші хімікати були аналітичнохімікати були аналітичного класу. Зміни у внутрішго класу. Високі рівні hrCXCR2 експресували в кліньоклітинному вільному кальції визначали флуотинах HEK 293 (293 клітинах ЕСАСС No. 85120602 рометрично зануренням нейтрофілів у чутливий нирок зародку людини) (Lee et al. (1992) J. Biol. кальцію флуоресцентний барвник, fluo-3, як опиChem. 267, pp. 16283-16291). hrCXCR2 кДНК підсано раніше (Merritt et аl. (1990) Biochem. J. 269, силювали та клонували із мРНК нейтрофілів люpp. 513-519). Клітини завантажували протягом 1 дини. ДНК клонували в PCRScript (Stratagene) та години при 37°С у завантажувальний буфер (збеклони ідентифікували, застосовуючи ДНК. Кодуварежувальний буфер з 0,1%мас./об.) желатином), льну послідовність субклоновували у вектор ексщо містить 5 мкм fluo-3-АМ-естеру, промивали пресії еукаріоту RcCMV (інвітроген). Плазміду ДНК завантажувальним буфером та тоді ресуспендуотримували, застосовуючи Quiagen Megaprep 2500 вали в розчині солі Тироде, доповненому 5,7 та трансфектували в клітини HEK 293, застосовуммоль глюкози, 0,1%мас./об. бичачим сироваткоючи реагент ліпофектамін (Gibco BRL). Клітини вим альбуміном (BSA), 1,8 ммоль СаСІ2 та 1 клону з найвищою експресією збирали в забуфеммоль МgСІ2. Клітини додавали піпеткою у 96рований фосфатом фізіологічний розчин, що міскомірковий мікропланшет (Costar, Boston, U.S.) з тить 0,2%мас./об. етиленедіамінтетраоцтової кистемними стінками та прозорим дном та центрифулоти (ЕДТА), та центрифугували (200 g, 5 хвилин). гували (200 g, 5 хвилин, кімнатна температура). Гранули клітин ресуспендували в охолодженому Сполуку формули (І) з прикладів попередньо льодом гомогенізаційному буфері [10 ммоль ГЕрозчиняли в ДМСО та додавали до кінцевої конПЕС (рН 7,4), 1 ммоль дитіотрейтолу, 1 ммоль центрації ДМСО 0,1% (об'єм в об'ємі). Аналізи ініЕДТА та панель інгібіторів протеази (1 ммоль феціювали додаванням А50-концентрації GROD та нілметилсульфонілфлуориду, 2 мг/мл інгібітору спостерігали короткочасне збільшення флуорестрипсину сої, 3 ммоль бензамідину, 0,5 мг/мл лейценції fluo-3 ( 3Б=490 нм та ЕМ=520 нм), застосо 31 92463 32 вуючи FLIPR (Fluorometric Imaging Plate Reader, пературі 1,5 години, тоді - при нагріванні зі зворотMolecular Devices, Sunnyvale, U.S.). ним холодильником протягом 20 годин, реакційну Сполуки формули (І) з прикладів тестували та суміш випаровували, суспендували у воді та екствизначали як антагоністи рецептору CXCR2 у нейрагували етилацетатом (х2). Комбіновані органічні трофілах людини. шари сушили магній сульфатом, фільтрували та Винахід подалі ілюстровано наступними неовипаровували. Залишок очищали хроматографією межуючими прикладами, в яких, якщо не встановна колонці з силікагелем, застосовуючи 98:2 суміш лено інше: метилен хлориду та метанолу як елюент що дає (і) коли надано спектр ядерного магнітного респолуку заголовку як білу тверду речовину. Вихід: зонансу (ЯМР), його визначали на спектрометрі 120 мг. Varian Unity Inova 300 або 400 МГц. Дані 1Н ЯМР МС: XIAT(+ve) 463, [М+Н+] 1 наведено у вигляді величин дельта для головних Η ЯМР: (ДМСО) 2,13 (квінтет, 2Н), 3,57 (m, діагностичних протонів, наданих в частинах на 4H), 3,89 (t, 4), 4,44 (s, 2H), 4,78 (t, 2Н), 5,13 (квінмільйон (млн-1) відносно тетраметилсилану (ТМС) тет, 1Н), 6,15 (s, 1Н), 7,17 (dq, 1Н), 7,36 (dq, 1Н), як внутрішнього стандарту. 7,45 (dt, 1Н), 11,11 (bs, 1Н); (іі) Мас-спектрометрчний (МС) спектр визнаІнтермедіати для цієї сполуки отримували начали на спектрометрі Finnigan Mat SSQ7000 або ступним чином: Micromass Platform. і) 2-[(2,3-Дифлуоробензил)тіо]піримідин-4,6(ііі) сполуки заголовку та підзаголовку прикладіол дів та способів названо, застосовуючи програму До кашки 2-меркаптопіримідин-4,6-діолу (55,6 ACD/Name (варіант 4,55) від Advanced Chemical г) у воді (735 мл) додавали натрій ацетат (47,4 г) з Development Inc, Canada. перемішуванням, що призводить до повного роз(iv) Звичайну фазову хроматографію на колочинення через 20 хвилин. Тоді додавали краплями нці та звичайну фазову верх виконували, застосоза 15 хвилин розчин 2,3-дифлуоробензил броміду вуючи колонку з оксидом силіцію. Очистку реверс(80 г) в ацетонітрилі (73,5 мл), та отриману суміш но-фазовою рідинною хроматографією високого нагрівали при 40°С з перемішуванням протягом 18 тиску (ВЕРХ) виконували, застосовуючи Waters годин. Після охолодження до навколишньої темMicromass LCZ з насосним регулятором Waters ператури отриманий осад фільтрували та проми600, детектором Waters 2487 та колектором фраквали Н2О (1L) перед висушуванням у вакуумі при цій Gilson FC024 або очисну систему Waters Delta 100°С, що дає придатну сполуку як твердий крем. Prep 4000 або Gilson Auto, застосовуючи реверсВихід: 101,5 г. 1 нофазову колонку з оксидом силіцію Symmetry, Н ЯМР: (ДМСО) 7,74 (1Н, s), 7,39-7,32 (2Н, NovaPak або Ex-Terra. m), 7,21-7,15 (1Н, m), 4,48 (2Н, s). (ν) Застосовано наступні скорочення: іі) 4,6-Дихлоро-2-[(2,3АсОН оцтова кислота дифлуоробензил)тіо]піримідин СНСІ3 хлороформ До суміші придатного продукту стадії і) (101,5 ДХМ дихлорметан г) з бензилтриетиламоній хлоридом (8,6 г) в 1,2ДМФ Ν,Ν-диметилформамід диметоксіетані (550 мл) додавали фосфор оксихДМСО диметилсульфоксид лорид (70 мл) і суміш нагрівали при 85°С протягом Et2O діетиловий етер 5 годин. Реакція дозволяли охолодитися та перед EtOAc етилацетат розподіленням між етилацетатом та льодяною MgSO4 магній сульфат водою розчинники та надлишок фосфор оксихлоNMP 1-метилпіролідин-2-он риду видаляли у вакуумі. Шари відокремлювали та ТГФ тетрагідрофуран висушену (MgSO4) органічні складові концентруН2О вода вали у вакуумі, що дає сирий продукт як бліде коNH3 аміак ричневе масло, яке застигало при стоянні. Сирий Приклад 1 продукт очищали хроматографією на колонці (4% N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2EtOAc/ізо-гексан), що дає придатну сполуку як білу гідрокси-1-(гідроксиметил)етокси]-4-піримідиніл]-1тверду речовину. Вихід: 90 г. 1 азетидинсульфонамід Н ЯМР: (ДМСО) 7,74 (1Н, s), 7,39-7,32 (2Н, m), 7,21-7,15 (1Н, m), 4,48 (2Н, s). ііі) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6[(2-феніл-1,3-діоксан-5-іл)окси]-піримідин До розчину 2-феніл-1,3-діоксан-5-олу (484 мг) в безводному тетрагідрофурані (10 мл) при 0°С додавали 60% натрій гідрид (110 мг), і суміш нагрівали під зворотним холодильником протягом 25 хвилин. Після охолодження до навколишньої температури додавали 4,6-дихлоро-2-[(2,3дифлуоробензил)тіо]піримідин (продукт стадії (іі) До суспензії N-[2-[[(2,3(75 мг) та реакцію нагрівали під зворотним холодифлуорофеніл)метил]тіо]-6-[(2-феніл-1,3-діоксандильником протягом ще 90 хвилин. Реакційній су5-іл)окси]-4-піримідиніл]-1-азетидинсульфонаміду міші дозволяли охолодитися, розбавляли водою (продукт стадії iv) (220 мг) в метанолі (5 мл)/воді та екстрагували етилацетатом (х3). Комбіновані (0,1 мл) додавали піридин п-толуолсульфонат (20 органічні шари сушили магній сульфатом, фільтмг) та суміш перемішували при навколишній темрували та випаровували. Залишок очищали хро 33 92463 34 матографією на колонці на оксиді силіцію, застоСуміш 4,6-дихлоро-2-[(2,3совуючи 95:5 - 90:10 суміш ізо-гексану та етилацедифлуоробензил)тіо]піримідину (продукт прикладу тату як елюент, що дає сполуку підзаголовку як 1 стадія іі) (0,5 г), білу тверду речовину. Вихід: 350 мг. трис(дибензиліденацетон)дипаладію(0) (45 мг), МС: XIAT(+ve) 451 [М+Н+] 2,2-диметил-4-вініл-1,3-діоксолану (630 мг), три-Niv) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(2бутиламіну (610 мг) та тетра-N-бутиламоній хлофеніл-1,3-діоксан-5-іл)окси]-4-піримідиніл]-1риду (460 мг) в безводному Ν,Νазетидинсульфонамід диметилформаміді (6,5 мл) нагрівали при 90°С Суміш азетидин-1-сульфонаміду (420 мг), протягом 3 годин. Тоді перемішували при кімнатній трис(дибензиліденацетон)дипаладію(0) (71 мг), 2температурі протягом ночі. Реакційну суміш роздициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'поділяли між етилацетатом та водою. Органічну біфенілу (XPHOS) (37 мг), цезій карбонату (380 мг) фазу промивали водою та розсолом, сушили та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(2(MgSO4) та розчинник випаровували під зниженим феніл-1,3-діоксан-5-іл)окси]-піримідину (350 мг) в тиском. Залишок очищали флеш-хроматографією безводному діоксані (8 мл) нагрівали під зворотна силікагелі, елюючи 10% діетиловим етером в ним холодильником в мікрохвильовому відкритому ізо-гексані, що дає сполуку підзаголовку як жовте контейнері при 100°С, 300W з охолодженням пров'язке масло. Вихід: 98 мг. тягом 10 хвилин. Реакційну суміш розбавляли меMC: XIAT(+ve) 399 [M+1] тилен хлоридом, фільтрували через арбоцел та іі) (R,S) 4-Хлор-2-[[(2,3фільтрат випаровували. Залишок очищали хромадифлуорофеніл)метил]тіо]-6-[2-(2,2тографією на колонці на оксиді силіцію, застосодиметил[1,3]діоксолан-4-іл)етил]-піримідин вуючи як елюент суміш ізо-гексану та етилацетату Розчин продукту стадії і) (96,8 мг) в етанолі (10 80:20 - 70:30, що дає сполуку підзаголовку як білу мл) гідрогенізували на платина оксиді (5 мг) при 3 тверду речовину. Вихід: 220 мг. атмосферах протягом 2 діб. Подалі додавали окМС: XIAT(+ve) 551 [М+Н+] сид платини (20 мг) та суміш гідрогенізували проПриклад 2 тягом ще 3 діб при 5 атмосферах. Каталізатор фі(R,S)-N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6льтрували (Целіт) та фільтрат випаровували під [3,4-дигідроксибутил]піримідин-4-іл]азетидин-1зниженим тиском. Залишок очищали флешсульфонамід хроматографією на силікагелі, елюючи 10% діетиловим етером в ізо-гексані, що дає сполуку підзаголовку як в'язке масло. Вихід: 33 мг. MC: XIAT(+ve) 401 [M+1] iii) (R,S)-N-[2-[[(2,3-дифлуорофеніл)метил]тіо]6-[2-(2,2-диметил[1,3]діоксолан-4-іл)-етил]піримідин-4-іл]азетидин-1-сульфонамід Розчин продукту стадії іі) (47 мг), трис(дибензиліденацетон)дипаладіи(0) (6 мг), азетидин-1-сульфонамід (62 мг), 2-дициклогексилРозчин N-[2-[[(2,3-дифлуорофеніл)метил]тіо]фосфіно-2',4',6'-три-ізопропіл,1,1'-біфеніл (XPHOS) 6-[2-(2,2-диметил[1,3]діоксолан-4-іл)-етил](6 мг) та цезій карбонат (52 мг) в безводному діокпіримідин-4-іл]азетидин-1-сульфонаміду (продукт сані (1 мл) нагрівали при 100°С протягом 45 хвистадії ііі) (43 мг) та піридин паралин. Реакційну суміш розподіляли між етилацетатолуолсульфонату (43 мг) в метанолі (1 мл) та том та водою. Додавали оцтову кислоту (0,2 мл) та одну краплю води нагрівали при 60°С протягом 1,5 відокремлену органічну фазу промивали водою та годин. Розчин охолоджували та розчинник випаророзсолом, сушили (MgSO4) та розчинник випаровували під зниженим тиском. Залишок розчиняли в вували під зниженим тиском. Залишок очищали дихлорметані та промивали водою, сушили флеш-хроматографією на силікагелі, елюючи 40% (MgSO4) та розчинник випаровували під зниженим етилацетатом в ізо-гексані, що дає сполуку підзатиском. Твердий жовтий залишок очищали препаголовку як жовте в'язке масло. Вихід: 46 мг. ративною планшетною хроматографією, елюючи MC: XIAT(+ve) 501 [М+1] етилацетатом. Виділений продукт розчиняли в Приклад 3 дихлорметані та розчинник випаровували при кімN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[3натній температурі під зниженим тиском, що дає гідрокси-2-(гідроксиметил)пропіл]піримідин-4продукт заголовку як білу тверду речовину. Вихід іл]азетидин-1-сульфонамід 20 мг. MC: XIAT(-ve) 459 [M-1] 1 Н ЯМР: (ДМСО) 11,18 (s, 1H), 7,44 (t, 1H), 7,33 (q, 1H), 7,14 (m, 1H), 6,66 (s, 1H), 4,57(d, 1H), 4,51 (t, 1H), 4,45 (s, 2H), 3,93 (t, 4H), 3,41 (m, 1H), 3,26 (m, 1H), 2,71 (m, 1H), 2,65 (m, 1H), 2,12 (p, 2H), 1,82 (m, 1H), 1,53 (m, 1H). Інтермедіати для цієї сполуки отримували наступним чином: і) (цис/транс) 4-Хлор-2-[[(2,3дифлуорофеніл)метил]тіо]-6-[2-(2,2диметил[1,3]діоксолан-4-іл)-вініл]-піримідин Розчин N-[2-[[(2,3-дифлуорофеніл)метил]тіо]6-[(2,2-диметил-1,3-діоксан-5-іл)метил]-4 35 92463 36 піримідиніл]азетидин-1-сульфонаміду (продукт MC: XIAT(-ve) 499 [M-1] стадії іі) (78 мг) та піридин пара-толуолсульфонату Приклад 4 (79 мг) в метанолі (1,8 мл) та одну краплю води N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1R,2R)-2нагрівали при 60°С протягом 15 хвилин. Розчин гідрокси-1-метилпропіл]окси}піримідин-4охолоджували та розчинник випаровували під іл)азетидин-1-сульфонамід зниженим тиском. Залишок розчиняли в дихлорметані та промивали 2N хлоридною кислотою та водою, сушили (MgSO4) та розчинник випаровували під зниженим тиском, що дає в'язке жовте масло (17 мг). Промивні води комбінували, рН регулювали до 5 водним натрій гідрокарбонатом та тоді екстрагували етилацетатом. Органічний розчин сушили (MgSO4) та розчинник випаровували під зниженим тиском. Залишкове в'язке масло розчиняли в дихлорметані та розчинник випаровуваСполуку заголовку отримували згідно з процели при кімнатній температурі під зниженим тиском, дурою, описаною в прикладі 1 стадія (iv), застосощо дає продукт заголовку як білу тверду речовину. вуючи суміш азетидин-1-сульфонаміду (150 мг), Вихід 62 мг. трис(дибензиліденацетон)дипаладію(0) (25 мг), 2MC: XIAT(-ve) 459 [M-1] дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'1 Н ЯМР: (ДМСО) 11,17 (s, 1H), 7,44 (t, 1H), біфенілу (XPHOS) (25 мг), цезій карбонату (244 мг) 7,33 (m, 1H), 7,14 (m, 1H), 6,65 (s, 1H), 4,45 (s, 4H), та (2R,3R)-3-({6-хлop-2-[(2,33,92 (t, 4H), 3,38 (m, 4H), 2,57 (d, 2H), 2,12 (p, 2H), дифлуоробензил)тіо]піримідин-4-іл}окси)бутан-21,98 (m, 1H). ол (200 мг) в безводному діоксані (10 мл). ОчищаІнтермедіати для цієї сполуки отримували нали реверсно-фазовою ВЕРХ, елюючи сумішшю ступним чином: ацетонітрилу/водн. 0,1% амоній ацетату, що дає і) 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6сполуку заголовку як білу тверду речовину. Вихід: [(2,2-диметил-1,3-діоксан-5-іл)метил]піримідин 79 мг Розчин 0,5М 9-борбіцикло[3,3,1]нонану (9МС: ХІАТ (+ve) 461 [М+1] BBN) у тетрагідрофурані (17,12 мл) та 2,21 Н ЯМР: (CDCI3) 7,26-7,22 (1Н, m), 7,10-6,99 диметил-5-метилен-1,3-діоксан (Tet. Lett. (1988) 29 (2Н, m), 6,33 (1Н, s), 5,07-5,00 (1Н, m), 4,37 (2Н, s), (45) 5703-5706) (1,3 г) нагрівали при 45°С протягом 4,02 (4Н, t), 3,89-3,82 (1Н, m), 2,25 (2Н, квінтет), 18 годин. Розчин охолоджували та додавали до 1,26-1,21 (6Н, m). суміші паладій(ІІ) ацетату, калій фосфату (1,16 г), Інтермедіати для цієї сполуки отримували на(біфеніл-2-іл)дициклогексил-фосфіну (0,14 г) та ступним чином: 4,6-дихлоро-2-[(2,3і) (2R,3R)-3-({6-хлор-2-[(2,3дифлуоробензил)тіо]піримідину (1,5 г) при передифлуоробензил)тіо]піримідин-4-іл}окси)бутан-2мішуванні під азотом. Суміш нагрівали в мікрохвиол лях при 70°С, 250W протягом повних 1,5 годин, До розчину (2R,3R)-бутан-2,3-діолy (250 мг) та тоді 70°С на гарячій политі протягом 2 діб. Реак4,6-дихлоро-2-[(2,3ційну суміш адсорбували на силікагелі, розчинник дифлуоробензил)тіо]піримідину (продукт прикладу випаровували під зниженим тиском та залишок 1, стадія (іі)) (427 мг) в безводному тетрагідрофуочищали флеш-хроматографією на силікагелі, рані (20 мл) при температурі навколишнього сереелюючи 20% етилацетатом в ізо-гексані, що дає довища додавали 60% натрій гідрид (33,4 мг). Пісжовте масло. Масло подалі очищали флешля перемішування протягом 15 хвилин реакційну хроматографією на силікагелі, елюючи дихлормесуміш розподіляли між водн. розчином амоній таном, що дає продукт підзаголовку як в'язке масхлориду та етилацетатом. Органічні складові збило. Вихід: 110 мг. рали, сушили (MgSO4) та розчинники видаляли під MC: XIAT(-ve) 399 [M-1] вакуумом, що дає придатну сполуку як безбарвну іі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(2,2смолу. Вихід: 525 мг. диметил-1,3-діоксан-5-іл)метил]-4МС: XIAT(+ve) 361 [М+Н+] піримідиніл]азетидин-1-сульфонамід Приклад 5 Розчин продукту стадії і) (109 мг), N-(2-[(2,3-дифлуоробензил)тіо]-6-{[(1S,2S)-2трис(дибензиліденацетон)дипаладій(0) (14 мг), гідрокси-1-метилпропіл]окси}піримідин-4азетидин-1-сульфонамід (145 мг), 2іл)азетидин-1-сульфонамід дициклогексил-фосфіно-2',4',6'-три-ізопропіл,1,1'біфеніл (XPHOS) (14 мг) та цезій карбонат (120 мг) в безводному діоксані (2,3 мл) нагрівали при 100°С протягом 45 хвилин. Реакційну суміш розподіляли між етилацетатом та водою. Додавали оцтову кислоту (0,2 мл) та відокремлену органічну фазу промивали водою та розсолом, сушили (MgSO4) та розчинник випаровували під зниженим тиском. Залишок очищали флеш-хроматографією на силікагелі, елюючи 40% етилацетатом в ізо-гексані, що Сполуку заголовку отримували згідно з процедає сполуку підзаголовку як жовте в'язке масло. дурою, описаною в прикладі 4, застосовуючи суВихід: 78 мг. 37 92463 38 міш азетидин-1-сульфонаміду (150 мг), Інтермедіати для цієї сполуки отримували натрис(дибензиліденацетон)дипаладію(0) (25 мг), 2ступним чином: дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6біфенілу (XPHOS) (25 мг), цезій карбонату (244 мг) [(2S)-1,4-діоксаспіро[4,5]дец-2-илметокси]та (2S,3S)-3-({6-хлор-2-[(2,3піримідин дифлуоробензил)тіо]піримідин-4-іл}окси)бутан-2Придатну сполуку отримували згідно з процеолу (200 мг) в безводному діоксані (10 мл). Очидурою, описаною в прикладі 1, стадія ііі), застосощали реверсно-фазовою ВЕРХ, елюючи сумішшю вуючи (2S)-1,4-діоксаспіро[4,5]декан-2-метанол ацетонітрилу/водн. 0,1% амоній ацетату, що дає (0,46 г) та 4,6-дихлоро-2-[(2,3сполуку заголовку як білу тверду речовину. Вихід: дифлуоробензил)тіо]піримідин (продукт прикладу 60 мг 1, стадія (іі) (0,75 г) в ТГФ (8 мл) та 60% натрій МС: ХІАТ (+ve) 461 [М+1] гідрид (39 мг), що дає придатну сполуку як бліду 1 жовту тверду речовину. Вихід: 0,70 г. Н ЯМР: (CDCI3) 7,25-7,21 (1Н, m), 7,10-6,99 МС: XIAT(+ve) 403/405 [М+Н+] (2Н, m), 6,32 (1Н, s), 5,07-5,00 (1Н, m), 4,37 (2Н, s), іі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(2S)4,02 (4Н, t), 3,88-3,81 (1Н, m), 2,26 (2Н, квінтет), 1,4-діоксаспіро[4,5]дец-2-илметокси]-41,26-1,21 (6Н, m). піримідиніл]-1-азетидинсульфонамід Інтермедіати для цієї сполуки отримували наПридатну сполуку отримували згідно з процеступним чином: дурою, описаною в прикладі 1, стадія iv), застосоі) (2S,3S)-3-({6-хлор-2-[(2,3вуючи суміш азетидин-1-сульфонаміду (отримано дифлуоробензил)тіо]піримідин-4-іл}окси)бутан-2згідно з патентом WO 2004/011443, 0,25 г), ол трис(дибензиліденацетон)дипаладію(0) (83 мг), 2Придатну сполуку отримували згідно з процедициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'дурою, описаною в прикладі 4, стадія (і), застособіфенілу (XPHOS) (43 мг), цезій карбонату (0,44 г) вуючи (2S,3S)-бутан-2,3-діол (250 мг) та 4,6та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6дихлоро-2-[(2,3-дифлуоробензил)тіо]піримідин [(2S)-1,4-діоксаспіро[4,5]дец-2-илметокси](продукт прикладу 1, стадія (іі)) (427 мг) в безводпіримідину (0,40 г) в діоксані (8 мл). Очищали хроному тетрагідрофурані (20 мл) та 60% натрій гідматографією на колонці з силікагелем, застосовурид (33,4 мг), що дає придатну сполуку як безбарючи EtOAc/ізогексан (градієнт 1:9-1:2) як елюент, вну смолу. Вихід: 440 мг. що дає придатну сполуку як бліде жовте масло. МС: XIAT(+ve) 361 [М+Н+] Вихід: 0,34 г. Приклад 6 МС: XIAT(+ve) 543 [М+Н+] N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2R)Приклад 7 2,3-дигідроксипропіл]окси]-4-піримідиніл]-1N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2S)азетидинсульфонамід 2,3-дигідроксипропіл]окси]-4-піримідиніл]-1азетидинсульфонамід До розчину N-[2-[[(2,3дифлуорофеніл)метил]тіо]-6-[(2S)-1,4діоксаспіро[4,5]дец-2-илметокси]-4-піримідиніл]-1азетидинсульфонаміду (продукт стадії іі) (0,34 г) в метанолі (5 мл)/Н2О (0,1 мл) додавали піридин птолуолсульфонат (78 мг) та суміш перемішували при нагріванні зі зворотним холодильником протягом 2 годин та тоді - температура навколишнього середовища протягом 20 годин. Реакційну суміш випаровували, суспендували в Н2О та екстрагували EtOAc (х2). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували. Залишок очищали хроматографією на колонці з силікагелем, застосовуючи ДХМ/МеОН (98:2) як елюент, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,15 г. МС: XIAT(+ve) 463 [М+Н+] 1 Н ЯМР: (ДМСО) 2,13 (квінтет, 2Н), 3,42 (m, 2Н), 3,77 (m, 1Н), 3,82 (t, 4H), 4,16 (dd, 1Н), 4,35 (dd, 1Н), 4,46 (s, 2Н), 4,67 (t, 1Н), 4,97 (d,1H), 6,16 (s, 1Н), 7,17 (m, 1Н), 7,35 (m, 1Н), 7,44 (m, 1Н), 11,13 (br s, 1H); До розчину N-[2-[[(2,3дифлуорофеніл)метил]тіо]-6-[[(4R)-2,2-диметил1,3-діоксолан-4-іл]метоксил]-4-піримідиніл]-1азетидинсульфонаміду (продукт стадії іі) (0,48 г) в метанолі (5 мл)/Н2О (0,1 мл) додавали піридин птолуолсульфонат (0,12 г) та суміш перемішували при нагріванні зі зворотним холодильником протягом 2 годин. Реакційну суміш випаровували, суспендували в Н2О та екстрагували EtOAc (х2). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували. Залишок порошкували ДХМ, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,30 г. МС: XIAT(+ve) 463 [М+Н+] 1 Н ЯМР: (ДМСО) 2,15 (квінтет, 2Н), 3,42 (m, 2Н), 3,77 (m, 1Н), 3,90 (t, 4H), 4,17 (dd, 1Н), 4,35 (dd, 1Н), 4,46 (S, 2Н), 4,67 (t, 1Н), 4,98 (d,1H), 6,16 (s, 1Н), 7,16 (m, 1Н), 7,34 (m, 1Н), 7,44 (m, 1Н), 11,13 (br s, 1Н); Інтермедіати для цієї сполуки отримували наступним чином: 39 92463 40 і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6і) , -2,2-тетраметил-(4R)-1,3-діоксолан-4[[(4R)-2,2-диметил-1,3-діоксолан-4-іл]метоксил]метанол піримідин До безводного церій (III) хлориду (8,1 г гептагіПридатну сполуку отримували згідно з процедрату сушили під високим вакуумом при 150°С дурою, описаною в прикладі 1, стадія ііі), застосопротягом 20 годин) додавали ТГФ (10 мл), тоді вуючи 2,2-диметил-(4R)-1,3-діоксолан-4-метанол метиллітій (1,6 М, 11,7 мл) та реакційну суміш пе(0,26 г) та 4,6-дихлоро-2-[(2,3ремішували при навколишній температурі 10 хвидифлуоробензил)тіо]піримідин (продукт прикладу лин. Додавали розчин метилового естеру 2,21, стадія іі) (0,50 г) в ТГФ (5 мл) та 60% натрій гіддиметил-(4R)-1,3-діоксолан-4-карбонової кислоти рид (79 мг), що дає придатну сполуку як чисте (1 г) в ТГФ (5 мл) та суміш перемішували при набезбарвне масло. Вихід: 0,47 г. вколишній температурі 1,5 години. Реакційну суМС: XIAT(+ve) 403/405 [М+Н+] міш гасили повільним додаванням Н2О (10 мл) та іі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6тоді екстрагували Et2O (x2). Комбіновані органічні [[(4R)-2,2-диметил-1,3-діоксолан-4-іл]метоксил]-4шари сушили (MgSO4), фільтрували та випаровупіримідиніл]-1-азетидинсульфонамід вали, що дає придатну сполуку як жовте масло. Придатну сполуку отримували згідно з процеВихід: 0,40 г. 1 дурою, описаною в прикладі 1, стадія iv), застосоН ЯМР: (CDCI3) 1,16 (s, 3H), 1,24 (s, 3H), вуючи суміш азетидин-1-сульфонаміду (отримано 1,37 (s, 3H), 1,46 (s, 3H), 3,83 (m, 1H), 3,96 (m, 2H). згідно з патентом WO 2004/011443, 0,24 г), іі) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6трис(дибензиліденацетон)дипаладію(0) (0,11 г), 2[1-[(4R)-2,2-диметил-1,3-діоксолан-4-іл]-1дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'метилетокси]-піримідин біфенілу (XPHOS) (55 мг), цезій карбонату (0,57 г) Придатну сполуку отримували згідно з процета 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6дурою, описаною в прикладі 1, стадія ііі), застосо[[(4R)-2,2-диметил-1,3-діоксолан-4-іл]метоксил]вуючи , -2,2-тетраметил-(4R)-1,3-діоксолан-4піримідину (0,47 г) в діоксані (8 мл). Очищали хрометанол (0,32 г) та 4,6-дихлоро-2-[(2,3матографією на колонці на оксиді силіцію, застодифлуоробензил)тіо]піримідин (продукт прикладу совуючи EtOAc/ізогексан (3:7) як елюент, що дає 1, стадія іі) (0,56 г) в ТГФ (5 мл) та 60% натрій гідпридатну сполуку як бліду жовту тверду речовину. рид (80 мг), що дає придатну сполуку як бліде жоВихід: 0,49 г. вте масло. Вихід: 0,43 г. + 1 МС: XIAT(+ve) 503 [М+Н ] Н ЯМР: (CDCI3) 1,16 (s, 3H), 1,24 (s, 3H), Приклад 8 1,55 (s, 3H), 1,57 (s, 3H), 3,87 (dd, 1H), 4,02 (dd, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2R)1H), 4,35 (t, 1H), 4,41 (s, 2H), 6,38 (s, 1H), 7,04 (m, 2,3-дигідрокси-1,1-диметилпропіл]окси]-42H), 7,26 (m, 1H). піримідиніл]-1-азетидинсульфонамід ііі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[1[(4R)-2,2-диметил-1,3-діоксолан-4-іл]-1метилетокси]-4-піримідиніл]-1азетидинсульфонамід Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,20 г), трис(дибензиліденацетон)дипаладію(0) (91 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'До суспензії N-[2-[[(2,3біфенілу (XPHOS) (42 мг), цезій карбонату (0,49 г) дифлуорофеніл)метил]тіо]-6-[1-[(4R)-2,2-диметилта 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[11,3-діоксолан-4-іл]-1-метилетокси]-4-піримідиніл][(4R)-2,2-диметил-1,3-діоксолан-4-іл]-11-азетидинсульфонаміду (продукт від, стадія ііі) метилетокси]-піримідину (0,43 г) в діоксані (8 мл). 0,34 г) в ДХМ (9 мл) додавали ферум (III) хлорид Очищали хроматографією на колонці з силікагегексагідрат (0,61 г) та суміш перемішували при лем, застосовуючи EtOAc/ізогексан (2:8) як елюнавколишній температурі 35 хвилин. Реакційну ент, що дає придатну сполуку як бліду жовту піну. суміш розбавляли насичен. розчином натрій гідроВихід: 0,43 г. карбонату та екстрагували ДХМ (х3). Комбіновані МС: XIAT(-ve) 529 [М+Н ] органічні шари сушили (MgSO4), фільтрували та Приклад 9 випаровували. Залишок очищали хроматографією N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[(2S)на колонці з силікагелем, застосовуючи Ме2,3-дигідрокси-1,1-диметилпропіл]окси]-4ОН/ДХМ (99:1 - 98:2 градієнт) як елюент, що дає піримідиніл]-1-азетидинсульфонамід сполуку заголовку як білу піну. Вихід: 0,20 г. + МС: XIAT(+ve) 489 [М+Н ] 1 Н ЯМР: (ДМСО) 1,41 (s, 3H), 1,44 (s, 3H), 2,16 (квінтет, 2Н), 3,32 (m, 1H), 3,56 (m, 1Н), 3,87 (m, 1Н), 3,91 (t, 4Н), 4,46 (m, 3H), 4,98 (d, 1Н), 6,06 (s, 1Н), 7,18 (m, 1Н), 7,37 (m, 1Н), 7,42 (m, 1Н), 11,06 (br s, 1Η). Інтермедіати для цієї сполуки отримували наступним чином: 41 92463 42 До суспензії N-[2-[[(2,3біфенілу (XPHOS) (40 мг), цезій карбонату (0,42 г) дифлуорофеніл)метил]тіо]-6-[1-[(4S)-2,2-диметилта 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[11,3-діоксолан-4-іл]-1-метилетокси]-4-піримідиніл][(4S)-2,2-диметил-1,3-діоксолан-4-іл]-11-азетидинсульфонаміду (продукт стадії ііі) (0,37 г) метилетокси]-піримідину (0,37 г) в діоксані (8 мл). в ДХМ (10 мл) додавали ферум (III) хлорид гексаОчищали хроматографією на колонці з силікагегідрат (0,66 г) та суміш перемішували при навколем, застосовуючи EtOAc/ізогексан (2:8 - 3:7 граділишній температурі 1 годину. Реакційну суміш роєнт) як елюент, що дає придатну сполуку як бліде збавляли насичен. розчином натрій жовте масло. Вихід: 0,37 г. гідрокарбонату та екстрагували ДХМ (х3). КомбіМС: XIAT(-ve) 529 [М+Н ] новані органічні шари сушили (MgSO4), фільтруваПриклад 10 ли та випаровували. Залишок очищали хроматогN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[2рафією на колонці з силікагелем, застосовуючи гідрокси-1-(гідроксиметил)-1-метилетокси]-4МеОН/ДХМ (градієнт 99:1 - 98:2) як елюент, що піримідиніл]-1-азетидинсульфонамід дає сполуку заголовку як білу тверду речовину. Вихід: 0,16 г. МС: XIAT(+ve) 489 [М+Н+] 1 Н ЯМР: (ДМСО) 1,42 (s, 3H), 1,44 (s, 3H), 2,15 (квінтет, 2Н), 3,33 (m, 1H), 3,56 (m, 1Н), 3,87 (m, 1Н), 3,90 (t, 4Н), 4,44 (m, 3H), 4,98 (d, 1Н), 6,06 (s, 1Н), 7,17 (m, 1Н), 7,36 (m, 1Н), 7,41 (m, 1Н), 11,06 (brs, 1H). Інтермедіати для цієї сполуки отримували наступним чином: До суспензії N-[2-[[(2,3і) , -2,2-тетраметил-(4S)-1,3-діоксолан-4дифлуорофеніл)метил]тіо]-6-[(2,2,5-триметил-1,3метанол діоксан-5-іл)окси]-4-піримідиніл]-1До безводного церій (III) хлориду (8,1 г гептагіазетидинсульфонаміду (продукт стадії іі) (0,46 г) в драту сушили під високим вакуумом при 150°С ДХМ (15 мл) додавали ферум (III) хлорид гексагідпротягом 20 годин) додавали ТГФ (10 мл) тоді рат (0,85 г) та суміш перемішували та температура метиллітій (1,6М, 11,7 мл) та реакційну суміш пенавколишнього середовища - протягом 30 хвилин. ремішували при навколишній температурі 10 хвиДодавали насичений розчин натрій гідрокарбонату лин. Додавали розчин метилового естеру 2,2та тоді екстрагували ДХМ (х4). Комбіновані органідиметил- -(4S)-1,3-діоксолан-4-карбонової кислоти чні шари сушили (MgSO4), фільтрували та випаро(1 г) в ТГФ (5 мл) та суміш перемішували при навували. Залишок очищали хроматографією на вколишній температурі 1,5 години. Реакційну суколонці з силікагелем, застосовуючи МеОН/ДХМ міш гасили повільним додаванням Н2О (10 мл) і (99:1 - 98:2 градієнт) як елюент, що дає сполуку тоді екстрагували Et2O (x2). Комбіновані органічні заголовку як білу піну. Вихід: 100 мг. шари сушили (MgSO4), фільтрували та випаровуМС: XIAT(-ve) 475 [М+Н ] вали, що дає придатну сполуку як жовте масло. 1 Вихід: 0,75 г. Н ЯМР: (ДМСО) 1,43 (s, 3H), 2,15 (квінтет, 1 2Н), 3,63 (dd, 2H), 3,73 (dd, 2H), 3,92 (t, 4Н), 4,44 (s, Н ЯМР: (CDCI3) 1,15 (s, 3H), 1,24 (s, 3H), 2Н), 4,78 (t, 2Н), 6,09 (s, 1Н), 7,17 (m, 1Н), 7,36 (m, 1,38 (s, 3H), 1,43 (s, 3H), 3,84 (m, 1H), і 3,97 (m,2H). 1Н), 7,43 (m, 1Н), 11,06 (s, 1H). іі) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6Інтермедіати для цієї сполуки отримували на[1-[(4S)-2,2-диметил-1,3-діоксолан-4-іл]-1ступним чином: метилетокси]-піримідин і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6Придатну сполуку отримували згідно з проце[(2,2,5-триметил-1,3-діоксан-5-іл)окси]-піримідин дурою, описаною в прикладі 1, стадія ііі), застосоПридатну сполуку отримували згідно з процевуючи , -2,2-тетраметил-(4S)-1,3-діоксолан-4дурою, описаною в прикладі 1, стадія ііі), застосометанол (0,32 г) та 4,6-дихлоро-2-[(2,3вуючи 2,2,5-триметил-1,3-діоксан-5-ол (як отримадифлуоробензил)тіо]піримідин (продукт прикладу но в Synthesis, 1998, р. 879) (0,29 г) та 4,61, стадія іі) (0,56 г) в ТГФ (5 мл) та 60% натрій гіддихлоро-2-[(2,3-дифлуоробензил)тіо]піримідин рид (80 мг), що дає придатну сполуку як безбарвне (продукт прикладу 1, стадія іі) (0,51 г) в ТГФ (5 мл) масло. Вихід: 0,37 г. 1 та 60% натрій гідрид (80 мг), що дає придатну споН ЯМР: (CDCI3) 1,15 (s, 3H), 1,24 (s, луку як жовте масло. Вихід: 0,44 г. 3H),.1,55 (s, 3H), 1,57 (s, 3H), 3,88 (dd, 1H), 4,02 1 Н ЯМР: (CDCI3) 1,16 (s, 3H), 1,24 (s, 3H), (dd, 1H), 4,35 (t, 1H), 4,41 (s, 2H), 6,38 (s, 1H), 7,03 1,53 (s, 3H), 3,85 (d, 2H), 4,14 (d, 2H), 4,38 (s, 2H), (m, 2H), 7,26 (m, 1H). 6,48 (s, 1H), 7,04 (m, 2H), 7,26 (m, 1H). ііі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[1іі) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6[(4S)-2,2-диметил-1,3-діоксолан-4-іл]-1[(2,2,5-триметил-1,3-діоксан-5-іл)окси]-4метилетокси]-4-піримідиніл]-1піримідиніл]-1-азетидинсульфонамід азетидинсульфонамід Придатну сполуку отримували згідно з процеПридатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосодурою, описаною в прикладі 1, стадія iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано вуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,22 г), згідно з патентом WO 2004/011443, 0,17 г), трис(дибензиліденацетон)дипаладію(0) (97 мг), 2трис(дибензиліденацетон)дипаладію(0) (78 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1' 43 92463 44 біфенілу (XPHOS) (50 мг), цезій карбонату (0,52 г) вого естеpy (0,27 г) в діоксані (5 мл). Очищали та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6хроматографією на колонці на оксиді силіцію, за[(2,2,5-триметил-1,3-діоксан-5-іл)окси]-піримідину стосовуючи EtOAc/ізогексан (градієнт 1:9 - 1:1) як (0,44 г) в діоксані (10 мл). Очищали хроматографіелюент, що дає придатну сполуку як бліде жовте єю на колонці з силікагелем, застосовуючи масло. Вихід: 0,11 г. + EtOAc/ізогексан (2:8 - 3:7 градієнт) як елюент, що MC: XIAT(+ve) 517 [M+H ] дає придатну сполуку як бліде жовте масло. Вихід: Приклад 12 0,46 г. N-[6-(дифлуорометокси)-2-[[(2,3MC: XIAT(+ve) 517 [M+H+] дифлуорофеніл)метил]тіо]-4-піримідиніл]-1Приклад 11 азетидинсульфонамід N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2гідрокси-1-метилетокси]-4-піримідиніл]-2тіазолсульфонамід До розчину 2-[[2-[[(2,3дифлуорофеніл)метил]тіо]-6-[(2тіазолілсульфоніл)амін]-4-піримідиніл]окси]-(2R)пропіонової кислоти етилового естеру (продукт стадії іі) (0,11 г) в ТГФ (3 мл) додавали літій боргідрид (2М розчин в ТГФ, 0,23 мл) та суміш перемішували при навколишній температурі 20 годин. Реакційну суміш охолоджували до 0°С, гасили 0,5М розчином НСІ та водну складову екстрагували EtOAc (х2). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували. Залишок очищали хроматографією на колонці з силікагелем, застосовуючи МеОН/ДХМ (градієнт 99:1 98:2) як елюент, що дає сполуку заголовку як білу тверду речовину. Вихід: 15 мг. МС: XIAT(+ve) 475 [М+Н+] 1 Н ЯМР: (CDCI3) 1,44 (d, 3H), 3,72 (m, 2H), 4,34 (q, 2H), 5,25 (m, 1H), 5,29 (s, 1H), 6,43 (s, 1H), 7,03 (m, 2H), 7,17 (t, 1H), 7,66 (s, 1H), 7,98 (s, 1H). Інтермедіати для цієї сполуки отримували наступним чином: і) 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]4-піримідиніл]окси]-(2R)-пропіонової кислоти етиловий естер Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія ііі), застосовуючи 2-гідрокси-(2R)-пропіонової кислоти етиловий естер (1,45 мл) та 4,6-дихлоро-2-[(2,3дифлуоробензил)тіо]піримідин (продукт прикладу 1, стадія іі) (3 г) в ТГФ (40 мл) та 60% натрій гідрид (0,55 г), що дає придатну сполуку як чисте безбарвне масло. Вихід: 2,85 г. МС: XIAT(+ve) 389/391 [М+Н+] іі) 2-[[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(2тіазолілсульфоніл)амін]-4-піримідиніл]окси]-(2R)пропіонової кислоти етиловий естер Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосовуючи суміш 2-тіазолсульфонаміду (0,17 г), трис(дибензиліденацетон)дипаладію(0) (64 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (33 мг), цезій карбонату (0,34 г) та 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-4піримідиніл]окси]-(2R)-пропіонової кислоти етило Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,11 г), трис(дибензиліденацетон)дипаладію(0) (0,10 г), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (60 мг), цезій карбонату (0,26 г), 4-хлор-6-(дифлуорометокси)-2-[[(2,3дифлуорофеніл)метил]тіо]-піримідину (продукт стадії іі) (0,18 г) та безводного діоксану (5 мл). Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (3:7) як елюент та придатні фракції випаровували. Отримане масло порошкували діетиловим етером/ізо-гексаном, що дає сполуку заголовку як білу тверду речовину. Вихід: 70 мг. МС: XIAT(+ve) 439 [М+Н+] 1 Н ЯМР: (ДМСО) 2,13 (квінтет, 2Н), 3,93 (t, 4H), 4,50 (s, 2H), 6,30 (s, 1H), 7,19-7,12 (m, 1H), 7,45-7,30 (m, 2Н), 7,79 (t, 1H), 11,53 (s, 1H). Інтермедіати для цієї сполуки отримували наступним чином: і) 6-(дифлуорометокси)-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідинол До розчину 2-[[(2,3-дифлуорофеніл)метил]тіо]4,6-піримідиндіолу (3 г) в ДМФ (30 мл) додавали цезій карбонат (4,3 г) та хлородифлуоро-оцтової кислоти натрієву сіль (1,9 г). Отриману суміш нагрівали при 100°С протягом 2 годин. Реакційну суміш охолоджували тоді розбавляли Н2О та екстрагували EtOAc. Органічний шар промивали з Н2О та сушили (MgSO4), фільтрували та випаровували. Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (2:8) як елюент, що дає придатну сполуку як білу тверду речовину. Вихід: 0,4 г. МС: XIAT(+ve) 421 [М+Н+] 1 Н ЯМР: (ДМСО) 4,53 (s, 2Н), 7,13-7,22 (m, 1Н), 7,30-7,42 (m, 2Н), 7,75 (t, 1H). іі) 4-хлор-6-(дифлуорометокси)-2-[[(2,3дифлуорофеніл)метил]тіо]-піримідин До розчину 6-(дифлуорометокси)-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідинолу (продукт стадії і) (0,4 г) в 1,2-диметоксіетані додавали бензилтриетиламоній хлорид (3 мг) та фосфорис 45 92463 46 тий оксихлорид (0,23 мл). Отриману суміш нагрідин. Реакційну суміш розбавляли толуолом, тоді вали під зворотним холодильником протягом 16 екстрагували розчином амоній хлориду (х2), тоді годин. Реакційну суміш охолоджували тоді розбарозсолом (х1) та органічний шар сушили (MgSO4), вляли Н2О та екстрагували EtOAc. Органічний шар фільтрували та випаровували. Отримане масло промивали Н2О та сушили (MgSO4), фільтрували порошкували ізо-гексаном, що дає придатну спота випаровували. Очищали хроматографією на луку як білу тверду речовину. Вихід: 4 г. 1 колонці з силікагелем, застосовуючи Н ЯМР: (CDCI3) 1,09 (d, 3H), 2,34 (d, 1H), EtOAc/ізогексан (2:8) як елюент, що дає придатну 2,97 (dt, 1H), 3,15 (dd, 1H), 3,97 (m, 1H), 7,23 (m, сполуку як чисте безбарвне масло. Вихід: 0,35 г. 3H), 7,28 (m, 6H), 7,45 (m, 6H). 1 Н ЯМР: (ДМСО) 4,54 (s, 2Н), 7,12-7,22 (m, ііі) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-62Н), 7,25 (s, 1Н), 7,30-7,42 (m, 2Н), 7,81 (t, 1H). [(1R)-1-метил-2-(трифенілметокси)етокси]Приклад 13 піримідин N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2Придатну сполуку отримували згідно з процегідрокси-1-метилетокси]-4-піримідиніл]-4дурою, описаною в прикладі 1, стадія (ііі), застосопіридинсульфонамід вуючи (2R)-1-(трифенілметокси)-2-пропанол (1,35г) та 4,6-дихлоро-2-[(2,3дифлуоробензил)тіо]піримідин (продукт прикладу 1, стадія (іі) (1 г), в ТГФ (15 мл) та 60% натрій гідриді (0,18 г), що дає придатну сполуку як бліде жовте масло. Вихід: 1,8 г. МС: XIAT(+ve) 589 [М+Н+] iv) N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6[(1R)-1-метил-2-(трифенілметокси)етокси]-4піримідиніл]-4-піридинсульфонамід Суміш 4-піридинсульфонаміду (продукт стадії До розчину N-[2-[[(2,3і) (0,21 г), трис(дибензиліденацетон)дипаладію(0) дифлуорофеніл)метил]тіо]-6-[(1R)-1-метил-2(50 мг), 2-дициклогексилфосфіно-2',4',6'(трифенілметокси)етокси]-4-піримідиніл]-4триізопропіл-1,1'-біфенілу (XPHOS) (50 мг), цезій піридинсульфонаміду (продукт стадії iv). (100 мг) в карбонату (0,66 г) та 4-xлор-2-[[(2,3МеОН (10 мл) додавали п-толуолсульфонову кисдифлуорофеніл)метил]тіо]-6-[(1R)-1-метил-2лоту (31 мг) та анізол (0,15 г). Тоді реакцію пере(трифенілметокси)етокси]-піримідину (продукт мішували при кімнатній температурі протягом 18 стадії ііі) (0,40 г) в діоксані (20 мл) нагрівали зі звогодин. Реакція розподіляли між EtOAc (100 мл) та ротним холодильником в мікрохвильовому відкриН2О (100 мл). Тоді подалі екстрагували водний тому контейнері при 100°С, 300W з охолодженням шар EtOAc (2x100 мл). Комбіновані органічні шари протягом 3 годин. Реакційну суміш розводили сушили (MgSO4), фільтрували та випаровували. ДХМ, фільтрували через арбоцел та фільтрат виЗалишок очищали реверсно-фазовою ВЕРХ, запаровували. Залишок очищали реверсно-фазовою стосовуючи TFA (0,2%)/MeCN, що дає сполуку ВЕРХ, застосовуючи систему TFA (0,2%)/MeCN, заголовку як білу тверду речовину. Вихід: 50 мг. що дає сполуку заголовку як жовту тверду речовиМС: XIAT(+ve) 496 [М+Н+] 1 ну. Вихід: 0,21 г. Н ЯМР: (ДМСО) 1,13 (d, 3H), 4,30 (s, 2H), МС: XIAT(+ve) 711 [М+Н+] 5,06-5,12 (m, 1Η), 6,0 (s, 1H), 7,07-7,38 (m, 3H), 1 Н ЯМР: (ДМСО) 8,85-8,76 (m, 2H), 7,83-7,73 7,84 (d, 2H), 8,86 (d, 2H). (m, 2Н),7,26-7,17 (m, 18Н), 6,03 (S, 1Н), 5,44-5,35 Інтермедіати для цієї сполуки отримували на(m, 1Н), 4,29 (s, 2Н), 3,08-3,01 (m, 2Н), 1,22-1,14 ступним чином: (m, 3H). і) 4-піридинсульфонамід Приклад 14 При кімнатній температурі протягом 3 годин N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-етоксичерез розчин 4-піридинтіону (3,33 г) в конц. НСІ 4-піримідиніл]-1-азетидинсульфонамід (22,5 мл) та Н2О (6 мл) барботували газ хлор. Потім реакційну суміш виливали на лід (15 г), та тоді кашку переносили до охолодженого льодом 0,88 аміаку (120 мл). Тоді цю суміш перемішували при кімнатній температурі протягом ночі перед концентруванням у вакуумі до початку випадіння твердого в осад. У цей момент реакційну суміш охолоджували протягом ночі у холодильнику та тверде збирали фільтрацією як жовту тверду речовину. Вихід: 1,51 г. Сполуку заголовку отримували згідно з проце1 Н ЯМР: (ДМСО) 7,73 (s, 2H), 7,75 (d, 2H), дурою, описаною в прикладі 1, стадія iv), застосо8,84 (d, 2H). вуючи суміш азетидин-1-сульфонаміду (отримано іі) (2R)-1-(трифенілметокси)-2-пропанол згідно з патентом WO 2004/011443, 0,17 г), До суспензії (2R)-1,2-пропандіолу (1,9 мл) в трис(дибензиліденацетон)дипаладію(0) (75 мг), 2толуолі (20 мл) додавали триетиламін (8,3 мл) та дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'4-диметиламінопіридин (32 мг). Суміш охолоджубіфенілу (XPHOS) (40 мг), цезій карбонату (0,40 г) вали льодом і додавали 1,1',1"4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6(хлорометиліден)трис-бензол (6,6 г), та суміш пеетокси-піримідину (продукт стадії і) (0,26 г)) в діокремішували при навколишній температурі 20 госані (5 мл). Очищали хроматографією на колонці з 47 92463 48 силікагелем, застосовуючи EtOAc/ізогексан (1:9) як лем, застосовуючи EtOAc/ізогексан (1:1) як елюелюент, що дає сполуку заголовку як білу тверду ент, що дає придатну сполуку як білу тверду речоречовину. Вихід: 0,17 г. вину. Вихід: 2,03 г. 1 MC: XIAT(+ve) 417 [M+H+] Н ЯМР: (ДМСО) 1,41 (s, 9H), 2,89 (t, 4H), 1 Н ЯМР: (ДМСО) 1,27 (t, 3H), 2,13 (квінтет, 3,40 (t, 4H), 6,81 (s, 2H). 2Н), 3,90 (t, 4Н), 4,34 (q, 2Н), 4,47 (s, 2Н), 6,12 (s, іі) 4-[[[2-[[(2,3-Дифлуорофеніл)метил]тіо]-61Н), 7,15 (m, 1Н), 7,33 (m, 1Н), 7,42 (m, 1Н), 11,11 етокси-4-піримідиніл]амін]сульфоніл]-1(brs, 1H). піперазинкарбонова кислота-1,1-диметилетиловий Інтермедіат для цієї сполуки отримували наестер ступним чином: Придатну сполуку отримували згідно з процеі) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6дурою, описаною в прикладі 1, стадія (iv), застосоетокси-піримідин вуючи суміш 4-(аміносульфоніл)-1До розчину 4,6-дихлоро-2-[(2,3піперазинкарбонова кислота-1,1дифлуоробензил)тіо]піримідину (0,50 г) в етанолі диметилетилового естеру (продукт стадії і) (0,29 г), (5 мл) додавали 60% натрій гідрид (72 мг) та реактрис(дибензиліденацетон)дипаладію(0) (67 мг), 2ційну суміш перемішували при навколишній темдициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'пературі 6 годин. Суміш розводили Н2О та екстрабіфенілу (XPHOS) (35 мг), цезій карбонату (0,36 г) гували EtOAc (х2). Комбіновані органічні шари та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6сушили (MgSO4), фільтрували та випаровували, етокси-піримідину (продукт із прикладу 14, стадія і) що дає придатну сполуку як чисте безбарвне мас(0,23 г) в діоксані (5 мл). Очищали хроматографією ло. Вихід: 0,53 г. на колонці на оксиді силіцію, застосовуючи МС: XIAT(+ve) 317/319 [М+Н+] EtOAc/ізогексан (1:9 - 1:3 градієнт) як елюент, що Приклад 15 дає придатну сполуку як жовте масло. Вихід: 0,25г. N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-етоксиМС: XIAT(-ve) 544 [М+Н ] 4-піримідиніл]-1-піперазинсульфонамід Приклад 16 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-(2,2,2трифлуороетокси)-4-піримідиніл]-1азетидинсульфонамід До розчину 4-[[[2-[[(2,3дифлуорофеніл)метил]тіо]-6-етокси-4піримідиніл]амін]сульфоніл]-1-піперазинкарбонова кислота-1,1-диметилетиллвого естеру (продукт стадії іі) (0,24 г) в ДХМ (2 мл) додавали трифлуороцтову кислоту (2 мл) та реакційну суміш перемішували при навколишній температурі 2,5 години. Реакційну суміш випаровували, залишок азеотропували ДХМ (х2) і тоді очищали реверснофазовою ВЕРХ, елюючи сумішами ацетонітрилу/водн. 0,2% трифлуороцтової кислоти, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,18 г. МС: XIAT(+ve) 446 [М+Н+] 1 Н ЯМР: (ДМСО) 1,28 (t, 3H), 3,18 (m, 4Н), 3,44 (m, 4Н), 4,36 (q, 2H), 4,47 (s, 2H), 6,05 (S, 1Н), 7,18 (m, 1Н), 7,37 (m, 2Н), 8,73 (brs, 1H), 11,33 (brs, 1H). Інтермедіат для цієї сполуки отримували наступним чином: і) 4-(Аміносульфоніл)-1,1-диметилетиловий естер-1-піперазинкарбонова кислота До розчину 1,1-диметилетиловий естер-1піперазинкарбонової кислоти (2,94 г) в діоксані (40мл) додавали сульфамід (4,0 г). Потім реакційну суміш нагрівали зі зворотним холодильником протягом 24 години. Реакційній суміші дозволяли охолодитися перед концентруванням у вакуумі. Залишок розподіляли між EtOAc (300 мл) та Н2О (300 мл) та подалі водну фазу екстрагували (2x300 мл) EtOAc. Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували. Залишок очищали хроматографією на колонці з силікаге Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 1, стадія iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,14 г), трис(дибензиліденацетон)дипаладію(0) (60 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (30 мг), цезій карбонату (0,32 г), 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-(2,2,2трифлуоретокси)-піримідин (продукт стадії і) (0,24г) в діоксані (5 мл). Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (1:9 - 2:8 градієнт) як елюент, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,11 г. МС: XIAT(+ve) 471 [М+Н+] 1 Н ЯМР: (ДМСО) 2,1 (квінтет, 2Н), 3,83 (t, 4Н), 4,51 (s, 2Н), 5,03 (q, 2Н), 6,22 (s, 1Н), 7,16 (m, 1H), 7,36 (m, 1H), 7,42 (m, 1H), 11,33 (s, 1H). Інтермедіат для цієї сполуки отримували наступним чином: і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6(2,2,2-трифлуоретокси)-піримідин Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія ііі), застосовуючи 2,2,2-трифлуоретанол (0,16 мл) та 4,6дихлоро-2-[(2,3-дифлуоробензил)тіо]піримідин (продукт прикладу 1, стадія іі) (0,60 г) в ТГФ (6 мл) та 60% натрій гідрид (94 мг), що дає придатну сполуку як чисте безбарвне масло. Вихід: 0,6 г. 49 92463 Н ЯМР: (ДМСО) 4,54 (s, 2Н, 5,14 (m, 2Н), 7,13 (s, 1Н), 7,19 (m, 1Н), 7,37 (m, 2Н). Приклад 17 N-[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6-(2,2,2трифлуоретокси)-4-піримідиніл]-1піперазинсульфонамід 50 1 До розчину 4-[[[2-[[(2,3дифлуорофеніл)метил]тіо]-6-(2,2,2трифлуоретокси)-4-піримідиніл]амін]сульфоніл]-1піперазинкарбонова кислота-1,1диметилетилового естеру (продукт стадії і) (0,21 г) в ДХМ (2 мл) додавали трифлуороцтову кислоту (2 мл) та реакційну суміш перемішували при навколишній температурі 4 години. Реакційну суміш випаровували, залишок азеотропували Et2O (x2) і тоді очищали реверсно-фазовою ВЕРХ, елюючи сумішами ацетонітрилу/водн. 0,2% трифлуороцтової кислоти, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,14 г. МС: XIAT(+ve) 500 [М+Н+] 1 Н ЯМР: (ДМСО) 3,17 (m, 4Н), 3,50 (m, 4Н), 4,51 (s, 2H), 5,06 (q, 2H), 6,17 (s, 1H), 6,96-7,42 (m, 3H), 8,82 (br s, 2H). Інтермедіат для цієї сполуки отримували наступним чином: і) 4-[[[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6(2,2,2-трифлуоретокси)-4піримідиніл]амін]сульфоніл]-1-піперазинкарбонова кислота-1,1-диметилетиловий естер Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосовуючи суміш 4-(аміносульфоніл)-1піперазинкарбонова кислота-1,1диметилетилового естеру (продукт із прикладу 15, стадія і), 0,40 г), трис(дибензиліденацетон)дипаладію(0) (91 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (48 мг), цезій карбонату (0,49 г) та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6(2,2,2-трифлуоретокси)-піримідину (продукт із прикладу 16, стадія і) (0,37 г) в діоксані (6 мл). Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (1:9 - 2:8 градієнт) як елюент, що дає придатну сполуку як жовту тверду речовину. Вихід: 0,22 г. МС: XIAT(-ve) 598 [М+Н ] Приклад 18 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-(1,1диметилетокси)-4-піримідиніл]-1азетидинсульфонамід Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 1, стадія iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,16 г), трис(дибензиліденацетон)дипаладію(0) (70 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (36 мг), цезій карбонату (0,37 г) та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-(1,1диметилетокси)-піримідину (продукт стадії і) (0,26г) в діоксані (6 мл). Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (1:9 - 2:8 градієнт) як елюент, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,28 г. МС: XIAT(-ve) 443 [М+Н ] 1 Н ЯМР: (ДМСО) 1,48 (s, 9Н), 2,16 (квінтет, 2Н), 3,92 (t, 4Н), 4,46 (s, 2Н), 6,03 (s, 1Н), 7,17 (m, 1Н), 7,35 (m, 1Н), 7,42 (m, 1Н), 11,05 (br s, 1H). Інтермедіат для цієї сполуки отримували наступним чином: і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6(1,1-диметилетокси)-піримідин До розчину 4,6-Дихлоро-2-[(2,3дифлуоробензил)тіо]піримідину (продукт прикладу 1, стадія іі) (2 г) в ТГФ (20 мл) додавали калій третбутоксид (0,8 г) та реакційну суміш перемішували при навколишній температурі 20 годин. Подалі додавали калій трет-бутоксид (0,8 г) та реакційну суміш перемішували при навколишній температурі 4 години. Суміш розводили Н2О та екстрагували EtOAc (x3). Комбіновані органічні шари промивали Н2О та сушили (MgSO4), фільтрували та випаровували. Отримане масло очищали хроматографією на колонці з силікагелем, застосовуючи МеОН/ДХМ (99:1 - 98:2 градієнт) як елюент, що дає придатну сполуку як чисте безбарвне масло. Вихід: 0,68 г. 1 Н ЯМР: (ДМСО) 1,50 (s, 9Н), 4,47 (s, 2Н), 6,70 (s, 1Н), 7,19 (m, 1Н), 7,37 (m, 2Н). Приклад 19 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[[2гідрокси-1-(гідроксиметил)етил]тіо]-піримідин-4іл]азетидин-1-сульфонамід Розчин N-[2-[[(2,3-дифлуорофеніл)метил]тіо]6-[(2-феніл-1,3-діоксан-5-іл)тіо]піримідин-4іл]азетидин-1-сульфонаміду (продукт стадії іі) (0,11г) та піридин пара-толуолсульфонату (99 мг) в метанолі (5 мл) та Н2О (2 краплі) нагрівали при 51 92463 52 60°С протягом 1 години. Розчин охолоджували та додавали трифлуороцтову кислоту (3 мл). Потім розчинник випаровували під зниженим тиском. реакційну суміш перемішували при кімнатній темЗалишок розчиняли в EtOAc, промивали Н2О, супературі протягом 1 години. Розчинник видаляли шили (MgSO4) та фільтрували. Розчинник випарота залишок очищали реверсно-фазовою ВЕРХ, вували під зниженим тиском та залишок очищали застосовуючи спосіб TFA (0,2%)/MeCN, що дає флеш-хроматографією на силікагелі, елюючи сполуку заголовку як білу тверду речовину. Вихід: EtOAc/ізо-гексаном (8:2), що дає придатний про77 мг. дукт як жовту смолу. Смолу розчиняли в ДХМ та МС: XIAT(+ve) 476 [М+Н+] 1 метанолі, фільтрували через деревне вугілля та Н ЯМР: (ДМСО) 1,13 (d, 3H), 3,01-3,05 (m, фільтрат випаровували під зниженим тиском. За4Н), 3,13-3,17 (m, 4Н), 4,34-4,41 (m, 2Н), 4,79 (s, лишок твердого сушили під високим вакуумом при 1Н), 4,97-5,05 (m, 1Н), 5,84 (s, 1Н), 7,10-7,16 (m, 40°С, що дає продукт заголовку як білу тверду 1Н), 7,27-7,34 (m, 1Н), 7,39-7,45 (m, 1Н). речовину. Вихід: 50 мг. Інтермедіати для цієї сполуки отримували наМС: XIAT(-ve) 477 [М-Н] ступним чином: 1 Н ЯМР: (ДМСО) 2,13 (m, 2Н), 3,66 (октет, (і) 4-[[[2-[[(2,3-дифлуорофеніл)метил]тіо]-64Н), 3,92 (t, 5H), 4,49 (s, 2H), 4,99 (t, 2Н), 6,65 (s, [(1R)-2-гідрокси-1-метилетокси]-41Н), 7,17 (m, 1Н), 7,36 (m, 2Н), 11,18 (s, 1H). піримідиніл]амін]сульфоніл], 1,1-диметилетиловий Інтермедіати для цієї сполуки отримували наестер1-піперазинкарбонова кислота ступним чином: Суміш 4-(аміносульфоніл)-1,1і) 4-Хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6диметилетиловий естер-1-піперазинкарбонової [(2-феніл-1,3-діоксан-5-іл)тіо]піримідин кислоти (продукт прикладу 15, стадія і) (0,40 г), Натрій метоксид (0,1 мл 25-30% розчину метатрис(дибензиліденацетон)дипаладію(0) (50 мг), 2нолу) додавали до розчину етил S-(2-феніл-1,3дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'діоксан-5-іл)етантіоату (0,12 г; отримано згідно з біфенілу (XPHOS) (50 мг), цезій карбонату (1 г) та процедурою в Chem. Pharm. Bull., 2000, 48, (5), р. (2R)-пропіонова кислота-2-[[6-хлор-2-[[(2,3694-707) в ТГФ (2 мл). Після перемішування протядифлуорофеніл)метил]тіо]-4-піримідиніл]окси]-, гом 15 хвилин, додавали продукт прикладу 1, стаетилового естеру (продукт із прикладу 11, стадія і) дія іі) (0,12 г). Реакційну суміш перемішували при (0,40 г) в діоксані (20 мл) нагрівали зі зворотним кімнатній температурі протягом 18 годин. Розчинхолодильником в мікрохвильовому відкритому ник випаровували під зниженим тиском та залишок контейнері при 100°С, 300W з охолодженням проочищали флеш-хроматографією на силікагелі, тягом 20 хвилин. Реакцію фільтрували через арелюючи Et2O/ізо-гексаном (1:9), що дає придатний боцел і тоді розподіляли між EtOAc (200 мл) та продукт як бежеву тверду речовину. Вихід: 0,18 г. Н2О (200 мл) та подалі водну фазу екстрагували МС: XIAT(+ve) 467/469 [М+Н] EtOAc (2x200 мл). Комбіновані органічні шари суіі) N-[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6-[(2шили (MgSO4), фільтрували та випаровували, що феніл-1,3-діоксан-5-іл)тіо]піримідин-4-іл]азетидиндає придатну сполуку як чисте масло. Вихід: 0,93 г. 1-сульфонамід MC: XIAT(+ve) 618 [M+H+] Придатну сполуку отримували з азетидин-1(іі), 4-[[[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6сульфонаміду (отримано згідно з патентом WO [(1R)-2-гідрокси-1-метилетокси]-42004/011443, 0,11 г) та 4-хлор-2-[[(2,3піримідиніл]амін]сульфоніл]-, 1,1дифлуорофеніл)метил]тіо]-6-[(2-феніл-1,3-діоксандиметилетиловий естер1-піперазинкарбонова кис5-іл)тіо]піримідину (продукт стадії і) (0,17 г) згідно з лота процедурою, описаною в прикладі 1, стадія iv). До розчину 4-[[[2-[[(2,3Залишок очищали флеш-хроматографією на силідифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1кагелі, елюючи EtOAc/ізо-гексаном (2:8), що дає метилетокси]-4-піримідиніл]амін]сульфоніл], 1,1придатну сполуку як безбарвне масло. Вихід: диметилетиловий естер-1-піперазинкарбонової 0,11г. кислоти (продукт стадії і) (0,93 г) в ТГФ (20 мл) МС: XIAT(+ve) 567 [М+Н] додавали 2М LіВН4 в ТГФ (3,0 мл). Потім реакційну Приклад 20 суміш нагрівали в мікрохвильовму відкритому конN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2тейнері при 500С, 300W з охолодженням протягом гідрокси-1-метилетокси]-4-піримідиніл]-110 хвилин. Реакційну суміш тоді гасили 2N НСІ та піперазинсульфонамід летючі складові випаровували. Залишок тоді розподіляли між EtOAc (200 мл) та Н2О (200 мл), подалі водну фазу екстрагували EtOAc (2x200 мл). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували та залишок очищали реверсно-фазовою ВЕРХ, застосовуючи спосіб TFA (0,2%)/MeCN, що дає сполуку заголовку як чисте масло. Вихід: 0,23 г. МС: XIAT(+ve) 576 [М+Н+] До розчину 4-[[[2-[[(2,3Приклад 21 дифлуорофеніл)метил]тіо]-6-[(1R)-2-гідрокси-1N-[6-(дифлуорометокси)-2-[[(2,3метилетокси]-4-піримідиніл]амін]сульфоніл], 1,1дифлуорофеніл)метил]тіо]-4-піримідиніл]-1-метилдиметилетиловий естер1-піперазинкарбонової 1Н-імідазол-4-сульфонамід кислоти (продукт стадії іі) (0,23 г) в ДХМ (3 мл) 53 Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосовуючи суміш 1-метил-1Н-імідазол-4-сульфонаміду (0,25 г), трис(дибензиліденацетон)дипаладію(0) (0,10 г), 2-дицикпогексилфосфіно-2',4',6'триізопропіл-1,1'-біфенілу (XPHOS) (60 мг), цезій карбонату (0,26 г), 4-хлор-6-(дифлуорометокси)-2[[(2,3-дифлуорофеніл)метил]тіо]-піримідину (продукт прикладу 12, стадія іі) (0,18 г) та безводного діоксану (5 мл). Очищали порошкуванням метанолом/ДХМ. Отриману білу тверду речовину розводили Н2О та екстрагували EtOAc. Органічний шар промивали Н2О (х2) тоді - розсолом та сушили (MgSO4), фільтрували та випаровували. Отримане масло порошкували метанолом/ДХМ, що дає сполуку заголовку як білу тверду речовину. Вихід: 15мг. МС: XIAT(+ve) 464 [М+Н+] 1 Н ЯМР: (ДМСО) 3,67 (s, 3H), 4,45 (s, 2H), 6,38 (s, 1H), 7,10-7,18 (m, 1H), 7,30-7,40 (m, 2Н), 7,70 (t, 1H), 7,82 (s, 1H), 8,08 (s, 1H). Приклад 22 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2гідрокси-1-метилетокси]-4-піримідиніл]-1,6-дигідро1-метил-6-оксо-3-піридинсульфонамід До розчину N-[2-[[(2,3дифлуорофеніл)метил]тіо]-6-[(1R)-1-метил-2(трифенілметокси)етокси]-4-піримідиніл]-1,6дигідро-1-метил-6-оксо-3-піридинсульфонаміду (продукт стадії іі) (0,16 г) в МеОН (10 мл) додавали п-толуолсульфонову кислоту (50 мг) та анізол (0,22 г). Тоді реакцію перемішували при кімнатній температурі протягом 18 годин. Реакція розподіляли між EtOAc (100 мл) та Н2О (100 мл). Подалі екстрагували водний шар EtOAc (2x100 мл). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували. Залишок очищали реверсно-фазовою ВЕРХ, застосовуючи TFA (0,2%)/MeCN, що дає білу тверду речовину. Вихід: 9 мг. МС: XIAT(+ve) 499 [М+Н+] 1 Н ЯМР: (CD3OD) 1,12 (d, 3H), 3,47 (s, 3H), 3,50-3,53 (m, 2H), 4,30-4,33 (m, 2H), 5,08-5,19 (m, 1H), 5,95 (s, 1H), 6,45 (d, 1H), 6,93-7,11 (m, 2H), 7,14-7,21 (m, 1H), 7,69-7,74 (m, 1H), 8,39 (d, 1H). 92463 54 Інтермедіати для цієї сполуки отримували наступним чином: і) [(1,6-дигідро-1-метил-6-оксо-3піридиніл)сульфоніл]-, 1,1-диметилетиловий естер кабамінова кислота Хлоросульфоніл ізоціанат (6 мл) додавали краплями до розчину 2-метил-2-пропанолу (6,5 мл) в ДХМ (75 мл) при 0°С. Через 5 хвилин додавали краплями 1-метил-2(1Н)-піридинон (9 мл) а потім також додавали краплями Ν,Ν-діізопропілетиламін (14,5 мл). Тоді реакційній суміші дозволяли нагріватися до кімнатної температури протягом 18 годин. До реакційної суміш додавали Н2О (100 мл) та органічний шар відокремлювали. Подалі водну фазу екстрагували ДХМ (2x100 мл). Комбіновані органічні шари сушили (MgSO4), фільтрували та випаровували, що дає придатну сполуку як бліде жовте масло. Вихід: 7 г. 1 Н ЯМР: (CDCI3) 1,45 (s, 9Н), 3,62 (s, 3H), 6,60-6,64 (m, 1H), 7,69-7,74 (m, 1H), 8,21-8,24 (m, 1H). іі) 4-Піридинсульфонамід-N-[2-[[(2,3дифлуорофеніл)метил]тіо]-6-[(1R)-1-метил-2(трифенілметокси)етокси]-4-піримідиніл] Суміш [(1,6-дигідро-1-метил-6-оксо-3піридиніл)сульфоніл]-, 1,1-диметилетиловий естер кабамінової кислоти (продукт стадії і) (0,60 г), трис(дибензиліденацетон)дипаладію(0) (50 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (50 мг), цезій карбонату (1 г) та 4-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)1-метил-2-(трифенілметокси)етокси]-піримідину (продукт прикладу 13, стадія ііі), 0,40 г) в діоксані (20 мл) нагрівали зі зворотним холодильником в мікрохвильовому відкритому контейнері при 100°С, 300W з охолодженням протягом 3 годин. Реакційну суміш розводили ДХМ, фільтрували через арбоцел та фільтрат випаровували. Залишок очищали реверсно-фазовою ВЕРХ, застосовуючи TFA (0,2%)/MeCN систем, що дає придатну сполуку як жовту тверду речовину. Вихід: 0,12 г. МС: XIAT(+ve) 741 [М+Н+] 1 Н ЯМР: (ДМСО) 1,16-1,23 (m, 3H), 3,06 (d, 2H), 3,35 (s, 3H), 4,33-4,41 (m, 2H), 5,39-5,47 (m, 1Н), 6,06 (s, 1Н), 6,47 (d, 1Н), 7,04-7,11 (m, 2Н), 7,17-7,34 (m, 17Н), 7,67-7,71 (m, 1Н), 8,54-8,56 (m, 1Н). Приклад 23 2-[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідиніл]окси](2R)-пропіонової кислоти етиловий естер Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 1, стадія (iv), застосовуючи суміш азетидин-1-сульфонаміду (отримано згідно з патентом WO 2004/011443, 0,61 г), трис(дибензиліденацетон)дипаладію(0) (0,15 г), 2 55 92463 56 дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'Сполуку заголовку отримували згідно з процебіфенілу (XPHOS) (105 мг), цезій карбонату (0,77г), дурою, описаною в прикладі 24, застосовуючи 22-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-4[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3піримідиніл]окси]-(2R)-пропіонової кислоти етилодифлуорофеніл)метил]тіо]-4-піримідиніл]окси]вого естеру (продукт прикладу 11, стадія і) (0,61 г) (2S)-пропіонова кислота, етиловий естер, (продукт та діоксану (15 мл). Очищали хроматографією на стадії іі) (0,28 г), ТГФ (8 мл) та 2М літій боргідрид в колонці з силікагелем, застосовуючи МеОН/ДХМ ТГФ (0,57 мл). Очищали хроматографією на коло(5:95) як елюент, а потім - реверсно-фазовою нці на оксиді силіцію, застосовуючи ВЕРХ (відповідно як стаціонарна фаза та EtOAc/ізогексан (2:3) як елюент, що дає сполуку TFA/ацетонітрил як мобільна фаза), що дає сполузаголовку як білу тверду речовину. Вихід: 0,15 г. ку заголовку як білу тверду речовину. Вихід: 46 мг. МС: XIAT(-ve) 445 [М-Н ] 1 МС: XIAT(+ve) 489 [М+Н+] Н ЯМР: (CD3OD) 1,27 (d, 3H), 2,23 (квінтет, 1 Н ЯМР: (ДМСО) 1,12 (t, 3H), 1,49 (d, 3H), 2Н), 3,66 (d, 2H), 4,00 (t, 4H), 4,48 (dd, 2Н), 5,28 (q, 2,14 (квінтет, 2Н), 3,92 (t, 4H), 4,05-4,16 (m, 2Н), 1Н), 6,24 (s, 1Н), 7,05-7,23 (m, 2Н), 7,33-7,43 (m, 4,42 (dd, 2Н), 5,26 (q, 1Н), 6,21 (s, 1Н), 7,12-7,21 1Н). (m, 1Н), 7,31-7,41 (m, 2Н), 11,24 (s, 1H). Інтермедіати для цієї сполуки отримували наПриклад 24 ступним чином: N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2і) 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]гідрокси-1-метилетокси]-4-піримідиніл]-14-піримідиніл]окси]-(2S)-пропіонової кислоти етиазетидинсульфонамід ловий естер Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія ііі), застосовуючи 4,6-дихлоро-2-[(2, 3дифлуоробензил)тіо]піримідин (продукт прикладу 1, стадія іі) (0,77 г), ТГФ (15 мл), 2-гідрокси-(2S)пропіонової кислоти етиловий естер (0,40 мл) та 60% натрій гідрид (0,14 г), що дає придатну сполуку як чисте безбарвне масло. Вихід: 1 г. МС: XIAT(+ve) 389/391 [М+Н+] 1 НЯМР: (ДМСО) 1,13 (t, 3H), 1,51 (d, 3H), До суспензії 2-[[6-[(13,99-4,17 (m, 2Н), 4,37-4,50 (m, 2H), 5,28-5,38 (m, азетидинілсульфоніл)амін]-2-[[(2,31Н), 7,02 (s, 1H), 7,13-7,23 (m, 1H), 7,28-7,42 (m, дифлуорофеніл)метил]тіо]-4-піримідиніл]окси]2H). (2R)-пропіонової кислоти етилового естеру, (проіі) 2-[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3дукт прикладу 23) (0,40 г) в ТГФ (10 мл) краплями дифлуорофеніл)метил]тіо]-4-піримідиніл]окси]додавали 2М літій боргідрид в ТГФ (0,82 мл) та (2S)-пропіонової кислоти етиловий естер суміш перемішували при навколишній температурі Придатну сполуку отримували згідно з проце20 годин. Реакційну суміш охолоджували до 0°С та дурою, описаною в прикладі 1, стадія (iv), застосогасили 1М водною хлоридною кислотою. Отримавуючи суміш азетидин-1-сульфонаміду (отримано ну суміш екстрагували EtOAc (х2). Комбіновані згідно з патентом WO 2004/011443, 0,13 г), органічні шари промивали 1М водн. хлоридною трис(дибензиліденацетон)дипаладію(0) (58 мг), 2кислотою, тоді - розсолом та сушили (MgSO4), фідициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'льтрували та випаровували. Залишок очищали біфенілу (XPHOS) (42 мг), цезій карбонату (0,31 г), хроматографією на колонці з силікагелем, засто2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-4совуючи EtOAc/ізогексан (1:1) як елюент. Отримапіримідиніл]окси]-(2S)-пропіонової кислоти етилоне масло порошкували ДХМ, що дає сполуку загового естеру (продукт стадії і) (0,25 г) та діоксану ловку як білу тверду речовину. Вихід: 0,25 г. (10 мл). Очищали хроматографією на колонці з МС: XIAT(-ve) 445 [М-Н ] 1 силікагелем, застосовуючи EtOAc/ізогексан (3:7) як Н ЯМР (CD3OD) 1,15 (d, 3H), 2,11 (квінтет, елюент, що дає придатну сполуку як чисте безба2Н), 3,54 (d, 2H), 3,88 (t, 4H), 4,36 (dd, 2Н), 5,16 (dt, рвне масло. Вихід: 0,28 г. 1Н), 6,12 (s, 1Н), 6,93-7,12 (m, 2Н), 7,22-7,31 (m, МС: XIAT(+ve) 489 [М+Н+] 1Н). Приклад 26 Приклад 25 2-[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1S)-2дифлуорофеніл)метил]тіо]-4-піримідиніл]окси]гідрокси-1-метилетокси]-4-піримідиніл]-1(2R)-пропанамід азетидинсульфонамід 57 92463 58 До розчину 2-[[6-хлор-2-[[(2,316 годин. Реакційну суміш підкислювали, застосодифлуорофеніл)метил]тіо]-4-піримідиніл]окси]вуючи 2М водн. НСІ, тоді екстрагували EtOAc (х2). (2R)-пропіонової кислоти етилового естеру (проКомбіновані органічні складові промивали розсодукт прикладу 23) (103 мг) в метанолі (8 мл) газ лом тоді сушили (MgSO4), фільтрували та випароаміак барботували при 0°С. Отриману суміш певували. Отримане масло порошкували ДХМ/ізоремішували в герметизованій посудині при навкогексаном, що дає сполуку заголовку як білу тверду лишній температурі 48 годин. Розчинник випароречовину. Вихід: 0,20 г. вували під зниженим тиском та отриману тверду МС: XIAT(-ve) 459 [М-Н ] 1 речовину порошкували етером, що дає сполуку Н ЯМР: (ДМСО) 1,49 (d, 3H), 2,13 (квінтет, заголовку як білу тверду речовину. Вихід: 88 мг. 2Н), 3,91 (t, 4H), 4,43 (dd, 2H), 5,23 (q, 1Н), 6,19 (s, МС: XIAT(+ve) 460 [М+Н+] 1Н), 7,12-7,21 (m, 1Н), 7,30-7,42 (m, 2Н). 1 Н ЯМР: (ДМСО) 1,43 (d, 3H), 2,13 (квінтет, Приклад 29 2Н), 3,91 (t, 4H), 4,45 (dd, 2H), 5,21 (q, 1Н), 6,23 (s, N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-21Н), 7,13-7,20 (m,2Н), 7,31-7,43 (m, 2Н), 7,59 (s, гідрокси-1-метилетокси]-4-піримідиніл]1H), 11,17 (s, 1H). метансульфонамід Приклад 27 2-[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідиніл]окси]-Nметил-(2R)-пропанамід До розчину 2-[[6-хлор-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідиніл]окси](2R)-пропіонової кислоти етилового естеру (продукт прикладу 23) (100 мг) в етанолі (1,5 мл) додавали 8М метиламін в етанолі. Отриману суміш перемішували в герметизованій посудині при навколишній температурі 16 годин. Розчинник випаровували під зниженим тиском. Очищали реверсно-фазовою ВЕРХ (відповідно як стаціонарна фаза та TFA/ацетонітрил як мобільна фаза), що дає сполуку заголовку як білу тверду речовину. Вихід: 60 мг. МС: XlAT(+ve) 474 [М+Н+] 1 Н ЯМР: (ДМСО) 1,41 (d, 3H), 2,14 (квінтет, 2Н), 2,57 (d, 3H), 3,92 (t, 4H), 4,43 (dd, 2H), 5,26 (q, 1H), 6,23 (s, 1H), 7,12-7,21 (m, 1H), 7,30-7,41 (m, 2H), 8,00-8,07 (m, 1Н), 11,18 (s, 1H). Приклад 28 2-[[6-[(1-азетидинілсульфоніл)амін]-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідиніл]окси](2R)-пропіонова кислота До розчину 2-[[6-хлор-2-[[(2,3дифлуорофеніл)метил]тіо]-4-піримідиніл]окси](2R)-пропіонової кислоти етилового естеру (продукт прикладу 23) (0,24 г) в метанолі (1 мл) додавали 1М водн. натрій гідроксид (1 мл). Отриману суміш перемішували при навколишній температурі Сполуку заголовку отримували згідно з процедурою, описаною в прикладі 24, застосовуючи суміш 2-[[2-[[(2,3-дифлуорофеніл)метил]тіо]-6[(метилсульфоніл)амін]-4-піримідиніл]окси]-(2R)пропіонової кислоти етилового естеру, (продукт стадії і) (0,28 г), ТГФ (8 мл) та 2М літій боргідриду в ТГФ (1,3 мл). Очищали реверсно-фазовою ВЕРХ (відповідно як стаціонарна фаза та TFA/ацетонітрил як мобільна фаза). Отримане масло порошкували толуолом, ДХМ, тоді - етером/ізо-гексаном, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,18 г. МС: XIAT(-ve) 440 [М-Н ] 1 Н ЯМР: (ДМСО) 1,17 (d, 3H), 3,29 (s, 3H), 3,47-3,50 (m, 3H), 4,47 (dd, 2H), 5,09-5,18(m, 1Н), 5,99 (s, 1Н), 7,13-7,21 (m, 1Н), 7,29-7,43 (m, 2Н), 11,14 (s, 1H). Інтермедіат для цієї сполуки отримували наступним чином: і) 2-[[2-[[(2,3-дифлуорофеніл)метил]тіо]-6[(метилсульфоніл)амін]-4-піримідиніл]окси]-(2R)пропіонової кислоти етиловий естер Придатну сполуку отримували згідно з процедурою, описаною в прикладі 1, стадія iv), застосовуючи суміш метансульфонаміду (93 мг), трис(дибензиліденацетон)дипаладію(0) (71 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (52 мг), цезій карбонату (0,38 г), 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-4піримідиніл]окси]-(2R)-пропіонової кислоти етилового естеру (продукт прикладу 23, стадія і) (0,30 г) та діоксану (10 мл). Очищали хроматографією на колонці на оксиді силіцію, застосовуючи EtOAc/ізогексан (1:1) як елюент, що дає придатну сполуку як масло. Вихід: 0,28 г. МС: XIAT(+ve) 448 [M+H+] Приклад 30 N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2гідрокси-1-метилетокси]-4-піримідиніл]-4морфолінсульфонамід 59 92463 60 ВЕРХ (відповідно як стаціонарна фаза та TFA/ацетонітрил як мобільна фаза). Отримане масло порошкували метанолом, толуолом, ДХМ, тоді - етером/ізо-гексаном, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,15 г. МС: XIAT(-ve) 459 [М-Н ] 1 Н ЯМР: (ДМСО) 1,16 (d, 3H), 1,75-1,82 (m, 4H), 3,27-3,38 (m, 4H), 3,44-3,51 (m, 2H), 4,45 (dd, 2H), 5,10-5,18 (m, 1H), 5,97 (s, 1H), 7,13-7,20 (m, Сполуку заголовку отримували згідно з проце1H), 7,29-7,42 (m, 2Н), 10,91 (s, 1H). дурою, описаною в прикладі 24, застосовуючи суІнтермедіат для цієї сполуки отримували наміш 2-[[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(4ступним чином: морфолінілсульфоніл)амін]-4-піримідиніл]окси]і) 2-[[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6-[(1(2R)-пропіонової кислоти етилового естеру, (пропіролідинілсульфоніл)амін]-4-піримідиніл]окси]дукт стадії і) (0,34 г), ТГФ (8 мл) та 2М літій боргід(2R)-пропіонової кислоти етиловий естер риду в ТГФ (1 мл). Очищали реверсно-фазовою Придатну сполуку отримували згідно з процеВЕРХ (відповідно як стаціонарну фазу та амоній дурою, описаною в прикладі 1, стадія iv), застосоацетат/ацетонітрил як мобільну фазу), що дає вуючи суміш 1-піролідинсульфонаміду (отримано сполуку заголовку як білу тверду речовину. Вихід: згідно з патентом WO 2004/011443, 0,19 г), 0,25 г. трис(дибензиліденацетон)дипаладію(0) (71 мг), 2МС: XIAT(-ve) 475 [М-Н ] дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'1 біфенілу (XPHOS) (52 мг), цезій карбонату (0,38 г), Н ЯМР: (ДМСО) 1,16 (d, 3H), 3,11 (s, 4H), 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-43,42-3,53 (m, 2H), 3,59 (t, 4H), 4,43 (dd, 2Н), 4,84 (t, піримідиніл]окси]-(2R)-пропіонової кислоти етило1Н), 5,10 (q, 1Н), 5,98 (s, 1Н), 7,12-7,19 (m, 1Н), вого естеру (продукт прикладу 23, стадія і) (0,30 г) 7,29-7,37 (m, 1Н), 7,39-7,45(m, 1Н). та діоксану (10 мл). Очищали хроматографією на Інтермедіат для цієї сполуки отримували наколонці з силікагелем, застосовуючи ступним чином: EtOAc/ізогексан (1:1) як елюент, що дає придатну і) 2-[[2-[[(2,3-Дифлуорофеніл)метил]тіо]-6-[(4сполуку як масло. Вихід: 0,38 г. морфолінілсульфоніл)амін]-4-піримідиніл]окси]МС: XIAT(+ve) 475 [М+Н+] (2R)-пропіонової кислоти етиловий естер Приклад 32 Придатну сполуку отримували згідно з процеN-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2дурою, описаною в прикладі 1, стадія iv), застосогідрокси-1-метилетокси]-4-піримідиніл]вуючи суміш 4-морфолінсульфонаміду (отримано циклопропансульфонамід згідно з патентом WO 2004/011443, 0,19 г), трис(дибензиліденацетон)дипаладію(0) (71 мг), 2дициклогексилфосфіно-2',4',6'-три-ізопропіл-1,1'біфенілу (XPHOS) (52 мг), цезій карбонату (0,38 г), 2-[[6-хлор-2-[[(2,3-дифлуорофеніл)метил]тіо]-4піримідиніл]окси]-(2R)-пропіонової кислоти етилового естеру (продукт прикладу 23, стадія і) (0,30 г) та діоксан (10 мл). Очищали хроматографією на колонці з силікагелем, застосовуючи EtOAc/ізогексан (1:1) як елюент, що дає придатну сполуку як масло. Вихід: 0,34 г. Сполуку заголовку отримували згідно з процеMC: XIAT(+ve) 519 [M+H+] дурою, описаною в прикладі 24, застосовуючи 2Приклад 31 [[6-[(циклопропілсульфоніл)амін]-2-[[(2,3N-[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1R)-2дифлуорофеніл)метил]тіо]-4-піримідиніл]окси]гідрокси-1-метилетокси]-4-піримідиніл]-1(2R)-пропіонової кислоти етиловий естер, (продукт піролідинсульфонамід стадії і) (0,30 г), ТГФ (8 мл) та 2М літій боргідрид в ТГФ (2 мл). Очищали реверсно-фазовою ВЕРХ (відповідно як стаціонарну фазу та TFA/ацетонітрил як мобільну фазу). Отримане масло порошкували метанолом, толуолом, ДХМ, тоді - етером/ізо-гексаном, що дає сполуку заголовку як білу тверду речовину. Вихід: 0,20 г. МС: XIAT(-ve) 430 [М-Н ] 1 Н ЯМР: (ДМСО) 1,00-1,10 (m, 4Н), 1,17 (d, 3H), 2,93-3,04 (m, 1Н), 3,47-3,50 (m, 2Н), 4,47 (s, Сполуку заголовку отримували згідно з проце2Н), 5,08-5,20 (m, 1Н), 6,06 (s, 1Н), 7,11-7,21 (m, дурою, описаною в прикладі 24, застосовуючи су1Н), 7,28-7,45 (m, 2Н), 11,10 (s, 1H). міш 2-[[2-[[(2,3-дифлуорофеніл)метил]тіо]-6-[(1Інтермедіат для цієї сполуки отримували напіролідинілсульфоніл)амін]-4-піримідиніл]окси]ступним чином: (2R)-пропіонової кислоти етилового естеру, (проі) 2-[[6-[(Циклопропілсульфоніл)амін]-2-[[(2,3дукт стадії і) (0,38 г), ТГФ (8 мл) та 2М літій боргіддифлуорофеніл)метил]тіо]-4-піримідиніл]окси]риду в ТГФ (1,3 мл). Очищали реверсно-фазовою (2R)-пропіонової кислоти етиловий естер
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrimidine sulphonamide derivatives as chemokine receptor modulators
Автори англійськоюCheshire David R., Cox Rhona J., Meghani Premji, Preston Cherylin F., Smith Neal M., Stonehouse Jeffrey P.
Назва патенту російськоюПроизводные пиримидинсульфонамида как модуляторы рецепторов хемокина
Автори російськоюЧешир Дейвид Рейналф, Кокс Роуна Джейн, Мегани Премджи, Престон Черилин Френсис, Смит Нил Майкл, Стоунгаус Джеффри Пол
МПК / Мітки
МПК: C07D 401/12, A61K 31/5377, C07D 417/12, C07D 403/12
Мітки: піримідинсульфонаміду, хемокіну, похідні, модулятори, рецепторів
Код посилання
<a href="https://ua.patents.su/77-92463-pokhidni-pirimidinsulfonamidu-yak-modulyatori-receptoriv-khemokinu.html" target="_blank" rel="follow" title="База патентів України">Похідні піримідинсульфонаміду як модулятори рецепторів хемокіну</a>
Наступний патент: Противірусні сполуки
Випадковий патент: Ущільнювач флотошламу












