Амперометричний біосенсор для визначення глутамату
Номер патенту: 101165
Опубліковано: 25.08.2015
Автори: Борисов Арсеній Андрійович, Кучеренко Іван Сергійович, Дзядевич Сергій Вікторович, Крисанова Наталія Валеріївна, Буржу Аката Курч, Кучеренко Дар'я Юріївна, Солдаткін Олексій Петрович, Солдаткін Олександр Олексійович, Берна Озансой Касап, Борисова Тетяна Олександрівна, Салих Канн Кірдесілер
Формула / Реферат
Амперометричний біосенсор для визначення глутамату, який складається з платинового дискового електроду та нанесених на електрод двох мембран цеолітної та ферментної на основі глутаматоксидази, робоча область біосенсора знаходиться у робочій комірці для досліджуваного розчину, в яку встановлені також допоміжний електрод та електрод порівняння, а виходи електродів і біосенсора під'єднані до потенціостату, виходи якого підключені до відповідних входів комп'ютера.
Текст
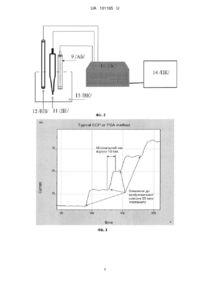
Реферат: Амперометричний біосенсор для визначення глутамату складається з платинового дискового електроду та нанесених на електрод двох мембран цеолітної та ферментної на основі глутаматоксидази. Робоча область біосенсора знаходиться у робочій комірці для досліджуваного розчину, в яку встановлені також допоміжний електрод та електрод порівняння. Виходи електродів і біосенсора під'єднані до потенціостату, виходи якого підключені до відповідних входів комп'ютера. UA 101165 U (12) UA 101165 U UA 101165 U 5 10 15 20 25 30 35 40 45 50 55 60 Пропонована корисна модель належить до галузі біотехнології та молекулярної біології і може бути використана, зокрема, для визначення концентрації глутамату в біотехнологічних зразках та наукових препаратах, а більш конкретно, до амперометричного біосенсору для визначення глутамату. Глутамат (глутамінова кислота) відіграє важливу роль в життєдіяльності організму людини і інших ссавців, особливо у функціонуванні центральної нервової системи. Зокрема, глутамат є основним збуджуючим нейротрансмітером в ЦНС ссавців. Також він відіграє важливу роль в азотистому обміні. Концентрація глутамату в окремих частинах організму може впливати на розвиток інфарктів, інсультів та різні нейропатологічні стани [1, 2]. Глутамат входить до складу багатьох фармацевтичних препаратів завдяки тому, що він має здатність сенсибілізувати смакові рецептори і стимулювати діяльність мозку. Також в невеликих кількостях він міститься в багатьох продуктах харчування [3, 4]. Присутність в їжі глутамату надає їй "м'ясного" смаку, тому глутамат часто застосовують в якості підсилювача смаку, додаючи його до багатьох харчових продуктів. Тому повністю виключити глутамат з раціону харчування досить проблематично. У чутливих до глутамату людей може розвиватися так званий "синдром китайського ресторану" [5, 6]. Глутамат погано впливає на сітківку ока і може сприяти погіршенню зору. Визначення глутамату займає важливе місце в клінічній біохімії при діагностиці захворювань, що пов'язані з різкими змінами рівня глутамату в організмі, зокрема хвороб печінки та серцево-судинної системи [5, 7]. Також в клінічних лабораторіях глутамат використовують під час визначення активності деяких амінотрансфераз. Таким чином, область практичного застосування глутамату неперервно збільшується. Через це виникає потреба в методах точної та швидкої детекції глутамату для потреб нейрофізіології і нейропатології, фундаментальної та клінічної медицини, фармацевтичної та харчової промисловості, а також в аналітичній біохімії та біотехнології [1, 5, 7]. Сучасні стандартні методи високоточного визначення глутамату, такі як спектрофотометрія та рідинна хроматографія, потребують наявності кваліфікованого персоналу та складного і дорогого обладнання [1, 5, 8, 9]. Крім цих методів, також може використовуватись хемолюмінесцентне визначення за участю люмінолу і фериціаніду калію і застосуванням люмінофотометра [10]. Споживання кисню при окисленні глутамату може бути зафіксоване кисневим волоконно-оптичним датчиком, який фіксує зміни люмінесценції спеціально нанесеного шару, який чутливий до концентрації кисню [3]. Для визначення кількості глутамату в м'ясі та м'ясних продуктах використовується метод за участю двох ферментативних реакцій, в результаті яких окислюється глутамат і утворюється кольорова сполука (формазан), концентрація якої вимірюється на спектрофотометрі [11]. Недоліком наведених вище методів є необхідність в досить складній попередній підготовці проб для аналізу і непридатність для швидкого аналізу великої кількості зразків, чи для моніторингу процесу в режимі реального часу. Способом вирішення указаних вище проблем є використання нових біоаналітичних приладів - біосенсорів [12]. На даний час розроблено біосенсори та біосенсорні системи для визначення глутамату в багатьох реальних зразках: в продуктах харчування і фармацевтичних препаратах [1, 7], в культурах клітин [13, 14], в сиворотці крові та сечі [1, 5], в мікродіалізатах при нейрофізіологічних дослідженнях [2, 15] та для контролю за ферментацією в харчовій промисловості [16, 17]. Відомий амперометричний біосенсор для визначення концентрації глутамату у водних розчинах, який має один амперометричний мікроелектрод на основі платинового волокна (довжина 200 мкм, діаметр 25 мкм), на який нанесена робоча мембрана на основі глутаматоксидази коіммобілізованої з бичачим сиворотковим альбуміном на поверхні перетворювача зшиваючим токсичним реагентом (глутаровим альдегідом) [18]. Однак, описаний пристрій менш швидкий та чутливий для аналізу зразків, що містять глутамат (швидкість одного сигналу 25-40 сек., границя визначення субстрату - 5 мкМ) та характеризується меншою безпечністю виготовлення за рахунок використання в процесі іммобілізації глутарового альдегіду. В основу запропонованої корисної моделі поставлено задачу створення такого амперометричного біосенсора для визначення глутамату, який би дозволив більш швидко та точно визначати концентрацію глутамату та був би більш перспективним та дешевим для подальшого масового виробництва. Поставлена задача вирішується запропонованим амперометричним біосенсором для визначення глутамату, який складається з платинового дискового електроду та нанесених на електрод двох мембран цеолітної та ферментної на основі глутаматоксидази, робоча область 1 UA 101165 U 5 біосенсора знаходиться у робочій комірці для досліджуваного розчину, в яку встановлені також допоміжний електрод та електрод порівняння, а виходи електродів і біосенсора під'єднані до потенціостату, виходи якого підключені до відповідних входів комп'ютера. Поставлена задача вирішується за рахунок безпечної, простої та швидкої процедури іммобілізації, а саме адсорбції глутаматоксидази на силікаліті. В основі роботи амперометричного біосенсора для визначення глутамату лежить ферментативна реакція, що протікає в ферментативній мембрані, а також реакція розкладу перекису водню, яка безпосередньо і реєструється амперометричним перетворювачем: ГлОД Глутамат + О2 + 600 мВ кетоглютарат + NH3 + H2O (1), 10 H2О2 15 20 25 30 35 40 45 50 55 2H+ + O2 + 2e (2) Перетворення глутамату супроводжується накопиченням електрохімічно-активного перекису водню, що дає можливість визначати субстрат за допомогою амперометричного біосенсора на основі глутаматоксидази. Суть корисної моделі пояснюється графічними матеріалами, де: на Фіг. 1 показано схематичний вигляд амперометричного біосенсора для визначення глутамату; на Фіг. 2 показано блок-схему портативної амперометричної біосенсорної системи для визначення глутамату; на Фіг. 3 показано відгуки біосенсора на різні концентрацій глутамату; на Фіг. 4 наведено графік залежності величини відгуку амперометричного біосенсора на основі глутаматоксидази від концентрації глутамату (калібрувальна крива). Пропонований амперометричний біосенсор для визначення глутамату (Фіг. 1) складається з робочої області 1 /РО/, платинового дроту 2 /ПД/ електричного з'єднаного за допомогою легкоплавкого сплаву Вуда 3 /ЕЗ/ з внутрішнім провідником 4 /ВП/, епоксидної смоли 5 /ЕС/ для запобігання потрапляння вологи в середину конструкції та контактної площадки 6 /КП/, при цьому на робочу область 1 /РО/ нанесено спочатку цеолітну мембрану на основі силікаліту 7 /ШС/ а зверху адсорбована ферментна мембрана на основі глутаматоксидази 8 /ГО/. Амперометричний біосенсор 9 /АБ/ на основі глутаматоксидази входить до складу портативної амперометричної біосенсорної системи для визначення концентрації глутамату у розчині (Фіг. 2), що складається з потенціостату "Palm Sens" 10 /ПС/ [19], до якого підключені два біосенсора 9 /АБ/, допоміжний електрод 11 /ДЕ/ та електрод порівняння 12 /ЕП/, що при роботі знаходяться у вимірювальній комірці з аналізованим розчином 13 /ВК/, а сам потенціостат "Palm Sens" 10 /ПС/ приєднаний до реєструючуго пристрою (комп'ютер) 14 /ПК/. Пропонований амперометричний біосенсор для визначення глутамату працює так. Попередньо виготовляли біоселективні мембрани. Для створення гелю для ферментної мембрани готували розчин з вмістом 8 % глутаматоксидази, 4 % сироваткового альбуміну бика (БСА), 10 % гліцерину у 100 мМ фосфатному буфері, рН 6,5. До складу гелів додавався гліцерин для стабілізації ферменту при іммобілізації та запобігання передчасному підсиханню розчину, нанесеного на поверхню перетворювача. В свою чергу, сироватковий альбумін бика в складі ферментних мембран відігравав роль стабілізуючого агенту для ферментів. Потім готувався 5 % розчин силікаліту у 5 мМ фосфатному буфері рН 6,5. Далі починався процес іммобілізації біологічного матеріалу на поверхню перетворювача. З цією метою, отриманий розчин силікаліту поміщали в ультразвукову баню на дві години для гомогенізації розчину. Далі, на робочі поверхні рН-чутливих польових транзисторів, наносили 0,2 мкл гомогенного розчину силікаліту. Для фіксації силікаліту на поверхні перетворювачів, їх розміщували у сухо-жаровій шафі на 15-20 хвилин за температури 140-170 С°. Далі приготовлені заздалегідь гелі наносили на поверхню перетворювачавкритого силікалітом (по 0,1 мкл) і залишали на відкритому повітрі на 20-25 хвилин до повного висихання. Таким чином, робоча мембрана біосенсора, нанесена на робочу область першого амперометричного перетворювача складалась з 100 мМ фосфатного буфера, рН 6,5, та з наступних інгредієнтів у такому їх співвідношенні (у мас %): 1-6 силікаліт, 1-7 глутаматоксидаза, 1-7 БСА, 4-11 гліцерин. 2 UA 101165 U 5 10 15 20 25 30 35 40 45 50 55 60 Співвідношення компонентів біоселективних мембран біосенсорної системи було отримано експериментально. Його підібрали для покращення аналітичних характеристик біосенсорів, таких як селективність, чутливість, операційна стабільність та ін. Після іммобілізації перед початком роботи, для видалення надлишку незв'язаних силікаліту, ферменту та інших компонентів мембран, біосенсори відмивали протягом 20 хвилин у буфері, в якому і проводили подальші досліди. Амперометричний біосенсор для визначення глутамату 9 /АБ/, а також допоміжний електрод 11 /ДЕ/ та електрод порівняння 12 /ЕП/ підключали до потенціостату "Palm Sens" та поміщали до вимірювальної комірки 13 /ВК/ об'ємом 2,0 мл, заповненої 20 мМ фосфатним буфером, рН 6,5, та витримували декілька хвилин для отримання стабільної базової лінії. Потім додавали певну аліквоту модельного розчину глутамату та отримували сигнал з робочого електроду. Сигнал від біосенсора автоматично оброблявся комп'ютером і виводився у графічному вигляді. Графічне зображення відгуків амперометричної біосенсорної системи на додавання у вимірювальну комірку різних концентрацій глутамату наведено на Фіг. 3. Шляхом додавання різної кількості певних аліквот модельних розчинів глутамату було побудовано калібрувальну криву для визначення концентрації глутамату (Фіг. 4). Після отримання кожного відгуку біосенсор відмивали від продукту, змінюючи робочий буфер мінімум 3 рази кожні 15-30 с до виходу сигналу на базову лінію. Приклад аналізу вмісту глутамату в розчині. Спочатку отримували залежності величин відгуків біосенсора від різних концентрацій глутамаму - одержували калібрувальний графік визначення глутамату (Фіг. 4). Для визначення умовно невідомої концентрації глутамату в досліджуваному розчині, додавали аліквоту досліджуваного розчину та отримували відгук біосенсора. Відгук біосенсора на основі глутаматоксидази збільшувався пропорційно вмісту глутамату, і за калібрувальною кривою визначали концентрацію глутамату, яка співпадала з умовно невідомою концентрацією глутамату у розчині. Порівняно з відомим біосенсором [18], використання в роботі запропонованого амперометричного біосенсора для визначення глутамату, дозволило більш швидко та більш точно визначати глутамат; розробка даного типу біосенсора є більш перспективним та дешевим для подальшого масового виробництва за рахунок безпечної, простої та швидкої процедури іммобілізації, а саме адсорбції глутаматоксидази на силікаліті. Наприклад, у випадку вимірювання глутамату амперометричним біосенсором мінімальна швидкість одного сигналу біосенсора складала 10 сек., що в 2.5 рази швидше відомого аналога [18]. Границя визначення глутамату була - 2.5 мкМ, шо 2 рази менше ніж у відомого біосенсора [18]. Крім того, процедура виготовлення запропонованого амперометричного біосенсора для визначення глутамату більш безпечна порівняно з аналогом. Джерела інформації: 1. Villarta R.L., Cunnigham D.D., Guilbault G.G. Amperometric enzyme electrodes for the determination of L-glutamate. Talanta 1991; 38: 1: 49-55. 2. Berners M.O.M., Boutelle M.G., Fillenz M. Online measurement of brain glutamate with an enzyme/polymer-coated tubular electrode. Anal Chem 1994; 66: 13: 2017-2021. 3. Dremel В.A.A., Schmid R.D. Comparison of two fibre-optic L-glutamate biosensors based on the detection of oxygen or carbon dioxide and their application in combination with flow-injection analysis to the determination of glutamate. Anal Chim Acta 1991; 248: 351-359. 4. Vahien W., Bradley J., Bilitewski U., Schmid R.D. Mediated enzyme electrode for the determination of L-glutamate. Anal Lett 1991; 24: 8: 1445-1452. 5. Ghobadi S., Csoregi E., Marko-Varga G., Gorton L. Bienzyme carbon paste electrodes for Lglutamate determination. Curr Sepr 1996; 14: 3/4: 94-102. 6. Suleiman A.A., Villarte R.L., Guilbault G.G. Analytical applications of glutamate oxidase based amperometric electrodes. Bull Electro-chem 1992; 8: 4: 189-192. 7. Almeida N.F., Mulchandani A.K. A mediated amperometric enzyme electrode using tetrathiafulvalene and L-glutamate oxidase for the determination of L-glutamic acid. Anal Chim Acta 1993; 282: 2: 353-361. 8. Herbreteau В., Lafosse M, Morin-Allory L., Dreux M. Automatic sugar analysis in the beet industry. Part I// High Res. Chromatogr. - 1990. - Vol. 13. - P. 239-243. 9. Vercelotti S.V., Clarke M.A. Comparison of modern and traditional methods of sugar analysis// Int Int. Sugar J. - 1994. - Vol.96. - P. 437-445. 10. Murachi Т., Tabata M. Use of a bioreactor consisting of a sequentially aligned L-glutamate dehydrogenase and L-glutamate oxidase for the determination of ammonia by chemiluminescence. Biotechnol Appl Biochem.1987; 9: 4: 303-309. 3 UA 101165 U 5 10 15 11. ГОСТ Р 51198-98 (ИСО 4134-78) Мясо и мясные продукты. Метод определения L-(+)глутаминовой кислоты. 12. Дзядевич С.В., Солдаткін О.П., Наукові та технологічні засади створення мініатюрних електрохімічних біосенсорів// Київ: Наукова думка. - 2006. – 255 с. 13. White S.F., Turner A.P.F., Bilitewski U. et al. Lactate, glutamate and glutamine biosensors based on rhodinized carbon electrodes. Anal Chim Acta 1994; 295: 243-251. 14. Wollenberger U., Scheller F.W., Hintsche R., Bohm K. Verfahren zur amperometrischen bestimmung von L-glutamat. Pat DD 272 478 Al; 1989. 15. Zilkha E., Koshy A., Obrenovitch T.P., Bennetto H.P., Symon L. Am-perometric biosensors for online monitoring of extracellular glucose and glutamate in the brain. Anal Lett 1994; 27: 3: 453-473. 16. Li Q"., Zhang S., Yu J. Immobilization of L-glutamate oxidase and peroxidase for glutamate determination in flow injection analysis system. Appl Biochem Biotechnol 1996; 59:1: 53-61. 17. Chen R.L.C., Matsumoto K. Sequential enzymatic monitoring of glucose, ethanol and glutamate in bioreactor fermentation broth containing a high salt concentration by a multichannel flowinjection analysis method. Anal Chim Acta 1995; 309: 145-151. 18. Солдаткін О.О. Оптимізація одночасної роботи трьох мікробіосенсорів для мультианалізу глюкози, лактату та глутамату Sеnsоr Electronics and Microsystem Technologies 2012 - Т. 3(9), № 3 - С. 53-61. 19. http://www.palmsens.com/en/instruments/palmsens/ 20 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 25 Амперометричний біосенсор для визначення глутамату, який складається з платинового дискового електроду та нанесених на електрод двох мембран цеолітної та ферментної на основі глутаматоксидази, робоча область біосенсора знаходиться у робочій комірці для досліджуваного розчину, в яку встановлені також допоміжний електрод та електрод порівняння, а виходи електродів і біосенсора під'єднані до потенціостату, виходи якого підключені до відповідних входів комп'ютера. 4 UA 101165 U 5 UA 101165 U Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори російськоюBerna Ozansoy Kasap, Salih Kaan Kirdeciler, Burcu Akata Kurc
МПК / Мітки
МПК: G01N 27/00, G01N 33/00
Мітки: амперометричний, визначення, глутамату, біосенсор
Код посилання
<a href="https://ua.patents.su/8-101165-amperometrichnijj-biosensor-dlya-viznachennya-glutamatu.html" target="_blank" rel="follow" title="База патентів України">Амперометричний біосенсор для визначення глутамату</a>
Попередній патент: Спосіб іммобілізації на поверхні золота рекомбінантних білків, що містять в своєму складі полігістидинову мітку
Наступний патент: Спосіб комплексної переробки сировини нафтогазоконденсатних родовищ
Випадковий патент: Вогнегасник порошковий