Спосіб синхронізації клітин в g1-фазі клітинного циклу
Номер патенту: 24026
Опубліковано: 31.08.1998
Автори: Дзюблик Ірина Володимирівна, Кейсевич Людвіг Владіславович, Трохименко Олена Петрівна
Формула / Реферат
1. Способ синхронизации клеток в G1-фазе клеточного цикла, включающий выращивание клеток, добавление к выращенным клеткам синхронизирующего агента и дальнейшую инкубацию, отличающийся тем, что в качестве синхронизирующего агента используют цис-дихлордиаминплатину (II)формулы PtCl2(NH3)2 или производные платины (II)с полианионом дезоксирибонуклеиновой кислоты (ДНК) общей формулы
2. Способ по п. 1, отличающийся тем, что цис-дихлораминплатину (IΙ) используют в концентрации (5,3-530)· 10-8 г/дм3, соединение платины (II) с полианионом ДНК- в концентрации (9-900) · 10-4 г/дм3.
3. Способ по п. 1 или 2, отличающийся тем, что инкубацию клеток в присутствии соединений платины проводят в течение 6-8 часов.
Текст
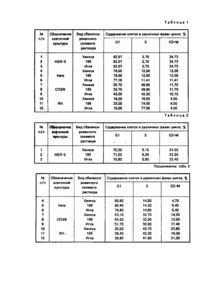
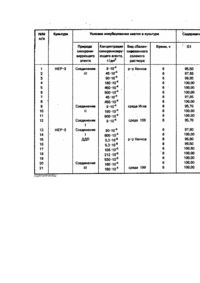
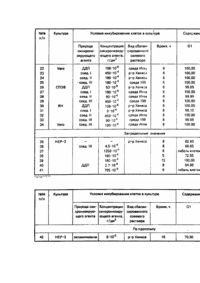
Изобретение относится к области биотехнологии, в частности к способам получения клеток в определенной фазе клеточного цикла, и может быть использовано для получения клеток, синхронизированных в просинтетической фазе клеточного цикла. Наибольший интерес для биотехнологии представляют клетки в просинтетической фазе (GI-фазе) клеточного цикла, в которых обеспечивается эффективный биосинтез вирусных препаратов, антигенов, ферментов, алкалоидов, инсектицидов и други х биологически активных ве ществ. Известен способ получения клеток в GI-фазе цикла, состоящий в выращивании клеток в суспензии или монослойной культуре с последующим разделением клеток на фракции и отделением той фракции клеток, которая содержит клетки в G1— фазе [1]. Культивирование клеток осуществляется в стерильных условия х в монослойной или суспензионной культуре в ростовой питательной среде в течение 24 часов (обеспечивается полный клеточный цикл). Затем ростовую среду удаляют и выращенные клетки суспендируют в сбалансированном солевом растворе. Полученную суспензию клеток, содержащую клетки в трех фазах клеточного цикла - GI-фазе, S-фазе и G2+М-фазе, направляют на разделение методом ультрацентрифугирования в градиенте плотности сахарозы с последующим отбором фракции клеток в GIфазе и их накоплением. Как следует из технической сущности известного способа, выход клеток в GI-фазе зависит от природы клеток в культуре и ограничен особенностями клеточного цикла. Кроме того, способ [1] трудоемок, имеет ряд промежуточных этапов, требует использования дорогрстоящих аппаратуры и реактивов, что лимитирует его применение в промышленных усло виях. Подтверждением указанных недостатков способа [1] являются данные, полученные нами при реализации известной технологии с использованием культуры клеток НЕР-2, Vero, СПЭВ, RH. Культуру клеток в посевной концентрации 2*105 кл/мл высевают в стерильные матрасы вместимостью 1,5 л в 150 мл ростовой питательной среды, содержащей 10% сыворотки крови крупного рогатого скота, 100 ЕД/мл пенициллина и 100 ЕД/мл стрептомицина. Клетки культивируют 24 часа при температуре 37°С. Затем среду роста заменяют равным объемом раствора Версена для снятия клеток с субстрата. Полученную суспензию клеток центрифугир уют при 3000 об/мин в течение 10 мин для удаления раствора Версена. Осадок, содержащий клетки в G1-фазе, S- и G2+М-фазах клеточного цикла, суспендируют в сбалансированном растворе (растворы Хенкса, 199, Игла), наслаивают на градиент плотности сахарозы и подвергают ультрацентрифугированию при 30 000 об/мин в течение 30 мин при 20°С. Собирают отдельные фракции и осуществляют определение качественного и количественного состава каждой фракции методом проточной цитофлюорометрии после комбинированного окрашивания ядер [Культура животных клеток. Методы. Под ред. Р. Фрешни. - М.: Мир, 1989. - С. 204, 333]. Для этого к 0,8 мл суспензии полученных клеток в концентрации 1 ·106 кл/мл добавляют последовательно 0,1 мл 1%-ного раствора Тритона Х-100; 0,02 мл 0,001% раствора бромистого этидия; 0,04 мл 0,01% раствора оливомицетина и 0,05 мл раствора магния хлорида с молярной концентрацией 0,03 моль/л. Окрашивание проводят на лазерном проточном цитофлюориметре "FACStar" фирмы BECTON DISKINSON USA по программе DNA Cell-Cycle Analysis Software-Ver С 5/87 Sum of Broadened Rectangles Model. Расчет относительного содержания клеток, находящихся в различных фазах цикла, проводят на основании анализа полученных гистограмм и выражают в процентах. Данные представлены в табл. 1, варианты 1-12. Как следует из представленных данных, известный способ [1] обеспечивает высокую эффективность фракционирования клеток. Однако выход клеток в G1-фазе зависит от вида клеточной культуры и ограничен свойствами клеточного цикла, т.е. для накопления значительного количества клеток в G1-фазе необходимо обработать большой массив клеточной культуры. Таким образом известный способ характеризуется недостаточно высокой производительностью процесса получения клеток в G1-фазе, требует для реализации дорогостоящее оборудование - центрифуги, что ограничивает его промышленное использование. Наиболее близким к изобретению по технической сущности и достигаемому результату является способ синхронизации клеток в присутствии синхронизирующего агента - оксимочевины [2]. Способ реализуется следующим образом. - Для получения массива клеточной культуры культивирование клеток осуществляют в стерильных условиях в монослойной или суспензионной культуре в ростовой питательной среде в течение 30 часов при 37°С. Затем среду роста заменяют равным объемом сбалансированного солевого раствора, содержащего оксимочевину в концентрации (0,5-1,0)·103 Μ и инкубируют в течение 16 часов при 37°С. После завершения процесса инкубирования получают конечный продукт - массив клеток, содержащий клетки в GIфазе, S-фазе и G2+М-фазе клеточного цикла. Для определения эффективности известного способа по синхронизации клеток в GI-фазе нами были осуществлены опыты по синхронизации клеток оксимочевиной согласно [2] использовали культуры клеток НЕР-2, Vero, СПЭВ и RH. Культур у клеток в посевной концентрации 2*105 кл/мл высевают в стерильные матрасы вместимостью 1,5 л в 150 мл ростовой питательной среды, содержащей 10% сыворотки крови крупного рогатого скота, 100 ЕД/мл пенициллина и 10 ЕД/мл стрептомицина. Клетки культивируют 20 часов при 37°С. Затем среду роста заменяют равным объемом сбалансированного солевого раствора (растворы Хенкса, Игла, 199), содержащего оксимочевину в концентрации 1 · 10-3 Μ (6 · 10-2 г/дм 3). Клетки инкубируют в термостате в течение 16 часов при 37°С. После завершения процесса инкубирования солевой раствор, содержащий оксимочевину, сливают и заменяют равным объемом раствора Версена, для снятия клеток с субстрата. Полученный конечный продукт представляет собой массив клеток, содержащий клетки в G1-, S-и G2+М-фазах клеточного цикла. Определение содержания клеток в каждой из указанных фаз клеточного цикла осуществляют методом проточной цитофлюорометрии. Данные представлены в табл. 2, варианты 1-12. Из данных табл. 2 следует, что выход клеток в G1-фазе при использовании известного способа [2] зависит от природы клеток, причем за один клеточный цикл не достигается максимально полная синхронизация клеток в G1-фаза ни для одного вида клеточной культуры. Для увеличения выхода клеток, синхронизированных в G1-фазе клеточного цикла, необходимо либо многократная обработка массива клеточной культуры, либо отделение и накопление клеток в G1-фазе при обработке большого массива клеточной культуры, что удорожает и усложняет технологию при ограниченном объеме обрабатываемой культуры клеток. Таким образом, из уровня техники следует, что известные способы синхронизации клеток в G1-фазе клеточного цикла не обеспечивают высокую производительность процесса получения клеток в G1-фазе, что ограничивает их промышленное использование. В основу изобретения поставлена задача усовершенствовать способ синхронизации клеток в G1-фазе клеточного цикла, основанный на обработке массива клеточной культуры синхронизирующим агентом, путем использования нового синхронизирующего агента - комплексных производных платины, что привело бы к достижению высокой производительности технологического процесса получения функционально однородного (гомогенного) пула клеток, синхронизированных в G1-фазе, независимо от способа культивирования клеток и их природы, обеспечению возможности обрабатывать неограниченный объем клеючной культуры, что позволит применять предложенный способ в промышленных условиях. Поставленная задача решается путем разработки способа синхронизации клеток в G1-фазе клеточного цикла, включающего выращивание клеток, добавление к выращенным клеткам синхронизирующего а гента и дальнейшую инкубацию, в котором, "вчасно изобретению, в качестве синхронизирующего агента используют цис-дих лордиаминплатину (II) формулы PtCl2(NH3)2 или производные платины (II) с полианионом дезоксирибонуклеиновой кислоты (ДНК) общей формулы в действующей концентрации. При этом, цис-дихлордиаминплатину (II) используют в концентрации (5,3-530)х10-8 г/дм 3, и соединения платины (II) с полианионом ДНК - в концентрации (9-900) · 10-4 г/дм ; а инкубацию клеток проводят в течение 6-8 часов. Установлено, что при инкубировании выращенной массы клеточной культуры, содержащей клетки в G1-, S- и G2+M- фазах клеточного цикла, в присутствии заявляемых комплексных соединений платины, создаются условия, обеспечивающие блок клеточного цикла на уровне S-фазы и накопления клеток в G 1-фазе; при этом клетки, уже находящиеся в момент блокирования в S- и G2+М-фазах продолжают клеточный цикл до момента их вступления в G1-фазу. Т.о. в процессе инкубирования клеток культуры происходит регуляция клеточного цикла под воздействием соединений платины, в результате которой достигается практически полная синхронизация клеток в G1-фазе, на 95-100%. При этом, независимо от способа культивирования клеток культуры, значительно увеличивается производительность технологического процесса синхронизации клеток в G1-фазе - в, 1,2-2,6 раза для культур СПЭВ, НЕР-2, Vero и RH; неограниченно возрастает объем перерабатываемой клеточной массы, что делает предложенный способ технологичным и экономичным. Известны используемые в данном способе комплексные производные платины: цисдихлордиаминплатина (II)[Rosenberg В. Clinical aspects of platinum anticancer drugs.// Metal Ions Blol. Syst., 1980, p.127-196]; производные платины (II) с полианионом дезоксирибонуклеиновой кислоты [Патент ЕР № 0374267, кл. А 61 К 35/28, 31/555, 1990]. Указанные соединения являются активными компонентами противоопухолевы х лекарственных препаратов. Способ реализуется следующим образом. Предварительно выращивают массив клеточной культуры. Культивирование клеток осуществляют в стерильных условия х в монослойной или суспензионной культуре в ростовой питательной среде в течение 24 часов при температуре 37°С. Затем среду роста заменяют равным объемом сбалансированного солевого раствора, содержащего комплексные соединения платины в заявляемых концентрациях и инкубируют в течение 6-8 часов при 37°С. После окончания инкубирования получают конечный продукт синхронизированную в GI-фазе монослойную клеточную структур у или взвесь клеток, которые используют для соответствующи х целей биотехнологии. Для реализации способа используют следующие клеточные культуры: Vero - клетки почки зеленой мартышки; СПЭВ - клетки эмбриона свиньи; ΗEΡ-2 - клетки карцинома гортани человека; RH - клетки почки эмбриона человека. В качестве стандартного сбалансированного солевого раствора применяют раствор Хенкса, а также среды Игла и 199. В качестве комплексных соединений платины используют: 1. Цис-дихлордиаминплатину (II) формулы 2. Производные платины (II) с полианионом дезоксирибонуклеиновой кислоты (ДНК) общей формулы Соединение I при х=0, у=12, m=6n, r=6, поли{гексакис[хлороаминдиакваплатина(II)]}-m-дезоксирибонуклеат формулы Соединение II при x = 2; у = 10; m = 4n; r = 4; поли{бис[гидроксохлороаминакваплатина (11)]}-m-дезоксирибонуклеат формулы Соединение III при х=0; у=6; m=6n; r=6; поли{гексакис[хлороаминакваплатина (II)]}-m-дезоксирибонуклеат формулы n=2000-2200, m=6n. Соединения ДДП, I, II, III представляют собой мелкокристаллические порошки желтого цвета без запаха, устойчивые на воздухе, способные в течение года храниться без изменения свойств. Контроль качества готового продукта осуществляли методом проточной цитофлюорометрии после комбинированного окрашивания ядер. Примеры реализации способа. Πример 1. Культуру клеток НЕР-2 в посевной концентрации 2 · 105 кл/мл высевают в стерильные матрасы вместимостью 1.5 л в 150 мл ростовой питательной среды, содержащей 10% сыворотки крови крупного рогатого скота, 100 ЕД/мл пенициллина и 100 ЕД/мл стрептомицина. Клетки культивируют 24 часа при температуре 37°С и получают клеточную массу, содержащую 7,5 * 107 клеток Затем среду роста заменяют равным объемом сбалансированного солевого раствора Хенкса, содержащего 180*10-4 г/дм 3 поли{гексакис[хлороаминак-ваплатины (II)]}-m-дезоксирибонуклеата (соединение III). Клетки инкубируют в термостате в течение 6 часов при температуре 37°С. После окончания инкубирования полученная клеточная масса, содержащая 7,5*107 клеток, представляет собой конечный продукт -синхронизированную в G1-фазе монослойную клеточную культур у. Анализ полученного продукта показывает, что 100% клеток находится в GI-фазе цикла, а клетки в S- G2+М-фазах не обнаружены (табл. 3, вариант 4) Пример 2. С целью выяснения влияния сбалансированного солевого раствора на качественный и количественный состав конечного продукта в процессе инкубирования клеток культуры, был осуществлен следующий опыт. Культивирование клеток осуществляют как в примере 1, с получением 7,5·107 клеток культуры. Затем среду роста заменяют равным объемом сбалансированного солевого раствора Хенкса и клетки инкубируют в термостате в течение б часов при температуре 37°С. После окончания инкубирования клеточная масса содержала те же 7,5Ί07 клеток, Анализ полученного продукта показывает, что 62,6% клеток находится в G1-фазе, 2,7% -в S-фазе и 34,7% - в G2+М-фазе клеточного цикла (табл. 3, вариант 35). Сопоставительный анализ составов конечного продукта, представленных в варианте 35, табл.3 и варианте 1,табл. 1, показывает, что содержание клеток в различных фазах цикла при инкубировании клеток культуры НЕР-2 только в сбалансированном солевом растворе не отличается от такового интактной суточной культуре (после культивирования). Пример 3. Культуру клеток НЕР-2 в посевной концентрации 2-105 кл/мл высевают в стерильные матрасы вместимостью 1,5 л в 150 мл ростовой питательной среды, содержащей 10% сыворотки крови крупного рогатого скота 100 ЕД/мл пенициллина и 100 Ед/мл стрептомицина. Клетки культивируют 24 часа при температуре 37°С и получают клеточную массу, содержащую 7,5 107 клеток. Затем среду роста заменяют равным объемом среды Игла, содержащим 53*10-8 г/дм циедихлордиаминплатины (И) РtСІ2(NН3)2(ДДЛ). Клетки инкубируют в термостате в течение 6 часов при температуре 37°С. После окончания инкубирования получают клеточную массу, содержащую 7,5 ·10 клеток, которая представляет собой конечный продукт - синхронизированную в G1-фазе монослойную клеточную культур у. Согласно анализу, конечный продукт содержит 99,5% клеток, находящихся в G1-фазе; 0,5% клеток, находящихся в G2+М-фазе и не обнаружены клетки, находящиеся в S-фазе клеточного цикла (табл. 3, вариант 16). Πример 4. Для синхронизации клеток в G1-фазе в суспензии используют культур у клеток Vero. Готовят суспензию клеток Vero в модифицированной среде Игла: из состава среды исключают ионы кальция и магния, и добавляют 10 глицерина, 10ф-4 Μ серина, 10 инозитам 10% сыворотки крови крупного рогатого скота. Посевная концентрация -2 *105 клеток в 1 мл 700 мл полученной суспенаии, содержащей 1,4 ·108 клеток вносят в 1-лйтрвшый сосуд (колбу), туда же помещают стерильный магнит и клетки культивируют в термостате при температуре 37°С в течение 24 часов при перемешивании со скоростью 250 об /мин. Получают клеточную массу, содержащую 2,8-10 клеток. Клетки осаждают центрифугированием, суспендируют в 700 мл среды Игла, содержащей 180*10-8 соединения III и инкубируют в термостате в течение 8 часов при 37°С и скорости перемешивания 250 об/мин. Получают конечный продукт - 2,8*108 (слеток, синхронизированных в G1-фазе (вариант 34). В табл. 3 отражена эффективность способа синхронизации клеток в G1-фазе клеточного цикла, характеризуемая содержанием в конечном продукте клеток в G1-, S- и G2+М-фазах цикла, при проведении инкубирования различного вида клеточной культуры в присутствии различных по химическому строению комплексных соединений платины, используемых как в заявляемом диапазоне концентраций, так и при запредельных их значениях (табл. 3, варианты 1-41). Установлено, что заявляемые соединения платины (II)(PtCl2(NH3)2 и производные платины (II)с полианионом ДНК используют в концентрациях, обеспечивающих высокую степень синхронизации клеток в культуре в G1-фазе на уровне 95-100%, достигаемую при оптимальном времени инкубирования - 6-8 часов (табл. 3, варианты 1-34). При снижении концентрации комплексного соединения платины ниже граничного значения, например, соединения III до 4,5 -10 -4 г/дм 3, а ДДП - до 2,7*10-8 г/дм 3, не обеспечивается регулирование клеточного цикла: содержание клеток в конечном продукте в G1-, S- и G2+М-фазах цикла (варианты 36 и 40, соответственно), практически соответствует и х содержанию в клеточной массе после инкубирования в присутствии синхронизирующего агента - океимочевины, используемой в способе-прототипе (табл. 3, вариант 42). Верхний предел значений концентраций соединений платины ограничен тем, что дальнейшее ее повышение (например, соединения III до 1350*10-4 г/дм 3, а ДДП - до 795*10-8 г/дм 3), приводит к гибели клеток культуры (варианты 37 и 41, соответственно). Оптимальными концентрациями соединений платины, обеспечивающими максимальную производительность предложенного способа, то есть 100%-ную синхронизацию клеток в G1-фазе в конечном продукте, являются: для ДДП - (106-530) · 10 -8 г/дм 3, для соединений I, II, III -(180-900)·10 -4 г/дм 3. Проведение процесса инкубирования клеток в присутствии комплексных соединений платины в заявляемых концентрациях, но в течение времени, менее 6 часов, например 5 часов, обеспечивает синхронизацию клеток НЕР-2 в G-1-фазе всего на 72,55%, при этом, 2,7% клеток находится в S-фазе и 24,75% - в G2+М-фазе (вариант 38). В этом случае эффективность предложенного способа находится практически на уровне способа-прототипа. Увеличение же времени инкубирования более 8 часов является нецелесообразным, так как не приводит к увеличению эффективности синхронизации клеток в G1-фазе (вариант 39). В табл. 4 представлены сопоставительные данные по производительности предложенного способа и способа-прототипа [2], выраженные количеством клеток в G1-фазе в конечном продукте, полученные при их реализации в оптимальных режимах, Как следует из представленных данных, предложенный способ обеспечивает достижение максимальной производительности - 100%-ной синхронизации клеток клеточного массива культур в G1-фазе, независимо от вида используемых культур. При этом достигаемая Производительность превышает производительность способа (2) в случае использования культуры Vero - в 1,2 раза, культуры НЕР-2 - в 1,4 раза, культуры СПЭВ -в 1,0 рбза, культуры RH - в 2,6 раза. Таким образом, основным преимуществом предложенного способа является достижение максимально полной синхронизации клеточной культуры в GI-фазе, независимо от вида клеточной культуры, способа культивирования и объема перерабатываемой клеточной массы, что не достигается ни одним из известных способов. Это приводит к значительному увеличению производительности процесса получения клеток в GIфазе: при использовании широко применяемых культур клеток Vero, СПЭВ, НЕР-2, RH производительность увеличивается в 1,2-2,6 раза. Следует также отметить, что высокая производительность .предложенного способа синхронизации клеток в G1-фазе клеточного цикла достигается с использованием простой технологии, не требующей больших затрат энергии, дорогостоящих оборудования и реактивов, что делает предложенный способ технологичным и экономным. (їЦЙПИЯЧНЯШ ^щ^щг^^Т™
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for cell synchronization in g1-phase of cell cycle
Автори англійськоюDziublyk Iryna Volodymyrivna, Trokhymenko Olena Petrivna, Keisevych Liudvih Vladislavovych
Назва патенту російськоюСпособ синхронизации клеток в g1-фазе клеточного цикла
Автори російськоюДзюблик Ирина Владимировна, Трохименко Елена Петровна, Кейсевич Людвиг Владиславович
МПК / Мітки
Мітки: клітин, спосіб, циклу, g1-фазі, синхронізації, клітинного
Код посилання
<a href="https://ua.patents.su/8-24026-sposib-sinkhronizaci-klitin-v-g1-fazi-klitinnogo-ciklu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синхронізації клітин в g1-фазі клітинного циклу</a>
Попередній патент: Вакцина ротавірусна інактивована для імунізації тварин
Наступний патент: Пристрій для реєстрації механоемісії
Випадковий патент: Комірка для затиску та нагрівання твердих зразків при вимірюванні електричних властивостей матеріалів