Сполуки, що мають ауксинову дію, і спосіб їх синтезу
Номер патенту: 55431
Опубліковано: 15.04.2003
Автори: Дульнєв Петро Георгійович, Чернишенко Тетяна Володимирівна, Сидоров Володимир Анатолійович, Кондратенко Сергій Іванович
Формула / Реферат
1. Сполуки загальної формули (І)
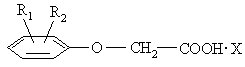 ,
,
де R1=R2=H, алкіл, галоїд або
R1=H, R2=алкіл, галоїд та
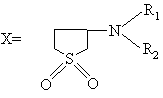 ,
,
де R1=R2 або R1=R2=H, алкіл (С1-С6) або
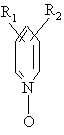 ,
,
де R1=R2=H; алкіл (С1-С4),
R1=H, R2=алкіл (С1-С4), що мають ауксинову дію.
2. Спосіб синтезу сполук формули (І)
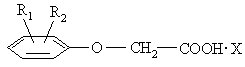 ,
,
де R1=R2=H, алкіл, галоїд або
R1=H, R2 алкіл, галоїд та
 ,
,
де R1=R2 або R1=R2=H, алкіл (С1-С6) або
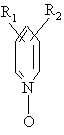 ,
,
де R1=R2=H, алкіл (С1-С4),
R1=H, R2=алкіл (С1-С4)
базуються на реакції взаємодії феноксіоцтових кислот з 3-аміно(алкіламіно)сульфоланами або N-окисом піридину, N-окисом алкілпіридинів.
Текст
1 Сполуки загальної формули (І) о-снгсоон х ДеХ О де Ri=R2=H, алкіл (С1-С4), R i - H , R2=anKin (C1-C4), що мають ауксинову дію 2 Спосіб синтезу сполук формули (І) о-снгсоон х де Ri=R2=H, алкіл, галоїд або R i - H , R2 алкіл, галоїд та R2 деХ О де Ri=R2=H, алкіл, галоїд або R i - H , R2=anKin, галоїд та де Ri=R2 або Ri=R2=H, алкіл (С-і-Сє) або N деХ R2 де Ri=R2 або Ri=R2=H, алкіл (С-і-Сє) або C O ДеХ Ю Ю О де Ri=R2=H, алкіл (С1-С4), Ri=H, R 2 =anKin (C1-C4) базуються на реакції взаємодії феноксюцтових кислот з 3-амшо(алкіламіно)сульфоланами або Nокисом піридину, N-окисом алкілпіридинів Винахід належить до виробництва і застосування похідних феноксиоцтових кислот загальної формули о-снгсоон х Ri = R2 = Н, алкіл, галоїд, або R2 = Н де Ri = Н, алкіл, галоїд (у а, р, у і ш положен 55431 нях), ДеХ де Ri = R2, або R1 Ф R2 = H, алкіл (Сі - C6), арил, 4 (Vas COO), 1320см 1 (Vas SO2), 1040см 1 (VCN) ДЛЯ СОЛІ 3-аміносульфолану і 4-метилфеноксиоцтовоі кислоти, 1245см 1 (VA r o c ), 1610см 1 (Vas COO), 1310см 1 (Vas SO2), 1055см 1 (V C N) ДЛЯ СОЛІ 3метиламшосульфолану і 4-метилфеноксиоцтовоі кислоти, 1235см 1 (VA r o c ), 1580см 1 (Vas COO), 1320см 1 (Vas SO2), 1060см 1 (VCN) ДЛЯ СОЛІ 3метиламшосульфолану і феноксиоцтової кислоти, 1245см 1 (VAr о с), 1625см 1 (Vas COO), 1185см 1 (VN он) для солі N-окису 2,6-диметилпіридину і 4МеТИЛфеНОКСИОЦТОВОІ 1 ДеХ Ri = R2 = H, алкіл (Сі - C4) де R = H, алкіл (Сі - C4) У 2, 3, 4 або 2, 6 положеннях Ці сполуки мають ауксинову дію і тому можливе їх застосування у біотехнологм та інших галузях народного господарства Синтезовані нами нові ПОХІДНІ фен О КС И ОЦТОВИХ кислот, які ми пропонуємо в літературних джерелах не зустрічаються Найближчими аналогами по дії є 1) 2,4-дихлорфеноксиоцтова кислота (еталон1) або и ПОХІДНІ солі, які рекомендовані для використання у сільському господарстві як гербіциди [1] або в біотехнологм [2] як стимулятори росту, 2) феноксиоцтова кислота (еталон-2), яка рекомендована як препарат, що мав ауксинову активність для використання у поживних середовищах у біотехнологм рослин [3] Головними недоліками еталону-1 є - можливість утворення у процесі синтезу надто токсичних супровідних речовин, які суттєво забруднюють навколишнє середовище і ШКІДЛИВІ ДЛЯ здоров'я людини, - використання еталону-1 у бютехнолопчних дослідах має значні обмеження у зв'язку з гербіцидним впливом на регенераційні процеси, особливо у дводольних видів рослин і потребує додаткових трудоемких засобів по вилученню цього препарату зі складу поживних середовищ при вирощуванні in vitro [4] Еталон-2 на відміну від запропонованих сполук виявив значно меншу ефективність, як стимулятор ауксинової дії (Табл 2, Табл 4) при проведенні біотестів на відібраних рослинних об'єктах Завданням цього винаходу є пошук нових сполук, що мають більш високу ауксинову активність на відміну від еталонних препаратів для використання в біотехнологм та інших галузях народного господарства Вирішення цього завдання стає можливим за рахунок синтезу нових похідних феноксиоцтових кислот, а також проведення ДОСЛІДІВ ПО вивченню їхньої ауксинової дії Запропоновані сполуки СТІЙКІ при збереженні, добре розчинюються у воді, не гігроскопічні і вибухобезпечні Структура запропонованих сполук підтверджена елементним аналізом і ІЧ спектрами знятими на спектрофотометрі SPECORD М 80 Присутність смуг поглинання у спектрах пропонованих сполук при 1240см 1 (VArOc), 1580см 1 КИСЛОТИ, 1 2 3 7 с м 1 1 (VAroc), 1610см (Vas COO), 1318см (Vas SO2), 1065см 1 (VCN) ДЛЯ СОЛІ 3-метиламіносульфолану і феноксиоцтової кислоти, 1235см 1 (VA rO c), 1625см 1 (Vas COO), 1320см 1 (Vas SO2), 1060см 1 (VCN) ДЛЯ СОЛІ 3-метиламіносульфолану і 4-хлорфеноксиоцтовоі кислоти, 1230см 1 (VAroc), 1615см 1 (Vas COO), 1315см 1 (Vas SO2), 1068см 1 (VCN) ДЛЯ СОЛІ 3аміносульфолану і 2-м етил фен о кс и оцтово і кислоти, що засвідчує на користь пропонованих структур Для кращого розуміння винаходу наводимо конкретні приклади Приклад 1 Спосіб отримання солі 3-аміносульфолану і 4метилфеноксиоцтової кислоти У трьохгорлому реакторі, оснащеному крапельною лійкою, мішалкою і зворотнім холодильником, розчиняють 83,05г (0,5М) 4метилфеноксиоцтової кислоти у 250мл ацетону і при ретельному перемішуванні до неї додають з крапельної лійки розчин 67,59г (0,5М) 3аміносульфолану у ЮОмл етанолу Реакційну масу нагрівають до кипіння і витримують ЗОхв Розчинники упаровують, залишок сіль 3аміносульфолану і 4-м етил фен о кс и оцтово і кислоти 147,6г (98%) кристалізують з метанолу Температура плавлення солі 3-аміносульфолану і 4метилфеноксиоцтової кислоти 184 - 185% Знайдено, % С - 52,0, Н - 6,1, N - 4,5, S - 10,5, C13H19NO7S Підраховано, % С - 51,82, Н - 6,35, N -4,64, S-10,64 Приклад 2 Спосіб отримання солі N-окису 2,6диметилпіридину і 4-метилфеноксиоцтовоІ кислоти У трьохгорлому реакторі, оснащеному крапельною лійкою, мішалкою і зворотнім холодильником, розчиняють 33,4г (0,2М) 4метилфеноксиоцтової кислоти у 150мл ацетону і потім до неї додають, при ретельному перемішуванні, в крапельної лійки розчин 27,8г (0,2М) Nокису 2,6-диметилпіридину у 50мл ацетону Реакційну масу нагрівають до кипіння і витримують 45хв Розчинники упаровують, залишок сіль Nокису 2,6-диметил піридину і 4метилфеноксиоцтової кислоти 49,4г (70%) кристалізують з метанолу Температура плавлення солі N-окису 2,6-диметил піридину і 4метилфеноксиоцтової кислоти 56 - 58°С Знайдено, % С - 66,6, Н - 6,4, N- 4,7, Ci 6 Hi 9 NO 4 Підраховано, % С - 66,42, Н - 6,62, N - 4,84 Приклад З Спосіб отримання солі 3метиламшосульфолану і 4-хлорфеноксиоцтовоі кислоти 55431 В умовах попереднього досліду (приклад 1) 93,3г (0,5М) 4-хлорфеноксиоцтовоі кислоти і 74,6г (0.05М) 3-метиламіносульфолану отримують 162,8г (97%) солі 3-метиламіносульфолану і 4хлорфеноксиоцтової кислоти Температура плавлення 161 - 163°С (з метанолу) Знайдено, % С 46,6, Н - 5,6, N - 4,3, S - 9,7, СІ - 10,7, Ci 3 Hi 8 NO s SCI Підраховано, % С - 46,49, Н - 5,4, N - 4,17, S 9,54, СІ-10,55 Приклад 4 Спосіб отримання солі 3-аміносульфолану і феноксиоцтової кислоти У трьохгорлому реакторі, оснащеному крапельною лійкою, мішалкою і зворотнім холодильником, розчиняють 76,07г (0,5М) феноксиоцтової кислоти у 200мл метанолу і до неї додають, при ретельному перемішуванні, з крапельної лійки розчин 67,6г (0,5М) 3-аміносульфолану у 50мл метанолу Реакційну масу нагрівають до кипіння і витримують 45хв Розчинник упаровують, залишок 140,8г (90%) солі 3-аміносульфолану і феноксиоцтової кислоти кристалізують з метанолу Температура плавлення солі 163 - 164°С Знайдено, % С 50,3, Н - 6,1, N - 4,9, S -11,5, C12H17NO5S Підраховано, % С - 50,16, Н - 5,96, N - 4,07, S -11,6 Приклад 5 Спосіб отримання солі 3метиламшосульфолану і феноксиоцтової кислоти В умовах попереднього досліду (приклад 4) з 76,07г (0,5М) феноксиоцтової кислоти і 74,6г (0,5М) 3-метиламіносульфолану отримують 146,15г (97%) солі 3-метиламіносульфолану 1 феноксиоцтової кислоти Температура плавлення 135 - 137°С (в метанолу) Знайдено, % С - 51,7, Н - 6,2, N - 4,7, S - 10,7, C13H19NO5S Підраховано, % С - 51,82, Н - 6,35, N - 4,64, S -10,64 Приклад 6 Спосіб отримання солі 3-аміносульфолану і 2метилфеноксиоцтової кислоти і 67,6г (0,5М) 3аміносульфолану отримують 144,5г (96%) солі 3аміносульфолану 1 2-метил феноксиоцтової кислоти Температура плавлення 155 - 157°С (в метанолу) Знайдено, % С - 51,2, Н - 6,5, N - 4,3, S - 10,2, C13H19NO7S Підраховано, % С - 51,82, Н - 6,35, N - 4,64, S -10,64 Приклад 7 Тестування препаратів на біологічну активність Приготування рослинного матеріалу і методика проведення досліду (біотестів) Ауксинова дія препаратів вивчалася у культурах тканини і клітин вищих рослин in vitro у зв'язку в дослідженнями морфогенетичних потенцій цих двох типів культур, як біологічних систем здатних до регенерації рослин Одна (перша) біологічна система пов'язана з використанням меристематичних тканин культури експлантів ппокотилів, інша (друга) система пов'язана з використанням соматичних клітин культури протопластів мезофіла листків Обидві біологічні системи дозволяють постадійно простежити процес детермінації стебло вого морфогенезу і послідуючу реалізацію програми розвитку у сформованих de novo рослин регенерантів Як відомо, згідно запропонованих принципів гормональної регуляції у культурах тканини і клітин in vitro [5], будь який морфогенетичний процес контролюється концентраційними співвідношеннями екзогенних фітогормонів ауксинів і ЦИТОКІНІНІВ у поживному середовищі У зв'язку з чим ауксинам відводиться регуляторна роль у процесах елонгації і поділу клітин [6] Елонгація клітин є надзвичайно швидкою реакцією рослин на обробку ауксинами і вже починається черев 10 - 15хв [6] Окрім швидкої реакції існують більш тривалі за часом, які наступають після латентного періоду протягом від декілька годин до декілька діб Довготривалою реакцією є клітинний поділ, диференціровка і морфогенез [6] Згідно мети проведених досліджень, при тестуванні та статистичному аналізі результатів біотестів нами враховувались тільки довготривалі морфофізіолопчні наслідки впливу проаналізованих препаратів ВІДПОВІДНО З існуючими критеріями оцінки, які застосовуються відносно до ауксинів [6] Як об'єкти дослідження нами було відібрано чотири сорти капусти білоголової, які відрізняються різними морфогенетичними властивостями у культурі in vitro, а також строками вегетації у польових умовах Зокрема, три сорти пізньостиглої капусти Харківська зимова, Українська осінь і Ярославна селекції Інституту овочівництва і баштанництва УААІІ та один сорт ранньостиглої капусти Дітмаршер Фрюер (Dithmarscher Fruher) селекції фірми "Nunhems zaden" (Голандія) Спосіб статистичного обрахунку результатів, приготування рослинного матеріалу та гормональних поживних середовищ при проведенні біотестів у культурі експлантів ппокотилів Застосування у бютестах ппокотилів капусти обумовлено тим, що цей вид рослинної тканини вміщує у своїй структурі клітини латеральної меристеми, з якої під впливом як природного (зеатин), так і синтетичних екзогенних ЦИТОКІНІНІВ (БАП, кінетин та ш) формуються адвентивні пагони при культивуванні в асептичних умовах Тому у якості контролю використовувалось поживне середовище, що вміщувало 1мг/л БАЛ для індукції адвентивних пагонів ДОСЛІДНІ ПОЖИВНІ середовища відрізнялися від контрольного тим, що мали у своєму гормональному складі 1мг/л БАП та додатковий вміст аналізованих препаратів ауксинової дм у рівних концентраціях Для приготування асептичної культури експлантів ппокотилів насіння вищевказаних сортів капусти спочатку поверхнево стерилізували послідовним зануренням у 70% розчин етанолу (1хв), а потім у розчин ппохлориду кальцію в концентрацією ЗОг/л активного хлору (Юхв), що вміщував 0,1% Tween-20 Далі насіння тричі відмивали у стерильній дистильованій воді протягом 10 - 20хв та висаджували на безгормональному поживному середовищі МС [7] і розміщували у темряві для пророщування при 25°С Протягом 7 - 9 діб культивування насіння проростало і формувало стерильні рослини з надмірно подовженими етюльованими ппокотилями Потім ГІПОКОТИЛІ З пророщеної 55431 розсади розрізали на сегменти довжиною 5 - 7 мм і висаджували на агаризоване поживне середовище МС, доповнене аналізованими препаратами ауксинової дм у різних концентраціях Для одного варіанту досліду 15 експлантів ппокотилів одного сорту капусти розміщували на одну чашку Петрі з поживним середовищем Культивування експлантів проводили в умовах 16-годинного фотоперіоду на розсіяному СВІТЛІ з низькою інтенсивністю (500люкс) і при ПОСТІЙНІЙ температурі повітря 25°С Фенологічні спостереження за розвитком культури проводились щодобово, а підрахунок КІЛЬКОСТІ сформованих адвентивних пагонів після 2-х МІСЯЦІВ культивування Для приготування гормональних поживних середовищ використовували заздалегідь приготовлені концентровані ВИХІДНІ розчини аналізованих препаратів Усі речовини розчиняли в універсальному розчиннику ДМСО (диметилсульфоксид) з розрахунку 1мг речовини на 1мл розчинника Додавання речовин у поживні середовища проводили в асептичних умовах після автоклавування і охолодження останніх до 40 - 50°С Для вивчення стимуляторної дії кожен аналізований препарат випробували у 4-х концентраціях 0,25, 0,5, 1 та Змг/л ВІДПОВІДНО За еталонні ауксини було прийнято фенольні стимулятори 2,4Д (2,4-дихлорфеноксиоцтова кислота) і ФОК (феноксиоцтова кислота) Під час проведення тестових аналізів враховувався статистичний показник формування вегетативного потомства коефіцієнт розмноження (КР) - КІЛЬКІСТЬ утворених адвентивних пагонів на один культивований експлант ппокотилів Для підрахунку КР використовували статистичний спосіб оцінки результатів досліджень, який враховував дискретне варіювання цієї контрольованої ознаки [9] Для однієї аналізованої сполуки дослід проводили утрьократній повторності Спосіб статистичного обрахунку результатів, приготування рослинного матеріалу та гормональних поживних середовищ при проведенні бютестів у культурі мезофільних протопластів Для бютестів у культурі мезофільних протопластів використовували рослини сорту Дітмаршер Фрюер, які вирощували в умовах in vitro Для отримання мезофільних протопластів використовували листя 3-4 тижневих рослин Тканину листа розрізали на смуги 1мм завширшки та шкубували у ферментному розчині, що вміщував 0,5% Macerozyme ("Calbiochem", США), 0,5% Onozuka R-10 ("Jacult Biochemicals", Японія), 0,5М сахарози та 5мМ СаСЬ (рН 5,6) в темряві при 28°С протягом 16 - 18 год Ізольовані протопласти відокремлювали від залишків тканини шляхом фільтрування через металеві фільтри з діаметром пор 64мкм Фільтрат переносили в центрифужні пробірки на Юмл та центрифугували зі швидкістю 700 обертів/хв протягом 7хв Кільце флотованих протопластів відбирали пастерівською піпеткою та відмивали не менше двох разів в середовищі W5 (Medgyesy et al 1980), осаджуючи їх кожного разу центрифугуванням протягом 5хв при 700 обертів/хв Після ЦЬОГО відбирали надосадочну рідину та культивували протопласти в рідкому поживному 8 середовищі з попередньою фіксацією в алпнатній ПЛІВЦІ ВІДПОВІДНО Damm and Willmitzer (1988) Для цього до протопластів додавали 0,5М манітолу так, щоб концентрація протопластів складала 80 х 104 клітин/мл Суспензію протопластів змішували з однаковим об'ємом 2,8%-ного розчину алпнату натрію в 0,4М манітолі У подальшому 1мл суміші переносили в чашки Петрі діаметром 50мм з агаризованим середовищем, яке вміщувало 20мМ СаСЬ в 0,4М манітолі та розподіляли по поверхні середовища так, щоб внаслідок присутності Іонів Са 2+ утворилась тонка алпнатна плівка з іммобілізованими в ній протопластами Після процедури фіксації в альпнатній ПЛІВЦІ культури переносили на рідке поживне середовище ТМНОдз (Табл 1) , що вміщувало препарати ауксинової та ЦИТОКІНІНОВОІ дій для стимуляції цитокшезу клітин Для подальшого формування калусної культури, утворенні мікроколонм клітин на стадії 3-го та 4-го мітотичних ЦИКЛІВ ПереНОСИЛИ На ріДКе СереДОВИЩе ТМнодЗ (Табл 1) для дорощування Середовище ТМНОдз повністю поновлювали кожні 10 днів і використовували до утворення колоній діаметром 0,5 1,5мм Після ЧОГО алпнатну плівку розчиняли за допомогою 0,ЗМ розчину цитрату натрію в 0,4М манітолу Потім КОЛОНІЇ КЛІТИН переносили на агаризоване регенераційне СереДОВИЩе ТМНОд4 (Табл 1) і вирощували при 25°С на СВІТЛІ інтенсивністю 5клк та фотоперіодом 16год Калус пересаджували кожні два тижні на свіже поживне середовище ТМНод4 Рослини, що регенерували, переносили на безгормональне середовище МС для укорінення Протягом усього періоду культивування для визначення стимуляторної дії кожен аналізований препарат додавали у концентраціях 0,5мг/л у поживні середовища ТМНод2 і ТМнодз та 0,2мг/л у ТМ Н од4 Для підрахунку результатів бютестів враховували такі показники 1) час культивування ініціальних клітин до фази 1-го мітотичного циклу (в добах) на середовищі ТМ Н од2, 2) ефективність висіву протопластів (ЕВП) оцінювали у відсотках як співвідношення КІЛЬКОСТІ калусних колоній, що сформувалися на середовищі ТМнодз до загальної КІЛЬКОСТІ протопластів, 3) частоту регенерації (ЧР) визначали у відсотках як співвідношення КІЛЬКОСТІ калусних колоній, здатних до морфогенезу на середовищі ТМНОд4 до загальної КІЛЬКОСТІ отриманих колоній на середовищі ТМнодЗ При проведенні бютестів до складу поживних середовищ ТМНод2 і ТМнодз було введено нафтилоцтову кислоту (НОК), як препарат ауксинової дії, додавання якого у експериментально підібраному співвідношенні з еталонними фенольними ауксинами індукувало одночасні елонгацію і цитокшез клітин (Табл 3), що є необхідною передумовою росту мікроколоній клітин При чому, як свідчать результати попередніх ДОСЛІДІВ використання тільки однієї НОК разом з ЦИТОКІНІНОМ БАП викликає тільки елонгацію клітин без ініціації клітинного поділу протопластів (Табл 3) Тому тестування аналізованих препаратів проводилось з метою порівняльного аналізу з дією еталонних фенольних 55431 ауксинів на індукцію цитокшезу клітин у такому ж поєднанні в НОК Для однієї аналізованої сполуки дослід проводили утрьократній повторності Використані у бютестах БАП (бензиламшопурин), зеатин, НОК, 2,4-Дта ФОК виробництва компанії "Sigma" (США) Порівняльний аналіз еталонних і запропонованих препаратів на ауксинову дію у культурах експлантів ппокотилів і мезофільних протопластів Як свідчать результати досліджень на двох типах культур усі аналізовані препарати виявили притаманну ауксинам регуляторну дію, яка за своїм характером більше відповідає довготривалим фізіологічним реакціям рослинних об'єктів на обробку екзогенними ауксинами Зокрема, у культурі мезофільних протопластів (Табл 4) запропоновані сполуки виявили адекватну дію еталонним препаратам по 1) ініціації 1-го мітотичного циклу клітин на поживному СереДОВИЩІ ТМНод2, 2) індукції фізюлопчнорівнополярного поділу клітин у сформованих калусних клонів на поживному СереДОВИЩІ ТМнодЗ, 3) стимуляції цитокшезу клітин при подальшому нарощуванні калусних клонів до критичної маси, необхідної для пересіву на регенераційне поживне СереДОВИЩе ТМнод4 Додатково слід зауважити, що при вищезазначених стимуляторних діях застосування препаратів на регенераційному середовищі ТМНОд4 не виявило гербіцид ного впливу на проліферацію адвентивних пагонів на відміну від еталонного препарату 2,4-Д у випробуваній концентрації 0,2мг/л Відзначимо, також, значно кращі значення часу ініціації 1-го мітотичного циклу клітин, ЕВП та ЧР при застосуванні більшості аналізованих препаратів на відміну від еталонних (Табл 4) Як показали попередні досліди на двох типах культур застосовані препарати ауксинової дії, що є похідними нафтолу (це нафтилоцтова або ІНДОЛІлоцтова кислоти (ІОК)) виявляють найбільший вплив на детермінацію меристематичних клітин корінців на відміну від досліджених фенольних сполук та похідних піридину Тому присутність 10 НОК або ІОК у гормональному складі регенераційного поживного середовища для культури протопластів у випробуваній концентрації 0,2мг/л завжди стимулювало укорінення калусної тканини і знижувало и морфогенетичний потенціал ще до утворення пагонів Культивування експлантів ппокотилів у присутності 0,2мг/л НОК або ІОК стимулювало одночасний розвиток пагонів та корінців тільки на ВІДПОВІДНИХ фізіологічних полюсах експлантів При такій одночасній стимуляції ризогенезу у присутності вищезазначених ауксинів значно знижувалась КІЛЬКІСТЬ утворених адвентивних пагонів на двох типах культур (дані не наведені) і інколи навіть спонукало спонтанне повернення тканин до дедиференціального росту у культурі калусної тканини на середовищі ТМНОд4 на відміну від аналізованих нами препаратів іншого синтетичного походження Морфогенетичні наслідки впливу аналізованих препаратів у культурі експлантів ппокотилів наведені у Таблиці 2 Як свідчать ці результати, додавання препаратів у концентраціях від 0,25 до 0,5мг/л, а інколи і до 1мг/л загалом підвищувало КІЛЬКІСТЬ утворених адвентивних пагонів у порівнянні в контролем (поживним середовищем, що вміщувало тільки екзогенний ЦИТОКІНІН) у декілька разів При цьому спостерігалась тенденція до пропорційного зростання показника КР ВІДПОВІДНО вмісту аналізованої сполуки Але при випробуванні високих концентрацій препаратів від 1 до Змг/л (для деяких препаратів тільки Змг/л) відбувалося зниження регенераційних властивостей меристематичних тканин, інколи до її повної відсутності при тестуванні окремих сполук Застосування еталонного препарату 2,4-Д виявило гербіцидний вплив цієї сполуки на регенерацію пагонів на всіх досліджених концентраціях Слід відзначити, що збільшення концентрації цитокінша БАП більше, ніж 1мг/л не призводить до вростання показника КР, а навпаки пригнічує регенерацію рослин У попередніх дослідах по визначенню оптимального вмісту цитокініну було обрано контрольний варіант поживного середовища для бютестів саме з такою концентрацією БАП Таблиця 1 Поживні середовища ДЛЯ культивування протопласта та регенерації рослин білоголової капусти Компоненти, мг/л* Мікроелементи NH4NO3 KNO3 СаСІ2 х 2Н2О MgSO4 х 7Н2О КН2РО4 Fe-хелат №2ЭДТА ТМ Н од2 ТМнодЗ ТМ Н од4 200 1500 200 1500 200 1500 440 440 440 370 170 370 170 370 170 37,3 37,3 37,3 Продовження таблиці 1 Компоненти, мг/л* FeSO4 х 7Н2О Мікроелементи ТМ Н од2 27,8 ТМнодЗ 27,8 ТМ Н од4 27,8 11 12 55431 НзВОз MnSO4 х 4Н2О ZnSO4 х 7Н2О Na 2 MoO 4 x2H 2 O 3,0 3,0 3,0 13,2 13,2 13,2 2,0 KJ COSO4 x 5H2O CuSO4 x 5H2O Вітаміни та ш біологічно активні речовини мезошозит ГЛІЦИН Ві в6 РР гідролізат казеїну глютамін ксилоза Гормони НОК (нафтилоцтова кислота) АС** БАП (бензил-амшопурин) зеатин Сахара сахароза глюкоза 2,0 2,0 0,25 0,75 0,025 0,025 0,25 0,75 0,025 0,025 0,25 0,75 0,025 0,025 100 2 10 1 1 150 100 2 10 1 1 500 500 250 100 2 10 1 1 500 500 125 1,0 0,5 0,5 0,1 0,5 0,5 0,5 0,2 1,0 90100 (0,5М) 40000 27000 (0,15М) 5,8 рН 72000 (0,4М) 5,8 5,8 *Примітка для культивування мезофільних протопластів сорту капусти Дітмаршер Фрюер було використано модифікований варіант поживного середовища Шахіна ТМ-2 (Shahin, 1985) [8], зокрема для ініціаЦІІ ЦИТОКІНезу КЛІТИН - ТМ Н од2, ДЛЯ НарОЩуваННЯ МІКрОКОЛОНІЙ - ТМнодЗ, ДЛЯ р е г е н е р а ц і ї РОСЛИН - ТМ Н од4 **Примітка АС - аналізовані сполуки, що додавалися у середовища для культивування протопластів з метою тестування їхньої ауксинової дії Таблиця 2 Вплив препаратів ауксинової дії на індукцію адвентивних пагонів досліджених сортів капусти у культурі експлантів ппокотилів Назва препарату бензиламшопурин (контроль) Концентрація препарату (мг/л) Значення статистичного показника коефіцієнта розмноження (КР) для досліджених сортів капусти Для сорту ЯроДля сорту Харків- для сорту Українславна ська зимова ська ОСІНЬ 1,12 + 0,47 1,05 + 0,23 0,80 + 0,56 0,25 2,4-дихлор-феноксиоцтова кислота (еталон-1) 1,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 3,60 + 0,95 2,40 + 0,60 0,80 + 0,49 3,40 + 0,79 4,56 + 0,97 3,90+1,19 0,50 + 0,47 3,11110,84 1,63П0,68 1.20П0.47 1,15110,45 1,60 + 0,92 1,67+1,02 0,20 + 0,10 0,5 1,0 3,0 0,25 феноксиоцтова кислота (еталон-2) сіль 3-метиламіносульфолану і феноксиоцтоВОІ КИСЛОТИ 0,5 1,0 3,0 0,25 0,5 1,0 3,0 0,0 4,67 + 0,11 3,25П0,66 3,00П0,98 2,30П0,66 0,0 4,25П1,09 3,67П1,13 1,00П0,57 0,0 13 55431 14 Продовження таблиці 2 Концентрація препарату (мг/л) Назва препарату 0,25 сіль 3-аміносульфолану і феноксиоцтової кислоти 0,5 1,0 3,0 сіль 3-метиламіносульфолану і 2метилфеноксиоцтовоікислоти сіль 3-метиламіносульфолану і 4метилфеноксиоцтової кислоти сіль 3-метиламіносульфолану і 4хлорфеноксиоцтової кислоти сіль N-окису 2,6диметилпіридину і 4метилфеноксиоцтової кислоти сіль 3-аміносульфолану і 4метилфеноксиоцтової кислоти 0,25 0,5 1,0 3,0 0,25 0,5 1,0 3,0 0,25 0,5 1,0 3,0 0,25 0,5 1,0 3,0 0,25 0,5 1,0 3,0 Значення статистичного показника коефіцієнта розмноження (КР) для досліджених сортів капусти Для сорту ЯроДля сорту Харків- для сорту Українславна ська зимова ська ОСІНЬ 3,ЗЗП0,88 3.50П1.14 2.67П1.45 2,70П0,70 3,83П0,77 2.80П1.31 0,80П0,52 2.60П1.16 1.92П0.43 0,20П0,18 1.50П0.78 1.00П0.34 4,36 ± 0,68 3,50П0,79 2,00П0,85 0,22П0,18 0,40П0,25 0,80П0,44 0,10П0,37 0,30П0,14 0,20П0,18 0,0 0,0 0,0 2,30П0,58 1.90П0.49 1.20П0.53 0.40П 0,38 3,67 ±1,67 4.33П1.35 7,00П1,80 3,50П0,57 3,20П0,51 3.17П1.01 1.50П0.45 4.00П1.47 3.67П1.84 1.67П0.15 1.67П0.84 1.00П0.69 0,60П0,36 0,50П0,31 5,ЗЗП2,94 4.17П1.88 0,50П0,31 0,0 0,0 0,0 5,50П2,34 6,17П2,99 7.17П1.54 О,86ПО,55 5.00П1.51 3,ЗЗП0,81 1.33П1.04 1.79П0.44 2,ЗЗП0,90 2,73П0,61 1.33П0.77 0.17П0.15 2.67П1.76 2.17П1.04 0,0 2.30П1.49 2.50П1.33 3,29П0,97 4.17П1.59 0,0 3,88П0,35 5.17П1.50 1.49П1.77 0.17П0.15 Таблиця З Вплив комбінованої дії ауксинових препаратів рівного синтетичного походження на одночасні стимуляції елонгації, цитокінезута росту мікроколоніи клітин у культурі протопластів сорту капусти Дітмаршер Фрюер (за результатами роботи з еталонними препаратами) Досліджені комбінації гормонів поживних середовищ (мг/л) 2,4 Д ФОК НОК БАП 1,0 1,0 0,2 0,2 0,2 0,2 0,2 0,2 1,0 1,0 1,0 0,1 0,1 0,5 0,5 0,5 0,5 0,5 0,5 0,5 Морфофізіолопчні реакції клітин на застосованих поживних середовищах для культивування ТМ Н од2 ТМнодЗ ркв ркв ел ркв ркв ел ел, цтк, рмк ел, цтк, рмк ел, цтк, рмк ел, цтк, рмк ел, цтк, рмк* ел, цтк, рмк* ркв ркв Умовні позначення до Таблиці 3 ркв - реакція клітин відсутня, ел - елонгація, цтк - цитокшез, рмк - ріст мікроколоніи клітин *Примітка вищезазначені морфофізіолопчні реакції спостерігались після пересіву сформованих мікроколоніи на середовище ТМНОдз з середовища ТМНОд2, що мало такі гормональні співвідношення для ініціації елонгації та цитокшезу клітин 1,0мг/л НОК, 0,5мг/л БАП, 0,2мг/л 2,4-Д або 1,0мг/л НОК, 0,5мг/л БАП, 0,2 ФОК 15 55431 16 Таблиця 4 Вплив аналізованих та еталонних препаратів ауксинової дії на ініціацію цитокінезута ріст мікроколоніи клітин на рівних стадіях культури мезофільних протопластів сорту капусти Дітмаршер Фрюер Назва препарату 2,4-дихлор-феноксиоцтова кислота (еталон-1) феноксиоцтова кислота (еталон-2) сіль 3-метиламшосульфолану і феноксиоц Значення застосованих показників стану культури протопластів на рівних стадіях культивування час культивування до ініціефективність висіву частота регенерації на ації 1-го мітотичного циклу протопластів на серед Серед ТМмод4 (ЧР, %) на серед ТМНОд2 (У добах) ТМмодз (ЕВП, %) 7-8 5,57 ± 0,79 0,0 9-Ю 3,67 ±0,21 15,8 ± 1,19 3-4 11,36 ±0,69 67,8 ± 1 , 4 5 5-7 5,77 ±0,71 47,2 ± 0,34 7-8 3,45 ± 0,56 10,4 ± 0 , 2 3 5-7 7,23 ±0,18 34,4 ± 0,67 3-4 12,65 ±0,89 71,3 ± 2 , 6 8 5-8 11,74 ±0,24 68,9 ± 1 , 6 3 5-9 10,49 ±1,27 41,3 ± 0 , 5 6 ТОВОІ КИСЛОТИ сіль 3-аміносульфолану і феноксиоцтової кислоти сіль 3-метиламшосульфолану і 2-метилфеноксиоцтової кислоти сіль 3-метиламшосульфолану і 4-метилфеноксиоцтової кислоти сіль 3-метиламшосульфолану і 4хлорфеноксиоцтової кислоти сіль N-окису 2,6диметил піридину і 4метилфеноксиоцтової кислоти сіль 3-аміносульфолану і 4-метилфеноксиоцтовоі кислоти Література 1 Мельников Н Н Пестициды М "Химия", 1987 229с 2 Dudits D , Gyorgyey J , Bogre L , Dako L Molecular Biology of Somatic Embryogenesis T A Thorpe (ed) In Vitro Embryogenesis in Plants, P 267 - 300 1995 Kluwer Academic Publishers Dordrecht Printed in the Hetherlands 3 Уоринт Ф , Филипс И Рост растений и дифференцировка М "Мир", 1984 512с 4 Дрейпер Дж Генная инженерия растений Лабораторное руководство М "Мир", 1991 408с 5 Skoog F , Miller W Chemical regulation of growth and organ formation in plant tissue cultured in vitro, Symp Soc Biol 1957, 11, P 118 6 Theologis A Rapid gene regulation by auxin Rev Plant Physiol 1986 V 37, P 407 - 438 7 Murashige T , Skoog F A revised medium for rapid growth and bioassays with tobacco tissue culture Physiol plant 1962 V 15, P 473-497 8 Shahm E A Totipotency of tomato protoplast Theor Appl Genet 1985 V 69, P 235 - 240 9 Дегтярьова Н І Лабораторний і польовий практикум з генетики Київ, 1973 272с Підписано до друку 05 05 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds having auxine effect and a method of synthesis thereof
Автори англійськоюDulniev Petro Heorhiiovych, Dulnev Petro Heorhiovych, Dulnev Petro Heorhiiovych, Kondratenko Serhii Ivanovych, Chernyshenko Tetiana Volodymyrivna
Назва патенту російськоюСоединения, обладающие ауксиновым действием, и способ их синтеза
Автори російськоюДульнев Петр Георгиевич, Кондратенко Сергей Иванович, Чернышенко Татьяна Владимировна
МПК / Мітки
МПК: A01N 43/10, C07D 333/48, C07D 211/94, A01P 21/00, A01N 39/00, A01N 43/40, C07C 59/00
Мітки: спосіб, сполуки, синтезу, дію, мають, ауксинову
Код посилання
<a href="https://ua.patents.su/8-55431-spoluki-shho-mayut-auksinovu-diyu-i-sposib-kh-sintezu.html" target="_blank" rel="follow" title="База патентів України">Сполуки, що мають ауксинову дію, і спосіб їх синтезу</a>
Попередній патент: Гірка настоянка “мрія”
Наступний патент: Спосіб та пристрій для ємнісного сприймання зображень
Випадковий патент: Спосіб синтезу суміші олігосахаридів












