Водорозчинні порфіринплатинові сполуки з високою селективністю до пухлин та їх застосування для лікування доброякісних та злоякісних пухлинних захворювань
Номер патенту: 78007
Опубліковано: 15.02.2007
Автори: Лоттнер Крістіан, Бруннер Генрі, Барт Карл-Крістіан, Бернхардт Гюнтер
Формула / Реферат
1. Похідні порфіринплатини, що являють собою (а) похідні тетраарилпорфіринплатини загальної формули I
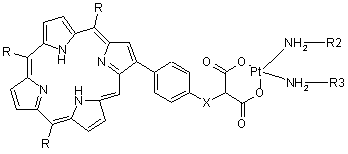 ,
,
де
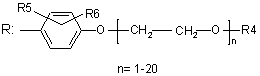 ,
,
Х вибраний з групи, яка включає О, S, NH, N-алкіл;
R2 і R3 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R4 вибраний з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R5 вибраний з групи, яка включає Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщену аміногрупу;
R6 вибраний з групи, яка включає Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщену аміногрупу;
та загальної формули II
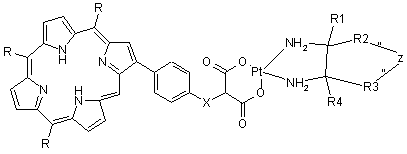 ,
,
де
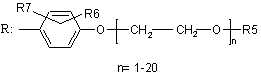 ,
,
X вибраний з групи, яка включає О, S, NH, N-алкіл;
R1, R2, R3 і R4 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл або
R2-Z-R3, де Z являє собою (СН2)n, n приймає значення від 0 до 6;
R1 і R4 являють собою -(CH2)n-COOR8, де n приймає значення від 0 до 6;
R5 вибраний з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R6 вибраний з групи, яка включає Н, алкіл, O-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщену аміногрупу;
R7 вибраний з групи, яка включає Н, алкіл, O-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщену аміногрупу;
R8 вибраний з групи, яка включає Н, алкіл;
та
(b) похідні гематопорфіринплатини загальної формули III
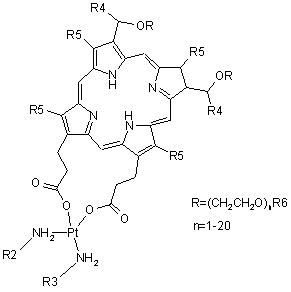 ,
,
де
R2 і R3 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R4 вибраний з групи, яка включає Н, алкіл, циклоалкіл;
R5 вибраний з групи, яка включає Н, алкіл, циклоалкіл;
R6 вибраний з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
та загальної формули IV
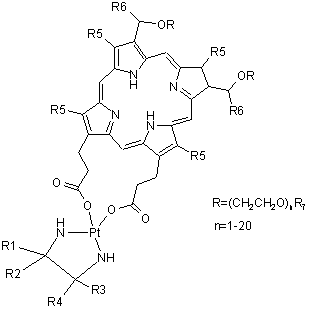 ,
,
де
R1, R2, R3 і R4 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл або
R2-Z-R4, де Z являє собою (СН2)n, n приймає значення від 0 до 6; або
R1 і R3 являють собою -(CH2)n-COOR6, де n приймає значення від 0 до 6;
R4 і R5 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R6 вибраний з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл;
R7 вибраний з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл.
2. Похідні порфіринплатини загальних формул I, II, III та IV за п. 1, які мають щонайменше один асиметричний атом вуглецю, у формі їх рацематів, їх чистих енантіомерів та/або їх діастереоізомерів, або у формі сумішей вказаних енантіомерів або діастереоізомерів.
3. Застосування щонайменше однієї похідної порфіринплатини загальної формули I, II, III та IV за п. 1 або 2 як терапевтично активної сполуки для приготування лікарського засобу для лікування раку.
4. Застосування щонайменше однієї похідної порфіринплатини загальної формули I, II, III і IV за п. 1 або 2 як терапевтично активної сполуки для приготування лікарського засобу при фотодинамічному лікуванні пухлин.
5. Застосування за п. 4, у якому фотодинамічне лікування пухлин передбачає опромінювання електромагнітним випромінюванням з довжиною хвилі від 600 до 730 нм.
6. Лікарський засіб, що містить щонайменше одну із сполук за п. 1 або 2, а також щонайменше один фізіологічно прийнятний носій та/або розріджувач, або допоміжну речовину.
7. Спосіб приготування лікарського засобу за п. 6, у якому щонайменше одну із сполук за п. 1 або 2 переробляють у фармацевтичну композицію або переводять у форму для терапевтичного застосування із використанням щонайменше одного з фармацевтичних носіїв та/або розріджувачів, або інших допоміжних речовин.
8. Застосування щонайменше однієї похідної порфіринплатини загальної формули I, II, III або IV за п. 1 або 2 та/або лікарського засобу за п. 6 або одержаного способом за п. 7, самих по собі або в комбінації один з одним, або в комбінації з щонайменше одним з носіїв та/або розріджувачів, або інших допоміжних речовин.
Текст
1. Похідні порфіринплатини, що являють собою (а) похідне тетраарилпорфіринплатини загальної формули I 2 CH 2 CH 2 O R5 n n= 1-20 , X вибраний з групи, яка включає О, S, NH, N-алкіл; R1, R2, R3 і R4 вибрані з групи, яка включає Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл або 3 78007 4 R2-Z-R3, де Z являє собою (СН2)n, n приймає знаR1, R2, R3 і R4 вибрані з групи, яка включає Н, чення від 0 до 6; алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоR1 і R4 являють собою -(CH 2)n-COOR8, де n приалкіл або ймає значення від 0 до 6; R2-Z-R4, де Z являє собою (СН2)n, n приймає знаR5 вибраний з групи, яка включає Н, алкіл, арил, чення від 0 до 6; або аралкіл, гетарил, гетарилалкіл, циклоалкіл; R1 і R3 являють собою -(CH 2)n-COOR6, де n приR6 вибраний з групи, яка включає Н, алкіл, Oймає значення від 0 до 6; алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщеR4 і R5 вибрані з групи, яка включає Н, алкіл, ну аміногрупу; арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл; R7 вибраний з групи, яка включає Н, алкіл, OR6 вибраний з групи, яка включає Н, алкіл, арил, алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщеаралкіл, гетарил, гетарилалкіл, циклоалкіл; ну аміногрупу; R7 вибраний з групи, яка включає Н, алкіл, арил, R8 вибраний з групи, яка включає Н, алкіл; аралкіл, гетарил, гетарилалкіл, циклоалкіл. та 2. Похіднi порфіринплатини загальних формул I, II, (b) похідне гематопорфіринплатини загальної фоIII та IV за п. 1, які мають щонайменше один асирмули III метричний атом вуглецю, у формі їх рацематів, їх R4 чистих енантіомерів та/або їх діастереоізомерів, OR R5 або у формі сумішей вказаних енантіомерів або R5 діастереоізомерів. N OR H N 3. Застосування щонайменше однієї похідної порR5 R4 N фіринплатини загальної формули I, II, III та IV за H N п. 1 або 2 як терапевтично активної сполуки для R5 приготування лікарського засобу для лікування O раку. R=(CH CH O ) R O O 4. Застосування щонайменше однієї похідної порO n=1-20 NH Pt фіринплатини загальної формули I, II, III і IV за п. 1 R2 NH або 2 як терапевтично активної сполуки для пригоR3 , тування лікарського засобу при фотодинамічному де лікуванні пухлин. R2 і R3 вибрані з групи, яка включає Н, алкіл, 5. Застосування за п. 4, у якому фотодинамічне арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл; лікування пухлин передбачає опромінювання елеR4 вибраний з групи, яка включає Н, алкіл, циклоктромагнітним випромінюванням з довжиною хвилі алкіл; від 600 до 730 нм. R5 вибраний з групи, яка включає Н, алкіл, цикло6. Лікарський засіб, що містить щонайменше одну алкіл; із сполук за п. 1 або 2, а також щонайменше один R6 вибраний з групи, яка включає Н, алкіл, арил, фізіологічно прийнятний носій та/або розріджувач, аралкіл, гетарил, гетарилалкіл, циклоалкіл; або допоміжну речовину. та загальної формули IV 7. Спосіб приготування лікарського засобу за п. 6, R6 у якому щонайменше одну із сполук за п. 1 або 2 OR R5 переробляють у фармацевтичну композицію або R5 переводять у форму для терапевтичного застосуN OR H N вання із використанням щонайменше одного з R5 R6 фармацевтичних носіїв та/або розріджувачів, або N H N інших допоміжних речовин. R5 8. Застосування щонайменше однієї похідної порфіринплатини загальної формули I, II, III або IV за O R=(C H CH O) R п. 1 або 2 та/або лікарського засобу за п. 6 або O O O H n=1-20 одержаного способом за п. 7, самих по собі або в N Pt R1 комбінації один з одним, або в комбінації з щонайNH менше одним з носіїв та/або розріджувачів, або R2 R3 інших допоміжних речовин. R4 , де 2 2 n 5 2 2 2 2 n 7 Винахід стосується нових водорозчинних порфірин-платинових сполук з високою селективністю до пухлин та їх застосування для лікування доброякісних та злоякісних пухлинних захворювань. Зокрема, сполуки згідно з винаходом є придатними для фотодинамічної протипухлинної терапії людини та ссавців. Комплекси платини(ІІ) з порфіриновими лігандами та їх застосування як ефективних цитостати чних та фототоксичних протипухлинних засобів раніше описувалися в таких публікаціях. [W.M.Sharman, C.M.Allen and J.E. van Lier, DDT 4, (11) 507-517 (1999). Photodynamic therapeutics: basic principles and clinical applications T.Okunaka and H.Kato, Rev. Contemp. Pharmacother., 10, 59-68 (1999). Potential Applications of Photodynamic Therapy. H.Brunner, H.Obermeier and R.-M. Szeimies, 5 78007 6 Chem. Ber., 1995, 128,173-181. Platinum(ll) complexes with porphyrin ligands: synthesis and synergism during photodynamic therapy. H.Brunner, K.-H. Schellerer and B.Treittinger, Inorg. Chim. Acta 1997, 264, 67-69. Synthesis and in vitro testing of hematoporphyrin type ligands in platinum(II) complexes as potent cytostatic and phototoxic antitumor agents]. Згідно з винаходом описано нові похідні порфіринів платини, які мають цитотоксичні властивості. Несподівано було виявлено, що ці сполуки R2/R3: Η, алкіл, арил, аралкіл, гетарил, гетамають добру розчинність у воді та високу селектирилалкіл, циклоалкіл вність. Ці сполуки можуть бути застосовані для R4: Н, алкіл, циклоалкіл лікування раку, зокрема, для фотодинамічного R5: Н, алкіл, циклоалкіл лікування пухлин. R6: Н, алкіл, арил, аралкіл, гетарил, гетарилаЗагальні формули заявлених сполук похідних лкіл, циклоалкіл тетраарилових порфіринів платини є такими: Формула IV Формула І X: О, S, NH, N-алкіл R2/R3: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл R4: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл R5: Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщ. аміно R6: Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщ. аміно Формула II Χ: Ο, S, NH, N-алкіл R1/R2/R3/R4: Η, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл або R2-Z-R3, де Ζ: (СН2)n, n=0-6 R1/R4: Н, -(CH 2)n-COOR8, n=0-6 R5: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл R6: Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщ. аміно R7: Н, алкіл, О-алкіл, S-алкіл, галоген, нітро, ціано, аміно, заміщ. аміно R8: Н, алкіл Загальні формули заявлених сполук похідних гематопорфіринів платини є такими: Формула ІІІ R1/R2/R3/R4: Η, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл або R2-Z-R4, де Ζ: (СН2)n, n=0-6 або R1/R3: Н, -(CH 2)n-COOR6, n=0-6 R4/R5: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл R6: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл R7: Н, алкіл, арил, аралкіл, гетарил, гетарилалкіл, циклоалкіл Якщо сполуки згідно з винаходом мають принаймні один центр асиметрії, вони можуть існувати у формі їх рацематів, їх чисти х енантіомерів та/або їх діастереоізомерів або у формі сумішей цих енантіомерів або діастереоізомерів. Сполуки згідно з винаходом виявляють цитотоксичну активність / вибраних лініях пухлинних клітин. Протипухлинну активність посилюють шляхом опромінення електромагнітними променями, що мають довжину хвилі від 600 до 730нм. Відповідно, винахід стосується хімічної комбінації цитотоксичного принципу платинових сполук цис-платинового типу з фо тодинамічно активною молекулою типу похідної порфірину таким чином, що в результаті одержують сполуки з доброю розчинністю у воді та високою селективністю. Сполуки згідно з винаходом вводять внутрішньоартеріально, інтрацеребрально, внутрішньом'язово, внутрішньоочеревинно, інтратекально, внутрішньовенно, перорально, парентерально, інтраназально, ректально, підшкірно та/або місцево у формі таблеток, вкритих плівкою таблеток, капсул, вкритих таблеток, порошків, гранул, крапель, сиропів, мазей, порошків для інгаляції, інфузійних розчинів, розчинів для пиття або в якійсь іншій придатній формі. Медикаменти включають одну або кілька спо 7 78007 8 лук додатково до традиційних фізіологічно прийнкомплексу додавали СН 2СІ2 для видалення нейтятних носіїв та/або розріджувачів або допоміжних ральних забруднювачів. Водну фаз у випарювали речовин. для одержання продукту. Спосіб одержання медикаменту відрізняється Фрагменти діамін(дихлоро) платини(ІІ) активутим, що одну або кілька сполук обробляють для вали шляхом перетворення на різновиди діаодержання фармацевтичних композицій або примін(дигідрокси)платини(ІІ), які піддавали реакції з водять у придатну для терапевтичного введення еквімолярною кількістю відповідної порфіринмаформу, застосовуючи традиційні фармацевтичні лонової кислоти у суміші СН 2СІ2, етанолу та води носії та/або розріджувачі або інші допоміжні речоабо, у разі водорозчинного ліганду, в чистій воді. вини. Комплекси осаджували. До водорозчинного комОписано синтез сполук згідно з винаходом. плексу додавали СН 2СІ2 для видалення нейтральПохідні тетраарилових порфіринів платини них забруднювачів, перш, ніж водну фазу випарюСинтез заміщених бензальдегідів. Для реакції вали для одержання продукту. з 4-гідрокси-бензальдегідом відповідні оліго- та Для реакції з порфіринмалоновими кислотами поліетиленглікольмонометилові етери мають бути було необхідно активувати комплекси діаактивовані на їх спиртовому кінці тозилхлоридом мін(дийодо) платини(ІІ) шляхом перетворення на згідно з описаною в літературі процедурою. Етерізновиди діамін(динітрато) платини(ІІ), які є водорифікацію здійснювали шляхом дефлегмації тозирозчинними. У цій формі їх піддавали реакції з лованих спиртів та 4-гідроксибензальдегіду разом еквімолярною кількістю порфіринових лігандів у з K2СО3 у DMF. Заміщені бензальдегіди відокремсуміші СН2СІ2, етанолу та води. Нерозчинні у воді лювали шляхом фільтрації й очищали шляхом комплекси осаджували після концентрування розколонкової хроматографії. чинів. Для платинової координації тетраарилпорфіПохідні гематопорфіринів платини ринів, які мають бути синтезовані, необхідно ввесСинтез порфіринових лігандів та платинових ти дві суміжні карбоновокислотні групи в одному з попередників. Гемін переносили до диметилового заміщених бензальдегідів. Таким чином, 4естеру протопорфірину, з якого починали всі нагідроксибензальдегід етерифікували діетиловим ступні реакції. Спочатку диметиловий естер пробромомалонатом у лужних умовах. Діетил 2-(4топорфірину обробляли 30% бромисто-водневою формілфенокси)малонат застосовували разом із кислотою в оцтовій кислоті для одержання нестійзаміщеними бензальдегідами для синтезу асиметкого адукту Марковникова НВr до двох вінілових ричних тетраарилпорфіринів. подвійних зв'язків, який піддавали реакції з різниСинтез порфіринових лігандів. Синтез асиметми типами спиртів для заміщення броміду відповіричних тетраарилпорфіринів здійснювали, застодними алкоксидами. Як спирти авторами було висовуючи спосіб Ліндсі. Пірол та відповідні бензабрано гідрофільні олігота льдегіди піддавали реакції під кислотним поліетиленглікольмонометилові етери. Під час каталізом Льюїса з порфіриногенами, які підкисетерифікації утворений НВr каталізував трансеслювали р-хлоранілом до відповідних порфіринів. терифікацію метилових естерів на естери відповіТетраарилпорфіринові естери очищали шляхом дних спиртів. Етерифіковані гематопорфіринові кількох колонкових хроматографій. Карбонові кисестери очищали шляхом колонкової хроматогралоти, які вимагалися для координації до фрагменфії. Карбонові кислоти, які вимагалися для коортів платини(ІІ), одержували шляхом гідролізу естединації до компонентів платини(ІІ), одержували рів сумішшю СНСІ3 та 20% розчину KОН у шляхом гідролізу естерів 20% розчином KОН у метанолі або лише чистим 20% розчином KОН у метанолі. метанолі. 1,2-діаміноетан, 1,3-діамінопропан, транс-1-2Синтез платинових фрагментів. 1,2діаміноциклогексан та 2,2'-біпіридин отримували з діаміноетан, 1,3-діамінопропан, транс-1,2комерційних джерел і застосовували як ліганди діаміноциклогексан та 2,2'-біпіридин отримували з для одержання відповідних дихлороплатинових (II) комерційних джерел і застосовували як ліганди комплексів згідно з описаними в літературі процедля одержання відповідних дихлороплатинових (II) дурами. Етил DL-2,3комплексів згідно з описаними в літературі процедіамінопропіонатдигідрохлорид, етил L-2,4дурами. Етил DL-2,3діамінобутаноатдигідрохлорид та діетил мезо-,5діамінопропіонатдигідрохлорид, етил L-2,4діаміносубератдигідрохлорид синтезували згідно з діамінобутаноатдигідрохлорид та діетил мезо-4,5описаними в літературі процедурами і застосовудіаміносубератдигідрохлорид синтезували згідно з вали як ліганди для одержання відповідних дийоописаними в літературі процедурами і застосовудоплатинових (II) комплексів. вали як ліганди для одержання відповідних дийоСинтез платинових комплексів. Реакція порфідоплатинових (II) комплексів. ринкарбонових кислот з цисплатином не забезпеСинтез платинових комплексів. Для реакції з чувала потрібні комплекси. Таким чином, цисплапорфіринкарбоновими кислотами цисплатин має тин має бути активований шляхом перетворення бути активований шляхом перетворення на гідрона гідроксид діамін(діаква)платини(ІІ), який піддаксид діамін(діаква)платини(ІІ). Його піддавали реавали реакції з еквімолярною кількістю порфіринокції з еквімолярною кількістю порфіринового ліганвого ліганду в суміші етанолу та води або, у разі ду в суміші СНСІ3, етанолу та води або, у разі водорозчинних лігандів, у чистій воді. Одержані в водорозчинного ліганду, в чистій воді. Одержані в результаті комплекси діамін(дикарбоксилато) пларезультаті діамін(малонато)комплекси платини(ІІ) тини(ІІ) осаджували. До реакційних сумішей водоосаджували. До реакційної суміші водорозчинного розчинних комплексів додавали СН 2СІ2 для вида 9 78007 10 лення нейтральних забруднювачів, перш, ніж вод(±)-транс-1.2-діаміноциклогексан[2-(4{10,15,20ну фазу випарювали для одержання продуктів. трис[4-1,4,7,10-тетраоксаундецил)феніл]порфіринПопередники діамін(дихлоро)платини(ІІ) акти5-іл}фенокси)малонато]платина(ІІ) (№29 на Фіг.1). вували шля хом перетворення на різновиди діа122мг (0,100ммоль) сполуки 2-(4-{10,15,20мін(дигідрокси)платини(ІІ), які піддавали реакції з трис[4-(1,4,7,10еквімолярною кількістю відповідної порфіринкартетраоксаундецил)феніл]порфірин-5бонової кислоти у суміші етанолу та води або, у іл}фенокси)малонової кислоти у 10мл СН 2СІ2 та разі водорозчинних лігандів, у чистій воді. Компле20мл ЕtOН піддавали реакції з 0,100ммоль актикси осаджували. До водорозчинного комплексу вованої (±)-транс-1,2додавали СН 2СІ2 для видалення нейтральних задіаміноциклогексан(дихлоро)платини(ІІ). Вихід: бруднювачів і водну фазу випарювали для одер113мг (73,9мкмоль, 74%) чиста тверда речовина, жання продукту. т. пл. 208°С. Аналіт. (C74H86N6 O17Pt) 1526,6) С, Η, Для реакції з порфіринкарбоновими кислотами Ν. необхідно активувати комплекси діамін(дийодо) Приклад 3 платини(ІІ) шляхом перетворення на різновиди діамін(динітрато) платини(ІІ), які є водорозчинними. У цій формі їх піддавали реакції з еквімолярною кількістю порфіринового ліганду в суміші етанолу та води або, у разі водорозчинного ліганду, в чистій воді. Нерозчинні у воді комплекси осаджували після концентрування розчину. Водорозчинні комплекси виділяли шляхом хроматографії на силікагелі. Приклади втілення Представлені нижче приклади пояснюють виДіамін{7,12-біс[1-(1,4,7-триоксаоктил)етил]нахід більш детально. Сполуки згідно з винаходом 3,8,13,17-тетраметилпорфірин-2,18є похідними тетраарилових порфіринів платини, дипропіонато}платина(ІІ) (№21 на Фіг.2). які охоплюються прикладами 1 та 2, та похідними Сполуку 7,12-біс[1-(1,4,7-триоксаоктил)етил]гематопорфіринів платини, які охоплюються при3,8,13,17-тетраметилпорфірин-2,18-дипропіонову кладами 3, 4 та 5. кислоту (80,3мг, 0,100ммоль) розчиняли у 6мл Приклади: ЕtOН, комбінували з 0,100ммоль водного розчину Приклад 1 гідроксиду діамін(діаква)платини(ІІ) і перемішували протягом 20год. Вихід: 23,0мг (22,3мкмоль, 22%) темно-бурий порошок, т. пл. >250°С. Аналіт. (C44H62N6 O10R, 1030.1). С: розрах. 51,30; виявлено 50,75. Н: розрах. 6,07; виявлено 5,49. N Приклад 4 Діамін[2-(4-{10,15,20-трис[4-(1,4,7триоксаоктил)феніл]порфірин-5іл}фенокси)малонато]платина(ІІ) (№21 на Фіг.1) Сполуку 2-(4-{10,15,20-трис[4-(1,4,7триоксаоктил)феніл]порфірин-5іл}фенокси)малонову кислоту (109мг, 0,100ммоль) розчиняли у 10мл СНСІ3 та 20мл ЕtOН, комбінували з 0,100ммоль водного розчину гідроксиду діамін(діаква)платина(ІІ) і перемішували протягом 20год. Вихід: 81,0мг (54,2мкмоль, 54%) чистий порошок, т. пл. 213-214°С. Аналіт. (C62H66N6 O14R×10Н2O,1494,5) С: розрах. 49,83; виявлено 49,19. Η, Ν: розрах. 5,62; виявлено 6,09. Приклад 2 (±)-транс-1,2-діаміноциклогексан{7,12-біс[1(1,4,7,10,13,16-гексаоксагептадецил)етил]3,8,13,17-тетраметилпорфірин-2,18дипропіонато}платина(ІІ) (№38 на Фіг.2). Сполуку 7,12-біс[1,4,7,10,13,16гексаоксагептадецил)етил]-3,8,13,17тетраметилпорфірин-2,18-дипропіонову кислоту (107мг, 0,100ммоль) у 10мл ЕtOН обробляли 0,100ммоль активованої (±)-транс-1,2діаміноциклогексан(дихлоро)платини(ІІ). Вихід: 25,5мг (17,2мкмоль, 17%) червонобурий порошок, т. пл. 245°С. Аналіт. (C62H94N6 O16Pt·6Н2О, 1482,6). С: розрах. 50,23; виявлено 49,02. Н: розрах. 7,21; виявлено 6,33. N: розрах. 5,67; виявлено 6,41. 11 78007 Приклад 5 2,2'-біпіридил{7,12-біс[1-(1,4,7триоксаоктил)етил]-3,8,13,17тетраметилпорфірин-2,18дипропіонато}платина(ІІ) (№40а на Фіг.2). 42,2мг (0,100ммоль) сполуки 2,2'біпіридил(дихлоро)платини(Іl) суспендували у 15мл Н2О. Після 10хв. ультразвукової обробки додавали 34,0мг (0,200ммоль) AgNO3 і суміш перемішували протягом 4год. у темноті при кімнатній температурі. Осаджений АgСl відфільтровували і промивали водою. Фільтрат, який містив активований платиновий(ІІ) комплекс, випарювали. Залишок розчиняли у 5мл Н2О і комбінували з розчином 80,3мг (0,100ммоль) 7,12-біс[1-(1,4,7триоксаоктил)етил]-3,8,13,17тетраметилпорфірин-2,18-дипропіонової кислоти у 10мл ЕtOН. Після перемішування протягом 20год. при 50°С та охолодження до кімнатної температури осаджену тверду речовину фільтрували, промивали водою та ЕtOН і висушували in vacuo. Вихід: 64,0мг (55,5мкмоль, 55%) темного чистого порошку, т. пл. >250°С. Аналіт. (C54H64N6 O10Pt, 1152,2) С, Η, N. Біологічні дані. Дані щодо цитотоксичного впливу отримували, наприклад, на лініях пухлинних клітин людини TCC-SUP та J82. Вплив сполук досліджували в темноті та під опроміненням світлом з довжиною хвилі 600-730нм. Вибрані сполуки явно мають більшу цитотоксичну активність під опроміненням. Існує синергізм між цитотоксичним впливом платинового компонента та фотодинамічним принципом. Лінії клітин та загальні процедури. Для визначення антипроліферативної активності нових порфіринових лігандів та відповідних платинових комплексів з різними амінними невідщеплюваними групами було вибрано дві лінії клітин раку сечового міхура TCC-SUP та J82 як in vitro моделі. Для розрізнення між цитотоксичним та фототоксичним впливом усі експерименти здійснювали двічі. Клітини висівали у мікротитрувальні планшети і через 48год додавали випробувані сполуки. Одну партію мікротитрувальних планшетів тримали в темноті до завершення експерименту, а інші мікротитрувальні планшети опромінювали через 48год. після додавання речовин протягом 10хв. порцією світла 24 J×cм -2 до реінкубації планшетів у темноті. Аналіз кінцевих результатів хімічної чутливості. 12 Похідні гематопорфіринів платини. При дозі 1мкМ токсичність порфіринплатинових кон'югатів зазнає впливу типу невідщеплюваної групи як у темноті, так і під опроміненням. Платинові комплекси з 2,2'-біпіридиловим (40, 41), етил DL-2,3-діамінопропіонатним (42-46), етил DL-2,3-діамінобутаноатним (47-51), діетил мезо-4,5-діаміносубератним (52-55) лігандами були неактивними при концентрації 1мкМ, як у темноті, так і після опромінення. Сполуки, які мають 1,2-діаміноетанову (27-30) та 1,2-діамінопропанову (31-34) невідщеплювані групи, також були неактивними на клітинах TCC-SUP. Найбільш цікавими порфірин-платиновими кон'югатами були ті, що містять діамінові (21-26) та (±)-транс-1,2діаміноциклогексанові (35-39) ліганди. У цих серіях сполук водорозчинні комплекси 26 та 39 були найбільш активними при Т/С corr. близько 30% та 15% відповідно. При концентрації 1мкМ контрольний цисплатин мав значення Τ/Ccorr. приблизно 2%. У цій дозі не було статистично значущого підвищення цитотоксичності через опромінення клітин раку сечового міхура. Підвищення концентрації комплексів 40-55 до 5мкМ не давало або давало лише незначне збільшення токсичності в темноті (Фіг.2). Для більшості цих комплексів фототоксичність є не набагато вищою, нiж цитотоксичність, яку спостерігали без опромінення. Однак, для 42, 45, 47, 49, 50 та 53 спостерігали помітний вплив, а для 40 та 44 - дуже значний вплив на проліферацію клітин TCC-SUP після опромінення (Фіг.2). Найвищий синергізм заявляли для сполуки 52, в результаті чого відбувався лізис пухлинних клітин. Крім цисплатину, найбільшу протипухлинну активність вимірювали у серії діамінних (21-26) та (±)-транс-1,2-діаміноциклогексанових (35-39) невідщеплюваних гр уп, які мають порфірин-платинові кон'югати. Розбіжності між токсичністю в темноті та під опроміненням були найбільшими для водорозчинних порфірин-платинових комплексів 26 та 39 з довжиною бокового ланцюга n=17 у позиції 7 та 12 порфіринової відщеплюваної групи. Усі етилендіамінові та пропілендіамінові комплекси 27-34 виявляли помітну викликану світлом токсичність (Фіг.2). Похідні тетраарилових порфіринів платини. При дозах 1мкМ та 5мкМ токсичність тетраарилпорфірин-платинових кон'югатів 21-38 зазнавала значного впливу типу невідщеплюваної групи як у темноті, так і під опроміненням, і результати узгоджувалися з результатами для гематопорфірин-платинових комплексів, які обговорювалися вище. 23, 29 та 30 були найбільш активними тетраарилпорфірин-платиновими кон'югатами зі значеннями Т/Ссоrr. приблизно 37%, 57% та 63% відповідно при концентрації 1мкМ. Ці показники є аналогічними показникам гематопорфіринплатинових комплексів, найбільш активними з яких були ті, що мають діамінні або (±)-транс-1,2діаміноциклогексанові невідщеплювані групи. При концентрації 1мкМ спостерігали лише незначне підвищення цитотоксичності тетраарилпорфіринплатинових кон'югатів з довжиною бокового ланцюга n=2 та n=3 після опромінення. В середньому викликані світлом значення Т/С corr. були приблизно 13 78007 14 на 20% нижчими, ніж показники цитотоксичності в діамінні (21-23) та (±)-транс-1,2темноті (дані не показано). діаміноциклогексанові (28-30) невідщеплювані Збільшення концентрації комплексів до 5мкМ групи. Розбіжності між токсичністю в темноті та збільшувало вплив у темноті та фототоксичність, викликаною світлом найбільшими були для тетраяк показано на Фіг.1. Крім цисплатину, найвищу арилпорфірин-платинових комплексів 24, 27, 32протипухлинну активність вимірювали для тетраа34, 36 та 38 з довжиною бокового ланцюга n=2 або рилпорфірин-платинових кон'югатів, які мають n=3 (Фіг.1). 15 Комп’ютерна в ерстка Т.Чепелева 78007 Підписне 16 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюWater-soluble porphyrin platinuim compounds with high tumor selectivity and their use for the treatment of benign and malignant tumor diseases
Назва патенту російськоюВодорастворимые порфиринплатиновые соединения с высокой селективностью к опухолям и их применение для лечения доброкачественных и злокачественных опухолевых заболеваний
МПК / Мітки
МПК: C07D 213/22, A61K 31/713, C07F 15/00, C08G 65/00, A61K 41/00, C07D 487/22, A61P 35/00
Мітки: злоякісних, порфіринплатинові, пухлин, сполуки, пухлинних, лікування, високою, застосування, водорозчинні, доброякісних, захворювань, селективністю
Код посилання
<a href="https://ua.patents.su/8-78007-vodorozchinni-porfirinplatinovi-spoluki-z-visokoyu-selektivnistyu-do-pukhlin-ta-kh-zastosuvannya-dlya-likuvannya-dobroyakisnikh-ta-zloyakisnikh-pukhlinnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Водорозчинні порфіринплатинові сполуки з високою селективністю до пухлин та їх застосування для лікування доброякісних та злоякісних пухлинних захворювань</a>
Попередній патент: Спосіб дегазації газоносних вугільних пластів
Наступний патент: Спосіб моделювання пластичних властивостей гірської породи та пристрій для його здійснення
Випадковий патент: Спосіб виготовлення біметаличних відливок












