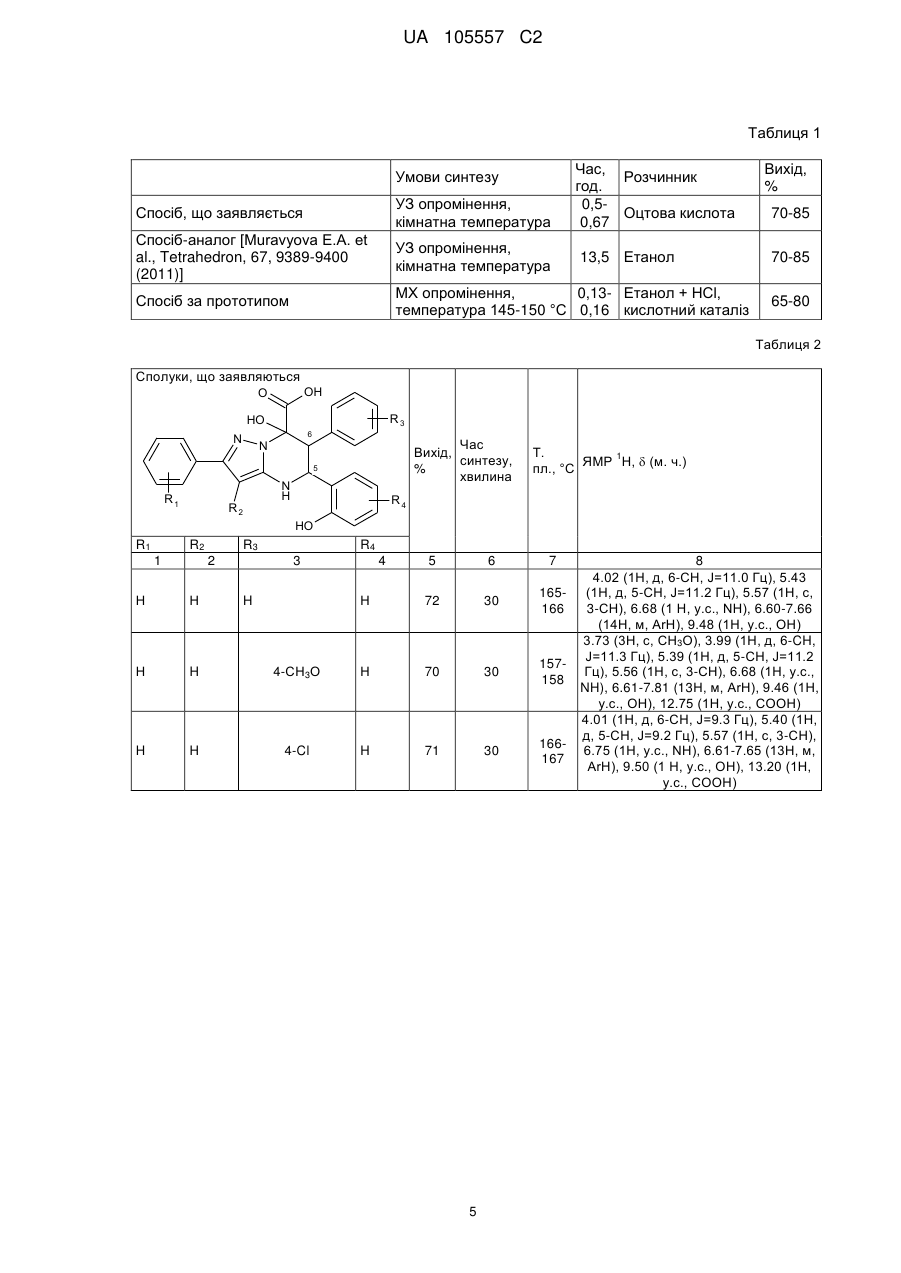
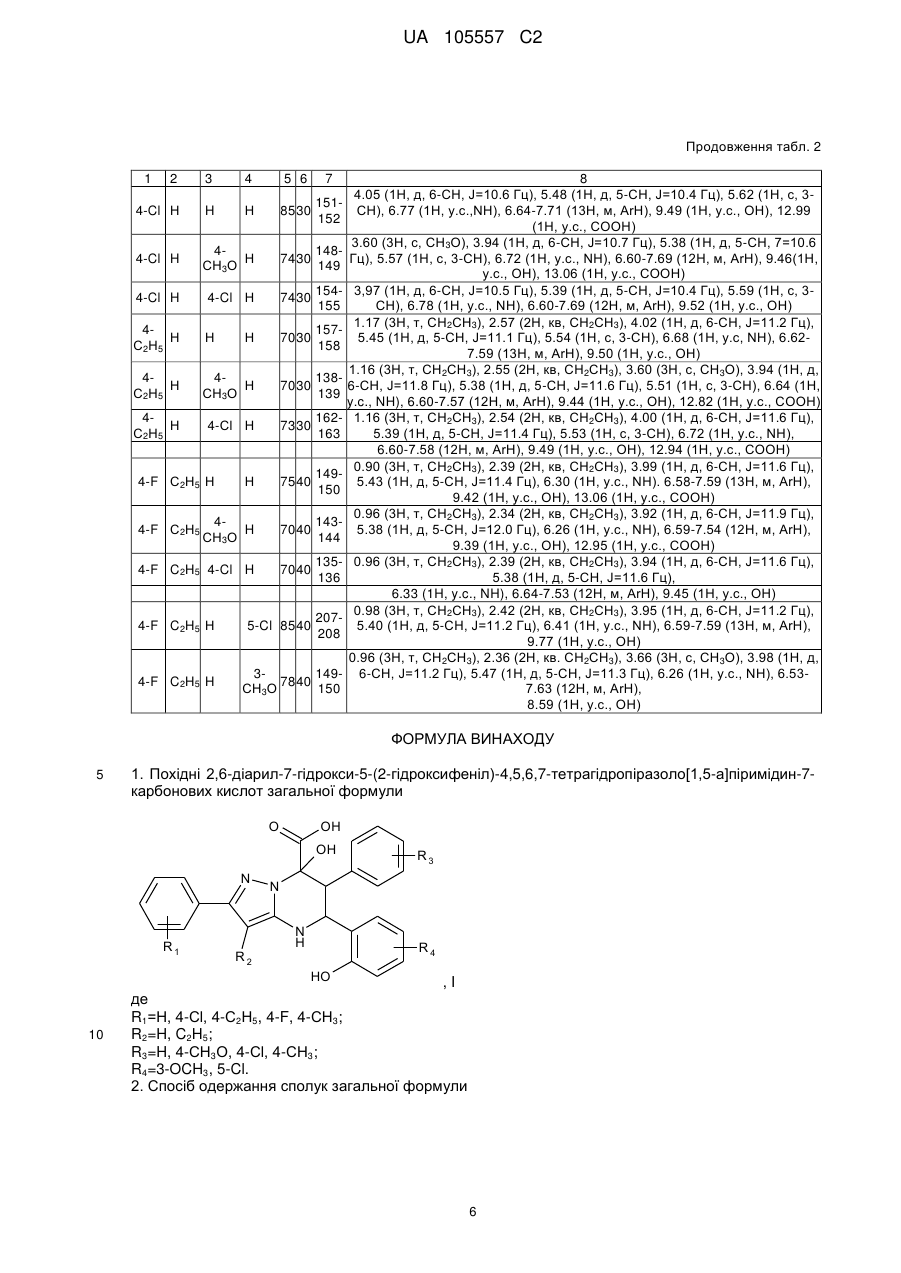
Похідні 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонової кислоти та спосіб їх одержання
Номер патенту: 105557
Опубліковано: 26.05.2014
Автори: Десенко Сергій Михайлович, Сахно Яна Ігорівна, Афанасіаді Людмила Михайлівна, Чебанов Валентин Анатолійович, Мурликіна Марина Володимирівна
Формула / Реферат
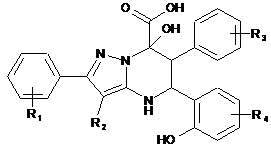
1. Похідні 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонових кислот загальної формули
 , I
, I
де
R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3;
R2=H, C2H5;
R3=H, 4-СН3О, 4-Сl, 4-СН3;
R4=3-OCH3, 5-Cl.
2. Спосіб одержання сполук загальної формули
 , I
, I
де
R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3;
R2=H, C2H5;
R3=H, 4-СН3О, 4-Сl, 4-СН3;
R4=3-OCH3, 5-Cl;
що включає конденсацію рівномолярних кількостей 5-аміноазолу, заміщених арилпіровиноградних кислот і ароматичного альдегіду в органічному розчиннику, який відрізняється тим, що як 5-аміноазол використовують заміщені 5-амінопіразолу формули, як ароматичний альдегід - заміщені 2-гідроксибензальдегіду формули
 ,
,
як органічний розчинник - оцтову кислоту; конденсацію проводять при кімнатній температурі в умовах ультразвукового опромінення протягом 30-40 хвилин.
Текст
Реферат: Пропонуються похідні 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбонових кислот загальної формули OH O OH N R1 R2 N N H R4 HO де R3 ,I UA 105557 C2 (12) UA 105557 C2 R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Сl, 4-СН3; R4=3-OCH3, 5-Cl; і спосіб їх одержання, який полягає у тому, що проводять конденсацію відповідних заміщених 5амінопіразолу, арилпіровиноградних кислот і заміщених 2-гідроксибензальдегіду в оцтовій кислоті при кімнатній температурі в умовах ультразвукового опромінення протягом 30-40 хвилин; одержану реакційну масу відфільтровують і сушать у вакуумі. Технічне рішення забезпечує створення широкого асортименту азолопіримідинкарбонових кислот для медицини, біології і фармації. UA 105557 C2 Винахід стосується області хімії і являє собою нові похідні формули І: OH O OH N R1 R3 N N H R2 R4 HO 5 10 15 20 25 ,I де R1=Н, 4-Cl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Cl, 4-СН3; R4=3-OCH3, 5-Cl. Сполуки, що заявляються, - складні азотовмісні гетероциклічні системи з фармакофорними фрагментами, що обумовлює перспективність пошуку у цій низці речовин з різним видами фізіологічної активності. Сполуки формули I мають високу реакційну здатність до хімічних реакцій. Завдяки наявності вільної карбоксильної групи вони необхідні при рішенні низки практичних задач у препаративному органічному синтезі, а саме у синтезі хлорангідридів, амідів, ефірів. о-Гідроксигрупа в арильному радикалі сприяє утворенню внутрішньомолекулярного Н-зв'язку з аміногрупою піримідинового фрагмента, в певних умовах можлива циклізація за цим зв'язком. Крім того, вільна карбоксильна і гідроксигрупи передбачають можливість утворення водорозчинних солей. Все це розширює можливість використання сполук формули І як проміжних продуктів (інтермедіатів, білдінг-блоків) у препаративному синтезі, в тому числі і в області комбінаторної хімії. Похідні азолопіримідинів є основною субстанцією багатьох лікарських препаратів для лікування серцево-судинної системи, ангіни, вони проявляють гіпнотичну і антиалергійну [Baziard-Mongsset G. et al., Eur. J. Med. Chem., 30, № 3, 253 (1995)]; протиракову [G. Atwell et al., J. Med. Chem., 32, 396 (1989)]; антибактеріальну [D. Bhatt et al., J. Indian Chem. Soc, 61, 816 (1984)]; протигрибкову [J. Bergman et al., Tetrahedron, 46, 1295 (1990)]; аналгетичну активності [А. Милютин и др., Хим.-фарм. ж., 32, 24 (1998)]. Відомий структурний аналог сполук, що заявляються,-7-гідрокси-7-метил-N,5-діарил-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-6-карбоксаміди формули II: HO N CONHR1 N R3 R2 R 30 35 , II де R=СН3, С6Н5, 4-ClС6Н4 і ін.; R1=4-СН3ОС6Н4, 2-СН3ОС6Н4; R2=С6Н5, 4-ClС6Н4, 4-Вr6Н4 і ін.; R3=Н, 4-СlС6Н4; і спосіб його одержання [Е.A. Muravyova et al., Tetrahedron, 67, 9389-9400 (2011)]. Спосіб одержання відомої сполуки формули II здійснюється за схемою: HO N O NH NH2 R3 + O N H R1 + R2 N CONHR1 R3 C H R 40 N O R2 R . II Суміш рівномолярних кількостей аміноазолу, ацетоацетамідів і ароматичних альдегідів в 10 мл етанолу конденсують при кімнатній температурі при ультразвуковому опроміненні протягом 90 хвилин. Реакційну суміш видержують при кімнатній температурі 12 годин і відфільтровують, продукт сушать у повітрі. Одержують безкольорові речовини з виходами 70-85 %. Загальний час 1 UA 105557 C2 5 проведення реакції складає приблизно 13,5 годин. За цей час реакція проходить повністю і автори одержують чисті продукти. Недоліком відомого способу одержання сполук формули II є тривалість технологічного процесу. Відомий структурний аналог сполук, що заявляються, - заміщені 7-гідрокси-5,6-діарил4,5,6,7-тетрагідропіразоло[1,5-a]піримідин-7-карбонові кислоти формули III: O HO OH N Ar2 N X N 10 15 N H Ar1 , III де X=CH, N; Аr1=С6Н5і 4-СlС6Н4, і ін. Ar2=С6Н5, 4-СН3С6Н4 і ін. і спосіб його одержання [Пат. України № 88504, С07D 487/04]. Недоліком структури сполук формули III є те, що можливість хімічної модифікації молекули обмежена тільки введенням функціональних груп в замісниках Ar 1 і Аr2 піримідинового циклу. В азольному фрагменті всі положення зайняті атомами азоту (тетразол) або метиновою групою (триазол), що унеможливлює хімічну модифікацію. Це зменшує одержання великої кількості потенційних біологічно активних речовин. Спосіб одержання сполук формули III - багатокомпонентний, одностадійний і здійснюється за схемою: O HO N O NH X N NH2 + Ar1 OH O H + Ar 2 OH N EtOH HCl 25 30 35 N N H Ar1 . III Синтез проходить в умовах кислотного каталізу і полягає в тому, що проводять конденсацію рівномолярних кількостей 5-аміно-1,2,4-триазолу або 5-амінотетразолу з відповідними ароматичними альдегідами і заміщеними арилпіровиноградної кислоти в етиловому спирті в присутності каталітичних кількостей (0,1 мл) НCl при мікрохвильовому опроміненні при температурі 145-150 °C протягом 8-10 хвилин. Вихід готового продукту складає 65-80 %. Недоліком відомого способу одержання сполук формули III є проведення реакції при нагріванні при високій температурі в присутності каталізатора. Без каталізатора реакція зовсім не проходить. Крім того, до недоліків способу одержання сполук формули III слід віднести використання аміноазолів складної структури, що мають три або чотири атоми азоту у молекулі. Сполуки формули III і спосіб їх одержання вибрано нами як прототип. В основу винаходу поставлено задачу пошуку нових сполук у низці азолопіримідинів, а також розробки простого і доступного способу одержання похідних 2,6-діарил-7-гідрокси-5-(2гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонових кислот з високими виходами. Рішення поставленої задачі забезпечується розробкою заміщених похідних 2,6-діарил-7гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонових кислот загальної формули І: OH O OH N R1 40 Ar2 X O 20 N R2 R3 N N H R4 HO ,I де R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Сl, 4-СН3; R4=3-OCH3, 5-Cl. Рішення поставленої задачі забезпечується також тим, що у способі одержання сполук загальної формули І: 2 UA 105557 C2 OH O OH N R1 R2 R3 N N H R4 HO 5 10 ,I де R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Сl, 4-СН3; R4=3-OCH3, 5-Cl; що включає конденсацію рівномолярних кількостей 5-аміноазолу, заміщених арилпіровиноградних кислот і ароматичного альдегіду в органічному розчиннику, згідно винаходу, як 5-аміноазол використовують заміщені 5-амінопіразолу формули , як ароматичний альдегід - заміщені 2-гідроксибензальдегіду формули O R4 OH 15 20 25 30 35 40 , як органічний розчинник - оцтову кислоту, конденсацію проводять при кімнатній температурі в умовах ультразвукового опромінення протягом 30-40 хвилин. Вибір розчинника - оцтової кислоти - для проведення реакції взаємодії всіх компонентів в умовах ультразвукового опромінення (у способі-прототипі етанол + кислотний каталізатор НCl) дозволяє не застосовувати каталізатор і проводити синтез при кімнатній температурі (у способіпрототипі - 145-150 °C). Модифікація структури сполук, що заявляються, за рахунок використання заміщених 5амінопіразолу і ароматичних альдегідів - заміщених 2-гідроксибензальдегіду - приводить до появи нової структури сполук формули І. Взаємодія заміщених 5-амінопіразолу з заміщеними арилпіровиноградними кислотами і заміщеними 2-гідроксибензальдегіду дозволяє одержувати циклічні продукти - похідні 2,6діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонових кислот, які потім легко трансформуються в нові циклічні або водорозчинні сполуки, що розширює кількість потенційних біологічно активних речовин. Експериментальним шляхом було установлено час протікання реакції - 30-40 хвилин. Для утворення цільових продуктів цього часу достатньо, тому збільшення часу реакції недоцільно, а зменшення часу приводить до значного зниження виходів сполук формули І. Використання будь-кого із компонентів реакції в інших співвідношеннях, ніж рівномолярні, приводить до утворення суміші відповідних вихідних і кінцевих продуктів реакції. Проведення реакції при кімнатній температурі виключає утворення будь-яких побічних продуктів або продуктів розпаду вихідних речовин. Реакція утворення нових азолопіримідинкарбонових кислот при кімнатній температурі в умовах ультразвукового опромінення екологічно чиста; оцтова кислота, що залишилася після проведення синтезу, утилізується розбавленням великою кількістю води. В таблиці 1 наведено характеристики способу, що заявляється, в порівнянні зі способамианалогами. В таблиці 2 дано характеристики сполук, що заявляються. Спосіб, що заявляється, здійснюється в одну стадію за схемою: 3 UA 105557 C2 R1 OH R2 + N N H NH2 R3 OH O OH O O N O + R4 OH R1 R2 N N H R4 HO 5 10 15 20 25 30 35 40 45 50 R3 .I Суміш, що складається із рівномолярних кількостей заміщеного 5-амінопіразолу, відповідного заміщеного арилпіровиноградної кислоти і заміщеного 2-гідроксибензальдегіду в оцтовій кислоті піддають дії ультразвукового опромінення при кімнатній температурі упродовж 30-40 хвилин. Осад, що утворився, відфільтровують і сушать у вакуумі, що забезпечує постійну температуру сушіння і відсутність вологи. Процес сушіння проходить значно скоріше, не залежить від температури і вологості навколишнього середовища (у способі-прототипі сушіння у повітрі). Кінцеві продукти чисті і не потребують перекристалізації. Приклад 1. Одержання 2,6-дифеніл-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7тетрагідропіразоло[1,5-а]піримідин-7-карбонової кислоти. 5-Аміно-3-фенілпіразол (0,095 г; 0,6 ммоль) розчиняють у 2,5 мл оцтової кислоти, додають 2-гідроксибензальдегід (0,06 мл; 0,6 ммоль) і фенілпіровиноградну кислоту (0,1 г; 0,6 ммоль). Суміш поміщають в ультразвукову баню на 30 хвилин. Осад, що випадає, відфільтровують, сушать у вакуумі. Осад являє собою білу кристалічну речовину. Вихід складає 0,19 г (72 %). Т. пл. - 165-166 °C. Елементний аналіз - знайдено %: N - 9.87, обчислено %: N - 9.83. Структуру 2,6-дифеніл-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5a]піримідин-7-карбонової кислоти підтверджено також спектральними даними. Спектри 1 ядерного магнітного резонансу (ЯМР Н ) виміряно на спектрометрі VARIAN Mercury VX-200 (200 МГц) у розчинах дейтеродиметилсульфоксиду (DMSO-d6), внутрішній стандарт тетраметилсилан; (м. ч.) 4.02 (1Н, д, 6-СН, J=11.0 Гц), 5.43 (1Н, д, 5-СН, J=11.2 Гц), 5.57 (1Н, с, 3-СН), 6.68 (1Н, у.с., NH), 6.60-7.66 (14Н, м, АrН), 9.48 (1Н, у.с., ОН). Приклад 2. Одержання 7-гідрокси-5-(2-гідроксифеніл)-2-(4-фторфеніл)-6-феніл-3-етил4,5,6,7-тетрагідропіразоло[1,5-a]піримідин-7-карбонової кислоти. 5-Аміно-3-(4-фторфеніл)-4-етилпіразол (0,15 г; 0,73 ммоль) розчиняють у 2,5 мл оцтової кислоти, додають 2-гідроксибензальдегід (0,08 мл; 0,73 ммоль) і фенілпіровиноградну кислоту (0,12 г; 0,73 ммоль). Суміш поміщають в ультразвукову баню на 40 хвилин. Осад, що випадає, відфільтровують, сушать у вакуумі. Осад являє собою білу кристалічну речовину. Вихід складає 0,26 г (75 %). Т. пл. 149-150 °C. Елементний аналіз - знайдено %: N - 8.85, обчислено %: N - 8.87. 1 Спектр ЯМР Н, (м. ч.) 0.98 (3Н, т, СН2СН3), 2.39 (2Н, кв, СH2СН3), 3.99 (1Н, д, 6-СН, J=11.6 Гц), 5.43 (1Н, д, 5-СН, J=11.4 Гц), 6.30 (1H, у.с., NH), 6.58-7.59 (13Н, м, АrН), 9-42 (1Н, у.с., ОН), 13.06 (1H, у.с., СООН). Решту прикладів зведено у таблицю 2. Як видно із опису матеріалів заявки і даних таблиць 1 і 2, технічне рішення, що пропонується, у порівнянні з прототипом має такі переваги: - структура, що заявляється, більш рухлива і забезпечує більш широкий асортимент піразолопіримідинкарбонових кислот завдяки варіації замісників в усіх фрагментах молекули (у структурі прототипу тільки модифікація піримідинової складової); - структура, що заявляється, дозволяє легко трансформуватися в сполуки більш складної будови з новими властивостями. Спосіб одержання сполук формули І, що пропонується, дозволяє: - проводити реакцію утворення сполук формули І при кімнатній температурі; - виключити кислотний каталіз; - широко варіювати у молекулі у молекулі R1, R2, R3, R4 замісники; - збільшити виходи сполук формули І за рахунок проведення реакції в оцтовій кислоті. Всі ці переваги нових сполук і способу їх одержання розширюють можливості їх потенційного застосування у медицині, біології і фармації. Спосіб одержання сполук формули І простий, доступний в лабораторних умовах при наявності ультразвукового обладнання. 4 UA 105557 C2 Таблиця 1 Умови синтезу Час, Розчинник год. 0,5Оцтова кислота 0,67 Спосіб, що заявляється УЗ опромінення, кімнатна температура Спосіб-аналог [Muravyova Е.A. et al., Tetrahedron, 67, 9389-9400 (2011)] УЗ опромінення, кімнатна температура Спосіб за прототипом MX опромінення, 0,13- Етанол + HCl, температура 145-150 °C 0,16 кислотний каталіз 13,5 Етанол Вихід, % 70-85 70-85 65-80 Таблиця 2 Сполуки, що заявляються OH O R3 HO 6 N Час Вихід, синтезу, % хвилина N 5 R1 R2 N H Т. 1 ЯМР Н, (м. ч.) пл., °C R4 HO R1 R2 1 R3 2 R4 3 4 5 6 7 Н 72 30 165166 Н Н Н H 4-СН3О Н 70 30 157158 H H 4-Cl H 71 30 166167 H 5 8 4.02 (1Н, д, 6-СН, J=11.0 Гц), 5.43 (1H, д, 5-СН, J=11.2 Гц), 5.57 (1H, с, 3-СН), 6.68 (1 Н, у.с., NH), 6.60-7.66 (14Н, м, АrН), 9.48 (1Н, у.с., ОН) 3.73 (3Н, с, СН3О), 3.99 (1Н, д, 6-CH, J=11.3 Гц), 5.39 (1Н, д, 5-СН, J=11.2 Гц), 5.56 (1Н, с, 3-СН), 6.68 (1Н, у.с., NH), 6.61-7.81 (13Н, м, АrН), 9.46 (1H, у.с., ОН), 12.75 (1Н, у.с., СООН) 4.01 (1Н, д, 6-CH, J=9.3 Гц), 5.40 (1Н, д, 5-СН, J=9.2 Гц), 5.57 (1H, с, 3-СН), 6.75 (1Н, у.с., NH), 6.61-7.65 (13Н, м, АrН), 9.50 (1 Н, у.с., ОН), 13.20 (1H, у.с., СООН) UA 105557 C2 Продовження табл. 2 1 2 3 4 5 6 7 4-Cl Н H Н 85 30 151152 4-Cl H 4Н СН3О 74 30 148149 4-Cl H 4-Cl Н 74 30 154155 4Н С2Н5 Н Н 70 30 157158 4Н С2Н5 4Н СН3О 70 30 138139 4Н С2Н5 4-Сl Н 73 30 162163 Н 75 40 149150 4H СН3О 70 40 143144 4-F C2H5 4-Cl H 70 40 135136 5-Cl 85 40 207208 4-F С2Н5 Н 4-F С2Н5 4-F C2H5 Н 4-F C2H5 H 314978 40 СН3О 150 8 4.05 (1H, д, 6-CH, J=10.6 Гц), 5.48 (1Н, д, 5-СН, J=10.4 Гц), 5.62 (1H, с, 3СН), 6.77 (1H, y.c.,NH), 6.64-7.71 (13Н, м, АrН), 9.49 (1Н, у.с., ОН), 12.99 (1Н, у.с., СООН) 3.60 (3Н, с, СН3О), 3.94 (1Н, д, 6-CH, J=10.7 Гц), 5.38 (1Н, д, 5-СН, 7=10.6 Гц), 5.57 (1H, с, 3-СН), 6.72 (1Н, y.c., NH), 6.60-7.69 (12Н, м, АrН), 9.46(1Н, у.с., ОН), 13.06 (1Н, у.с., СООН) 3,97 (1H, д, 6-СН, J=10.5 Гц), 5.39 (1Н, д, 5-СН, J=10.4 Гц), 5.59 (1Н, с, 3СН), 6.78 (1Н, y.c., NH), 6.60-7.69 (12Н, м, АrН), 9.52 (1H, у.с., ОН) 1.17 (3Н, т, СН2СН3), 2.57 (2Н, кв, СН2СН3), 4.02 (1H, д, 6-CH, J=11.2 Гц), 5.45 (1Н, д, 5-СН, J=11.1 Гц), 5.54 (1H, с, 3-СН), 6.68 (1H, y.c, NH), 6.627.59 (13Н, м, АrН), 9.50 (1H, у.с., ОН) 1.16 (3Н, т, СН2СН3), 2.55 (2Н, кв, СН2СH3), 3.60 (3Н, с, СH3О), 3.94 (1Н, д, 6-СН, J=11.8 Гц), 5.38 (1Н, д, 5-СН, J=11.6 Гц), 5.51 (1Н, с, 3-СН), 6.64 (1H, y.c., NH), 6.60-7.57 (12Н, м, АrН), 9.44 (1Н, у.с., ОН), 12.82 (1Н, у.с., СООН) 1.16 (3Н, т, СН2СН3), 2.54 (2Н, кв, СН2СН3), 4.00 (1Н, д, 6-СН, J=11.6 Гц), 5.39 (1Н, д, 5-СН, J=11.4 Гц), 5.53 (1H, с, 3-СН), 6.72 (1H, у.с., NH), 6.60-7.58 (12Н, м, АrН), 9.49 (1Н, у.с., ОН), 12.94 (1Н, у.с., СООН) 0.90 (3Н, т, СН2СН3), 2.39 (2Н, кв, СН2СН3), 3.99 (1Н, д, 6-СН, J=11.6 Гц), 5.43 (1H, д, 5-СН, J=11.4 Гц), 6.30 (1H, у.с., NH). 6.58-7.59 (13Н, м, АrН), 9.42 (1H, у.с., ОН), 13.06 (1Н, у.с., СООН) 0.96 (3Н, т, СН2СН3), 2.34 (2Н, кв, СН2СН3), 3.92 (1Н, д, 6-CH, J=11.9 Гц), 5.38 (1Н, д, 5-СН, J=12.0 Гц), 6.26 (1Н, у.с., NH), 6.59-7.54 (12Н, м, АrН), 9.39 (1Н, у.с., ОН), 12.95 (1Н, у.с., СООН) 0.96 (3Н, т, СН2СН3), 2.39 (2Н, кв, СН2СН3), 3.94 (1Н, д, 6-СН, J=11.6 Гц), 5.38 (1H, д, 5-СН, J=11.6 Гц), 6.33 (1H, y.c., NH), 6.64-7.53 (12Н, м, АrН), 9.45 (1Н, у.с., ОН) 0.98 (3Н, т, СН2СН3), 2.42 (2Н, кв, СН2СН3), 3.95 (1Н, д, 6-СН, J=11.2 Гц), 5.40 (1Н, д, 5-СН, J=11.2 Гц), 6.41 (1Н, y.c., NH), 6.59-7.59 (13Н, м, АrН), 9.77 (1Н, у.с., ОН) 0.96 (3Н, т, СН2СН3), 2.36 (2Н, кв. СН2СH3), 3.66 (3Н, с, СН3О), 3.98 (1H, д, 6-СН, J=11.2 Гц), 5.47 (1Н, д, 5-СН, J=11.3 Гц), 6.26 (1H, y.c., NH), 6.537.63 (12Н, м, АrН), 8.59 (1Н, у.с., ОН) ФОРМУЛА ВИНАХОДУ 5 1. Похідні 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7карбонових кислот загальної формули OH O OH N R1 R2 R3 N N H R4 HO 10 ,I де R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Сl, 4-СН3; R4=3-OCH3, 5-Cl. 2. Спосіб одержання сполук загальної формули 6 UA 105557 C2 OH O OH N R1 N N H R2 R4 HO 5 10 R3 ,I де R1=Н, 4-Сl, 4-С2Н5, 4-F, 4-СН3; R2=H, C2H5; R3=H, 4-СН3О, 4-Сl, 4-СН3; R4=3-OCH3, 5-Cl; що включає конденсацію рівномолярних кількостей 5-аміноазолу, заміщених арилпіровиноградних кислот і ароматичного альдегіду в органічному розчиннику, який відрізняється тим, що як 5-аміноазол використовують заміщені 5-амінопіразолу формули, як ароматичний альдегід - заміщені 2-гідроксибензальдегіду формули O R4 OH , як органічний розчинник - оцтову кислоту; конденсацію проводять при кімнатній температурі в умовах ультразвукового опромінення протягом 30-40 хвилин. Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюSakhno Yana Ihorivna, Murlykina Maryna Volodymyrivna, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Автори російськоюСахно Яна Игоревна, Мурлыкина Марина Владимировна, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 487/04
Мітки: похідні, спосіб, одержання, 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонової, кислоти
Код посилання
<a href="https://ua.patents.su/9-105557-pokhidni-26-diaril-7-gidroksi-5-2-gidroksifenil-4567-tetragidropirazolo15-apirimidin-7-karbonovo-kisloti-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 2,6-діарил-7-гідрокси-5-(2-гідроксифеніл)-4,5,6,7-тетрагідропіразоло[1,5-а]піримідин-7-карбонової кислоти та спосіб їх одержання</a>
Попередній патент: Комбінація сполук, що містить інгібітори віл інтегрази з іншими терапевтичними агентами
Наступний патент: Спосіб відводу інформації із оптичної телекомунікаційної лінії зв’язку
Випадковий патент: Спосіб безперервної прокатки дроту