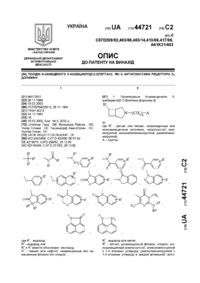
Похідні n-заміщеного 3-азабіцикло[3.2.0]гептану, які є антагоністами рецептора d4 допаміну
Номер патенту: 44721
Опубліковано: 15.03.2002
Автори: Муншауер Райнер, Штайнер Герд, Тешендорф Ханс-Юрген, УНГЕР Ліліане, Хьогер Томас
Формула / Реферат
1. Производные N-замещенного 3-азабицикло[3.2.0]гептана формулы (I):
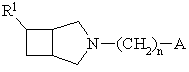 ,
,
(I)
где R1 - фенил или тиенил, незамещенные или монозамещенные галогеном, нитрогруппой, аминогруппой, монометиламиногруппой, диметиламиногруппой,
A – группы
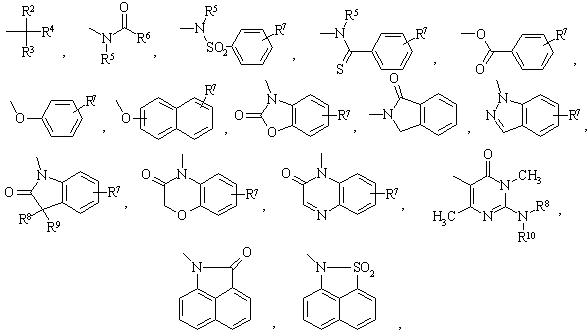
где R2 - водород,
R3 - водород или
R2 и R3 вместе обозначают кислород,
R4 - тиенил или нафтил, незамещенные или замещенные фтором или хлором,
R5 - водород или метил,
R6 - фенил, дизамещенный фтором, хлором, монозамещенный аминогруппой, алкиламиногруппой c 1-4 атомами углерода, диалкиламиногруппой с 1-4 атомами углерода в каждой алкильной части, или незамещенные или замещенные фтором, хлором, нитрогруппой тиенил, нафтил, бензофурил, бензотиенил, индолил, N-метилиндолил или инденил, циклоалкил с 3-6 атомами углерода,
R7 - водород, фтор, хлор, алкил с 1 - 4 атомами углерода, амино,
R8 - водород, метил,
R9 - водород, метил, или
R8 и R9 вместе с кольцевым атомом углерода представляют собой спироциклопропановое кольцо,
R10 - фенил или бензил, цианогруппа,
n = 1, 2, 3, 4,
и их соли с физиологически переносимыми кислотами.
2. Производные N-замещенного 3-азабицикло[3.2.0]гептана формулы (I) по п. 1, представляющие собой антагонисты рецептора D4 допамина.
Текст
1 Производные N-замещенного азабицикло[3 2 0]гептана формулы (I) 3 R1 N-(CH 2 )-A ( | ) і где R - фенил или тиенил, незамещенные или монозамещенные галогеном, нитрогруппой, аминогруппой, монометиламиногруппой, диметиламиногруппой, А - группы О где R2 - водород, R - водород или R2 и R вместе обозначают кислород, R4 - тиенил или нафтил, незамещенные или замещенные фтором или хлором, R - водород или метил, R6 - фенил, дизамещенный фтором, хлором, монозамещенный аминогруппой, алкиламиногруппой с 1-4 атомами углерода, диалкиламиногруппой с 1-4 атомами углерода в каждой алкильной части, 44721 или незамещенные или замещенные фтором, хлором, нитрогруппой тиенил, нафтил, бензофурил, бензотиенил, индолил, N-метилиндолил или инденил, циклоалкил с 3-6 атомами углерода, 7 R - водород, фтор, хлор, алкил с 1 - 4 атомами углерода, амино, 8 R - водород, метил, 9 R - водород, метил, или 8 9 R и R вместе с кольцевым атомом углерода представляют собой спироциклопропановое кольцо, Настоящее изобретение относится к новым азотсодержащим гетероциклическим соединениям, обладающим биологической активностью, более конкретно к производным N-замещенного азабициклогептана Известны производные 1,3,4-тризамещенного пиперидина, которые можно применять в качестве нейролептических средств или средств для защиты мозга (см заявку WO №9218480, опуб 29 10 1992г) Задачей изобретения является расширение ассортимента азотсодержащих гетероциклических соединений, которые можно применять в качестве нейролептических средств и средств для защиты мозга, в частности представляют собой антагонист рецептора D4 допамина Поставленная задача решается предлагаемыми производными N-замещенного азабициклогептена общей формулы R1 где R1 - фенил или тиенил, незамещенные или монозамещенные галогеном, нитро-группой, амино-группой, монометиламино-группой, диметиламино-группой, А - группы :о -o^g R - фенил или бензил, цианогруппа, п = 1, 2, 3, 4, и их соли с физиологически переносимыми кислотами 2 Производные N-замещенного Зазабицикло[3 2 0]гептана формулы (I) по п 1, представляющие собой антагонисты рецептора D4 допамина і X о R - водород, R3 - водород или R2 и R вместе обозначают кислород, R4 - тиенил или нафтил, незамещенные или замещенные фтором или хлором, R5 - водород или метил, R6 - фенил, дизамещенный фтором, хлором, монозамещенный аминогруппой, алкиламиногруппой с 1-4 атомами углерода, диалкиламиногруппой с 1-4 атомами углерода в каждой алкильной части, или незамещенные или замещенные фтором, хлором, нитро-группой тиенил, нафтил, бензофурил, бензотиенил, индолил, Nметил индол ил или инденил, циклоалкил с 3-6 атомами углерода, R7 - водород, фтор, хлор, алкил с 1-4 атомами углерода, амино, R3 - водород, метил, R9 - водород, метил, или R8 и R9 вместе с кольцевым атомом углерода представляют собой спироциклопропановое кольR10 - фенил или бензил, циано-группа, п - 1 , 2, 3, 4, и их солями с физиологически переносимыми кислотами 1 1П В формуле (I) радикалы R -R и п имеют предпочтительно следующие значения R1 - фенил, тиенил, незамещенные или замещенные фтором, хлором, йодом, нитро-группой, R2- водород, R3- водород, R4 -1-нафтил, R5- водород, R6 - о-аминофенил, o-N-метиламинофенил, 5 44721 хлортиен-1-ил, 1-нафтил, 3-инде-нил, циклогексил, З-хлор-1 -бензотиен-2-ил, R 8 - водород, R 9 - водород, метил, R - водород, метил, 10 R - фенил, п-1, 2 Предлагаемые соединения формулы (I) получают за счет того, что соединение формулы (II) Nu-(CH2)n-A (II) где А и п имеют указанные значения и Nu представляет собой нуклеофугную удаляемую группу, подвергают взаимодействию с производным 3-азабицикло[3 2 0 ]гептана формулы (III) (III) где R1 - фенил или тиенил, незамещенные или монозамещенные галогеном, нитро-группой, амино-группой, монометиламино-группой, диметиламино-группой, и получаемые таким образом соединения переводят, в случае необходимости, в их кислотно-аддитивные соли с физиологически переносимыми кислотами В качестве нуклеофугной удаляемой группы применяют предпочтительно галоген, в частности бром или хлор Реакция целесообразно осуществляется в присутствии служащего в качестве связывающего кислоту агента инертного основания, такого, как, например, триэтиламин или карбонат калия, в инертном растворителе, таком, как циклический насыщенный эфир, в частности тетрагидрофуран или диоксан, или в ароматическом углеводороде, как толуоле или ксилоле Реакция осуществляется, как правило, при температурах от 20 до 150°С и завершается обычно за 1 -10 часов Предлагаемые соединения формулы (I) можно перекристаллизовывать из обычных органических растворителей, предпочтительно из низших спиртов, таких, как этанол, или очищать колоночной хроматографией водные винной кислоты, в среде инертного растворителя, такого, как низшие спирты Свободные производные 3азабицикло[3 2 0]гептана формулы (I) можно переводить обычным приемом в аддитивную соль фармакологически переносимой кислоты, предпочтительно добавлением в раствор эквивалента соотвествующей кислоты В качестве фармацевтичкески переносимых кислот применяют, например, соляную, фосфорную, серную, малеиновую, фумаровую, щавелевую, винную, лимонную кислоты, а также метансульфокислоту и амидосульфокислоту Биологическая активность предлагаемых соединений определялась следующим образом Опыты осуществлялись на трансфецированных клетках Cos7, экспримирующих клонированные О4-рецепторы человека При этом после лизиса клетки повторно суспендировали в инкубационном буфере- (50ммоль трис-НСІ, рН 7,4), содержащем 5ммоль натриевой соли этилендиаминтетрауксусной кислоты, 1,5ммоль хлори стого кальция, 5ммоль хлористого калия, 120нмоль хлористого натрия и 5ммоль хлористого 5 магния, при концентрации 10 клеток/опыт Инкубацию осуществляли при температуре 25°С с 25 применением 50пмоль [ J] спиперона в присутствии или отсутствии предлагаемых соединений Неспецифичную способность к связыванию определяли с помощью галоидперидола, взятого в 6 количестве 10 моль После 60-минутной инкубации связанную и свободную радиоактивность разделяли путем скоростной фильтрации через стеклянные фильтры марки GF/B английской фирмы Уотман с применением скатроновского харвестера клеток норвежской скоростной фильтрации через стеклянные фильтры марки GF/B английской фирмы Уотман с применением скатроновского харвестера клеток норвежской фирмы Лир Фильтры промывали холодным буфером три-НСІ, рН 7,0, содержащим 20ммоль трис, 20ммоль хлористого магния и 7% полиэтиленгликоля с молярной массой 6000 Связанную радиоактивность определяли с помощью сцинтилляционного счетчика марки Паркард 2200 СА Активность Кі в нмоль/л исследуемых соединений определяли методом нелинейной регрессии с применением программы Лиганд Результаты опытов сведены в следующей таблице Таблица Соединение примера № Активность КІ в нмоль/л 4 5,6 5 5,9 6 1,9 7 3,3 8 5,1 10 1,7 11 2,4 14 2,4 15 2,2 18 0,6 19 5,5 20 2,1 22 1,8 23 1,8 24 2,6 25 0,7 26 0,9 27 1,5 28 0,8 29 1,1 31 7,3 32 2,6 33 2,3 34 1,6 35 1,3 36 2,8 37 2,2 38 7,1 39 3,2 43 4,4 44 2,4 45 0,9 46 8,4 44721 Продолжение таблицы 47 48 49 50 52 53 54 55 56 21 , 5,3 2,2 13 , 4,3 1,4 4,6 7,5 5,0 Предлагаемые соединения вводят в организм обычными путями, т е через рот, парентерально, внутривенно или внутримышечно Дозировка зависит от роста, состояния, веса пациента, а также от способа введения лекарства Как правило, суточная доза составляет примерно 1 - 100мг/кг веса тела при оральном введении, а 0,1 - 10мг/кг веса тела при парентеральном введении Новые соединения можно применять в твердом или жидком состоянии как активное начало обычных галенических лекарственных форм, например, таблеток, которые могут быть снабжены пленкой, капсул, порошков, гранул, драже, суппозиториев, растворов, мазей, кремов или аэрозолей Лекарственные формы получают обычными способами с применением обычных галенических вспомогательных веществ, таких, как, например, связующие, носители, консерванты, разрыхлители, регуляторы текучести, мягчители, смачиватели, диспергаторы, эмульгаторы, растворители, обеспечивающие продленное действие вещества, антиокислители и/или рабочие газы (см X Суккер и др, "Pharmazeutische Technology", из-во Тиме-Ферлаг, 1978г) Получаемые таким образом препараты, как правило, содержат активное начало в количестве от 1 до 99вес % Исходные соединения формулы (II) известны или получаются по известным в литературе способам Соединения формулы (III) можно получать за счет того, что амин формулы (IV) М R (IV) где R1 имеет вышеуказанные значения и R11 означает водород, ацетил, бензил, трифторацетил, подвергают фотохимическому 2+2циклоприсоединению, при необходимости, с последующим отщеплением ацила или бензила Фотореакция хорошо осуществляется в среде инертного растворителя, предпочтительно ацетона, при температурах от 20 до 80°С В качестве источника света особенно пригодна ртутная лампа высокого давления В случае необходимости, выгодно осуществлять фотоциклоприсоединение в кварцевом устройстве в атомосфере азота, при необходимости, с добавлением примерно 1моль соляной кислоты на каждый моль амина В большинстве случаев фотоциклоприсоединение протекает с высокой селективностью образования диастереомеров При этом получают бициклические соединения формулы (III), имеющие экзо-конфигурацию по отношению к радикалам R1 1 и R', где R имеет вышеуказанное значение,a R' означает водород Путем разделения рацемата, например, с помощью оптически активных производных винной кислоты возможно чистое выделение обоих энантиомеров 12 Отщепление ацила (R ), а также бензила целесообразно осуществляется омылением по известным способам Амины формулы (IV) известны в литературе или их получают за счет того, что альдегид фор1 мулы R -CHO подвергают взаимодействию с хлоридом винил магния с получением алл илового спирта формулы (V) ОН (V) R /1 J "«^ ^*^г который подвергают взаимодействию с хлористым водородом и получаемый при этом аллилхлорид формулы (VI) R С1 (VI) подвергают взаимодействию с соответствующим аллиламином формулы (VII) (VII) или за счет того, что коричный альдегид формулы (VIII) подвергают непосредственному восстановительному аминированию аллиламином формулы (VII) Нижеследующие примеры поясняют изобретение А) Получение исходных соединений 1 Экзо-6-(п-фтор)-фенил-3азабицикло[3 2 0]гептан В раствор 19,4г (102ммоль) г\І-аллил-І\І-[3-(4фторфенил)аллил]амина в 130мл ацетона подают 130мл 10%-ной соляной кислоты, а также 600мг кетона Михлера и получаемую смесь облучают в атмосфере азота с помощью ртутной лампы высокого давления мощностью в 150вт в кварцевом аппарате при комнатной температуре в течение 55 часов Затем реакционную смесь сгущают и остаток распределяют между хлористым метиленом и водой Смесь подщелачивают водным аммиачным раствором и водную фазу дополнительно экстрагируют два раза хлористым метиленом Объединенные органические фазы сушат над сульфатом натрия и сгущают Выход 19,3г (99%), точка плавления 165 - 166°С (малеинат) Для разделения антиподов в 15г (78,5ммоль) рацемата подают раствор 31,7г (78,5ммоль) (-)-ди-Отолуоил-Ьвинной кислоты в 300мл кипящего этанола 13,8г выпавших при охлаждении смешиванием кристаллов отсасывают при дополнительной промывке этанолом и перекристаллизовывают из 44721 200мл этанола с добавлением 200мл воды В результате высвобождения основания получают 5,5г (+)-антипода Показатель преломления [а]о +97,0°, (этанол, с = 0,969) Из маточного раствора кристаллизуется в течение ночи 14,2г соли, которую перекристаллизовывают из 400мл этанола (отфильтровыванием нерастворимого компонента при кипячении) Затем смесь сгущают до объема в 300мл В результате высвобождения основания получают 4,0г (-)антипода Показатель преломления [а]о -96,0° (этанол, с = 0,940) Экзо-фениловые конфигурации доказывают с помощью рентгеноструктурного анализа 2 Экзо-6-фенил-3-азабицикло[3 2 0]гептан В раствор 50,0г (28,9ммоль) г\І-циннамил-І\Іаллиламина в 1600мл ацетона подают 300мл 10%-ной соляной кислоты и получаемую смесь облучают в атмосфере азота с помощью ртутной лампы высокого давления мощностью в 150вт в кварцевом аппарате при комнатной температуре в течение двух суток Затем реакционную смесь сгущают и остаток распределяют между хлористым метиленом и водой Смесь подщелачивают водным аммиачным раствором и водную фазу дополнительно экстрагируют два раза хлористым метиленом Объединенные органические фазы сушат над сульфатом натрия и сгущают Выход 49,Ог (98%) вязкого масла, точка плавления 177 - 178°С (малеинат) 3 Экзо-6,7-дифенил-3-бензил-3азабицикло[3 2 0]гептан В раствор 70,Ог (206ммоль) бис-(Ы-циннамил)бензиламина в 2500мл ацетона подают 0,8г кетона Михлера и получаемую смесь облучают в атмосфере азота с помощью ртутной лампы высокого давления мощностью в 150вт в аппарате, выполненного из стекла марки "дуран", при комнатной температуре в течение 25 часов Затем реакционную смесь сгущают и остаток распределяют между хлористым метиленом и водой Смесь подщелачивают водным аммиачным раствором и водную фазу дополнительно экстрагируют два раза хлористым метиленом Объединенные органические фазы сушат над сульфатом натрия и сгущают 65,Ог сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси толуола и этанола в соотношении, равном 98 2 Получают 58,Ог (83%) целевого продукта, точка плавления 230 - 232°С (гидрохлорид) 4 Экзо-6,7-дифенил-3-азабицикло[3 2 0]гептан В раствор 12,0г (35,4ммоль) экзо-6,7-дифенил3-бензил-3-азаби-цикло[3 2 0]гептана в 300мл нпропанола и 16мл воды подают 16,0г (254ммоль) формиата аммония, а также 2,0г 10%-ного палладия на угле и реакционную смесь кипятят с обратным холодильником в течение 4 часов, причем образуется двуокись углерода После охлаждения определенное количества катализатора отсасывают, смесь дополнительно промывают пропанолом и хлористым метиленом и фильтрат сгущают Остаток распределяют между хлористым метиленом и водой, смесь подщелачивают водным аммиачным раствором и водную фазу дополнительно экстрагируют два раза хлористым метиленом 10 Объединенные органические фазы сушат над сульфатом натрия и сгущают Получают 8,1 г (92%) целевого продукта, точка плавления 140 - 142°С (малеинат) 5 Экзо-6-фенил-З-бензил-Зазабицикло[3 2 0]гептан В раствор 9,2г (35,0ммоль) г\І-циннамил-І\Іаллил-бензиламина в 1100мл ацетона подают 100мг кетона Михлера и получаемую смесь облучают в атмосфере азота с помощью ртутной лампы высокого давления мощностью 150вт в аппарате, выполненного из стекла марки "дуран", при комнатной температуре в течение 5 часов Затем реакционную смесь сгущают 9,4г сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 98 2 Получают 3,3г (36%) целевого продукта, точка плавления 126 - 128°С (малеинат) 6 2,2,2-трифтор-1-[экзо-6-(3-пиридил)-3азабицикло[3 2 0]-гепт-3-ил]-этанон 14,0г (51,8ммоль) г\І-аллил,2,2,2-трифтор-І\І-[3(3-пиридил)-аллил]-ацетамида растворяют в 140мл ацетона, в раствор подают 30мл 10%-ной водной соляной кислоты и получаемую смесь облучают в атмосфере азота с помощью ртутной лампы высокого давления мощностью в 150вт в аппарате, выполненного из стекла марки "дуран", при комнатной температуре в течение двух суток Затем реакционную смесь сгущают, подают в 150мл воды и водным аммиачным растворм доводят до величины рН, равной 8-9 Водную фазу экстрагируют два раза трет-бутил метиловым эфиром, объединенные органические фазы сушат над сульфатом натрия и сгущают Остаток фракционируют колоночной хроматографией на силикагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 98 2 Получают 6,2г (42%) неизмененного |\|-аллил-2,2,2-трифтор-г\1-[3-(3-пиридил)-аллил]ацетамида и 3,7г (26%) 2,2,2-трифтор-1-[экзо-6-(3пиридил)-3-азабицикло[3 2 0]гепт-3-ил]-этанона в виде черного масла 7 Экзо-6-(3-пиридил)-3азабицикло[3 2 0]гелтан 8 раствор 3,7г (13,7ммоль) 2,2,2-трифтор-1[экзо-6-(3-пиридил)-3-аза-бицикло[3 2 0]гепт-3-ил]этанона в 50мл этанола подают 2,5г частиц гидроокиси калия Реакционную смесь дополнительно смешивают при комнатной температуре в течение 2 часов и затем подают в 100мл ледяной воды Водную фазу экстрагируют 3 раза трет, бутилметиловым эфиром, объединенные органические фазы сушат над сульфатом натрия и сгущают Выход 2,3г (96%) желтого масла, точка плавления 202 - 205°С (гидрохлорид) Аналогично получают следующие соединения 8 экзо-6-(о-фторфенил)-3азабицикло[3 2 0]гептан, точка плавления 118 120°С (малеинат), 9 экзо-6-(п-хлорфенил)-3азабицикло[3 2 0]гептан, точка плавления 152 154°С (малеинат), 10 экзо-6-(м-хлорфенил)-3азабицикло[3 2 0]гептан, точка плавления 130 132°С (малеинат), 11 44721 12 11 экзо-6-(п-нитрофенил)-34 3-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-1-феноксипропан, азабицикло[3 2 О]гептан, точка плавления 158 точка плавления 128 - 130°С (гидрохлорид), 160°С (малеинат), 5 2-[экзо-6-п-фторфенил-312 экзо-6-(п-трифторметилфенил)-3азабицикло[3 2 0]гептан-3-ил]-1-пазабицикло[3 2 0]гептан, точка плавления 155 фторфеноксиэтан, точка плавления 177 - 178°С 156°С (малеинат), (гидрохлорид), 13 экзо-6-(3,5-дихлорфенил)-3азабицикло[3 2 0]гептан, точка плавления выше 6 3-[экзо-6-п-фторфенил-3250°С (гидрохлорид), азабицикло[3 2 0]гептан-3-ил]-1-(1-нафтилокси)пропан, точка плавления 79°С (гидрохлорид), 14 экзо-6-(п-т-бутилфенил)-3разл азабицикло[3 2 0]гептан, точка плавления выше 255°С (гидрохлорид), Пример 8 15 экзо-6-(п-цианофенил)-3Тозилат 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан, точка плавления 168 азабицикло[3 2 0]гептан-3-ил]-этил)-тиобензамида 170°С (малеинат), В раствор 2,4г (7,1ммоль) 1\1-(2-[экзо-6-п16 экзо-б-тиен-2-ил-Зфторфенил-3-азабицикло-[3 2 0]гелтан-3-ил]азабицикло[3 2 0]гептан, точка плавления 180 этилбензамида (см заявку DE №4219973) в 50мл 182°С (гидрохлорид), толуола подают 1,5г (З.бммоль) реактива Лейвессона и получаемую смесь кипятят с обратным хо17 экзо-6-тиен-З-ил-Злодильником при тщательном смешении в течеазабицикло[3 2 0]гептан, точка плавления 143 ние 3 часов После охлаждения смесь сгущают в 145°С (гидрохлорид), ротационном испарителе, остаток распределяют 18 экзо-6-(5-хлортиен-2-ил)-3между хлористым метиленом и водой и смесь азабицикло[3 2 0]гептан, точка плавления 156 подщелачивают 10%-ным натровым щелком Вод157°С (малеинат) ную фазу дополнительно экстрагируют два раза Б Получение целевых продуктов хлористым метиленом и органическую фазу сушат Пример 1 над сульфатом натрия и сгущают 3,5г сырого Гидрохлорид 1\1-(2-[экзо-6-п-фторфенил-3продукта очищают колоночной хроматографией на азабицикло[3 2 0]гептан-3-ил]этил)силикагеле с применением в качестве элюента бензосульфонамида смеси хлористого метилена и метанола в соотноВ раствор 3,0г (15,7ммоль) экзо-6-пшении, равном 99 1 Очищенное свободное оснофторфенил-3-азабицикло[3 2 0]гептана в 60мл вание растворяют в 150мл простого эфира и при ксилола подают 3,5г (15,7ммоль) 1\1-(2-хлорэтил)охлаждении льдом и смешивании в смесь медбензосульфонамида, 2,2г (15,7ммоль) тонкоизленно накапывают раствор 1,0г пмельченного карбоната калия, а также 0,5г йодида толуолсульфокислоты в сложном эфире уксусной калия и получаемую смесь кипятят с обратным кислоты Осадившуюся соль отсасывают в атмохолодильником при тщательном смешении в тесфере азота, дополнительно промывают простым чение 4 часов После охлаждения смесь сгущают эфиром и сушат в атмосфере азота Выделяют в ротационном испарителе и остаток распределя2,7г (72%) целевого продукта в качестве тозилата, ют между хлористым метиленом и водой (рН 10) точка плавления 119 - 122°С Водную фазу дополнительно экстрагируют два раза хлористым метиленом и затем органичеПример 9 скую фазу дополнительно промывают водой, суМалеинат О-(2-[экзо-6-п-фторфенил-3шат над сульфатом натрия и сгущают 7,6г сырого азабицикло[3 2 0]гептан-3-ил]-этил)-бензоата продукта очищают колоночной хроматографией на а) В раствор 11,5г (142ммоль) хлорэтанола в силикагеле с применением в качестве элюента 200мл тетрагидрофурана при тщательном смешесмеси хлористого метилена и метанола в соотнонии при комнатной температуре накапывают 20,Ог шении, равном 98 2 Свободное основание подают (142ммоль) бензоилхлорида и затем 14,4г в 30мл сложного эфира уксусной кислоты, нерас(142ммоль) триэтиламина (экзотермическая реактворимые хлопья отфильтровывают и в раствор ция) После 1 часа смешивания смесь сгущают в простого эфира подают избыточную эфирную соротационном испарителе, остаток распределяют ляную кислоту После 1 часа смешивания в расмежду хлористым метиленом и водой и смесь твор подают 150мл простого эфира и оставляют подкисляют 10%-ной соляной кислотой Водную, стоять в течение ночи Затем твердые тела отсафазу дополнительно экстрагируют два раза хлосывают в холодном состоянии и гидрохлорид дористым метиленом и затем органическую фазу полнительно промывают обильным количеством сушат над сульфатом натрия и сгущают Выделяпростого эфира Выделяют 4,1 г (64%) целевого ют 26,Ог (99%) 2-хлорэтилбензоата продукта, точка плавления 133-135°С б) В раствор 3,0г (15,7ммоль) экзо-6-(пфторфенил)-3-азабицикло[3 2 0]гептана в 50мл Аналогично получают следующие соединения толуола подают 6,0г (32ммоль) 22 1Ч-(2-[экзо-6-фенил-3хлорэтилбензоата, 2,2г (16ммоль) тонкоизмельазабицикло[3 2 0]гептан-3-ил]-этил)ченного карбоната калия, а также 0,4г йодида кабензосульфонамид, точка плавления 116 - 118°С лия и получаемую смесь кипятят с обратным хо(гидрохлорид), лодильником при тщательном смешении в 3 1\1-(2-[экзо-6-п-фторфенил-3-азабициклотечение 15 часов После охлаждения ее сгущают в [3 2 0]гептан-3-ил]-этил)-1\1ротационном испарителе и остаток распределяют метилбензосульфонамид, точка плавления 63 между хлористым метиленом и водой Водную 65°С (гидрохлорид), 13 фазу доводят до величины рН, равной 10, и дополнительно экстрагируют два раза хлористым метиленом Затем органическую фазу сушат над сульфатом натрия и сгущают 8,9г сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 99 1 2,8г очищенного свободного основания растворяют в 150мл простого эфира и при охлаждении льдом и смешивании в смесь медленно накапывают раствор 1,0г малеиновой кислоты в 10мл ацетона Осадившуюся соль отсасывают в атмосфере азота, дополнительно промывают простым эфиром и сушат в атмосфере азота Выделяют 3,9г (53%) целевого продукта в качестве малеината, точка плавления 139 141 °С Пример 10 |\|-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]этил)-1Нбензо[с,сі]индол-2-он В раствор 2,5г (13,1ммоль) экзо-6-пфторфенил-3-азабицикло[3 2 0]гептана в 50мл ксилола подают 3,0г (13,1ммоль) 1-(2-хлорэтил)1Н-бензо-[с,с1]индол-2-ана, 1,9г (13,1ммоль) тонкоизмельченного карбоната калия, а также 0,5г йодида калия и получаемую смесь кипятят с обратным холодильником при тщательном смешении в течение 3 часов После охлаждения смесь сгущают в ротационном испарителе и остаток распределяют между хлористым метиленом и водой, причем рН составляет 10 Водную фазу дополнительно экстрагируют два раза хлористым метиленом и органическую фазу сушат над сульфатом натрия и сгущают 6,0г сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 98 2 3,4г свободного основания растворяют в небольшом количестве сложного этилового эфира уксусной кислоты и при охлаждении льдом в смесь подают избыточную эфирную соляную кислоту Добавляют диэтиловый эфир с последующим смешением при температуре 0°С в течение 10 минут Осадившийся при этом гидрохлорид отсасывают в атмосфере азота, дополнительно промывают диэтиловым эфиром и сушат в вакуумном сушильном шкафе при температуре 40°С Получают 2,7г (49%) светлого порошка, точка плавления выше 250°С (гидрохлорид) Аналогично получают следующие соединения 11 1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-1Нбензо[с,сі]индол-2-он, точка плавления 233 235°С (гидрохлорид), 12 1\1-(2-[экзо-6-м-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-1Нбензо[с,сі]индол-2-он, точка плавления 230 233°С (гидрохлорид), 13 1\1-(2-[экзо-6-м-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-1Нбензо[с,сі]индол-2-он, точка плавления 233 235°С (гидрохлорид), 14 3,3-диметил-1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-индолинон-2, точка плавления 198 - 200°С (гидрохлорид), 44721 14 15 3,3-диметил-1 -(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-индолинон-2, разложение 102°С (малеинат), 16 3,3-диметил-1 -(2-[экзо-6-м-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-индолинон-2, 17 1 -(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-3,3,5триметил-индолинон-2, точка плавления 227 229°С (гидрохлорид), 18 3,4-дихлор-1\1-(2-[экзо-6-п-нитрофенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-бензамид, точка плавления 146 - 147°С (гидрохлорид), 19 2,5-дифтор-1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-бензамид, точка плавления 182 - 183°С (гидрохлорид), 20 2-амино-1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-бензамид, точка плавления 138-139°С, 21 2-амино-1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-бензамид, точка плавления 127-128°С, 22 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-2-метиламинобензамид, точка плавления 105 - 110°С (дигидрохлорид), 23 1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-2-метиламинобензамид, разложение 107°С (дигидрохлорид), 24 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-тио-фен-2амид карбоновой кислоты, точка плавления 185 186°С (гидрохлорид), 25 5-хлор-1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-тиофен-2амид карбоновой кислоты, точка плавления 129 131 °С, 26 5-хлор-1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-тиофен-2амид карбоновй кислоты, точка плавления 136 138°С, 27 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)бензо[Ь]фуран-2-амид карбоновой кислоты, точка плавления 250 - 251 °С (гидрохлорид), 28 3-хлор-1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)бензо[Ь]тиофен-2-амид карбоновой кислоты, точка плавления 104-106°С, 29 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-инден-3-амид карбоновой кислоты, точка плавления 107 109°С, 30 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-циклопропанамид карбоновой кислоты, точка плавления 104-105°С, 31 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-циклопентанамид карбоновой кислоты, точка плавления 78 - 82°С, 32 1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-циклопентанамид карбоновой кислоты, точка плавления 84 - 86°С, 33 1\1-(2-[экзо-6-п-фторфенил-3 15 азабицикло[3 2 0]гептан-3-ил]-этил)-циклогексанамид карбоновой кислоты, точка плавления 111 -113°С, 34 1\1-(2-[экзо-6-п-хлорфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-циклогексанамид карбоновой кислоты, точка плавления 106-107°С, 35 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-нафталин-1амид карбоновой кислоты, точка плавления 202 204°С (гидрохлорид), Пример 36 Экзо-6-п-фторфенил-3-[2-(1-нафтил)-этил]-3азабицикло[3 2 0]гептан В раствор 2,5г (13,1ммоль) экзо-6-пфторфенил-3-азабицикло[3 2 0]гептана в 50мл ксилола подают 3,2г (13,6ммоль) 1-(2-бромэтил)нафталина, 1,9г (13,1ммоль) тонкоизмельченного карбоната калия, а также 0,5г йодида калия и получаемую смесь кипятят с обратным холодильником при тщательном смешении в течение 2 часов После охлаждения ее сгущают в ротационном испарителе и остаток распределяют между хлоридом метилена и водой, причем рН составляет 10 Водную фазу дополнительно экстрагируют два раза хлористым метиленом, органическую фазу сушат над сульфатом натрия и сгущают 6,7г сырого продукта очищают колоночной хроматографией на си-ликагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 97,5 2,5 3,3 г свободного основания растворяют в диэтиловом эфире и небольшом количестве сложного этилового эфира уксусной кислоты и при охлаждении льдом в смесь подают избыточную эфирную соляную кислоту Осадившийся гидрохлорид отсасывают в атмосфере азота, дополнительно промывают диэтиловым эфиром и затем сушат в вакуумном сушильном шкафе при температурах 40°С Таким образом получают 1,2г (24%) белого, тонкого порошка, точка плавления 212 214°С (гидрохлорид) Аналогично получают 37 экзо-6-п-хлорфенил-3-[2-(1-нафтил)-этил]3-азабицикло[3 2 0]гептан, точка плавления 215 216°С (гидрохлорид), 38 экзо-6-м-хлорфенил-3-[2-(1-нафтил)-этил]3-азабицикло[3 2 0]гептан, точка плавления 185 187°С (гидрохлорид), 39 экзо-6-(5-хлор-2-тиенил)-3-[2-(1-нафтил)этил]-3-азабицикло[3 2 0]-гептан, точка плавления 209 - 210°С (гидрохлорид), 40 экзо-6-п-фторфенил-3-[2-(2-нафтил)-этил]3-азабицикло[3 2 0]гелтан, точка плавления 163 164°С (гидрохлорид), 41 экзо-6-п-фторфенил-3-[1-нафтилметил]-3азабицикло[3 2 0]гептан, точка плавления 114 116°С (малеинат), 42 экзо-6-п-фторфенил-3-[2-нафтилметил]-3азабицикло[3 2 0]гептан, точка плавления 153 155°С (гидрохлорид), 43 4-(6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил)-1-(тиофен-2-ил)бутан-1-он, точка плавления 197 - 199°С (гидрохлорид), 44 4-(6-п-хлорфенил-3 44721 16 азабицикло[3 2 0]гептан-3-ил)-1-(тиофен-2-ил)бутан-1-он, точка плавления 176 - 177°С (гидрохлорид) Пример 45 Тартрат 1\1-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-4фенилпирролидинона-2 а) В раствор 25, Ог (131 ммоль) экзо-6-(пфторфенил)-3-азабицикло[3 2 0]гептана в 350мл тетрагидрофурана подают 74,Ог (523ммоль) 1бром-2-хлорэтана, а также 18,0г (131 ммоль) тонкоизмельченного карбоната калия и получаемую смесь кипятят с обратным холодильником при тщательном смешении в течение 15 часов После охлаждения ее сгущают в ротационном испарителе и остаток распределяют между м етил-третбутиловым эфиром и водой Водную фазу доводят до величины рН, равной 10, и дополнительно экстрагируют два раза метил-трет-бутиловым эфиром Затем органическую фазу сушат над сульфатом натрия и сгущают 34,8г сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента хлористого метилена Выделяют 21,9г (66%) 3-([3-хлорэтил)-экзо-6-(п-фторфенил)3-азабицикло[3 2 0]гептана в качестве светложелтого масла б) В раствор 1,56г (9,9ммоль) 4-фенилпирролидинона-2 в 30мл диметилформамида подают 0,30г (9,9ммоль) 80%-ного гидрида натрия в атмосфере азота и при комнатной температуре и получаемую смесь нагревают при тщательном смешении при температуре 120°С в течение 1 часа После охлаждения в смесь подают 2,5г (9,9ммоль) 3-([3-хлорэтил)-экзо-6-(п-фторфенил)-3азабицикло[3 2 0]гептана и смесь дополнительно смешивают при 140°С в течение 2 часов После охлаждения ее сгущают в ротационном испарителе и остаток распределяют между м етил-третбутиловым эфиром и водой Водную фазу доводят до величины рН, равной 10, и дополнительно экстрагируют два раза метил-трет-бутиловым эфиром Затем органическую фазу сушат над сульфатом натрия и сгущают 3,5г сырого продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента смеси хлористого метилена и метанола в соотношении, равном 97 3 2,5г очищенного свободного основания растворяют в 150мл простого эфира и при охлаждении льдом и смешивании в смесь медленно накапывают раствор 1,0г винной кислоты в 10мл этанола Осадившуюся соль отсасывают в атмосфере азота, дополнительно промывают простым эфиром и сушат в атмосфере азота Выделяют 3,2г (61%) целевого продукта в качестве тартрата, точка плавления 74 - 77°С Пример 46 |\|-(2-[экзо-6-(п-фторфенил)-3азабицикло[3 2 0]гептан-3-ил]-этил)бензоксазолинон-2 а) В раствор Юг (74ммоль) бензоксазолинона2 в 150мл 1,2-дихлорэтана подают-7,1 г (111 ммоль) порошка гидроокиси калия (88%), а также 0,5г хлорида бензилтриэтиламмония и получаемую смесь кипятят с обратным холодильником при тщательном смешении в течение 4 часов 17 44721 18 После охлаждения смесь сгущают в ротационном стым метиленом Затем органическую фазу сушат испарителе и остаток распределяют между хлоринад сульфатом натрия и сгущают 15,Ог сырого стым метиленом и водой продукта очищают колоночной хроматографией на силикагеле с применением в качестве элюента Водную фазу дополнительно экстрагируют смеси хлористого метилена и метанола в соотнодва раза хлористым метиленом, органическую шении, равном 97 3 Выделяют 9,8г (50%) N-(2фазу сушат над сульфатом натрия и сгущают хлор)-этилизоиндолинона 11,7г сырого продукта очищают колоночной хроматографией на силикагеле с применением в каб) В раствор 2,5г (13,1ммоль) зкзо-6-(пчестве элюента хлористого метилена Выделяют фторфенил)-3-азабицикло[3 2 0]гептана в 50мл 8,2г (56%) 1\1-(2-хлор)-этилбензоксазолинона-2 ксилола подают 2,75г (14,0ммоль) ІЧ-(2-хлор)этилизоиндолинона, 2,0г (14,0ммоль) тонкоизб) В раствор 2,5г (13,1ммоль) экзо-6-(пмельченного карбоната калия, а также 0,5г йодида фторфенил)-3-азабицикло[3 2 0]-гептана в 40мл калия и получаемую смесь кипятят с обратным ксилола подают 3,0г (15,2ммоль) N-(2-хлор)-этилхолодильником при тщательном смешении в тебензоксазолинона-2, 1,8г (13,1ммоль) тонкоизчение 8 часов После охлаждения ее сгущают в мельченного карбоната калия, а также 0,Зг йодида ротационном испарителе и остаток распределяют калия и получаемую смесь кипятят с обратным между хлористым метиленом и водой холодильником при тщательном смешении в течение 7 часов После охлаждения ее сгущают в Водную фазу доводят до величины рН, равной ротационном испарителе и остаток распределяют 10, и дополнительно экстрагируют два раза хломежду хлористым метиленом и водой ристым метиленом Затем органическую фазу сушат над сульфатом натрия и сгущают 5,6г сырого Водную фазу доводят до величины рН, равной продукта очищают колоночной хроматографией на 9, и дополнительно экстрагируют два раза хлорисиликагеле с применением в качестве элюента стым метиленом Органическую фазу сушат над смеси хлористого метилена и метанола в соотносульфатом натрия и сгущают 6,5г сырого продукшении, равном 96 4 Выделяют 3,5г (76%) целевота очищают колоночной хроматографией на силиго продукта, точка плавления 223 - 225°С (гидрокагеле с применением в качестве элюента смеси хлорид) хлористого метилена и метанола в соотношении, равном 98 2 Выделяют 3,5г (76%) целевого проАналогично получают следующие соедиения дукта, точка плавления 138 - 140°С (фумарат) 48 1 -(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-индазол, точка Пример 47 плавления 164 - 166°С (гидрохлорид), |\|-(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-изоиндолинон 49 1 -(2-[экзо-6-п-фторфенил-3азабицикло[3 2 0]гептан-3-ил]-этил)-1,8а) В раствор 13,Зг (ЮОммоль) фталимидина в нафталинсультам, точка плавления 206 - 208°С 200мл 1,2-дихлорэтана подают 9,6г (150ммоль) (гидрохлорид), порошка гидроокиси калия (88%), а также 0,5г хлорида бензилтриэтиламмония и получаемую 50 4-(2-[экзо-6-п-фторфенил-3смесь кипятят с обратным холодильником при азабицикло[3 2 0]гептан-3-ил]-этил)-1,4тщательном смешении в течение 5 часов После бензоксазин-3-он, точка плавления 166 - 168°С охлаждения ее сгущают в ротационном испарите(тозилат), ле и остаток распределяют между хлористым ме51 1 -(2-[экзо-6-п-фторфенил-3тиленом и водой азабицикло[3 2 0]гептан-3-ил]-этил)-хиноксалин-2(1 Н)-он, точка плавления 54 - 56°С (тартрат) Водную фазу доводят до величины рН, равной 6, и дополнительно экстрагируют два раза хлори ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна (044) 456 - 20 - 90
ДивитисяДодаткова інформація
Автори англійськоюSteiner Gerd, Munschauer Rainer, Unger Liliane, Teschendorf Hans-Juergen
Автори російськоюШтайнер Герд, Муншауер Райнер, Унгер Лилиане, Тешендорф Ханс-Юрген
МПК / Мітки
МПК: A61P 43/00, C07D 209/52, A61K 31/505, A61P 25/18, A61K 31/44, C07D 409/04, A61K 31/403, A61P 25/02, C07D 403/06, C07D 401/04, A61P 25/08, C07D 405/06, A61K 31/4433, A61K 31/4427, A61K 31/443, C07D 409/06, A61K 31/40
Мітки: n-заміщеного, 3-азабіцикло[3.2.0]гептану, антагоністами, допаміну, похідні, рецептора
Код посилання
<a href="https://ua.patents.su/9-44721-pokhidni-n-zamishhenogo-3-azabiciklo320geptanu-yaki-eh-antagonistami-receptora-d4-dopaminu.html" target="_blank" rel="follow" title="База патентів України">Похідні n-заміщеного 3-азабіцикло[3.2.0]гептану, які є антагоністами рецептора d4 допаміну</a>
Попередній патент: Вторинне літієве хімічне джерело струму з неводним електролітом
Наступний патент: Лікарський засіб пролонгованої дії для зниження рівня тестостерону
Випадковий патент: Пристрій для сушіння матеріалів