Тіольні похідні, що мають інгібуючу активність щодо металопептидаз, фармацевтична композиція та спосіб лікування серцево-судинних захворювань
Номер патенту: 62923
Опубліковано: 15.01.2004
Автори: Сантанжело Франческо, Фантучі Маріо, Норчіні Габріеле, Пеллачіні Франко, Романьяно Стефано, Семераро Клаудіо
Формула / Реферат
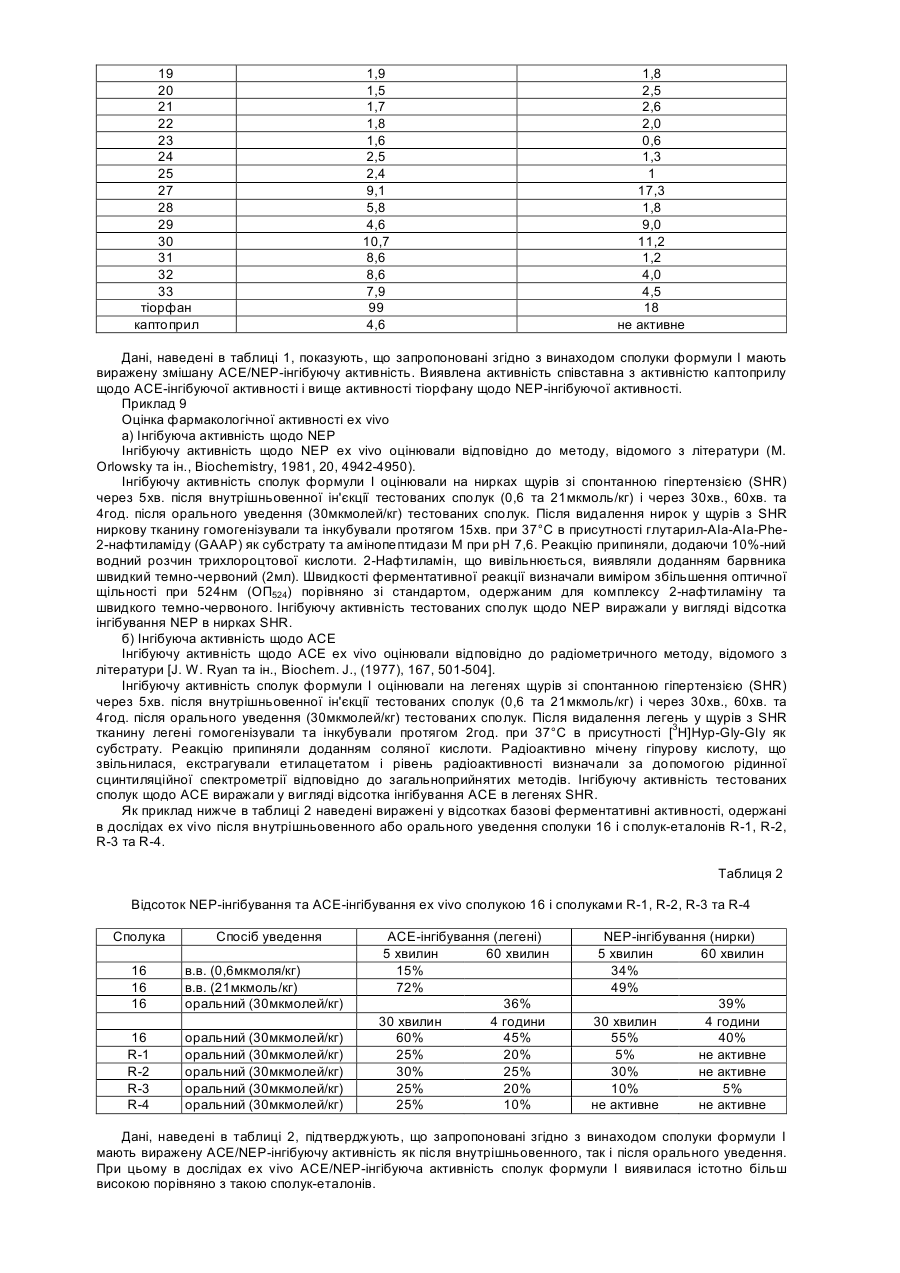
1. Сполука формули
 , (І)
, (І)
де
R означає меркаптогрупу або групу R4COS, яка перетворюється в організмі в меркаптогрупу;
R означає С2-С4алкільну групу з прямим або розгалуженим ланцюгом або арильну чи арилалкільну групу, що має від 1 до 6 атомів вуглецю в алкільному фрагменті, де арил означає феніл або 5- чи 6-членний ароматичний гетероцикл з одним або двома гетероатомами, відібраними з групи, що включає азот, кисень та сірку, необов'язково заміщений одним або кількома однаковими чи різними замісниками, відібраними з групи, що включає атоми галогену, гідроксигрупи, алкокси-, алкіл-, алкілтіо-, алкілсульфонільні або алкоксикарбонільні групи, які мають від 1 до 6 атомів вуглецю в алкільному фрагменті, С1-С3алкільні групи, які містять один або декілька атомів фтору, карбоксигрупи, нітрогрупи, аміно- або амінокарбонільні групи, ациламіногрупи, алкіламіногрупи, аміносульфонільні групи, моно- чи діалкіламіно- або моно- чи діалкіламінокарбонільні групи, що мають від 1 до 6 атомів в алкільному фрагменті;
R2 означає водень, С1-С4алкільну групу з прямим чи розгалуженим ланцюгом або бензильну групу;
R3 означає фенільну групу, заміщену 5- або 6-членним ароматичним гетероциклом, який містить один або два гетероатоми, відібраних з групи, що включає азот, кисень та сірку, причому фенільна і гетероциклічна групи необов'язково заміщені одним або кількома однаковими чи різними замісниками, що мають значення, вказані для R1;
R4 означає С1-С4алкільну групу з прямим чи розгалуженим ланцюгом або фенільну групу;
атоми вуглецю, позначені зірочкою, є стереогенними центрами;
та її фармацевтично прийнятні солі.
2. Сполука формули І за п. 1, де R3 означає фенільну групу, заміщену в положенні 4 гетероциклічною групою.
3. Сполука формули І за п. 2, де R1 означає арилалкільну групу, необов'язково заміщену одним або кількома однаковими чи різними замісниками, відібраними з групи, що включає атоми галогену, гідрокси-, алкіл- або алкоксигрупи.
4. Сполука формули І за п. 3, де R1 означає фенілалкільну групу, необов'язково заміщену одним або кількома однаковими або різними замісниками, відібраними з групи, що включає атоми галогену, гідрокси-, алкіл- або алкоксигрупи.
5. Сполука формули І за п. 1 у формі солі лужного металу, відібраного з групи, що включає натрій, літій та калій.
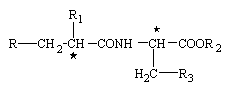
6. Спосіб одержання сполуки формули І за п. 1, що включає взаємодію між сполукою формули
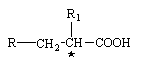 , (II)
, (II)
де R та R1 мають вказані вище значення, та похідним фенілаланіну формули
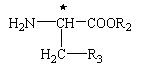 , (III)
, (III)
де R2 та R3 мають вказані вище значення.
7. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки формули І за п. 1 в суміші з носієм, придатна для фармацевтичного застосування.
8. Фармацевтична композиція за п. 7, призначена для лікування серцево-судинних захворювань.
9. Спосіб лікування серцево-судинних захворювань, який включає уведення терапевтично ефективної кількості сполуки формули І за п. 1.
10. Сполука формули І за п. 1, відібрана з групи, що включає:
метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-тіазоліл)-L-фенілаланіну;
метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-піридил)-L-фенілаланіну;
бензиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-піридил)-L-фенілаланіну;
метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-фурил)-L-фенілаланіну;
етиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(5-піримідиніл)-L-фенілаланіну;
метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-піразиніл)-L-фенілаланіну;
метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-тієніл)-L фенілаланіну;
метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-тієніл)-L-фенілаланіну;
метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-фурил)-L-фенілаланіну;
метиловий ефір Ν-[3-фенілкарбонілтіо-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-тіазоліл)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-піридил)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-піридил)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-фурил)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(5-піримідиніл)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-піразиніл)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-тієніл)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-тієніл)-L-фенілаланін;
N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-фурил)-L-фенілаланін;
N-[3-меркапто-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)-L-фенілаланін;
метиловий ефір Ν-[3-ацетилтіо-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
метиловий ефір Ν-[3-ацетилтіо-2- (2-фторфеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
метиловий ефір N-[3-фенілкарбонілтіо-2-(2-тієніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
метиловий ефір N-[2-(2-фурил)метил-3-фенілкарбонілтіопропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
метиловий ефір N-[2-(3-метил-5-ізоксазоліл)метил-3-фенілкарбонілтіопропіоніл]-4-(2-тіазоліл)-L-фенілаланіну;
N-[3-меркапто-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін;
N-[3-меркапто-2-(3-тієніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін;
N-[3-меркапто-2-(3-метил-5-ізоксазоліл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін;
Ν-[2-(2-фторфеніл)метил-3-меркаптопропіоніл]-4-(2-тіазоліл) -L -фенілаланін;
N-[2-(2-фурил)метил-3-меркаптопропіоніл]-4-(2-тіазоліл)-L-фенілаланін;
та її (2S)- або (2R)-стереоізомери.
Текст
Даний винахід відноситься до тіольних похідних, що мають інгібуючу активність щодо металопептидаз, зокрема винахід відноситься до похідних N-меркаптоацилфенілаланіну, придатних для лікування серцевосудинних захворювань. Інтерес до вивчення молекул, що мають здатність інгібувати металопептидази, з точки зору фармакології зумовлений роллю зазначених ферментів, яка проявляється на рівні серцево-судинної системи. Добре відомим є той факт, що сполуки, які мають інгібуючу активність щодо ангіотензинперетворюючого ферменту (АСЕ), дуже перспективні для лікування гіпертензії, серцевої недостатності та постінфарктного стану завдяки тому, що вони інгібують утворення ангіотензину II, речовини, яка чинить різноманітний вплив, у тому числі збільшує кров'яний тиск. Сполуки, що мають інгібуючу активність щодо ендотелій перетворюючого ферменту (ЕСЕ), придатні як антисудиннозвужувальні агенти, оскільки вони інгібують утворення ендотеліну, пептиду, що складається з 21 амінокислоти та має судиннозвужувальну активність. І навпаки, сполуки, що мають інгібуючу активність щодо ферменту нейтральна ендопептидаза (NEP), який ще називають енкефаліназою, придатні як судиннорозширювальні агенти, оскільки фермент NEP відповідальний за інактивацію не тільки ендогенного енкефаліну, але також і деяких натрійуретичних чинників, серед яких, наприклад, слід відзначити передсерцевий чинник (передсерцевий натрійуретичний чинник або ANF), гормон, секретований серцем, який збільшує розширення кровоносних судин і на нирковому рівні підвищує діурез та натрійурез. Таким чином, з урахуванням їхніх різних механізмів дії на серцевосудинну систему сполуки, що мають інгібуючу активність щодо металопептидаз, звичайно використовуються окремо або у комбінації для лікування гіпертензії, ниркової недостатності, застійної серцевої недостатності та ішемічних кардіопатологій. З тіольних похідних, що мають інгібуючу активність щодо металопептидаз, як сполуки-найближчі аналоги для NEP- та АСЕ-інгібіторів відповідно розглядаються тіорфан [(DL-(3-меркапто-2бензилпропаноїл)гліцин, вперше описаний Roquest та ін. в Nature, том 288, стор. 286-288 (1980), і каптоприл (The Merck Index, XI вид., №1773, стор. 267). В літературі описані інші тіольної будови молекули, які мають інгібуючу активність щодо металопептидаз. В патентах США 4401677 та 4199512 (обидва на ім'я Ε.R. Squibb & Sons, Inc.) описані меркаптоалканоїльні амінокислоти, що мають інгібуючу активність щодо енкефалінази та інгібуючу активність щодо АСЕ відповідно. В європейській заявці 0419327 (Societe Civile Bioproject) описані деякі похідні амінокислот, що мають інгібуючу активність щодо енкефалінази та щодо АСЕ відповідно. В європейській заявці 0449523 (Е.R. Squibb & Sons, Inc.) описані меркапто- або ацилтилтіофторметиламіди, які мають інгібуючу активність щодо NEP. В міжнародній заявці WO 93/08162 [Rhone-Poulenc Rorer S. A.-Institut National de la Sante et de la Recherche Medicale (ІNSERM)] описані b,b-дизаміщені a-меркаптометилпропіоніламіди, що мають змішану ACE/NEP-інгібуючу активність. В європейській заявці 0524553 [Institut National de la Sante et de la Recherche Medicale (INSERM)] описані ацилмеркаптоалканоїлдипептиди, що мають інгібуючу активність щодо нейтральної ендопептидази та пептидилдипептидази А. В європейській заявці 0566157 (Schermg Corporation) описані тіольні похідні, такі як, наприклад, Nмеркаптоациламінокислоти, що мають інгібуючу активність щодо NEP. a-Меркаптоацильні дипептиди, що мають інгібуючу активність щодо АСЕ та NEP, також описані у S.S. Bhagwat та ін. в Bioorganic & Medicinal Chemistry Letters, 7, 735-738, 1995. В цій останній роботі автори зробили висновок, що присутність біфенілметильної групи додає становлячу інтерес змішану ACE/NEP-інгІбуючу активність молекулам, які мають будову aмеркаптоацильного дипептиду, а заміщення біфенільної групи такими групами, як a- або b-нафтил, призводить до істотного зниження активності. Згідно з даним винаходом були виявлені похідні N-меркаптоацилфенілаланіну, які мають виражену інгібуючу активність щодо ангіотензинперетворюючого ферменту, а також щодо ферменту нейтральна ендопептидаза (змішана або подвійна ACE/NEP-інгібуюча активність), що робить їх особливо придатними для лікування серцево-судинних патологій. Таким чином, об'єктом даного винаходу є сполуки формули (І) де R означає меркаптогрупу або групу R4COS, яка перетворюється в організмі в меркаптогрупу; R1 означає С2-С4алкільну групу з прямим або розгалуженим ланцюгом або арильну чи арилалкільну групу, що має від 1 до 6 атомів вуглецю в алкільному фрагменті, де арил означає феніл або 5- чи 6-членний ароматичний гетероцикл з одним або двома гетероатомами, відібраними з групи, включаючої азот, кисень та сірку, необов'язково заміщений одним або кількома однаковими чи різними замісниками, відібраними з групи, включаючої атоми галогену, гідроксигрупи, алкокси-, алкіл-, алкілтіо-, алкілсульфонільні або алкоксикарбонільні групи, які мають від 1 до 6 атомів вуглецю в алкільному фрагменті, С1-С3алкільні групи, які містять один або декілька атомів фтору, карбоксигрупи, нітрогрупи, аміно- або амінокарбонільні групи, ациламіногрупи, алкіламіногрупи, аміносульфонільні групи, моно- чи діалкіламіно- або моно- чи діалкіламінокарбонільні групи, що мають від 1 до 6 атомів в алкільному фрагменті; R2 означає водень, С1-С4алкільну групу з прямим чи розгалуженим ланцюгом або бензильну групу; R3 означає фенільну групу, заміщену 5- або 6-членним ароматичним гетероциклом, який містить один або два гетероатоми, відібраних з групи, включаючої азот, кисень та сірку, причому фенільна і гетероциклична групи необов'язково заміщені одним або кількома однаковими чи різними замісниками, що мають значення, вказані для R1; R4 означає С1-С4алкільну групу з прямим чи розгалуженим ланцюгом або фенільну групу; атоми вуглецю, позначені зірочкою, є стереогенними центрами; та їхні фармацевтично прийнятні солі. Сполуки формули І містять два стереогенних центри і тому можуть перебувати у формі стереоізомерів. Таким чином, об'єктом даного винаходу є сполуки формули І в формі стереоізомерної суміші, а також в формі окремих стереоізомерів. Сполуки формули І, що пропонуються, виявляють змішану ACE/NEP-інгібуючу активність і придатні для лікування серцево-судинних захворювань. Хоча обидва поняття "змішана" та "подвійна" використовуються; взаємозамінно, поняття "подвійна" є більш широко застосовуваним в літературі для сполук, що мають одночасно як АСЕ-, так і NEP-інгібуючу активність. В контексті даного опису поняття "змішана" і "подвійна" розглядаються як еквівалентні. В контексті даного опису, якщо не вказане інше, під поняттям "алкільна група з прямим або розгалуженим ланцюгом" розуміють алкіл, такий, як метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, трет-бутил, ізобутил, н-пептил, 2-пентнл, 3-пентил, ізопентил, трет-пентил, н-гексил та ізогексил; під поняттям "алкоксигрупа з прямим або розгалуженим ланцюгом" розуміють алкоксигрупу, таку, як метокси-, етокси-, н-пропокси- та ізопропоксигрупу; під поняттям "атом галогену" розуміють атом фтору, хлору, брому або йоду; під поняттям "ацил" розуміють ацильну групу, що є похідним аліфатичної або ароматичної карбонової кислоти, такої, як оцтова, пропіонова, масляна і бензойна кислота; під поняттям "5- або 6членний ароматичний гетероцикл з 1 або 2 гетероатомами, відібраними з групи, включаючої азот, кисень та сірку", розуміють таку групу, як тіазол, ізоксазол, оксазол, ізотіазол, піразол, імідазол, тіофен, пірол, піридин, піримідин, піразин, піридазин та фуран, необов'язково сконденсований з бензольним кільцем. Прикладами фармацевтично прийнятних солей сполук формули І є солі лужних або лужно-земельних металів та солі фармацевтично прийнятних органічних основ. Прийнятними сполуками формули І є сполуки, в яких R3 означає фенільну групу, заміщену в положенні 4 гетероциклічною групою. Більш прийнятними в цьому ряді є сполуки формули І, в яких R1 означає арилалкільну групу, необов'язково заміщену одним або кількома однаковими або різними замісниками, відібраними з групи, включаючої атоми галогену, гідроксигрупу, алкільну або алкоксигрупу. Ще більш прийнятними сполуками в цьому ряді є сполуки формули І, в яких R1 означає фенілалкільну групу, необов'язково заміщену одним або кількома однаковими чи різними замісниками, відібраними з групи, включаючої атоми галогену, гідроксигрупу, алкільну або алкоксигрупу. Прийнятними прикладами фармацевтично прийнятних солей сполук формули І є солі лужних металів, таких, як натрій, літій та калій. Для фахівця в даній галузі техніки очевидно, що сполуки формули І, в яких R означає групу R4COS, мають здатність перетворюватися в організмі у сполуки, в яких R є меркаптогрупою, а сполуки формули І, в яких R2 означає алкільну або бензильну групу, є біологічними попередниками (проліками) відповідних сполук формули І, в яких R означає меркаптогрупу (R означає SH) або R2 означає атом водню (R2 означає Н) відповідно. Конкретні приклади більш прийнятних сполук формули І за винаходом включають; метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-тіазоліл)фенілаланіну; бензиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-піридил)фенілаланіну; метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-піридил)фенілаланіну; метиловий ефір N-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-фурил)фенілаланіну; етиловий ефір N-(3-фетлкарбонілтіо-2-фенілметилпропіоніл)-4-(5-піримідиніл)фенілаланіну; метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-піразиніл)фенілаланіну; метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(2-тієніл)фенілаланіну; метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-тієніл)фенілаланіну; метиловий ефір Ν-(3-фенілкарбонілтіо-2-фенілметилпропіоніл)-4-(3-фурил)фенілаланіну; метиловий ефір Ν-[3-фенілкарбонілтіо-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)фенілаланіну; метиловий ефір N-[3-ацетилтіо-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)фенілаланіну; метиловий ефір N-[3-ацетилтіо-2-(2-фторфеніл)метилпропіоніл]-4-(2-тіазоліл)фенілаланіну; метиловий ефір N-[3-фенілкарбонілтіо-2-(2-тієніл)метилпропіоніл]-4-(2-тіазоліл)фенілаланіну; метиловий ефір N-[2-(2-фурил)метил-3-фенілкарбонілтіопропіоніл]-4-(2-тіазоліл)фенілаланіну; метиловий ефір N-[2-(3-метил-5-ізоксазоліл)метил-3-фенілкарбоніл-тіопропіоніл]-4-(2тіазоліл)фенілаланіну; N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-тіазоліл)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-піридил)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-піридил)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-фурил)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(5-піримідиніл)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-піразиніл)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(2-тієніл)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-тієніл)фенілаланін; N-(3-меркапто-2-фенілметилпропіоніл)-4-(3-фурил)фенілаланін; N-[3-меркапто-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)фенілаланін; N-[3-меркапто-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)фенілаланін; N-[3-меркапто-2-(3-тієніл)метилпропіоніл]-4-(2-тіазоліл)фенілаланін; N-[3-меркапто-2-(3-метил-5-ізоксазоліл)метилпропіоніл]-4-(2-тіазоліл)фенілаланін; N-[2-(2-фторфеніл)метил-3-меркаптопропіоніл]-4-(2-тіазоліл)фенілаланін; N-[2-(2-фурил)метил-3-меркаптопропіоніл]-4-(2-тіазоліл)фенілаланін. Одержання запропонованих згідно з даним винаходом сполук формули І проводять відповідно до способу синтезу, включаючого взаємодію між сполукою формули (ІІ) де R та R1 мають вказані вище значення, та похідним фенілаланіну формули (ІІІ) де R2 та R3 мають вказані вище значення. Реакцію конденсації проводять відповідно до способів, загальноприйнятих в хімії пептидів. До проведення реакції може виявитися доцільним відповідним чином захистити необов'язкові функціональні групи, які можуть перешкоджати взаємодії. Необов'язковий захист проводять загальноприйнятими способами. Стосовно сполук, в яких R означає групу R4COS, більш прийнятно використати як проміжні речовини сполуки формули II, одержуючи таким чином відповідні сполуки формули І, в яких R означає групу R4COS, з яких шляхом гідролізу можуть бути одержані сполуки формули І, в яких R означає групу SH. Оцінка придатності необов'язкового захисту, а також вибір прийнятного типу захисту, відповідного реакції, що проводиться, та функціональним групам, що підлягають захисту, добре відомі фахівцям в даній галузі. Вилучення необов'язкових захисних груп проводять відповідно до загальноприйнятих способів. Загальні приклади застосування захисних груп в органічній хімії можна знайти у Theodor W. Greene та Peter G.M. Wuts в "Protective Groups in Organic Synthesis", John Wiley & Sons, Inc., 2-е вид., 1991. Сполуки формули II є відомими або легко можуть бути одержані відомими методами, як описано, наприклад, в патенті Великобританії 1576161 на ім'я Е.R. Squibb & Sons, Inc. В альтернативному варіанті сполуки формули II можуть бути одержані відповідно до методів синтезу, описаних у М.С. Fournie-Zalusky та ін. в J. Med. Chem., 1994, 37, 1070-1083. Проміжні сполуки формули III також є відомими або легко можуть бути одержані відомими методами. Наприклад, сполуки формули III можуть бути одержані відповідно до способів синтезу, описаних у W.С Shieh та ін. в J. Org. Chem., 1992, 57, 379-381. В альтернативному варіанті сполуки формули III можуть бути одержані за допомогою методів поєднання (поперечного поєднання) з використанням як вихідні речовини галогенованих гетероциклічних сполук та похідних станілфенілаланіну, як описано у D.С. Wilbur та ін. в Bioconjugate Chem., 1993, 4, 574580. Сполуки формули І в формі окремих стереоізомерів одержують шляхом стереоселективного синтезу або розподілу стереоізомерної суміші відповідно до загальноприйнятих способів. Одержання солей сполук, що пропонуються, формули І також проводять відповідно до загальноприйнятих способів. Сполуки формули І за винаходом виявляють змішану ACE/NEP-інгібуючу активність і придатні для лікування серцево-судинних захворювань. Інгібуючу активність сполук формули І оцінювали в дослідах in vitro (приклад 8). Зокрема інгібуючу активність сполук формули І оцінювали в порівнянні з вищезазначеними тіорфаном та каптоприлом. Виявлена інгібуюча активність in vitro сполук формули І, виражена у вигляді значення IC50, вияляється в діапазоні наномолярних (нМ) концентрацій. Виявлена інгібуюча активність щодо АСЕ виявилася співставною з активністю каптоприлу, а інгібуюча активність щодо NEP виявилася вищою, ніж у тіорфану. Крім того, інгібуючу активність сполук формули І також оцінювали в дослідах ex vivo в порівнянні з відомими сполуками (приклад 9). Зокрема як еталони для порівняння застосовували N-[3-меркапто-2-(3,4метилендіоксифеніл)метилпропіоніл]-(S)-фенілаланін та N-[3-меркапто-2-(3,4метилендіоксифеніл)метилпропіоніл]-(S)-тірозин, описані як інгібітори енкефалінази та АСЕ у вищезазначеній європейській заявці 0419327 та позначені в даному описі як сполуки R-1 та R-2 відповідно, а також N-(3-меркапто-2-метилпропаноїл)-L-тірозин та N-(3-меркапто-2-метилпропаноїл)-L-триптофан, описані як інгібітори АСЕ в патенті США 4199512 та як інгібітори енкефалінази в патенті США 4401677 і позначені в даному описі як сполуки R-3 та R-4 відповідно. ACE/NEP-інгібуючу активність в дослідах ex vivo зокрема визначали оцінкою ферментативної активності в гомогенатах тканини (легені та нирки для АСЕ- та NEP-активності відповідно), взятих у щурів зі спонтанною гіпертензією (SHR), яким тестовані сполуки уводили внутрішньовенно або орально. Слід відзначити, що активність, яку виявляють сполуки формули І в дослідах ex vivo, підтверджує змішану активність (подвійну активність), виявлену в дослідах in vitro, також і після орального уведення. Більш того, виявлена зазначена активність виявилася істотно більш високою, ніж у сполук-еталонів. Для практичного застосування в терапії на основі сполук формули І можуть бути виготовлені тверді або рідкі фармацевтичні композиції, придатні для орального або парентерального уведення. Таким чином, фармацевтичні композиції, що містять терапевтично ефективну кількість сполуки формули І в суміші з носієм, призначені для фармацевтичного застосування, є ще одним об'єктом даного винаходу. Конкретними прикладами фармацевтичних композицій за даним винаходом є таблетки, таблетки з покриттям, капсули, грануляти, розчини та суспензії, придатні для орального уведення, розчини та суспензії, придатні для парентерального уведення. Фармацевтичні композиції за винаходом одержують відповідно до загальноприйнятих способів. Добова доза сполуки формули І або відповідних проліків може залежати від ряду чинників, таких, як серйозність захворювання, індивідуальна реакція пацієнта або тип композиції, але вона звичайно складає 0,1-10мг на кг ваги тіла і може застосовуватися у вигляді однократної дози або може бути поділена на декілька добових доз. Нижче винахід проілюстрований на прикладах. Якщо не вказане інше, швидку хроматографію проводили з використанням силікагелю для швидкої хроматографії компанії Baker (код 7024-00). Приклад 1 Одержання етилового ефіру N-трет-бутоксикарбоніл-4-(5-піримідиніл)-L-фенілаланіну Суміш, що містить 5-піримідинілборну кислоту (850мг; 2ммоля), етиловий ефір N-трет-бутоксикарбоніл4-трифторметилсульфоніл-L-фенілаланіну (450мг; 2,2ммоля), розчин карбонату натрію (530мг) у воді (2,59мл) та суміш толуол:етанол у співвідношенні 10:4,5 (20мл), дегазували азотом протягом 30хв. Далі до реакційної суміші додавали тетра-кис-(трифенілфосфін)паладій(0) (120мг; 0,06ммоля), нагрівали до 90°С і витримували при перемішуванні протягом 3год. Після цього суміш витримували при кімнатній температурі і знов додавали етиловий ефір N-трет-бутоксикарбоніл-4-трифторметилсульфоніл-L-фенілаланіну (112мг) і тетракис(трифенілфосфін)паладій(0) (30мг). Суміш ще раз нагрівали до 90°С і витримували при перемішуванні протягом 18год. Після охолодження реакційної суміші до кімнатної температури додавали етилацетат (100мл) і воду (40мл). Фази поділяли і органічну фазу висушували над сульфатом натрію та упарювали під вакуумом. Одержаний залишок очищали швидкою хроматографією (силікагель, елюент гексан:етилацетат у співвідношенні 7:3, тиск азоту 0,1атм.), одержуючи при цьому етиловий ефір N-третбутоксикарбоніл-4-(5-піримідиніл)-L-фенілаланіну (130мг; вихід 14%) у вигляді безбарвного масла. 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,24 (t, 3Н, СH2-СН3); 1,40 [s, 9Н, С (CH3)3]; 3,01-3.25 (m, 2H, СН2-СН); 4,19 (q, 2Н, СН2-СH3); 4,52-4,65 (m, 1Н, CH-COO); 5,06 (d, 1H, NH); 7,25-7,52 (m, 4H, фенілен); 8,91 (s, 2H, N-CH-C-CH-N); 9,19 (s, 1H, N-CH-N). Приклад 2 Одержання метилового ефіру N-трет-бутоксикарбоніл-4-(2-тіазоліл)-L-фенілаланіну Метиловий ефір N-трет-бутоксикарбоніл-4-(трифторметилсульфоніл)-L-фенілаланіну (8г, 32,3ммоля) та хлорид біс(трифенілфосфін)паладію (2,3г) додавали до розчину 2-триметилстанілтіазолу (13,8г; 32,3ммоля) в суміші тетрагідрофуран:толуол у співвідношенні 10:1 (50мл), попередньо дегазованої азотом. Суміш нагрівали зі зворотним холодильником протягом 24год. і після цього ще раз додавали 2триметилстанілтіазол (2г). Через 6год. при нагріванні зі зворотним холодильником знов додавали метиловий ефір N-трет-бутоксикарбоніл-4-(трифторметилсульфоніл)-L-фенілаланіну (2г) та хлорид біс(трифеніл-фосфін)паладію (700мг). Утворену реакційну суміш витримували, перемішуючи, при 70°С протягом 16год., а після цього охолоджували до кімнатної температури. Після цього до суміші додавали воду (200мл) і екстрагували метиленхлоридом (4x200мл). Об'єднані органічні фази висушували над сульфатом натрію і упарювали під вакуумом. Одержаний залишок очищали експрес-хроматографією (силікагель, елюент метиленхлорид:етилацетат у співвідношенні 9:1, тиск азоту 0,1атм.), одержуючи при цьому метиловий ефір N-трет-бутоксикарбоніл-4-(2-тіазоліл)-L-фенілаланіну (2,3г; вихід 20%). 1 H-ЯМР (200МГц, CDCІ 3: d (част./млн): 1,40 [s, 9Н, С (СН3)3]; 3,00-3,21 (m, 2Н, СН2); 3,70 (s, 3Н, СООСН3); 4,42-4,65 (m, 1H, СН-СОО); 5,02 (bd, 1H, NH); 7,30 (d, 1H, S-CH-CH-N); 7,81 (d, 1H, S-CH-CH-N); 7,15-7,90 (m, 4Н, фенілен). Приклад 3 Одержання метилового ефіру N-трет-бутоксикарбоніл-4-(3-піридил)-L-фенілаланіну 3-бромпіридин (1,67г; 10ммолей) та тетракис(трифенілфосфін)паладій(0) (370мг; 0,219ммоля) додавали до розчину метилового ефіру N-трет-бутоксикарбоніл-4-(трибутилстаніл)-L-фенілаланіну (4г; 7,03ммоля), одержаного згідно з D.S. Wilbur та ін., Bioconjugate Chem., 1973, 4, 574-580, у безводному диметилформаміді (30мл), попередньо дегазованому азотом. Реакційну суміш витримували при перемішуванні протягом 10хв. при кімнатній температурі і після цього витримували при 105°С протягом 6год. Знов додавали тетракис(трифенілфосфін)паладій(0) (0,0035ммоля), суміш витримували при 105°С протягом 8год. і охолоджували до кімнатної температури. Після цього в реакційну суміш додавали воду (100мл) і екстрагували гексаном (3x150мл). Об'єднані органічні фази промивали насиченим водним розчином фториду калію, висушували над сульфатом натрію і упарювали під вакуумом. Одержаний залишок об'єднували з етилацетатом і фільтрували. Утворений розчин упарювали під вакуумом і залишок очищали експрес-хроматографією (силікагель, елюент гексан:етилацетат у співвідношенні 8:2, тиск азоту 0,1атм.), одержуючи метиловий ефір N-трет-бутоксикарбоніл-4-(3-піридил)-L-фенілаланіну (1,5г; вихід 60%) у вигляді безбарвного масла. МС (С. І.): (М+Н)+=357. 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 1,40 [s, 9H, С (СН3)3]; 3,00-3,20 (m, 2Н, СН2); 3,71 (s, 3Н, СООСН3); 4,55 (m, 1H, СН-СОО); 5,05 (bd, 1H, NH); 7,19-7,51 (m, 4Н, фенілен); 7,30-8,82 (bm, 4H, піридил). Аналогічним чином одержували наступні сполуки: метиловий ефір N-трет-бутоксикарбоніл-4-(2-піридил)-L-фенілаланіну: МС (С. І.): (М+Н)+=357; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,40 [s, 9Н, С(СН3)3]; 3,03-3,21 (m, 2H, CH2-СН); 3,70 (s, 3Н, СООСН3); 4,54-4,65 (m, 1Н, СН-СОО); 4,98 (d, 1Н, CONH); 7,16-7,21 (m, 1H, N-C-CH-СН); 7,65-7,77 (m, 2Н, NCH-CH-CH); 7,19-7,93 (m, 4Н, фенілен), 8,63-8,68 (m, 1Н, N-CH); метиловий ефір N-трет-бутоксикарбоніл-4-(2-піразиніл)-L-фенілаланіну: 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,40 [s, 9Н, С(СН3)3]; 3,02 (m, 2Н, СН2); 3,70 (s, 3Н, СООСН3); 4,53-4,70 (m, 1H, СН-СОО); 5,03 (bd, 1Н, NH); 7,21-7,98 (m, 4Н, фенілен); 8,49 і 8,62 [2 (bs, 2H, N-CH-CH-N)]; 9,00 (s, 1H, СН-N-СН-СН); метиловий ефір N-трет-бутоксикарбоніл-4-(2-тіеніл)-L-фенілаланіну: 1 H-ЯМР (200МГц, CDCІ3): d (част./млн): 1,41 [m, 9Н, С(СН3 )3]; 2,98-3,18 (m, 2H, СН2); 3,71 (s, 3Н, СООСН3); 4,53-4,64 (m, 1Н, СН-СОО); 4,98 (bd, 1Н, NH); 7,02-7,28 (m, 3Н, тієніл); 7,10-7,54 (m, 4H, фенілен). Приклад 4 Одержання дигідрохлориду метилового ефіру 4-(3-піридил)-L-фенілаланіну Тіонілхлорид (0,85мл; 4,78ммоля) додавали по краплях до розчину метилового ефіру N-третбутоксикарбоніл-4-(3-піридил)-L-фенілаланіну (1,4г; 3,93ммоля) в метанолі (30мл), одержаного згідно з прикладом 3, підтримуючи температуру на рівні 0°С. По закінченні додання температуру реакційної суміші доводили до кімнатної і витримували при перемішуванні протягом 8год. Розчинник випарювали при пониженому тиску, одержуючи дигідрохлорид метилового ефіру 4-(3-піридил)-L-фенілаланіну (820мг; вихід 71%), який безпосередньо використали в наступних реакціях. МС (С. І.): (М+Н)+=257 (вільна основа). 1 H-ЯМР (200МГц, D2O): d (част./млн): 3,11-3,32 (m, 2Н, СН2); 3,67 (s, 3Н, СН3); 4,31-4,37 (m, 1H, СН); 7,30-7,63 (т, 4Н, фенілен); 7,97 (dd, 1Н, CH-N-CH-CH-CH); 8,59 (d, 1Н, CH-N-CH-CH-CH); 8,65-8,71 (m, 1Н, CH-N-CH-CH); 8,89 (d, 1H, CH-N-CH-CH-CH). Працюючи аналогічно, одержували наступні сполуки: дигідрохлорид метилового ефіру 4-(2-піридил)-L-фенілаланіну: МС (С. І.): (М+Н)+=257 (вільна основа); 1 H-ЯМР (200МГц, D2O): d (част./млн): 3,12-3,33 (m, 2Н, СН2); 3,64 (s, 3Н, СН3); 4,30-4,37 (m, 1Н, СН); 7,36-7,73 (m, 4Н,фенілен); 7,78-8,58 (m, 4Н, піридил); дигідрохлорид етилового ефіру 4-(5-піримідиніл)-L-фенілаланіну: 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,11 (t, 3Н, СН2-СH3); 3,10-3,35 (m, 2Н, СН2-СН); 4,04-4,20 (m, 2Н, СН2-СН3), 4,22-4,35 (m, 1Н, СН); 7,40-7,84 (m, 4Н, фенілен); 9,15 (s, 2Н, N-CH-C-CH-N); 9,19 (s, 1H, NCH-N); дигідрохлорид метилового ефіру 4-(2-піразиніл)-L-фенілаланіну: МС (С. І.): (М+Н)+=258 (вільна основа); 1 H-ЯМР (200МГц, DCI 1н.): d (част./млн): 3,45-3,67 (m, 2Н, СН2); 3,98 (s, 3Н, СН3); 4,65-4,72 (m, 1H, СН); 7,68-8,26 (m, 4Н, фенілен); 9,02 (d, 1H, CH-N-CH-CH); 9,44 (dd, 1H, СН-N-CH-СН); 9,54 (d, 1H, CH-N-CH-CH); гідрохлорид метилового ефіру 4-(2-тієніл)-L-фенілаланіну: МС (С. І.): (М+Н)+=262 (вільна основа); 1 H-ЯМР (200МГц, D2O): d (част./млн): 2,98-3,19 (m, 2Н, СН2); 3,65 (s, 3Н, СН3); 4,21-4,28 (m, 1H, СН); 6,96-7,28 (m, 3Н, тієніл); 7,08-7,52 (m, 4H, фенілен); дигідрохлорид метилового ефіру 4-(2-тіазоліл)-L-фенілаланіну: 1 H-ЯМР (200МГц, D2O): d (част./млн): 3,10-3,32 (m, 2Н, СН2-СН); 3,68 (s, 3Н, СН3); 4,30-4,38 (m, 1Н, СН); 7,30-7,80 (m, 4Н, фенілен); 7,70-7,91 (m, 2Н, тіазолiл). Приклад 5 Одержання 2-ізобутил-3-фенілкарбонілтіопропіонової кислоти Суміш 2-ізобутилакрилової кислоти (6,34г; 49ммолей) та тіобензойної кислоти (5,96мл; 51ммоль) витримували, перемішуючи, при 100°С протягом 2год. Після цього реакційну суміш обробляли петролейним ефіром при 40-60°С (100мл) і охолоджували при -70°С в бані сухий лід/ацетон. Після фільтрації та промивання петролейним ефіром при -70°С збирали залишок, з якого після сушіння при пониженому тиску одержували 2-ізобутил-3-фенілкарбонілтіопропіонову кислоту (11,12г; вихід 85%) у вигляді твердої речовини білого кольору. 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 0,90-1,00 (m, 6Н); 1,40-1,90 (m, 3Н); 2,70-2,90 (m, 1Н); 3,10-3,40 (m, 2H); 7,35-7,62 (m, 3H); 7,90-8,00 (d, 2H). Аналогічним чином одержували наступні сполуки: 2-(З-метоксифеніл)метил-3-фенілкарбонілтіопропіонову кислоту: 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,32 (s, 3Н); 2,80-3,15 (m, 5Н); 3,77 (s, 3Н); 6,70-6,80 (m,3H); 7,14-7,25 (m, 1Н); 3-ацетилтіо-2-(2-фторфеніл)метилпропіонову кислоту: 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,31 (s, 3Н); 2,90-3,20 (m, 5H); 6,95-7,30 (m, 4H); бензиламінову сіль 3-фенілкарбонілтіо-2-(2-тієніл)метилпропіонової кислоти: 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,45-3,25 (m, 5Н, S-CH2-CH-CH2); 3,90 (s, 2H, CH2-феніл); 6,85-7,91 (m, 13Н, арил). Приклад 6 Одержання метилового ефіру N-[(2S)-3-фенІлкарбонілтіо-2-фенілметилпропіоніл]-4-(2-тіазоліл)-Lфенілаланіну (сполука 1) Розчин гідроксибензотриазолу (0,54г; 4ммоля) в тетрагідрофурані (30мл) і потім розчин дициклогексилкарбодіїміду (0,825г; 4ммоля) в метиленхлориді (15мл) додавали з перемішуваням при 0°С до суміші, що містить (2S)-3-фенілкарбонілтіо-2-(фенілметилпропіонову кислоту (1,2г; 4ммоля), дигідрохлорид метилового ефіру 4-(2-тіазоліл)-L-фенілаланіну (1,34г; 4ммоля), одержаний згідно з прикладом 4, триетиламін (1,11мл; 8ммолей) в тетрагідрофурані (20мл) та в метиленхлориді (30мл). Реакційну суміш витримували при перемішуванні протягом 20год., після цього відфільтровували дициклогексилсечовину і розчинник випарювали при пониженому тиску. Залишок збирали етилацетатом і розчин промивали 20%-ним водним розчином хлориду натрію, 5%-ним розчином бікарбонату натрію і ще раз 20%-ним розчином хлориду натрію. Після розподілу фаз та упарювання органічної фази утворену білу тверду речовину очищали експрес-хроматографією (силікагель, елюент етилацетат:гексан у співвідношенні 40:60, тиск азоту 0,1атм.), одержуючи таким шляхом метиловий ефір N-[(2S)-3-фенілкарбонілтіо-2фенілметилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (1,5г). tпл 98-100°С. МС (С. І): (М+Н)+=545. 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,63-3,35 (m, 7H, СН2-СН-СН2, СН2-С6Н4-тіазоліл); 3,68 (s, 3Н, СООСН3); 4,75-4,85 (m, 1Н, CH-COO); 5,78 (d, 1H, NH); 7,10-8,00 (m, 16H, арил). Аналогічним чином, використовуючи як вихідні речовини відомі сполуки або сполуки, одержані згідно з прикладами 4 та 5, одержували наступні сполуки: метиловий ефір N-[(2S)-(3-фенідкарбонілтіо-2-фенілметилпропіоніл]-4-(2-фурил)-L-фенілаланіну (сполука 2): tпл 132-134°С; МС (С. І.): (М+Н)+=528; 1 H-ЯМР (200МГц, CDCl3): d (част./млн): 2,60-3,35 (m, 7H, СH2-СН-СH2, СН2-С6H4-фурил); 3,58 (s, 3Н, СООСН3); 4,71-4,81 (m, 1H, СН-СОО); 5,73 (d, 1H, NH); 6,40-8,00 (m, 17Н, арил); етиловий ефір N-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(5-піримідиніл)-L-фенілаланіну (сполука 3): tпл 117-119°С; МС (С. І.): (М+Н)+=554; H-ЯМР (200МГц, CDCl3): d (част./млн): 1,18 (t, 3H, СН3-СН2); 2,65-3,35 (m, 7H, СН2-СН-СН2, СH2-С6H4піримідиніл); 3,95-4,20 (m, 2Н, СООСН2); 4,70-4,80 (m, 1H, СН-СОО); 5,78 (d, 1H, NH); 7,05-8,00 (m, 14Н, феніл, фенілен); 8,68 (s, 2Н, CH-N-CH-N-CH); 9,11 (s, 1H, N-CH-N); метиловий ефір N-[(2S)3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(2-піразиніл)-L-фенілаланіну (сполука 4): tпл 145-147°C; МС (С. І.): (М+Н)+=540; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,65-3,35 (m, 7H, СН2-СН-СН2, СН2-С6Н4-піразиніл); 3,61 (s, 3Н, СООСН3); 4,75-4,85 (m, 1H, СН-СОО); 5,78 (d, 1H, NH); 7,10-8,00 (m, 14Н, феніл, фенілен); 8,48-8,75 (m, 3Н, CH-N-CH-CH-N); метиловий ефір N-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(3-піридил)-L-фенілаланіну (сполука 5): tпл 132-134°C; МС (С. І.): (М+Н)+=539; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,66-2,79 (m, 1Н, СН2-СН-СН2); 2,88-3,35 (m, 6H, СН2-СН-СН2, СН2-С6Н4-піридил); 3,61 (s, 3Н, СООСН3); 4,75-4,85 (m, 1Н, СН-СОО); 5,77 (d, 1H, NH); 7,07-7,99 (m, 16H, СН-CH-CH-N, феніл, фенілен); 8,51-8,64 (m, 2H, CH-N-CH); метиловий ефір Ν-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(2-піридил)-L-фенілаланіну (сполука 6): tпл 123-125°С; МС (С. І.): (М+Н)+=539; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,63-2,77 (m, 1Н, СН2-СН-СН2); 2,85-3,35 (m, 6H, CH2-CH-CH2, СН2-С6Н4-піридил); 3,56 (s, ,Н, СООСН3); 4,75-4,85 (m, 1Н, СН-СОО); 5,75 (d, 1Н, NH); 7,09-7,99 (m, 16H, СНCH-CH-N, феніл, фенілен); 8,61-8,65 (m, 1H, N-CH-CH); метиловий ефір N-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(2-тієніл)-L-фенілаланіну (сполука 7): МС (С. І.): (М+Н)+=544; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,64-3,36 (m, 7Н, СН2-СН-СН2, CONH-CH-CH2); 3,58 (s, 3Н, СООСН3); 4,74-4,83 (m, 1Н, СН-СОО); 5,74 (d, 1Н, NH); 6,97-7,99 (m, 17H, арил); метиловий ефір Ν-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(3-тієніл)-L-фенілаланіну (сполука 8): МС (С. І.): (М+Н)+=544; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 2,63-3,35 (m, 7Н, СН2-СН-СН2, NH-CH-CH2); 3,58 (s, 3Н, СООСН3); 4,73-4,85 (m, 1H, CH-COO); 5,70-5,76 (bd, 1H, NH); 7,00-7,62 (m, 15H, феніл, фенілен, CH-CH-S); 7,93-8,00 (m, 2H, CH-S-CH); метиловий ефір Ν-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіаніл]-4-(3-фурил)-L-фенілаланіну (сполука 9): tпл 115-117°C; МС (С. І.): (М+Н)+=528; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,62-3,36 (m, 7Н, СН2-СН-СН2, NH-CH-CH2; 3,58 (s, 3Н, СООСН3); 4,71-4,82 (m, 1H, CH-COO); 5,72 (bd, 1H, NH); 6,50-8,00 (m, 17H, арил); метиловий ефір Ν-[3-фенілкарбонілтіо-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)-L-фенідаланіну: стереоізомер А (сполука 10): МС (С. І.): (М+Н)+=546; ТСХ (етилацетат:петролейний ефір = 95:5), Rf=0,33; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,60-3,38 (m, 7H, CH2-CH-CH2, NH-CH-СН2; 3,60 (s, 3Н, СООСН3); 4,79-4,90 (m, 1Н, CH-COO); 6,21 (bd, 1Η, ΝΗ); 7,29-7,81 (m, 2H, тіазоліл); 6,75-8,48 (m, 13H, феніл, фенілен, піридил); метиловий ефір N-[3-фенілкарбонілтіо-2-(3-піридилметил)пропіоніл]-4-(2-тіазоділ)-L-фенілаланіну: стереоізомер В (сполука 11): МС (С. І.): (М+Н)+=546; ТСХ (етилацетат:петролейний ефір = 95:5), Rf=0,24; 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,61-3,25 (m, 7H, CH2-CH-CH2, NH-CH-СН2); 3,60 (s, 3Н, СООСН3); 4,80-4,91 (m, 1Н, CH-COO); 6,09 (bd, 1Н, NH); 7,27-7,80 (m, 2H, тіазоліл); 7,10-8,40 (m, 13H, феніл, фенілен, піридил); метиловий ефір N-[2-ізобутил-3-фенілкарбонілтіопропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (сполука 12): 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 0,80-0,95 (m, 6Н); 1,30-1,80 (m, 3Н); 2,40-2,60 (m, 1Н); 3,00-3,30 (m, 4H); 3,70 (d, 3H); 4,90-5,05 (m, 1Н); 6,00-6,15 (bt, 1H); 7,10-8,00 (m, 11H); метиловий ефір Ν-[3-ацетилтіо-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (сполука 13): 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,30 (d, 3Н); 2,45-3,20 (m, 7Н); 3,63 (d, 3Н); 3,75 (d, 3Н); 4,70-4,93 (m, 1Н); 5,70-5,90 (dd, 1Н); 6,60-6,85 (m, 4H); 7,17-7,32 (m, 3H); 7,68-7,90 (m, 3H); метиловий ефір N-[3-ацетилтіо-2-(3-фторфеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (сполука 14): 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,29 (s, 3Н); 2,55-3,20 (m, 7H); 3,65 (2s, 3Н); 4,70-4,90 (m, 1H); 5,80-6,00 (2d, 1H): 6,70-7,32 (m, 3H); метиловий ефір N-[3-фенілкарбонілтіо-2-(2-тієніл)метилпропіоніл]-4-(2-тіазоліл)-L-феніладаніну (сполука 15): 1 H-ЯМР (200МГц, CDCІ 3): d (част./млн): 2,68-3,37 (m, 7Н); 3,60-3,61 (2s, 3Н, СООСН3); 4,31-4,45 (m, 1H, СН-СООСН3); 6,01-6,10 (2d, 1H, NH); 6,80-8,00 (m, 14H). Приклад 7 1 Одержання Ν-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (сполука 16) Метиловий ефір N-[(2S)-3-фенілкарбонілтіо-2-фенілметилпропіоніл]-4-(2-тіазоліл)-L-фенілаланіну (1,4г; 2,57ммоля), одержаний, як описано у прикладі 6, суспендували в етанолі (30мл), дегазували, барботуючи азотом, для вилучення кисню. До суспензії при 5°С додавали по краплях водний дегазований 1н. розчин гідроксиду натрію (7,7мл) і в кінці додавали додаткову порцію дегазованого етанолу (20мл). Реакційну суміш витримували при перемішуванні протягом 4год. при кімнатній температурі, після цього охолоджували до 0°С та підкисляли 5%-ною соляною кислотою (10мл). Реакційну суміш упарювали досуха і залишок збирали ацетонітрилом та водою і після цього фільтрували, одержуючи таким шляхом N-[(2S)-3-меркапто2-фенілметилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (1г). tпл 180-182°C. МС (С. І.): (М+Н)+=427. 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,80-1,88 (m, 1Н, SH); 2,22-2,84 (m, 5H, CH2-CH-CH2 ); 2,863,18 (m, 2H, CH2-CH-COO); 4,46-4,57 (m, 1H, CH-COO); 7,10-7,25 (m, 5H, феніл); 7,32-7,84 (m, 4H, фенілен); 7,74 (d, 1H, N-CH=CH-S); 7,89 (d, 1H, N-CH=CH-S); 8,35 (d, 1H, NH); 12,76 (s, 1Н, COOH). Аналогічним чином одержували наступні сполуки: N-[(2R)-3-меркапто-2-фенілметилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 17): 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,15-2,23 (m, 1Н, SH); 2,31-2,74 (m, 5Н, СН2-СН-СН2 ); 2,783,07 (m, 2Н, СН2-СН-СОО); 4,42-4,53 (m, 1H, СН-СОО); 7,02-7,80 (m, 9Н, феніл та фенілен); 7,75 (d, 1H, NCH=CH-S); 7,90 (d, 1H, N-CH=H-S); 8,36 (d, 1H, NH); Ν-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(2-фурил)-L-фенілаланін (сполука 18): tпл 153-155°C; МС (С. І.): (М+Н)+=410; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн); 1,40 (t, 1Н, SH); 2,45-3,25 (m, 7H, CH2-CH-CH2, CH2-CH-COO); 4,80-4,90 (m, 1H, CH-COO); 5,86 (d, 1H, NH); 6,42-7,42 (m, 3Н, фурил); 7,07-7,57 (m, 9H, феніл, фенілен); Ν-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(5-піримідиніл)-L-фенілаланін (сполука 19): tпл 193-195°C; MC (C. I.): (M+H)+=422; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,81 (bm, 1Н, SH); 2,21-3,20 (m, 7H, СH2-СН-CH2, СН2-С6Н4піримідиніл); 4,46-4,57 (m, 1H, CH-COO); 7,06-7,29 (m, 5H, феніл); 7,36-7,72 (m, 4Н, фенілен); 8,33 (d, 1H, NHCO); 9,08 (s, 2H, N-CH-C-CH-N); 9,15 (s, 1H, N-CH-N); N-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(2-піразиніл)-L-фенілаланін (сполука 20): tпл 176-178°C; MC (C. I.): (M+H)+=422; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,84 (bt, 1H, SH); 2,21-3,21 (m, 7H, СH2-СН-CH2, CH2-CHCOO); 4,48-4,59 (m, 1H, CH-COO); 7,10-7,26 (m, 5H, феніл); 7,37-8,05 (m, 4H, фенілен); 8,37 (d, 1H, NHCO); 8,58 (d, 1H, CH-N-CH-CH-N); 8,68-8,70 (m, 1H, CH-N-CH-CH-N); 9,21 (d, 1H, C-CH-N); 12,78 (b, 1H, COOH); N-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(3-піридил)-L-фенілаланін (сполука 21): tпл 146-148°C; MC (C. I.): (M+H)+=421; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,69-1,89 (b, 1Н, SH); 2,22-3,18 (m, 7H, CH2-CH-CH2, СН2фенілен); 4,45-4,56 (m, 1H, CH-COO): 7,09-7,26 (m, 5H, феніл); 7,42-7,48 (m, 1H, CH-N-CH-CH-CH); 7,62-7,33 (m, 4H, фенілен); 7,98-8,04 (m, 1H, CH-N-CH-CH-CH); 8,30 (d, 1H, CONH); 8,53 (dd, 1H, CH-N-CH-CH-CH); 8,83 (d, 1H, CH-N-CH-CH-CH): N-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(2-піридил)-L-фенілаланін (сполука 22): tпл 157-159°C; MC (С. I.): (M+H)+=421; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,87 (b, 1H, SH); 2,23-3,19 (m, 7H, S-CH2-CH-CH2, CONH-CHCH2); 4,44-4,45 (m, 1H, CH-COO); 7,09-7,93 (m, 8H, N-CH-CH-CH-CH, феніл); 7,30-7,99 (m, 4H, фенілен); 8,29 (d, 1Н, CONH); 8,61-8,65 (m, 1H, C-N-CH); N-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(2-тієніл)-L-фенілаланін (сполука 23): tпл 152-154°C; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,34-1,43 (m, 1Н, SH); 2,44-3,26 (m, 7H, S-CH2-CH-CH2, CONHCH-CH2); 4,80-4,89 (m, 1H, NH-CH-COO); 5,81 (d, 1H, NH); 7,02-7,52 (m, 12H, арил); N-[(2S)-3-меркапто-2- фенілметилпропіоніл]-4-(3-тієніл)-L-фенілаланін (сполука 24): tпл 169-171°С; MC (С. I.): (M+H)+=426; TCX (етилацетат:гексан:оцтова кислота = 50:50:5), Rf=0,44; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,84 (bs, 1H, SH); 2,23-3,13 (m, 7H, S-CH2-CH-CH2, NH-CH-CH2); 4,42-4,53 (m, 1H, NH-CH-СОО); 7,12-7,80 (m, 12H, арил); 8,30 (d, 1H, JHH=8,2Гц, NH); N-[(2S)-3-меркапто-2-фенілметилпропіоніл]-4-(3-фурил)-L-фенілаланін (сполука 25): tпл 140-142°С; MC (C. I.): (M+H)+=410; TCX (етилацетат:гексан:оцтова кислота = 50:50:5), Rf=0,42; 1 H-ЯМР (200МГц, CDCI 3): d (част./млн): 1,79-1,90 (m, 1H, SH); 2,22-3,11 (m, 7H, S-СH2-СН-CH2, NH-CHCH2); 4,41-4,53 (m, 1Н, NH-CH-СОО); 7,11-7,50 (m, 9H, феніл, фенілен); 6,91-8,12 (m, 3Н, фурил); 8,30 (d, 1H, JHH=8,2Гц, NH); N-[3-меркапто-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)-L-фенілаланін: стереоізомер А (сполука 26): tпл 193-196°C; МС (С. І.): (М+Н)+=428; ТСХ (метиленхлорид:метанол:оцтова кислота = 85:15:1,5), Rf=0,53; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,37-3,05 (m, 7Н, S - СН2-СН-СН2, NH-CH-СН2); 4,36-4,47 (m, 1Н, NH-CH-COO); 7,76-7,90 (т, 2Н, тіазоліл); 7,10-8,33 (m, 9Н, NH, піридил, фенілен); N-[3-меркапто-2-(3-піридилметил)пропіоніл]-4-(2-тіазоліл)-L-фенілаланін: стереоізомер В (сполука 27): МС (С. І.): (М+Н)+=428; ТСХ (метиленхлорид:метанол:оцтова кислота = 85:15:1,5), Rf=0,47; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,28-3,20 (m, 7Н, S - СН2-СН-СН2, NH-CH-СH2; 4,20-4,35 (m, 1H, NH-CH-COO); 7,70-7,90 (m, 2Н, тіазоліл); 7,17-8,40 (m, 9Н, NH, піридил, фенілен); N-(2-ізобутил-3-меркаптопропіоніл)-4-(2-тіазоліл)-L- фенілаланін (сполука 28): МС (С. І.): (М+Н)+=393; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 0,50-1,44 (m, 9H); 1,68-2,25 (m, 4H); 2,79-3,22 (m, 2Н); 4,504,63 (m, 1H); 7,34-7,85 (m, 4Н); 7,73-7,90 (m, 2Н); 8,27-8,39 (2d, 1H); N-[3-меркапто-2-(3-метоксифеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 29): МС (С. І.): (М+Н)+=457; 1 H-ЯМР (200МГц, ДМСО- d6+D2O): d (част./млн): 2,20-3,21 (m, 7Н); 3,70 (d, 3Н); 4,48 (m, 1Н): 6,55-6,86 (m, 3Н); 7,00-7,40 (m, 3Н); 7,65-7,95 (m, 4H); 8,27-8,45 (bt, CONH); Ν-[3-меркапто-2-(2-фторфеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 30): МС (С. І.): (М+Н)+=445; 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,20-3,18 (m, 8Н); 4,35-4,55 (m, 1Н); 6,85-7,35 (m, 6H); 7,657,90 (m, 4H); 8,35 (d, 1Н); N-[3-меркапто-2-(2-тіеніл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 31): 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,82-3,19 (m, 8Н, СН2-СН2-СН2; NH-CH-СН2); 4,44-4,59 (m, 1Н, СН-СОО); 6,62-7,91 (m, 9Н, арил); 8,42 (d, 1Н, NH); N-[3-меркапто-2-(2-фурил)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 32): 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 1,79-3,18 (m, 8Н, S-CH2-CH2-CH2; NH-CH-СН2); 4,43-4,58 (m, 4Н, CH-NH); 5,79-7,47 (m, 3H, фурил); 7,30-7,85 (m, 4H, фенілен); 7,73-7,91 (m, 2Н, тіазоліл); 8,40-8,46 (2d, 1Н, NH); N-[3-меркапто-2-(3-метил-5-ізоксазоліл)метилпропіоніл]-4-(2-тіазоліл)-L-фенілаланін (сполука 33): 1 H-ЯМР (200МГц, ДМСО-d6): d (част./млн): 2,00-2,12 (2s, 3Н, СН3-ізоксазоліл); 2,28-3,19 (m, 8Н, S-CH2CH2-CH2; СН2-фенілен); 4,43-4,59 (т, 1Н, CH-NH); 5,75-6,03 (2s, 1Н, ізоксазоліл); 7,29-7,86 (m, 4Н, фенілен); 7,74-7,90 (m, 2Н, тіазоліл); 8,46-8,53 (2d, 1Н, NH). Приклад 8 Оцінка фармакологічної активності іn vitro а) Інгібуюча активність щодо NEP Інгібуючу активність щодо NEP оцінювали на мембранах кіркового шару нирки щурів, одержаних відповідно до способу, описаного у Т. Maeda та ін. в Biochim. Biophys. Acta, 1983, 731 (1), 115-120. У самців щурів лінії Sprague-Dawley вагою приблизно 300г видаляли нирки та витримували при 4°С Кірковий шар нирки обережно відсікали, тонко подрібнювали і суспендували в гомогенізуючому буфері (10мМ фосфат натрію, рН 7,4, що містить1імМ MgCl2, 30мМ NaCl, 0,02% NaN3) у співвідношенні 1:15мас/об. Після цього тканину гомогенізували протягом 30сек. на холоді з використанням гомогенізатора типу UltraТurrах. Приблизно 10мл гомогенату нашаровували на 10мл сахарози (41% мас/об.) і центрифугували при 31200об./хв. протягом 30хв. при 4°С з фіксованим кутом ротора. Мембрани збирали з поверхні буферу/сахарози, двічі промивали 50мМ трис-НСІ-буфером (рН 7,4) та ресуспендували в цьому ж буфері для зберігання до використання у вигляді невеликих аліквотних кількостей при -80°С. Інгібуючу активність щодо NEP оцінювали відповідно до методу, описаного у С. Llorens та ін. в Eur. J. Pharmacol., 69, (1981), 113-116, згідно з даним описом. Аліквотні кількості одержаної за описаною вище методикою суспензії мембран (концентрація 5мкг/мл протеїнів) попередньо iнкубували в присутності інгібітора амінопептидази (бестатин-1мМ) протягом 10хв. при 30°С. Додавали [3Н] [Leu5-енкефалiн (15нМ) та трис-НСІ-буфер, рН 7,4 (50мМ) таким чином, щоб одержати кінцевий обсяг 100мкл. Інкубацію (20хв. при 30°С) припиняли, додаючи 0,1Μ НСl (100мкл). Утворення метаболіту [3Н] Tyr-Gly-Gly кількісно оцінювали за допомогою хроматографії на полістиролових колонках (Porapak Q). Відсоток інгібування утворення метаболіту в препаратах мембран, оброблених сполуками формули І та сполуками-еталонами, у порівнянні з необробленими препаратами мембран виражали у вигляді значення IC50 (нМ). б) Інгібуюча активність щодо АСЕ Інгібуючу активність щодо АСЕ оцінювали відповідно до методу, відомого з літератури [В. Holmquist та ін., Analytical Biochemistry, 95, 540-548 (1979)]. 50мкМ АСЕ (250міліод./мл, виділений з легені кролика, КФ 3.4.15.1, фірма SIGMA) попередньо інкубували в термостатованих кюветах при 37°С з 50мкл сполуки формули І або сполуки-еталону чи відповідного носія. Реакцію починали доданням 0,8мМ фурилакрилоїлфенілаланілгліцилгліцину (FAPGGSIGMA). Одночасно за допомогою спектрофотометра типу Beckman DU-50, оснащеного програмою для розрахунку дельта А/хв. та коефіцієнтів регресії кривих, що описують кінетику ферменту, реєстрували безперервно протягом 5хв. поглинання при 340нм. Відсоток інгібування ферменту в препаратах, оброблених сполуками формули І або сполуками-еталонами, у порівнянні з необробленими препаратами виражали у вигляді значення IC50 (нМ). Значення IC50 (нМ), відповідні інгібуючій активності щодо АСЕ та інгібуючій активності щодо NEP сполук 16, 18-25, 27-33 і сполук-еталонів тіорфану та каптоприлу, наведені нижче в таблиці 1. Таблиця 1 NEP-інгібуюча та АСЕ-інгібуюча активність, виражена у вигляді значення IC50 (нМ) сполук 16, 18-25, 27-33 і спрлук-еталонів тіорфану та каптоприлу Сполука 16 18 АСЕ-інгібуюча активність ІС50 (нМ) 3,2 1,8 NEP - інгібуюча активність IC50 (нМ) 1,8 1,8 19 20 21 22 23 24 25 27 28 29 30 31 32 33 тіорфан каптоприл 1,9 1,5 1,7 1,8 1,6 2,5 2,4 9,1 5,8 4,6 10,7 8,6 8,6 7,9 99 4,6 1,8 2,5 2,6 2,0 0,6 1,3 1 17,3 1,8 9,0 11,2 1,2 4,0 4,5 18 не активне Дані, наведені в таблиці 1, показують, що запропоновані згідно з винаходом сполуки формули І мають виражену змішану ACE/NEP-інгібуючу активність. Виявлена активність співставна з активністю каптоприлу щодо АСЕ-інгібуючої активності і вище активності тіорфану щодо NEP-інгібуючої активності. Приклад 9 Оцінка фармакологічної активності ex vivo а) Інгібуюча активність щодо NEP Інгібуючу активність щодо NEP ex vivo оцінювали відповідно до методу, відомого з літератури (М. Orlowsky та ін., Biochemistry, 1981, 20, 4942-4950). Інгібуючу активність сполук формули І оцінювали на нирках щурів зі спонтанною гіпертензією (SHR) через 5хв. після внутрішньовенної ін'єкції тестованих сполук (0,6 та 21мкмоль/кг) і через 30хв., 60хв. та 4год. після орального уведення (30мкмолей/кг) тестованих сполук. Після видалення нирок у щурів з SHR ниркову тканину гомогенізували та інкубували протягом 15хв. при 37°С в присутності глутарил-АІа-АІа-Рhе2-нафтиламіду (GAAP) як субстрату та амінопептидази Μ при рН 7,6. Реакцію припиняли, додаючи 10%-ний водний розчин трихлороцтової кислоти. 2-Нафтиламін, що вивільнюється, виявляли доданням барвника швидкий темно-червоний (2мл). Швидкості ферментативної реакції визначали виміром збільшення оптичної щільності при 524нм (ОП524) порівняно зі стандартом, одержаним для комплексу 2-нафтиламіну та швидкого темно-червоного. Інгібуючу активність тестованих сполук щодо ΝΕΡ виражали у вигляді відсотка інгібування ΝΕΡ в нирках SHR. б) Інгібуюча активність щодо АСЕ Інгібуючу активність щодо АСЕ ex vivo оцінювали відповідно до радіометричного методу, відомого з літератури [J. W. Ryan та ін., Biochem. J., (1977), 167, 501-504]. Інгібуючу активність сполук формули І оцінювали на легенях щурів зі спонтанною гіпертензією (SHR) через 5хв. після внутрішньовенної ін'єкції тестованих сполук (0,6 та 21мкмоль/кг) і через 30хв., 60хв. та 4год. після орального уведення (30мкмолей/кг) тестованих сполук. Після видалення легень у щурів з SHR тканину легені гомогенізували та інкубували протягом 2год. при 37°С в присутності [3H]Нур-Gly-Gly як субстрату. Реакцію припиняли доданням соляної кислоти. Радіоактивно мічену гіпурову кислоту, що звільнилася, екстрагували етилацетатом і рівень радіоактивності визначали за допомогою рідинної сцинтиляційної спектрометрії відповідно до загальноприйнятих методів. Інгібуючу активність тестованих сполук щодо АСЕ виражали у вигляді відсотка інгібування АСЕ в легенях SHR. Як приклад нижче в таблиці 2 наведені виражені у відсотках базові ферментативні активності, одержані в дослідах ex vivo після внутрішньовенного або орального уведення сполуки 16 і сполук-еталонів R-1, R-2, R-3 та R-4. Таблиця 2 Відсоток NEP-інгібування та АСЕ-інгібування ex vivo сполукою 16 і сполуками R-1, R-2, R-3 та R-4 Сполука Спосіб уведення 16 16 16 в.в. (0,6мкмоля/кг) в.в. (21мкмоль/кг) оральний (30мкмолей/кг) 16 R-1 R-2 R-3 R-4 оральний (30мкмолей/кг) оральний (30мкмолей/кг) оральний (30мкмолей/кг) оральний (30мкмолей/кг) оральний (30мкмолей/кг) АСЕ-інгібування (легені) 5 хвилин 60 хвилин 15% 72% 36% 30 хвилин 4 години 60% 45% 25% 20% 30% 25% 25% 20% 25% 10% NEP-інгібування (нирки) 5 хвилин 60 хвилин 34% 49% 39% 30 хвилин 4 години 55% 40% 5% не активне 30% не активне 10% 5% не активне не активне Дані, наведені в таблиці 2, підтверджують, що запропоновані згідно з винаходом сполуки формули І мають виражену ACE/NEP-інгібуючу активність як після внутрішньовенного, так і після орального уведення. При цьому в дослідах ex vivo ACE/NEP-інгібуюча активність сполук формули І виявилася істотно більш високою порівняно з такою сполук-еталонів.
ДивитисяДодаткова інформація
Назва патенту англійськоюThiol derivatives having an inhibiting activity relative to metal-peptidases, a pharmaceutical composition and a method for the treatment of cardiovascular diseases
Автори англійськоюSemeraro Claudio
Назва патенту російськоюТиольные производные, имеющие ингибирующую активность относительно металлопептидаз, фармацевтическая композиция и способ лечения сердечно-сосудистых заболеваний
Автори російськоюСемераро Клаудио
МПК / Мітки
МПК: C07D 417/12, A61K 31/426, C07D 307/54, C07D 277/20, C07D 213/55, A61K 31/4439, A61K 31/425, A61K 31/44, A61P 43/00, A61P 9/00, A61K 31/381, A61K 31/4427, C07D 241/12, C07D 333/24, C07D 277/30, C07D 239/26, A61K 31/495, A61K 31/505, A61K 31/38, A61K 31/34, A61K 31/341, A61K 31/00
Мітки: фармацевтична, похідні, інгібуючу, спосіб, металопептидаз, мають, лікування, серцево-судинних, захворювань, тіольні, активність, композиція
Код посилання
<a href="https://ua.patents.su/9-62923-tiolni-pokhidni-shho-mayut-ingibuyuchu-aktivnist-shhodo-metalopeptidaz-farmacevtichna-kompoziciya-ta-sposib-likuvannya-sercevo-sudinnikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Тіольні похідні, що мають інгібуючу активність щодо металопептидаз, фармацевтична композиція та спосіб лікування серцево-судинних захворювань</a>
Попередній патент: Спосіб одержання гетероядерних координаційних сполук
Наступний патент: Фармацевтична лікарська форма, що містить силанзетрон
Випадковий патент: Спосіб приглушення білого шуму в адитивній суміші з повністю відомим імпульсним сигналом