Кристалічна форма кальцію біс[(е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3r,5s)-3,5-дигідроксигепт-6-енової кислоти]
Номер патенту: 85062
Опубліковано: 25.12.2008
Автори: Джоунс Девід Він Калверт, Сіттерн Пітер Ентоні, Кребб Джеффрі Норман, Горбері Джон, Бут Ребекка Джейн
Формула / Реферат
1. Кристалічна гідратована форма сполуки: сіль кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] формули І
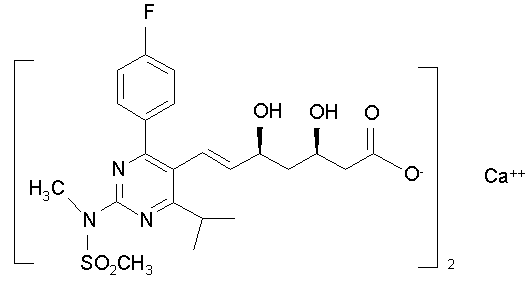 І,
І,
яка має рентгенодифрактограму порошку з піками при 2-тета (2q) = 8,8, 13,1 та 21,5°.
2. Кристалічна гідратована форма за п. 1, яка має рентгенодифрактограму порошку з піками при 2-тета (2q) = 4,3, 8,8, 13,1, 13,7, 21,5, 22,8 та 28,9°.
3. Кристалічна гідратована форма за п. 1, яка має рентгенодифрактограму порошку з піками при 2-тета (2q) = 4,3, 8,8, 13,1, 13,7, 15,2, 15,8, 17,5, 21,5, 21,9, 22,8, 24,5 та 28,9°.
4. Кристалічна гідратована форма за пп. 1, 2 або 3, котра містить приблизно 9-10 % води.
5. Кристалічна гідратована форма за п. 1, яка має рентгенодифрактограму порошку по суті таку, як показано на Фіг. 1.
6. Кристалічна форма сполуки формули І, яку визначено у п. 1, яка має рентгенодифрактограму порошку з піками при 2-тета (2q) = 4,4, 7,7, 9,0 та 20,7°.
7. Кристалічна форма сполуки формули І, яку визначено у п. 1, яка має рентгенодифрактограму порошку по суті таку, як показано на Фіг. 2.
8. Фармацевтична композиція, яка містить кристалічну форму за будь-яким з попередніх пунктів разом із фармацевтично прийнятним носієм.
9. Спосіб отримання аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти], що полягає у виділенні кристалічної форми, яку визначено у будь-якому з пп. 1-5, із розчину та наступному перетворенні в аморфну форму.
10. Спосіб за п. 9, що полягає у змішуванні розчину, який містить сіль кальцію [(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти], з кашкою у воді кристалічної форми, яку визначено у будь-якому з пп. 1-5, виділенні кристалів кристалічної форми, яку визначено у будь-якому з пп. 1-5, та наступному перетворенні отриманих кристалів в аморфну форму.
11. Спосіб за п. 10, де розчин, який містить сіль кальцію [(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти], є відпрацьованим розчином, як-то маточним розчином після утворення та виділення аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] з відповідної солі натрію та кальцій хлориду.
12. Спосіб за пп. 10 або 11, де змішування здійснюють між 37 та 43 °С.
13. Застосування кристалічної форми за будь-яким з пп. 1-5 як технологічної добавки для отримання аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти].
14. Застосування за п. 13, де технологічна добавка призначена для регенерації аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] із відпрацьованого розчину.
15. Застосування кристалічної форми за будь-яким із пп. 1-5, як інтермедіату у виробництві аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти].
16. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, котрий полягає в утворенні кристалів із насиченого розчину сполуки формули (І), яку визначено у п. 1, у водній солі натрію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти].
17. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, у котрому застосовують затравлювання водного розчину або кашки сполуки формули (І), яку визначено у п. 1.
18. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, у котрому застосовують тривале перемішування водного розчину аморфної форми сполуки формули (І), яку визначено у п. 1.
19. Спосіб виробництва фармацевтичної композиції за п. 8, котрий полягає у змішуванні кристалічної форми за будь-яким з пп. 1-5 з фармацевтично прийнятним носієм.
20. Застосування кристалічної форми за будь-яким із пп. 1-5 у виробництві медикаменту.
21. Спосіб лікування хворобливого стану, при якому є корисним інгібування HMG СоА-редуктази, спосіб полягає у застосуванні до теплокровного ссавця ефективної кількості кристалічної форми за будь-яким з пп. 1-5.
Текст
1. Кристалічна гідратована форма сполуки: сіль кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] формули І C2 2 (19) 1 3 85062 4 [метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти], є відпрацьованим розчином, як-то маточним розчином після утворення та виділення аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] з відповідної солі натрію та кальцій хлориду. 12. Спосіб за пп. 10 або 11, де змішування здійснюють між 37 та 43°С. 13. Застосування кристалічної форми за будь-яким з пп. 1-5 як технологічної добавки для отримання аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти]. 14. Застосування за п. 13, де технологічна добавка призначена для регенерації аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] із відпрацьованого розчину. 15. Застосування кристалічної форми за будь-яким із пп. 1-5, як інтермедіату у виробництві аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти]. 16. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, котрий полягає в утворенні кристалів із насиченого розчину сполуки формули (І), яку визначено у п. 1, у водній солі натрію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти]. 17. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, у котрому застосовують затравлювання водного розчину або кашки сполуки формули (І), яку визначено у п. 1. 18. Спосіб виробництва кристалічної форми за будь-яким із пп. 1-5, у котрому застосовують тривале перемішування водного розчину аморфної форми сполуки формули (І), яку визначено у п. 1. 19. Спосіб виробництва фармацевтичної композиції за п. 8, котрий полягає у змішуванні кристалічної форми за будь-яким з пп. 1-5 з фармацевтично прийнятним носієм. 20. Застосування кристалічної форми за будь-яким із пп. 1-5 у виробництві медикаменту. 21. Спосіб лікування хворобливого стану, при якому є корисним інгібування HMG СоА-редуктази, спосіб полягає у застосуванні до теплокровного ссавця ефективної кількості кристалічної форми за будь-яким з пп. 1-5. Заявлений винахід стосується нової кристалічної хімічної сполуки, а більш конкретно, нової кристалічної форми солі кальцію біс[(Е)-7-[4-(4флуорфеніл)-6-ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5іл](ЗР,58)-3,5-дигідроксигепт-6-енової кислоти], подалі позначеної як "засіб" та подалі ілюстрованої формулою (І), ця сполука є інгібітором ферменту 3-гідрокси-3-метилглутарил-кофермент Аредуктази (HMG CoA-редуктази) та є корисною як фармацевтичний засіб, наприклад, у лікуванні гіперліпіде-мії, гіперхолестеринемії та атеросклерозу а також інших хвороби або станів, у котрі залучено HMG СоА-редуктазу. Винахід також стосується способів виробництва кристалічної форми, фармацевтичних композицій, що містять кристалічну форму, та застосування кристалічної форми у лікуванні. Європейська заявка на патент, [публікація No.521471 (подалі ЕРА 521471)], котру тут охоплено посиланням, розкриває аморфну (порошкову) форму засобу, отриманого розчиненням відповідної солі натрію у воді, додаванням кальцій хлориду та збиранням отриманого осаду фільтрацією. [Міжнародна заявка на патент WO 2004/014872] розкриває поліпшений спосіб осадження аморфної форми засобу. [Міжнародна заявка на патент WO 00/42024] розкриває кристалічну форму засобу, віднесену тут до форми А, котру отримано із суміші води та одного або більше органічних розчинників, наприклад, суміші 1:1 ацетонітрилу та води. Однак, не знайдено придатних умов для отримання форми А із води без присутності органічного співрозчиннику. Застосування органічних розчинників у виробництв великого масштабу звичайно, є небажаним з точки зору впливу на навколишнє середовище (наприклад, позбавлення від великих об'ємів відходів) та міркувань безпеки (наприклад, якщо продукт є фармацевтичним засобом, потрібно забезпечити видалення органічних розчинників з кінцевого продукту). Тому є нагальна потреба знайти кристалічні форми засобу, котрі можна отримувати з одної тільки води. Ми несподівано знайшли, що засіб можна отримувати у др угій кристалічній формі з води без потреби у органічному співрозчинникові. Згідно із заявленим винаходом запропоновано кристалічну гідратовану форму засобу, яка має рентгенодифрактограму порошку з піками при 2 5 85062 тета (2q) = 8,8,1 3,1 та 21,5° (подалі віднесено до Форми В). Згідно із заявленим винаходом запропоновано кристалічну гідратовану форму засобу, яка має рентгенодифрактограму порошку з піками при 2тета (2q) = 4,3, 8,8, 13,1, 13,7,21,5, 22,8 та 28,9°. Згідно із заявленим винаходом запропоновано кристалічну гідратовану форму засобу, яка має рентгенодифрактограму порошку з піками при 2тета (2q) = 4,3, 8,8, 13,1, 13,7, 15,2, 15,8, 17,5, 21,5, 21,9, 22,8, 24,5 та 28,9°. Згідно із заявленим винаходом запропоновано кристалічну гідратовану форму засобу, яка має таку рентгенодифрактограму порошку по суті як показано на Фіг. 1. Форма В, отримана згідно із заявленим винаходом по суті є вільною від інших кристалічних та некристалічних форм засобу. Термін "по суті вільна від інших кристалічних та некристалічних форм" треба розуміти таким чином, що бажана кристалічна форма містить менше 50%, переважно менше 20%, більш переважно менше 10%, більше переважно менше 5% будь-якої іншої форми засобу. Спектр рентгенодифрактограми порошку (тут позначено РДГП або РДГ) визначали розміщенням зразку кристалічної форми на пластинчатому держателі з монокриста-лічного силіцію (SSC) фірми Сименс та нанесенням зразку тонким шаром за допомогою предметного скла для мікроскопу). Застосовуючи ди фрактометр Siemens D5000, зразок обертали при 30 обертах на хвилину (для поліпшення статистики підрахунку) та опромінювали рентгенівськими променями, генерованими мідною довгогострофокусною лампою при 40кВ та 40мА з довжиною хвилі 1,5406 ангстремів. Промені колімованого рентгенівського джерела проходили через автоматично регульований дивергентний щілинний агрегат при V20 (довжина шляху 20мм) та відбите випромінювання спрямовували через 2мм антирозсіювальну щілину та 0,2мм щілину детектора. Зразок експонували протягом 4 секунд зі ступенем зростання 2-тета 0,02 (безперервний спосіб сканування) у діапазоні 2 градуси-40 градусів 2-тета у режимі тета-тета. Час прогону був 2 години 6 хвилин та 40 секунд. Прилад оснащено детектором - сцинтиляційним лічильником. Керування та збір даних здійснювали експлуатаційним персональним комп'ютером DECpc LPv 433sx з програмою Diffrac AT (Socabim). Спектр рентгенодифрактограми порошку типового зразка форми В показано подалі на Фіг. 1. Зрозуміло, що величини 2-тета рентгенодифрактограми порошку можуть незначно змінюватися від одного пристрою до іншого або від одної форми В зразку до іншої, і таким чином цитовані величини не можна витлумачувати як абсолютні. Також треба розуміти, що відносні інтенсивності піків можуть змінюватися згідно орієнтації зразка при дослідженні, отже інтенсивності, показані у представленому тут записі РДГ, є ілюстративними, і не призначені для абсолютного співставлення. Форму В також можна охарактеризувати інфрачервоним спектром (ІЧ), як-то отриманим способом ІЧСДВФ (Ін фрачервона спектроскопія дифузного відбиття з перетворенням Фур'є). Спектр 6 ІЧСДВФ форми В показано подалі у Прикладі 1. Спектр отримували, застосовуючи масову частку 2% (у порошку KBr) у спектральному діапазоні 4,000 - 400 см -1 на спектрометрі Nicolet Magna 860 ESP FT-ІЧ. Умовами отримання спектрів були дискретне розділення 2см -1, 64 сканувань фону (тільки KBr) та 64 сканувань зразків (2% зразка, змішаного з KBr). Треба оцінювати, що на розділення спектра ІЧСДВФ може впливати розмір частинок досліджуваного зразку. Показаний подалі спектр форми В отримано на зразку, котрий подрібнено до тонкого порошку. Повторні зразки, або ці ж зразки альтернативного отримання можуть давати спектр ІЧСДВФ відмінного розділення, хоча частота позиції піку повинна бути незмінною. Форму В також можна охарактеризувати іншими аналітичними способами, відомими у рівні техніки. Звичайно форму В отримували у гідратованій формі, наприклад, з масовою часткою води приблизно 9-10%, наприклад, приблизно 9%. Форму В можна кристалізувати з насиченого розчину засобу у водній натрієвій солі [(Е)-7-[4-(4флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](ЗР,58)-3,5-дигідроксигепт6-енової кислоти] (подалі позначено як "сіль натрію1). Відповідно аморфну форму засобу застосовували як ви хідну речовину та її можна отримувати, наприклад, як описано у [ЕРА 521471]. Сіль натрію можна отримувати, як описано у [WO 00/49014] та подалі у Прикладі. Тому у подальшому аспекті заявленого винаходу запропоновано спосіб виробництва кристалічної гідратованої форми сполуки формули (І), котрий полягає в утворенні кристалів із насиченого розчину сполуки формули (І) у водній натрієвій солі біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5-іл](3R, 5S)-3,5-дигідроксигепт-6-енової кислоти]. Подальший аспект заявленого винаходу пропонує спосіб виробництва кристалічної гідратованої форми сполуки формули (І), котрий полягає в утворенні кристалів із насиченого розчину аморфної форми сполуки формули (І) у водній натрієвій солі біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2[метил(метилсульфоніл)аміно]піримідин-5-іл](3R, 5S)-3,5-дигідроксигепт-6-енової кислоти] Насичення розчину солі натрію засобом означає додавання, наприклад, аморфної форми до розчину солі натрію доти, поки розчин не буде насиченим стосовно аморфної форми. Подалі додають аморфну форму для підтримування насичення, після того, як почалась кристалізація форми В. Спосіб винаходу легко здійснювати між 20 та 45°С, ще легше між 30 та 45°С, а найлегше між 37 та 43°С, і переважно - приблизно при 40°C. Форму В можна також створювати затравлюванням водного розчину або кашки аморфної форми засобу, або тривалим перемішуванням розчину аморфної форми. Корисність сполуки винаходу можна показати стандартними тестами та клінічними дослідженнями, що охоплюють описані у [ЕРА 521471]. Згідно з подальшою особливістю винаходу запропоновано спосіб лікування хворобливого стану, 7 85062 де є благотворним інгібування HMG СоАредуктази, котрий полягає у застосуванні до теплокровного ссавця ефективної кількості форми В засобу. Винахід також стосується застосування форми В у виробництві медикаменту для застосування у хворобливому стані. Сполуку винаходу у разі її потреби можна застосовувати до теплокровної тварини, конкретно людини, для лікування хвороби, у котрій залучено HMG СоА-редуктазу, у формі звичайної фармацевтичної композиції. Тому у іншому аспекті винаходу запропоновано фармацевтичну композицію, що містить форму В у суміші з фармацевтично прийнятним носієм. Такі композиції для хворобливого стану, який бажано лікувати, можна застосовувати звичайним способом, наприклад, перорапьним, місцевим, парентеральним, бука-льним, назальним, вагінальним або ректальним, або інгаляцією. Для цього засіб можна формувати способом, відомим у рівні техніки, наприклад, у вигляді таблеток, капсул, водних або олійних розчинів, суспензій, емульсій, кремів, мазей, гелів, назальних спре-їв, супозиторіїв, тонко розділених порошків або аерозолів для інгаляції та для парентерального застосування (що охоплює внутрішньовенне, внутрішньом'зове або інфузію), стерильного водного або олійного розчину, або суспензії, або стерильної емульсії. Кращим шляхом застосування є пероральний. Засіб треба застосовувати до людей з добовою дозою, наприклад, у діапазонах, викладених у [ЕРА 521471]. Добові дози, якщо необхідно, можна надавати у розділених дозах, точна кількість засобу та шлях застосування залежить від маси, віку та статі пацієнта, якого лікують, та конкретного хворобливого стану, який лікують, згідно принципів, відомих у рівні техніки. Згідно з подальшою особливістю винаходу запропоновано спосіб виробництва фармацевтичної композиції, яка складається з форми В як активної складової, котра містить суміш форми В разом із фармацевтично прийнятним носієм. Треба розуміти, що спосіб, описаний у [WO2004/014872] для осадження аморфної форми засобу з (по суті) водного розчину відмінної форми солі, повинен, звичайно, приводити до частини залишкового засобу у відпрацьованих розчинах, як-то маточних розчинах, які залишилися після відфільтровування осадженого засобу. Навіть дуже мала частина такого залишку може призводити до значних фінансових втрат, якщо спосіб здійснювати багатократно у промисловомк виробництві. Будь-яке зменшення такого залишку також може призводити до корисності стосовно навколишнього середовища, зменшуючи об'єм обробки, якої потребують стоки перед їх видаленням. Ми виявили, що ци х втрат можна уникнути обробкою відпрацьованих розчинів (як-то маточних розчинів) таким чином, щоб виділяти залишок засобу як форму В, а тоді переробляти у бажану аморфну форму. Таким чином, форма В має значення як технологічна добавка для отримання аморфної форми засобу. Цей аспект винаходу ілюстровано у Прикладі 3. 8 Тому у подальшому аспекті винаходу запропоновано спосіб отримання аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил (метилсульфоніл)аміно]піримідин-5-іл](ЗР,53)-3,5дигідроксигепт-6-енової кислоти], що полягає, як вище визначено, у виділенні форми В із розчину та наступне перетворення в аморфну форму. У подальшому аспекті запропоновано спосіб отримання аморфної солі кальцію біс[(Е)-7-[4-(4флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигетг6-енової кислоти], що полягає у змішуванні розчину, який складається із солі кальцію [(Е)-7-[4-(4флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт -6-енової кислоти] з кашкою форми В у воді, виділенні форми В та наступному перетворенні виділеної форми В в аморфну форму, де форма В є такою, як вище визначено. Спосіб виділення форми В легко виконувати між 20 та 45°С, легше - між 30 та 45°C, ще легше між 37 та 43°C, а переважно - приблизно при 40°C. Розчин, який містить соль кальцію [(Е)-7-[4-(4флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] є просто відпрацьованим розчином, як-то маточним розчином для утворення та виділення аморфної солі кальцію біс[(Е)-7-[4(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] із відповідної солі натрію та кальцій хлориду. Треба розуміти, що цей відпрацьований розчин звичайно, повинен містити залишковий натрій хлорид, а можливо і домішки від попередніх стадій синтезу. Форма В, отримана таким способом, має високу чистоту, наприклад, >90% сухої маси, переважно >95%, більш переважно >99%. Зручно, коли кількість засобу у кашці форми В дорівнює приблизно 15моль% тієї кількості, що міститься у відпрацьованому розчині. Зручно, коли кашка та відпрацьований розчин є у концентрації приблизно 7мг/мл. У подальшому аспекті винаходу запропоновано застосування форми В (як вище визначено) як технологічної добавки для отримання аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти]. У подальшому аспекті винаходу запропоновано застосування форми В (як вище визначено) як технологічної добавки для регенерації аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)-3,5-дигідроксигепт-6-енової кислоти] із відпрацьованого розчину. У подальшому аспекті винаходу запропоновано застосування форми В (як вище визначено) як інтемедіату у виробництві аморфної солі кальцію біс[(Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3R,5S)3,5-дигідроксигепт-6-енової кислоти]. У певних обставинах засіб може існувати у кристалічній формі, котра, звичайно, стосується 9 85062 форми В, котра звичайно, має дальній порядок, але тільки обмежений ближній порядок, та котра, звичайно, має нижчий склад води ніж форма В. Цю форму, що стосується форми В, подалі віднесено до форми В-1. РДГ форми В-1 показано у Прикладі 2. Форму В-1 створено видаленням води із кристалічної решітки форми В. Після дегідратації дальній порядок форми В зберігається у формі В-1, але форма В-1 має тільки обмежений ближній порядок. Форму В-1 можна утворювати нагріванням зразку форми В до 60°С або зберіганням зразка форми В при відносній вологості 0% (BB), застосовуючи апаратуру, як-то DVS (D ynamic Vapour Sorption), наприклад, систему Surface Measurment Systems DVS_1, як описано у Прикладі 2. Форму В1 можна перетворювати назад у форму В придатним піддаванням дії води, наприклад, суспендуванням у воді. Як ілюстровано у Прикладі 2, форма В-1 показує відмінну РДГ у порівнянні з формою В. РДГ форми В-1 можна визначити способом, описаним вище для форми В. Тому у іншому аспекті запропоновано форму 'дегідратованого гідрату' засобу, яка має рентгенодифрактограму порошку з піками при 2-тета (2q) = 4,4, 7,7, 9,0 та 20,7 при BB 0%. У подальшому аспекті запропоновано 'дегідратований гідрат' засобу, який має рентгенодифрактограму порошку з піками при 2-тета (2q) = 4,4, 9,0 та 20,7 при BB 0%. У подальшому аспекті запропоновано 'дегідратований гідрат' засобу, який має рентгенодифрактограму порошку по суті як показано у Фіг. 2. Витримка форми В-1 при вологості вище 0% BB дозволяє воді знов увійти у кристалічну решітку до рівня, який визначається BB навколишнього середовища. Однак, пара води не спроможна легко пребудувати стр уктур у, щоб відтворити форму В, отже речовині продовжує бракувати ближнього порядку, і вода легко втрачається при зниженні відносної вологості. Абсорбція та десорбція води може приводити до малих зрушень піків РДГ. Спектр ІЧСДВФ форми В-1 наведено у Прикладі 2 подалі. Умови експерименту описано вище для форми В, за виключенням того, що зразок обережно подрібнювали. Винахід ілюстровано наступними Прикладами. Приклад 1 10 Водний натрій гідроксид (8% масова частка, 27,2мл) додавали при перемішувані до суміші метиламінової солі [(Е)-7-[4-(4-флуорфеніл)-6ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](ЗК58)-3,5-дигідроксигепт-6-енової кислоти] (30г) в очищеній воді (234мл) при 20°C, і суміші перемішували протягом 15 хвилин. Суміш можна фільтрува ти, якщо необхідно, щоб видалити нерозчинну речовину. Суміш концентрували під зниженим тиском при
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline form of bis [(e)-7-[4-(4-fluorophenyl) -6-isopropyl -2-[methyl(methylsulfonyl) amino]pyrimidin-5-yl](3r, 5s)-3,5-dihydroxyhept-6 -enoic acid] calcium salt
Автори англійськоюBooth Rebecca Jane, Cittern Peter Anthony, Crabb Jeffrey Norman, Horbury John, Jones David Wyn Calvert
Назва патенту російськоюКристаллическая форма кальция бис[(е)-7-[4-(4-флуорфенил)-6-изопропил-2-[метил(метилсульфонил)амино]пиримидин-5-ил](3r,5s)-3,5-дигидроксигепт-6-еновой кислоты]
Автори російськоюБут Ребекка Джейн, Ситтерн Питер Энтони, Кребб Джеффри Норман, Горбери Джон, Джоунс Девид Вин Калверт
МПК / Мітки
МПК: A61P 3/06, C07D 239/42, A61K 31/505
Мітки: кальцію, кристалічна, форма, біс[(е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3r,5s)-3,5-дигідроксигепт-6-енової, кислоти
Код посилання
<a href="https://ua.patents.su/9-85062-kristalichna-forma-kalciyu-bise-7-4-4-fluorfenil-6-izopropil-2-metilmetilsulfonilaminopirimidin-5-il3r5s-35-digidroksigept-6-enovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Кристалічна форма кальцію біс[(е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2-[метил(метилсульфоніл)аміно]піримідин-5-іл](3r,5s)-3,5-дигідроксигепт-6-енової кислоти]</a>
Попередній патент: Спосіб роботи двигуна внутрішнього згоряння з продовженим стиском
Наступний патент: Спосіб охолодження цементного клінкеру
Випадковий патент: Інгібітор регулюючої апоптотичні сигнали кінази












