18-метил-19-норандрост-4-ен-17,17-спіроефір (18-метил-19-нор-20-спірокс-4-ен-3-он) і фармацевтичний препарат, який його містить
Номер патенту: 94952
Опубліковано: 25.06.2011
Автори: Хюбнер Ян, Борден Штеффен, Мун Ханс-Петер, Прелле Катя, Менгес Фредерік, Кунке Йоахім, Галлус Норберт, Больманн Рольф
Формула / Реферат
1. 18-Метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-они загальної формули І
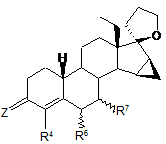 , Формула І
, Формула І
у якій
Z являє собою атом кисню, два атоми водню, групу =NOR або =NNHSO2R, де R являє собою атом водню або прямо ланцюгову або розгалужену алкільну групу, яка містить від 1 до 4 або від 3 до 4 атомів вуглецю,
R4 являє собою атом водню, атом галогену або трифторметильну групу,
R6 та/або R7 можуть мати α- або β-конфігурацію, і R6 і R7 незалежно один від одного являють собою атом водню або прямоланцюгову або розгалужену алкільну групу, яка містить від 1 до 4 або від 3 до 4 атомів вуглецю, або прямоланцюгову або розгалужену алкенільну групу, яка містить від 2 до 4 або від 3 до 4 атомів вуглецю, або насичену циклоалкільну групу, яка містить від 3 до 5 атомів вуглецю, або разом являють собою метиленову групу або подвійний зв'язок.
2. 18-Метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-они загальної формули І за пунктом 1, які відрізняються тим, що Z являє собою атом кисню.
3. 18-Метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-они загальної формули І за пунктом 1, які відрізняються тим, що R4 являє собою атом водню, метильну групу або атом хлору.
4. 18-Метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-они загальної формули І за пунктом 1, які відрізняються тим, що R6 і R7 разом являють собою 5α,6α- або 5β,6β-метиленову групу або додатковий зв'язок.
5. 18-Метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-они загальної формули І за пунктом 1, які відрізняються тим, що R7 являє собою α- або β-метил-, етил-, пропіл- або етенільну групу або α- або β-циклопропільний залишок.
6. Сполука за пунктом 1, вибрана з групи:
18-метил-15β,16β-метилен-19-нор-20-спірокса-4,6-дієн-3-он,
18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
18-метил-6β,7β,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он,
18-метил-6α,7α,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он
18-метил-15β,16β-метилен-7α-пропіл-19-нор-20-спірокс-4-ен-3-он,
18-метил-15β,16β-метилен-7β-пропіл-19-нор-20-спірокс-4-ен-3-он,
7α,18-диметил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7β,18-диметил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7α-етил-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7β-етил-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7α-етеніл-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7β-етеніл-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7α-циклопропіл-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
7β-циклопропіл-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
4,18-диметил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
4-хлор-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он,
4,18-диметил-6β,7β,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он,
4,18-диметил-6α,7α,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он,
4-хлор-18-метил-6β,7β,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он,
4-хлор-18-метил-6α,7α,15β,16β-диметилен-19-нор-20-спірокс-4-ен-3-он,
6β-фтор-18-метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3-он.
7. Фармацевтичний препарат, який містить принаймні одну сполуку за пунктом 1-6 і фармацевтично прийнятний носій.
8. Фармацевтичний препарат за пунктом 7, який додатково містить принаймні один естроген.
9. Фармацевтичний препарат за пунктом 8, який містить етинілестрадіол.
10. Фармацевтичний препарат за пунктом 8, який містить природний естроген.
11. Фармацевтичний препарат за пунктом 10, який містить естрадіол.
12. Фармацевтичний препарат за пунктом 10, який містить естрадіолу валерат.
13. Фармацевтичний препарат за пунктом 10, який містить щонайменше один кон'югований естроген.
Текст
1. 18-Метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-они загальної формули І 2 (19) 1 3 94952 4 18-метил-6α,7α,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он 18-метил-15β,16β-метилен-7α-пропіл-19-нор-20спірокс-4-ен-3-он, 18-метил-15β,16β-метилен-7β-пропіл-19-нор-20спірокс-4-ен-3-он, 7α,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7β,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7α-етил-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7β-етил-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7α-етеніл-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7β-етеніл-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 7α-циклопропіл-18-метил-15β,16β-метилен-19-нор20-спірокс-4-ен-3-он, 7β-циклопропіл-18-метил-15β,16β-метилен-19-нор20-спірокс-4-ен-3-он, 4,18-диметил-15β,16β-метилен-19-нор-20-спірокс4-ен-3-он, 4-хлор-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он, 4,18-диметил-6β,7β,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он, 4,18-диметил-6α,7α,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он, 4-хлор-18-метил-6β,7β,15β,16β-диметилен-19-нор20-спірокс-4-ен-3-он, 4-хлор-18-метил-6α,7α,15β,16β-диметилен-19-нор20-спірокс-4-ен-3-он, 6β-фтор-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он. 7. Фармацевтичний препарат, який містить принаймні одну сполуку за пунктом 1-6 і фармацевтично прийнятний носій. 8. Фармацевтичний препарат за пунктом 7, який додатково містить принаймні один естроген. 9. Фармацевтичний препарат за пунктом 8, який містить етинілестрадіол. 10. Фармацевтичний препарат за пунктом 8, який містить природний естроген. 11. Фармацевтичний препарат за пунктом 10, який містить естрадіол. 12. Фармацевтичний препарат за пунктом 10, який містить естрадіолу валерат. 13. Фармацевтичний препарат за пунктом 10, який містить щонайменше один кон'югований естроген. Даний винахід стосується 18-метил-15β,16βметилен-19-нор-20-спірокс-4-ен-3-онів [відповідно [(17S)-спіро[18а-гомо-15α,16α-дигідро-3'Нциклопропа-[15,16]естр-4-ен-17,2'-пергідрофуран]3-онів] загальної формули І Підходящою прямоланцюговою або розгалуженою алкільною групою, що містить від 1 до 4 або від 3 до 4 атомів вуглецю, є метильна, етильна, н-пропільна або н-бутильна група або ізопропільна, ізо- або трет-бутильна група. 6 7 У тих випадках, коли R та/або R представляє собою насичену циклоалкільну групу, то такою підходящою групою є циклопропільна, -бутильна або –пентильна група. 4 R переважно представляє собою атом водню, метильну групу або атом хлору. 4 6 Підходящий атом галогену R або R представляє собою атом фтору, хлору, брому або йоду; 4 6 Хлор є кращим для R ; R переважно предста6 вляє собою атом фтору. Атом галогену R переважно знаходиться в β положенні. 6 7 У тих випадках, коли R та/або R представляє собою прямоланцюгову або розгалужену алкільну групу, яка містить від 1 до 4 або від 3 до 4 атомів вуглецю, то такою підходящою групою є метильна, етильна, н-пропільна або н-бутильна група, або 6 7 ізопропільна, ізо- або трет-бутильна група. R і R переважно представляють собою атом водню й метильну, етильну або пропільну групу або разом представляють собою метиленову групу або подвійний зв'язок. У випадку алкенільного радикала 6 7 R та/або R , він представляє собою, особливо, етенільний радикал. Кращим характерним прикла6 7 дом насиченої циклоалкільної групи R та/або R , що містить від 3 до 5 атомів вуглецю, є циклопропільний радикал. Сполуки, наведені нижче, є особливо переважними відповідно до винаходу: 18-метил-15β,16β-метилен-19-нор-20-спірокса4,6-дієн-3-он у якій Ζ представляє собою атом кисню, два атоми водню, групу =NOR або =NNHSO2R, де R представляє собою атом водню або прямоланцюгову або розгалужену алкільну групу, яка містить від 1 до 4 або від 3 до 4 атомів вуглецю, 4 R представляє собою атом водню, атом галогену або трифторметильну групу, 6 7 R та/або R можуть мати α або β конфігура6 7 цію, і R і R незалежно один від одного представляють собою атом водню або прямоланцюгову або розгалужену алкільну групу, яка містить від 1 до 4 або від 3 до 4 атомів вуглецю, або прямоланцюгову або розгалужену алкенільну групу, яка містить від 2 до 4 або від 3 до 4 атомів вуглецю, або насичену циклоалкільну групу, яка містить від 3 до 5 атомів вуглецю, або разом представляють собою метиленову групу або подвійний зв'язок. Ζ представляє собою переважно атом кисню. У тих випадках, коли Ζ представляє собою групу =NOR або =NNHSO2R, то R переважно представляє собою атом водню. 5 18-метил-15β,16β-метилен-19-нор-20-спірокс4-ен-3-он 18-метил-6β,7β,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он 18-метил-6α,7α,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он 18-мeтил-15β,16β-мeтилeн-7α-пpoпiл-19-нop20-cпipoкc-4-ен-3-он 18-мeтил-15β,16β-мeтилeн-7β-пpoпiл-19-нop20-cпipoкc-4-ен-3-он 7α,18-димeтил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-eн-3-он 7β,18-димeтил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-eн-3-он 7α-eтил-18-мeтил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-ен-3-он 7β-eтил-18-мeтил-15β,16β-мeтилeн-19-нοр-20cпipoкc-4-ен-3-он 7α-eтeнiл-18-мeтил-15β,16β-мeтилeн-19-нop20-cпipoкc-4-ен-3-он 7β-eтeнiл-18-мeтил-15β,16β-мeтилeн-19-нop-2 0-cпipoкc-4-ен-3-он 7α-циклoпpoпiл-18-мeтил-15β,16β-мeтилeн-19нop-20-спірокс-4-ен-3-он 7β-циклoпpoпiл-18-мeтил-15β,16β-мeтилeн-19нop-20-спірокс-4-ен-3-он 4,18-димeтил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-eн-3-он 4-xлop-18-мeтил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-eн-3-он 4,18-димeтил-6β,7β,15β,16р-диметилен-19нор-20-спірокс-4-ен-3-он 4,18-диметил-6а,7α,15β,16β-диметилен-19нор-20-спірокс-4-ен-3-он 4-xлop-18-мeтил-6β,7β,15β,16β-димeтилeн-19нop-20-спірокс-4-ен-3-он 4-хлор-18-метил-6α,7α,15β,16β-димeтилeн-19нop-20-спірокс-4-ен-3-он 6β-фтop-18-мeтил-15β,16β-димeтилeн-19-нop20-спірокс-ен-3-он. Дроспіренон (6β,7β-15β,16β-димeтилeн-3-oxo17-пpeгн-4-ен-21,17β-кapбoлaктoн) є новим прогестогеном, який міститься, наприклад, у протизаплідному засобі для перорального застосування YASMIN® і в продукті ANGELIQ® для лікування постклімактеричних симптомів (обидва виробництва SCHERING AG). У зв'язку з його порівняно низкою афінністю до рецептора прогестогену і його порівняно високою дозою для інгібування овуляції, дроспіренон присутній в YASMIN® у відносно високій добовій дозі 3 мг. Відомо, що дроспіренон має, додатково до дії, що сприяє настанню або збереженню вагітності, також альдостеронантагоністичну (антимінералокортикоїдну) і антиандрогенну дію. 94952 6 Обидві ці властивості роблять дроспіренон дуже подібним за його фармакологічним профілем до природного прогестогену прогестерону, який, на відміну від прогестерону, має недостатню пероральну біодоступність. Отже, об'єктом даного винаходу є забезпечення нових сполук, які мають менш роз'єднаний профіль у порівнянні із дроспіреноном щодо їх зв'язування з рецептором прогестерону й мінералокортикоідним рецептором, і переважно мають більш сильне зв'язування, ніж дроспіренон, з рецептором прогестерону. Внаслідок цього, переважно ці нові сполуки мають більш ефективну дію, що сприяє настанню або збереженню вагітності, у порівнянні із дроспіреноном, але мають більш слабкою антимінералокортикоідну дію, ніж дроспіренон, або порівнянною з дією дроспіренону. Ця задача вирішується за допомогою забезпечення 18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-онів загальної формули І, описаних у даному винаході. Нові сполуки відрізняються в дослідженні зв'язування рецептора прогестерону, використовуючи цитозоль із гомогенату матки крон лика й 3 -прогестерон як порівняльну речовину, і вони мають порівняну або більш високу афінність до рецептора прогестерону, ніж дроспіренон, і більш низьку аффнність до мінералокортикоідного рецептора з гомогенату нирки кролика (див. таблицю 1). Таблиця 1 Приклад PR [KF] MR [KF] PR [RBA] MR [RBA] DRSP 2,5 0,3 40 333 2 2,34 0,4 43 250 6 1,13 0,6 88 167 7 1, 08 0,5 93 200 9 4,295 42 23 2 12 2,355 0,7 42 143 14 3,245 7,6 31 13 17 3,45 7,8 29 13 18 3,01 88 33 1 20 0,9 од 111,11 1000 3 3 PR [KF]: Н-прогестерон = 1; MR [KF]: Нальдостерон = 1; 3 PR [RBA]: H- прогестерон = 100; MR [RBA]: 3 Н-альдостерон = 100 Сполуки за винаходом несподівано відрізняються сильною дією, що сприяє настанню або збереженню вагітності, і є надзвичайно ефективними після підшкірного введення в тесті на збереження вагітності в щурів. Методика тесту на збереження вагітності в щурів: Видалення жовтого тіла або кастрація у вагітних щурів викликає аборт. Екзогенне введення прогестинів (прогестогенів) у комбінації з підходящою дозою естрогену забезпечує збереження вагітності. Тест на збереження вагітності в оваріектомованих щурів служить для визначення периферичної активності сполуки, яка сприяє настанню або збереженню вагітності. 7 Щурів парували при проеструсі протягом ночі. Спарювання перевіряли на наступний ранок, досліджуючи мазок з піхви. Наявність сперми в цьому випадку вважали днем 1 початку вагітності. На 8ий день вагітності, щурів піддавали оваріектомії під ефірним наркозом. Лікування тестованою сполукою й екзогенним естрогеном (естрон, 5 мкг/кг/доба) здійснювали шляхом підшкірного введення один раз доба від 8-го дня до 15-го дня або 21-го дня вагітності. Перше введення на 8-ий день здійснювали за 2 години до кастрації. Інтактний контроль одержували тільки наповнювач. Оцінка: Після закінчення експерименту (день 15 або день 21), тварин умертвляли в атмосфері СО2 і підраховували живі плоди (плоди з пульсуючим серцем) і ділянки імплантації (ранньої резорбції й мертвих плодів, включаючи аутолізовані й з атрофічною плацентою) в обох рогах матки. У день 22 додатково можна досліджувати плоди щодо наявності вад розвитку. У матці без плодів або ділянках імплантації, визначали кількість ділянок нідації шляхом фарбування 10% концентрованим розчином сульфіду амонію. Ступінь збереження вагітності розраховували у вигляді співвідношення кількості живих плодів до загального числа ділянок нідації (як резорбованих, так і мертвих плодів, а також ділянок нідації). Сполуки за винаходом загальної формули І мають дуже ефективну активність, що сприяє настанню або збереженню вагітності, і в той же час, незначне зв'язування з рецептором андрогену (дисоціація). Додатково було виявлено, що сполуки за винаходом мають натрій-утримуючу, наутрійуретичну (антимінералокортикоїдну) дію в адреналектомованих щурів. Завдяки їх активності, що сприяє настанню або збереженню вагітності, нові сполуки загальної формули І можуть використовуватися самостійно або в комбінації з естрогеном у фармацевтичних препаратах для контрацепції. Внаслідок їх сприятливого профілю дій, сполуки за винаходом особливо придатні для лікування передместруальних симптомів, таких як головні болі, депресивного настрою, утримання води й мастодинії. Дозування сполук за винаходом в контрацептивних продуктах становить від 0,01 до 5 мг, переважно від 0,01 до 2 мг, на добу. Добова доза для лікування предменструальних симптомів становить приблизно від 0,1 до 2 0 мг. Складові компоненти контрацептивних продуктів з активністю, що сприяє настанню або збереженню вагітності, і естрогенною активністю переважно спільно вводяться перорально. Добова доза переважно вводиться один раз на добу. Підходящими естрогенами є синтетичні естрогени, переважно етинілестрадіол, але також і местранол. Естроген вводиться в добовій кількості, що відповідає від 0,01 до 0,04 мг етинілестрадіолу. Нові сполуки загальної формули І також можуть застосовуватися у фармацевтичних препара 94952 8 тах для лікування перед-, пери- й постклімактеричних симптомів і в препаратах для гормональнозамісної терапії (HRT). Естрогени, які використовуються в таких препаратах, головним чином представляють собою природні естрогени, особливо естрадіол або його складні ефіри, наприклад естрадіолу валерат або ще кон'юговані естрогени (СЕЕ = кон'юговані кінські естрогени), як вони представлені, наприклад, у продукті PREMARIN®. Фармацевтичні препарати на основі нових сполук готують способом, відомим per se, шляхом обробки активного компонента, якщо це є підходящим, у комбінації з естрогеном, з речовинаминосіями, розріджувачами, якщо це є підходящим, ароматизаторами й т.д., які звичайно використовуються у фармацевтиці, і перетворення в бажану форму для введення. Підходящими для кращого перорального введення є, зокрема, таблетки, таблетки з оболонкою, капсули, пігулки, суспензії або розчини. Особливо придатними для перорального введення є масляні розчини, такі як, наприклад, розчини в кунжутній олії, рициновій олії й бавовняній олії. Для підвищення розчинності представляється можливим додавати солюбілізатори, такі як, наприклад, бензилбензоат або бензиловий спирт. Також представляється можливим включати речовини за винаходом в трансдермальну систему й використовувати її для трансдермального введення. Нові сполуки загальної формули І готують відповідно до винаходу, як описано нижче. Шлях синтезу для нових 19-нор-20-спіроксенонів наведений на схемі, з використанням як вихідної сполуки, наприклад, дієнолового простого ефіру 2 (Hofmeister та ін. Arzneim.-Forsch. 36(1), 781, 1986). Після цього сполуку 3 (R = метил) одержують шляхом метенілування 15-ацетату 2 за допомогою відомих методів, наприклад, з метилідом диметилсульфоксонію й гідроксидом натрію (див., наприклад, DE-A 11 83 500, DE-A 29 22 500, ЕР-А 0 019 690, US-A 4,291,029; Е. J. Corey і М. Chaykovsky, J. Am. Chem. Soc. 84, 867 (1962)). 9 Потім здійснюють алілування в положенні 17, наприклад, із бромідом алілмагнію в простому діетиловому ефірі, одержуючи сполуку 4. При здійсненні обробки гідроборуванням, наприклад, з 9-борабіцикло[3.3.1]нонаном і окисної обробки, наприклад, з перекисом водню одержували в пер6 винному спирті 5. Введення Δ подвійного зв'язку здійснювали шляхом бромування 3,5-дієнольного ефіру 5 і наступного видалення бромистого водню (див., наприклад, J. Fried, J. A. Edwards, Organic Reactions in Steroid Chemistry, van Nostrand Reinhold Company 1972, стор. 265 - 374). Бромування дієнольного ефіру можна здійснювати аналогічно до, наприклад, методу J. A. Zderic, Humberto Carpio, A. Bowers і Carl Djerassi в Steriods 1, 233 (1963).Видалення бромистого водню здійснювали шляхом нагрівання 6-бромсполуки з лужними реагентами, такими як, наприклад, LiBr або L12CO3 в апротонних розчинниках, таких як диметилформамід, при температурах 50120 °С або ще шляхом нагрівання 6-бром-сполук у розчиннику, такому як колідин або лутидин, одержуючи сполуку 6. Потім сполуку 6 перетворювали шляхом мете6 нілування Δ подвійного зв'язку за допомогою відомих методів, наприклад, з метилідом диметилсульфоксонію (див., наприклад, DE-A 11 83 500, DE-A 29 22 500, ЕР-А 0 019 690, US-A 4,291,029; Е. J. Corey і М. Chaykovsky, J. Am. Chem. Soc. 84, 867 (1962)) у сполуку 7, одержуючи в результаті суміш α і β ізомерів (сполуки 3а/3b), які можуть бути розділені на окремі ізомери, наприклад, шляхом хроматографії. 4 Введення замісника R можна здійснювати, використовуючи як вихідну речовину, наприклад, 4 сполуку формули (6) шляхом епоксидування Δ подвійного зв'язку з перекисом водню в лужних умовах і взаємодії отриманих епоксидів у підходящому розчиннику з обробкою кислотами загальної 4 4 формули H-R , де -R може являти собою атом галогену або псевдогалоген, або взаємодії каталітичних кількостей мінеральної кислоти й, якщо це є підходящим, то отримані 4-бром-сполуки загаль4 ної формули І (де R = бром) піддають реакції з метил 2,2-дифтор-2-(фторсульфоніл)ацетатом у диметилформаміді в присутності йодиду міді (І). Введення б-метиленової групи можна здійснювати, використовуючи як вихідну речовину, наприклад, похідне 3-аміно 3,5-дієну шляхом взаємодії з формаліном у спиртовому розчині з утворенням 6α-гідроксиметильної групи й наступного кислотного видалення води, наприклад, із соляною кислотою в діоксані/воді. Однак видалення води також можна здійснити таким чином, щоб у вихідному положенні гідрокси групу заміняли групою, яка краще вилучається, і потім видаляли. Прикладами підходящих груп, які вилучаються, є мезилат, тозилат або бензоат (див. DE-A 34 02 3291, ЕР-А 0 150 157, US-A 4,584,288; K. Nickisch та ін., J. Med. Chem. 34, 2464 (1991)). Подальшою можливістю одержання 6метиленових сполук є безпосередня взаємодія 4(5) незаміщених 3-кетонів з ацеталями формальдегіду в присутності ацетату натрію, наприклад, з оксихлоридом фосфору або пентахлоридом фос 94952 10 фору в підходящим розчинникам, таких як хлороформ (див., наприклад, K. Annen, Η. Hofmeister, H. Laurent і R. Wiechert, Synthesis 34 (1982)). 6-Метиленові сполуки можна використовувати для одержання сполук загальної формули І, у якій 6 6 7 R представляє собою метил, і R і R разом утворюють додатковий зв'язок. Для цього представляється можливим застосовувати, наприклад, спосіб, описаний D. Burn та ін. в Tetrahedron 21, 1619 (1965), у якому ізомеризацію подвійного зв'язку здійснюють шляхом нагрівання 6-метиленових сполук в етанолі з каталізатором 5% паладієм на вугіллі, який попередньо обробляють або у воднем або шляхом нагрівання з невеликою кількістю циклогексену. Ізомеризацію також можна здійснювати з каталізатором, який не піддався попередній обробці, якщо в реакційну суміш додають невелику кількість циклогексену. Появі невеликих кількостей гідрованих продуктів можна запобігти шляхом додавання надлишку ацетату натрію. Однак також можна прямо одержати похідні бметил-4,6-дієн-3-ону (див. К. Annen, Η. Hofmeister, H. Laurent ι R. Wiechert, Lieb. Ann. 712 (1983)). 6 Сполуки, у яких R представляє собою функціональну α-метильну групу, можуть бути отримані з 6-метиленових сполук шляхом гідрування в підходящих умовах. Найкращих результатів (селективне гідрування екзо-метиленової функціональної групи) досягають шляхом трансферного гідрування (Е. A. Brande, R. P. Lmstead і P. W. D. Mitchell, J. Chem. Soc. 3578 (1954)). Нагрівання похідних 6метилену в підходящому розчиннику, такому як, наприклад, етанол, у присутності донора гідриду, такого як, наприклад, циклогексен, приводить до дуже гарного виходу 6α-метильних похідних. Невеликі порції 6β-метильних сполук можуть бути ізомеризовані з кислотою (див., наприклад, D. Burn, D. N. Kirk і V. Petrow, Tetrahedron 1619 (1965)). Також можливе цільове одержання 6βалкільних сполук. Для цієї мети, 4(5)-ненасичені 3кетони піддають реакції, наприклад, з етиленгліколем, триметилортоформіатом у дихлорметані в присутності каталітичної кількості кислоти (наприклад, п-толуолсульфоновоі кислоти) з одержання відповідних 3-кеталів. Подвійний зв'язок в 5(6) положенні ізомеризується при здійсненні цієї кеталізаци. Селективне епоксидування цього 5(6) подвійного зв'язку здійснюють, наприклад, за допомогою органічних перкислот, наприклад, мхлорпербензойної кислоти, у підходящих розчинниках, таких як дихлорметан. Як альтернатива для цього шляху, епоксидування також можна здійснювати з перекисом водню в присутності, наприклад, гексахлорацетону або 3нітротрифторацетофенону. Після цього утворені 5α,6α-епоксиди можна відкривати аксіально за допомогою підходящих галогенідів алкілмагнію або сполук алкіллітію. У такий спосіб одержують 5α-гідрокси-6β-алкільні сполуки. Можна здійснювати розщеплення 3-кето-захисні групи для одержання функціональної 5α-гідрокси групи шляхом обробки в м'яких кислотних умовах (оцтової кислоти або 4н. соляної кислоти при 0°С). При лужному 11 видаленні функціональної 5α-гідрокси групи, наприклад, з розведеним водним розчином гідроксиду натрію одержують 3-кето 4-ен-сполуки з 6алкільною групою в β конфігурації. Як альтернатива до цього шляху, при кетальному розщепленні в більш жорстких умовах (водна соляна кислота або інша сильна кислота) одержують відповідні 6αалкільні сполуки. Сполуки, заміщені в положенні 7 алкільною, алкенільною або циклоалкільною групою, можуть бути отримані, як описано в прикладах або аналогічно до цих методів, використовуючи реагенти, аналогічні до описаних. Отримані сполуки загальної формули І, у якій Ζ представляє собою атом кисню, можна, якщо це є бажаним, перетворювати шляхом взаємодії з гідрохлоридом гідроксиламіну в присутності третинного аміну при температурах в інтервалі від -20 до +40 °С у їх відповідні оксими (загальної формули І зі значенням Ζ =ΝΟΗ, де гідрокси група може бути синтетичною або анти) . Підходящими третинними основами є, наприклад, триметиламін, триетиламін, піридин, Ν,Ν-диметиламінопіридин, 1,5-діазабіцикло[4,3,0]нон-5-єн (DBN) і 1,5діазабіцикло[5,4,0]ундец-5-ен (DBU), кращим є піридин. Це здійснюють аналогічно до описаного в заявці WO 98/24801 для одержання відповідних 3оксііміно похідних дроспіренону. Видалення 3-оксо групи для одержання кінцевого продукту загальної формули І, де Ζ представляє собою два атоми водню, можна здійснювати, наприклад, за допомогою методу, описаного в DEA 28 05 4 90, шляхом відновного розщеплення тіокеталю 3-кето сполуки. Наступні приклади служать для більш докладного пояснення винаходу: Приклад 1 18-метил-15β,16β-метилен-19-нор-20-спірокса4,6-дієн-3-он а) 3-метокси-18-метил-15β,16β-метилен-естра3,5-дієн-17-он Суспензію 92,0 г 15α-ацетокси-3-метокси-18метилестра-3,5-дієн-17-ону (Hofmeister та ін. Arzneim.-Forsch. 36(1), 781, 1986) в 500 мл диметилсульфоксиду додавали до суспензії 254 г йодиду триметилсульфоксонію в 1165 мл диметилсульфоксиду, який попередньо перемішували з 43,5 г гідроксиду натрію при кімнатній температурі в атмосфері аргону протягом 2 годин. Його перемішували при кімнатній температурі додатково протягом 1,5 години. Після цього здійснювали перемішування в 15 л льодяної води / хлориду натрію, і осад відфільтровували, промивали водою, і висушували у вакуумі при 60 °С. 94,5 г 3-метокси18-метил-15β,16β-метилен-естра-3,5-дієн-3-ону одержували у вигляді неочищеного продукту. 134 135°С, [α]D-215,2° (хлороформ, с = 9,9 мг/мл) б) 3-метокси-18-метил-15β,16β-метилен-17α(проп-2-еніл)-естра-3,5-дієн-17β-ол 574 мл 1М розчину броміду алілмагнію в простому діетиловому ефірі додавали до розчину 75,8 г 3-метокси-18-метил-15β,16β-метилен-естра-3,5дієн-17-ону в 920 мл дихлорметану при 0°С і перемішували при 0°С в атмосфері аргону протягом 1 години. Після цього по краплях додавали 290 мл 94952 12 насиченого розчину хлориду амонію при 0°С, перемішували при 0°С протягом 0,5 години, додавали воду, ресуспендували в етилацетаті, промивали водою до досягнення нейтрального стану, висушували над сульфатом натрію, і концентрували у вакуумі. 86,5 г 3-мeтoкcи-18-мeтил-15β,16βметилен-17α-(проп-2-еніл)-естра-3,5-дiєн-17β-oлy одержували у вигляді неочищеного продукту. Кристали очищеної сполуки мали точку плавлення 110-112°С, [α]D= -80,2° (хлороформ, с = 9,94 мг/мл). в) 17α-(3-Гідроксипропаніл)-3-метокси-18метил-15β,16β-метилєн-естра-3,5-дієн-17β-ол 1,5 л 0,5М розчину 9-борабіцикло[3.3.1]нонану в тетрагідрофурані додавали до розчину 86,5 г 3метокси-18-мeтил-15β,16β-мeтилeн-17α-(проп-2еніл)естра-3,5-дiєн-17β-oлy віл тетрагідрофурану при 25 °С, і суміш перемішували при 25 °С в атмосфері аргону протягом 4 годин і потім, при 0°С, повільно по краплях додавали 33,77 г гідроксиду натрію в 475 мл води й, після перемішування при 25 °С протягом 5 хвилин, повільно по краплях додавали 172 мл 30% концентрованого перекису водню й перемішували при 25°С протягом 18 годин. Після цього здійснювали перемішування в льодяній воді/хлориді натрію, осад видаляли шляхом фільтрації, промивали водою й висушували насухо у вакуумі при 60 °С. 91,5 г 17α-(3гідроксипропаніл)-3-мeтoкcи-18-мeтил-15β,16βметилен-естра-3,5-дiєн-17β-oлy одержували у вигляді неочищеного продукту. Кристали очищеної сполуки мали точку плавлення 152-154°С, [α]D = 155,2° (хлороформ, с = 9,7 6 мг/мл). г) 17β-Гідрокси-17α-(3-гідроксипропаніл)-18метил-15β,16β-метилен-естра-4,6-дієн-3-он До суспензії 91,5 г 17α-(3-гідроксипропаніл)-3мeтoкcи-18-мeтил-15β,16β-метилен-естра-3,5-дієн17β-олу в 915 мл 1-метил-2-піролідону послідовно додавали, при 0°С, 91,5 мл 10% концентрованого розчину ацетату натрію й, при цій температурі, 35,9 г 1,3-дибром-5,5-диметилгідантоїну порціями, суміш перемішували при 0°С (льодяна баня) протягом 0,5 години, додавали 34 г броміду літію й 29,9г карбонату літію, і суміш перемішували при температурі бані 100°С протягом 3,5 годин. Потім перемішували в льодяній воді/хлориді натрію, і осад видаляли шляхом фільтрації, промивали водою й перемішували у вологому стані з 250 мл етилацетату. 44,1 г 17β-гідрокси-17α-(3гідроксипропаніл)-18-метил-15β,16β-мeтилeнecтpa-4,6-дієн-3-ону одержували у вигляді кристалів із точкою плавлення 132 - 135°С, [α]D = -14,0° (піридин, с = 4,28 мг/мл). д) 18-Метил-15β,16β-меатилен-19-нор-20спірокса-4,6-дієн-3-он 720 мг хлориду п-толуолсульфонілу додавали до розчину 1,07 г 17β-гідрокси-17α-(3гідроксипропаніл)-18-метил-15β,16β-метиленестра-4,6-дієн-3-ону в 2,5 мл піридину, і суміші перемішували при кімнатній температурі протягом 18 годин. Після цього додавали воду й три рази екстрагували етилацетатом, і об'єднані органічні фази промивали 1М соляною кислотою, водою й соляним розчином до досягнення нейтрального стану, висушували над сульфатом натрію, концен 13 трували у вакуумі й хроматографували на силікагелі з гексаном/етилацетатом. Одержували 630 мг очищеного 18-мeтил-15β,16β-метилен-19-нор-20спірокса-4,6-дієн-3-ону. При здійсненні кристалізації з ацетону/гексану одержували кристали із точкою плавлення 134 - 135°С, [α]D = -80,6 °С (хлороформ, с = 10,03 мг/мл). Приклад 2 18-метил-6α, 7α, 15β,16β-диметилен-19-нор20-спірокс-4-ен-3-он Суспензію 9,41 г йодиду триметилсульфоксонію в 210 мл диметилсульфоксиду перемішували з 1,71 г гідриду натрію (60% у маслі) при кімнатній температурі в атмосфері аргону протягом 2 годин і, після додавання 5,7 г 18-метил-15β,16βметилен-19-нор-20-спірокса-4,б-дієн-3-ону (= приклад 1), і перемішували при кімнатній температурі протягом 20 годин. Звичайна обробка включала додавання води, екстрагування три рази етилацетатом, промивання водою й соляним розчином до досягнення нейтрального стану, висушування над сульфатом натрію, розпарювання насухо у вакуумі й хроматографування на силікагелі з дихлорметаном/ацетоном. Фракція II хроматографії надавала 438 мг 18-метил-6α,7α,15β,16βдиметилен-19-нор-20-спірокс-4-ен-3-ону. При здійсненні кристалізації з ацетону одержували кристали із точкою плавлення 228-230°С, [α]D = +40,2° +/0,2° (хлороформ, с = 11,1 мг/мл) Приклад 18-метил-6β,7β,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 2, із фракції І хроматографії одержували 1,2 г 18метил-6β,7β,15β,16β-димeтилeн-19-нop-20cпipoкc-4-eн-3-oнy. При здійсненні кристалізації з ацетону/гексану одержували кристали із точкою плавлення 154-155 °С, [α]D = -175,1° (хлороформ, с = 9,5 мг/мл). Приклад 4 18-метил-15β,16β-метилен-7α-пропіл-19-нор20-спірокс-4-ен-3-он 31,2 мг хлориди міді (І) додавали до розчину 1,0 г 18-метил-15β,16β-мeтилeн-19-нop-20cпipoкca-4,6-дієн-3-ону (= приклад 1) в 20 мл тетрагідрофурану при кімнатній температурі, і суміш перемішували протягом 10 хвилин, після цього охолоджували до 15°С, додавали 200 мг хлориду алюмінію, перемішували при цій температурі протягом 30 хвилин, по краплях додавали 3,34 мл розчину броміду пропілмагнію (2М у тетрагідрофурані), і перемішували при -15°С протягом однієї години. Звичайна обробка включала додавання 3 мл 2М соляної кислоти до реакційної суміші при -15 °С, перемішування при кімнатній температурі протягом 0,5 години, додавання води, екстрагування три рази з етилацетатом, висушування над сульфатом натрію, концентрування у вакуумі, і хроматографування на силікагелі з гексаном/етилацетатом. При здійсненні кристалізації фракції І одержували 233 мг 18-метил-15β,16β-метилен-7α-пропіл-19-нор-20спірокс-4-ен-3-ону у вигляді кристалів із точкою плавлення 142 - 143°С, [α]D = -2,1° (хлороформ, с = 9,5 мг/мл). 94952 14 Приклад 5 18-метил-15β,16β-метилен-7β-пропіл-19-нор20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 4, із фракції II хроматографії одержували 241 мг 18-метил-15β,16β-мeтилeн-7β-пpoпiл-19-нop-20cпipoкc-4-eн-3-oнy у вигляді твердої речовини із точкою плавлення 87-88°С, [α]D = -10,8° (хлороформ, с = 10,0 мг/мл) Приклад 6 7α,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 4 з 3М броміди метилмагнію в простому ефірі замість броміду пропілмагнію, із фракції І хроматографії одержували 483 мг 7α,18-диметил-15β,16βметилен-19-нор-20-спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 190 - 191°С, [α]D = 6,5° (хлороформ, с = 10,16 мг/мл). Приклад 7 7β,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 6, із фракції II хроматографії одержували 201 мг 7β,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 172 - 173°С, [α]D = -11,2° (хлороформ, с = 10,35 мг/мл). Приклад 8 7α-етил-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 4 з ЗМ бромідом етилмагнію в простому ефірі замість броміду пропілмагнію, із фракції І хроматографії одержували 4 53 мг 7α-етил-18-метил15β,16β-метилен-19-нор-20-спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 197198°С, [α]D = -6,7° (хлороформ, с = 10,42 мг/мл). Приклад 9 7β-Етил-18-метил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-ен-3-он При здійсненні методу відповідно до прикладу 8, із фракції II хроматографії одержували 113 мг 7β-eтил-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 185-187 °С, [α]D = -11,7° (хлороформ, с = 9,4 мг/мл). Приклад 10 7α-етилен-18-метил-15β,16β-мeтилeн-19-нop20-cпipoкc-4-ен-3-он При здійсненні методу відповідно до прикладу 4, із фракції І хроматографії одержували 280,6 мг 7α-етеніл-18-метил-15β,16β-мeтилeн-19-нop-20cпipoкc-4-eн-3-oнy у вигляді твердої речовини із точкою плавлення 188 - 190 °С, [α]D = -59,8° (хлороформ, с = 9,87 мг/мл). Приклад 11 7β-Εтеніл-18-метил-15β,16β-мeтилeн-19-нop20-cпipoкc-4-ен-3-он При здійсненні методу відповідно до прикладу 4, із фракції II хроматографії одержували 54,4 мг 7β-Етеніл-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-ону у вигляді твердої речовини із е точкою плавлення 149 - 150°С. [α]D = -37,6 (хлороформ, с = 5,11 мг/мл). 15 Приклад 12 7α-циклопропіл-18-метил-15β,16β-мeтилeн-19нop-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 4, із фракції І хроматографії одержували 360 мг 7α-циклопропіл-18-метил-15β,16β-метилен-19-нор20-спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 167- 168°С. [α]D = -55,3° (хлороформ, с = 10,14 мг/мл). Приклад 13 7β-Циклопропіл-18-метил-15β,16β-метилен-19нор-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 4, із фракції II хроматографії одержували 63 мг 7βциклопропіл-18-метил-15β,16β-метилен-19-нор-2 0-спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 124 - 126°С. [α]D = -16,9° (хлороформ, с = 10,18 мг/мл). Приклад 14 4,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он а) 15α-ацетокси-3,3-етилендіокси-18-метил-19нор-андрост-5-ен-17-он 4 0 мл етиленгліколю й 27,5 мл триметилортоформіату додавали до розчину 10 г 15αацетокси-3-метокси-18-метил-естра-3,5-дієн-17ону в 140 мл дихлорметану й, після додавання 670 мг пара-толуолсульфонової кислоти, суміш перемішували при кімнатній температурі протягом 1 години. Після цього додавали 1,8 5 мл піридину, розводили дихлорметаном, промивали насиченим розчином бікарбонату натрію, водою й соляним розчином, висушували над сульфатом натрію й концентрували у вакуумі. Одержували 11,1 г неочищеного 15а-ацетокси-3,3-етилендіокси-18метил-19-нор-андрост-5-ен-17-ону. б) 3,3-етилендіокси-18-метил-15β,16βметилен-19-нор-андрост-5-ен-17-он Суспензію 28,75 г йодиду триметилсульфоксонію в 210 мл диметилсульфоксиду перемішували з 4,92 г гідриду натрію (60% у маслі) при кімнатній температурі в атмосфері аргону протягом 2 годин і, після додавання 11,1 г 15α-ацетокси-3,3етилендіокси-18-метил-19-нор-андрост-5-ен-17ону, перемішували при кімнатній температурі протягом 20 годин. Звичайна обробка включала додавання води, екстракцію три рази етилацетатом, промивання водою й соляним розчином до досягнення нейтрального стану, висушування над сульфатом натрію й концентрування насухо у вакуумі. Одержували 10,2 г неочищеного 3,3етилендіокси-18-метил-15β,16β-метилен-19-норандрост-5-ен-17-ону. При здійсненні кристалізації з ацетону одержували кристали із точкою плавлення 221,7 °С. в) 3,3-етилендіокси-18-метил-15β,16βметилен-17α-(проп-2-еніл)-19-нор-андрост-5-ен17β-ол 71 мл 1М розчину броміду алілмагнію в простому діетиловому ефірі повільно додавали до розчину 10,2 г 3,3-етилендіокси-18-метил-15β,16βмeтилeн-19-нop-андрост-5-ен-17-ону в 120 мл дихлорметану при 0°С, і суміш перемішували при 0°С протягом однієї години. Після цього по краплях додавали 4 0 мл насиченого розчину хлориду 94952 16 амонію, перемішували при 0°С протягом 0,5 години, додавали воду, екстрагували етилацетатом, промивали водою й соляним розчином до досягнення нейтрального стану, висушували над сульфатом натрію й концентрували насухо у вакуумі. При здійсненні хроматографії на силікагелі з гексаном/етилацетатом одержували 7,33 г очищеного 3,3-етилендіокси-18-метил-15β,16β-метилен-17α(проп-2-еніл)-19-нор-андрост-5-ен-17β-олу г) 3,3-етилендіокси-17α-(3-гідроксипропіл)-18метил-15β,16β-метилен-19-нор-андрост-5-ен-17βол 1,4 л 0,5М розчину розчину 9борабіцикло[3.3.1]нонану в тетрагідрофурані додавали до розчину 8 0,3 г 3,3-етилендіокси-18метил-15β,16β-метилен-17α-(проп-2-еніл)-19-нopaндpocт-5-eн-17β-oлy в 900 мл тетрагідрофурану при 25 °С, і суміш перемішували при 25 °С в атмосфері аргону протягом 4 годин, потім повільно по краплях додавали 30,5 г гідроксиду натрію а 425 мл води при 0°С, перемішували при 25°С протягом 5 хвилин, повільно по краплях додавали 155 мл 30% концентрованого перекису водню, і перемішували при 25°С протягом 18 годин. Після цього розводили етилацетатом, промивали водою, висушували над сульфатом натрію й концентрували насухо у вакуумі при 60 °С. Одержували 80,7 г 3,3етилендіокси-17α-(3-гідроксипропіл)-18-метил15β,16β-метилен-19-нор-андрост-5-ен-17β-олу у вигляді масла. д) 3,3-етилендіокси-18-метил-15β,16βмєтилен-19-нор-20-спірокс-5-ен Розчин 80,7 г 3,3-етилендіокси-17α-(3гідроксипропіл)-18-мeтил-15β,16β-мeтилeн-19-нopaндpocт-5-eн-17β-oлy в 170 мл піридину змішували з 48 г пара-толуолсульфонілхлориду й перемішували при 25 °С протягом 24 годин. Потім його розводили етилацетатом, промивали водою й насиченим соляним розчином до досягнення нейтрального стану, висушували над сульфатом натрію й концентрували насухо у вакуумі при 60 °С. Одержували 7 5,8 г неочищеного продукту. При здійсненні хроматографії на силікагелі з гексаном/етилацетатом одержували 50,5 г очищеного 3,3-етилендіокси-18-метил-15β,16β-метилен-19нор-20-спірокс-5-ену. Кристали очищеної сполуки мали точку плавлення 58 - 60 °С, [α]D = -9,3° (хлороформ, с = 10,59 мг/мл). е) 18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он 50 мл водної сірчаної кислоти (концентрація 8%) додавали до розчину 50,5 г 3,3-етилендіокси18-метил-15β,16β-метилен-19-нор-20-спірокс-5-ену в 500 мл метанолу, і суміш перемішували при 25°С протягом 8,5 годин. Після цього додавали розчин бікарбонату натрію, екстрагували три рази етилацетатом, промивали водою до досягнення нейтрального стану, висушували над сульфатом натрію й концентрували насухо у вакуумі при 50 °С. одержували 46,2 г неочищеного продукту. При здійсненні хроматографії на силікагелі з дихлорметаном/ацетоном одержували 25,8 г очищеного 18метил-15β,16β-метилен-19-нор-20-спірокс-4-ен-3ону. Кристали очищеної сполуки мали точку плав 17 94952 лення 208-210 °С, [а]о = +4,4° (хлороформ, с = 10,1 мг/мл). ж) 4,18-диметил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он До розчину 508 мг трет-бутилату калію в 20 мл трет-бутанолу додавали, при температурі бані 100 °С, розчин 1 г 18-метил-15β,16β-метилен-19-нор20-спірокс-4-ен-3-ону в 20 мл трет-бутанолу і, протягом 4 годин, другий розчин 1,46 мл йодметану в 50 мл трет-бутанолу, і суміш перемішували при температурі бані 100 °С протягом додаткової години. Потім його концентрували у вакуумі до однієї третини об'єму, розводили етилацетатом, два рази промивали водою й три рази насиченим соляним розчином, висушували над сульфатом натрію й концентрували насухо у вакуумі. Одержували 1,1 г неочищеного продукту. При здійсненні хроматографії на силікагелі з гексаном/етилацетатом одержували 301,2 мг 4,18-диметил-15β,16β-метилен19-нор-20-спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 155-156°С. [α]D = +1° (хлороформ, с = 10,75 мг/мл). Приклад 15 4-хлор-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-он 0,38 мл сульфурилхлориду додавали до розчину 1 г 18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-ону в 10 мл піридину при температурі бані 0°С, і продовжували перемішувати протягом 3 годин. Після цього додавали воду, екстрагували три рази етилацетатом, промивали водою до досягнення нейтрального стану, висушували над сульфатом натрію й концентрували насухо у вакуумі. Одержували 1,2 г неочищеного продукту. При здійсненні хроматографії на силікагелі з гексаном/етилацетатом одержували 604,8 мг очищеного 4-хлор-18-метил-15β,16β-метилен-19-нор-20спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 149-151°С. [α]D = +9,4° (хлороформ, с = 11,06 мг/мл). Приклад 16 4,18-диметил-6α, 7α, 15β,16β-диметилен-19нор-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 14 з 0,5 г 18-метил-6α,7α,15β,16β-диметилен-19нор-20-спірокс-4-ен-3-ону одержували 220 мг 4,18диметил-6а,7α,15β,16β-диметилен-19-нор-20спірокс-4-ен-3-ону у вигляді твердої речовини із точкою плавлення 190-191°С. [α]D = +103,3° (хлороформ, с = 10,22 мг/мл). Приклад 17 4,18-диметил-6β,7β,15β,16β-диметилен-19нор-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 14 з 0,66 г 18-мeтил-6β,7β,15β,16β-диметилен-19 Комп’ютерна верстка Т. Чепелева 18 нор-20-спірокс-4-ен-3-ону одержували 186,7 мг 4,18-диметил-6β,7β,15β,16β-димeтилeн-19-нop-20cпipoкc-4-eн-3-oнy у вигляді твердої речовини із точкою плавлення 175-177°С. [α]D = -230,7° (хлороформ, с = 10,79 мг/мл). Приклад 18 4-Хлор-18-метил-6β,7β,15β,16β-диметилен-19нор-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 15 з 0,66 г 18-мeтил-6β,7β,15β,16β-димeтилeн-19нop-20-cпipoкc-4-ен-3-ону одержували 303,4 мг 4хлор-18-метил-6β,7β,15β,16β-димeтилeн-19-нop20-cпipoкc-4-eн-3-oнy у вигляді твердої речовини із точкою плавлення 152-153°С. [α]D = -222,7° (хлороформ, с = 10,30 мг/мл). Приклад 19 4-Хлор-18-метил-6α,7α,15β,16β-диметилен-19нор-20-спірокс-4-ен-3-он При здійсненні методу відповідно до прикладу 15 з 534 мг 18-метил-6а,7α,15β,16β-димeтилeн-19нop-20-cпіpoкc-4-ен-3-ону одержували 128 мг 4хлор-18-метил-6α,7α,15β,16β-димeтилeн-19-нop20-cпipoкc-4-eн-3-oнy у вигляді твердої речовини із точкою плавлення 177-178°С. [α]D = +80,0° (хлороформ, с = 9,94 мг/мл). Приклад 20 6β-Фтор-18-метил-15β,16р-метилен-19-нор-20спірокс-4-ен-3-он а) 3-Ацетокси-18-метил-15β,16β-метилен-19нор-20-спірокса-3,5-дієн Суспензію 0,25 г 18-метил-15β,16β-метилен19-нор-20-спірокс-4-ен-3-ону в 2,5 мл ізопропенілацетату змішували з 24 мг ларатолуолсульфонової кислоти й перемішували при 80 °С в атмосфері аргону протягом 1 години. Для здійснення обробки, додавали 0,1 мл триетиламіну й концентрували насухо у вакуумі. Одержували 0,28 г очищеного 3-ацетокси-18-метил-15β,16βмeтилeн-19-нop-20-cпipoкca-3,5-дієну. б) 6β-Фтор-18-метил-15β,16β-метилен-19-нор20-спірокс-4-ен-3-он 0,26 г 1-хлорметил-4-фтор-1,4діазоніабіцикло[2,2,2]октану біс(тетрафторборату) додавали до розчину 0,28 г 3-ацетокси-18-метил15β,16β-метилен-19-нор-20-спірокса-3,5-дієну в 7,8 мл ацетонітрилу при кімнатній температурі в атмосфері аргону, і суміш перемішували протягом 15 хвилин. Звичайна обробка включала додавання етилацетату, промивання водою й соляним розчином, висушування над сульфатом натрію, концентрування насухо у вакуумі й хроматографування на силікагелі з гексаном/етилацетатом. Із фракції І хроматографії одержували 23 мг 6β-фтор-18метил-15β,16β-мeтилeн-19-нop-20-cпipoкc-4-eн-3oнy у вигляді піни. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською18-methyl-19-nor-androst-4-en-17,17-spiroether (18-methyl-19-nor-20- spirox-4-en-3-one) and pharmaceutical preparations containing the same
Автори англійськоюBohlmann Rolf, Kuhnke Joachim, Huebner Jan, Gallus Norbert, Menges Frederik, Borden Steffen, Muhn Hans-Peter, Prelle Katja
Назва патенту російською18-метил-19-норандрост-4-ен-17,17-спироэфир(18-метил-19-нор-20-спирокс-4-ен-3-он) и фармацевтический препарат, который его содержит
Автори російськоюБольманн Рольф, Кунке Йоахим, Хюбнер Ян, Галлус Норберт, Менгес Фредерик, Борден Штеффен, Мун Ханс-Петер, Прелле Катя
МПК / Мітки
МПК: A61P 5/42, A61K 31/58, A61P 5/34, C07J 53/00
Мітки: препарат, 18-метил-19-норандрост-4-ен-17,17-спіроефір, фармацевтичний, містить, 18-метил-19-нор-20-спірокс-4-ен-3-он
Код посилання
<a href="https://ua.patents.su/9-94952-18-metil-19-norandrost-4-en-1717-spiroefir-18-metil-19-nor-20-spiroks-4-en-3-on-i-farmacevtichnijj-preparat-yakijj-jjogo-mistit.html" target="_blank" rel="follow" title="База патентів України">18-метил-19-норандрост-4-ен-17,17-спіроефір (18-метил-19-нор-20-спірокс-4-ен-3-он) і фармацевтичний препарат, який його містить</a>
Попередній патент: Пристрій для нанесення мастила на гребені бандажів колісних пар залізничного транспортного засобу на криволінійних ділянках шляху
Наступний патент: Агоністи рецепторів ep2
Випадковий патент: Спосіб лікування порушень ліпідного обміну у людей літнього віку без ожиріння













