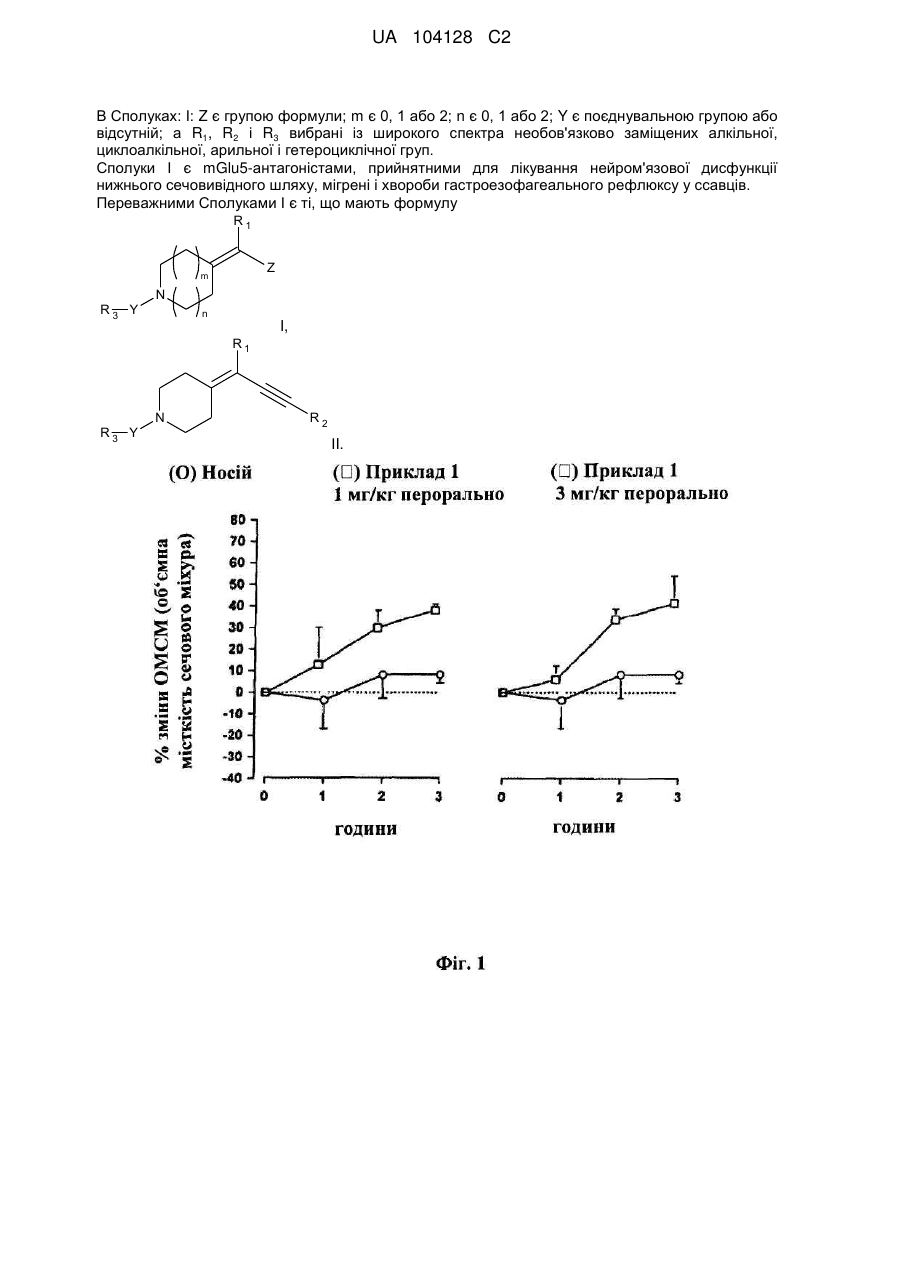
Гетероциклічні сполуки як антагоністи mglu5
Номер патенту: 104128
Опубліковано: 10.01.2014
Автори: Лонгі Маттео Марко, Гразіані Давіде, Мотта Джіанні, Поггесі Елена, Леонарді Амедео, Ріва Карло
Формула / Реферат
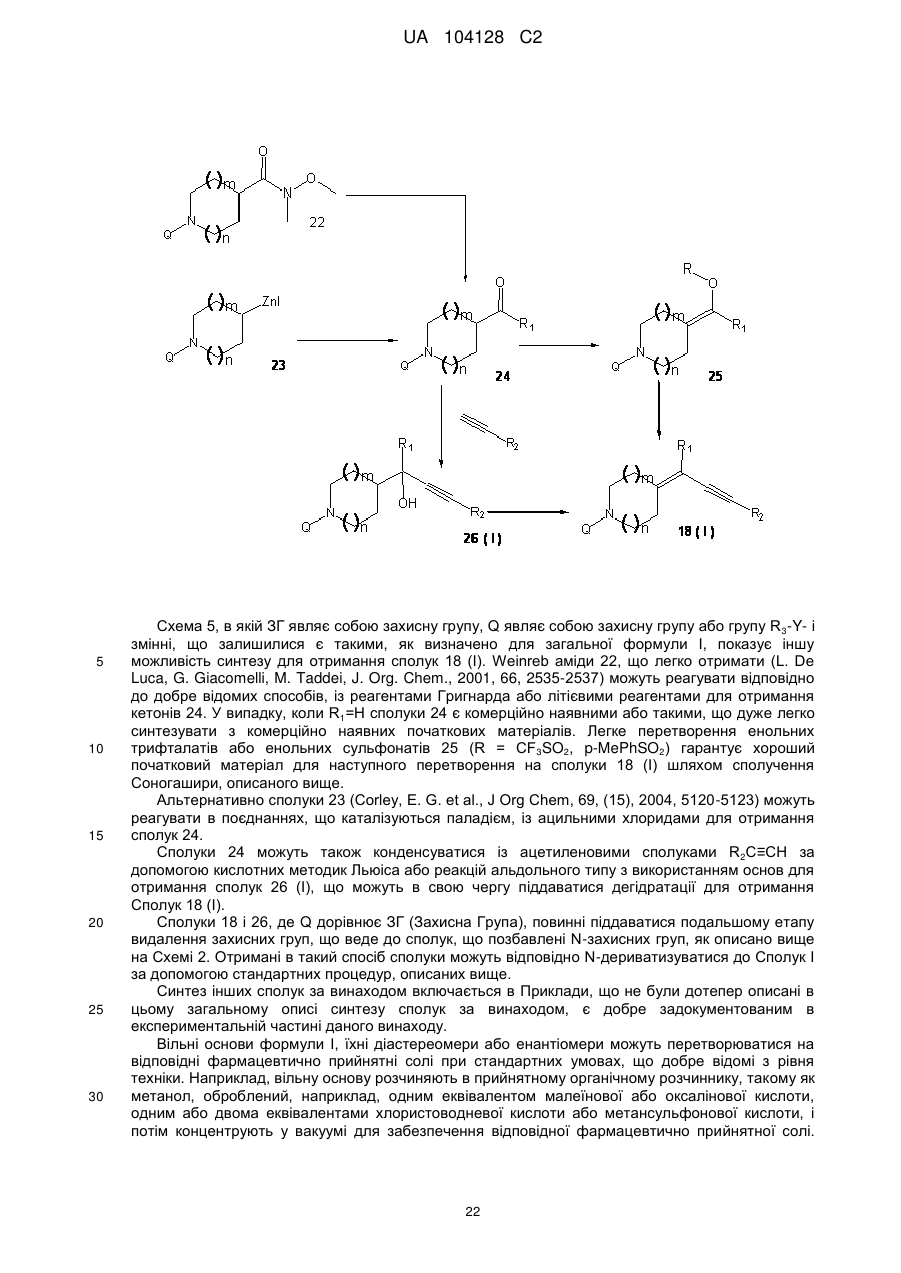
1. Сполука, що має загальну формулу І
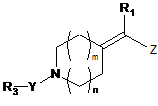 , I
, I
де
Z являє собою групу формули -СºС-R2 або -СН=СН-R2;
R1 являє собою
атом водню або галогену, або
гідрокси, ціано, С1-С6алкільну, С1-С6алкілкарбонільну, С1-С6алкокси, С1-С6алкоксикарбонільну, С1-С6алкілкарбонілокси, С1-С6алкоксикарбонілокси, С1-С6алкілтіо, ді-(С1-С6алкіл)-аміно або С3-С14циклоалкільну групу,
R2 являє собою
необов'язково заміщену моно- або біциклічну С1-С9гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки,
необов'язково заміщену моно-, бі- або трициклічну С6-С14арильну групу,
необов'язково заміщену С1-С6алкільну групу,
необов'язково заміщену С2-С6алкенільну групу або
необов'язково заміщену С3-С6циклоалкільну групу,
або R2 являє собою групу -C(O)-R2A, де R2A визначений як R2 вище;
R3 являє собою атом водню,
необов'язково заміщену С1-С6алкільну групу,
необов'язково заміщену моно-, бі- або трициклічну С1-С14гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки,
необов'язково заміщену моно-, бі- або трициклічну С6-С14арильну групу,
необов'язково заміщену С3-С6циклоалкільну групу або
необов'язково заміщену С3-С6циклоалкенільну групу,
Y являє собою групу формули -С(О)-, -C(S), -NH-C(O)-, -N(С1-С6алкіл)-С(О)-, -О-С(О)-, -NH-C(S)-, -N(С1-С6алкіл)-С(S)-, -O-C(S)- або -SO2-, або відсутній;
m є 0, 1 або 2;
n є 0, 1 або 2;
замісниками для кожної необов'язково заміщеної групи є
атом галогену або оксо, нітро, ціано, гідрокси, карбамоїльна, С1-С6алкілсульфонільна, С1-С6алкілтіо, С1-С6алкілкарбонільна або С1-С6алкілкарбоніл-(С1-С6)алкільна група, або група формули -NR*R*, де кожний R* незалежно являє собою атом водню або С1-С6алкільну, С1-С6алкілкарбонільну, фенільну або бензильну групу, або
С1-С6алкільна, С2-С6алкенільна, С2-С6алкінільна або С1-С6алкоксигрупа, кожна з яких може необов'язково нести від 1 до 8 незалежно вибраних оксо, гало, ціано, нітро, аміно, гідрокси або фенільних замісників,
C3-C9моно- або біциклоалкільна група, що необов'язково несе від 1 до 3 незалежно вибраних С1-С6алкільних, оксо, гало, ціано, нітро, аміно, гідрокси або фенільних замісників, або
група формули -А, -О-А, -С(О)-А, -(CH2)q-A, -NR**-A, -C(O)NR**-A, -NR**C(O)-A або -ОС(О)-А,
де А являє собою фенільну групу або С1-С8гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки, причому кожна із груп А може необов'язково нести від 1 до 3 незалежно вибраних гало, гідрокси, ціано, нітро і С1-С6алкільних замісників,
кожний R** незалежно являє собою атом водню або С1-С6алкільну групу, і
q є 0 або ціле число від 1 до 6;
за умови, якщо Z являє собою групу формули -СН=СН-R2, тоді R1 являє собою атом водню, і оксо та гідрокси виключено з факультативних замісників;
або її енантіомер, діастереомер, N-оксид або фармацевтично прийнятна сіль.
2. Сполука за п. 1, де Z являє собою групу формули -СºС-R2, де R2 визначено в п. 1.
3. Сполука за п. 2, де R1 являє собою атом водню або фтору або метильну групу.
4. Сполука за будь-яким із попередніх пунктів, де m є 1 і n є 1.
5. Сполука за будь-яким із попередніх пунктів, де Y являє собою групу формули -С(О)-, -NH-C(O)-, -N(С1-С6алкіл)-С(О)-, -О-С(О)-, -NH-C(S)- або -SO2-, або відсутній.
6. Сполука за будь-яким із попередніх пунктів, де R2 являє собою
необов'язково заміщену моно- або біциклічну С1-С9гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки,
необов'язково заміщену фенільну групу,
необов'язково заміщену С1-С6алкільну групу,
необов'язково заміщену С2-С6алкенільну групу,
необов'язково заміщену С3-С6циклоалкільну групу,
або R2 являє собою групу -C(O)-R2A, де R2A визначений як R2 в цьому пункті.
7. Сполука за п. 6, де R2 являє собою необов'язково заміщену піролідинільну, тіазолільну, піридильну, хінолільну, хіноксалінільну або фенільну групу, причому замісниками для кожної необов'язково заміщеної групи є атом фтору, хлору або брому або оксо, нітро, ціано, ціанометильна, ацетильна, метильна, метокси, етокси, ізопропокси, трифторметильна, трифторметокси, ацетаміно, 2,2-диметилпропаноїламіно, 3,3-диметил-2-оксо-1-азетидинільна, 1-піролідинілметильна, 1H-піразол-1-ільна, 3-метил-1,2,4-оксадіазол-5-ільна або морфоліногрупа.
8. Сполука за п. 7, де R2 являє собою піридильну або фенільну групу, заміщену атомом фтору та/або метильною групою, причому інші замісники є необов'язковими.
9. Сполука за п. 7, де R2 являє собою 6-метил-2-піридильну, 5-ціано-2-піридильну, 3-фторфенільну, 2,5-дифторфенільну групу або 3,5-дифторфенільну групу.
10. Сполука за будь-яким із попередніх пунктів, де R3 являє собою
С1-С6алкільну групу, заміщену необов'язково заміщеною групою А,
необов'язково заміщену моно- або біциклічну С1-С9гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки,
необов'язково заміщену фенільну групу,
необов'язково заміщену С3-С6циклоалкільну групу або
необов'язково заміщену С3-С6циклоалкенільну групу.
11. Сполука за п. 10, де R3 являє собою моно- або біциклічну С1-С9гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки, і щонайменше 2 суміжних атомів вуглецю, один з яких зв'язується з атомом азоту проілюстрованого кільця, що містить азот (Y є відсутнім), та інший з яких несе ціано- або нітрозамісник, причому подальші замісники є необов'язковими.
12. Сполука за п. 10, де R3 являє собою необов'язково заміщену піролідинільну, піразолільну, імідазолільну, 1,2,4-триазолільну, ізоксазолільну, фурильну, тієнільну, піридильну, піперидильну, піразинільну, піримідинільну, морфолінільну, імідазо[2,1-b]тіазолільну, індолільну, ізоіндолільну, імідазо[1,2-а]піридильну, 1,2,3-бензотриазолільну, хінолільну, ізохінолільну, хіноксалінільну, піридо[2,3-b]піразинільну, 1,4-бензоксазинільну або фенільну групу, причому замісниками для кожної необов'язково заміщеної групи є атом фтору, хлору, брому або йоду або метильна, ізопропільна, метокси, етокси, пропокси, ціано, нітро, трифторметильна, трифторметокси, ацетильна, ацетаміно, фенільна, бензилокси, фенілкарбамоїльна, 4-фторфенільна, 3-фтор-4-метилфенільна, 2-фурильна, 2-тієнільна, 4-піридильна, піперидино, 2-піримідинільна, 2-піримідинілокси, 1,3-тіазол-2-ільна, 2-метил-1,3-тіазол-4-ільна, 2-оксопіролідин-1-ільна, 5-метил-1,2,4-оксадіазол-3-ільна, 2,5-диметил-1H-пірол-1-ільна група.
13. Сполука за п. 10, де R3 являє собою 6-метил-3-нітро-2-піридильну, 6-метил-3-ціано-2-піридильну, 4-метокси-3-ціано-2-піридильну, 3-ціано-2-тієнільну або 3-ціано-2-піразинільну групу.
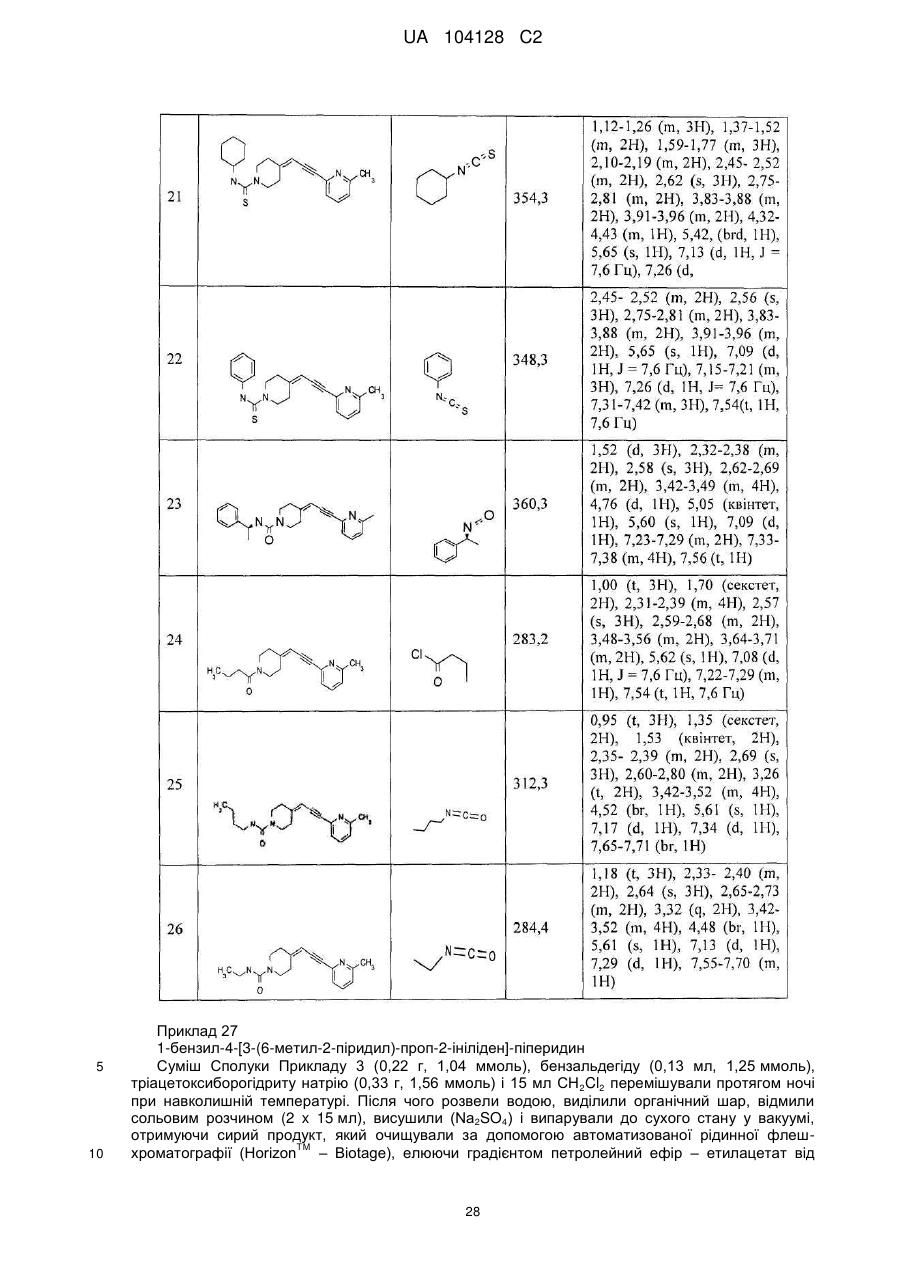
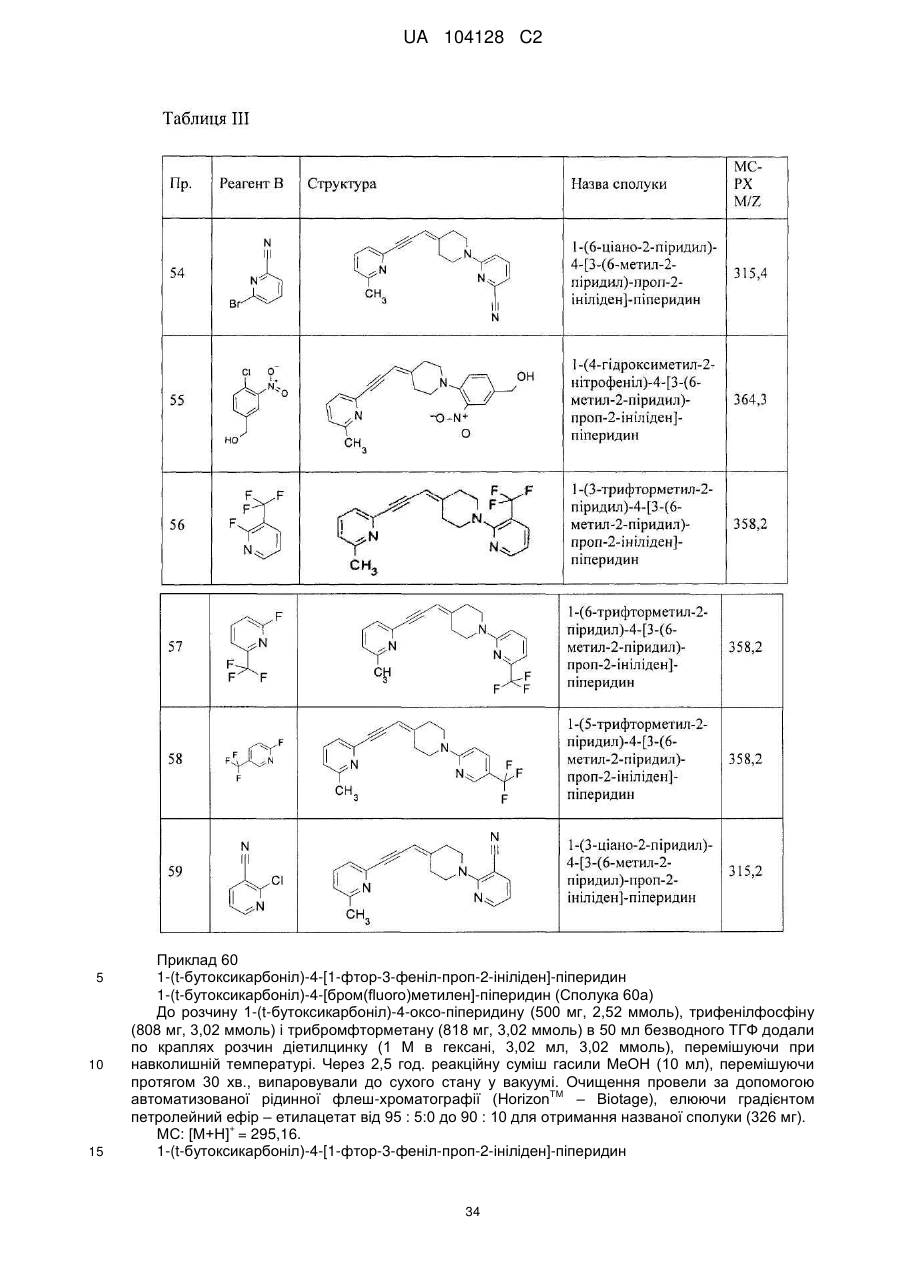
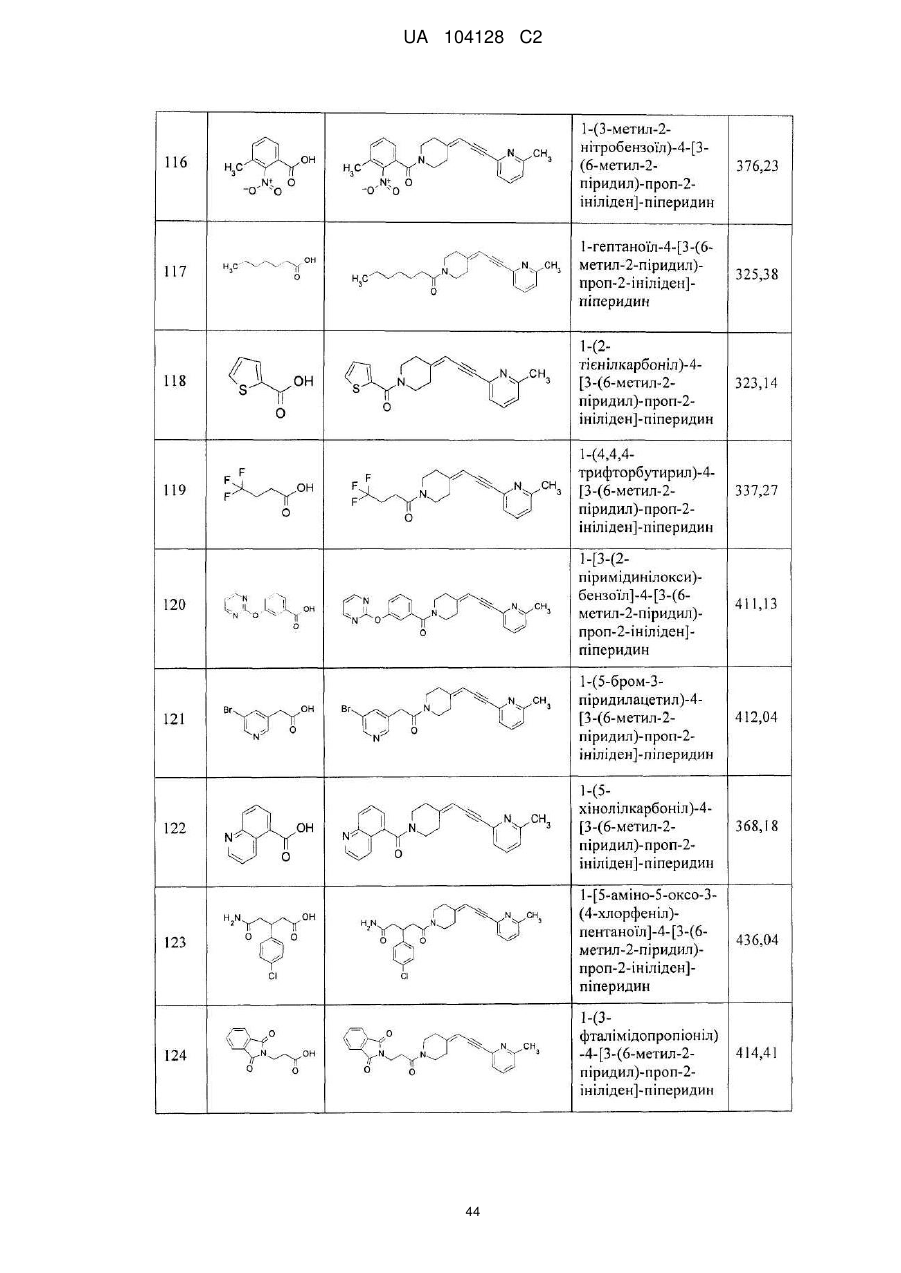
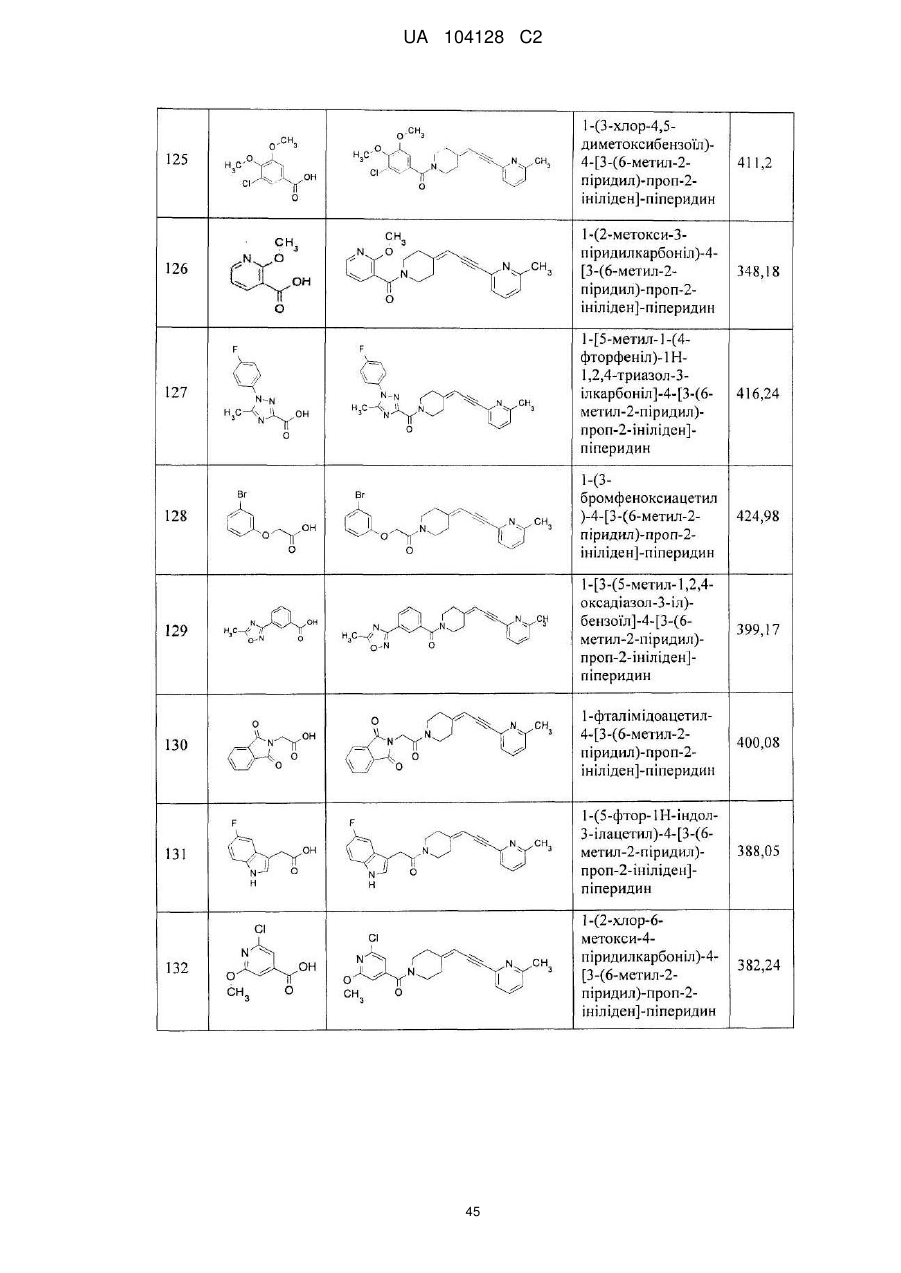
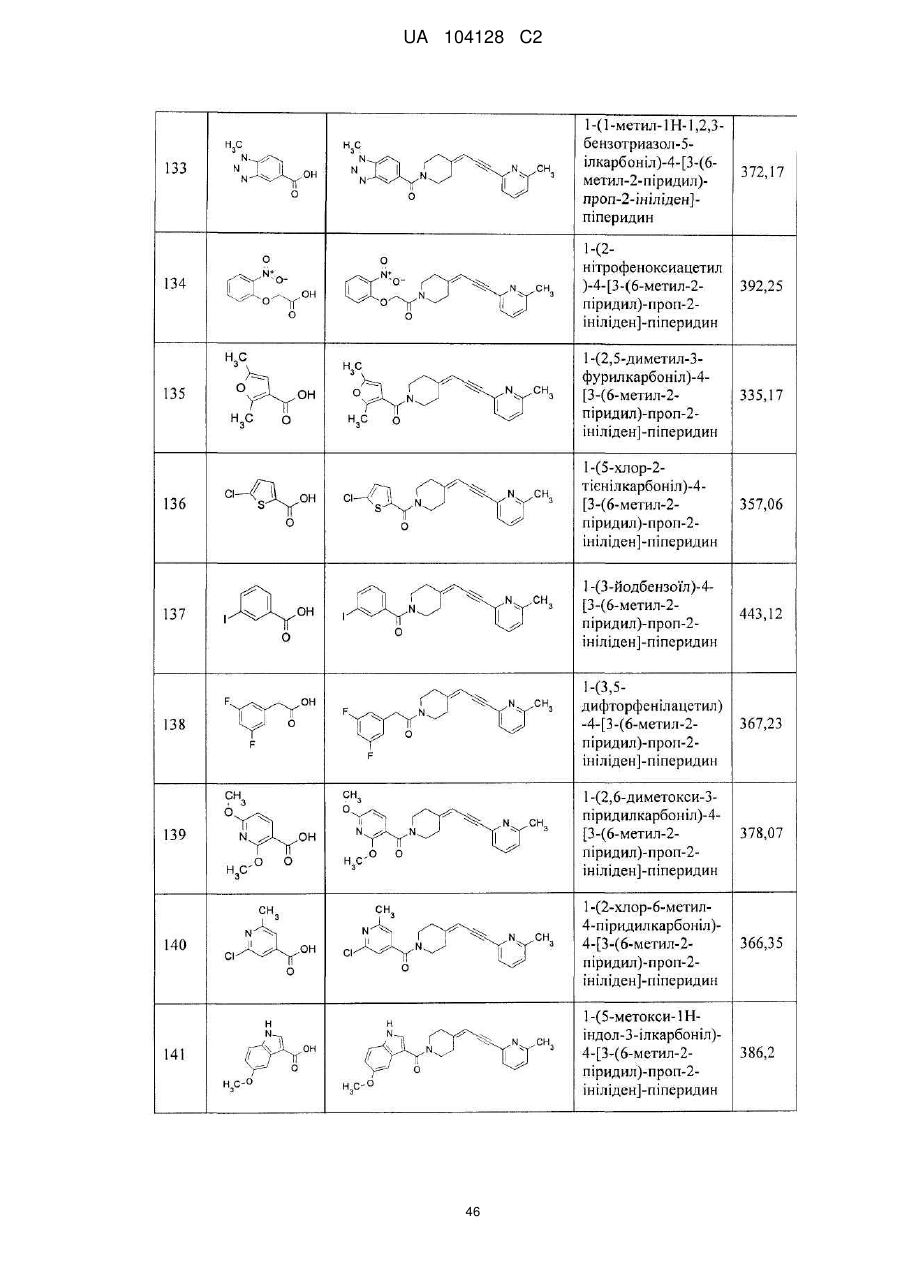
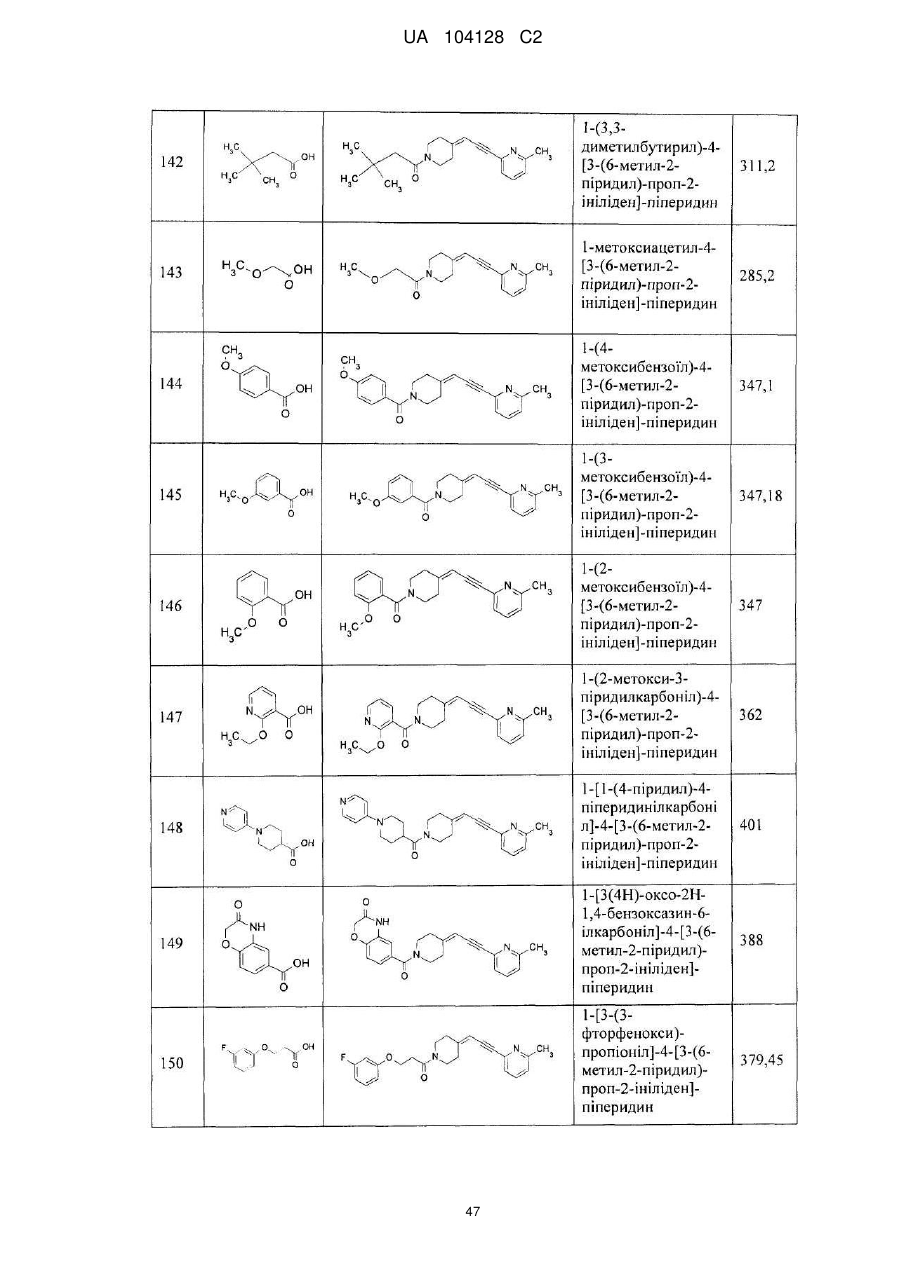
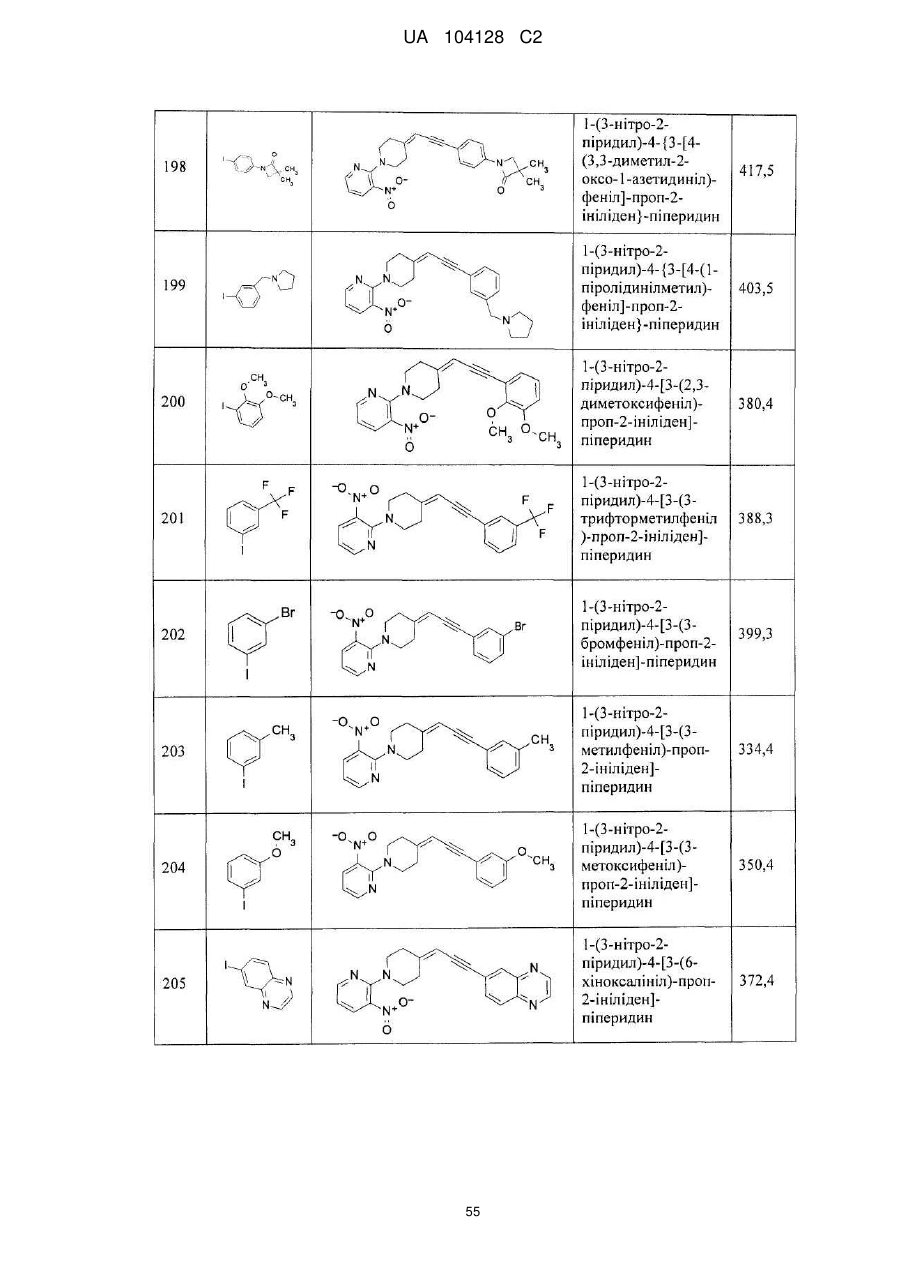
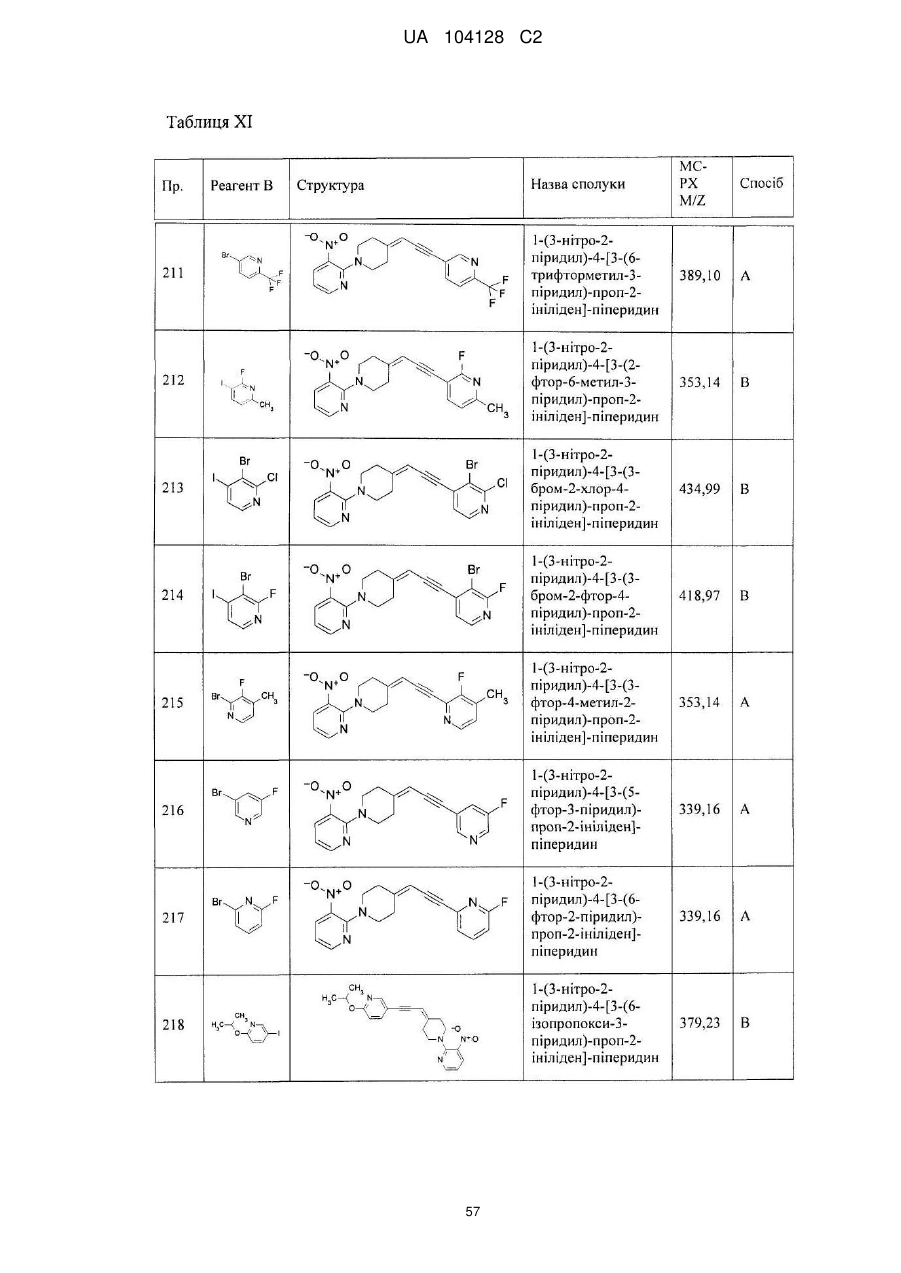
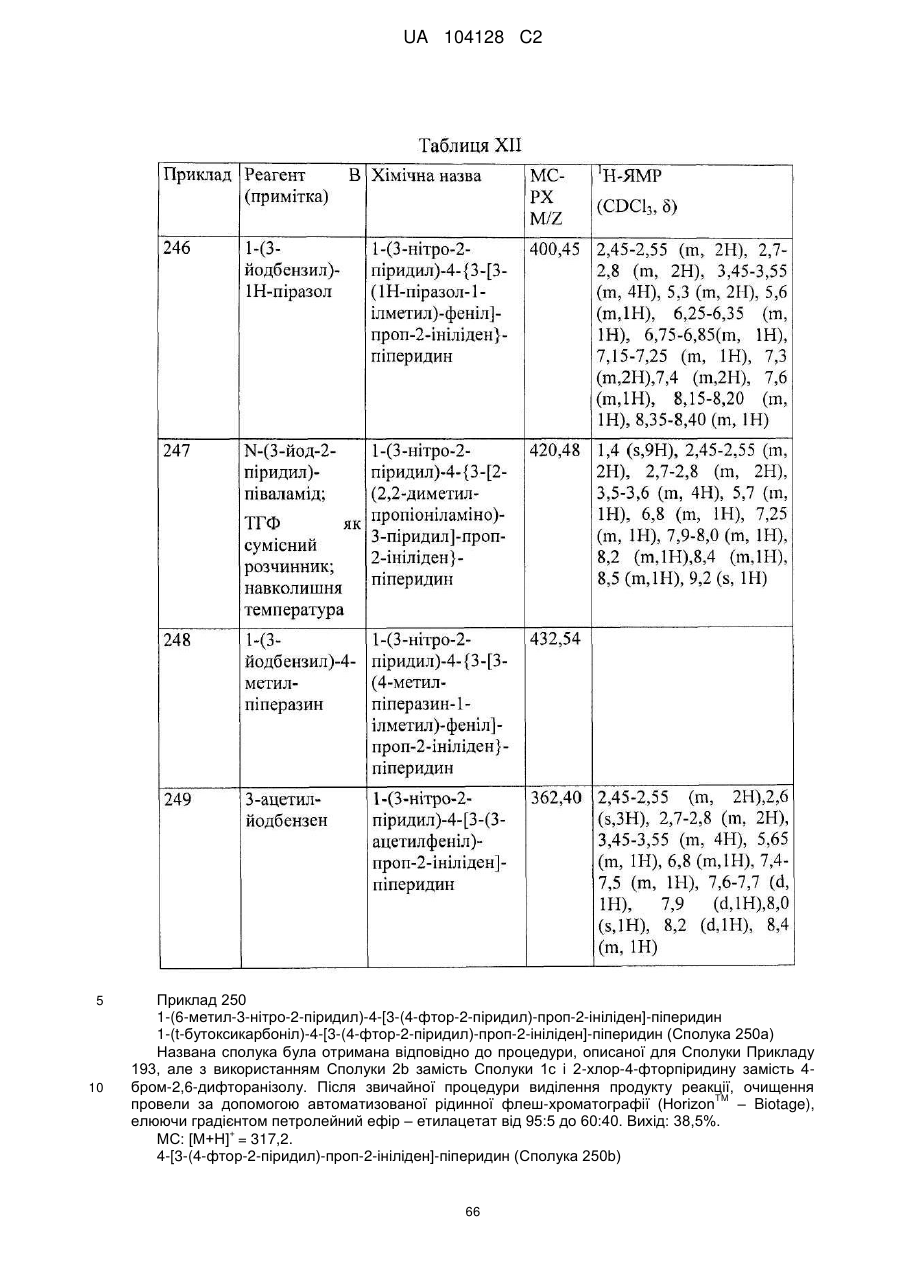
14. Cполука за п. 1, що вибрана з групи, яку складають:
1-(3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1-бутоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метокси-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-метил-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-метокси-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-(3-фенілпроп-2-ініліден)-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-піридил)-проп-2-ініліден]-піперидин,
1-фенілкарбамоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-морфолінокарбоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бензоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бутиламінотіокарбоніл-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
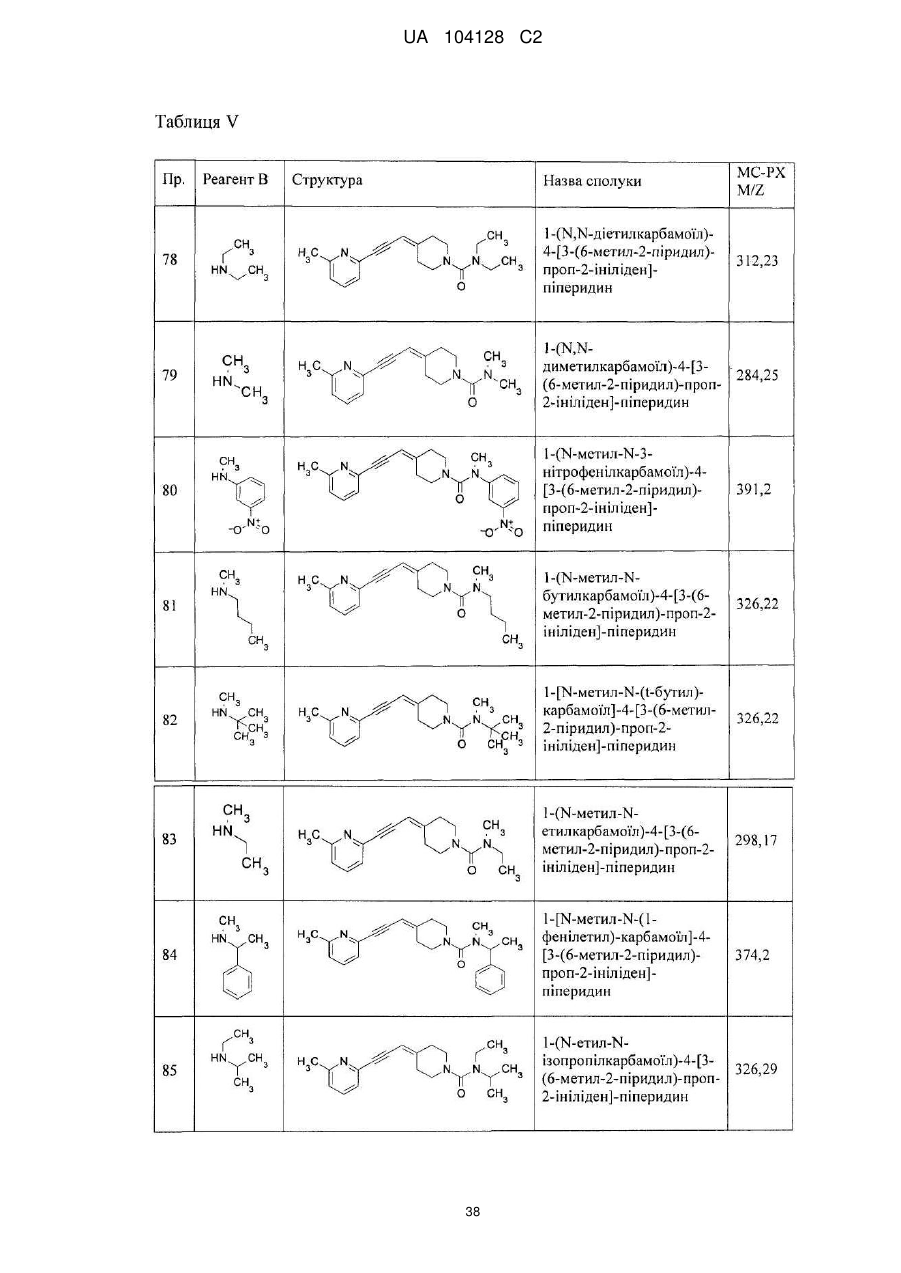
1-етиламінотіокарбоніл-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1-бутилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітрофенілкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітробензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-етоксикарбоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-циклогексиламінотіокарбоніл-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-феніламінотіокарбоніл-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1-фенілетилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бутирил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
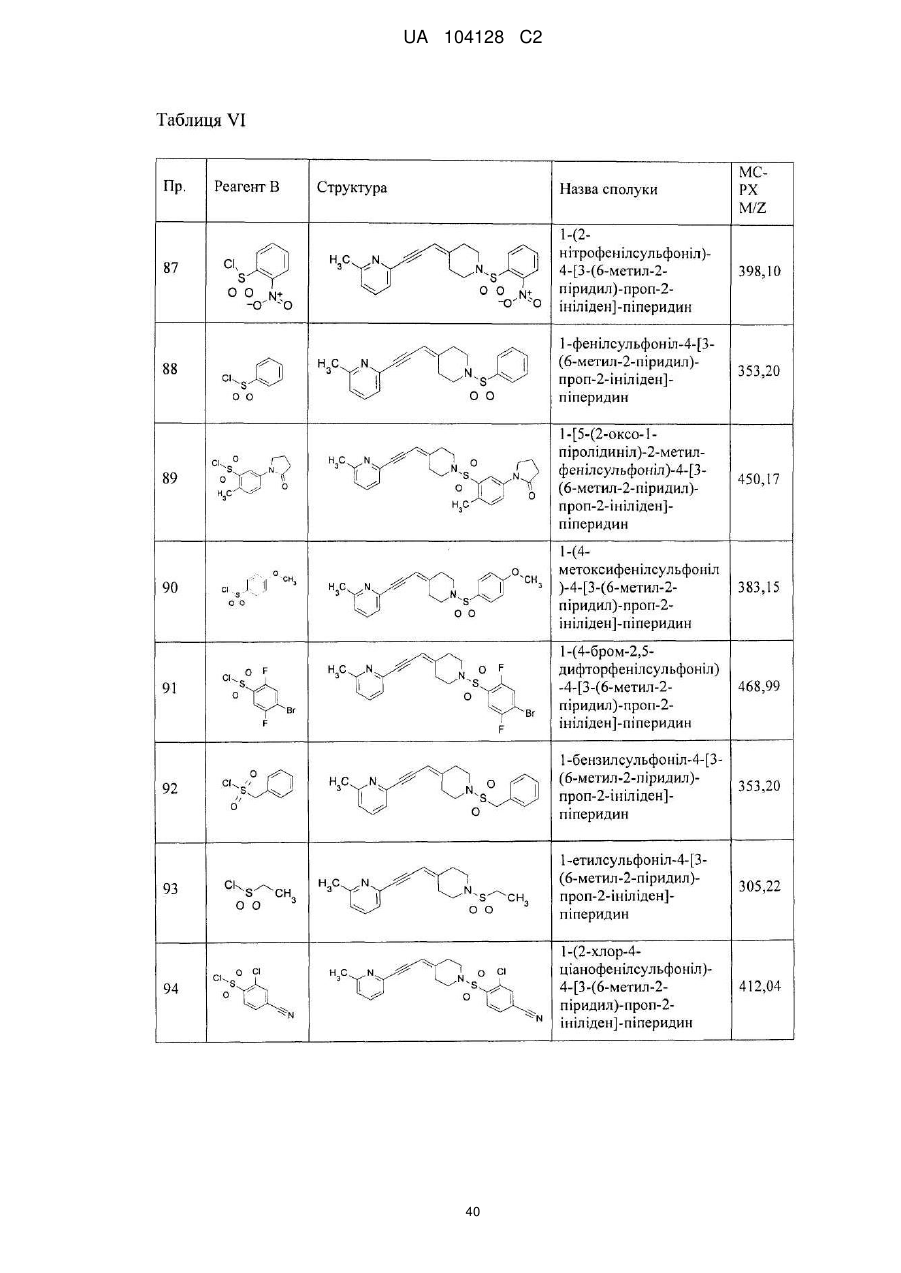
1-бутилкарбамоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-етилкарбамоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бензил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бутил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(4-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-хіноліл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-морфолінo-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-ацетил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-ізопропокси-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-метокси-2-піридил)-проп-2-ініліден]-піперидин,
1-феніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-ціанофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метокси-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(t-бутоксикарбоніл)-4-[3-(5-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(t-бутоксикарбоніл)-4-[3-(6-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(5-ціано-3-піридил)-проп-2-ініліден]-піперидин,
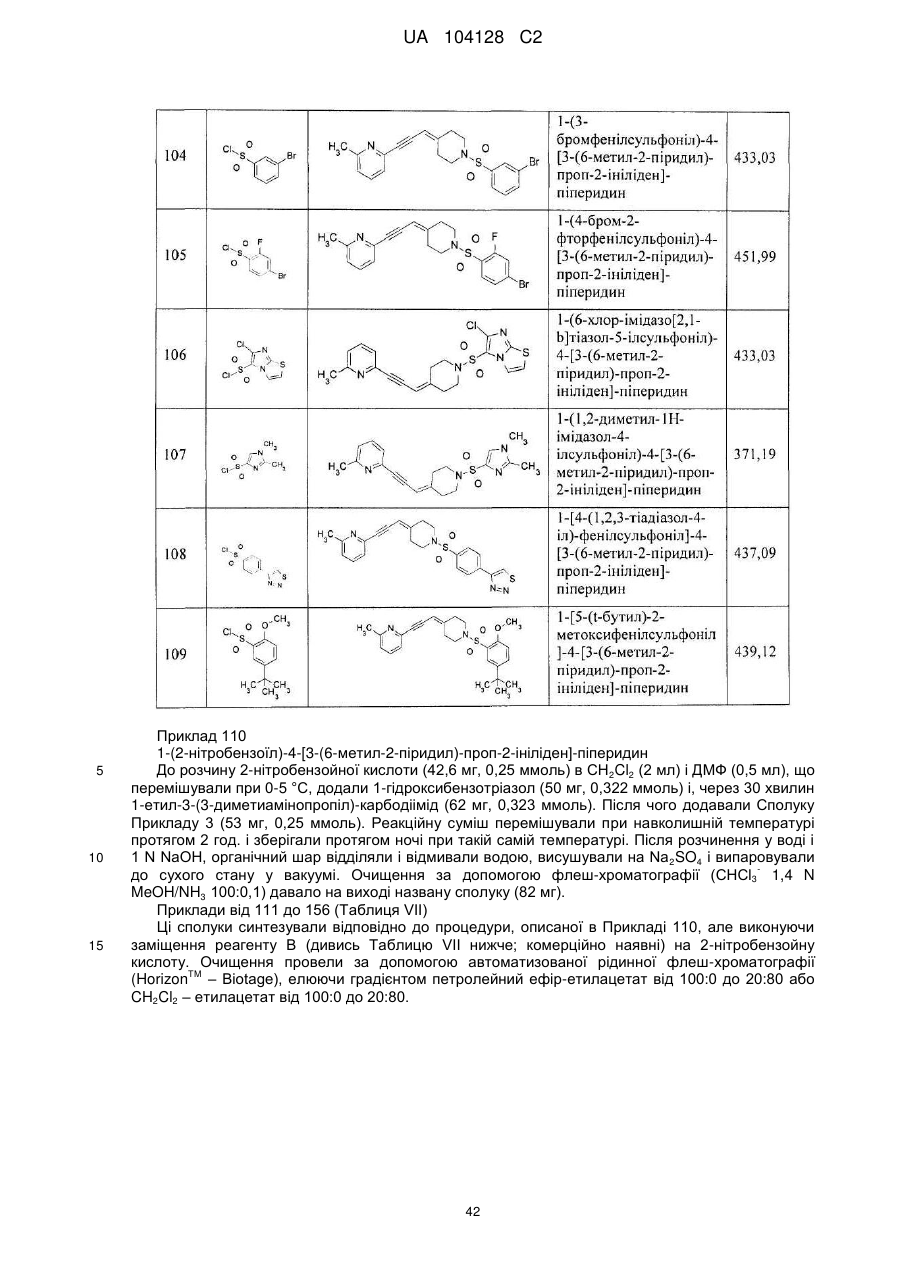
1-(3-нітро-2-піридил)-4-[3-(6-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(t-бутоксикарбоніл)-4-[3-(2-метил-1,3-тіазол-4-іл)-проп-2-ініліден]-піперидин,
4-[3-(2-метил-1,3-тіазол-4-іл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2-метил-1,3-тіазол-4-іл)-проп-2-ініліден]-піперидин,
1-(4-ціано-3,5-дифторфеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-ціано-2-метоксифеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-бром-2-ціано-3-фторфеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
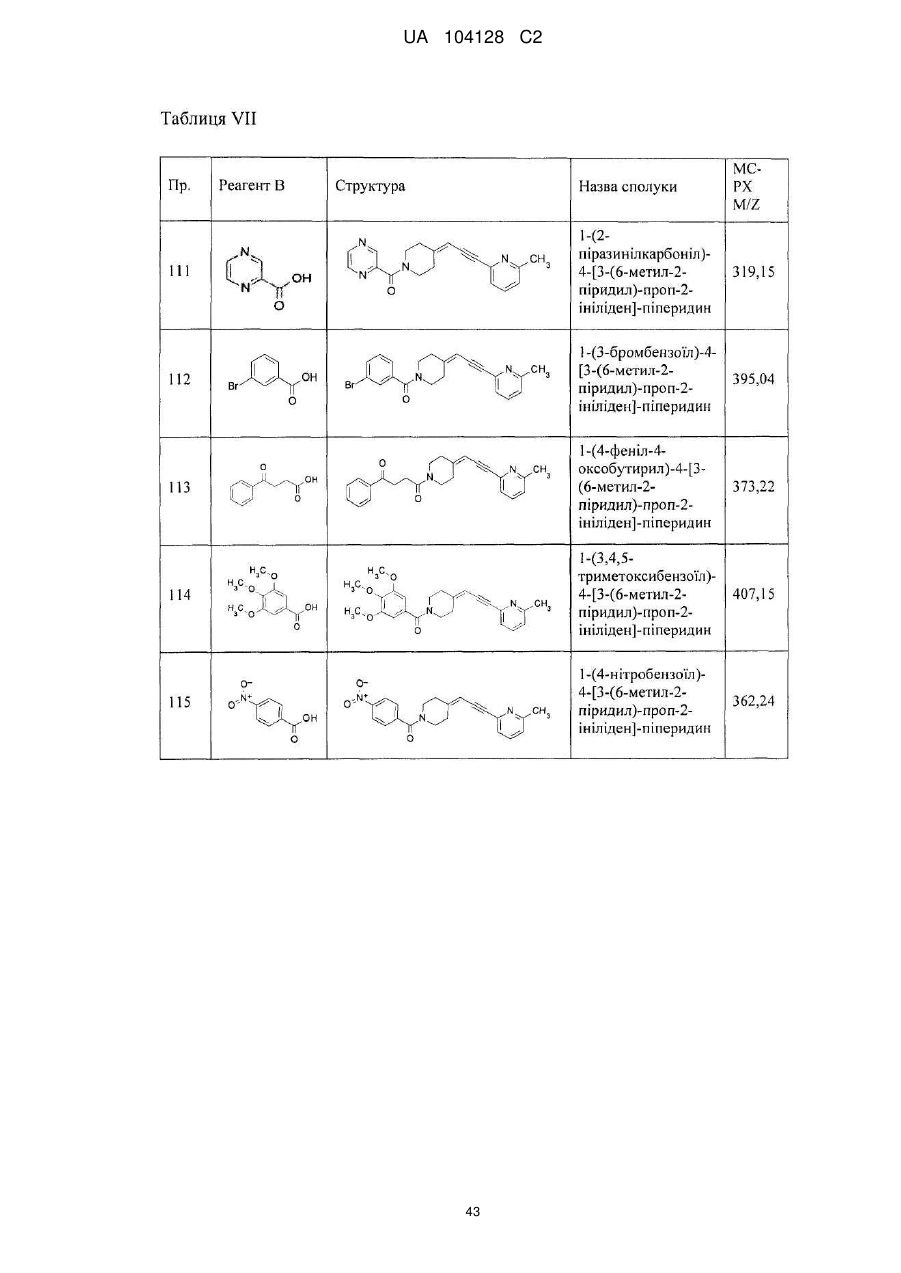
1-(4-фтор-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-ціано-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[2-(2,5-диметил-1Н-пірол-1-іл)-5-піримідиніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-хіноксалініл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-ціано-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-гідроксиметил-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-трифторметил-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-трифторметил-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-трифторметил-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(t-бутоксикарбоніл)-4-[1-фтор-3-фенілпроп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[1-фтор-3-фенілпроп-2-ініліден]-піперидин,
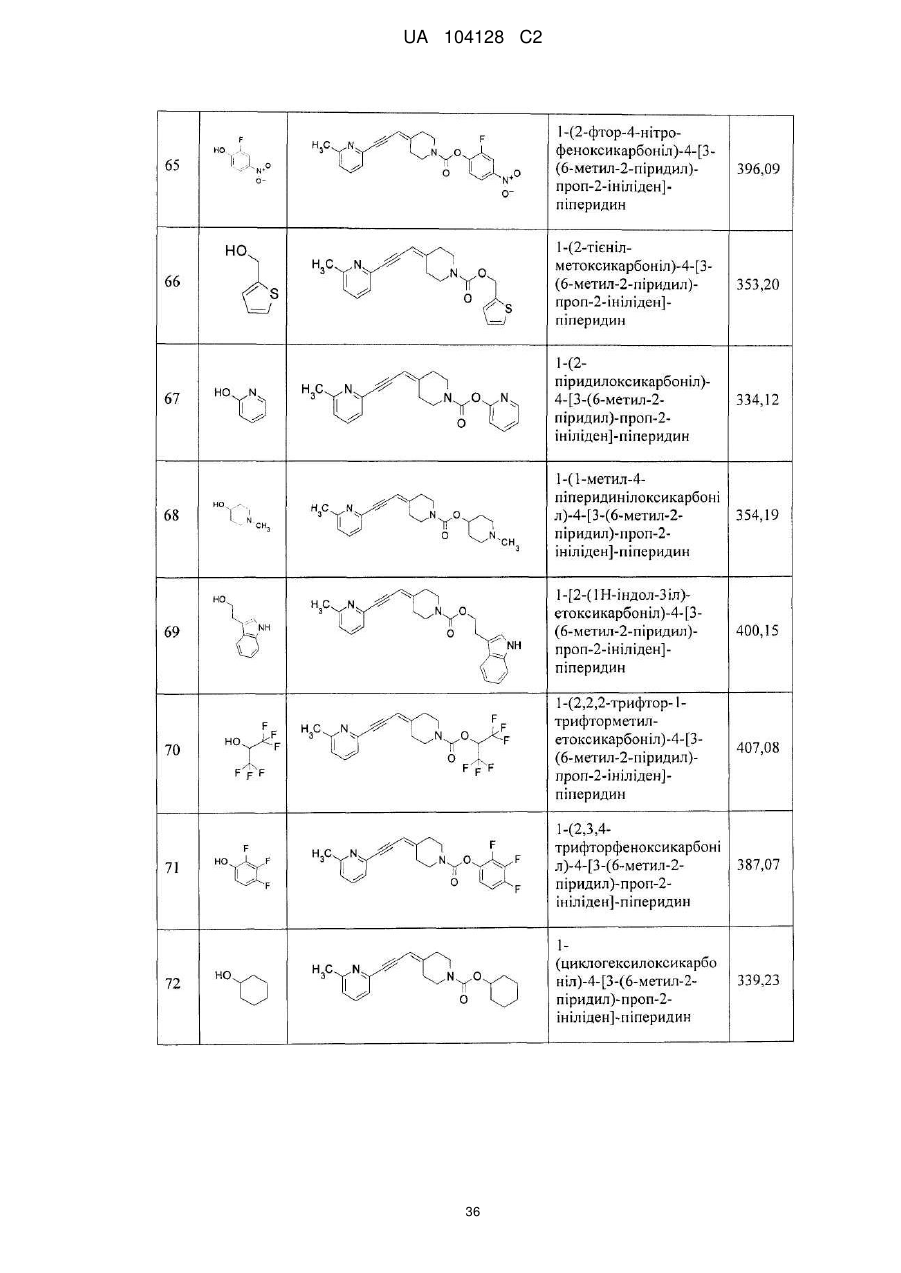
1-(2-метоксіетоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-ціаноетоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бензилоксикарбоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-фтор-4-нітрофеноксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-тієнілметоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-піридилоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1-метил-4-піперидинілоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[2-(1Н-індол-3-іл)-етоксикарбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,2,2-трифтор-1-трифторметилетоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,3,4-трифторфеноксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(циклогексилоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(циклобутилметоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-бром-2-піридилоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-феноксипропоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4,6-диметилпіримідинілоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N-метил-N-фенілкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N,N-діетилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N,N-диметилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N-метил-N-3-нітрофенілкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N-метил-N-бутилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[N-метил-N-(1-бутил)-карбамоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N-метил-N-етилкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[N-метил-N-(1-фенілетил)-карбамоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(N-етил-N-ізопропілкарбамоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(р-толілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-нітрофенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-фенілсульфоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-(2-оксо-1-піролідиніл)-2-метилфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метоксифенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-бром-2,5-дифторфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бензилсульфоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-етилсульфоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-хлор-4-ціанофенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-фторбензилсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-циклогексилметилсульфоніл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метил-3-нітрофенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,2,2-трифторетилсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-ізопропілфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-ціанофенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-хлор-2-метокси-4-метилфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(7,7-диметил-2-оксобіцикло[2,2,1]гепт-1-илметилсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(4-метоксифенокси)-пропілсульфоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-бромфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-бром-2-фторфенілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-хлорімідазо[2,1-b]тіазол-5-ілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1,2-диметил-1Н-імідазол-4-ілсульфоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[4-(1,2,3-тіадіазол-4-іл)-фенілсульфоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-(t-бутил)-2-метоксифенілсульфоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-нітробензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-піразинілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-бромбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-феніл-4-оксобутирил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3,4,5-триметоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-нітробензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-метил-2-нітробензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-гептаноїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4,4,4-трифторбутирил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(2-піримідинілокси)-бензоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-бром-3-піридилацетил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-хінолілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-аміно-5-оксо-3-(4-хлорфеніл)-пентаноїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-фталімідопропіоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-хлор-4,5-диметоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-метокси-3-піридилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-метил-1-(4-фторфеніл)-1Н-1,2,4-триазол-3-ілкарбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-бромфеноксіацетил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(5-метил-1,2,4-оксадіазол-3-іл)-бензоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-фталімідоацетил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-фтор-1H-індол-3-ілацетил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-хлор-6-метокси-4-піридилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(1-метил-1Н-1,2,3-бензотриазол-5-ілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-нітрофеноксіацетил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,5-диметил-3-фурилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-хлор-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-йодбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3,5-дифторфенілацетил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,6-диметокси-3-піридилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-хлор-6-метил-4-піридилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-метокси-1Н-індол-3-ілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3,3-димeтилбутирил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-метоксіацетил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-метоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-метоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-метокси-3-піридилкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[1-(4-піридил)-4-піперидинілкарбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3(4Н)-оксо-2Н-1,4-бензоксазин-6-ілкарбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(3-фторфенокси)-пропіоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-піперидино-5-піримідинілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[1-(3-фтор-4-метилфеніл)-2-оксопіролідин-4-ілкарбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-ацетамідо-2-метилбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-хлорбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-фенілбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-фенілацетил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-фенілбутирил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-фторбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-метилбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціанобензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-трифторметоксибензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-трифторметилбензоїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-бром-2-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-нітро-2-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-феніл-2-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-хлор-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метил-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-метил-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2,5-дихлор-3-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-феніл-3-ізоксазолілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-(2-тієніл)-1Н-піразол-3-іл-карбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[5-(2-фурил)-1Н-піразол-3-іл-карбоніл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-нітро-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-бензилоксибензоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-метил-2-фуроїл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-етокси-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-ацетил-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-феніл-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(2-метил-1,3-тіазол-4-іл)-бензоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-хлор-4-метокси-3-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-метилтіо-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-хлор-4-метил-2-тієнілкарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(1,3-тіазол-2-іл)-бензоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-[3-(2-піримідиніл)-бензоїл]-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-(4-оксопент-2-ініліден)-піперидин,
1-(3-нітро-2-піридил)-4-[4-(4-фторфеніл)-4-оксобут-2-иніліден]-піперидин,
1-(3-нітро-2-піридил)-4-(5,5-диметил-4-оксогекс-2-иніліден)-піперидин,
1-(3-нітро-2-піридил)-4-[4-(2-тієніл)-4-оксобут-2-иніліден]-піперидин,
1-(3-нітро-2-піридил)-4-(4-циклогексил-4-оксобут-2-иніліден)-піперидин,
1-(3-нітро-2-піридил)-4-(5-метил-4-оксогекс-5-ен-2-ініліден)-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3,5-дифтор-4-метоксифеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(4-ціано-3-фторфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(5-фтор-2-метоксифеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(4-ціанофеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-{3-[4-(3,3-диметил-2-оксо-1-азетидиніл)-феніл]-проп-2-ініліден}-піперидин,
1-(3-нітро-2-піридил)-4-{3-[4-(1-піролідинілметил)-феніл]-проп-2-ініліден}-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2,3-диметоксифеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-трифторметилфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-бромфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-метилфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-метоксифеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-хіноксалініл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-ціанометилфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-нітрофеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-ціанофеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-хлорфеніл)-проп-2-ініліден]-піперидин,
1-(1-бутоксикарбоніл)-4-(гепт-2-иніліден)-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-трифторметил-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2-фтор-6-метил-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-бром-2-хлор-4-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-бром-2-фтор-4-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-фтор-4-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(5-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-фтор-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(6-ізопропокси-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2-етокси-3-піридил)-проп-2-ініліден]-піперидин,
1-(5-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метокси-3-нітро-2-піридил)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(5-бром-2-піримідиніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-метил-5-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-ціано-3-метил-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-ціано-3-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метил-3-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-ізохіноліл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-метил-5-оксоциклопентиніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-тієніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-нітро-2-фурил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(5-фенілкарбамоїл-2-фурил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-метил-4-нітро-1Н-5-імідазоліл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(t-бутоксикарбоніл)-(3Е)-3-[3-(6-метил-2-піридил)-проп-2-ініліден]-піролідин,
1-(3-нітро-2-піридил)-4-(4-фенілбут-3-ин-2-іліден)-піперидин,
1-(3-нітро-2-піридил)-4-[(2Е)-3-фенілпроп-2-еніліден]-піперидин,
1-(3-нітроімідазо[1,2-а]піридин-2-іл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-трифторметоксифеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2-оксо-1-піролідиніл)-проп-2-ініліден]-піперидин,
1-(5-трифторметил-3-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-5-феніл-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(2-пропокси-3-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(піридо[2,3-b]піразин-7-іл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-2-тієніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-етокси-3-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-[3-(2,6-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-нітро-2-піридил)-4-{3-[3-(1Н-піразол-1-ілметил)-феніл]-проп-2-ініліден}-піперидин,
1-(3-нітро-2-піридил)-4-{3-[2-(2,2-диметилпропіоніламіно)-3-піридил]-проп-2-ініліден}-піперидин,
1-(3-нітро-2-піридил)-4-{3-[3-(4-метилпіперазин-1-ілметил)-феніл]-проп-2-ініліден}-піперидин,
1-(3-нітро-2-піридил)-4-[3-(3-ацетилфеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(4-фтор-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3-фторфеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(6-фтор-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(6-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(2-фтор-4-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(5-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(5-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(2,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(3-фторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(4-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(6-фтор-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(5-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(2-фтор-4-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(2,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(5-ціано-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(6-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-[3-(5-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(3-фторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(2,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(6-фтор-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(6-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(2-фтор-4-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(5-фтор-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(5-ціано-3-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-4-метокси-2-піридил)-4-[3-(5-ціано-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-6-метил-2-піридил)-4-(4-фенілбут-3-ин-2-іліден)-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(6-бром-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3-етоксифеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3-ацетилфеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3-ацетамідофеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-[3-(3-ацетонілфеніл)-проп-2-ініліден]-піперидин,
l-(6-мeтил-3-нiтpo-2-пipидил)-3-(3Z)-[3-(6-мeтил-2-пipидил)-пpoп-2-iнiлiдeн]-піперидин,
1-(6-метил-3-нітро-2-піридил)-3-(3Е)-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-(4-фенілбут-3-ин-2-іліден)-піперидин,
1-(1-метил-4-нітро-1Н-імідазол-5-іл)-4-(4-фенілбут-3-ин-2-іліден)-піперидин,
1-(1-метил-4-нітро-1H-імідазол-5-іл)-4-[3-(3,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(1-метил-4-нітро-1Н-імідазол-5-іл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(4-нітро-1Н-імідазол-5-іл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
1-(3-ціано-2-тієніл)-4-[3-(2,5-дифторфеніл)-проп-2-ініліден]-піперидин,
1-(6-метил-3-нітро-2-піридил)-4-{3-[3-(3-метил-1,2,4-оксадіазол-5-іл)-феніл]-проп-2-ініліден}-піперидин та
1-(2-ціано-3-піразиніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин,
або її енантіомер, діастереомер, N-оксид або її фармацевтично прийнятна сіль.
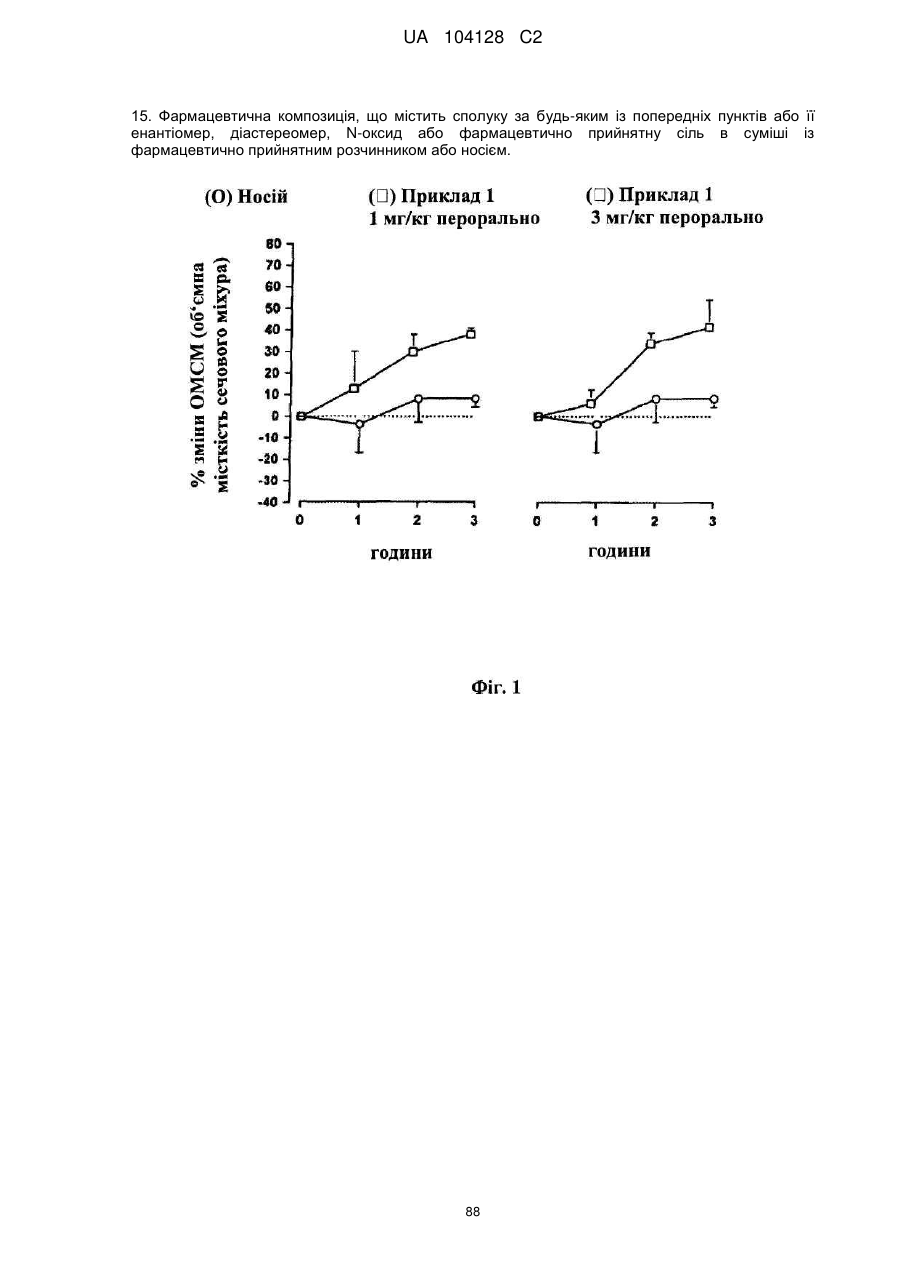
15. Фармацевтична композиція, що містить сполуку за будь-яким із попередніх пунктів або її енантіомер, діастереомер, N-оксид або фармацевтично прийнятну сіль в суміші із фармацевтично прийнятним розчинником або носієм.
Текст
Реферат: Перелік документів, взятих до уваги експертизою: US 2004077671 (A1), 22.04.2004 JP 59095249 (A), 01.06.1984 US 2005065156 (A1), 24.03.2005 WO 0102386 (A1), 11.01.2001 US 2006264415 (A1), 23.11.2006 WO 2007118137 (A1), 18.10.2007 US 2004186292 (A1), 23.09.2004 WO 2004069158 (A2), 19.08.2004 WO 2006089700 (A1), 31.08.2006 WO 2004020435 (A1), 11.03.2004 WO 2005090347 (A1), 29.09.2005 WO 2007070173 (A2), 21.06.2007 EP 0537993 (A1), 21.04.1993 US 2867620 (A), 06.01.1959 US 6265434 (B1), 24.07.2001 WO 03093236 (A1), 13.11.2003 WO 2007006530 (A1), 18.01.2007 JEFFREY M. DENER ET AL: "Dibasic inhibitors of human mast cell tryptase. Part 3: Identification of a series of potent and selective inhibitors containing the benzamidine functionality" BIOORGANIC & MEDICINAL CHEMISTRY LETTERS, vol. 11, no. 13, 2001, pages 1629-1633 NEEL K. ANAND AND ERICK M. CARREIRA: "A simple, mild, catalytic, enantioselective addition of terminal acetylenes to aldehydes" JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 123, no. 39, 2001, pages 96879688 HIDENORI SOMEYA ET AL: "Cobalt-catalyzed sequential cyclization/cross-coupling reactions of 6-halo-1-hexene derivatives with Grignard reagents and their application to the synthesis of 1,3-diols" TETRAHEDRON, ELSEVIER SCIENCE PUBLISHERS, AMSTERDAM, NL, vol. 63, no. 35, 27 July 2007 (2007-07-27), pages 8609-8618 JOHN H. BIEL AND FRANK DIPIERRO: "Hypotensive agents. I. Acetylenic diamines" JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 80, 1958, pages 4609-4614 UA 104128 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 104128 C2 В Сполуках: І: Z є групою формули; m є 0, 1 або 2; n є 0, 1 або 2; Y є поєднувальною групою або відсутній; а R1, R2 і R3 вибрані із широкого спектра необов'язково заміщених алкільної, циклоалкільної, арильної і гетероциклічної груп. Сполуки І є mGlu5-антагоністами, прийнятними для лікування нейром'язової дисфункції нижнього сечовивідного шляху, мігрені і хвороби гастроезофагеального рефлюксу у ссавців. Переважними Сполуками І є ті, що мають формулу R1 Z m R3 Y N n I, R1 R3 Y N R2 ІI. UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 НОВІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ ЯК АНТАГОНІСТИ MGLU5 Галузь винаходу Даний винахід стосується нових гетероциклічних сполук, що мають вибіркову спорідненість до підтипу mGlu5 метаботропних рецепторів і до фармацевтичних композицій, що містять такі сполуки. Передумови винаходу Порушення нижніх сечовивідних шляхів включають багато синдромів, що вражають нормальне сечовипускання. Порушення нижніх сечовивідних шляхів можуть розвиватися як комбінація патологічних та/або вікових змін урогенітальної системи, або іншої етіології, а саме, неврологічні порушення. Індивідууми, що страждають від порушень нижніх сечовивідних шляхів, страждають від зниженої якості життя, включаючи утруднення, занижене самосприйняття і загальне ослаблення емоційного самопочуття, соціальної функції і загального стану здоров‘я. Порушення нижніх сечовивідних шляхів, крім того, можуть бути пов‘язані з іншими фізичними захворюваннями, включаючи целюліт, пролежні, інфекції сечовивідних шляхів, супроводжуються переломами, депривацією сну, соціальною ізоляцією, депресією і сексуальною дисфункцією. Індивідууми старші за віком, що страждають від порушень нижніх сечовивідних шляхів, можуть вимагати більше догляду від тих, хто забезпечує догляд, як родини, так і професіоналів, що може слугувати фактором для прийняття рішень щодо поміщення їх до спецзакладів. Відповідно до Національних Інститутів Здоров‘я США (NIH), вважають, що до 35 мільйонів американців страждають від порушень нижніх сечовивідних шляхів. Порушення нижніх сечовивідних шляхів більш поширені серед жінок, ніж серед чоловіків (2:1) до 80 років, після чого чоловіки і жінки уражаються однаково. Поширення порушень нижніх сечовивідних шляхів збільшується із віком. У віці 65 років порушення нижніх сечовивідних шляхів вражає від 15% до 30% всіх індивідуумів і приблизно 50% індивідуумів у довготривалому лікуванні. Агенти з різними способами дії використовуються для лікування порушень нижніх сечовивідних шляхів. Вони включають агенти, що діють безпосередньо на нижні сечовивідні шляхи, наприклад, антимускаринові та альфа 1 антагоністи, а також агенти, що діють через центральну нервову систему, наприклад, інгібітори зворотного захвату серотоніну та/або норадреналіну. Відповідно до NIH, не дивлячись на те, що був досягнутий деякий прогрес в діагностиці, управлянні та лікуванні порушень нижніх сечовивідних шляхів, ці порушення частіше залишаються важко виліковними. Таким чином, залишається необхідність у вдосконалених агентах, складах і способах лікування для лікування порушень нижніх сечовивідних шляхів. Глютамінова кислота, збуджувальна амінокислота, присутня в синапсах всієї центральної нервової системи, також відомо, що вона діє на, щонайменше, два типи рецепторів: іонотропні і метаботропні глютаматні рецептори. Принципове функціонування іонотропних глютаматних рецепторів полягає в тому, що їхня активація формує іонні канали, що керуються лігандом, і, таким чином, напряму опосередковує передачу електричного сигналу нервових клітин, приводячи до швидких і відносно великих змін провідності в пост-синаптичних мембранах. Метаботропні глютаматні рецептори (mGluR) регулюють передачу електричного сигналу не прямо, шляхом впливу на внутрішньоклітинні метаболічні процеси за допомогою G-білків. Зміни в пост-синатничній клітині, що опосередковані через mGluR, відповідно відносно повільні у часі і не пов’язані із швидкими і значними змінами у провідності нейрональної мембрани. Описані три підтипи іонотропних глютаматних рецепторів, а саме, NMDA (N-метил-Dаспартат), AMPA (альфа-аміно-3-гідрокси-5-метил-4-ізоксазол-пропіонова кислота) і каїнатний підтипи. Було клоновано вісім підтипів метаботропних глютаматних рецепторів. Підтипи класифікують у три групи на основі схожостей у послідовностях і фармакологічних та біохімічних властивостях (Spooren et al., Trends Pharmacol. Sci. 22: 331-337, 2001): рецептори Групи I mGlu (mGlu1 і mGlu5), рецептори Групи II mGlu (mGlu2 і mGlu3) і рецептори Групи III mGlu (mGlu4, mGlu6, mGlu7 і mGlu8). Відомо, що рецептор Групи I mGlu5 (як людини, так і щура) включає, щонайменше, два підтипи, “a” і “b”. Підтип “b” є довшим, ніж підтип “a”, через альтернативний сплайсинг 32амінокислотного подовження на C-термінальному (внутрішньоклітинному) домені, 50 залишків в прямому напрямку с початку домену. Довжина mGlu5b людини складає 1212 амінокислот, тоді як “a” формі бракує амінокислот від 877 до 908 (номер 828 є першою у внутрішньоклітинному домені). Довжина mGlu5b щура складає 1203 амінокислот, тоді як “a” формі бракує амінокислот 1 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 від 876 до 907 (номер 827 є першою у внутрішньоклітинному домені). (Hermans and Challis, Biochem. J. 359: 465-484, 2001). Рецептори mGlu, що належать до родини 3 GPCR, характеризуються двома відмінними топологічними доменами: великий зовнішньоклітинний N-термінальний домен, який містить модуль венериної мухоловки, що відповідає за зв‘язок із агоністом, і 7-TM домен разом із внутрішньоклітинним C-термінальним доменом, що включений до рецепторної активації і сполучення G-білків. Показано, що 7-TMD рецепторів mGlu I формує кишеню зв‘язування для позитивних і негативних алостеричних модуляторів; причому негативні модулятори були ідентифіковані за допомогою технологій скринінгу високої продуктивності, та діють як неконкурентні антагоністи, що не мають ефекту на зв‘язування агоністу. Найбільш цікавою властивістю цих молекул, окрім їхньої великої сили, є їхня визначна селективність до підтипів. Зона зв‘язування 7-TM локалізована в кишені, що лежить в одному ряду із TM-III, TM-V, TMVI і TM-VII; цей сайт відповідає ретинальній кишені зв‘язування в родопсині. Алостеричні модулятори mGlu5 являють собою чудову перевагу в демонстрації потенційних можливостей для розвитку нових методів дослідження і терапевтичних агентів, що регулюють активність специфічних mGluR підтипів. Про сполуки даного винаходу завжди говорили як про антагоніст mGlu5, але в дійсності вони є негативними алостеричними модуляторами, що діють в 7-TM зоні зв‘язування. Публікація міжнародної заявки WO 00/63166 описує похідні трициклічної карбамінової кислоти, корисні для лікування різних захворювань, включаючи нетримання сечі. Описані похідні є агоністами або антагоністами рецепторів Групи I mGlu із специфічністю до mGlu1 рецептору. Публікація міжнародної заявки WO 01/32632 описує піримідинові похідні, корисні для лікування різних захворювань, включаючи нетримання сечі. Описані похідні є селективними антагоністами mGlu 1 рецептору із, щонайменше, в 10 разів більшою селективністю до mGlu1 рецептору, ніж до mGlu 5 рецептору. Публікація міжнародної заявки WO 01/27070 описує нові бісарилацетаміди, корисні для лікування нетримання сечі, серед інших захворювань. Описані молекули є агоністами або антагоністами, селективними до mGlu 1 рецептору. Патент США US 6369222 описує похідні гетероциклоазепініл піримідину, корисні для лікування нетримання сечі, серед інших захворювань. Описані похідні є антагоністами mGlu 1 рецептору. Вищезгадані заявки та патент, таким чином, описують антагоністи mGlu1 рецептору, що є корисними для лікування нетримання сечі. Жодне із цих посилань, тим не менш, не забезпечує експериментальний супровід для лікування нетримання сечі, на людях або тваринній моделі, для порушень нижніх сечовивідних шляхів. Ми проаналізували активність селективних mGlu1 і селективних mGlu5 антагоністів, на моделі щура, прийнятній для визначення активності на нижніх сечовивідних шляхах. Несподівано винайшли значну активність для антагоністів, селективних до mGlu5 рецептору, тоді як два комерційно наявних антагоністи, селективні до mGlu1 рецептору, не проявили ефекту. Антагоніст, селективний до рецепторів Групи II mGluR, також не показав ефекту на щурячій моделі. Отримавши ці результати, селективні mGlu5 антагоністи можуть бути ефективними засобами для лікування порушень нижніх сечовивідних шляхів. Відповідно, винахідники даного винаходу несподівано відкрили, що введення негативних алостеричних модуляторів глютаматного mGlu5 рецептору, які в цьому документі названі mGlu5 антагоністами, забезпечують сильне інгібування рефлексу сечовипускання. Ці модулятори, таким чином, є прийнятними для лікування порушень нижніх сечовивідних шляхів та їхніх симптомів, Міжнародна Заявка на патент WO04/067002 (Recordati). Опис винаходу Винахід забезпечує сполуки, що мають загальну формулу I 2 UA 104128 C2 R1 m Z N R3 Y n I 5 10 15 20 25 30 35 40 45 50 де Z являє собою групу формули -C≡C-R2 або -CH═CH-R2, R1 являє собою атом водню або галогену, або гідрокси, ціано, C1-C6 алкільну, C1-C6 алкілкарбонільну, C1-C6 алкокси, C1-C6 алкоксикарбонільну, C1-C6 алкілкарбонілокси, C1-C6 алкоксикарбонілокси, C1-C6 алкілтіо, ди-(C1-C6 алкіл)-аміно або C3-C14 циклоалкільну групу; R2 являє собою необов‘язково заміщену моно- або біциклічну C1-C9 гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки, необов‘язково заміщену моно-, бі- або трициклічну C6-C14 арильну групу, необов‘язково заміщену C1-C6 алкільну групу, необов‘язково заміщену C2-C6 алкенільну групу, або необов‘язково заміщену C3-C6 циклоалкільну групу, або R2 являє собою групу –C(O)-R2A, де R2A визначається як R2 вище; R3 являє собою атом водню, необов‘язково заміщену C1-C6 алкільну групу, необов‘язково заміщену моно-, бі- або трициклічну C1-C14 гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки, необов‘язково заміщену моно, бі або трициклічну C6-C14 арильну групу, необов‘язково заміщену C3-C6 циклоалкільну групу, або необов‘язково заміщену C3-C6 циклоалкенільну групу, Y являє собою групу формули -C(O)-, -C(S)-, -NH-C(O)-, -N(C1-C6 алкіл)-C(O)-, -O-C(O)-, -NH-C(S)-, -N(C1-C6 алкіл)-C(S)-, -O-C(S)- або -SO2- або відсутній. m являє собою 0, 1 або 2; n являє собою 0, 1 або 2. Замісниками для кожної необов‘язково заміщеної групи є - атом галогену або оксо, нітро, ціано, гідрокси, карбамоїльна, C1-C6 алкілсульфонільна, C1-C6 алкілтіо, C1-C6 алкілкарбонільна або C1-C6 алкілкарбоніл-( C1-C6)алкільна група або групa формули -NR*R*, де кожний R* незалежно являє собою атом водню або C 1-C6 алкільну, C1-C6 алкілкарбонільну, фенільну або бензильну групу, або - C1-C6 алкіл, C2-C6 алкеніл, C2-C6 алкініл або C1-C6 алкокси група, кожна з яких може необов‘язково нести від 1 до 8 незалежно вибраних оксо, галогенових, ціано, нітро, аміно, гідрокси або феніл замісників, - C3-C9 моно- або біциклоалкільна група, що необов‘язково несе від 1 до 3 незалежно вибраних C1-C6 алкіл, оксо, галогенових, ціано, нітро, аміно, гідрокси або феніл замісників, або - група формули -A, -O-A, -C(O)-A, -(CH2)q-A, -NR**-A, -C(O)NR**-A, -NR**C(O)-A або -OC(O)-A, де A являє собою фенільну групу або C1-C8 гетероциклічну групу, що містить від 1 дo 3 гетероатомів, вибраних із азоту, кисню і сірки, причому кожна із групи A може необов‘язково нести від 1 до 3 незалежно вибраних галогенових, гідрокси, ціано, нітро і C 1-C6 алкіл замісників, кожний R** незалежно являє собою атом водню або C1-C6 алкільну групу, і q є 0 або цілим числом від 1 до 6; за умови, якщо Z являє собою групу формули ─C═C─R 2, тоді R1 являє собою атом галогену, а оксо та гідрокси виключено з необов’язкових замісників. Енантіомери, діастереомери, N-оксиди і фармацевтично прийнятні солі сполук I включені до винаходу. Переважними сполуками за винаходом є ті, в яких Z являє собою групу формули ─C≡C─R2. 3 UA 104128 C2 Також переважними є сполуки, в яких m являє собою 1, та n являє собою 1. Поєднуючи ці переважні ознаки із переважною групою Z, отримуємо наступні сполуки II R1 II N 5 10 15 20 25 30 35 40 45 50 R2 R3 Y як найбільш переважні. Сполуки за винаходом являють собою mGlu5 антагоністи, прийнятні в лікуванні нейром‘язової дисфункції нижніх сечовивідних шляхів, мігрені і хвороби гастроезофагеального рефлюксу у ссавців. В юрисдикціях, де способи лікування людей і тварин розглядаються як патентоспроможні, винахід стосується способів лікування нейром‘язової дисфункції нижніх сечовивідних шляхів, лікування мігрені і лікування хвороби гастроезофагеального рефлюксу у ссавців. Y переважно являє собою групу формули -C(O)-, -NH-C(O)-, -N(C1-C6 алкіл)-C(O)-,-O-C(O)-, -NH-C(S)- або -SO2- або відсутній. R1 переважно являє собою атом водню або фтору або метил, гідрокси, метокси, метоксикарбонілокси, диметиламіно або піперидино групу. Коли Z являє собою групу формули – C=C–R2, R1 переважно являє собою атом водню або фтору, або метильну групу. R2 переважно являє собою необов‘язково заміщену моно або біциклічну C1-C9 гетероциклічну групу, що містить від 1 до 3 гетероатомів, вибраних із азоту, кисню і сірки, необов‘язково заміщену фенільну групу, необов‘язково заміщену C1-C6 алкільну групу, необов‘язково заміщену C2-C6 алкенільну групу, необов‘язково заміщену C3-C6 циклоалкільну групу, або групу –C(O)-R2A, де R2A є таким, що визначено як R2 вище. Більш переважно, R2 являє собою необов‘язково заміщену піролідинільну, тіазолільну, піридильну, хінолільну, хіноксалінільну або фенільну групу, причому замісниками для кожної необов‘язково заміщеної групи є атоми фтору, хлору або брому або оксо, нітро, ціано, ціанометильна, ацетильна, метильна, метокси, етокси, ізопропокси, трифторметильна, трифторметокси, ацетаміно, 2,2-диметилпропаноїламіно, 3,3-диметил-2-оксо-1-азетидинільна, 1-піролідинілметильна, 1H-піразол-1-ільна, 3-метил-1,2,4-оксадіазол-5-ільна або морфоліно група. Зокрема переважними серед цієї групи є сполуки, в яких R 2 являє собою піридильну або фенільну групу, заміщену атомом фтору та/або метильною групою, причому інші замісники є необов‘язковими. Найбільш переважно, R2 являє собою 6-метил-2-піридильну, 5-ціано-2-піридильну, 3фторфенільну, 2,5-дифторфенільну групу або 3,5-дифторфенільну групу. R3 переважно являє собою C1-C6 алкільну групу, заміщену необов‘язково заміщеною групою A, необов‘язково заміщену моно- або біциклічну C1-C9 гетероциклічну групу, що містить від 1 дo 3 гетероатомів, вибраних із азоту, кисню і сірки, необов‘язково заміщену фенільну групу, необов‘язково заміщену C3-C6 циклоалкільну групу, або необов‘язково заміщену C3-C6 циклоалкенільну групу. Більш переважно R3 являє собою моно- або біциклічну C1-C9 гетероциклічну групу, що містить від 1 дo 3 гетероатомів, вибраних із азоту, кисню і сірки, і, щонайменше, 2 суміжні атоми вуглецю, один з яких зв‘язаний із атомом азоту проілюстрованого кільця, що містить азот (Y є відсутнім) та інший з яких несе ціано або нітро замісник, причому інші замісники є необов‘язковими. Альтернативно R3 може являти собою необов‘язково заміщену піролідинільну, піразолільну, імідазолільну, 1,2,4-тріазолільну, ізоксазолільну, фурильну, тієнільну, піридильну, піперидильну, піразинільну, піримідинільну, морфолінільну, імідазо[2,1-b]тіазолільну, індолільну, ізоіндолільну, імідазо[1,2-a]піридильну, 1,2,3-бензотріазолільну, хінолільну, ізохінолільну, хіноксалінільну, піридо[2,3-b]піразинільну, 1,4-бензоксазинільну або фенільну групу, причому замісниками для кожної необов‘язково заміщеної групи є атом фтору, хлору, брому або йоду або метильна, ізопропільна, метокси, етокси, пропокси, ціано, нітро, трифторметильна, трифторметокси, ацетильна, ацетаміно, фенільна, бензилокси, фенілкарбамоїльна, 4-фторфенільна, 3-фтор-4 4 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 метилфенільна, 2-фурильна, 2-тієнільна, 4-піридильна, піперидино, 2-піримідинільна, 2піримідинілокси, 1,3-тіазол-2-ільна, 2-метил-1,3-тіазол-4-ільна, 2-оксо-піролідин-1-ільна, 5метил-1,2,4-оксадіазол-3-ільна, 2,5-диметил-1H-пірол-1-ільна група. Найбільш переважно R3 являє собою 6-метил-3-нітро-2-піридильну, 6-метил-3-ціано-2піридильну, 4-метокси-3-ціано-2-піридильну, 3-ціано-2-тієнільну, або 3-ціано-2-піразинільну групу. Найбільш переважні сполуки відповідно до винаходу є ті, що отримані в Прикладах нижче. Селективність сполук за винаходом можна виміряти за допомогою (a) індивідуального вимірювання спорідненості зв‘язування пробної сполуки до mGlu5 рецептору, mGlu1 рецептору і Групи II mGlu рецепторів; (b) визначення цих пробних сполук, які: (1) зв‘язуються із mGlu5 рецептором із спорідненістю, щонайменше, 10-6 M, і (2) зв‘язуються із mGlu5 рецептором із спорідненістю, щонайменше, у 10 разів сильнішою за спорідненість для mGlu1 рецептору і рецепторів Групи II mGlu. (c) індивідуального вимірювання здатності кожної із сполук, визначених на етапі (b) до дії в якості антагоністу або зворотного агоністу на mGlu5 рецепторі. Переважно, активність сполук, визначених на етапах (a), (b), і (c) вище підтверджують вимірюванням активності сполуки в лікуванні порушення нижніх сечовивідних шляхів у людей або на тваринній модельній системі. Більш переважно визначені сполуки проявляють активність у збільшенні об‘ємної місткості сечового міхура у щурів при свідомості. Визначення “солі” може включати кислотно-адитивні солі або адитивні солі вільних основ. Переважно, солі є фармацевтично прийнятними. Приклади таких кислот, що можуть застосовуватися для формування фармацевтично прийнятних кислотно-адитивних солей включають, але не обмежуються наступним: солі, що походять від нетоксичних неорганічних кислот, таких як азотна, фосфорна, сірчана або бромистоводнева, йодистоводнева, фтористоводнева, фосфориста, а також солі, що походять від нетоксичних органічних кислот, таких як аліфатичні моно- і дикарбонові кислоти, феніл-заміщені алканові кислоти, гідроксил алканові кислоти, алкандіолові кислоти, ароматичні кислоти, аліфатичні і ароматичні сульфонові кислоти, і оцтова, малеїнова, бурштинова або лимонна кислоти. Приклади таких солей, що не обмежують, включають нападисилат, бесилат, сульфат, піросульфат, бісульфат, сульфіт, бісульфіт, цитрат, фосфат, моногідрофосфат, дигідрофосфат, метафосфат, пірофосфат, хлорид, бромид, йодид, ацетат, трифторацетат, пропіонат, каприлат, ізобутират, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат, динітробензоат, фталат, бензолсульфонат, толуолсульфонат, фенілацетат, цитрат, лактат, малеат, тартрат, метансульфонат і подібне. Також прийнятними є солі амінокислот, таких як аргінат і подібне і глюконат, галактуронат (див., наприклад, Berge, et al. “Pharmaceutical Salts,” J. Pharm. Sci. 1977;66:1). Типово, фармацевтично прийнятна сіль сполуки I може бути отримана з використанням бажаної кислоти або основи при необхідності. Сіль можна осадити із розчину і зібрати шляхом фільтрації або можна відновити випаровуванням розчинника. Наприклад, водний розчин кислоти, такої як соляна кислота, може бути доданий до водної суспензії сполуки I і отриману суміш випаровують до сухого стану (ліофілізують) для отримання кислотно-адитивної солі у вигляді твердої речовини. Альтернативно, сполуку I можна розчинити в прийнятному розчиннику, наприклад, в спирті, такому як ізопропанол, і кислоту можна додати в той самий розчинник або в інший прийнятний розчинник. Отриману кислотно-адитивну сіль можна потім осадити безпосередньо, або шляхом додавання менш полярного розчинника, такого як діізопропіловий ефір або гексан, і виділити шляхом фільтрації. Кислотно-адитивні солі сполук I можна отримати шляхом контактування форми вільної основи із необхідною кількістю бажаної кислоти для отримання солі в традиційний спосіб. Форма вільної основи може бути відновлена шляхом контактування сольової форми із основою і шляхом виділення вільної основи в традиційний спосіб. Форми вільних основ дещо відрізняються від їхніх сольових форм за певними фізичними властивостями, такими як розчинність в полярних розчинниках, але в інших випадках солі є еквівалентними до їхньої відповідної вільної основи для цілей даного винаходу. Фармацевтично прийнятні основно-адитивні солі формуються із металами або амінами, такими як лужні і лужноземельні метали або органічні аміни. Приклади металів, що використовуються як катіони, включають натрій, калій, магній, кальцій і подібне. Приклади прийнятних амінів включають N,N’-дибензилетилендіамін, хлорпрокаїн, холін, діетаноламін, дициклогексиламін, етилендіамін, N-метилглюкамін і прокаїн. 5 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 60 Основно-адитивні солі зазначених кислотних сполук отримують шляхом контактування форми вільної кислоти із необхідною кількістю бажаної основи для отримання солі в традиційний спосіб. Форма вільної кислоти може бути відновлена шляхом контактування сольової форми із кислотою і шляхом виділення вільної кислоти. Сполуки за винаходом можуть мати як основний, так і кислотний центр і, таким чином, бути у формі цвіттеріонів. Фахівці в галузі органічної хімії розуміють, що багато органічних сполук можуть формувати комплекси із розчинниками, в яких вони реагують або з яких вони осаджуються або кристалізуються. Ці комплекси відомі як “сольвати”. Наприклад, комплекс з водою відомий як “гідрат”. Сольвати сполуки за винаходом знаходяться в обсязі даного винаходу. Солі сполук I можуть формувати сольвати (наприклад, гідрати) і даний винахід також включає всі такі сольвати. Значення слова “сольвати” є добре відомим для фахівців в даній галузі техніки як сполука, що сформувалася шляхом взаємодії розчинника і речовини, що розчиняється (а саме, сольвації). Методики для отримання сольватів добре описані в даній галузі техніки (див., наприклад, Brittain. Polymorphism in Pharmaceutical solids. Marcel Decker, New York, 1999.). Сполуки I можуть існувати в рацемічних сумішах або в будь-якій іншій комбінації. Рацемічні суміші можуть підлягати способам енантіомерного збагачення для отримання композицій, збагачених за конкретним енантіомером, або розділятися до композиції, що містить окремий енантіомер. Очищення складних сумішей діастереомерів до енантіомерів звичайно потребує два етапи. На першому етапі суміш діастереомерів розділяють на енантіомерні пари. На другому етапі енантіомерні пари далі очищують до композицій, збагачених на один або інший енантіомер або, більш переважно, розділяють до композицій, що містять чисті енантіомери. Розділення енантіомерів звичайно потребує реакції або молекулярної взаємодії із хіральним агентом, наприклад, розчинником або стовпчиковою матрицею. Розділення може бути досягнуто, наприклад, шляхом перетворення суміші енантіомерів, наприклад, рацемічної суміші, в суміш діастереомерів шляхом реакції із чистим енантіомером другого агенту, а саме, агенту розділення. Два отриманих діастереоізомерних продукти можна далі розділити. Розділені діастереомери потім зворотно перетворюють на чисті енантіомери шляхом обертання початкової хімічної трансформації. Розділення енантіомерів можна також провести шляхом відмінностей в їх нековалентному зв‘язуванні з хіральною речовиною, наприклад, шляхом хроматоргафії на гомохіральних адсорбентах. Нековалентне зв‘язування між енантіомерами і хроматографічним адсорбентом виявляє діастереомерні комплекси, що приводить до диференційного розділення в рухливому і зв‘язаному станах в хроматографічній системі. Два енантіомери, таким чином, рухаються крізь хроматографічну систему, наприклад, колонку, з різними швидкостями, що дозволяє їх розділити. Колонки хірального розділення добре відомі в галузі техніки і є комерційно наявними (наприклад, від MetaChem Technologies Inc., відділення ANSYS Technologies, Inc., Lake Forest, CA). Енантіомери можуть бути проаналізовані і очищені за допомогою, наприклад, хіральних нерухливих фаз (ХНФ) для ВЕРХ (високоефективна рідкісна хроматографія). Хіральні ВЕРХ колонки типово містять одну форму енантіомерної сполуки, іммобілізовану на поверхні силікагелевого наповнювача. D-фенілгліцин і L-лейцин є прикладами ХНФ типу I і використовують комбінації π - π взаємодій, водневих зв‘язків, диполь-дипольні взаємодій і стеричних взаємодій для отримання хірального розпізнавання. Для розділення на колонці Типу I, досліджувані енантіомери повинні містити функціональну комплементарність до ХНФ, так щоб досліджувана речовина підлягала значним взаємодіям із ХНФ. Зразок повинен переважно містити одну із наступних функціональних груп: π-кислота або π-основа, донор та/або акцептор водневого зв‘язку або амідний диполь. Дериватизація іноді використовується для додавання сайтів взаємодії до тих сполук, яким цього бракує. Найбільш поширені похідні включають формування амідів з амінів і карбонових кислот. MetaChiral ODM™ є прикладом ХНФ типу II. Первинні механізми для формування комплексів розчинена речовина - ХНФ полягають у взаємодіях притягнення, але комплекси включення також відіграють важливу роль. Водневий зв‘язок, π - π взаємодії, і дипольний стекінг є важливими для хірального розділення на MetaChiral™ ODM. Дериватизація може бути необхідною, коли молекули розчиненої речовини не містять групи, необхідні для взаємодій розчинена речовина - колонка. Дериватизація, звичайно для бензиламідів, може бути необхідною для деяких сильно полярних молекул, таких як аміни і карбонові кислоти, які в інших випадках сильно взаємодіють із нерухливою фазою шляхом неспецифічних стереовзаємодій. 6 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 Сполуки формули I можуть бути виділені в діастереомерні пари шляхом, наприклад, виділення за допомогою колонкової хроматографії або ТШХ (тонкошарової хроматографії) на силікагелі. Ці діастереомерні пари тут мають назву діастереомер з верхнім коефіцієнтом утримування ТШХ; і діастереомер з нижнім коефіцієнтом уторимування ТШХ. Діастереомери можуть потім бути збагачені на певний енантіомер або розділені на окремий енантіомер із застосуванням способів, добре відомих в галузі техніки, таких як ті, що наведені в даному описі. Відносну конфігурацію діастереомерних пар можна вивести із застосуванням теоретичних моделей або правил (наприклад, правило Крама, модель Фелкін-Ен) або із застосуванням більш достовірних тривимірних моделей, отриманих за допомогою комп‘ютеризованих хімічних програм. В багатьох випадках, ці способи здатні передбачити, який діастереомер є енергетично переважним продуктом хімічної трансформації. Альтернативно, відносну конфігурацію діастереомерних пар можна опосередковано визначити шляхом визначення абсолютних конфігурацій окремого енантіомера в одній (чи обох) діастереомерній(их) парі(парах). Абсолютну конфігурацію стереоцентрів можна визначити шляхом добре відомого для фахівців в даній галузі способу (наприклад, рентгенівської дифракції, циркулярного дихроїзму). Визначення абсолютної конфігурації може бути важливим для підтвердження передбачуваності теоретичних моделей і може допомогти в поширенні використання таких моделей на схожі молекули, отримані аналогічними механізмами (наприклад, відновлення кетонів і відновлювальне амінування кетонів гідридами). Даний винахід також включає стереоізомери типу син-анти та їхні суміші, що зустрічаються, коли є подвійний зв‘язок, і R2 є алкільна група, та/або m не є 1. Група найвищого пріоритету Кана-Інгольда-Прелога, що приєднується до одного з атомів термінального подвійного зв‘язку оксиму, порівнюється із гідроксильною групою оксиму. Стереоізомер позначається як Z (zusammen = разом) або Син, якщо гідроксил оксиму лежить на тому ж боці, що і стандартна площина, проведена через C=N подвійний зв‘язок як група вищого пріоритету; інший стереоізомер позначається як E (entgegen = навпроти) або Анти. Винахід також включає пролікарські засоби сполук I, а саме, сполуки, що вивільняють активний вихідний лікарський засіб відповідно до формули I in vivo при введенні до суб‘єктассавця. Пролікарський засіб являє собою фармацевтично активну або більш типово неактивну сполуку, що перетворюється на фармацевтично активний агент шляхом метаболічної трансформації. Пролікарські засоби сполук I отримують шляхом модифікації функціональних груп, присутніх в сполуках I таким чином, щоб модифікації могли розщепитися in vivo для вивільнення вихідної сполуки. In vivo, пролікарський засіб підлягає хімічним змінам при фізіологічних умовах [наприклад, на нього діє природно присутній фермент(и)], що призводить до вивільнення фармакологічно активного агенту. Пролікарські засоби включають сполуки I, де гідрокси, аміно або карбокси група зв‘язана з будь-якою групою, що можу бути розщеплена in vivo для відновлення вільної гідрокси, аміно або карбокси групи, відповідно. Приклади пролікарських засобів включають, але не обмежуються наступним: складні ефіри (наприклад, похідні ацетату, форміату і бензоату) сполук I або будь-яка інша похідна, що при перенесенні у фізіологічний pH або при дії ферменту перетворюється на активний вихідний лікарський засіб. Традиційні процедури для відбору і приготування прийнятних похідних пролікарських засобів описані в галузі техніки (див., наприклад, Bundgaard. Design of Pro-drugs. Elsevier, 1985). Пролікарські засоби можуть бути введені в той же спосіб, що й активний інгредієнт, в який вони перетворюються, або вони можуть бути доставлені у формі ємності, наприклад, трансдермальний пластир або інша ємність, що адаптована для того, щоб дозволити (шляхом забезпечення ферментом або іншим прийнятним реагентом) перетворення пролікарського засобу в активний інгредієнт повільно протягом часу, і доставити активний інгредієнт пацієнту. Даний винахід також включає метаболіти. “Метаболіт” сполуки, описаної в даному описі, являє собою похідну сполуки, що сформована, коли сполука метаболізується. Визначення “активний метаболіт” стосується біологічно активної похідної сполуки, що утворюється, коли сполука метаболізується. Визначення “метаболізується” стосується сукупності процесів, за допомогою яких конкретна речовина змінюється в живому організмі. Коротко, всі сполуки, присутні в організмі, підлягають дії ферментів в тілі для того, щоб отримати енергію та/або видалити їх з організму. Специфічні ферменти утворюють специфічні структурні зміни сполуки. Наприклад, цитохром P450 каталізує багато окиснювальних і відновлювальних реакцій, тоді як уридин дифосфат глюкуронілтрансферази каталізують перенесення активованої молекули глюкуронової кислоти на ароматичні спирти, аліфатичні спирти, карбонові кислоти, аміни і вільні сульфгідрильні групи. Більше інформації про метаболізм можна отримати з The Pharmacological th Basis of Therapeutics, 9 Edition, McGraw-Hill (1996), pages 11-17. 7 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 Метаболіти сполук, описаних тут, можуть бути визначені або шляхом введення сполук в організм-хазяїн і аналізу зразків тканини хазяїна, або шляхом інкубування сполук з клітинами печінки in vitro і аналізу отриманих сполук. Обидва способи є добре відомими в галузі техніки. Короткий опис фігур Фігура 1 представляє графік, що показує залежність від часу ефекту на об‘ємну місткість сечового міхура щура Сполуки Прикладу 1, що вводили в кількості 1 і 3 мг/кг, перорально, проти контролів, що отримували наповнювач. Фігура 2 представляє графік, що показує залежність від часу ефекту на об‘ємну місткість сечового міхура щура Сполуки Прикладу 10, що вводили в кількості 0,3 і 1 мг/кг, перорально, проти контролів, що отримували наповнювач. Фігура 3 представляє графік, що показує залежність від часу ефекту на об‘ємну місткість сечового міхура щура еталонної сполуки, MTEP, що вводили в кількості 1 і 3 мг/кг, перорально, проти контролів, що отримували наповнювач. Порушення нижніх сечовивідних шляхів Номенклатура симптомів і патологій нижніх сечовивідних шляхів, що використовується в даному описі, викладена в повному обсязі в Abrams et al., Neurol. and Urodyn. 21:167-178 (2002) і Andersson et al., Pharmacol. Rev. 56:581-631 (2004). Дисфункції видалення сечі можуть бути в цілому класифіковані як порушення збереження або спорожнювання. Симптоми збереження спостерігаються протягом фази збереження сечового міхура і включають збільшену частоту сечовипускання протягом дня, ноктурію (нічні позиви до сечовипускання один або більше разів), невідкладність (несподіване, непереборне бажання мочитися, яке важко затримати), і нетримання сечі (будь-яке мимовільне витікання сечі). Нетримання сечі може також бути охарактеризоване симптомами. Нетримання сечі при напрузі - це мимовільне витікання при зусиллі або навантаженні, або при чханні або кашлі. Невідкладне нетримання сечі - це мимовільне витікання сечі, що супроводжує або безпосередньо йде за невідкладністю. Змішане нетримання сечі – це мимовільне витікання сечі, пов‘язане із невідкладністю, а також із навантаженням, зусиллям, чханням або кашлем. Нетримання сечі внаслідок переповненого сечового міхура – це мимовільне витікання сечі, що має місце після того, як ємність сечового міхура переповниться, наприклад, через неможливість спорожнення. Енурез також стосується будь-якої мимовільної втрати сечі. Нічний енурез являє собою втрату сечі, що трапляється протягом сну. Симптоми виділення включають повільний струмінь, розщеплення або розбризкування струменя сечі, переривчастий струмінь (переривчастість, а саме, зупинку і початок знову витікання сечі протягом сечовипускання), затримку сечі (труднощі в початку сечовипускання через затримку початку виділення після того, як індивідуум готовий мочитися), проціджування і кінцеве сечовипускання по краплях (подовжена кінцева частина сечовипускання, коли потік уповільнюється до тонкого струмка/крапель). Порушення нижніх сечовивідних шляхів може бути поділено на категорії за сукупністю симптомів (а саме, за синдромом) або за етіологією. Індивідууми, що страждають від синдрому гіперактивного сечового міхура (ГСМ), наприклад, типово страждають від симптомів невідкладності, невідкладного нетримання сечі, збільшеної частоти сечовипускання протягом дня або ноктурії. ГСМ трапляється як результат надмірної м‘язової активності детрузора, що має назву м‘язова нестабільність детрузора. М‘язова нестабільність детрузора може виникати через не неврологічні порушення, такі як камені в сечовому міхурі, м‘язова хвороба, інфекція сечовивідних шляхів або побічні ефекти лікарських засобів або може бути ідіопатичною. Нейрогенний гіперактивний сечовий міхур (нейрогенний сечовий міхур) являє собою тип гіперактивного сечового міхура, що трапляється як результат надмірної м‘язової активності детрузора, що має назву гіперрефлексія детрузора, вторинно через відомі неврологічні порушення. Пацієнти із неврологічними порушеннями, такими як напад, хвороба Паркінсона, діабет, множинний склероз, периферійна невропатія або порушення спинного мозку часто страждають від нейрогенного гіперактивного сечового міхура. Цистит (включаючи інтерстиціальний цистит) – це порушення нижніх сечовивідних шляхів невідомої етіології, що переважно вражає молодих жінок і жінок середнього віку, хоча чоловіки і діти також можуть бути враженими. Симптоми інтерстиціального циститу можуть включати симптоми виділення, збільшену частоту сечовипускання протягом дня, невідкладність, ноктурію або надлобковий або тазовий біль, пов’язаний із виділенням і має полегшення після виділення. Багато пацієнтів із інтерстиціальним циститом також страждають від головного болю, а також шлунково-кишкових і шкірних проблем. В деяких випадках, інтерстиціальний цистит може бути пов‘язаним також із виразками або рубцями сечового міхура. 8 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 Простатит і простатодинія є іншим порушенням нижніх сечовивідних шляхів, що, як вважають, вражає приблизно 2-9% дорослих чоловіків. Простатит являє собою запалення простати, і включає бактеріальний простатит (гострий і хронічний) і небактеріальний простатит. Гострий і хронічний бактеріальний простатит характеризуються запаленням передміхурової залози і бактеріальною інфекцією передміхурової залози, що звичайно пов‘язана із симптомами болю, збільшеною частотою сечовипускання протягом дня та/або невідкладністю. Хронічний бактеріальний простатит відрізняється від гострого бактеріального простатиту на основі рецидивуючої природи порушення. Хронічний небактеріальний простатит характеризується запаленням передміхурової залози, що має невизначену етіологію, що супроводжується присутністю надмірної кількості клітин запалення в секретах передміхурової залози, що звичайно не пов‘язане із бактеріальною інфекцією передміхурової залози, і звичайно пов‘язане із симптомами болю, збільшеною частотою сечовипускання протягом дня та/або невідкладністю. Простатодинія являє собою порушення, що повторює симптоми простатиту при відсутності запалення передміхурової залози, бактеріальної інфекції передміхурової залози і підвищеного рівня клітин запалення в секретах передміхурової залози. Простатодинія може бути пов‘язана із симптомами болю, збільшеною частотою сечовипускання протягом дня та/або невідкладністю. Доброякісна гіперплазія передміхурової залози (ДГП) являє собою незлоякісне збільшення постати, що є дуже поширеним у чоловіків віком старше 40 років. Гадають, що ДГП спричиняється надмірним клітинним ростом як гранулярного, так і стромального елементів передміхурової залози. Симптоми ДГП можуть включати підвищену частоту сечовипускання, невідкладність, невідкладне нетримання сечі, ноктурію, і симптоми виділення, включаючи повільний струмінь, розщеплення або розбризкування струменя сечі, переривчастість, затримку сечі, проціджування і кінцеве сечовипускання по краплях. Ефективні кількості сполуки I можуть бути використані для лікування порушень нижніх сечовивідних шляхів у пацієнта, що потребує такого лікування. Лікування порушень нижніх сечовивідних шляхів включає лікування симптомів збереження або симптомів видалення сечі. Лікування порушень нижніх сечовивідних шляхів також включає лікування збільшеної частоти сечовипускання протягом дня, ноктурії, невідкладності, нетримання сечі, включаючи невідкладне нетримання сечі, нетримання сечі при напрузі, змішане нетримання сечі і нетримання сечі внаслідок переповненого сечового міхура, енурез, включаючи нічний енурез, повільний струмінь, розщеплення або розбризкування струменя сечі, переривчастість, затримку сечі, проціджування і кінцеве сечовипускання по краплях. Лікування порушень нижніх сечовивідних шляхів також включає лікування синдрому гіперактивного сечового міхура (ГСМ), включаючи лікування одного або декількох симптомів з невідкладності, невідкладного нетримання сечі, збільшеної частоти сечовипускання протягом дня або ноктурії. Лікування порушень нижніх сечовивідних шляхів також включає лікування будь-яких вищезгаданий станів, симптомів та/або синдромів, якщо вони спричинені або пов‘язані із циститом, включаючи інтерстиціальний цистит, простатит, ДГП, неврологічні порушення, зменшену сечову розтяжність (а саме, зменшену накопичувальну ємність сечового міхура). Сполука I може використовуватися для лікування мимовільного сечовипускання, а саме, нетримання сечі, наприклад, невідкладного нетримання сечі, нетримання сечі при напрузі, змішаного нетримання сечі або нетримання сечі внаслідок переповненого сечового міхура. Таке нетримання сечі викликане та/або пов‘язане із ГСМ або ДГП. Фармацевтичні композиції Через те, що сполука I може бути введена як нерозфасована речовина, переважним є можливість представлення активного інгредієнту в фармацевтичному складі, наприклад, де агент знаходиться в суміші із фармацевтично прийнятним носієм, вибраним з точки зору передбаченого шляху введення і стандартної фармацевтичної практики. Відповідно, в одному аспекті винахід також забезпечує фармацевтичну композицію, що містить сполуку I, або її енантіомер, діастереомер, N-оксид або фармацевтично прийнятну сіль в суміші із фармацевтично прийнятним носієм. Сполуки I можуть використовуватися в комбінації із іншими способами терапії та/або активними агентами. Відповідно винахід забезпечує, в іншому аспекті, фармацевтичну композицію, що містить, щонайменше, одну сполуку I або її фармацевтично прийнятну похідну, другий активний агент і, необов‘язково, фармацевтично прийнятний носій. Зрозуміло, що при поєднанні в одному складі дві сполуки повинні бути стабільними і сумісними одна з одною та іншими компонентами складу. Якщо вони сформульовані окремо, то 9 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 60 вони можуть забезпечуватися в будь-якому прийнятному складі, причому прийнятно у такий спосіб, що є відомим для таких сполук в галузі техніки. Визначення “носій” стосується розчинника, допоміжної речовини та/або наповнювача, з яким вводиться активна сполука. Фармацевтичні композиції за винаходом можуть містити комбінації більш ніж одного носія. Такі фармацевтичні носії можуть бути стерильними рідинами, такими як вода, сольові розчини, водні розчини декстрози, водні розчини гліцеролу і оліями, включаючи олії нафтового, тваринного, рослинного або синтетичного походження, такі як арахісова олія, соєва олія, мінеральна олія, сезамова олія і подібне. Вода або водні і сольові розчини і водні розчини декстрози і гліцеролу переважно використовуються в якості носіїв, зокрема в розчинах для ін‘єкцій. Прийнятні фармацевтичні носії описані в “Remington’s Pharmaceutical Sciences” th E.W. Martin, 18 Edition. Сполуки за винаходом можуть бути сформульовані для введення будь-яким прийнятним шляхом для використання в медицині або ветеринарії і винахід, таким чином, включає в свій обсяг фармацевтичні композиції, що містять сполуку за винаходом, прийнятну для використання в медицині або ветеринарії. Такі композиції можуть бути представлені для використання у прийнятний спосіб за допомогою одного або декількох прийнятних носіїв. Прийнятні носії для терапевтичного використання є добре відомими в фармацевтичній галузі, і описані, наприклад, в Remington’s Pharmaceutical Sciences, Mack Publishing Co. (A. R. Gennaro edit. 1985). Вибір фармацевтичного носія може бути здійснений з точки зору передбаченого шляху введення і стандартної фармацевтичної практики. Фармацевтичні композиції можуть містити як носій, крім того, будь-який прийнятний зв‘язувальний(і) агент(и), змащувальний(і) агент(и), суспендуючий(і) агент(и), покривний(і) агент(и), та/або агент(и), що розчиняє(ють). Консерванти, стабілізатори, барвники і навіть ароматизатори можуть забезпечуватися в фармацевтичній композиції. Приклади консервантів включають бензоат натрію, аскорбінову кислоту і складні ефіри p-гідроксибензойної кислоти. Також можуть використовуватися антиоксиданти і суспендуючі агенти. Сполуки за винаходом можуть бути розмелені із використанням відомих процедур помелу, таких як вологий помел для отримання частин розміром, прийнятним для формування таблеток та складів інших типів. Дрібно дисперсні (у формі наночастинок) препарати сполук за винаходом можуть бути отримані способом, відомим в галузі техніки, наприклад, дивись публікацію міжнародної заявки WO 02/00196 (SmithKline Beecham). Шляхи введення і дозовані лікарські форми Шляхи введення (доставки) включають, але не обмежуються наступним одним або декількома з: пероральний (наприклад, в якості таблетки, капсули або розчину, що можна проковтнути), місцевий, мукозальний (наприклад, в якості назального спрею або аерозоль для інгаляції), назальний, парентеральний (наприклад, шляхом форм для ін‘єкцій), гастроінтестинальний, інтраспінальний, внутрішньочеревинний, внутрішньом‘язовий, внутрішньовенний, внутрішньоматковий, внутрішньооковий, внутрішньошкірний, інтракраніальний, внутрішньотрахеальний, внутрішньовагінальний, інтрацеребровентрикулярний, інтрацеребральний, підшкірний, очний (включаючи в скловидне тіло або інтракамеральний), трансдермальний, ректальний, букальний, епідуральний і сублінгвальний. Таким чином, композиції за винаходом включають такі композиції, що є у формі, які особливо сформульовані для, наприклад, парентерального, перорального, букального, ректального, місцевого, імплантного, очного, назального або урогенітального використання. В переважних варіантах здійснення винаходу фармацевтичні композиції за винаходом сформульовані у формі, що є прийнятною для пероральної доставки. Можуть існувати різні умови для композиції/складу в залежності від різних систем доставки. Треба розуміти, що не всі сполуки повинні вводитися однаковим шляхом. Також, якщо композиція містить більш ніж один активний компонент, то ці компоненти можуть вводитися різними шляхами. Наприклад, фармацевтична композиція за даним винаходом може бути сформульована для доставки за допомогою міні-помпи або мукозальним шляхом, наприклад, в якості назального спрею або аерозолю для інгаляції або розчину, що можна проковтнути, або парентерально, причому композиція сформульована у формі для ін‘єкції, для доставки, наприклад, внутрішньовенним, внутрішньом‘язовим або підшкірним шляхом. Альтернативно, склад може бути розроблений для того, щоб бути доставленою багатьма шляхами. Коли агент доставляється мукозально через гастроінтестинальний слиз, він повинен залишатися стабільним протягом транспортування крізь гастроінтестинальний тракт; наприклад, він повинен бути стійким до протеолітичної деградації, стабільним при кислому pH і стійким до детергентних ефектів жовчі. Наприклад, сполука I може бути покритою 10 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 60 кишковорозчинною оболонкою. Матеріал кишковорозчинної оболонки може диспергуватися або розчинятися як у воді, так і в прийнятному органічному розчиннику. В якості полімерів кишковорозчинної оболонки, одного або декількох, окремого або в комбінації, можуть використовуватися наступні; наприклад, розчини або дисперсії сополімерів меакрилової кислоти, ацетат фталат целюлози, ацетат бутират целюлози, фталат гідроксипропіл метилцелюлози, гідроксипропіл метилцелюлози ацетат сукцинат, полівініл ацетат фталат, ацетат тримелітат целюлози, карбоксиметилетилцелюлоза, шелак або інші прийнятний(і) полімер(и) кишковорозчинної оболонки. З екологічних міркувань водний спосіб покриття може бути переважним. В таких водних способах найбільш переважними є сополімери метакрилової кислоти. Там, де це прийнятно, фармацевтичні композиції можуть вводитися шляхом інгаляції, у формі супозиторію або песарію, місцево у формі лосьйону, розчину, крему, мазі або присипки, шляхом використання шкірного пластиру, перорально у формі таблеток, що містять допоміжні речовини, такі як крохмаль або лактоза, або в капсулах або супозиторіях, як окремо, так і в суміші із допоміжними речовинами, або у формі еліксирів, розчинів або суспензій, що містять ароматизатори або фарбники, або вони можуть вводитися шляхом ін‘єкції парентерально, наприклад внутрішньовенно, внутрішньом‘язово або підшкірно. Для букального або сублінгвального введення композиції можуть вводитися у формі таблеток або льодяників, які можуть бути сформульовані прийнятним способом. Фармацевтичні композиції за даним винаходом можуть бути введені парентерально, наприклад, шляхом інфузії або ін‘єкції. Якщо композиція за винаходом вводиться парентерально, таке введення включає один або декілька з наступних: введення агенту внутрішньовенно, внутрішньоартеріально, внутрішньочеревинно, інтратекально, інтравентрикулярно, інтрауретрально, інтрастернально, інтракраніально, внутрішньом‘язово або підшкірно; та/або шляхом використанні методик інфузії. Фармацевтичні композиції, прийнятні для ін‘єкції або інфузії, можуть бути у формі стерильного водного розчину, дисперсії або стерильного порошку, що містить активний інгредієнт, пристосований, при необхідності, для приготування такого стерильного розчину або дисперсії, прийнятної для інфузії або ін‘єкції. Такий препарат може необов‘язково бути інкапсульованим в ліпосоми. У всіх випадках кінцевий препарат повинен бути стерильним, рідким і стабільним в умовах виготовлення і зберігання. Для покращення стабільності при зберіганні такі препарати можуть також містити консервант для попередження розвитку мікроорганізмів. Попередження активності мікроорганізмів також досягається додаванням різних антибактеріальних і протигрибкових агентів, наприклад, парабену, хлорбутанолу або аскорбінової кислоти. В багатьох випадках рекомендовані ізотонічні речовини, наприклад, цукри, буфери і хлорид натрію, для того, щоб гарантувати осмотичний тиск, однаковий із тиском рідин тіла, зокрема крові. Подовжена абсорбція таких сумішей для ін‘єкції може бути досягнута введенням агентів, що подовжують абсорбцію, таких як моностеарат алюмінію або желатин. Дисперсії можуть бути приготовані в рідкому носії або проміжній речовині, такій як гліцерин, рідкі поліетиленгліколі, тріацетинові олії та їх суміші. Рідкий носій або проміжна речовина може бути розчинником або рідким дисперсним середовищем, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерол, пропіленгліколь або подібне), рослинні олії, нетоксичні гліцеринові складні ефіри та їх прийнятні суміші. Необхідно підтримувати прийнятну плинність шляхом утворення ліпосом, введенням часток прийнятного розміру у випадку дисперсій або шляхом додавання поверхнево-активних речовин. Для парентерального введення сполуку найкраще використовувати у формі стерильного водного розчину, що може містити інші речовини, наприклад, достатню кількість солей або глюкози для утворення розчину, ізотонічного до крові. Водні розчини повинні бути відповідно забуферені (переважно до pH від 3 до 9), при необхідності. Приготування прийнятних парентеральних складів у стерильних умовах проводиться за допомогою стандартних фармацевтичних методик, добре відомих фахівцям в даній галузі. Стерильні розчини для ін‘єкцій можуть бути приготовані шляхом змішування сполуки формул I, II, або III із відповідним розчинником і одним або декількома з вищезгаданих носіїв, з наступним стерильним фільтруванням. У випадку стерильних порошків, прийнятних для використання у приготуванні стерильних розчинів для ін‘єкцій, переважні способи приготування включають сушіння у вакуумі ті ліофілізацію, що забезпечує порошкову суміш антагоністів рецептору альдостерону і бажаних допоміжних речовин для наступного приготування стерильних розчинів. Сполуки відповідно до винаходу можуть бути сформульовані для використання в медицині або ветеринарії шляхом ін‘єкції (наприклад, внутрішньовенна болюсна ін‘єкція або інфузія або 11 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 через внутрішньом‘язовий, підшкірний або інтратрахеальний шляхи) і може бути представлена в дозованій лікарській формі, в ампулах, або інших контейнерах для багатьох доз, при необхідності із доданим консервантом. Композиції для ін‘єкції можуть бути в формі суспензій, розчинів або емульсій, в олійних або водних наповнювачах, і можуть містити агенти для утворення складу, такі як агенти, що суспендують, стабілізують, розчиняють та/або диспергують. Альтернативно активний інгредієнт може бути у формі стерильного порошку для змішування із прийнятним наповнювачем, наприклад, стерильною, непірогенною водою, перед використанням. Сполуки за винаходом можуть вводитися (наприклад, перорально або місцево) у формі таблеток, капсул, супозиторіїв, еліксирів, розчинів або суспензій, що можуть містити ароматизатори або фарбники, для введень із негайним, відкладеним, модифікованим, уповільненим, імпульсним або контрольованим вивільненням. Сполуки за винаходом можуть також бути представлені для застосування в медицині або ветеринарії у формі, прийнятній для перорального або букального введення, наприклад в формі розчинів, гелів, сиропів, полоскань для рота або суспензій, або сухого порошку для розбавлення водою або іншим прийнятним наповнювачем до застосування, необов‘язково із ароматизаторами та агентами для офарблення. Також можуть використовуватися тверді композиції, такі як таблетки, капсули, льодяники, пастилки, шарики, болюси, порошок, пасти, гранули, пілюлі або препарати попереднього змішування. Тверді та рідкі композиції для перорального використання можуть бути приготовлені відповідно до способів, добре відомих в галузі техніки. Такі композиції також можуть містити один або декілька фармацевтично прийнятних носіїв і допоміжних речовин, що можуть бути в твердій або рідкій формі. Таблетки можуть містити допоміжні речовини, такі як мікрокристалічна целюлоза, лактоза, цитрат натрію, карбонат кальцію, двоосновний фосфат кальцію і гліцин, розпушувачі, такі як крохмаль (переважно кукурудзяний, картопляний або крохмаль з тапіоки), натрію гліколат крохмалю, кроскармелоза натрію і подібні складні силікати, і зв‘язувальні агенти для грануляції, такі як полівінілпіролiдон, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза (ГПЦ), цукроза, желатин і камедь. Крім того, також можуть включатися змащувальні агенти, такі як стеарат магнію, стеаринова кислота, бегенат гліцерилу і тальк. Композиції можна вводити перорально, у формі таблеток із швидким або уповільненим вивільненням, мікрочастинок, мінітаблеток, капсул, саше і пероральних розчинів або суспензій або порошків для їхнього приготування. Крім нових твердих форм пантопразолу за даним винаходом в якості активної речовини, пероральні препарати можуть необов‘язково включати різні стандартні фармацевтичні носії і допоміжні речовини, такі як зв‘язувальні агенти, наповнювачі, буфери, змащувальні агенти, агенти для покращення ковзання, барвники, розпушувачі, віддушки, підсолоджувачі, поверхнево-активні речовини, агенти для змазки, протиадгезійні агенти і покривні агенти. Деякі допоміжні речовини можуть відігравати багато ролей в композиціях, наприклад, діють як зв‘язувальні агенти і розпушувачі. Приклади фармацевтично прийнятних розпушувачів для пероральних композицій, корисних в даному винаході, включають, але не обмежуються наступним: крохмаль, прежелатинізований крохмаль, натрію гліколят крохмалю, карбоксиметилцелюлоза натрію, кроскармелоза натрію, мікрокристалічна целюлоза, альгінати, смоли, поверхнево-активні речовини, шиплячі композиції, водні силікати алюмінію і поперечно-зшитий полівінілпіролiдон. Приклади фармацевтично прийнятних зв‘язувальних агентів для пероральних композицій, корисних в даному винаході, включають, але не обмежуються наступним: камедь; похідні целюлози, такі як метилцелюлоза, карбоксиметилцелюлоза, гідроксипропілметилцелюлоза, гідроксипропілцелюлоза або гідроксиетилцелюлоза; желатин, глюкоза, декстроза, ксилітол, поліметакрилати, полівінілпіроліддоп, сорбітол, крохмаль, прежелатинізований крохмаль, трагакант, ксантанова смола, альгінати, силікат магнію-алюмінію, поліетиленгліколь або бентоніт. Приклади фармацевтично прийнятних наповнювачів для пероральних композицій включають, але не обмежуються наступним: лактоза, безводна лактоза, моногідрат лактози, цукроза, декстроза, манітол, сорбітол, крохмаль, целюлоза (зокрема мікрокристалічна целюлоза), дигідро- або безводний фосфат кальцію, карбонат кальцію і сульфат кальцію. Приклади фармацевтично прийнятних змащувальних агентів, корисних в композиціях за винаходом включають, але не обмежуються наступним, стеарат магнію, тальк, поліетиленгліколь, полімери оксиду етилену, лаурилсульфат натрію, лаурилсульфат магнію, олеат натрію, стеарилфумарат натрію і колоїдний діоксид кремнію. 12 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 Приклади відповідних фармацевтично прийнятних віддушин для пероральних композицій включають, але не обмежуються наступним: синтетичні ароматичні агенти і натуральні ароматичні олії, такі як екстракти олії, квітів, фруктів (наприклад, банану, яблука, вишні садової, персика) та їхні комбінації, і подібні ароматичні агенти. Їх використання залежить від багатьох факторів, серед яких найбільш важливим є органолептична прийнятність для населення, що буде приймати фармацевтичні композиції. Приклади відповідних фармацевтично прийнятних барвників для пероральних композицій включають, але не обмежуються наступним: синтетичні і натуральні барвники, такі як діоксид титану, бета-каротин і екстракти цедри грейпфруту. Приклади корисних фармацевтично прийнятних покривних агентів для пероральних композицій, що звичайно використовують для полегшення ковтання, модифікації властивостей вивільнення, покращення зовнішнього вигляду, та/або маскування смаку композицій, включають, але не обмежуються наступним: гідроксипропілметилцелюлоза, гідроксипропілцелюлоза і акрилат-метакрилат сополімери. Відповідні приклади фармацевтично прийнятних підсолоджувачів для пероральних композицій включають, але не обмежуються наступним: аспартам, сахарин, сахарин натрію, цикамат натрію, ксилітол, манітол, сорбітол, лактоза і цукроза. Відповідні приклади фармацевтично прийнятних буферів включають, але не обмежуються наступним: лимонна кислота, цитрат натрію, бікарбонат натрію, двоосновний фосфат натрію, оксид магнію, карбонат кальцію і гідроксид магнію. Відповідні приклади фармацевтично прийнятних поверхнево-активних речовин включають, але не обмежуються наступним: лаурилсульфат натрію і полісорбати. Тверді композиції подібного типу можуть також використовуватися в якості наповнювачів в желатинових капсулах. Переважні допоміжні речовини з цієї точки зору включають лактозу, крохмаль, целюлозу, молочний цукор або високомолекулярні поліетиленгліколі. Для водних суспензій та/або еліксирів агент може бути комбінований із різними підсолоджувачами або ароматизаторами, пігментами або барвниками, із агентами, що емульсифікують та/або суспендують та із розчинниками, такими як вода, етанол, пропіленгліколь і гліцерин, та їхніми комбінаціями. Сполуки за винаходом можуть також, наприклад, бути сформульовані в якості супозиторіїв, наприклад, що містять прийнятні основи для супозиторіїв для використанні в медицині або ветеринарії або в якості песаріїв, наприклад, що містять прийнятні основи для песаріїв. Сполуки відповідно до винаходу можуть бути сформульовані для місцевого введення, для використання в медицині і ветеринарії, в формі мазей, кремів, гелів, гідрогелів, лосьйонів, розчинів, шампунів, порошків (включаючи порошки в аерозольних упаковках або присипки), песаріїв, тампонів, спреїв, рідин для умочування, аерозолів, крапель (наприклад, очних, вушних або крапель для носу) або присипок. Для нанесення місцево на шкіру агент за даним винаходом може бути сформульований в якості прийнятної мазі, що містить активну сполуку, суспендовану або розчиненув, наприклад, суміші з одним або декількох з наступних: мінеральна олія, вазелінове масло, білий вазелін, пропіленгліколь, сполука поліоксиетилену та поліококсипропілену, емульгований віск, сорбітан моностеарат, поліетиленгліколь, рідкий парафін, полісорбат 60, віск цетилового складного ефіру, цетеариловий спирт, 2-oктилдодеканол, бензиловий спирт і вода. Такі композиції можуть також містити інші фармацевтично прийнятні допоміжні речовини, такі як полімери, олії, рідкі носії, поверхнево-активні речовини, буфери, консерванти, стабілізатори, антиоксиданти, зволожувачі, пом’якшувальні речовини, барвники і віддушки. Приклади фармацевтично прийнятних полімерів, відповідних для таких місцевих композицій, включають, але не обмежуються наступним: акрилові полімери; похідні целюлози, такі як карбоксиметилцелюлоза натрію, метилцелюлоза або гідроксипропілцелюлоза; нейтральні полімери, такі як альгінати, трагакант, пектин, ксантан і хітозан. Приклади відповідних фармацевтично прийнятних олій, які є також корисними, включають, але не обмежуються наступним: мінеральні олії, силіконові олії, жирні кислоти, сприти і гліколі. Приклади відповідних фармацевтично прийнятних рідких носіїв включають, але не обмежуються наступним: вода, спирти або гліколі, такі як етанол, ізопропанол, пропіленгліколь, гексиленгліколь, гліцерол і поліетиленгліколь, або їхні суміші, в яких псевдополіморф розчиняють або диспергують, необов‘язково за допомогою додавання нетоксичних аніоннних, катіоннних або неіоннних поверхнево-активних речовин, і неорганічних або органічних буферів. Відповідні приклади фармацевтично прийнятних консервантів включають, але не обмежуються наступним: різні антибактеріальні і протигрибкові агенти, такі як розчинники, 13 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад етанол, пропіленегліколь, бензиловий спирт, хлорбутанол, четвертинні амонійні солі і парабени (такі як метилпарабен, етилпарабен, пропілпарабен і т. і.). Відповідні приклади фармацевтично прийнятних стабілізаторів і антиоксидантів включають, але не обмежуються наступним: етилендіамінтетраоцтова кислота (EDTA), тіосечовина, токоферол і бутил гідроксианізол. Відповідні приклади фармацевтично прийнятних зволожувачів включають, але не обмежуються наступним, гліцерин, сорібтол, сечовина і поліетиленгліколь. Приклади фармацевтично прийнятних пом‘якшувальних речовин включають, але не обмежуються наступним: мінеральні олії, ізопропіл міристат і ізопропіл пальмітат. Сполуки також можуть вводитися дермально або трансдермально, наприклад, за допомогою використання шкірного пластиру. Для очного застосування сполуки можуть бути сформульовані в якості тонкошарових суспензій в ізотонічному, pH відрегульованому, стерильному сольовому розчині, або, переважно, в якості розчинів в ізотонічному, pH відрегульованому, стерильному сольовому розчині, необов‘язково в комбінації із консервантом, таким як хлорид бензилалконію. Як передбачено, сполуки за даним винаходом можуть вводитися інтраназально або шляхом інгаляції і відповідно доставлятися у формі інгалятору сухого порошку або у формі спрею– аерозолю із контейнера під тиском, помпи, спрею або розпилювача із використанням прийнятного пропеленту, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, гідрофторалкану, такого як 1,1,1,2-тетрафторетан (HFA 134AT) або 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA), діоксиду вуглецю або іншого прийнятного газу. У випадку аерозолю під тиском одиниця дозування може визначатися шляхом забезпечення клапаном для доставки виміряної кількості. Контейнер під тиском, помпа, спрей або розпилювач можуть містити розчин або суспензію активної сполуки, наприклад, використовуючи суміш етанолу і пропеленту в якості розчинника, що може додатково містити змащувальний агент, наприклад, тріолеат сорбітану. Капсули і картриджі (зроблені, наприклад, із желатину) для використання в інгаляторі або інсуфляторі можуть бути сформульовані так, щоб містити порошкову суміш сполуки і прийнятної порошкової основи, такої як лактоза або крохмаль. Для місцевого введення шляхом інгаляції сполуки відповідно до винаходу можуть бути доставлені для використанні в медицині або ветеринарії за допомогою розпилювача. Фармацевтичні композиції за винаходом можуть містити від 0,01 до 99% вагових одиниць на об‘єм активного матеріалу. Для місцевого введення, наприклад, композиція буде загалом містити від 0,01-10%, більш переважно 0,01-1% активного матеріалу. Активні агенти можуть також вводитися у формі систем ліпосомної доставки, таких як малі одноламелярні везикули, великі одноламелярні везикули і багатоламелярні везикули. Ліпосоми можуть бути сформовані з різних фосфоліпідів, таких як холестерол, стеариламін або фосфатидилхоліни. Фармацевтична композиція або дозовані лікарські форми, що містять ефективну кількість за даним винаходом можуть вводитися тварині, переважно людині, що потребує лікування нейром‘язової дисфункції нижніх сечовивідних шляхів, описаної E. J. McGuire в “Campbell’s th UROLOGY”, 5 Ed., 616-638, 1986, W.B. Saunders Company. Як використовується в даному описі, визначення “ефективна кількість” стосується кількості, що приводить до значного покращення, щонайменше, одного симптому або параметру специфічного порушення. В переважному варіанті здійснення винаходу сполука лікує порушення сечовивідних шляхів, таких як невідкладене покликанні до сечовипускання, гіперактивний сечовий міхур, збільшена частота сечовипускання, зменшена сечова еластичність (зменшення накопичувальної ємності сечового міхура), цистит (включаючи інтерстиціальний цистит), нетримання сечі, витікання сечі, енурез, дизурія, утруднений початок сечовипускання і утруднення у спустошенні сечового міхура. В іншому переважному варіанті здійснення винаходу сполука лікує мігрень. В іншому переважному варіанті здійснення винаходу сполука використовується для лікування хвороби гастроезофагеального рефлюксу. Фармацевтична композиція або дозована лікарська форма за даним винаходом може бути введена відповідно до дози і режиму введення, визначеного шляхом рутинного аналізу в світлі інструкцій, наведених вище, для того, щоб отримати оптимальну активність при мінімізації токсичності або побічних ефектів для певного пацієнта. Проте, таке настроювання терапевтичного режиму є рутинною технікою в світлі інструкцій, наведених в даному описі. Дозування активних агентів за даним винаходом може змінюватися відповідно до багатьох факторів, таких як вищезгадані хворобливі стани, індивідуальний стан, вага, стать і вік, і спосіб введення. Ефективна кількість для лікування порушення може легко бути визначена 14 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 емпіричними способами, відомими для фахівця в даній галузі, наприклад, шляхом формування шаблону доз і частоти введення і порівняння груп експериментальних одиниць або суб‘єктів в кожній точці шаблону. Точна кількість для введення пацієнту буде залежати від стану і тяжкості порушення і фізичного стану пацієнту. Значне покращення будь-якого симптому або параметру може бути визначено фахівцем в даній галузі або зазначено пацієнтом лікарю. Необхідно розуміти, що будь-яке клінічно або статистично значуще ослаблення або покращення будьякого симптому або параметру порушень нижніх сечовивідних шляхів знаходитися в об‘ємі даного винаходу. Клінічно значуще ослаблення або покращення означає відчутний для пацієнта та/або для лікаря. Наприклад, окремий пацієнт може страждати від декількох симптомів дисурії одночасно, таких як, наприклад, невідкладність і надмірна частота сечовипускання або їх обох, і вони можуть бути зменшені із застосуванням способу за даним винаходом. У випадку нетримання сечі будь-яке зменшення у частоті або об‘ємі небажаного сечовипускання розглядається як позитивний ефект даного способу лікування. Кількість агенту для введення може бути в діапазоні від близько 0,01 до близько 25 мг/кг/день, переважно від близько 0,1 до близько 10 мг/кг/день і найбільш переважно від 0,2 до близько 5 мг/кг/день. Треба розуміти, що фармацевтичні склади за даним винаходом не обов‘язково повинні містити повну кількість агенту, що є ефективною в лікуванні порушення, так як ефективні кількості можуть бути досягнуті введенням багатьох доз таких фармацевтичних складів. В переважному варіанті здійснення даного винаходу сполуки I сформульовані в капсулах або таблетках, переважно, що містять від 10 до 200 мг сполук за винаходом, і переважно вводяться пацієнту в загальній щоденній дозі від 10 до 300 мг, переважно від 20 до 150 мг і найбільш переважно близько 50 мг, для полегшення нетримання сечі та інших дисфункцій. Фармацевтична композиція для парентерального введення містить від близько 0,01% до близько 100% за вагою активних агентів за даним винаходом, беручи за основу 100% ваги загальної фармацевтичної композиції. В цілому, трансдермальні лікарські форми містять від близько 0,01% до близько 100% за вагою активних агентів проти 100% загальної ваги лікарської форми. Для лікування порушень нижніх сечовивідних шляхів сполукаI може вводитися в комбінації із, щонайменше, однією сполукою додаткового класу терапевтичних агентів. Такий додатковий клас може бути антимускариновими лікарськими засобами, такими як, без обмеження, оксибутинін, толтеродин, дарифенацин, соліфенацин, троспіум, фезотеродин і теміверин. Комбінована терапія із, щонайменше, однією сполукою I може також включати лікування неселективним інгібітором циклооксигенази (ЦОГ). Приклади ЦОГ інгібіторів включають, без обмежень, ібупрофен, напроксен, беноксапрофен, флурбіпрофен, фенопрофен, фенбуфен, кетопрофен, індопрофен, пірпрофен, карпрофен, тіоксапрофен, супрофен, тіапрофенову кислоту, флупрофен, індометацин, суліндак, толметин, зомепірак, диклофенак, фенклофенак, ібуфенак, ацетилсаліцилову кислоту, піроксикам, теноксикам, набуметон, кеторолак, азапропазон, мефенамову кислоту, толфенамову кислоту, дифлунізал, ацеметацин, фентіазак, кліданак, меклофенамову кислоту, флуфенамову кислоту, ніфлумову кислоту, флуфенізал, судоксикам, етодолак, саліцилову кислоту, бенорилат, ізоксикам, 4-(нітроокси)бутиловий ефір 2фтор-α-метил[1,1’-біфеніл]-4-оцтової кислоти (дивись Wenk et al. Europ. J. Pharmacol. 453, 319324 (2002)), мелоксикам, парекоксиб, німесулід. Комбінована терапія із, щонайменше, однією сполукою I може також включати лікування альфа1-адренергічним антагоністом. Переважні альфа1- адренергічні антагоністи, прийнятні для введення в комбінації з mGlu5 антагоністами являють собою, наприклад, і без обмеження, празозин, доксазозин, теразозин, алфузозин, силодозин і тамсулозин. Додаткові альфа1адренергічні антагоністи, прийнятні для введення в комбінації з mGlu5 антагоністами, описані в Патентах США 5990114, 6306861, 6365591, 6387909 і 6403594. Комбінована терапія із, щонайменше, однією сполукою I може також включати лікування інгібітором зворотного захвату серотоніну та/або норадреналіну. Приклади інгібіторів зворотного захвату серотоніну та/або норадреналіну включають, без обмеження, дулоксетин, мілнаципран, амоксапін, венлафаксин дес-венлафаксин, сибутрамін, тезофензин і десметилсибутрамін. В певних варіантах здійснення винаходу, інгібітор зворотного захвату серотоніну та/або норадреналіну, прийнятний для введення в комбінації з mGlu5 антагоністами, є селективним інгібітором зворотного захвату серотоніну (а саме, SSRI, або СІЗС). В певних варіантах здійснення винаходу, інгібітор зворотного захвату серотоніну та/або норадреналіну, прийнятний 15 UA 104128 C2 5 10 15 20 25 30 для введення в комбінації з mGlu5 антагоністами, є селективним інгібітором зворотного захвату норадреналіну (а саме, NARI, або СІЗН). Фармацевтична композиція або дозована лікарська форма може вводитися в якості окремої щоденної дози, або загальна щоденна доза може вводитися в розділених дозах. Крім того, може бути необхідним сумісне введення або послідовне введення іншої сполуки для лікування порушення. Для цього комбіновані активні діючі речовини формулюють в простій одиниці дозування. Для комбінованого лікування, коли сполуки знаходяться в окремих дозованих складах, сполуки можуть вводитися одночасно, або кожна може вводитися із поступовими інтервалами. Наприклад, сполука за винаходом може вводитися вранці, а антимускаринова сполука може вводитися ввечері, або навпаки. Додаткові сполуки можуть також вводитися зі специфічними інтервалами. Порядок введення буде залежати від багатьох факторів, включаючи вік, вагу, стать і медичний стан пацієнту; тяжкість та етіологію порушення, що підлягає лікуванню, шлях введення, функцію нирок та печінки пацієнту, історію хвороби пацієнту і чутливість пацієнту до лікарських засобів. Визначення порядку введення може бути відкореговано, і така корекція є рутинною процедурою у світлі наданих рекомендацій. Синтез сполук за винаходом Фахівцям в даній галузі зрозуміло, що може бути бажаним використання захищених похідних проміжних сполук, що використовуються для отримання сполук I. Утворення і видалення захисних груп з функціональних груп може виконуватися способами, відомими з рівня техніки (наприклад, наприклад, Green and Wuts Protective Groups in Organic Synthesis. John Wiley and Sons, New York, 1999.). Гідрокси або аміно групи можуть захищатися будь-якою гідрокси або аміно захисною групою. Аміно-захисні групи можуть бути видалені прийнятними методиками. Наприклад, ацильні групи, такі як алканоїльні, алкоксикарбонільні і ароїльні групи, можуть видалятися шляхом сольволізу, гідролізу в кислотних або основних умовах. Арилметоксикарбонільні групи (наприклад, бензилоксикарбоніл) можуть відщеплятися гідрогенолізом в присутності каталізатору, такого як паладій-на-активованому вугіллі. Синтез необхідних сполук завершується шляхом видалення будь-яких захисних груп, що можуть бути присутніми в передостанніх проміжних сполуках з використанням стандартних методик, що є добре відомими для фахівців в даній галузі. Кінцеві продукти без захисних груп потім очищують при необхідності за допомогою стандартних методик, таких як хроматографія на силікагелі, ВЕРХ на силікагелі і подібне, або шляхом рекристалізації. Сполуки за винаходом, де R1 є H звичайно отримують відповідно до наступних схем: Схема 1 35 16 UA 104128 C2 5 10 15 20 25 На Схемі 1, Ak являє собою алкільну групу, L являє собою групу, що відходить, а ті змінні, що залишилася, є такими, як визначено для загальної формули I. 3-бром-1-триметилсиліл-1-пропін (1) додають при температурі від -10 °C до 25 °C до розчину попередньо отриманого фосфаніону, утвореного in situ з відповідного діалкіл фосфіту (наприклад, діетил фосфіт), обробленого основою, переважно біс-триметилсиліламідом натрію або літію, в апротонному розчиннику, переважно тетрагідрофурані (ТГФ, або ТГФ) або диметилетаноламіні (ДМЕ, або ДМЕ) при температурі від -50 °C до 0 °C. Ця процедура дає на виході сполуку 2 (дивись також Gibson, A. W.; Humphrey, G. R.; Kennedy, D. J.; Wright, S. H. B.; Synthesis 1991 (5), 414). Сполука 2 потім перетворюється у відповідний стабілізований ілід шляхом реакції із основою, переважно біс-триметилсиліламідом натрію або літію (LiHMDS), в апротонному розчиннику, переважно ТГФ або ДМЕ при температурі від -78 °C і 0 °C. Цей ілід потім реагує з піперидонами 3 в тому ж реакційному апараті при -60 - 0 °C, даючи на виході сполуки 4 (Gibson, A. W.; Humphrey, G. R.; Kennedy, D. J.; Wright, S. H. B.; Synthesis 1991 (5), 414 або Boehmer, J.; Schobert, R.; J Chem Res, Synop, 1998, (7), 372-373). Ацетилeнові сполуки 4 можуть бути альтернативно отримані шляхом реакції піперидонів 3 з ілідом, отриманим від (3-триметилсиліл-2-пропініл)-трифенілфосфоніум бромідом і наприклад, BuLi, в ТГФ (Hann, M. M.; Sammes, P. G.; Kennewell, P. D.; Taylor, J. B.; J Chem Soc, Perkin Trans 1, 1982, 307 або Nicolaou, K. C.; Webber, S. E.; J Am Chem Soc 1984, 106, 5734) і проводячи реакцію у такий же спосіб, як описано вище. Інша прийнятна процедура включає використання (3-2-пропініл)трифеніларсонію броміду (Shen, Yanchang; Liao, Quimu; J. Organomet. Chem.; 346; 1988; 181-184) і утворення арсенієвого іліду з BuLi або іншою прийнятною основою і реакцією із піперидонами 3. Силільна захисна група 4 потім видаляється фторидом тетрабутиламонію в ТГФ при температурі в діапазоні від навколишньої температури до дефлегмації або шляхом гідролізу із основою (K2CO3 або KOH в MeOH) або іншим прийнятним способом, вибраним з тих, що 17 UA 104128 C2 rd 5 10 15 20 25 30 наведені в Greene-Wuts (Greene’s Protective Groups in Organic Synthesis, 3 Edition, Peter G. M. Wuts, Theodora W. Greene 1999, Wiley Interscience page 654-659) і є добре відомими для фахівців у даній галузі. Отримані у такий спосіб ацетилeнові сполуки 5 потім трансформують в сполуки I шляхом їхньої реакції з R2-L відповідно до добре відомої процедури Соногашири (Science of Synthesis, H. Heaney і S. Christie, October 2003, Vol. 3, Page 402 і наступне), що використовує йодид міді і комплекс паладію, вибраний з (Ph 3P)2PdCl2, (Ph3P)2Pd(OAc)2, (Ph3P)4Pd (який також можу бути утвореним in situ, наприклад, з трифенілфосфіну і Pd(OAc) 2) і всіх інших комплексі паладію, процитованих в літературі та використаних для таких типів реакцій, в присутності основи, такої як TEA, ДЕА (діетаноламін), ДІПЕА (діізопропілетиламін), TMA (триметиамін), бутиламін, піперидин. Розчинники є вибраними з ТГФ, ДМЕ, ДМФ (диметилформамід), ДМА (диметиалацетамід), етилацетат (EtOAc), ДМСО (диметилсульфоксид), толуол та інші, прийнятні для цілей реакції; або та ж сама основа у надлишку може використовуватися в якості розчинника. Якщо реакцію проводять в ДМФ або ДМЕ, виділення сполук 5 можна уникнути додаванням фториду тетрабутиламонію або хлориду тетрабутиламонію безпосередьо до реакційного середовища, що містить 4, до поєднання (Sorensen, U.S., Pombo-Villar, E. Тетраhedron 2005, 61, 2697-2703). R2 замісники вводять, використовуючи арильні або гетероарильні галіди (переважно в порядку зменшення йодид, бромід, хлорид), арильні або гетероарильні трифталати, алкільні галогенiди або ацильні хлориди, ароїльні хлориди, гетероароїльні хлориди. Трифталати синтезують з використанням способу, добре відомого фахівцям в даній галузі, наприклад, з фенолів або гідроксиарилів (гетероарилів), використовуючи трифторметансульфоновий ангідрит в хлорованому розчиннику або використовуючи N-фенілтрифлімід в толуолі або хлорованому розчиннику в присутності або відсутності основи (наприклад TEA). Обидва процеси можуть прискорюватися за допомогою мікрохвиль, проводячи реакцію в мікрохвильовій печі. Інші прийнятні групи, що уходять L для R2-L являють собою нонафлати, тозилати і трифторборати калію. Піперидони 3 є комерційно наявними або їх можна легко отримати з піперидонів, із вільною кетогрупою або захищеною, як кеталь, відповідно до простих процедур ацилювання, (тіо)карбамоїлювання, відновлювального амінування, алкілування, арилування на основному азоті, що є добре відомими для фахівців в даній галузі і добре відображені в літературі. Схема 2 18 UA 104128 C2 5 10 15 20 25 Схема 2 є практично і можливо альтернативною Схемі 1 для отримання сполуки I із R 1 = H. На Схемі 2, Ak являє собою алкільну групу, ЗГ являє собою захисну групу і змінні, що залишилися, є такими як визначено для загальної формули I. Цей шлях синтезу використовує N-захищені піперидони (комерційно наявні або ті, що легко отримати за допомогою стандартних процедур), де ЗГ є прийнятно вибраною захисною групою, такою як t-бутоксикарбоніл (Boc, або Бок), фтоенілметоксикарбоніл (Fmoc), бензил (Bn), бензилоксикарбоніл (Z), тритил (Tr), арилсульфоніл або інша. Захищені піперидони 6 реагують тими ж способами, що описані для сполук 3 для отримання сполук 7, добре розроблених похідних із ортогональним захистом. Так, сполуки 7 можуть бути послідовно перетворені, як описано вище для Схеми 1, на сполуки 8 і 9 і позбавлені захисних груп до 10, відповідно до стандартних процедур відщеплення захисних груп, вибраних з тих, що описані в Greene-Wuts (Greene’s Protective Groups in Organic Synthesis, 3rd Edition, Peter G. M. Wuts, Theodora W. Greene 1999, Wiley Interscience page 654-659). 10 є синтонами для синтезування шляхом простих реакційних процедур сполук I із попередньо визначеним і фіксованим R2 замісником. Альтернативно, сполуки 8 можуть далі бути позбавлені N-захисних груп відомими процедурами для отримання сполук 11, які, навпаки, послідовно N-дериватизують і піддають ацетиленовій CH дериватизації як описано вище для 5 на Схемі 1. Альтернативно, вибіркове видалення захисних N-ЗГ груп 7 веде до отримання сполук 12, які можуть реагувати, як описано вище для забезпечення сполук 4, які здатні до подальшої дериватизації відповідно до схеми 1 для отримання сполук I. Сполуки I за винаходом, де R1 є таким, як описано в загальній формулі I (H також включений) можуть взагалі бути отримані відповідно до наступної схеми 3: Схема 3 19 UA 104128 C2 5 10 15 20 25 На Схемі 3, Q являє собою захисну групу або групу R 3-Y-, Hal являє собою атом галогену і змінні, що залишилися, є такими, як визначено для загальної формули I. Сполуки 14 можуть втримуватися з 13 із використанням стандартних умов олефінування, таких як методики Віттига, Хорнера-Емонсена, Петерсена або методики на основі миш‘яку. Декілька загальних оглядових статей щодо цих методик і напрямків містяться в наступних посиланнях: ’The Wittig reaction and related methods’, N. J. Lawrence in Preparation of Alkenes, J. M. J. Williams, Ed., OxfordUniversity Press, Oxford (1996); pp 19-58; Phosphorus Ylides, O. I. Kolodiazhnyi, Wiley, N.Y. (1999); A. W. Johnson, Ylides and Imines of Phosphorus, Wiley, N.Y. (1993); Ager, D. J. Org. React. 1990, 38, 1-223. Коли реакцію проводять з використанням солі трифенілфосфонію, бутил літію або ЛДА (діізопропіламід літію) або ЛГМДС (гексаметилдисиліламід літію) можуть використовуватися для утворення фосфорного іліду в ТГФ або іншому апротонному розчиннику (наприклад ДМЕ), та ілід реагує з відповідним піперидоном для забезпечення бажаного продукту. Реагенти на основі фосфінату, оксиду фосфіну або фосфонату можуть використовуватися зі схожими основами або з метоксидом або етоксидом натрію або калію в спиртових розчинниках або з гідридом натрію в апротонних розчинниках. Сполуки 14 потім просто перетворюються на сполуки 16, звичайно без виділення проміжних дигалогенпохідних 15, проводячи перше дигалогенування етиленового зв‘язку (Br 2, NCS (тіоціанат), БСІ (N-бромсукцинімід) або іншими реагентами в прийнятному розчиннику, наприклад, AcOH або хлорованому розчиннику) потім шляхом дегідрогалогенування сполук 15 з використанням основи (K2CO3, ДБУ (діазабіциклоундецен), ДМАП (диметиламінопіридин) або подібне). Якщо на 13 поводять реакцію олефінування, як описано вище, з використанням CHBr 3 або CBr4 або CHFBr2 або CFBr3 і трифенілфосфіну (або іншого триарилфосфіну, зв‘язаного або ні з полімерною смолою) в присутності або у відсутності каталізатору, такого як ZnBr 2 або 20 UA 104128 C2 5 10 15 20 25 30 35 діетилцинк, то сполуки 17 легко отримати. Використання CBr 4 веде до отримання 1,1дибромвінілової похідної 17, що може реагувати, в свою чергу, з органометалевими видами, наприклад, бромідом метилмагнію, даючи похідну 16 (R 1 = Алкіл, Феніл) або реагує із сильною органічною основою (наприклад BuLi або NaHMDS (натрієва сіль гексаметилдисилілазиду) або подібне) для утворення карбаніону, який, в свою чергу, реагує із електрофілом (наприклад CH 3I (йодметан)) для отримання 16 (R1 = Алкіл, Феніл). Використання галогенметилфосфорного реагенту (наприклад, хлорметилтрифеніл фосфоніум хлориду або дифенілхлорметилфенілфосфонату) веде, з використанням таких самих методик, що описані вище для реакції Хорнера, безпосередньо до сполук 16, починаючи із Сполук 13. Альтернативна методика, корисна для виконання перетворення 13 на 17 включає використання CH2Br2 або CH2I2 або CH2Cl2 або CHI3 в присутності TiCl4 і Магнію або в присутності титанового комплексу або із CrCl2. Сполуки 16 (або Сполуки 17, де (Hal, Hal являє собою фтор з додаванням йодиду або фтор з додаванням броміду) потім реагують способом Соногашири (дивись вище) для отримання Сполук 18 (I) з R1 = F. Сполуки 18, де Q дорівнює ЗГ (Захисна Група), повинні піддаватися подальшому етапу видалення захисних груп, що веде до Сполук 19, як описано вище на Схемі 2. Сполуки 19 можуть відповідно перетворюватися на Сполуки I з використанням стандартних процедур, описаних вище. Схема 4 На Схемі 4, L являє собою прийнятну групу, що відходить (галоген, мезилат, тозилат або іншу), PR являє собою залишок, що містить фосфор (наприклад, діалкоксифосфорил або дифеноксифосфорил або трифенілфосфорил або трифеніларсиніл), Q являє собою захисну групу або групу R3-Y-, R1 являє собою алкільну або фенільну групу і змінні, що залишилися є такими, як визначено для загальної формули I. Схема 4 описує альтернативну процедуру для отримання сполук 14 із R 1 = алкіл або феніл. В цьому способі сполуки 20 (що є комерційно наявним або такими, що легко отримати за допомогою стандартних процедур, добре відомих для фахівців в даній галузі), реагують відповідно до процедури Арбузова або іншого прийнятного способу для отримання солей фосфонію або фосфонатів або інших проміжних фосфорних сполук, які, в свою чергу, можуть поєднуватися із алкільним альдегідом або бензальдегідом за допомогою процедури ВіттигаХорнера для отримання сполук 14 (R1 = алкіл або феніл). Схема 5 21 UA 104128 C2 5 10 15 20 25 30 Схема 5, в якій ЗГ являє собою захисну групу, Q являє собою захисну групу або групу R 3-Y- і змінні, що залишилися є такими, як визначено для загальної формули I, показує іншу можливість синтезу для отримання сполук 18 (I). Weinreb аміди 22, що легко отримати (L. De Luca, G. Giacomelli, M. Taddei, J. Org. Chem., 2001, 66, 2535-2537) можуть реагувати відповідно до добре відомих способів, із реагентами Григнарда або літієвими реагентами для отримання кетонів 24. У випадку, коли R1=H сполуки 24 є комерційно наявними або такими, що дуже легко синтезувати з комерційно наявних початкових матеріалів. Легке перетворення енольних трифталатів або енольних сульфонатів 25 (R = CF 3SO2, p-MePhSO2) гарантує хороший початковий матеріал для наступного перетворення на сполуки 18 (I) шляхом сполучення Соногашири, описаного вище. Альтернативно сполуки 23 (Corley, E. G. et al., J Org Chem, 69, (15), 2004, 5120-5123) можуть реагувати в поєднаннях, що каталізуються паладієм, із ацильними хлоридами для отримання сполук 24. Сполуки 24 можуть також конденсуватися із ацетиленовими сполуками R2C≡CH за допомогою кислотних методик Льюіса або реакцій альдольного типу з використанням основ для отримання сполук 26 (I), що можуть в свою чергу піддаватися дегідратації для отримання Сполук 18 (I). Сполуки 18 і 26, де Q дорівнює ЗГ (Захисна Група), повинні піддаватися подальшому етапу видалення захисних груп, що веде до сполук, що позбавлені N-захисних груп, як описано вище на Схемі 2. Отримані в такий спосіб сполуки можуть відповідно N-дериватизуватися до Сполук I за допомогою стандартних процедур, описаних вище. Синтез інших сполук за винаходом включається в Приклади, що не були дотепер описані в цьому загальному описі синтезу сполук за винаходом, є добре задокументованим в експериментальній частині даного винаходу. Вільні основи формули I, їхні діастереомери або енантіомери можуть перетворюватися на відповідні фармацевтично прийнятні солі при стандартних умовах, що добре відомі з рівня техніки. Наприклад, вільну основу розчиняють в прийнятному органічному розчиннику, такому як метанол, оброблений, наприклад, одним еквівалентом малеїнової або оксалінової кислоти, одним або двома еквівалентами хлористоводневої кислоти або метансульфонової кислоти, і потім концентрують у вакуумі для забезпечення відповідної фармацевтично прийнятної солі. 22 UA 104128 C2 5 10 15 20 25 30 35 40 45 50 55 60 Залишок потім очищують шляхом рекристалізації із відповідного органічного розчинника або суміші органічних розчинників, таких як метаноловий/діетиловий простий ефір. N-оксиди сполук формули I можуть бути синтезовані шляхом простих окиснювальних процедур, що добре відомі фахівцям в даній галузі. Приклади винаходу Наступні приклади ілюструють винахід. Приклад 1 1-(3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Діетил (3-триметилсилілпроп-2-ініл)фосфонат (Сполука 1a) В розчин LiHMDS (1M в ТГФ, 63,8 мл, 63,8 ммоль) в безводному ТГФ (162 мл) додали по краплях діетил фосфіт (7,4 мл, 63,8 ммоль) при перемішуванні при -10 °C в атмосфері азоту. Отриманий розчин перемішували при такій самій температурі протягом 20 хв. Після чого, 3бром-1-триметилсиліл-1-пропін (10 мл, 63,8 ммоль) додали по краплях і реакційну суміш перемішували при -10 °C протягом 2 год., потім гасили водою і екстрагували з етилацетатом. Комбіновані органічні шари відмивали сольовим розчином, висушували на Na 2SO4 і 1 випаровували до сухого стану у вакуумі для отримання 14,86 г названого продукту. H-ЯМР (ядерно-магнітний резонанс) (CDCl3, δ): відповідно до Feringa, Ben L. et al., Org. Biomol. Chem., Volume 3 (14), 2005, 2524-2533. + MS (мас-спектрометрія): [M+NH4] = 266,15. 1-(3-нітро-2-піридил)-4-(3-триметисиліл-проп-2-ініліден)-піперидин (Сполука 1b) В розчин Сполуки 1a (0,68 г, 2,74 ммоль) в безводному ТГФ (15 мл), перемішаного при – 60 °C в умовах потоку N2, додали по краплях розчин LiHMDS (1M в ТГФ, 2,74 мл, 2,74 ммоль) і суміш перемішували при –60 °C протягом 15 хв. До отриманого розчину додали по краплях розчин 1-(3-нітро-2-піридил)-4-оксо-піперидину (0,55 г, 2,49 ммоль) в безводному ТГФ (12 мл). Реакційну суміш перемішували при –60° протягом 15 хв., потім нагрівали до навколишньої температура протягом 2 год. Після чого її гасили водою і екстрагували з етилацетатом. Комбіновані органічні шари відмивали сольовим розчином, висушували на Na 2SO4 і випаровували до сухого стану у вакуумі для отримання 0,79 г названого продукту. Сирий продукт був достатньо чистим, щоб використовуватися в наступному етапі без будь-якого очищення. + МС: [M+H] = 316,16. 1-(3-нітро-2-піридил)-4-(проп-2-ініліден)-піперидин (Сполука 1c) Розчин Сполуки 1b (0,57 г, 1,81 ммоль), гідрату тетра-n-бутиламонію фториду (0,57 г, 2,03 ммоль) в 38 мл ТГФ перемішували при навколишній температурі протягом 2 год. Реакційну суміш виливали у воду і екстрагували з етилацетатом. Комбіновані органічні шари відмивали сольовим розчином, висушували на Na2SO4 і випаровували до сухого стану у вакуумі для отримання залишку, який очищували за допомогою флеш-хроматографії (етилацетат – петролейний ефір 1 : 9) з отриманням названого продукту (0,21 г). + МС: [M+H] = 244,13. 1-(3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Суміш Сполуки 1c (0,21 г, 0,86 ммоль), 2-бром-6-метилпіридину (0,11 мл, 0,95 ммоль), тетракіс (трифенілфосфін)паладій(0) (70 мг, 0,06 ммоль), CuI (16 мг, 0,09 ммоль) в безводному і дегазованому триетиламіні (10 мл) нагрівали при 80 °C в атмосфері азоту протягом 2 год. в герметичній посудині. Реакційну суміш охолоджували, виливали в воду і екстрагували з етилацетатом. Комбіновані органічні шари відмивали сольовим розчином, висушували на Na2SO4 і випаровували до сухого стану у вакуумі для отримання залишку, який очищували за допомогою флеш-хроматографії (етилацетат – петролейний ефір 3,5 : 6,5), отримуючи названий продукт (0,20 г). 1 H-ЯМР (CDCl3δ): 2,48-2,55 (m, 2H), 2,61 (s, 3H), 2,80-2,85 (m, 2H), 3,50-3,58 (m, 4H), 5,66 (s, 1H), 6,75-6,80 (m, 1H), 7,09 (d, 1H, J = 7,46 Гц), 7,24-7,29 (m, 1H), 7,55 (t, 1H, J = 7,46 Гц), 8,148,19 (m, 1H), 8,35-8,38 (m, 1H). + МС: [M+H] = 335,12. Приклад 2 1-(t-бутоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин 1-(t-бутоксикарбоніл)-4-(3-триметисиліл-проп-2-ініліден)-піперидин (Сполука 2a) Названу сполуку отримували відповідно до процедури, описаної для Сполуки 1b, але з використанням 1-(t-бутоксикарбоніл)-4-оксо-піперидину замість 1-(3-нітро-2-піридил)-4-оксопіперидину. Після звичайної процедури виділення продукту реакції, випаровуванням комбінованих екстрактів етилацетату отримували сирий продукт, який був достатньо чистим, щоб використовувати на наступному етапі без подальшого очищення. 23 UA 104128 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (CDCl3δ): 0,21 (s, 9H), 1,50 (s, 9H), 2,21-2,27 (m, 2H), 2,48-2,53 (m, 2H), 3,40-3,51 (m, 4H), 5,40 (s, 1H). + МС: [M+H] = 294,29. 1-(t-бутоксикарбоніл)-4-(проп-2-ініліден)-піперидин (Сполука 2b) Названу сполуку отримували відповідно до процедури, описаної для Сполуки 1c, але з використанням Сполуки 2a замість Сполуки 1b. Після звичайної процедури виділення продукту реакції, випаровуванням комбінованих екстрактів етилацетату отримували сирий продукт який був достатньо чистим, щоб використовувати на наступному етапі без подальшого очищення. 1 H-ЯМР (CDCl3δ): 1,50 (s, 9H), 2,20-2,27 (m, 2H), 2,48-2,53 (m, 2H), 3,02 (s, 1H), 3,40-3,51 (m, 4H), 5,48 (s, 1H). + МС: [M+H] = 222,23. 1-(t-бутоксикарбоніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Названу сполуку отримували відповідно до процедури, описаної для Сполуки Прикладу 1, починаючи зі Сполуки 2b замість Сполуки 1c. Після звичайної процедури виділення продукту реакції, випаровуванням комбінованих екстрактів етилацетату отримували сирий продукт, який очищували за допомогою флеш-хроматографії (етилацетат – петролейний ефір 3,5 : 6,5), отримуючи названий продукт. 1 H-ЯМР (CDCl3δ): 1,50 (s, 9H), 2,29-2,35 (m, 2H), 2,58 (s, 3H), 2,59-2,65 (m, 2H), 3,45-3,55 (m, 4H), 5,60 (s, 1H), 7,09 (d, 1H, J = 7,51 Гц), 7,26(d, 1H, 7,51 Гц), 7,55 (t, 1H, J = 7,51 Гц). + МС: [M+H] = 313,27. Приклад 3 4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин До розчину Сполуки Прикладу 2 (17 г, 54,4 ммоль) в CHCl 3 (840 мл) додали трифтороцтову кислоту (60 мл, 779 ммоль) і реакційну суміш потім перемішували при 70 °C протягом 15 хв., доки повне перетворення реагенту не буде спостерігатися за допомогою МС-РХ (масспектрометр для рідинної хроматографії, або LC-MS). Після охолодження до навколишньої температури, додавали воду з додаванням водного NaOH (2N), щоб зробити лужний pH. Виділенням органічного шару і екстракцією водного шару за допомогою CH 2Cl2, відмиванням в сольовому розчині і висушуванням на Na2SO4 отримали названу сполуку (11,6 г). 1 H-ЯМР (CDCl3δ): 2,29-2,35 (m, 2H), 2,58 (s, 3H), 2,59-2,65 (m, 2H), 2,91-2,99 (m, 4H), 5,52 (s, 1H), 7,07 (d, 1H, J = 7,54 Гц), 7,24(d, 2H, 7,54 Гц), 7,53 (t, 1H, J = 7,54 Гц). + МС: [M+H] = 213,25. Приклад 4 1-(2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Добре гомогенізовану суміш Сполуки Прикладу 3 (20 мг, 0,09 ммоль) і 1-бром-2нітробензену (22,8 мг, 0,11 ммоль) перемішували при 90 °C протягом 0,5 год., потім при 110 °C протягом 1 год. Сирий продукт реакції очищували за допомогою флеш-хроматографії (градієнт етилацетат – петролейний ефір складав від 3 : 7 до 4 : 6), отримуючи названий продукт (8,3 мг). 1 H-ЯМР (CDCl3δ): 2,50-2,55 (m, 2H), 2,61 (s, 3H), 2,82-2,87 (m, 2H), 3,11-3,16 (m, 2H), 3,163,21 (m, 2H), 5,62 (s, 1H), 7,03-7,16 (m, 2H), 7,19 (d, 1H, J = 7,51 Гц), 7,26-7,30 (m, 1H), 7,48 (t, 1H, J = 7,51 Гц), 7,52-7,64 (m, 1H), 7,81 (d, 1H). + МС: [M+H] = 334,30. Приклад 5 1-(6-метил-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Добре гомогенізовану суміш Сполуки Прикладу 3 (23 мг, 0,11 ммоль) і 2-хлор-6-метил-3нітропіридину (26,2 мг, 0,15 ммоль) перемішували при 120 °C протягом 0,5 год. Сирий продукт реакції очищували за допомогою флеш-хроматографії (градієнт етилацетат – петролейний ефір складав від 3 : 7 до 4 : 6), отримуючи названий продукт (21 мг). 1 H-ЯМР (CDCl3δ): 2,48 (s, 3H), 2,49-2,53 (m, 2H), 2,67 (s, 3H), 2,81-2,86 (m, 2H), 3,49-3,55 (m, 2H), 3,56-3,60 (m, 2H), 5,66 (s, 1H), 6,61 (d, 1H, J=8,2Гц), 7,13-7,18 (m, 1H), 7,29-7,35 (m, 1H), 7,60-7,70 (m, 1H), 8,09 (d,1H, J = 8,2Гц). + МС: [M+H] = 349,41. Приклад 6 1-(6-метокси-3-нітро-2-піридил)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Добре гомогенізовану суміш Сполуки Прикладу 3 (23 мг, 0,11 ммоль) і 2-хлор-5-метокси-3нітропіридину (24,4 мг, 0,13 ммоль) перемішували при 120 °C протягом 0,5 год. Сирий продукт реакції очищували за допомогою флеш-хроматографії (градієнт етилацетат – петролейний ефір складав від 2 : 8 до 3 : 7), отримуючи названий продукт (24 мг). 24 UA 104128 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (CDCl3δ): 2,50-2,55 (m, 2H), 2,66 (s, 3H), 2,85-2,90 (m, 2H), 3,50-3,55 (m, 2H), 3,603,65 (m, 2H), 3,97 (s, 3H), 5,68 (s, 1H), 6,17 (d, 1H, J=8,76Гц), 7,13-7,18 (m, 1H), 7,29-7,35 (m, 1H), 7,60-7,70 (m, 1H), 8,25 (d, 1H, J=8,76Гц). + МС: [M+H] = 365,36. Приклад 7 1-(5-метил-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Добре гомогенізовану суміш Сполуки Прикладу 3 (19 мг, 0,89 ммоль) і 3-фтор-4нітротолуолу (20,2 мг, 0,13 ммоль) перемішували при 120 °C протягом 0,5 год. Сирий продукт реакції очищували за допомогою флеш-хроматографії (градієнт етилацетат – петролейний ефір складав від 2 : 8 до 3 : 7), отримуючи названий продукт (18 мг). 1 H-ЯМР (CDCl3δ): 2,40 (s, 3H), 2,52-2,57 (m, 2H), 2,68 (s, 3H), 2,85-2,92 (m, 2H), 3,10-3,15 (m, 2H), 3,17-3,22 (m, 2H), 5,64 (s, 1H), 6,85 (d, 1H, J=8,19Гц), 6,93 (s, 1H), 7,13-7,20 (m, 1H), 7,307,37 (m, 1H), 7,60-7,72 (m, 1H), 7,78 (d,1H, J=8,19Гц). + МС: [M+H] = 348,36. Приклад 8 1-(5-метокси-2-нітрофеніл)-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Добре гомогенізовану суміш Сполуки Прикладу 3 (20 мг, 0,93 ммоль) і 2-фтор-4метоксинітробензену (21,3 мг, 0,12 ммоль) перемішували при 120 °C протягом 0,5 год. Сирий продукт реакції очищували за допомогою флеш-хроматографії (етилацетат – петролейний ефір 1 : 1), отримуючи названий продукт (21 мг). 1 H-ЯМР (CDCl3δ): 2,55-2,62 (m, 2H), 2,80 (s, 3H), 2,93-3,02 (m, 2H), 3,10-3,18 (m, 2H), 3,223,28 (m, 2H), 3,88 (s, 3H), 5,66 (s, 1H), 6,51-6,59 (m, 2H), 7,19-7,31 (m, 1H), 7,36-7,46 (m, 1H), 7,737,87 (m, 1H), 8,05 (d,1H). + МС: [M+H] = 364,31. Приклад 9 1-(3-нітро-2-піридил)-4-[3-(2-піридил)-проп-2-ініліден]-піперидин Названу сполуку отримували, як описано для Сполуки Прикладу 1, проводячи реакцію Сполуки 1c з 2-йодпіридином замість 2-бром-6-метилпіридину. Сирий продукт очищували за допомогою флеш-хроматографії (етилацетат – петролейний ефір 1 : 1), отримуючи названу сполуку. 1 H-ЯМР (CDCl3δ): 2,50-2,55 (m, 2H), 2,80-2,85(m, 2H), 3,50-3,60 (m, 4H), 5,68 (s, 1H), 6,78 (dd, 1H, J=4,6 і 7,8Гц), 7,27-7,32 (m, 1H), 7,48 (d, 1H, J=7,84Гц), 7,81 (t, 1H, J = 4,2 Гц), 8,16 (dd, 1H, J= 7,8 Гц і 1,7Гц), 8,36 (dd, 1H, J=1,7 Гц і 4,2 Гц), 8,60-8,65 (m, 1H). + МС: [M+H] = 321,10. Приклад 10 1-(3-нітро-2-піридил)-4-(3-феніл-проп-2-ініліден)-піперидин Названу сполуку отримували, як описано для Сполуки Прикладу 1, проводячи реакцію Сполуки 1c з йодбензеном замість 2-бром-6-метилпіридину. Очищення за допомогою флешхроматографії із сумішшю петролейний ефір - етилацетат 65:35 давало названий продукт. 1 H-ЯМР (CDCl3δ): 2,50-2,55 (m, 2H), 2,76-2,81(m, 2H), 3,52-3,60 (m, 4H), 5,65 (s, 1H), 6,80 (dd, 1H, J=4,6 і 7,8Гц), 7,30-7,36 (m, 3H), 7,43-7,47 (m, 2H), 8,19 (d, 1H, J= 7,8 Гц), 8,38 (d, 1H, J=4,2 Гц). + МС: [M+H] = 320,24. Приклад 11 1-(3-нітро-2-піридил)-4-[3-(3-піридил)-проп-2-ініліден]-піперидин Названу сполуку отримували, як описано для Сполуки Прикладу 1, проводячи реакцію Сполуки 1c з 3-йодпіридином замість 2-бром-6-метилпіридину. Очищення за допомогою флешхроматографії із сумішшю петролейний ефір – етилацетат 6 : 4 давало Сполуку Прикладу 11. 1 H-ЯМР (CDCl3δ): 2,52-2,57 (m, 2H), 2,74-2,79(m, 2H), 3,50-3,60 (m, 4H), 5,67 (s, 1H), 6,82 (dd, 1H, J=4,4 і 7,8Гц), 7,66-7,74 (m, 1H), 8,13-8,21 (m, 2H), 8,38 (dd, 1H), 8,58-8,63 (m, 1H), 8,72-8,77 (m, 1H). + МС: [M+H] = 321,30. Приклад 12 1-фенілкарбамоїл-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин До розчину Сполуки Прикладу 3 (0,11 г, 0,52 ммоль) в CH2Cl2 (10 мл) додали фенілiзоціанат (0,06 мл, 0,54 ммоль) і реакційну суміш перемішували протягом ночі при навколишній температурі. Випаровування і очищення сирого продукту за допомогою автоматизованої TM рідинної флеш-хроматографії (Horizon – Biotage), елюючи градієнтом петролейний ефір – етилацетат від 87 : 13 до 0 : 100 дають названий продукт (154 мг). 25 UA 104128 C2 1 5 10 H-ЯМР (CDCl3δ): 2,41-2,46 (m, 2H), 2,64 (m, 3H), 2,74-2,79 (m, 2H), 3,57-3,62 (m, 4H), 5,65 (s, 1H), 6,58 (s, 1H), 7,05 (t, 1H, J = 7,52 Гц), 7,14 (d, 1H, J = 7,88 Гц), 7,28-7,34 (m, 3H), 7,38-7,42 (m, 2H), 7,63 (t, 1H, J = 7,88 Гц). + МС: [M+H] = 332,4. Приклади від 13 до 26 (Таблиця I). Ці сполуки синтезували відповідно до процедури, описаної в Прикладі 12, заміщаючи реагент B (дивись Таблицю I нижче) на фенілізоціанат. Очищення провели за допомогою TM автоматизованої рідинної флеш-хроматографії (Horizon – Biotage), елюючи градієнтом петролейний ефір – етилацетат від 100:0 до 20:80. Сполуки Прикладу 17 і 18 далі очищували за допомогою препаративної хроматографії на ПР (препаративний) МС-РХ, з використанням MSC18 XTerra колонки 30x50 мМ, елюючи градієнтом бікарбонат амонію 20 мМ рН 8 - ацетонітрил. 26 UA 104128 C2 27 UA 104128 C2 5 10 Приклад 27 1-бензил-4-[3-(6-метил-2-піридил)-проп-2-ініліден]-піперидин Суміш Сполуки Прикладу 3 (0,22 г, 1,04 ммоль), бензальдегіду (0,13 мл, 1,25 ммоль), тріацетоксиборогідриту натрію (0,33 г, 1,56 ммоль) і 15 мл CH 2Cl2 перемішували протягом ночі при навколишній температурі. Після чого розвели водою, виділили органічний шар, відмили сольовим розчином (2 x 15 мл), висушили (Na2SO4) і випарували до сухого стану у вакуумі, отримуючи сирий продукт, який очищували за допомогою автоматизованої рідинної флешTM хроматографії (Horizon – Biotage), елюючи градієнтом петролейний ефір – етилацетат від 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel heterocyclic compounds as mglu5 antagonists
Автори англійськоюLeonardi Amedeo, Motta, Gianni, Riva, Carlo, Poggesi, Elena, Graziani, Davide, Longhi, Matteo Marco
Автори російськоюЛеонарде Амедео, Мотта Джианни
МПК / Мітки
МПК: A61K 31/4545, C07D 413/14, C07D 417/14, C07D 471/04, C07D 409/14, C07D 401/14, C07D 513/04, A61P 13/02, C07D 401/06, C07D 401/04, C07D 211/70, C07D 407/14, C07D 417/06
Мітки: mglu5, гетероциклічні, сполуки, антагоністи
Код посилання
<a href="https://ua.patents.su/92-104128-geterociklichni-spoluki-yak-antagonisti-mglu5.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні сполуки як антагоністи mglu5</a>
Попередній патент: Модулюючі сиртуїн сполуки імідазотіазолу
Наступний патент: Зменшення супутніх інфекцій у свиней за допомогою антигену pcv2
Випадковий патент: Шестеренна реверсивна гідромашина