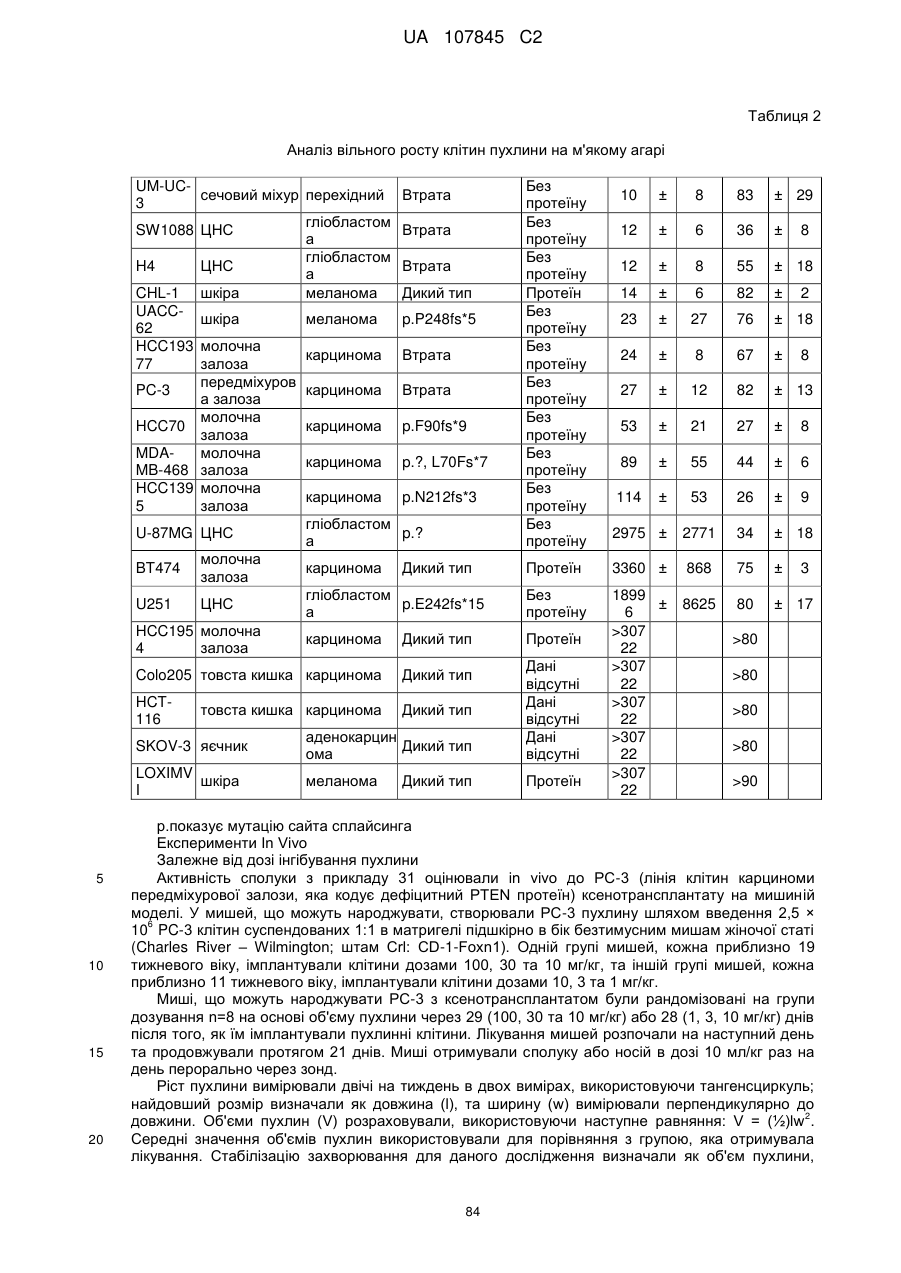
Похідні бензімідазолу як інгібітори pi3-кінази
Номер патенту: 107845
Опубліковано: 25.02.2015
Автори: Тедеско Розанна, Санчез Роберт, Ріверо Ральф, Цюй Дзюнья
Формула / Реферат
1. Сполука формули (І):
 , (I)
, (I)
де
R1 вибрано з Н, С1-6алкілу, алкокси, гідрокси, галогену, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra, -СО2Н, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома С1-3алкільними групами;
R2 вибрано з Н, -NHRa, алкокси, галогену, -CF3, -CHF2 або С1-6алкілу;
R3 вибрано з арилу або гетероарилу, де згаданий арил або гетероарил може бути заміщеним від одного до трьох Rc;
R4 вибрано з Н або Ra;
кожен R5 незалежно вибрано з С1-6алкілу;
кожен Ra незалежно вибрано з С1-3алкілу;
Rb вибрано з Н, С1-3алкілу або SO2Me;
кожен Rc незалежно вибрано з С1-3алкілу, галогену, -CF3 або гідрокси;
n є 0-2,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, що відповідає формулі (І)(С)
 , (I)(C)
, (I)(C)
де
кожен з R6, R7 та R8 незалежно вибрано з С1-3алкілу, галогену, -CF3 або гідроксилу, або R6 та R7 об'єднані з утворенням біциклічного арилу або гетероарилу, або R7 та R8 об'єднані з утворенням біциклічного арилу або гетероарилу.
3. Сполука, вибрана з групи, що складається з:
2-(1-метилетил)-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-олу,
2-етил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-олу,
1-[(2,3-дихлорфеніл)метил]-2-(1-метилетил)-6-(4-морфолініл)-1Н-бензімідазол-4-олу,
1-[(2,3-дихлорфеніл)метил]-4-флуор-2-метил-6-(4-морфолініл)-1Н-бензімідазолу,
1-[(2,3-дихлорфеніл)метил]-2-етил-6-(4-морфолініл)-1Н-бензімідазол-4-олу,
4-флуор-2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазолу,
2-етил-4-флуор-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазолу,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2,3-дихлорфеніл)метил]-2-етил-4-флуор-6-(4-морфолініл)-1Н-бензімідазолу,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1Н-піразол-5-іл)-1Н-бензімідазолу,
1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-4-(1Н-піразол-5-іл)-1Н-бензімідазолу,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1Н-1,2,4-триазол-3-іл)-1Н-бензімідазолу,
метил 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбоксилату,
1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбоксаміду,
метил 1-[(2-флуор-3-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбоксилату,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбонітрилу,
1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонітрилу,
метил 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбоксилату,
2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2-флуор-3-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбоксаміду,
1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-4-(1Н-1,2,4-триазол-3-іл)-1Н-бензімідазолу,
метил 2-метил-6-(4-морфолініл)-1-(5-хінолінілметил)-1Н-бензімідазол-4-карбоксилату,
2-метил-6-(4-морфолініл)-1-(5-хінолінілметил)-1Н-бензімідазол-4-карбонової кислоти,
1-[(3,4-диметилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2-метил-6-(4-морфолініл)-1-(2-нафталінілметил)-1Н-бензімідазол-4-карбонової кислоти,
1-[(3,4-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1Н-1,2,4-триазол-3-іл)-1Н-бензімідазолу,
2-метил-4-(3-метил-1Н-1,2,4-триазол-5-іл)-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазолу,
1-[2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-іл]етанону,
[2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-іл]метанолу,
2-метил-N-(метилсульфоніл)-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбоксаміду,
метил 5-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-7-карбоксилату,
метил 1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбоксилату,
1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбонової кислоти,
6-(4-морфолініл)-1-(1-нафталінілметил)-2-(трифлуорметил)-1Н-бензімідазол-4-карбонової кислоти,
метил 1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбоксилату,
1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбонової кислоти,
1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбоксаміду,
метил 6-(4-морфолініл)-1-(1-нафталінілметил)-2-(трифлуорметил)-1Н-бензімідазол-4-карбоксилату,
метил 1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбоксилату,
1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1Н-1,2,4-триазол-3-іл)-2-(трифлуорметил)-1Н-бензімідазолу,
1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-4-(1Н-1,2,4-триазол-3-іл)-2-(трифлуорметил)-1Н-бензімідазолу,
1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-4-(1Н-1,2,4-триазол-3-іл)-2-трифлуорметил)-1H-бензімідазолу,
2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1Н-тетразол-5-іл)-1Н-бензімідазолу,
[2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-іл]метанолу,
1-[(3-хлор-2-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2-метил-1-[(2-метилфеніл)метил]-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
етил 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбоксилату,
4-бром-2-метил-6-(4-морфолініл)-1Н-бензімідазолу,
4-бром-2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазолу,
2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1,3-оксазол-2-іл)-1Н-бензімідазолу,
метил 2-хлор-5-(4-морфолініл)-1Н-бензімідазол-7-карбоксилату,
метил 2-хлор-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбоксилату,
2-хлор-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти
метил 2-(дифлуорметил)-5-(4-морфолініл)-1Н-бензімідазол-7-карбоксилату,
2-(дифлуорметил)-6-(4-морфолініл)-1-(1-нафталінілметил)-1Н-бензімідазол-4-карбонової кислоти,
2-(дифлуорметил)-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2,3-дихлорфеніл)метил]-2-(дифлуорметил)-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(3-хлор-2-метилфеніл)метил]-2-(дифлуорметил)-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-(1-бензотієн-7-ілметил)-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(2,3-диметилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
1-[(3-флуор-2-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2,4-диметил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазолу,
1-[1-(3-хлор-2-метилфеніл)етил]-2-метил-6-(4-морфолініл)-1Н-бензімідазол-4-карбонової кислоти,
2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1,3-тіазол-2-іл)-1Н-бензімідазолу,
4-(2-фураніл)-2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазолу та
2-метил-4-[(метилокси)метил]-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Н-бензімідазолу,
або її фармацевтично прийнятної солі.
4. Сполука формули
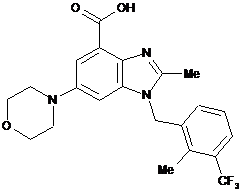
або її фармацевтично прийнятна сіль.
5. Фармацевтична композиція, що містить сполуку за п. 4 та фармацевтично прийнятний носій.
6. Сполука формули
 .
.
7. Фармацевтична композиція, що містить сполуку за п. 6 та фармацевтично прийнятний носій.
8. Фармацевтично прийнятна сіль сполуки формули
 .
.
9. Фармацевтична композиція, що містить сполуку за п. 8 та фармацевтично прийнятний носій.
10. Тріс сіль сполуки формули
 .
.
11. Фармацевтична композиція, що містить сполуку за п. 10 та фармацевтично прийнятний носій.
12. Спосіб лікування чутливого новоутворення у ссавців, за необхідністю такого лікування, за яким ссавцю вводять терапевтично ефективну кількість сполуки за будь-яким з пп. 1-11.
13. Спосіб за п. 12, де згадане чутливе новоутворення є PTEN-дефіцитним новоутворенням, вибраним з мозку (гліом), гліобластом, лейкемій, синдрому Баньяна-Зонана, захворювання Каудена, захворювання Лермітта-Дюкло, раку молочної залози, запального раку молочної залози, раку товстої та прямої кишок, пухлини Вільма, саркоми Юінга, рабдоміосаркоми, епендіоми, гранулобластоми, раку товстої кишки, раку голови та шиї, раку нирки, раку легені, раку печінки, меланоми, плоскоклітинної карциноми, раку яєчників, раку підшлункової залози, раку передміхурової залози, саркоми, раку, остеогенної саркоми, гігантоклітинної мієлогенної пухлини, раку щитовидної залози, лімфобластомних Т-клітин, лейкемії, хронічної мієлоїдної лейкемії, хронічної лімфоцитарної лейкемії, волосатоклітинного лейкозу, гострої лімфобластної лейкемії, гострої мієлогенної лейкемії, хронічної нейтрофільної лейкемії, гострої лімфобластної Т-клітинної лейкемії, плазмацитоми, імунобластної великоклітинної лейкемії, лейкемії клітин мантії, множинної мієломи, мегакаріобластної лейкемії, множинної мієломи, гострої мегакаріоцитарної лейкемії, промієлоцитарної лейкемії, еритролейкемії, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластної Т-клітинної лімфоми, лімфоми Беркитта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелія, раку вульви, раку шийки матки, раку ендометрію, раку нирки, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоцелюлярного раку, раку шлунку, назофарангеального раку, раку щоки, раку ротової порожнини, GIST (шлунково-кишкової стромальної пухлини) або раку яєчка.
14. Спосіб за п. 13, де згадане PTEN-дефіцитне новоутворення вибрано з гормонорезистентного раку передміхурової залози, не дрібноклітинного раку легені, раку ендометрію, раку шлунку, меланоми, раку голови та шиї, раку молочної залози, включаючи потрійно-негативний рак молочної залози, або гліоми.
15. Спосіб за будь-яким з пп. 12-14, де згаданим ссавцем є людина.
16. Спосіб за п. 14, де згаданий рак передміхурової залози є гормонорезистентним раком передміхурової залози.
17. Сполука за будь-яким з пп. 1-11, яка є придатною для застосування в терапії.
18. Сполука за будь-яким з пп. 1-11, яка є придатною для застосування в лікуванні PTEN-дефіцитного чутливого новоутворення, вибраного з мозку (гліом), гліобластом, лейкемій, синдрому Баньяна-Зонана, захворювання Каудена, захворювання Лермітта-Дюкло, раку молочної залози, запального раку молочної залози, раку товстої та прямої кишок, пухлини Вільма, саркоми Юінга, рабдоміосаркоми, епендіоми, гранулобластоми, раку товстої кишки, раку голови та шиї, раку нирки, раку легені, раку печінки, меланоми, плоскоклітинної карциноми, раку яєчників, раку підшлункової залози, раку передміхурової залози, саркоми, раку, остеогенної саркоми, гігантоклітинної мієлогенної пухлини, раку щитовидної залози, лімфобластомних Т-клітин, лейкемії, хронічної мієлоїдної лейкемії, хронічної лімфоцитарної лейкемії, волосатоклітинного лейкозу, гострої лімфобластної лейкемії, гострої мієлогенної лейкемії, хронічної нейтрофільної лейкемії, гострої лімфобластної Т-клітинної лейкемії, плазмацитоми, імунобластної великоклітинної лейкемії, лейкемії клітин мантії, множинної мієломи, мегакаріобластної лейкемії, множинної мієломи, гострої мегакаріоцитарної лейкемії, промієлоцитарної лейкемії, еритролейкемії, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластної Т-клітинної лімфоми, лімфоми Беркитта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелія, раку вульви, раку шийки матки, раку ендометрію, раку нирки, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоцелюлярного раку, раку шлунку, назофарангеального раку, раку щоки, раку ротової порожнини, GIST (шлунково-кишкової стромальної пухлини) або раку яєчка.
19. Застосування сполуки за будь-яким з пп. 1-11 для одержання лікарського засобу для лікування PTEN-дефіцитного чутливого новоутворення, вибраного з мозку (гліом), гліобластом, лейкемій, синдрому Баньяна-Зонана, захворювання Каудена, захворювання Лермітта-Дюкло, раку молочної залози, запального раку молочної залози, раку товстої та прямої кишок, пухлини Більма, саркоми Юінга, рабдоміосаркоми, епендіоми, гранулобластоми, раку товстої кишки, раку голови та шиї, раку нирки, раку легені, раку печінки, меланоми, плоскоклітинної карциноми, раку яєчників, раку підшлункової залози, раку передміхурової залози, саркоми, раку, остеогенної саркоми, гігантоклітинної мієлогенної пухлини, раку щитовидної залози, лімфобластомних Т-клітин, лейкемії, хронічної мієлоїдної лейкемії, хронічної лімфоцитарної лейкемії, волосатоклітинного лейкозу, гострої лімфобластної лейкемії, гострої мієлогенної лейкемії, хронічної нейтрофільної лейкемії, гострої лімфобластної Т-клітинної лейкемії, плазмацитоми, імунобластної великоклітинної лейкемії, лейкемії клітин мантії, множинної мієломи, мегакаріобластної лейкемії, множинної мієломи, гострої мегакаріоцитарної лейкемії, промієлоцитарної лейкемії, еритролейкемії, злоякісної лімфоми, ходжкінської лімфоми, неходжкінської лімфоми, лімфобластної Т-клітинної лімфоми, лімфоми Беркитта, фолікулярної лімфоми, нейробластоми, раку сечового міхура, раку уротелія, раку вульви, раку шийки матки, раку ендометрію, раку нирки, мезотеліоми, раку стравоходу, раку слинних залоз, гепатоцелюлярного раку, раку шлунку, назофарангеального раку, раку щоки, раку ротової порожнини, GIST (шлунково-кишкової стромальної пухлини) або раку яєчка у ссавців (наприклад, людини), за необхідністю такого лікування.
Текст
Реферат: Даний винахід стосується застосування похідних бензімідазолу для модуляції, а саме інгібування активності або функції родини фосфоїнозитид 3' ОН кіназ (в подальшому РІ3-кіназ), відповідно, РІ3К, РІ3К, РІ3К та/або РІЗК. Відповідно, представлений винахід стосується застосування бензімідазолів в лікуванні одного або більше хворобливих станів, вибраних з: аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, поліорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантату або ушкодження легень. Більш відповідно, представлений винахід стосується РІ3К селективних бензімідазольних сполук для лікування раку. UA 107845 C2 (12) UA 107845 C2 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід стосується застосування похідних бензімідазолу для модуляції, зокрема інгібування активності або функції родини кіназ фосфоінозитиду 3' OH (в подальшому PI3 кінази), відповідно, PI3Kα, PI3Kδ, PI3Kβ, та/або PI3Kγ. Відповідно, представлений винахід стосується застосування бензімідазолів в лікуванні одного або більше станів захворювання, які вибирають з: аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, множинні ураження, захворювання нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантату та ушкодження легень. Більш відповідно, представлений винахід стосується PI3Kβ селективних сполук бензімідазолу для лікування раку. Передумови створення винаходу Шлях фосфоінозитид 3-кінази (PI3K) є з числа найбільш широко активованих при раку у людини та добре відома його важливість в карциногенезі (Samuels Y and Ericson K. Oncogenic PI3K and its role in cancer. Current Opinion in Oncology, 2006; 18: 77-82). Ініціанілізація сигнальної системи починається з фосфорилювання фосфатидилінозитол-4,5-біфосфату (PIP2), щоб отримати фосфатидилінозитол-3,4,5-P3 (PIP3). PIP3 є важливим вторинним месенджером, який мобілізує протеїни, які містять плекстрин-гомологичні домени, до клітинної мембрани, де вони активуються. Найбільш вивченими серед даних протеїнів є AKT, що сприяє виживанню клітини, її росту та проліферації. Родина PI3K складається з 15 протеїнів, які приймають участь в гомології послідовностей з їх доменами кінази, але мають індивідуальні субстратні специфічності та способи регуляції (Vivanco I and Sawyers CL. The phosphatidylinositol 3-kinase-AKT pathway in human cancer. Nature Reviews Cancer, 2002;2:489-501). PI3K класу I є гетеродимерами, що складаються з p110 каталітичної субодиниць, кон'югованою з однією з декількох регуляторних субодиниць, які в сукупності називають як p85, і які найбільш широко вивчені в контексті утворення пухлин. Каталітичні субодиниці PI3K класу 1A містять p110α, p110βта p110δ ізоформи, які зв'язуються з однією з п'яти різних регуляторних субодиниць, кодованих трьома окремими генами. Єдина каталітична ізоформа p110γ класу 1B PI3K взаємодіє з однією або двома зв'язаними регуляторними субодиницями (Crabbe T, Welham MJ, Ward SG, The PI3k inhibitor arsenal: choose your weapon Trends in Biochem Sci, 2007;32:450-456). PI3K класу 1 є в першу чергу відповідальними за фосфорилювання сигнальної молекули критичної PIP2. Зв'язок між шляхом PI3K та раком був підтверджений шляхом дослідження, яке ідентифікувало соматичні мутації в гені PIK3CA, що кодує p110α протеїн. Потім, мутації в PIK3CA ідентифікували в чисельних різновидах раку, включаючи колоректальний, молочної залози, гліобластому яєчників та легені. На відміну від PIK3CA, в β ізоформі були ідентифіковані несоматичні мутації. Однак, при дослідженні гіперекспресії, PI3Kβ ізоформа була включена як необхідна для перетворення, викликаного втратією або інактивацією супресору пухлини PTEN, як in vitro, так і in vivo (Torbett NE, Luna A, Knight ZA, et al., A chemical screen in diverse рак молочної залози cell lines reveals genetic enhancers and suppressors of sensitivity to PI3K isotypeselective inhibition. Biochem J 2008;415:97-110; Zhao JJ, Liu Z, Wang L, Shin E, Loda MF, Roberts TM, The oncogenic properties of mutant p110a and p110b phosphatidylinositol 3-kinases in human mammary epithelial cells. Proc Natl Acad Sci USA 2005; 102: 18443-8). У відповідності з даним висновком, гіперекспресія PIK3CB гена була виявлена в сечовому міхурі, товстій кишці, гліобластомах та лейкеміях та міРНК опосередкованих міРНК обумовлений зниженням p110β в лініях клітин гліобластоми в результаті призводить до пригнічення росту пухлини in vitro та in vivo (Pu P, Kang C, Zhang Z, et al., Downregulation of PIK3CB by siRNA suppresses malignant гліома cell growth in vitro and in vivo. Technolo Cancer Res Treat 2006;5:271-280). Пізніші дані з використанням ShRNA показали, що знижена регуляція p110β, а не p110α, в результаті призвела до інактивації PI3K шляху та подальшої інактивації росту клітин пухлини в PTEN дефіцитних клітинах раку як in vitro, так і in vivo (Wee S, Wiederschain, Maira S-M, Loo A, Miller C, et al., PTEN-deficient cancers depend on PIK3CB. Proc Natl Acad Sci 2008;105:13057-13062). Повідомлялось, що відповідно до ролі PIK3CB сигнальної системи в PTEN нульовій пухлині, p110β є суттєвим для трансформованого фенотипу в PTEN-нульовій моделі раку передміхурової залози (Jia S, Liu Z, Zhang S, Liu P, Zhang L, et al., Essential roles of PI(3)K-p110b in cell growth, metabolism and tumorgenesis. Nature 2008; 10: 1038). Крім того, повідомлялося, що фіброгенез, включаючи системний склероз (SSc), артрит, нефропатію, цироз печінки та деякі ракові захворювання, є пов'язаним з дефіцитом PTEN та відповідні PI3K-Akt гіперекспресією (Parapuram, S.K., et al., Loss of PTEN expression by dermal fibroblasts cuases skin fibrosis. J. of Investigative Dermatology, advance online publication 9 June 2011; doi: 10.1038/jid.2011.156). Взяті разом дані результати демонструють βPI3K p110 як 1 UA 107845 C2 5 перспективний об'єкт дослідження для раку та інших синдромів, пов'язаних з втратією PTEN (Hollander, M. Christine; Blumenthal, Gideon M.; Dennis, Phillip P.; PTEN loss in the continuum of common cancers, rare syndromes and mouse models. Nature Reviews/Cancer 2011; 11: 289-301). Тому бажаним є створення потужного, селективного інгібітору PI3K-β. Короткий опис винаходу Даний винахід стосується нової сполуки формули (I): R1 N N N O R3 R4 (R5)n R2 (I) 10 15 20 25 30 35 40 45 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra, CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома C1-3алкільними групами; R2 вибирають з H, -NHRa, алкокси, галогену, -CF3, -CHF2 або C1-6алкілу; R3 вибирають з арилу або гетероарилу, де згаданий арил або гетероарил може бути заміщеним від одного до трьох Rc; R4 вибирають з H або Ra; кожен R5 незалежно вибирають з C1-6алкілу; кожен Ra незалежно вибирають з C1-3алкілу; Rb вибирають з C1-3алкілу або SO2Me; кожен Rc незалежно вибирають з C1-3алкілу, галогену, -CF3 або гідрокси; n є 0-2, або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування чутливих новоутворень у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається сполука формули (I), (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятна сіль для застосування в терапії. В іншому аспекті передбачається сполука формули (I) (включаючи будь-яку конкретну підвидову формулу, описану в даному документі) або її фармацевтично прийнятну сіль для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. В іншому аспекті представленого винаходу передбачається застосування сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі, у виготовлені лікарського засобу для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. В іншому аспекті представленого винаходу передбачається фармацевтична композиція, що містить сполуку формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятну сіль, для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. Детальний опис винаходу. Даний винахід стосується сполуки формули (I). Відповідно до іншого втілення винахід включає сполуку формули (I)(A), R1 N R2 N N O R4 (R5)n 2 R3 UA 107845 C2 (I)(A), 5 10 15 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra, CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH та гетероарилу, де гетероарил може бути заміщеним одним або двома C1-3алкільними групами, де гетероарил вибирають з групи, яка складається з: піразолілу, триазолілу, тетразолілу, оксазолілу та імідазолілу; R2 вибирають з H, -NHRa, алкокси, галогену, -CF3, -CHF2 або C1-6алкілу; R3 вибирають з арилу або гетероарилу, де згаданий арил або гетероарил може бути заміщеним від одного до трьох Rc; R4 вибирають з H або Ra; кожен R5 незалежно вибирають з C1-6алкілу; кожен Ra незалежно вибирають з C1-3алкілу; Rb вибирають з C1-3алкілу або -SO2Me; кожен Rc незалежно вибирають з C1-3алкілу, галогену, -CF3 або гідрокси; та n є 0-2, або її фармацевтично прийнятну сіль. Відповідно до іншого втілення, винахід включає сполуку формули (I)(B), R1 N R2 N N O (R5)n 20 R3 R4 (I)(B), 25 30 35 40 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra, CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома C1-3алкільними групами; R2 вибирають з H, -NHRa, алкокси, галогену, -CF3, -CHF2 або C1-6алкілу; R3 вибирають з арилу або гетероарилу, де згаданий арил або гетероарил може бути заміщеним від одного до трьох Rc, та де арил або гетероарил вибирають з фенілу, нафтилу, бензотієнілу, хінолінілу, ізохінолінілу або хіназолінілу; R4 вибирають з H або Ra; кожен R5 незалежно вибирають з C1-6алкілу; кожен Ra незалежно вибирають з C1-3алкілу; Rb вибирають з C1-3алкілу або -SO2Me; кожен Rc незалежно вибирають з C1-3алкілу, галогену, -CF3 або гідрокси; n є 0-2, або її фармацевтично прийнятну сіль. Відповідно до іншого втілення винахід включає сполуки формули (I)(B), де кожен R c незалежно є C1-3алкілом, F або Cl, та n є 0. Відповідно до іншого втілення, винахід включає сполуки формули (I)(B), де кожен Rc незалежно є CF3 або F, та n є 0. Відповідно до іншого втілення, винахід включає сполуки формули (I)(C) R1 N R2 N N O R6 R7 R8 45 (I)(C), 3 UA 107845 C2 5 10 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NHC(O)Ra, -NHSO2Ra, -CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома C1-3алкільними групами; R2 вибирають з H, -NHRa, алкокси або C1-6алкілу; кожен з R6, R7 та R8 незалежно вибирають з C1-3алкілу, галогену, -CF3 або гідроксилу, або R6 та R7 об'єднуються з утворенням біциклічного арилу або гетероарилу, або R 7 та R8 об'єднуються з утворенням біциклічного арилу або гетероарилу; кожен Ra незалежно вибирають з C1-3алкілу; та Rb вибирають з C1-3алкілу або -SO2Me; або їх фармацевтично прийнятні солі. Відповідно до іншого втілення, винахід включає сполуки формули (I)(D) R1 N R2 N N O 15 (I)(D), 20 25 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NHC(O)Ra, - NHSO2Ra, -CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома C1-3алкільними групами; R2 вибирають з H, NHRa, алкокси або C1-6алкілу; кожен Ra незалежно вибирають з C1-3алкілу; та Rb вибирають з C1-3алкілу або SO2Me; або їх фармацевтично прийнятні солі. Відповідно до іншого втілення, винахід включає сполуки формули (I)(E) R1 N R2 N N O R6 R7 (I)(E), 30 35 40 де R1 вибирають з H, C1-6алкілу, алкокси, гідрокси, галогену, -CN, -NHC(O)Ra, - NHSO2Ra, -CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH або гетероарилу, де гетероарил може бути заміщеним однією або двома C1-3алкільними групами; R2 є H, NHRa, алкокси або C1-6алкілом; кожен з R6 та R7 незалежно вибирають з C1-3алкілу, галогену, -CF3 або гідроксилу; кожен Ra незалежно є C1-3алкілом; Rb є C1-3алкілом або SO2Me; або їх фармацевтично прийнятні солі. Відповідно до іншого втілення, винахід включає сполуки: 4 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 2-(1-метилетил)-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-ол, 2-етил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-ол, 1-[(2,3-дихлорфеніл)метил]-2-(1-метилетил)-6-(4-морфолініл)-1H-бензімідазол-4-ол, 1-[(2,3-дихлорфеніл)метил]-4-флуор-2-метил-6-(4-морфолініл)-1H-бензімідазол, 1-[(2,3-дихлорфеніл)метил]-2-етил-6-(4-морфолініл)-1H-бензімідазол-4-ол, 4-флуор-2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол, 2-етил-4-флуор-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4- карбонову кислоту, 1-[(2,3-дихлорфеніл)метил]-2-етил-4-флуор-6-(4-морфолініл)-1H-бензімідазол, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1H-піразол-5-іл)-1H-бензімідазол, 1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-4-(1H-піразол-5-іл)-1H-бензімідазол, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1H-1,2,4-триазол-3-іл)-1H-бензімідазол, метил 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-карбоксилат, 1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбоксамід, метил 1-[(2-флуор-3-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4карбоксилат, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-карбонітрил, 1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонітрил, метил 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол-4-карбоксилат, 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол-4карбонову кислоту, 1-[(2-флуор-3-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-карбоксамід, 1-[(2,3-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-4-(1H-1,2,4-триазол-3-іл)-1Hбензімідазол, метил 2-метил-6-(4-морфолініл)-1-(5-хінолінілметил)-1H-бензімідазол-4-карбоксилат, 2-метил-6-(4-морфолініл)-1-(5-хінолінілметил)-1H-бензімідазол-4-карбонову кислоту, 1-[(3,4-диметилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2-метил-6-(4-морфолініл)-1-(2-нафталінілметил)-1H-бензімідазол-4-карбонову кислоту, 1-[(3,4-дихлорфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1H-1,2,4-триазол3-іл)-1H-бензімідазол, 2-метил-4-(3-метил-1H-1,2,4-триазол-5-іл)-6-(4-морфолініл)-1-(1-нафталінілметил)-1Hбензімідазол, 1-[2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-іл]етанон, [2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-іл]метанол, 2-метил-N-(метилсульфоніл)-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4карбоксамід, метил 5-(4-морфолініл)-2-(трифлуорметил)-1H-бензімідазол-7-карбоксилат, метил 1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Hбензімідазол-4-карбоксилат, 1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Hбензімідазол-4-карбонову кислоту, 6-(4-морфолініл)-1-(1-нафталінілметил)-2-(трифлуорметил)-1H-бензімідазол-4-карбонову кислоту, метил 1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1Hбензімідазол-4-карбоксилат, 1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1H-бензімідазол-4карбонову кислоту, 1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-2-(трифлуорметил)-1Hбензімідазол-4-карбоксамід, метил 6-(4-морфолініл)-1-(1-нафталінілметил)-2-(трифлуорметил)-1H-бензімідазол-4карбоксилат, метил 1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1H-бензімідазол-4карбоксилат, 5 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1H-1,2,4-триазол-3-іл)-2(трифлуорметил)-1H-бензімідазол, 1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-2-(трифлуорметил)-1H-бензімідазол-4карбонову кислоту, 1-[(2,3-дихлорфеніл)метил]-6-(4-морфолініл)-4-(1H-1,2,4-триазол-3-іл)-2-(трифлуорметил)1H-бензімідазол, 1-[(3-хлор-2-метилфеніл)метил]-6-(4-морфолініл)-4-(1H-1,2,4-триазол-3-іл)-2(трифлуорметил)-1H-бензімідазол, 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-4-(1H-тетразол-5-іл)-1H-бензімідазол, [2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол-4іл]метанол, 1-[(3-хлор-2-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2-метил-1-[(2-метилфеніл)метил]-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, етил 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол-4-карбоксилат, 4-бром-2-метил-6-(4-морфолініл)-1H-бензімідазол, 4-бром-2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол, 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1,3-оксазол-2-іл)1H-бензімідазол, метил 2-хлор-5-(4-морфолініл)-1H-бензімідазол-7-карбоксилат, метил 2-хлор-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол-4-карбоксилат, 2-хлор-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол-4карбонову кислоту метил 2-(дифлуорметил)-5-(4-морфолініл)-1H-бензімідазол-7-карбоксилат, 2-(дифлуорметил)-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-карбонову кислоту, 2-(дифлуорметил)-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол-4-карбонову кислоту, 1-[(2,3-дихлорфеніл)метил]-2-(дифлуорметил)-6-(4-морфолініл)-1H-бензімідазол-4карбонову кислоту, 1-[(3-хлор-2-метилфеніл)метил]-2-(дифлуорметил)-6-(4-морфолініл)-1H-бензімідазол-4карбонову кислоту, 1-(1-бензотієн-7-ілметил)-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 1-[(2,3-диметилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 1-[(3-флуор-2-метилфеніл)метил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2,4-диметил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол, 1-[1-(3-хлор-2-метилфеніл)етил]-2-метил-6-(4-морфолініл)-1H-бензімідазол-4-карбонову кислоту, 2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-4-(1,3-тіазол-2-іл)-1Hбензімідазол, 4-(2-фураніл)-2-метил-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1Hбензімідазол та 2-метил-4-[(метилокси)метил]-1-{[2-метил-3-(трифлуорметил)феніл]метил}-6-(4-морфолініл)1H-бензімідазол. Визначення Під терміном "арил", як використано в даному документі, якщо не зазначене інше, розуміють ароматичну, вуглеводневу, кільцеву систему. Кільцева система може бути моноциклічною або конденсованою поліциклічною (наприклад, біциклічною, трициклічною, тощо). В різних втіленнях моноциклічне арильне кільце є C5-C10, або C5-C7, або C5-C6, де дане число карбонів стосується числа атомів карбону, що утворюють кільцеву систему. C6 кільцева система, тобто фенільне кільце є прийнятною арильною групою. В різних втіленнях поліциклічне кільце є біциклічною арильною групою, де прийнятними біциклічними арильними групами є C8-C12 або C9-C10. Нафтильне кільце, яке містить 10 атомів карбону, є прийнятною поліциклічною арильною групою. 6 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Під терміном "гетероарил", як використано в даному документі, якщо не зазначене інше, розуміють ароматичну кільцеву систему, що містить карбон(и) та, щонайменше, один гетероатом. Гетероарил може бути моноциклічним або поліциклічним. Моноциклічна гетероарильна група може мати від 1 до 4 гетероатомів у кільці, в той же час поліциклічний гетероарил може містити від 1 до 10 гетероатомів. Поліциклічне гетероарильне кільце може містити сконденсовані, спіро або місткові кільцеві преходи, наприклад, біциклічний гетероарил є поліциклічним гетероарилом. Біциклічні гетероарильні кільця можуть містити від 8 до 12 атомів. Моноциклічні гетероарильні групи можуть містити від 5 до 8 атомів (карбонів та гетероатомів). Ілюстративні гетероарильні групи включають: бензофуран, бензотієн, бензотіофен, фуран, імідазол, індол, ізотіазол, оксазол, піразин, піразол, піридазин, піридин, піримідин, пірол, хінолін, ізохінолін, хіназолін, хіноксалін, тіазол та тіофен. Відповідно до альтернативного втілення, гетероарили можуть бути заміщеними від однієї до трьох алкільними групами. Під терміном "алкокси", як використано в даному документі, розуміють -O(алкіл), включаючи -OCH3, -OCH2CH3 та -OC(CH3)3, де алкіл є таким, як описано в даному документі. Під терміном "гетероатом", як використано в даному документі, розуміють оксиген, нітроген або сульфур. Під терміном "галоген", як використано в даному документі, розуміють замісник, вибраний з броміду, йодиду, хлориду або флуориду. Під терміном "алкіл" та його похідними в усіх карбонових ланцюгах, як використано в даному документі, включаючи алкільні ланцюги, визначені терміном “-(CH2)n", “-(CH2)m", тощо, розуміють лінійний або розгалужений, насичений або ненасичений вуглеводневий ланцюг, та, якщо не зазначене інше, карбоновий ланцюг буде містити від 1 до 12 атомів карбону. Під терміном "спільне введення" та його похідними, як використано в даному документі, розуміють або одночасне введення або будь-яким способом окреме послідовне введення сполуки, що інгібує PI3 кіназу, як описано в даному документі, та додаткового(их) активного(их) інгредієнту або інгредієнтів. Термін додатковий(і) активний(і) інгредієнт або інгредієнти, як використано в даному документі, включає будь-яку сполуку або терапевтичний агент відомий або який демонструє покращені властивості при введенні пацієнту, який потребує лікування. Відповідно, якщо введення не є одночасним, сполуки вводять в безпосередньо близький період часу один за одним. Більш того, не має значення, якщо сполуки вводять в однаковій дозованій формі, наприклад, одну сполуку можуть вводити місцево, а іншу сполуку можуть вводити перорально. Термін "сполука", як використано в даному документі, включає всі ізомери сполуки. Приклади таких ізомерів включають: енантіомери, таутомери, ротамери. В формулах, де зображують "пунктирний" зв'язок між двома атомами, розуміють, що такий зв'язок може бути або одинарним, або подвійним зв'язком. Кільцева система, що містить такі зв'язки, може бути ароматичною або неароматичною. Конкретні сполуки, описані в даному документі, можуть містити один або більше хіральних атомів, або, по-іншому, можуть бути здатними до існування у вигляді двох енантіомерів, або двох або більше діастереомерів. Відповідно, сполуки за даним винаходом включають суміші енантіомерів/діастереоізомерів, а також очищених енантіомерів/діастереоізомерів або енантіомерно/діастереоізомерно збагачені суміші. Крім того, включеними в межі даного винаходу є індивідуальні ізомери сполук, представлених формулою (I) вище, а також повністю або частково врівноважені їх суміші. Представлений винахід, крім того, покриває індивідуальні ізомери сполук, представлені формулами вище, як суміші їх ізомерів, в яких один або більше хіральних центрів є інверсними. Представлений винахід, крім того, включає ізотопомери сполук формули (I). Приклади таких ізотопомерів включають, але не обмежуються цим, сполуки з одним або більше атомами дейтерію. Сполуки формули (I) входять до складу фармацевтичних композицій винаходу. Якщо -COOH або -OH група є присутньою, можуть застосовувати фармацевтично прийнятні естери, наприклад метиловий, етиловийпівалоїлоксиметиловий, та тому подібні для -COOH, та малеату ацетат та подібні для -OH, та такі естери є відомими з рівня техніки для модифікування характеристик щодо розчинності або гідролізу, для застосування як препаратів з уповільненим вивільненням або проліків. Кваліфікованому спеціалісту в даній галузі з рівня техніки буде зрозуміло, що сполуки формули (I) можуть використовуватися у формі їх фармацевтично прийнятних солей. Фармацевтично прийнятні солі сполук формули (I) включають традиційні солі, утворені з фармацевтично прийнятними (тобто, нетоксичними) неорганічними або органічними кислотами або основами, а також четвертинні амонієві солі. Представлені солі включають наступні: ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, брпомід, кальцію едетат, 7 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 камсилат, карбонат, хлорид, клавуланат, цитрат, динідрохлорид, едетат, едизилат, естолат, езилат, етаноламін, фумарат, глюцептат, глюконат, глютамат, гліколіларсанилат, гексилрезорцинат, гідрабамінпеніцилін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, лаурат, малат, малеат, мигдалат, мезилат (метансульфонат), метилбромід, метилнітрат, метилсульфат, монокалію малеат, мукат, напсилат, нітрат, Nметилглюкамін, оксалат, памоат (ембонат), пальмітат, пантотенат, фосфат/дифосфат, полігалактуронат, калію, саліцилат, натрію, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат (метилбензолсульфонат), триетилйодид, триметиламонію та валерат. Інші солі, такі як солі щавелевої та трифлуороцтової кислоти, які самі по собі не є фармацевтично прийнятними, можуть бути використані у виробництві солей прийнятних, як проміжні сполуки, для одержання сполук за даним винаходом та вони складають додатковий аспект винаходу. В одному втіленні сполука формули (I) знаходиться в формі вільної основи. В одному втіленні сполука формули (I) знаходиться в формі три-солі, тобто три(гідроксиметил)амінометану. В одному втіленні сполука формули (I) знаходиться в формі сульфатної солі. В одному втіленні сполука формули (I) знаходиться в формі гідрохлоридної солі. В одному втіленні сполука формули (I) знаходиться в формі натрієвої солі. Конкретними варіантами солей сполук можуть бути сольвати, а саме гідрати. В одному втіленні сполука формули (I) або її фармацевтично прийнятна сіль знаходиться в формі моно-, ди-, три- або гемі- гідрату. На даний момент виявлено, що сполуки за представленим винаходом є інгібіторами фосфатоінозитидів 3-кіназ (PI3K). Коли фермент фосфатоінозитидів 3-кінази (PI3K) є інгібованим сполукою за представленим винаходом, PI3K є нездатною проявляти свою біокаталітичну, біологічну та/або фармакологічну дії. Сполуки за представленим винаходом внаслідок цього є корисними в лікуванні аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, поліорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантату та ушкоджень легень. Сполуки відповідно до формули (I) є прийнятними для модулювання, особливо для інгібування активності фосфатоінозитидів 3-кіназ (PI3K) та, більш переважно, є селективними інгібіторами ізоформ фосфатоінозитидів 3-кінази (PI3Kβ). Тому, сполуки за представленим винаходом, крім того, є корисними для лікавуння розладів, які є опосередкованими PI3K. Згадане лікування включає модуляцію – особливо інгібування або зниження регуляції – фосфатоінозитидів 3-кіназ. В зв'язку з тим, що фармацевтично активні сполуки за представленим винаходом є активними як інгібітори PI3 кінази, особливо сполуки, які інгібують PI3Kβ, або селективно, або в поєднанні з однією або більше з PI3Kδ, PI3Kα та/або PI3Kγ, вони демонструють терапевтичне застосуванняв лікуванні чутливих новоутворень, переважно тих новоутворень, що демонструють дефіцит PTEN. Як використано в даному документі, вираз "дефіцит PTEN" або "відсутність PTEN" буде описувати пухлини з дефіцитом пухлинної супрессорної функції PTEN (гомолог фосфатази та тензину). Такий дефіцит включає мутацію в гені PTEN, зниження або відсутність протеїнів PTEN, при порівнянні з PTEN дикого типу, або мутацію або відсутність інших генів, що викликають супрессію функції PTEN. Як використано в даному документі термін "лікування" або "процес лікування" в контексті терапевтичних способів стосується полегшення конкретного стану, усунення або зниження симптомів стану, уповільнення або усунення прогресування, інвазії, або метастатичного розповсюдження стану та попередження або уповільнення повторення стану у вже страждаючого суб'єкта. Представлений винахід, крім того, передбачає застосування сполук винаходу у виробництві лікарського засобу для лікування різних станів у ссавців (наприклад, людини) за необхідністю такого лікування. "Чутливе новоутворення", як використано в даному документі, стосується новоутворень, які є сприйнятливими до лікування інгібітором кінази та особливо новоутворень, які є сприйнятливими до лікування інгібітором PI3Kβ. Новоутворення, які пов'язані з невідповідною активністю PTEN фосфатази та особливо новоутворень, які є проявом мутації PTEN, або мутації вищерозташованого активатору PI3Kβ кінази, або гіперекспресії вищерозташованого активатору PI3Kβ кінази, та є, в наслідок цього, сприйнятливими до лікування інгібітором PI3Kβ, який є відомим з рівня техніки, та включає як первинні, так і метастатуючі пухлини та раки. Відповідно до одного з втілень, опис лікування чутливих новоутворень може бути використаний взаємозаміняючи з описом лікування раку. 8 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до одного з втілень, "чутливі новоутворення" включають, але не обмежуються цим, PTEN-дефіцитні новоутворення, наведені нижче: мозку (гліоми), гліобластоми, лейкеміі, синдром Баньяна-Зонана, захворювання Каудена, захворювання Лермітта—Дюкло, рак молочної залози, запальний рак молочної залози, рак товстої та прямої кишок пухлину Вільма, саркому Юінга, рабдоміосаркому, епендіому, гранулобластому, рак товстої кишки, рак голови та шиї, рак нирки, рак легені, рак печінки, меланому, плоскоклітинну карциному, рак яєчників, рак підшлункової залози, рак передміхурової залози, ракову саркому, остеогенну саркому, гігантоклітинну мієлогенну пухлину, рак щитовидної залози, лімфобластну Т-клітинну лейкемію, хронічну мієлоїдну лейкемію, хронічну лімфоцитарну лейкемію, волосатоклітинний лейкоз, гостру лімфобластну лейкемію, гостру мієлогенну лейкемію, хронічну нейтрофільну лейкемію, гостру лімфобластну Т-клітинну лейкемію, плазмацитому, імунобластну великоклітинну лейкемію, лейкемію клітин мантії, множинну мієлому, мегакаріобластну лейкемію, множинну мієлому, гостру мегакаіоцитарну лейкемію, промієлоцитарну лейкемію, еритролейкемію, злоякісну лімфому, ходжкінську лімфому, неходжкінську лімфому, лімфобластну Т-клітинну лімфому, лімфому Беркитта, фолікулярну лімфому, нейробластому, рак сечового міхура, рак уротелія, рак вульви, рак шийки матки, рак ендометрію, рак нирки, 9 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 мезотеліому, рак стравоходу, рак слинних залоз, гепатоцелюлярний рак, рак шлунку, назофарангеальний рак, рак щоки, рак ротової порожнини, GIST (шлунково-кишкову стромальну пухлину), та рак яєчка. Відповідно до альтернативного втілення термін "чутливе новоутворення" включає та обмежується гормонорезистентним раком передміхурової залози, не дрібноклітинним раком легені, раком ендометрію, раком шлунку, меланомою, раком голови та шиї, раком молочної залози, включаючи тріп-негативний рак молочної залози, та гліомою. PTEN дефіцит пов'язують з певними раковими захворюваннями, як продемонстровано в низьці опублікованих джерел, наприклад, Am J Clin Pathol. 2009 Feb; 131(2): 257-63 (гліобластома), J Clin Neurosci. 2010 Dec; 17(12): 1543-7 (гліобластома), Nat Genet. 2009 May; 41(5): 619-24 (рак передміхурової залози), Br J Cancer. 2008 Oct 21; 99(8): 1296-301 (рак передміхурової залози), Int J Cancer. 2007 Mar 15; 120(6): 1284-92 (рак передміхурової залози), J Invest Dermatol. 2006 Jan; 126(1): 154-60 (меланома), J Clin Oncol. 2006 Jan 10; 24(2): 288-95 (меланома), Am J Clin Pathol. 2005 Oct; 124(4): 528-36 (меланома), Int J Oncol. 2009 Apr; 34(4): 983-93 (рак молочної залози), Epigenetics. 2011 May 1; 6(5): 638-49 (рак молочної залози), Gynecol Oncol. 2009 Feb; 112(2): 307-13 (рак яєчників), Mod Pathol. 2010 Oct; 23(10): 1316-24 (рак яєчників), J Pathol. 2010 Feb; 220(3): 392-400 (рак яєчників), Lung. 2009 Mar-Apr; 187(2): 104-9 (рак легені), Anticancer Res. 2007 Jan-Feb; 27(1B): 575-81 (рак легені), Am J Surg. 2008 Jun; 195(6): 719-25 (рак товстої кишки), J Clin Oncol. 2009 Dec 10; 27(35): 5924-30 (рак товстої кишки), Gynecol Oncol. 2004 Jun; 93(3): 621-7 (рак шийки матки) та J Oral Pathol Med. 2002 Aug; 31(7): 379-84 (рак голови та шиї). В іншому аспекті представленого винаходу передбачається спосіб лікування чутливого новоутворення у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування фіброзу у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. Фіброз включає, альтернативно або в сукупності, системний склероз (SSc), артрит, нефропатію та цироз печінки. В іншому аспекті представленого винаходу передбачається спосіб лікування гормонорезистентного раку передміхурової залози у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування не дрібноклітинного раку легені у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну підвидову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування раку ендометрію у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування раку шлунку у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування меланоми у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування раку голови та шиї у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної 10 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування тріпнегативного раку молочної залози у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається спосіб лікування гліоми у ссавців за необхідністю такого, який включає введення ссавцю терапевтично ефективної кількості сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі. В іншому аспекті представленого винаходу передбачається сполука формули (I), (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятна сіль для застосування в терапії. В іншому аспекті передбачається сполука формули (I) (включаючи будь-яку конкретну підвидову формулу, описану в даному документі) або її фармацевтично прийнятна сіль для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. В іншому аспекті представленого винаходу передбачається застосування сполуки формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі, у виробництві лікарського засобу для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. В іншому аспекті представленого винаходу передбачається фармацевтична композиція, яка включає сполуку формули (I) (включаючи будь-яку конкретну під-видову формулу, описану в даному документі) або її фармацевтично прийнятної солі для застосування в лікуванні чутливого новоутворення у ссавців за необхідністю такого. Коли сполуку формули (I) вводять для лікування раку, термін "спільне введення" та його похідні, як використано в даному документі, означає, або одночасне введення, або будь-який спосіб окремого послідовного введення сполуки, що інгібує PI3 кіназу, як описано в даному документі, та додаткового(их) активного(их) інгредієнту або інгредієнтів, відомих, що є корисними в лікуванні раку, включаючи хіміотерапію та радіаційну терапію. Термін додатковий активний інгредієнт або інгредієнти, як використано в даному документі, включає будь-яку сполуку або терапевтичний ягент, відомий або такий, що демонструє корисні властивості при введенні пацієнту, що потребує лікування раку. Переважно, якщо введення не є одночасним, сполуки вводять в безпосередньо близький період часу один за одним. До того ж, не має значення як сполуки вводять в однаковій дозованій формі, чи ні, наприклад, одна сполука може бути введена місцево, а інша споука може бути введена перорально. Як правило, будь-який протипухлинний агент, що має активність проти чутливої пухлини, яку лікуватимуть, можуть спільно вводити при лікуванні раку в представленому винаході. Приклади таких агентів можна знайти в Cancer Principles and Practice f Oncology by V.T. Devita and S. th Hellman (editors), 6 edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Кваліфікований спеціаліст в даній галузі зміг би розглянути які комбінації агентів могли б бути корисними, ґрунтуючись на специфічних характеристиках лікарських засобів та раку, який лікують. Типові противопухлинні агенти прийнятні в представленому винаході включають, але не обмежуються цим, протиканальцієві агенти, такі як дитерпеноїди та барвінкові алкалоїди; координаційні комплекси платини; алкілуючі, агенти такі як азотисті іприти, оксазафосфорини, алкілсульфонати, нітрозосечовини, та триазини; антибіотичні агенти, такі як антрацикліни, актиноміцини та блеоміцини; інгібітори топоізомерази II, такі як епіподофілотоксини; антиметаболіти, такі як аналоги пурину та піримідину та антифолатні сполуки; інгібітори топоізомерази I, такі як камптотецини; гормони та аналоги гормонів; інгібітори шляху сигнальної трансдукції; інгібітори ангіогенезу нерецепторної тирозин кінази; імунотерапевтичні агенти; проапоптичні агенти; та інгібітори клітинного циклу сигнальної системи. Прикладами додаткового активного інгредієнту або інгредієнтів для застосування в комбінації або для спільного введення зі сполуками, що інгібують присутню PI3 кіназу є хіміотерапевтичні агенти. Протиканальцієві або антимітотичні агенти є фазо-специфічними агентами активними проти мікроканальців клітин пухлини під час M або фази мітозу клітинного циклу. Приклади протиканальцієвих агентів включають, але не обмежуються цим, дитерпеноїди та барвінкові алкалоїди. Дитерпеноїди, які одержують з природніх джерел, є фазо-специфічними протираковими агентами, що діють на G2/M фазах клітинного циклу. Вважається, що дитерпеноїди стабілізують β-тубулінову субодиницю мікроканальців, шляхом зв'язування з даним протеїном. Розпад 11 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 протеїну виникає потім при інгібуванні із зупинкою мітозу та наступною смертю клітини. Приклади дитерпеноїдів включають, але не обмежуються цим, паклітаксел та його аналог доцетаксел. Паклітаксел, 5β,20-епокси-1,2α,4,7β,10β,13α-гекса-гідрокситакс-11-ен-9-он 4,10-діацетат 2бензоат 13-естер з (2R, 3S)-N-бензоїл-3-фенілізосерином; є природним дитерпеновим продуктом, виділеним з тису тихоокеанського Taxus brevifolia та є комерційно доступним як ін'єкційний розчин ТАКСОЛ (TAXOL). Він є членом таксанової родини терпенів. Вперше був виділений в 1971 Wani et al. J. Am. Chem, Soc., 93:2325. 1971), які охарактеризували його структуру хімічними та рентгено-кристалографічними методами. Один з механізмів його активності стосується здатності паклітакселу зв'язувати тубулін, таким чином інгібуючи ріст ракової клітини. Schiff et al., Proc. Natl. Acad, Sci. USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol, Chem, 256: 10435-10441 (1981). Для ознайомлення з синтезом та протираковою активностю деяких похідних паклітакселу дивись: D. G. I. Kingston et al., Studies in Organic Chemistry vol. 26, під назвою "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier, Amsterdam, 1986) pp 219-235. Паклітаксел був схвалений для клінічного застосування в лікуванні резистентного раку яєчників в Сполучених Штатах Америки (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann. lntem, Med., 111:273,1989) та в лікуванні раку молочної залози (Holmes et al., J. Nat. Cancer Inst., 83:1797,1991.). Він є потенційним кандидатом в лікуванні новоутворення на шкірі (Einzig et. al., Proc. Am. Soc. Clin. Oncol., 20:46) та карцином голови та шиї (Forastire et. al., Sem. Oncol., 20:56, 1990). Сполука, крім того, показує можливість її застосування в лікуванні полікістозного захворювання нирок (Woo et. al., Nature, 368:750. 1994), раку легені та малярії. Лікування пацієнтів паклітакселем в результаті призводить до пригнічення кісткового мозку (множинна послідовність клітинних поколінь, Ignoff, R.J. et. al, Cancer Chemotherapy Pocket Guide, 1998), яке пов'язане з тривалістю дозування вище порогової концентрації (50 нМ) (Kearns, C.M. et. al., Seminars in Oncology, 3(6) p.16-23, 1995). Доцетаксел, (2R, 3S)-N-карбокси-3-фенілізосерин, N-трет-бутиловий естер, 13-естер 5β-20епокси-1,2α,4,7β,10β,13α-гексагідрокситакс-11-ен-9-ону 4-ацетат 2-бензоат, тригідрат; є комерційно доступним, як ін'єкційний розчин, як TAXOTERE. Доцетаксел призначають для лікування раку молочної залози. Доцетаксел є напівсинтетичною похідною паклітакселу, дивись, одержаний, використовуючи природний попередний, 10-дезацетил-баккатин III, екстрагований з хвої тису європейського. Токсичність, що обмежує дозу доцетакселу, викликає нейтропенію. Барвінкові алкалоїди є фазо-специфічними протипухлинними агентами, одержаними з рослини барвінку. Барвінкові алкалоїди діє в M фазі (фазі мітозу) клітинного циклу шляхом специфічного зв'язування з тубуліном. В результаті, молекула зв'язаного тубуліну не є здатною до полімеризації в мікроканальці. Вважається, що мітоз зупиняє метафазу з наступною смертю клітини. Приклади барвінкових алкалоїдів включають, але не обмежуються цим, вінбластин, вінкристин та вінорельбін. Вінбластин, вінкалейкобластину сульфат, є комерційно доступним як VELBAN, як ін'єкційний розчин. Незважаючи на те, що він має можливі показання як терапевтичний агент другого ряду в лікуванні різних солідних пухлин, його першочергово призначають в лікувнні раку яєчка та різних лімфом, включаючи захворювання Ходжкіна; та лімфоцитарній і гістіоцитарній лімфомах. Мієлосупресія є побічною дією, що обмежує дозу вінбластину. Вінкристин, вінкалейкобластину, 22-оксо-, сульфат, є комерційно доступним як ONCOVIN, як ін'єкційний розчин. Вінкристин призначають в лікуванні гострих лейкемій та, крім того, знайдено їх застосування в регулюванні лікування ходжкінської та неходжкінської злоякісних лімфом. Алопеція та неврологічні дії є найбільш загальними побічними ефектами вінкристину та меншими за поширінестю є ефекти мієлосупресії та запалення слизової оболонки шлунковокишкового тракту. Вінорельбін, 3',4’-дидегідро-4’-дезокси-C’-норвінкалейкобластин[R-(R*,R*)-2,3дигідроксибутандіотат (1:2)(сіль)], комерційно доступний як ін'єкційний розчин вінорельбіну тартрату (NAVELBINE), є напівсинтетичним барвінковим алкалоїдом. Вінорельбін призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами, такими як цисплатин, при лікуванні різних солідних пухлин, зокрема недрібноклітинного раку легень, запущеного раку молочної залози та гормонорезистентного раку передміхурової залози. Пригнічення функції кісткового мозку є найбільш загальною побічною дією, що обмежує дозу вінорельбіну. Координаційні комплекси платини є не фазо-специфічними протираковими агентами, які взаємодіють з ДНК. Платинові комплекси проникають в клитини пухлини, піддаються, гідратації та утворюють внутрішньо- та міжниткове поперечне зшивання з ДНК, викликаючи несприятливі 12 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 біологічні ефекти щодо пухлини. Приклади координаційних комплексів платини включають, але не обмежуються цим, цисплатин та карбоплатин. Цисплатин, цис-діаміндихлорплатина, є комерційно доступним як ПЛАТИНОЛ (PLATINOL), як ін'єкційний розчин. Цисплатин першочергово призначають в лікуванніметастатичного тестикулярного раку та раку яєчників, та запущеного раку сечового міхура. Основна доза обмежується побічними ефектами цисплатину, якими є нефротоксичність, яка може контролюватися за рахунок гідратації та діурезу, та ототоксичність. Карбоплатин, платини діамін[1,1-циклобутандикарбоксилат(2-)-O, O"], є комерційно доступним як ПАРАПЛАТИН (PARAPLATIN), як ін'єкційний розчин. Карбоплатин першочергово призначають як засіб першого та другого ряду при лікуванні запущеної карциноми яєчника. Пригнічення діяльності кісткового мозку є проявом токсичності карбоплатину, що обмежує його дозу. Алкілуючі агенти є не фазо-специфічними протираковими агентами та сильними електрофілами. Як правило, алкілуючі агенти утворюють ковалентні зв'язки, за рахунок алкілування, з ДНК за рахунок нуклеофільних залишків молекули ДНК, таких як фосфатні, аміно, сульфгідрильні, гідрокси, карбоксильні та імідазольні групи. Таке алкілування порушує функцію нуклеїнової кислоти, що призводить до смерті клітини. Приклади алкілуючих агентів включають, але не обмежуються цим, азотисті іприти, такі як циклофосфамід, мелфалан та хлорамбуцил; алкілсульфонати, такі як бусулфан; нітрозосечовини, такі як кармустин; та триазини, такі як дакарбазин. Циклофосфамід, 2-[біс(2-хлоретил)аміно]тетрагідро-2H-1,3,2-оксазафосфорин-2-оксид моногідрат, є комерційно доступним як ін'єкційний розчин або таблетки, як CYTOXAN. Циклофосфамід призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами при лікуванні злоякісних лімфом, множинної мієломи та лейкемій. Алопеція, нудота, блювання та лейкопенія є найбільш загальними побічними ефектами, що обмежують дозу циклофосфаміду. Мелфалан, 4-[біс(2-хлоретил)аміно]-L-фенілаланін, є комерційно доступним як ін'єкційний розчин або таблетки, як ALKERAN. Мелфалан призначають при паліативному лікуванні множинної мієломи та неоперабельноїепітеліальної карциноми яєчника. Пригнічення діяльності кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу мелфалану. Хлорамбуцил, 4-[біс(2-хлоретил)аміно]бензолбутанова кислота, є комерційно доступним як таблетки LEUKERAN. Хлорамбуцил призначають при паліативному лікуванні хронічної лімфатичної лейкемії та злоякісних лімфом, таких як лімфосаркома, гігінтська фолікулярна лімфома та захворювання Ходжкіна. Пригнічення діяльності кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу хлорамбуцилу. Бусулфан, 1,4-бутандіол диметансульфонат, є комерційно доступним як таблетки MYLERAN. Бусулфан призначають при паліативному лікуванні хронічної мієлоїдної лейкемії. Пригнічення діяльності кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу бусулфану. Кармустин, 1,3-[біс(2-хлоретил)-1-нітрозосечовина, є комерційно доступним як одноразові ємності з ліофілізованою речовиною, як BiCNU. Кармустин призначають, як самостійний агент або в комбінації з іншими агентами, при паліативному лікуванні пухлин мозку, множинної мієломи, захворювання Ходжкіна, та неходжкінських лімфом. Уповільнене пригнічення функції кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу кармустину. Дакарбазин, 5-(3,3-диметил-1-триазено)імідазол-4-карбоксамід, є комерційно доступним як одноразові ємності з речовиною, як DTIC-Dome. Дакарбазин призначають для лікування метастатичної злоякісної меланоми та в комбінації з іншими агентами для другого ряду терапії при лікуванні захворювання Ходжкіна. Нудота, блювання та анорексія є найбільш загальними побічними ефектами, що обмежують дозу дакарбазину. Протипухлинні антибіотики є не фазо-специфічними агентами, які зв'язуються або інтеркалюють в ДНК. Як правило, така дія в результаті призводить до стабільних ДНК комплексів або пошкодження нитки, що порушує звичайну функцію нуклеїнових кислот, призводячи до смерті клітини. Приклади антибіотичних протипухлинних агентів включають, але не обмежуються цим, актиноміцини, такі як дактиноміцин, антрацикліни, такі як даунорубіцин та доксорубіцин; та блеоміцини. Дактиноміцин, також відомий як актиноміцин D, є комерційно доступним в ін'єкційній формі як COSMEGEN. Дактиноміцин призначають для лікування пухлини Вільма та рабдоміосаркоми. Нудота, блювання та анорексія є найбільш загальними побічними ефектами, що обмежують дозу дактиноміцину. 13 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 Даунорубіцин, (8S-цис-)-8-ацетил-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12-нафтацендіон гідрохлорид, є комерційно доступним у вигляді ліпосомальної ін'єкційної форми, як DAUNOXOME або як ін'єкційний, як CERUBIDINE. Даунорубіцин призначають для індукування ремісії при лікуванні гострої нелімфоцитарної лейкемії та запущеного ВІЛ, асоційованого із саркомою Капоші. Пригнічення функції кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу даунорубіцину. Доксорубіцин, (8S, 10S)-10-[(3-аміно-2,3,6-тридезокси-α-L-ліксо-гексопіранозил)окси]-8гліколоїл, 7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12-нафтацендіон гідрохлорид, є комерційно доступним у вигляді ін'єкційної форми як RUBEX або ADRIAMYCIN RDF. Доксорубіцин першочергово призначають в лікуванні гострої лімфобластної лейкемії та гострої мієлобластної лейкемії, але, крім того, є корисним компонентом в лікуванні деяких солідних пухлин та лімфом. Пригнічення функції кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу доксорубіцину. Блеоміцин, суміш цитотоксичних глікопептидних антибіотиків, виділених зі штаму Streptomyces verticillus, є комерційно доступним як BLENOXANE. Блеоміцин призначають у вигляді самостійного агенту або в комбінації з іншими агентами, як паліативне лікування плоскоклітинної карциноми, лімфом та тестикулярних карцином. Легенева та шкірна токсичності є найбільш загальними побічними ефектами, що обмежують дозу блеоміцину. Інгібітори топоізомерази II включають, але не обмежуються цим, епіподофілотоксини. Епіподофілотоксини є фазо-специфічними протипухлинними агентами, одержаними з рослини мандрагори. Епіподофілотоксини, як правило, діють на клітини в S та G 2 фази клітинного циклу шляхом утворення потрійного комплексу з топоізомеразою II та ДНК, викликаючи розриви нитки ДНК. Розриви нитки накопичуються, з наступною смертю клітини. Приклади епіподофілотоксинів включають, але не обмежуються цим, етопозид та теніпозид. Етопозид, 4’-диметилепіподофілотоксин 9[4,6-0-(R)-етиліден-β-D-глікопіранозид], є комерційно доступним у вигляді ін'єкційного розчину або капсул, як ВЕПЕЗИД (VePESID) та є загально відомим як VP-16. Етопозид призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні тестикулярного раку та недрібноклітинного раку легень. Пригнічення функції кісткового мозку є найбільш загальним побічним ефектом етопозиду. Схиляються, що захворюваність лейкопенією є більш серьйозною ніж тромбоцитопенія. Теніпозид, 4’-диметилепіподофілотоксин 9[4,6-0-(R)-теніліден-β-D-глікопіранозид], є комерційно доступним у вигляді ін'єкційного розчину як ВУМОН (VUMON) та є загально відомим як VM-26. Теніпозид призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні гострої лейкемії у дітей. Пригнічення функції кісткового мозку є найбільш загальним побічним ефектом, що обмежує дозу теніпозиду. Теніпозид може викликати як лейкопенію, так і тромбоцитопенію. Антиметаболітні протипухлинні агенти є фазо-специфічні протипухлинні агенти, що діють в S фазі (синтез ДНК) клітинного циклу шляхом інгібування синтезу ДНК або шляхом інгібування основного синтезу пурину або піримідину, та, таким чином, стримуючи синтез ДНК. В результаті, S фаза не продовжується та наступає смерть клітини. Приклади антиметаболітних протипухлинних агентів включають, але не обмежуються цим, фторурацил, метотрексат, цитарабін, меркаптопурин, тіогуанін та гемцитабін. 5-Фторурацил, 5-флуор-2,4-(1H, 3H)-піримідиндіон, є комерційно доступним як фторурацил. Введення 5-фторурацилу призводить до інгібування синтезу тимідилату та, крім того, вбудовується як в РНК, так і в ДНК. Результатом, як правило, є смерть клітини. 5-фторурацил призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні карцином молочної залози, товстої кишки, прямої кишки, шлунку та підшлункової залози. Пригнічення функції кісткового мозку та запалення слизової оболонки є найбільш загальними побічними ефектами, що обмежують дозу 5-фторурацилу. Інші аналоги флуорпіримідинів включають 5-флуордезоксиуридин (флоксуридин) та 5-флуордезоксиуридину монофосфат. Цитарабін, 4-аміно-1-(β-D-арабінофуранoзил)-2,1-піримідин-2-он, є комерційно доступним як CYTOSAR-U та є загальновідомим як Ara-C. Вважається, що цитарабін демонструє специфічність до клітинної фази в S-фазі шляхом інгібування подовження ДНК ланцюга за рахунок термінальної включення цитарабіну в ланцюг ДНК, що росте. Цитарабін призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні гострої лейкемії. Інші аналоги цитидину включають 5-азацитидин та 2',2’-дифлуордезоксицитидин 14 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 (гемцитабін). Цитарабін викликає лейкопенію, тромбоцитопенію та запалення слизової оболонки. Меркаптопурин, 1,7-дигідро-6H-пурин-6-тіон моногідрат, є комерційно доступним як PURINETHOL. Меркаптопурин демонструє специфічність до клітинної фази в S-фазі шляхом інгібування синтезу ДНК за рахунок як все ще неспецифічного механізму. Меркаптопурин призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні гострої лейкемії. Пригнічення функції кісткового мозку та запалення шлунковокишкової слизової оболонки є очикуваними побічними ефектами меркаптопурину при високих дозах. Прийнятним аналогом меркаптопурину є азатіопрін. Тіогуанін, 2-аміно-1,7-дигідро-6H-пурин-6-тіон, є комерційно доступним як TABLOID. Тіогуанін демонструє специфічність до клітинної фази в S-фазі шляхом інгібування синтезу ДНК за рахунок як все ще неспецифічного механізму. Тіогуанін призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні гострої лейкемії. Пригнічення функції кісткового мозку, включаючи лейкопенію, тромбоцитопенію та анемію, є найбільш загальними побічними ефектами введення тіогуаніну. Однак, існують побічні ефекти з боку шлунково-кишкового тракту, які можкть обмежувати його дозу. Інші аналоги пурину включають пентостатин, еритрогідроксиноніладенін, флударабіну фосфат та кладрибін. Гемцитабін, 2’-дезокси-2',2’-дифлуорцитидин моногідрохлорид (β-ізомер), є комерційно доступним як GEMZAR. Гемцитабін демонструє специфічність до клітинної фази в S-фазі та шляхом блокування розвитку клітин внаслідок G1/S межі. Гемцитабін призначають в комбінації з цисплатином в лікувнні місцевопоширеного недрібноклітинного раку легені та самостійно в лікувнні місцевопоширеного раку підшлункової залози. Пригнічення функції кісткового мозку, включаючи лейкопенію, тромбоцитопенію та анемію, є найбільш загальним побічним ефектом, що обмежує дозу введення гемцитабіну. Метотрексат, N-[4[[(2,4-діаміно-6-птеридиніл)метил]метиламіно]бензоїл]-L-глутамінова кислота, є комерційно доступним у вигляді метотрексату натрію. Метотрексат демонструє специфічність до клітинної фази в S-фазі шляхом інгібування синтезу, репарації та/або реплікації ДНК за рахунок інгібування дигідрофолієвої кислоти редуктази, яка є необхідною для синтезу пуринових нуклеотидів та тимідилату. Метотрексат призначають як самостійний агент або в комбінації з іншими хіміотерапевтичними агентами в лікуванні хоріокарциноми, менінгеальної лейкемія, неходжкінської лімфоми та карцином молочної залози, голови, шиї, яєчника та сечового міхура. Пригнічення функції кісткового мозку (лейкопенія, тромбоцитопенія та анемія) та запалення слизової оболонки є очикуваними побічними ефектами введення метотрексату. Камптотецини, включаючи камптотецин та похідні камптотецину є доступними або в процесі розробки як інгібітори топоізомерази I. Вважається, що итотоксична активність камптотецинів є пов'язаною з їх інгібіторною активністю топоізомерази. Приклади камптотецинів включають, але не обмежуються цим, іринотекан, топотекан та різні оптичні форми 7-(4метилпіперазинометилен)-10,11-етилендіокси-20-камптотецину, описаного нижче. Іринотекан HCl, (4S)-4,11-діетил-4-гідрокси-9-[(4-піперидинопіперидино)-карбонілокси]-1Hпірано[3',4',6,7]індолізино[1,2-b]хінолін-3,14(4H, 12H)-діон гідрохлорид, є комерційно доступним у вигляді ін'єкційного розчину CAMPTOSAR. Іринотекан є похідною камптотецину, що зв'язується, у відповідності зі своїм активним метаболітом SN-38, з топоізомеразою I – ДНК комплекс. Вважається, що цитотоксичність виникає як результат невідновних подвійних розривів ниток, зумовлених взаємодією топоізомерази І: ДНК: іринотекану або SN-38 потрійного комплексу з ферментами реплікації. Іринотекан призначають для лікування метастатуючого раку товстої або прямої кишки. Побічними ефектами, що обмежують дозу іринотекану HCl, є пригнічення функції кісткового мозку, включаючи нейтропенію, та ЖК ефекти, включаючи діарею. Топотекан HCl, (S)-10-[(диметиламіно)метил]-4-етил-4,9-дигідрокси-1Hпірано[3',4',6,7]індолізино[1,2-b]хінолін-3,14-(4H, 12H)-діон моногідрохлорид, є комерційно доступним у вигляді ін'єкційного розчину HYCAMTIN. Топотекан є похідною камптотецину, що зв'язується з топоізомеразою I – ДНК комплекс та запобігає повторному лігуванню одноланцюгового розрива, який спричинений топоізомеразою I у відповідь на торсійні деформації молекули ДНК. Топотекан призначають як засіб другого ряду лікування метастатуючої карциноми яєчника та дрібноклітинного раку легені. Побічними ефектами, що обмежують дозу топотекану HCl, є пригнічення функції кісткового мозку, первинна нейтропенію. Крім того, зацікавленість викликає похідна камптотецину наступної формули A, на даний час знаходитьсчя в розробці, включаючи суміш рацемічних форм (R, S), а також R і S енантіомери: 60 15 UA 107845 C2 NMe N O O N O A N O Me 5 10 15 20 25 30 35 40 45 O O , Відому за хімічною назвою "7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(R, S)камптотецин (рацемічна суміш) або "7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(R)камптотецин (R енантіомер) або "7-(4- метилпіперазинометилен)-10,11- етилендіокси -20(S)камптотецин (S енантіомер). Така сполука, а також споріднені сполуки описані, включаючи способи їх одержання, в патенті США U.S. No 6,063,923; 5,342,947; 5,559,235; 5,491,237 та в заявці на патент США No. 08/977,217, що очикує рішення, подана 24листопада 1997. Гормони та аналоги гормонів є прийнятними сполуками для лікування ракових захворювань, в яких присутній взаєзв'язок між гормоном(ами) та ростом та/або незростанням раку. Приклади гормонів та аналогів гормонів прийнятних в лікуванні ракових захворювань включають, але не обмежуються цим, адренокортикостероїди, такі як преднізон та преднізолон, які є прийнятними для лікування злоякісної лімфоми та гострої лейкемії у дітей; аміноглютетімід та інші інгібітори ароматази, такі як анастрозол, летразол, воразол, та екземестан є прийнятними в лікуванні адренокортикальної карциноми та гормонозалежної карциноми молочної залози, що містить естрогенові рецептори; прогестини, такі як мегестролу ацетат, є прийнятним в лікуванні гормонозалежного раку молочної залози та ендометріальної карциноми; естрогени, андрогени та антиандрогени, такі як флутамід, нілутамід, бікалутамід, ципртерону ацетат, та 5α-редуктази, такі як фінастерид та дутастерид, є прийнятними в лікуванні карциноми передміхурової залози та доброякісної гіпертрофії передміхурової залози; антиестрогени, такі як тамоксифен, тореміфен, ралоксифен, дролоксифен, йодоксифен, а також селективні модулятори естрогенового рецептору (SERMS) такі як ті, що описані в патенті США No. 5,681,835, 5,877,219 та 6,207,716, є прийнятними в лікуванні гормонозалежної карциноми молочної залози та інших чутливих ракових захворювань; та гонадотропін-вивільняючий гормон (GnRH) та його аналоги, які стимулюють вивільнення лютеїнізуючого гормону (LH), та/або фолікулостимулюючий гормон (FSH) для лікування карциноми передміхурової залози, наприклад, LHRH агоністи та антагоністи, такі як госереліну ацетат та лупролід. Інгібітори шляхів сигнальної трансдукції є такими інгібіторами, які блокують або інгібують хімічний процес, який викликає внутрішньоклітинну зміну. Як використано в даному документі дана зміна є клітинною проліферацією або диференціацією. Інгібітори сигнальної трансдукції прийнятні в представленому винаході включають інгібітори рецепторних тирозинкіназ, нерецепторних тирозинкіназ, блокатори SH2/SH3 домену, серин/треонін кіназ, фосфотидил інозитол-3 кіназ, міо-інозитол сигнальної системи та Ras онкогенезу. Деякі протеїнові тирозинкінази каталізують фосфорилювання специфічних тирозильних залишків у різних протеїнів, включених в регуляцію росту клітини. Такі протеїнові тирозинкінази можуть бути загально класифіковані як рецепторні або нерецепторні кінази. Рецепторні тирозинкінази є трансмембранними протеїнами, які мають позаклітинний лігандзв'язуючий домен, трансмембранний домен та домен тирозинкінази. Рецепторні тирозинкінази є включеними в регуляцію клітинного росту та які, як правило, називають рецепторами фактору роста. Показано, що неналежна або неконтрольована активація багатьох з даних кіназ, тобто аберантна активність рецептора фактора росту кінази, наприклад шляхом гіперекспресії або мутації, в результаті призводить до неконтрольованого росту клітин. Відповідно, аберрантна активність таких кіназ пов'язана з ростом злоякісної тканини. Тому, інгібітори таких кіназ могли б забезпечити способи лікування раку. Рецептори фактору росту включають, наприклад, рецептор епідермального фактор росту (EGFr), рецептор тромбоцитарного фактору росту (PDGFr), erbB2, erbB4, рецептор судинного-ендотеліального фактору росту (VEGFr), тирозинкіназу з гомологічними доменами імуноглобулін-подібного та епідермального фактору росту (TIE-2), рецептор інсулінового фактору росту – I (IGFI), стимулюючий фактор колонії макрофагів (cfms), BTK, ckit, cmet, рецептори фактору росту 16 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 фібробластів (FGF), рецептори Trk (TrkA, TrkB та TrkC), рецептори ефріну (eph) та RET протоонкоген. Деякі інгібітори рецепторів росту знаходяться в розробці та включають лігандні антагоністи, антитіла, інгібітори тирозинкінази та антисмислові олігонуклеотиди. Рецептори фактору росту та агенти, що інгібують функцію рецептору фактору росту описані, наприклад, в Kath, John C., Exp. Opin. Ther. Patents (2000) 10(6):803-818; Shawver et al DDT Vol 2, No. 2 February 1997; та Lofts, F. J. et al, "Growth factor receptors as targets", New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David, CRC press 1994, London. Тирозинкінази, що не є кіназами рецептору фактору росту назівають нерецепторними тирозинкіназами. Нерецепторні тирозинкінази прийнятні в представленому винаході, які є мішенями або потенційними мішенями протиракових лікарських засобів, включають cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (кіназу фокального сполучення), тирозинкіназу Брутона та Bcr-Abl. Такі нерецепторні кінази та агенти, які інгібують функцію нерецепторної тирозинкінази описані в Sinh, S. and Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8 (5): 465 – 80; та Bolen, J.B., Brugge, J.S., (1997) Annual review of Immunology. 15: 371-404. Блокатори SH2/SH3 домену є агентами, що розривають SH2 або SH3 домен зв'язування в різновидності ферментів або адапторних протеїнів, включаючи PI3-K p85 субодиницю, Src родина кіназ, адапторні молекули (Shc, Crk, Nck, Grb2) та Ras-GAP. SH2/SH3 домени як мішені для протиракових лікарських засобів обговорюються в Smithgall, T.E. (1995), Journal of Pharmacological and Toxicological Methods. 34(3) 125-32. Інгібітори серин/треонін кіназ, включаючи каскадні блокатори MAP кінази, які включають блокатори Raf кіназ (rafk), мітоген або позаклітинні регульоввані кінази (MEK), та позаклітинні регульоввані кінази (ERK); та блокатори члени родини протеїнкіназ C, включаючи блокатори PKC (альфа, бета, гама, епсилон, мю, лямбда, йота, дзета). Родина IkB кіназ (IKKa, IKKb), родина PKB кіназ, члени родини AKT кіназ та TGF бета рецепторні кінази. Такі серин/треонін кінази та їх інгібітори описані в Yamamoto, T., Taya, S., Kaibuchi, K., (1999), Journal of Biochemistry. 126 (5) 799-803; Brodt, P, Samani, A., and Navab, R. (2000), Biochemical Pharmacology, 60. 1101-1107; Massague, J., Weis-Garcia, F. (1996) Cancer Surveys. 27:41-64; Philip, P.A., and Harris, A.L. (1995), Cancer Treatment and Research. 78: 3-27, Lackey, K. et al Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; U.S. Patent No. 6,268,391; та Martinez-Iacaci, L., et al, Int. J. Cancer (2000), 88(1), 44-52. Інгібітори членів родини фосфотидил інозитол-3 кінази, включаючи блокатори PI3-кінази, ATM, ДНК-PK та Ku також є прийнятними в представленому винаході. Такі кінази описані в Abraham, R.T. (1996), Current Opinion in Immunology. 8 (3) 412-8; Canman, C.E., Lim, D.S. (1998), Oncogene 17 (25) 3301-3308; Jackson, S.P. (1997), International Journal of Biochemistry and Cell Biology. 29 (7):935-8; та Zhong, H. et al, Cancer res, (2000) 60(6), 1541-1545. Крім того, прийнятними в представленому винаході є інгібітори міо-інозитол сигнальної системи, такі як блокатори фосфоліпази C та міоінозитольні аналоги. Такі інгібітори сигнальної системи описані в Powis, G., and Kozikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., Paul Workman and David Kerr, CRC press 1994, London. Інша група інгібіторів шляхів сигнальної трансдукції є інгібіторами ras онкогену. Такі інгібітори включають інгібітори фарнезилтрансферази, гераніл-гераніл трансферази та CAAX протеаз, а також антисмислові олігонуклеотиди, рибозими та імкнотерапію. Показано, що такі інгібітори блокують ras активацію в клітинах, що містять дикий тип мутантного ras, таким чином активуючись як антипроліфераційні агенти. Інгібування Ras онкогену обговорюється в Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology. 9 (2) 99 – 102; та BioChem. Biophys. Acta, (19899) 1423(3):19-30. Як згадано вище, антагоністи антитіл до зв'язування лігандів можуть, крім того, виступати як інгібітори сигнальної трансдукції. Дана група інгібіторів шляху сигнальної трансдукції включає застосування гуманізованих антитіл до позаклітинного ліганду, що зв'язує домен рецепторних тирозинкіназ. Наприклад, специфічне антитіло Imclone C225 EGFR (дивись Green, M.C. et al, Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat. Rev., (2000), 26(4), 269-286); Herceptin erbB2 антитіло (дивись Tyrosine Kinase Signalling in Breast cancer:erbB Family receptor Tyrosine Kinases, Breast cancer Res., 2000, 2(3), 176-183); та специфічне антитіло 2CB VEGFR2 (дивись Brekken, R.A. et al, Selective Inhibition of VEGFR2 Activity by a monoclonal AntiVEGF antibody blocks tumor growth in mice, Cancer Res. (2000) 60, 5117-5124). Інгібітори ангіогенезу нерецепторної кінази також можуть знайти застосування в представленому винаході. Інгібітори ангіогенезу споріднених VEGFR та TIE2 обговорюються вище по відношенню до інгібіторів сигнальної трансдукції (обидва рецептори є рецепторними тирозинкіназами). Відповідно, інгібітори нерецепторної тирозинкінази можуть застосовувати в 17 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 55 60 комбінації з інгібіторами за представленим винаходом. Наприклад, анти-VEGF антитіла, які не розпізнають VEGFR (рецептор тирозинкіназа), але зв'язуються з лігандом; низькомолекулярні інгібітори інтегрину (альфаv бета3), що інгібуватимуть ангіогенез; ендостатин та ангіостатин (неRTK) можуть також виявитися корисними в комбінації з розкритими інгібіторами родини. (Дивись Bruns CJ et al (2000), Cancer Res., 60: 2926-2935; Schreiber AB, Winkler ME, and Derynck R. (1986), Science, 232: 1250-1253; Yen L et al. (2000), Oncogene 19: 3460-3469). Агенти, застосовані в імунотерапевтичних системах лікування, також можуть бути корисними в комбінації зі сполуками формули (I). Існує низка імунологічних стратегій для генерування імунної відповіді до erbB2 або EGFR. Дані стратегії, як правило, знаходяться в області вакцинацій пухлин. Ефективність імунологічних підходів може бути значно підвищена за рахунок комбінованого інгібування erbB2/EGFR шляхів сигнальної системи, використовуючи низькомолекулярний інгібітор. Обговорення імунологічного/пухлинно вакцинаційного підходу до erbB2/EGFR наведено в Reilly RT et al. (2000), Cancer Res. 60: 3569-3576; та Chen Y, Hu D, Eling DJ, Robbins J, and Kipps TJ. (1998), Cancer Res. 58: 1965-1971. Агенти, застосовані в проапоптозних системах лікування (наприклад, bcl-2 антисмислові олігонуклеотиди) також можуть бути застосовані в комбінації за представленим винаходом. Члени родини Bcl-2 протеїнів блокують апоптоз. Тому, підвищена регуляція bcl-2 є пов'язаною з хіміорезистентністю. Дослідження показали, що фактор епідермального росту (EGF) стимулює антиапоптичні члени родини bcl-2 (тобто, mcl-1). Таким чином, стратегії, спрямовані на зниження регуляції експресії bcl-2 в клітинах, продемонстрували клінічні переваги та знаходяться на даний момент в фазі випробувань II/III, а саме Genta G3139 bcl-2 антисмисловий олігонуклеотид. Такі проапоптозні стратегії, що застосовують антисмислову олігонуклеотидну стратегію для bcl-2 обговорюються в Water JS et al. (2000), J. Clin. Oncol. 18: 1812-1823; та Kitada S et al. (1994), Antisense Res. Dev. 4: 71-79. Інгібітори сигнальної системи клітинного циклу інгібують молекули, включені в контроль клітинного циклу. Родина протеїнкіназ, названа циклін залежними кіназами (CDK), та їх взаємодія з родиною протеїнів названих циклінами, контролює розвиток протягом циклу еукаріотичної клітини. Координована активація та інактивація різних циклін/CDK комплексів є необхідною для нормального розвитку протягом клітинного циклу. Деякі інгібітори сигнальної системи клітинного циклу знаходяться на стадії розробки. Наприклад, приклади циклін залежних кіназ, включаючи CDK2, CDK4 та CDK6, та інгібіторів для таких же описані в, наприклад, Rosania et al, Exp. Opin. Ther. Patents (2000) 10(2):215-230. В одному втіленні, спосіб лікування раку, заявлений у винаході включає спільне введення сполуки формули I та/або її фармацевтично прийнятної солі, гідрату, сольвату або проліків та щонайменше одного протипухлинного агенту, такого як такий, що є вибраним з групи, що складається з протиканальцієвих агентів, координаційних комплексів платини, алкілуючих агентів, антибіотиків, інгібіторів топоізомерази II, антиметаболітів, інгібіторів топоізомерази I, гормонів та аналогів гормонів, інгібіторів шляху сигнальної трансдукції, інгібіторів ангіогенезу нерецепторної тирозинкінази, імунотерапевтичних агентів, проапоптозних агентів та інгібіторів сигнальної системи клітинного циклу. Фармацевтично активні сполуки за представленим винаходом є включеними в традиційні дозовані форми, такі як капсули, таблетки або ін'єкційні препарати. Застосовують тверді або рідкі фармацевтичні носії. Тверді носії включають крохмаль, лактозу, сульфат кальцію дигідрат, каолін, цукрозу, тальк, желатин, агар, пектин, гуміарабік, стеарат магнію та стеаринову кислоту. Рідкі носії включають сироп, арахісову олію, оливкову олію, сольовий розчин та воду. Аналогічно, носій або розбавлювач може включати будь-яку речовину, що подовжує вивільнення, таку як гліцерилмоностеарат або гліцерилдистеарат, самостійно або з воском. Кількість твердого носія широко варіює, але переважно складатиме від близько 25 мг до близько 1 г на дозовану одиницю. Коли застосовують рідкий носій, препарати будуть знаходитися в формі сиропу, елексиру, емульсії, м'якої желатинової капсули, стерильної ін'єкційної рідини, такої як ампула, або водні або неводні рідкі суспензії. Фармацевтичні препарати виробляють за наступними традиційними методиками фармацевтичної хімії, що включають змішування, гранулювання та пресування, коли необхідно, для таблетованих форм, або змішування, заповнення та розчинення інгредієнтів, як відповідне, щоб одержати бажані пероральні або парентеральні продукти. Дози на даний момент заявлених фармацевтично активних сполук у фармацевтичній дозованій одиниці, як описано вище, будуть ефективною, нетоксичною кількістю, переважно вибраною з діапазону 0,001-100 мг/кг активної сполуки, переважно 0,001-50 мг/кг. При лікуванні пацієнта-людини за необхідністю інгібітором PI3K, вибрану дозу вводять переважно 1-6 разів на день, перорально або парентерально. Переважні форми парентерального введення включають 18 UA 107845 C2 5 10 15 20 25 30 35 40 45 50 місцеве, ректальне, трансдермальне, шляхом ін'єкції та постійне шляхом інфузії. Пероральні дозовані одиниці для введення людині переважно містять від 0,05 до 3500 мг активної сполуки. Відповідно до одного з втілень, пероральна доза для введення людині містить від 100 до 1000 мг на день. Пероральне введення, яке застосовує нижчі дози, є переважним. Парентеральне введення, при високих дозах, однак, також може бути застосоване, коли воно є безпечним та прийнятним для пацієнта. Оптимальні дози, що вводять, можуть бути легко визначені кваліфікованим спеціалістом в даній галузі, та будуть варіювати в залежносі від конкретного інгібітора PI3 кінази в застосуванні, сили препарату, способу введеннята розвитку стану захворювання. Додаткові фактори, що включають вік пацієнта, вагу, дієту та час введення в залежності від конкретного пацієнта, якого лікують, в результаті призведуть до корегування доз. Ілюстративні дози включають пероральні препарати еквівалентні 10 мг, 25 мг та 100 мг сполуки формули (I), що вводять одноразово, багаторазово, або в комбінації. Інша ілюстративна доза включає пероральні препарати три(гідроксиметил)амінометанової солі 2-метил-1-{[2-метил-3(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол-4-карбонової кислоти еквівалент 10 мг, 25 мг або 100 мг вільної основи 2-метил-1-{[2-метил-3(трифлуорметил)феніл]метил}-6-(4-морфолініл)-1H-бензімідазол-4-карбонової кислоти. Спосіб, за даним винаходом, індукування активності інгібіторy PI3 кінази у ссавців, включаючи людей, включає введення суб'єкту, який потребує такої активності, ефективної кількості, що модулює/інгібує PI3 кіназу, фармацевтично активної сполуки за представленим винаходом. Крім того, винахід передбачає застосування сполуки формули (I) у виробництві лікарського засобу для застосування як інгібітор PI3 кінази. Крім того, винахід передбачає застосування сполуки формули (I) у виробництві лікарського засобу для застосування в терапії. Крім того, винахід передбачає застосування сполуки формули (I) у виробництві лікарського засобу для застосування в лікуванні аутоімунних розладів, запальних захворювань, серцевосудинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, поліорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантату та ушкодження легень. Крім того, винахід передбачає фармацевтичну композицію для застосування як інгібітора PI3, яка містить сполуку формули (I) та фармацевтично прийнятний носій. Крім того, винахід передбачає фармацевтичну композицію для застосування в лікуванні аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, поліорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантату та ушкодження легень, яка містить сполуку формули (I) та фармацевтично прийнятний носій. Крім того, фармацевтично активні сполуки за представленим винаходом можуть спільно вводити з додатковими активними інгредієнтами, включаючи сполуки, що мають застосування, коли використовуються в комбінації з інгібітором PI3 кінази. Без додаткової розробки, вважається, що кваліфікований спеціаліст в даній галузі може, використовуючи згаданий опис, застосувати його в повному обсязі. Наступні приклади, таким чином, слід розглядати тільки як ілюстративні, а не як такі, що обмежують межі представленого винаходу в будь-якому випадку. Експериментальні методики Сполуки формули (I) можуть бути одержані, використовуючи загальні схеми I – VII, як описано нижче. Схема I (R2=Me) 19 UA 107845 C2 (NH4)2S Br2 HOAc EtOH, HCl кип'ятіння EtOH 2 1 Основа 3 4 [H] Pd2(dba) 3, CsCO3, X-Phos 80C o/n 6 5 7 7 11 8 X = Br, F 9 5 10 10 2,6-динітроанілін 1 можуть бромувати бромом в оцтовій кислоті, одержуючи 4-бром-2,6+ динітроанілін 2, який може бути відновлений до діамінонітробензолу 3 (NH 4 )2S. Наступна реакція 3 з 2,4-пентандіоном в присутності сильної кислоти при температурах кипіння зі зворотним холодильником, в спиртовому розчиннику, дає нітробензімідазол 4. Алкілування, яке призводить до одержання заміщеного бензімідазолу 5, може бути виконано відповідно із заміщеним алкілгалідом з основою, такою як K 2CO3, в полярному апротонному розчиннику, такому як ДМФ. Каталізоване паладієм заміщення ароматичного брому морфаліном далі може давати заміщений нітробензімідазол 6, який потім можуть відновлювати до амінобензімідазолу 7. Амінобензімідазол 7 далі може бути перетворений в гідроксильний аналог 8, сульфонамід 9, амід 10, та галогенвмісний аналог 11, використовуючи стандартні прийоми органічної хімії. Схема II 20 UA 107845 C2 Br2 (NH4)2S HOAc H2SO4 EtOH 3 2 1 Основа 4 Pd2(dba)3, CsCO3, X-Phos [H] 80C o/n 6 5 7 7 8 11 X = Br, F 9 5 10 10 2,6-динітроанілін 1 можуть бромувати бромом в оцтовій кислоті, одержуючи 4-бром-2,6+ динітроанілін 2, який може бути відновлений до діамінонітробензолу 3 (NH 4 )2S. Наступна реакція 3 з карбоновою кислотією в присутності сильної кислоти при підвищених температурах дає нітробензімідазол 4. Алкілування, яке призводить до одержання заміщеного бензімідазолу 5, може бути виконано відповідно із заміщеним алкілгалідом з основою, такою як K2CO3, в полярному апротонному розчиннику, такому як ДМФ. Каталізоване паладієм заміщення ароматичного брому морфаліном далі може давати заміщений нітробензімідазол 6, який потім можуть відновлювати до амінобензімідазолу 7. Амінобензімідазол 7 потім можуть перетворювати в гідроксильний аналог 8, сульфонамід 9, амід 10, та галогенвмісний аналог 11, використовуючи стандартні прийоми органічної хімії. Схема III (R1=OMe; R2=Me) 15 MeI, K2CO3 Br 2 ДМФ H2SO4 HOAc 2 1 20 25 80C o/n 4 3 K2CO3, ДМФ Fe, HOAc 5 Pd2(dba) 3, CsCO3, X-Phos Ac 2O, HOAc 6 7 2-аміно-3-нітрофенол 1 може бути метильований MeI в присутності K2CO3 в ДМФ з одержанням метоксинітроаніліну 2. Бромування, бромом в оцтовій кислоті, з наступним ацетилюванням оцтовим ангідридом в оцтовій кислоті та сірчаній кислоті, може призвести до одержання проміжної сполдуки 4. Каталізоване паладієм заміщення ароматичного брому на морфолін потім може дати проміжнк сполуку 5. Індуковане залізом відновлення нітрогрупи з наступним замкненням кільця далі може призвести до одержання бензімідазолу 6, який може бути алкільованим, відповідно, заміщеним алкілбромідом з використанням основи, такої як K2CO3, в полярному апртонному розчиннику, такому як ДМФ, з одержанням кінцевих продуктів 7. Схема IV 21 UA 107845 C2 HetB(OH) 2 NaNO2, NaBr 1 5 водн. HBr Pd2(dba) 3, P(tBu) 3 CsCO3, діоксан, 100C 2 3 Амінобензімідазол 1 може бути перетворений в бромбензімідазол 2, використовуючи нітрит натрію з NaBr у водному HBr. Каталізоване паладієм сполучення з арилбороновую кислотією в присутності прийнятного фосфіну з неорганічною основою в полярному непротонному розчиннику далі може призвести до одержання кінцевих заміщених бензімідазолів 3. Het включає 2-, 3- фураніли та 1,3-тіозоли. Схема V 10 CO(g), dppf, Pd(OAc)2 LiOH ТГФ / H2O TEA, MeOH 1 15 2 3 Каталізоване паладієм карбонілювання бромбензімідазолу 1 можуть виконувати шляхом барботування газоподібного монооксиду карбону в метанолі з триетиламіном, одержуючи метиловий естер 2. Гідроліз естеру далі можуть виконувати з гідроксидом літію в суміші ТГФ/вода з одержанням кінцевого продукту бензімідазольної кислоти 3. Схема VI Zn(CN)2, Pd(PPh3)4 30% H2O2, KOH ДМФ-ДMA ДМФ ТГФ 3 2 1 H2NNH2H2O AcOH 4 5 20 25 Каталізоване паладієм ціанування бромбензімідазолу 1 можуть виконувати, використовуючи ціанід цинку в ДМФ з одержанням нітрилу бензімідазолу 2. Нітрил можуть перетворювати в первинний карбоксамід використовуючи KOH та пероксид в ТГФ з одержанням аміду 3. Обробка карбоксаміду 3 ДМФ-ДMA може призвести до одержання проміжної сполуки 4, яку далі можуть циклізувати до аналогів триазолу 5, використовуючи гідразин в оцтовій кислоті. Схема VII 22 UA 107845 C2 Cu(OAc)2, MeONH 2 MeOH, H 2SO4 трет-BuOK, ДМФ K2CO3, ДМФ 1 2 [H] 3 4 1) алкілування R2CO2H 2) різні 5 5 10 6 7 Амінування 5-хлор-2-нітробензойної кислоти O-метилгідроксиламіном та трет-бутоксидом в присутності ацетату купруму може призвести до одержання 3-аміно-5-хлор-2-нітробензойної кислоти 2. Естерифікацію можуть виконувати, використовуючи метанол та сірчану кислоту, з одержанням метилового естеру 3, який може реагувати з морфоліном в ДМФ в присутності K2CO3, з одержанням аналогу фенілморфоліну 4. Відновлення нітрогрупи можуть виконувати, використовуючи різноманітні відновлення металів, одержуючи діамін 5. Конденсація 5 з різними карбоновими кислотами може призводити до одержання метилового естеру бензімідазолу 6, який далі можуть перетворювати до кінцевих продуктів 7 (R1=CO2Me, CO2H, CONH2, CN, триазол, тетразол) після алкілування алкілгалідом, з наступними стандартними органічними процедурами, як описано раніше. Приклад 1 15 NO2 N Me N H Br Одержання 5-бром-2-метил-7-нітро-1H-бензімідазолу a) 4-бром-2,6-динітробензоламін 20 NH2 O2 N NO2 Br 25 30 До суспензії 2,6-динітроаніліну (5 г, 27,3 ммоль) в крижаній оцтовій кислоті (50 мл), що струшують, по краплям додавали бром (1,5 мл, 30 ммоль) та нагрівали при 120 °C протягом 2 годин. Після охолодження до температури навколишнього середовища одержану в результаті суміш виливали в воду (50 мл). Осаджену тверду речовину збирали фільтруванням та промивали водою, потім сушили в вакуумі. Тверду речовину пере розчиняли в EtOAC, промивали водою та насиченим сольовим розчином. Органічний шар збирали та концентрували 1 в вакуумі, одержуючи бажаний продукт (6,88 г, 95 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 8.37 (ш с, 2H), 8.58 (с, 2H). b) 5-бром-3-нітробензол-1,2-діамін 23 UA 107845 C2 NH2 O2 N NH2 Br 5 10 4-бром-2,6-динітробензоламін розчиняли в EtOH (50 мл) та до суміші додавали (NH 4)2S (2,2 мл). Реакційну суміш нагрівали до 90 °C протягом 1 години. ТШХ показала нову сполуку та деякі залишки вихідної речовини. Додатково, додавали іншу порцію (NH4)2S (2,5 мл). Через 1 годину, ТШХ аналіз показали малу кількість вихідної речовини, що залишилася. Реакційну суміш концентрували, одержуючи тверду речовину глибоко червоного кольору. Потім її очищували шляхом силікагелевої хроматографії, елюювали ДХМ, одержуючи бажаний продукт у вигляді 1 червоної твердої речовини (578 мг, 50 %). H ЯМР (300 МГц, CDCl3) δ м.ч. 3,50 (ш с, 2H), 5,93 (ш + с, 2H), 7,04 (д, 1H, J=1,8 Гц), 7,87 (д, 1H, J=1,8 Гц); РХ-МС: m/e=232 [M+1] . c) 6-бром-2-метил-4-нітро-1H-бенз[d]імідазол NO2 N Me N H Br 15 20 Суміш 5-бром-3-нітробензол-1,2-діаміну (464 мг) та пентан-2,4-діону (400 мг) в EtOH (27 мл) та 5 N HCl (7,4 мл) кип'ятили зі зворотним холодильником протягом 3 годин. Суміш охолоджували до кімнатної температури та розчинник видаляли в вакуумі. Залишок розчиняли в EtOAc та промивали водним NaHCO3 розчином та сольовим розчином. Органічний шар 1 концентрували, одержуючи бажаний продукт у вигляді твердої речовини (460 мг, 90 %). H ЯМР (300 МГц, CDCl3) δ м.ч. 2,73 (с, 3H), 8,11 (д, 1H, J=1,8 Гц), 8,24 (д, 1H, J=1,8 Гц), 10,20 (с, 1H, с); + РХ-МС: m/e=256 [M+1] Приклад 2 (R=H) та Приклад 3 (R=Ac) HN R N Me N N O 25 Одержання 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-аміну та N(2-метил-6-морфолін-4-іл-1-нафталін-1-ілметил-1H-бензімідазол-4-іл)-ацетаміду a) 6-бром-2-метил-1-(нафталін-1-ілметил)-4-нітро-1H-бенз[d]імідазол NO2 N Me Br N 30 35 Суміш 6-бром-2-метил-4-нітро-1H-бенз[d]імідазолу (одержаний за тією самою методикою як і в прикладі 1) (3 г), 1-(бромметил)нафталіну (2,85 г) та K2CO3 (3,23 г) в ДМФ (100 мл) струшували o при 80 C протягом ночі. Суміш охолоджували до кімнатної температури та фільтрували. Фільтрат далі виливали у воду. Знову фільтрували, одержуючи тверду речовину та тверду речовину промивали водою та далі сушили в вакуумі, одержуючи бажаний продукт (4,63 г, 24 UA 107845 C2 1 100 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,54 (с, 3H), 6,16 (с, 2H), 6,32 (д, 1H, J=7,5 Гц), 7,33 (т, 1H, J=7,5 Гц), 7,61-7,72 (м, 2H), 7,87 (д, 1H, J=7,5 Гц), 8,01 (д, 1H, J=7,5 Гц), 8,14 (д, 1H, J=1,8 + Гц), 8,19 (д, 1H, J=7,5 Гц), 8,28 (д, 1H, J=1,8 Гц); РХ-МС: m/e=296 [M+1] . b) 4-(2-метил-3-(нафталін-1-ілметил)-7-нітро-3H-бенз[d]імідазол-5-іл)морфолін 5 NO2 N Me N N O 10 15 20 25 30 Суміш 6-бром-2-метил-1-(нафталін-1-ілметил)-4-нітро-1H-бенз[d]імідазолу (4,63 г), морфоліну (3,05 г), Pd2(dba)3 (1,05 г), Cs2CO3 (5,72 г) та X-Phos (1,09 г) в діоксані (100 мл) o дегазували азотом та потім струшували при 80 C протягом ночі. Суміш охолоджували до кімнатної температури та розчинник видаляли в вакуумі. Залишок далі очищували шляхом силікагелевої хроматографії, елюювали сумішшю EtOAc: петролейний етер = 1:1, одержуючи бажаний продукт у вигляді жовтої твердої речовини (2,8 г, 60 %). 1H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,46 (с, 3H), 3,12 (т, 4H, J=4,8 Гц), 3,70 (т, 4H, J=4,8 Гц), 6,09 (с, 2H), 6,31 (д, 1H, J=7,5 Гц), 7,34 (т, 1H, J=7,5 Гц), 7,53 (д, 1H, J=2,1 Гц), 7,62-7,70 (м, 3H), 7,86 (д, 1H, J=8,1 Гц), 8,01 (д, 1H, + J=7,5 Гц), 8,23 (д, 1H, J=8,1 Гц); РХ-МС: m/e=403 [M+1] . c) 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-амін та N-(2-метил-6морфолін-4-іл-1-нафталін-1-ілметил-1H-бензімідазол-4-іл)ацетамід До суміші 4-(2-метил-3-(нафталін-1-ілметил)-7-нітро-3H-бенз[d]імідазол-5-іл)морфоліну (804 мг) в HOAc (50 мл), що струшували, додавали порошок заліза (336 мг) та суміш продовжували кип'ятити зі зворотним холодильником протягом 3 годин. Суміш охолоджували до кімнатної температури та HOAc видаляли в вакуумі. Залишок потім нейтралізували водним розчином NaHCO3. Далі екстрагували ДХМ та органічний шар промивали сольовим розчином, сушили над безводним Na2SO4, фільтрували та концентрували в вакуумі. Залишок очищували шляхом силікагелевої хроматографії, елюювали сумішшю MeOH: ДХМ = 1: 30, одержуючи сполуку 1 прикладу 2 (350 мг, 47 %) та прикладу 3 (350 мг, 42 %). Приклад 2 H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,33 (с, 3H), 2,91 (т, 4H J=4,8 Гц), 3,64 (т, 4H J=4,8 Гц), 5,15 (ш с, 2H), 5,83 (с, 2H), 6,10 (д, 1H, J=2,1 Гц), 6,12 (д, 1H, J=2,1 Гц), 6,38 (д, 1H, J=7,5 Гц), 7,34 (т, 1H, J=7,5 Гц), 7,58-7,68 (м, + 2H), 7,84 (д, 1H, J=8,4 Гц), 8,01 (д, 1H, J=7,5 Гц), 8,23 (д, 1H, J=8,4 Гц); РХ-МС: m/e=373 [M+1] ; 1 Приклад 3 H ЯМР (300МГц, ДМСО-d6) δ м.ч. 2,18 (с, 3H), 2,40 (с, 3H, s), 2,96 (т, 4H, J=4,8 Гц), 3,67 (т, 4H, J=4,8 Гц), 5,95 (с, 2H), 6,34 (д, 1H, J=7,5 Гц), 6,68 (с, 1H), 7,34 (т, 1H, J=7,5 Гц), 7,597,70 (м, 2H), 7,76 (с, 1H), 7,85 (д, 1H, J=7,5 Гц), 8,01 (д, 1H, J=7,5 Гц), 8,23 (д, 1H, J=7,5 Гц), 9,81 + (с, 1H); РХ-МС: m/e=415 [M+1] Приклад 4 35 O S HN O N Me N N O 40 Одержання N-[2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4іл]метансульфонаміду a) 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-амін 25 UA 107845 C2 NH2 N Me N N O 5 10 15 20 25 Суміш 4-(2-метил-3-(нафталін-1-ілметил)-7-нітро-3H-бенз[d]імідазол-5-іл)морфоліну (804 мг), одержаного як описано в прикладі 2, порошку заліза (168 мг) та FeSO 4 (84 мг) в етанолі (30 мл) та H2O (30 мл) струшували при температурі кипіння зі зворотним холодильником протягом ночі. Суміш охолоджували до кімнатної температури та розчинник видаляли в вакуумі. Залишок розчиняли в ДХМ та фільтрували. Фільтрат потім промивали сольовим розчином, сушили над безводним Na2SO4, фільтрували та концентрували в вакуумі, одержуючи бажаний продукт у 1 вигляді твердої речовини (720 мг, 97 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,33 (с, 3H), 2,91 (т, 4H J=4,8 Гц), 3,64 (т, 4H J=4,8 Гц), 5,15 (ш с, 2H), 5,83 (с, 2H), 6,10 (д, 1H, J=2,1 Гц), 6,12 (д, 1H, J=2,1 Гц), 6,38 (д, 1H, J=7,5 Гц), 7,34 (т, 1H, J=7,5 Гц), 7,58-7,68 (м, 2H), 7,84 (д, 1H, J=8,4 Гц), + 8,01 (д, 1H, J=7,5 Гц), 8,23 (д, 1H, J=8,4 Гц); РХ-МС: m/e=373 [M+1] b) N-(2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4іл)метансульфонамід До розчину 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-аміну (186 мг), Et3N (0.15 мл) та ДХМ (20 мл) додавали розчин метансульфонілхлориду (69 мг) в ДХМ при 0 °C та потім суміш струшували при кімнатній температурі протягом 1 години. Суміш розбавляли ДХМ та промивали сольовим розчином, сушили над безводним Na 2SO4, фільтрували та концентрували в вакуумі. Залишок далі очищували шляхом силікагелевої хроматографії, елюювали сумішшю MeOH: ДХМ = 1: 30, одержуючи бажаний продукт у вигляді 1 твердої речовини (180 мг, 80 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,40 (с, 3H), 2,98 (т, 4H, J=4,8Hz), 3,21 (с, 3H), 3,68 (т, 4H, J=4,8Hz), 5,96 (с, 2H), 6,37 (д, 1H, J=8,1Hz), 6,80 (с, 2H), 7,35 (т, 1H, J=8,1Hz), 7,60-7,71 (м, 2H), 7,85 (д, 1H, J=8,1Hz), 8,01 (д, 1H, J=8,1Hz), 8,24 (д, 1H, + J=8,1Hz), 9,49 (ш с, 1H); РХ-МС: m/e=451 [M+1] . Приклад5 OH N Me N N O 30 Одержання 2-метил-6-(4-морфолініл)-1-(1-нафталінілметил)-1H-бензімідазол-4-олу a) 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-амін NH2 N Me N N O 35 TiCl3 (19,7 мл) додавали до розчину 4-(2-метил-3-(нафталін-1-ілметил)-7-нітро-3Hбенз[d]імідазол-5-іл)морфоліну (1,82 г), який одержували за тією самою методикою, що описана 26 UA 107845 C2 5 10 15 20 в прикладі 4, та NH4OAc (4,85 г) в MeOH (150 мл). Після струшування протягом 7 хвилин при кімнатній температурі, ТШХ показала відсутність залишків вихідної речовини. pH суміші робили основним шляхом додавання водного розчину Na2CO3. Розчинник видаляли при зниженому тиску, та залишок екстрагували ДХМ (250 мл×2). Об'єднані органічні шари промивали сольовим розчином, сушили над безводним Na2SO4, фільтрували та концентрували в вакуумі, одержуючи 1 бажаний продукт у вигляді білої твердої речовини (1,52 г, 91 %). H ЯМР (300 МГц, CDCl3) δ м.ч. 2,47 (с, 3H), 3,02 (т, 4H, J=4,8 Гц), 3,78 (т, 4H, J=4,8 Гц), 4,30 (с, 2H), 5,68 (с, 2H), 6,05 (д, 1H, J=1,8 Гц), 6,25 (д, 1H, J=1,8 Гц), 6,56 (д, 1H, J=7,5 Гц), 7,27 (т, 1H, J=7,5 Гц), 7,55-7,66 (м, 2H), 7,77 (д, 1H, J=8,1 Гц), 7,93 (д, 1H, J=8,1 Гц), 8,05 (д, 1H, J=8,1 Гц); РХ-МС: m/e=373 [M+1]+. b) 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-ол До розчину 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-аміну (842 мг) в H2O (20 мл), MeOH (1 мл) та конц. H2SO4 (3 мл) по краплям при 0 °C додавали водний розчин NaNO2 (344 мг). Суміш струшували при 0 °C протягом 15 хвилин та потім струшували при температурі кипіння зі зворотним холодильником пртягом 1 години. Суміш охолоджували до кімнатної температури та pH нейтралізували водним розчином NaHCO 3. Суміш екстрагували ДХМ (100 мл×3). Об'єднані органічні шари промивали сольовим розчином, сушили над безводним Na2SO4, фільтрували та концентрували в вакуумі. Залишок далі очищували шляхом силікагелевої хроматографії, елюювали сумішшю MeOH: ДХМ = 1: 60, та потім використовуючи + препаративну хроматографію, одержуючи сирий бажаний продукт РХ-МС: m/e=374 [M+1] , що містить домішки, які видаляли за допомогою дво-стадійного циклу, який описано нижче. c) 4-{[(1,1-диметилетил)(дифеніл)силіл]окси}-2-метил-6-(4-морфолініл)-1-(1нафталінілметил)-1H-бензімідазол O Si N Me N N O 25 30 35 40 45 Суміш сирого 2-метил-6-морфолін-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-олу (200 мг), імідазолу (73 мг) та TBDPSCl (162 мг) в сухому ДХМ (30 мл) струшували при кімнатній температурі протягом 1 години. РХ-МС аналіз показав бажаний продукт, тому розчинник видаляли в вакуумі. Залишок очищували шляхом силікагелевої хроматографії, елюювали сумішшю EtOAc: петролейний етер = 1: 2, одержуючи TBDP етер бажаного продукту у вигляді 1 білої твердої речовини (260 мг, 79 %). H ЯМР (300 МГц, CDCl3) δ м.ч. 1,24 (с, 9H), 2,53-2,56 (м, 7H), 3,55(т, 4H, J=4,8 Гц), 5,69 (с, 2H), 5,92 (д, 1H, J=1,8 Гц), 6,12 (д, 1H, J=1,8 Гц), 6,55 (д, 1H, J=7,5 Гц), 7,25-7,45 (м, 7H), 7,56-7,67 (м, 2H), 7,78 (д, 1H, J=8,7 Гц), 7,84-7,87 (м, 4H), 7,94 (д, 1H, J=7,5 Гц), 8,06 (д, 1H, J=8,7 Гц); РХ-МС: m/e=612 [M+1]+. d) 2-метил-6-морфолінo-1-(нафталін-1-ілметил)-1H-бенз[d]імідазол-4-ол До розчину 4-{[(1,1-диметилетил)(дифеніл)силіл]окси}-2-метил-6-(4-морфолініл)-1-(1нафталінілметил)-1H-бензімідазолу в ТГФ (50 мл) додавали TBAF (0,64 мл, 1 моль/л) при кімнатній температурі та суміш струшували протягом 1 години. ТШХ показала витрату вихідної речовини. Розчинник видаляли в вакуумі та залишок очищували шляхом силікагелевої хроматографії, елюювали сумішшю MeOH: ДХМ = 1: 60, одержуючи бажаний продукт у вигляді 1 білої твердої речовини (150 мг, 94 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,36 (с, 3H), 2,94 (т, 4H, J=4,8 Гц), 3,65 (т, 4H, J=4,8 Гц), 5,87 (с, 2H), 6,30 (д, 1H, J=1,8 Гц), 6,35 (д, 1H, J=1,8 Гц), 6,39 (д, 1H, J=7,5 Гц), 7,35 (т, 1H, J=7,5 Гц), 7,60-7,71 (м, 2H), 7,86 (д, 1H, J=8,4 Гц), 8,01 (д, 1H, J=7,5 Гц), 8,23 (д, 1H, J=8,4 Гц); РХ-МС: m/e=374[M+1]+ Приклад 6 27 UA 107845 C2 OMe N Me N N O Cl Cl 5 Одержання 1-[(2,3-дихлорфеніл)метил]-2-метил-4-(метилокси)-6-(4-морфолініл)-1Hбензімідазолу a) 2-метокси-6-нітробензоламін NH2 NO2 MeO 10 15 До суміші 2-аміно-3-нітрофенолу (19,25 г) та K2CO3 (19 г) в ДМФ (100 мл) додавали MeI (11 мл) при кімнатній температурі та суміш струшували протягом ночі та потім виливали у воду. Одержаний в результаті осад збирали фільтруванням та тверду речовину промивали водою, 1 одержуючи бажаний продукт (19 г, 90 %). H ЯМР (300 МГц, CDCl3) δ м.ч. 3,92 (с, 1H), 6,43 (ш с, 1H), 6,61 (дд, 1H, J=7,5, 9,0 Гц), 6,89 (дд, 1H, J=0,9, 7,5 Гц), 7,73 (дд, 1H, J=0,9, 9,0 Гц); РХ-МС: m/e=169 [M+1]+ b) 4-бром-2-метокси-6-нітробензоламін NH2 NO2 MeO Br 20 NaOAc (17,6 г) та Br2 (6,76 мл) додавали до розчину 2-метокси-6-нітробензоламіну (21,74 г) в HOAc (250 мл). Суміш струшували при кімнатній температурі протягом 20 хвилин. Одержаний в результаті осад фільтрували, промивали водою та сушили в вакуумі, одержуючи бажаний 1 продукт у вигляді жовтої твердої речовини (26,43 г, 83 %). H ЯМР (300 МГц, ДМСО-d6) δ 3,91 (с, + 3H), 7,18 (д, 1H, J=1,8 Гц), 7,70 (д, 1H, J=1,8 Гц); РХ-МС: m/e=247 [M+1] . c) N-(4-бром-2-метокси-6-нітрофеніл)ацетамід 25 O HN NO2 MeO Br 30 До розчину 4-бром-2-метокси-6-нітробензоламіну (27,85 г) в HOAc (150 мл) та Ac 2O (17 мл) додавали конц. H2SO4 при 70 °C та суміш струшували при 70 °C протягом 30 хвилин та витримували при кімнатній температурі протягом ночі. Утворений осад збирали фільтруванням та промивали гексаном, одержуючи бажаний продукт у вигляді світло-жовтої твердої речовини 1 (24,45 г, 75 %). H ЯМР (300 МГц, ДМСО-d6) δ м.ч. 2,01 (с, 3H), 3,92 (с, 3H), 7,61 (д, 1H, J=1,8 Гц), 7,65 (д, 1H, J=1,8 Гц), 9,91(с, 1H); РХ-МС: m/e=289 [M+1]+ d) N-(2-метокси-4-морфолін-6-нітрофеніл)ацетамід 35 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives aspi3 kinase inhibitors
Автори англійськоюQu, Junya, Rivero, Ralph, Sanchez, Robert, Tedesco, Rosanna
Автори російськоюЦюй Дзюнья, Риверо Ральф, Санчез Роберт, Тедеско Розанна
МПК / Мітки
МПК: C07D 235/08, C07D 413/04, C07D 235/24, A01N 43/52, A61K 31/4164, C07D 235/10
Мітки: похідні, бензимідазолу, інгібітори, pі3-кінази
Код посилання
<a href="https://ua.patents.su/93-107845-pokhidni-benzimidazolu-yak-ingibitori-pi3-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні бензімідазолу як інгібітори pi3-кінази</a>
Попередній патент: Спосіб очистки підземних вод від стійких форм органічних та залізоорганічних сполук
Наступний патент: Спосіб комплексної переробки сланей ламінарії з отриманням засобів з широким спектром терапевтичної дії
Випадковий патент: Спосіб збагачування дрібних класів вугілля у важких суспензіях