Полінуклеотидна вакцина на основі плазмідної днк, імуногенна композиція(варіанти)
Номер патенту: 42715
Опубліковано: 15.11.2001
Автори: Шівер Джон В., Алмер Джеффрі Б., Доннеллі Джон Дж., Монтгомері Донна Л., Ліу Маргарет А., Паркер С'юзанн Е., Дваркі Варавані Дж.
Формула / Реферат
1. Полинуклеотидная вакцина на основе плазмидной ДНК, содержащая ген нуклеопротеина вируса гриппа, оперативно связанный с регуляторной последовательностью, причем указанная полинуклеотидная вакцина на основе плазмидной ДНК способна индуцировать специфичный иммунный ответ на вирус гриппа при введении в клетки млекопитающего in vivo, причем указанная полинуклеотидная вакцина на основе плазмидной ДНК содержит регуляторную последовательность, которая представляет собой промотор цитомегаловируса с последовательностью интрона А (1,63 т.п.н.), терминатор транскрипции, который представляет собой терминатор транскрипции бычьего гормона роста (0,55 т.п.н.), бактериальную область начала репликации, которая представляет собой ori (0,64 т.п.н.) и определяемый маркер, который представляет собой ген устойчивости к канамицину (1,30 т.п.н.).
2. Полинуклеотидная вакцина на основе плазмидной ДНК по п. 1, выбранная из
а) плазмиды V1J-PR-NP, 5'-концом которой является последовательность
б) плазмиды VlJneo-BJ-NP, 5'-концом которой является последовательность
a 3'-концом которой является последовательность
в) плазмиды VlJneo – TX - NP, 5'-концом которой является последовательность
а .3' -концом которой является последовательность
г) плазмиды VlJns-BJ-NP (A/Beijing /353/89), размер конструкта 6,42 т.п.н., 5' - концом которой является последовательность
а 3' - концом которой является последовательность;
д) плазмиды VlJns - PA-NP (B/Panama/45/90), размер конструкта 6,54 т.п.н., 5'-концом которой является последовательность
а 3' - концом которой является последовательность
где V1J описана как последовательность
VlJneo описана как последовательность
VlJns представляет собой VlJneo, где сайт Kpnl заменен сайтом Sfil, и V1R представляет собой последовательность
3. Иммуногенная композиция, состоящая из полинуклеотидной вакцины на основе плазмидной ДНК, охарактеризованной в п. 1.
4. Иммуногенная композиция, состоящая из полинуклеотидной вакцины на основе плазмидной ДНК, охарактеризованной в п. 2.
Текст
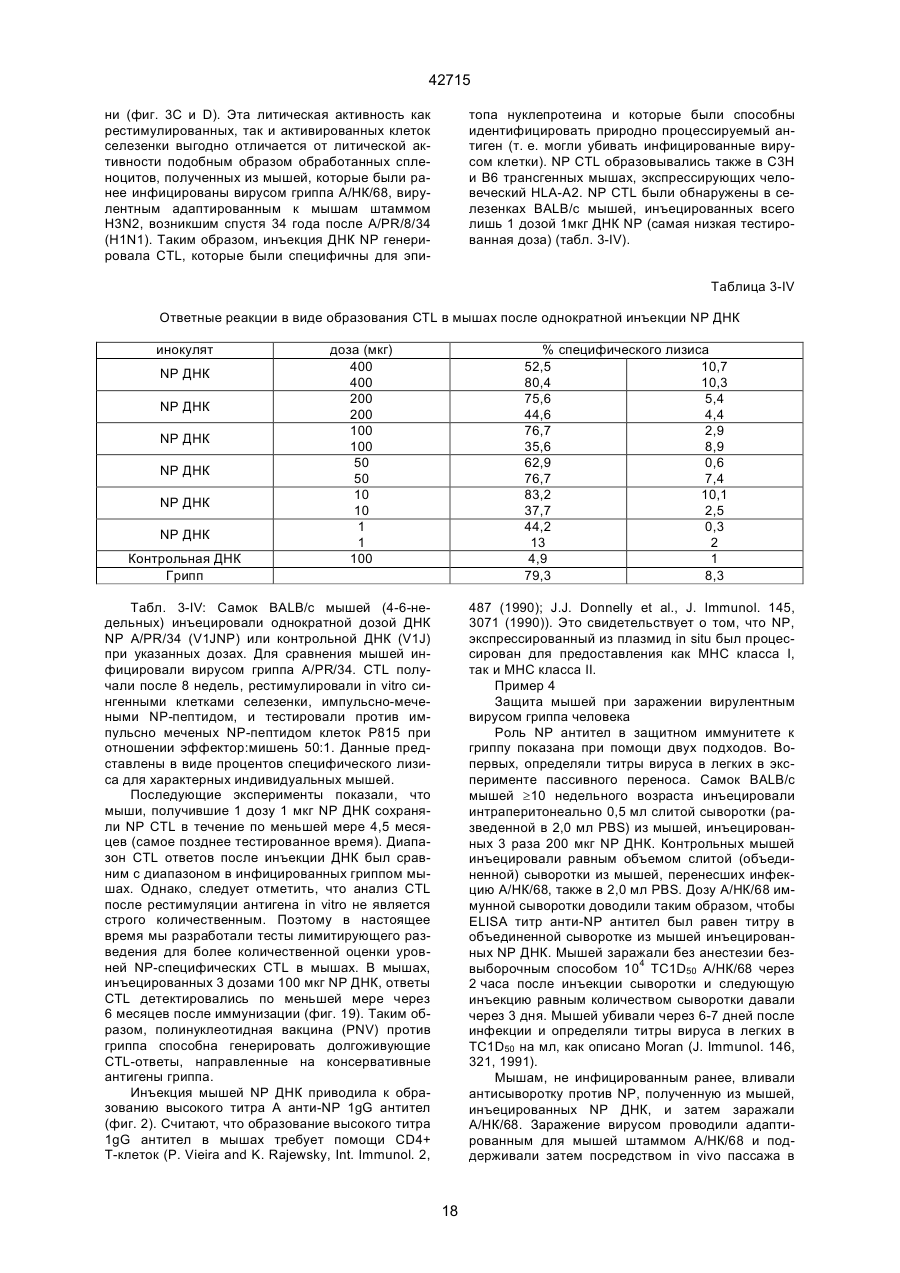
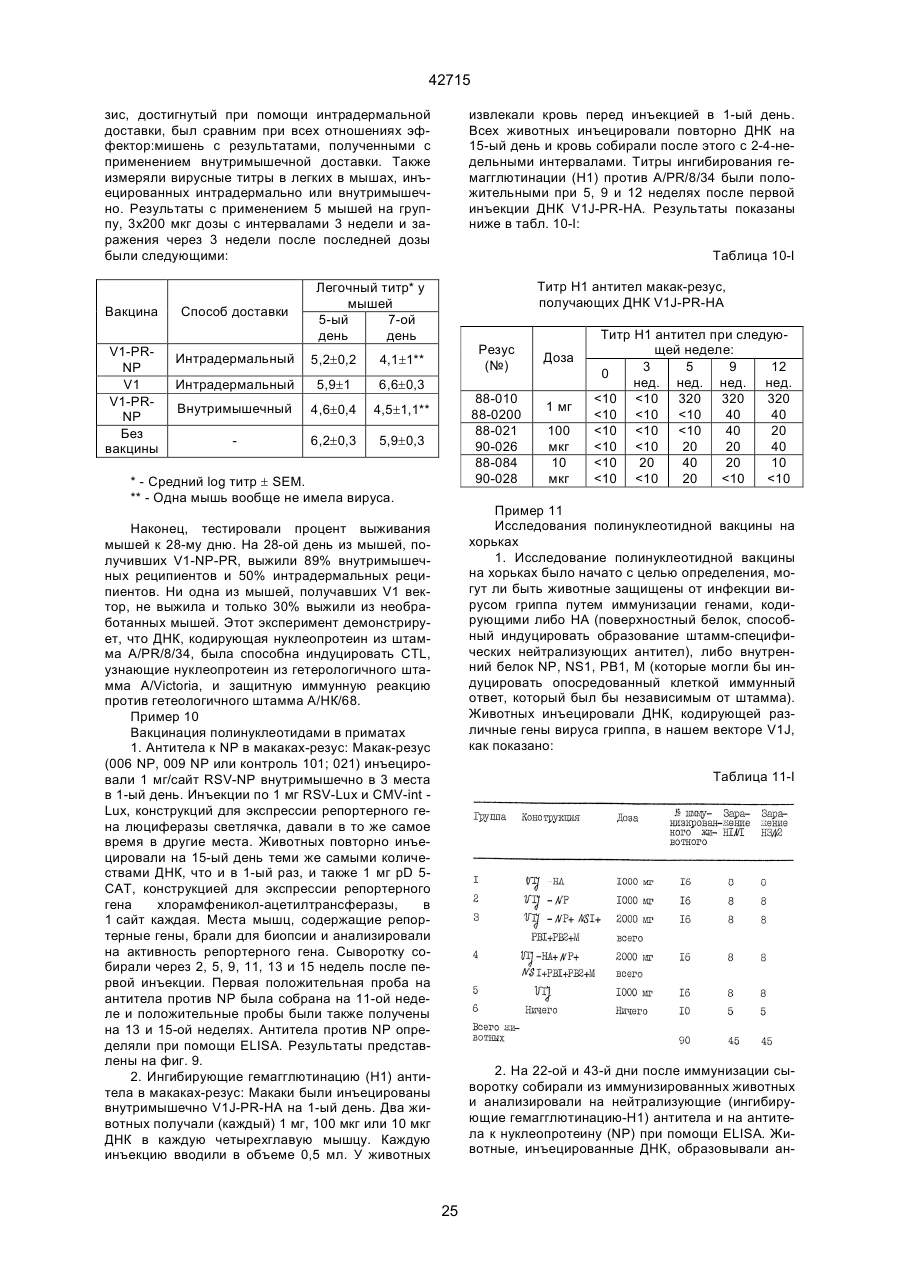
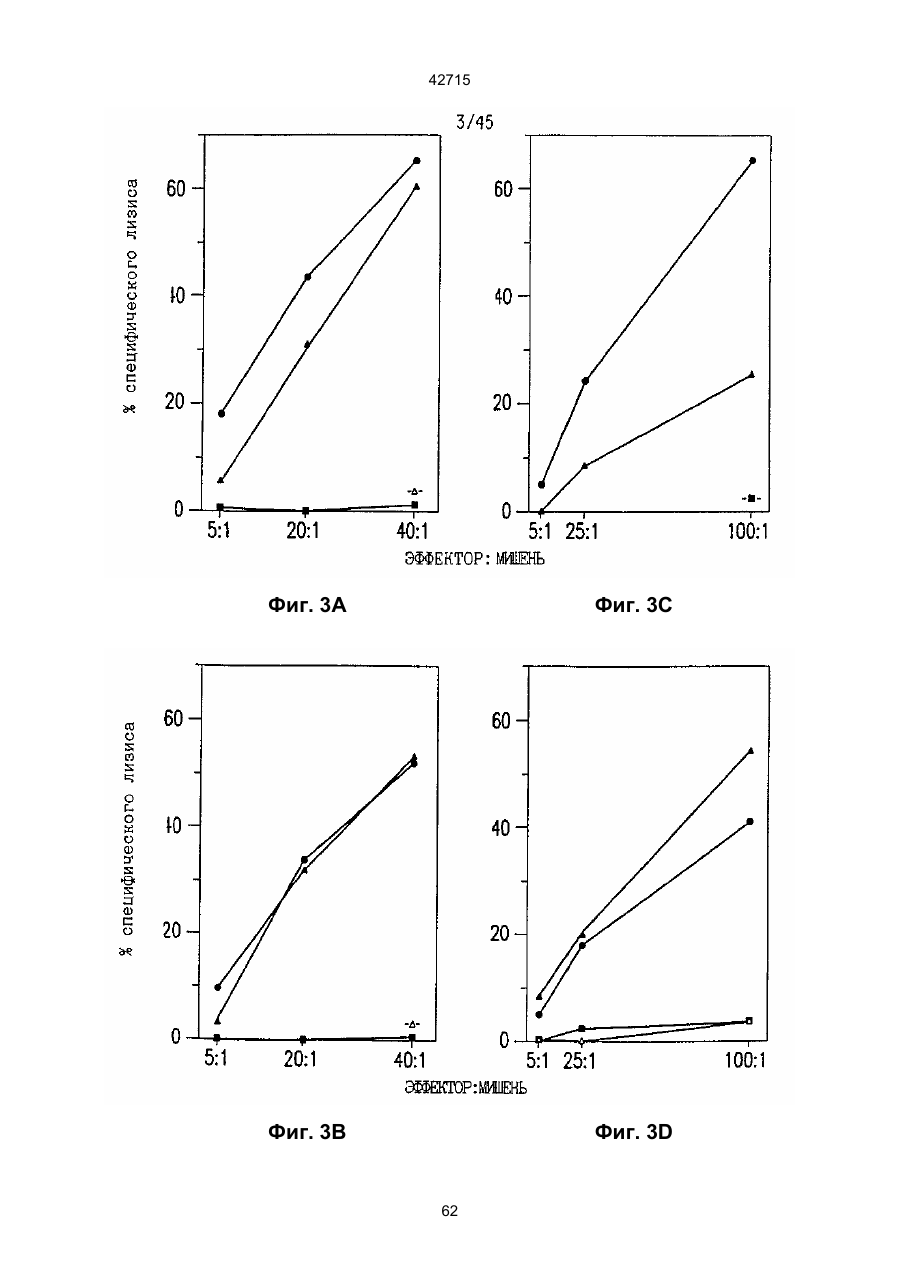
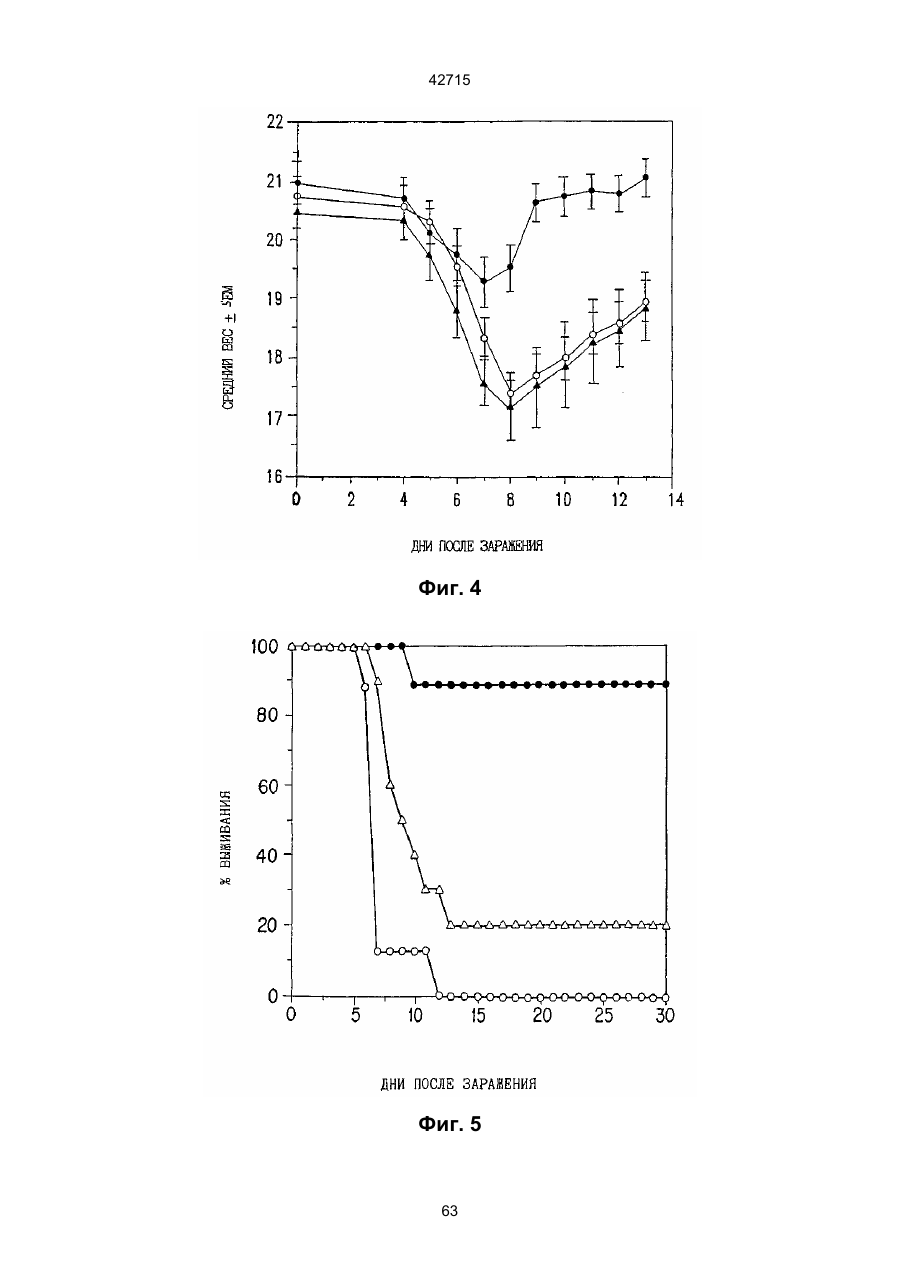
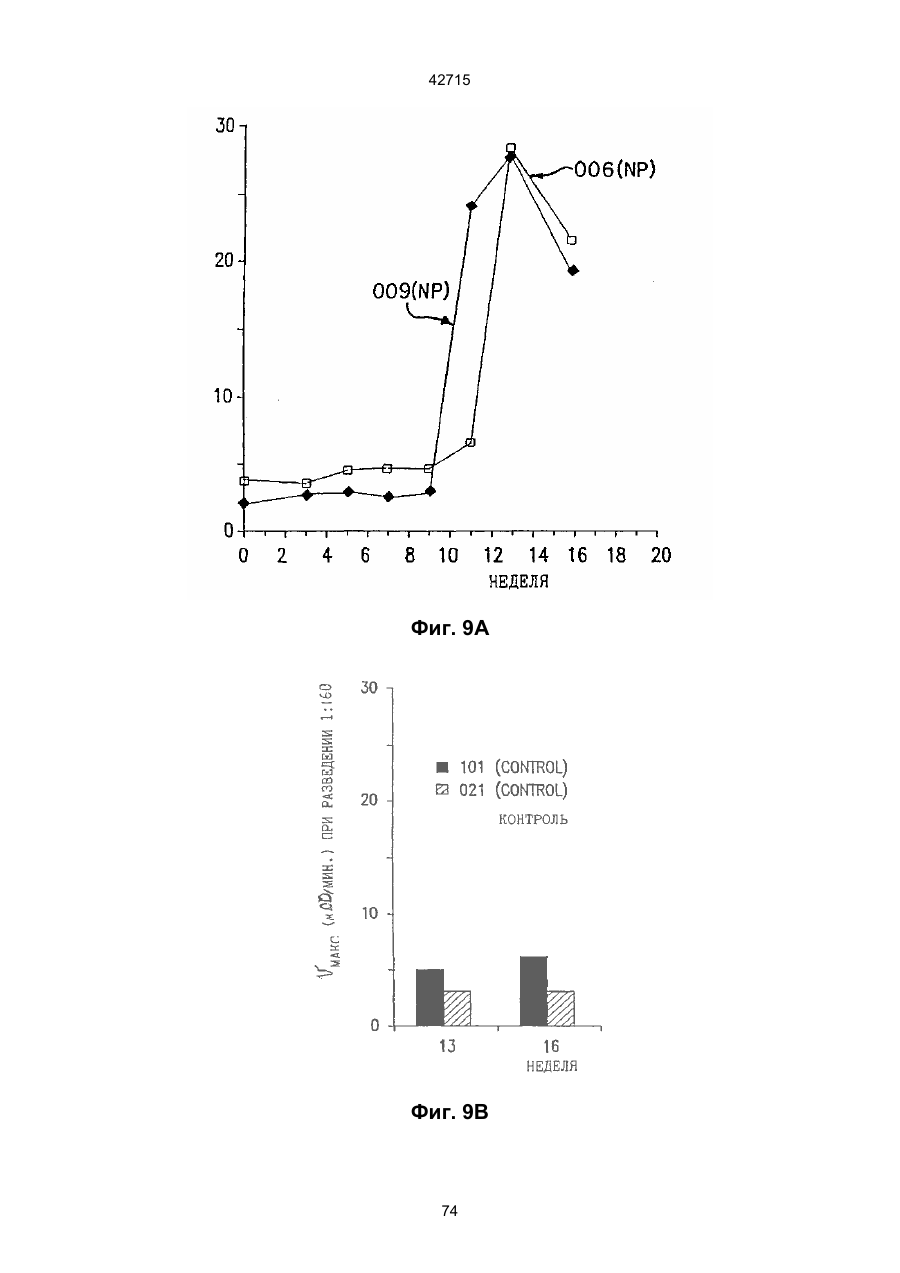
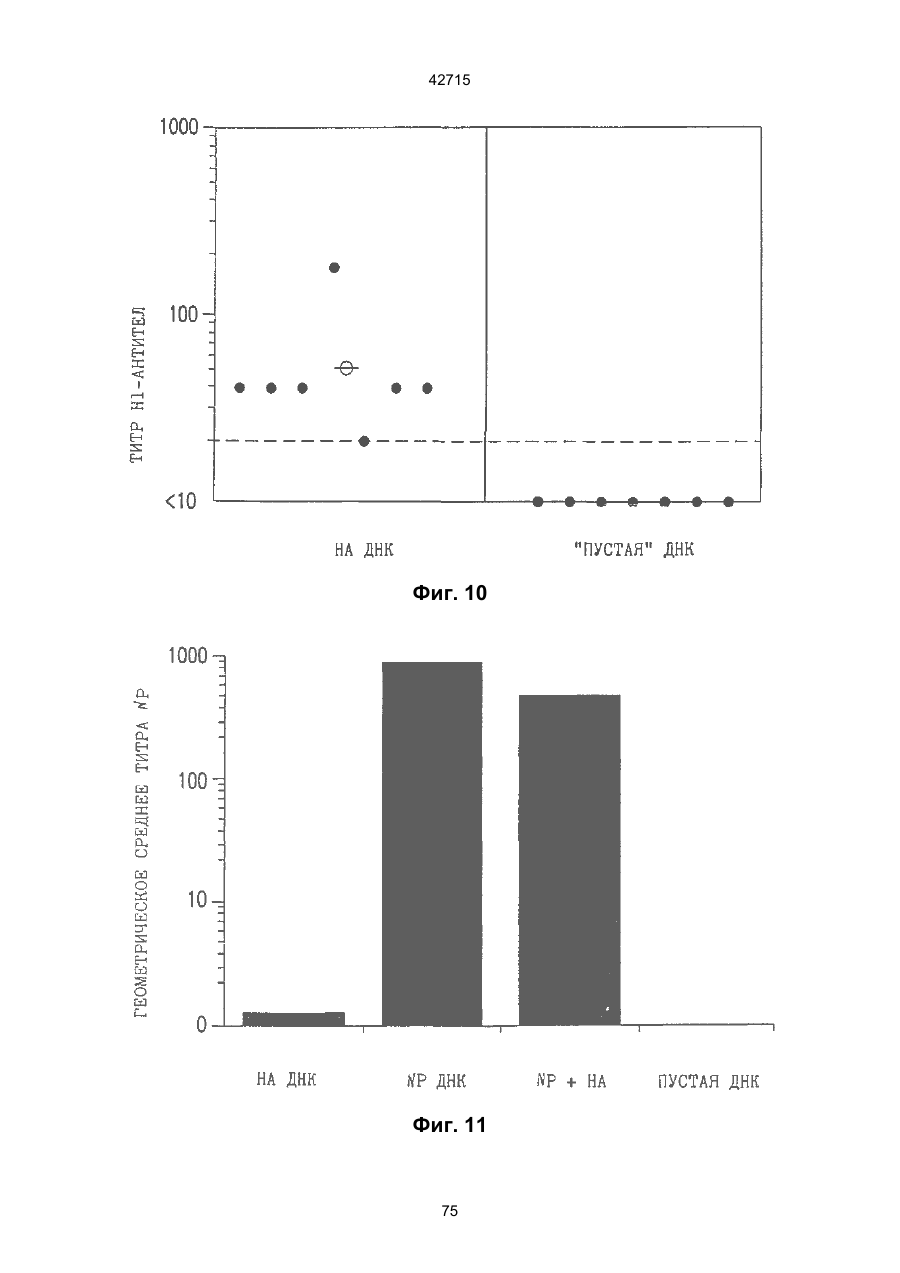
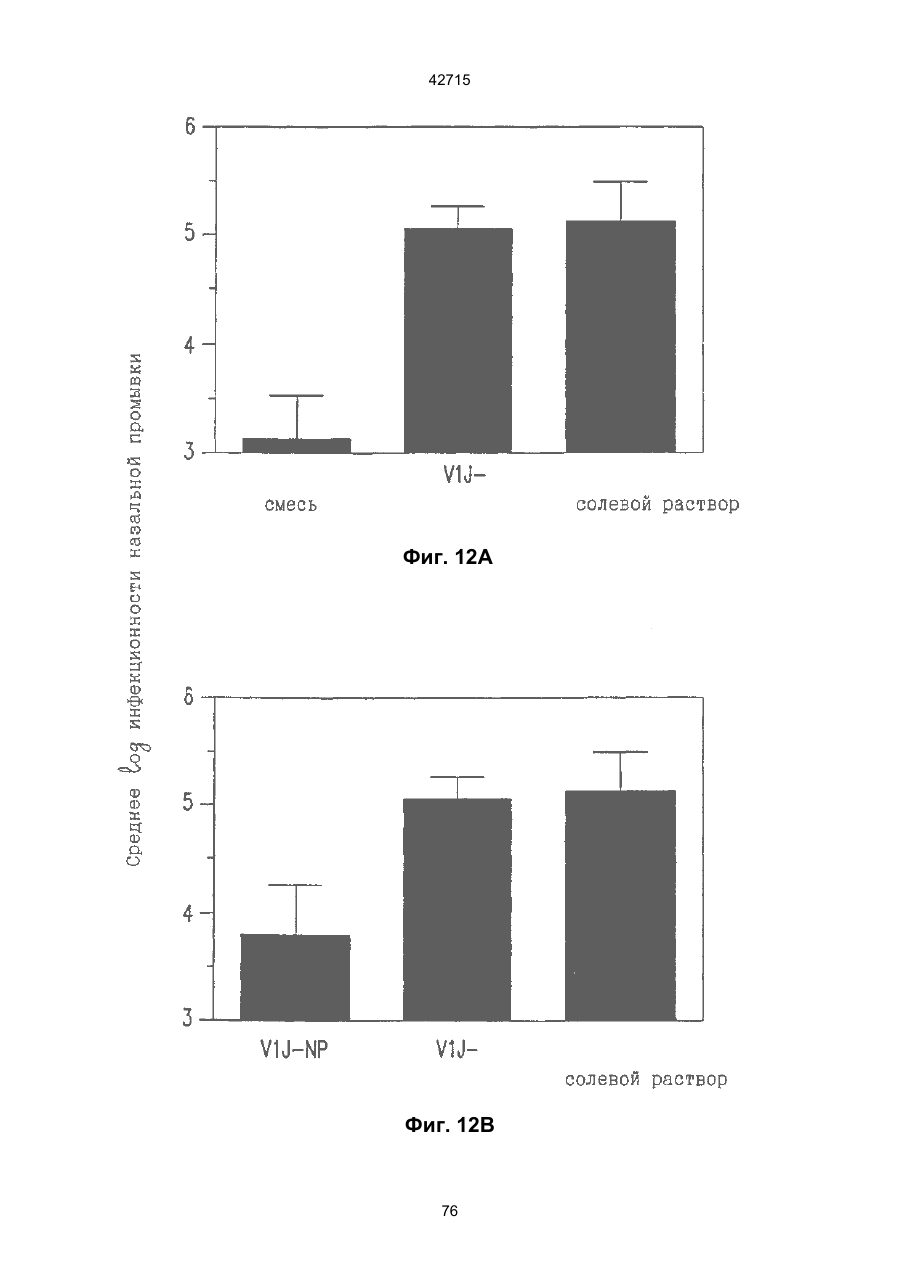
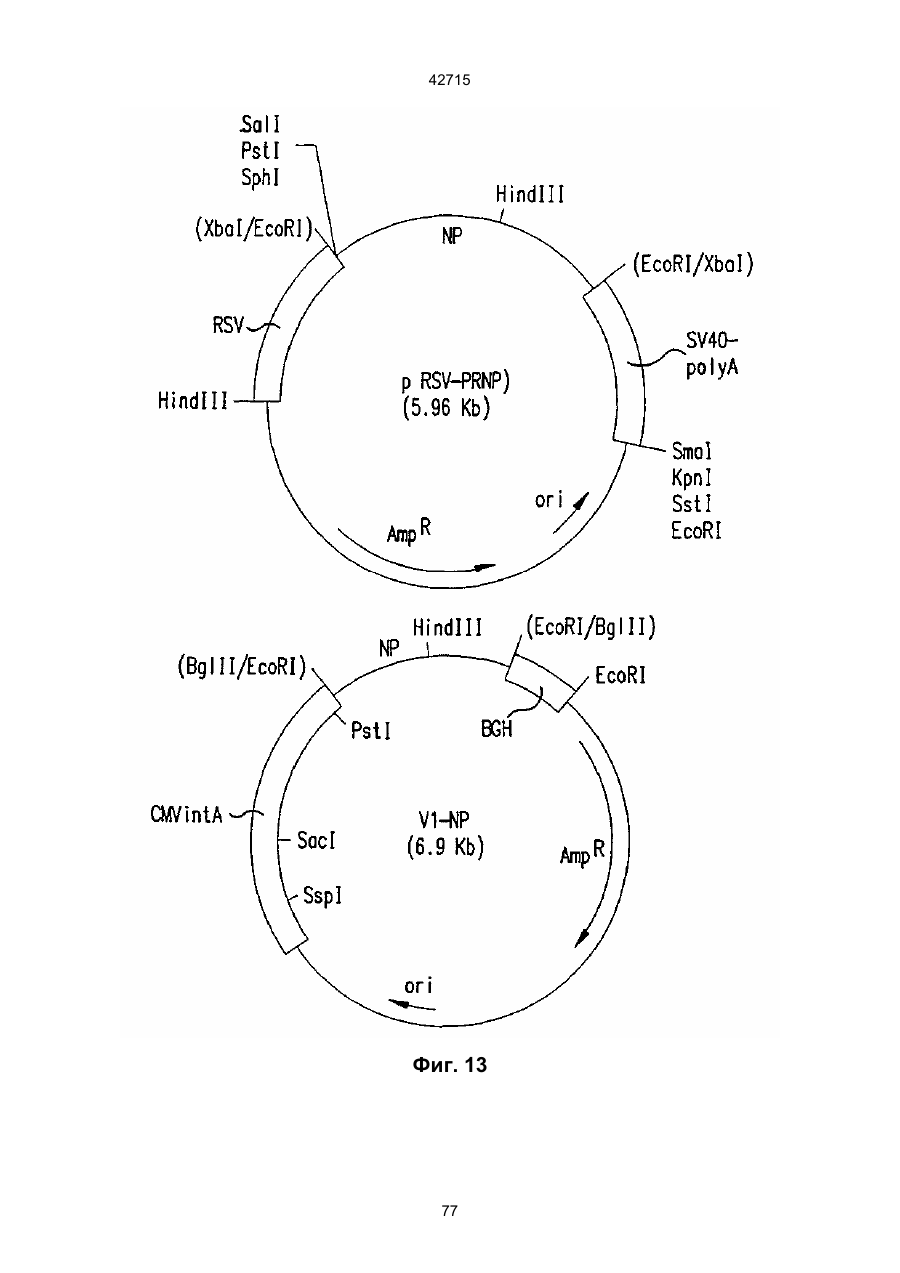
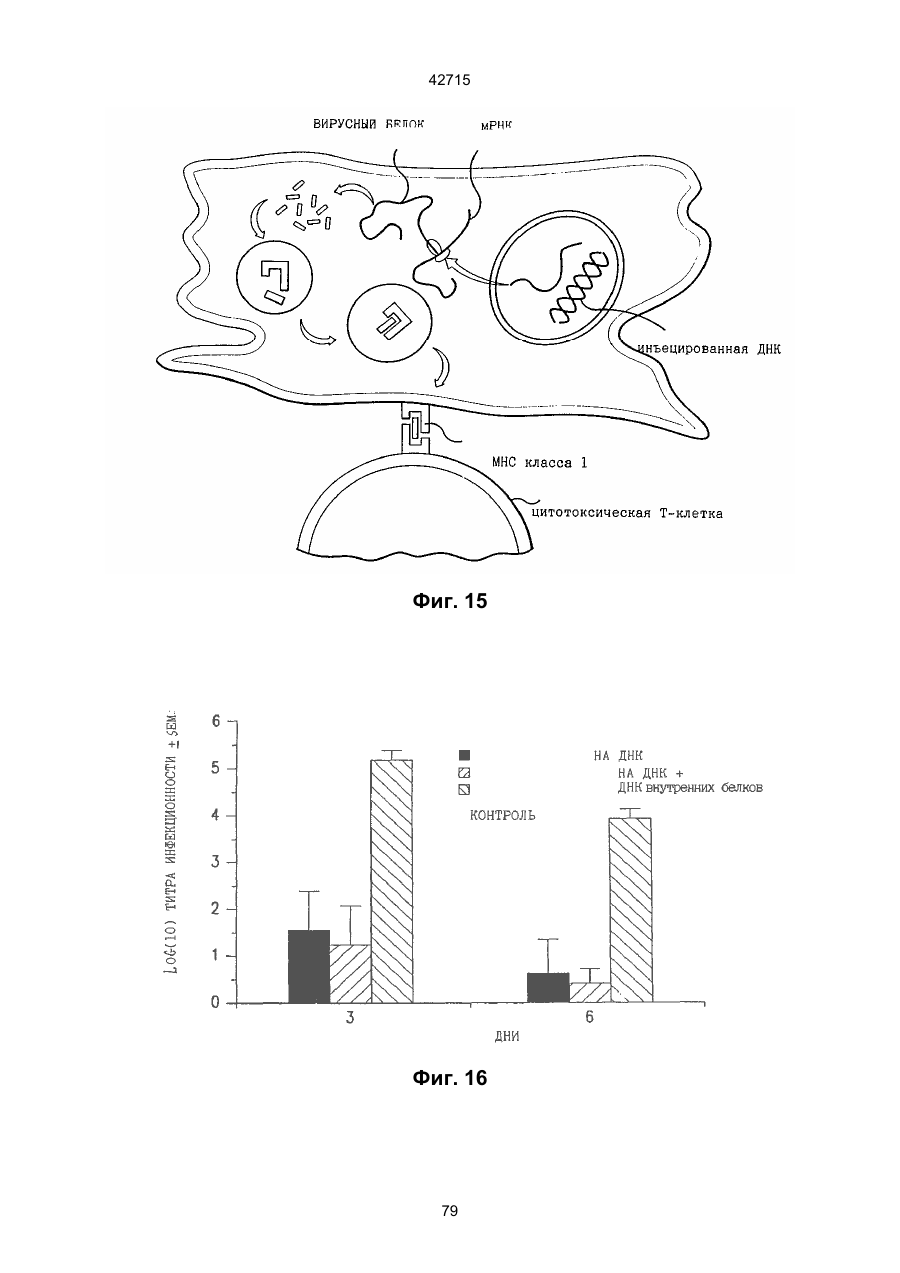
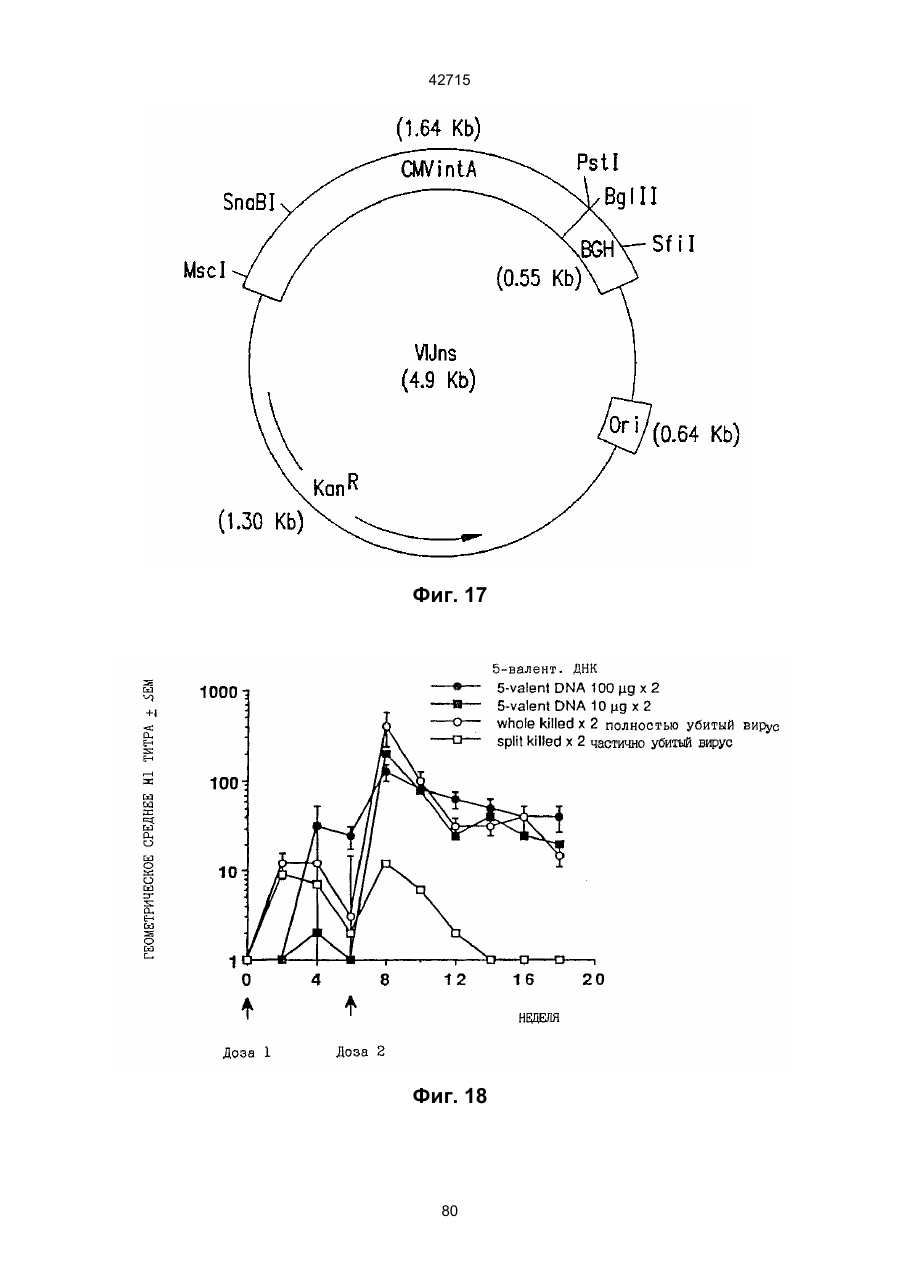
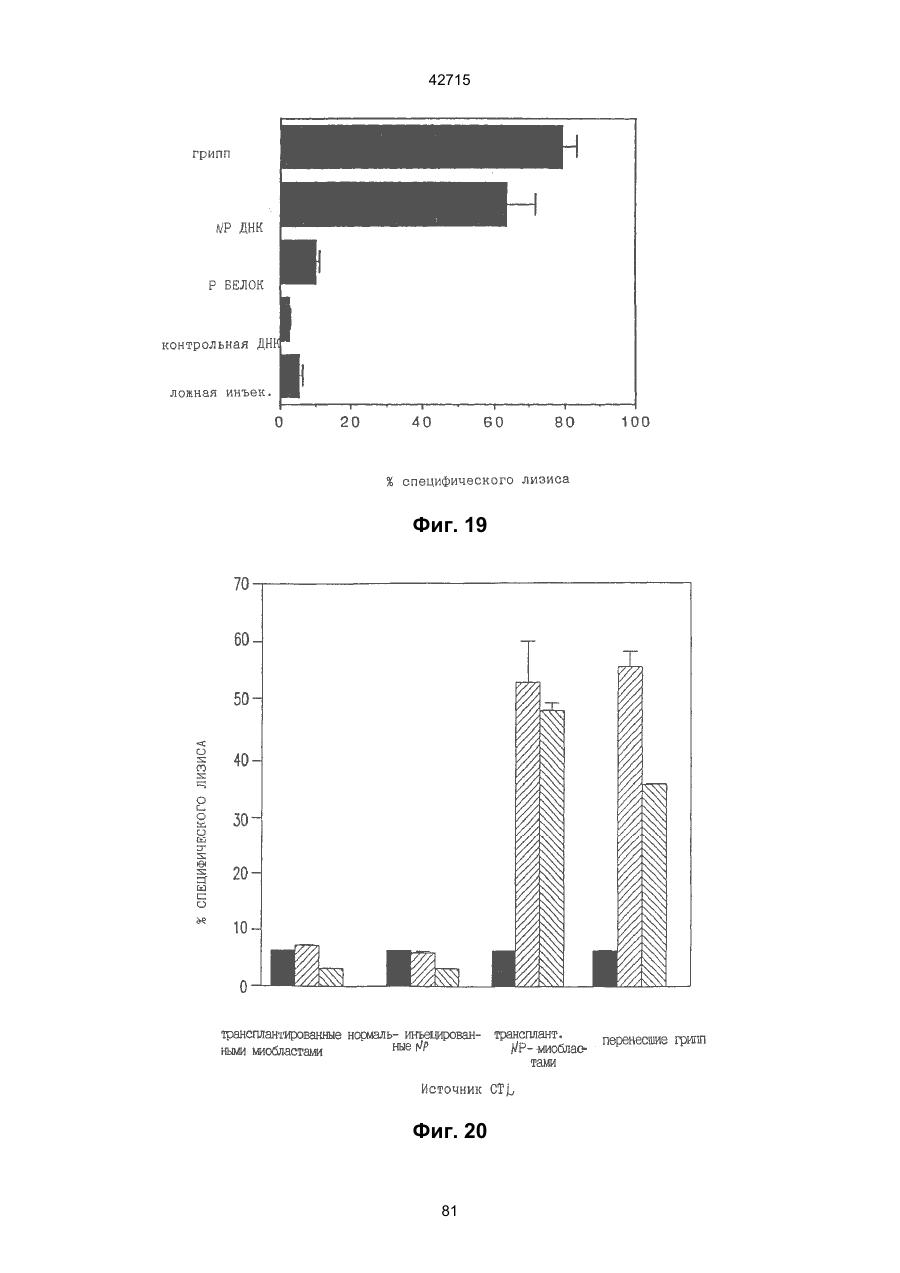
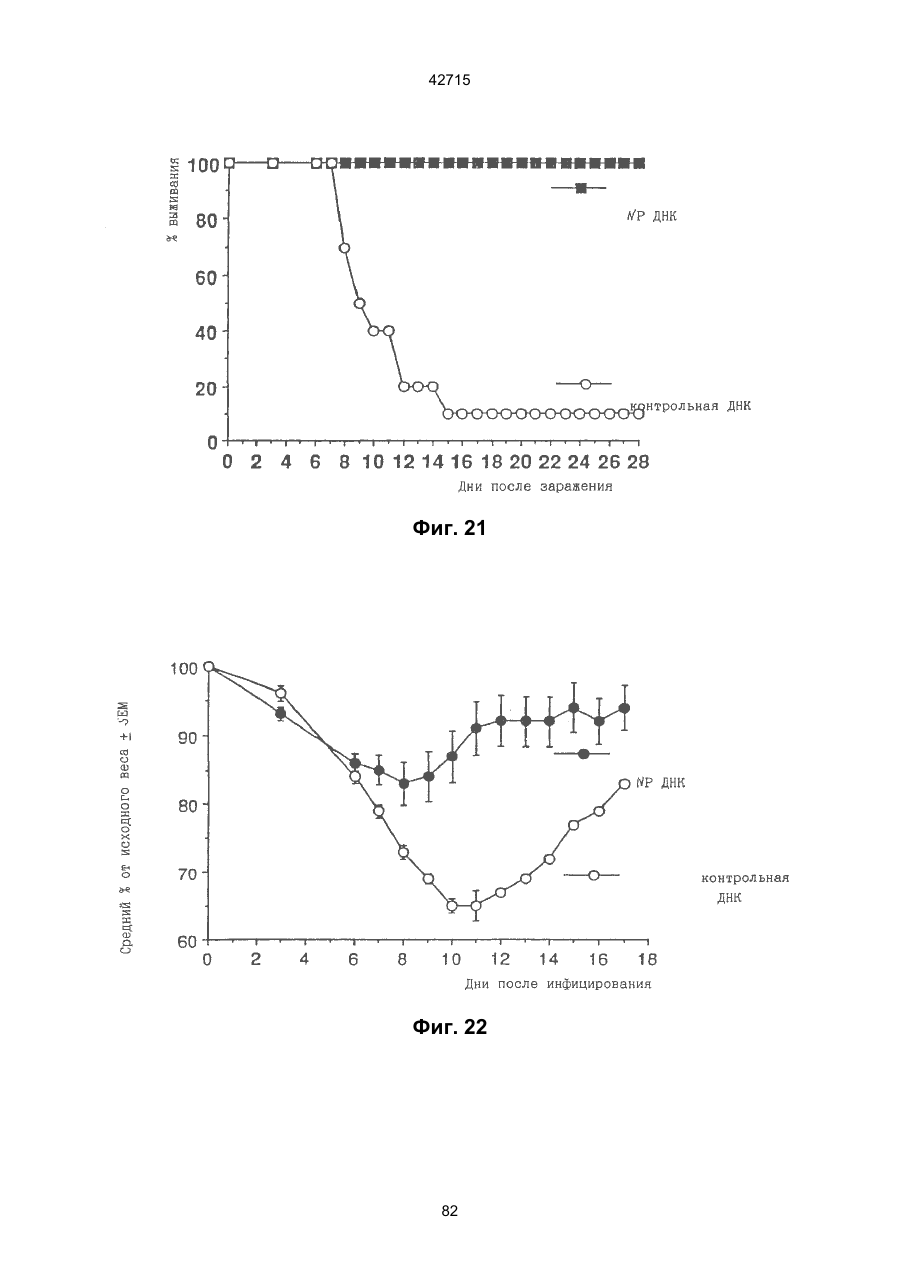
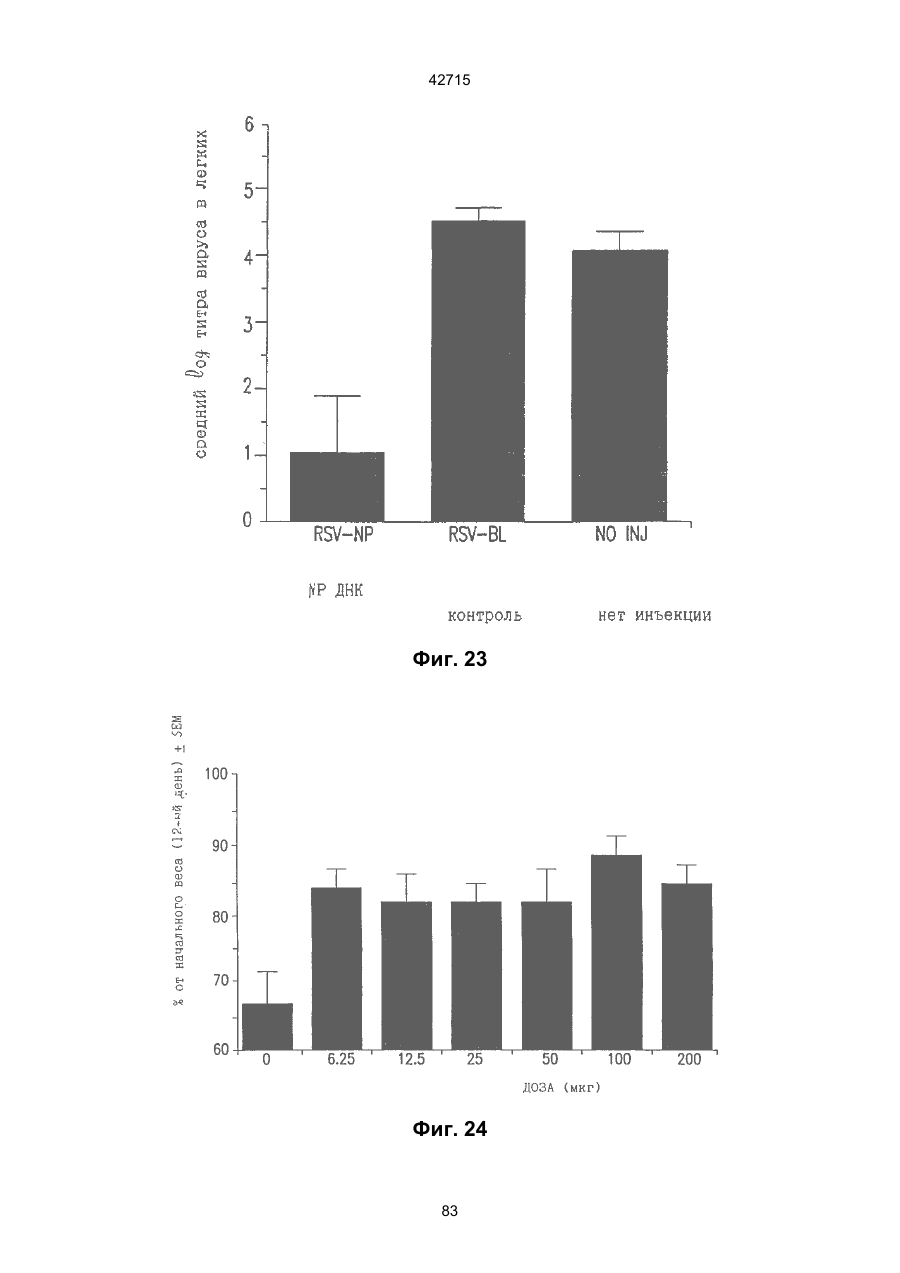
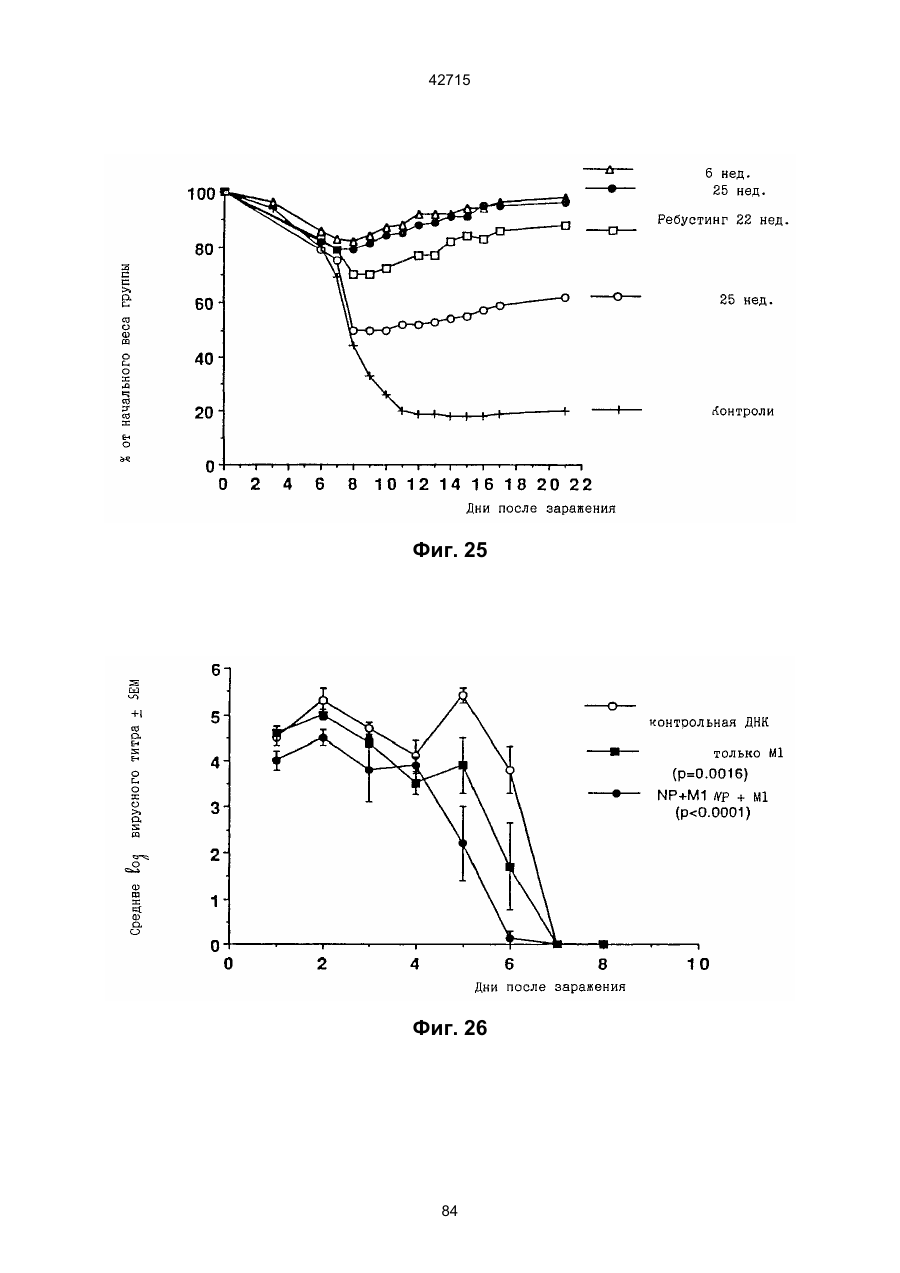
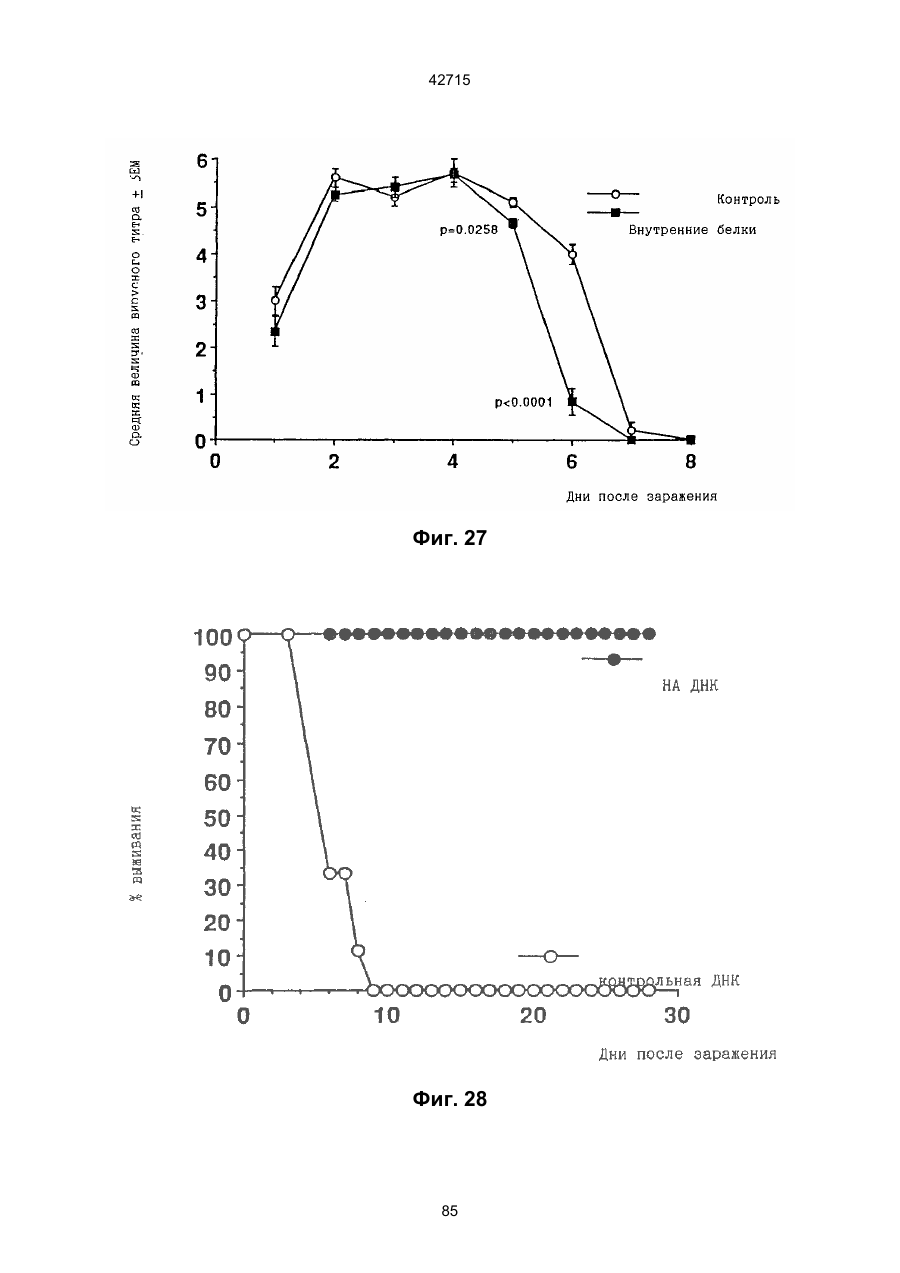
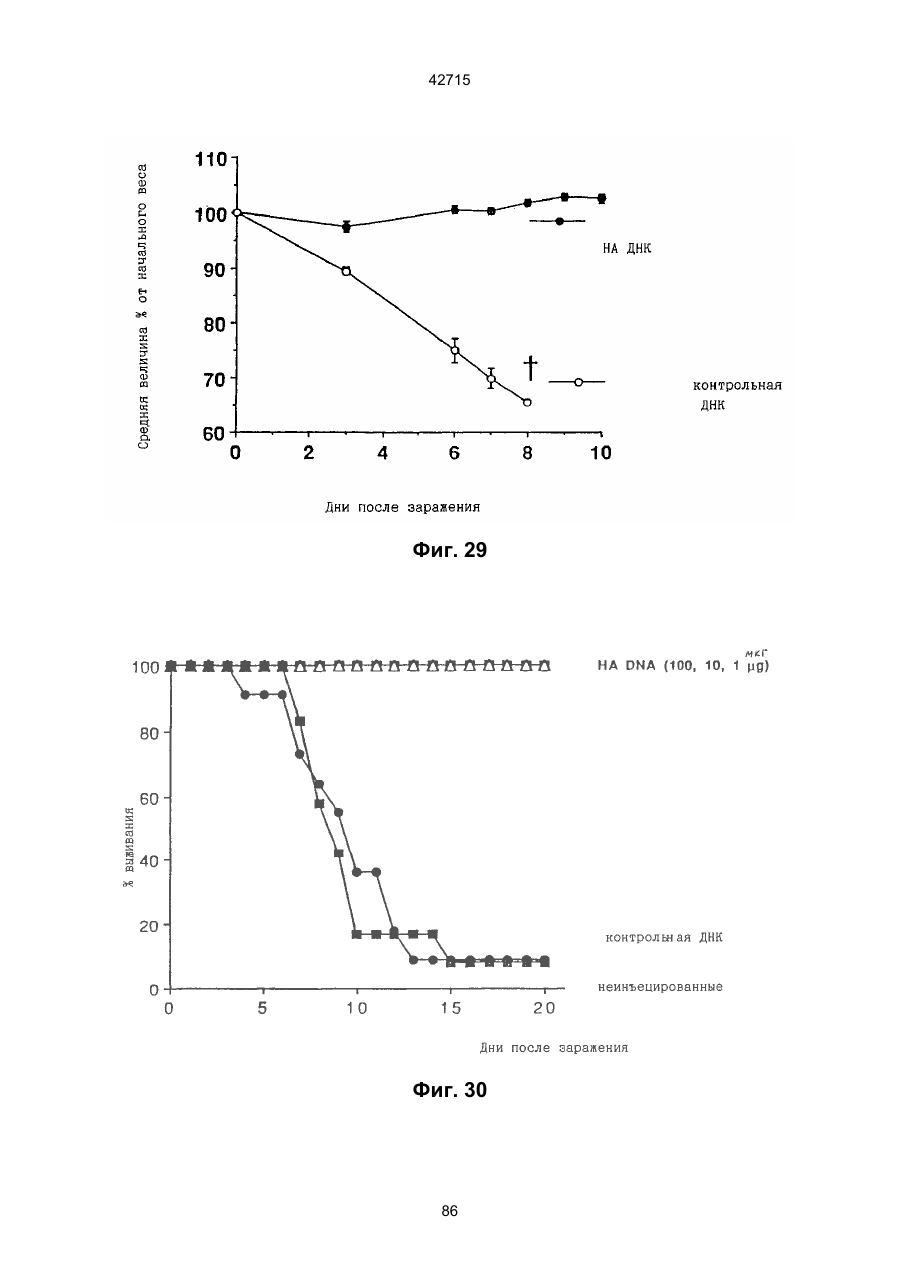
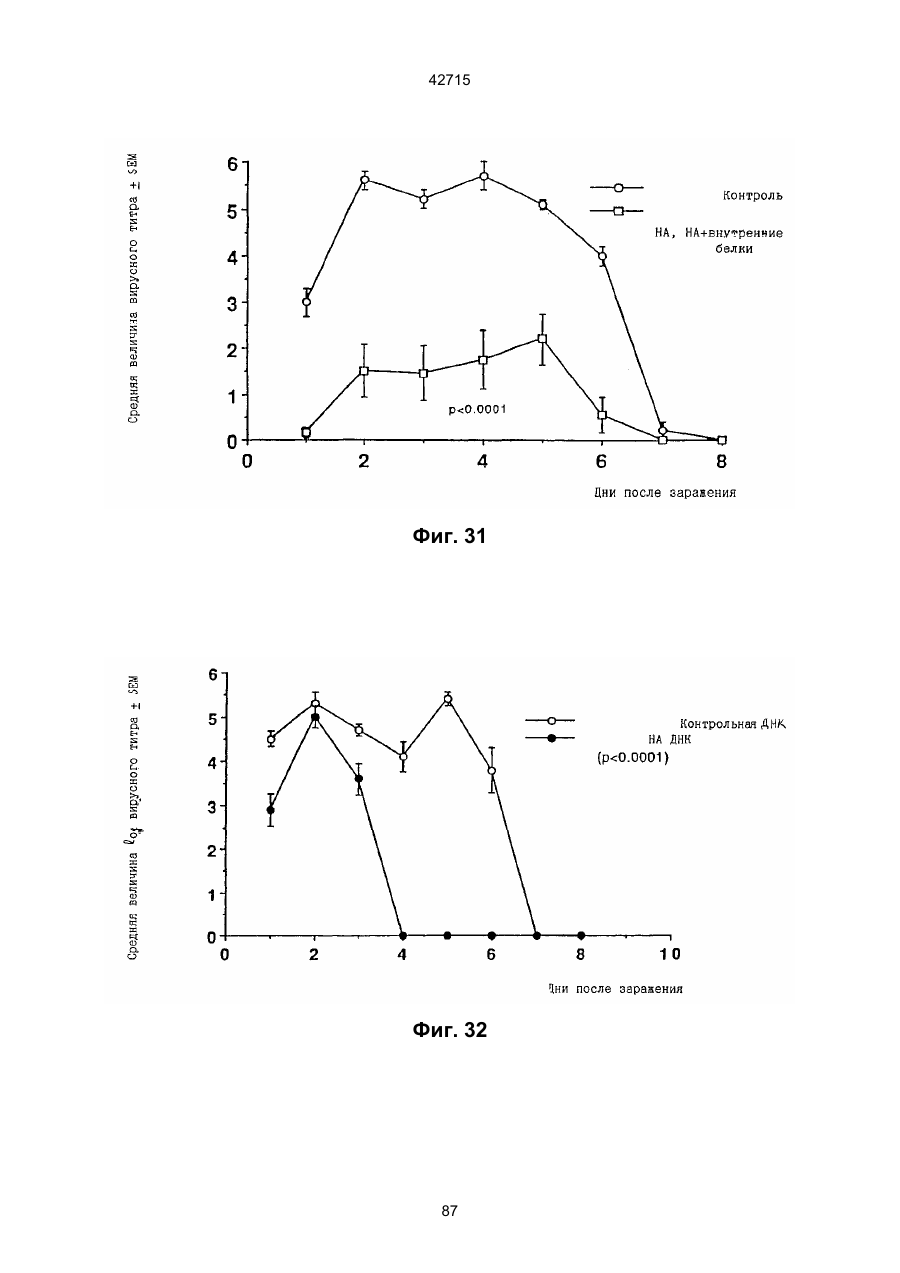
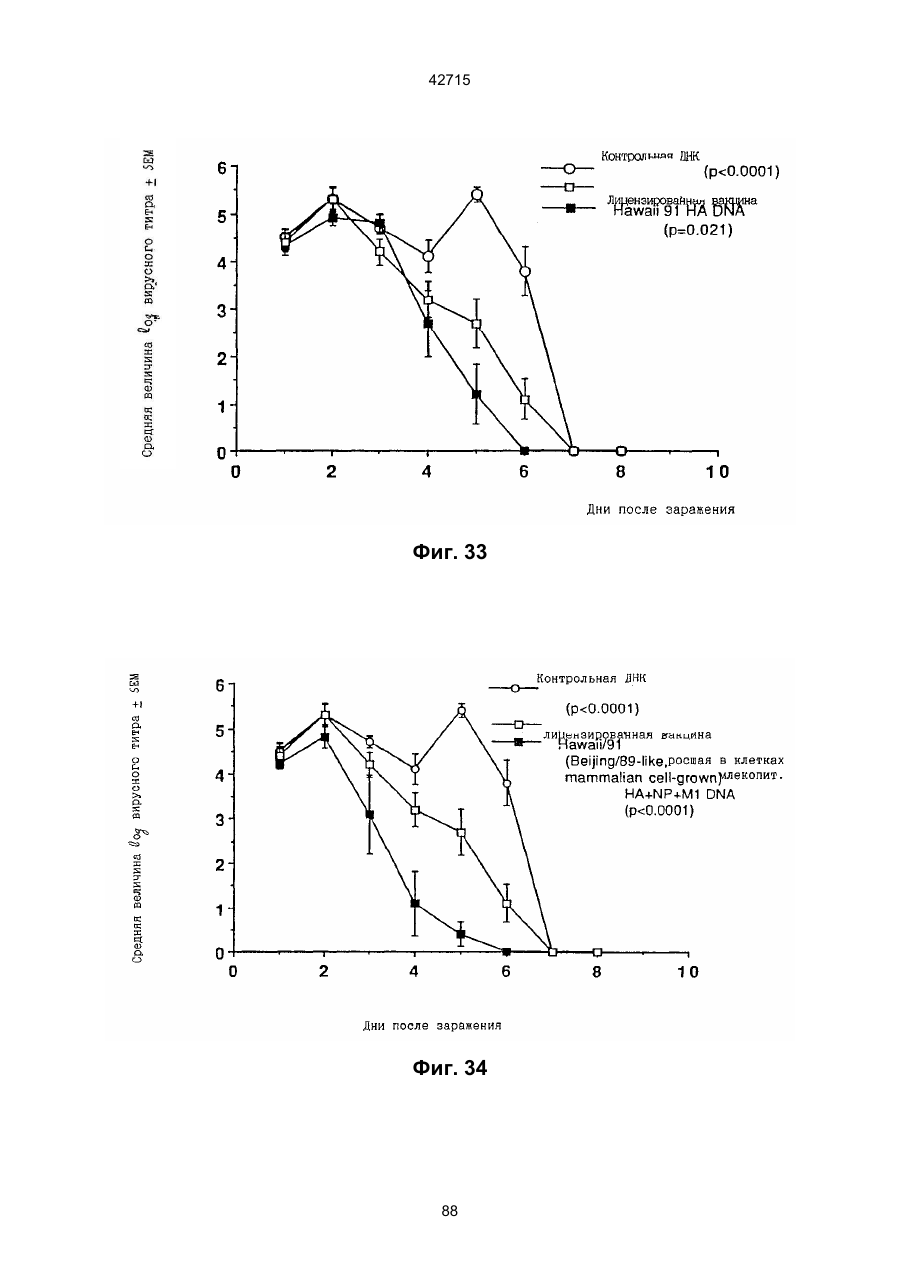
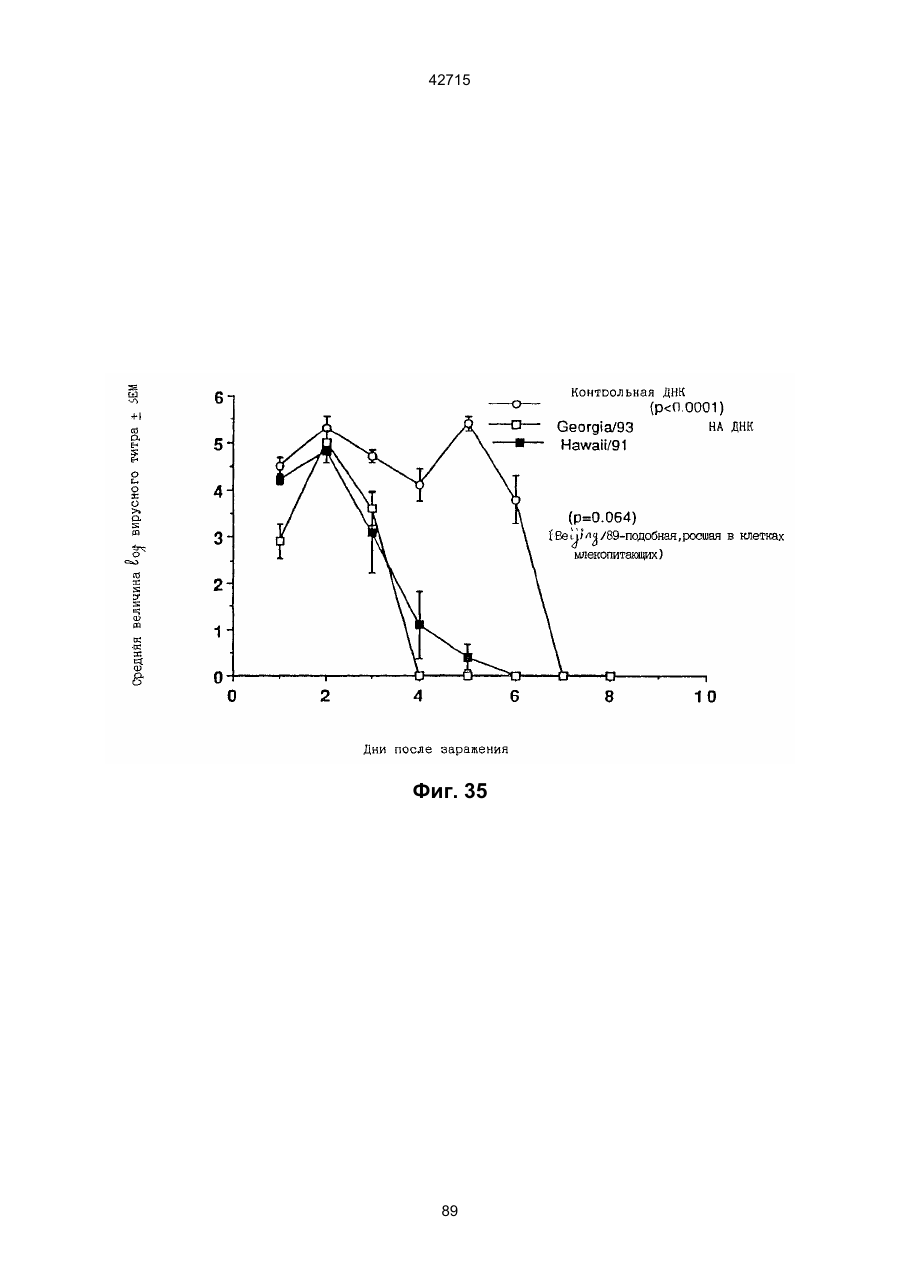
1. Полинуклеотидная вакцина на основе плазмидной ДНК, содержащая ген нуклеопротеина вируса гриппа, оперативно связанный с регуляторной последовательностью, причем указанная полинуклеотидная вакцина на основе плазмидной ДНК способна индуцировать специфичный иммунный ответ на вирус гриппа при введении в клетки млекопитающего in vivo, причем указанная полинуклеотидная вакцина на основе плазмидной ДНК содержит регуляторную последовательность, которая представляет собой промотор цитомегаловируса с последовательностью интрона А (1,63 т.п.н.), терминатор транскрипции, который представляет собой терминатор транскрипции бычьего гормона роста (0,55 т.п.н.), бактериальную область начала репликации, которая представляет собой ori (0,64 т.п.н.) и определяемый маркер, который представляет собой ген устойчивости к канамицину (1,30 т.п.н.). 2. Полинуклеотидная вакцина на основе плазмидной ДНК по п. 1, выбранная из а) плазмиды V1J-PR-NP, 5'-концом которой является последовательность 42715 V1Jneo описана как последовательность 2 42715 V1Jns представляет собой V1Jneo, где сайт Kpn1 заменен сайтом Sfi1, и V1R представляет собой последовательность 3. Иммуногенная композиция, состоящая из полинуклеотидной вакцины на основе плазмидной ДНК, охарактеризованной в п. 1. 4. Иммуногенная композиция, состоящая из полинуклеотидной вакцины на основе плазмидной ДНК, охарактеризованной в п. 2. Это изобретение является частичным продолжением USSN 08/089985, представленной от 8 июля 1993 г., ожидающей решения, которая бы ла продолжением USSN 08/032383, представленной 18 марта 1993 г., ожидающей решения. 3 42715 Предпосылки изобретения Данное изобретение касается получения и применения нового фармацевтического продукта: нуклеиновой кислоты, которая при непосредственном введении в ткань живого позвоночного животного вызывает образование иммунных ответных реакций, специфически узнающих вирус гриппа человека. Грипп представляет собой острое лихорадочное заболевание, вызываемое инфекцией дыхательных путей вирусами гриппа А или В. Вспышки заболеваний гриппом происходят по всему свету почти каждый год с периодическими эпидемиями или пандемиями. Грипп может вызывать значительные общие симптомы, тяжелые заболевания (например, вирусное воспаление легких), требующие госпитализации, и осложнения, такие как вторичная бактериальная пневмония. Недавние эпидемии в Соединенных Штатах, как считают, привели к более 10000 (до 40000) смертных случаев в год и к 5000-10000 смертям в год в неэпидемические годы. Наилучшей стратегией для предотвращения заболеваемости и смертности, связанных с гриппом, является вакцинация. Лицензированные в настоящее время вакцины получают из выращенного в яйцах вируса и затем инактивированного. Вакцины включают в себя три вирусных штамма (два А штамма и один В штамм). Пригодны три типа вакцин: содержащие целый вирус, субвирион и очищенный поверхностный антиген. Только две последние применяют для детей из-за повышенных лихорадочных ответных реакций при использовании вакцины с целым вирусом. Детям моложе 9 лет требуются две иммунизации, тогда как взрослым нужна только однократная инъекция. Однако, было высказано предположение (см. Medical Letter 32:89-90, Sept. 17, 1993), что "больные, вакцинированные рано осенью, получают преимущества от второй дозы зимой или ранней весной", основанное на наблюдениях на пожилых больных. Титры антител после вакцинации могут снижаться до уровней ниже защитных в пределах четырех или менее месяцев. Эти вакцины готовят заново каждый год на основе прогнозирования, какой из новых вирусных штаммов будет клинически распространяться, и на основе оценки, какой из новых вирулентных штаммов ожидается преобладающим в наступающем сезоне гриппа. Рекомендуется ежегодная ревакцинация. А. Недостатками лицензированной вакцины являются: 1) Антигенная изменчивость, в частности, в штаммах А гриппа, приводит к появлению вирусов, которые не нейтрализуются антителами, выработанными под действием прежней вакцины или при предшествующей инфекции. Новые штаммы возникают в результате точковой мутации (антигенного дрейфа) и рекомбинации (антигенной изменчивости) генов, кодирующих поверхностные гликопротеины (гемагглютинин [НА] и нейраминидазу), тогда как внутренние белки являются высококонсервативными в штаммах с антигенным дрейфом и антигенной изменчивостью. Иммунизация вызывает "гомологичный" штамм-специфический опосредованный антителами иммунитет, но не "гетерологичный, общий для групп иммунитет, основанный на опосредованном клеткой иммунитете. 2) Дажеесли преобладающие распространяющиеся штаммы вируса гриппа не обнаруживают значительных антигенного дрейфа или антигенной изменчивости от одного года к другому, иммунизацию следует проводить каждый год из-за снижения титров антител. Хотя некоторые исследователи сообщали, что ингибирущие гемагглюцинацию (Н1) и нейтрализующие антитела сохраняются в течение месяцев - лет с последующим постепенным снижением, Консультативный Комитет по иммунизации считает снижение титров антител в течение следующего после вакцинации года достаточной причиной для ежегодной иммунизации, даже если не было большого антигенного дрейфа или антигенной изменчивости. (Н1 антитела ингибируют способность вируса гриппа агглютинировать эритроциты крови. Подобно нейтрализующим антителам, они первично направлены против антигена НА. Тесты ингибирования гемагглютинации легче и дешевле в проведении, чем тесты нейтрализации и, следовательно, их чаще применяют в качестве средства для оценки способности антител, выработанных против одного из штаммов вируса гриппа, реагировать с отличающимся штаммом.) Как упоминалось выше, Medical Letter предполагает, что определенные более старые индивидуумы, с высоким риском заболевания, должны вакцинироваться дважды в сезон вследствие короткоживущих защитных титров антител. 3) Эффективность вакцины является субоптимальной. Разработка вакцины для следующего сезона основана на прогнозировании ожидаемых распространяющихся штаммов (через дежурное выборочное исследование в Азии), которая является неточной и может привести к плохому соответствию между штаммами, применяемыми для вакцины, и штаммами, действительно распространяющимися в данном пространстве. Кроме того, как это произошло во время сезона гриппа 19921993 годов новый штамм Н3N2 (А/Beijing/92) стал клинически выявляемым во время последней фазы этого сезона гриппа. Это потребовало быстрого изменения в составе вакцины 1993-1994 вследствие слабой перекрестной реактивности с А/Beijing/92 антител, индуцируемых прежним штаммом H3N2 (А/Beijing/89), из-за антигенного дрейфа. Однако, из-за длительного периода времени, необходимого для приготовления лицензированной в настоящее время вакцины, новый штамм вакцины не мог быть введен во время сезона 19921993 г., несмотря на доказательство плохой защиты при применении существующей тогда вакцины и увеличенной вирулентности нового распространяющегося штамма Н3N2. Даже когда вакцина и распространяющиеся штаммы хорошо подходят друг другу, лицензированная вакцина предотвращает болезнь только у приблизительно 70% детей и молодежи и в 30-40% слабых старых людей. Поэтому используют другие критерии для доказательства эффективности вакцины, когда вакцинные штаммы соответствуют циркулирующим штаммам. Эти критерии включают в себя предотвращение тяжелого заболевания и вторичных осложнений, что отражается в предотвращении госпитализации (70% для пожилых людей, живущих дома, по сравнению с 50-60% пожилых, живущих в домах престарелых 4 42715 и инвалидов), и предотвращение смерти (80% для обитателей домов престарелых). Иммунитет населения для снижения распространения инфекции в доме престарелых рассматривается как еще одно преимущество иммунизации. В. Характеристики идеальной универсальной вакцины против гриппа 1) Генерирование общей для всех групп (гетерологичной) защиты. Универсальная вакцина должна быть способна защищать против различных штаммов, например, в пределах подтипа Н3N2, и, возможно, даже в случае перекрестных подтипов, например, от H1N1 до H3N2. Защита, вероятно, должна быть медиирована цитотоксическими Тлимфоцитами (СТL), узнающими антигены из внутренних консервативных вирусных белков, хотя нейтрализующие антитела, направленные против консервативных частей мембраносвязанных белков, также могут играть роль. 2) Увеличенная широта ответной реакции в виде антител. Поскольку считают, что СТL, играют роль в выздоровлении, вакцина на основе только СТL ответа, по-видимому, должна, сокращать продолжительность заболевания (потенциально до превращения болезни в преклиническую (бессимптомную), но она не могла бы полностью предотвратить болезнь. Экспериментально было показано, что способ получения вакцины против гриппа при помощи пассажа в яйцах способен отбирать субпопуляции вируса с измененной НА антигенностью. В результате эффективность вакцины могла бы снижаться, поскольку антитела, индуцируемые этой вакциной, могут быть не вполне эффективными против преобладающего циркулирующего штамма. Поэтому хотелось бы получить антитела, имеющие улучшенную широту ответа по сравнению с имеющейся сейчас вакциной. Сезон гриппа 1992-1993 г. предоставил превосходный случай исследования недостатков существующей вакцины, заключающихся в том, что вакцина, которая использована А/Beijing/89, генерировала антитела, которые были слабо реагирущими перекрестно (и менее защитными) против нового штамма А/Beijing/92, который был также более вирулентным. Оба штамма представляют собой Н3N2, т. е. принадлежат к одному и тому же подтипу. По аминокислотной последовательности, однако, А/Beijing/92A-подобные штаммы отличаются от А/Beijing/89-подобных штаммов только 11 точковими мутациями (положения 133, 135, 145, 156, 157, 186, 190, 191, 193, 226 и 262) в районе НА1. Неизвестно, повлиял ли существующий процесс изготовления вакцины на отсутствие перекрестной реактивности, но очевидно, что желательно улучшение в широте ответной реакции антител. 3) Увеличенная продолжительность ответной реакции в виде образования антител. Поскольку одной из групп, представляющих наибольшую опасность для заболеваемости и смертности от инфекции гриппом (пожилые люди), является также группа, в которой защитные титры антител могут снижаться слишком быстро для того, чтобы ежегодная иммунизация была эффективной, усовершенствованная вакцина должна генерировать защитные титры антител, сохраняющиеся более долго. С. Полинуклеиды в качестве вакцины Было показано, что внутримышечная инокуляция полинуклеотидных конструкций, т. е. ДНК плазмид, кодирующих белки, приводит к образованию in situ данного белка в мышечных клетках. Путем применения кДНК-плазмид, кодирующих вирусные белки, генерировали ответную реакцию как в виде антител, так и в виде СТL, обеспечивая гомологичную и гетерологичную защиту против последующего заражения с гомологичной или перекрестной в отношении штаммов защитой, соответственно. Каждый из этих типов иммунных реакций предоставляет потенциальное преимущество по сравнению с существующими стратегиями вакцинации. Применение полинуклеотидных вакцин (РNV) для образования антител может привести к увеличенной продолжительности образования антител, а также к обеспечению антигена, который может иметь как точную последовательность клинически циркулирующего штамма вируса, так и правильные посттрансляционные модификации и конформацию нативного белка (по сравнению с рекомбинантным белком). Генерирование СТLответов этим способом предоставляет преимущества перекрестной в отношении штаммов защиты без необходимости применения живого потенциально патогенного вектора или ослабленного вируса. Таким образом, основным стимулом к разработке вакцин против таких вирусов, как вирус гриппа, против которого генерируются нейтрализующие антител, является разнообразие белков оболочки вируса среди различных изолятов или штаммов. Поскольку цитотоксические Т-лимфоциты (CTL) в мышах и в человеке способны узнать эпитопы, происходящие из консервативных внутренних вирусных белков (J.W. Yewdell et al., Proc. Natl. Acad. Sci. (USA) 82, 1785 (1985); A.R.M. Fownsend et al., Cell 44, 959 (1986); A.J. McMichael et al., J. Gen. Virol. 67, 719 (1986); J. Bastin et al., J. Exp. Med. 165, 1508 (1987); A.R.M. Fownsend and H. Bodmer, Annu. Rev. Immunol. 7, 601 (1989)), и считаются важным в иммунном ответе на вирусы (Y.-Z. Zin and B.A. Askonas, J. Exp. Med. 154, 225 (1981); I. Gardner et al., Eur. J. Immunol. 4, 68 (1974); K.L. Yap and G.L. Ada, Nature 273, 238 (1978); A.J. McMichael et al., New Engl. J. Med. 309, 13 (1983); P.M. Faylor and B.A. Askonas, 58, 417 (I986)), усилия был направлены на развитие СТLвакцин, способных обеспечить гетерологичную защиту против различных вирусных штаммов. CD8+ CTL убивают инфицированные вирусом клетки, когда их Т-клеточные рецепторы узнают вирусные пептиды, ассоциированные с молекулами МНС (главной системы тканевой совместимости) класса I (R.M. Zinkernagel and P.C. Doherty, ibid. 141, 1427 (I975); R.N. Germain, Nature 353 605 (1991)). Эти пептиды получают из эндогенно синтезированных вирусных белков, независимо от локализации или функции белка внутри вируса. Поэтому путем узнавания эпитопов из консервативных вирусных белков CTL могут обеспечивать перекрестную в отношении штаммов защиту. Пептиды, способные к ассоциации с МНС класса І, узнаваемые СТL, происходят из белков, присутствующих в цитоплазме или эндоплазматическом ретикулуме или проходящих через них (J.W. Yewdell 5 42715 and J.R. Bennink, Science 244, 1072 (1989); A.R.M. Townsend et al., Nature 340, 443 (1989); J.G. Nuchtern et al., ibid. 339, 223 (1989)). Таким образом, обычно экзогенные белки, вступающие в ядрышковый путь процессинга (как в случае антигенов, представленных молекулами МНС класса II), не являются эффективными в генерировании Сd8+ CTL-ответных реакций. Большинство попыток генерировать СТL-ответы использовали реплицирующиеся векторы для получения белкового антигена внутри клетки (J.R. Bennink et al., ibid. 311, 578 (1984); J.R. Bennink and J.W. Yewdell, Curr. Top. Microbiol. Immunal 163, 153 (1990); C.K. Stover et al., Nature 351, 455 (1991); A. Aldovini and R.A. Young, Nature 351, 479 (1991); R. Schafer et al., J. Immunal., 149, 53 (1992); C.S. Hahn et al., Proc. Natl. Acad. Sci. (USA) 89, 2679 (1992)) или они фокусировались на введении пептидов в цитозоль (F.R. Carbone and M.J. Bevan, J. Exp. Med. 169, 603 (1989); K. Deres et al., Nature 342, 561 (1989); H. Takahashi et al., ibid. 344, 873 (1990); D.S. Collins et al., J. Immunol. 148, 3336 (1992); M.J. Newman et al., ibid. 148, 2357 (1992)). Оба эти подхода имеют недостатки, которые могут уменьшить их применение для получения вакцин. Ретровирусные векторы имеют ограничения в отношении размера и структуры полипептидов, которые могут экспрессироваться в виде слитых белков с сохранением способности репликации рекомбинантного вируса (A.D. Miller, Curr. Top. Microbiol. Immunol. 158, 1 (1992)), и эффективность векторов, таких как вирус осповакцины, для последующих иммунизаций может быть ослаблена иммунными ответными реакциями против самих векторов (E.L. Cooney et al., Lancet 337, 567 (1991)). Кроме того, вирусные векторы и модифицированные патогены сами по себе опасны, что может препятствовать их использованию в человеке (R.R. Redfield et al., New Engl. J. Med. 316, 673 (1987); L. Mascola et al., Arch, Intern. Med. 149, 1569 (1989)). Кроме того, выбор пептидных эпитопов зависит от структуры МНС антигенов индивидуумов и, следовательно, пептидные вакцины могут иметь ограниченную эффективность вследствие разнообразия гаплотипов МНС в популяциях при аутбридинге. Benvenisty, N., и Reshef, L. (IPNAS 83, 95519555 (1986)) показали, что осажденная CaCI2 ДНК, введенная в мышей интраперитонеально, внутривенно или внутримышечно могла экспрессироваться. Было показано, что внутримышечная (i. m.) инъекция экспрессирующих векторов ДНК в мышей приводит к поглощению ДНК мышечными клетками и экспрессии белка, кодируемой этой ДНК (J.A. Wolff et al., Science 247, 1465 (1990); G. Ascadi et al., Nature 352, 815 (1991)). Было показано, что эти плазмиды сохранялись в эписомах и не реплицировались. Затем, сохраняющаяся экспрессия наблюдалась после i. m. инъекции в скелетные мышцы крыс, рыбы и приматов и в сердечную мышцу крыс (Н. Lin et al., Circulation 82, 2217 (1990); R.N. Kistis et al., Proc. Natl. Acad. Sci. (USA) 88, 4138 (1991), E. Hausen et al., FEBS Lett. 290, 73 (1991); S. Jiao et al., Hum. Gene Therapy 3, 21 (1992); J.A. Wolff et al., Human Md. Genet. 1, 363 (1992)). Способ применения нуклеиновых кислот в качестве терапевтических средств сообщался в WO 90/11092 (4 октября 1990), в котором для вакцинации позвоночных животных использовали одни полинуклеотиды. Для успеха способа необязательно, чтобы иммунизация была внутримышечной. Так, Tang et al., (Nature, 356, 152-154 (1992)) обнаружили, что введение золотых микроснарядов, покрытых ДНК, кодирующей бычий гормон роста (BGH), в кожу мышей приводило к образованию антител против ВGH в мышах. Turth et al. (Analytical Biochemistry, 205, 365-368 (1992)) показал, что можно было бы использовать струйный инжектор для трансфекции мышечных, жировых тканей и тканей молочной железы живых животных. Обзор различных способов введения нуклеиновых кислот сделан недавно Friedman. T. (Science, 244, 1275-1281 (1989)). См. также Robinson et al., Abstracts of Papers Presented at the 1992 Meeting of Modern Approaches to New Vaccines, Including Prevention of AIDS, Colol Spring Harbor, p. 92, где утверждается, что внутримышечное, внутрибрюшинное и внутривенное введение ДНК вируса гриппа птиц обеспечивало защиту против летальной инфекции. Однако не было указаний о том, гены какого вируса птичьего гриппа были использованы. Кроме того, говорилось только о Н7-специфических ответных реакциях без упоминания об индуцировании перекрестной в отношении разных штаммов защиты. Таким образом, данное изобретение рассматривает любые из известных способов введения нуклеиновых кислот в живые, ткани для индуцирования экспрессии белков. Данное изобретение обеспечивает способ введения вирусных белков в путь процессинга антигена для генерирования вирус-специфических СТL. Данное изобретение удовлетворяет потребность в специфических терапевтических средствах, способных вызывать желаемые профилактические иммунные реакции против вирусных патогенов (для вируса гриппа). Особенно важна в этом терапевтическом подходе возможность индуцирования Т-клеточных иммунных реакций, которые могут предотвращать инфекции даже в том случае, когда вирусные штаммы гетерологичны относительно штамма, из которого получен ген антигена. Таким образом, данное изобретение обеспечивает конструкции ДНК, кодирующие вирусные белки вируса гриппа человека; нуклеопротеин (NР), гемагглютинин (НА), нейраминидазу (NМ), матричный белок (М), неструктивный белок (NS), полимеразу (PB1 и РВ2 – основные полимеразы 1 и 2; РА - кислую полимеразу) или любые другие гены вируса гриппа, кодирующие продукты, которые генерируют специфические CTL. Вирус гриппа имеет РНК-геном, состоящий из множественных сегментов РНК (рибонуклеиновой кислоты). Каждая РНК кодирует по меньшей мере один генный продукт. Продукт гена NР связывается с РНК и переносит вирусные РНК в ядро инфицированной клетки. Эта последовательность является консервативной, только приблизительно 7% дивергенции аминокислотной последовательности возникает в течение периода 50 лет. Продукты гена Р (РB1, РВ2, РА) ответственны за синтез новых вирусных РНК. Эти гены даже более консервативны, чем ген NP. НА является основным генным продуктом оболочки вируса. Он менее вы 6 42715 соко консервативен, чем NP. Он связывает клеточный рецептор и, следовательно, участвует в инициации новых инфекций гриппом. Основная нейтрализующая реакция антител направлена против этого генного продукта. Основной ответ цитотоксических Т-лимфоцитов (СТL) также направлен против этого белка. Существующие вакцины против гриппа человека включают в себя три штамма вируса гриппа или их НА белки. Однако, вследствие вариабельности в белковой последовательности НА в различных штаммах эта вакцина должна постоянно подгоняться к штаммам, которые в данный момент вызывают патологию. Однако НА действительно имеет некоторые консервативные элементы для генерирования СTL, если он предоставлен должным образом. Продукты генов NS1 и NS2 имеют не полностью охарактеризованные биологические функции, но они могут иметь значение в образовании защитных СTL-ответных реакций. Наконец, генные продукты М1 и М2, которые несколько более консервативны, чем НА, индуцируют основной СTL-ответ. М1 белок является очень обильным по массе продуктом вирусного гена. Защитная эффективность вакцинации ДНК против последующего вирусного заражения демонстрируется иммунизацией нереплицирующейся плазмидной ДНК, кодирующей один или несколько вышеупомянутых вирусных белков. Это является преимуществом, так как в вакцинации не участвует инфекционный агент, не требуется сборки вирусных частиц и возможна селекция антигенных детерминант. Кроме того, так как последовательность нуклепротеина и некоторых других продуктов вирусных генов консервативна и имеется в многочисленных штаммах гриппа, защита против последующих заражений вирулентным штаммом вируса гриппа, гомологичным или гетерологичным по отношению к штамму, из которого получен клонированный ген, является возможной. Конструкции ДНК, способные экспрессироваться при прямом введении, инъекцией или другим способом, в ткани животных, представляют собой новые профилактические фармацевтические препараты. Они индуцируют цитотоксические Т-лимфоциты (СТL), специфические для вирусных антигенов и отвечающие на различные штаммы вируса, в отличие от антител, которые, как правило, штамм-специфичны. Генерирование таких СТL in vivo обычно требует эндогенной экспрессии антигена, как в случае вирусной инфекции. Для генерирования вирусного антигена для предоставления его иммунной системе, без недостатков прямой доставки пептида или применения вирусных векторов, плазмидную ДНК, кодирующую белки вируса гриппа человека, инъецировали в четырехглавую мышцу BALB/с мышей, это приводило к генерированию специфических для вируса гриппа СTL и защите от последующего заражения гетерологичным штаммом вируса гриппа, как было измерено уменьшенным вирусным титром в легких, ингибированием потери веса и повышенным выживанием. Высокий титр нейтрализующих антител к гемагглютинину и антител к нуклеопротеину был обнаружен у макаки-резус и уменьшенные титры вируса в носу наблюдали после гомологичного и гетерологичного заражения у африканских хорь ков. Основные наблюдения, относящиеся к нашему изобретению, включают в себя: 1) Демонстрацию эффективности. Гетерологичная защита наблюдается после иммунизации ДНК нуклеопротеина (NP), измеренная по повышенному выживанию, пониженным вирусным титрам в легких и ингибированию потери веса в мышах, заражаемых штаммом вируса гриппа, отличающимся от источника штамма для гена NР. В этом случае поверхностные белки двух штаммов были совершенно различными (Н1N1 vs. Н3N2) и штамм для заражения возник через 34 года после исходного штамма. Иммунизация хорьков ДНК NР и ДНК матрикса (M1), по отдельности, вместе или в комбинации с ДНК НА, обеспечила защиту (уменьшенное назальное выделение вируса) против заражения штаммом с антигенным дрейфом (клинический изолят). Защита коктейлем ДНК (ДНК NР и M1, кодирующая белки Beijing/89, и ДНК НА, кодирующая либо Beijing/89, либо Hawaii/91) была заметно выше против штамма с антигенным дрейфом, что даваемая лицензированной вакциной, содержащей Beijing/89, у хорьков. Смесь (коктейль), содержащая ДНК НА из Hawaii/91, по-видимому, была несколько более эффективной, чем смесь, содержащая ДНК НА из Beijing/89. Защита, обнаруживаемая с коктейлем, содержащим ДНК НА для Hawaii/91, приводила к защите, идентичной защите, наблюдаемой с гомологичной ДНК НА (Georgia/93), тогда как коктейль с ДНК НА для Beijing/89 отличался от гомологичной защиты, хотя все еще был значительно лучше, чем лицензированный продукт. Антитела к H1 образовались во всех видах, в том числе в мышах, хорьках, макаках-резус и Африканских зеленых мартышках. 2) Постоянство. В исследованиях с применением ДНК, кодирующей репортерный ген, присутствие ДНК и экспрессия белка сохранялись по меньшей мере в течение 1,5 года (самое продолжительное время, тестированное в мышах; Wolff et al., Human Mol. Genet., 1992). Таким образом, если генные продукты вируса гриппа также экспреccировались постоянно, то полученная иммунная реакция также должна была сохраняться. Было показано, что антитела и СТL (Yankoueckas et al., DNA and Cell Biol., 1993) и гомологичный защитный иммунитет (данные MRL), генерированные инъекцией ДНК вируса гриппа, сохранялись в течение более 1 года в мышах. Было показано, что антитела сохранялись с макаке-резус в течение по меньшей мере 1 года. Ответные СТL реакции и гетерологичная защита (увеличенное выживание) сохранялись до 6 месяцев (самая дальняя точка, тестированная до сих пор). Небольшое снижение степени гетерологичной защиты наблюдалось, но защита может быть усилена (повторной иммунизацией). 3) Диапазон доз. Исследования требуемых доз, проводимые на макаках резус показали, что доза 100 мкг ДНК НА, даваемая два раза, приводила к хорошим титрам Н1 антител, которые сохранялись пока до одного года. Образование защиты (повышенное выживание после гетерологичного заражения) наблюдали с дозами такими низкими, как 6 мкг (даваемыми 3 раза), и с однократной инъекцией 200 мкг, но обычно увеличен 7 42715 ное число инъекций (до трех) улучшало степень защиты. Исследования на приматах обнаружили, что 2 инъекции 10 или 100 мкг ДНК, кодирующей 3 НА и NP и M1 (последняя - кодирует генные продукты H3N2 Beijing/89) приводили к титрам H1 антител, таким же, какие генерируются лицензированной вакциной. Важно помнить, что все исследованные животные не подвергались действию вируса гриппа, тогда как клиническая популяция (более старые индивидуумы) все перенесли грипп. (Вспомните, что детям до 9 лет давали 2 инъекции лицензированной вакцины). Фиг. 1. Обнаружение плазмидной ДНК NP в мышцах при помощи PCR. Мышей инъецировали три раза с интервалами три недели ДНК NP RSV или пустым вектором (100 мкг на ногу) в обе четырехглавые мышцы BALB/с мышей с последующим заражением гриппом. Мышцы удаляли спустя 4 недели после конечной инъекции и сразу же замораживали в жидком азоте. Затем их пульверизировали в буфере для лизиса (25 мМ Трис-Н3РО4, рН 8, 2 мМ транс-1:2-диаминоциклогексан-тетрауксусная кислота (СDТА), 2 мМ ДТТ, 10% глицерин, 1% Тритон X-100) в MIKRODISMEMBRATOR™ (B. Braun Instruments) и высокомолекулярную ДHК экстрагировали смесью фенол/хлороформ и осаждали этанолом. Реакцию PCR из 40 циклов проводили согласно инструкциям в ките (наборе) Perkin Elmer Cetus GENEAMP™, для детектирования присутствия плазмиды ДНК NP в мышце. Продукт PCR из 772 п. н. (см. головку стрелки), простирающийся от промотора СМV через большую часть 5'-района встроенного гена NP, получали из смыслового олигонуклеотида из 18 п. н., примированного в промоторном районе, (GTGTGCACCTCAAGCTGG, SEQ. ID:1) и олигонуклеотидного антисмыслового праймера из 23 п. н. в 5'-части встроенной последовательности NP (СССTTTGAGAATGTTGCACATTC, SEQ:2:). Продукт 772 п. н. виден на окрашенном бромидом этидия агарозном геле в выбранных инъецированных ДНК NP мышечных пробах, но не в контроле (пустой вектор) (600 L). Метки над каждой дорожкой указывают идентификационный номер мыши и правую или левую ногу. Фиг. 2. Получение NP антител в мышах, инъецированных ДНК NР. Мышей инъецировали 100 мкг ДHК V1-NР в каждую ногу при 0,3 и 6 неделях и кровь извлекали при 2, 5 и 8 неделях. Присутствие aнти-NP 1gG в сыворотке определяли при помощи ELISA (J.J. Donnelly et al., J. Immunol., 145, 3071 (1990)), с применением NP, очищенного из клеток насекомых, которые были трансфицированы экспрессирующим бакуловирусным вектором. Результаты нанесены на график как средний log10 титр ELISA±SEM (n=10) в зависимости от времени после первой инъекции ДHK NР. Мыши, иммунизированные пустым вектором, не генерировали детектируемых NP антител. Фиг. 3. Процент специфического лизиса, определяемого в 4-часовом тесте высвобождения 51Сг, для СТL, полученных из мышей, иммунизированных ДНК. Мыши были иммунизированы 400 мкг ДНК V1-NР (сплошные кружки) или пустым вектором (сплошные квадратики) и убивали спустя 34 недель. Отрицательные контроли CTL получали из незаражаемой мыши (белые треугольники) и положительные контроли из мыши, которая выздоровела после инфекции A/HК/68 раньше на 4 недели (сплошные треугольники). Графики изображают данные из репрезентативных отдельных мышей. По меньшей мере, 8 мышей исследовали для каждой серии условий. Панель А: Клетки селезенки, повторно стимулированные NP147-155-импульсно-мечеными аутологичными клетками селезенки, тестировали против NP147-155-импульсно-меченых Р815 клеток. Панель В: Клетки селезенки, повторно стимулировали NP147-155-импульсно-мечеными аутологичными клетками селезенки и тестировали против мишеней P815, инфицированных вирусом A/Victoria/73 (Н3N2) в течение 6 часов перед добавлением СTL. Панель С: Клетки селезенки повторно стимулировали Соn А и IL-2 без дополнительного антигена и тестировали против P815 клеток, импульсно меченых NP147-155. Панель D: Мышей инъецировали 200 мкг на одну инъекцию ДHК V1-NP или пустым вектором 3 раза в 3-недельными интервалами. Селезенки собирали спустя 4 недели после последней иммунизации, клетки селезенки культивировали с IL-2 и Соn А в течение 7 дней и СТL определяли против клеток-мишеней P815, инфицированных A/Victoria/73. Фиг. 4. Потеря массы (в граммах) и выздоровление в иммунизированных ДНК мышах после интраназального (без наркоза) заражения с применением 104 ТСID50 A/HK/68. Мышей иммунизировали три раза с 3-неделъными интервалами ДНК VI-NР или пустым вектором или не инъецировали и заражали через 3 недели после последней иммунизации. Массы для групп из 10 мышей определяли во время заражения и ежедневно, начиная с 4-го дня, для инъецированных ДНК NР мышей (сплошные кружки), контролей (пустые векторы) (белые треугольники) и неинъецированных мышей (контролей) (белые кружки). Представлены средние массы ±SEM. Инъецированные ДНК NР мыши обнаружили гораздо меньшую потерю массы на 813 дни, чем инъецированные пустым вектором мыши (р£0,005) и неинъецированные мыши (р£01), как показал t-тест. Не было значительной разницы между двумя контролями (р=0,8 согласно t-тесту). Фиг. 5. Выживание иммунизированных ДНК мышей после интраназального заражения (под наркозом) 102,5 ТСID50 A/HK/68. Мышей, иммунизированных три раза с 3-недельными интервалами ДНК \/1-NP (сплошные кружки) или пустыми векторами (белые кружки), и неинъецированные контроли (белые треугольники) заражали через три недели после последней иммунизации. Процент выживания показан для групп из 9 или 10 мышей. Выживание инъецированных ДНК NP мышеи была значительно выше, чем контролей (р=0,0004 согласно Chi-square анализу), тогда как между инъецированными пустым вектором и неинъецированными мышами не наблюдали значительного различия (р=0,1 согласно Chi-square анализу). Фиг. 6. Последовательность экспрессирущего вектора V1J, SEQ. ID:10:. 8 42715 фицированных миобластах. СТL получали из этих мышей через 6 недель после обработки и рестимулировали in vitro инфицированными вирусом группа сингенными клетками селезенки. В качестве положительного контроля получали СТL из мышей, которые были инфицированы вирусом гриппа А/НК/68. Необработанные (сплошные столбики), инфицированные вирусом гриппа A/Victoria/73 (полосатые столбики) и NP-трансфицированные (заштрихованные столбики) миобласты применяли в качестве клеток-мишеней при отношении эффектор:мишень 25:1. Данные представлены как % специфического лизиса ± sd, где n=3. Фиг. 21. 4-недельных самок ВАLВ/с мышей иммунизировали внутримышечно 200 мкг ДHК NP трижды с 3-недельными интервалами. Мышей заражали через 3 недели после третьей иммунизации 300 ТС1D50 А/НК/68, вводимыми под наркозом (заражение всех дыхательных путей). Процент выживших мышей (10 мышей на группу) нанесен на график в зависимости от времени после заражения. Фиг. 22. 4-недельных самок ВАLВ/с мышей иммунизировали внутримышечно 100 мкг ДНК NP трижды при 3-недельных интервалах. Мышей заражали через 3 недели после третьей иммунизации 300 ТС1D50 А/НК/68, вводимыми под наркозом (общее заражение дыхательных путей). Мышей взвешивали 1 раз в день и процент от исходного веса рассчитывали для каждой выжившей мыши. Средний % от исходных весов наносили на график ± SЕМ в зависимости от времени после заражения. Фиг. 23. 4-недельных самок BALB/c мышей иммунизировали внутримышечно 200 мкг ДНК NP трижды при 3-недельных интервалах. Мышей заражали через 3 недели после третьей иммунизации 2000 ТС1D50 А/НК/68, вводимыми без наркоза (заражение верхних дыхательных путей). Мышей убивали через 7 дней после заражения, легкие извлекали и гомогенизировали и определяли титры вируса серийным титрованием на клетках МDСК. Фиг. 24. 4-недельных самок ВАLВ/с мышей иммунизировали внутримышечно 6,25, 25, 100 или 200 мкг ДНК NP трижды с 3-недельными интервалами. Мышей заражали через 3 недели после третьей иммунизации 300 ТС1D50 А/НК/68, вводимыми под наркозом (общее заражение дыхательных путей). Процент выживших мышей (10 мышей на группу) наносили на график в зависимости от времени после заражения. Фиг. 25. 4-недельных самок ВАLВ/с мышей иммунизировали внутримышечно трижды с 3-недельными интервалами 200 мкг A/PR/34 ДНК NP, контрольной ДНК или ложно инъецировали. Затем мышей заражали 300 ТС1D50 А/НК/68 под наркозом через 6, 12 и 25 недель после третьей инъекции ДНК. Выбранных мышей реиммунизировали 200 мкг ДНК NP при 22-ой неделе и затем заражали на 25-ой неделе ("реиммунизация"). Средние массы представлены в виде процентов от исходной общей массы для каждой группы. Контрольная масса является средним из масс всех контрольных групп из 6, 12 и 25-недельных заражений, всего 6 группу, получавших контрольную ДНК или ложную инъекцию. Группы исходно содержали Фиг. 7. Последовательность экспрессирущего вектора V1Jneo SEQ. ID:18:. Фиг. 8. Последовательность промотор-терминаторной последовательности CM Vint А-В Н, SEQ. ID:11. Фиг. 9. Анти-NP антитела мартышек. Фиг. 10 Ингибирование гемагглютинации у хорьков, с пунктирной линией, указывающей минимальный защитный титр антител, и средней величиной, обозначенной кружком с проходящей через него линией. Фиг. 11. Анти-NР 1gG антитела в хорьках после иммунизации ДНK. Фиг. 12. Выделение вируса гриппа в хорьках с иммунизацией ДНК и без иммунизации ДНК. Фиг. 13. Диаграмма векторов рRSV-PR-NР и V1-NP, X обозначает встроенный кодирующий район. Фиг. 14. Схематическое изображение белков и штаммов гриппа. Фиг. 15. Схематическое изображение процессинга инъецированной ДНК внутри клетки. Фиг. 16. Устойчивость хорьков к штамму A/RP/8/34 гриппа, индуцированная иммунизацией генами НА и внутренних белков. Фиг. 17. Схематическое изображение вектора V1Jns. Фиг. 18. Африканских зеленых мартышек инъецировали смесью ДНК, состоящей из НА ДНК (А/Beijing/89, B/Panama/90, A/Texas/91), NP ДНК (А/РR/34) и M1 ДНК (A/PR/34). Каждый компонент был в количестве либо 10 мкг (сплошные квадраты), либо 100 мкг (сплошные кружки), вводимых дважды с 6-недельным интервалом (см. стрелки). Для сравнения других животных инъецировали лицензированными вакцинами с субвирионом (белые квадраты) или целым вирионом (белые кружки) при полной дозе, применяемой для человека (45 мкг белковый эквивалент; 15 мкг на НА). Пробы сыворотки брали каждые две недели в течение 18 недель и анализировали на Н1 титр против А/Beijing/89 НА. Данные выражали в виде геометрического среднего титра H1±SЕМ, где n=3. Фиг. 19. Самок ВАLВ/с мышей (4-6-недельных) инъецировали ДНК A/PR/34 NР (200 мкг) три раза с 3-недельными интервалами. Отрицательные контроли включали в себя мышей, инъецированных контрольной ДНК (200 мкг), рекомбинантным белком NP (10 мкг), и неинъецированных мышей (ложный контроль). Для сравнения тестировали также мышей, инфицированных вирусом гриппа A/HK/68 (flu). СТL получали через 6 месяцев после первой дозы и их рестимулировали in vitro инфицированными вирусом сингенными клетками селезенки и тестировали против NP пептидом импульсно-меченых Р815 клеток при отношении эффектор:мишень 10:1. Данные обозначают % специфического лизиса ± sd, где n=3. Фиг. 20. С3Н/НеN мышей инъецировали нормальными C2C12 миобластами (1x107 клеток), рекомбинантным белком NP (2 мкг) или NР-трансфицированными миобластами (1x107 клеток). Это количество NP белка (2 мкг) было достаточным для генерирования ответной реакции в виде образования антител и было эквивалентным приблизительно в 100 раз большему количеству NP, присутствующему в трансплантированных NP-транс 9 42715 по 10 животных; мышей исключали из дальнейшего анализа массы после смерти. Фиг. 26. Взрослых самцов хорьков (22-28-недельных) иммунизировали внутримышечно 1 мг ДНК, кодирующей NP из A/Beijing/89, 1 мг ДНК, кодирующей М1 из A/Beijing/89 или 1 мг этих объединенных ДНК в дни 0 и 42-ой. Контрольные хорьки получали некодирующую ДНК или полную дозу, применяемую для человека (15 мкг/штамм), лицензированной вакцины целого вируса гриппа (препарат 92-93 г., содержащей A/Beijing/89, в дни 0-ой и 42-ой. Хорьков заражали A/Georgia/93 на 5-й день. Выделение вируса в назальных промывках определяли, как описано выше. Выделение вируса на 3-ий - 5-ый дни сравнивали с выделением в хорьках, которым давали контрольную ДНК, при помощи двухфакторного дисперсионного анализа. Выделение вируса в хорьках, которым давали ДНК NP, ДНК М1 или ДНК NP + М1, было значительно ниже (р
ДивитисяДодаткова інформація
Назва патенту англійськоюPolynucleotide vaccine, based on plasmid dna, immunogenic composition (variants)
Автори англійськоюDONNELLY JOHN J., DWARKI VARAVANI J., LIU MARGARET A., MONTGOMERY DONNA L., PARKER SUEZANNE E., SHIVER JOHN W., ULMER JEFFREY B.
Назва патенту російськоюПолинуклеотидная вакцина на основе плазмидной днк, иммуногенная композиция (варианты)
Автори російськоюДоннелли Джон Дж., Дварки Варавани Дж., Лиу Маргарет А., Монтгомери Донна Л., Паркер Съюзанн Е., Шивер Джон В., Алмер Джеффри Б.
МПК / Мітки
МПК: A61K 31/70, C07K 14/11, C07H 21/04, C12N 15/44, A61K 48/00, C12N 15/00, A61P 31/16, A61K 39/145, A61P 31/12, C12N 15/09
Мітки: полінуклеотидна, імуногенна, плазмідної, днк, композиція(варіанти, основі, вакцина
Код посилання
<a href="https://ua.patents.su/93-42715-polinukleotidna-vakcina-na-osnovi-plazmidno-dnk-imunogenna-kompoziciyavarianti.html" target="_blank" rel="follow" title="База патентів України">Полінуклеотидна вакцина на основі плазмідної днк, імуногенна композиція(варіанти)</a>
Попередній патент: Спосіб одержання олігомерного термопласту
Наступний патент: Гемісольвати 6-гідрокси-2-(4-гідроксифеніл)-3-[4-(піперидиноетокси)бензоїл]бензо[b]тіофенгідрохлориду
Випадковий патент: Струмопровідний рейковий з'єднувач