Солюбілізовані композиції сертраліну
Номер патенту: 67741
Опубліковано: 15.07.2004
Автори: Шенкер Раві Майсор, Хербіг Скотт Макс, Фрізен Дуейн Томас, Вест Джеймс Блеер
Формула / Реферат
1. Композиція, що містить сертралін або його фармацевтично прийнятну сіль та солюбілізувальний агент в кількості, що достатня для одержання концентрації розчиненого сертраліну у середовищі використання, що містить іони хлору, яка в 1,5 рази вища, ніж концентрація, що забезпечується композицією порівняння, що є ідентичною заявленій, але не містить згаданого солюбілізувального агента, за умови, що згаданий солюбілізувальний агент не є альгіновою кислотою, цитратом натрію, карбонатом кальцію або поліетиленгліколем з молекулярною вагою, вищою ніж 3350.
2. Композиція згідно з пунктом 1, де співвідношення сертраліну або його фармацевтично прийнятної солі до солюбілізувального агента становить 1:0,01-1,5.
3. Композиція згідно з пунктом 1, де згаданим середовищем використання є шлунково-кишковий тракт.
4. Композиція згідно з пунктом 1, де згаданим середовищем використання є водне тестувальне середовище, що містить іони хлору.
5. Композиція згідно з пунктом 4, де згаданим середовищем використання є 0,075 Μ розчин хлориду натрію.
6. Композиція згідно з пунктом 1, що є дозованою формою швидкого вивільнення.
7. Композиція згідно з пунктом 1, що є дозованою формою контрольованого вивільнення.
8. Композиція згідно з пунктом 1, де згаданий солюбілізувальний агент вибирають з:
1) органічних кислот та солей органічних кислот;
2) часткових гліцеридів;
3) гліцеридів;
4) похідних гліцериду;
5) поліетиленгліколевих естерів;
6) поліпропіленгліколевих естерів;
7) естерів полігідрованих спиртів;
8) поліоксіетиленових етерів;
9) естерів сорбіту;
10) естерів поліоксіетилену і сорбіту і
11) карбонатних солей.
9. Композиція згідно з пунктом 5, де кількість згаданого солюбілізувального агента є достатньою, щоб підтримувати, щонайменше 2 години, концентрацію розчиненого сертраліну на рівні, що є, як мінімум, в 1,5 рази вищим, ніж концентрація сертраліну, що забезпечується композицією порівняння, що є ідентичною заявленій, але не містить згаданий солюбілізувальний агент.
10. Композиція згідно з пунктом 1, де згаданий солюбілізувальний агент вибирають з-поміж аспартаму, гліцерил монокаприлату, гліцерил монолаурату, ацетату кальцію, аскорбінової кислоти, лимонної кислоти, глютамінової кислоти.
11. Композиція, що містить сертралін або його фармацевтично прийнятну сіль та солюбілізувальний агент, в кількості, що достатня для одержання і підтримання, принаймні, протягом 2 годин в 0,075 Μ розчині хлориду натрію, концентрації розчиненого сертраліну, яка в 1,5 рази вища, ніж концентрація, що забезбечується композицією порівняння, що є ідентичною заявленій, але не містить згаданого солюбілізувального агента, за умови, що згаданий солюбілізувальний агент не є альгіновою кислотою, цитратом натрію, карбонатом кальцію або поліетиленгліколем з молекулярною вагою, вищою ніж 3350.
12. Композиція згідно з пунктом 11, де співвідношення сертраліну або його фармацевтично прийнятної солі до солюбілізувального агента становить 1:0,01-1,5.
13. Композиція згідно з пунктом 11, що є дозованою формою швидкого вивільнення.
14. Композиція згідно з пунктом 11, що є дозованою формою контрольованого вивільнення.
15. Композиція згідно з пунктом 11, де згаданий солюбілізувальний агент вибирають з:
1) органічних кислот та солей органічних кислот;
2) часткових гліцеридів;
3) гліцеридів;
4) похідних гліцериду;
5) поліетиленгліколевих естерів;
6) поліпропіленгліколевих естерів;
7) естерів полігідрованих спиртів;
8) поліоксіетиленових етерів;
9) естерів сорбіту;
10) естерів поліоксіетилену і сорбіту і
11) карбонатних солей.
16. Композиція згідно з пунктом 11, де згаданий солюбілізувальний агент вибирають з аспартаму, гліцерил монокаприлату, гліцерил монолаурату, ацетату кальцію, аскорбінової кислоти, лимонної кислоти, глютамінової кислоти.
17. Композиція, що містить сертралін або його фармацевтично прийнятну сіль та солюбілізувальний агент, в кількості, що достатня для одержання, in vivo, Сmax і/або AUC, що є більшими, як мінімум, на 10%, ніж Сmax і/або AUC, що забезпечується композицією порівняння, що є ідентичною заявленій, але не містить згаданого солюбілізувального агента, за умови, що згаданий солюбілізувальний агент не є альгіновою кислотою, цитратом натрію, карбонатом кальцію або поліетиленгліколем з молекулярною вагою, вищою ніж 3350.
18. Композиція згідно з пунктом 17, де співвідношення сертраліну або його фармацевтично прийнятної солі до солюбілізувального агента становить 1:0,01-1,5.
19. Композиція згідно з пунктом 17, де згадані Сmax і/або AUC, що забезпечуються згаданою композицією, що містить солюбілізувальний агент, є, щонайменше, на 15% вищими, ніж відповідні Сmax і/або AUC, викликані згаданою композицією порівняння.
20. Композиція згідно з пунктом 19, де згадані Сmax і/або AUC, що забезпечуються згаданою композицією, що містить солюбілізувальний агент, є, щонайменше на 20% вищими, ніж відповідні Сmax і/або AUC, викликані згаданою композицією порівняння.
21. Композиція згідно з пунктом 17, що є дозованою формою швидкого вивільнення.
22. Композиція згідно з пунктом 17, що є дозованою формою контрольованого вивільнення.
23. Композиція згідно з пунктом 17, де згаданий солюбілізувальний агент вибирають з:
1) органічних кислот та солей органічних кислот;
2) часткових гліцеридів;
3) гліцеридів;
4) похідних гліцериду;
5) поліетиленгліколевих естерів;
6) поліпропіленгліколевих естерів;
7) естерів полігідрованих спиртів;
8) поліоксіетиленових етерів;
9) естерів сорбіту;
10) естерів поліоксіетилену і сорбіту і
11) карбонатних солей.
24. Композиція згідно з пунктом 17, де згаданий солюбілізувальний агент вибирають з: аспартаму, гліцерил монокаприлату, гліцерил монолаурату, ацетату кальцію, аскорбінової кислоти, лимонної кислоти, глютамінової кислоти.
25. Спосіб підвищення розчинності сертраліну у водному середовищі використання, що містить іони хлору, в якому вводять згаданий сертралін в назване середовище використання у вигляді композиції, що додатково включає солюбілізувальний агент, за умови, що згаданий солюбілізувальний агент не є альгіновою кислотою, цитратом натрію, карбонатом кальцію або поліетиленгліколем з молекулярною вагою, вищою ніж 3350.
26. Спосіб згідно з пунктом 25, де концентрація розчиненого сертраліну в згаданому середовищі використання, що також містить згаданий солюбілізатор є, щонайменше, в 1,5 рази вищою, ніж концентрація сертраліну, що забезпечується композицією порівняння, що є ідентичною згаданій композиції, яка містить солюбілізувальний агент, за виключенням включення згаданого солюбілізувального агента.
27. Спосіб згідно з пунктом 25, де згаданим середовищем використання є шлунково-кишковий тракт.
28. Спосіб згідно з пунктом 25, де згаданим середовищем використання є водне тестувальне середовище, що містить іони хлору.
29. Спосіб згідно з пунктом 28, де згаданим середовищем використання є 0,075 Μ розчин хлориду натрію.
30. Спосіб згідно з пунктом 25, де згаданою композицією є дозована форма швидкого вивільнення.
31. Спосіб згідно з пунктом 25, де згаданою композицією є дозована форма контрольованого вивільнення.
32. Спосіб згідно з пунктом 25, де згаданий солюбілізувальний агент вибирають з:
1) органічних кислот та солей органічних кислот;
2) часткових гліцеридів;
3) гліцеридів;
4) похідних гліцериду;
5) поліетиленгліколевих естерів;
6) поліпропіленгліколевих естерів;
7) естерів полігідрованих спиртів;
8) поліоксіетиленових етерів;
9) естерів сорбіту;
10) естерів поліоксіетилену і сорбіту і
11) карбонатних солей.
Текст
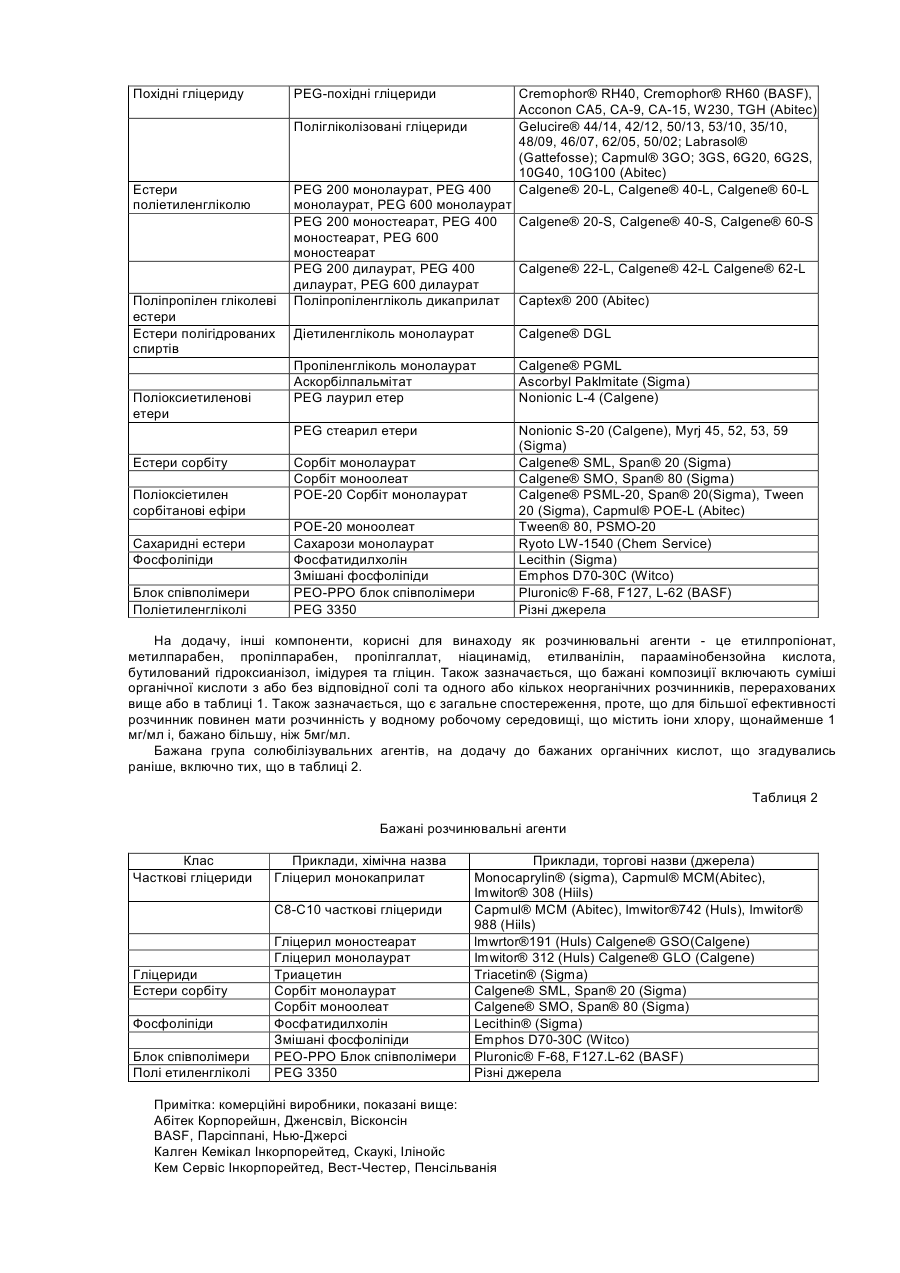
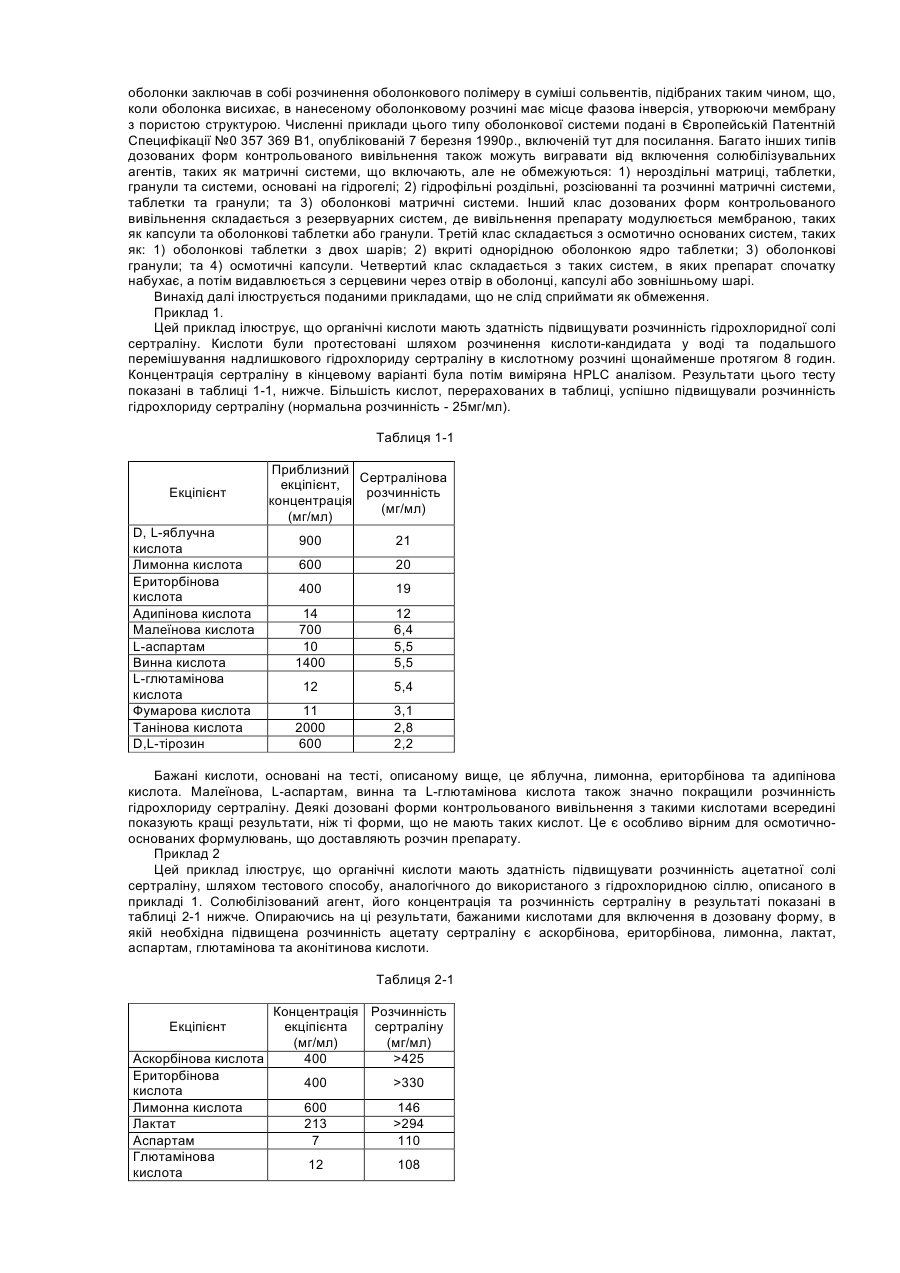
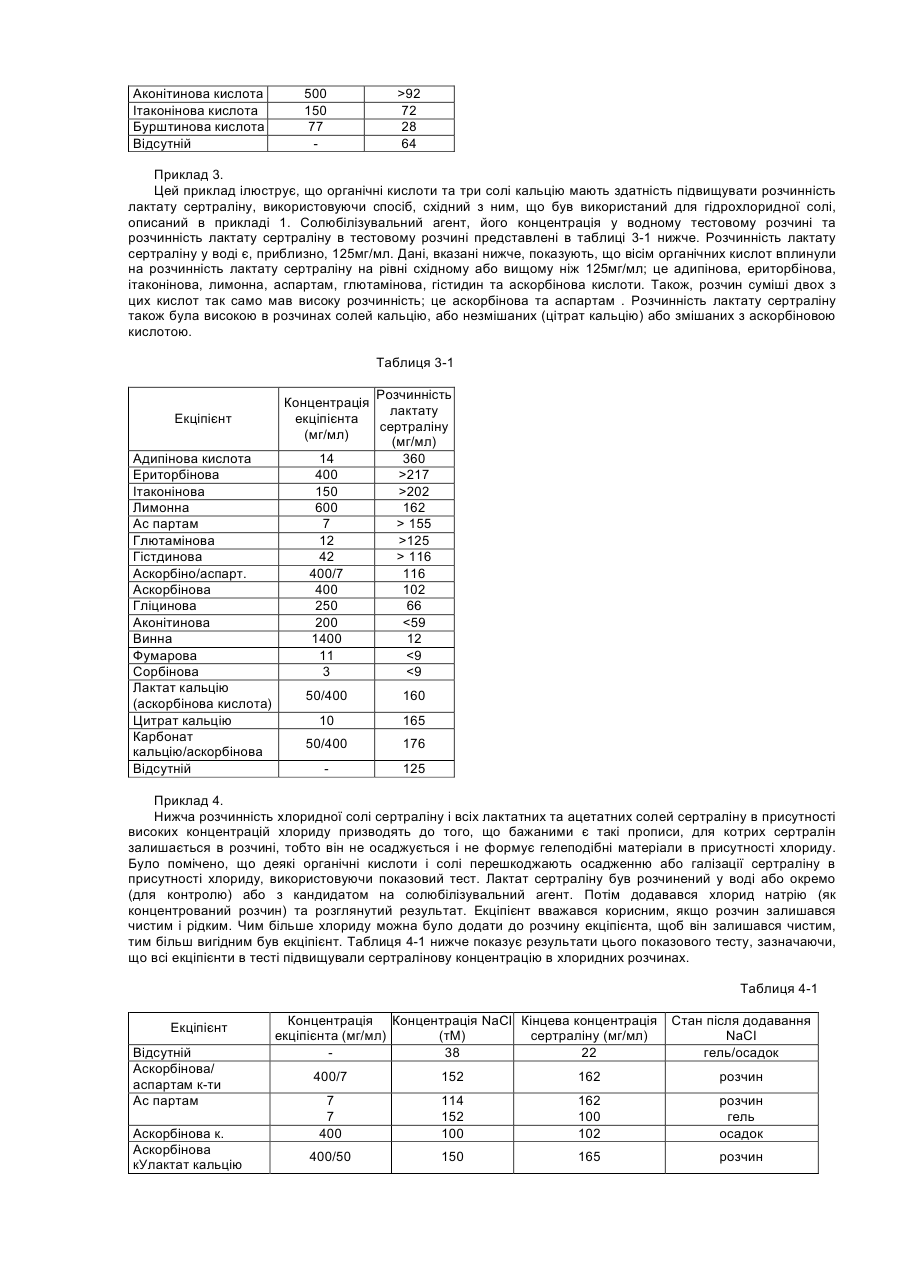
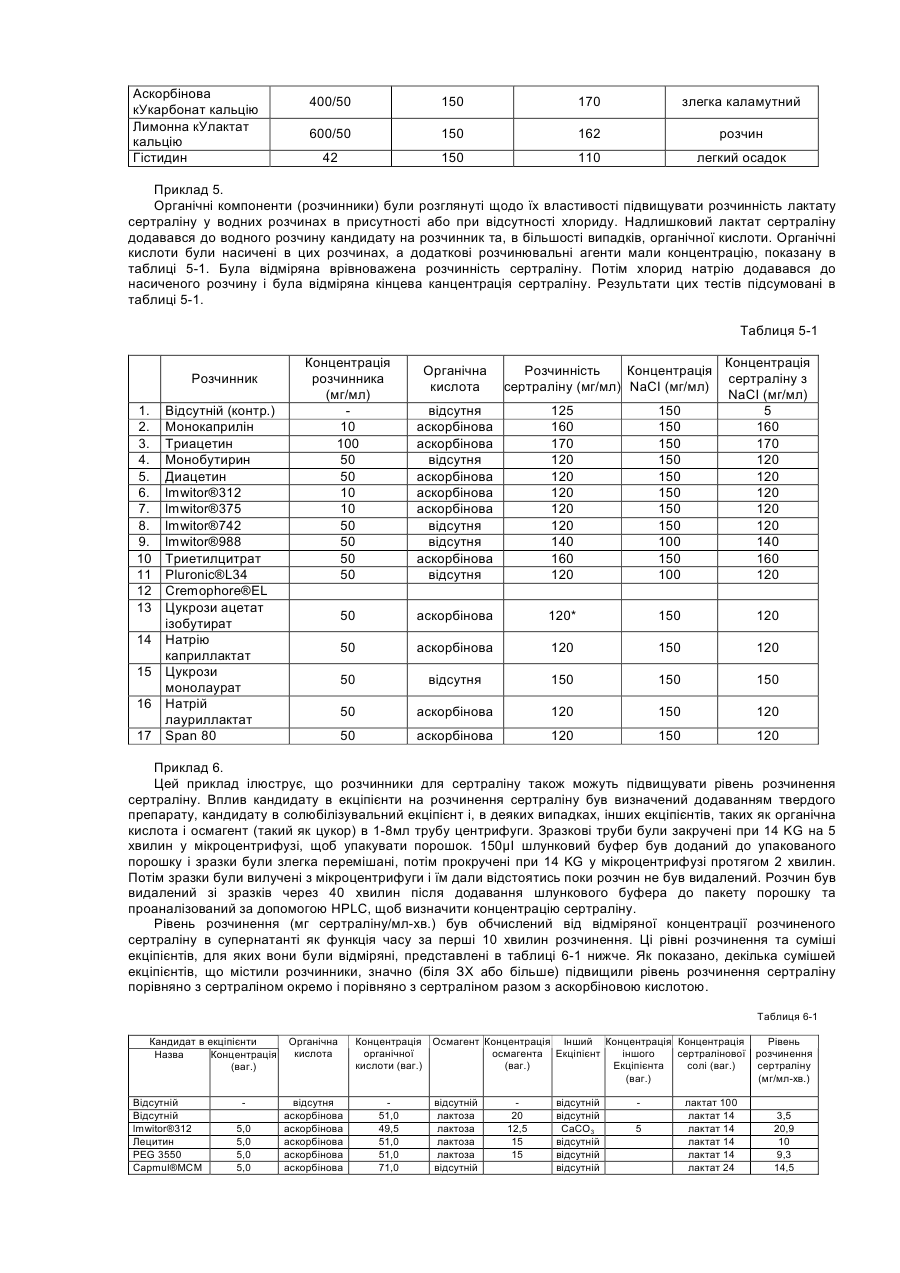
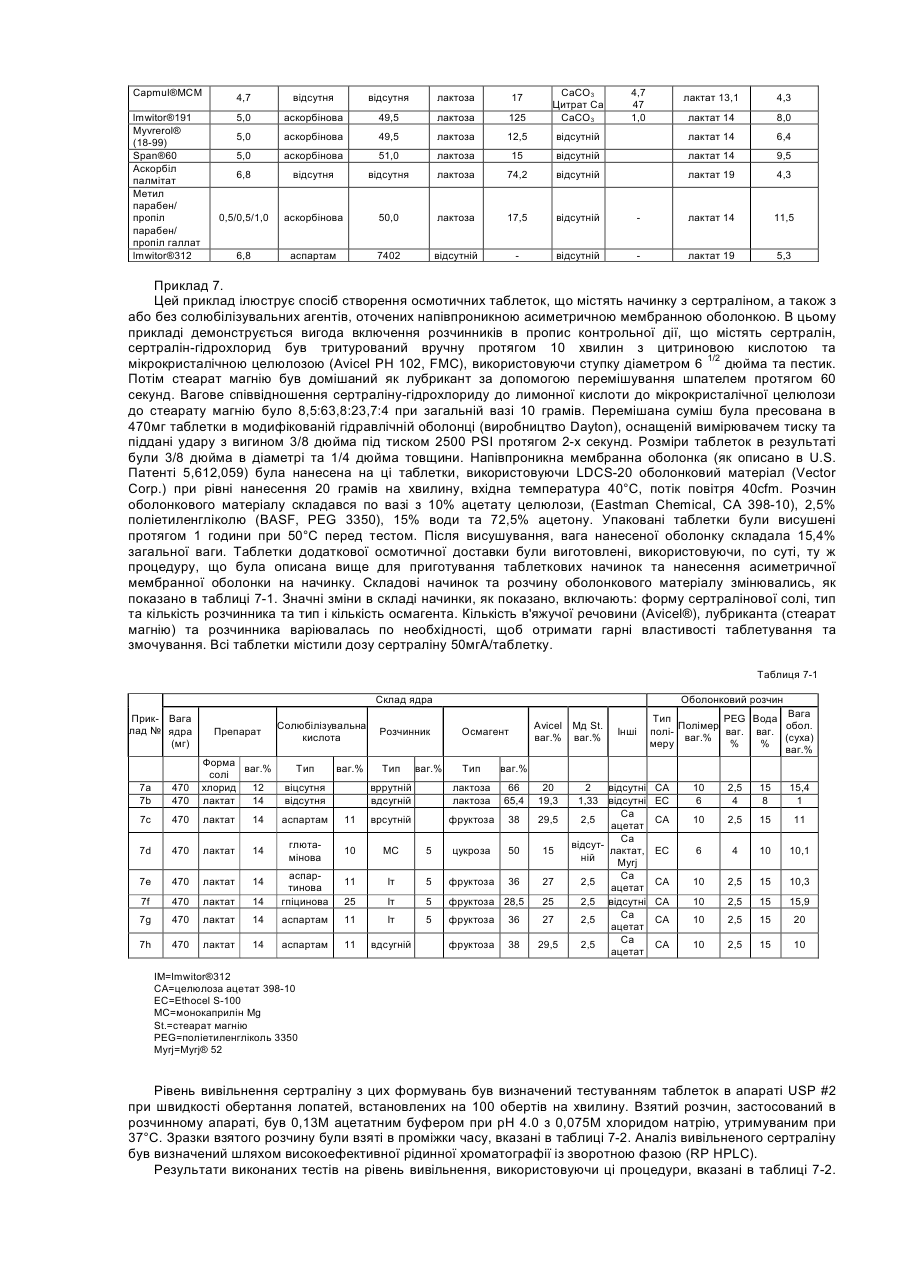
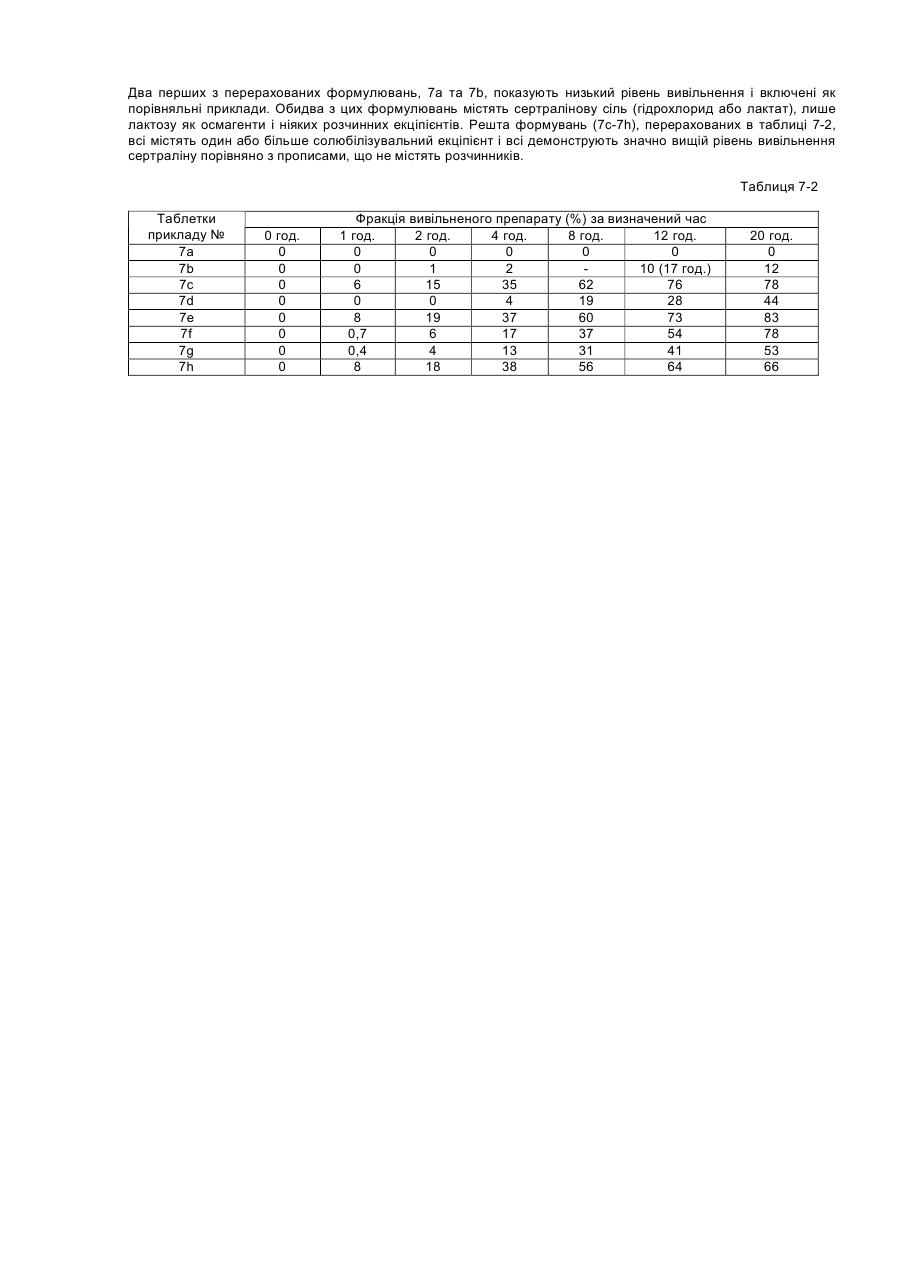
Цей винахід стосується композиції, що складається з сертраліну або його фармацевтично прийнятної солі та солюбілізувального агенту, який попереджає утворення гелю або, іншими словами, підтримує розчинність сертраліну в середовищі використання, що містить хлорид-іони. Винахід, надалі, стосується способу лікування психіатричних або інших хвороб, який полягає в призначенні сертраліну в такій розчинній композиції ссавцю, у тому числі людині, які потребують такого лікування. Сертралін є селективним інгібітором повторної реакції серотоніну (SSRI), що використовується як антидепресант та аноректичний агент, також в лікуванні нав'язливо-примусових ідей, предменструального дисфоричного розладу, пост-травматичного стресового розладу, хімічної залежності, розладів, пов'язаних з хвилюванням, панікою та передчасною еяколяцією. Сертралін, зазвичай, призначається для терапії депресивних захворювань, загальною дозою від 50 до 200 мг на день. Сертралін має період напіврозпаду 23 години і призначається один раз на день. З комерційного аспекту, сертралін є прийнятним як гідрохлоридна сіль, що є, безсумнівно, терапевтично ефективною, багато пацієнтів спробували на собі позитивні сторони цього препарату. Деякі форми сертраліну, особливо солі, що показують високу розчинність, можуть, однак, бути проблематичними. Такі солі, що загалом мають розчинність у воді більшу за 10мл/мг, можуть проявляти тенденцію до утворення гелю і/або проявляти зменшену розчинність (наприклад, осаджуватися як сіль або як вільна основа, що мають меншу розчинність в середовищі використання ніж форма солі, що була спочатку призначена), коли попадають в середовище використання, що містить іони хлору, таке, як шлунково-кишковий тракт. Гель, сам по собі, має тенденцію до повільного розчинення, тобто вивільняє сертралін з малою швидкістю, таким чином впливаючи на засвоєння. Ще невідомо, чи є утворення цього гелю єдиним механізмом, що перешкоджає розчинності сертраліну в середовищі використання. Однак, терапевтичні складнощі можуть відповідно зростати від призначення дозованої форми швидкого вивільнення in vivo, якщо розчинність є залежною, незважаючи на механізм. Проблеми також можуть зростати у випадку дозованих форм контрольованого вивільнення, тому що профіль контрольованого вивільнення дозованої форми може бути зміненим in vivo через фактори, що впливають на розчинність. Непередбачуваний феномен утворення гелю з сертралінових солей в середовищі, що містить іони хлору, може, таким чином, створювати терапевтичні складнощі через несподівану зміну профілю вивільнення дозованої форми, як при швидкому, так і при контрольованому вивільненні. Механізм утворення гелю сертраліну не є добре зрозумілим і може бути ще більш проблематичним з терапевтичного боку, тому що характеристики вивільнення гелю, утвореного форм in situ не можна передбачити. Особливо ж, утворення гелю сертраліну в дозованих формах подовженого вивільнення може бути шкідливою в тих системах подовженого вивільнення, що відомі як невимивні матричні системи, резервуарні системи та осмотичні системи. В кожній з цих типів форм препарату подовженої дії вивільнення залежить від транспортування його на відстань у межах засобу (матриці або оболонкового шару) до оточуючої рідини. Це транспортування зможе виникати при дифузивному або конвективному механізмах. В обох механізмах утворення гелю може зменшити транспортування на порядок від величини або більше і, в деяких випадках, може призвести до проблем з оболонкою, що показує неповне вивільнення препарату (наприклад, менше ніж 70% загальної ваги препарату в формі). Цей винахід забезпечує композицію, придатну для призначення ссавцям, включаючи людину; яка містить сертралін або його фармацевтично прийнятну сіль та певну кількість ексціпієнту, зазначеного тут як «солюбілізувальний агент», достатню, щоб забезпечити концентрацію солюбілізованого сертраліну в середовищі використання, що містить іони хлору, що є щонайменше в 1,5 рази вищою, переважно в 2 рази, більш переважно в З рази вищою ніж концентрація, що забезпечується композицією порівняння матеріалу (тобто, контрольною), ідентичною даній композиції, за виключенням названого солюбілізувального агенту. Середовища використання являють собою, головним чином, водні in vivo травні рідини шлунково-кишкового (GI) тракту, включаючи шлунок, тонку кишку та товсту кишку; та водні in vitro тестові середовища, що містять іони хлору, як буде описано нижче. Композиції підходять для формування в оральні дозовані форми, включаючи таблетки, капсули, пігулки, порошки для оральної суспензії та дозовані упаковки препарату (інколи згадуються у даній галузі як «саше»). Крім того, композиції можуть використовуватись в рідких дозованих формах, таких як оральні розчини або суспензії та ін'єкційні форми. Для пристосування композицій цього винаходу до оральних дозованих форм, можуть бути застосовані стандартні посібники, відомі в даній галузі. Композиція може додатково включати інші відомі фармацевтичні інгредієнти і/або фармацевтично прийнятні носії. Щодо цього винаходу, було визначено, що у випадку з дозованими формами, що містять сертралінові солі, що утворюють гелі або які, іншими словами, проявляють зменшену розчинність в середовищі використання, їхня розчинність може бути вигідно збільшена, а в деяких випадках в'язкість розчину може бути вигідно зменшена, шляхом використання сертралінової солі разом з розчинним агентом, що підвищує розчинність сертраліну. Солюбілізувальний агент повинен, бажано, також підтримувати розчинність, тобто, щоб рівень розчиненого сертраліну в середовищі використання, незважаючи на задіяну сіль, підтримувався в концентрації більшій або рівній до 1,5 раз, ніж концентрація сертраліну у подібній формі без солюбілізувального ексціпієнту, щонайменше 2 години. Для багатьох дозованих форм може бути вигідним підтримувати концентрацію сертраліну більшу або рівну до 1,5 раз ніж концентрація сертраліну в подібних формах без солюбілізувального екціпієнту протягом довших періодів часу, такий як 4, 8, 16 або 20 годин, і на це можна вплинути за допомогою вибору та кількості солюбілізувального агента. Було визначено, що в середовищі використання, що містить іони хлору, без солюбілізувального агенту, наприклад, в тестовому середовищі, такому як 0,075Μ розчин хлориду натрію, розчинність сертраліну є, зазвичай, меншою за 10мгА/мл, навіть менше за 5мгА/мл, незважаючи на вибір солі і на той факт, що багато солей самі по собі показують розчинність в чистій воді (тобто без іонів хлору) набагато більшу за 10мгА/мл. Розчинювальні агенти, таким чином, також можуть бути сконструйовані в складні компоненти, що підтримують сертралінову концентрацію в 10мгА/мл або більше в робочих середовищах, що містять іони хлору. Посилання на «солюбілізувальний агент» в різних місцях, включаючи формулу винаходу, потрібно розуміти як можливе включення до використання кількох солюбілізувальних агентів в композиції, доданих окремо або в суміші. Як згадано вище, термін «середовище використання» може відноситись до водних in vivo рідин травлення з шлунку, що містять іони хлору; або in vitro водного середовища, що містить іони хлору, та використовується для тестування дозованої форми на характеристики вивільнення сертраліну. Корисним in vitro тестовим середовищем для цілей цього винаходу є 0,075Μ хлориду натрію. 0,075Μ хлориду натрію є переважним як тестове середовище, завдяки його доступності та подібності концентрації іонів хлору до нижчих рівнів іонів хлору, що є в рідинах шлунково-кишкового тракту. «Blood & Other Body Fluids». Dorothy S. Dittmer та ін., Federation of American Societies for Experimental Biology, Washington, D.C., 1961, стор.404-419. Таким чином, як додаткова риса, цим винаходом забезпечується тест in vitro для визначення того, чи знаходиться дозована форма в рамках цього винаходу. Тобто, винахід забезпечує композицію матеріалу, що містить сертралін або його фармацевтично прийнятну сіль та певну кількість солюбілізувального агенту, достатню, щоб виробити та підтримувати, щонайменше протягом 2-х годин в 0,075Μ хлориді натрію, концентрацію солюбілізувального сертраліну, що є, щонайменше, в 1,5 рази вищою ніж концентрація, що забезпечується композицією порівняння матеріалу, що є ідентичною, за виключенням названого солюбілізувального агенту. Під час тесту повинно застосовуватись перемішування, хоча, як пояснюється нижче, ступінь або тип перемішування, не є критичним. Температура розчину солі не повинна вважатись особливо критичною, якщо вона сягає близько 37°С плюс-мінус 3°С протягом тесту. Екціпієнти, включаючи розчинювальні агенти, повинні бути в бажаній концентрації у тестовому водному середовищі перш ніж додавати сертралін та хлорид натрію. Сертралін потім доводиться до концентрації від 80% до 100% від його концентрації насичення в тестовому розчині. Цей розчин повинен бути зціджений або відфільтрований від будь-яких твердих речовин. До цього розчину, помішуючи, повільно додається розчин 3Μ NaCI, поки концентрація NaCI в тестовому розчині не сягає 0,075М. Концентрація сертраліну в цьому тестовому розчині через 2 години порівнюється з контрольним розчином, зробленим тим же шляхом, з тих самих компонентів, за винятком солюбілізувального агенту. Як альтернатива, солюбілізувальний екціпієнт може бути ідентифікований в тесті in vivo, такому, як перехресне вивчення. В перехресному вивченні in vivo розчинна дозована форма, що містить сертралін, відміряється половині групи з 12 або більше людей і, після відповідного періоду вимивання (наприклад, один тиждень), ті самі суб'єкти одержують дозовану форму майже схожу, за виключенням солюбілізувального агенту. Інша половина групи одержує спочатку нерозчинну дозовану форму, за якою йде розчинна дозована форма. Максимальна концентрація в крові (Сmах) і/або біодоступність, що вимірюється як площа під кривою (AUC) графіка залежності концентрації сертраліну в крові від часу, визначається для кожної групи. За допомогою порівняння можна зробити оцінку розчинної дозованої форми. Якщо середня Сmах або AUC для форми, що містить солюбілізувальний агент, більша за 10%, ніж у формі без солюбілізувального агенту, то солюбілізувальний екціпієнт є втіленням цього винаходу. Переважно, щоб Сmах і/або AUC була більшою, як мінімум, на 15%, більш переважно, щоб один або обидва фактори були більше на 20%. Визначення AUC є добре відомою процедурою і описано, наприклад, у виданні «Pharmacokinetics; Processes and Mathematics», Peter Welling (ACS Monograph 185, Amer.Chem.Soc, Wash.D.C, 1986). Таким чином, як додаткова риса цього винаходу, забезпечується композиція матеріалу, що містить сертралін або його фармацевтично прийнятну сіль та певну кількість солюбілізувального агенту, достатню, щоб впливати in vivo, на Cmax і/або на AUC, що є більшою, як мінімум, на 10%, ніж Сmах і/або AUC, що забезпечується композицією порівняння матеріалу (тобто, контрольною), що є ідентичною, за виключенням вищезгадуваного солюбілізувального агенту. Винахід надалі забезпечує спосіб підвищення розчинності сертраліну в водному середовищі, що містить іони хлору, яке складається з сертраліну, так би мовити, призначеного в композиції з матеріалом, що містить сертралін та солюбілізувальний агент. Винахід є неочікуваним тому, що до нього було невідомо, що: (1) існує феномен зменшеної розчинності сертраліну в середовищах, що містять іони хлору, (2) існує будь-який хімічний агент, що зменшував би або попереджав утворення гелю сертраліну або зменшення розчинності сертраліну в робочих середовищах, що містять іони хлору; або іншим чином впливав би на підвищення розчинності сертраліну в таких робочих середовищах. Термін «солюбілізувальний сертралін» використовується тут по відношенню до композиції, що містить або сертралінову сіль плюс екціпієнт (тобто, солюбілізувальний агент), що попереджає утворення гелю або іншим чином підвищує і, бажано, підтримує розчинність сертраліну або його солі in vivo або in vitro в середовищі використання, що містить іони хлору. Схожим чином, термін «розчиняти» використовується, щоб зазначити, що розчинність сертраліну або солі була підвищена, як мінімум, в 1,5 рази в середовищі використання порівняно з тим, якою вона була б при відсутності солюбілізувального агента. Винахід бажано використовувати з аспартатними, ацетатними, лактатними солями, що проявляють високу розчинність у воді порівняно з вільною основою. Ці солі розкрито в заявці, розгляд якої ще не закінчено, PC 9337 JTJ, поданій як РСТ заявка, з зазначенням Сполучених Штатів і приведена тут для посилання. Для зручності та логічності, посилання на «сертралін» в термінах терапевтичної кількості щодо цього винаходу, включаючи формулу винаходу, відноситься до активного сертраліну, скороченого тут як «мгА», тобто не сіль, не гідратована вільна основа, що має молекулярну вагу 306,2, Кількість в мгА може бути зручно переведена в еквівалентну вагу для будь-якої бажаної солі. Багато солюбілізувальних агентів, корисних тут, можуть бути згруповані в кілька великих категорій: 1. Органічні кислоти та солі органічних кислот; 2. Часткові гліцериди, тобто неповно естерифіковані похідні гліцерину, включаючи моногліцериди та дигліцериди; 3. Гліцериди; 4. Похідні гліцеридів; 5. Етери поліетиленгліколю; 6. Етери поліпропіленгліколю; 7. Етери полігідрованих спиртів; 8. Поліоксіетиленові етери; 9. Естери сорбіту; 10. Естери поліоксіетилену і сорбіту; і 11. Карбонатні солі. Кількість солюбілізувального агента, задіяного в композиції, відповідно до винаходу, залежить від конкретного солюбілізувального агента. У випадку з розчинними агентами, що є органічними кислотами, бажана кількість розчинника може бути обчислена як коефіцієнт помножений на кількість використаного сертраліну, в той час, як коефіцієнт є відношенням розчинності органічної кислоти до розчинності сертралінової солі: (розчинність органічної кислоти або її солі/розчинність сертраліну або сертралінової солі) х кількість сертраліну, де розчинності вимірюються в мг/мл. Вищезгаданий приклад є приблизним, і для оптимізації може бути корисним деяке регулювання. Зазвичай, цей приклад дає кількість, що різниться плюс-минус 25% від фінальної задіяної величини, хоча більші кількості солюбілізувального агенту можуть бути задіяні без будь-яких особливих додаткових переваг. На додачу, солі органічних кислот можуть бути додані для модифікації рН і/або розчинності органічної кислоти, ефективно оптимізуючи ефект розчинності агентів. Для інших типів перерахованих солюбілізувальних агентів типовою кількістю задіяного в дозованій формі солюбілізувального агенту буде від 1 до 150% ваги кількості сертраліну, задіяного в даному випадку, бажано від 1 до 100%, більш бажано від 3 до 75%. Солюбілізований агент в кількості, більшій за 150%, може бути задіяний, хоча вважається, що в більшості випадків не буде забезпечено будь-яких особливих переваг. Солі сертраліну або екціпієнти, що в комбінації з сертраліном допомагають в розчиненні сертраліну, можуть бути вигідними фактично для будь-якого типу сертралінових дозованих форм, призначених для орального прийому, включаючи форми швидкого вивільнення так само, як і системи контрольованого вивільнення, включаючи (1) дозовані форми подовженої дії, що відміряють сертралін під час проходження через шлунково-кишкову систему і (2) системи тривалого вивільнення, що вивільняють сертралін після початкового періоду відстрочки, що йде після ковтання. Системи швидкого вивільнення добре відомі і комерційно прийнятні як в твердих, так і в рідких прописах. Дозовані форми контрольованого вивільнення сертраліну ще обговорюються і є включеними в загально призначений поповнюваний список Pfizer Docket PC 9337 JTJ та PC 9824 JTJ, кожен з них є призначенням РСТ, характерним для Сполучених Штатів і кожен є включеним тут для посилання в усій повноті. Солюбілізований сертралін може прискорити вивільнення з дозованої форми шляхом підвищення градієнту концентрації для дифузно заснованих систем, таких як матричні дозовані форми та резервуарні дозовані форми. Солюбілізований сертралін також може покращити доставку від осмотичних дозованих форм в тому, що більш солюбілізований сертралін може підвищити осмотичний тиск в серцевині та підвищити сертралінову концентрацію в рідині, що накачується або видавлюється з дозованої форми. На додачу, солюбілізований сертралін може покращити пропис подовженої дії, допомагаючи засвоєнню препарату з шлунково-кишкового тракту. Наприклад, більші концентрації препарату в кишках, можуть підвищити засвоєння завдяки вищому градієнту концентрації через кишкову стінку. Помічено, що доступні на даний момент дозовані форми сертраліну - це дозовані форми швидкого вивільнення, що містять гідрохлорид сертраліну. Хоча гідрохлорид довів свою високу ефективність, можливо, що дозовані форми, які містять гідрохлорид, також можуть виграти від додавання солюбілізувального агента. Приклади органічних кислот, корисних для винаходу, включають яблучну, лимонну, ериторбінову, адипінову, глютамінову, аспартам, малеїнову, аконітинову та аскорбінову кислоту. Перевага надається лимонній, ериторбіновій, аскорбіновій, глютаміновій та аспартаму. Солі органічних кислот, таких як лужноземельних металів(магній, кальцій), тобто їх солі, та солі лужних металів (літій, калій, натрій) є також ефективними у вигляді суміші органічних кислот та їх солей. Солі кальцію, такі як карбонат, ацетат, аскорбат, цитрат, моногідратглюконат, лактобіонат, глюцептат, левулинат, пантотенат, пропріонат, двоосновний фосфат та сахарат кальцію є бажаними солями органічної кислоти. Приклади складових в інших категоріях, згаданих вище, викладені в Таблиці 1. Таблиця 1 Розчинювальні агенти Клас Часткові гліцериди Приклади, хімічні назви Гліцерил монокаприлат С8-С10 частков гліцериди Гліцерил моно олеат Гліцериди Гліцерил моно лінолеат Гліцерил моностеарат Гліцерил монолаурат Гліцерил дилаурат Триацетин Приклади, торгова марка, продавець Monocaprylin® (Sigma), Capmul® MCM(Abitec), lmwitor®308 (Huls) Capmul® MCM (Abitec), lmwitor®742 (Huls), Imwitor® 988 (Huls) Myverol® 18-99 (Eastman), Calgene® GMO (Calgene), Capmul® GMO(Abitec) Myverol® 18-92 (Eastman) Imwitor® 191 (Huls) Calgene® GSO(Calgene) Imwitor® 312 (Huls) Calgene® GLO (Calgene) Capmul® GDL (Abitec) Triacetin (Sigma) Похідні гліцериду PEG-похідні гліцериди Cremophor® RH40, Cremophor® RH60 (BASF), Acconon CA5, CA-9, CA-15, W230, TGH (Abitec) Gelucire® 44/14, 42/12, 50/13, 53/10, 35/10, 48/09, 46/07, 62/05, 50/02; Labrasol® (Gattefosse); Capmul® 3GO; 3GS, 6G20, 6G2S, 10G40, 10G100 (Abitec) Calgene® 20-L, Calgene® 40-L, Calgene® 60-L Полігліколізовані гліцериди Естери поліетиленгліколю Поліпропілен гліколеві естери Естери полігідрованих спиртів PEG 200 монолаурат, PEG 400 монолаурат, PEG 600 монолаурат PEG 200 моностеарат, PEG 400 Calgene® 20-S, Calgene® 40-S, Calgene® 60-S моностеарат, PEG 600 моностеарат PEG 200 дилаурат, PEG 400 Calgene® 22-L, Calgene® 42-L Calgene® 62-L дилаурат, PEG 600 дилаурат Поліпропіленгліколь дикаприлат Captex® 200 (Abitec) Естери сорбіту Поліоксіетилен сорбітанові ефіри Сахаридні естери Фосфоліпіди Блок співполімери Поліетиленгліколі Calgene® DGL Пропіленгліколь монолаурат Аскорбілпальмітат PEG лаурил етер Calgene® PGML Ascorbyl Paklmitate (Sigma) Nonionic L-4 (Calgene) PEG стеарил етери Поліоксиетиленові етери Діетиленгліколь монолаурат Nonionic S-20 (Calgene), Myrj 45, 52, 53, 59 (Sigma) Calgene® SML, Span® 20 (Sigma) Calgene® SMO, Span® 80 (Sigma) Calgene® PSML-20, Span® 20(Sigma), Tween 20 (Sigma), Capmul® POE-L (Abitec) Tween® 80, PSMO-20 Ryoto LW-1540 (Chem Service) Lecithin (Sigma) Emphos D70-30C (Witco) Pluronic® F-68, F127, L-62 (BASF) Різні джерела Сорбіт монолаурат Сорбіт моноолеат РОЕ-20 Сорбіт монолаурат РОЕ-20 моноолеат Сахарози монолаурат Фосфатидилхолін Змішані фосфоліпіди РЕО-РРО блок співполімери PEG 3350 На додачу, інші компоненти, корисні для винаходу як розчинювальні агенти - це етилпропіонат, метилпарабен, пропілпарабен, пропілгаллат, ніацинамід, етилванілін, параамінобензойна кислота, бутилований гідроксианізол, імідурея та гліцин. Також зазначається, що бажані композиції включають суміші органічної кислоти з або без відповідної солі та одного або кількох неорганічних розчинників, перерахованих вище або в таблиці 1. Також зазначається, що є загальне спостереження, проте, що для більшої ефективності розчинник повинен мати розчинність у водному робочому середовищі, що містить іони хлору, щонайменше 1 мг/мл і, бажано більшу, ніж 5мг/мл. Бажана група солюбілізувальних агентів, на додачу до бажаних органічних кислот, що згадувались раніше, включно тих, що в таблиці 2. Таблиця 2 Бажані розчинювальні агенти Клас Часткові гліцериди Приклади, хімічна назва Гліцерил монокаприлат С8-С10 часткові гліцериди Гліцериди Естери сорбіту Фосфоліпіди Блок співполімери Полі етиленгліколі Гліцерил моностеарат Гліцерил монолаурат Триацетин Сорбіт монолаурат Сорбіт моноолеат Фосфатидилхолін Змішані фосфоліпіди РЕО-РРО Блок співполімери PEG 3350 Приклади, торгові назви (джерела) Monocaprylin® (sigma), Capmul® MCM(Abitec), Imwitor® 308 (Hiils) Capmul® MCM (Abitec), lmwitor®742 (Huls), Imwitor® 988 (Hiils) lmwrtor®191 (Huls) Calgene® GSO(Calgene) Imwitor® 312 (Huls) Calgene® GLO (Calgene) Triacetin® (Sigma) Calgene® SML, Span® 20 (Sigma) Calgene® SMO, Span® 80 (Sigma) Lecithin® (Sigma) Emphos D70-30C (Witco) Pluronic® F-68, F127.L-62 (BASF) Різні джерела Примітка: комерційні виробники, показані вище: Абітек Корпорейшн, Дженсвіл, Вісконсін BASF, Парсіппані, Нью-Джерсі Калген Кемікал Інкорпорейтед, Скаукі, Ілінойс Кем Сервіс Інкорпорейтед, Вест-Честер, Пенсільванія Хюльс Амеріка, Піскатавей, Нью-Джерсі Сігма, Сент-Луїс, Міссурі Вітко, Х'юстон, Техас. Бажані комбінації солюбілізувальних агентів включають: (1) органічна кислота плюс сіль тієї ж або іншої органічної кислоти, (2) органічна кислота плюс неіонний солюбілізувальний агент, будь-який з таблиці 1, та (3) органічна кислота плюс сіль тієї ж або іншої органічної кислоти плюс неіонний солюбілізувальний агент. Особливо бажані розчинювальні агенти включають аспартам, гліцерилмонокаприлат, гліцерилмонолаурат, ацетат кальцію, аскорбінову кислоту, лимонну кислоту, глутамінову кислоту та карбонат кальцію. Аспартам, гліцерилмонокаприлат, гліцерилмонолаурат, ацетат кальцію є найбільш бажаними. Як обговорювалось раніше, дозована форма може бути протестована в лабораторних умовах, щоб визначити, чи спричиняє екціпієнт солюбілізувальний ефект на сертралін в середовищі використання, що містить іони хлору, і чи є він, таким чином, корисним як солюбілізувальний агент. 0,075Μ розчин натрію хлориду є бажаним для використання як тестовий засіб, хоча інші розчини, що містять іони хлору того ж або вищого рівня концентрації іонів хлориду, ніж 0,075Μ (наприклад, 0,1N НСІ або ізотонічний розчин) можуть бути використані, щоб визначити солюбілізувальний ефект тестового екціпієнта. В деяких випадках зменшена розчинність є очевидною просто шляхом додавання дозованої форми, такою як порошок, до тестового засобу, тому що помітна гелізація. Аналогічні проблеми можуть бути очевидними в дозованій формі, такій як таблетка, якщо таблетка, наприклад розрізана і на її відкритій поверхні помітна гелізація. Рекомендується спочатку зробити розчин, що містить бажані екціпієнти, включаючи розчинювальні агенти. Екціпієнти можуть бути будьякої концентрації, що підходить до заплановоної дозованої форми, але типовою концентрацією для органічних кислот та розчинних солей або сахаридів є 80-100% насичення. Для інших компонентів, подібних до змащувачів, концентрація типово варіює від 1 до 150% концентрація сертраліну в тестовому розчині. Сертралін додається до цього розчину, що містить екціпієнт при типовій концентрації 80-100% насичення. Розчин фільтрується або зціджується, щоб видалити тверді частки, а потім ЗМ розчин хлориду натрію додається, поки концентрація хлориду натрію не сягає 0,075М. Концентрований розчин хлориду натрію повинен додаватися по краплям з перемішуванням. Цей тестований препарат повинен зберігатись при температурі приблизно 37°С щонайменше дві години, за цей час визначається концентрація сертраліну в розчині. Бажано, щоб концентрація сертраліну підтримувалась протягом 4 годин, краще 8 годин, ще краще 16 годин, ідеально - 20 годин, щонайменше. Кількість нестабільності - некритична. Коли береться зразок тестового препарату, можна задіяти фільтрування або обробку на центрифузі, щоб одержати розчин, вільний від твердих часток або гелевого матеріалу, а також, щоб запобігти включення домішок (що можуть містити сертралін) у зразок. Аналіз зразків на визначення концентрації сертраліну може бути проведений декількома стандартними аналітичними способами, такими як високоефективна рідинна хроматографія (HPLC). Наприклад, концентрація сертраліну може бути визначена, використовуючи HPLC із зворотною фазою з колонкою ULTRACARB® 5ODS 4,6x250мм (Phenomonex, Torrance, CA) та суміш оцтової кислоти, триетиламіну, ацетонітрилу та води, як мобільної фази, з ультрафіолетовим визначенням на 230нм. Наприклад, мобільна фаза може бути виготовлена шляхом комбінування, змішуючи 2,86мл оцтової кислоти, 3,48мл триетиламіну, розчинюючи літром води, фільтруючи та дегазуючи. Рівень швидкості типово сягає величини порядку 1,5мл/хв, а час утримання - біля 4 хвилин. Дозовані форми з розчинним агентом можуть бути утворені по стандартним технологіям. Дозовані форми швидкого вивільнення можуть бути в капсулах, таблетках, гранулах, рідких розчинах або суспензіях. Капсульовані форми можуть бути або з м'якого желатину, де сертралін або розчиняється, або розповсюджується в середині капсули, або з твердого желатину, наповненого гранулами, таблетками, або рідким розчином, або суспензією, наповнювачем. Таблетки швидкого вивільнення можуть вироблятися по стандартним технологіям в промисловості простим включенням солюбілізувального агента як одного або декількох екціпієнтів таблетки. Подібним чином, гранули швидкого вивільнення можуть бути вироблені включенням солюбілізувальних агентів, використовуючи такі технології, як розширювальна сферонізація, обертальна грануляція, включення в оболонку або інші способи, загальноприйнятні в фармацевтичній індустрії. Рідкі форми, що містять розчин або суспензії, або те й інше, можуть бути виготовленні способами, загальноприйнятними в фармацевтичній індустрії. Дозовані форми контрольованого вивільнення також можуть бути зроблені включенням солюбілізувальних агентів за способами, звичним в фармацевтичній індустрії. Дозовані форми контрольованої дії включають велику кількість дозованих форм, що контролюють рівень розчинення або рівень вивільнення сертраліну з дозованої форми. Такі дозовані форми включають, але не обмежуються формами подовженої дії, уповільненої, а потім швидкого вивільнення, уповільненої, а потім подовженої дії, та дозовану форму з малою порцією сертраліну, що швидко вивільняється, а потім йде основна маса сертраліну з подовженим вивільненням дози. Інші алгоритми вивільнення також можуть бути задіяні, скажімо, пульсоване вивільнення. Багато цих формувань описано у вищезгаданих поповнюваних призначеннях PC 9337 JTJ та PC 9824 JTJ. Стандартні техніки можуть бути використані для виробництва дозованих форм контрольованої дії. Наприклад, таблетки можна виробляти звичайно використовуваними способами безпосереднього пресування, що містять сертралін та солюбілізувальний агент. Щоб забезпечити подовжене вивільнення, для цих таблеток можна застосувати оболонку з чутливим рН, використовуючи оболонку з боковою вентиляцією (наприклад, НСТ-60 оболонку для таблеток, корпорація Vector). Оболонка з рН чутливістю опирається середовищам з низьким рН, таким, що є типовим для шлунку, а потім розчиняється, вивільняючи сертралін, у середовищі з нейтральним рН, що є типовим для тонкої кишки. Такі оболонкові матеріали (наприклад, фталат ацетатцелюлози або співполімер метакрилової кислоти) є звичайними в фармацевтичній індустрії. Як альтернатива, таблетки можуть бути заключені в пористу або напівпроникну мембранну оболонку, щоб забезпечити подовжене вивільнення начинки таблеток. Особливо корисний процес для нанесення мембранної оболонки заключав в собі розчинення оболонкового полімеру в суміші сольвентів, підібраних таким чином, що, коли оболонка висихає, в нанесеному оболонковому розчині має місце фазова інверсія, утворюючи мембрану з пористою структурою. Численні приклади цього типу оболонкової системи подані в Європейській Патентній Специфікації №0 357 369 В1, опублікованій 7 березня 1990p., включеній тут для посилання. Багато інших типів дозованих форм контрольованого вивільнення також можуть вигравати від включення солюбілізувальних агентів, таких як матричні системи, що включають, але не обмежуються: 1) нероздільні матриці, таблетки, гранули та системи, основані на гідрогелі; 2) гідрофільні роздільні, розсіюванні та розчинні матричні системи, таблетки та гранули; та 3) оболонкові матричні системи. Інший клас дозованих форм контрольованого вивільнення складається з резервуарних систем, де вивільнення препарату модулюється мембраною, таких як капсули та оболонкові таблетки або гранули. Третій клас складається з осмотично основаних систем, таких як: 1) оболонкові таблетки з двох шарів; 2) вкриті однорідною оболонкою ядро таблетки; 3) оболонкові гранули; та 4) осмотичні капсули. Четвертий клас складається з таких систем, в яких препарат спочатку набухає, а потім видавлюється з серцевини через отвір в оболонці, капсулі або зовнішньому шарі. Винахід далі ілюструється поданими прикладами, що не слід сприймати як обмеження. Приклад 1. Цей приклад ілюструє, що органічні кислоти мають здатність підвищувати розчинність гідрохлоридної солі сертраліну. Кислоти були протестовані шляхом розчинення кислоти-кандидата у воді та подальшого перемішування надлишкового гідрохлориду сертраліну в кислотному розчині щонайменше протягом 8 годин. Концентрація сертраліну в кінцевому варіанті була потім виміряна HPLC аналізом. Результати цього тесту показані в таблиці 1-1, нижче. Більшість кислот, перерахованих в таблиці, успішно підвищували розчинність гідрохлориду сертраліну (нормальна розчинність - 25мг/мл). Таблиця 1-1 Екціпієнт D, L-яблучна кислота Лимонна кислота Ериторбінова кислота Адипінова кислота Малеїнова кислота L-аспартам Винна кислота L-глютамінова кислота Фумарова кислота Танінова кислота D,L-тірозин Приблизний Сертралінова екціпієнт, розчинність концентрація (мг/мл) (мг/мл) 900 21 600 20 400 19 14 700 10 1400 12 6,4 5,5 5,5 12 5,4 11 2000 600 3,1 2,8 2,2 Бажані кислоти, основані на тесті, описаному вище, це яблучна, лимонна, ериторбінова та адипінова кислота. Малеїнова, L-аспартам, винна та L-глютамінова кислота також значно покращили розчинність гідрохлориду сертраліну. Деякі дозовані форми контрольованого вивільнення з такими кислотами всередині показують кращі результати, ніж ті форми, що не мають таких кислот. Це є особливо вірним для осмотичнооснованих формулювань, що доставляють розчин препарату. Приклад 2 Цей приклад ілюструє, що органічні кислоти мають здатність підвищувати розчинність ацетатної солі сертраліну, шляхом тестового способу, аналогічного до використаного з гідрохлоридною сіллю, описаного в прикладі 1. Солюбілізований агент, його концентрація та розчинність сертраліну в результаті показані в таблиці 2-1 нижче. Опираючись на ці результати, бажаними кислотами для включення в дозовану форму, в якій необхідна підвищена розчинність ацетату сертраліну є аскорбінова, ериторбінова, лимонна, лактат, аспартам, глютамінова та аконітинова кислоти. Таблиця 2-1 Концентрація Розчинність екціпієнта сертраліну (мг/мл) (мг/мл) Аскорбінова кислота 400 >425 Ериторбінова 400 >330 кислота Лимонна кислота 600 146 Лактат 213 >294 Аспартам 7 110 Глютамінова 12 108 кислота Екціпієнт Аконітинова кислота Ітаконінова кислота Бурштинова кислота Відсутній 500 150 77 >92 72 28 64 Приклад 3. Цей приклад ілюструє, що органічні кислоти та три солі кальцію мають здатність підвищувати розчинність лактату сертраліну, використовуючи спосіб, східний з ним, що був використаний для гідрохлоридної солі, описаний в прикладі 1. Солюбілізувальний агент, його концентрація у водному тестовому розчині та розчинність лактату сертраліну в тестовому розчині представлені в таблиці 3-1 нижче. Розчинність лактату сертраліну у воді є, приблизно, 125мг/мл. Дані, вказані нижче, показують, що вісім органічних кислот вплинули на розчинність лактату сертраліну на рівні східному або вищому ніж 125мг/мл; це адипінова, ериторбінова, ітаконінова, лимонна, аспартам, глютамінова, гістидин та аскорбінова кислоти. Також, розчин суміші двох з цих кислот так само мав високу розчинність; це аскорбінова та аспартам . Розчинність лактату сертраліну також була високою в розчинах солей кальцію, або незмішаних (цітрат кальцію) або змішаних з аскорбіновою кислотою. Таблиця 3-1 Екціпієнт Адипінова кислота Ериторбінова Ітаконінова Лимонна Ас партам Глютамінова Гістдинова Аскорбіно/аспарт. Аскорбінова Гліцинова Аконітинова Винна Фумарова Сорбінова Лактат кальцію (аскорбінова кислота) Цитрат кальцію Карбонат кальцію/аскорбінова Відсутній Розчинність Концентрація лактату екціпієнта сертраліну (мг/мл) (мг/мл) 14 360 400 >217 150 >202 600 162 7 > 155 12 >125 42 > 116 400/7 116 400 102 250 66 200
ДивитисяДодаткова інформація
Назва патенту англійськоюSoluble sertraline compositions
Назва патенту російськоюРастворимые композиции сертралина
МПК / Мітки
МПК: A61K 31/137, A61K 9/20, A61K 31/135
Мітки: сертраліну, композиції, солюбілізовані
Код посилання
<a href="https://ua.patents.su/10-67741-solyubilizovani-kompozici-sertralinu.html" target="_blank" rel="follow" title="База патентів України">Солюбілізовані композиції сертраліну</a>
Попередній патент: Спосіб часткового окислення вуглеводнів та пальник для його здійснення
Наступний патент: Спосіб виготовлення заготовок артилерійської гільзи і піддона та інших подібних деталей
Випадковий патент: Установка для стерилізації рідких середовищ