Кристалічна і аморфна форма триазоло(4,5-d)піримідину, спосіб його одержання, фармацевтична композиція та спосіб лікування або профілактики артеріальних тромботичних ускладнень
Формула / Реферат
1. Триазоло(4,5-d)піримідин формули (І):
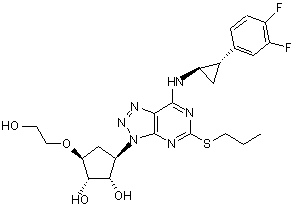 (І)
(І)
по суті в кристалічній формі.
2. Сполука формули (І) за п. 1, яка знаходиться в по суті безводній формі.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки високої інтенсивності при 5,3° (±0,1°), 20,1° (±0,1), 20,7° (±0,1°), 21,0° (±0,1°) і 21,3° (±0,1°) ![]() .
.
4. Сполука формули (І) за пп. 1 або 3, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки при 5,3° (±0,1°), 8,0° (±0,1°), 9,6° (±0,1°), 13,9° (±0,1°), 15,3° (±0,1°), 20,1° (±0,1°), 20,7° (±0,1°), 21,0° (±0,1°), 21,3° (±0,1°), 26,2° (±0,1°) і 27,5° (±0,1°) ![]() .
.
5. Сполука формули (І) за одним з пп. 1, 3 або 4, яка відрізняється тим, що крива диференціальної скануючої калориметрії має точку початку плавлення, що знаходиться в межах 146-152°С.
6. Сполука формули (І) за п. 1, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки високої інтенсивності при 5,5° (±0,1°), 13,5° (±0,1), 18,3° (±0,1°), 22,7° (±0,1°) і 24,3° (±0,1°) ![]() .
.
7. Сполука формули (І) за пп. 1 або 6, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки при 5,5° (±0,1°), 6,8° (±0,1°), 10,6° (±0,1°), 13,5° (±0,1°), 14,9° (±0,1°), 18,3° (±0,1°), 19,2° (±0,1°), 22,7° (±0,1°), 24,3° (±0,1°) і 27,1° (±0,1°) ![]() .
.
8. Сполука формули (І) за одним з пп. 1-6 або 7, яка відрізняється тим, що крива диференціальної скануючої калориметрії має точку початку плавлення, що знаходиться в межах 136-139°С.
9. Сполука формули (І) за п. 1, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки високої інтенсивності при 14,0° (±0,1°), 17,4° (±0,1), 18,4° (±0,1°), 21,4° (±0,1°) і 24,1° (±0,1°) ![]() .
.
10. Сполука формули (І) за пп. 1 або 9, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки при 5,6° (±0,1°), 12,5° (±0,1°), 14,0° (±0,1°), 17,4° (±0,1°), 18,4° (±0,1°), 21,4° (±0,1°), 22,2° (±0,1°), 22,9° (±0,1°), 24,1° (±0,1°) і 24,5° (±0,1 °) ![]() .
.
11. Сполука формули (І) за одним з пп. 1, 9 і 10, яка відрізняється тим, що крива диференціальної скануючої калориметрії має точку початку плавлення, що знаходиться в межах 127-132°С.
12. Сполука формули (І) за п. 1, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки високої інтенсивності при 4,9° (±0,1°), 9,2° (±0,1), 11,6° (±0,1°), 15,6° (±0,1°) і 16,4° (±0,1°) ![]() .
.
13. Сполука формули (І) за пп. 1 або 12, яка відрізняється тим, що її порошкова рентгенограма містить характерні піки при 4,9° (±0,1°), 6,0° (±0,1°), 9,2° (±0,1°), 11,6° (±0,1°), 12,8° (±0,1°), 15,6° (±0,1°), 16,4° (±0,1°), 17,2° (±0,1°) і 18,1° (±0,1°) ![]() .
.
14. Сполука формули (І) за одним з пп. 1, 12 або 13, яка відрізняється тим, що крива диференціальної скануючої калориметрії має точку початку плавлення, що знаходиться приблизно на рівні 139°С.
15. Сполука формули (І) в по суті аморфній формі.
16. Сполука формули (І), яка знаходиться в формі гідрату.
17. Суміш сполуки формули (І) за одним з пп. 6-8 і сполуки формули (І) за одним з пп. 9-11.
18. Спосіб одержання сполуки за п. 1, в якому сполуки формули (І) кристалізують з розчинника, вибраного з групи: нижчих алкілацетатів, нижчих алкілспиртів, аліфатичних і ароматичних вуглеводнів, діалкілефірів, діалкілкетонів, ацетонітрилу, води і їх суміші.
19. Спосіб за п. 18, в якому розчинник вибраний з групи: етанолу, етилацетату, ізопропанолу, ізооктану, ацетонітрилу, води і їх суміші.
20. Спосіб за п. 19, в якому розчинник вибраний з групи: суміші метанол-вода, етанолу, етилацетату, суміші етанол-вода, суміші ізопропанол-вода, суміші етилацетат-ізооктан і ацетонітрилу.
21. Спосіб за одним з пп. 18-20 одержання сполуки за одним з пп. 3-5, в якому розчинником є суміш метанол-вода.
22. Спосіб одержання сполуки за одним з пп. 3-5 з використанням затравки кристалів.
23. Спосіб за п. 22, в якому затравку кристалів готують плавленням сполуки за одним з пп. 6-8.
24. Спосіб за одним з пп. 18-20, який відрізняється тим, що розчинником, що використовують, є етилацетат, і що одержана сполука являє собою сполуку за одним з пп. 6-8.
25. Спосіб за одним з пп. 18-20, який відрізняється тим, що розчинником, що використовують, є спирт, і що одержана сполука являє собою сполуку за одним з пп. 9-11.
26. Спосіб одержання сполуки за одним з пп. 9-11, який включає суспендування сполуки формули (І) в системі розчинників ІПС/вода при температурі в межах 5-65°С.
27. Спосіб за одним з пп. 18-20, який відрізняється тим, що розчинником, що використовують, є ацетонітрил, і що одержана сполука являє собою сполуку за одним з пп. 12-14.
28. Сполука за будь-яким з пп. 1-17 для застосування як лікарського препарату.
29. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за одним з пп. 1-17 в суміші з фармацевтично прийнятним ад'ювантом, розріджувачем або носієм.
30. Фармацевтична композиція, що містить сполуку за одним з пп. 1-17 для застосування з метою профілактики артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярним і периферичним судинним захворюванням.
31. Застосування сполуки за одним з пп. 1-17 у виробництві лікарського препарату з метою профілактики артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярним і периферичним судинним захворюванням.
32. Спосіб лікування або профілактики артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярним і периферичним судинним захворюванням, який включає введення людині, страждаючій або схильній до такого захворювання, терапевтично ефективної кількості сполуки за одним з пп. 1-17.
Текст
Даний винахід відноситься до форм хімічної сполуки, зокрема, кристалічної і аморфної формам, більш конкретно, чотирьом кристалічним формам і аморфній формі. Винахід, далі, відноситься до способів одержання таких форм, фармацевтичних композицій, що включають сполуки в кристалічній і/або аморфній формі, і до терапевтичного застосування таких форм. При складанні лікарських композицій важливо, щоб лікарська сполука знаходилася в формі, в якій з нею було б зручно поводитися і обробляти. Це важливе не тільки з точки зору одержання комерційно життєздатного виробничого процесу, але також з точки зору подальшого виробництва фармацевтичних композицій, що включають активну сполуку. Хімічна стабільність, стабільність в твердому стані і термін зберігання активних компонентів також є дуже важливими чинниками. Лікарська сполука і композиції, що включають її, повинні володіти здатністю ефективно зберігатися протягом значних періодів часу, не виявляючи значної зміни фізико-хімічних властивостей активного компонента (наприклад, його хімічного складу, щільності, гігроскопічності і розчинності). Крім того, також є важливим представити лікарський препарат в формі, яка є якомога більш чистою. У цьому відношенні аморфні сполуки можуть представляти значні проблеми. Наприклад, з такими сполуками важче поводитися і включати їх в лікарські форми в порівнянні з кристалічною сполукою, за рахунок сумнівної розчинності, і часто виявляється, що вони нестабільні і хімічно забруднені. Фахівцеві в даній області буде зрозуміло, що, якщо лікарський препарат можна легко одержувати в стабільній кристалічній формі, то можна вирішити вищезгадані проблеми. Таким чином, при виробництві комерційно життєздатних і фармацевтично прийнятних лікарських композицій, бажано, де це можливе, забезпечити лікарський препарат в основному в кристалічній і стабільній формі. Потрібно відмітити, однак, що дана мета не завжди є досяжною. Дійсно, звичайно неможливо передбачити тільки на основі молекулярної структури, якою буде поведінка сполуки при кристалізації, і звичайно це можна встановити тільки емпірично. Адгезія і агрегація тромбоцитів є початковими подіями при тромбозі артерій. Хоч процес адгезії тромбоцитів до субендотеліальної поверхні може грати важливу роль при відновленні пошкоджених стінок судин, агрегація тромбоцитів, яка ініціює цей процес, може викликати гостру тромботичну оклюзію життєво важливих судин, приводячи до патологій з високою смертністю таких, як інфаркт міокарду і нестабільна стенокардія. Успіх втручань, що використовуються для профілактики або полегшення даних станів, такої, як тромболіз і ангіопластика також знаходиться під загрозою оклюзії, що опосередковується тромбоцитами і повторної оклюзії. Було встановлено, що аденозин-5'-дифосфат (ДЦФ) діє як ключовий медіатор тромбозу. Агрегація тромбоцитів, що ДЦФ-індукується опосередковується підтипом Р2Т-рецепторів, розташованих на мембрані тромбоцитів. Р2Т-рецептор (також відомий, як Р2YАДФ або Р2ТАС) в основному бере участь в опосередкуванні агрегації/активації тромбоцитів і є зв'язаним з G-білком рецептором, який ще не клонований. Описані фармакологічні властивості даного рецептора, наприклад, в джерелах Humphries et al., Br. J. Pharmacology (1994), 113, 1057-1063 і Fagura et al., Br. J. Pharmacology (1998), 124, 157-164. Недавно було показано, що антагоністи відносно даного рецептора дають істотні поліпшення по відношенню до інших антитромботичних засобів (дивись J. Med. Chem. (1999), 42, 213). У заявці на міжнародний патент WO 9905143 розкривається загальному ряду група триазоло[4,5-d]піримідинових сполук, що володіють активністю як антагоністи Р2Т (Р2YАДФ або Р2ТАС). Сполука формули (І) (приведена нижче) входить в загальний об'єм заявки на міжнародний патент WO 9905143, але спеціально там не розкривається. Дана сполука виявляє високу ефективність як антагоніст Р2Т (Р2YАДФ або Р2ТАС). Також вона володіє дивно високою метаболічною стабільністю і біодоступністю. Відповідно, даний винахід відноситься до сполуки формули (І): по суті кристалічній формі. Сполука формули (І) звичайно називається: {1S-[1a,2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксізеокси) циклопентан-1,2-діол. Сполука формули (І) може знаходитися в чотирьох різних, по суті кристалічних, формах, які називаються в подальшому поліморф І, поліморф II, поліморф III і поліморф IV. Поліморф являє собою конкретну кристалічну форму сполуки. Різні фізичні властивості поліморфних форм по відношенню одна до одної і по відношенню до аморфного стану можуть впливати помітним чином на хімічну і фармацевтичну обробку сполуки, особливо, коли сполуку одержують або використовують в промисловому масштабі. В одному аспекті винаходу переважною кристалічною формою сполуки формули (І) є форма поліморфу І, поліморфу II, поліморфу III або поліморфу IV. В альтернативному аспекті винаходу переважною кристалічною формою сполуки формули (І) є поліморф І. В іншому аспекті винаходу переважною кристалічною формою сполуки формули (І) є поліморф II. У ще одному аспекті винаходу переважною кристалічною формою сполуки формули (І) є поліморф III. У додатковому аспекті винаходу переважною кристалічною формою сполуки формули (І) є поліморф IV. У наступному аспекті винаходу сполука формули (І) знаходиться в по суті аморфній формі. В аморфній формі трьохмірний дальній порядок структури, який є в кристалічній формі (наприклад, в поліморфі) відсутній, і положення молекул по відношенню одна до одної в аморфній формі в основному безладні (дивись В.С.Hancock and G.Zografi, J.Pharm. Sei. (1997) 86 1). Аморфну форму сполуки формули (І) називають форма a. Заявники виділили сполуку формули (І) в кристалічній і аморфній формах. Дані форми можуть існувати значною мірою або практично вільному від води вигляді ("безводні" форми). Отже, в одному аспекті винаходу пропонується безводна форма сполуки формули (І) в кристалічній формі або аморфній формі. При використанні терміну "значною мірою чистій і в практично безводній формі" заявники не виключають наявність деякої кількості розчинника, включаючи воду, в кристалічній решітці або поза кристалічною решіткою. Безводна форма має менше, ніж 0,4 молекули води на молекулу сполуки (гідратована менше, ніж на 40%). Переважно, безводна форма містить менше ніж 0,1 молекули води на молекулу сполуки. Поліморфи І, II, III і IV можна розрізнювати по початку плавлення, спектрам порошкової дифракції рентгенівських променів і/або даним рентгеноскопії монокристалу. Поліморф І має точку початку плавлення, яка знаходиться в межах 146-152°С, наприклад, близько 151°С, коли він є значною мірою чистим і в практично безводній формі. Поліморф II має точку початку плавлення, яка знаходиться в межах 136-139°С, наприклад, близько 137,5°С, коли він є значною мірою чистим і в практично безводній формі. Поліморф III має точку початку плавлення, яка знаходиться в межах 127-132°С, наприклад, близько 132°С, коли він є значною мірою чистим і в практично безводній формі. Поліморф IV має точку початку плавлення, яка звичайно становить 139°С, коли він є значною мірою чистим і в практично безводній формі. Форма а звичайно зазнає склування з подальшою кристалізацією в одну з вищезгаданих поліморфних форм, наприклад, поліморф II, перед плавленням. Точки плавлення визначали з використанням диференціальної скануючої калориметрії (ДСК), використовуючи обладнання Perkin Elmer DSC7. Початок плавлення визначають як точку, в якій має місце значна зміна в порівнянні з базовою лінією, і його визначають за допомогою програмного забезпечення Perkin Elmer Pyris. Зрозуміло, що альтернативні дані по точці плавлення можна одержати з іншими типами обладнання або при використанні умов, відмінних від описаних тут. Отже, приведені цифри не треба розглядати як абсолютні значення. Фахівцям в даній області зрозуміло, що на точне значення точки плавлення буде впливати чистота сполуки, маса проби, швидкість нагрівання і розмір часток. Поліморф І, коли він є значною мірою чистим і в практично безводній формі, має порошкову рентгенограму, що включає характерні піки високої інтенсивності при 5,3° (±0,1°), 20,1° (±0,1°), 20,7° (±0,1°), 21,0° (±0,1°) і 21,3° (±0,1°) 2q. Більш переважно значною мірою чистий і практично безводний поліморф І має порошкову рентгенограму, що включає характерні піки при 5,3° (±0,1°), 8,0° (±0,1°), 9,6° (±0,1°), 13,9° (±0,1°), 15,3° (±0,1°), 20,1° (±0,1°), 20,7° (±0,1°), 21,0° (±0,1°), 21,3° (±0,1°), 26,2° (±0,1°) і 27,5° (±0,1°) 2q. Поліморф II, коли він є значною мірою чистим і в практично безводній формі, має порошкову рентгенограму, що включає характерні піки високої інтенсивності при 5,5° (±0,1°), 13,5° (±0,1°), 18,3° (±0,1°), 22,7° (±0,1°) і 24,3° (±0,1°) 2q. Більш переважно значною мірою чистий і практично безводний поліморф II має порошкову рентгенограму, що включає характерні піки при 5,5° (±0,1°), 6,8° (±0,1°), 10,6° (±0,1°), 13,5° (±0,1°), 14,9° (±0,1°), 18,3° (±0,1°), 19,2° (±0,1°), 22,7° (±0,1°), 24,3° (±0,1°) і 27,1° (±0,1°) 2q. Поліморф III, коли він є значною мірою чистим і в практично безводній формі, має порошкову рентгенограму, що включає характерні піки високої інтенсивності при 14,0° (±0,1°), 17,4° (±0,1°), 18,4° (±0,1°), 21,4° (±0,1°) і 24,1° (±0,1°) 2q. Більш переважно значною мірою чистий і практично безводний поліморф III має порошкову рентгенограму, що включає характерні піки при 5,6° (±0,1°), 12,5° (±0,1°), 14,0° (±0,1°), 17,4° (±0,1°), 18,4° (±0,1°), 21,4° (±0,1°), 22,2° (±0,1°), 22,9° (±0,1°), 24,1° (±0,1°) і 24,5° (±0,1°) 2q. Поліморф IV, коли він є значною мірою чистим і в практично безводній формі, має порошкову рентгенограму, що включає характерні піки високої інтенсивності при 4,9° (±0,1°), 9,2° (±0,1), 11,6° (±0,1°), 15,6° (±0,1°) і 16,4° (±0,1°) 2q. Більш переважно значною мірою чистий і практично безводний поліморф IV має порошкову рентгенограму, що включає характерні піки при 4,9° (±0,1°), 6,0° (±0,1°), 9,2° (±0,1°), 11,6° (±0,1°), 12,8° (±0,1°), 15,6° (±0,1°), 16,4° (±0,1°), 17,2° (±0,1°)і 18,1°(±0,1°)2q. Форма a, коли вона є значною мірою чистою і в практично безводній формі, має порошкову рентгенограму, що не містить гострих піків. Дані по дифракції рентгенівських променів для поліморфу II, поліморфу III, поліморфу IV і форми а одержували з використанням обладнання Siemens D5000. Дані по дифракції рентгенівських променів для поліморфу І одержували на апараті Philips X'Pert MPD. Зрозуміло, що інше обладнання і/або умови можуть привести до одержання дещо інших даних. Отже, приведені цифри не треба розглядати як абсолютні значення. В альтернативному аспекті винаходу може утворитися сольватована форма, наприклад, гідратована форма ("гідрат"). Отже, в даному аспекті винаходу пропонується гідрат сполуки формули (І) в кристалічній формі. Гідрат має 0,8 або більше молекул води на молекулу сполуки (80% і більше гідратована). Гемігідрат має від 0,4 до 0,8 молекул води на молекулу сполуки (40-80% гідратована). У додатковому аспекті винаходу пропонується будь-яка суміш кристалічної і/або аморфної форм сполуки формули (І). Переважно суміш представляє поліморф І, поліморф II, поліморф III, поліморф IV і/або форму а. Більш переважно винахід забезпечує будь-яку суміш поліморфу II і поліморфу III. У додатковому аспекті винаходу пропонується спосіб одержання кристалічної форми сполуки формули (І) кристалізацією сполуки формули (І) з відповідного розчинника. Переважно розчинник вибраний з групи: етанол, етилацетат, ізопропанол, ізооктан, ацетонітрил, вода або їх суміш, Більш переважно розчинник вибраний з групи: етанол, етилацетат, ізопропанол, ізооктан, вода або їх суміш. Переважно розчинник вибраний з групи: суміш метанол-вода, етанол, етилацетат, суміш етанол-вода, суміш ізопропанол-вода, суміш етилацетатізооктан і ацетонітрил. Сполуки формули (І) можна одержати способами, аналогічними таким, описаним в WO 9905143. Для початку кристалізації може бути необхідним внесення затравкових кристалів сполуки формули (І). Внесення затравкових кристалів необхідного поліморфу може бути необхідним для одержання вибраного поліморфу. Кристалізацію сполуки формули (І) з відповідної системи розчинників можна досягнути перенасиченням, наприклад, охолоджуванням, випаровуванням розчинника і/або доданням антирозчинника (розчинника, в якому сполуки формули (І) слаборозчинні; приклади відповідних антирозчинників включають гептан або ізооктан). Температура і час кристалізації будуть варіювати в залежності від концентрації сполуки в розчині, системи розчинників, що використовується і прийнятного способу кристалізації. Сполуки формули (І) в кристалічній формі можна виділити з вищезгаданої реакційної суміші з використанням способів, добре відомих фахівцям в даній області, наприклад, декантацією, фільтруванням або центрифугуванням. Аналогічно сполуки формули (1) в кристалічній формі можна висушити з використанням добре відомих методів. Необов'язкову стадію(ї) перекристалізації можна провести з використанням тих же або інших систем розчинників для подальшого зниження вмісту домішок, таких як аморфна речовина, хімічні домішки, або перетворення кристалічної форми з одного поліморфу в інший поліморф або в гідратовану або безводну форму. Крім того, можна провести стадію кондиціонування, піддавши тверду речовину впливу високої вологості для видалення аморфної речовини. Переважно кристалізацію проводять безпосередньо з реакційного розчину. Альтернативно кристалізацію проводять з подальшого розчину. У додатковому аспекті винаходу пропонується спосіб одержання поліморфу І, який включає одержання декількох затравкових кристалів поліморфу І внаслідок повільного зростання кристалів поліморфу І з розплаву поліморфу II, і використання їх для внесення затравкових кристалів в реакційну суміш, що включає сполуку формули (І) і відповідну змішану систему розчинників, таку як метанол/вода. У додатковому аспекті винаходу пропонується спосіб одержання поліморфу II, який включає кристалізацію з відповідного розчинника такого, як етилацетат. У додатковому аспекті винаходу пропонується спосіб одержання поліморфу III, який включає кристалізацію з відповідного розчинника, такого як спирт, наприклад, етанол або ізопропіловий спирт (ІПС), при внесенні затравки конкретно кристалів поліморфу III або суспендуванні сполуки формули (І) у відповідному розчиннику, такому як ІПС. У додатковому аспекті винаходу пропонується спосіб одержання поліморфу IV, який включає кристалізацію з відповідного розчинника, такого як ацетонітрил, при внесенні затравки конкретно кристалів поліморфу IV або суспендуванні сполуки формули (І) у відповідному розчиннику, такому як ацетонітрил. У додатковому аспекті винаходу пропонується спосіб одержання поліморфу IIІ, в основному вільного від поліморфу II, який включає, наприклад, суспендування сполуки формули (І) в системі розчинників ^^аліфатичний спирт/вода (переважно ІПС/вода) при температурі в межах 5-65°С протягом 1-10 діб. У додатковому аспекті винаходу пропонується спосіб одержання сполуки формули (І) в основному в аморфній формі, який включає сушку виморожуванням або розпилювальну сушку розчину сполуки формули (І) з використанням відповідної системи розчинників, наприклад, суміші етанол/вода. Термін "в основному вільний" відноситься до випадку вмісту менш ніж 10% іншого поліморфу, переважно менше за 5%. У додатковому аспекті винаходу пропонується сполука, що одержується одним з вищезгаданих способів. Сполука формули (І) в кристалічній і/або аморфній формі діє як антагоніст рецепторів Р 2Т (Р2YАДФ або Р2ТАС)- Отже, сполука формули (І) в кристалічній і/або аморфній формі придатна для лікування, включаючи комбіновану терапію. Зокрема, сполука формули (І) в кристалічній формі показана для застосування при лікуванні або профілактиці артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярному або периферичному судинному захворюванні. Артеріальні тромботичні ускладнення можуть включати нестабільну стенокардію, первинні артеріальні тромботичні ускладнення при атеросклерозі, такі як тромботичний або емболічний інсульт, короткочасні приступи ішемії, периферичне судинне захворювання, інфаркт міокарда з тромболізом або без нього, артеріальні ускладнення внаслідок втручань при атеросклерозі, таких як ангіопластика, включаючи ангіопластику коронарної артерії (РТСА), ендартеректомію, установку стентів, операцію по пересадці коронарних і інших судин, тромботичні ускладнення при хірургічному або механічному пошкодженні, таку як збереження тканин після випадкової або хірургічної травми, відновної хірургії, включаючи шкіряні і м'язові клапті, стану з наявністю компонента дифузного тромботичного/виснаження тромбоцитів, такі як поширена внутрішньосудинна коагуляція, тромбогемолітична тромбоцитопенічна пурпура, гемолітичний сечовий синдром, тромботичні ускладнення при септицемії, дихальний дистрес - синдром дорослих, антифосфоліпідний синдром, індуковану гепарином тромбоцитопенію і прееклампсію/еклампсію або венозний тромбоз, такий як тромбоз глибоких вен, венооклюзивне захворювання, гематологічні стани, такі як мієлопроліферативне захворювання, включаючи тромбоцитемію, серпасту-клітинну хворобу; або при профілактиці механічно індукованої активації тромбоцитів in vivo, як, наприклад, екстракорпоральний кровообіг і екстракорпоральне мембранне насичення киснем (профілактика мікротромбоемболії), механічно індукованої активації тромбоцитів in vitro, як, наприклад, використання при консервації продуктів крові, наприклад, концентратів тромбоцитів, або оклюзії при шунтуванні, таких як при діалізі нирок і плазмаферезі, тромбозу, повторного пошкодження/запалення судин, такого як васкуліт, артеріїт, гломерулонефрит, запальне захворювання кишечнику і відторгнення при трансплантації органів, таких станів, як мігрень, синдром Рейно, станів, при яких тромбоцити вносять свій внесок в основне запальне захворювання в стінках судин, як, наприклад, утворення/прогресування атероматозних бляшок, стеноз/рестеноз і при інших запальних станах, таких як астма, при яких тромбоцити і похідні від тромбоцитів чинники беруть участь в імунологічному захворюванні. Додаткові показання включає лікування розладів ЦНС і профілактику зростання і поширення пухлин. Згідно з додатковим аспектом даного винаходу пропонується сполука формули (І) в кристалічній і/або аморфній формі для застосування в терапевтичному способі лікування людини або тварини. Згідно з додатковим аспектом даного винаходу пропонується сполука формули (І) в кристалічній і/або аморфній формі для застосування як лікарський препарат. Переважно сполука формули (І) в кристалічній і/або аморфній формі використовується як лікарський препарат як антагоніст рецептора Р 2Т (Р2YАДФ або Р2ТАС) У теплокровної тварини, такої як людина. Більш переважно сполука формули (І) в кристалічній і/або аморфній формі застосовується як лікарський препарат для лікування або профілактики артеріальних тромботичиих ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярним або периферичним судинному захворюванні у теплокровної тварини, такої як людина. Згідно з винаходом додатково пропонується застосування сполуки формули (І) в кристалічній і/або аморфній формі у виробництві лікарського препарату для використання як антагоніста рецептора Р 2Т (Р2YАДФ або Р2ТАС). Зокрема додатково пропонується застосування сполуки формули (І) в кристалічній і/або аморфній формі у виробництві лікарського препарату для лікування або профілактики артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярному і периферичному судинному захворюванні. Винахід також забезпечує спосіб лікування або профілактики артеріальних тромботичних ускладнень у пацієнтів із захворюванням коронарної артерії, цереброваскулярним або периферичним судинним захворюванням, який включає введення людині, страждаючій таким захворюванням або схильній до нього, терапевтично ефективної кількості сполуки формули (І) в кристалічній і/або аморфній формі. Сполуку формули (І) в кристалічній і/або аморфній формі можна вводити місцево в легені і/або дихальні шляхи, у вигляді розчинів, суспензій, аерозолів HFA і сухих порошкоподібних композицій; або системно, наприклад, при пероральному введенні у вигляді таблеток, пілюль, капсул, сиропів, порошків або гранул, або парентерально у вигляді стерильних розчинів або суспензій для парентерального введення, підшкірно або ректально у вигляді супозиторіїв, або трансдермально. Сполуку формули (І) в кристалічній і/або аморфній формі можна вводити саму по собі або у вигляді фармацевтичної композиції, що включає сполуку формули (І) в кристалічній і/або аморфній формі в комбінації з фармацевтично прийнятним розріджувачем, ад'ювантом і/або носієм. Отже, пропонується як додатковий аспект винаходу фармацевтична композиція, що включає сполуку формули (І) в кристалічній і/або аморфній формі в поєднанні з фармацевтично прийнятним розріджувачем, ад'ювантом і/або носієм. Особливо переважними є композиції, що не містять речовини, здатної викликати побічну реакцію, таку як побічна алергічна реакція. Сухі порошкоподібні композиції і HFA-аерозолі під тиском з сполукою формули (І) в кристалічній і/або аморфній формі можна вводити перорально або інгаляцією через ніс. Для інгаляції сполуку формули (І) в кристалічній і/або аморфній формі бажане дрібно подрібнити. Також сполуку формули (І) в кристалічній і/або аморфній формі можна вводити за допомогою інгалятора для вдихання сухих порошків. Інгалятор може бути інгалятором з однією або багатьма дозами і може бути інгалятором для сухих порошків для вдихання. Однією можливістю є змішати тонкоподрібнену сполуку формули (І) в кристалічній і/або аморфній формі з речовиною-носієм, наприклад, моно-, ди- або полісахаридом, спиртом - похідним цукру або іншим поліолом. Відповідні носії включають цукор і крохмаль. Альтернативно, тонкоподрібнену сполуку формули (І) в кристалічній і/або аморфній формі можна покрити іншою сполукою. Порошкоподібну суміш можна розподілити в тверді желатинові капсули, що містять кожна бажану дозу активної сполуки формули (І) в кристалічній і/або аморфній формі. Іншою можливістю є перетворення тонкоподрібненого порошку в кульки, які руйнуються при інгаляції. Такий сферонізований порошок можна вмістити в резервуар для лікарського препарату багатодозового інгалятора, наприклад, відомого як Turbuhaler®, в якому дозуючий пристрій відмірює бажану дозу, яка потім вдихається пацієнтом. За допомогою цієї системи активна сполука формули (І) з речовиною-носієм і без нього доставляється пацієнту. Фармацевтична композиція, що включає сполуку формули (І) в кристалічній і/або аморфній формі, може представляти такі зручні форми, як таблетки, пілюлі, капсули, сиропи, порошки або гранули для перорального введення; стерильні розчини для парентерального або підшкірного введення; суспензії для парентерального введення або супозиторії для ректального введення. Для перорального введення сполуку формули (І) в кристалічній і/або аморфній формі можна змішати з ад'ювантом або носієм, наприклад, лактозою, сахарозою, сорбітом, манітом, крохмалем, таким як картопляний крохмаль, кукурудзяний крохмаль або амілопектин, похідними целюлози, зв'язуючими речовинами, такими як желатин або полівінілпіролідон, змащувальними речовинами такими, як стеарат магнію, стеарат кальцію, поліетиленгліколь, віск, парафін і тому подібне, і потім спресувати в таблетки. Якщо потрібні покриті оболонкою таблетки, ядра, одержані, як описано вище, можна покрити концентрованим розчином цукру, який може містити, наприклад, гуміарабік, желатин, тальк, діоксид титана і тому подібне. Альтернативно, таблетку можна покрити відповідним полімером, розчиненим або в легколеткому органічному розчиннику, або у водному розчиннику. Для одержання м'яких желатинових капсул сполуку формули (І) в кристалічній і/або аморфній формі можна змішати, наприклад, з рослинною олією або поліетиленгліколем. Тверді желатинові капсули можуть містити гранули сполуки з використанням або вищезгаданих наповнювачів для таблеток, наприклад, лактози, сахарози, сорбіту, маніту, крохмалю, похідних целюлози або желатину. Також рідкі або напіврідкі композиції лікарського препарату можна розлити в тверді желатинові капсули. Рідкі препарати для перорального застосування можуть бути у вигляді сиропів або суспензій, наприклад, розчинів, що містять сполуку формули (І) в кристалічній і/або аморфній формі, причому залишок складає цукор і суміш етанолу, води, гліцерину і пропіленгліколю. Необов'язково, такі рідкі препарати можуть містити забарвлюючі речовини, ароматизатори, сахарин і карбоксиметилцелюлозу як згущувач або інші наповнювачі, відомі фахівцям в даній області. Фіг.1.1. представляє рентгенограму поліморфу І, одержану з використанням приладу Philips XfPert MPD в q-q конфігурації в межах сканування від 1° до 40° 2q при 2 або 5сек експозиції на приріст 0,02° 2q. Рентгенівські промені одержували за допомогою мідної довгофокусної трубки, що працює при 40кВ і 50мА. Довжина хвилі рентгенівських променів дорівнювала 1,5406 Å. Фіг.1.2. представляє рентгенограму поліморфу II, одержану з використанням приладу Siemens D5000 в q-q конфігурації в межах сканування від 2° до 30° 2q при 4сек експозиції на приріст 0,02° 2q. Рентгенівські промені одержували за допомогою мідної довгофокусної трубки, що працює при 45кВ і 40мА. Довжина хвилі рентгенівських променів дорівнювала 1,5406 Å. Держак був зроблений з монокристала кремнію, який був зрізаний вздовж недифрагуючої площини і потім відшліфований до оптично плоскої обробки. Рентгенівські промені, падаючі на цю поверхню, зводилися на ні за рахунок екстинкції Брегга. Фіг.1.3. представляє рентгенограму поліморфу III, одержану з використанням приладу Siemens D5000, як описано вище. Фіг.1.4. представляє рентгенограму поліморфу IV, одержану з використанням приладу Siemens D5000, як описано вище. Фіг.1.5. представляє рентгенограму форми а, одержану з використанням приладу Siemens D5000, як описано вище. Фіг.2 показує криві ДСК для поліморфів І, II, III і IV і форми a, одержані з використанням приладу Perkin Elmer DSC 7. Чашечка була алюмінієвою з ковпаком. Маса проби становила 1-3мг. Процедуру вимірювання проводили в атмосфері газоподібного азоту (30мл/хв.), а температурний інтервал, що досліджується складав між 30°С і 325°С при постійній швидкості підвищення температури 10°С на хв. Потрібно розуміти, що аналіз проб із зернами розміром понад 30 мікрон і неуніфіковані співвідношення геометричних розмірів можуть впливати на відносну інтенсивність піків. Фахівцеві в даній області буде також зрозуміло, що на положення відображень впливає точна висота, на яку вміщується проба в дифрактометрі, і нульове калібрування дифрактометра. Площина поверхні проби може також мати невеликий ефект. Отже, представлені дані по спектрах дифракції не треба розглядати як абсолютні значення. Винахід можна ілюструвати наступними прикладами, що його не обмежують. Приклад 1 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол в формі поліморфу І Частина 1 Сполуку формули (І) у вигляді поліморфу II (2мг) нагрівали і охолоджували в ДСК наступним чином: від 35 до 143, до 35, до 148, до 35, до 148, до 35°С. Даний процес відпалу приводив до кристалізації чистого поліморфу І за даними ДСК. Частина 2 Розчин, що містить сполуку формули (І), 5мл/г метанолу і 7,3мл/г води і невелику кількість затравкових кристалів поліморфу І, кристалізували при 30°С. Дані порошкового РСА і ДСК підтверджували, що утворився в основному чистий поліморф І. Приклад 2 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол в формі поліморфу II Хлороформ (150мкл) додавали до 45мг сполуки формули (І) і суміш нагрівали до розчинення на паровій бані. Одержаний розчин залишали для кристалізації протягом ночі і висушували в атмосфері азоту. Дані порошкового РСА і ДСК підтверджували, що утворився в основному чистий поліморф II. Приклад 3 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол в формі поліморфу III Етанол (200мкл) додавали до 10мг сполуки формули (І) і суміш нагрівали до розчинення на паровій бані. Одержаний розчин залишали для кристалізації протягом ночі. Дані порошкового РСА і ДСК підтверджували, що утворилася суміш поліморфів II і III. Дану речовину використали для внесення затравки для одержання в більшому об'ємі: 191мг поліморфу II суспендували в 1мл 50% водного розчину ізопропанолу. До даної суспензії додавали 15мг затравкових кристалів змішаного поліморфу ІІ/ІІІ. Через 2 доби відбувалося повне перетворення в поліморф III за даними порошкового РСА. Приклад 4 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол в формі поліморфу IV Ацетонітрил (0,12мл) додавали до 10мг сполуки формули (І) і суміш нагрівали до розчинення на паровій бані. Теплому розчину давали повільно охолодитися у водяній сорочці з гарячою водою. Одержані кристали висушували в атмосфері азоту. Дані порошкового РСА і ДСК показували, що це був інший поліморф. Приклад 5 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол в основному у вигляді форми a Сполуку формули (І) (218мг) розчиняли у 50% водному розчині етанолу (24мл). До даного розчину по краплях додавали ще 14,5мл води. Потім одержаний насічений розчин сушили виморожуванням з використанням апарату Віртіса в наступних умовах (вакуум 2170мТ, цикл 20,2год., температура конденсації 52°С, температура навколишнього середовища 20,3°С). Посилальний приклад 1 {1S-[1a2a,3b(1S*,2R*),5b]}-3-(7-{[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)-5-(2-гідроксіетокси)циклопентан-1,2-діол Розчин {3аR-[3аa,4a,6a(1R*,2S*),6аa]}-2-[6-({7-[2-(3,4-дифторфеніл)циклопропіл]аміно-5-(пропілтіо)-3Н 1,2,3-триазоло[4,5-d]піримідин-3-іл}тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-іл)окси]етанолу (спосіб А, 0,59г) в трифтороцтовій кислоті (15мл) і воді (15мл) перемішували при кімнатній температурі протягом 30хв. Реакційну суміш обережно додавали до розчину бікарбонату натрію (21г) у воді (150мл) і перемішували протягом 30хв. Суміш екстрагували етилацетатом, який висушували і випаровували, Залишок очищали (SiO2, етилацетат як елюент) з одержанням вказаної в заголовку сполуки (0,44г). MC (APCI) (хімічна іонізація при атмосферному тиску) 523 (М+Н+, 100%); ЯМР: 8,95 (1H, д, J=3,3), 7,39-7,21 (2Н,:м), 7,10-7,00 (1H, м),5,12 (1Н, д, J=6,4),5,05 (1H, д, J=3,6), 4,96 (1H, кв, J=9,0), 4,62-4,54 (2Н, м), 3,95 (1H, шир. с), 3,79-3,73 (1H, м), 3,55-3,47 (4Н, м), 3,20-3,13 (1Н, м), 2,98-2,81 (2Н, м), 2,63 (1H, дт, J=13,6, 8,5), 2,29-2,21 і 2,16-2,09 (1H, м), 2,07-2,00 (1H, м), 1,73-1,33 (4Н, м), 0,99 (3Н, т, J=7,4). Одержання початкових сполук Початкові сполуки є такими, що промислово випускаються, або їх легко одержати звичайними способами з відомих сполук. Наприклад, подальші реакції представляють ілюстрації, але не обмеження, одержання деяких початкових сполук, що використовується у вищенаведених реакціях. Спосіб А {3аR-[3аa,4a,6a(1R*,2S*),6аa]}-2-[6-({7-[2-(3,4-дифторфеніл)циклопропіл]аміно-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-іл)окси]етанол DIBAL-H® (1,0М розчин в гексані, 5,15мл) додавали до охолодженого на льоду розчину метилового ефіру {3аR-[3аa,4a,6a(1R*,2S*),6аa]}-{[6-(7-[2-(3,4-дифторфеніл)циклопропіл]аміно}-5-(пропілтіо)-3Н-1,2,3триазоло[4,5-d]піримідин-3-іл)тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-іл]окси} оцтової кислоти (спосіб В, 0,76г) в ТГФ (1мл) і розчин перемішували при даній температурі протягом 2 год. Реакційну суміш концентрували у вакуумі і залишок розчиняли в етилацетаті (75мл). Додавали насичений водний розчин тартрату натрію-калію (75мл) і суміш енергійно перемішували протягом 16год. Органічні фракції збирали і водну фракцію повторно екстрагували етилацетатом (2´50мл). Об'єднані органічні фракції висушували і концентрували, і залишок очищали (SiO2, суміш ізогексан:етилацетат 1:1 як елюент) з одержанням вказаної в заголовку сполуки (0,63г). MC (АРСl) 563 (М+Н+, 100%). Спосіб В Метиловий ефір {3аR-[3аa,4a,6a(1R*,2S*),6аa]}-{[6-(7-{[2-(3,4-дифторфеніл) циклопропіл]аміно}-5(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл)тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4іл]окси}оцтової кислоти До суміші метилового ефіру [3aR-(3aa,4a,6a,6aa)]-({6-[7-бром-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5d]піримідин-3-іл]тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-ол}окси)оцтової кислоти (спосіб D, 0,80г) і (1R-транс)-2-(3,4-дифторфеніл)циклопропанаміну, [R-(R*,R*)]-2,3-дигідроксибутандіоату (1:1) (спосіб С, 0,61г) в дихлорметані (25мл) додавали N,N-діізопропілетиламін (0,85мл). Одержаний розчин перемішували при кімнатній температурі протягом 16год. і потім концентрували у вакуумі. Очищення (SiO2, суміш ізогексан:етилацетат 3:1 як елюент) давало вказану в заголовку сполуку у вигляді безбарвної піни (0,77г). MC (APCI) 591 (М+Н+, 100%). Спосіб С (1R-транс)-2-(3,4-дифторфеніл)циклопропанамін, [R-(R*,R*)]-2,3-дигідроксибутандіоат (1:1) Вказану в заголовку сполуку можна одержати за способом, описаним в заявці WO9905143. Спосіб D Метиловий ефір [3аR-(3аa,4a,6a,6аa)]-({6-[7-бром-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3іл]тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-ол}окси) оцтової кислоти Метиловий ефір [3аR-(3аa,4a,6a,6аa)]-({6-[7-бром-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3іл]тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-ол}окси) оцтової кислоти (спосіб Е, 1,1г) і ізоамілнітрит (2,4мл) в бромоформі (30мл) нагрівали при 80°С протягом 30хв. Охолоджену реакційну суміш очищали (SiO2, суміш етилацетат:ізогексан 1:4 як елюент) з одержанням вказаної в заголовку сполуки (0,44г). MC (APCI) 502/4 (М+Н+),504 (100%). Спосіб Е Метиловий ефір [3аR-(3аa,4a,6a,6аa)]-({6-[7-бром-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3іл]тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-ол}окси) оцтової кислоти До розчину [3аR-(3аa,4a,6a,6аa)]-6-[7-аміно-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл]тетрагідро2,2-диметил-4Н-циклопента-1,3-діоксол-4-олу (спосіб F, 0,50г) в ТГФ (25мл) при 0°С додавали бутиллітій (0,62мл 2,5н в гексані). Через 20хв. суспензію обробляли розчином метилового ефіру трифторметансульфонілоксіоцтової кислоти (0,34г) (одержаного за способом Biton, Tetrahedron, 1995, 51, 10513) в ТГФ (10мл). Одержаному розчину давали підігрітися до кімнатної температури, потім концентрували і очищали (SiO2, етилацетат:гексан 4:6 як елюент) з одержанням вказаної в заголовку сполуки (0,25г). MC (APCI) 439 (М+Н+, 100%). Спосіб F [3аR-(3аa,4a,6a,6аa)]-6-[7-аміно-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл]тетрагідро-2,2диметил-4Н-циклопента-1,3-діоксол-4-ол [3аR-(3аa,4a,6a,6аa)]-6-[7-аміно-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл]тетрагідро-2,2диметил-4Н-циклопента-1,3-діоксол-4-ол (спосіб G, 13,2г) в ТГФ (200мл), що містить 0,88 аміак (5мл), перемішували протягом 2год., потім концентрували досуху і залишок розподіляли у воді і етилацетаті. Органічні фракції висушували і потім концентрували з одержанням вказаної в заголовку сполуки (12,5г). MC (APCI) 367 (М+Н+, 100%). Спосіб G [3аR-(3аa,4a,6a,6аa)]-6-[7-аміно-5-(пропілтіо)-3Н-1,2,3-триазоло[4,5-d]піримідин-3-іл]тетрагідро-2,2диметил-4Н-циклопента-1,3-діоксол-4-ол Ізоамілнітрит (1,1мл) додавали до розчину [3аR-(3аa,4a,6a,6аa)]-6-{[5-аміно-6-хлор-2-(пропілтіо)піримідин4-іл]аміно}тетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-олу (спосіб Н, 2,0г) в ацетонітрилі (100мл) і розчин нагрівали при 70°С протягом 1год. Охолоджену реакційну суміш концентрували і очищали (SiO2, суміш етилацетат:ізогексан 1:3 як елюент) з одержанням вказаної в заголовку сполуки (1,9г). MC (APCI) 386 (М4Н+ 100%). Спосіб Н [3аR-(3аa,4a,6a,6аa)]-6-{[5-аміно-6-хлор-2-(пропілтіо)піримідин-4-іл]аміно}тетрагідро-2,2-диметил-4Нциклопента-1,3-діоксол-4-ол Порошок заліза (3,0г) додавали до розчину, що перемішується [3аR-(3аa,4a,6a,6аa)]-6-{[6-хлор-5-нітро-2(пропілтіо)піримідин-4-іл]аміно}тетрагідро-2,2-диметил-4Н-цкклопента-1,3-діоксол-4-олу (спосіб І, 2,7г) в оцтовій кислоті (100мл). Реакційну суміш перемішували при кімнатній температурі протягом 2год., концентрували до половини об'єму, розбавляли етилацетатом і промивали водою. Органічну фазу висушували і концентрували з одержанням вказаної в заголовку сполуки (2,0г). MC (APCI) 375 (М+Н+, 100%). Спосіб І [3аR-(3аa,4a,6a,6аa)]-6-{[6-хлор-5-нітро-2-(пропілтіо)піримідин-4-іл]аміно}тетрагідро-2,2-диметил-4Нцкклопента-1,3-діоксол-4-ол Розчин [3аR-(3аa,4a,6a,6аa)]-6-амінотетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-олу гідрохлориду (спосіб J, 10,0г) і N,N-діізопропілетиламіну (35мл) в ТГФ (600мл) перемішували протягом 1год. Суміш фільтрували і розчин додавали протягом 1год. до розчину 4,6-дихлор- 5-нітро-2-(пропілтіо)піримідину (WO 9703084, 25,6г) в ТГФ (1000мл) і перемішували ще протягом 2год. Об'єм розчинника зменшували у вакуумі і додавали етилацетат (1000мл). Суміш промивали водою і органічні шари висушували і очищали (SiO2, суміш ізогексан-етилацетат як елюент) з одержанням вказаної в заголовку сполуки (14,2г). MC (АРСІ) 405 (М+Н+, 100%). Спосіб J [3аR-(3аa,4a,6a,6аa)]-6-амінотетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-ол гідрохлорид Біс (1,1-диметилетиловий) ефір [1R-(1a,2b,3b,4a)]-2,3,4-тригідроксициклопентенилімідодикарбонової кислоти (спосіб K, 17,4г) в 6М НСI (100мл)/метанолу (500мл) перемішували протягом 18год. Суміш упарювали і потім проводили азеотропну перегонку з толуолом (4´200мл) з одержанням безбарвного порошку (8,7г). Дану тверду речовину суспендували в ацетоні (250мл), що містить 2,2-диметоксипропан (25мл) і концентровану НСl (0,2мл), потім кип'ятили із зворотним холодильником протягом 2год. Суміш охолоджували, упарювали і проводили азеотропну перегонку з толуолом (3´200мл). Залишок розчиняли у 20%; водній оцтовій кислоті і перемішували протягом 2год. Суміш упарювали і проводили азеотропну перегонку з толуолом (4´200мл) з одержанням вказаної в заголовку сполуки (10,1г). MC (АРСІ) 174 (М+H+, 100%). Спосіб K Біс [1R-(1a,2b,3b,4a)]-2,3,4-тригідроксициклопентенилімідодикарбонової кислоти До розчину (1R-цис)-біс(1,1-диметилетил)-4-гідрокси-2-циклопентенілімідодикарбонату (спосіб L, 17,1г) в ТГФ (500мл)/воді (50мл) додавали N-метилморфолін-N-оксид (9,4г) потім чотириокис осмію (10мл, 2,5% розчин в трет-бутанолі). Суміш перемішували при кімнатній температурі протягом 4діб, потім обробляли гідросульфітом натрію (6,0г). Суспензію фільтрували через діатомову землю і продукт очищали (SiO2, суміш етилацетат:гексан 1:1 як елюент) з одержанням вказаної в заголовку сполуки (19,1г). ЯМР: 1,44 (18Н, с), 1,461,60 (1Н, м), 1,97-2,05 (1Н, м), 3,55-3,58 (1Н, м), 3,66-3,73 (1Н, м), 4,11-4,21 (2Н, м), 4,54 (1Н, д, J=4,8), 4,56 (1Н, д, J=5,9), 4,82 (1Н, д, J=4,6). Спосіб L (1R-цис)-біс(1,1-диметилетил)-4-гідрокси-2-циклопентенілімідодикарбонат До суспензії ефіру, промитого гідридом натрію (60% дисперсія в маслі; 0,31г) в ТГФ (30мл) додавали біс(1,1-диметилетиловий)ефір імідодикарбонової кислоти (1,84г). Суміш перемішували при 40°С протягом 1год. Потім до суміші при кімнатній температурі додавали (18-цис)-4-ацетокси-2-циклопентен-1-ол (0,5г) і тетракис(трифенілфосфін)паладій(0) (0,18г). Реакційну суміш перемішували протягом 24год., потім очищали (SiO2, суміш етилацетат:гексан 1:9 як елюент) з одержанням вказаної в заголовку сполуки у вигляді безбарвної твердої речовини (0,90г). ЯМР: 1,43 (18Н, с), 1,61 (1Н, ддд, J=12,3, 7,7, 6,4), 2,54 (1Н, дт, J=12,6, 7,4), 4,51-4,57 (1Н, м), 4,86 (1Н, ткв, J=8,0, 1,8), 4,91 (1Н, д, J=5,4), 5,71-5,77 (2Н, м). Приклад 2 Подальше показує типові фармацевтичні лікарські форми, що містять сполуку формули (1) в кристалічній і /або аморфній формі (нижче сполука X), для терапевтичного або профілактичного застосування у людей. (а) Таблетка І мг/на таблетку Сполука X 100 Лактоза за Євр. Фармакопеєю 182,75 Натрієва сіль кроскармелози 12,0 Паста кукурудзяного крохмалю (5% паста мас./об.) 2,25 Стеарат магнію 3,0 (b) Таблетка II мг/на таблетку Сполука X 50 Лактоза за Євр. Фармакопеєю 223,75 Натрієва сіль кроскармелози 6,0 Кукурудзяний крохмаль 15,0 Полівінілпіролідон (5% паста мас./об.) 2,25 Стеарат магнію 3,0 (c) Таблетка IIІ Сполука X Лактоза за Євр. Фармакопеєю Натрієва сіль кроскармелози Паста кукурудзяного крохмалю (5% паста мас./об.) Стеарат магнію (d) Капсула Сполука X Лактоза за Євр. Фармакопеєю Стеарат магнію (e) Ін'єкційний розчин І Сполука X 1н розчин гідроокису натрію 0,1н соляна кислота Поліетиленгліколь 400 Вода для ін'єкцій до 100% (f) Ін'єкційний розчин II Сполука X Фосфат натрію ВР 0,1н розчин гідроокису натрію Вода для ін'єкцій до 100% (g) Ін'єкційний розчин III мг/на таблетку 1,0 93,25 4,0 0,75 1,0 мг/на капсулу 10 488,5 1,5 (50мг/мл) 5,0% мас./об. 15,0% об./об. (довести pH до 7,6) 4,5% мас./об. (10мг/мл) 1,0% мас./об. 3,6% мас./об. 15,0% об./об. (1мг/мл, забуферений до pH6) 0,1% мас./об. 2,26мас./об. 0,38% мас./об. 3,5% мас./об. Сполука X Фосфат натрію ВР Лимонна кислота Поліетиленгліколь 400 Вода для ін'єкцій до 100% Примітка Вищезгадані композиції можна одержати звичайними способами, добре відомими в області фармації. Таблетки (а)-(с) можна покрити ентеросолюбільною оболонкою звичайними способами, наприклад, із забезпеченням оболонки з ацетатфталатцелюлози. ЯМР-спектри знімали на спектрометрі Varian Unity Tnova 300 або 400; дані ЯМР дані в формі дельтазначень для основних діагностичних протонів, представлені в мільйонних частках (ррm) по відношенню до тетраметилсилану (TMS) як внутрішній стандарт з використанням пердейтерованого диметилсульфоксиду (ДМСО-d 6) як розчинника, якщо не указано інакше; для прикладів, що показують наявність ротамерів в протонних спектрах ЯМР, представлені тільки хімічні зсуви для основного ротамеру; константи взаємодії (J) представлені в Гц.) Мас-спектри (MC) визначали таким чином: ЕІ-спектри (електронна іонізація) одержували на спектрофотометрі VG 70-250S або Finnigan Mat Incos-XL, FAB-спектри (бомбардування швидкими атомами) одержували на спектрофотометрі VG 70-25 OSEQ, ESI (іонізація електровприскуванням) і АРСІ-спектри (хімічна іонізація при атмосферному тиску) одержували на спектрофотометрі Finnigan Mat SSQ7000 або Micromass Platform. Препаративне розділення ВЕРХ в основному проводили з використанням колонок Novapak®, Bondapak® або Hypersil®, заповнених зворотнофазовим кремнеземом BDSC-18. Флеш-хроматографію (вказана в прикладах, як (SiO2)) проводили з використанням кремнезему Fisher Matrix, 35-70мкм. Скорочення ТГФ - тетрагідрофуран Порошковий РСА - порошковий рентгеноструктурний аналіз ДСК - диференціальна скануюча калориметрія.
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline and amorphous forms of triazol(4,5-d)pirimidin, method for obtaining thereof, pharmaceutical compositon and method of therapy or prophilaxis of arterial thrombotic complications
Назва патенту російськоюКристаллическая и аморфная форма триазоло(4,5-d)пиримидина, способ его получения, фармацевтическая композиция и способ лечения или профилактики артериальных тромботических осложнений
МПК / Мітки
МПК: A61P 35/04, A61P 9/00, A61P 13/12, A61P 13/02, C07D 487/04, A61K 31/519, A61P 9/10, A61P 25/06, A61P 9/14, A61P 7/00, A61P 25/00, A61P 35/00, A61P 11/06, A61P 7/02, A61P 41/00, A61P 29/00, A61P 9/04
Мітки: композиція, форма, профілактики, тромботичних, кристалічна, лікування, ускладнень, спосіб, артеріальних, фармацевтична, триазоло(4,5-d)піримідину, одержання, аморфна
Код посилання
<a href="https://ua.patents.su/10-73181-kristalichna-i-amorfna-forma-triazolo45-dpirimidinu-sposib-jjogo-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-likuvannya-abo-profilaktiki-arterialnikh-trombotichnikh-uskladnen.html" target="_blank" rel="follow" title="База патентів України">Кристалічна і аморфна форма триазоло(4,5-d)піримідину, спосіб його одержання, фармацевтична композиція та спосіб лікування або профілактики артеріальних тромботичних ускладнень</a>
Попередній патент: Апарат для розливу напоїв, розливний пристрій для напоїв, ємність для напоїв і роздавальний патрубок для напоїв
Наступний патент: Триазолопіримідинові сполуки, спосіб їх одержання (варіанти) та проміжні сполуки (варіанти)
Випадковий патент: Спосіб ліквідації підтоплення примикаючих до зрошувальних систем земель












