Похідні арил-1,4-піразину
Формула / Реферат
1. Сполука формули І
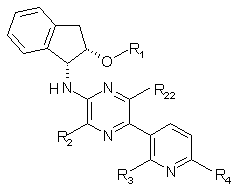
або її фармацевтично прийнятна сіль, де
R1 - С1-С6алкіл, С1-С6алкеніл, С1-С6алкініл, С(О)С1-С6алкіл, С(О)С1-С6алкеніл або С(O)С1-С6алкініл;
R2 - С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл;
R22 - С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл;
R3 - С1-С6алкіл, С1-С6алкеніл, С1-С6алкініл, галоген, ОС1-С6алкіл, ОС1-С6алкеніл або ОС1-С6алкініл;
R4 - С1-С6алкіл, С1-С6алкеніл, С1-С6алкініл, галоген, ОС1-С6алкіл, ОС1-С6алкеніл, ОС1-С6алкініл або NR5R6;
R5 - гідроген, С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл;
а
R6 - гідроген, С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл.
2. Сполука за п. 1, де R1 - етил або С(О)СН3.
3. Сполука за п. 1, де R2 - етил та R22 - етил.
4. Сполука за п. 1, де R3 - С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл.
5. Сполука за п. 1, де R4 - NR5R6.
6. Сполука за п. 5, де R3 - С1-С6алкіл, С1-С6алкеніл або С1-С6алкініл.
7. Сполука за п. 6, де R3 - метил, a R4 - N(CH3)2.
8. Сполука, вибрана з групи:
(1R,2S)-2-ацетокси-1-[5-(6-диметиламіно-2-метилпіридин-3-іл)-3,6-діетилпіразин-2-іламіно]-індан;
(1R,2S)-2-ацетокси-1-[5-(6-диметиламіно-2-метилпіридині-3-іл)-3,6-діетилпіразин-2-іламіно]-індану тозилат та
(1R,2S)-[5-(6-диметиламіно-2-метилпіридин-3-іл)-3,6-діетилпіразин-2-іл]-(2-етоксііндан-1-іл)-амін.
9. Фармацевтична композиція, що містить фармацевтично прийнятний носій та сполуку за п. 1.
10. Спосіб лікування розладу, вибраного з групи: генералізований розлад з компонентом тривоги, соціальний розлад з компонентом тривоги, розлад панічного типу, обсесивно-компульсивний розлад, тривога при депресивному нездужанні, афективний розлад, тривога, розлади харчування, біполярний розлад та депресія у ссавця, спосіб полягає у введенні ссавцю сполуки за п. 1.
11. Спосіб лікування розладу, що виявляє гіперсекрецію ФВК у ссавця, який полягає у введенні ссавцю терапевтично ефективної кількості сполуки за п. 1.
12. Спосіб відбору лігандів для рецепторів ФВК1, у якому здійснюють:
а) проведення аналізу конкурентного зв'язування із рецепторами ФВК1 сполуки за п. 1, котру помічено відкривною міткою, та кандидатурного ліганду; та
b) визначення здатності вказаного кандидатурного ліганду заміщувати вказану мічену сполуку.
13. Спосіб визначення рецепторів ФВК у тканині, у якому здійснюють:
а) контактування сполуки за п. 1, котру помічено відкривною міткою, з тканиною в умовах, що дозволяють зв'язування сполуки з тканиною; та
b) визначення міченої сполуки, приєднаної до тканини.
14. Спосіб інгібування зв'язування ФВК з рецептором ФВК1, у якому здійснюють контактування сполуки за п. 1 з розчином, що містить клітини, які експресують рецептор ФВК1, де сполука є у розчині у концентрації, достатній для інгібування зв'язування ФВК з рецептором ФВК1.
15. Спосіб зменшення рівня зв'язування ФВК in vitro з клітинами, що експресують рецептор ФВК1, у якому здійснюють контактування сполуки за п. 1 з розчином, що містить клітини, де сполука є у розчині у концентрації, достатній для зменшення рівнів зв'язування ФВК з клітинами in vitro.
Текст
1. Сполука формули І C2 2 (19) 1 3 86873 4 ні у концентрації, достатній для інгібування зв'язування ФВК з рецептором ФВК1. 15. Спосіб зменшення рівня зв'язування ФВК in vitro з клітинами, що експресують рецептор ФВК1, у якому здійснюють контактування сполуки за п. 1 з розчином, що містить клітини, де сполука є у розчині у концентрації, достатній для зменшення рівнів зв'язування ФВК з клітинами in vitro. Цей винахід стосується заміщених похідних арил-1,4-піразину та способів їх отримання, фармацевтичних композицій, що їх містять, та способів їх застосування для лікування розладу або стану, на котрий може діяти чи сприяти йому антагонізм рецептору ФВК, охоплюючи, але без обмеження, розлади, які індукує або сприяє їм ФВК, якто розлади з компонентом тривоги, та пов'язані з депресією та стресом розлади. Крім того, цей винахід стосується застосування таких сполук як зондів для локалізації рецепторів ФВК1 у клітинах чи тканинах. Фактор вивільнення кортикотропіну (ФВК) є пептидом з 41 амінокислоти, що є первинним фізіологічним регулятором секреції похідного від проопіомеланокортину (ПОМК) пептиду з переднього гіпофізу [J. Rivier et al, Proc. Natl. Acad. Sci (USA) 80:4851 (1983); W. Vale et al., Science 213:1394 (1981)]. На додаток до його ендокринної ролі у гіпофізі, імуногістохімічна локалізація ФВК показала, що гормон має широкий екстрагіпоталамічний розподіл у центральній нервовій системі та виробляє широкий спектр автономної, електрофізіологічної та поведінкової дії, сумісної з нейромедіаторною або нейромодуляторною роллю у мозку [W. Vale et al., Rec. Prog. Horm. Res. 39:245 (1983); .F. Koob, Persp. Behav. Med. 2:39 (1985); E.B. De Souza et al., J. Neurosci. 5:3189 (1985)]. Є також свідоцтво, що ФВК грає значну роль в інтегруванні реакцій в імунній системі на фізіологічні, психологічні та імунологічні стресори [J.E. Blalock, Physiological Reviews 69:1 (1989); J.E. Morley, Life Sci. 41:527 (1987)]. Є свідоцтва, що ФВК грає роль у психіатричних розладах та неврологічних хворобах, охоплюючи депресію, розлади, пов'язані з тривогою та розлади харчування. Роль ФВК також встановлена в етіології та патофізіології хвороби Альцгеймера, хвороби Паркінсона, хвороби Хантингтона, прогресуючого супрануклеарного паралічу та бічного аміотрофічного склерозу, оскільки вони стосуються дисфункції ФВК нейронів у центральній нервовій системі [для огляду дивись: E.B. De Souze, Hosp. Practice 23:59 (1988)]. Розлади з компонентом тривоги є групою хвороб, відомих у галузі, а саме фобічні розлади, стани тривоги, пост-травматичний стрес-розлад та атипові розлади з компонентом тривоги [The Merck Manual of Diagnosis та Therapy, 16th edition (1992)]. Емоційний стрес є часто продукувальним фактором у розладах з компонентом тривоги, і такі розлади загалом чутливі до ліків, що знижують реакцію на стрес. В афективному розладі або глибокій депресії, концентрація ФВК є значно збільшеною у спинномозковій рідині (СМР) осіб, що не приймали ліків [С.В. Nemeroff et al., Science 226:1342 (1984); CM. Banki et al., Am. J. Psychiatry 144:873 (1987); R.D. France et al., Biol. Psychiatry 28:86 (1988); M. Arato et al., Biol. Psychiatry 25:355 (1989)]. Крім того, густина рецепторів ФВК є значно зменшеною у лобній корі самовбивць, що сумісно з гіперсекрецією ФВК [С.В. Memeroff et al., Arch. Gen. Psychiatry 45:577 (1988)]. Ha додаток, є притуплена адренокортикотропінова реакція (АКТГ) на ФВК (внутрішньовенне застосування) спостережена у пацієнтів з депресією [P.W. Gold et al., Am. J. Psychiatry 141:619 (1984); F. Holsboer et al., Psychoneuroendocrinology 9:147 (1984); P.W. Gold et al., New Engl. J. Med. 314:1129 (1986)]. Предклінічні дослідження на щурах та приматах дають додаткову підтримку гіпотези, що гіперсекреція ФВК може приймати участь у симптомах, спостережених у депресії людини [R.M. Sapolsky, Arch. Gen. Psychiatry 46:1047 (1989)]. Є також попередні свідоцтва, що трициклічні антидепресанти можуть змінювати рівні ФВК та таким чином модулювати ряд рецепторів у мозку [Grigoriadis et al., Neuropsychopharmacology 2:53 (1989)]. ФВК також залучено в етіології розладів, пов'язаних з тривогою, та, як відомо, створюють анксіогенну дію у тварин. Взаємодії між бензодіазепіновими/небензодіазепіновими анксіолітиками та ФВК показані у різних поведінкових моделях тривоги [D.R. Britton et al., Life Sci. 31:363 (1982); C.W. Berridge та A.J. Dunn Regul. Peptides 16:83 (1986)]. Попереднє дослідження застосування припустимого антагоністу рецептору ФВК a-спірального овечого ФВК (9-41) у різних поведінкових парадигмах показує, що антагоніст виявляє "анксіолітичноподібну" дію, що є якісно подібною бензодіазепінам [C.W. Berridge та A.J. Dunn Horm. Behav. 21:393 (1987), Brain Research Reviews 15:71 (1990)]. Нейрохімічні, ендокринні дослідження та дослідження зв'язування рецептору показали взаємодії між ФВК та бензодіазепіновими анксіолітиками, забезпечуючи наступне свідоцтво стосовно залучення ФВК у цих розладах. Клодіазепоксид послаблює "анксіогенну" дію ФВК у конфліктному тесті [K.Т. Britton et al., Psychopharmacology 86:170 (1985); K.T. Britton et al., Psychopharmacology 94:306 (1988)] та у тесті акустичного переляку [N.R. Swerdlow et al., Psychopharmacology 88:147 (1986)] на щурах. Антагоніст бензодіазепінового рецептору Ro 15-1788, котрий не мав поведінкової активності сам по собі в оперантному конфліктному тесті, інвертував дію ФВК залежним від дози чином, а бензодіазепіновий інверсний агоніст FG 7142 посилював дію ФВК [K.Т. Britton et al., Psychopharmacology 94:396 (1988)]. Механізми та ділянки дії, через котрі звичайні анксіолітики та 5 антидепресанти виявляють свою терапевтичну дію, залишаються невідомими. Попередні дослідження дії пептиду антагоністу рецептору ФВК1 (aспірального ФВК9-41) у різних поведінкових парадигмах, показали, що антагоніст ФВК1 виробляє "анксіолітично-подібну" дію якісно подібну бензодіазепінам [для огляду дивись: G.F. Koob and K.Т. Britton, In: Corticotropin-Releasing Factor: Basic and Clinical Studies of a Neuropeptide, E.B. De Souza and C.B. Nemeroff eds., CRC Press p,2 21 (1990)]. Застосування антагоністів ФВК1 для лікування синдрому X також описано у заявці на патент США №09/696,822, зареєстровано жовтня 26, 2000, зараз розглянуто як патент США №6,589,947 та Європейській заявці на патент №003094414, зареєстровано жовтня 26, 2000, котрі також надані як посилання. Способи застосування ФВК1 антагоністи для лікування застійної серцевої недостатності описані у США Serial №09/248,073, зареєстровано лютого 10, 1999, зараз патент США 6,043,260 (Березень 28, 2000), котрі також надані як посилання. ФВК, як відомо, мають широкий екстрагіпоталамічний розподіл у центральній нервовій системі, сприяючи широкому спектру автономної поведінкової та фізіологічної дії [дивись, наприклад, Vale et al., 1983; Koob, 985; та E.B. De Souze et al., 1985]. Наприклад, концентрації ФВК значно збільшені у спинномозковій рідині пацієнтів, що потерпають від афективного розладу або глибокої депресії [дивись, наприклад, Nemeroff et al., 1984; Banki et al., 1987; France et al., 1988; Arato et al., 1989]. Більш того, надлишкові рівні ФВК, як відомо, створюють анксіогенну дію у тваринній моделі [дивись, наприклад, Britton et al., 1982; Berridge та Dunn, 1986 та 1987], а антагоністи ФВК1, як відомо, створюють анксіолітичну дію; відповідно, терапевтично ефективні кількості сполук, запропонованих тут, наприклад, визначають оцінкою анксіолітичної дії різної кількості сполук у таких тваринних моделях. Наступні патенти або заявки на патент розкривають сполуки як антагоністи рецепторів ФВК1: WO01/60806, WO97/35901, WO98/29119, WO97/36886, WO97/36898, та патенти США №№5,872,136, 5,880,140, та 5,883,105. Сполуки корисні для лікування пов'язаних з центральною нервовою системою розладів, зокрема афективних розладів та гострих та хронічних неврологічних розладів. Публікація патенту США 2003-0144297, надана як посилання, також розкриває сполуки як антагоністи ФВК. Ми виявили, що сполуки формули І, описані нижче, а також їх фармацевтично прийнятні солі, є антагоністами ФВК1 та корисні у лікуванні розладів та хвороб, асоційованих з рецепторами ФВК1 охоплюючи пов'язані з центральною нервовою системою розлади та хвороби. Таким чином, цей винахід стосується сполуки формули І, 86873 6 або її фармацевтично прийнятної солі, де R1-С1-C6 алкіл, С1-С6 алкеніл, С1-С6 алкініл, C(O)С1-С6 алкіл, С(О)С1-С6 алкеніл або С(О)С1С6алкініл; R2-С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл; R22-С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл; R3-С1-С6 алкіл, С1-С6 алкеніл, С1-С6 алкініл, галоген, OС1-С6 алкіл, ОС1-С6 алкеніл, або Od-C6 алкініл; R4 - d-Сє алкіл, Сі-С6 алкеніл, d-C6 алкініл, галоген, ОСі-С6 алкіл, Od-C6 алкеніл, OС1-С6 алкініл або NR5R6; R5 - гідроген, С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл; та R6 - гідроген, С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл. Згідно з ще одним аспектом заявлений винахід стосується способу лікування розладу або хвороби, що асоційовані з рецепторами ФВК1, або розладу, на лікування котрого може діяти чи сприяти йому антагонізм ФВК1, у ссавця, зокрема у людини, як-то генералізований розлад з компонентом тривоги, соціальний розлад з компонентом тривоги; розлад панічного типу; обсесивнокомпульсивний розлад; хвороблива тривога при депресивному нездужанні; афективний розлад; тривога; розлади харчування; та депресії, спосіб полягає у застосуванні до ссавця сполуки формули І. Згідно з ще одним аспектом заявлений винахід стосується фармацевтичної композиції, що містить фармацевтично прийнятний носій або наповнювач та сполуку винаходу. Сполука винаходу у композиції може бути у кількості, що є терапевтично ефективною для лікування розладу або хвороби, що асоційовані з рецепторами ФВК1 або розладу, на лікування котрого може діяти чи сприяти йому антагонізм ФВК1, у ссавця, зокрема у людини. Згідно з ще одним аспектом заявлений винахід стосується способу лікування розладу з гіперсекрецією ФВК у ссавця, що полягає у застосуванні до ссавця терапевтично ефективної кількості сполуки винаходу. Переважно, ссавцем є ссавець, який потребує лікування, описаного тут. Згідно з ще одним аспектом заявлений винахід стосується способу відбору лігандів для рецепторів ФВК1 спосіб полягає у: а) проведенні аналізу конкурентного зв'язування з рецепторами ФВК1 сполук винаходу, котрі помічено відривною міткою, та кандидатурного ліганду; та b) визначення здатності вказаного кандидатурного ліганду до заміщення вказаної міченої сполуки. 7 Згідно з ще одним аспектом заявлений винахід стосується способу визначення рецепторів ФВК у тканині, який полягає у: а) контактуванні сполуки винаходу, котру помічено відривною міткою, з тканиною, в умовах, що дозволяють приєднання сполуки до тканини; та b) визначення міченої сполуки, приєднаної до тканини. Згідно з ще одним аспектом заявлений винахід стосується способу інгібування зв'язування ФВК з рецептором ФВК1, який полягає у контактуванні сполуки винаходу з розчином, що містить клітини, що експресують рецептор ФВК1, де сполука є у розчині у концентрації, достатній для інгібування приєднання ФВК до рецептору ФВК1. Згідно з ще одним аспектом заявлений винахід стосується способу зменшення рівня зв'язування ФВК in vitro до клітини, що експресують рецептор ФВК1, який полягає у контактуванні сполуки згідно з пунктом 1 з розчином, що містить клітини, де сполука є у розчині у концентрації, достатній для зменшення рівнів зв'язування ФВК з клітинами in vitro. Згідно з ще одним аспектом заявлений винахід стосується виробу, що містить: а) пакувальний матеріал; b) сполуку винаходу; та с) мітку або упаковану у вказаний пакувальний матеріал вставку, яка свідчить, що вказана сполука є ефективною для лікування розладу або хвороби, що асоційовані з рецепторами ФВК1, або розладу, на лікування котрого може діяти чи сприяти йому антагонізм ФВК1, у ссавця. Згідно з ще одним аспектом заявлений винахід стосується застосування сполуки винаходу в аналізі зв'язування, де одну чи більше сполук можна приєднати до мітки, де мітка може безпосередньо або опосередковано давати відкривний сигнал. Різні мітки охоплюють радіоізотопи, люмінофори, хемілюмінофори, молекули, частинки для специфічного зв'язування, наприклад, магнітні частинки, тощо. Згідно з ще одним аспектом заявлений винахід стосується застосування сполук винаходу (зокрема мічених сполук цього винаходу) як зондів для локалізації рецепторів у клітинах та тканини та як стандарти та реагенти для застосування у визначенні характеристик зв'язування рецептором тестсполук. Зразкові втілення винаходу охоплюють сполуки формули І, у котрих R1 - етил або С(О)СН3. Зразкові втілення винаходу також охоплюють сполуки формули І, у котрих R2 - етил та R22 етил. Зразкові втілення винаходу також охоплюють сполуки формули І, у котрих R3 - С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл. Зразкові втілення винаходу також охоплюють сполуки формули І, у котрих R4 - NR5R6. Зразкові втілення винаходу також охоплюють сполуки формули І, у котрих R3 - С1-С6 алкіл, С1-С6 алкеніл, або С1-С6 алкініл, a R4 - NR5R6. Зразкові втілення винаходу також охоплюють сполуки формули І, у котрих R3 - метил, aR4 N(CH3)2. Сполука винаходу може виявляти сприятливу розчинність у воді та шлункових рідинах. Як при 86873 8 клад, сполука винаходу, де R4 - NR5R6 може виявляти сприятливу розчинність у воді та шлункових рідинах. Як ще один приклад, сполука винаходу, де R3 - С1-С6 алкіл, a R4 - NR5R6 може виявляти сприятливу розчинність у воді та шлункових рідинах. У наступному зразковому втіленні сполука винаходу, де R3 - метил, a R4 - N(CH3)2 може виявляти сприятливу розчинність у воді та шлункових рідинах. При застосуванні тут "галоген" вибрано з групи: -F, -СІ, -Вr та -І. При застосуванні тут термін "С1-С6 алкіл" означає насичену частину з лінійним чи розгалуженим ланцюгом частину з 1-6 атомів карбону. При застосуванні тут термін "С1-С6 алкеніл" означає частину з лінійним чи розгалуженим ланцюгом з 1-6 атомів карбону, що містить один чи більше подвійних зв'язків. При застосуванні тут термін "С1-С6 алкініл" означає частину з лінійним чи розгалуженим ланцюгом з 1-6 атомів карбону, що містить один чи більше потрійних зв'язків. При застосуванні тут термін "фармацевтично прийнятна сіль" стосується солі, отриманої з фармацевтично прийнятної нетоксичної кислоти, охоплюючи неорганічні та органічні кислоти. Придатні нетоксичні кислоти охоплюють неорганічні та органічні кислоти основних залишків як-то амінів, наприклад, оцтова, бензол сульфонова, бензойна, камфорсульфонова, лимонна, етенсульфонова, фумарова, глюконова, глутамінова, бромідна, хлоридна, ізетіонова, молочна, малеїнова, яблучна, мигдальна, метансульфонова, слизова, нітратна, памова, пантотенова, фосфатна, бурштинова, сульфатна, барбарова, п-толуолсульфонова кислота тощо; та лужні або органічні солі кислотних залишків як-то карбонових кислот, наприклад, солі лужних та лужно-земельних металів, похідні від таких основ: натрій гідрид, натрій гідроксид, калій гідроксид, кальцій гідроксид, алюміній гідроксид, літій гідроксид, магній гідроксид, цинк гідроксид, аміак, триметиламіак, триетиламіак, етилендіамін, лізин, аргінін, орнітин, холін, N,N'дибензилетилендіамін, хлорпрокаїн, діетаноламін, прокаїн, н-бензилфенетиламін, діетиламін, піперазин, трис(гідроксиметил)-амінометан, тетраметиламоній гідроксид, тощо. Фармацевтично прийнятні солі сполук формули І можна отримувати реакцією вільної кислотної або основної форми цих сполук зі стехіометричною кількістю прийнятної основи або кислоти у воді або в органічному розчиннику, або у суміші двох; загалом, неводні середовища, як-то етер, етилацетат, етанол, ізопропанол, або ацетонітрил є кращими. Перелік придатних солей надано у Remington's Pharmaceutical Sciences, 17th ea., Mack Publishing Company, Easton, PA, 1985, p.1418, розкриття, котрого надане як посилання. У зразковому втіленні сіль сполуки формули І та п-толуолсульфонової кислоти є фармацевтично прийнятною сіллю сполуки формули І. Термін "терапевтично ефективна кількість" сполуки цього винаходу означає кількість, ефективну для протидії анормальному рівню ФВК, або лікування симптомів афективного розладу, триво 9 ги, депресії або інших розладів, описаних тут вище. Термін "сполука винаходу" означає сполуку формули І або її фармацевтично прийнятну сіль. Заявлений винахід також стосується проліків сполук формули І. Термін "проліки" при застосуванні тут означає будь-який ковалентно приєднаний носій, котрий вивільняє активні вихідні ліки формули І in vivo при застосуванні таких проліків до ссавця. Проліки сполук формули І у рамках медичних вимог є придатними для застосування у контакті з тканинами людей та нижчих тварин при надмірній токсичності, подразненні, алергічній реакції, тощо, відповідними прийнятному співвідношенню користь/ризик та ефективними стосовно їх застосування, а також амфіонними формами, де можливо, сполук винаходу. Термін "проліки" означає сполуки, що швидко перетворюються in vivo, утворюючи вихідну сполуку формули І, наприклад, гідролізом у крові. Функціональні групи, котрі можуть швидко перетворюватися метаболічним розщепленням in vivo, утворюють клас груп, реагуючих з карбоксигрупою сполуки цього винаходу. Вони охоплюють, але без обмеження, такі групи, як алканоїл (як-то ацетил, пропіоніл, бутирил, тощо), незаміщений та заміщений ароїл (як-то бензоїл та заміщений бензоїл), алкоксикарбоніл (як-то етоксикарбоніл), триалкілсиліл (як-то триметил- та триетилсиліл), моноестери, утворені з дикарбоновими кислотами (як-то сукциніл), тощо. Внаслідок легкості, з котрою здатні до метаболічного розщеплення групи сполук, корисних згідно з цим винаходом розщеплюються in vivo, сполуки, що несуть такі групи, діють як про-ліки. Сполуки, що несуть здатні до метаболічного розщеплення групи мають перевагу в тому, що вони можуть виявляти поліпшену біозасвоюваність як результат збільшеної розчинності та/або швидкості абсорбції, наданої вихідній сполуці у присутності здатної до метаболічного розщеплення групи. Обговорення проліків представлено у Design of Prodrugs, H. Bundgaard, ea., Elsevier, 1985; Methods in Enzymology, K. Widder et al, Ed., Academic Press, 42, p,3 09-396, 25 1985; A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bundgaard, ea., Chapter 5; "Design and Applications of Prodrugs" p,1 13-191, 1991; Advanced Drug Delivery Reviews, H. Bundgard, 8, p,1-38, 1992; Journal of Pharmaceutical Sciences, 77, p. 285, 30 1988; Chem. Pharm. Bull., N. Nakeya et al, 32, p. 692, 1984; Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, Vol. 14 of A.C.S. Symposium Series, and Bioreversible Carriers in Drug Design, Edward B. Roche, et al., American Pharmaceutical Association and Pergamon Press, 1987, котрі надані як посилання. "Проліки", як вважають, є будь-який ковалентно приєднаний носій, котрий вивільняє активні вихідні ліки формули І in vivo, коли такі проліки застосовують до ссавця. Проліки сполук формули І отримують модифікуванням функціональних груп сполуки таким чином, щоб модифікації розщеплювалися при звичайному перетворенні або in vivo до вихідної сполуки. Проліки охоплюють сполуки, де гідрокси, аміно, або сульфгідрильні групи приєднані до будьякої групи, що при застосуванні до ссавця, розще 86873 10 плюється з утворенням вільної гідрокси, аміно або сульфгідрильної групи, відповідно. Приклади проліків охоплюють, але без обмеження, ацетатні, форміатні та бензоатні похідні спиртових та амінофункціональних груп у сполуках формули І, тощо. Мічені сполуки винаходу можна застосовувати для досліджень in vitro, як-то авторадіографії зрізів тканин або для способів in vivo, наприклад, сканування ПЕТ або ГТГ. Зокрема, сполуки винаходу корисні як стандарти та реагенти у визначенні здатності потенційних фармацевтичних засобів для зв'язування з рецептором ФВК1. Сполуки, запропоновані тут, можуть мати один чи більше асиметричних центрів або площин, усі діастереомерні форми сполуки охоплені у заявленому винаході. Багато геометричних ізомерів олефінів, подвійних зв'язків C=N, тощо можуть також бути у сполуках, усі такі стабільні ізомери охоплені у заявленому винаході. Сполуки винаходу можна виділяти в оптично чистій формі, наприклад, розділенням рацемату звичайними способами як-то кристалізація із засобом розділення або хроматографія, застосовуючи, наприклад, хіральну колонку ВЕРХ, або синтезувати асиметричним синтезом, отримуючи енантіомерно збагачений матеріал. Заявлений винахід охоплює усі можливі таутомери сполук формули І. Прикладами сполук винаходу є такі: (1R,2S)-оцтової кислоти 1-[5-(6-диметиламіно2-метил-піридин-3-іл)-3,6-діетил-піразин-2іламіно]-індан-2-іл-естер; (1R,2S)-оцтової кислоти 1-[5-(6-диметиламіно2-метил-піридин-3-іл)-3,6-діетил-піразин-2іламіно]-індан-2-іл-естер толуол-4-сульфонової кислоти; та (1R,2S) [5-(6-Диметиламіно-2-метил-піридин-3іл)-3,6-діетил-піразин-2-іл]-(2-етокси-індан-1-іл)амін. Сполуки винаходу можна отримувати реакціями, зображеними у нижченаведених схемах або їх варіаціями, відомими спеціалістам. Як ілюстровано у схемі А для зразкових сполук винаходу, амінопіразин А-ІІ можна отримати з належно функціоналізованого хлорпіразину А-І (дивись схему В) реакцією із прийнятним гетероциклічним або карбоциклічним аміном у присутності каталізатору на основі перехідного металу (наприклад, паладій(ІІ) ацетату або трис(дибензиліденацетон)дипаладію(0)), основи (наприклад, натрій або калій трет-бутоксиду) у розчинниках, як-то, але без обмеження, толуол, ДМФ, або діоксан, (наприклад, дивись Buchwald, S.L. et al J. Org. Chem. 2000, 65, 1158. Утворення ацетату можна досягти сполученням з оцтовим ангідридом або ацетилхлоридом у присутності основи (дивись А-ІІІ). Етери можна отримувати сполученням алкілйодиду з натрій алкоксидом А-ІІ. Галогенування А-ІІІ можна здійснювати рядом способів, добре відомих спеціалістам застосовуючи реагенти, як-то N-хлорсукцинімід, Nбромсукцинімід, N-йодсукцинімід, бром, йод, піридиній трибромід у розчинниках, як-то дихлорметан, оцтова кислота, ДМФ, тощо, отримуючи галогенпіразин A-IV. Утворення заявленої сполуки 11 здійснюють каталізованим перехідним металом сполученням з A-IV та прийнятним металоарильним реагентом, як-то арил-боронові кислоти (дивись наприклад, Miyaura, N.; et al Chem. Rev. 1995, 95, 2457), арилста-нани (дивись наприклад, Mitchell, T.N. Synthesis 1992, 803), або арильні реагенти Гриньяра (дивись наприклад, Miller, J.A. Tetrahedron Lett. 1998, 39, 7275). Схема А Схема В ілюструє отримання монохлорпіразинів, як-то А-І. У монохлорпіразинів схеми В, R2 та R22 можуть бути однаковими С1-С6 алкілами, як-то етил, або відмінними С1-С6 алкілами сполученням прийнятних амінокислот. Послідовність реакцій, показана нижче відповідає описаній у Chemical and Pharmaceutical Bulletin of Japan, 1979, 27, 2027. Схема В Схема С зображує утворення зразкових боронових кислот сполучення фрагменту. Воронові кислоти можна отримувати метал-галоген-обміном або способами сполучення з паладієм, відомими спеціалістам. Схема С На додаток до вищенаведених станів сполуки винаходу корисні для лікування різних розладів у ссавця, зокрема людини, як-то соціальний розлад з компонентом тривоги; розлад панічного типу; обсесивно-компульсивний розлад; тривога при депресивному нездужанні; афективний розлад; тривога; депресія; синдром подразненого кишечнику; посттравматичний стрес-розлад; супрануклеарний параліч; імуно-пригнічення; шлунковокишкова хвороба; нервова анорексія або інший розлад харчування; симптоми припинення зловживання ліками або алкоголем; розлад при зловживанні (наприклад, нікотин, кокаїн, етанол, опіати або інші ліки); запальний розлад; проблеми здатності до відтворення потомства; розлади, на лікування котрих може діяти чи сприяти йому антагонізм ФВК1, охоплюючи, але без обмеження, роз 86873 12 лади, які індукує або сприяє їм ФВК; розлад, вибраний із запальних розладів, як-то ревматоїдний артирит та остеоартирит, біль, астма, псоріаз та алергії; генералізований розлад з компонентом тривоги; паніка, фобії, обсесивно-компульсивний розлад; пост-травматичний стрес-розлад; розлади сну, індуковані стресом; больові відчуття, як-то фіброміалгія; розлади настрою, як-то депресія, охоплюючи глибоку депресію, епізодичну депресію, рецидивну депресію, індуковану жорстоким поводженням з дітьми депресію, та післяпологову депресію; психічна депресія; біполярні розлади; циклотімія; синдром стомленості; індукований стресом головний біль; рак, інфекції вірусом імунодефіциту людини (ВІЛ); нейродегенеративні хвороби, як-то хвороба Альцгеймера, хвороба Паркінсона та хвороба Хантингтона; розлади шкіри, як-то вугри та псоріаз; шлунково-кишкові хвороби, як-то виразки, синдром подразненого кишечнику, хвороба Крона, спастичний коліт, діарея, та кишкова непрохідність після операції та ободова гіперчутливість, асоційована з психопатологічними порушеннями або стресом; геморагічний стрес; індуковані стресом психотичні приступи; еутиреоїдний синдром хворобливості; синдром неприйнятного антидіуретичного гормону (АДГ); ожиріння; нездатність до відтворення потомства; травми голови; травма спинного хребта; ішемічні нейронні пошкодження (наприклад, церебральна ішемія, якто церебральна гіпокампальна ішемія); ексцитотоксичні нейронні пошкодження; епілепсія; серцевосудинні та пов'язані зі слухом розлади, охоплюючи гіпертензію, тахікардію та застійну серцеву недостатність; інсульт; імунні дисфункції, охоплюючи стрес, індуковані імунні дисфункції (наприклад, стрес, індуковані лихоманки, стрес-синдром свиней, лихоманка корів при перевезені, пароксизмальна фібриляція коней, та дисфункції, індуковані обмеженням свободи у курей, стрес у овець при стрижці, або пов'язаний з взаємодією людинатварина стрес у собак); м'язові спазми; енурез; сенільна деменція типу Альцгеймера; багатоінфарктна деменція; бічний аміотрофічний склероз; хімічні залежності та схильності (наприклад, залежності від алкоголю, кокаїну, героїну, бензодіазепінів, або інших ліків); остеопороз; психосоціальна наносомія та гіпоглікемія. Сполуку цього винаходу можна застосовувати для лікування станів, що описано тут, у ссавця або людини, засобами, що створюють контакт активного засобу із ділянкою дії засобу в організмі ссавця або людини. Сполуки можна застосовувати будьякими звичайними засобами корисними для застосування разом з фармацевтичними засобами як окремий терапевтичний засіб або у комбінації терапевтичних засобів. Їх можна застосовувати самі по собі, але загалом застосовують з фармацевтичним носієм, вибраним на основі шляху застосування та стандартної фармацевтичної практики. Дозування залежатиме від застосування та відомих факторів, як-то фармакодинамічний характер конкретного засобу, та режиму і шляху його застосування; віку реципієнта, маси, та здоров'я; природи та ступеню симптомів; типу супутнього лікування; частоти лікування; та потрібної дії. 13 Для застосування у лікуванні хвороб або станів, що описано тут, сполуку цього винаходу можна застосовувати перорально у дозі активного інгредієнту приблизно 0,002-200мг/кг маси тіла. Звичайно, доза 0,01-10мг/кг у поділених дозах 1-4 рази/добу, або у композиції з безперервним вивільненням буде ефективною стосовно потрібної фармакологічної дії. Активний інгредієнт можна застосовувати перорально у твердих формах дозування, як-то капсули, таблетки та порошки; або у рідких формах, як-то еліксири, сиропи, та/або суспензії. Сполуки цього винаходу можна також застосовувати парентерально у стерильній рідкій дозі композиції. Форми дозування (композиції), придатні для застосування, містять приблизно від 1мг до 100мг активного інгредієнту на одиницю. У цих фармацевтичних композиціях, активний інгредієнт звичайно є у кількості приблизно 0,5-95мас.% від загальної маси композиції. Сполуки цього винаходу можна також застосовувати як реагенти або стандарти у біохімічних дослідженнях неврологічної функції, дисфункції та хвороби. Отримання та приклади Винахід ілюстровано наступними прикладами та отриманнями, котрі не обмежують винахід у рамках. Приклад А Аналіз зв'язування рецептору ФВК1 для оцінки біологічної активності Наступне є описом виділення мембран мозку щура для застосування у стандартному аналізі зв'язування, а також описом самого аналізу зв'язування на основі модифікованого протоколу, що описано De Souza (De Souza, 1987). Для отримання мембран мозку для аналізів зв'язування, лобну кору щурів гомогенізують у 10мл охолодженого льодом буферу для тканин (50мМ буферу ГЕПЕС рН 7,0 , що містить 10мМ МgСІ2, 2мМ ЕГТА, 1мкг/мл апротиніну, 1мкг/мл лейпептину та 1мкг/мл пепстатину). Гомогенат центрифугують при 48000 х g протягом 10хвил. та утворену гранулу знов гомогенізують у 10мл буферу для тканин. Після додаткового центрифугування при 48000 х g протягом 10хвил. гранулу ресуспендують до концентрації білку 300мкг/мл Аналізи зв'язування проводять у 96-коміркових планшетах у кінцевому об'ємі 300мкл. Аналізи ініціюють додаванням 150мкл суспензії мембран до 150мкл буферу для аналізу, що містить 125І-овечійФВК (кінцева концентрація 150пМ) та різні концентрації інгібіторів. Буфер для аналізу є тим же, що описано вище для отримання мембран з додаванням 0,1% яєчного альбуміну та 0,15мМ бацитрацину. Зв'язування радіоліганду закінчують після 2 годин при кімнатній температурі фільтруванням через однофільтрувальні планшети Packard GF/C (попередньо просочені 0,3% поліетиленіміном) застосуванням збирача клітин Packard. Фільтри промивають три рази охолодженим льодом буферованим фосфатом фізіологічним розчином з рН 7,0, що містить 0,01% тритон Х-100. Фільтри оцінюють стосовно радіоактивності у Packard 86873 14 TopCount. Неспецифічне зв'язування визначають у присутності надлишку (10мкМ) a-спірального ФВК. Альтернативно, тканини та клітини, що природно експресують рецептори ФВК, як-то клітини нейробластом людини IMR-32 (АТСС; Hogg et al., 1996), можна застосовувати в аналізах зв'язування, аналогічним описаним вище. Значення ІК50 розраховують застосуванням відомих стандартних способів, як-то програмою нелінійної підгонки кривих RS/1 (BBN Software Products Corp., Cambridge, MA). Сполуку вважають активною, якщо вона має значення ІК50 менше приблизно 10мкМ для інгібування рецепторів ФВК1 афінність стосовно зв'язування сполук формули І виражають, як значення ІК50 у межах приблизно від 0,5нМ до приблизно 10мкМ. Кращі сполуки формули І виявляють ІК50 1мкМ або менше, більш кращі сполуки формули І виявляють ІК50 менше 100нМ або менше, ще кращі сполуки формули І виявляють ІК50 менше 10нМ або менше. Приклад В. Інгібування стимульованої ФВК аденілатної активності цикпази Інгібування стимульованої ФВК аденілатної активності циклази можна проводити, як раніше описано [G. Battaglia et al., Synapse 1:572 (1987)]. Коротше, аналізи проводять при 37°С протягом 10хвил у 200мл буферу, що містить 100мМ ТрисНСІ (рН 7,4 при 37°С), 10мМ МgСІ2, 0,4мМ ЕГТА, 0,1% альбуміну коров'ячої сироватки, 1мМ ізобутилметилксантину (ІВМХ), 250одиниці/мл фосфокреатин-кінази, 5мМ креатин-фосфату, 100мМ гуанозин 5'-трифосфату, 100нМ о-ФВК, пептиди антагоністів (різні концентрації) та 0,8мг вихідної вологої маси тканини (приблизно 40-60мг білку). Реакції ініціюють додаванням 1мМ АТФ/[32Р]АТФ (приблизно 2-4мКі/тубу) та закінчують додаванням 100мл 50мМ Трис-НСІ, 45мМ АТФ та 2% натрій додецилсульфату. Для моніторингу регенерації цАМФ, 1мл [3Н]цАМФ (приблизно 40000 розпад/хвил) додають до кожної туби для розділення. Відділення [3Н]цАМФ від [32Р]АТФ проводять послідовним елюванням через колонки Dowex та з алюміній оксидом. Альтернативно, аденілатна активність циклази може бути оцінена у 96-комірковому форматі аналізом Adenylyl Cyclase Activation FlashPlate Assay від NEN Life Sciences NEN Life Sciences згідно з доданими протоколами. Коротше, фіксовану кількість радіоміченого цАМФ додають до 96коміркових планшетів, що попередньо покриті антитілом проти циклічного АМФ. Клітини або тканини додають та стимулюють у присутності або відсутності інгібіторів. Немічений цАМФ, створений клітинами заміщуватиметься радіоміченим цАМФ від антитіла. Приєднаний радіомічений цАМФ виробляє світловий сигнал, що можна визначити застосуванням мікропланшетного сцинтиляційного лічильника, як-то Packard Top-Count. Збільшення кількості неміченого цАМФ призводить до зменшення відкривного сигналу протягом часу інкубування (2-24 години). Приклади Отримання 1 (1R,2S)-1-(3,6-Діетил-піразин-2-іламіно)-індан2-ол 15 У продутий азотом скляний лінійний реактор на 200л додавали (1R,2S)-(+)-цис-1-аміно-2інданол (2,5кг, 16,1моль, 1,5екв.), паладій(ІІ) ацетат (72г, 0,3моль, 3мол.%), 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (200г, 0,3моль, 3мол.%) та цезій карбонат (7,0кг, 21,5моль, 2,0екв.), а потім толуол (65л). При перемішуванні до білої суспензії додавали 3-Хлор-2,5-діетилпіразин (1,83кг, 10,7моль, 1,0екв.) при кімнатній температурі та вміст гріли при кипінні під зворотним холодильником (110°С) протягом 2 годин, тоді за даними ВЕРХ реакція завершувалася (4 краплі реакційної суміші гасили водою та тоді екстрагували 1мл МТВЕ, видаляли розчинник та розбавляли 1,5мл СН3СN/вода). До реакційної суміші додавали метил-трет-бутил-етер (45л) та воду (45л) і шари відокремлювали. Органічний шар промивали ще раз водою (45л) і екстрагували метил-трет-бутил-етером (45л). Комбіновані органічні шари тоді концентрували під вакуумом до мінімального об'єму. Диметилформамід (4гал, Е&М Science) додавали та утворений чорний розчин переносили у 20-л бутель. Вихід (1R,2S)-1-(3,6Діетил-піразин-2-іламіно)-індан-2-олу визначали за допомогою кількісної ВЕРХ (2,27кг, 73%). Цей матеріал застосовували без подальшої очистки. ВЕРХ-час утримання заголовної сполуки 2,1 хвил. Колонка 150мм х 4,6мм, Luna 5мкм феніл-гексил; 50/50 СН3СN/вода + 0,1% TFA з градієнтом до 75/25 + 0,1% СН3СN/вода + 0,1% TFA.IR (коефіцієнт дифузного відбиття) 3435, 3241, 2962, 2935, 2912, 2873, 1581, 1547, 1500, 1453, 1184, 1163, 1047, 744, 733см-1; OAMS-підтримування іонів при: ІЕР+ 384,0 ; МС (XI) m/z 284 (МН+); МСВР (БША) розраховано для C17H21N3O + Н1 284,1 763, знайдено 284,1 754. [D]25D = 12 (с 0,5 5, метиленхлорид); Аналіз: розраховано для C17H21N3O: С, 72,0 6; Н, 7,4 7; N, 14,8 3. Знайдено: С, 72,1 5; Н, 7,5 3; N,14,4 2. Отримання 2 (1R,2 S)-оцтової кислоти 1-(3,6-діетил-5-йодпіразин-2-іламіно)-індан-2-іл-естер У продутий азотом скляний лінійний реактор на 1200л додавали (1R,2S)-1-(3,6-Діетил-піразин2-іламіно)-індан-2-ол (25кг, 86,1моль, 1,0екв.), 4диметиламінопіридин (1,0кг, 8,6моль, 10мол.%) та тетрагідрофуран (139л), а потім триетиламін (18кг, 177,9моль, 2,1екв.). До цього розчину додавали оцтовий ангідрид (10,6кг, 103,8моль, 1,2екв.), тримаючи внутрішню температуру менше 30°С. Після перемішування протягом 3 годин при 20-25°С ВЕРХ (3 краплі гасили 1,0мл метанолу, тоді розбавляли 0,5мл води) показала, що реакція не завершувалася. Додатковий оцтовий ангідрид (2,4кг, 23,8моль, 0,3екв.) додавали та вміст перемішували протягом 1 години і знов аналізували та вважали реакцію завершеною. Метанол (6,3кг, 197,2) моль додавали для знищення надлишку оцтового ангідриду та перемішували протягом 1 години, після чого суміш розбавляли метил-трет-бутилетеромом (200л) та водою (200л), що містить лимонну кислоту (23,0кг, 119,7моль). Фази відокремлювали та водний шар екстрагували метил-третбутил-етером (100л), комбіновані органічні фази промивали 1Н водним натрій гідроксидом (200л) 86873 16 та водою (2´100л). Комбіновані органічні продукти переганяли під вакуумом до об'єму менше 75л і додавали диметилформамід (150л) та концентрацію продовжували до об'єму приблизно 160л. Цей розчин додавали у другий скляний лінійний реактор на 1200л, що містить N-йодсукцинімід (30,0кг, 133,3моль, 1,5екв.) та гріли до 55°С протягом 3 годин, тоді за даними ВЕРХ реакція завершувалася (3 краплі реакційної суміші гасили водою та тоді екстрагували 1мл МТВЕ, видаляли розчинник та розбавляли 1,5мл CH3CN/вода). Суміш розбавляли метил-трет-бутил-етером (200л) та обробляли водою (200л), що містить натрій тіосульфат пентагідрат (22,6кг, 91моль). Шари відокремлювали та водний шар екстрагували метил-трет-бутилетером (100л). Комбіновані органічні шари промивали водою (3´100л) та тоді переганяли до меншого об'єму під вакуумом, отримуючи сирий (1R,2S)-оцтової кислоти 1-(3,6-діетил-5-йодпіразин-2-іламіно)-індан-2-іл-естер. Очистку робили через силікагель (500кг), елюючи 20/80 ЕtoАс/октаном, збираючи фракції 200-л. Концентрація прийнятних фракцій з додаванням октану дала суспензію, що охолоджували до 0°С, фільтрували та промивали октаном, тоді сушили азотом при 40°С, отримуючи 31,1кг (80%) заголовної сполуки, як білий твердий продукт. 1Н ЯМР (400МГц, ДMCO-d6) d 7,2 8 (m, 4 Н), 6,6 6 (d, J = 9 Гц, 1 Н), 5,8 0 (т, 1 Н), 5,6 8 (т, 1 Н), 3,2 9 (т, 1 Н), 3,0 1 (d, J = 17 Гц, 1 Н), 2,6 9 (т, 4 Н), 1,8 8 (s, 3 Н), 1,1 5 (т, 6 Н); 13С ЯМР (ДMCO-d6) d 169,7 2, 153,7 5, 151,0 1, 143,7 3, 141,2 4, 139,8 9, 127,8 0, 126,7 5, 124,7 2, 124,3 9, 100,6 6, 74,3 3, 57,0 1, 36,8 2, 31,0 4, 24,7 1, 20,8 6,12,6 0,11,1 7. Отримання 3 (5-Бром-6-метил-піридин-2-іл)диметил-амін До розчину 5-Бром-6-метил-піридин-2-іламіну (4г, 0,021моль) у тетрагідрофурані (105мл) додавали натрій гідрид (60%, 1,2екв. 1г). Після 30хвил. додавали йодметан (1,56мл, 1,2екв.). Після ще 24 годин додавали натрій гідрид (60%, 1,2екв. 1г) та подметан (1,5 6мл, 1,2екв.). Реакційну суміш перемішували 72 години та виливали у 1Н NaOH, екстрагували етил-етером, сушили магній сульфатом, фільтрували та концентрували. Хроматографія, елюючи сумішшю 2-10%етилацетат/гексан дала заголовну сполуку як масло. (4,3 1г, 96%). 1Н ЯМР (400МГц, CDCI3) d 7,4 5 (d, J=8,7 Гц, 1 Н), 6,2 0 (d, J = 8,7 Гц, 1 Н), 3,0 1 (s, 6H), 2,4 6 (s, 3Н). Отримання 4 (5-Боронової кислоти-6-метилпіридин-2-іл)-диметил-аміну До розчину (5-Бром-6-метил-піридин-2-іл)диметил-аміну (1,0г, 0,0046моль) у суміші тетрагідрофуран (1,6мл) / толуол (6,6мл) додавали n-BuLi (2,24мл 2,5М) краплями в атмосфері азоту при 78°С. Після 30хвил. додавали краплями триізопропілборат (1,28мл). Після 30хвил. реакційну суміш гріли до кімнатної температури та перемішували 30хвил і додавали 7мл 1Н НСІ. Реакційну суміш перемішували 1Н та гасили до рН 8 1 Н NaOH. Екстракція етилацетатом, сушка магній сульфатом та концентрація дали білий твердий продукт. Розтирання на порошок з гексаном та фільтрування дали заголовну сполуку, як білий твердий продукт 550мг (65%) (400МГц, ДМСО) d 17 7,9 0 (гл, 1 Н), 6,4 5 (т, 1 Н), 3,0 1 (s, 6Н), 2,6 3 (s, 3Н). Приклад 1 (1R,2S)-оцтової кислоти 1-[5-(6-диметиламіно2-метил-піридин-3-іл)-3,6-діетил-піразин-2іламіноі-індан-2-іл-естер У чисту суху тригорлу круглодонну колбу на 1л з мішалкою, трубкою для уведення азоту та зворотним холодильником завантажували тетрагідрофуран (8,60моль; 700мл; 620г), (5-боронової кислоти-6-метил-піридин-2-іл)-диметил-амін (1,00еквів [обмежувальний реагент]; 194ммоль; 35,0г), (1R,2S)-оцтової кислоти 1-(3,6-діетил-5-йодпіразин-2-іламіно)-індан-2-іл-естер (0,500 еквів; 97,2ммоль; 43,9г) Pd(OAc)2 (0,0 200 еквів; 3,89ммоль; 873мг),1,1'Біс(дифенілфосфіно)фероцен (0,0 200еквів; 3,8 9ммоль; 2,1 6г), калій гідрофлуорид, 99-100-мас.% (4,0 0 еквів; 778ммоль; 61,0г). Реакційну суміш гріли до 60°С та тримали протягом 18г. Реакційну суміш тоді охолоджували до кімнатної температури, фільтрували та продукт виділяли хроматографією (20% МЕТВ/Гексан). 42г потрібного продукту отримували. Це застосовували без подальшої очистки. (Низькоплавкий твердий продукт) 1Н ЯМР (400МГц, CDCI3) d 7,3 7 (гл, 1 Н), 7,2 8 (т, 4 Н), 6,4 0 (d, J=8,7 Гц, 1 Н), 6,0 5 (т, 1 Н), 5,7 2 (т, 1Н), 4,8 2 (d, J=9,1 Гц, 1 Н), 3,3 3 (dd, J = 17,0, 5,0 Гц, 1 Н), 3,0 8 (s, 6 Н), 2,0 5 (т, 1 Н), 2,6 7 (q, J=7,5 Гц, 2 Н), 2,4 9 (q, J=7,5 Гц, 2Н), 2,2 3 (s, 3Н), 1,9 4 (s, 3Н), 1,2 7 (т, 3Н), 1,1 2 (t, J=7,5 Гц, 3Н); МС: (Вихідний М+Н m/z = 460,4). Приклад 2 (1R,2S) Оцтової кислоти 1-[5-(6диметиламіно-2-метил-піридин-3-іл)-3,6-діетилпіразин-2-іламіно]-індан-2-іл-естер толуол-4сульфонової кислоти У чисту суху промиту 2-Метил-ТГФ круглодонну колбу завантажували 650мл 2-Метил-ТГФ, 65г (1R,2S)-оцтової кислоти 1-[5-(6-диметиламіно-2метил-піридин-3-іл)-3,6-діетил-піразин-2-іламіно]індан-2-іл-естеру. Цей розчин фільтрували у промиту 2-метил-ТГФ 2л круглодонну колб. До цього додавали фільтруванням розчин 150мл 2-МетилТГФ та 34,4г п-толуолсульфонової кислоти моногідрату. Розчин солі гріли до 60°С та охолоджували до кімнатної температури. Продукт гранулюють при кімнатній температурі та виділяють фільтруванням, промивають фільтрованим 2-Метил ТГФ та сушать у вакуумній шафі протягом ночі при 45°С. Продукт (79,2г, 89% виходу) відповідав потрібній структурі та порошкова рентгенографія підтвердили потрібну поліморфну форму. 1Н ЯМР (400МГц, CDCI3) d 7,8 0 (d, J=8,3 Гц, 2 H), 7,6 7 (d, J = 9,5 Гц, 1 H), 7,3 4 (m, 1Н), 7,2 9 (m, 3Н), 7,1 5 (d, J=8,7 Гц, 2 H), 6,7 2 (d, J = 9,1 Гц, 1 H), 6,0 3 (m, 1H), 5,7 2 (m, 1H), 4,9 7 (d, J=9,1 Гц, 1 H), 3,3 9 (s, 6H), 3,3 4 (dd, J = 17,4 , 5,4 Гц, 1 H), 3,0 9 (d, J=17,0 Гц, 1 H), 2,6 3 (m, 2 Н), 2,5 7 (s, 3Н), 2,4 2 (q, J=7,5 Гц, 2 Н), 2,3 2 (s, 3Н), 1,9 6 (s, 3Н), 1,2 7 (t, J=7,5 Гц, 3Н), 1,1 5 (t, J=7,5 Гц, 3Н); МС: (Вихідний М+Н m/z = 460,1); Аналіз: розраховано для C34H41N5O5S: С, 64,6 4; Н, 6,5 4; N, 11,0 8; S, 5,0 7. Знайдено: С, 64,2 7; Н, 6,5 7; N, 10,9 4; S, 5,4 1. 86873 18 Отримання 5 (1R,2S) 1-r5-(6-Диметиламіно-2метил-піридин-3-vn-3,6-діетил-піразин-2-іламіно]індан-2-ол До розчину (1R, 2S) 1-(3,6-Діетил-5-йодпіразин-2-іламіно)-індан-2-олу (1г) у бензолі (20мл) додавали (5-Боронової кислот-6-метил-піридин-2іл)-диметил-амін (880мг, 2екв.), дихлорпаладій дитрифенілфосфін (171мг, 0,1екв.) та 2Н розчин натрій карбонату (4мл) і реакційну суміш гріли при 75°С протягом 18г. Реакційну суміш охолоджували до кімнатної температури, виливали у насичений гідрокарбонат та екстрагували 2 х етилацетатом. Органічний шар сушили магній сульфатом, фільтрували та концентрували. Очистка ПЕРХ Biotage, елюючи сумішшю 20-40% етилацетат/гексан дала заголовну сполуку (355мг, 36%). 1Н ЯМР (400МГц, CDCI3) d 7,2 3 (m, 5 Н), 6,4 0 (d, J=8,3 Гц, 1 Н), 6,5 7 (t, J=5,4 Гц, 1 Н), 4,8 0 (m, 2 Н), 3,2 1 (m, 2 Н), 3,0 8 (s, 6 Н), 2,7 0 (q, J=7,5 Гц, 2 Н), 2,5 1 (q, J=7,5 Гц, 2Н), 2,2 3 (s, 3Н), 1,2 8 (t, J=7,5 Гц, 3Н), 1,1 2 (t, J=7,5 Гц, 3Н); МС: (Вихідний М+Н m/z = 418,3). Приклад 3 (1R,2S)-5-(6-Диметиламіно-2-метил-піридин-3іл)-3,6-діетил-піразин-2-іл]-)2-етокси-індан-1-іл)амін До розчину (1R,2S)-1-[5-(6-Диметиламіно-2метил-піридин-3-іл)-3,6-діетил-піразин-2-іламіно]індан-2-олу (93мг) у диметилформаміді (2,2мл) при 0°С додавали натрій гідрид (11мг, 1,2екв.) під N2. Після 5хвил. додавали йодетан (1,2екв.). Після 2 годин реакційну суміш виливали у насичений натрій гідрокарбонат, екстрагували метиленхлоридом, сушили магній сульфатом, фільтрували та концентрували. Очистка ПЕРХ Biotage, елюючи сумішшю 5-20% етилацетат/гексан дала заголовну сполуку (61мг). 1Н ЯМР (400МГц, CDCI3) d 7,4 3 (d, J=6,6 Гц, 1Н), 7,2 5 (m, 1Н), 7,2 3 (m, 3 Н), 6,4 0 (d, J=8,3 Гц, 1 Н), 5,7 9 (m, 1 Н), 5,2 6 (d, J=7,9 Гц, 1 H), 4,3 5 (m, 1 Н), 3,6 6 (m, 1 Н), 3,4 6 (m, 1Н), 3,1 0 (m, 2Н), 3,0 9 (s, 6 Н), 2,7 0 (q, J=7,5 Гц, 2 H), 2,5 0 (q, J=7,5 Гц, 2H), 2,2 4 (s, 3Н), 1,2 8 (t, J=7,5 Гц, 3Н), 1,1 2 (m, 6Н); МС: (Вихідний М+Н m/z = 446,3). Значення Кl, константи зв'язування з рецептором ФВК1, вимірювали для зразкових сполук винаходу. Сполука прикладу 1, (1R,2S)-оцтової кислоти 1-[5-(6-диметиламіно-2-метил-піридин-3-іл)-3,6діетил-піразин-2-іламіно]-індан-2-іл-естер, як виявлено, має Кl19нМ. Сполука прикладу 3, (1R,2S)[5-(6-Диметиламіно-2-метил-піридин-3-іл)-3,6діетил-піразин-2-іл]-(2-етокси-індан-1-іл)-амін, як виявлено, має Кl13нМ. Ці результати дають міцне свідоцтво гарної здатності сполук винаходу діяти як антагоністи рецептору ФВК1. Специфічні втілення, розкриті тут ілюструють аспекти винаходу без обмеження рамок винаходу будь-яким чином. Будь-які еквівалентні втілення є у рамках цього винаходу. Різні модифікації винаходу на додачу до показаних та описаних тут зрозумілі спеціалістам з вищенаведеного опису. Такі модифікації також є у рамках доданої формули винаходу. 19 Комп’ютерна верстка М. Ломалова 86873 Підписне 20 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted aryl 1,4-pyrazlne derivatives
Автори англійськоюVerhoest Patric Robert, Hoffman Robert Louis
Назва патенту російськоюПроизводные арил-1,4-пиразина
Автори російськоюФергест Патрик Роберт, Гоффман Роберт Люис
МПК / Мітки
МПК: C07D 401/04, A61P 25/00, A61K 31/497
Мітки: арил-1,4-піразину, похідні
Код посилання
<a href="https://ua.patents.su/10-86873-pokhidni-aril-14-pirazinu.html" target="_blank" rel="follow" title="База патентів України">Похідні арил-1,4-піразину</a>
Попередній патент: Спосіб і апарат для сушіння вологої сировини
Наступний патент: Стенд для випробування ходунків
Випадковий патент: Закупорювальний пристрій для пляшки з рідиною












