Кристалічна основа транс-1-((1r,3s)-3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину
Формула / Реферат
1. Кристалічна основа сполуки формули (І), сполуки І, транс-l-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину
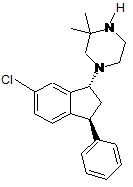 , (I)
, (I)
яка характеризується порошковою рентгенівською дифрактограмою, одержаною з використанням СuKа1 опромінення (λ=1,5406 Å), що показує сигнали при наступних 2θ-кутах: 6,1, 11,1, 12,1, 16,2, 16,8, 18,3, 18,6, 20,0.
2. Кристалічна основа за п. 1, яка характеризується наявністю ДСК термограми, відповідно до Фіг. 2.
3. Кристалічна основа за п. 1 або п. 2, яка характеризується наявністю ДСК кривої, що виявляє ендотерму з наростанням близько 91-93 °С.
4. Кристалічна основа за будь-яким з пп. 1-3, де вказана кристалічна основа є безводною.
5. Кристалічна основа за п. 4, яка вільна від розчинника.
6. Кристалічна основа за будь-яким з пп. 1-5, яка має чистоту не менше 98 %, що виміряно ВЕРХ (площа).
7. Кристалічна основа за будь-яким з пп. 1-6, сполуки I, де енантіомерний надлишок сполуки І складає щонайменше 98 %.
8. Кристалічна основа за будь-яким з пп. 1-7 для застосування в медицині.
9. Фармацевтична композиція, яка містить кристалічну основу за будь-яким з пп. 1-7.
10. Застосування кристалічної основи за будь-яким з пп. 1-7 для виготовлення лікарського засобу для лікування хвороби, вибраної з групи, яка складається з хвороб, що включають психотичні симптоми, шизофренію, тривожні розлади, афективні розлади, порушення сну, мігрень, нейролептикзумовлений паркінсонізм і порушення, викликані зловживанням наркотичними речовинами.
11. Застосування за п. 10, де вказаний афективний розлад являє собою депресію.
12. Застосування за п. 10, де вказане порушення викликане зловживанням наркотичними речовинами.
13. Застосування для виготовлення лікарського засобу за п. 10 для лікування шизофренії або інших психотичних розладів.
14. Застосування за п. 13 для виготовлення медикаменту для лікування одного або більше з: позитивних симптомів, негативних симптомів і депресивних симптомів шизофренії.
15. Застосування кристалічної основи за будь-яким з пп. 1-7 для виготовлення лікарського засобу для лікування захворювання, вибраного з групи, яка складається з: шизофренії, шизофреноформного розладу, шизоафективного розладу, розладу марення, короткого психотичного розладу, колективного психотичного розладу і манії при біполярному розладі.
16. Застосування за п. 10, де пацієнт, що лікується, також приймає щонайменше один інший лікарський засіб.
17. Застосування за п. 15, де пацієнт, що лікується, також приймає щонайменше один інший лікарський засіб.
18. Спосіб одержання кристалічної основи сполуки І за п. 1, який відрізняється тим, що вказана кристалічна сполука І утворюється в розчиннику, де вказаний розчинник являє собою етилацетат або гептан, або їх суміш.
19. Спосіб за п. 18, який включає кристалізацію осадженням основи сполуки І з розчинника, наприклад з гептану, і відділення розчинника від одержаної кристалічної основи сполуки І.
20. Спосіб за пп. 18, 19, де вказана кристалічна сполука І визначена в будь-якому з пп. 2-7.
21. Кристалічна основа сполуки І, яку одержують способом за пп. 18, 19.
22. Спосіб одержання сполуки І, яка має формулу, визначену у п.1, де спосіб включає стадію, де сполуку І переводять у кристалічну вільну основу сполуки І.
23. Спосіб одержання солі сполуки І, що включає перетворення кристалічної основи сполуки І, одержаної способом за п. 22, у сіль сполуки І.
24. Спосіб за п. 23, який відрізняється тим, що вільну основу сполуки І одержують чистою і осадженою у кристалічній формі, і, потім, переводять у сіль сполуки І.
25. Спосіб за п. 23, де осаджену у кристалічній формі основу сполуки І перекристалізовують один або більше разів до переведення у сіль сполуки І.
26. Спосіб за п. 24 або 25, де вказана основа сполуки І вільна від вихідної солі або вихідної суміші сполуки І.
27. Спосіб за п. 22, де вказана кристалічна основа сполуки І одержана згідно зі способом за п. 18.
28. Спосіб за будь-яким з пп. 23-26, де вказана кристалічна основа сполуки І одержана згідно зі способом за п. 18.
29. Спосіб одержання фармацевтичної композиції, яка містить сполуку І або її сіль, де сполуку І або її сіль одержують згідно зі способом за п. 22 або п. 27.
30. Спосіб одержання фармацевтичної композиції, яка містить сполуку І або її сіль, де сполуку І або її сіль одержують згідно з способом за будь-яким з пп. 22-26 або 28.
31. Вільна основа сполуки формули (І) [сполука І, транс-1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазин], визначеної у п. 1, яка є основою в твердій формі.
32. Вільна основа за п. 31, де вказана тверда речовина містить кристалічну основу сполуки І.
Текст
1. Кристалічна основа сполуки формули (І), сполуки І, транс-1-((1R,3S)-3-феніл-6-хлороіндан1-іл)-3,3-диметилпіперазину H 2 (11) 1 ТРАНС-1-((1R,3S)-3-ФЕНІЛ-6-ХЛОРОІНДАН-1-ІЛ)-3,3 UA ОСНОВА (19) (54) КРИСТАЛІЧНА ДИМЕТИЛПІПЕРАЗИНУ 3 95901 4 18. Спосіб одержання кристалічної основи сполуки І за п. 1, який відрізняється тим, що вказана кристалічна сполука І утворюється в розчиннику, де вказаний розчинник являє собою етилацетат або гептан, або їх суміш. 19. Спосіб за п. 18, який включає кристалізацію осадженням основи сполуки І з розчинника, наприклад з гептану, і відділення розчинника від одержаної кристалічної основи сполуки І. 20. Спосіб за пп. 18, 19, де вказана кристалічна сполука І визначена в будь-якому з пп. 2-7. 21. Кристалічна основа сполуки І, яку одержують способом за пп. 18, 19. 22. Спосіб одержання сполуки І, яка має формулу, визначену у п. 1, де спосіб включає стадію, де сполуку І переводять у кристалічну вільну основу сполуки І. 23. Спосіб одержання солі сполуки І, що включає перетворення кристалічної основи сполуки І, одержаної способом за п. 22, у сіль сполуки І. 24. Спосіб за п. 23, який відрізняється тим, що вільну основу сполуки І одержують чистою і осадженою у кристалічній формі, і, потім, переводять у сіль сполуки І. 25. Спосіб за п. 23, де осаджену у кристалічній формі основу сполуки І перекристалізовують один або більше разів до переведення у сіль сполуки І. 26. Спосіб за п. 24 або 25, де вказана основа сполуки І вільна від вихідної солі або вихідної суміші сполуки І. 27. Спосіб за п. 22, де вказана кристалічна основа сполуки І одержана згідно зі способом за п. 18. 28. Спосіб за будь-яким з пп. 23-26, де вказана кристалічна основа сполуки І одержана згідно зі способом за п. 18. 29. Спосіб одержання фармацевтичної композиції, яка містить сполуку І або її сіль, де сполуку І або її сіль одержують згідно зі способом за п. 22 або п. 27. 30. Спосіб одержання фармацевтичної композиції, яка містить сполуку І або її сіль, де сполуку І або її сіль одержують згідно з способом за будь-яким з пп. 22-26 або 28. 31. Вільна основа сполуки формули (І) [сполука І, транс-1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазин], визначеної у п. 1, яка є основою в твердій формі. 32. Вільна основа за п. 31, де вказана тверда речовина містить кристалічну основу сполуки І. Даний винахід належить до кристалічної основи транс-1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазину, одержання вказаної основи, її використання при одержанні солі транс-1-((1R,3S)3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину, одержання такої солі і медичного застосування вказаної основи або солі, особливо для лікування шизофренії або інших захворювань, які включають психотичні симптоми. Сполука, яка є об'єктом даного винаходу (сполука І, транс-1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)3,3-диметилпіперазин), має загальну формулу (І) відносно слабим інгібітором CYP2D6 (тобто знижена здатність взаємодії з іншими ліками) і має відносно низький ефект на QT-інтервал в моделі на кроликах (тобто знижена можливість вияву зумовленого дією лікарського засобу збільшення QTінтервалу і симптому смертельної аритмії серця, двоспрямованої веретеноподібної шлуночкової тахікардії (TdP) у людей). Крім цього, 5-НТ2антагоністична активність сполуки І дозволяє передбачити, що сполука І може мати відносно невеликий ризик екстрапірамідальних побічних ефектів. Вищезгадані властивості, наприклад, дані зв'язування (включаючи альфа1, DA D1 або D2 рецептори), дані ефективності (включаючи DA D1 або D2 або серотонін 5-НТ2А рецептори), інгібування CYP2D6 і QT-інтервал можуть бути одержані, як описано в PCT/DK04/000546, особливо в розділі «Приклад», сторінки 19-24 тексту заявки, як представлено в PCT/DK04/000546. Більше того, автори виявили, що сполука І не індукує дистонію при дослідженні на свинях, чутливих до галоперидолу, це показує, що сполука І не має EPS (екстрапірамідальних симптомів) сприйнятливості/лабільності у людей. PCT/DK04/000546 описує наступні медичні застосування сполуки І: захворювання центральної нервової системи, включаючи психоз, особливо шизофренію (наприклад позитивні, негативні і/або депресивні симптоми) або інші захворювання, що включають психотичні симптоми, наприклад такі, як шизофренія, шизофреноформний розлад, шизоафективний розлад, галюцинації, короткий психотичний, колективний психотичний розлад, так і інші психотичні розлади або захворювання, в яких (I) Сполука І і її солі, включаючи сіль фумарової кислоти і сіль малеїнової кислоти, описані в РСТЛЖ04/00546 (WO05/016901). Як описано в PCT/DK04/00546, автори виявили, що сполука І показує високу спорідненість з D1 рецепторами дофаміну (DA), DA D2 рецепторами і з альфа 1 адренорецепторами. Більше того, було виявлено, що сполука І є антагоністом D1 і D2 рецепторів дофаміну і 5-НТ2А рецепторів серотоніну. Як також описано в PCT/DK04/00546, сполука І є 5 присутні психотичні симптоми, наприклад, манія при біполярному розладі. Також описане використання сполуки І для лікування тривожних розладів, афективних розладів, включаючи депресію, порушення сну, мігрень, нейролептикзумовлений паркінсонізм або вживання кокаїну, вживання нікотину, алкоголізм і інші розлади, викликані зловживанням. Як показано в PCT/DK04/000546, група сполук структурно родинних сполуці І, тобто трансізомери 3-арил-1-(1-піперазиніл)інданів, заміщених у 2- і/або 3-положенні піперазинового кільця, були описані в ЕР 638 073; Bøgesø et al. in J. Med. Chem., 1995, 38, 4380-4392 and Klaus P. "Bøgesø in Drug Hunting, the Medicinal Chemistry of 1Piperazino-3-phenylindans and Related Compounds", 1998, ISBN 87-88085-10-41. Наприклад, енантіомерно чиста сполука, яка відповідає формулі (І), але яка відрізняється тим, що вона має Nметильну групу замість N-водню в піперазині, була розкрита в Bogeso et al. в J. Med. Chem., 1995, 38, 4380-4392, дивись таблицю 5, сполука (-)-38. Ні в одному з вищенаведених джерел, крім PCT/DK04/000546, не розкритий специфічний енантіомерний вид вищезгаданої сполуки І або її медичне застосування. Лише тільки транс-ізомер у вигляді рацемату сполуки І непрямо розкритий як інтермедіат в синтезі сполуки 38 в Bøgesø et al. в J. Med. Chem., 1995, 38, 4380-4392, тоді як медичне застосування сполуки І або відповідного ній рацемату не описане. Сполука І, як інтермедіат, розкрита в PCT/DK04/00545 (WO05/016900). Фіг. 1: показує порошкову рентгенівську дифрактограму вільної основи кристалічної сполуки І (одержану з використанням СuKα1 опромінення). Фіг. 2: показує ДСК термограму вільної основи кристалічної сполуки І. Додаткові докладні дані розкриті далі в прикладах. За способами, розкритими в PCT/DK04/000546, сполука І була одержана у вигляді масла. Було виявлено, що вільна основа сполуки І може бути одержана у вигляді кристалічного продукту, що є переважною формою сполуки І, як для способу виробництва (наприклад, загалом поліпшується спосіб роботи і обробки), так і для приготування лікарського засобу (наприклад, для приготування лікарського засобу необхідні однорідні фізичні і хімічні властивості твердих речовин). Більше того, було виявлено, що ефективне очищення сполуки І може бути здійснене під час способу виробництва сполуки І за допомогою кристалізації основи і, потім, можливо, за допомогою утворення солі основи. У процесі синтезу, як домішка в кінцевому продукті може утворюватися який-небудь цис-діастереоізомер сполуки І (а саме, 1-((1S,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазин). Автори виявили, що кінцевий вміст цис-ізомеру може бути значно зменшений за допомогою осадження кристалічної основи сполуки І. Більше того, очищення відносно інших домішок, наприклад детектованих за допомогою ВЕРХ, значно поліпшується кристалізацією вільної осно 95901 6 ви (Приклад 9, де домішки, які не є цис-ізомером, знижені від 10% до 1%.) Навпаки, винахідники виявили, що важко одержати сполуку І в твердому стані у вигляді солі, придатної для лікарського засобу, наприклад, було важко одержати сіль сполуки І, яка має чітко визначене стехіометричне відношення між кислотою і сполукою І, навіть при перекристалізації, і/або яка б не мала органічних розчинників або води в кристалі. Таким чином, винахід належить до кристалічної основи сполуки І (формула І далі) (I) У подальших варіантах здійснення винаходу, кристалічна основа сполуки І характеризується одним або більше з: (і) порошковою рентгенівською дифрактограмою, відповідно до Фіг. 1, одержаною з використанням СuKα1 опромінення; (іі) порошковою рентгенівською дифрактограмою, одержаною з використанням СuKα1 опромінення (=1,5406 Å), що виявляє сигнали при наступних 2-кутах: 6,1, 11,1, 12,1, 16,2, 16,8, 18,3, 18,6, 20,0; (ііі) ДСК термограмою, відповідно до Фіг. 2; (iv) ДСК кривою, яка виявляє ендотерму з наростанням близько 91-93°С; (ν) значною мірою безводна і/або вільна від розчинника; (vi) вона має чистоту не менше 90%, не менше 95% або не менше 98%, що виміряно за допомогою ВЕРХ (площа). Описуючи інакше, винахід належить до вільної основи сполуки формули (І) [сполука І, транс-1((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазин] в твердій формі, переважно в твердій формі, яка містить кристалічну вільну основу сполуки І, наприклад, в твердій формі, яка є кристалічною не менше ніж на 80%, кристалічною не менше ніж на 90%, кристалічною не менш ніж на 95% або кристалічною не менше ніж на 98%. Подальші варіанти здійснення винаходу, описані далі для «кристалічної основи сполуки І», тобто способи виробництва, фармацевтичні композиції, медичні застосування, такі як застосування вільної основи винаходу в медицині і способи лікування, які також передбачають для застосування тверду основу винаходу, як подальші варіанти здійснення винаходу. Використовуваний в даному описі термін «тверда форма» відносно сполуки І, належить до будь-якої твердої форми сполуки І, представленої як в кристалічній формі або в аморфній твердій 7 95901 формі, так і у вигляді їх суміші, на відміну, наприклад, від сполуки І у формі масла. Використовуваний в даному описі такий вираз, як «характеризується порошковою рентгенівською дифрактограмою, показаною на Фіг. 1, одержаною з використанням СuKα1 опромінення», означає кристалічну форму сполуки І, яка має порошкову рентгенівську дифрактограму, в основному аналогічну Фіг. 1, тобто таку, що дає набір ліній порошкової рентгенівської дифракції, приклад якої приведений на даній фігурі, і яка одержана при аналогічних умовах, як було тут указанно, або будь-яким іншим способом з використанням СuKα1 опромінення, так щоб були прийняті до уваги границі аналітичних варіантів. Те, що кристалічна основа є значною мірою безводною або вільною від розчинника можна оцінити, наприклад, з аналізу ТГА, наприклад, як описано в Прикладах даного опису. У одному варіанті здійснення винаходу, кристалічна основа винаходу не є сольватом, тобто кристалічна основа винаходу не містить внутрішнокристалічно зв'язаних молекул розчинника. Сполука формули (І) у вигляді рацемату, наприклад, може бути одержана аналогічно способу, викладеному в ЕР 638 073 і в Begese et al. J. Med. Chem., 1995, 38, сторінка 4380-4392, з подальшим оптичним розщепленням рацемічної сполуки за допомогою кристалізації діастереоізомерних солей, таким чином, одержуючи енантіомер формули (І), тобто сполуку І. З іншого боку, сполука І може бути одержана за способом, описаним в міжнародній заявці на патент PCT/DK04/00546, тобто виходячи з чистого енантіомера V, тобто сполуки Va (18,38)-3-феніл-6-хлороіндан-1-ол, дивись далі). Сполука V має наступну формулу (V) з цис-конфігурацією: (V) Сполука Va має наступну формулу (Va), тобто також з цис-конфігурацією: (Va) Як відмічено вище, в процесі синтезу утворюються деякі цис-діастереоізомери сполуки І як домішка. Цис-форма сполуки І може бути альтернативно або додатково видалена, наприклад, осадженням придатної солі сполуки формули сполуки І, наприклад, НСI або солі органічної кислоти, такої як органічної дикислоти, наприклад, фумарової солі або малеїнової солі сполуки формули (І), можливо після однієї або декількох перекристалізацій. 8 Загалом, кристалічна основа сполуки І може бути одержана кристалізацією основи сполуки І з розчинника, тобто з одного придатного розчинника або придатної суміші розчинників. Таким чином, термін «розчинник», використаний в даному описі, включає як один розчинник, так і суміш різних розчинників. Очевидно, що даний розчинник, в залежності від обставин, може містити воду, наприклад, приблизно 0-10% води. Сполука І може бути одержана з використанням відомих способів в даній галузі, наприклад таких, які описані тут. За допомогою основного керуючого пристрою, сполука І може бути змішана з придатним розчинником, який може бути нагрітий для забезпечення розчинення сполуки І. При цьому, переважні температури можуть знаходитися в діапазоні приблизно від 30°С до точки кипіння (тобто температури флегми) розчинника або суміші розчинників. Більш переважні температури можуть знаходитися в діапазоні приблизно від 60°С до точки кипіння розчинника. Одержана суміш розчинника і сполуки І може бути охолоджена до початку і/або продовження кристалізації. Суміш переважно охолоджується (а саме включаючи природне охолоджування до температури навколишнього середовища) до температури, яка знаходиться в межах, наприклад, від приблизно мінус 20°С до приблизно 20°С, наприклад, до температури навколишнього середовища. Тверді частинки, що випали в осад, можуть бути виділені з охолодженої суміші, наприклад, фільтрацією або центрифугуванням і, якщо необхідно, промиті придатним розчинником, таким як, але не обмежуючись ним, розчинником, що застосовується для кристалізації, і висушені при атмосферному тиску або у вакуумі при температурі навколишнього середовища або злегка підвищеній температурі, наприклад, в потоці азоту. Для ініціювання кристалізації до будь-якої суміші, що кристалізується, можуть бути додані кристали затравки. Таким чином, винахід в наступному аспекті належить до способу одержання кристалічної основи сполуки І, в якому кристалічна основа сполуки І утворюється в розчиннику, наприклад, в етилацетаті або гептані, або їх суміші. У одному варіанті здійснення винаходу, кристалічну основу сполуки І одержують кристалізацією основи сполуки І з розчинника, наприклад, етилацетату або гептану, або суміші даних розчинників, і відділяючи розчинник від одержаних кристалів основи сполуки І. Винахід також належить до способу виробництва сполуки І, який відрізняється тим, що основа сполуки І одержується чистою і осадженою, даючи вільну основу сполуки І в кристалічній формі, можливо перекристалізовану один або більше разів і, потім, переведену в сіль сполуки І. В одному варіанті здійснення винаходу, основа сполуки І одержується вільною від вихідної солі або вихідної суміші сполуки І. Термін вихідна суміш, в даному контексті, означає, що суміш містить домішки, наприклад, діастереомер сполуки І і сполуки V(a) і реагенти, що не прореагували, які необхідно видалити. Вихідна суміш може бути виділена безпосередньо з реакційної суміші, або вихідна реакцій 9 95901 на суміш може бути піддана деякому початковому очищенню. Таким чином, винахід також належить до солей сполуки І, одержаних в процесі, який включає стадії: (і) кристалізація основи сполуки І, і (іі) утворення солі з основи, яка також називається «сіль винаходу». Винахід також належить до способу виробництва наступної сполуки формули II [транс-4((1R,3S)-3-феніл-6-хлороіндан-1-іл)-1,2,2,триметилпіперазин; сполуки II] або її солі (II) який включає стадію метилування вторинного аміну сполуки І, даючи вільну основу сполуки II і, альтернативно, осадження вказаної сполуки у вигляді солі, де сполука І одержана згідно зі способом винаходу, як описано тут, тобто, зокрема, включаючи стадію, в якій сполука І переводиться в кристалічну вільну основу сполуки І. Синтез сполуки II із сполуки І описаний в WO05/016900. Сіль сполуки II, наприклад, може бути янтарною або малоновою сіллю, наприклад гідроянтарною сіллю або гідромалоновою сіллю, як описано в WO05/016900. У подальших варіантах здійснення винаходу, сполука II або її сіль можуть далі увійти до складу фармацевтичної композиції. Таким чином, в подальших аспектах, винахід забезпечує наступні варіанти здійснення: кристалічна основа сполуки І, що одержується, особливо одержується способом, як описано тут; сіль сполуки І, що одержується, особливо одержується способом, як описано тут, наприклад фумарова або малеїнова сіль або гідрохлорид сполуки І; фармацевтична композиція, що включає таку основу сполуки І або сіль сполуки І, що одержується або одержану за способом винаходу; і медичні застосування, як описано тут, для даних продуктів сполуки І. Властивості сполуки І показують, що вона буде придатна як фармацевтичний препарат. Таким чином, даний винахід далі належить до фармацевтичної композиції кристалічної основи сполуки І або солі винаходу спільно, наприклад з принаймні одним фармацевтично прийнятним носієм, наповнювачем або розріджувачем. Винахід також належить до медичного застосування такої кристалічної основи або солі винаходу і композицій, наприклад, для лікування захворювання центральної нервової системи, включаючи психоз, особливо шизофренію або інші захворювання, які включають психотичні симптоми, наприклад, як шизофренія, шизофреноформний розлад, шизоафективний розлад, галюцинації, короткий психотичний розлад, колективний психотичний розлад, так і інші психотичні розлади або 10 захворювання, в яких присутні психотичні симптоми, наприклад, манія при біполярному розладі. Даний винахід також належить до застосування кристалічної основи сполуки І або солі винаходу для лікування захворювань вибраних з групи, яка складається з тривожних розладів, афективних розладів, включаючи депресію, порушення сну, мігрені, нейролептикзумовленого паркінсонізму або вживання кокаїну, вживання нікотину, алкоголізм і інші розлади, викликані зловживанням. У переважному варіанті здійснення, даний винахід належить до способу лікування шизофреноформного розладу, шизоафективного розладу, галюцинацій, короткого психотичного розладу, колективного психотичного розладу або манії при біполярному розладі, включаючи застосування терапевтично ефективних кількостей кристалічної основи сполуки І або солі винаходу. Подальший варіант здійснення винаходу належить до способу лікування позитивних симптомів шизофренії, включаючи застосування терапевтично ефективних кількостей кристалічної основи сполуки І або солі винаходу. Інший варіант здійснення винаходу належить до способу лікування негативних симптомівшизофренії, включаючи застосування терапевтично ефективних кількостей кристалічної основи сполуки І або солі винаходу. Подальший варіант здійснення винаходу належить до способу лікування депресивних симптомів шизофренії, включаючи застосування терапевтично ефективних кількостей кристалічної основи сполуки І або солі винаходу. Подальший аспект винаходу належить до способу лікування манії і/або підтримки при біполярному розладі, включаючи застосування терапевтично ефективних кількостей кристалічної основи сполуки І або солі винаходу. У даному контексті, особливо для фармацевтичних застосувань, очевидно, що якщо вказана енантіомерна форма така, як в формулі (І) для сполуки І, то сполука відносно стехіометрично чиста, переважно енантіомерний надлишок складає не менше 60%, не менше 70% і більш переважно не менше 80% (80% енантіомерний надлишок означає, що відношення сполуки І до її енантіомера становить 90:10 в суміші, що розглядається), не менше 90%, не менше 96% або переважно не менше 98%. У переважному варіанті здійснення винаходу, діастереомерний надлишок сполуки І складає не менше 90% (90% діастереомерний надлишок означає, що відношення сполуки І до цис-1((1S,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазину становить 95:5), не менше 95%, не менше 97% або не менше 98%. Подальший аспект винаходу належить до способу лікування як описано тут, де пацієнт, що піддається лікуванню кристалічною основою сполуки І або сіллю винаходу, також піддається лікуванню принаймні одним іншим медикаментом. У зв'язку з цим, важливим окремим варіантом здійснення винаходу є лікування з іншими медикаменти, які є метаболітами CYP2D6 або, які принаймні мають подібну активність. У придатному варіанті здійснення винаходу, інші медикаменти є протипсихотичними. Таким чином, один з варіантів здійснення 11 винаходу належить до використання кристалічної основи або солі винаходу, або фармацевтичної композиції винаходу для лікування пацієнта, що страждає від шизофренії або інших психозів, який також піддається лікуванню іншим медикаментом(ами), наприклад, де цей інший медикамент є протипсихотичним. У іншому варіанті здійснення, винахід належить до використання кристалічної основи І, солі винаходу або фармацевтичної композиції винаходу для лікування пацієнта, що страждає від шизофренії або іншого психозу, який знаходиться в залежності, наприклад, від алкоголю або наркотиків. Кристалічна основа винаходу або сіль винаходу, або фармацевтична композиція винаходу може бути введена будь-яким придатним шляхом, наприклад, орально, букально, сублінгвально або парентерально, і сполука може бути присутньою в будь-якій придатній формі для такого введення, наприклад, орально у формі таблеток, капсул, порошків, сиропів, розчинів або суспензії, або парентерально, у формі суспензій або розчинів для ін'єкцій. У одному варіанті здійснення винаходу, кристалічна основа винаходу вводиться в формі твердої дозованої форми, переважно у вигляді таблетки або капсули. Способи одержання твердих фармацевтичних препаратів добре відомі в даній галузі. Таким чином, таблетки можуть бути одержані за допомогою змішування активного інгредієнта зі стандартними допоміжними речовинами, наповнювачами і розріджувачами і з подальшим пресуванням суміші у відповідній таблетувальній машині. Приклади допоміжних речовин, наповнювачів і розріджувачів включають мікрокристалічну целюлозу, кукурудзяний крохмаль, картопляний крохмаль, лактозу, манітол, сорбітовий тальк, стеарат магнію, желатин, лактозу, смоли і т. п. Також, можуть бути використані будь-які інші допоміжні речовини або добавки, такі як барвники, ароматизатори, консерванти і т. п., при умові, що вони сумісні з активними інгредієнтами. Зокрема, згідно з винаходом, таблетовані препарати можуть бути приготовані безпосереднім пресуванням сполуки І з добавкою придатних допоміжних речовин або розріджувачів. Альтернативно, для пресування таблеток можуть бути використані сирі гранули або розплавлені гранули сполуки І, можливо з добавкою придатних допоміжних речовин або розріджувачів. Розчини для ін'єкцій можуть бути одержані розчиненням активного інгредієнта і можливих добавок в частині розчинника для ін'єкцій, переважно в стерильній воді, доведенням розчину до необхідного об'єму, стерилізацією розчину і наповненням відповідних ампул або флаконів. Можуть бути додані які-небудь придатні добавки, що звичайно використовуються в галузі техніки, такі як тонізуючі агенти, консерванти, антиоксиданти, солюбілізуючі агенти і т. д. Альтернативно, кристалічна вільна основа може бути розчинена у засвоюваному або незасвоюваному маслі, їх суміші або в чомусь подібному, для створення внутрішньомолекулярного 95901 12 депо, препарату здатного вивільняти активний інгредієнт протягом тривалого періоду часу. Добова доза вищенаведеної сполуки формули (І), розрахована для вільної основи, знаходиться між 1,0 і 160 мг/день, більш застосовно між 1 і 100 мг, наприклад, переважно між 2 і 55 мг. Як указанно вище, винахід, зокрема, належить до: - кристалічної основі сполуки І; - солі винаходу, тобто солі сполуки І, одержаної з кристалічної основи сполуки І; - фармацевтичної композиції, як описано тут, включаючи кристалічну основу сполуки І або сіль винаходу; - медичного застосування, як описано тут для сполуки І; де сполука І має енантіомерний надлишок не менше 60% (60% енантіомерний надлишок означає, що відношення сполуки І до її енантіомера є 80:20 в суміші, що розглядається), не менше 70%, не менше 80%, не менше 85%, не менше 90%, не менше 96%, переважно не менше 98%. Один з варіантів винаходу належить до кристалічної основи сполуки І або солі винаходу, або фармацевтичній композиції винаходу і застосування, як описано тут, де сполука І має діастереомерний надлишок не менше 10% (10% діастереомерний надлишок означає, що відношення сполуки І до її цис-(18,38)діастереоізомеру є 55:45 в суміші, що розглядається), не менше 25%, не менше 50%, не менше 70%, не менше 80%, не менше 90%, не менше 95%, не менше 97%, переважно не менше 98%. Використаний в даному описі термін «лікування» застосовний до захворювання, також, в залежності від обставин, включає профілактику. Використаний в даному описі термін «захворювання», також, в залежності від обставин, включає розлад. Винахід буде пояснений в наступних не обмежуючих прикладах. Приклади Аналітичні методи Енантіомерний надлишок сполуки (Vа) в Прикладі 1 визначають за допомогою хіральної ВЕРХ, з ® використанням колонки CHIRALCEL OD, 0,46 см внутрішній діаметр X 25 см довжина, 10 μм при 40°С. Як рухому фазу використовують нгексан/етанол 95:5 (об'єм/об'єм) при швидкості потоку 1,0 мл/хв., проводячи детектування з використанням УФ-детектора при 220 нм. Енантіомерний надлишок сполуки (І) може бути визначений з використанням гельсилікагельного капілярного електрофорезу (КЕ), застосовуючи наступні умови: Капіляр: 50 цм внутрішній діаметр X 48,5 см довжина, буфер: 1,25мМ β-циклодекстрин в 25 мМ натрійдигідрофосфату, рН 1,5, напруга: 16кВ, температура: 22°С, введення 40 мбар протягом 4 секунд, детектування: колонкова діодна матриця з детектуванням 195 нм, концентрація зразка: 500 μг/мл. У даній системі сполука І має час утримання приблизно 10 хвилин і інший енантіомер має час утримання приблизно 11 хвилин. 1 Н ЯМР спектри одержують на приладі Bruker Avance DRX500 при 500,13 МГц або на приладі 13 Bruker AC 250 при 250,13 МГц. Як розчинники використовують хлороформ (99,8%D) або диметилсульфоксид (99,8%D), і, як внутрішній стандарт, використовують тетраметилсилан (ТМС). Чистоту сполуки І визначають за допомогою ВЕРХ (наприклад, також відношення цис/транс), використовуючи колонку LunaC18(2) 150*4,6 мм (3 μм) при 40°С. Рухомою фазою є фосфатний буфер рН 7,4/ацетонітрил 40/60, робочий час 60 хвилин і після 32 хвилин застосовують градієнт ацетонітрил/вода 90/10. Детектування проводять з використанням УФ-детектора при 220 нм. Цис/транс відношення сполуки І і ключових інтермедіатів можна також визначити, використову1 ючи Н ЯМР, як описано, наприклад, в Bøgesø et al., J. Med. Chem. 1995, 38, 4380-4392 (сторінка 4388, права колонка). Звичайно, вміст близько 1% небажаного ізомеру можливо визначити за ЯМР. Точку плавлення вимірюють, використовуючи диференціальну скануючу калометрію (ДСК). Обладнанням є ТА-Instruments DSC-Q1000, відкалібрований на 57хвилину, даючи точку плавлення при наростанні. Близько 2 мг зразка нагрівають 5°/хвилину в нещільно закритій кюветі при потоці азоту. Термогравіметричний аналіз (ТГА), що використовується для встановлення вмісту розчинник/вода в сухій речовині, проводять з використанням TA-instruments TGA-Q500. 1-10 мг зразка нагрівають 107хвилину у відкритій кюветі при потоці азоту. Порошкові рентгенівські дифрактограми одержують на PANalytical X'Pert PRO X-Ray дифрактометрі, з використанням СuKα1 опромінення. Зразки досліджують в режимі відображення в 20-діапазоні 5-40°, використовуючи детектор X'celerator. Оптичне обертання досліджують на поляриметрі Perkin Elmer, модель 241. Синтез Приклад 1 Синтез (1S,3S)-3-феніл-6-хлороіндан-1-олу (Va) з використанням хіральної хроматографії Рацемічний цис-3-феніл-6-хлороіндан-1-ол (V) (одержаний, як описано в PCT/DK04/00546, тобто за адаптованим способом, описаним в Bøgesø et al. J. Med. Chem. 1995, 37, 4380-4392, використовуючи етанол як розчинник, і проводячи реакцію при температурі близько 0°С) (492 грами) розділяють із застосуванням препаративної хроматографії, використовуючи колонку CHIRALPAK AD, 10 см внутрішній діаметр X 50 см довжина, 10 μм при 40°С. Як рухому фазу використовують метанол при швидкості потоку 190 мл/хв., детектування проводять за допомогою УФ-детектора при 287 нм. Рацемічний спирт (V) вводять у вигляді 50000 м. ч. розчину в метанолі; вводять 90 мл з інтервалами 28 хв. Всі фракції, які містять вказану сполуку з більше ніж 98% енантіомерного надлишку, об'єднують і упарюють досуха на роторному випарнику, потім сушать у вакуумі при 40°С. Вихід 220 грамів твердої речовини. Елементний аналіз і ЯМР підтверджують структуру, енантіомерний надлишок перевищує 98%, згідно з хіральною ВЕРХ, 20 [α]D +44,5° (с=1,0, метанол). 95901 14 Приклад 2 Синтез (1S, 3S)-1-феніл-3,5-дихлороіндану Цис-(1S,3S)-3-феніл-6-хлороіндан-1-ол (Va) (204 грами) одержаний, як описано в Прикладі 1, розчиняють в ТГФ (1500 мл) і охолоджують до 5°С. Протягом години по краплях додають тіонілхлорид (119 грамів) у вигляді розчину в ТГФ (500 мл). Суміш перемішують при кімнатній температурі протягом ночі. До реакційної суміші додають лід (100 г). Після розчинення льоду водну фазу А і органічну фазу В відділяють, і органічну фазу В двічі промивають насиченим водним розчином бікарбонату натрію (200 мл). Водні бікарбонатні фази об'єднують з водною фазою А, доводять до рН 9 гідроксидом натрію (28%) і знову використовують для промивання органічної фази В. Одержану водну фазу С і органічну фазу В розділяють, і водну фазу С екстрагують етилацетатом. Фазу етилацетату об'єднують з органічною фазою В, сушать сульфатом магнію і упарюють досуха на роторному випарнику, одержуючи вказану сполуку у вигляді масла. Вихід 240 грамів, які безпосередньо використовують в прикладі 5а. Відношення цис/транс 77:23 згідно з даними ЯМР. Приклад 3 Синтез 3,3-диметилпіперазин-2-ону Карбонат калію (390 грамів) і етилендіамін (1001 грам) перемішують з толуолом (1,50 л). Додають розчин етил-2-бромоізобутирату (500 грамів) в толуолі (750 мл). Суспензію нагрівають до кип'ятіння протягом ночі і відфільтровують. Осад на фільтрі промивають толуолом (500 мл). Об'єднані фільтрати (об'ємом 4,0 л) нагрівають на водяній бані і переганяють при 0,3 атм., використовуючи апарат Кляйзіна; перші 1200 мл збирають при 35°С (температура в суміші 75°С). Додають ще толуол (600 мл) і наступні 1200 мл дистиляту збирають при 76°С (температура в суміші 80°С). Знов додають толуол (750 мл) і збирають 1100 мл дистиляту при 66°С (температура в суміші 71°С). Суміш перемішують на льодяній бані і ініціюють кристалізацію, таким чином, осаджуючи продукт. Продукт відділяють фільтрацією, промивають толуолом і сушать протягом ночі під вакуумом при 50°С. Вихід 3,3-диметилпіперазин-2-ону 171г (52%). ЯМР відповідає структурі. Приклад 4 Синтез 2,2-диметилпіперазину Суміш 3,3-диметилпіперазин-2-ону (8,28 кг, 64,6 моль, одержання великої кількості аналогічне одержанню, описаному в Прикладі 3) і тетрагідрофурану (ТГФ) (60 кг) нагрівають до 50-60°С, одержуючи трохи каламутний розчин. ТГФ (50 кг) перемішують в потоці азоту і додають LiAlH4 (250 г, в розчинній пластиковій тарі), що приводить до повільного виділення газу. Після припинення виділення газу додають ще LiAlH4 (в загальній складності використовують 3,0 кг, 79,1 моль) і температура підвищується з 22°С до 50°С, оскільки процес екзотермічний. Повільно, протягом 2 годин, при 4159°С додають розчин 3,3-диметилпіперазин-2-ону. Суспензію перемішують протягом наступної години при 59°С (температура оболонки 60°С). Суміш охолоджують, і протягом двох годин додають воду (3 л), підтримуючи температуру нижче 25°С (необ 15 хідне охолоджування з температурою оболонки 0°С). Потім, протягом 20 хвилин, при 23°С, охолоджування необхідне, додають водний гідроксид натрію (15%, 3,50 кг). Протягом півгодини додають ще воду (9 л) (охолоджування необхідне), і суміш перемішують протягом ночі в потоці азоту. Додають фільтруючий агент Целіт (4 кг), і суміш відфільтровують. Осад на фільтрі промивають ТГФ (40 кг). Об'єднані фільтрати концентрують в реакторі доти, поки температура в реакторі не стане 70°С (температура дистиляту 66°С) при 800 мбар. Далі залишок (12,8 кг) концентрують на роторному випарнику приблизно до 10 л. Нарешті, суміш переганяється по фракціях при атмосферному тиску, і продукт збирають при 163-164°С. Вихід 5,3 кг (72%). ЯМР відповідає структурі. Приклад 5а Синтез гідромалеїнової солі транс-1-((1R,3S)3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину (сполука І) Цис-(1S,3S)-1-феніл-3,5-дихлороіндан (240 г) розчиняють в бутан-2-оні (1800 мл). Додають карбонат калію (272 г) і 2,2-диметилпіперазин (одержаний, як описано в Прикладі 4) (113 г), і суміш нагрівають до температури кипіння протягом 40 год. До реакційної суміші додають діетиловий ефір (2 л) і соляну кислоту (1 М, 6 л). Фази відділяють, і рН водної фази знижують з 8 до 1 концентрованою хлороводневою кислотою. Водну фазу використовують для відмивання органічної фази ще раз для того, щоб бути упевненим в тому, що весь продукт знаходиться у водній фазі. До водної фази додають гідроксид натрію (28%) доти, поки рН не стане 10, і водну фазу двічі екстрагують діетиловим ефіром. Екстракти діетилового ефіру збирають, сушать сульфатом натрію і упарюють досуха на роторному випарнику. Вихід 251 грам вільної основи сполуки І у вигляді масла. Відношення цис/транс згідно з ЯМР даними становить 18:82. Неочищене масло (приблизно 20 грамів) далі очищають за допомогою флеш-хроматографії на силікагелі (елюент: етилацетат/етанол/триетиламін 90:5:5), потім упарюють досуха на роторному випарнику. Вихід 12 грамів вільної основи сполуки І у вигляді масла (відношення цис/транс згідно з ЯМР даними становить 10:90). Масло розчиняють в етанолі (100 мл), і до цього розчину додають розчин малеїнової кислоти в етанолі до рН 3. Одержану суміш перемішують при кімнатній температурі протягом 16 годин, і осад, що утворився, збирають фільтрацією. Об'єм етанолу зменшують і збирають нову порцію осаду. Вихід 3,5 г твердої речовини, тобто гідромалеїнової солі сполуки І (цис-ізомер не визначається за ЯМР) вказаної сполуки. Енантіомерний надлишок за СЕ>99%. Точка плавлення 175-178°С. ЯМР відповідає структурі. Приклад 5b Синтез солі гідрохлориду транс-1-((1R,3S)-3феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину (Сполука І) Цис-(1S,3S)-1-феніл-3,5-дихлороіндан (одержання великої кількості аналогічне одержанню, описаному в Прикладі 2) (50,9 кг) розчиняють в ізобутилметилкетоні (248 кг). Додають карбонат 95901 16 калію (56,8 кг) і 2,2-диметилпіперазин (29,6 кг), і суміш нагрівають до температури 100°С протягом 8 годин. Реакційну суміш охолоджують до кімнатної температури, після чого фільтрацією видаляють нерозчинні неорганічні речовини. Потім фільтрат промивають водою (520 л), розділяють фази і рН органічної фази доводять до значення між 3-6, повільно додаючи хлороводень (15,4 кг 37% водного розчину), під час додавання продукт відділяється. Продукт відфільтровують на нутч-фільтрі, і залишок на фільтрі промивають ізобутилметилкетоном (100 кг) і циклогексаном (80 кг). Продукт сушать при 50°С і 0,05 бар протягом 12 годин. Вихід: 40 кг сполуки І (цис-ізомер не визначається за ЯМР). Енантіомерний надлишок за СЕ>99%. ЯМР відповідає структурі. Приклад 6а Синтез вільної основи сполуки І, виходячи з гідромалеїнової солі Суміш гідромалеату транс-1-((1R,3S)-3-феніл6-хлороіндан-1-іл)-3,3-диметилпіперазину (9,9 грама), концентрованого водного аміаку (100 мл), соляного розчину (150 мл) і етилацетату (250 мл) перемішують при кімнатній температурі протягом 30 хвилин. Фази розділяють, і водну фазу екстрагують ще раз етилацетатом. Об'єднані органічні фази промивають соляним розчином, сушать над сульфатом магнію, фільтрують і упарюють досуха у вакуумі. Вихід 7,5 грама сполуки І у вигляді масла, яке може затвердіти при стоянні. ЯМР відповідає структурі. Приклад 6b Синтез вільної основи сполуки І, виходячи з солі гідрохлориду Вільну основу сполуки І одержують, як описано в прикладі 6а, використовуючи гідрохлорид транс-1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазину замість гідромалеату транс-1((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазину. Вихід сполуки І становив 9,0 грамів виходячи з 10,2 грамів гідрохлориду транс1-((1R,3S)-3-феніл-6-хлороіндан-1-іл)-3,3диметилпіперазину. Приклад 7а Одержання кристалічної основи сполуки І з 6а сполуку І (9,0 грамів, одержаних, як описано в Прикладі 6а) розчиняють в етилацетаті (30 мл), і, потім, до розчину додають гептан (75 мл). Розчин залишають при перемішуванні на 4-16 годин. У деяких випадках спостерігається кристалізація, і кристалічну речовину збирають фільтрацією. У інших випадках, коли кристалізація не спостерігається, частина розчинника видаляється дистиляцією. Дистиляція припиняється, коли температура дистиляції міняється з точки кипіння етилацетату на точку кипіння гептану. Розчин, що залишився, залишають охолоджуватися до кімнатної температури при температурі навколишнього середовища і перед фільтрацією на водяній/льодяній бані. Кристалізація може бути ініційована тертям скляним шпателем або з використанням затравки. Кристалічну сполуку І виділяють фільтрацією. Вихід 6,8 грам (74%). ЯМР відповідає структурі. Точка плавлення: 92,4 (ДСК температура наростання), енантіомерний надлишок за СЕ>99%. 17 Приклад 7b Одержання кристалічної основи сполуки І з 6b Одержують, як описано в прикладі 7а, виходячи з 9,0 грамів вихідної основи. Вихід 6,8 грама. Точка плавлення 92,3°С (ДСК температура наростання) і енантіомерний надлишок за СЕ>99%.) Приклад 8 Характеристика кристалічної основи сполуки І Кристалічна основа сполуки І, одержана за способом, як описано в прикладі 7а і 7b має порошкову рентгенівську дифрактограму (ПРД), яка наведена на Фіг. 1 і характеризується наступними відображеннями (піками) в порошковій рентгенівській дифрактограмі, одержаній з використанням СuKα1 опромінення при наступних 2-тета кутах: 6,1, 11,1, 12,1, 16,2, 16,8, 18,3, 18,6, 20,0. Кристалічна основа також має ДСК термограму, відповідно до Фіг. 2, і ДСК криві, що показують ендотерму з наростанням близько 91-93°С. 95901 18 Одержана кристалічна основа безводна і вільна від розчинника, про що можна судити з аналізу ТГА. Приклад 9 Одержання кристалічної основи сполуки І з вихідної сполуки І Прикладу 5а Сполуку І (2,0 грама вихідного масла, одержаного, як описано в Прикладі 5а, чистота визначена з використанням ВЕРХ: 73% площі, відношення цис/транс становить 17/73) розчиняють в етилацетаті (5 мл), і, потім, до розчину додають гептан (10 мл). Частину розчинника видаляють дистиляцією, і до розчину, що залишився, додають шпатель кристалічної сполуки І (одержаної з 7а або 7b). Одержану суміш залишають при температурі навколишнього середовища на 16 годин. Кристалічну сполуку І виділяють фільтрацією. ЯМР відповідає структурі. Чистота за ВЕРХ (площа %): 98%, вміст цис-ізомеру: 1%. Енантіомерний надлишок за СЕ>99%. 19 Комп’ютерна верстка Т. Чепелева 95901 Підписне 20 Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCrystalline base of trans-1-((1r,3s)-6-chloro-3-phenylindan-1-yl)-3,3-dimethylpiperazine
Автори англійськоюBang-Andersen Benny, Lopez De Diego Heidi
Назва патенту російськоюКристаллическое основание транс-1-((1r,3s)-3-фенил-6-хлороиндан-1-ил)-3,3-диметилпиперазина
Автори російськоюБанг-Андерсен Бенни, Лопес де Диего Хейди
МПК / Мітки
МПК: A61K 31/495, A61P 25/18, C07D 295/073
Мітки: транс-1-((1r,3s)-3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину, основа, кристалічна
Код посилання
<a href="https://ua.patents.su/10-95901-kristalichna-osnova-trans-1-1r3s-3-fenil-6-khloroindan-1-il-33-dimetilpiperazinu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна основа транс-1-((1r,3s)-3-феніл-6-хлороіндан-1-іл)-3,3-диметилпіперазину</a>
Попередній патент: Пристрій для підгонки та вирівнювання плитки
Наступний патент: Спосіб збільшення часу розвитку захворювання або виживаності у ракових пацієнтів
Випадковий патент: Пристрій для динамічної корекції рухів людини












