Кристалічна основа есциталопраму і фармацевтична композиція, яка містить основу есциталопраму
Номер патенту: 86536
Опубліковано: 27.04.2009
Автори: Дансер Роберт, Еліасен Хелле, Нільсен Оле, Петерсен Ханс, Рок Майкл Харольд, Лільєгрен Кен
Формула / Реферат
1. Вільна основа есциталопраму в твердій формі, яка відрізняється тим, що вона містить кристалічний есциталопрам.
2. Вільна основа есциталопраму за п. 1, яка відрізняється тим, що вона є принаймні на 90% кристалічною, конкретно, принаймні на 95% кристалічною, а більш конкретно, принаймні на 98% кристалічною.
3. Вільна основа есциталопраму за п. 1, яка відрізняється тим, що вона є кристалічною.
4. Фармацевтична композиція, яка містить вільну основу есциталопраму згідно з будь-яким з пп. 1-3.
5. Спосіб виготовлення вільної основи есциталопраму або її солі, який відрізняється тим, що гідробромід есциталопраму осаджують в кристалічній формі з розчинника і відділяють від розчинника, необов’язково, перекристалізовують один або декілька разів, а потім перетворюють у вільну основу есциталопраму або її сіль, за умови, що одержувана сіль есциталопраму не є гідробромідом.
6. Спосіб виготовлення вільної основи есциталопраму або її солі за п. 5, який відрізняється тим, що гідробромід есциталопраму осаджують з неочищеного есциталопраму.
7. Спосіб виготовлення вільної основи есциталопраму або її солі за п. 5 або п. 6, який відрізняється тим, що одну або декілька домішок формули (II) або (III)
 , (II)
, (II)
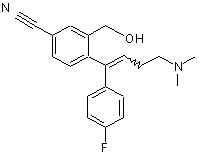 , (III)
, (III)
де Z являє собою галоген, ціано або -CONH2,
R1 і R2 незалежно являють собою водень або метил, за умови, що, коли як R1, так і R2 являють собою метил, тоді Z не може бути ціано,
і зв’язок, зображений як ламана лінія у формулі (III), показує, що конфігурація навколо подвійного зв’язку може бути Е- або Z-;
видаляють з есциталопраму або зменшують їх кількість.
8. Спосіб за п. 7, в якому домішки мають формулу (II), де
Z являє собою бром або хлор, а як R1, так і R2 являють собою метил,
Z являє собою -CONH2, і як R1, так і R2 являють собою метил, або
Z являє собою ціано, R1 являє собою водень і R2 являє собою метил;
або формулу (III), де конфігурація навколо подвійного зв’язку є Z-.
9. Спосіб за будь-яким з пп. 6-8, в якому неочищений есциталопрам піддають початковому очищенню перед тим, як гідробромід есциталопраму осаджують в кристалічній формі.
10. Спосіб за будь-яким з пп. 5-9, який відрізняється тим, що гідробромід есциталопраму перетворюють у вільну основу есциталопраму або оксалат есциталопраму.
11. Кристалічна основа есциталопраму, яка містить менше ніж 0,20% домішок інших, ніж R-циталопрам, зокрема менше ніж 0,10%.
12. Кристалічна основа за п. 11, яка відрізняється тим, що вона містить менше ніж 0,10% будь-якої конкретної домішки іншої, ніж R-циталопрам.
13. Спосіб виготовлення солі есциталопраму, який відрізняється тим, що вільну основу есциталопраму осаджують в твердій формі з розчинника і відділяють від розчинника, необов’язково перекристалізовують один або декілька разів, а потім перетворюють в сіль есциталопраму.
14. Спосіб виготовлення солі есциталопраму за п. 13, який відрізняється тим, що вільну основу есциталопраму осаджують з неочищеного есциталопраму.
15. Спосіб виготовлення солі есциталопраму за п. 13 або п. 14, який відрізняється тим, що домішку формули (II)
 , (II)
, (II)
де Z являє собою ціано, R1 являє собою метил і R2 являє собою водень, видаляють з есциталопраму або зменшують її кількість.
16. Спосіб за п. 15, де Z являє собою бром.
17. Спосіб за будь-яким з пп. 14-16, в якому неочищений есциталопрам піддають початковому очищенню перед осадженням гідроброміду есциталопраму в кристалічній формі.
18. Спосіб за будь-яким з пп. 14-17, який відрізняється тим, що вільну основу есциталопраму перетворюють в оксалат есциталопраму.
19. Спосіб зменшення кількості N-оксиду есциталопраму у вільній основі есциталопраму або її солі, при якому розчиняють вільну основу есциталопраму в діетиловому етері та видаляють N-оксид есциталопраму у вигляді твердого матеріалу.
Текст
1. Вільна основа есциталопраму в твердій формі, яка відрізняється тим, що вона містить кристалічний есциталопрам. 2. Вільна основа есциталопраму за п.1, яка відрізняється тим, що вона є принаймні на 90% кристалічною, конкретно, принаймні на 95% кристалічною, а більш конкретно, принаймні на 98% кристалічною. 3. Вільна основа есциталопраму за п.1, яка відрізняється тим, що вона є кристалічною. 4. Фармацевтична композиція, яка містить вільну основу есциталопраму згідно з будь-яким з пп.1-3. 5. Спосіб виготовлення вільної основи есциталопраму або її солі, який відрізняється тим, що гідробромід есциталопраму осаджують в кристалічній формі з розчинника і відділяють від розчинника, необов’язково, перекристалізовують один або декілька разів, а потім перетворюють у вільну основу есциталопраму або її сіль, за умови, що одержувана сіль есциталопраму не є гідробромідом. 6. Спосіб виготовлення вільної основи есциталопраму або її солі за п.5, який відрізняється тим, що гідробромід есциталопраму осаджують з неочищеного есциталопраму. 7. Спосіб виготовлення вільної основи есциталопраму або її солі за п.5 або п.6, який відрізняється тим, що одну або декілька домішок формули (II) або (III) 2 3 86536 12. Кристалічна основа за п.11, яка відрізняється тим, що вона містить менше ніж 0,10% будь-якої конкретної домішки іншої, ніж R-циталопрам. 13. Спосіб виготовлення солі есциталопраму, який відрізняється тим, що вільну основу есциталопраму осаджують в твердій формі з розчинника і відділяють від розчинника, необов’язково перекристалізовують один або декілька разів, а потім перетворюють в сіль есциталопраму. 14. Спосіб виготовлення солі есциталопраму за п.13, який відрізняється тим, що вільну основу есциталопраму осаджують з неочищеного есциталопраму. 15. Спосіб виготовлення солі есциталопраму за п.13 або п.14, який відрізняється тим, що домішку формули (II) Z O R1 4 де Z являє собою ціано, R1 являє собою метил і R2 являє собою водень, видаляють з есциталопраму або зменшують її кількість. 16. Спосіб за п.15, де Z являє собою бром. 17. Спосіб за будь-яким з пп.14-16, в якому неочищений есциталопрам піддають початковому очищенню перед осадженням гідроброміду есциталопраму в кристалічній формі. 18. Спосіб за будь-яким з пп.14-17, який відрізняється тим, що вільну основу есциталопраму перетворюють в оксалат есциталопраму. 19. Спосіб зменшення кількості N-оксиду есциталопраму у вільній основі есциталопраму або її солі, при якому розчиняють вільну основу есциталопраму в діетиловому етері та видаляють Nоксид есциталопраму у вигляді твердого матеріалу. N R2 F , (II) Цей винахід відноситься, в першому аспекті, до кристалічної основи добре відомого лікарського засобу-антидепресанту есциталопраму, 8-1-[3(диметиламіно)пропіл]-1-(4-фторфеніл)-1,3дигідро-5-ізобензофуранкарбонітрилу, до препаративних форм вказаної основи, до способів одержання очищеної вільної основи есциталопраму і її солей, з використанням кристалічної основи або гідроброміду есциталопраму, до солей, одержаних за допомогою вказаного способу, і до препаративних форм, що містять такі солі. У другому аспекті, цей винахід відноситься до дисперговних в роті пігулок, що містять активний фармацевтичний інгредієнт, адсорбований на водорозчинному наповнювачі, де вказаний активний фармацевтичний інгредієнт має температуру плавлення в діапазоні 40-100°С, і до способів виробництва таких дисперговних в роті пігулок. Есциталопрам є добре відомим лікарським засобом-антидепресантом, що знаходиться на ринку протягом декількох років і має наступну структуру: (I) Він є селективним інгібітором зворотного захоплення серотоніну (5-гідрокситриптаміну; 5-НТ) центральної дії, що має, відповідно, антидепресивну активність. Есциталопрам вперше був описаний в [патенті США №4943590]. Одержаний есциталопрам був виділений як оксалат. Крім того, основу есциталопраму було одержано у вигляді оливи. Есциталопрам представлений на ринку як оксалат. Есциталопрам може, серед іншого, бути одержаний відповідно до способів, описаних в публікації міжнародної патентної заявки [WO 2003006449] і в публікації міжнародної патентної заявки [WO 2003051861]. Кристалічний гідробромід есциталопраму описаний в публікації міжнародної патентної заявки [WO 2004056791]. Дисперговні в роті пігулки привертають значну увагу протягом останніх років. Дисперговні в роті пігулки розпадаються в роті, а потім заковтуються. Це є переважним для пацієнтів, що мають труднощі з проковтуванням препаратів у вигляді звичайних пігулок, і, як наслідок, дисперговні в роті пігулки підвищують не тільки зручність для пацієнта, але також поліпшують дотримання пацієнтом схеми лікування. Активний фармацевтичний інгредієнт, який включається в пігулку, що швидко розпадається, може частково або повністю розчинятися в роті, тим самим роблячи можливим поглинання з ротової порожнини. У літературі використовується декілька термінів для дисперговних в роті пігулок. Серед них: пігулки, що швидко розчиняються, пігулки, що швидко диспергуються, пігулки, що швидко дезінтегруються, пігулки, що розплавляються, пігулки швидкого розчинення, пігулки швидкого плавлення, пігулки, що розчиняються в роті, пігулки, що швидко розпадаються. Для виробництва пігулок, що швидко дезінтегруються, використовуються різні способи. Безліч способів використовують незвичайне устаткування і складні технології переробки, такі як технології ліофілізації і спінювання. Багато з цих способів приводять до одержання пігулок, що швидко дезінтегруються, з поганою міцністю пігулки і низькою крихкістю. Це може зробити неможливим викорис 5 тання звичайного пакувального матеріалу і звичайних процедур упаковки. У [WO 2005/018617] описується застосування звичайного гранулювання з використанням розплаву для одержання гранул із сполуки з низькою температурою плавлення, яка плавиться або розм'якшується при 37°С або нижче, і водорозчинного ексципієнта. Потім гранули змішують з активним фармацевтичним інгредієнтом і додатковими ексципієнтами, а потім пресують з одержанням швидкорозчинних пігулок з низькою твердістю, 2,2 кілофунта або менше. З цієї причини є бажаними способи виробництва, які ґрунтуються на використанні звичайного устаткування і технологій і які приводять до одержання пігулок, що швидко дезінтегруються, з достатньою міцністю. Тепер виявлено, що основа есциталопраму може бути одержана у вигляді дуже чистого кристалічного продукту, який може легко піддаватися обробці та зручно готуватися у вигляді пігулок та інших фармацевтичних форм. Крім того, виявлено, що ефективне очищення есциталопраму може бути здійснене під час виробництва есциталопраму (наприклад, оксалатної солі) за допомогою кристалізації основи, а потім необов'язкового утворення солі з основи. Подібним же чином, виявлено, що дуже ефективне очищення есциталопраму може бути здійснене під час виробництва есциталопраму (наприклад, вільної основи або оксалатної солі) за допомогою кристалізації гідроброміду, а після цього необов'язкового утворення основи або солі, яка не є гідробромідом, з цієї основи. Ці способи очищення є особливо придатними для видалення проміжних продуктів, які є по структурі близько спорідненими до есциталопраму, зокрема, сполук, які відрізняються від есциталопраму тільки замісником, розташованим в положенні 5 на ізобензофурановому кільці, та/або відсутністю однієї або обох метильних груп, і проміжних сполук, які мають фізичні/хімічні властивості, які близькі до властивостей есциталопраму, наприклад, 1-[3-(диметиламіно)пропіл]-1-(4-фторфеніл)-1,3дигідроізобензофуранів, що мають галоген (зокрема, бромід і хлорид), амід або складний ефір в положенні 5 ізобензофуранового кільця, або сполук формули (III). Крім того, розроблений новий тип дисперговних в роті пігулок з високою міцністю і низькою крихкістю. Ці нові дисперговні в роті пігулки можуть вироблятися за способом агломерації з використанням розплаву, за способом нанесення покриття в розплаві або за способом екструзії розплаву, які можуть здійснюватися з використанням звичайного устаткування для агломерації з використанням розплаву або устаткування для екструзії розплаву. У способі активний фармацевтичний інгредієнт нагрівається до температури вищої, приблизно рівної або злегка меншої, ніж температура плавлення, щоб розплавити агломерат або розплавити частинки наповнювача покриття. Агломерати або частинки наповнювача покриття, як наслідок, змішуються з відповідними ексципієнтами і пресуються в пігулки. 86536 6 Основа есциталопраму, як виявлено, є придатною для приготування таких дисперговних в роті пігулок. Цей винахід представляє кристалічну основу есциталопраму формули (І): (I) У другому аспекті, цей винахід представляє спосіб виготовлення вільної основи есциталопраму або її солі, переважно, оксалату, в якому гідробромід есциталопраму осаджують з розчинника у формі кристалів і відділяють від розчинника, необов'язково перекристалізовують один або декілька разів, а потім перетворюють у вільну основу есциталопраму або її фармацевтично прийнятну сіль, за умови, що одержувана сіль есциталопраму не є гідробромідом. У третьому аспекті, цей винахід відноситься до чистої кристалічної вільної основи есциталопраму або до оксалату есциталопраму, одержаного за допомогою вказаного вище способу за цим винаходом. У четвертому аспекті, цей винахід представляє спосіб виготовлення солі есциталопраму, переважно, оксалату, в якому вільну основу есциталопраму осаджують в твердій формі з розчинника і відділяють від розчинника, необов'язково перекристалізовують один або декілька разів, а потім перетворюють у фармацевтично прийнятну сіль есциталопраму. У п'ятому аспекті, цей винахід відноситься до чистого кристалічного оксалату есциталопраму, одержаного за допомогою вказаного вище способу за цим винаходом. У шостому аспекті, цей винахід відноситься до способу зменшення кількості N-оксиду есциталопраму (N-оксиду (S)-1-(3-диметиламінопропіл)-1-(4фторфеніл)-1,3-дигідроізобензофуран-5карбонітрилу) у вільній основі есциталопраму або її солі, що включає розчинення вільної основи есциталопраму в діетиловому етері та видалення Nоксиду есциталопраму у вигляді твердого матеріалу. У сьомому аспекті, цей винахід відноситься до дисперговної в роті пігулки, що має твердість принаймні 22 Η і час дезінтеграції в ротовій порожнині менше ніж 120 секунд і що містить активний фармацевтичний інгредієнт, адсорбований на водорозчинному наповнювачі, один або декілька дезінтегруючих агентів і, необов'язково, додатковий водорозчинний наповнювач, де вказаний активний фармацевтичний інгредієнт має температуру плавлення в діапазоні 40-100°С. У восьмому аспекті, цей винахід відноситься до способу виробництва дисперговної в роті пігулки, як описано вище, що включає: a) змішування водорозчинного наповнювача і активного фармацевтичного інгредієнта при температурі вищій, приблизно рівній або трохи меншій, ніж температура плавлення активного фармацевтичного інгредієнта, при цьому активний 7 86536 фармацевтичний інгредієнт адсорбується на водорозчинному наповнювачі; b) з подальшим охолоджуванням до температури нижче за 40°С; c) змішування суміші активного фармацевтичного інгредієнта і водорозчинного наповнювача з одним або декількома дезінтегруючими агентами і, необов'язково, з іншими ексципієнтами; d) пресування суміші в пігулки з твердістю принаймні 22Н. У дев'ятому аспекті, цей винахід відноситься до фармацевтичних препаратів, що містять основу есциталопраму в твердій формі. У одному з варіантів здійснення, цей винахід відноситься до вільної основи есциталопраму в твердій формі, зокрема, в твердій формі, що містить кристалічну вільну основу есциталопраму, а більш конкретно, в твердій формі, яка є принаймні на 90% кристалічною, ще більш конкретно, принаймні на 95% кристалічною, а найбільш конкретно, принаймні на 98% кристалічною. Конкретно, цей винахід відноситься до кристалічної вільної основи есциталопраму. У одному з конкретних варіантів здійснення, цей винахід відноситься до дисперговної в роті пігулки, що містить вільну основу есциталопраму, тоді як в іншому такому ж конкретному варіанті здійснення, цей винахід відноситься до фармацевтичної композиції, що містить вільну основу есциталопраму в твердій формі, як описано вище. Зокрема, фармацевтична композиція призначена для перорального введення. Фармацевтична композиція відповідно до цього винаходу може бути одержана за допомогою безпосереднього пресування есциталопраму в суміші із звичайними ексципієнтами. Альтернативно, для пресування пігулок може використовуватися гранулят есциталопраму, одержаний вологим гранулюванням, або гранулят, одержаний гранулюванням з використанням розплаву, необов'язково, в суміші із звичайними ексципієнтами. Ще в одному варіанті здійснення, цей винахід відноситься до способу виробництва вільної основи есциталопраму або її солі, який відрізняється тим, що гідробромід есциталопраму осаджують в кристалічній формі з розчинника і відділяють від розчинника, необов'язково перекристалізовують один або декілька разів, а потім перетворюють у вільну основу есциталопраму або її сіль, за умови, що сіль есциталопраму, яка виробляється, не є гідробромідом. У конкретному варіанті здійснення, цей винахід відноситься до такого способу, де гідробромід есциталопраму осаджують з неочищеного есциталопраму. У іншому конкретному варіанті здійснення, цей винахід відноситься до такого способу, де одну або декілька домішок формули (II) або (III): (II) 8 (III) де Ζ являє собою галоген, ціано або -CONH2, R1 і R2 незалежно являють собою водень або метил, за умови, що, коли як R1, так і R2 являють собою метил, тоді Ζ не є ціано, і зв'язок, зображений як ламана лінія у формулі (III), показує, що конфігурація навколо подвійного зв'язку може бути Еабо Ζ-, видаляють з есциталопраму або зменшують їх кількість за допомогою способу. Конкретніше, цей винахід відноситься до такого способу, де домішки мають формулу (II), де Ζ являє собою бром або хлор, а як R1, так і R2 являють собою метил, Ζ являє собою -CONH2, а як R1, так і R2 являють собою метил, або Ζ являє собою ціано, R1 являє собою водень і R2 являє собою метил; або де домішки мають формулу (III), де конфігурація навколо подвійного зв'язку є Ζ. У описі винаходу і формулі винаходу, сполуки формули (II) можуть мати S-конфігурацію, Rконфігурацію, бути рацемічними або бути будьякою їх сумішшю. У описі і формулі винаходу, терміни "оксалат есциталопраму" і "геміоксалат есциталопраму" відносяться до однієї і тієї ж солі 1:1, есциталопраму і щавлевої кислоти. У іншому конкретному варіанті здійснення, цей винахід відноситься до такого способу, де неочищений есциталопрам піддають початковому очищенню перед тим, як гідробромід есциталопраму осаджують в кристалічній формі. У ще одному конкретному варіанті здійснення, цей винахід відноситься до такого способу, де гідробромід есциталопраму перетворюють у вільну основу есциталопраму або оксалат есциталопраму. У іншому варіанті здійснення, цей винахід відноситься до кристалічної основи есциталопраму або оксалатної солі есциталопраму, одержаної за допомогою способу, як описано вище; зокрема, до такої основи або оксалатної солі, яка містить менше ніж 0,2% домішок інших, ніж R-циталопрам, більш конкретно, менше ніж 0,1%. Зокрема, цей винахід відноситься до кристалічної основи або оксалатної солі, як описано вище, яка містить менше ніж 0,1% будь-якої конкретної домішки іншої, ніж R-циталопрам. У іншому варіанті здійснення, цей винахід відноситься до кристалічної основи есциталопраму або до оксалатної солі есциталопраму, що відрізняється тим, що вона містить менше ніж 0,2% домішок інших, ніж R-циталопрам, зокрема, менше ніж 0,1%. У конкретному варіанті здійснення, цей винахід відноситься до кристалічної основи або оксалатної солі, як описано вище, яка містить менше ніж 0,1% будь-якої конкретної домішки іншої, ніж R-циталопрам. У описі і формулі винаходу вміст домішок надається як відсоток площі під кривою, що визначається за допомогою ВЕРХ. 9 86536 Ще в одному варіанті здійснення, цей винахід відноситься до способу виготовлення солі есциталопраму, який відрізняється тим, що вільну основу есциталопраму осаджують в твердій формі з розчинника і відділяють від розчинника, необов'язково перекристалізовують один або декілька разів, а потім перетворюють в сіль есциталопраму. У конкретному варіанті здійснення, цей винахід відноситься до такого способу, де вільну основу есциталопраму осаджують з неочищеного есциталопраму. У іншому конкретному варіанті здійснення, цей винахід відноситься до такого способу, де одну або декілька домішок формули (II) (II) де Ζ являє собою галоген або -CONH2, видаляють з есциталопраму або їх кількість зменшують за допомогою цього способу; більш конкретно, до такого способу, де Ζ являє собою бром. У іншому конкретному варіанті здійснення, цей винахід відноситься до такого способу, де неочищений есциталопрам піддають початковому очищенню перед тим, як вільну основу есциталопраму осаджують в твердій формі. Ще в одному конкретному варіанті здійснення, цей винахід відноситься до такого способу, де вільну основу есциталопраму перетворюють в оксалат есциталопраму. У іншому варіанті здійснення цей винахід відноситься до дисперговної в роті пігулки, що має твердість принаймні 22Н, і час дезінтеграції в ротовій порожнині менше ніж 120 секунд, і що містить активний фармацевтичний інгредієнт, адсорбований на водорозчинному наповнювачі, один або декілька дезінтегруючих агентів і, необов'язково, додатковий водорозчинний наповнювач, де вказаний активний фармацевтичний інгредієнт має температуру плавлення в діапазоні від 40 до 100°С, конкретно, в діапазоні від 40 до 90°С, більш конкретно, від 40 до 80°С, і найбільш конкретно, від 45 до 70°С. У конкретному варіанті здійснення цей винахід відноситься до такої дисперговної в роті пігулки, де активний фармацевтичний інгредієнт вибраний з групи, що складається з есциталопраму, етосуксиміду, триметадіону, хлорамбуцилу, дисульфіраму, фенофібрату, гуаіфенезину, ломустину, каризопродолу і перфеназину, а більш конкретно, де активний фармацевтичний інгредієнт являє собою есциталопрам. У іншому конкретному варіанті здійснення цей винахід відноситься до такої дисперговної в роті пігулки, де водорозчинний наповнювач вибраний з групи, що складається з: моносахаридів, дисахаридів, цукрових спиртів і полісахаридів; а більш конкретно, де водорозчинний наповнювач вибраний з групи, що складається з: маніту, сорбіту, глюкози, манози і лактози. У іншому конкретному варіанті здійснення цей винахід відноситься до такої дисперговної в роті 10 пігулки, що містить антиоксидант, такий як С1-6алкілгалат, наприклад, пропілгалат, як інтра- або екстрагранулярний ексципієнт. У іншому конкретному варіанті здійснення цей винахід відноситься до такої дисперговної в роті пігулки, яка має твердість принаймні 22Н, конкретно, принаймні 2 Н, більш конкретно, принаймні 30Н, ще більш конкретно, принаймні 40Η і, найбільш конкретно, принаймні 60Н. Зручно, щоб пігулка мала твердість в діапазоні 22-125Н, конкретно, 25-125Н, більш конкретно, 30-125Н, ще більш конкретно, 40-125Η і, найбільш конкретно, 60125Н. Також зручно, щоб пігулка мала твердість в діапазоні 22-100Н, конкретно, 30-100Н, більш конкретно, 40-100Н, ще більш конкретно, 25-60Η і, найбільш конкретно, 30-60Н. У іншому конкретному варіанті здійснення, цей винахід відноситься до такої дисперговної в роті пігулки, яка має час дезінтеграції в ротовій порожнині менше ніж 60 секунд, конкретно, менше ніж 40 секунд, і, більш конкретно, менше ніж 30сек. У іншому конкретному варіанті здійснення, цей винахід відноситься до такої дисперговної в роті пігулки, яка має крихкість не більше ніж 1%, конкретно, не більше ніж 0,8%. Дезінтегруючі агенти, придатні для використання в дисперговній в роті пігулці, описані вище, вибираються з групи, що складається з: мікрокристалічної целюлози (целюлоза), натрій крохмаль гліколяту (натрій карбоксиметил крохмаль), натрій кроскармелози (натрієва сіль карбоксиметилового етеру целюлози, поперечний зшита), кросповідону (полівінілполіпіролідону), повідону (полівінілпіролідону), природних крохмалів, таких як кукурудзяний крохмаль і картопляний крохмаль, заздалегідь желатинованого крохмалю, пресованого крохмалю, альгінової кислоти, альгінату натрію і полакриліну калію (полімер 2-метил-2-пропенової кислоти з дивінілбензолом, калієва сіль); і зокрема, з групи, що складається з: мікрокристалічної целюлози, натрій крохмаль гліколяту, натрій кроскармелози, кросповідону і повідону. Найбільш конкретно, дезінтегруючий засіб являє собою продукт натрій кроскармелози, який може забезпечити більш стабільний продукт, в порівнянні з іншими дезінтегруючими агентами. Ще в одному варіанті здійснення, цей винахід відноситься до способу виробництва дисперговної в роті пігулки, як описано вище, де вказаний спосіб включає: a) змішування водорозчинного наповнювача і активного фармацевтичного інгредієнта при температурі вищій, приблизно рівній або трохи меншій, ніж температура плавлення активного фармацевтичного інгредієнта, при цьому активний фармацевтичний інгредієнт адсорбується на водорозчинному наповнювачі; b) з подальшим охолоджуванням до температури нижче за 40°С, зокрема, нижче 35°С, а більш конкретно, нижче за 30°С; c) змішування суміші активного фармацевтичного інгредієнта і водорозчинного наповнювача з одним або декількома дезінтегруючими агентами і, необов'язково, з іншими ексципієнтами; 11 d) пресування суміші в пігулки з твердістю принаймні 22Н. У описі і формулі винаходу термін "охолоджування" включає активне і пасивне охолоджування. Використання штампів для таблетування з поверхнею, що містить нітрид хрому, для способу таблетування може бути переважним для зменшення адгезії до штампів. Такі штампи для таблетування можуть бути виготовлені з використанням доступного від BeamAlloy Technologies LLC поліпшеного покриття, осадженого за допомогою іонного пучка. У конкретному варіанті здійснення, змішування на стадії а), вище, здійснюється при температурі вищій, ніж температура плавлення активного інгредієнта. Температура плавлення переважно знаходиться в діапазоні від 44 до 49°С, найбільш переважно, від 45 до 48°С (DSC; початок). Терміни "неочищений есциталопрам", "неочищена сіль" і "неочищена суміш" відноситься до того факту, що сіль і суміш, відповідно, містять домішки, зокрема, домішки формули (II), які повинні бути видалені або які бажано видаляти. Неочищена сіль може бути відділена безпосередньо від реакційної суміші, або неочищена реакційна суміш може піддаватися деякому початковому очищенню, наприклад, одній перекристалізації і/або обробці за допомогою активованого вугілля і/або силікагелю, а сіль утворюють потім за допомогою обробки кислотою з використанням способів, відомих в даній галузі. Сіль може бути виділена за допомогою осадження або вона може існувати в розчиннику, наприклад, в суміші, одержаній безпосередньо від синтезу солі. Подібним же чином, неочищена суміш, що містить есциталопрам, може бути одержана безпосередньо від синтезу сполуки відповідно до будьякого з розглянутих вище способів або вона може піддаватися деякому початковому або одночасному очищенню, наприклад, одній перекристалізації, і/або обробці активованим вугіллям і/або силікагелем. Основа есциталопраму може вивільнятися з неочищеної солі за допомогою розчинення неочищеної солі в суміші води і органічного розчинника, а потім додавання основи до досягнення рН7 або більше. Органічний розчинник може бути толуолом, етилацетатом, діетиловим етером, метилтрет-бутиловим етером, діізопропіловим етером, гексаном, гептаном, циклогексаном, метилциклогексаном або будь-яким іншим придатним для використання розчинником, а також їх сумішами, і основа може бути будь-якою зручною основою, переважно, NaOH або NH3. Подібним же чином, основа есциталопраму може, якщо це необхідно, вивільнятися з неочищеної суміші, що містить есциталопрам, за допомогою обробки основою. Неочищені суміші, що містять основу есциталопраму, можуть піддаватися додатковому очищенню і екстрагуванню перед осадженням основи в кристалічній формі. Основа есциталопраму може бути виділена за допомогою відділення органічної фази від водної фази, випаровування розчинника 86536 12 для одержання основи, найймовірніше, у вигляді оливи, а потім кристалізації основи з розчинника, такого як алкан, включаючи н-гептан, гексан, ізооктан, циклогексан і метилциклогексан, 2метилтетрагідрофуран; 1-пентанол і петролейні етери з високими і низькими температурами кипіння або їх суміші; а також суміші одного або декількох зі згаданих вище розчинників з більш полярними розчинниками, такими як етилацетат, ізопропілацетат, бутилацетат, ацетонітрил, тетрагідрофуран і спирти, такі як 2-бутанол або 2пропанол, і відокремлення основи есциталопраму від розчинника. Кристалічна основа есциталопраму може бути перекристалізована з цих же розчинників. Кристалізація може ініціюватися за допомогою затравки з кристалічного оксалату есциталопраму або кристалічної вільної основи есциталопраму. Фармацевтично прийнятні солі есциталопраму, такі як оксалат, можуть бути одержані за допомогою способів, відомих в даній галузі. Так, основа може взаємодіяти, або із стехіометричною кількістю кислоти в змішуваному з водою розчиннику, такому як ацетон або етанол, з подальшим виділенням солі за допомогою концентрування і охолоджування, або з надлишком кислоти в незмішуваному з водою розчиннику, такому як діетиловий етер, етилацетат або дихлорметан, з мимовільним виділенням солі. Вільна основа есциталопраму або оксалат есциталопраму, одержаний за допомогою способу цього винаходу, має дуже високу чистоту і містить менше ніж 0,20% домішок інших, ніж R-циталопрам, зокрема, менше ніж 0,10%. Зокрема, вільна основа есциталопраму або оксалат есциталопраму, одержаний за способом цього винаходу, містить менше ніж 0,10% будь-якої конкретної домішки іншої, ніж Rциталопрам. Інші солі есциталопраму також можуть бути одержані в дуже чистій формі за допомогою цього способу. Сполуки формули (II) можуть бути одержані, як описано в [патенті Німеччини DE 2657013, в міжнародних патентних заявках WO 0011926 і WO 0013648, WO 9819513, WO 9819512 і WO 9900548]. У описі і формулі винаходу, термін "тверда форма" відноситься до будь-якої твердої форми, ілюстрованою кристалічною формою, формою аморфного твердого продукту, склоподібною формою, піною, а також їх сумішами. У описі і формулі винаходу, температури плавлення вимірюються з використанням диференціальної сканувальної калориметрії (DSC). Використовуване устаткування є приладом TA-Instruments DSC-Q1000, що калібрується при 5°С/хв., з отриманням температури плавлення як значення для його початку. Приблизно 2 мг зразка нагрівають при 5°С/хв. в нещільно закритому піддоні, в потоці азоту. У описі і формулі винаходу "галоген" означає хлор, бром або йод. У описі і формулі винаходу термін "дисперговні в роті пігулки" відноситься до пігулок без покриття, призначених для розміщення в роті, де вони швидко диспергуються перед проковтуванням. 13 Дисперговні в роті пігулки розпадаються протягом 3 хвилин, коли досліджуються в тесті дезінтеграції пігулок і капсул, описаному в section 2.9.1, European Pharmacopoeia 5.1, 5th edition 2005. У описі і формулі винаходу термін "твердість" відноситься до "стійкості до роздавлювання пігулок", як визначено в section 2.9.8, European Pharmacopoeia 5.1, 5th edition 2005. Твердість може вимірюватися, серед іншого, в ньютонах (Н) або кілофунтах (кфунт). 1 кфунт= 9,807Н. У описі і формулі винаходу термін "крихкість" має значення, визначене в section 2.9.7, European Pharmacopoeia 5.1, 5th edition 2005. У описі і формулі винаходу термін "водорозчинний" відноситься до речовин, які є розчинними, добре розчинними або дуже добре розчинними у воді, як визначено в European Pharmacopoeia 5.1, 5th edition 2005. Тобто, "водорозчинний" відноситься до речовин, де 1г є розчинним в менше ніж 30мл води. Зокрема, це відноситься до таких речовин, які є добре розчинними або дуже добре розчинними у воді. Це речовини, для яких 1г є розчинним в менше ніж 10мл води. У описі і формулі винаходу термін "дезінтегруючий агент" відноситься до агентів, що додаються до гранул пігулок для цілей спричинення руйнування (розкладання) пресованої пігулки, коли вона поміщається у водне навколишнє середовище. У одному з конкретних варіантів здійснення, цей винахід відноситься до дисперговної в роті пігулки, що містить вільну основу есциталопраму, тоді як в іншому еквівалентному конкретному варіанті здійснення фармацевтичні композиції цього винаходу можуть вводитися будь-яким придатним для використання способом і в будь-якій придатній для використання формі, наприклад, перорально, у формі пігулок, капсул, порошків або сиропів, або парентерально, у формі звичайних стерильних розчинів для ін'єкцій. Переважно, фармацевтичні композиції цього винаходу вводяться перорально. У одному з конкретних варіантів здійснення, цей винахід відноситься до дисперговної в роті пігулки, що містить вільну основу есциталопраму, тоді як в іншому еквівалентному конкретному варіанті здійснення фармацевтичні препарати, що містять вільну основу есциталопраму цього винаходу, можуть бути одержані за допомогою звичайних способів, відомих в даній галузі. Наприклад, пігулки можуть бути одержані за допомогою змішування активного інгредієнта із звичайними ексципієнтами і подальшого пресування суміші в звичайній таблетувальній машині. Приклади наповнювачів включають: мікрокристалічну целюлозу, двоосновний кальцію фосфат, маніт, кукурудзяний крохмаль, картопляний крохмаль, тальк, стеарат магнію, желатин, лактозу, смоли, і тому подібне. Можуть використовуватися будь-які інші ексципієнти, такі як барвники, ароматизатори, консерванти, і тому подібне, за умови, що вони не зменшують термін придатності пігулок в упаковці. Переважні ексципієнти не впливають негативно на 13 стабільність активних інгредієнтів в препараті. У одному з конкретних варіантів здійснення, цей винахід відноситься до дисперговної в роті 86536 14 пігулки, що містить вільну основу есциталопраму, тоді як в іншому еквівалентному конкретному варіанті здійснення, препарати відповідно до цього винаходу можуть бути одержані за допомогою безпосереднього пресування есциталопраму в суміші із звичайними ексципієнтами. Альтернативно, гранулят есциталопраму, одержаний вологим гранулюванням, або гранулят есциталопраму, одержаний з використанням розплаву, необов'язково, в суміші із звичайними ексципієнтами, може бути використаний для пресування пігулок. Розчини для ін'єкцій можуть бути одержані за допомогою розчинення активного інгредієнта і можливих добавок в частині розчинника для ін'єкцій, переважно, в стерильній воді, доведення розчину до бажаного об'єму, стерилізації розчину і заповнення відповідних ампул або флаконів. Можуть додаватися будь-які відповідні добавки, використовувані в даній галузі, такі як агенти ізотонічності, консерванти, антиоксиданти, агенти для підвищення розчинності і тому подібне. Відповідно до цього винаходу, як виявлено, основа есциталопраму є кристалічною, із стабільними білими кристалами, і виявлено, що основа може легко кристалізуватися в дуже чистій формі. Так, наприклад, чисту основу есциталопраму, що містить менше 0,2% домішок, відмінних від Rциталопраму, зокрема, менше 0,1%, одержують за допомогою кристалізації з гідроброміду есциталопраму з чистотою принаймні 95%, без додаткового очищення. У конкретному варіанті здійснення одержують чисту основу есциталопраму, яка містить менше 0,1% будь-якої конкретної домішки. Відповідно, спосіб одержання солей есциталопраму цього винаходу, як виявлено, дає солі у вигляді дуже чистих продуктів фармацевтично прийнятної якості. Відповідно, під час виробництва есциталопраму, вихід може бути істотно поліпшений. Агломерація з використанням розплаву являє собою процес агломерації, в якому використовується розплавлена зв'язувальна рідина. Розплавлена зв'язувальна речовина твердіє при кімнатній температурі. Одна з таких зв'язувальних речовин згадується як здатна до розплавлення зв'язувальна речовина. У способі агломерації з використанням розплаву, спосіб звичайно здійснюється при підвищених температурах. Температура способу може бути схожою з температурою, при якій плавиться зв'язувальна речовина, але вона може також бути вище і навіть нижче за температуру плавлення. Коли температура способу досягає рівня, який викликає плавлення або розм'якшення зв'язувальної речовини, тоді зв'язувальна речовина сприяє утворенню та зростанню агломератів. Під час процесу агломерації температура в суміші може бути неоднорідною через локальні сили тертя, що приводять до локального нагріву тертям. Це призводить до того, що частина зв'язувальної речовини може бути твердою, тоді як інші частини можуть плавитися або розм'якшуватися. Процес агломерації може здійснюватися за допомогою будь-якого з механізмів, з механізму розподілу, механізму занурення або за допомогою поєднання цих двох механізмів. Коли агломерати бажаних розмірів сформовані, тоді агломерати охолоджу 15 ють до температури нижче за 40°С, при цьому розплавлена або розм'якшена зв'язувальна речовина твердіє. Потім агломерати можна змішати з ексципієнтами перед пресуванням в пігулки. Спосіб може також здійснюватися таким чином, що агломерація не матиме місця. В цьому випадку, спосіб може визначатися як спосіб нанесення покриття з використанням розплаву. Процедура схожа з процедурою, описаною для агломерації з використанням розплаву. Єдина відмінність полягає в тому, що матеріал покриття, тобто здатна до розплавлення зв'язувальна речовина, розподілятиметься поверх частинок наповнювача, приводячи до утворення більш або менш гомогенного шару покриття. Для запобігання агломерації умови процесу або кількість матеріалу покриття, наприклад здатної до розплавлення зв'язувальної речовини, по відношенню до кількості частинок наповнювача повинні контролюватися. Частинки наповнювача з нанесеним покриттям можна потім змішувати з наповнювачами перед пресуванням в пігулки. Здатна до розплавлення зв'язувальна речовина, що застосовується при агломерації з використанням розплаву, звичайно являє собою поліетиленгліколі, жирні кислоти, жирні спирти або гліцериди. Виявлено, що фармацевтично активні речовини з відповідною температурою плавлення можуть використовуватися як здатні до розплавлення зв'язувальні речовини в способі агломерації з використанням розплаву. Відповідні температури плавлення знаходяться в діапазоні 40-100°С. У одному з варіантів здійснення, агломерат або частинку наповнювача з покриттям одержують за допомогою плавлення активного фармацевтичного інгредієнта і розпилювання або виливання розплаву на наповнювач. Стадія розпилювання або виливання може здійснюватися відповідно до відомих процедур. У іншому варіанті здійснення всі складові агломерату або частинки наповнювача з покриттям додаються у високозсувний міксер, необов'язково забезпечений нагрівальним кожухом. За допомогою роботи високозсувного міксера тепло тертя і/або тепло, що подається нагрівальним кожухом, розплавлятиме активний фармацевтичний інгредієнт, який осаджується на наповнювач. Цей спосіб є дуже привабливим способом для агломерації з використанням розплаву, оскільки спосіб є швидким і простим в здійсненні. Екструзія розплаву є способом, де сполуки з низькою температурою плавлення і наповнювач змішуються і нагріваються в змішувачі, який звичайно є частиною екструдера. Потім м'яка маса вводиться в екструзійну камеру і продавлюється через малі отвори або насадки, з формуванням її у вигляді тонких стрижнів або циліндрів. Спосіб екструзії розплаву може альтернативно здійснюватися за допомогою змішування сполуки з низькою температурою плавлення і наповнювача в змішувачі, що не нагрівається. Потім суміш переноситься в екструдер, що нагрівається. У екструдері, що нагрівається, сполука з низькою температурою плавлення плавиться і робить можливим формування м'якої маси в екструзійній камері. М'яка ма 86536 16 са продавлюється через малі отвори або насадки, з формуванням її у вигляді тонких стрижнів або циліндрів. Після того, як екструдований матеріал твердіє, його можна молоти або сферонізувати з використанням стандартного устаткування. Агломерати, частинки наповнювача з покриттям або екструдати відповідно до цього винаходу можуть бути одержані із застосуванням процедур і пристроїв, відомих у галузі агломерації з використанням розплаву. Приклади пристроїв, які можуть використовуватися, є низькозсувні міксери, високозсувні міксери, псевдозріджені шари, гранулятори з псевдозрідженим шаром, псевдозріджені шари, що обертаються, і барабанні гранулятори. Перед виробництвом пігулок потрібна попередня операція для встановлення сили стиснення, необхідної для пресування пігулок з бажаною твердістю, крихкістю тощо. Фахівці в даній галузі знатимуть, як встановити силу стиснення для отримання бажаної твердості та/або крихкості. Проте фахівцям в даній галузі відомо, що стисливість препарату визначає те, яка твердість пігулок може бути досягнута за допомогою даної сили стиснення. Цей винахід додатково ілюструється наступними прикладами. Аналізи ВЕРХ здійснюються на колонці Luna C18, (2) 2504,6мм, внутрішній діаметр (ID) 5мкм, з градієнтним елююванням, з використанням рухомої фази А (25мМ водний фосфатний буфер, рН3,0/ацетонітрил (90:10)) і рухомої фази В (25мМ водний фосфатний буфер, рН3,0/ацетонітрил (35:65)), з УФ детектуванням на 224нм. Використовується температура колонки 45°С, і об'єми інжекції складають 20мкл. Час дослідження дорівнює 65 хвилинам, з наступним профілем градієнта: Час (хв.) 0,0 35,0 45,0 45,1 60,0 60,1 65,0 Фаза А (%) 95 65 0 0 0 95 95 Фаза В (%) 5 35 100 100 100 5 5 Потік (мл/хв.) 1,0 1,0 1,0 2,0 1,0 1,0 1,0 Результати надаються як відсоток площі під кривою. Стандарти використовуються тільки для ідентифікації розглянутих сполук. Приклад 1 Вивільнення вільної основи есциталопраму з оксалату есциталопраму 704г оксалату есциталопраму поміщають в 6-л тригорлову колбу, забезпечену механічною мішалкою і лійкою для вирівнювання тиску. Додають 3л води, а потім 600мл діетилового етеру. рН доводять до 9-9,5 за допомогою додавання 27% мас/мас водного розчину амонію, і суміш перемішують протягом ½ години. Фази розділяють і водну фазу екстрагують ще раз 300мл діетилового етеру. Об'єднані органічні фази промивають двічі 300мл води, висушують над MgSO4, фільтрують і 17 випаровують у вакуумі при 40°С з одержанням світло-коричневої оливи. Вихід: 542,5г (98,4%). Приклад 2 Осадження гідроброміду есциталопраму, вивільнення вільної основи і кристалізація цієї основи Осадження гідробромідної солі есциталопраму: Зкг вільної основи есциталопраму (чистота згідно ВЕРХ: 99,16% (відсоток площі під кривою)) у вигляді світло-коричневої оливи, розчиненої в 12кг 2-пропанолу, завантажують в 20-л термостатично контрольований реактор з механічним перемішуванням, зворотним холодильником, скрубером, входом для газу і термометром. Розчин нагрівають до 40°С і газоподібний НВr барботують через розчин до встановлення рН між 3 і 4. Ця реакція є екзотермічною, і температуру в реакторі підтримують між 40 і 43°С. Додають невелику кількість кристалів затравки (гідробромід есциталопраму, 100-200мг) і кристалізація починається протягом 10 хвилин. Потім суміш поволі охолоджують до 10°С протягом 5 годин і витримують при цій температурі протягом додаткових 12 годин. Кристали відфільтровують, промивають на фільтрі 3´1л 2пропанолу і висушують до постійної маси у вакуумі при 60°С. Вихід: 3,49кг (93%). Чистота продукту згідно ВЕРХ: 99,86% (відсоток площі під кривою). Вивільнення вільної основи: 650г гідроброміду есциталопраму (чистота згідно ВЕРХ (гідробромідна сіль): 99,86%, відсоток площі під кривою) поміщають в 4-л тригорлову колбу, забезпечену механічною мішалкою і лійкою для вирівнювання тиску. Додають 2л води, а потім 1л діетилового етеру. рН доводять до 9-9,5 за допомогою додавання 27% мас/мас водного розчину амонію і суміш перемішують протягом ½ години. Фази розділяють і водну фазу екстрагують ще раз 500мл діетилового етеру. Об'єднані органічні фази промивають двічі 300мл води, висушують над MgSO4, відфільтровують і випаровують у вакуумі при 40°С, з одержанням світло-коричневої оливи. Вихід: 520г (100%). Кристалізація вільної основи: Вільну основу есциталопраму переносять в 2л термостатично контрольований реактор, забезпечений механічною мішалкою, зворотним холодильником, входом/виходом N2 і термометром. Додають 50мл етилацетату, а потім 1,3л гептану. Суміш нагрівають до 40°С з утворенням гомогенного розчину. Після цього починають повільне охолоджування до -5°С протягом 12 годин, а коли температура становить приблизно 20°С, в суміш додають малу кількість затравки оксалату есциталопраму (10-20мг). Кристалізація вільної основи починається приблизно через ½ години. Потім 86536 18 суміш перемішують протягом 5 годин при -5°С, кристали відфільтровують, промивають на фільтрі 2´150мл гептану і висушують у вакуумі при 25°С до постійної маси. Вихід: 432г (83%). Чистота продукту згідно ВЕРХ: 99,95% (відсоток площі під кривою). Температура плавлення (DSC, початок): 46,6°С. Приклад 3 Кристалізація вільної основи есциталопраму 520г вільної основи есциталопраму у вигляді світло-коричневої оливи (чистота: 99,25%; ВЕРХ) поміщають в 2-л термостатично контрольований реактор, забезпечений механічною мішалкою, зворотним холодильником, входом/виходом N2 і термометром. Додають 50мл етилацетату і суміш нагрівають до 35°С, після чого додають 1,3л гептану. Коли розчин стає гомогенним, починають повільне охолоджування до -5°С протягом 12 годин. Коли температура становить 20°С, додають малу кількість (10-20мг) кристалів затравки (основа есциталопраму). Кристалізація починається при приблизно 10°С. Суміш перемішують при -5°С протягом додаткових 5-7 годин, після чого кристали видаляють за допомогою фільтрування. Кристали промивають на фільтрі 2´150мл гептану і висушують у вакуумі при 25°С до постійної маси. Вихід: 485г (93,3%). Чистота продукту згідно ВЕРХ: 99,58% (відсоток площі під кривою). Температура плавлення (DSC, початок): 45,8°С. Приклад 4 Очищення есциталопраму за допомогою осадження вільної основи або гідроброміду есциталопраму Використовують початковий розчин есциталопраму (вільна основа, олива) в етанолі. Етанол видаляють при зниженому тиску і 400г одержаної оливи відмірюють в колбу, куди додають наступне: 2г 5-амідо аналога циталопраму (амід (R,S)-1-(3диметиламінопропіл)-1-(4-фторфеніл)-1,3дигідроізобензофуран-5-карбонової кислоти), 2г 5бромо аналога циталопраму ((R,S)-{3-[5-бром-1-(4фторфеніл)-1,3-дигідроізобензофуран-1іл]пропіл}диметиламін) і 2г десметильного аналога циталопраму ((R,S)-1-(4-фторфеніл)-1-(3метиламінопропіл)-1,3-дигідроізобензофуран-5карбонітрил). Одержану суміш (SO) розчиняють в етилацетаті до 1000мл і розділяють на 4 рівні частини, а кожну з них випаровують окремо, з одержанням оливи. Кожну з чотирьох частин послідовно кристалізують відповідно до схеми і процедур, нижче: 19 86536 Осадження кристалічної вільної основи: 100г вільної основи розчиняють в 10мл етилацетату і 240мл гептану при 40°С. Суміші дозволяють охолодитися до кімнатної температури, при якій до суміші додають затравку з кристалічної вільної основи есциталопраму. Потім суміш охолоджують приблизно до 0°С і перемішують протягом приблизно 2 годин, кристали відфільтровують, промивають на фільтрі гептаном і висушують у вакуумі при 25°С до постійної маси. Перекристалізація вільної основи здійснюється за такою ж процедурою, що й осадження вільної основи. Осадження гідробромідної солі есциталопраму: 100г вільної основи розчиняють в 250мл 2пропанолу. Додають бромистий водень (безводний) в 2-пропанолі до отримання рН3,5-4 і об'єм доводять до 400мл за допомогою 2-пропанолу. Кристалізація починається протягом 10 хвилин. Потім суміші дозволяють охолодитися до кімнатної температури і перемішують протягом приблизно 2 годин. Кристали відфільтровують, промивають на фільтрі 2-пропанолом і висушують до постійної маси у вакуумі при 60°С. Перекристалізація гідробромідної солі есциталопраму: 100г гідроброміду есциталопраму розчиняють в 500мл 2-пропанолу при 70°С. Суміші дозволяють охолодитися до кімнатної температури. Кристали відфільтровують, промивають на фільтрі 2пропанолом і висушують до постійної маси у вакуумі при 60°С. Осадження оксалатної солі есциталопраму: 100г вільної основи розчиняють в 250мл 2пропанолу. Один еквівалент дигідрату щавлевої 20 кислоти розчиняють в 250мл теплого 2-пропанолу і додають при 40°С до розчину основи есциталопраму. Після перемішування при 40°С протягом 10 хвилин починається кристалізація. Потім суміші дозволяють охолодитися до кімнатної температури і її перемішують протягом приблизно 2 годин. Кристали відфільтровують, промивають на фільтрі 2-пропанолом і висушують до постійної маси у вакуумі при 60°С. Перекристалізація оксалатної солі есциталопраму: 100г оксалату есциталопраму розчиняють в 1250мл етанолу при нагріванні зі зворотним холодильником. Суміші дозволяють охолодитися до кімнатної температури. Кристали відфільтровують, промивають на фільтрі етанолом і сушать до постійної маси у вакуумі при 60°С. Вивільнення вільної основи: 100г гідроброміду або оксалату есциталопраму розчиняють або суспендують у воді та додають етилацетат. рН доводять до 9-9,5 за допомогою додавання 27% мас/мас водного розчину амонію і суміш перемішують протягом ½ години. Фази розділяють і водну фазу екстрагують ще раз етилацетатом. Об'єднані органічні фази промивають водою, висушують над MgSO4, фільтрують і випаровують у вакуумі при 40°С, з одержанням світло-коричневої оливи. Після кожного осадження або кристалізації відбирають зразок, який аналізують на загальну чистоту і вміст 5-амідо аналога циталопраму, 5бромо аналога циталопраму і десметильного аналога циталопраму. Результати наведені у відсотках у Таблиці 1. Всі продукти є кристалічними, якщо не вказано інше. Таблиця 1 Зразок S.0 S.I.1 S.I.2 S.I.3 S.I.4 S.0 S.II.1 S.II.2 S.II.3 S.II.4 Форма Основа (олива) Основа НВr Основа Оксалат Основа (олива) Основа Основа Основа Оксалат Чистота 97,63 98,51 99,50 99,65 99,60 97,63 98,55 98,71 98,78 98,87 5-амідо аналог 0,52 0,48 0,07 0,06 0,05 0,52 0,42 0,43 0,45 0,41 5-бромо аналог 0,50 0,44 0,21 0,20 0,17 0,50 0,42 0,42 0,40 0,37 Десметильний аналог 0,47 0,13 0,06 0,03 0,03 0,47 0,14 0,07 0,04 0,04 21 86536 22 Продовження таблиці 1 S.0 S.III.1 S.III.2 S.III.3 S.III.4 S.0 S.IV.1 S.IV.2 S.IV.3 S.IV.4 Основа (олива) НВr НВr Основа Оксалат Основа (олива) Оксалат Оксалат Основа Оксалат 97,63 99,34 99,65 99,71 99,70 97,63 98,06 98,81 99,42 99,34 0,52 0,10 0,02 0,017 0,015 0,52 0,45 0,20 0,16 0,15 0,50 0,23 0,15 0,16 0,10 0,50 0,42 0,21 0,165 0,15 0,47 0,16 0,06 0,03 0,03 0,47 0,48 0,47 0,13 0,13 Приклад 5 Очищення есциталопраму за допомогою осадження вільної основи або гідроброміду есциталопраму № Зразка Енантіомер Т.0 Т.І Т.ІІ Т.ІІІ.1 T.IV.1 № Зразка Енантіомер Т.0 Т.І Т.ІІ Т.ІІІ.2 T.IV.2 Тип Неочищений геміоксалат Перекрист. окс. Основа геміоксалат Тип Неочищений геміоксалат Перекрист. окс. сіль НВr геміоксалат 5-амідо Lu 14-017 (S) 0,73 0,253 0,13 0,118 0,078 Lu 14-017 (S) 0,73 0,253 0,13 0,022 0,014 Десметил Lu 11-109 (S) 0,753 0,274 0,114 0,115 0,059 Lu 11-109 (S) 0,753 0,274 0,114 0,064 0,037 Неочищену основу есциталопраму (олива, 20,7г) (Т.0) (чистота: 97,59% виміряна за РХ-МС в порівнянні із стандартами), що містить чотири домішки: 5-амідо аналог есциталопраму (амід (S)-1(3-диметиламінопропіл)-1-(4-фторфеніл)-1,3дигідроізобензофуран-5-карбонової кислоти) (0,73%); десметильний аналог есциталопраму ((S)1-(4-фторфеніл)-1-(3-метиламінопропіл)-1,3дигідроізобензофуран-5-карбонітрил) (0,753%); 5хлоро аналог есциталопраму ((S)-{3-[5-хлор-1-(4фторфеніл)-1,3-дигідроізобензофуран-1іл]пропіл}диметиламін) (0,165%); 5-бромо аналог есциталопраму ((S)-{3-[5-бром-1-(4-фторфеніл)1,3-дигідроізобензофуран-1-іл]пропіл} диметиламін) (0,291%)), як описано в наведених вище схемах, очищають за різними способами. Геміоксалатну сіль есциталопраму осаджують з IPА (2-пропанолу, 150мл) і щавлевої кислоти, 2Н2О (8,0г) (Т.І, 26,0г). Геміоксалатну сіль (Т.І, 26,0г) перекристалізовують з ІРА (250мл) (Т.II, 24,3г). З (Т.ll, 20г) вивільняють та виділяють вільну основу есциталопраму у вигляді оливи (15,4г). Приблизно половину кількості цієї основи (7,8г) осаджують у вигляді кристалічної основи з (нгептану/етилацетату (95:5), 8,5мл) (Т.ІІІ.1, 7,0г). Іншу половину (7,6г) розчиняють в ІРА (60мл) і за допомогою додавання НВr (НВr в ІРА: 0,12г НВr/мл; 16,6мл) осаджують і виділяють гідробромід есциталопраму у кристалічній формі (Т.ІІІ.2, 8,53г). (Т.III.1, 6,91г) розчиняють в ІРА (70мл) і додають щавлеву кислоту, 2Н2О (2,82г). Осаджується геміоксалат есциталопраму (T.IV.l, 8,67г). Подібним же чином, осаджується геміоксалатна сіль 5-хлор Lu 10-134 (S) 0,165 0,167 0,164 0,091 0,069 Lu 10-134 (S) 0,165 0,167 0,164 0,078 0,073 5-бром Lu 10-132 (S) 0,291 0,289 0,276 0,166 0,133 Lu 10-132 (S) 0,291 0,289 0,276 0,137 0,126 Есциталопрам РХ-МС, чистота (%) 97,59 98,89 99,27 99,51 99,66 РХ-МС, чистота (%) 97,59 98,89 99,27 99,67 99,76 есциталопраму (T.IV.2, 8,35г) після вивільнення та виділення основи (6,78г) з (Т.ІІІ.2) з ІРА (70мл) і щавлевої кислоти, 2Н2О (2,77г). Приклад 6 Зменшення вмісту N-оксиду есциталопраму в есциталопрамі Основу есциталопраму (51,3г, чистота 98,60% (ВЕРХ - відсоток площі під кривою)), що містить Nоксид есциталопраму (0,45% згідно ВЕРХ - відсоток площі під кривою), розчиняють в діетиловому етері (250мл) при кімнатній температурі. Майже відразу після розчинення неочищеного есциталопраму починає утворюватися преципітат. Суспензію перемішують протягом трьох годин при 20°С. Преципітат (0,77г) відфільтровують і ідентифікують за допомогою РХ-МС як суміш основи есциталопраму і N-оксиду есциталопраму при співвідношенні приблизно 2/1. Фільтрат містить основу есциталопраму (50,5г, чистота 99,0% (ВЕРХ - відсоток площі під кривою)). Кількість N-оксиду есциталопраму у фільтраті вимірюється як 0,07% (ВЕРХ - відсоток площі під кривою) по відношенню до основи есциталопраму. Приклади приготування (дисперговної в роті пігулки) Приклад 7 Таблиця 2 Композиція І Основа есциталопраму II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH101) V Стеарат магнію мг/пігулку 4,98 99,57 73,80 (Avicel 63,96 3,69 23 86536 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач) і (V) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 3. Таблиця 3 Рівень тиску Твердість пресування пігулки (Н) 1 67 2 93 3 103 Крихкість Час дезінтеграції пігулки (%) (хв.:сек.) 0,19 00:26 0,09 00:50 0,08 01:26 Приклад 8 Таблиця 4 Композиція І Основа есциталопраму II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза (Avicel PH101) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію мг/пігулку 4,98 99,57 61,5 51,66 24,6 3,69 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 5. Таблиця 5 Рівень тиску Твердість Крихкість пігу- Час дезінтеграції лки (%) пресування пігулки (Н) (хв.:сек.) не детектуєть1 56 00:30 ся не детектуєть2 78 00:46 ся не детектуєть3 107 00:56 ся Приклад 9 24 Таблиця 6 Композиція І Основа есциталопраму II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH101) V Кросповідон (Kollidon CL) VI Стеарат магнію мг/пігулку 5,0 100,04 73,80 (Avicel 51,17 12,3 3,69 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) кросповідоном (Kollidon CL) (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 7. Таблиця 7 Рівень тиску Твердість пресування пігулки (Н) 1 70 2 90 3 121 Крихкість Час дезінтеграції пігулки (%) (хв.:сек.) 0,11 00:14 0,04 00:21 0,007 00:35 Приклад 10 Таблиця 8 Композиція І Основа есциталопраму Il маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH101) V Primojel VI Стеарат магнію мг/пігулку 5,0 100,04 73,80 (Avicel 51,17 12,3 3,69 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) Primojel (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 9. 25 86536 Таблиця 9 Рівень тиску пресування 1 2 3 Твердість пігулки (Н) 64 85 103 Крихкість Час дезінтеграції пігулки (%) (хв.:сек.) 0,26 00:20 0,19 00:27 0,13 00:40 Приклад 11 Таблиця 10 Композиція І Основа есциталопраму II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза (Avicel PH101) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію мг/пігулку 5,0 100,04 73,80 12,3 3,69 Таблиця 11 Твердість пігулки (Н) 64 87 94 Крихкість Час дезінтеграції (хв.:сек) пігулки (%) 0,16 00:22 0,15 00:31 0,11 00:32 Приклад 12 Таблиця 12 Композиція І Основа есциталопраму II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH101) V Кросповідон (Kollidon CL) VI Стеарат магнію мг/пігулку 5,01 47,52 36,90 (Avicel Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 13. Таблиця 13 Рівень тиску пресування 1 2 3 Твердість пігулки (Н) 35 58 86 25,58 6,15 1,85 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) кросповідоном (Kollidon CL) (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,6 00:14 0,6 00:30 0,62 01:22 Приклад 13 Таблиця 14 51,17 (І) Основу есциталопраму і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 50°С і застосовують швидкість міксера 500об/хв Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 11. Рівень тиску пресування 1 2 3 26 Композиція мг/пігулку I Основа есциталопраму 5,02 II Кристалічний мальтитол (Maltisorb Ρ 90) 100,46 III маніт (Pearlitol SD 100) 36,00 IV Мікрокристалічна целюлоза (Avicel 25,02 PH102) V Натрій кроскармелоза (Ac-Di-Sol) 9,00 VI Стеарат магнію 4,5 (І) Основу есциталопраму і (II) кристалічний мальтитол (Maltisorb P90) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 15. Таблиця 15 Рівень тиску Твердість Крихкість Час дезінтеграції пресування пігулки (Н) пігулки (%) (хв.:сек) 1 24,6 Не виміряно 01:09 Приклад 14 Таблиця 16 Композиція мг/пігулку І Основа есциталопраму 5,02 II Кристалічний моногідрат декстрози SF 100,46 IIlMamT(PearlitolSDlOO) 36,00 IV Мікрокристалічна целюлоза (Avicel 25,02 PH102) V Натрій кроскармелоза (Ac-Di-Sol) 9,00 VI Стеарат магнію 4,5 (І) Основу есциталопраму і (II) кристалічний моногідрат декстрози SF (розмір частинок приблизно 50мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану 27 86536 суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 17. Таблиця 17 Рівень тиску Твердість пресування пігулки (Н) 1 30,5 Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,6 01:11 28 Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на три порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 21. Таблиця 21 Приклад 15 Таблиця 18 Композиція І Основа есциталопраму II Кристалічна лактоза III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза (Avicel PH102) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію мг/пігулку 5,02 100,46 36,00 9,00 4,5 Таблиця 19 Рівень тиску Твердість Крихкість Час дезінтеграції пресування пігулки (Н) пігулки (%) (хв.:сек) 1 33,5 0,5 00:37 2 41,7 0,5 00:34 Приклад 16 Таблиця 20 мг/пігулку 5,02 100,46 36,00 (Avicel Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,5 00:38 0,6 01:03 0,6 01:20 Приклад 17 25,02 (І) Основу есциталопраму і (II) кристалічну лактозу (Pharmatose 125 Μ. Розмір частинок приблизно 55мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на дві порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 19. Композиція І Основа есциталопраму II Кристалічна лактоза III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH102) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію Рівень тиску Твердість пресування пігулки (Н) 1 33,3 2 36,3 3 40,4 25,02 9,00 4,5 (І) Основу есциталопраму і (II) кристалічну лактозу (Pharmatose 110 Μ. Розмір частинок приблизно 105мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Таблиця 22 Композиція І Основа есциталопраму II Кристалічна лактоза III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH102) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію мг/пігулку 5,02 100,46 36,00 (Avicel 25,02 9,00 4,5 (І) Основу есциталопраму і (II) кристалічну лактозу (Pharmatose 90 Μ. Розмір частинок приблизно 135мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 23. Таблиця 23 Рівень тиску Твердість пресування пігулки (Н) 1 30,6 Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,8 00:53 Приклад 18 Таблиця 24 Композиція мг/пігулку І Основа есциталопраму 5,02 II Висушена розпилюванням лактоза 100,46 IIlMaHiT(PearlitolSDlOO) 36,00 IV Мікрокристалічна целюлоза (Avicel 25,02 PH102) V Натрій кроскармелоза (Ac-Di-Sol) 9,00 VI Стеарат магнію 4,5 29 86536 Приклад 19 30 Приклад 21 Таблиця 26 Композиція мг/пігулку І Основа есциталопраму 5,02 II Висушена розпилюванням лактоза 100,46 III маніт (Pearlitol SD 100) 36,00 IV Мікрокристалічна целюлоза (Avicel 25,02 PH102) V Натрій кроскармелоза (Ac-Di-Sol) 9,00 VI Стеарат магнію 4,5 (І) Основу есциталопраму і (II) висушену розпилюванням лактозу (Pharmatose DCL 14. Розмір частинок приблизно 110мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С і застосовують швидкість міксера 800об/хв. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) Ac-Di-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 27. Таблиця 30 Композиція І Основа есциталопраму ІІ маніт(РеагШо1160С) III маніт (Pearlitol 160C) IV Мікрокристалічна целюлоза PH102) V Кросповідон (Kollidon CL) VI Стеарат магнію мг/пігулку 4,99 99,84 36,40 (Avicel 25,30 9,10 6,37 (І) Основу есциталопраму і (II) маніт (Pearlitol 160C). Розмір частинок приблизно 160мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 65°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (Pearlitol 160C) (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) Кросповідоном (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 31. Таблиця 31 Таблиця 27 Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,8 01:01 Рівень тиску Твердість пресування пігулки (Н) 1 24,3 Рівень тиску пресування 1 Твердість Крихкість Час дезінтеграції пігулки (Н) пігулки (%) (хв.:сек) 24,1 0,7 00:18 Приклад 22 Приклад 20 Таблиця 32 Таблиця 28 Композиція І Фенофібрат II маніт (Pearlitol SD 100) III маніт (Pearlitol SD 100) IV Мікрокристалічна целюлоза PH102) V Натрій кроскармелоза (Ac-Di-Sol) VI Стеарат магнію мг/пігулку 5,02 100,46 36,00 (Avicel 25,02 9,00 4,5 Композиція І Основа есциталопраму II маніт (Pearlitol 300DC) III маніт (Pearlitol 300DC) IV Мікрокристалічна целюлоза PH102) V Кросповідон (Kollidon CL) VI Стеарат магнію мг/пігулку 4,99 99,84 36,40 (Avicel 25,30 9,10 6,37 (І) Фенофібрат і (II) маніт (Pearlitol SD 100) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 80°С. Одержану суміш змішують з (III) манітом (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH102) (екстрагранулярний наповнювач), (V) АсDi-Sol (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш розділяють на дві порції. Кожну порцію пресують в пігулки з використанням різного тиску пресування протягом процесу таблетування. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 29. (І) Основу есциталопраму і (II) маніт (Pearlitol 300DC. Розмір частинок приблизно 300мкм) піддають агломерації з використанням розплаву у високозсувному міксері. Температуру нагрівального кожуха підтримують при 65°С і застосовують швидкість міксера 500об/хв. Одержану суміш змішують з (III) манітом (Pearlitol 300DC) (екстрагранулярний наповнювач), (IV) мікрокристалічною целюлозою (Avicel PH101) (екстрагранулярний наповнювач), (V) Кросповідоном (дезінтегратор) і (VI) стеаратом магнію (змащувальна речовина). Суміш пресують в пігулки. Твердість пігулок, крихкість пігулок і час дезінтеграції наведені в Таблиці 33. Таблиця 29 Таблиця 33 Рівень тиску Твердість пресування пігулки (Н) 1 33,2 2 56,3 Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,6 00:28 0,7 00:30 Рівень тиску Твердість пресування пігулки (Н) 1 27 Крихкість Час дезінтеграції пігулки (%) (хв.:сек) 0,33 00:30 31 Комп’ютерна верстка Т. Чепелева 86536 Підписне 32 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;crystalline base of escitalopram and orodispersible tablets comprising escitalopram base
Автори англійськоюDancer Robert, Petersen Hans, Nielsen Ole, Rock Michael Harold, Eliasen Helle, Liljegren Ken
Назва патенту російськоюКристаллическая основа эсциталопрама и фармацевтическая композиция, которая содержит основу эсциталопрама
Автори російськоюДансер Роберт, Петерсен Ханс, Нильсен Оле, Рок Майкл Харольд, Элиасен Хелле, Лильегрен Кен
МПК / Мітки
МПК: C07D 307/87
Мітки: основа, основу, кристалічна, есциталопраму, фармацевтична, композиція, містить, яка
Код посилання
<a href="https://ua.patents.su/16-86536-kristalichna-osnova-escitalopramu-i-farmacevtichna-kompoziciya-yaka-mistit-osnovu-escitalopramu.html" target="_blank" rel="follow" title="База патентів України">Кристалічна основа есциталопраму і фармацевтична композиція, яка містить основу есциталопраму</a>
Попередній патент: Спосіб нагрівання виробів в паливній печі
Наступний патент: Система й спосіб керування тепловою енергією в будинку, обладнаному шахтою для ліфтових установок
Випадковий патент: Фільтрувальний елемент дискового фільтра












