Моноциклічні гетероцикли як інгібітори кінази
Номер патенту: 85087
Опубліковано: 25.12.2008
Автори: Кім Кьянг С., Шрьодер Гретхен М., Корнеліус Ліндон А.М., Борзіллєрі Роберт М., Шмідт Роберт Дж.
Формула / Реферат
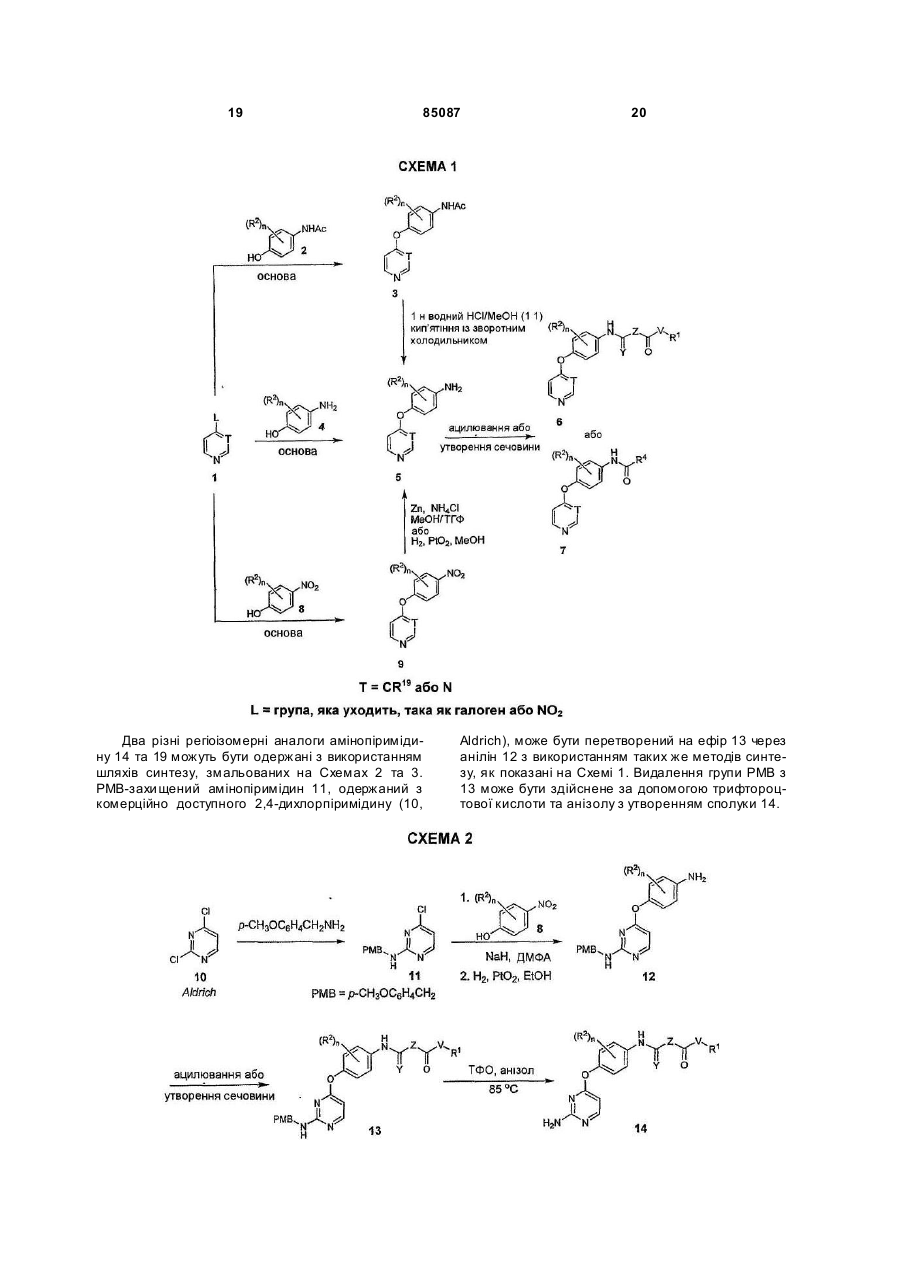
1. Сполука Формули І або Формули II:
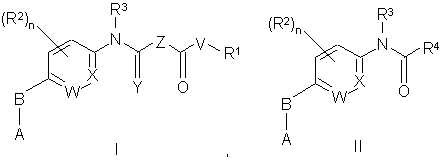
або її енантіомер, діастереомер, гідрат, сольват або фармацевтично прийнятна сіль, де:
R1 являє собою Н, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арилалкіл, заміщений арилалкіл, арил, заміщений арил, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероарилалкіл, заміщений гетероарилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл;
кожен R2 незалежно являє собою Н, галоген, ціано, NO2, OR5, NR6R7, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, арилалкіл, заміщений арилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл;
В являє собою О, NR8, NR8CH2, S, SO, SO2 або CR9R10;
V являє собою NR11 або -(CR37R38)p- за умови, що якщо VR11 являє собою N, R1 являє собою алкіл або циклоалкіл;
кожен з W та X незалежно являє собою С або N;
Y вибраний з О, S та NR12;
Z являє собою -CR13R14- або -(CR13R14)iNR15-;
i дорівнює цілому числу від 0 до 2;
n дорівнює цілому числу від 0 до 4, якщо W та X обидва являють собою С, від 0 до 3, якщо один з X або W являє собою N, та від 0 до 2, якщо X та W обидва являють собою N;
р дорівнює цілому числу від 1 до 4;
R3, R5, R6, R7, R8, R11 та R15 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло;
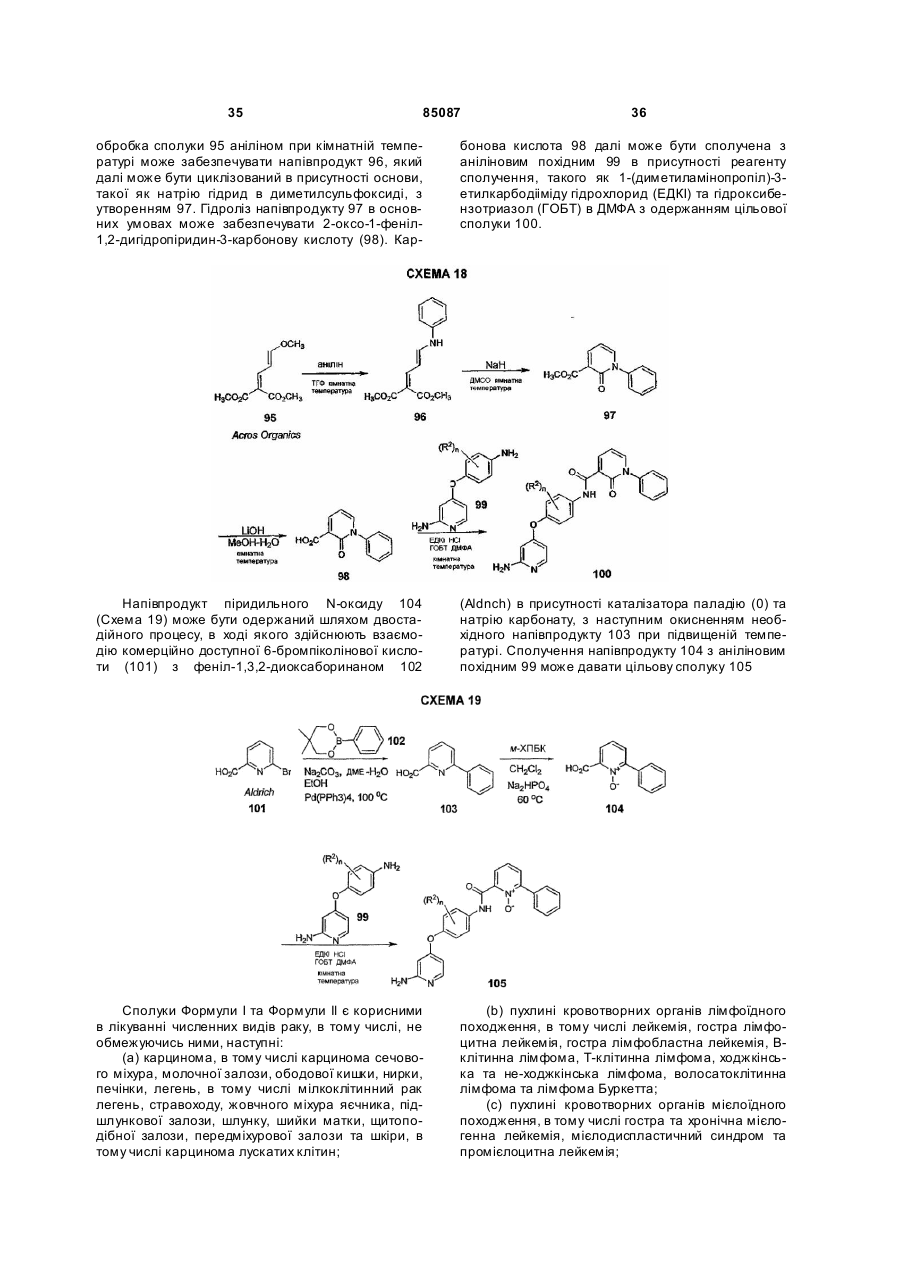
R4 вибраний з наступного: арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл та заміщений гетероциклоалкіл, за умови, що
(а) якщо R4 являє собою феніл;
(і) R4 не є заміщеним гідрокси та амідо; та
(іі) R4 не є заміщеним -NRSO2R-, де R являє собою алкіл або арил;
(b) якщо R4 являє собою піридил, R4 не є заміщеним гідрокси та метокси; та
(c) якщо R4 являє собою піримідиніл, він не є заміщеним =O;
R9 та R10 незалежно вибрані з наступного: Н, галоген, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл;
R12 вибраний з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, CN, NO2 або SO2NH2;
R13 та R14 незалежно вибрані з наступного: Н, галоген, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл, заміщений гетероциклоалкіл або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів;
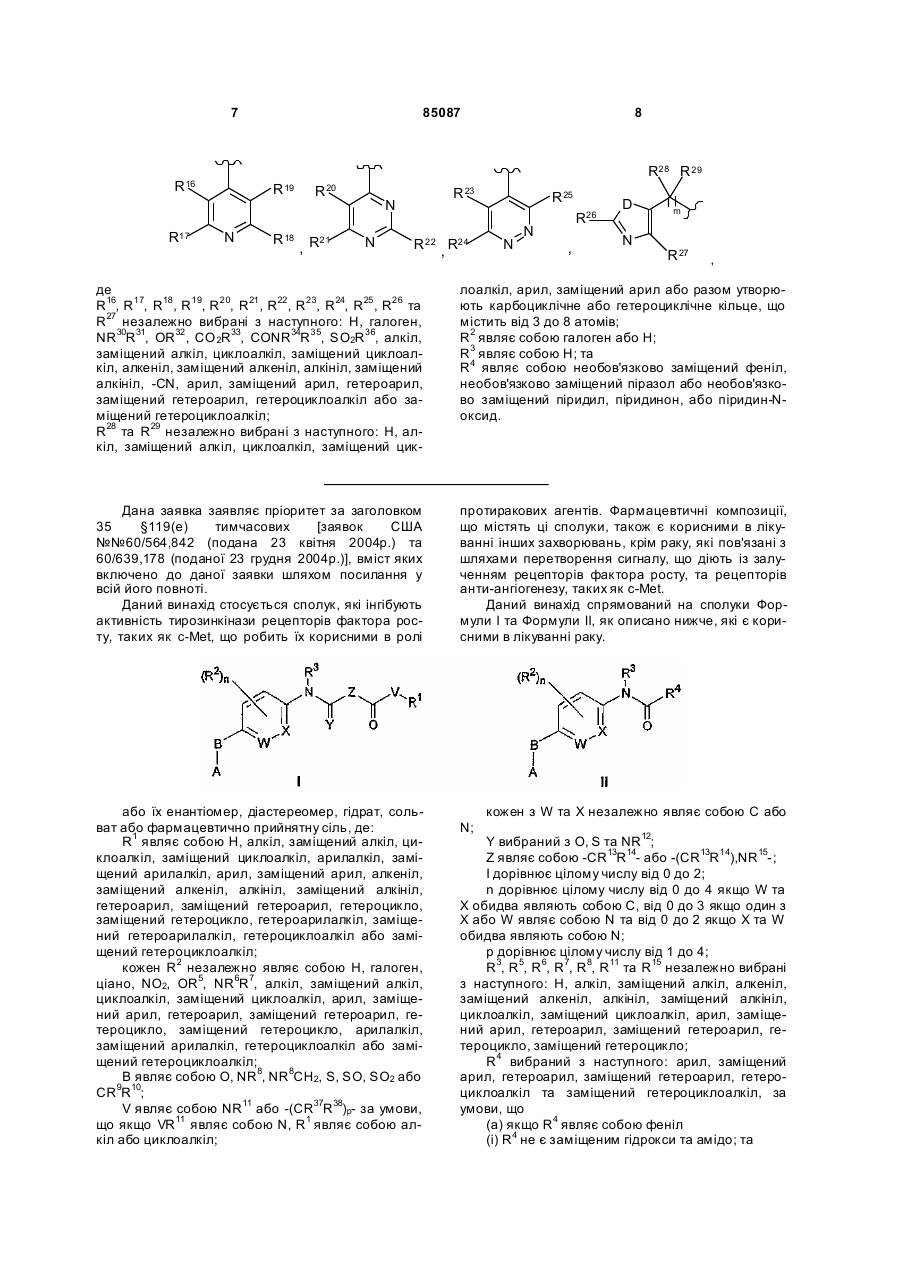
А вибраний як одне з наступного:
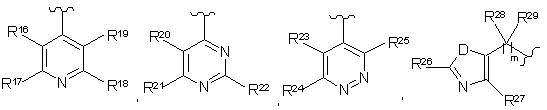 ,
,
де
D являє собою S абоО;
m дорівнює числу від 0 до 6;
R16, R17, R18, R19, R20, R21, R22, R23, R24, R25, R26 та R27 незалежно вибрані з наступного: Н, галоген, NR30R31, OR32, CO2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл;
R28 та R29 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів;
R30, R31, R32, R33, R34, R35 та R36 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, алкоксикарбоніл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероциклоалкіл або заміщений гетероциклоалкіл; та
кожен з R37 тa R38 незалежно являє собою Н, галоген або алкіл.
2. Сполука за п. 1, яка відрізняється тим, що R1 являє собою заміщений або незаміщений феніл, заміщений або незаміщений С1-С4 алкіл або заміщений або незаміщений С3-С8 циклоалкіл.
3. Сполука за п. 2, яка відрізняється тим, що R1 являє собою фторфеніл, заміщений метил, циклогексил або циклопентил.
4. Сполука за п. 1, яка відрізняється тим, що R2 являє собою С1-С4 алкіл, галоген або галогеналкіл.
5. Сполука за п. 1, яка відрізняється тим, що R4 являє собою необов'язково заміщений феніл, піридинон, піридил, піридил-N-оксид, піразоліл або піролідил.
6. Сполука за п. 5, яка відрізняється тим, що R4 заміщений киснем, фенілом, С1-С4 алкілом або галогеном.
7. Сполука за п. 1, яка відрізняється тим, що В являє собою О, NHCH2, CH2 або СН(ОН); Y являє собою О або S та Z являє собою -CR13R14 або -NR15, де R13, кожен з R14 та R15 являє собою Н.
8. Сполука за п. 1, яка відрізняється тим, що А являє собою необов'язково заміщений піридин або піримідин.
9. Сполука за п. 8, яка відрізняється тим, що замісник являє собою алкіл, алкеніл, алкініл, галоген, циклоалкіл, гетероциклоалкіл, -NR39COR40, -NR39C(O)2R40, -NR41R42 або -C(O)NR43R44, де R39, R40, R41, R42, R43 та R44 незалежно являють собою Н, нижчий алкіл, заміщений нижчий алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл, заміщений циклоалкіл, гетероциклоалкіл, заміщений гетероциклоалкіл, циклоалкеніл, заміщений циклоалкеніл, арил, заміщений арил, гетероарил, заміщений гетероарил або -NR43R44 утворюють гетероциклоалкіл.
10. Сполука за п. 7, яка відрізняється тим, що А являє собою піридин, заміщений -NR41R42, -NR39COR40, -C(O)NR43R44, галоген, С1-С4 алкіл, -C=C-R45, -С![]() С-R46, арил або гетероарил, де R45 та R46 являють собою алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл, гетероциклоалкіл, -C(O)R47, -NR39COR40, арил або гетероарил.
С-R46, арил або гетероарил, де R45 та R46 являють собою алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл, гетероциклоалкіл, -C(O)R47, -NR39COR40, арил або гетероарил.
11. Сполука за п. 10, яка відрізняється тим, що вказаний С1-С4 алкіл є заміщеним гідрокси, гідроксіалкіламіно, алкіламіно, аміноалкіламіно або гетероарил алкілом.
12. Сполука за п. 8, яка відрізняється тим, що кожен з R41 та R42 незалежно являє собою Н, метил, етил, пропіл, бутил, феніл або бензил та R39 являє собою Н та R40 являє собою метил, циклоалкіл або гетероциклоалкіл.
13. Сполука за п. 8, яка відрізняється тим, що R43 та R44 являють собою Н та кожен з R45 та R46 являє собою циклогексен, азетидин, піперазин, піперидин, піролідин або піридин, необов'язково заміщений С1-С4 алкілом, -CH2NH2, -NH2 або піролідином.
14. Сполука за п. 8, яка відрізняється тим, що піридин заміщений фенільною групою, яка необов'язково є заміщеною CONH2, метилом, аміноетилом, гідроксіетилом, -CONHCH2CH2NHCH або CH2CONH2; піридином або піперазином.
15. Сполука за п. 8, яка відрізняється тим, що А являє собою піримідин, заміщений with-NR41R42 або -NR39CO2R40.
16. Сполука за п. 15, яка відрізняється тим, що R41 та R42 являють собою Н або метил та R39 та R40 незалежно являють собою Н або алкіл.
17. Сполука за п. 1, яка відрізняється тим, що має Формулу III:
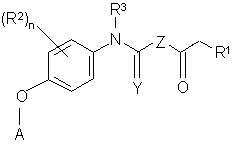 , III
, III
де
R1 являє собою необов'язково заміщений феніл або алкіл; Z являє собою NH або NCH3; R2 являє собою F, Сl, СН3 або CF3; R3 являє собою Н; та Y являє собою О або S.
18. Сполука за п. 17, яка відрізняється тим, що R1 являє собою С3-С7 циклоалкіл, заміщений або незаміщений феніл або -(CH2)n-R50, де n дорівнює цілому числу від 1 до 3, R50 являє собою Н, заміщений або незаміщений феніл, аміно, амідо, CN, -С(О)2Н або -С(О)2СН3.
19. Сполука за п. 1, яка відрізняється тим, що має Формулу IV:
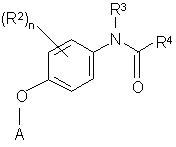 , IV
, IV
де
R2 являє собою галоген або Н; R3 являє собою Н; R4 являє собою необов'язково заміщений феніл, необов'язково заміщений піразол або необов'язково заміщений піридил; та А являє собою необов'язково заміщений піридил.
20. Сполука за п. 19, яка відрізняється тим, що R4 являє собою необов'язково заміщений піридинон або піридин-N-оксид.
21. Сполука за п. 1, яка відрізняється тим, що має Формулу V:
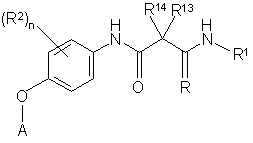 , V
, V
де
R1 являє собою необов'язково алкіл або циклоалкіл; А являє собою необов'язково заміщений піримідин або піридин; та R2 являє собою галоген або Н; та R13 та R14 або являють собою Н, або разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропіл.
22. Сполука за п. 1, яка відрізняється тим, що має значення ІС50 менше приблизно 1,0![]() М.
М.
23. Спосіб лікування раку у пацієнта, який потребує такого лікування, який відрізняється тим, що включає введення пацієнту терапевтично ефективної кількості сполуки за п. 1.
24. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну кількість сполуки за п. 1 та фармацевтично прийнятний носій.
25. Сполука Формули IV:
 , IV
, IV
де А є
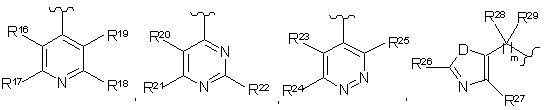 ,
,
де
R16, R17, R18, R19, R20, R21, R22, R23, R24, R25, R26 та R27 незалежно вибрані з наступного: Н, галоген, NR30R31, OR32, CO2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл;
R28 та R29 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів;
R2 являє собою галоген або Н;
R3 являє собою Н; та
R4 являє собою необов'язково заміщений феніл, необов'язково заміщений піразол або необов'язково заміщений піридил, піридинон, або піридин-N-оксид.
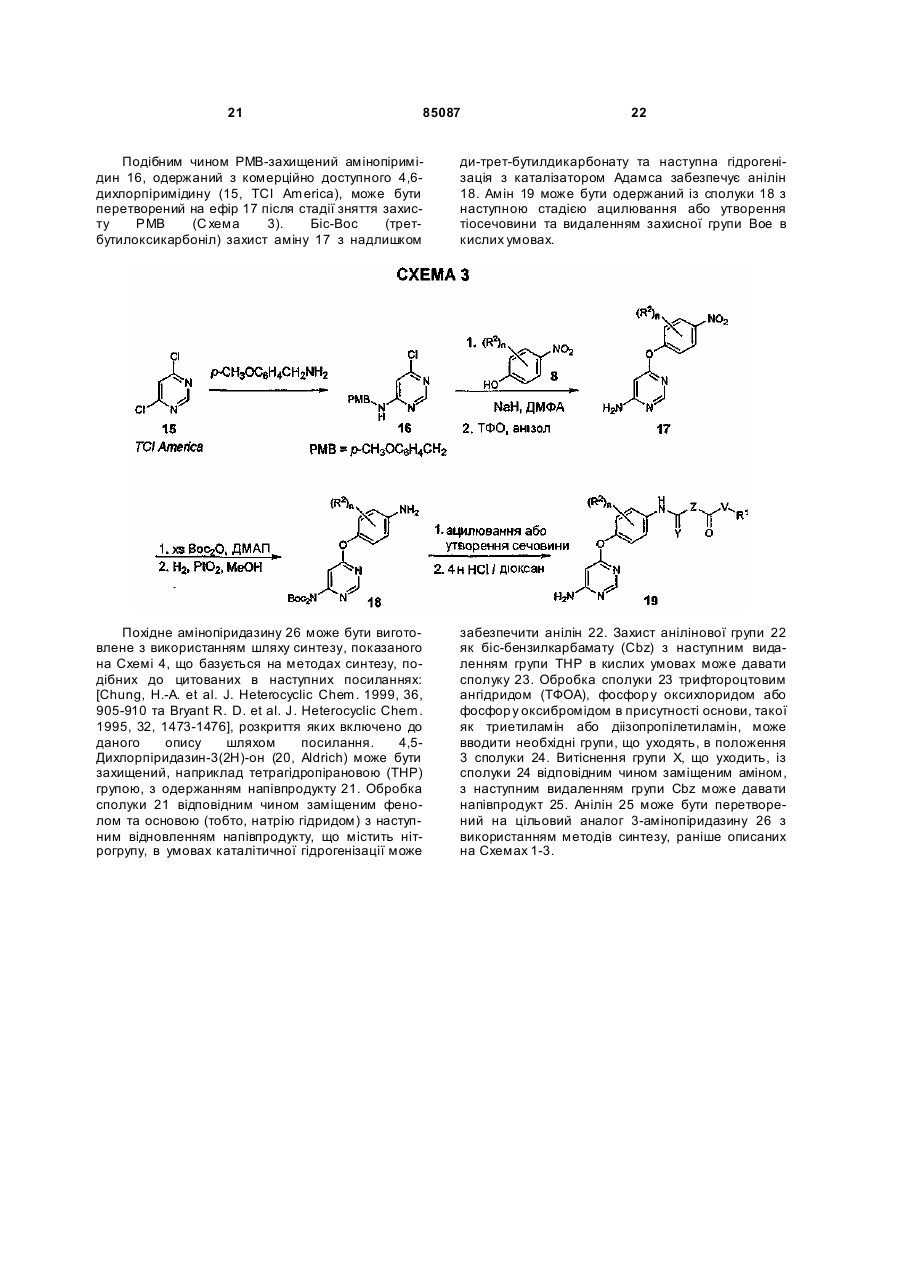
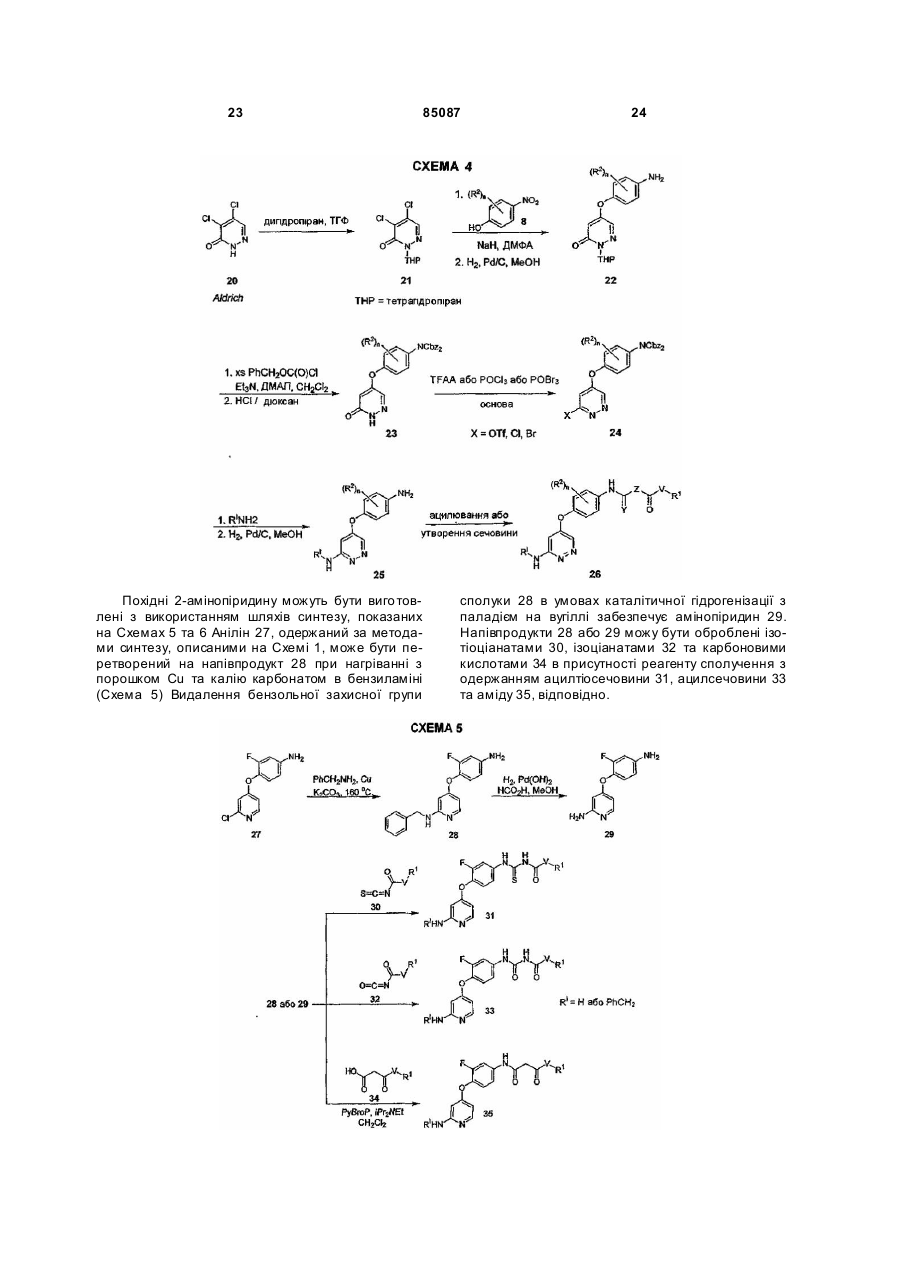
Текст
1. Сполука Формули І або Формули II: UA (21) a200612282 (22) 22.04.2005 (24) 25.12.2008 (86) PCT/US2005/014120, 22.04.2005 (31) 11/111,144 (32) 21.04.2005 (33) US (31) 60/564,842 (32) 23.04.2004 (33) US (31) 60/639,178 (32) 23.12.2004 (33) US (46) 25.12.2008, Бюл.№ 24, 2008 р. (72) БОРЗІЛЛЄРІ РОБЕРТ М., КОРНЕЛІУС ЛІНДОН А.М., ШМІДТ РОБЕРТ ДЖ., ШРЬОДЕР ГРЕТХЕН М., КІМ КЬЯНГ С. (73) БРІСТОЛ-МАЙЕРС СКВІББ КОМП АНІ (56) DATABASE CROSSFIRE BEILSTEIN BEILSTEIN INSTITUT ZUR FOERDERUNG DER CHEMISCHEN WISSENSCHAFT, FR ANKFURT AM MAIN, DE; XP002362294 Database accession no. BRN 66792 DATABASE CROSSFIRE BEILSTEIN BEILSTEIN INSTITUT ZUR FOERDERUNG DER CHEMISCHEN WISSENSCHAFT, FR ANKFURT AM MAIN, DE; XP002362295 Database accession no. BRN 413351 DATABASE CROSSFIRE BEILSTEIN BEILSTEIN INSTITUT ZUR FOERDERUNG DER CHEMISCHEN WISSENSCHAFT, FR ANKFURT AM MAIN, DE; XP002362296 Database accession no. BRN 450834 2 (19) 1 3 85087 В являє собою О, NR8, NR8CH2, S, SO, SO2 або CR9R10; V являє собою NR11 або -(CR37R38)P- за умови, що якщо VR11 являє собою N, R1 являє собою алкіл або циклоалкіл; кожен з W та X незалежно являє собою С або N; Y вибраний з О, S та NR12; Z являє собою -CR13R14- або -(CR13R14)iNR15-; i дорівнює цілому числу від 0 до 2; n дорівнює цілому числу від 0 до 4, якщо W та X обидва являють собою С, від 0 до 3, якщо один з X або W являє собою N, та від 0 до 2, якщо X та W обидва являють собою N; р дорівнює цілому числу від 1 до 4; R3, R5, R6, R7 , R8, R11 та R15 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло; R4 вибраний з наступного: арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл та заміщений гетероциклоалкіл, за умови, що (а) якщо R4 являє собою феніл; (і) R4 не є заміщеним гідрокси та амідо; та (іі) R4 не є заміщеним -NRSO2R-, де R являє собою алкіл або арил; (b) якщо R4 являє собою піридил, R4 не є заміщеним гідрокси та метокси; та (c) якщо R4 являє собою піримідиніл, він не є заміщеним =O; R9 та R10 незалежно вибрані з наступного: Н, галоген, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R12 вибраний з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, CN, NO2 або SO2NH2; R13 та R14 незалежно вибрані з наступного: Н, галоген, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл, заміщений гетероциклоалкіл або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; А вибраний як одне з наступного: R28 R29 R16 R17 4 R19 N R18 R20 ,R 21 R23 N N R22 R24 де D являє собою S або О; m дорівнює числу від 0 до 6; R16, R17, R18 , R19, R20, R21 , R22 , R23, R24, R25 , R26 та R27 незалежно вибрані з наступного: Н, галоген, NR30R31, OR32 , CO 2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R28 та R29 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; R30, R31, R32, R33, R34, R35 та R36 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, алкоксикарбоніл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероциклоалкіл або заміщений гетероциклоалкіл; та кожен з R37 тa R38 незалежно являє собою Н, галоген або алкіл. 2. Сполука за п. 1, яка відрізняється тим, що R1 являє собою заміщений або незаміщений феніл, заміщений або незаміщений С 1-С4 алкіл або заміщений або незаміщений С 3-С8 циклоалкіл. , R25 N N R26 , D N Im R27 , 3. Сполука за п. 2, яка відрізняється тим, що R1 являє собою фторфеніл, заміщений метил, циклогексил або циклопентил. 4. Сполука за п. 1, яка відрізняється тим, що R2 являє собою С 1-С4 алкіл, галоген або галогеналкіл. 5. Сполука за п. 1, яка відрізняється тим, що R4 являє собою необов'язково заміщений феніл, піридинон, піридил, піридил-N-оксид, піразоліл або піролідил. 6. Сполука за п. 5, яка відрізняється тим, що R4 заміщений киснем, фенілом, С1-С4 алкілом або галогеном. 7. Сполука за п. 1, яка відрізняє ться тим, що В являє собою О, NHCH2, CH2 або СН(ОН); Y являє собою О або S та Z являє собою -CR13R14 або NR15, де R13, кожен з R14 та R15 являє собою Н. 8. Сполука за п. 1, яка відрізняє ться тим, що А являє собою необов'язково заміщений піридин або піримідин. 9. Сполука за п. 8, яка відрізняється тим, що замісник являє собою алкіл, алкеніл, алкініл, галоген, циклоалкіл, гетероциклоалкіл, -NR39COR40, NR39C(O)2R40 , -NR41R42 або -C(O)NR43R44 , де R39, R40, R41, R 42, R43 та R44 незалежно являють собою Н, нижчий алкіл, заміщений нижчий алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл, заміщений циклоалкіл, гетероциклоалкіл, заміщений гетероциклоалкіл, циклоалкеніл, заміщений циклоалкеніл, арил, заміщений арил, гетероарил, заміщений гетероарил або -NR43R44 утворюють гетероциклоалкіл. 10. Сполука за п. 7, яка відрізняється тим, що А являє собою піридин, заміщений -NR41R42, 5 85087 NR39COR40, -C(O)NR43R44, галоген, С1-С4 алкіл, C=C-R 45, -С º С-R46, арил або гетероарил, де R45 та R46 являють собою алкіл, гідроксіалкіл, аміноалкіл, циклоалкіл, гетероциклоалкіл, -C(O)R47, NR39COR40, арил або гетероарил. 11. Сполука за п. 10, яка відрізняється тим, що вказаний С 1-С4 алкіл є заміщеним гідрокси, гідроксіалкіламіно, алкіламіно, аміноалкіламіно або гетероарил алкілом. 12. Сполука за п. 8, яка відрізняється тим, що кожен з R41 та R42 незалежно являє собою Н, метил, етил, пропіл, бутил, феніл або бензил та R39 являє собою Н та R40 являє собою метил, циклоалкіл або гетероциклоалкіл. 13. Сполука за п. 8, яка відрізняється тим, що R43 та R44 являють собою Н та кожен з R45 та R46 являє собою циклогексен, азетидин, піперазин, піперидин, піролідин або піридин, необов'язково заміщений С1-С4 алкілом, -CH2NH2, -NH2 або піролідином. 14. Сполука за п. 8, яка відрізняється тим, що піридин заміщений фенільною групою, яка необов'язково є заміщеною CONH2, метилом, аміноетилом, гідроксіетилом, -CONHCH 2CH2NHCH або CH2CONH2; піридином або піперазином. 15. Сполука за п. 8, яка відрізняється тим, що А являє собою піримідин, заміщений with-NR41R42 або -NR39CO2R40. 16. Сполука за п. 15, яка відрізняється тим, що R41 та R42 являють собою Н або метил та R39 та R40 незалежно являють собою Н або алкіл. 17. Сполука за п. 1, яка відрізняється тим, що має Формулу III: (R2 )n O R3 N Z Y R1 O A , III де R1 являє собою необов'язково заміщений феніл або алкіл; Z являє собою NH або NCH3; R2 являє собою F, Сl, СН3 або CF3; R3 являє собою Н; та Y являє собою О або S. 18. Сполука за п. 17, яка відрізняється тим, що R1 являє собою С 3-С7 циклоалкіл, заміщений або незаміщений феніл або -(CH2)n-R50, де n дорівнює цілому числу від 1 до 3, R50 являє собою Н, заміщений або незаміщений феніл, аміно, амідо, CN, С(О)2Н або -С(О)2СН3. 19. Сполука за п. 1, яка відрізняється тим, що має Формулу IV: 6 (R2)n R3 N R4 O O A , IV де R2 являє собою галоген або Н; R3 являє собою Н; R4 являє собою необов'язково заміщений феніл, необов'язково заміщений піразол або необов'язково заміщений піридил; та А являє собою необов'язково заміщений піридил. 20. Сполука за п. 19, яка відрізняється тим, що R4 являє собою необов'язково заміщений піридинон або піридин-N-оксид. 21. Сполука за п. 1, яка відрізняється тим, що має Формулу V: (R2)n R14 R13 H N O O H N R1 R A ,V де R1 являє собою необов'язково алкіл або циклоалкіл; А являє собою необов'язково заміщений піримідин або піридин; та R2 являє собою галоген або Н; та R13 та R14 або являють собою Н, або разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропіл. 22. Сполука за п. 1, яка відрізняється тим, що має значення ІС 50 менше приблизно 1,0 m М. 23. Спосіб лікування раку у пацієнта, який потребує такого лікування, який відрізняється тим, що включає введення пацієнту терапевтично ефективної кількості сполуки за п. 1. 24. Фармацевтична композиція, яка відрізняється тим, що містить терапевтично ефективну кількість сполуки за п. 1 та фармацевтично прийнятний носій. 25. Сполука Формули IV: (R2)n O A де А є R3 N R4 O , IV 7 8 R28 R 29 R 16 R17 85087 R 19 N R 18 R 20 21 ,R R 23 N N R 22 , R24 R 25 N N R26 , D N Im R 27 , де R16, R17, R18 , R19, R20, R21 , R22 , R23, R24, R25 , R26 та R27 незалежно вибрані з наступного: Н, галоген, NR30R31, OR32 , CO 2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R28 та R29 незалежно вибрані з наступного: Н, алкіл, заміщений алкіл, циклоалкіл, заміщений цик лоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; R2 являє собою галоген або Н; R3 являє собою Н; та R4 являє собою необов'язково заміщений феніл, необов'язково заміщений піразол або необов'язково заміщений піридил, піридинон, або піридин-Nоксид. Дана заявка заявляє пріоритет за заголовком 35 §119(е) тимчасових [заявок США №№60/564,842 (подана 23 квітня 2004р.) та 60/639,178 (поданої 23 грудня 2004p.)], вміст яких включено до даної заявки шляхом посилання у всій його повноті. Даний винахід стосується сполук, які інгібують активність тирозинкінази рецепторів фактора росту, таких як c-Met, що робить їх корисними в ролі протиракових агентів. Фармацевтичні композиції, що містять ці сполуки, також є корисними в лікуванні інших захворювань, крім раку, які пов'язані з шляхами перетворення сигналу, що діють із залученням рецепторів фактора росту, та рецепторів анти-ангіогенезу, таких як c-Met. Даний винахід спрямований на сполуки Формули І та Формули II, як описано нижче, які є корисними в лікуванні раку. або їх енантіомер, діастереомер, гідрат, сольват або фармацевтично прийнятну сіль, де: R1 являє собою H, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арилалкіл, заміщений арилалкіл, арил, заміщений арил, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероарилалкіл, заміщений гетероарилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл; кожен R2 незалежно являє собою H, галоген, ціано, NO2, OR5, NR6R7, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, арилалкіл, заміщений арилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл; В являє собою O, NR8, NR8CH2, S, SO, SO2 або 9 10 CR R ; V являє собою NR11 або -(CR37R38)p- за умови, що якщо VR11 являє собою N, R1 являє собою алкіл або циклоалкіл; кожен з W та X незалежно являє собою C або N; Y вибраний з O, S та NR12; Z являє собою -CR13R14- або -(CR13R14),NR15-; І дорівнює цілому числу від 0 до 2; n дорівнює цілому числу від 0 до 4 якщо W та X обидва являють собою C, від 0 до 3 якщо один з X або W являє собою N та від 0 до 2 якщо X та W обидва являють собою N; p дорівнює цілому числу від 1 до 4; R3, R5, R6, R7, R8, R11 та R15 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло; R4 вибраний з наступного: арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл та заміщений гетероциклоалкіл, за умови, що (a) якщо R4 являє собою феніл (і) R4 не є заміщеним гідрокси та амідо; та 9 85087 10 (іі) R4 не є заміщеним -NRSO2R- де R являє собою алкіл або арил; (b) якщо R4 являє собою піридил, R4 не є заміщеним гідрокси та метокси; та (c) якщо R4 являє собою піримідиніл, він не є заміщеним =O; R9 та R10 незалежно вибрані з наступного: H, галоген, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R12 вибраний з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, CN, NO2 або SO2NH2; R13 та R14 незалежно вибрані з наступного: H, галоген, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл, заміщений гетероциклоалкіл або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; А вибраний як одне з наступного:: де D являє собою S або O; m дорівнює числу від 0 до 6; R16, R17 , R18, R19, R20 , R21, R22, R23, R24 , R25, R26 та R27 незалежно вибрані з наступного: H, галоген, NR30R31, OR32 , CO 2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R28 та R29 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; R30, R31 , R32 , R33, R34, R35 та R36 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, алкоксикарбоніл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероциклоалкіл або заміщений гетероциклоалкіл; та кожен з R37 тa R38 незалежно являє собою H, галоген або алкіл. Даний винахід забезпечує сполуки Формули І та Формули II, визначені вище, фармацевтичні композиції з вмістом таких сполук, а також способи застосування таких сполук в лікуванні раку. Термін "алкіл" в даному описі, окремо або як частина іншої групи, означає радикал моновалентного алкану (вуглеводень), що містить від 1 до 12 атомів вуглецю, якщо не вказано інше. Переважні алкільні групи являють собою нижчі алкільні групи, які містять від 1 до 6 атомів вуглецю. Алкільна група являє собою необов'язково заміщену нерозгалужену, розгалужену або циклічну насичену вуглеводневу груп у. Алкільна група може бути заміщеною в будь-якій доступній точці приєднання. Алкільна група, заміщена іншою алкільною групою, також має назву "розгалуженої алкільної групи". Приклади алкільних гр уп включають метил, етил, пропіл, ізопропіл, н-бутил, трет-бутил, ізо-бутил, пентил, гексил, ізогексил, гептил, 4,4 диметилпентил, октил, 2,2,4-триметилпентил, ноніл, децил, ундецил, додецил, і т. п. Приклади замісників включають, не обмежуючись ними, одну або більше з наступних гр уп: алкіл, циклоалкіл, гетероциклоалкіл, -CN, арил, гетероарил, галоген (такий як F, Cl, Br, І), галоалкіл (такий як CCI3 або CF3), гідроксил, алкокси, алкілтю, алкіламіно, COOH, -COOR, -C(O)R, -OCOR 5 аміно, карбамоїл (-NHCOORабо -OCONHR-), сечовина (NHCONHR-) або тіол (-SH). Термін "алкеніл" в даному описі, окремо або як частина іншої групи, означає вуглеводневий радикал, нерозгалужений, розгалужений або циклічний, що містить від 2 до 12 атомів вуглецю та щонайменше один вуглець-вуглецевий подвійний зв'язок. Алкенільна група також може бути заміщеною в будь-якій доступній точці приєднання. Приклади замісників для алкенільної групи включають замісники, наведені вище для алкільної групи. Числа в нижньому індексі після символу "C" позначають кількість атомів вуглецю, яку може містити конкретна група. Наприклад "C1-6алкіл" означає нерозгалужений або розгалужений насичений вуглецевий ланцюг, який містить від 1 до 6 атомів вуглецю; приклади включають метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізо-бутил, трет-бутил, н-пентил, втор-пентил, ізо-пентил та нгексил. В залежності від контексту, "C1-6алкіл" також може означати С 1-6алкілен, який з'єднує дві групи; приклади включають пропан-1,3-дііл, бутан1,4-дііл, 2-метил-бутан-1,4-дііл, тощо. "С2-6алкеніл" означає нерозгалужений або розгалужений вуглецевий ланцюг, який містить щонайменше один вуглець-вуглецевий подвійний зв'язок та включає від 2 до б атомів вуглецю; приклади включають епотиміл, пропеніл, ізопропеніл, бутеніл, ізобутеніл, пентеніл та гексеніл. В залежності від контексту, "С2-6алкеніл" також може означати С 26алкендііл, який з'єднує дві групи; приклади включають етилен-1,2-дііл (вінілен), 2-метил-2-бутен1,4-дііл, 2-гексен-1,6-дііл, тощо. "С2-6алкініл" означає нерозгалужений або розгалужений вуглецевий ланцюг, який містить щонайменше один вуглецьвуглецевий потрійний зв'язок та від 2 до 6 атомів 11 85087 вуглецю; приклади включають етиніл, пропініл, бутиніл та гексиніл. Термін "циклоалкіл" в даному описі, окремо або як частина іншої групи, являє собою вид алкілу, що містить від 3 до 15 атомів вуглецю, без чергування або утворення ароматичної системи подвійних зв'язків між атомами вуглецю. Він може містити від 1 до 4 кілець. Приклади груп включають циклопропіл, циклобутил, циклопентил, циклогексил, адамантил, тощо. Циклоалкільна група може бути заміщена в будь-якій доступній точці приєднання. Приклади замісників включають одну або більше з наступних гр уп: галоген, такий як F, Br або Cl, гідроксил, алкіл, алкокси, аміно, нітро, ціано, тіол, алкілтіо будь-який із замісників, описаних ви ще для алкільної групи. Терміни "алкокси" або "алкілтіо" в даному описі, окремо або як частина іншої групи, означають апкільну групу, як описано вище, зв'язану через кисневий зв'язок (-O-) або сірчаний зв'язок (-S-), відповідно. Термін "алкілоксикарбоніл" в даному описі, окремо або як частина іншої групи, позначає алкоксильну груп у зв'язану через карбонільну гр упу. Алкоксикарбонільний радикал представлений формулою: -C(O)OR, де група R являє собою нерозгалужену або розгалужену С 1-6алкільну груп у, циклоалкіл, арил або гетероарил. Термін "алкілкарбоніл" в даному описі, окремо або як частина іншої групи, означає алкільну гр упу, зв'язану через карбонільну гр упу. Термін "алкілкарбонілокси" в даному описі, окремо або як частина іншої групи, позначає алкілкарбонільну гр упу, зв'язану через кисневий зв'язок. Термін "арил" в даному описі, окремо або як частина іншої групи, означає моноциклічні або біциклічні ароматичні кільця, наприклад феніл, заміщений феніл і т. п, а також злиті групи, наприклад, нафтил, фенантреніл і т.п. Арильна група, таким чином, включає щонайменше одне кільце, яке включає щонайменше 6 атомів, причому присутні до 5 таких кілець, що містять до 22 атомів, з чергуванням (утворенням ароматичної системи) подвійних зв'язків між суміжними атомами вуглецю або придатними гетероатомами. Арильні групи можуть бути необов'язково заміщені однією або більше групами, в тому числі, не обмежуючись ними, галоген, алкіл, алкокси, гідрокси, карбокси, карбамоїл, алкілоксикарбоніл, нітро, алкенілокси, трифторметил, аміно, циклоалкіл, арил, гетероарил, ціано, алкіл S(O)m(m=0, 1,2) або тіол. Термін "арилалкіл" або "аралкіл" в даному описі, окремо або як частина іншої групи, позначає арильну групу, як описано вище, зв'язану через алкільну груп у, як описано вище. Прикладом аралкільної групи є бензильна група. Термін "аміно" в даному описі, окремо або як частина іншої групи, означає -NH2. "Аміно" може бути необов'язково заміщений одним або двома замісниками, які можуть бути однаковими або різними, такими як алкіл, арил, арилалкіл, алкеніл, алкініл, гетероарил, гетероарилалкіл, циклогетероалкіл, циклогетероалкілалкіл, циклоалкіл, циклоалкілалкіл, галоалкіл, гідроксиалкіл, алкоксиал 12 кіл, тіоалкіл. карбоніл або карбоксил. Вказані замісники можуть бути додатково заміщені карбоновою кислотою, будь-яким з алкільних або арильних замісників, наведених в даному описі. В деяких втіленнях аміногрупи заміщені карбоксилом або карбонілом з утворенням N-ацильних або Nкарбамоїльних похідних. Термін "гетероарил" в даному описі, окремо або як частина іншої групи, означає заміщену та незаміщену ароматичну 5- або б-членну моноциклічну груп у, 9- або 10-членну біциклічну групу та 11-14-членну трициклічну групу, яка включає щонайменше один гетероатом (O, S або N) в щонайменше одному з кілець. Кожне кільце гетероарильної групи, що містить гетероатом, може містити один або два атоми кисню або сірки та/або від одного до чотирьох атомів азоту, за умови, що загальна кількість гетероатомів в кожному кільці являє собою чотири або менше та кожне кільце містить щонайменше один атом вуглецю. Злиті кільця, що утворюють біциклічні та трициклічні групи, можуть містити тільки атоми вуглецю та можуть бути насиченим, частково насиченими або ненасиченими. Атоми азоту та сірки можуть бути необов'язково окиснені та атоми азоту можуть бути необов'язково кватернізовані. Гетероарильні групи, які є біциклічними або трициклічними, повинні включати щонайменше одне повністю ароматичне кільце, але інше злите кільце або кільця можуть бути ароматичними або неароматичними. Гетероарильна група може бути приєднана за будь-яким доступним атомом азоту або вуглецю в будь-якому кільці. Система гетероарильного кільця може містити нуль, один, два або три замісники, вибраних з гр упи, що складається з наступного: галоген, алкіл, заміщений алкіл, алкеніл, алкініл, арил, нітро, ціано, гідрокси, алкокси, тіоалкіл, =О, CO2H, -С(=О)Н, -СО2-алкіл, -С(=О)алкіл, феніл, бензил, фенілетил, фенілокси, фенілтіо, циклоалкіл, заміщений циклоалкіл, гетероцикло, гетероарил, -NR'R", -C(=O)NR'R", -CO2NR1R", 1 C(=O)NR'R", -NR CO2R", -NR'C(=О)R", -SO2NR1R", тa -NR'SO2R", де кожен з R' та R" незалежно вибраний з водню, алкілу, заміщеного алкілу та циклоалкілу, або R' та R" разом утворюють героциклічне або гетероарильне кільце. Приклади моноциклічних гетероарильних груп включають піроліл, піразоліл, піразолініл, імідазоліл, оксазоліл, діазоліл, ізоксазоліл, тіазоліл, тіадіазоліл, ізотіазоліл, фураніл, тієніл, оксадіазоліл, піридил, піразиніл, піримідиніл, піридазиніл, триазиніл і т. п. Приклади біциклічне гетероарильних груп включають індоліл, бензотіазоліл, бензодіоксоліл, бензоксазоліл, бензотієніл, хінолініл, тетрагідроізохінолініл, ізохінолініл, бензімідазоліл, бензопіраніл, індолізиніл, бензофураніл, хромоніл, кумариніл, бензопіраніл, цинолініл, хіноксалініл, індазоліл, піролпіридил, фуропіридиніл, дигідроізоіндоліл, тетрагідрохінолініл і т. п. Приклади трициклічних гетероарильних груп включають карбазоліл, бензіндоліл, фенантролініл, акридиніл, фенантридиніл, ксантеніл і т. п. Термін "гетероциклічне кільце" в даному описі, окремо або як частина іншої групи, означає стабі 13 85087 льну, насичену або частково ненасичену моноциклічну кільцеву систему, що містить в кільці від 5 до 7 атомів вуглецю та інши х атомів, вибраних з числа азоту, сірки та/або кисню. Переважно, гетероциклічне кільце являє собою 5- або 6-членне моноциклічне кільце та містить один, два або три гетероатоми, вибраних з числа азоту, сірки та/або кисню. Гетероциклічне кільце може бути необов'язково заміщеним; це означає, що гетероциклічне кільце може бути заміщене за одним або більше положеннями кільця, що піддаються заміщенню, однією або більше груп, незалежно вибраних з наступного: алкіл (переважно нижчий алкіл), алкокси (переважно нижчий алкокси), нітро, моноалкіламіно (переважно нижчий алкіламіно), діалкіламіно (переважно ди[нижчий]алкіламіно), ціано, галоген, галоалкіл (переважно трифторметил), алканоїл, амінокарбоніл, моноалкіламінокарбоніл, діалкіламінокарбоніл, алкіламідо (переважно нижчий алкіламідо), алкоксиалкіл (переважно нижчий алкокси [нижчий] алкіл), алкоксикарбоніл (переважно нижчий алкоксикарбоніл), алкілкарбонілокси (переважно нижчий алкілкарбонілокси) та арил (переважно феніл), вказаний арил необов'язково заміщений галогеном, нижчою алкільною та нижчою алкоксильною групою. Приклади таких гетероциклічних кілець являють собою ізоксазоліл, імідазолініл, тіазолініл, імідазолідиніл, піроліл, піролініл, піраніл, піразиніл, піперидил, морфолініл і триазоліл. Гетероциклічне кільце може бути приєднане до вихідної структури через атом вуглецю або через будь-який гетеро або їх енантіомер, діастереомер, гідрат, сольват або фармацевтично прийнятну сіль, де: R1 являє собою H, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арилалкіл, заміщений арилалкіл, арил, заміщений арил, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероарилалкіл, заміщений гетероарилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл; кожен R2 незалежно являє собою H, галоген, ціано, NO2, OR5, NR6R7, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, арилалкіл, заміщений арилалкіл, гетероциклоалкіл або заміщений гетероциклоалкіл; В являє собою O, NR8, NR8CH2, S, SO, SO2 або CR9R10; V являє собою NR11 або -(CR37R38)р- за умови, що якщо V являє собою N, R1 являє собою алкіл або циклоалкіл; 14 атом гетероциклілу, що приводить до утворення стабільної структури. Термін "гетероатом" означає O, S або N, вибраний незалежно. Слід відзначити, що для будьякого гетероатому з незайнятими валентностями мається на увазі водень, який бере на себе такі валентності. Термін "галоген" або "гало" означає хлор, бром, фтор або йод, вибраний незалежно. Якщо функціональні групи називаються "захи щеними", це означає, що гр упа знаходиться в модифікованій формі для запобігання небажаним побічним реакціям в захищеному положенні. Придатні захисні групи для сполук за даним винаходом будуть зрозумілими з даної заявки з урахуванням рівня фахівця и даній галузі та стандартних монографій, таких як [Greene, T.W. et al, Protective Groups in Organic Synthesis, Wiley, N. Y. (1991)]. В даному описі термін "пацієнт" включає всі види ссавців. Придатні приклади солей сполук у відповідності до винаходу з неорганічними або органічними кислотами являють собою гідрохлорид, гідробромід, сульфат, метансульфонат, малеат, фумарат та фосфат. Існуючі солі, які є непридатними для фармацевтичний цілей, але які можуть бути використані, наприклад, для виділення або очищення вільної сполуки І або II, їх фармацевтично прийнятні солі, також включені. В цілому, даний винахід включає сполуки Формули І або II: кожен з W та X незалежно являє собою C або N; Y вибраний з O, S та NR12; Z являє собою -CR13R14- або -(CR13R14),NR15-; І дорівнює цілому числу від 0 до 2; n дорівнює цілому числу від 0 до 4 якщо W та X обидва являють собою C, від 0 до 3 якщо один з X або W являє собою N та від 0 до 2 якщо X та W обидва являють собою N; р дорівнює цілому числу 1 до 4; R3, R5, R6, R7, R8, R11 та R15 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло; R4 вибраний з наступного: арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл та заміщений гетероциклоалкіл, за умови, що (a) якщо R4 являє собою феніл (і) R4 не є заміщеним гідрокси та амідо; та 15 85087 16 (іі) R4 не є заміщеним -NRSO2R- де R являє собою алкіл або арил; (b) якщо R4 являє собою піридил, R4 не є заміщеним гідрокси та метокси; та (c) якщо R4 являє собою піримідиніл, він не є заміщеним =0; R9 та R10 незалежно вибрані з наступного: H, галоген, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R12 вибраний з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, CN, NO2 або SO2NH2; R13 та R14 незалежно вибрані з наступного: H, галоген, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл, заміщений гетероциклоалкіл або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; А вибраний як одне з наступного:: де D являє собою S або O; m дорівнює цілому числу від O до 6; R16, R17 , R18, R19, R20 , R21, R22, R23, R24 , R25, R26 та R27 незалежно вибрані з наступного: H, галоген, NR30R31, OR32 , CO 2R33, CONR34R35, SO2R36, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, -CN, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероциклоалкіл або заміщений гетероциклоалкіл; R28 та R29 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, арил, заміщений арил або разом утворюють карбоциклічне або гетероциклічне кільце, що містить від 3 до 8 атомів; R30, R31 , R32 , R33, R34, R35 та R36 незалежно вибрані з наступного: H, алкіл, заміщений алкіл, алкеніл, заміщений алкеніл, алкініл, заміщений алкініл, циклоалкіл, заміщений циклоалкіл, алкоксикарбоніл, арил, заміщений арил, гетероарил, заміщений гетероарил, гетероцикло, заміщений гетероцикло, гетероциклоалкіл або заміщений гетероциклоалкіл; та кожен з R37Ta R38 незалежно являє собою H, галоген або алкіл. У деяких варіантах за даним винаходом, R1 являє собою заміщений або незаміщений феніл, такий як фторфеніл, заміщений або незаміщений C1-C4алкіл, такий як метил або заміщений або незаміщений C3-C8циклоалкіл, такий як циклогексил або циклопентил. В деяких варіантах за даним винаходом R2 являє собою C1-C4алкіл, галоген або галоалкіл. В деяких варіантах за даним винаходом R4 являє собою необов'язково заміщений феніл або 5- або 6-членну азотовмісну гетероарильну групу, таку як піридил, піридинон, піразоліл або піролідил. У відповідності до одного варіанту за даним винаходом В являє собою O, NHCH2, CH2 або CH(OH); Y являє собою O або S та Z являє собою -CR13R14 або -NR15 де R13, R14 та R15 кожен з являє собою H. В деяких варіантах за даним винаходом А являє собою необов'язково заміщений піридин або піримідин, де замісник являє собою алкіл, алкеніл, алкініл, галоген, циклоалкіл, гетероциклоалкіл, NR39COR40, -NR39C(O)2R40, -NR41R42 або C(O)NR43R44, де R39 , R40, R 41, R42 , R43 та R44 незалежно являють собою H, нижчий алкіл, заміщений нижчий алкіл, гідроксиалкіл, аміноалкіл, циклоалкіл, заміщений циклоалкіл, гетероциклоалкіл, заміщений гетероциклоалкіл, циклоалкеніл, заміщений циклоалкеніл, арил, заміщений арил, гетероарил, заміщений гетероарил або -NR43R44 утворюють циклоалкіл. У відповідності до деяких варіантів за даним винаходом А являє собою піридин, заміщений NR41R42, -NR39COR40, -C(O)NR43R44, галоген, C1C4алкіл, необов'язково заміщений гідрокси, гідроксиалкіламіно, алкіламіно, аміноалкіламіно або гетероарилалкілом; або -C=C-R45, -C=C-R 46, де R45 та R46 являють собою алкіл, гідроксиалкіл, аміноалкіл, циклоалкіл, гетероциклоалкіл, -C(O)R47, NR39COR40, арил або гетероарил; або піридин являє собою заміщений з арил, такий як феніл, який може бути додатково заміщений CONH2, метилом, аміноетилом, гідроксиетилом, CONHCH2CН2NHCH3, або CH2CONH2; піридини також може бути заміщені піридильною або піперидильною групою. У відповідності до деяких варіантів за даним винаходом А являє собою необов'язково заміщений піримідин. Переважні замісники включають NR41R42 або -NR39CO2R40, де R41 та R2 переважно являють собою H або метил та R39 та R40 переважно являють собою, H або алкіл. В одному варіанті за даним винаходом сполуки мають наступну Формулу III: де R1 являє собою необов'язково заміщений феніл або алкіл; Z являє собою NH або NCH3; R2 яв 17 85087 ляє собою F, Cl, CH3, або CF3; R3 являє собою H; та Y являє собою O або S. В деяких втіленнях R1 являє собою C3-C7циклоалкіл, заміщений або незаміщений феніл або -(CH2)n-R50 де n дорівнює цілому числу від 1 до 3, R50 являє собою H, заміщений або незаміщений феніл, аміно, амідо, CN, C(O)2H або -C(O)2CH3. В деяких варіантах за даним винаходом сполуки мають наступну Формулу IV: де R2 являє собою галоген або H; R3 являє собою H; R4 являє собою необов'язково заміщений феніл, необов'язково заміщений піразол або необов'язково заміщений піридил, піридинон або піридин-N-оксид. В одному варіанті за даним винаходом сполуки мають наступну Формулу V: де R1 необов'язково являє собою алкіл або циклоалкіл; А являє собою необов'язково заміщений піримідин або піридин; та R2 являє собою галоген або H; та R13 та R14 являють собою або H або разом з атомом вуглецю, до якого вони приєднані: утворюють циклоалкіл, такий як циклопропіл. Винахід також забезпечує способи лікування проліферативного захворювання, такого як рак, шляхом введення виду ссавця, який потребує такого лікування, ефективної кількості сполуки Формули І або Формули II, як визначено вище. В іншому втіленні винахід забезпечує спосіб лікування проліферативного захворювання шляхом модулювання кінази Met шля хом введення виду ссавця, 18 який потребує такого лікування, ефективної кількості сполуки Формул І або II, як визначено вище, в сполученні (одночасно або послідовно) з щонайменше одним іншим протираковим агентом. В переважному варіанті проліферативне захворювання являє собою рак. Деякі сполуки Формули І та Формули Il загалом можуть бути одержані у відповідності до наступних Схема 1-14. Сполуки легко синтезуються з використанням методів синтезу, відомих фахівцю в даній галузі. Сольвати (наприклад, гідрати) сполук Формули І та Формули Il також знаходяться в межах даного винаходу. Способи сольватації загалом відомі з рівня техніки. Відповідно, сполуки за даним винаходом можуть існувати у вільній або гідратованій формі та можуть бути одержані за способами, приклади яких наведені на схемах нижче. Загальні шляхи синтезу аналогів піридину та піримідину, описаних у винаході, проілюстровані на Схемі 1. Належним чином заміщений піридин або піримідин 1 може бути оброблений фенолами 2, 4 та 8, що містять функціональні групи, в присутності основи, такої як натрію гідрид, натрію гідроксид або калію карбонат, для одержання цільових ефірів 3, 5 та 9, відповідно. Видалення ацетамідної захисної групи сполуки 3 за допомогою водного HCI в метанолі забезпечує ключовий напівпродукт 5. Альтернативно, анілін 5 може бути одержаний із сполуки 9 шляхом відновлення нітрогрупи за допомогою цинкового пилу та амонію хлориду або каталізатора Адамса (платини (IV) оксид) в умовах гідрогенізації. Аналоги 6 та 7 далі можуть бути одержані шляхом ацилювання аніліну 5, наприклад, з використанням ізоціанатів, галогенангідридів кислот або шляхом обробки карбоновою кислотою та реагентом сполучення, таким як: бензотриазол-1ілокситрис(триметиламіно)фосфонію гексафторфосфа т (реагент BOP), бромтрипіролідинофосфонію гексафторфосфа т (РуВrоР), O-(1Нбензотриазол-1-іл)-N,N,N’,N’-тетраметилуронію тетрафторборат (ТБТУ). Утворення ацилтіосечовини 6 (Y=S, Z=NH) може бути здійснене шляхом обробки аніліну 5 відповідним чином заміщеним ізотіоціанатом. 19 85087 Два різні регіоізомерні аналоги амінопіримідину 14 та 19 можуть бути одержані з використанням шляхів синтезу, змальованих на Схемах 2 та 3. РМВ-захи щений амінопіримідин 11, одержаний з комерційно доступного 2,4-дихлорпіримідину (10, 20 Aldrich), може бути перетворений на ефір 13 через анілін 12 з використанням таких же методів синтезу, як показані на Схемі 1. Видалення групи PMB з 13 може бути здійснене за допомогою трифтороцтової кислоти та анізолу з утворенням сполуки 14. 21 85087 22 Подібним чином РМВ-захищений амінопіримідин 16, одержаний з комерційно доступного 4,6дихлорпіримідину (15, TCI America), може бути перетворений на ефір 17 після стадії зняття захисту PMB (С хема 3). Біс-Вос (третбутилоксикарбоніл) захист аміну 17 з надлишком ди-трет-бутилдикарбонату та наступна гідрогенізація з каталізатором Адамса забезпечує анілін 18. Амін 19 може бути одержаний із сполуки 18 з наступною стадією ацилювання або утворення тіосечовини та видаленням захисної групи Вое в кислих умовах. Похідне амінопіридазину 26 може бути виготовлене з використанням шляху синтезу, показаного на Схемі 4, що базується на методах синтезу, подібних до цитованих в наступних посиланнях: [Chung, H.-A. et al. J. Heterocyclic Chem. 1999, 36, 905-910 та Bryant R. D. et al. J. Heterocyclic Chem. 1995, 32, 1473-1476], розкриття яких включено до даного опису шляхом посилання. 4,5Дихлорпіридазин-3(2Н)-он (20, Aldrich) може бути захищений, наприклад тетрагідропірановою (THP) групою, з одержанням напівпродукту 21. Обробка сполуки 21 відповідним чином заміщеним фенолом та основою (тобто, натрію гідридом) з наступним відновленням напівпродукту, що містить нітрогрупу, в умовах каталітичної гідрогенізації може забезпечити анілін 22. Захист анілінової групи 22 як біс-бензилкарбамату (Cbz) з наступним видаленням групи THP в кислих умовах може давати сполуку 23. Обробка сполуки 23 трифтороцтовим ангідридом (ТФОА), фосфор у оксихлоридом або фосфор у оксибромідом в присутності основи, такої як триетиламін або діізопропілетиламін, може вводити необхідні групи, що уходять, в положення 3 сполуки 24. Витіснення групи X, що уходить, із сполуки 24 відповідним чином заміщеним аміном, з наступним видаленням групи Cbz може давати напівпродукт 25. Анілін 25 може бути перетворений на цільовий аналог 3-амінопіридазину 26 з використанням методів синтезу, раніше описаних на Схемах 1-3. 23 85087 Похідні 2-амінопіридину можуть бути виго товлені з використанням шляхів синтезу, показаних на Схемах 5 та 6 Анілін 27, одержаний за методами синтезу, описаними на Схемі 1, може бути перетворений на напівпродукт 28 при нагріванні з порошком Cu та калію карбонатом в бензиламіні (Схема 5) Видалення бензольної захисної групи 24 сполуки 28 в умовах каталітичної гідрогенізації з паладієм на вугіллі забезпечує амінопіридин 29. Напівпродукти 28 або 29 можу бути оброблені ізотіоціанатами 30, ізоціанатами 32 та карбоновими кислотами 34 в присутності реагенту сполучення з одержанням ацилтіосечовини 31, ацилсечовини 33 та аміду 35, відповідно. 25 85087 26 У спорідненому підході 2-хлорпіридиновий напівпродукт 36, одержаний з використанням методів синтезу, описаних на Схемі 1 може бути перетворений на N-оксид 37 з використанням 3хлорпероксибензойної кислоти (м-ХПБК) в хлороформі [див. WO2004/002410] (Схема 6). Обробка сполуки 37 відповідним чином заміщеним аміном може давати напівпродукт 38. Відновлення Nоксиду сполуки 38, наприклад трифенілфосфіном, з наступним видаленням ацетамідної захисної групи в кислих умовах може забезпечувати анілін 39. Перетворення аніліну 39 на цільовий аналог 40 може бути здійснене з використанням методів синтезу, раніше описаних на Схемах 1-5. В альтернативному підході до сполук, споріднених із 40, похідні 2-амінопіридину 47 та 48 можуть бути виготовлені у відповідності до послідовності синтезу, проілюстрованої на Схемі 7. До цього кінця 4-хлорпіколінова кислота (41, TCI America) може бути перетворена на 4хлорпіколінамід (42) з використанням двостадійної методики, що включає тіонілхлорид, з наступним додаванням аміаку в метанолі. Сполучення напівпродукту 42 з похідним 4-амінофенолу 43 в прису тності основи, такої як калію трет-бутоксид може давати похідне піколінаміду 44. Ацилювання або утворення ацилсечовини напівпродукту 44 може забезпечувати напівпродукти, такі як 45 та 46. Обробка похідних піколінаміду 45 та 46 біс(трифторацетокси)-йодбензолом, піридином та водою в ДМФА або бромом, калію гідроксидом у воді сприяє перегрупуванню Гофмана з утворенням цільових похідних 2-амінопіридину 47 та 48. 27 85087 28 Тіазолвмісні сполуки 53, 57 та 62 можуть бути одержані з використанням шляхів синтезу, показаних на Схемах 8-10. Витіснення груп, які уходять, із 49 (Схема 8) або 54 (Схема 9) аніліном/фенолом 50 може забезпечувати напівпродукти 51 та 55, відповідно. Продемонстровано, що відновлення замісників 51 та 55, які містять нітрогрупу, цинковим пилом та амонію хлоридом в суміші ТГФМеОН дає аніліни 52 та 56, відповідно. Перетворення анілінів 52 та 56 на цільові сполуки 53 та 57 може бути здійснене з використанням методів синтезу, описаних раніше (див. ви ще). Відновлювальне амінування альдегіду 58, що може бути здійснене з використанням способів, описаних в WO 2004/001059, які включені до даного опису шляхом посилання у всій їх повноті, з використанням відповідним чином заміщеного аніліну 59 може давати напівпродукт 60, що містить нітрогрупу (Схема 10). Цільове похідне амінотіазолу 62 далі може бути одержане з використанням методів синтезу, подібних до описаних Схемах 8 та 9. Введення різних замісників в положення 3 піридинового ядра може бути здійснене з використанням методів синтезу, показаних на Схемі 11. З цією метою 4-хлор-3-йодпіридин [63, Tabanella, S. et al. Org. Biomol. Chem. 2003, 1, 4254-4261] може бути сполучений з 4-нітрофенольним похідним 8 в присутності основи, такої як діізопропілетиламін (основа Ханіга) з одержанням цільового йодидного напівпродукту 64. Далі можуть бути здійснені численні реакції сполучення, опосередковані металоорганічними сполуками, з прикладами йодидного похідного 64, проілюстрованими на Схемі 11. Йо 29 85087 30 дид 64 може бути оброблений аміном (R"R'NH), заміщеними алкінами 66, арилборонатами 67, вінілстананами та α,β-ненасиченими естерами в присутності паладієвого або мідного каталізатора з одержанням напівпродуктів 65, 68-71, відповідно. Нітро-фрагмент сполук 65 та 68-71 може бути відновлений, наприклад з використанням цинкового пилу та амонію хлориду в суміші ТГФ-МеОН та одержані анілінові напівпродукти можуть бути ацильовані з використанням методів синтезу, раніше описаних на Схемах 1-5. Напівпродукт 71 далі може бути перетворений на α,β-ненасичені аміди 73 (Схема 12). Сполука 72, одержана шляхом гідролізу естеру 71 за сприяння кислоти, може бути сполучена з різними амінами (R"R'NH) в присутності реагенту сполучення, такого як, не обмежуючись ними ЕДКI, ТБТУ, DCC, з одержанням цільового амідного напівпродукту 73. Відновлення нітро-фрагменту 73 та наступне ацилювання необхідного анілінового напівпродукту може бути здійснене з використанням методів синтезу, раніше описаних на Схемах 1-5. Напівпродукт 74 також може бути додатково модифікований для одержання пропаргілових амінів 76 (Схема 13). Введення мезитильного залишку в пропаргіловий спирт 74 може бути здійснене з використанням метансульфонілхлориду в присутності основи, такої як діізопропілетиламін (основа Ханіга), з одержанням мезилату 75. Витіснення мезилатної групи сполуки 75 за допомогою різноманітних амінів (R11R1NH) може забезпечувати пропаргілові аміни 76. Відновлення нітро-фрагменту 76 та наступне ацилювання необхідного анілінового напівпродукту може бути здійснене з використанням методів синтезу, раніше описаних на Схемах 1-5. 31 85087 32 3-Амінопіридинові похідні 79 та 80 можуть бути одержані у відповідності до шляху синтезу, описаного на Схемі 14. З цією метою 4-хлор-3нітропіридин (77, Lancaster Synthesis Ltd.) може бути сполучений з 4-амінофенолом в присутності основи, такий як натрію гідрид в ДМФА, з одержанням напівпродукту 78, що містить нітрогрупу. Методи синтезу, описані вище, можуть бути використані для перетворення напівпродукту 78 на цільові сполуки 79 та 80. Амінний замісник у 79 та 80 також може бути додатково модифікований, наприклад, шляхом алкілування, ацилювання, арилування або сульфонилування. Введення замісників в положення 5- або 3- 2амінопіридинового кільця може бути здійснене з використанням йодидних напівпродуктів 83 та 86, відповідно (Схеми 15 та 16). 2-Карбоксамідне похідне 81 може бути перетворене на 2амінопіридинове похідне 82 з використанням протоколу перегрупування Гофмана, раніше описаного на Схемі 7. Йодування положення 5 сполуки 82 може бути здійснене за допомогою Nйодсукциніміду в суміші ацетонітрил/ізопропанол з одержанням цільового йодидного напівпродукту 83. Альтернативно, трет-бутил-4-хлорпіридин-2ілкарбамат (84, CB Research та Development Inc.) може бути перетворений на трет-бутил-4-хлор-3 йодпіридин-2-ілкарбамат (85) шляхом двохстадійного процесу з використанням N-бутиллітію в ТГФ при низькій температурі з наступним додаванням йоду. Видалення N-Вос (трет-бутилкарбамат) захисної гр упи 85 за допомогою киплячого із зворотним холодильником водного гідроброміду з наступним сполученням хлоридного напівпродукту з 4нітрофенольним похідним 8 в присутності діізопропіламіну (основа Ханіга) в N-метилпіролідиноні (НМП) при підвищеній температурі може забезпечувати йодидний напівпродукт 86. Йодидні напівпродукти 83 та 86 можуть бути перетворені далі з використанням способів синтезу, подібним до раніше описаних на Схемі 11. 33 85087 34 Зв'язані за допомогою метилену (В=CH2) аналоги 93 та 94 можуть бути одержані у відповідності до послідовності синтезу, показаної на Схемі 17. Сполука 88, одержана в результаті захисту N-Boc 4-броманілінового похідного 87, може бути оброблена метилмагнію бромідом з наступним додаванням трет-бутиллітію та 2-хлорізонікотинальдегіду [Frey, L. F. et al. Tetrahedron Lett. 2001, 42, 68156818] при низькій температурі з одержанням напівпродукту 90. Окиснення піридинового кільця сполуки 90 за допомогою 3-хлорпероксибензойної кислоти (м-ХПБК) з наступним витісненням хлорного замісника з використанням аміну (R'NH2) та подальшим відновленням N-оксидного напівпродукту з використанням цинку та амонію форміату в метанолі може забезпечувати напівпродукт 91. У випадку використання аліламіну як нуклеофільно го аміну (R'NH2), алільна група може бути видалена з аміну 91 з використанням родієвого каталізатора в суміші етанол-вода. Видалення гідроксильної групи сполуки 91 може бути здійснене двома різними способами. Наприклад, гідроліз сполуки 91 в присутності паладієвого каталізатора з наступним зняттям захисту гр упи N-Boc аніліну в кислих умовах (HCI в метанолі) може давати сполуку 92. Альтернативно, сполука 92 може бути одержана шляхом ацилювання спирту 91 та наступного гідролізу напівпродукту в присутності паладієвого каталізатора та видалення захисної групи N-Boc в кислих умовах (трифтороцтова кислота в метиленхлориді). Напівпродукт 92 далі може бути ацильованиий з одержанням цільових сполуки 93 та 94 з використанням методів синтезу, раніше описаних на Схемах 1-5. Гетероциклічні амідні похідні 100 та 105 можуть бути одержані у відповідності до шляхі в синтезу, показаних на Схемах 18 та 19. З цією метою метил-2-оксо-1-феніл-1,2-дигідропіридин-3 карбоксилат (97) може бути одержаний шляхом двостадійного процесу, починаючи з комерційно доступного (Е)-диметил-2-(3-метоксиаліліден)малонату (95) (Схема 18). Таким чином, 35 85087 36 обробка сполуки 95 аніліном при кімнатній температурі може забезпечувати напівпродукт 96, який далі може бути циклізований в присутності основи, такої як натрію гідрид в диметилсульфоксиді, з утворенням 97. Гідроліз напівпродукту 97 в основних умовах може забезпечувати 2-оксо-1-феніл1,2-дигідропіридин-3-карбонову кислоту (98). Кар бонова кислота 98 далі може бути сполучена з аніліновим похідним 99 в присутності реагенту сполучення, такого як 1-(диметиламінопропіл)-3етилкарбодііміду гідрохлорид (ЕДКІ) та гідроксибензотриазол (ГОБТ) в ДМФА з одержанням цільової сполуки 100. Напівпродукт піридильного N-оксиду 104 (Схема 19) може бути одержаний шляхом двостадійного процесу, в ході якого здійснюють взаємодію комерційно доступної 6-бромпіколінової кислоти (101) з феніл-1,3,2-диоксаборинаном 102 (Aldnch) в присутності каталізатора паладію (0) та натрію карбонату, з наступним окисненням необхідного напівпродукту 103 при підвищеній температурі. Сполучення напівпродукту 104 з аніліновим похідним 99 може давати цільову сполуку 105 Сполуки Формули І та Формули Il є корисними в лікуванні численних видів раку, в тому числі, не обмежуючись ними, наступні: (a) карцинома, в тому числі карцинома сечового міхура, молочної залози, ободової кишки, нирки, печінки, легень, в тому числі мілкоклітинний рак легень, стравоходу, жовчного міхура яєчника, підшлункової залози, шлунку, шийки матки, щитоподібної залози, передміхурової залози та шкіри, в тому числі карцинома лускатих клітин; (b) пухлині кровотворних органів лімфоїдного походження, в тому числі лейкемія, гостра лімфоцитна лейкемія, гостра лімфобластна лейкемія, Вклітинна лімфома, Т-клітинна лімфома, ходжкінська та не-ходжкінська лімфома, волосатоклітинна лімфома та лімфома Буркетта; (c) пухлині кровотворних органів мієлоїдного походження, в тому числі гостра та хронічна мієлогенна лейкемія, мієлодиспластичний синдром та промієлоцитна лейкемія; 37 85087 (d) пухлини мезенхімального походження, в тому числі фібросаркома і рабдоміосаркома; (е) пухлини центральної і периферичної нервової системи, в тому числі астроцитома, нейробластома, гліома і шванноми; та (f) інші пухлини, в тому числі меланома, семінома, тератокарцинома та остеосаркома, пігментна ксенодерома, ксератоксантома, фолікулярний рак щитоподібної залози та саркома Капоші. Внаслідок ключової ролі протеїнкіназ в регулюванні проліферації клітин в цілому, інгібітори можуть діяти як оборотні цитостатичні агенти, які можуть бути коричними в лікуванні будь-якого патологічного процесу, який характеризується аномальною проліферацією клітин, наприклад, доброякісна гіперплазія передміхурової залози, родинний аденоматозний поліпоз, нейрофіброматоз, рестеноз після ангіопластики або судинної хірургії, утворення гіпертрофічних рубців, запальне захворювання кишечнику, відторгнення трансплантату, ендотоксичний шок та грибкові інфекції. Сполуки Формул І та Il як модулятори апоптоза, є корисними в лікуванні раку (в тому числі, не обмежуючись ними, види, вказані в будь-якому розділі даного опису), вір усні інфекції (в тому числі, не обмежуючись ними, вірус герпеса, вірус вітряної віспи, вірус Епштейна-Барра, вірус Синдбіс та аденовірус), профілактики розвитку СНІДу у ВІЛ-інфікованих сполук, аутоімунних захворювань (в тому числі, не обмежуючись ними, системний червоний вовчак, аутоімунно опосередкований гломерулонефрит, ревматоїдний артрит, псоріаз, запальне захворювання кишечнику та цукровий діабет аутоімунного генеза), нейродегенеративні захворювання (в тому числі, не обмежуючись ними, хворобу Альцгеймера, пов'язану із СНІДом деменцію, хворобу Паркінсона, аміотрофний латеральний склероз, пігментний ретиніт, атрофію м'язів спини та мізочкову дегенерацію корінців нервів), мієлодиспластичних синдромів, апластичної анемії, ішемічного пошкодження, асоційованого з інфарктом міокарду, інсультом та пошкодженням внаслідок реперфузії, аритмії, атеросклерозу, індукованих токсинами або пов'язаних з алкоголем захворювань печінки, гематологічних захворювань (в тому числі, не обмежуючись ними, хронічну анемію та апластичну анемію), дегенеративних захворювань скелетно-м'язової системи (в тому числі, не обмежуючись ними, остеопороз та артрит), риносинуситу внаслідок чутливості до аспірину, цистофіброзу, множинного склерозу, захворювань нирок та болю при раку. Сполуки Формул І та Il можуть модулювати рівень синтезу РНК та ДНК в клітині. Вказані агенти, таким чином, мають бути корисними в лікуванні вірусних інфекцій (в тому числі, не обмежуючись ними, ВІЛ, папіломавірус людини, вірус герпеса, вірус вітряної віспи, вірус Епштейна-Барра, вірус Синдбіса та аденовірус). Сполуки Формул І та Il можуть бути корисними для хіміопрофілактики раку. Хіміопрофілактика визначається як інгібування розвитку інвазійного раку шляхом блокування початкового кроку мутагенезу або шляхом блокування прогресування 38 перед-злоякісних клітин, які вже страждають на інсульт, або інгібування рецидиву п ухлини. Термін "протираковий" агент включає будьякий відомий агент, що є корисним для лікування раку, в тому числі 17α-етинілестрадіол, діетилстільбестрол, тестостерон, преднізон, флуоксиместерон, дромостанолон пропіонат, тестолактон, мегестролу ацетат, метилпреднізолон, метилтестостерон, преднізолон, триамцинолон, хлоротрианізен, гідроксипрогестерон, аміноглуте тімід, естрамустин, медроксипрогестерону ацетат, лейпролід, флутамід, тореміфен, золадекс, інгібітори металопротеїнази матриксу, інгібітори VEGF, в тому числі анти-VEGF антитіла, такі як Авастин, а також молекули невеликого розміру, такі як ZD6474 та SU6668, ваталаніб, BAY-43-9006, SUI 1248, СР-547632 та СЕР-7055 також включені. Анти-Неr2 антитіла від Genentech (такі, як Герцептин) також можуть бути використані. Придатні інгібітори. EGFR включають гефітиніб, ерлотиніб та цетуксимаб. Інгібітори Pan Her включають канертуніб, ЕКВ-569 та GW-572016. Також включені інгібітори Src, а також Casodex® (бікалутамід, Astra Zeneca), тамоксифен, інгібітори MEK-I кінази, інгібітори МАРК кінази, інгібітори РІЗ та інгібітори PDGF, такі як іматиніб. Також включені антиангіогенні та анти-васкулярні агенти, які шляхом переривання току крові до солідних пухлин приводять ракові клітини в стан спокою, позбавляючи їх поживних речовин. Кастрація, яка також залишає андроген-залежні карциноми в не проліферативному стані, також може застосовуватися. Також включені інгібітори IGFIR, інгібітори нерецепторних та рецепторних тирозинкіназ та інгібітори сигналу інтегрину. Додаткові протиракові агенти включають агенти, що стабілізують мікротрубочки, такі як паклітаксел (також відомий як Таксол®), доцетаксел (також відомий як Таксотер®), 7-Ометилтіометилпаклітаксел [розкритий в U.S. 5,646,176], 4-дезацетил-4-метилкарбонатпаклітаксел, 3'-трет-бутил-3'-N-третбутилоксикарбоніл-4-деацетил-3'-дефеніл-S'-Nдебензоїл-4-O-метоксикарбоніл-паклітаксел (розкритий в USSN 09/712,352 поданій 14 листопада 2000), С-4 метилкарбонатпаклітаксел, епотилон А, епотилон В, епотилон C, епотилон D, дезоксиепотилон А, дезоксиепотилон В, [1S[1R*,3R*(E),7R*,10S*,11R*,12R*,16S*]]-7-11дигідрокси-8,8,10,12,16-пентаметил-3-[1-метил-2(2-метил-4-тіазоліл)епотиміл]-4-аза-17 оксабіцикло [14,1,0]гептадекан-5,9-діон [розкритий в WO 99/02514], [1S-[1R*,3R*(E),7R*, 10S*, 11R*, 12R*, 168*]]-3-[2-[2-(амінометил)-4-тіазоліл]-1метилепотиміл]-7,11-дигідрокси-8,8,10,12,16пентаметил-4-17-діоксабіцикло[14,1,0]-гептадекан5,9-діон [розкритий в USP 6,262,094] та їх похідні; а також агенти, що руйнують мікротрубочки. Також придатними є інгібітори CDK, антипроліферативний інгібітор клітинного циклу епідофілотоксин; антинеопластичний фермент; інгібітор топоізомерази; прокарбазин; мітоксантрон; координаційні сполуки платини, такі як цисплатин та карбоплатин; модулятори біологічної реакції; інгібітори росту; антигормональні терапевтичні агенти; лейковорин; тегафур; а також гемопоетичні фактори росту. 39 85087 Додаткові цитотоксичні агенти включають мефалан, гексаметилмеламін, тіотепа, цитарабін, ідатрексат, триметрексат, дакарбазин, Lаспарагіназу, камптотецин, топотекан, бікалутамід, флутамід, лейпролід, похідні піридобензоіндолу, інтерферони та інтерлейкіни. Фармацевтичні композиції за даним винаходом, які містять активний інгредієнт, можуть існувати у форм1, придатній для перорального застосування, наприклад, у ви гляді таблеток, льодяників, водних або масляних суспензій, порошків або гранул, що піддаються диспергуванню, емульсій, твердих або м'яких капсул або сиропів або еліксирів. Композиції, призначені для перорального застосування, можуть бути виготовлені у відповідності до будь-якого способу, відомого з рівня техніки для виробництва фармацевтичних композицій, і такі композиції можуть включати один або більше агентів, вибраних з групи, що складається з підсолоджуючих агентів, ароматизаторів, барвників та консервантів, з метою забезпечення фармацевтично досконалих і приємних на смак препаратів. Таблетки містять активний інгредієнт в суміші з нетоксичними фармацевтично прийнятними допоміжними речовинами, які є придатними для виробництва таблеток. Такі допоміжні речовини можуть являти собою, наприклад, інертні розбавлювачі, такі як кальцію карбонат, натрію карбонат, лактоза, кальцію фосфат або натрію фосфат; агенти, що сприяють грануляції та розпаданню, наприклад, мікрокристалічна целюлоза, натрій кроскармелоза, крохмаль кукурудзяний або альгінова кислота; зв'язуючі агенти, наприклад, крохмаль, желатин, полівінілпіролідон або акацієва камедь, а також змащувальні агенти, наприклад, магнію стеарат, стеаринова кислота або тальк. Таблетки можуть не мати покриття, або можуть мати покриття, нанесене за допомогою відомих технік для маскування неприємного смаку лікарського засобу або затримки розпадання та абсорбції в шлунково-кишковому тракті, і таким чином, забезпечувати подовжену дію протягом більш тривалого періоду. Наприклад, може бути використаний водорозчинний матеріал для маскування смаку, такий як гідроксипропілметилцелюлоза або гідроксипропілцелюлоза, або матеріал для затримки вивільнення, такий як етилцелюлоза, целюлози ацетат бутират. Рецептури для перорального застосування також можуть бути представлені у вигляді твердих желатинових капсул, де активний інгредієнт змішаний з інертним твердим розбавлювачем, наприклад, кальцію карбонатом, кальцію фосфатом або каоліном, або у вигляді м'яких желатинових капсул, де активний інгредієнт змішаний з водорозчинним носієм, таким як поліетиленгліколь або масляне середовищем, наприклад, арахісова олія, рідкий парафін або оливкова олія. Водні суспензії містять активний матеріал в суміші з допоміжними речовинами, придатними для виробництва водних суспензій. Такі допоміжні речовини являють собою суспендувальні агенти, наприклад, натрій карбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, натрію альгінат, полівінілпіролідон, трагакантова 40 камедь та акацієва камедь; диспергувальні або зволожувальні агенти можуть бути природними фосфа тидами, наприклад, лецитин, або продуктами конденсації алкіленоксиду з жирними кислотами, наприклад, поліоксиетилену стеарат: або продуктами конденсації етиленоксиду з аліфатичними спиртами з довгим ланцюгом, наприклад, гептадекаетиленоксиетанол, або продуктам конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот і гекситолу, такого як поліоксиетилен сорбітол моноолеат, або продуктами конденсації етиленоксиду з частковими ефірами, одержаними з жирних кислот та ангідридів гекситолу, наприклад, поліетиленсорбітан моноолеат. Водні суспензії також можуть містити один або більше консервантів, наприклад, етил- або н-пропіл-пгідроксибензоат, один або більше барвників, один або більше ароматизаторів, та один або більше підсолоджуючих агентів, таких як сахароза, сахарин або аспартам. Масляні суспензії можуть бути виготовлені суспендуванням активного інгредієнта в рослинній олії, наприклад, арахісовій олії, оливковій олії, сезамовій олії або кокосовому маслі, або в мінеральному маслі, такому як рідкий парафін. Масляні суспензії можуть містити загущувальний агент, наприклад, бджолиний віск, твердий парафін або цетиловий спирт. Підсолоджуючі агенти, такі як наведені вище, та ароматизатори можуть бути додані для забезпечення приємного на смак препарату для перорального застосування. Вказані композиції можуть зберігати стабільність завдяки додавання антиоксиданту, такого як бутильований гідроксианізол або альфа-токоферол. Порошки та гранули, що піддаються диспергуванню, придатні для виготовлення водної суспензії шляхом додавання води,забезпечують активний інгредієнт в суміші з диспергувальним або зволожувальним агентом, суспендувальним агентом та одним або більше консервантами. Прикладами придатних диспергувальних або зволожувальних агентів та суспендувальних агентів є ті, які були наведені вище. Додаткові допоміжні речовини, наприклад, підсолоджувальні агенти, ароматизатори і барвники, також можуть бути присутні. Такі композиції можуть зберігати стабільність завдяки додаванню антиоксиданту, такого як аскорбінова кислота. Фармацевтичні композиції за винаходом також можуть існувати у формі емульсій масло-у-воді. Масляна фаза може являти собою рослинну олію, наприклад, оливкову олію або арахісову олію, або мінеральне масло, наприклад, рідкий парафін, або суміші цих компонентів. Придатні емульгуючі агенти можуть бути природними фосфатидами, наприклад, соєвий лецитин, а також ефірами або частковими ефірами жирних кислот і ангідридів гекситолу, наприклад, сорбітан моноолеат, а також продуктами конденсації вказаних часткових е фірів з етиленоксидом, наприклад, поліоксиетилен сорбітан моноолеат. Емульсії також можуть містити підсолоджувальні агенти, ароматизатори, консерванти та антиоксиданти. Сиропи та еліксири можуть бути створені з підсолоджуючими агентами, наприклад, гліцерин, 41 85087 пропіленгліколь, сорбітол або сахароза. Такі рецептури також можуть містити емульгатори, консерванти, ароматизатори та барвники, а також антиоксидант. Фармацевтичні композиції можуть існувати у формі стерильних ін'єкційних водних розчинів. Серед придатних розчинників і носіїв, які можуть використовува тися, - вода, розчин Рингера та ізотонічний розчин натрію хлориду. Стерильний ін'єкційний препарат також може являти собою стерильну ін'єкційну мікроемульсію масло-у-воді, в якій активний інгредієнт розчинений в масляній фазі. Наприклад, активний інгредієнт може бути спочатку розчинений у суміші соєвої олії і лецитину. Далі масляний розчин вводять в суміш води і гліцерину та обробляють для утворення мікроемульсії. Ін'єкційні розчини або мікроемульсії можуть бути введені в кровотік пацієнта за допомогою ін'єкції місцевого болюсу. Альтернативно, може бути переважним введення розчину або мікроемульсії таким чином, щоб підтримувати постійну концентрацію розчиненої речовини в кровотоку. Для підтримання такої постійної концентрації можуть застосовуватися пристрої для безперервного внутрішньовенного введення. Прикладом такого пристрою є внутрішньовенний насос Deltec-CADDPLUS, модель 5400. Фармацевтичні композиції можуть існувати у формі стерильної ін'єкційної водної або масляної суспензії для внутрішньом'язового або підшкірного введення. Така суспензія може бути виготовлена у відповідності до рівня техніки з використанням придатних диспергувальних або зволожувальних агентів і суспендувальних агентів, які були згадані вище. Стерильний ін'єкційний препарат може також являти собою стерильний ін'єкційний розчин або суспензію в нетоксичному розбавлювачі або розчиннику, придатному для парентерального введення, наприклад, розчин в 1,3-бутандіолі. Крім того, як розчинник або середовище суспендування традиційно використовують стерильні нелеткі масла. З цією метою будь-яке легке нелетке масло може бути використане, в тому числі синтетичні моно- або дигліцериди. Крім того, у виготовленні ін'єкційних лікарських форм використовують жирні кислоти, такі як олеїнова кислота. Сполуки формули І також можуть вводитися у формі супозиторіїв для ректального введення лікарського засоби. Такі композиції можуть бути виготовленні змішуванням лікарського засобу з придатною не подразнюючою допоміжною речовиною, яка є твердою при звичайних температурах, але рідкою при температурі прямої кишки, 1, таким чином, буде плавитися в прямій кишці з вивільненням лікарського засобу. Такі матеріали включають кокосове масло, гліцеринований желатин, гідрогенізовані рослинні олії, суміші поліетиленгліколів з різною молекулярною масою і ефіри жирних кислот та поліетиленгліколю. Для місцевого застосування використовують креми, мазі, гелі, розчини або суспензії, і т. п, які містять сполуку формули І. (З метою такого застосування місцеве застосування буде включати полоскання для рота і горла.) 42 Сполуки за даним винаходом можуть бути введені в інтраназальній формі шляхом місцевого застосування придатних інтраназальних розчинників і пристроїв для введення, або трансдермально, з використанням форми трансдермальних шкірних пластирів, добре відомих спеціалістам в даній галузі. Для введення у вигляді системи трансдермальної доставки введення дози скоріше буде безперервним, ніж переривчастим, протягом курсу лікування. Сполуки за даним винаходом також можуть бути введені у вигляді супозиторію з використанням таких основ, як масло какао, гліцеринізований желатин, гідрогенізовані рослинні олії, суміші поліетиленгліколів з різною молекулярною масою і ефіри жирних кислот та поліетиленгліколю. Якщо сполуки за даним винаходом вводять суб'єкту-людині, добова доза звичайно буде визначатися лікарем причому дози будуть звичайно варіювати в залежності від віку, маси тіла, статі та відповіді конкретного пацієнта, а також вираженості симптомів у пацієнта. Якщо рецептура містить фіксовану дозу, в таких комбінованих продуктах використовують сполуки за винаходом в інтервалі доз, описаному вище, а також інший фармацевтично активний агент або засіб лікування в придатному для нього інтервалі доз. Сполуки формули І також можуть бути введенні послідовно з відомими протираковими або цитотоксичними агентами, якщо комбінована рецептура є непридатною. Винахід не обмежується послідовністю введення; сполуки формули І можуть бути введені до або після введення відомого протиракового або цитотоксичного агента(ів). Аналізи Фармакологічні властивості сполук за даним винаходом можуть бути підтверджені за допомогою численних фармакологічних аналізів. Наведені далі приклади фармакологічних аналізів здійснювалися з використанням сполук у відповідності до винаходу та їх солей. Аналіз Met кінази Кінцева концентрація в Реактиви суміші субстрату Запасний розчин Трис-НСІ (1М, рН7,4) 20мМ MnCI2 (1 M) 1мМ DTT (1M) 1мМ BSA(100мг/мл) 0,1мг/мл PolyGlu:Tyr (10мг/мл) 0,1мг/мл АТФ (1мм) 1мкм 0,2мкКІ/мл g-АТФ (10мкКі/мкл) Буфер 20мкл 1M DTT 200мкл 1M Трис-НСІ, рН7,4 20мкл 100мг/мл BSA Необхідна кількість H2O до 20мл Суміш ферментів 4мкл ферменту GST/Met (3,2мг/мл)=10нг/rxn Необхідна кількість буферу до 12мл Суміші для інкубації, які використовували для аналізу Met кінази, містили синтетичний субстрат 43 85087 PolyGlu:Tyr (4:1), АТФ, ΑТΦ-g- 33Ρ та буфер, що містить Mn+4 та/або Mg+2, DTT, BSA та Трис буфер. Реакційні суміші інкубували протягом 60хв. при 27°C та зупиняли реакцію додаванням холодної трихлороцтової кислоти (TCA) до кінцевої концентрації 4%. Осад TCA збирали на однофільтрові планшети GF/C (Packard Instrument Co, Meriden, CT) з використанням універсального пристрою для збирання Filtermate (Packard Instrument Co, Meriden, CT) та фільтри кількісно вимірювали з використанням TopCount-well рідинного сцинтиляційного лічильника (Packard Instrument Co, Meriden, CT). Криві "доза-реакція" будували для визначення концентрації, необхідної для інгібування 50% активності кінази (ІС50). Сполуки розчиняли з концентрацією 10мМ в диметилсульфоксиді (ДМСО) та оцінювали при шести концентраціях, кожна в чотириразовому повторенні Кінцева концентрація диметилсульфоксиду в аналізах становила 1%. Значення IC50 одержували за допомогою нелінійного регресивного аналізу з коефіцієнтом варіації (стандартне відхилення/середнє значення, n=6)=16%. Переважні сполуки за винаходом інгібують кіназу Met із значеннями IC50 від 0,01 до 100мкм. Для найбільш переважних сполук значення IC50 становлять менше 0,5мкм. Додатковий об'єкт винаходу також включає фармацевтичні засоби для застосування, описаного вище, в тому числі для контролю раку, запалення та артриту, які містять щонайменше одну сполуку Формули І та Формули II, як визначено вище, або щонайменше одну з її фармакологічно прийнятних кислотно-адитивних солей, а також застосування сполуки Формули І та Формули II, як визначено вище, для одержання фармацевтичного засобу, який володіє активністю проти проліферативних захворювань, як описано вище, в тому числі проти раку, запалення та/або артриту. Наступні Приклади та Способи одержання описують спосіб та процес виготовлення з використанням винаходу та є ілюстративними, а не обмежуючими. Слід розуміти, що можуть існувати інші варіанти, які знаходяться в дусі і межах винаходу, як визначено доданими пунктами формули. Приклади Винахід далі буде описаний за допомогою наступних робочих прикладів, що являють собою переважні варіанти винаходу. Всі реакції здійснювали при перемішуванні за допомогою магнітної мішалки в атмосфері сухо го азоту або аргону. Всі операції упарювання та випарювання здійснювали на роторному випарювачі при зниженому тиску. Комерційні реагенти використовували в тому вигляді, в якому вони надійшли, без додаткового очищення. Розчинники було комерційної якості та використовувалися без додаткового сушіння або очищення Флеш-хроматографію здійснювали з використанням силікагелю (EMerck Kieselgel 60, 0,040-0,060мм). Аналітичну обернено-фазну (RP) ВЕРХ здійснювали з використанням колонки Phenomenex Luna Cl 8 S5 4,6мМ´50мМ або колонки YMC S5 ODS 4,6´50мМ. В кожному випадку 4хв. застосовували лінійний градієнт (від 100% А. 0% В до 0% 44 А: 100% В) з наступною системою рухомої фази: А=90% H2O/MeOH+0,2% H3PO4; В=90% МеОН/Н2О+0,2% H3PO4 із швидкістю потоку=4мл/хв. та детектуванням на довжині хвилі 220нм. Препаративну обернено-фазну (RP) ВЕРХ здійснювали шляхом елюації з лінійним градієнтом з використанням 10% метанолу, 90% води, 0,1% ТФО (розчинник А) та 90% метанолу, 10% води, 0,1% ТФО (розчинник В) та детектуванням на довжині хвилі 220нм на одній з наступних колонок: колонка A-Shimadzu S5 ODS-VP 20´100мМ із швидкістю потоку 20мл/хв; колонка B-YMC S5 ODS 30´100мМ із швидкістю потоку 20мл/хв; колонка CPhenomonex 30´250мМ із швидкістю потоку 10мл/хв, колонка D-YMC S5 ODS 20´250мМ із швидкістю потоку 10мл/хв; колонка E-YMC S10 ODS 50´500мМ із швидкістю потоку 50мл/хв; або колонка F-YMC S10 ODS 30´500мМ із швидкістю потоку 20мл/хв. Всі кінцеві продукти описували за допомогою 1 H ЯМР, RP ВЕРХ, мас-спектрометрія з іонізацією розпилюванням електронів (ESI MS) або іонізацією атмосферного тиску (API MS). 1H ЯМР спектри реєстрували на інструменті 500МГц JEOL або 400МГц Bruker. 13C ЯМР спектри реєстрували при 100 або 125МГц. Напруження поля, виражені в одиницях δ (частини на мільйон, проміле) відносно піків розчинника та множинність піків позначені наступним чином: с, синглет; д, дублет; дд, дублет дублетів; дм, дублет мультиплетів; т, триплет; к, квартет; ш с, широкий сунглет; м, мультиплет. Наступні скорочення використані для широко розповсюджених реагентів: Вос або BOC: третбутилкарбамат; Fmoc: 9Н-флуоренілкарбамат; TEA: триетиламін; NMM: N-метилморфолін; Ms: метансульфоніл; ДІЕА або ДІПЕА: діізопропілетиламін або основа Ханіга; НМП: Nметилпіролідинон; BOP реагент: бензотриазол-1ілокситрис(триметиламіно)фосфонію гексафторфосфа т; ДЦК: 1,3-дициклогексилкарбодіімід; ЕДКІ: 1-(диметиламінопропіл)-3-етилкарбодііміду гідрохлорид; RT або rt: кімнатна температура; tR.: час утримання; год: година(и); хв: хвилина(и); РуВrоР: бромтрипіролідинофосфонію гексафторфосфат; ТБТУ: O-(1H-бензотриазол-1-іл)-N,N,N',N'тетраметилуронію тетрафторборат; ДМАП: 4-N,Nдиметиламінопіридин; ГОБТ: гідроксибензотриазол; Na(OAc)3BH: натрію триацетоксиборгідрид; HOAc: оцтова кислота; ТФО: трифтороцтова кислота; LiHMDS: літію біс(триметилсиліл)амід; ДМСО: диметилсульфоксид; MeCN: ацетонітрил; MeOH: метанол; EtOAc: етилацетат, ДМФА: диметилформамід; ТГФ: тетрагідрофуран, ДХЕ: 1,2дихлоретан; Et2O: діетиловий ефір; ДХМ: ди хлорметан або метиленхлорид; м-ХПБК: 4хлорпероксибензойна кислота. Приклад 1 45 85087 N-(4-Фторфеніл)-N-(4-(піридин-4ілокси)феніл)малонамід A) 4-(4-Амінофенокси)піридин Розчин 4-хлорпіридину гідрохлориду (Aldrich, 3,0г, 20,0ммоль) в диметилсульфоксиді (40мл) обробляють 4-амінофенолом (Aldrich, 2,1г, 20,0ммоль), додають гранули натрію гідроксиду (2,0г, 50,0ммоль) і суміш нагрівають до 100°С, витримуючи при цій температурі протягом 18год. Суміш охолоджують до кімнатної температури, виливають на суміш води з льодом (300г) та екстрагують Et2 O (3´150мл). Об'єднані екстракти промивають розсолом, сушать (MgSO4) та упарюють з одержанням 4-(4-амінофенокси)аніліну у вигляді твердої речовини блідо-жовтого кольору (3,5г, 94%). 1H ЯМР (ДMCO-d6) δ 8,38 (дд, 2Н, J=5,5, 1,5Гц), 6,83-6,79 (м, 4Н), 6,63-6,59 (м, 2Н), 5,13 (ш с, 2Н); MS (ESI+) m/z 187,2 (M+H)+. 46 C) N-(4-Фторфеніл)-N-(4-(піридин-4ілокси)феніл)малонамід Розчин 4-(4-амінофенокси)піридину (93мг, 0,50ммоль) в ДМФА обробляють 3-(4фтор феніламіно)-3-оксопропановою кислотою (99мг, 0,50ммоль), ДІПЕА (113мкл, 0,65ммоль) та ТБТУ (209мг, 0,65ммоль) і суміш перемішують при кімнатній температурі протягом 2год. Суміш упарюють для видалення ДМФА і залишок розподіляють між EtOAc та насиченим розчином натрію бікарбонату. Фракцію EtOAc промивають насиченим розчином натрію бікарбонату, розсолом, сушать (MgSO4) та упарюють з одержанням названої в заголовку сполуки у вигляді майже білої піни (140мг, 76%). 1H ЯМР (ДМСО-d6) δ 10,30 (с, 1Н), 10,24 (с, 1Н), 8,43 (дд, 2Н, J=5,5,1,5Гц), 7,70 (д, 2Н, J=9,1Гц), 7,63-7,60 (м, 2Н), 7,17-7,14 (м, 4Н), 6,89 (дд, 2Н, J=5,5, 1,5Гц), 3,46 (с, 2Н); MS (ESI+) m/z 365,9 (M+H)+. Приклад 2 1-(4-(6-Хлорпіримідин-4-ілокси)-3-фторфеніл)3-(2-(4-фторфеніл)ацетил)тіосечовина B) 3-(4-Фторфеніламіно)-3-оксопропанова кислота До розчину етил-3-хлор-3-оксопропаноату (Aldrich, 5,0мл, 40ммоль) в метиленхлориді (100мл) при 0°С додають діізопропілетиламін (8,4мл, 48ммоль) з наступним додаванням 4-фтораніліну (Aldrich, 3,6мл, 38ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі та після цього гасять за допомогою 100мл насиченого розчину NaHCO3. Водну фракцію екстрагують хлороформом (3´100мл). Об'єднані органічні екстракти сушать над безводним Na2SO4 та упарюють під вакуумом з одержанням сирого продукту у вигляді жовтого масла що затвердіває при стоянні (10г). 1H ЯМР (CDCI3) δ 9,30 (ш с, 1Н), 7,55 (м, 2Н), 7,05 (т, 2Н, J=8,8Гц), 4,28 (к, 2Н, J=12Гц), 3,49 (с, 2Н), 1,35 (т, 3N, J=7,1Гц); MS (ESI+) m/z 226,11 (M+H)+. Одержаний ефір розчиняють в 100мл етанолу та охолоджують до 0°С. Додають 1н водний розчин NaOH (100мл) і реакційну суміш перемішують при 0°С, витримуючи при цій температурі протягом 1год. Реакційну суміш упарюють під вакуумом для видалення етанолу. Водний розчин екстрагують етилацетатом (50мл) та після цього підкислюють 1н водним розчином HCI. Водний розчин екстрагують етилацетатом (5´100мл). Об'єднані органічні екстракти сушать над безводним Na2SO4 та упарюють під вакуумом з одержанням сирого продукту у вигляді твердої речовини жовтого кольору (6,31г, 84%), яку застосовують без подальшого очищення. 1H ЯМР (ДМСО-d6) δ 12,9 (ш с, 1Н), 10,3 (ш с, 1Н), 7,59 (м, 2Н), 7,16 (т, 2H, J=8,9Гц), 3,34 (с, 2Н); MS (ESI+) m/z 198,43 (M+H)+. A) 4-Хлор-6-(2-фтор-4-нітрофенокси)піримідин Суміш 4,6-дихлорпіримідину (Aldrich, 0,74г, 5,0ммоль), 2-фтор-4-нітрофенолу (Aldrich, 0,79г, 5,0ммоль) та ДМФА (10мл) обробляють калію карбонатом (0,72г, 5,2ммоль) та нагрівають до 80°С, витримуючи при цій температурі протягом 3год. Суміш охолоджують, розбавляють водою та екстрагують етилацетатом. Етилацетатний екстракт промивають розсолом, сушать (MgSO 4) та упарюють з одержанням сирого продукту у вигляді твердої речовини жовтого кольору. Сирий продукт розтирають з ізопропіловим ефіром з одержанням 4хлор-6-(2-фтор-4-нітрофенокси)піримідину у вигляді твердої речовини жовтого кольору (1,3г, 94%). 1H ЯМР (ДМСО-d6) δ 8,80 (с, 1Н), 8,51 (дд, 1Н, J=8,6, 2,5Гц), 8,31 (д, 1Н, J=9,1Гц), 7,87 (д, 1Н, J=9,1Гц), 7,84 (с, 1Н). B) 4-Хлор-6-(2-аміно-2-фторфенокси)піримідин Розчин 4-хлор-6-(2-фтор-4нітрофенокси)піримідину (1,3г, 4,8ммоль) в метанолі (120мл) обробляють нікелем Ренея (1,5г, водна суспензія) і реакційну суміш перемішують в атмосфері водню (з латексного балону) при кімнатній температурі протягом 3год. Каталізатор 47 85087 відфільтровують, фільтрат упарюють, і залишок розподіляють між CH2CI2 та водою. Ме тиленхлоридну фракцію відокремлюють, сушать (MgSO4) та упарюють. Сирий продукт очищують флешхроматографією на силікагелі з використанням 12% MeOH в CH2CI2 як елюенту з одержанням 4хлор-6-(2-аміно-2-фторфенокси)піримідину у вигляді білої твердої речовини (600мг, 52%). 1H ЯМР (ДМСО-d6) δ 8,64 (с, 1Н), 7,39 (с, 1Н), 6,97 (дд, 1Н, J=8,8, 8,8Гц), 6,46 (дд, 1H, J=13,1, 2,5Гц), 6,38 (дд, 1H, J=8,6,2,5Гц), 5,44 (ш с, 2Н); MS (ESI+) m/z 240,04 (M+H)+. C) 1-(4-(6-Хлорпіримідин-4-ілокси)-3фтор феніл)-3-(2-(4-фторфеніл)ацетил)тіосечовина 4-Фторфенілацетилхлорид (Lancaster, 0,52г, 3,0ммоль) додають до суміші NaSCN (0,27г, 3,3ммоль) та EtOAc (12мл) та одержану суміш перемішують при кімнатній температурі протягом 30хв. Одержану суміш додають до розчину 4-хлор6-(2-аміно-2-фторфенокси)піримідину в суміші ЕtOАс/СН 2СІ2 1:1 (5мл) та одержану суміш перемішують при кімнатній температурі протягом ночі. Суміш упарюють і залишок розподіляють між EtOAc та H2O. Фракцію EtOAc відокремлюють, промивають розсолом, сушать (MgSO 4) та упарюють. Продукт очищують флеш-хроматографією з використанням 10-35% ЕtOАс/гексану як елюенту з одержанням названої в заголовку сполуки у вигляді кристалічної твердої речовини жовтого кольору (0,85г, 65%). 1H ЯМР (ДMCO-d 6) δ 12,40 (с, 1Н), 11,81 (с, 1Н), 8,67 (с, 1Н), 7,90 (дд, 1Н, J=12,1,2,0Гц), 7,62 (с, 1Н), 7,47-7,41 (м, 2Н), 7,387,35 (м, 2Н), 7,17 (т, 2H, J=8,8Гц), 3,81 (с, 2Н); MS (ESI+) m/z 434,98 (M+H)+. Приклад 3 1-(2-(4-Фторфеніл)ацетил)-3-(4-(піридин-4ілокси)феніл)тіосечовина Названу в заголовку сполуку одержують з використанням 4-(4-амінофенокси)піридину (Сполука А Прикладу 1) та методики, подібної до описаної для одержання сполуки C Прикладу 2. Вихід: 10%. 1 H ЯМР (CDCI3) δ 12,3 (с, 1Н), 8,63 (с, 1Н), 8,49, (д, 2Н, J=6,2Гц), 7,71 (д, 2Н, J=8,9Гц), 7,31-7,27 (м, 2Н), 7,14-7,09 (м, 4Н), 6,90 (дд, 2Н, J=4,8, 1,4Гц), 3,73 (с, 2Н); MS (ESI+) m/z 382,2 (M+H)+. Приклад 4 N1-(4-(6-Хлорпіримідин-4-ілокси)-3фтор феніл)-N3-(4-фторфеніл)малонамід Розчин 4-хлор-6-(2-аміно-2фтор фенокси)піримідину (29мг, 0,12ммоль, Сполука В Прикладу 2), 3-(4-фторфеніламіно)-3оксопропанової кислоти (26мг, 0,13ммоль, Сполу 48 ка В Прикладу 1) в ДМФА (1,5мл) обробляють ДІПЕА (24мкл, 0,14ммоль) та ТБТУ (46мг, 0,14ммоль). Реакційну суміш перемішують при кімнатній температурі протягом ночі, розбавляють етилацетатом (25мл) та органічну фракцію промивають розсолом (3´20мл), сушать (MgSO 4) та упарюють. Продукт очищують флеш-хроматографією з використанням 1-3% MeOH в CH2CI2 як елюенту з одержанням названої в заголовку сполуки у вигляді білої твердої речовини (35мг, 78%). 1H ЯМР (ДМСО-d6) δ 10,49 (с, 1Н), 10,25 (с, 1Н), 8,65 (с, 1Н), 7,78 (д, 1Н, J=12,1Гц), 7,63-7,57 (м, 3H), 7,407,34 (м, 2Н), 7,16 (т, 2H, J=8,8Гц), 3,48 (с, 2H); MS (ESI+) m/z 419,21 (M+H)+. Приклад 5 N1-(3-Фтор-4-(6-(метиламіно)піримідин-4ілокси)феніл)-N3-(4-фторфеніл)малонамід Розчин N1-(4-(6-хлорпіримідин-4-ілокси)-33 фтор феніл)-N -(4-фторфеніл)малонаміду (100мг, 0,42ммоль, Приклад 4) в H-BuOH (3мл) обробляють сумішшю 2 M метиламіну/ТГФ (0,2мл) та нагрівають у флаконі із нагвинчуваною кришкою при 80°С, витримуючи при цій температурі протягом 12год. Суміш упарюють і залишок очищують препаративною ВЕРХ з використанням градієнту МеОН/Н2О, що містить 0,1% ТФО. Фракцію, яка містить продукт, ліофілізують з одержанням названої в заголовку сполуки у вигляді твердої речовини блідо-жовтого кольору (60мг, 34%). 1H ЯМР (ДМСО-d6) δ 10,58 (с, 1Н), 10,36 (ш с, 2Н), 8,19 (ш с, 1Н), 7,76 (д, 1H, J=12,1Гц), 7,64-7,62 (м, 2Н), 7,36-7,27 (м, 2Н), 7,15 (дд, 2Н, J=8,8, 8,8Гц), 5,95 (ш с, 1Н), 3,49 (с, 2Н), 2,80 (с, 3H); MS (ESI+) m/z 414,16 (M+H)+. Приклад 6 трет-Бутил-6-(2-фтор-4-(3-(4-фторфеніламіно)3-оксопропанамідо)фенокси)піримідин-4ілкарбамат A) N-(2,4,6-Триметоксибензил)-6хлорпіримідин-4-амін Суміш 4,6-дихлорпіримідину (Aldrich, 1,48г, 10,0ммоль), 2,4,6-триметоксибензиламіну гідрохлориду (2,33г, 10,0ммоль), ДІПЕА (4,8мл, 27,7ммоль) та H-BuOH (50мл) нагрівають до 49 85087 100°С, витримуючи при цій температурі протягом 2год. Суміш о холоджують, розбавляють водою (200мл) та осаджений продукт збирають вакуумною фільтрацією на лійці Бюхнера. Продукт промивають холодною водою, ефіром та сушать під вакуумом з одержанням твердої речовини майже білого кольору (2,8г, 90%). 1H ЯМР (ДMCO-d 6) δ 8,28 (с, 1Н), 7,38 (с, 1Н), 6,49 (с, 1H), 6,25 (с, 2H), 4,34 (с, 2H), 3,77 (с, 9H). B) 6-(2-Фтор-4-нітрофенокси)піримідин-4-амін Суміш N-(2,4,6-триметоксибензил)-6хлорпіримідин-4-аміну (2,2г, 7,11ммоль), 2-фтор-4нітрофенолу (1,1г, 7,0ммоль) та 2метоксиетилового ефіру (50мл) нагрівають до 160°С, витримуючи при цій температурі протягом 60год. Реакційну суміш охолоджують до кімнатної температури та виливають у H2O (200мл). Тверду речовину збирають, промивають 2M водним Na2CO3 та H2O, після чого сушать під вакуумом на лійці Бюхнера. Сирий продукт обробляють трифтороцтовою кислотою (20мл) в діоксані (40мл) та перемішують при кімнатній температурі протягом 4год. Реакційну суміш упарюють, залишок розподіляють між EtOAc та насиченим розчином NaHCO3. Фракцію EtOAc відокремлюють, сушать (MgSO4) упарюють та сирого продукту очи щують флеш-хроматографією з використанням 1-2% MeOH в CH2CI2 як елюенту з одержанням 6-(2фтор-4-нітрофенокси)піримідин-4-аміну (440мг, 31%). 1H ЯМР (ДМСО-d6) δ 8,31 (дд, 1H, J=10,4,2,5Гц), 8,14 (дд, 1H, J=9,8,2,0Гц), 8,04 (с, 1Н), 7,61 (дд, 1Н, J=8,3, 8,3Гц), 7,07 (с, 2Н), 6,02 (с, 1Н); MS (ESI+) m/z 251,15 (M+H)+. С) трет-Бутил-6-(2-фтор-4нітрофенокси)піримідин-4-ілкарбамат Суміш 6-(2-фтор-4-нітрофенокси)піримідин-4аміну (439мг, 1,2ммоль), BOC2O (261мг, 1,2ммоль), ДМАП (10мг) та ТГФ (10мл) перемішують при кімнатній температурі протягом 1год., після чого упарюють під вакуумом з одержанням сирого продукту Продукт очищують флешхроматографією з використанням 1-2% MeOH в CH2CI2 як елюенту з одержанням трет-бутил-6-(2фтор-4-нітрофенокси)піримідин-4-ілкарбамату у вигляді білої твердої речовини (110мг, 26%). 1H ЯМР (ДМСО-d6) δ 10,59 (с, 1Н), 8,39 (дд, 1H, J=8,8,1,1Гц), 8,32 (дд, 1Н, J=10,3,2,4Гц), 8,15 (ддц, 1Н, J=9,1,2,5,1,0Гц), 7,67 (дд, 1Н, J=8,8, 8,8Гц), 7,45 (с, 1Н), 1,44 (с, 9Н); MS (ESI+) m/z 349,08 (MH). 50 D) трет-Бутил-6-(4-аміно-2фтор фенокси)піримідин-4-ілкарбамат Розчин трет-бутил-6-(2-фтор-4нітрофенокси)піримідин-4-ілкарбамату (11мг, 0,031ммоль) в метанолі (2мл) обробляють PtO2 і реакційну суміш перемішують в атмосфері водню (з латексного балону) протягом 2год. Каталізатор відфільтровують і фільтрат упарюють з одержанням трет-бутил-6-(4-аміно-2фтор фенокси)піримідин-4-ілкарбамату (8мг, 81%). 1 H ЯМР (ДMCO-d6) δ 10,62 (с, 1Н), 8,43 (д, 1Н, J=2,5Гц), 8,36 (дд, 1Н, J=9,8,2,5Гц), 8,36 (дд, 1Н, J=9,8,2,5Гц), 8,20-8,17 (м, 1Н), 7,71 (дд, 1Н, J=8,8, 8,8Гц), 7,49 (c, 1Н), 1,48 (с, 9Н). Е) трет-Бутил-6-(2-фтор-4-(3-(4фтор феніламіно)-3оксопропанамідо)фенокси)піримідин-4-ілкарбамат Названу в заголовку сполуку одержують з трет-бутил-6-(4-аміно-2-фторфенокси)піримідин-4ілкарбамату (8мг, 0,025ммоль) та (4фтор феніламіно)-3-оксопропанової кислоти (6мг, 0,031ммоль, Сполука В Прикладу 1), ТБТУ (11мг, 0,034ммоль) та ДІПЕА (6мкл, 0,030ммоль) з використанням методики, подібної до описаної для одержання сполуки С, Приклад 1. Флешхроматографія з використанням 1-1,5% MeOH в CH2CI2 як елюенту дає названу сполуку у вигляді білої твердої речовини (10мг, 80%). 1H ЯМР (ДMCO-d6) δ 10,48 (с, 1Н), 10,46 (с, 1Н), 10,25 (с, 1H), 8,39 (с, 1H), 7,74-7,77 (м, 1H), 7,62 (д, 1H, J=5,5Гц), 7,61 (д, 1Н, J=4,9Гц), 7,36-7,30 (м, 2H), 7,17-7,13 (м, 2H), 3,48 (с, 2H), 1,46 (с, 9H); MS (ESI+) m/z 500,12 (M+H)+. Приклад 7 трет-Бутил-6-(2-фтор-4-(3-(4фтор фенілаіиіно)-3оксопропанамідо)фенокси)піримідин-4іл(метил)карбамат А) трет-Бутил-6-(2-фтор-4нітрофенокси)піримідин-4-іл(метил)карбамат Розчин трет-бутил-6-(2-фтор-4нітрофенокси)піримідин-4-ілкарбамату (Сполука C Прикладу 6,44мг, 0,13ммоль) в безводному ДМФА 51 85087 (1мл) охолоджують на льодяній бані та обробляють 60% NaH (44мг, 0,16ммоль) та перемішують при тій же температурі протягом 30хв. Реакційну суміш обробляють йодметаном (10мкл, 0,15ммоль) та перемішують при 0-5°C, витримуючи при цій температурі протягом 10хв. Реакційній суміші дозволяють нагрітися до кімнатної температури та перемішують протягом 30хв. С уміш розбавляють H2O (10мл) та екстрагують етилацетатом (2´10мл). Об'єднані екстракти сушать (MgSO4) та упарюють під вакуумом з одержанням продукту (35мг, 74%) у вигляді твердої речовини блідожовтого кольору. 1H ЯМР (ДMCO-d6) δ 8,57 (д, 1H, J=1,1Гц), 8,37 (дд, 1Н, J=9,8, 3,0Гц), 8,19 (ддд, 1Н, J=9,1, 2,5, 10Гц), 7,71 (дд, 1Н, J=8,8, 8,8Гц), 7,66 (с, 1Н), 3,38 (с, 3H), 1,51 (с, 9Н). В) трет-Бутил-6-(4-аміно-2фтор фенокси)піримідин-4-іл(метил)карбамат Суміш трет-бутил-6-(2-фтор-4нітрофенокси)піримідин-4-іл(метил)карбамату в суміші ЕtOН/МеОН 1:1 (2мл) обробляють PtO2 (10мг) і реакційну суміш перемішують в а тмосфері H2 (з латексного балону) протягом 2год. Реакційну суміш фільтрують та упарюють з одержанням цільового продукту (30мг, 75%) у вигляді твердої речовини світло-коричневого кольору. MS (ESI+) m/z 365,13 (M+H)+. C) трет-Бутил-6-(2-фтор-4-(3-(4фтор феніламіно)-3оксопропанамідо)фенокси)піримідин-4іл(метил)карбамат Названу в заголовку сполуку одержують з трет-бутил-6-(4-аміно-2-фторфенокси)піримідин-4іл(метил)карбамату (30мг, 0,068ммоль), 4фтор фенілацетилхлориду (Lancaster, 15мг, 0,088ммоль) та NaSCN (9мг, 0,11ммоль) в суміші етилацетат/СН2СІ2 з використанням методики, подібної до описаної для одержання сполуки C Прикладу 2. Флеш-хроматографія на SiO2 з використанням 1-40% етилацетату в гексані як елюенту дає названу сполуку (30мг, 83%) у вигляді білої твердої речовини. 1H ЯМР (ДМСО-d6) δ 12,40 (с, 1Н), 11,79 (с, 1Н), 8,55 (с, 1Н), 7,86 (дд, 1H, J=12,1, 2,5Гц), 7,54 (д, 1Н, J=1,1Гц), 7,45-7,35 (м, 4H), 7,207,14 (ддд, 2Н, J=8,8, 8,8, 2,1Гц), 3,81 (с, 2H), 3,36 (с, 3H), 1,49 (с, 9H); MS (ESI+) m/z 530,09 (M+H)+. Приклад 8 1-(3-Фтор-4-(6-(метиламіно)піримідин-4ілокси)феніл)-3-(2-(4фтор феніл)ацетил)тіосечовина 52 трет-Бутил-6-(2-фтор-4-(3-(4-фторфеніламіно)3-оксопропанамідо)фенокси)піримідин-4іл(метил)карбамат (Приклад 7, 25мг, 0,047ммоль) обробляють 4M HCI в 1,4-діоксані (3мл), перемішують при кімнатній температурі протягом 4год. та упарюють під вакуумом. Залишок розподіляють між насиченим водним розчином NaHCO3 та EtOAc. Фракцію EtOAc відокремлюють, сушать (MgSO4) та упарюють під вакуумом Флешхроматографія на SiO2 з використанням 1% MeOH в CH2CI2 як елюенту дає названу сполуку (10мг, 50%) у вигляді білої твердої речовини 1H ЯМР (ДМСО-d6) δ 12,37 (с, 1Н), 11,77 (с, 1Н), 8,09 (с, 1H), 7,82 (д, 1Н, J=11,6Гц), 7,41-7,35 (м, 5H), 7,327,28 (м, 1H), 7,19-7,14 (м, 2H), 3,81 (с, 2H), 2,78 (с, 3H); MS (ESI+) m/z 430,07 (M+H)+. Приклад 9 1-(4-(6-Амінопіримідин-4-ілокси)-3-фторфеніл)3-(2-(4-фторфеніл)ацетил)тіосечовина А) 6-(N,N-ди-трет-Бутилоксикарбоніл)аміно-4(2-фтор-4-нітрофенокси)піримідин Суміш 6-(2-фтор-4-нітрофенокси)піримідин-4аміну (Сполука В Прикладу 6,150мг, 0,60ммоль), BOC2O (275мг, 1,26ммоль), ДМАП (5мг) та ТГФ (20мл) перемішують при кімнатній температурі протягом 2,5год. Реакційну суміш упарюють під вакуумом з одержанням сирого продукту. Флешхроматографія на SiO2 з використанням 5-15% етилацетату в гексані як елюенту дає названу сполуку (180мг, 67%) у вигляді білої твердої речовини. 1H ЯМР (ДMCO-d6) δ 8,62 (д, 1Н, J=1,0Гц), 8,42-8,39 (м, 1Н), 8,21 (ддд, 1Н, J=9,1, 2,5,1,0Гц), 7,77 (дд, 1Н, J=8,8, 8,8Гц), 7,49 (д, 1Н, J=1,1Гц), 1,49 (с, 18Н); MS (ESI+) m/z 451,12 (M+H)+. В) 6-(N,N-ди-трет-Бутилоксикарбоніл)аміно-4(4-аміно-2-фторфенокси)піримідин Суміш 6-(N,N-ди-третбутилоксикарбоніл)аміно-4-(2-фтор-4нітрофенокси)піримідину (175мг, 0,38ммоль) в толуолі (5мл) та MeOH (3мл) обробляють PtO2 (35мг) і реакційну суміш перемішують в а тмосфері H2 (з латексного балону) протягом 15год. Каталізатор відфільтровують, фільтрат упарюють під вакуумом 53 85087 54 та залишок очищують флеш-хроматографією на SiO2 з використанням 1-10% MeOH в CH 2CI2 як елюенту з одержанням продукту (110мг, 68%) у вигляді білої твердої речовини. 1H ЯМР (ДМСО-d6) δ 8,56 (с, 1Н), 7,17 (с, 1Н), 6,97 (дд, 1Н, J=8,8, 8,8Гц), 6,46 (дд, 1H, J=12,6,2,5Гц), 6,38 (дд, 1Н, J=8,8,2,5Гц), 5,40 (с, 2Н), 1,89 (с, 18Н). C) 1-(4-(N,N-ди-трет-Бутилоксикарбоніл 6амінопіримідин-4-ілокси)-3-фторфеніл)-3-(2-(4фтор феніл)ацетил)тіосечовина Названу в заголовку сполуку одержують з 6(Ν,Ν-ди-трет-бутилоксикарбоніл)аміно-4-(4-аміно2-фторфенокси)піримідину (20мг, 0,048ммоль), 4фтор фенілацетилхлориду (Lancaster, 10мг, 0,062ммоль) та NaSCN (95мг, 0,062ммоль) в суміші етилацетат/СН 2СІ2 з використанням методики, подібної до описаної для одержання сполуки C Прикладу 2. Флеш-хроматографія на SiO2 з використанням 10-20% етилацетату в гексані як елюенту дає названу сполуку (23мг, 77%) у вигляді білої твердої речовини. 1H ЯМР (ДMCO-d6) δ 12,40 (с, 1Н), 11,79 (с, 1H), 8,59 (с, 1H), 7,88 (дд, 1Н, J=12,5,1,8Гц), 7,46-7,41 (м, 2H), 7,38-7,35 (м, 3H), 7,17 (дд, 2Н, J=8,8, 8,8Гц), 3,81 (с, 2H), 1,47 (с, 18H); MS (ESI+) m/z 616,12 (M+H)+. D) 1-(4-(6-Амінопіримідин-4-ілокси)-3фтор феніл)-3-(2-(4-фторфеніл)ацетил)тіосечовина Суміш 1-(4-(N,N--ди-трет-бутилкарбоніл-6амінопіримідин-4-ілокси)-3-фторфеніл)-3-(2-(4фтор феніл)ацетил)тіосечовини (18мг, 0,029ммоль) та 4M HCI в діоксані (1,5мл) перемішують при кімнатній температурі протягом 18год., після чого упарюють з одержанням сирого продукту. Сирий продукт розподіляють між EtOAc та насиченим водним розчином NaHCO3. Фракцію EtOAc відокремлюють, сушать (MgSO4), упарюють під вакуумом та залишок очищують флеш-хроматографією на SiO2 з використанням 1-2% MeOH в CH2CI2 з одержанням названої в заголовку сполуки (12мг, 99%) у вигляді білої твердої речовини. 1H ЯМР (ДMCO-d6) δ 12,38 (с, 1Н), 11,77 (с, 1H), 8,05 (с, 1H), 7,83 (дд, 1Н, J=12,3,1,8Гц), 7,41-7,35 (м, 3H), 7,31 (дд, 2Н, J=8,8, 8,8Гц), 7,17 (т, 1H, J=8,8Гц), 7,02 (с, 2H), 5,89 (с, 1H), 3,81 (с, 2H); MS (ESI+) m/z 416,06 (M+H)+. Приклад 10 N1-1-(4-(6-Амінопіримідин-4-ілокси)-3фтор феніл)-N3-(4-фторфеніл)малонамід A) N1-(4-(N,N-ди-трет-Бутилкарбоніл-6амінопіримідин-4-ілокси)-3-фторфеніл)-N3(4чрторфеніл)малонамід Названу в заголовку сполуку одержують з суміші 6-(N,N-ди-трет-бутилоксикарбоніл)аміно-4-(4аміно-2-фторфенокси)піримідину (Сполука В Прикладу 9,20мг, 0,048ммоль), 3-(4-фторфеніламіно)3-оксопропанової кислоти (Сполука В Прикладу 1,14мг, 0,072ммоль), ДІПЕА (12мкл, 0,069ммоль) в ДМФА з використанням методики, подібної до описаної для одержання сполуки C Прикладу 1. Флеш-хроматографія на SiO2 з використанням 1550% етилацетату в гексані як елюенту дає названу сполуку (23мг, 80%) у вигляді білої твердої речовини. 1H ЯМР (ДMCO-d6) δ 10,47 (с, 1Н), 10,24 (с, 1Н), 8,58 (д, 1Н, J=1Гц), 7,77 (дд, 1Н, J=12,9,1,8Гц), 7,63-7,60 (м, 2Н), 7,37-7,36 (м, 2Н), 7,32 (с, 1Н), 7,15 (т, 2Н, J=8,8Гц), 1,47 (с, 18Н); MS (ESI+) m/z 600,17 (M+H)+. B) N1-(4-(6-Амінопіримідин-4-ілокси)-3фтор феніл)-N3-(4-фторфеніл)малонамід Названу в заголовку сполуку одержують з N1(4-(N,N-ди-трет-бутилкарбоніл-6-амінопіримідин-4ілокси)-3-фторфеніл)-N-3-(4фтор феніл)малонаміду (20мг, 0,032ммоль) з використанням методики, подібної до описаної для одержання сполуки D Прикладу 9, з одержанням названої в заголовку сполуки (13мг, 98%) у вигляді білої твердої речовини. 1H ЯМР (ДМСО-d6) δ 10,42 (с, 1Н), 10,24 (с, 1Н), 8,03 (с, 1Н), 7,73 (д, 1H, J=11,0Гц), 7,61 (дд, 2Н, J=9,2, 4,9Гц), 7,33-7,30 (м, 1H), 7,28-7,23 (м, 1H), 7,18-7,13 (м, 2H), 6,89 (с, 2H), 5,80 (с, 1H), 3,47 (с, 2H); MS (ESI+) m/z 400,09 (M+H)+. Приклад 11 1-(4-(6-(4-Метоксибензиламіно)піримідин-4ілокси)-3-фторфеніл)-3-(2-(4фтор феніл)ацетил)сечовина А) N-(4-Метоксибензил)-6-хлорпіримідин-4амін Суміш 4,6-дихлорпіримідину (Aldrich, 3,6г, 24,2ммоль), 4-метоксибензиламіну (2,7г, 19,7ммоль), DEPEA (5мл, 28,8ммоль) та H-BuOH 55 85087 кип'ятять із зворотним холодильником протягом 3год. Суміш упарюють і залишок обробляють H 2O (150мл) та EtOAc (175мл). Фракцію EtOAc відокремлюють, промивають насиченим водним розчином NaHCO3 і розсолом, сушать (MgSO4) та упарюють з одержанням названої в заголовку сполуки (4,5г), яку застосовують без подальшого очищення. 1H ЯМР (ДМСО-d6) δ 8,29 (с, 1Н), 8,13 (ш с, 1Н), 7,25 (д, 2Н, J=8,2Гц), 6,90 (д, 2Н, J=8,2Гц), 6,56 (с, 1Н), 4,48(с, 2Н), 3,75(с, 3H). B) N-(4-Метоксибензил)-6-(2-фтор-4нітрофенокси)піримідин-4-амін Суміш N-(4-метоксибензил)-6-хлортримідин-4аміну (2,3г, 9,2ммоль), 2-фтор-4-нітрофенолу (1,45г, 9,2ммоль), ДІПЕА (15мл) та 2метоксиетилового ефіру (75мл) нагрівають до 160°С в закупореній пляшці, призначеній для роботи під тиском, протягом 50год. Суміш охолоджують, виливають на подрібнений лід (200г), обробляють етилацетатом (200мл). Після енергійного перемішування протягом 10хв., нерозчинний матеріал відфільтровують. Фракцію EtOAc промивають насиченим водним розчином Na2CO3 (100мл), розсолом (3´100мл), сушать (MgSO4) та упарюють під вакуумом. Одержану смолисту тверду речовину розтирають з ізопропіловим ефіром з одержанням названої в заголовку сполуки (1,75г, 76%) у вигляді твердої речовини коричневого кольору. 1H ЯМР (ДМСО-d6) δ 8,32 (дд, 1Н, J=10,2,2,0Гц), 8,15 (д, 2Н, J=9,2Гц), 8,05 (ш с, 1Н), 7,61 (дд, 1H, J=8,4, 8,4Гц), 7,26 (д, 2H, J=8,5Гц), 6,91 (д, 2H, J=8,5Гц), 6,14 (ш с, 1Н), 4,48 (ш с, 2Н), 3,74 (с, 3H). C) N-(4-Метоксибензил)-6-(4-аміно-2фтор фенокси)піримідин-4-амін Розчин N-(4-метоксибензил)-6-(2-фтор-4нітрофенокси)піримідин-4-амін (150мг, 0,41ммоль) в 1:1 MeOH/ТГФ (20мл) обробляють амонію хлориду (0,22г, 4,1ммоль) та цинковий пил (
ДивитисяДодаткова інформація
Назва патенту англійськоюMonocyclic heterocycles as kinase inhibitors
Автори англійськоюBorzilleri Robert M., Cornelius Lyndon A. M., Schmidt Robert J., Schroeder Gretchen M., Kim Kyoung S.
Назва патенту російськоюМоноциклические гетероциклы - ингибиторы киназы
Автори російськоюБорзиллери Роберт М., Корнелиус Линдон А.М., Шмидт Роберт Дж., Шредер Гретхен М., Ким Кьянг С.
МПК / Мітки
МПК: C07D 213/75, C07D 417/12, C07D 401/12, C07D 401/14, C07D 213/68, C07D 401/04, C07D 239/34, C07D 213/74, A61K 31/44, C07D 213/73, A61P 35/00, C07D 401/06, C07D 239/46
Мітки: моноциклічні, гетероцикли, кінази, інгібітори
Код посилання
<a href="https://ua.patents.su/102-85087-monociklichni-geterocikli-yak-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Моноциклічні гетероцикли як інгібітори кінази</a>
Попередній патент: Спосіб комплексного рибозахисту водозаборів та пристрій для його здійснення
Наступний патент: Інструмент для виймання клапанного пристрою
Випадковий патент: Спосіб підвищення віддачі потужності нагрівально-спонукаючим пристроєм опалювальним приладам