Пероральна комплексна композиція, яка містить складний ефір жирної кислоти омега-3 і інгібітор hmg-coa редуктази
Номер патенту: 106457
Опубліковано: 26.08.2014
Автори: Кім Йонг Іл, Воо Дзонг-Соо, Ім Хо Таєк, Шин Йоон Суб, Йоон Єун Дзін, Парк Дзає Хіун
Формула / Реферат
1. Пероральна комплексна композиція, яка містить:
(a) серцевину у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3;
(b) перший покривний шар, який містить серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і
(c) другий покривний шар, нанесений на перший покривний шар, який містить:
(і) розувастатин або його фармацевтично прийнятну сіль і
(іі) полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш.
2. Пероральна комплексна композиція за п. 1, де складні ефіри жирної кислоти омега-3 містять етилові ефіри ейкозапентаенової кислоти і докозагексанової кислоти в кількості 80 % по масі або більше.
3. Пероральна комплексна композиція за п. 1, де складні ефіри жирної кислоти омега-3 присутні в кількості від 100 мг до 2000 мг.
4. Пероральна комплексна композиція за п. 1, де гідрофобна покривна речовина вибрана з групи, що складається з ацетатцелюлози, полівінілацетату, етилцелюлози, співполімерів (метил)акрилової кислоти і їх суміші.
5. Пероральна комплексна композиція за п. 1, де гідрофобна покривна речовина присутня в кількості від 15 % до 75 % по масі з розрахунку на загальну кількість першого покривного шару.
6. Пероральна комплексна композиція за п. 1, де розувастатин або його фармацевтично прийнятна сіль присутні в кількості від 1 мг до 50 мг.
7. Пероральна комплексна композиція за п. 1, де полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш присутні в кількості від 25 % до 85 % по масі з розрахунку на загальну кількість другого покривного шару.
8. Пероральна комплексна композиція за п. 1, яка демонструє швидкість вивільнення розувастатину або його фармацевтично прийнятної солі 80 % або більше в 0,05 М цитратному буфері протягом 10 хв.
9. Спосіб отримання пероральної комплексної композиції за п. 1, який містить етапи:
(1) отримання серцевини у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3;
(2) формування першого покривного шару, який містить серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і
(3) формування другого покривного шару на першому покривному шарі, який містить:
(і) розувастатин або його фармацевтично прийнятну сіль і
(іі) полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш.
Текст
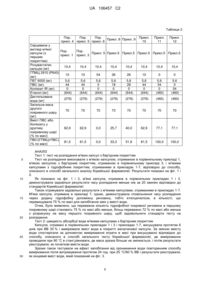
Реферат: Винахід належить до пероральної комплексної композиції, що містить складні ефіри жирної кислоти омега-3 і інгібітор HMG-CoA редуктази, може ефективно підвищувати рівень сироваткового ЛПВГ, при цьому знижуючи рівні сироваткового ЛПНГ і ТГ, і може бути використаний для лікування гіперліпідемії завдяки хорошій швидкості розчинення лікарського засобу і стійкості при зберіганні, виявляючи відсутність властивості уповільненого вивільнення навіть після 6 місяців прискореного зберігання. UA 106457 C2 (12) UA 106457 C2 UA 106457 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується пероральної комплексної композиції, яка містить складні ефіри жирної кислоти омега-3 і інгібітор HMG-CoA редуктази. РІВЕНЬ ТЕХНІКИ, ПОПЕРЕДНІЙ ВИНАХОДУ Морські жири, які також звичайно називаються риб'ячими жирами, є основними джерелами жирних кислот омега-3, тобто ейкозапентаенової кислоти (ЕПК) і докозагексанової кислоти (ДГК), які модулюють ліпідний метаболізм. Жирні кислоти омега-3 можуть без яких-небудь небажаних побічних ефектів підвищувати сироватковий холестерин ліпопротеїнів високої густини (ЛПВГ), при цьому знижуючи сироваткові тригліцериди (ТГ), систолічний і діастолічний тиск крові, частоту серцевих скорочень і активацію комплексу фактора згортання крові VII і фосфоліпідів. Доступними в цей час лікарськими засобами з жирними кислотами омега-3 є етилові ефіри жирної кислоти омега-3 (що далі в цьому документі називаються "складні ефіри жирної кислоти омега-3"), етил-етерифікований концентрат жирних кислот омега-3, тобто поліненасичених ® жирних кислот з ДГК і ЕПК-вмісних риб'ячих жирів, і продаються під торговою назвою ОМАКОР . Такі складні ефіри жирної кислоти омега-3 звичайно виготовляють в формі капсули, такої як желатинова капсула, як розкрито в патентах США №№ 5502077, 5656667 і 5698594. Крім продуктів природної ферментації, мевастатину і ловастатину (МЕВАКОР®; див. патент США № 4231938), існують різні типи синтезованих і напівсинтезованих інгібіторів HMG-CoA ® редуктази, включаючи симвастатин (ЗОКОР ; див. патент США № 4444784), натрієву сіль ® правастатину (ПРАВАХОЛ ; див. патент США № 4346227), натрієву сіль флувастатину ® ® (ЛЕСКОЛ ; див. патент США № 5354772), кальцієву сіль аторвастатину (ЛІПІТОР ; див. патент США № 5273995), натрієву сіль церивастатину (також відому, як ривастатин; див. патент США ® № 5177080), кальцієву сіль розувастатину (КРЕСТОР ; див. патент Кореї № 105431) і кальцієву ® сіль питавастатину (ЛІВАРО ; див. патент Кореї № 101149). Такі інгібітори HMG-CoA редуктази містять 3-гідроксилактони або відповідні дигідроксикислоти з розкритим кільцем, і їх часто називають "статини". Статини звичайно використовуються для підтримки рівнів холестерину в нормальному діапазоні. Статини можуть інгібувати HMG-CoA редуктазу, яка регулює синтез холестерину, тим самим сповільнюючи вироблення холестерину, або можуть знижувати сироватковий холестерин ліпопротеїнів низької густини (ЛПНГ) підвищуючим регулюванням ЛПНГ рецепторів в печінці. Таким чином, головна функція статинів полягає в зменшенні холестерину ЛПНГ. Відомо, що статини знижують ризик коронарної хвороби серця (КХС) на одну третину і ще володіють обмеженими ефектами на ТГ і сироватковий ЛПВГ. Пацієнти з гіперхолестеринемією і змішаною дисліпідемією демонструють високі рівні ЛПНГ і ТГ. Ефективним є використання фармацевтичної комбінації складних ефірів жирної кислоти омега-3 і статинів, тому що вона підходить для лікування високих рівнів як ЛПНГ, так і ТГ. Отже, розробка фармацевтичної комбінації складних ефірів жирної кислоти омега-3 і статинів може бути придатна для лікування гіперліпідемії за рахунок підвищення сироваткового ЛПВГ і одночасного зниження рівнів ЛПНГ і ТГ. У зв'язку з цим мала місце велика кількість досліджень комбінованого складу складних ефірів жирної кислоти омега-3. Наприклад, в ® публікації патенту США № 2007/0212411 розкриті комбіновані склади ОМАКОР шляхом здійснення послідовно-полімерного бар'єрного покриття, лікарського покриття і верхнього покриття. Приклади активних фармацевтичних інгредієнтів, які можуть бути використані для покриттів, включають в себе симвастатин, фенофібрат, правастатин, пропранолол, еналаприл і пріоглітазон. Патентні публікації Кореї №№ 2007-0038553, 2007-0108945 і 2009-0086078 розкривають фармацевтичні композиції зі змішуванням напряму складних ефірів жирної кислоти омега-3 зі статинами, однак їх лікарська стабільність не може бути гарантована при змішуванні напряму. Також патентні публікації Кореї №№ 2007-0108945 і 2007-0083715 стосуються фармацевтичних композицій, що містять статини або їх мікрокапсули. Композиції складаються у вигляді м'якої капсули, змішуються з маслами жирної кислоти омега-3, які спричиняють уповільнене вивільнення статину, так що швидкість розчинення статину набагато нижча, ніж у доступних для придбання в цей час статинових лікарських засобів. У цей час не існує доступного лікарського засобу з пероральною композицією, що містить складні ефіри жирної кислоти омега-3 і інгібітор HMG-CoA редуктази, що має таку ж швидкість розчинення статину, як у доступних для придбання статинових лікарських засобів. Отже, має місце потреба в розробці комплексної композиції, що містить складні ефіри жирної кислоти омега-3 і інгібітори HMG-CoA редуктази, які є фармацевтично стабільними; що мають такі ж швидкість розчинення і ефективність, як доступні для придбання статинові лікарські засоби; і що не виявляють властивостей уповільненого вивільнення навіть після тривалого зберігання. 1 UA 106457 C2 5 10 15 20 25 30 35 40 45 50 55 60 СУТЬ ВИНАХОДУ Відповідно, задача даного винаходу полягає в наданні пероральної комплексної композиції, що містить складні ефіри жирної кислоти омега-3 і розувастатин або його фармацевтично прийнятну сіль, яка виявляє поліпшену швидкість вивільнення розувастатину і не демонструє властивість відстроченого вивільнення навіть після довготривалого зберігання. Інша задача даного винаходу полягає в наданні способу отримання пероральної комплексної композиції. Відповідно до одного аспекту даного винаходу надана пероральна комплексна композиція, яка містить: (a) серцевину у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (b) перший покривний шар, який містить в собі серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (с) другий покривний шар, нанесений на перший покривний шар, який містить (i) розувастатин або його фармацевтично прийнятну сіль і (ii) полівініловий спирт (ПВС), графт-співполімер полівінілового спирту і поліетиленгліколю (ПВСПЕГ) або їх суміш. Відповідно до іншої задачі даного винаходу наданий спосіб отримання пероральної комплексної композиції, який містить етапи: (1) отримання серцевини у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (2) формування першого покривного шару, який містить в собі серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (3) формування другого покривного шару на першому покривному шарі, який містить (i) розувастатин або його фармацевтично прийнятну сіль і (ii) ПВА, графт-співполімер ПВС-ПЕГ або їх суміш. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Вищенаведені і інші задачі і особливості даного винаходу стануть очевидними з подальшого опису винаходу в поєднанні з супроводжуючими кресленнями, які демонструють відповідно: фіг. 1: час розпадання капсул, отриманих в порівняльних прикладах 1, 3 і прикладах 1-7; фіг. 2: час розпадання з розрахунку на кількість етилцелюлози в капсулах, отриманих в порівняльному прикладі 3 і прикладах 1-7; фіг. 3: зміни у вмісті води в капсулі, отриманій в порівняльних прикладах 1, 3 і прикладах 1-7; і фіг. 4: зміни в швидкостях розчинення розувастатину в капсулах, отриманих в порівняльних прикладах 2, 4, 5 і прикладах 8-12. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Пероральна комплексна композиція за винаходом характеризується вмістом наступного: (a) серцевина у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (b) перший покривний шар, який містить в собі серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (с) другий покривний шар, нанесений на перший покривний шар, який містить інгредієнти: (i) розувастатин або його фармацевтично прийнятну сіль і (ii) ПВС, графт-співполімер ПВС-ПЕГ або їх суміш. Далі в цьому документі компоненти, що містяться в пероральній комплексній композиції згідно з даним винаходом, описані детально. (a) Серцевина у вигляді м'якої капсули Серцевина у вигляді м'якої капсули з комплексною композицією відповідно до даного винаходу містить складні ефіри жирної кислоти омега-3, як перший активний фармацевтичний інгредієнт. В одному варіанті здійснення даного винаходу складні ефіри жирної кислоти омега-3 можуть містити етилові ефіри ЕПК і ДГК в кількості 80 % по масі або більше, переважно щонайменше 40 % по масі етилового ефіру ЕПК і щонайменше 34 % по масі етилового ефіру ДГК. Переважно складні ефіри жирної кислоти омега-3 можуть містити етиловий ефір жирної кислоти омега-3 в кількості 90 % по масі або більше. Кількість складних ефірів жирної кислоти омега-3, представлених в серцевині у вигляді м'якої капсули, може складати від 100 мг до 2000 мг. У переважному варіанті здійснення даного винаходу кількість складного ефіру жирної кислоти омега-3 може складати від 70 % до 95 % по масі з розрахунку на загальну масу серцевини у вигляді м'якої капсули, але не обмежена ними. Також серцевина у вигляді м'якої капсули може бути отримана звичайним для виробництва м'яких капсул чином за допомогою використання звичайних речовин для м'яких капсул, наприклад, желатину. (b) Перший покривний шар У пероральній комплексній композиції згідно з даним винаходом перший покривний шар містить гідрофобну покривну речовину, яка інкапсулює серцевину у вигляді м'якої капсули для 2 UA 106457 C2 5 10 15 20 25 30 35 40 45 50 55 60 того, щоб запобігти впливу зміни у вмісті води всередині серцевини у вигляді м'якої капсули на швидкість розчинення того, що містить розувастатин другого покривного шару і збільшення пов'язаних з ним речовин. Коли розувастатин нанесений безпосередньо на серцевину у вигляді м'якої капсули, що містить складний ефір жирної кислоти омега-3, то вміст води в капсулі може діяти на вміст розувастатину, знижувати його швидкість розчинення і збільшувати пов'язані з ним речовини. У даному винаході, однак, перший покривний шар, що містить гідрофобну покривну речовину, застосований між серцевиною, що містить складний ефір жирної кислоти омега-3 у вигляді м'якої капсули і другим покровним шаром, що містить розувастатин, мінімізуючи вплив вмісту води, також як і інших видів потенційного ризику. Приклади гідрофобної покривної речовини можуть включати ацетат целюлози, ® полівінілацетат, етилцелюлозу і співполімери (метил)акрилової кислоти, тобто Еудрагіт , переважно етилцелюлозу. Кількість використаної гідрофобної покривної речовини може бути основана на загальній кількості першого покривного шару, від 15 % до 75 % по масі, переважно від 16 % до 75 % по масі, більш переважно від 16 % до 72 % по масі. Якщо кількість використаної гідрофобної покривної речовини менше 15 % по масі, то зміна у вмісті води збільшується, спричиняючи погіршення стійкості при зберіганні за допомогою зниження вмісту розувастатину і швидкості розчинення, також як і збільшення пов'язаних з ним речовин. Перший покривний шар може додатково містити загальноприйняті покривні речовини, такі як гідроксипропілметилцелюлоза (ГПМЦ) і гідроксипропілцелюлоза (ГПЦ), які звичайно використовуються в фармацевтичній галузі. У доповнення, перший покривний шар може додатково містити інші фармацевтично прийнятні добавки, такі як розпушувачі, розріджувачі, стабілізатори, зв'язуючі речовини і модифікатори ковзання, при умові, що вони не впливають негативно на швидкість розпадання капсули. Перший покривний шар може бути отриманий розчиненням або диспергуванням гідрофобної покривної речовини у воді, етанолі або їх суміші, переважно в змішаному розчиннику, для отримання розчину для нанесення покриття і потім нанесення розчину на поверхню серцевини у вигляді м'якої капсули. Перший покривний шар може бути нанесений на серцевину у вигляді м'якої капсули в кількості 2 частин по масі або більше, переважно від 4 до 10 частин по масі з розрахунку на 100 частин від маси серцевини у вигляді м'якої капсули. (с) Другий покривний шар У пероральній комплексній композиції згідно з даним винаходом другий покривний шар містить інгредієнти: (i) розувастатин або його фармацевтично прийнятну сіль як другий активний фармацевтичний інгредієнт і (ii) ПВС, графт-співполімер ПВС-ПЕГ або їх суміш як покривну речовину, яка дозволяє швидке вивільнення розувастатину при розчиненні і також запобігає відстроченому вивільненню розувастатину після зберігання. Другий покривний шар може бути отриманий розчиненням або диспергуванням вказаних інгредієнтів (i) і (ii) у воді, етанолі або їх суміші, переважно в змішаному розчиннику, для отримання розчину для нанесення покриття, з подальшим нанесенням розчину на поверхню першого покривного шару. Кількість інгредієнта (i), застосованого у другому покривному шарі, може складати від 1 мг до 50 мг, і кількість застосованого інгредієнта (ii) може складати від 25 % до 85 % по масі, переважно від 25 % до 80 % по масі з розрахунку на загальну кількість другого покривного шару. Другий покривний шар може додатково містити ГПМЦ, полівінілпіролідон (ПВП) або їх суміш і може також містити інші фармацевтично прийнятні добавки, такі як лужні стабілізатори, якщо потрібно. Другий покривний шар може бути нанесений на перший покривний шар в кількості від 3 до 30 частин по масі, переважно від 5 до 20 частин по масі з розрахунку на 100 частин від маси серцевини у вигляді м'якої капсули. Даний винахід також надає спосіб отримання пероральної комплексної композиції згідно з даним винаходом, який містить етапи: (1) отримання серцевини у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (2) формування першого покривного шару, який містить в собі серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (3) формування другого покривного шару на першому покривному шарі, який містить інгредієнти (i) розувастатин або його фармацевтично прийнятну сіль і (ii) ПВС, графт-співполімер ПВС-ПЕГ або їх суміш. Зокрема, спосіб отримання пероральної комплексної композиції згідно з даним винаходом може містити наступні етапи: (1) приготування серцевини у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3, звичайним для виробництва м'яких капсул способом; (2) формування першого покривного шару, що містить в собі серцевину у вигляді м'якої капсули, 3 UA 106457 C2 5 10 15 20 25 30 35 40 45 50 розчиненням гідрофобної покривної речовини у відповідному розчиннику для бар'єрного покриття, наприклад, в суміші етанолу і води, нанесення розчину для нанесення покриття на серцевину у вигляді м'якої капсули і потім висушування розчину; і (3) формування другого покривного шару на першому покривному шарі розчиненням інгредієнтів (i) і (ii) з лужними стабілізаторами і/або іншими фармацевтично прийнятними добавками у придатному розчиннику, наприклад, в суміші етанолу і води, нанесення розчину для нанесення покриття на поверхню першого покривного шару і потім висушування розчину. Комплексна композиція згідно з даним винаходом може бути отримана в капсульній формі і може бути введена перорально. Пероральна комплексна композиція згідно з даним винаходом може демонструвати швидкість вивільнення розувастатину або його фармацевтично прийнятної солі 80 % або більше в 0,05 M цитратному буфері протягом 30 хв., переважно протягом 10 хв.; і відсутність відстроченого вивільнення після терміну зберігання 6 місяців при 40 °C при відносній вологості (ВВ) 75 %. Результати вищезгаданого тесту показують хорошу швидкість розчинення і стійкість при зберіганні, і, отже, можливе їх використання в композитних формах. Пероральна комплексна композиція згідно з даним винаходом містить, як складні ефіри жирної кислоти омега-3, так і розувастатин, як активні фармацевтичні інгредієнти, які можуть підвищувати рівень сироваткових ЛПВГ, при цьому знижуючи як ЛПНГ, так і ТГ рівні. Таким чином, вона може бути використана для ефективного запобігання або лікування гіпертригліцеридемії, гіперхолестеринемії, коронарно-артеріальних хвороб серця (КАХС), дисліпідемії і підвищених рівнів сироваткового холестерину ЛПНГ, і вона також може бути використана для запобігання або лікування серцево-судинних захворювань. ПРИКЛАДИ Наступні приклади надані для ілюстрації переважних варіантів здійснення даного винаходу, і мається на увазі, що вони не обмежують об'єм даного винаходу. Приготування серцевини у вигляді м'якої капсули Порівняльний приклад 1: м'яка капсула, що містить складний ефір жирної кислоти омега-3 М'яку капсулу виготовили, використовуючи 1000 мг масел, що містять складні ефіри жирної кислоти омега-3, із застосуванням загальноприйнятого способу виробництва м'якої желатинової капсули. Порівняльний приклад 2: м'яка капсула, що містить складний ефір жирної кислоти омега-3 і розувастатин М'яку капсулу виготовили, повторюючи процедури порівняльного прикладу 1, за винятком застосування гомогенної суміші 1000 мг масел, що містять складні ефіри жирної кислоти омега3 і 10 мг розувастатину. Перше покриття Порівняльний приклад 3: м'яка капсула зі складним ефіром жирної кислоти омега-3 із загальноприйнятим бар'єрним покриттям Відповідно до інгредієнтів, описаних в таблиці 1, гідроксипропілметилцелюлозу (ГПМЦ 2910, Shinetsu Co. Ltd., Японія), поліетиленгліколь (ПЕГ 6000, Sanyo Chemical Industries, Ltd., Японія) і полівінілпіролідон (ПВП K-30, BASF SE, Німеччина) додавали до суміші етанолу і води, і потім перемішували для отримання розчину для нанесення покриття. Розчин для нанесення покриття наносили на поверхню серцевини у вигляді м'якої капсули, отриманої в порівняльному прикладі 1, з використанням пристрою для нанесення покриття (SFC-30, SEJONG Co., Ltd.), де температура повітря, що подається, становила 45 °C, і температура продукту була встановлена на 30 °C. Продукт висушували протягом 30 хвилин для видалення залишкового розчинника, таким чином отримували м'яку капсулу з бар'єрним покриттям. Приклади 1-7: м'яка капсула зі складним ефіром жирної кислоти омега-3 з гідрофобним бар'єрним покриттям Відповідно до інгредієнтів, описаних в таблиці 1, м'яку капсулу з гідрофобним бар'єрним покриттям готували повторенням процедури порівняльного прикладу 3, за винятком додавання етилцелюлози (Dow Chemical Company, США), як гідрофобної покривної речовини. Композиції м'яких капсул і бар'єрні покриття підсумовані в таблиці 1. 55 4 UA 106457 C2 Таблиця 1 Пор. Прикл. 1 Прикл. 2 Прикл. 3 Прикл. 4 Прикл. 5 Прикл. 6 Прикл. 7 прикл. 3 Серцевина у Пор. Пор. Пор. Пор. Пор. вигляді м'якої прикл. 1 прикл. 1 прикл. 1 прикл. 1 прикл. 1 капсули ГПМЦ 2910 (% по 80 72 64 48 32 масі) ПЕГ 6000 (% по 10 10 10 10 10 масі) ПВП K-30 (% по 10 10 10 10 10 масі) Етилцелюлоза (% 0 8 16 32 48 по масі) Етанол (мг) (1040) (1040) (1040) (1040) (1040) Дистильована вода (440) (440) (440) (440) (440) (мг) Загальна кількість першого 100 100 100 100 100 покривного шару (% по масі) Вміст ЕЦ в першому 0 8,0 16,0 32,0 48,0 покривному шарі (% по масі) 5 10 15 20 25 Пор. прикл. 1 Пор. Пор. прикл. 1 прикл. 1 16 8 0 10 10 10 10 10 10 64 72 80 (1040) (1040) (1040) (440) (440) (440) 100 100 100 64,0 72,0 80,0 Друге покриття Порівняльні приклади 4-6: м'яка капсула зі складним ефіром жирної кислоти омега-3 з розувастатиновим покриттям Кальцієву сіль розувастатину, гідроксипропілметилцелюлозу (ГПМЦ 2910, Shinetsu Co., Ltd., Японія), поліетиленгліколь (ПЕГ 6000, Sanyo Chemical Industries, Ltd., Японія) і ПВС (Kurary Co., Ltd., Японія) додавали до суміші етанолу і води і потім перемішували для отримання розчину, для нанесення покриття. Розчин для нанесення покриття наносили на поверхню м'яких капсул зі складним ефіром жирної кислоти омега-3, отриманих в порівняльних прикладах 1, 3 і прикладі 5, відповідно, з використанням пристрою для нанесення покриття (SFC-3, SEJONG Co., Ltd.), де температура повітря, що подається, становила 45 °C, і температура продукту була встановлена на 30 °C. Продукти висушували протягом 30 хвилин для видалення залишкового розчинника, таким чином отримували комплексні композиції. Приклади 8-12: м'яка капсула зі складним ефіром жирної кислоти омега-3 з розувастатиновим покриттям Розувастатин кальцію, гідроксипропілметилцелюлозу (ГПМЦ 2910, Shinetsu Co., Ltd., Японія) і поліетиленгліколь (ПЕГ 6000, Sanyo Chemical Industries, Ltd., Японія) додавали до суміші етанолу і води. Туди додавали додатково ПВС (Kurary Co., Ltd., Японія) або графт-співполімер ПВС-ПЕГ (Kollicoat IR, BASF SE, Німеччина) і потім перемішували для отримання розчину для нанесення покриття. Розчин для нанесення покриття наносили на поверхню м'якої капсули зі складним ефіром жирної кислоти омега-3, отриманої в прикладі 5, з використанням пристрою для нанесення покриття (SFC-3, SEJONG Co., Ltd.), де температура повітря, що подається, становила 45 °C, і температура продукту була встановлена на 30 °C. Продукти висушували протягом 30 хвилин для видалення залишкового розчинника, таким чином отримували комплексні композиції. Композиції других покривних шарів підсумовані в таблиці 2. 5 UA 106457 C2 Таблиця 2 Пор. Пор. Пор. Прикл. 8 Прикл. 9 прикл. 4 прикл. 5 прикл. 6 Серцевина у вигляді м'якої Пор. капсули (з прикл. 1 першим покриттям) Розувастатин 10,4 кальцію (мг) ГПМЦ 2910 (Р645) 10 (мг) ПЕГ 6000 (мг) 5,6 ПВС (мг) 44 Колікоат IR (мг) 0 Етанол (мг) (644) Дистильована (276) вода (мг) Загальна маса другого 70 покривного шару (мг) Вміст ПВС або Колікоату у другому 62,9 покривному шарі (% по масі) ПВС/(ГПМЦ+ПВС) 81,5 (% по масі) 5 10 15 20 25 30 Прикл. 10 Прикл. 11 Прикл. 12 Пор. Прикл. 5 Прикл.5 Прикл.5 Прикл.5 Прикл.5 Прикл.5 прикл. 3 10,4 10,4 10,4 10,4 10,4 10,4 10,4 10 54 36 26 10 0 0 5,6 44 0 (644) 5,6 0 0 (644) 5,6 18 0 (644) 5,6 28 0 (644) 5,6 44 0 (644) 5,6 54 0 (460) 5,6 0 54 (460) (276) (276) (276) (276) (276) (460) (460) 70 70 70 70 70 70 70 62,9 0,0 25,7 40,0 62,9 77,1 77,1 81,5 0,0 33,3 51,9 81,5 100,0 100,0 АНАЛІЗ Тест 1: тест на розпадання м'яких капсул з бар'єрним покриттям Тест на розпадання виконували з м'якою капсулою, отриманою в порівняльному прикладі 1, м'якою капсулою з бар'єрним покриттям, отриманою в порівняльному прикладі 3, і м'якими капсулами з гідрофобним покриттям, отриманими в прикладах 1-7, відповідно до способу, описаного в способі загального аналізу Корейської фармакопеї. Результати показані на фіг. 1 і 2. Як показано на фіг. 1 і 2, м'яка капсула, отримана в порівняльних прикладах 1 і 3, демонструвала задовільні результати часу розпадання менше ніж за 20 хвилин відповідно до стандартів Корейської фармакопеї. Також отримували задовільні результати з м'якими капсулами, отриманими в прикладах 1-7. М'яка капсула, отримана в прикладі 7, однак, демонструвала сповільнення часу розпадання через додану гідрофобну допоміжну речовину, тобто етилцелюлози, в кількості, що перевищувала 75 % по масі для запобігання змін у вмісті води. Отже, було виявлено, що переважна кількість гідрофобної покривної речовини в першому покривному шарі становить 75 % по масі або менше, більш переважно 72 % по масі або менше з розрахунку на масу першого покривного шару, щоб задовольнити стандарти тесту на розпадання. Тест 2: швидкість абсорбції води м'якими капсулами з бар'єрним покриттям Капсули, отримані в порівняльних прикладах 1 і 3 і прикладах 1-7, висушували протягом 6 днів при ВВ 30 % і вимірювали вміст води в покритті желатинової капсули. За зміною вмісту води спостерігали за допомогою вимірювання втрати в масі при висушуванні відповідно до способу, описаного в способі загального тесту Корейської фармакопеї, де вимірювання проводили при 90 °C в стані рівноваги, де маса зразка більше не змінюється, і потім результати реєстрували, як початкові вмісти води. Зразки також тестували на ефект запобігання від проникнення води повторенням способу вимірювання після витримування протягом 24 год. при 25 °C/60 % ВВ і результати реєстрували, як кінцевий вміст води, який показаний на фіг. 3. 6 UA 106457 C2 5 10 15 20 25 30 35 40 Як показано на фіг. 3, м'які капсули без покриття і із загальноприйнятим бар'єрним покриттям, отримані в порівняльному прикладі 1 і 3, відповідно, демонстрували відносно велику зміну у вмісті води, тобто 6 % або більше, в порівнянні з початковим вмістом води. Однак, м'які капсули з гідрофобним покриттям, що містить етилцелюлозу, отримані в прикладах 1-7, мали результатом невелику зміну у вмісті води. Зокрема, м'які капсули з гідрофобним покриттям, що містить етилцелюлозу в кількості 16 % або більше, мали результатом тільки 3 % зміну або менше у вмісті води, що демонструє, що застосування етилцелюлози значно поліпшує стабільність композиції, знижуючи абсорбцію води на 50 % або більше в порівнянні з покриттями без етилцелюлози. Додатково, може бути виявлено, що переважна кількість гідрофобної покривної речовини, використаної в першому покривному шарі, складає від 15 % до 75 % по масі, більш переважно від 16 % до 75 % по масі, найбільш переважно від 16 % до 72 % по масі з розрахунку на масу першого покривного шару. Тест 3: швидкість розчинення розувастатину ® Тест розчинення розувастатину виконували з Крестор (AstraZeneca plc, UK), як контрольним лікарським засобом і комплексними композиціями, отриманими в порівняльних прикладах 2, 4-6 і прикладах 8-12. Тест проводили на основі способу з використанням лопатевої мішалки в Корейській фармакопеї при 50 об./хв. з використанням 900 мл буфера 0,05 M лимонної кислоти, як середовища для розчинення і середовища збирали після 10 хвилин, потім вимірювали їх початкові швидкості розчинення. Також, зразки зберігали в герметизованих посудинах з ПЕНД протягом шести місяців при умовах прискореного зберігання (40 °C/75 % ВВ) і вимірювали їх швидкості розчинення. Результати показані на фіг. 4. Як показано на фіг. 4, комплексна композиція, отримана в порівняльному прикладі 2, мала низьку швидкість розчинення розувастатину з початкового вимірювання. Комплексні композиції, отримані в порівняльних прикладах 4 і 5, мали достатні початкові швидкості розчинення 80 % або більше, але швидкості погіршувались після шести місяців прискореного зберігання. Також, комплексна композиція, отримана в порівняльному прикладі 6, яка не містить одне з ПВС або графт-співполімера ПВС-ПЕГ, мала низьку швидкість розчинення в порівнянні з комплексними композиціями прикладів 8-12. З іншого боку, комплексні композиції, отримані в прикладах 8-12, де перший покривний шар містить гідрофобну покривну речовину, тобто етилцелюлозу, в кількості від 16 % до 72 % по масі, і другий покривний шар містить ПВС або графт-співполімер ПВС-ПЕГ з розувастатином, мали початкові швидкості розчинення 80 % або більше. Також, комплексні композиції виявляли мале вивільнення або відсутність відстроченого вивільнення навіть після 6 місяців прискореного зберігання, демонструючи фармацевтично стабільні швидкості розчинення. Відповідно, за результатами може бути виявлено, що комплексна композиція згідно з даним винаходом має ефективність in vivo. Незважаючи на те, що винахід був описаний за допомогою наведених вище конкретних варіантів здійснення, необхідно усвідомлювати, що фахівцем в даній галузі можуть бути внесені різні модифікації і зміни у винаході, і вони також потраплять в об'єм винаходу, як це визначається прикладеною формулою винаходу. ФОРМУЛА ВИНАХОДУ 45 50 55 60 1. Пероральна комплексна композиція, яка містить: (a) серцевину у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (b) перший покривний шар, який містить серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (c) другий покривний шар, нанесений на перший покривний шар, який містить: (і) розувастатин або його фармацевтично прийнятну сіль і (іі) полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш. 2. Пероральна комплексна композиція за п. 1, де складні ефіри жирної кислоти омега-3 містять етилові ефіри ейкозапентаенової кислоти і докозагексанової кислоти в кількості 80 % по масі або більше. 3. Пероральна комплексна композиція за п. 1, де складні ефіри жирної кислоти омега-3 присутні в кількості від 100 мг до 2000 мг. 4. Пероральна комплексна композиція за п. 1, де гідрофобна покривна речовина вибрана з групи, що складається з ацетатцелюлози, полівінілацетату, етилцелюлози, співполімерів (метил)акрилової кислоти і їх суміші. 7 UA 106457 C2 5 10 15 5. Пероральна комплексна композиція за п. 1, де гідрофобна покривна речовина присутня в кількості від 15 % до 75 % по масі з розрахунку на загальну кількість першого покривного шару. 6. Пероральна комплексна композиція за п. 1, де розувастатин або його фармацевтично прийнятна сіль присутні в кількості від 1 мг до 50 мг. 7. Пероральна комплексна композиція за п. 1, де полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш присутні в кількості від 25 % до 85 % по масі з розрахунку на загальну кількість другого покривного шару. 8. Пероральна комплексна композиція за п. 1, яка демонструє швидкість вивільнення розувастатину або його фармацевтично прийнятної солі 80 % або більше в 0,05 М цитратному буфері протягом 10 хв. 9. Спосіб отримання пероральної комплексної композиції за п. 1, який містить етапи: (1) отримання серцевини у вигляді м'якої капсули, що містить складні ефіри жирної кислоти омега-3; (2) формування першого покривного шару, який містить серцевину у вигляді м'якої капсули і містить гідрофобну покривну речовину; і (3) формування другого покривного шару на першому покривному шарі, який містить: (і) розувастатин або його фармацевтично прийнятну сіль і (іі) полівініловий спирт, графт-співполімер полівінілового спирту і поліетиленгліколю або їх суміш. 8 UA 106457 C2 Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюOral complex composition comprising omega-3 fatty acid ester and hmg-coa reductase inhibitor
Автори англійськоюKim, Yong Il, Yoon, Eun Jin, Im, Ho Taek, Shin, Yoon Sub, Park, Jae Hyun, Woo, Jong Soo
Автори російськоюКим Йонг Ил, Йоон Еун Дзин, Им Хо Таек, Шин Йоон Суб, Парк Дзае Хиун, Воо Дзонг Соо
МПК / Мітки
МПК: A61K 31/20, A61K 47/48, A61K 9/28, A61K 9/48
Мітки: комплексна, омега-3, яка, hmg-coa, складний, жирної, містить, інгібітор, ефір, пероральна, кислоти, редуктази, композиція
Код посилання
<a href="https://ua.patents.su/11-106457-peroralna-kompleksna-kompoziciya-yaka-mistit-skladnijj-efir-zhirno-kisloti-omega-3-i-ingibitor-hmg-coa-reduktazi.html" target="_blank" rel="follow" title="База патентів України">Пероральна комплексна композиція, яка містить складний ефір жирної кислоти омега-3 і інгібітор hmg-coa редуктази</a>
Попередній патент: Прес для виготовлення пустотілої цегли
Наступний патент: Процес виробництва коксу з високим вмістом vcm
Випадковий патент: Спосіб проведення аерофотозйомки для якісної оцінки рослинності за азотом