Спосіб одержання похідних 5′-дезокси-5-фторцитидину
Номер патенту: 19333
Опубліковано: 25.12.1997
Автори: Моріо Фуджію, Масанорі Міва, Хідео Ішітсука, Казутеру Іокосе, Ісао Умеда
Формула / Реферат
Способ получения производных 5'-дезокси-5-фторцитидина общей формулы
где R1, R2 и R3 независимо друг от друга радикал R4CO- или R5OCO- или R6SCO-, где R4 - алкил С1-С17 циклоалкил С3-С10, С3 - алкенил, бензил, фенэтил. Фенил, возможно замещенный атомом хлора или фтора, метильной группой, одной или двумя или тремя метоксигруппами, нитрогруппой, ацетоксигруппой, тиометильной группой или R4-фенилвинил, 3-индолилметил, пиридил, фурил, тиенил, нафтил, пиперонил, нитрофурил, R5-алкил C1-C8- -бензил, R6-алкил С2-С4, при условии, что один из R1, R2 и R3 не является водородом, отличающийся тем, что соединение общей формулы
где R7 и R8 - защитная группа, подвергают взаимодействию с соединением общей формулы: XCOR7,
где Х-ОН группа, -COOR7 или галоген,
R4 имеет указанные значения, или соединением общей формулы HalCOR9,
где НаР - галоген,
R9 - радикал R5O, или R6S, где R5 и R6 имеют указанные значения с последующим удалением защитных групп.
Текст
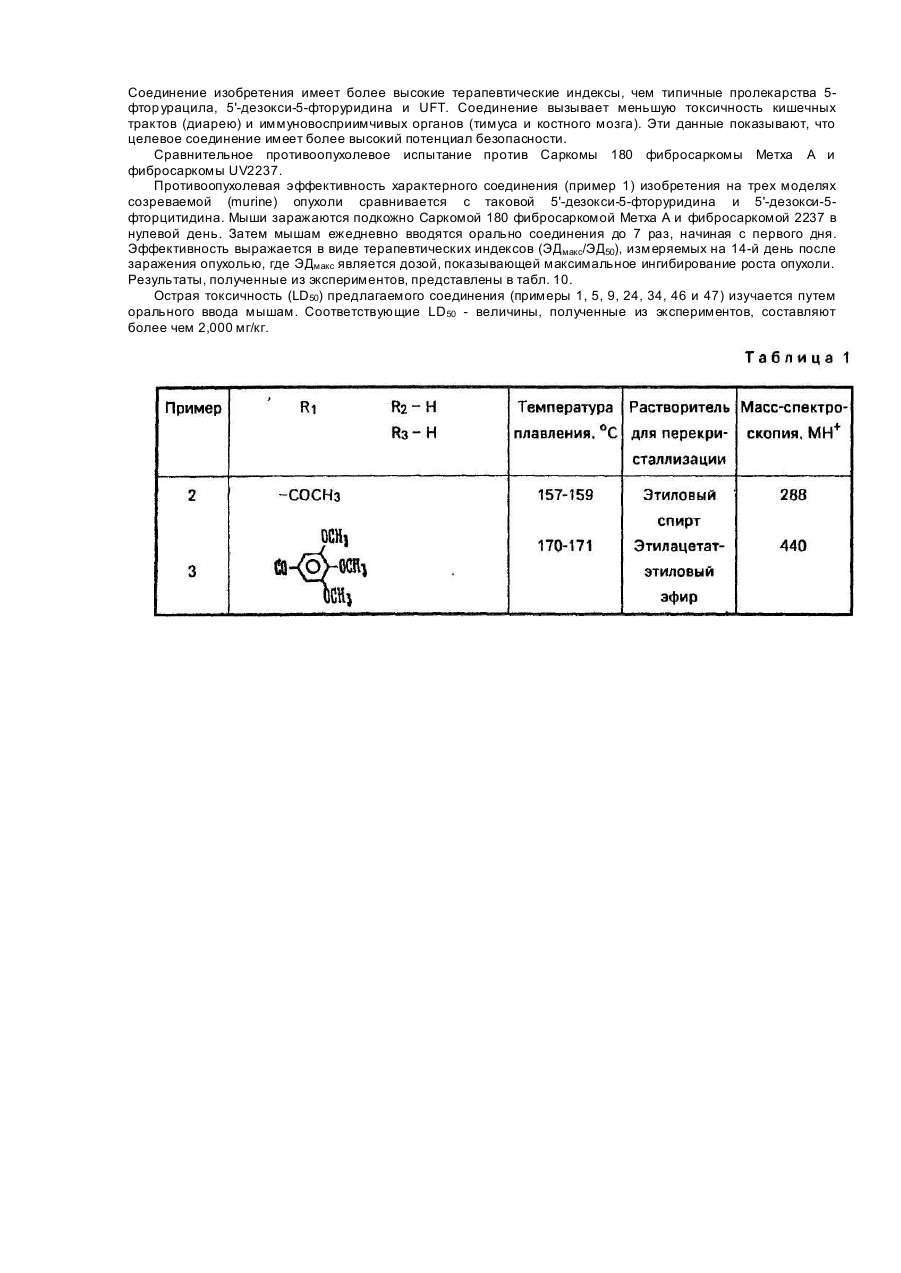
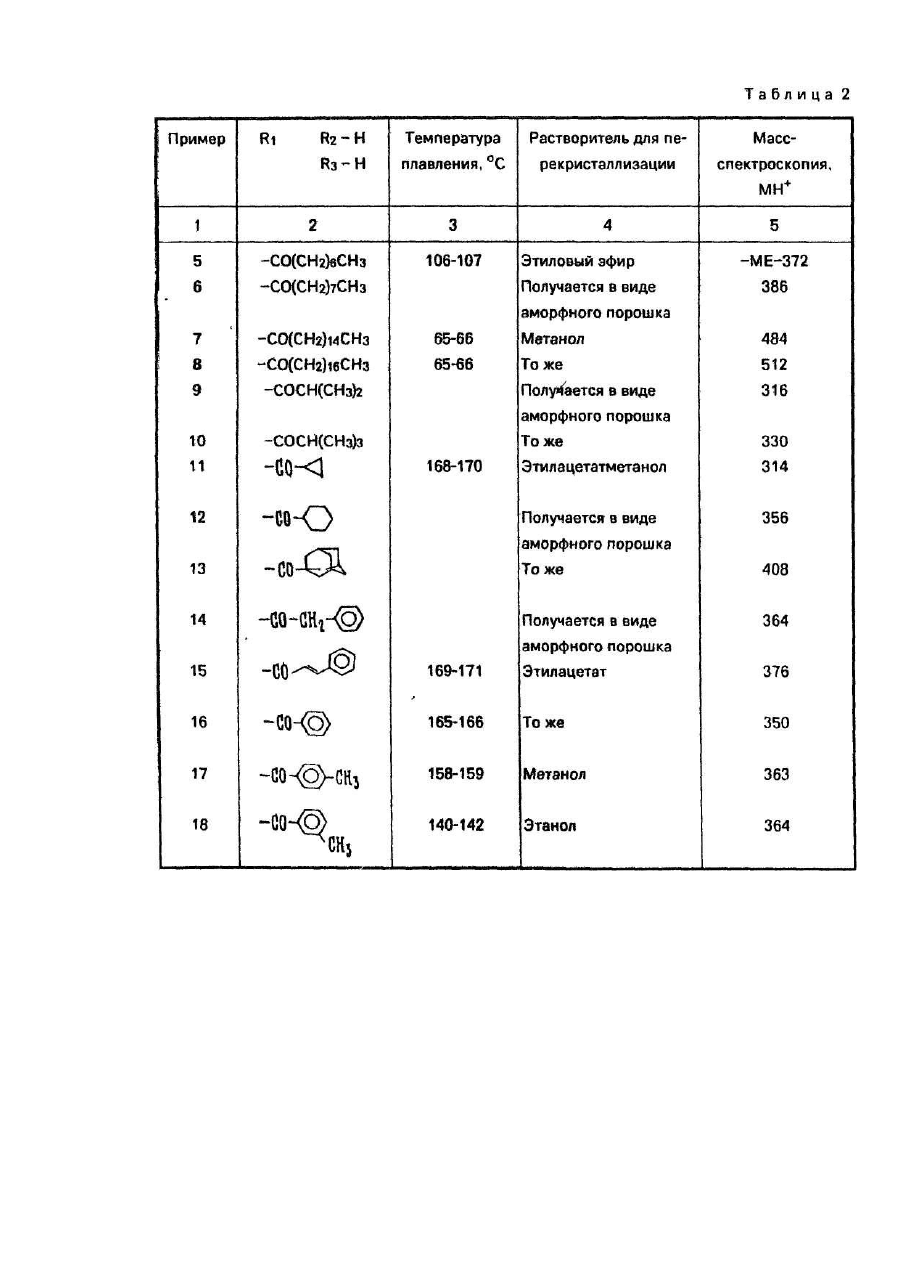
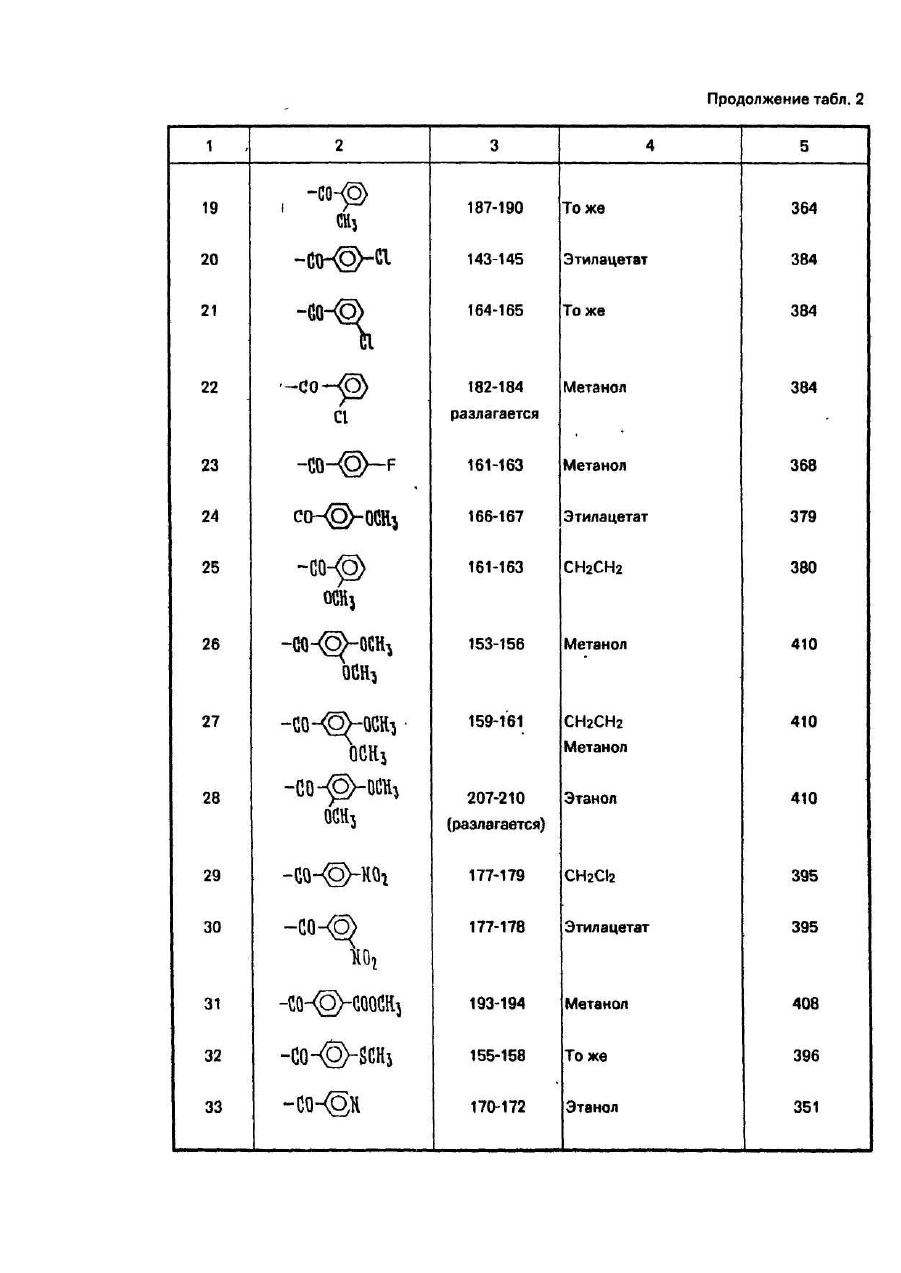
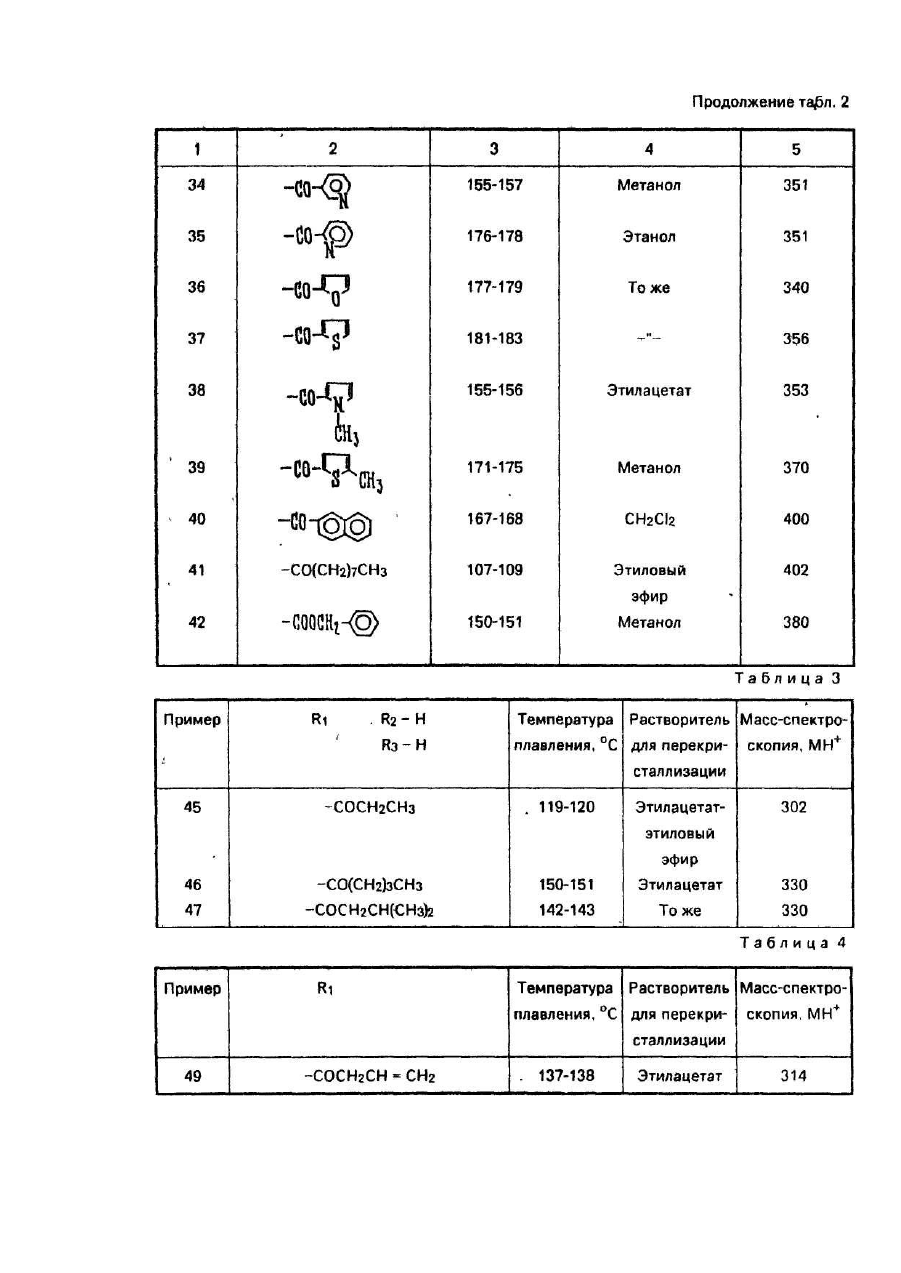
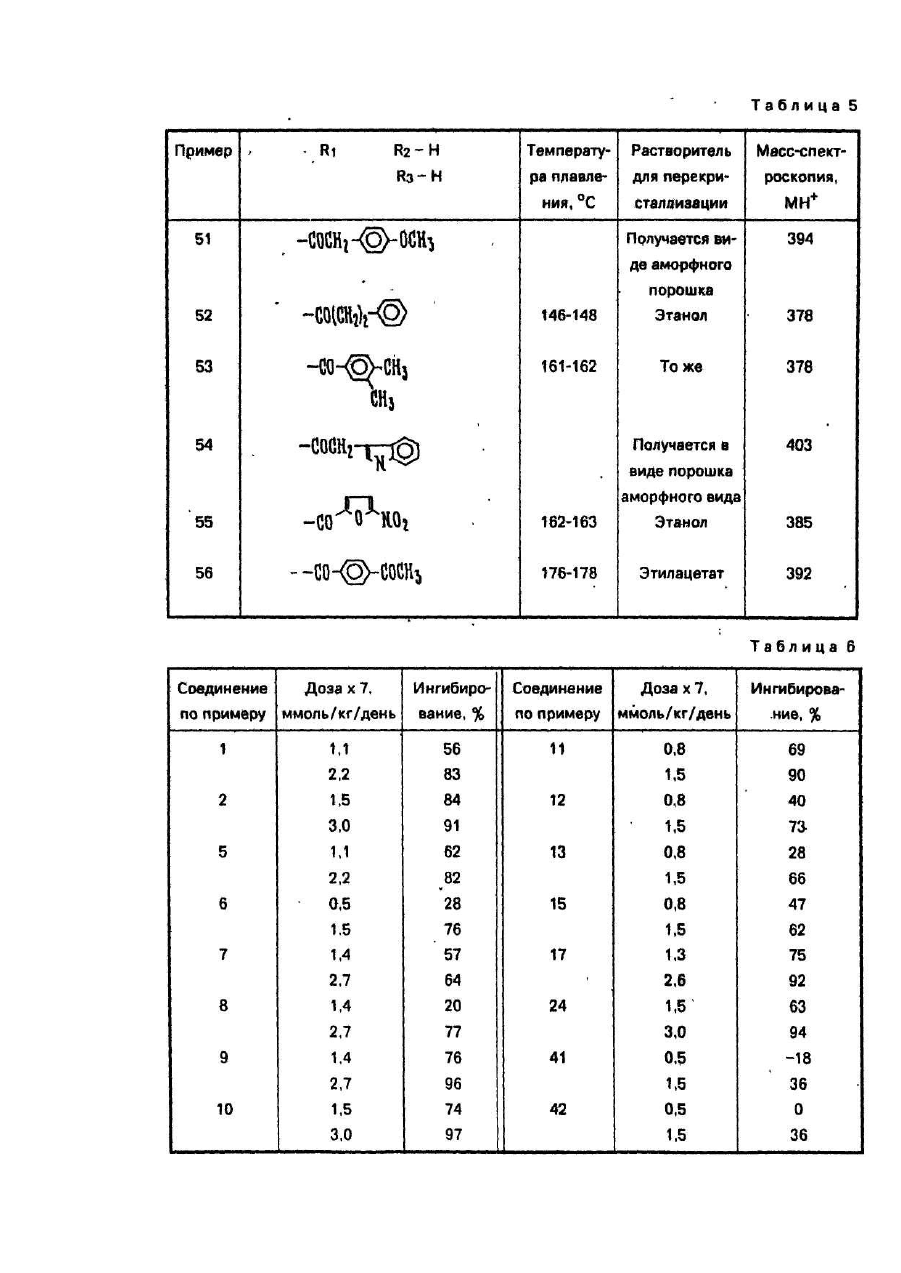
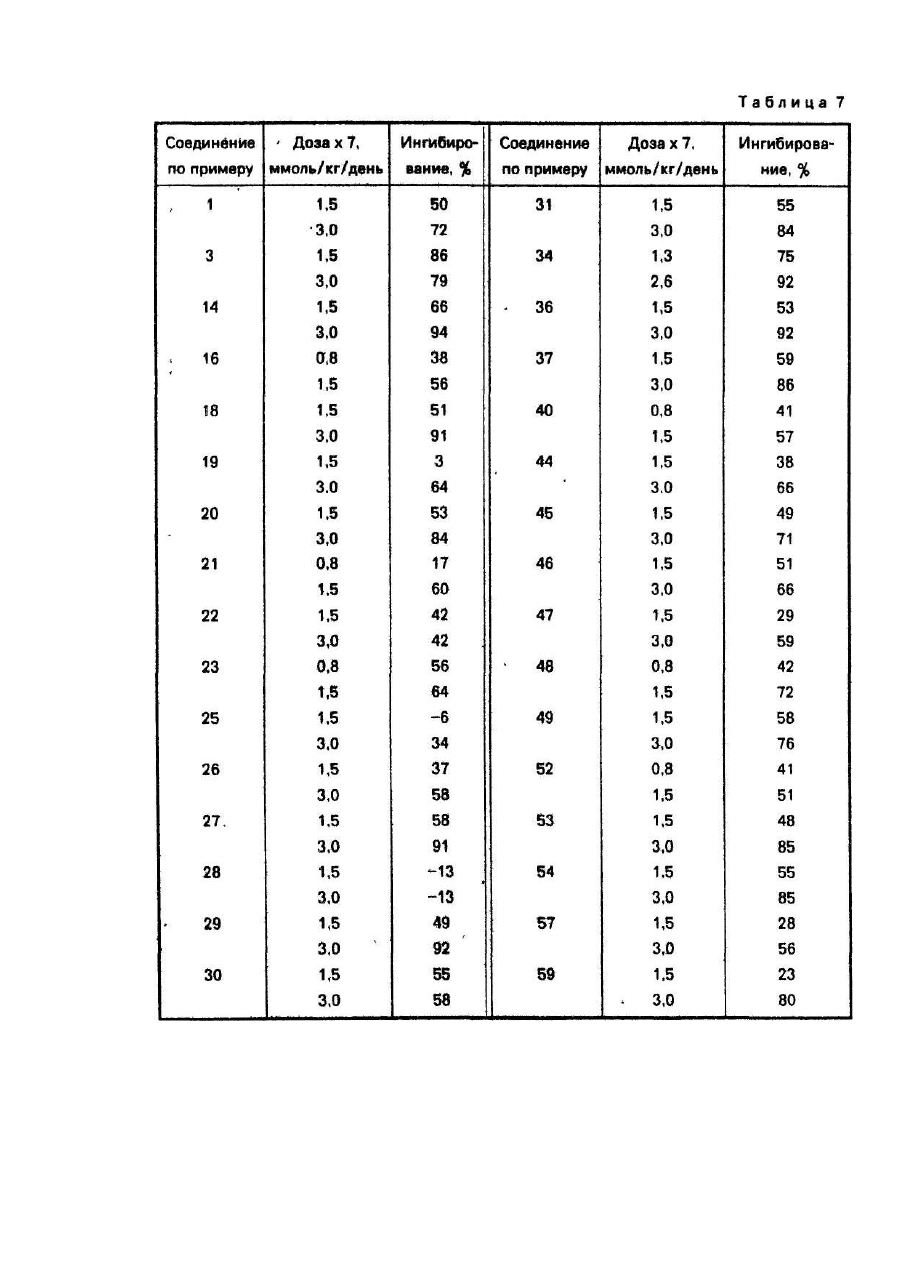
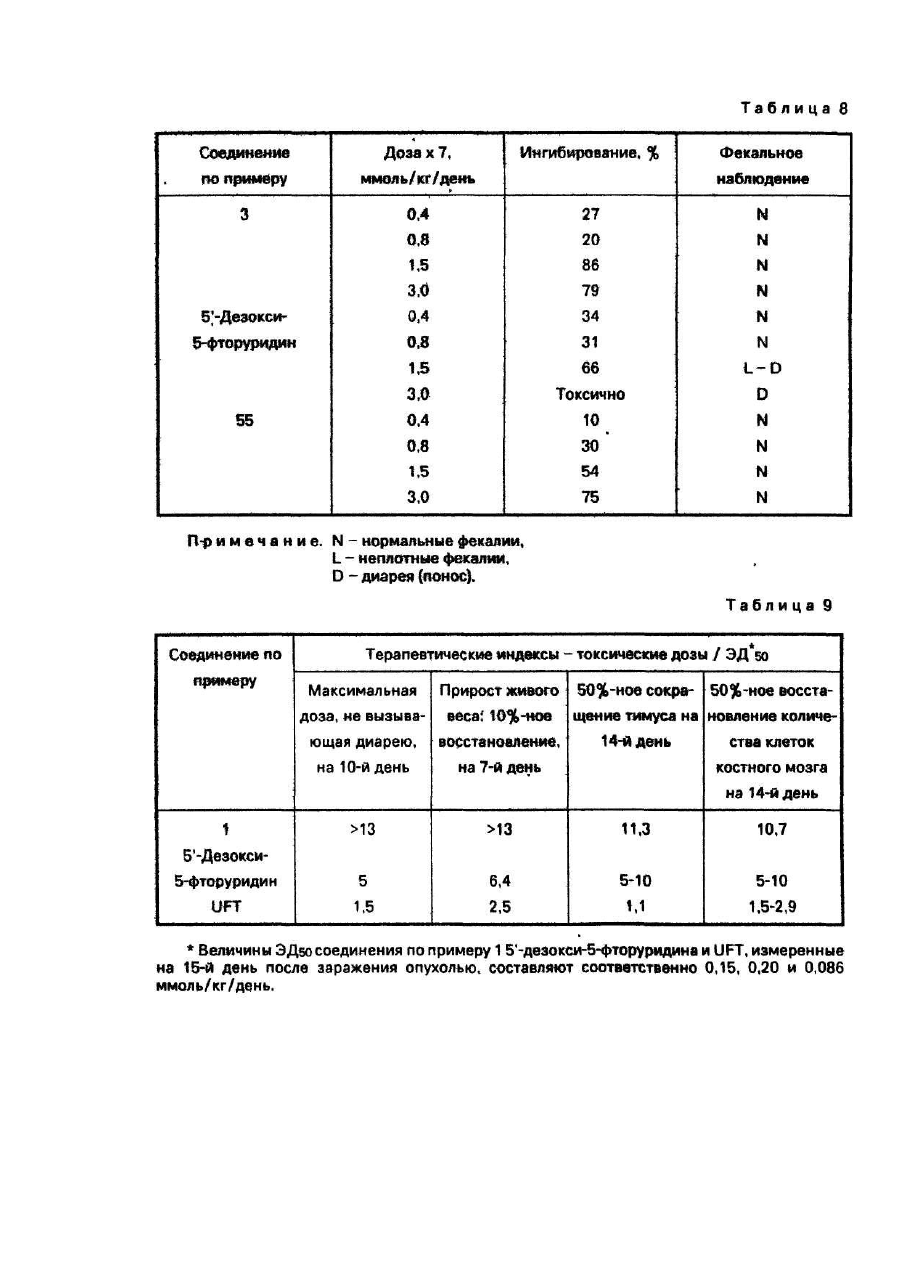
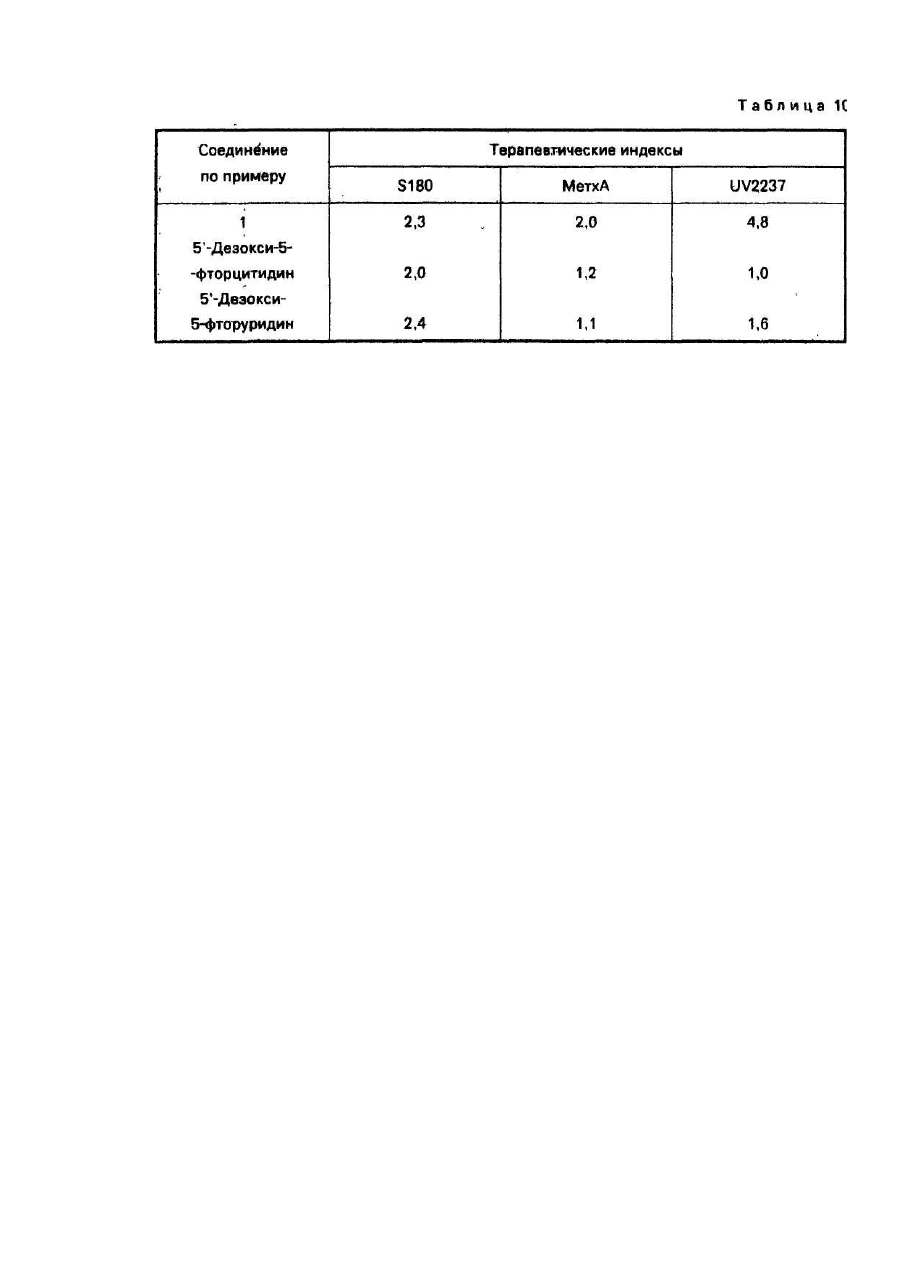
Изобретение относится к способу получения новых производных 5-фторцитидина, а именно 5-дезокси-5фторцитидина общей формулы где R1, R2 и R3 независимо друг от др уга радикал, R4CO- или R5OCO- или R6SCO-, где R4 - алкил С1-С17, циклоалкил С 3-C10, · С3 - алкенил, бензил, этенфенил, фенил, возможно замещенный атомом хлора или фтора, метильной группой, одной, двумя или тремя метоксигруппами, нитрогруппой, ацетоксигруппой, тиометильной группой, или R4-фенилвинил, 3-индолилметил, пиридил, фурил, тиенил, нафтил, пиперонил, нитрофурил, R5 - алкил С 1-С8, бензил, R6 - алкил С2-С4, при условии, что один из R1, R2 и R3 не является водородом, обладающих противоопухолевыми свойствами. Известен ряд производных 5-фторцитидина (1-4), обладающих например 5'-дезокси-5-фтаруридин, противоопухолевыми свойствами. Цель изобретения - получение новых производных 5-фторцитидина. обладающих преимуществами в фармакологическом отношении перед известными структурными аналогами подобного действия. Цель достигается описываемым способом, заключающимся в том, что соединение общей формулы где R7 и R8 - защитная группа, повергают взаимодействию с соединением общей формулы XCOR4, где X - ОН-группа, COOR4 или галоген, a R4 имеет указанные значения, или с соединением общей формулы HalCOR9, где Hal - атом галогена, R9 - радикал R5O или R6S, где R5 и R6 имеют указанные значения, с последующим удалением защитных групп. Пример (известный). А). В 1,5 мл диметилформамида растворяют 245 мг 5'-дезокси-5-фторцитидина, 354 мг третбутилдиметилсилил-хлорида и 284 мг имидазола. Смесь перемешивают в течение 18 ч при комнатной температуре в атмосфере азота. Затем реакционную смесь выливают в воду и экстрагируют этилацетатом. Экстракт промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении, получая 431 мг 2',3'-бис-О-(трет-бутилдиметилсилил)-5'-дезокси-5-фторцитидина, (массспектроскопия 473 (М+). Б). Раствор 490 мг 5'-дезокси-5-фторцитидина, 418 мг моногидрата паратолуолсульфоновой кислоты и 934 мкл 2,2-диметоксипропана в 10 мл ацетона перемешивают в течение 1,5 ч при комнатной температуре. К раствору добавляют 900 мг гидрокарбоната натрия и смесь перемешивают в течение 4 ч при комнатной температуре. Выпадающий осадок отфильтровывают и промывают ацетоном. Объединенный фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией над силикагелью (дихлорметан-метанол), чтобы получить 570 мг 5'-дезокси-5-фтор- 2’,3'-О-изопропилиденцитидина, массспектроскопия 288 (МН+), т.пл. пикрата 169-171°С. Пример 1. А. В 150 мл дихлорметана растворяют 9,46 г 2',3'-бис-О-(трет-бутилдиметилсилил)-5'-дезокси5-фторцитидина, полученного по известному примеру (А), 3,48 г ангидрида н-масляной кислоты в 2,93 г 4диметиламинопиридина. Смесь перемешивают в течение ночи, затем промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении, чтобы получить 9,75 г N4 -бутирид2’,3'-6ис-О-(трет- бутилдиметилсилил)-5’-дезокси-5’-фторцитидина, масс-спектрокопия 544 (МН+). Б. Продукт реакции по примеру 1 (А) (9,75г) растворяют в 80 мл тетрагидрофурана, содержащего 80 ммоль фтористого тетра-бутиламмония. Реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии над силикагелью (этилацетат - метанол), за которой следует перекристаллизация из метанола, чтобы получить 4,5 г N 4-бутирил-5'-дезокси-5-фторцитидина, т.пл. 156-157°С, массспектроскопия 316 (МН+). Следующие соединения были получены по способу, аналогичному примеру 1 (табл. 1). Пример 4. Α. Β 150 мл сухого пиридина растворяют 14,19 г 2',3'-бис-О-(трет-бутилдиметилсилил)-5' дезокси-5-фторцитидина, полученного по известному примеру (А). К раствору добавляют по каплям при перемешивании 3,84 г хлорангидрида н-масляной кислоты. Реакционную смесь перемешивают в течение ночи. Пиридин удаляют при пониженном давлении и остаток разделяют на части между водой и этилацетатом. Этилацетатный слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии над силикагелыо (н-гексан-этилацетат), чтобы получить N4-бутирил- 2',3'-бис-О-(трет-бутилдиметил-силил)-5'дезокси-5- фторцитидин (25,82 г). Б. Продукт реакции по примеру 4 (А) обрабатывают по способу, аналогичному примеру 1 (Б), чтобы получить бесцветные кристаллы N4-бутирил-5'-дезокси-5-фторцитидина. Следующие соединения получают по способу, аналогичному пример 4 (табл. 2). Пример 43. В 20 мл 75%-него водного диоксана растворяют 735 мг 5'-дезокси-5-фторцитидина и 1,04 г ангидрида масляной кислоты: Смесь перемешивают в течение 18 ч при комнатной температуре. После удаления растворителя остаток очищают с помощью колоночной хроматографии над силикагелем, чтобы получить бесцветные кристаллы 420 мг N4-бутирил-5'-дезокси-5-фторцитидина, т.пл. 156-157°С, массспектроскопия 316 (МН+). Пример 44. Α. Β 50 мл сухого пиридина растворяют 4,9 г 5'-дезокси-5-фторцитидина и 5,58 мл хлористого триметилсилила. Смесь перемешивают в течение 2 ч. К реакционной смеси добавляют 2,09 мл этилового эфира хлортиомуравьиной кислоты. После перемешивания смеси в течение 2,5 ч пиридин выпаривают при пониженном давлении. Остаток разделяют затем на части между водой и этилацетатом. Органический слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. К остатку добавляют 5 г лимонной кислоты и 80 мл метанола. Смесь перемешивают в течение 1 ч. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии над силикагелыо (метанол-дихлорметан), за которым следует перекристаллизация из дихлорметана, чтобы получить 2,66 г 5'-дезокси-М4-[(этилтио)карбонил]-5-фторцитидина, т.пл. 138-139°С (разл.), масс-спектроскопия 334 (МН+). Б. К перемешиваемому раствору 1 г 5'-дезокси-5-фтор-2',3'-О- изопропилиденцитидина, полученного по известному примеру, в 8 мл пиридина добавляют при 0°С 365 мкл этилового эфира хлортиомуравьиной кислоты, а затем смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении и остаток разделяют на части между этилацетатом и водой. Органический слой промывают раствором гидрокарбоната натрия и водой и высушивают над безводным сульфатом натрия. После удаления растворители остаток очищают с помощью колоночной хроматографии над силикагелью (СНСІ3), чтобы получить 510 мг 5'-дезокси-5-N4-[(этилтио)- карбонил]-5-фтор-2',3'-Оизопропилиденцитина, масс-спектроскопия 374 (МН+). В. К раствору продукта реакции по примеру 44 (Б) (150 мг) в 50%-ном водном этаноле добавляют Дауэкс 50 (Н+) (150 мг), а затем смесь нагревают при 50-60°C с перемешиванием в течение 4 ч, Да уэкс 50 отфильтровывают и фильтрат концентрируют досуха при пониженном давлении. Остаток очищают с помощью колоночной хроматографии над силикагелью (CHCF3 - ацетон), за которой следует перекристаллизация из дихлорметана, чтобы получить 5'-дезокси-N4-[(этилтио)-карбонил]-5-фторцитидин, т.пл. 138-139°С (разл.), масс-спектроскопия 334. (МН+). Следующие соединения получают по способу, аналогичному примеру 44 (табл. 3). Пример 48. Раствор 0,42 г пиперониловой кислоты в 5 мл сухого ацетонитрила, содержащего 0,36 мл триэтиламина, обрабатывают 0,37 мл диэтилового эфира хлорфосфорной кислоты в течение 1 ч. К реакционной смеси добавляют 2’,3'-бис-О-(трет-бутилдиметилсилил)-5'-дезокси-5-фторцитидина (1,0 г), полученного по известному примеру (А), 0,36 мл триэтиламина и 0,05 г 4-диметиламинопиридина. После перемешивания смеси в течение 12 ч при комнатной температуре, ацетонитрил выпаривают при пониженном давлении. Остаток разделяют на части между водой и диэтиловым эфиром. Органический слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный порошок растворяют в 6,3 мл тетрагидрофурана, содержащего 1,65 г фтористого тетрабутиламмония и реакционную смесь перемешивают в течение 1 ч. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии над силикагелем (изопропанол-дихлорметан), за которой следует перекристаллизация из этилацетата, чтобы получить 0,5 г 5'дезокси-5-фτορ-Ν 4- пиперонилоилцитидина, т.пл. 124-125°С, масс-спектроскопия 394 (МН+). Следующее соединение получают по способу, аналогичному в примере 48 (табл.4). Пример 50. В 5 л сухого пиридина растворяют 0,355 г 3-фуранкарбоновой кислоты и 0,96 г 2,4,6триизопропилбензолсульфонила хлористого. Смесь перемешивают в течение 1 ч. К смеси добавляют 1,0 г 2’,3'-бис-О-(трет-бутилдиметилсилил}- 5'-дезокси-5-фторцитидина, полученного по известному примеру (А), 0,80 г 4-диметиламинопиридина. После перемешивания смеси в течение 12 ч при комнатной температуре, пиридин выпаривают при пониженном давлении. Затем остаток обрабатывают, как в примере 48, чтобы получить 0,55 г 5'-дезокси-5-фтор-N4-(3-фуроил)- цитидина, т.пл. 173-174°С (этанол), масс-спектроскопия 340 (МН+). Следующие соединения получают по способу аналогичному в примере 50 (табл. 5). Пример 57. А. К перемешиваемому раствору 24,5 г 5'-дезокси-5-фторуридина в 150 мл сухого пиридина добавляют по каплям 24,5 мл хлористого бензоила в течение 10 мин при 0°С и смесь перемешивают в течение 5 ч при комнатной температуре. После удаления пиридина при пониженном давлении остаток разделяют на части между водой и етилацетатом. Органический слой промывают насыщенным раствором гидрокарбоната натрия и водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток перекристаллизовывают из этилацетата вместе с н-гексаном, чтобы получить 38,9 г 2',3’ -ди-О-бензоил-5'-дезокси -5-фторуридина, масс-спектроскопия 455 (МН+). Б. К смеси 0,8 мл N-метилимидазола и 0,28 мл хлористого фосфорила в 20 мл ацетонитрила добавляют 500 мг 2',3'-ди-О-бензоил-5'-дезокси- 5-фторуридина, получен«ого при 0°С. После перемешивания реакционной смеси в течение 1,5 ч при комнатной температуре к смеси добавляют при 0°С 2,5 мл 28%-ной гидроокиси аммония, а затем смесь перемешивают в течение 1 ч при ком-натной температуре. Ацетонитрил и аммиак удаляют при пониженном давлении. Остаток подкисляют с помощью 1 N раствора HCI, а затем экстрагируют этилацетатом. Органический слой промывают водой, высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток перекристаллизовывают из этилацетата, чтобы получить 155 г 2'3'-ди-О-бензоил-5'-дезокси-5-фторцитидина, т.пл. 192-194°С, масс-спектроскопия 476 (MH+Na)+. Пример 58. А. К охлаждаемому льдом уксусному ангидриду (0,57 мл) добавляют по каплям 286 мкл 99%ной муравьиной кислоты. Раствор перемешивают в течение 15 мин при 0°С и в течение 50 мин при 50°С, а затем охлаждают до 0°С. К раствору добавляют 473 мг 2',3’-бис-О-(трет-бутилдиметилсилил)-5'-дезокси-5фторцитидина, полученного по известному примеру (А), в 5 мл сухого пиридина при 0°С. Реакционную смесь перемешивают в течение 10 мин при 0°С и в течение 26 ч при комнатной температуре. После удаления растворителя при пониженном давлении остаток разделяют на части между водой и этилацетатом. Органический слой промывают насыщенным раствором гидрокарбоната натрия и водой, а затем высушивают над безводным сульфатом натрия. Этилацетат выпаривают при пониженном давлении и остаток очищают с помощью колоночной хроматографии над силикагелью (н-гексан-этилацетат), за которой следует перекристаллизация из смеси н-гексана и этилацетата, чтобы получить 144 мг 2',3'-бис-О-(третбутилдиметилсилил)-5' -дезокси-5-фτορ-Ν4-формилцитидина, т.пл. 188°С(разл.), масс-спектроскопия 502 (МН+). Б. Продукт реакции по примеру 58 (А) обрабатывают по способу, аналогичному в примере 1 (Б), чтобы получить аморфный порошок 5'-дезокси-5'фтор-N4-формилцитидина, масс-спектроскопия 274 (МН+). Пример 59. В 5 мл сухого пиридина растворяют 245 мг 5'-дезокси-5-фторцитидина. К раствору добавляют 130 мкл хлористого бензоила с перемешиванием при 0°С. Реакционную смесь перемешивают в течение 1 ч при 0°С. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии над силикагелью (дихлорметан-метанол), за которой следует перекристаллизация из этилацетата, чтобы получить 51 мг бесцветных кристаллов 3'-O-бензоил-5'-дезокси-5-фторцитидина, т.пл. 127-129°С, масс-спектроскопия 350 (МН+). Пример 60. В 0,5 мл сухого пиридина растворяют 35 мл продукта реакции по примеру 59. К раствору добавляют 13,8 мкл хлористого триметилсилила. После перемешивания в течение 2 ч при комнатной температуре добавляют 12,6 мкл хлористого бензоила. Реакционную смесь перемешивают в течение 1 ч. После удаления растворителя при пониженном давлении остаток растворяют в 0,5 мл сухого метанола. К раствору добавляют 15 мг карбоната калия и реакционную смесь перемешивают в течение 30 мин при 0°С. После удаления растворителя при пониженном давлении остаток разделяют на части между водой и этилацетатом. Органический слой высушивают над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии над силикагелью (дихлорметанметанол), чтобы получить 15 мг аморфного порошка N 4-3'-О-дибензоил-5'-дезокси-5фторцитидина, масс-спектроскопия 454 (МН+) Пример 61. В 5 мл сухого пиридина растворяют 245 мг 5'-дезокси-5-фторцитидина, 400 мкл хлористого бензоила и 122 мг 4-диметиламинопиридина. После перемешивания в течение 3 ч при комнатной температуре удаляют пиридин при пониженном давлении. Остаток разделяют на части между этилацетатом и водой. Этилацетатный слой высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаток перекристаллизовывают из метанола, чтобы получить 280 мг Ν4-2'-0,3-Ο-трибензоил-5'-дезокси-5фторцитидина, т.пл. 158-1бО°С, масс-спектроскопия 558 (МН+). Противоопухолевые активности предлагаемых соединений представляются следующим образом. Противоопухолевое испытания против Саркомы 180. Клетки Саркомы 180 (2 х 106 клеток) имплантируются подкожно мышам (20-22 г) в нулевой день, Соединения изобретения вводятся ежедневно орально от первого дня по 7-й день включительно. Животные приносятся в жертву на 14-й день и опухоли вырезаются и взвешиваются. Процент ингибирования роста опухоли, представленный в табл. 6, вычисляется по формуле (1-Т/С) х 100, где Τ - вес опухолей от обработанной группы; С - вес опухолей от контрольной группы. Противоопухолевое испытание против фибросаркомы Метха А. Клетки фибросаркомы Метха А (2 х 105 клеток) имплантируются подкожно мышам (21-22 г). Испытание против фибросаркомы Метха А и вычисление процента ингибирования роста опухоли осуществляются по способу, аналогичному способу испытания против Саркомы 180. Результаты представлены в табл. 7. Сравнительное исследование противоопухолевой активности характерного соединения (пример 3) изобретения вместе с 5'-дезокси-5-фторуридином осуществляется по методу, аналогичному таковому противоопухолевого испытания против фибросаркомы Метха А. Результаты этого эксперимента и фекального наблюдения на 8-й день представлены в табл. 8 и показывают, что соединение примера 3 является более сильно действующим по противоопухолевой активности, но менее токсичным, чем 5'-дезокси-5-фторуридин. В таком же эксперименте соединение примера 3 не вызывает диарею (поноса), которая является ограничивающим дозу фактором 5'-дезокси-5-фторуридина. Сравнительное противоопухолевое испытание против карциномы Льюиса. Противоопухолевая активность характерного соединения (пример 1) изобретения сравнивается с таковой 5'-дезокси-5-фторуридина и сочетания лекарства, UFT (тегафур: урация = 1:4). Мышей заражают подкожно карциномой легких Льюиса (106 клеток) в нулевой день. Соединения вводятся ежедневно 14 раз, начиная с первого дня пероральным путем. Эффективная доза (ЭД50), при которой рост опухоли ингибируется на 50%, а также токсические дозы определяются. Терапевтические индексы (токсические дозы) (ЭД50), полученные из экспериментов, представлены в табл. 9. Соединение изобретения имеет более высокие терапевтические индексы, чем типичные пролекарства 5фтор урацила, 5'-дезокси-5-фторуридина и UFT. Соединение вызывает меньшую токсичность кишечных трактов (диарею) и иммуновосприимчивых органов (тимуса и костного мозга). Эти данные показывают, что целевое соединение имеет более высокий потенциал безопасности. Сравнительное противоопухолевое испытание против Саркомы 180 фибросаркомы Метха А и фибросаркомы UV2237. Противоопухолевая эффективность характерного соединения (пример 1) изобретения на трех моделях созреваемой (murine) опухоли сравнивается с таковой 5'-дезокси-5-фторуридина и 5'-дезокси-5фторцитидина. Мыши заражаются подкожно Саркомой 180 фибросаркомой Метха А и фибросаркомой 2237 в нулевой день. Затем мышам ежедневно вводятся орально соединения до 7 раз, начиная с первого дня. Эффективность выражается в виде терапевтических индексов (ЭДмакс/ЭД50), измеряемых на 14-й день после заражения опухолью, где ЭДмакс является дозой, показывающей максимальное ингибирование роста опухоли. Результаты, полученные из экспериментов, представлены в табл. 10. Острая токсичность (LD50) предлагаемого соединения (примеры 1, 5, 9, 24, 34, 46 и 47) изучается путем орального ввода мышам. Соответствующие LD50 - величины, полученные из экспериментов, составляют более чем 2,000 мг/кг.
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of 5'-desoxy-5-fluorocytidine derivatives
Автори англійськоюIsao Umeda
Назва патенту російськоюСпособ получения производных 5'-дезокси-5-фторцитидина
Автори російськоюИсао Умеда
МПК / Мітки
МПК: C07H 19/067
Мітки: спосіб, одержання, 5'-дезокси-5-фторцитидину, похідних
Код посилання
<a href="https://ua.patents.su/11-19333-sposib-oderzhannya-pokhidnikh-5-dezoksi-5-ftorcitidinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 5′-дезокси-5-фторцитидину</a>
Попередній патент: Стояночне гальмо пневматичної гальмової системи залізничного транспортного засобу
Наступний патент: Спосіб приготування засобу для лікування хвороб типу псоріазу
Випадковий патент: Ферментатор біогазової установки