Пептид, який викликає утворення антитіл, що проявляють нейтралізуючу активність відносно штамів та/або ізолятів віл-1 , та/або пригнічують злиття уражених віл-1 клітин, фармацевтичний засіб для утворення антиті
Формула / Реферат
1. Пептид, вызывающий образование антител, проявляющих нейтрализующую активность относительно штаммов и/или изолятов ВИЧ-1, и/или подавляющий слияние пораженных ВИЧ-1 клеток, включающий аминокислотную последовательность, выбранную из группы ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS, LELNKWAS.
2. Пептид по п. 1, отличающийся тем, что соединен с носителем.
3. Пептид по п. 2, отличающийся тем, что соединен с носителем, представляющим собой часть вируса, выбранного из группы, включающей вирус гриппа, вирус коровьей оспы или бакуловирус, предпочтительно в рекомбинантной форме.
4. Пептид по п. 3, отличающийся тем, что по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну область детерминанты вирусного белка.
5. Пептид по п. 4, отличающийся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В.
6. Пептид по п. 4, отличающийся тем, что вирусный белок получен из бакуловируса или вируса коровьей оспы, предпочтительно в, рекомбинантной форме.
7. Фармацевтическое средство для образования антител, проявляющих нейтрализующую активность относительно штаммов и/или изолятов ВИЧ-1 и/или подавляющий слияние пораженных ВИЧ-1 клеток, отличающееся тем, что содержит по меньшей мере один пептид, включающий аминокислотную последовательность, выбранную из группы ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS, LELNKWAS.
8. Фармацевтическое средство по п. 7, отличающееся тем, что вызывает образование анти-ВИЧ-1 IgA антител.
9. Фармацевтическое средство по п. 7 или 8, отличающееся тем, что его используют для интраназального применения у млекопитающих.
10. Фармацевтическое средство по любому из пп. 7-9, отличающееся тем, что его используют для профилактики или для предотвращения ВИЧ-1 инфекциий у лиц из группы риска.
11. Фармацевтическое средство по любому из пп. 7-10, отличающееся тем, что пептид соединен с носителем.
12. Фармацевтическое средство по любому из пп. 7-11, отличающееся тем, что пептид соединен с частью рекомбинантного вируса, выбранного из группы, включающей вирус гриппа, бакуловирус и вирус коровьей оспы, предпочтительно в рекомбинантной форме.
13. Фармацевтическое средство по любому из пп. 7-12, отличающееся тем, что по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну из областей детерминанты вирусного белка.
14. Фармацевтическое средство по п. 13, отличающееся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В.
15. Фармацевтическое средство по п. 13, отличающееся тем, что вирусный белок получают из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантной форме.
16. Способ получения пептида для образования антител, проявляющих нейтрализующую активность относительно штаммов и/или изолятов ВИЧ-1 и/или подавляющий слияние пораженных ВИЧ-1 клеток, который предусматривает получение по меньшей мере одной аминокислотной последовательности, включающей ELDKWAS или LELDKWAS, или ELDNWAS, или ELNKWAS, или LELDNWAS, или LELNKWAS.
17. Способ по п. 16, отличающийся тем, что включает присоединение нуклеотидной последовательности, кодирующей одну из указанных аминокислотных последовательностей, или нуклеотидной последовательности, гибридизующейся с одной из нуклеотидных последовательностей, кодирующей одну из аминокислотных последовательностей, или нуклеотидной последовательности, полученной путем вырождения из нуклеотидной последовательности, кодирующей одну из указанных аминокислотных последовательностей, к нуклеотидной последовательности носителя, перенесения соединенной нуклеотидной последовательности в организм хозяина, и последующее проведение экспрессии соединенной последовательности и выделение по крайней мере одного пептида, соединенного с носителем.
18. Способ по п. 17, отличающийся тем, что, по крайней мере, одну нуклеотидную последовательность, кодирующую одну из указанных аминокислотных последовательностей, или полученную из нее путем вырождения, связывают с соответствующей последовательностью, кодирующей белок, в качестве носителя, с замещением в результате по меньшей мере части последовательности, кодирующей вирусный белок или встраиванием по меньшей мере в одну из областей указанной последовательности, кодирующей участок детерминанты вирусного белка.
19. Способ по п. 18. отличающийся тем, что вирусный белок выбирают из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В.
20. Способ по любому из пп. 17-19, отличающийся тем, что в качестве вектора экспрессии используют вирус, выбранный из группы, включающей вирус гриппа, бакуловирус и вирус коровьей оспы, предпочтительно в рекомбинантой форме.
21. Способ получения антител, проявляющих ВИЧ-1 нейтрализующую активность или предотвращающих слияние пораженных ВИЧ-1 клеток, отличающийся тем, что проводят иммунизацию млекопитающего путем введения пептида, выбранного из группы, включающей ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS и LELNKWAS.
22. Способ по п.21, отличающийся тем, что указанный пептид вводят через поверхность слизистой оболочки, предпочтительно через нос.
23. Способ по п. 21 или 22, отличающийся тем, что IgA антитела получают предпочтительно в результате секреторных процессов в поверхности слизистой оболочки.
24. Способ по любому из пп. 21-23, отличающийся тем, что вводят пептид, соединенный с носителем.
25. Способ по п. 24, отличающийся тем, что вводят пептид, соединенной с частью вируса, выбранного из группы, включающей вирус гриппа, вирус коровьей оспы и бакуловирус, предпочтительно в рекомбинантной форме.
26. Способ по п. 24 или 25, отличающийся тем, что вводят пептид, в котором, по меньшей мере, одна из указанных аминокислотных последовательностей замещает, по меньшей мере, часть аминокислотной последовательности вирусного белка как носителя или встроена, по меньшей мере, в одну область детерминанты вирусного белка.
27. Способ по п. 26, отличающийся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В.
28. Способ по п. 26, отличающийся тем, что вводят вирусный белок, который получен из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантной форме.
29. Антитело IgA, проявляющее ВИЧ-1 нейтрализующую активность и/или подавляющее слияние пораженных ВИЧ-1 клеток, получаемое иммунизацией млекопитающего путем введения по крайней мере одного из пептидов, выбранного из группы, включающей ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS и LELNKWAS.
30. Антитело по п. 29, отличающееся тем, что его получают с помощью иммунизации млекопитающего через поверхность слизистой оболочки, предпочтительно через нос.
31. Антитело по любому из пп. 29, 30, отличающееся тем, что его получают в результате секреторных процессов в поверхности слизистой оболочки.
32. Антитело по любому из пп. 29-31, отличающееся тем, что его получают в результате введения пептида, соединенного с носителем.
33. Антитело по п. 32, отличающееся тем, что его получают в результате введения пептида, который соединен с вирусом, выбранным из группы, включающей вирус гриппа, вирус коровьей оспы и бакуловирус, предпочтительно в рекомбинантной форме.
34. Антитело по п. 33 , отличающееся тем, что его получают в результате введения пептида, в котором по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну область детерминанты вирусного белка.
35. Антитело по п. 34, отличающееся тем, что его получают в результате введения пептида, который соединен с вирусным белком, выбранным из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В.
36. Антитело по п. 34, отличающееся тем, что его получают в результате введения пептида, в котором вирусный белок получен из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантой форме.
Текст
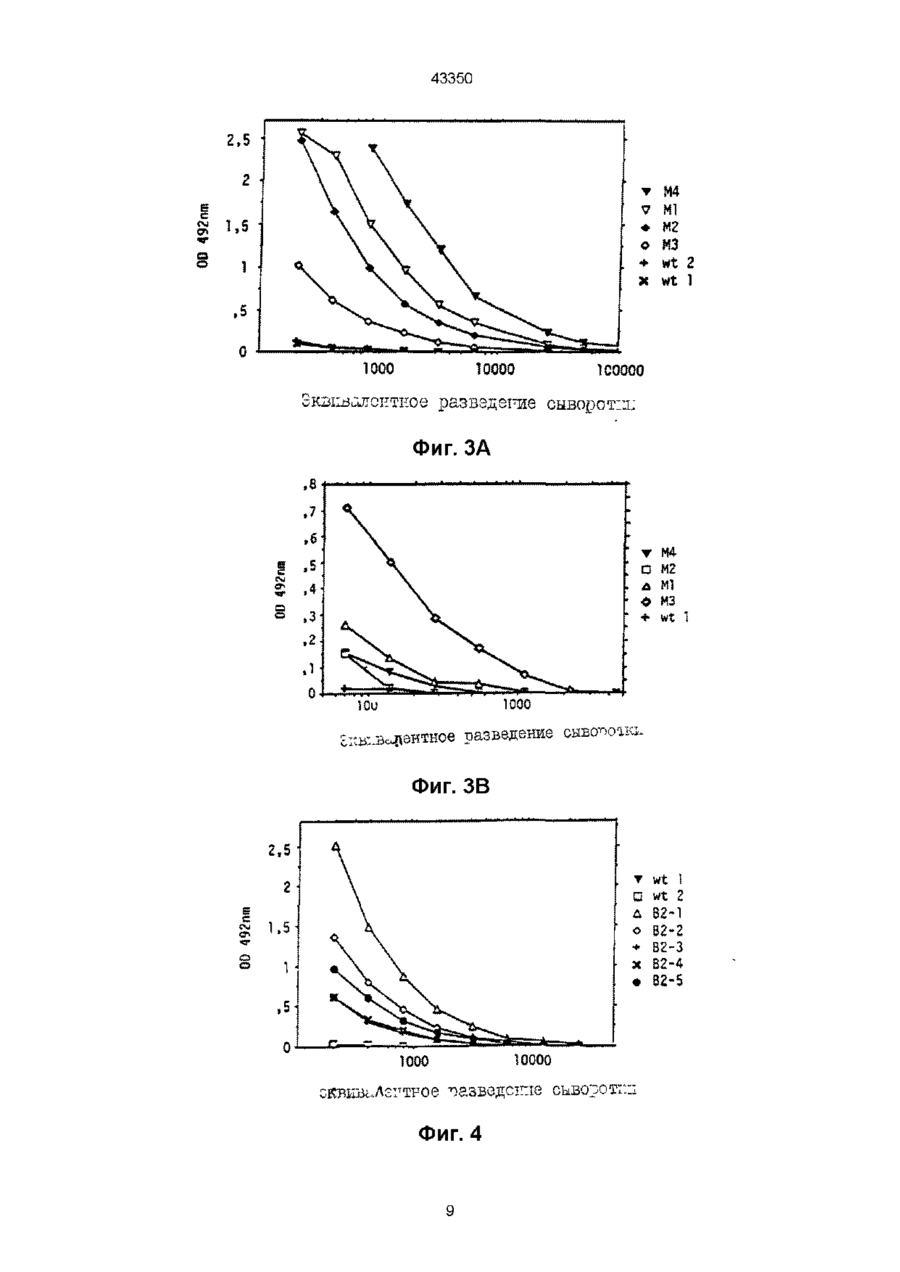
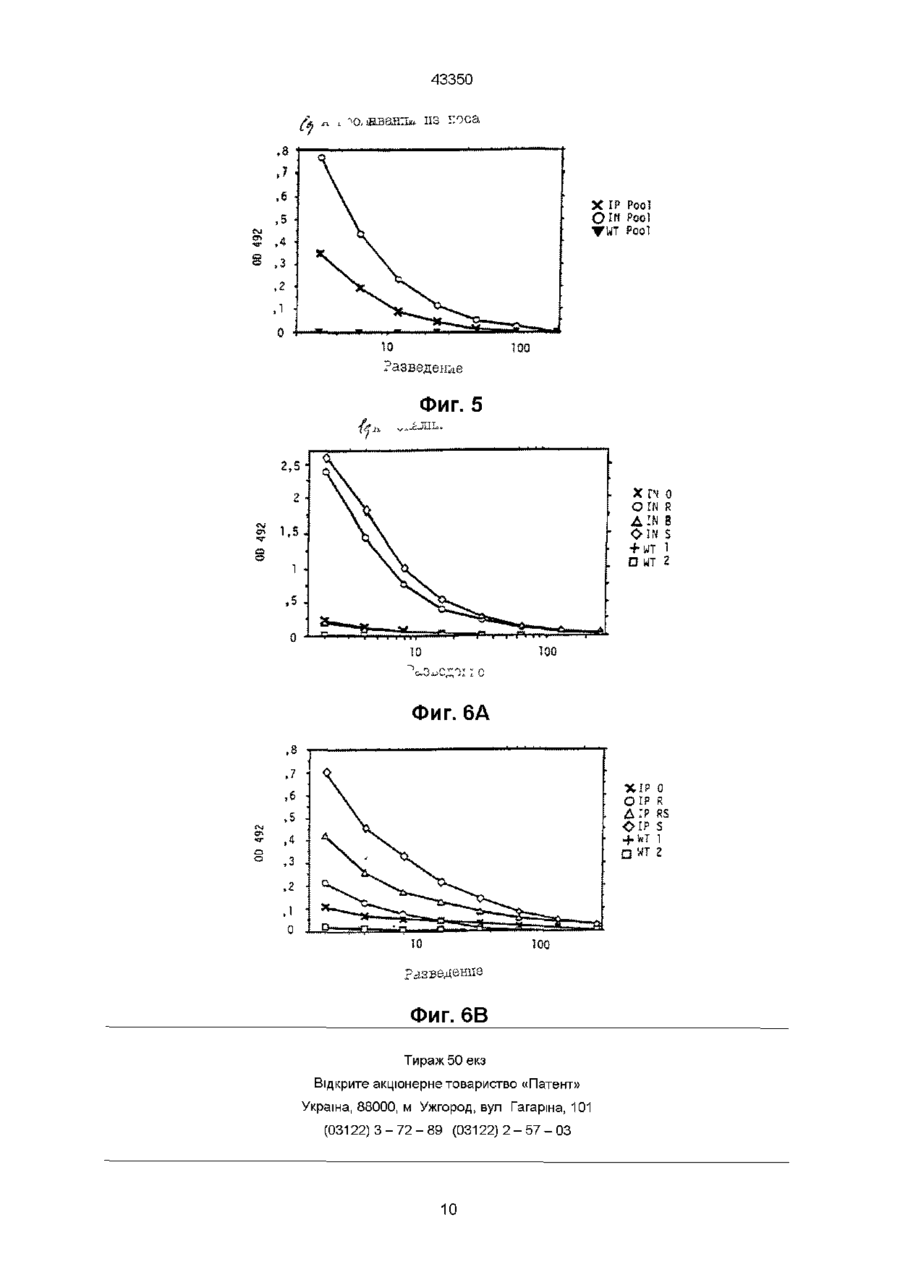
1 Пептид, вызывающий образование антител, проявляющих нейтрализующую аісгивность относительно штаммов и/или изолятов ВИЧ-1, и/или подавляющий слияние пораженных ВИЧ-1 клеток, включающий аминокислотную последовательность, выбранную из группы ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS, LELNKWAS 2 Пептид по п 1, отличающийся тем, что соединен с носителем 3 Пептид по п 2, отличающийся тем, что соединен с носителем, представляющим собой часть вируса, выбранного из группы, включающей вирус гриппа, вирус коровьей оспы или бакуловирус, предпочтительно в рекомбинантной форме 4 Пептид по п 3, отличающийся тем, что по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну область детерминанты вирусного белка 5 Пептид по п 4, отличающийся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В 6 Пептид по п 4, отличающийся тем, что вирусный белок получен из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантной форме Зоя 7 Фармацевтическое средство для образования антител, проявляющих нейтрализующую активность относительно штаммов и/или изолятов ВИЧ1 и/или подавляющий слияние пораженных ВИЧ-1 клеток, отличающееся тем, что содержит по меньшей мере один пептид, включающий аминокислотную последовательность, выбранную из группы ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS, LELNKWAS 8 Фармацевтическое средство по п 7, отличающееся тем, что вызывает образование анти-ВИЧ-1 IgA антител 9 Фармацевтическое средство по п 7 или 8, отличающееся тем, что его используют для интраназального применения у млекопитающих 10 Фармацевтическое средство по любому из пп 7-9, отличающееся тем, что его используют для профилактики или для предотвращения ВИЧ-1 инфекций улиц из группы риска 11 Фармацевтическое средство по любому из пп 7-10, отличающееся тем, что пептид соединен с носителем 12 Фармацевтическое средство по любому из пп 7-11, отличающееся тем, что пептид соединен с частью рекомбинантного вируса, выбранного из группы, включающей вирус гриппа, бакуловирус и вирус коровьей оспы, предпочтительно в рекомбинантной форме 13 Фармацевтическое средство по любому из пп 7-12, отличающееся тем, что по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну из областей детерминанты вирусного белка 14 Фармацевтическое средство по п 13, отличающееся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В 15 Фармацевтическое средство по п 13, отличающееся тем, что вирусный белок получают из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантной форме 16 Способ получения пептида для образования антител, проявляющих нейтрализующую актив О о ю ГО ГО 43350 ность относительно штаммов и/или изолятов ВИЧ1 и/или подавляющий слияние пораженных ВИЧ-1 клеток, который предусматривает получение по меньшей мере одной аминокислотной последовательности, включающей ELDKWAS или LELDKWAS, или ELDNWAS, или ELNKWAS, или LELDNWAS, или LELNKWAS 17 Способ по п 16, отличающийся тем, что включает присоединение нуклеотидной последовательности, кодирующей одну из указанных аминокислотных последовательностей, или нуклеотидной последовательности, гибридизующейся с одной из нуклеотидных последовательностей, кодирующей одну из аминокислотных последовательностей, или нуклеотидной последовательности, полученной путем вырождения из нуклеотидной последовательности, кодирующей одну из указанных аминокислотных последовательностей, к нуклеотидной последовательности носителя, перенесения соединенной нуклеотидной последовательности в организм хозяина, и последующее проведение экспрессии соединенной последовательности и выделение по крайней мере одного пептида, соединенного с носителем 18 Способ по п 17, отличающийся тем, что, по крайней мере, одну нуклеотидную последовательность, кодирующую одну из указанных аминокислотных последовательностей, или полученную из нее путем вырождения, связывают с соответствующей последовательностью, кодирующей белок, в качестве носителя, с замещением в результате по меньшей мере части последовательности, кодирующей вирусный белок или встраиванием по меньшей мере в одну из областей указанной последовательности, кодирующей участок детерминанты вирусного белка 19 Способ по п 18, отличающийся тем, что вирусный белок выбирают из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В 20 Способ по любому из пп 17-19, отличающийся тем, что в качестве вектора экспрессии используют вирус, выбранный из группы, включающей вирус гриппа, бакуловирус и вирус коровьей оспы, предпочтительно в рекомбинантой форме 21 Способ получения антител, проявляющих ВИЧ-1 нейтрализующую активность или предотвращающих слияние пораженных ВИЧ-1 клеток, отличающийся тем, что проводят иммунизацию млекопитающего путем введения пептида, выбранного из группы, включающей ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS и LELNKWAS 22 Способ по п 21, отличающийся тем, что указанный пептид вводят через поверхность слизистой оболочки, предпочтительно через нос 23 Способ по п 21 или 22, отличающийся тем, что IgA антитела получают предпочтительно в результате секреторных процессов в поверхности слизистой оболочки 24 Способ по любому из пп 21-23, отличающийся тем, что вводят пептид, соединенный с носителем 25 Способ по п 24, отличающийся тем, что вводят пептид, соединенной с частью вируса, выбранного из группы, включающей вирус гриппа, вирус коровьей оспы и бакуловирус, предпочтительно в рекомбинантной форме 26 Способ по п 24 или 25, отличающийся тем, что вводят пептид, в котором, по меньшей мере, одна из указанных аминокислотных последовательностей замещает, по меньшей мере, часть аминокислотной последовательности вирусного белка как носителя или встроена, по меньшей мере, в одну область детерминанты вирусного белка 27 Способ по п 26, отличающийся тем, что вирусный белок выбран из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В 28 Способ по п 26, отличающийся тем, что вводят вирусный белок, который получен из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантной форме 29 Антитело IgA, проявляющее ВИЧ-1 нейтрализующую активность и/или подавляющее слияние пораженных ВИЧ-1 клеток, получаемое иммунизацией млекопитающего путем введения по крайней мере одного из пептидов, выбранного из группы, включающей ELDKWAS, LELDKWAS, ELDNWAS, ELNKWAS, LELDNWAS и LELNKWAS 30 Антитело по п 29, отличающееся тем, что его получают с помощью иммунизации млекопитающего через поверхность слизистой оболочки, предпочтительно через нос 31 Антитело по любому из пп 29, 30, отличающееся тем, что его получают в результате секреторных процессов в поверхности слизистой оболочки 32 Антитело по любому из пп 29-31, отличающееся тем, что его получают в результате введения пептида, соединенного с носителем 33 Антитело по п 32, отличающееся тем, что его получают в результате введения пептида, который соединен с вирусом, выбранным из группы, включающей вирус гриппа, вирус коровьей оспы и бакуловирус, предпочтительно в рекомбинантной форме 34 Антитело по п 33, отличающееся тем, что его получают в результате введения пептида, в котором по меньшей мере одна из указанных аминокислотных последовательностей замещает по меньшей мере часть аминокислотной последовательности вирусного белка или встроена по меньшей мере в одну область детерминанты вирусного белка 35 Антитело по п 34, отличающееся тем, что его получают в результате введения пептида, который соединен с вирусным белком, выбранным из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В 36 Антитело по п 34, отличающееся тем, что его получают в результате введения пептида, в котором вирусный белок получен из бакуловируса или вируса коровьей оспы, предпочтительно в рекомбинантой форме 43350 Настоящее изобретение относится к пептидам, способствующим образованию нейтрализующих антител к различным штаммам и клиническим изолятам ВИЧ-1, а также к создаваемым пептидами антителами и кроме того к комбинациям пептид-носитель, эффективно переносящими эти пептиды в иммунную систему Более конкретно, данное изобретение относится к созданию вакцины против ВИЧ-1 Синдром приобретенного иммунодефицита (СПИД) является последней стадией клинического проявления долговременной устойчивой инфекции вирусом иммунодефицита человека типа 1 (ВИЧ-1) Направленные на вирус и на инфицированные вирусом клетки иммунные реакции в ходе устойчивой инфекции обычно не способны прекратить инфекцию Вакцины могут создать такие иммунные реакции, которые способны предотвратить возникновение устойчивой инфекции или даже предотвратить ее развитие в СПИД Большинство стратегий вакцинации против ВИЧ-1 направлены на его поверхностный гликопротеин др160, состоящий из др120 и др41 и ответственный за связывание вируса с клеточным рецептором CD 4 и за последующий запуск направленной на слияние активности Однако, что касается др160, то некоторые наблюдаемые явления свидетельствуют о неприемлемости в качестве иммуногена полного др160 или др120 Опыты in vitro показывают, что синергизм между др120 и др120-специфичными антителами блокирует активность Т-клеток человека (Mittler и др , Science (1989) 245, 1380) Кроме того, известно, что ряд антигенных доменов в др160 индуцируют антитела, усиливающие инфекцию ВИЧ-1 (Jiang и др , J, Exp Med (1991) 174, 1557) Применение в качестве иммуногенов синтетических пептидов имеет целый ряд преимуществ Создаваемые синтетическими пептидами антитела обладают заданной специфичностью и в случае вирусов могут быть подобраны пептиды, образующие на поверхности вирионов целые структуры Синтетические полипептиды интересны также с точки зрения их способности индуцировать реакцию антитела, не наблюдаемую в обычных условиях К примеру, можно индуцировать нейтрализующие антитела с более широкой, чем у целостных белков, реакционной способностью (Green и др , Cell (1982) 28, 477) коровьей оспы, полиомиелита ли гриппа Кролики, зараженные рекомбинантным вирусом коровьей оспы, содержащим последовательности из поверхностного антигена вируса гепатита В (HBSAg), гликопротеина вируса простого герпеса и гемагглютинина вируса гриппа, продуцируют антитела ко всем трем чужеродным антигенам (Perkus и др , Science (1985) 229, 981) Более того, химерный вирус полиомиелита, экспессирующий эпитоп из др41 ВИЧ-1, успешно индуцирует у кроликов нейтрализующие антитела к ВИЧ-1 (Evans и др , Nature (1989, 339, 385) Совсем недавно стало возможным изменять in vitro мутагенезом геном вируса гриппа (Enami и др , Proc Natl Acad Sci США (1990) 87, 3802) С помощью подобной технологии методами генной инженерии удалось создать устойчивый ослабленный вирус гриппа А ( Muster и др , Ргос Natl Acad Sci США (1991)88,5177) Преимущества вируса гриппа в данном контексте заключаются в доступности многих вариантов, что позволяет проводить повторные вакцинации Кроме того, вирус гриппа индуцирует сильные секреторные и клеточные иммунные реакции, которые могут иметь успех при создании анти-ВИЧ-1 вакцины Цель настоящего изобретения состоит в создании пептидных последовательностей, которые всего лишь минимально иммуногенны в сравнении с целостным др160 Такие пептидные последовательности могут быть использованы для создания антител, проявляющих нейтрализующую активность относительно различных штаммов и/или клинических изолятов ВИЧ-1 и/или подавляющих слияние клеток млекопитающего, пораженных ВИЧ-1 Еще одна цель изобретения заключается в создании стратегии индуцирования секреторных антител, секретируемых из слизистой поверхности и направленных на вирус ВИЧ-1 и на инфицированные вирусом клетки Согласно изобретению предполагается, что созданные в ткани слизистой анти-ВИЧ-1 IgA антитела станут оружием, особенно мощным для профилактики и предотвращения инфицирования ВИЧ-1 индивидуумов из группы риска, поскольку многие вирусные инфекции, включая ВИЧ-1, передаются через поверхность слизистой дыхательных путей, желудочнокишечного тракта и половых путей Кроме того, пептид, содержащий часть V3 петли др120 из ВИЧ-1 изолята (ВИЧ-1 1Mb), как показано, индуцирует антитела, защищающие шимпанзе от вируса при искусственном заражении животного тем же ВИЧ-1 изолятом (Emim и др , Nature (1992) 355, 728) Поскольку синтетические пептиды сами по себе обладают слабой иммуногенностью, их необходимо соединить с молекулами, создающими синергическое действие, например столбнячным токсидом или гемоцианином лимфы улитки (Bittle и др , Nature (1982) 298, 30) Другая возможность заключается в клонировании небольших пептидов в виде слитых белков с глютатион-Э-трансферазой из Schistosoma japomcum (Fikkig и др , Science (1990) 250, 553) В качестве векторов для иммуногенов могут быть использованы также и вирусы, например Указанные цели достигаются получением небольших пептидов из семи или восьми аминокислот, полученных либо химическим синтезом, либо микробиологическими методами Рекомендуется, чтобы пептиды происходили из последовательностей нуклеиновых кислот, кодирующих Glu Leu Asp Lys Trp Ala Ser (=ELD KWAS в однобуквенном коде), Leu Glu Leu Asp Lys Trp Ala Ser (LELDKWAS), Glu Leu Asn Lys Trp Ala Ser (ELN KWAS), Leu Glu Leu Asn Lys Trp Ala Ser (LELNKWAS), Glu Leu Asp Asn Trp Ala Ser (ELDNWAS) или Leu Glu Leu Asp Asn Trp Ala Ser (LELDNWAS) По меньшей мере одна, но предпочтительно все шесть вышеупомянутые аминокислотные последовательности (далее называются «указанными шестью АКП») могут быть успешно введены в иммунную систему чтобы индуцировать 43350 образование и выделение антител, проявляющих нейтрализующую аісгивность относительно ВИЧ-1 штаммов и/или подавляющих клеточное слияние, вызываемое этими штаммами Основная цель изобретения заключается в создании многообещающей анти-ВИЧ-1 вакцины, основанной на препарате, включающем по меньшей мере один, предпочтительно смесь всех шести вышеупомянутых пептидов Характерные признаки и преимущества изобретения приводятся ниже В рекомендуемом воплощении изобретения аминокислотную последовательность Clu Leu Asp Lys Trp Ala (ELDKWA), определяющую последовательность эпитопа из моноклонального антитела человека 2Р5 (получено из гибридомной клеточной линии 2Р5, PHLS депонент № 90091704, депонирован 09/17/90), соединяют с Ser или с Leu и Ser одновременно, расположенными рядом с ELDKWA последовательностью в др41, определяющей 2Р5 эпитоп, с образованием пептидных последовательностей Glu Leu Asp Lys Trp Ala Ser (ELDKWAS) и Leu Glu Leu Asp Lys Trp Ala Ser (LELDKWAS) соответственно и введение в молекулу носителя, а именно, область детерминанты В из НА вируса гриппа Модифицированный «химерный» НА слитый белок, несущий чужеродную аминокислотную последовательность ELDKWAS или LELDKWAS, очень эффективно индуцирует антитела, направленные на указанную ELDKWAS или LELDKWAS последовательность, при введении белка, предпочтительно в виде инъекции в иммунную систему млекопитающего, в частности, человека Полученные таким путем антитела проявляют нейтрализующую активность относительно различных штаммов и/или клинических изолятов ВИЧ-1 Тем не менее оказалось, что вследствие известного полиморфизма ВИЧ-1, мутации вируса могут присходить даже в пределах высококонсервативной (L) ELDKWAS аминокислотной последовательности др41, соответствующей аминокислотам 661-668 (LELDKWAS) или 662-668 (ELDKWAS) из ВИЧ-1 изолята ВН10 Нумерация нуклеотидов и аминокислот, применяемая в данном описании, соответствует нумерации др160 из ВИЧ-1 изолята ВН10, применяемой согласно базы данных Лос Алмоса (Myers и др , Data Base Human Retrovirus and Aids) Особенно подвержены мутации Asp (D) и/или Lys (К) аминокислоты, находящиеся в центре указанной последовательности, с уменьшением вероятности нейтрализации вируса антителами, несущими 2Р5 эпитоп Такой нежелательный вариант механиза «побега вируса» можно успешно избежать применением тех пептидов настоящего изобретения, в которых либо Asp (D), либо соседний Lys (К) заменены аспарагином (N) Для приготовления фармацевтического средства, предназначенного для индуцирования антител, проявляющих нейтрализующую активность относительно различных штаммов и/или клинических изолятов ВИЧ-1 и/или подавляющих слияние пораженных ВИЧ-1 клеток, может быть использован хотя бы один, предпочтительно смесь всех шести пептидов В другом варианте для изготовления фармацевтического средства, предназначенного для инду цирования анти-ВИЧ-1 IgA антител, секретируемых поверхностью слизистой оболочки, предпочтительно при введении млекопитающему через нос, могут быть использованы те же пептиды либо в виде каждого пептида по отдельности, либо в смеси с хотя бы с одним другим пептидом В еще одном варианте изобретения по меньшей мере один из шести указанных пептидов соединяют с носителем Подобным носителем может служить, к примеру, вирус в его ослабленной и/или рекомбинантной форме С успехом могут быть использованы вирус гриппа, бакуловирус или вирус коровьей оспы Присоединение небольших пептидов к носителю, такому как, например, вирусный белок или вирус целиком повышает эффективность индуцирования антитела после введения в иммунную систему таких химерных комбинаций пептид-носитель или химерных слитых белков Особенно успешным является применение каждого из вышеприведенных пептидов в виде слитого белка с вирусным белком в качестве носителя, причем по меньшей мере одна аминокислотная последовательность по изобретению замещает по меньшей мере одну часть вирусного белканосителя или встроена в по меньшей мере одну из областей детерминанты вирусного белка Данный признак, таким образом, представляет важное воплощение изобретения В рекомендуемом варианте указанный вирусный белок является гемагглютинином (НА) вируса гриппа, нейраминидазой (NA) вируса гриппа или поверхностным антигеном вируса гепатита В В другом варианте источника белка может служить бакуловирус (предпочтительно рекомбинантный) или вирус коровьей оспы Настоящее изобретение относится также к применению любого из вышеохарактеризованных пептидов, состоящих из семи или восьми аминокислот, и/или комбинаций пептид-носитель, или слитых белков для приготовления фармацевтического средства, предназначенного для создания или индуцирования антител, проявляющих нейтрализующую активность относительно различных штаммов и/или клинических изолятов ВИЧ-1 и/или подавляющих слияние пораженных ВИЧ-1 клеток Если более конкретно, то поставлена задача создания эффективной вакцины, основанной на по меньшей мере одном, предпочтительно смеси всех шести указанных пептидов и/или шести указанных пептидов, соединенных с носителем, для профилактической обработки индивидуумов, которым угрожает заражение ВИЧ-1, и/или для лечения инфицированных ВИЧ-1 больных, особенно для предотвращения развития инфекции в СПИД В еще одном рекомендуемом варианте указанные шесть пептидов и/или указанные шесть пептидов, соединенные с носителем, применяют для изготовления фармацевтических препаратов, которые после введения в иммунную систему млекопитающего приводят к индуцированию антиВИЧ-1 IgA антител, секретируемых с поверхности слизистой больного животного или человека В этом случае рекомендуется введение через нос Соответственно, указанные шесть пептидов и/или комбинации пептид-носитель настоящего изобретения могут быть также использованы для приготовления фармацевтического средства, 43350 предназначенного для профилаїсгики или предотвращения инфекции ВИЧ-1 в группах риска инфицирования ВИЧ-1 По всей видимости, именно данный характерный признак настоящего изобретения позволяет надеяться на то, что путем индуцирования анти-ВИЧ-1 специфичных секреторных IgA антител на поверхности слизистой оболочки согласно настоящему изобретению дается медицинский инструмент, с помощью которого эффективно атакуется вирусная агрессия уже на первых этапах проникновения вируса в организм млекопитающего Полагают, что способы-прототипы лечения ВИЧ-1 инфицированных больных по меньшей мере частично не способны защитить больного потому, что охота за вирусом происходит в кровеносной системе, т е после широкого распространения вируса в гуморальной системе В рекомендуемом варианте указанное антитело является секреторным антителом, предпочтительно анти-ВИЧ-1 IgA антителом, которое с успехом секретируется поверхностью слизистой оболочки Кроме того, настоящее изобретение относится также к способу получения любого из шести указанных пептидов либо микробиологическими, либо химическими методами В одном из вариантов указанные шесть пептидов синтезируют химически по стандартным биохимическим методикам, предпочтительно с помощью синтезатора пептидов модели 431А фирмы Эпплайд Биосистемс В другом варианте указанные аминокислотные последовательности получают микробиологическим способом, включающим стадии встраивания нуклеотидной последовательности, выбранной из группы, состоящей из a) нуклеотидной последовательности, соответствующей одному из шести указанных пептидов, b) нуклеотидной последовательности, гибридизованной с одной из нуклеотидных последовательностей по пункту а), c) нуклеотидной последовательности, полученной из одной из нуклеотидных последовательностей по пункту а) путем вырождения в геном микроорганиза-хозяина, ведущего экспрессию генома, применением стандартной технологии микробиологического культивирования и выделением по меньшей мере одного, предпочтительно нескольких указанных пептидов Химерные слитые белки или комбинации пептид-носитель могут быть получены способом, включающем соединение аминокислотной последовательности, выбранной из группы, состоящей из шести указанных пептидов, с носителем, предпочтительно вирусом или вирусным белком химическими или микробиологическими методами В рекомендуемом варианте способ получения шести указанных пептидов, связанных с носителем, предпочтительно вирусом или вирусным белком, является микробиологическим способом и состоит из стадий присоединения нуклеотидной последовательности, выбранной из группы, включающей а) нуклеотидную последовательность, соответствующую одной из аминокислотных последовательностей указанных шести пептидов, b) нуклеотидную последовательность, гибридизованную с одной из нуклеотидных последовательностей по пункту а), c) нуклеотидную последовательность, полученую из одной из нуклеотидных последовательностей по пункту а) путем вырождения к нуклеотидной последовательности, соответствующей аминокислотной последовательности носителя, переноса соединенной нуклеотидной последовательности в микроорганизм-хозяин, проведения экспрессии соединенной последовательности применением стандартной микробиологической технологии и выделения по меньшей мере одного, предпочтительно нескольких указанных пептидов, связанных с носителем В еще одном варианте способ получения указанных шести пептидов, связанных с носителем, предпочтительно вирусом или вирусным белком, отличается тем, что по меньшей мере одну нуклеотидную последовательность, выбранную из группы, включающей a) нуклеотидную последовательность, соответствующую одной из аминокислотных последовательностей указанных шести пептидов, b) нуклеотидную последовательность, гибридизованную с одной из нуклеотидных последовательностей по пункту а), c) нуклеотидную последовательность, полученую из одной из нуклеотидных последовательностей по пункту а) путем вырождения соединяют с нуклеотидной последовательностью, соответствующей аминокислотной последовательности вирусного белка в качестве носителя, с замещением в результате по меньшей мере части нуклеотидной последовательности, соответствующей аминокислотной последовательности вирусного белка или встраиванием в по меньшей мере один участок указанной последовательности, соответствующий области детерминанты вирусного белка В характерном воплощении изобретения применяемый вирусный белок выбирают из группы, включающей гемагглютинин вируса гриппа, нейраминидазу вируса гриппа и поверхностный антиген вируса гепатита В, а в другом характерном варианте в качестве микроорганизма-хозяина применяют вирус гриппа, бакуловирус или вирус коровьей оспы, предпочтительно каждый из них в рекомбинантной форме Встраивание последовательностей шести указанных пептидов в область детерминанты В в НА штаммов вируса грип па, отличных от WSN, на который в основном и происходит ссылка в нижеследующих примерах , приводит в равной степени к слитым белкам и/ или химерным вирусам , создающим нейтрализующие анти-ВИЧ-1 антитела и предотвращающим направляемое ВИЧ-1 клеточное слияние Введение этих же послед овал ьностей в другие участки НА вируса гриппа или нейраминидазу (NA) вируса гриппа также приводит к слитым белкам пептид-носитель и/или химерным вирусам , создающим нейтрализующие анти-ВИЧ антитела и предотвращающим направляемое ВИЧ-1 клеточное слияние Настоящее изобретение далее дополнительно разъясняется и иллюстрируется следую 43350 щими примерами, которые ни в коей мере не ограничивают объема настоящего изобретения Пример 1. Картирование эпитопа Эпитоп моноклонального антитела 2Р5 идентифицируют иммуноблоттингом по методике, приведенной в работе Towbm и др , Proc Natl Acad Sci США (1979) 76, 4850 Пептиды перекрывающихся фрагментов из др41 ВИЧ-1 изолята ВН10 клонируют в виде пептидов, слитых с глютатионтрансферазой Различные слитые пептиды получены путем гибридизации соответствующих др41 олигонуклеотидов, клонированных между Bam H1 и ECO R1 сайтами плазмиды pGEX-2T (Фармация) Рекомбинантными плазмидами трансформируют Е coh штамм DH5, и экспрессию слитых белков индуцируют изопропилтиогалактозидом (ИПТГ) Экстракт Е coh затем очищают на колонках глютатион-сефарозы 4В, переносят на натрийдодецилсульфат-полиакриламидные гели, разделяют электрофорезом, и экспрессию белка анализируют окрашиванием серебром и иммуноблотингом (Рис 1) Полученные иммуноблотингом данные показывают, что эпитоп моноклонального антитела 2Р5 человека включает аминокислотную последовательность ELDRWA, соответствующую в др160 аминокислотам 662-667 Рис 1 иллюстрирует специфичность моноклонального антитела 2Р5 человека (см Пример 1) Рис 2 иллюстрирует конструкцию химерных гемагглютининов, несщих последовательность 2Р5-эпитопа (см Пример 2) На рис 3 показаны титры в ферментном иммуносорбентном тесте (EL ISA) для антисыворотки мыши, иммунизированной химерным вирусом гриппа (см Пример 3) На Рис 4 показаны титры в EL ISA мыши, иммунизированной клетками, инфицированными рекомбинантным бакуловирусом (см Пример 5) На рис 1 приведены результаты иммуноблоттинга пептидов, слитых с перекрывающимися фрагментами из др160 ВИЧ-1 (изолят ВН10) В отличие от конструкций, содержащих аминокислоты 597-677 (полоса 2), 634-677 (полоса 3) и 648677 (полоса 4) и реагирующих с антителом 2Р5, слитый белок, содержащий аминокислоты 667-677 (полоса 5), не дает положительной реакции Это является прямым указанием на то, что эпитоп моноклонального антитела 2Р5 образован аминокислотами в пределах последовательности в положении 648-667 в др160 На основании этих результатов перекрывающиеся 6-тимерные пептиды из этой области сливают с глютатион-sтрансферазой Как видно из Рис 1Ь, пептид, содержащий аминокислотную последовательность Glu LEUASP LYS TRP ALA (аминокислоты 662-667, полоса 2), отличается высокой реакционноспособностью относительно антитела 2Р5, в то время как у пептидов, содержащих аминокислотную последовательность LEU ASP LYS TRP ALA SER (LDKWAS, аминокислоты 663-668, полоса 3) или ASP LYS TRP ALA SER LEU (DKWASL, аминокислоты 664669, полоса 4), реакционноспособность относительно моноклонального антитела понижена Пептид, содержащий аминокислотную последовательность LEU Glu LEU ASP LYS TRP (LELDKW, аминокислоты 661-666, полоса 1), не проявляет значительной реакционноспособности Приведенные данные показывают, что эпитоп моноклонального антитела включает аминокислотную последовательность Glu LEU ASP LYS TRP ALA (ELDKWA), соответствующую аминокислотам 662667 в gp160 из ВИЧ-1 (изолят ВН10) В данном контексте, как синтетический пептид, соответствующий последовательности данного эпитопа, так и слитый белок, содержащий эту последовательность, оказались способными подавлять нейтрализацию, происходящую при участии 2Р5 антитела Пример 2 Конструирование плазмид и химерных вирусов гриппа Все приемы генной инженерии осуществлены согласно стандартным методикам, приведенным в издании Sambrook и др (1989) "Molecular, Cloning", Laboratory Manual, Коулд СпрингХарбор Лэборетори Пресс, Нью-Йорк Как показано, на Рис 2, др41-последовательности Leu Glu Leu Asp Lys Trp Ala Ser (LELDKWAS) или Glu Leu Asp Lys Trp Ala Ser (ELDKWAS) вводят в область детерминанты В в НА вируса WSN гриппа Плазмиды pHA-ELDKWAS и рНА-1 ELDKWAS конструируют заменой Pst 1 -Hind III фрагмента плазмиды рТЗ/WSN-HAml, описанной Li и др (Proc Natl Acad Sci США 90, 5214-5218 (1993), ПЦР продуктом, полученным применением рТЗЛ/VSN-HAml в качестве матрицы и смыслового и антисмыслового праймеров, происходящих из вируса WSN HAml гриппа, причем антисмысловой праймер дополнительно содержит 21 и 24 нуклеотидную вставку, соответствующую положения 1981 или 1984-2004 в др160 Аналогичным путем получены плазмиды pHA-EL NKWAS, pHA-LEL NKWAS, pHA-ELDNWAS и pHA-1 ELDNWAS Последовательность WSN НА приводится в работе Hiti и др (J Virol 41 730-734 (1982), а последовательность gp160 содержится в базе данных Суисспорт, поступление ENVSHTV10 Трансфекцию РНК, происходящую из этой плазмиды, в MDBK клетки, отбор и получение химерных вирусов осуществляют согласно Enami и др (Proc Natl Acad Sci США 87, 3802-3805 (1990) с модификациями приведенными Enami и Palese (J Virol 65 2711-2713(1991)) Пример 3. Иммунизация и реакция антител у мышей, иммунизированных химерными вирусами гриппа Мышей линии OF-1 иммунизируют химерным вирусом ELDKWAS-гриппа (мыши М1, М2, МЗ, М4) или вирусом LELDKWAS-гриппа (мышь М5) Вначале мышей иммунизируют 102 TCIDso через нос (1 N) с последующей бустериммунизацией ч н 5x105 TCID50 спустя 6 недель, иммунизацией внутрибрюшинно (1Р) 20 мкг очищенного на сахарозе живого вируса через 3 недели и наконец бустер-инъекцией 20 мкг НДСденатурированного вируса в неполном адъюванте Фрейнда с интервалом в еще 3 недели При иммунизации через нос мыши находятся под эфирной анестезией Для WSN контрольного вируса дикого типа (wt1, wt2) применяют ту же методику Через 12 дней после конечной бустеринъекции у мышей отбирают образцы крови, антисыворотку дезактивируют 1 ч при 56°С и определяют титры в 43350 ELISA и нейтрализующую активность антисыворотки На Рис За показано связывание антисыворотки ELDKWAS-гриппа с пептидом, слитым с глютатион-трансферазой (GST) и содержащим у своего С-окончания последова-тельность ELDKWA Последовательность опре-делена с помощью EL ISA Титрационные мик-ропланшеты на 96 лунок покрывают GST-ELDKWA слитым пептидом в количестве 4 мкг/мл (100 мкл/лунку) в карбонатном буфере (рН 9,6) и выдерживают 4 ч при комнатной температуре Затем планшеты промывают ФБСР-0,05% Твина Антисыворотку разбавляют ФБСР-1% БСА-0,05% Твина, вносят в планшеты и выдерживают 1 час при комн т-ре После промывания антитела обнаруживают инкубированием с козьим антимышиным IgC (у-цепь) антителом, конъюгированным с пероксидазой хрена Планшеты окрашивают применением в качестве субстрата дигидрохлорида о-фенилендиамина Реакцию прекращают добавлением 2,5 М H2SO4, и проводят измерение планшеты (длина волны 492 нм, ссылочная длина волны 620 нм) Рис Зв Воспроизведена методика, приведенная для Рис За, за тем исключением, что для обнаружения антител применяют козье антимышиное IgA антитело, конъюгированное с пероксидазой хрена Нейтрализующую активность антисыворотки определяют анализом с подавлением синцитий Эквивалентные разведения антисыворотки, при которых происходит подавление образования синцития на 50% (ЭД50), приведены в Таблице 1 Антисыворотка от мышей М1-МЗ нейтрализует испытуемую панель полностью при различных разбавлениях антисыворотки Антисыворотка мышей М4 и М5 нейтрализует ВИЧ-1 изолятыMN и RF, но не IIIB Антисыворотка, индуцированная WSN вирусом дикого типа, не нейтрализует никаких испытанных ВИЧ-1 изолятов даже при самых низких разбавлениях сыворотки (1 20) Нейтрализация ВИЧ-1 сывороткой, индуцированной против химерного вируса гриппа Титр нейтрализации (ЭД50) антисывоMN RF III В ротка М1 М2 МЗ М4 53 24 34 29 95 40 160 24 М5 20 34 20 160 67 не испытывалась 24 Для анализа с подавлением сицинтий применяют индикаторную клеточную линию АА-2, описанную в работе Chaffee и др, J Exp Med (1988) 168, 605, и исходные замороженные образцы вирусного инокулума ВИЧ-1 штаммов MN, RF и IIB Все образцы вируса разбавляют до концентрации 9x10-5x102 TCID50 на мл Мышиную антисыворотку разбавляют в 2 раза средой и вносят в традиционные микропланшеты на 96 лунок (4 повтора на каждое разбавление) К 50 мл разбавленной антисыворотки добавляют 50 мкл вируса и смесь вирус-антитело выдерживают 2 ч при 4°С Для инфицирования в каждую лунку вносят 100 мкл АА-2 клеток (5x106 клеток/мл), присутствие сицинтий регистрируют через 5 дней, как указание на ВИЧ-1 инфекцию Определение 50%-ой ингибирующей дозы (ЭДбо) проводят по методике Reed и Muench, приведенной в Am J Hyg (1938) 27, 493 Приведены эквивалентные разведения сыворотки, при которых происходит 50%-ое подавление образование сицинтий (ЭД50) Пример 4. Экспрессии рекомбинантными бакуловирусами химерных гемагглютининов, несущих удлиненные 2Р5-эпитопы Химерные гемагглютинины, содержащие шесть указанных пептидов, получают по методике Примера 1 Последовательность, кодирующая эти химерные гемагглютинины, фланкирована сайтом фермента рестрикции ВатН1 и встроена в ВатН1 сайт плазмиды Bluebac III (Инвитроген, Сан-Диего, КА) Эксперименты с трансфекцией с целью получения рекомбинантных бакуловирусов, содержащих химерные гемагглютинины, проведены по методикам, приведенным в работах Groebe и др , Nucleic Acids Res (1990) 18, 4033 и Feigner и др , Proc Natl Acad Sci США (1987) 84, 7413 Полученные рекомбинантные химерные бакуловирусы могут быть использованы для создания нейтрализующих ВИЧ-1 антител Пример 5 Иммунизация и реакции антител у мышей, иммунизированных клетками, инфицированными рекомбинантными бакуловирусами Применяемые для иммунизации Sf9 клетки инфицируют рекомбинантными бакуловирусами при множественности заражения (МОТ) 1-5 и собирают через 3 дня после заражения Клетки дважды промывают ФБСР и вновь суспендируют в ФБСР в концентрации 5x106 клеток/мл Данные клетки специфично реагируют с моноклональным антителом 2F5 в анализе вестерн блоттингом, что можно считать указанием на содержание в этих клетках гемагглютинина, несущего ELDKWAS или LELDKWAS последовательность Мышей линии Balb/cA иммунизируют четырьмя инъекциями внутрибрюшинно по 1х106 инфицированных Sf9 клеток с интервалом в 2 недели (Van Wyyke Coelingh и др Virology (1987) 160, 4465) Через семь дней после четвертой иммунизации у мышей отбирают образцы крови и определяют EL ISA титры антисыворотки На Рис 4 показано связывание созданной рекомбинантным бакуловирусом антисыворотки с синтетическим пептидом, состоящим из последовательности Gly Gly Gly Glu leu Asp Lys Trp Ala (GGCELDKWA) методом EL ISA, осуществлен по методике Примера 2 Индуцирование секреторных антител Иммунизация, проведенная введением по меньшей мере одного, предпочтительно смеси шести указанных пептидов, привела к значительному улучшению IgG ELDKWA - специфичных EL ISA титров Более того, в отличие от иммунизации с применением ELDKWA последовательности, иммунизация шестью указанными пептидами приводит также к значительной IgA реакции Оказалось неожиданностью то, что такая IgA имунная реакция запускается также и на уровне слизистой Пример 6 IgA антитела в секреции дыхательных путей Balb/c мышей, иммунизированных вирусом гриппа-ELDKWAS 43350 Мышей иммунизируют введением через нос 102 PFU и спустя 4 недели повторно иммунизируют введением тем же путем 105 PFU. Третью иммунизацию проводят спустя еще 4 недели введением через нос (IN) или внутрибрюшинно (I Р) 107 PFU. Через 8 недель после третьей иммунизации собирают и объединяют продукты промывания носа и методом EL ISA определяют реакционность этих образцов с пептидом ELDKWA. В качестве контроля (образец WT) анализируют объединенные продукты промывания носов мышей, иммунизированных вирусом гриппа дикого типа (WT). Применена та же схема иммунизации, что и для IN группы (см. Рис. 5). Индуцированные антитела продуцируются преимущественно слизистой носа, и можно считать, что титр антитела необычайно высок. Из Рис. 5 видно также, что введение через нос вируса гриппа-ELDKWAS приводит к более высокой концентрации ВИЧ-1 нейтрализующих антител по сравнению с внутрибрюшинным введением. Пример 7. ТдА антитела в секреции кишечника Balb/c мышей, иммунизированных вирусом гриппа-ELDKWAS. Мышей иммунизируют введением через нос 102PFU и спустя 4 недели повторно иммунизируют введением тем же путем 106 PFU. Третью иммунизацию проводят спустя еще 4 недели введением через нос (см. Рис. 6а) или внутрибрюшинно (см. Рис. 6В) 107 PFU. Через 8 недель после третьей иммунизации собирают и экстрагируют фекалии, содержащие антитела, выделенные из слизистой кишечника и методом EL ISA определяют реакционноспособность этих образцов относительно пептида ELDKWA. I N О, IN R, IN В и IN S - это образцы от мышей, которым третья иммунизация проводилась через нос, а образцы IP О, IP R, IP RS и IP S отобраны у мышей, которым третья иммунизация проводилась внутрибрюшинно. WT1 и WT2 - это образцы контрольных мышей, иммунизированных вирусом гриппа дикого типа (WT). b а ••гтатга; 106 10649шипа ."Ц^у ТУ ^ 7 Фиг. 1 560 534 HA ( w t ) : ACG AAG AAG GGG GAT TCA TAC CCA AAG T K K G D S Y P K 2004 1984 HA-ELDKWAS: AAG AAG GGG GAG CTC GAT AAA TGG GCT AGC GAT TCA TAC K K 6 E L D K W A S D S Y 1 981 HA-LELDKWAS: 2004 AAG AAG GGG TTG GAG CTC 6AT AAA TGG SCT AGC GAT TCA TAC K K G L E L D K W A S D S Y Фиг. 2 43350 т * М4 Ml М2 о М З •+ X wt 2 wt 1 О * 1000 10000 1С0ОО0 лентное развэдепае сыворот:х Фиг. ЗА 1000 10U Е:з:_Вс^энтвое разведение сыво-поакх. ФИГ. ЗВ wt I • wt 2 л В2-1 о В2-2 + В2-3 X В2-4 о • 1000 Фиг. 4 ЮООО В2-5 43350 из і:оса ,8 ,7 ,6 \ .5 •ег .4 • О О ,3 • X IP Pool О IN Pool TWT Pool \ Л \ . • ,1 \ ^ • 0 • 10 100 ^азведеиье Фиг. 5 xn о О IN R A IN В О IN S + W 1 T DWT 2 ФИГ. 6А ФИГ. 6В Тираж 50 екз Відкрите акціонерне товариство «Патент» Україна, 88000, м Ужгород, вул Гагаріна, 101 (03122) 3-72-89 (03122) 2-57-03 10 43350 11
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptide induced production antibodies having neutralizing activity concerning hiv-1 strains and/or isolates, and/or inhibite due to vil-1 injured cell fusion, farmaceutical agent for antibody formation, method for antibody obtaining, iga, antibody demonstrating counteractive activity neutralizing hiv-1 and/or inhibits due to vil-1 injured cell fusion
Автори англійськоюKATINGER HERMANN, MUSTER THOMAS
Назва патенту російськоюПептид, вызывающий образование антител, проявляющих нейтрализирующую активность относительно штамов и/или изолятов вич-1 , и/или угнетающих слияние пораженных вич-1 клеток, фармацевтическое средство для образования антител, способ получения пептида для образования антител, способ получения антител, антитело iga, проявляющее вич-1 нейтрализирующую активность и/или угнетающее слияние пораженных вич-1 клеток
Автори російськоюКатингер Герман, Мустер Томас
МПК / Мітки
МПК: C12N 15/48, A61K 39/21, C12P 21/02, C07K 14/16, C07K 16/08, C07K 7/06, A61P 31/12, A61K 39/395, C12P 21/08, C12N 15/09, C12N 7/00
Мітки: фармацевтичний, активність, проявляють, антитіл, антиті, викликає, відносної, пептид, штамів, злиття, пригнічують, віл-1, нейтралізуючу, засіб, уражених, ізолятів, утворення, клітин
Код посилання
<a href="https://ua.patents.su/11-43350-peptid-yakijj-viklikaeh-utvorennya-antitil-shho-proyavlyayut-nejjtralizuyuchu-aktivnist-vidnosno-shtamiv-ta-abo-izolyativ-vil-1-ta-abo-prignichuyut-zlittya-urazhenikh-vil-1-klitin.html" target="_blank" rel="follow" title="База патентів України">Пептид, який викликає утворення антитіл, що проявляють нейтралізуючу активність відносно штамів та/або ізолятів віл-1 , та/або пригнічують злиття уражених віл-1 клітин, фармацевтичний засіб для утворення антиті</a>
Попередній патент: Роздільник незмішуваних рідин
Наступний патент: Діюча речовина медичних та фармакологічних засобів з активністю антагоніста ексайторних амінокислот
Випадковий патент: Планетарний редуктор