Спосіб підвищення оптичної чистоти 2r-[1-гідрокси-1-трифторметил-3-циклопропілпропін-2-іл]-4-хлораніліну
Номер патенту: 56258
Опубліковано: 15.05.2003
Автори: Чен Ченг Йі, Тілльєр Річард Д., Тан Луши, Рейдер Пол Дж., Грабовскі Едвард Дж. Дж.
Формула / Реферат
1. Спосіб підвищення оптичної чистоти R-аміноспирту формули:
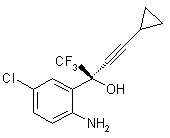 ,
,
що включає стадії:
(a) повільного додання розчину кислоти або газоподібної кислоти до розчину аміноспирту в органічному розчиннику з утворенням суспензії кислотно-адитивної солі аміноспирту;
(b) концентрування суспензії кислотно-адитивної солі аміноспирту;
(c) промивання концентрованої суспензії кислотно-адитивної солі аміноспирту органічним розчинником для регулювання складу розчинника;
(d) витримування суспензії кислотно-адитивної солі аміноспирту при температурі навколишнього середовища протягом приблизно від 2 годин до 24 годин;
(e) фільтрування витриманої суспензії кислотно-адитивної солі аміноспирту для виділення вологого осаду кислотно-адитивної солі аміноспирту;
(f) промивання вологого осаду кислотно-адитивної солі аміноспирту холодним органічним розчинником і
(g) сушіння вологого осаду кислотно-адитивної солі аміноспирту для виділення кислотно-адитивної солі аміноспирту у вигляді твердого продукту з підвищеною оптичною чистотою.
2. Спосіб за пунктом 1, де кислота має рКа менше, ніж 3 або рівний 3.
3. Спосіб за п. 2, де органічний розчинник вибирають з групи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового простого ефіру, ацетонітрилу, тетрагідрофурану, метанолу, етанолу, ізопропанолу, вуглеводневих розчинників і їх сумішей.
4. Спосіб за п. 3, де кислота має рКа менше, ніж 1 або рівний 1.
5. Спосіб за п. 4, де органічний розчинник вибирають згрупи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового простого ефіру, ацетонітрилу, тетрагідрофурану, метанолу, етанолу, ізопропанолу, вуглеводневого розчинника і їх сумішей.
6. Спосіб за п. 5, де кислоту вибирають з групи, що складається з НХ, де Χ визначають як галогенід (Сl, Вr, I або F), H2SO4, трифтороцтової кислоти, трихлороцтової кислоти, RSO3H, де R означає (C1-С6)-алкіл, (C2-С6)-алкеніл, (C2-С6)-алкініл, арил, який визначають як феніл або нафтил, і гетероарил, який визначають як 5- або 6-членне кільце, заміщене одним або двома гетероатомами, вибраними з О, S, N, і (C1-С6)-алкіл, (C2-С6)-алкеніл, (C2-С6)-алкініл, арил або гетероарил може бути незаміщений або заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з: Вr, Сl, F, I, (C1-С6)-алкілу, (C2-С6)-алкенілу, (C2-С6)-алкінілу, (C1-С6)-алкокси, ціано, нітро, гідрокси, СНО, СО2Н, SO3H, СО-C1-С6-алкілу, СО2-C1-С6-алкілу, CONR1R2, NR1R2, NR1CO-C1-С6-алкілу, де R1 і R2, незалежно, визначають як: галоген (Сl, Вr, F, І), СF3, CN, NO2, NH2, NH(C1-С6-алкіл), N(C1-С6-алкіл)2, CONH2, CONH(C1-С6-алкіл), CON(C1-С6-алкіл)2, NHCONH2, NHCONH(C1-С6-алкіл), NHCON(C1-С6-алкіл)2, СO2-C1-С6-алкіл, (C1-С6)-алкіл, (C2-С6)-алкеніл, (C2-С6)-алкініл, C3-С7-циклоалкіл або (C1-С6)-алкокси, так що C1-С6-алкіл незаміщений або заміщений арилом, арил визначають як феніл або нафтил, незаміщений або заміщений C1-С6-алкілом, C1-С6-алкокси, NO2 або галогеном (Сl, Br, F, І).
7. Спосіб за п. 6, де органічний розчинник вибирають з групи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового простого ефіру, ацетонітрилу, тетрагідрофурану, метанолу, етанолу, ізопропанолу і вуглеводневих розчинників і їх сумішей.
8. Спосіб за п. 7, де розчин кислоти або газоподібну кислоту вибирають з групи, що складається з 1,5-нафталіндисульфонової кислоти, р-толуолсульфонової кислоти, CH3SO3H, трифторметансульфонової кислоти і камфорасульфонової кислоти, НСl, HBr i H2SO4.
9. Спосіб за п. 8, де розчин кислоти або газоподібна кислота і органічний розчинник являють собою: НСl і ізопропілацетат, НВr і ізопропілацетат або НВr і суміш толуол-тетрагідрофуран.
Текст
1 Спосіб підвищення оптичної чистоти Rаміноспирту формули що включає стадії (a) повільного додання розчину кислоти або газоподібної кислоти до розчину аміноспирту в органічному розчиннику з утворенням суспензії кислотно-адитивної солі аміноспирту, (b) концентрування суспензії кислотно-адитивної солі аміноспирту, (c) промивання концентрованої суспензії кислотноадитивної солі аміноспирту органічним розчинником для регулювання складу розчинника, ЧИСТОТИ 2R-[1 -ПДРОКСИ-1 -ТРИФТОРМЕТИЛ-3 (d) витримування суспензії кислотно-адитивної солі аміноспирту при температурі навколишнього середовища протягом приблизно від 2 годин до 24 годин, (є) фільтрування витриманої суспензії кислотноадитивної солі аміноспирту для виділення вологого осаду кислотно-адитивної солі аміноспирту, (f) промивання вологого осаду кислотно-адитивної солі аміноспирту холодним органічним розчинником і (д) сушіння вологого осаду кислотно-адитивної солі аміноспирту для виділення кислотноадитивної солі аміноспирту у вигляді твердого продукту з підвищеною оптичною чистотою 2 Спосіб за пунктом 1, де кислота має рКа менше, ніж 3 або рівний З 3 Спосіб за п 2, де органічний розчинник вибирають з групи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового простого ефіру, ацетонітрилу, тетрапдрофурану, метанолу, етанолу, ізопропанолу, вуглеводневих розчинників і їх сумішей 4 Спосіб за п 3, де кислота має рКа менше, ніж 1 або рівний 1 5 Спосіб за п 4, де органічний розчинник вибирають з групи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового простого ефіру, ацетонітрилу, тетрапдрофурану, метанолу, етанолу, ізопропанолу, вуглеводневого розчинника і їх сумішей 6 Спосіб за п 5, де кислоту вибирають з групи, що складається з НХ, де X визначають як галогенід (СІ, Вг, І або F), H2SO4, трифтороцтової кислоти, трихлороцтової кислоти, RSO3H, де R означає ( d Сє)-алкіл, (С2-Сб)-алкеніл, (С2-Сб)-алкшіл, арил, який визначають як феніл або нафтил, і гетероарил, який визначають як 5- або 6-членне кільце, заміщене одним або двома гетероатомами, вибраними з О, S, N, і (С-і-Сб)-алкіл, (С2-Сє)-алкеніл, (С2-Сб)-алкшіл, арил або гетероарил може бути незаміщений або заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з Вг, СІ, F, І, (С-і-Сб)-алкілу, (Сг-Сє)алкенілу, (С2-Сб)-алкшілу, (Сі-Сб)-алкокси, ціано, нітро, гідрокси, СНО, СО2Н, SO3H, СО-С Г С 6 алкілу, СО2-Сі-С6-алкілу, CONR1R2, NR1R2, NR1CO-Ci-C6-anKiny, де R і R2, незалежно, визна О 00 ю (О ю чають як галоген (СІ, Вг, F, I), CF3, CN, NO2, NH2, І\ІН(Сі-С6-алкіл), N(Ci-C6-anKin)2, CONH2, CONH(d-C6-anKin), CON(Ci-C6-anKin)2, NHCONH2, NHCONH(d-C6-anKin), NHCON(Ci-C6-anKin)2, CO2Сі-Сб-алкіл, (Сі-Сє)-алкіл, (С2-Сє)-алкеніл, (С2-Сє)алкініл, Сз-Суциклоалкіл або (Сі-Сб)-алкокси, так що Сі-Сб-алкіл незаміщений або заміщений арилом, арил визначають як феніл або нафтил, незаміщений або заміщений Сі-Сє-алкілом, С-і-Сєалкокси, NO2 або галогеном (СІ, Br, F, І) 7 Спосіб за п 6, де органічний розчинник вибирають з групи, що складається з ізопропілацетату, етилацетату, толуолу, метил-трет-бутилового про 56258 стого ефіру, ацетонітрилу, тетрапдрофурану, метанолу, етанолу, ізопропанолу і вуглеводневих розчинників і їх сумішей 8 Спосіб за п 7, де розчин кислоти або газоподібну кислоту вибирають з групи, що складається з 1,5-нафталшдисульфоновоі кислоти, ртолуолсульфонової кислоти, CH3SO3H, трифторметансульфонової кислоти і камфорасульфонової кислоти, НС1, НВг і H2SO4 9 Спосіб за п 8, де розчин кислоти або газоподібна кислота і органічний розчинник являють собою НСІ і ізопропі л ацетат, НВг і ізопропілацетат або НВг і суміш толуол-тетрапдрофуран Ключовою стадією в синтезі шпбітора зворотної транскриптази (-)-6-хлор-4-циклопропілетиніл4-тр и фтор метил 1,4-дипдро-2Н-3,1 -бензоксазин2-она, відомого також як DMP-266, є хіральне приєднання 2-трифторметилкарбоніл-4-хлораніліна для отримання цільового етантюмера аміноспирту в оптично чистій формі Синтез DMP-266 і структурно подібних інгібіторів зворотної транскриптази описується в патенті США 5519021 і ВІДПОВІДНІЙ заявці на Міжнародний патент РСТ WO 95/20389, яка опублікована 3 серпня 1995 Крім того, асиметричний синтез енантюмерного бензоксазинону шляхом приєднання ацетил іду з високою енантюселективністю і подальшою циклізацією був описаний Thompson, et al Tetrahedron Letters 1995, 36, 8937-8940, а також в публікації РСТ WO 96/37457, яка опублікована 28 листопада 1996 Крім того, були зареєстровані декілька заявок, в яких описуються різні аспекти синтезу (-)-б-хлор4-циклопропілетиніл-4-трифторметил-1,4-дипдро2Н-3, 1-бензоксазин-2-ону, що включають 1) спосіб отримання хірального спирту, заявка на патент США, per № 60/035462, зареєстрована 14 січня 1997, 2) хіральну добавку, заявка на патент США, per № 60/034926, зареєстрована 10 січня 1997, заявка на патент США, per № 60/042021, зареєстрована 17 квітня 1997, заявка на патент США, per № 60/045167, зареєстрована ЗО квітня 1997, 3) реакцію циклізації, заявка на патент США, per № 60/037059, зареєстрована 12 лютого 1997, 4) методику кристалізації із застосуванням антирозчинника, заявка на патент США, per № 60/037385, зареєстрована 5 лютого 1997 і заявка на патент США, per № 60/042807, зареєстрована 8 квітня 1997, 5) енантюселективне приєднання, що каталізується цинком, заявка на патент США, per № 60/046713, зареєстрована 16 травня 1997, і 6) спосіб отримання циклопропілацетилену, заявка на патент США, per № 60/047692, зареєстрована 23 травня 1997 У даному винаході описується ефективний спосіб підвищення оптичної чистоти аміноспирту Даний спосіб дозволяє підвищити оптичну чистоту, незалежно від синтетичного шляху, використаного для отримання цього аміноспирту У попередніх способах захист аміногрупи використовували як засіб для підвищення енантіомерного надлишку цільового R-амшоспирту, У самої останній розробці способу була виключена ПОСЛІДОВНІСТЬ захист-зняття захисту, що робило необхідним застосування засобу, за допомогою якого можна було підвищити енантюмерний надлишок аміноспирту Даний винахід відноситься до способу підвищення енантюмерного надлишку R-амшоспирту, що включає утворення кислотно-адитивної солі з кислотою, що має рКа нижче, ніж 3, або рівне 3, і селективну кристалізацію кислотно-адитивної солі R-амшокислоти з рацемічної суміші з використанням ВІДПОВІДНОГО органічного розчинника, щоб підвищити оптичну чистоту Даний винахід відноситься до способу підвищення оптичної чистоти R-амшоспирту формули що включає стадії (a) повільного додання розчину кислоти або газоподібної кислоти до розчину аміноспирту в органічному розчиннику з утворенням суспензії кислотно-адитивної солі аміноспирту (b) концентрування суспензії кислотноадитивної солі аміноспирту, (c) промивання концентрованої суспензії кислотно-адитивної солі аміноспирту органічним розчинником для регулювання складу розчинника, 56258 (d) витримування суспензії кислотно-адитивної солі аміноспирту при температурі навколишнього середовища протягом приблизно від 2 годин до 24 годин, (є) фільтрування витриманої суспензії кислотно-адитивної солі аміноспирту для виділення вологого осаду кислотно-адитивної солі аміноспирту, (І) промивання вологого осаду кислотноадитивної солі аміноспирту холодним органічним розчинником і (д) сушки вологого осаду кислотно-адитивної солі аміноспирту для виділення кислотноадитивної солі аміноспирту у вигляді твердого продукту з підвищеною оптичною чистотою Розчин кислоти або газоподібну кислоту визначають як кислоту, що має рКа менше, ніж З, або рівний 3, переважно, рКа менше, ніж 1, або рівний 1 Прикладами кислот, які можна використати в даному способі, є НХ, де X представляє галогенід (СІ, Вг, І або F), H2SO4, трифтороцтова кислота (ТФК), трихлороцтова кислота, RSO3H, де R представляє (Сі-Сє)- алкіл, (С2-Сє)-алкеніл, (СгСб)-алкшіл, арил, який визначають як феніл або нафтил, і гетероарил, який визначають як 5- або 6членное кільце, заміщене одним або двома гетероатомами, вибраними з О, S, N і (Сі-Сє)-алкіл, (С2-Сб)-алкеніл, (С2-Сб)-алкшіл, арил або гетероарил може бути незаміщений або заміщений одним, двома або трьома замісниками, вибраними з групи, що складається з Вг, СІ, F, І, (Сі-Сє)-алкілу, (С2-Сб)-алкенілу, (С2-Сб)-алкшілу, (Сі-Сб)-алкокси, ціано, нітро, гідрокси, СНО, СО2Н, SO3H, СО-С1Сє-алкіл, СО2-С,-С6-алкіл, CONR1R2, NR1R2, NR СО-Сі-Сб-алкіл, де R1 і R2, незалежно, визначають як галоген (Сі, ВГ, F, I), CF3, CN, NO2, NH2, NH ( C r Сє-алкіл), N (Сі-С6-алкіл)2, CONH2, CONH (С Г С 6 алкіл), CON (Сі-С6-алкіл)2, NHCONH2, NHCONH (d-Сб-алкіл), NHCON (Сі-С6-алкіл)2, СО2-Сі-С6алкіл, (Сі-Сє)-алкіл, (С2-Сє)-алкеніл, (С2-Сб)-алкшіл, Сз-Суциклоалкіл або (Сі-Сб)-алкокси, так що С г Сє-алкіл незаміщений або заміщений арилом, арил визначають як феніл або нафтил, незаміщений або заміщений Сі-Сє-алкілом, Сі-Сє-алкокси, NO2 або галогеном (СІ, Вг, F, І) Приклади RSO3H включають, але не обмежуються ними, 1,5нафталіндисульфонову кислоту, ртолуолсульфонову кислоту (p-TsOH), CH3SO3H, трифторметансульфонову кислоту (CF3SO3H) і камфорасульфонову кислоту Розчин органічної кислоти найчастіше може бути доданий до розчину аміноспирту, проте, газоподібна кислота може бути барбутована в реакційну суміш Розчинником, що використовується для розчинення кислоти, може бути вода або алканол, такий як метанол, етанол, ізопропанол Переважними кислотами є НСІ, HBr, H2SO4, 1,5-нафталшдисульфонова кислота і р-толуолсульфонова кислота Найбільш переважними кислотами є НСІ і НВг Прикладами органічних розчинників є ізопропіл-ацетат (ІРАс), етилацетат (EtOAc), толуол, метил-третбутиловий простий ефір (МТВЕ), ацетонітрил (ACN), тетрапдрофуран ЛТФ), ізопропанол (ІРА) і вуглеводневі розчинники, такі як гексани, пентани, гептани і т д В визначення органічного розчинника включається також суміш згаданих розчинників Варіант способу підвищення оптичної чистоти R-амшоспирту де розчин кислоти або газоподібна кислота і органічний розчинник являють собою НСІ і ізопропілацетат, НВг і ізопропілацетат або НВг і суміш толуол-тетрапдрофуран Суспензію концентрують і промивають додатковим органічним розчинником для регулювання складу розчинника, щоб знизити концентрацію аміноспирту від приблизно 10% до приблизно 2% R-амшоспирту в розчиннику Суспензію витримують приблизно протягом від 2 годин до 36 годин Вологий осад кислотноадитивної солі аміноспирту промивають об'ємом органічного розчинника, що складає менше, ніж 20% первинного об'єму розчинника, або рівним йому Зрозуміло, що термін інертна атмосфера означає атмосферу аргону або азоту, переважно, азоту Зрозуміло, що температура навколишнього середовища представляє температурний інтервал від 20°С до приблизно 35°С R-Амшоспирт (2R-[1 -гідрокси1трифторметил-3-циклопропілпропш-2-іл]-4хлоранілін) можна отримати по методиках, описаних тут, а також з використанням будь-яких Інших відомих способів для його отримання Даний винахід являє собою спосіб підвищення оптичної чистоти цього ключового проміжного продукту в синтезі (-)-6-хлор-4-циклопропілєтиніл-4трифторметил- 1,4-дипдро-2Н-3,1 -бензоксазин-2ону Попередні способи отримання цього ключового проміжного продукту включали захист аміну амінозахисною групою, такою як р-нітробензильна, р-метоксибензильна і тритільна група, і підвищення оптичної чистоти цього захищеного проміжного продукту Див схему 1 Методика поєднання з цинком, використана для отримання аміноспирту, виключала ПОСЛІДОВНІСТЬ стадій захист-зняття захисту і вимагала розробки способу підвищення оптичної чистоти R-амшоспирту Однак, цю методику, як вказано раніше, можна використовувати для підвищення оптичної чистоти цієї сполуки, незалежно від того, як вона була отримана Сполуки даного винаходу мають асиметричні центри, і цей винахід включає всі оптичні ізомери і їх суміші Термін "алкіл", що використовується тут, включає алкільні групи з вказаним числом атомів вуглецю і або з нерозгалуженою, розгалуженою, або з циклічною конфігурацією Приклади «алкілу» включає метил, етил, пропіл, ізопропіл, бутил, втор- і третбутил, пентил, гексил, гептил, циклопропіл, циклобутан, циклопентил, циклогексил, циклогептил, норборніл і тому подібне «Алкоікси» представляє алкільну групу з вказаним числом атомів вуглецю, приєднану через кисневий місток, таку як метокси, етокси, пропокси, бутокси і пенто 56258 КС И «Алкеніл і алкініл» призначаються для включення вуглеводневих ланцюгів з певним числом атомів вуглецю і або нерозгалуженою, або розгалуженою конфігурацією і щонайменше з одним подвійним або потрійним зв'язком, який може мати місце в будь-якій точці ланцюга Приклади «алкенілу» включають етеніл, пропеніл, бутеніл, пентеніл, діметилпентеніл і тому подібне і включають Еі Z-форми, де придатне Приклади «алкінілу» включають етиніл, пропініл, бутиніл, пентініл і диметилпентініл Термін «галоген», що використовується тут, означає фтор, хлор, бром і йод Термін «арил» визначають як кільце фенілу або нафтилу, яке, необов'язково, заміщено замісниками, перерахованими вище, у будь-яких доступних атомів вуглецю, Арил може бути заміщений також конденсованим 5-, 6- або 7-чденним кільцем, що містить один або два атоми кисню, причому ІНШІ атоми кільця є атомами вуглецю, конденсоване 5-, 6- або 7-членне кільце вибирають з групи, що складається з дюксоланілу, дипдрофуранілу, дипдропіранілу і дюксанілу Термін «гетероарил», що використовується тут, призначається для включення наступного 5або 6-члеиного кільця, заміщеного одним або двома гетероатомами, вибраними з О, S, N, і иезаміщеного або заміщеного одним, двома або трьома заступниками, вибраними з групи, що складається з Вг, СІ, F, І, (Сі-Сб)-алкокси, ціано, нітро, гідрокси, СНО, СОгН, СО-Сі-Сб-алкіл, СО2С,-С6-алкіл, CONR1R2, NR1R2, NR1CO-Ci-C6-anKin, будь-які два сусідніх замісники можуть бути сполучені з утворенням 5-, 6- або 7-членного конденсованого кільця, причому згадане кільце містить 1 або 2 атоми кисню і ІНШІ атоми є атомами вуглецю, або будь-які два сусідніх замісники можуть бути сполучені разом з утворенням бензоконденсованого кільця, Гетероарильні групи в обсязі цього винаходу включають, але не обмежуються ними акридиніл, карбазоліл, ЦИНОЛІНІЛ, хіноксалініл, піразол іл, ІНДОЛІЛ, бензотріазоліл, фураніл, ТІЄНІЛ, СХЕМА! стадія хірального приєднання NHPM8 стадія зняття захисту V Огі NHPMB стадія цикдшші 4 (DMP 266) Схема 2 зображає отримання DMP-266 з використанням способу даного винаходу, який являє собою реакцію хірального приєднання Нова реакція хірального приєднання дозволяє виключити ПОСЛІДОВНІСТЬ захист-зняття захисту, як показано на схемі 1 СХЕМА 2 бензотієніл, бензофураніл, ХІНОЛІНІЛ, ІЗОХІНОЛІНІЛ, піразиніл, піридазиніл, піридиніл, піримідиніл і піроліл, які не заміщені або заміщені, як визначено вище Схема 1 зображає ключові стадії в синтезі (-)6-хлор-4-циклопропілетиніл-4-трифторметил-1,4дипдро-2Н-3,1-бензоксазин-2-ону (DMP-266) Стадія хірального приєднання дозволяє здійснити енантюселективне приєднання циклопропілацетиліду до трифторметилкетону 1, У отриманого рметоксибензилу (РМВ ) захищеного аміноспирту 2, потім знімають захист, отримуючи аміноспирт З Цей аміноспирт потім циклізують з використанням хлорформіату і основи, отримуючи DMP-266 CFa стадія хіраяьного приєднання NH, 1а "ейF3C. i/вдш іщклізаші 4 (DMP 266) Схема 3 описує спосіб даного винаходу, коли він відноситься до синтезу хіральної проміжної сполуки, використаної при отриманні DMP-266 Було показано, що ця реакція протікає з використанням приблизно 1,2 еквівалента цикло 56258 10 пропілацетилену і хіральної добавки, значно в мети одностадійним способом або, альтернативно, ншій КІЛЬКОСТІ, ніж в попередніх способах У реакції двостадійним способом з можливим, в залежності застосовували різні хіральні добавки і отримували від використаного хлорформіату, виділенням провисокі виходи з комерційне доступним хіральним міжного карбам ату 5 Було показано, що арилхлолігандом, таким як N-пиролідинілнорефедрин і Nрформіати утворюють менш стабільні карбамати, метилефедрин Цей процес забезпечує ефективтак що, коли їх обробляють водною основою, вони ний спосіб введення хірального спирту бажаної циклізуються в цей продукт при одностадійі-юму конфігурації, коли утвориться ВІДПОВІДНИЙ хіральспособі Алкілхлорформіат, альтернативно, дає ний цинкоорганічний комплекс алкілкарбамат, ключовий проміжний продукт, який можна виділити і очистити до проведення стадії Даний винахід описує спосіб утворення хірациклізації На основі стабільності алкілкарбаматів льного цинкоорганічного комплексу, який містить 6 був розроблений придатний двостадійний спосіб вибраний нуклеофіл, R M Цей реагент, який генеотримання DMP-266, який включає утворення алрується in situ, потім піддають взаємодії з прохіракілкарбаматного проміжного продукту 5, подальшу льним кетоном з утворенням хірального спирту циклізацію карбамату для отримання цільового Отримання спирту 3 вимагало використання продукту 4 Кроме того, було показано, що можна приблизно від 1,0 до 1,5 еквівалента хіральної також використати фосген добавки і нуклеофіла або, переважно, біля 1,2 еквівалента хіральной добавки і біля 1,0 еквівалеПотрібно зазначити, що використання матерінта нуклеофіла алу, отриманого способом даного винаходу, буде вимагати додатковий еквівалент основи АміноРеакцію можна провести при температурі приспирт з підвищеною оптичною чистотою виділяють близно від -78°С до 70°С і, переважно, при темпеу вигляді кислотно-адитивної солі, до проведення ратурі приблизно від -20°С до 60°С, в протилежстадії циклізації буде необхідне руйнування солі ність низькотемпературним умовам (-65°С), аміну Це було виконане простим використанням необхідним при попередньому способі Діалкілдодаткового еквівалента основи в стадії циклізації цинк типово додають при температурі приблизно від -20°С до 0°С Другу добавку типово додають СХЕМА 4 приблизно при температурі навколишнього середовища, потім суміш нагрівають до приблизно 60°С для здійснення утворення хірального цинкоорганічного комплексу До хірального цинкоорганічного комплексу при приблизно кімнатній температурі додають металоорганічний реагент (R6M) До цього хірального нуклеофіл цинкоорганічного комплексу при кімнатній температурі додають прохіральний кетон Переважна процедура включає повільне додання розчину діалкілцинку до розчину розчиненої хіральної добавки і другої добавки так, щоб підтримувати температуру реакції між 0°С і 30°С Приблизно через одну годину отримують металоорганічний реагент, такий як хлормагнійциклопропілацетилід, і додають до хірального цинкоорганічногокомплексу Потім, ДО ЦЬОГО розчину хірального нуклеофілциикоорганічного комплексу приблизно при -10°С додають кетоанілін Реакційну суміш перемішують протягом приблизно 35 годин при температурі приблизно від 0°С до -10°С, нагрівають до кімнатної температури, перемішують протягом біля 3 годин і потім гасять основою Крім того, було показано, що цей спосіб забезпечує каталітичний спосіб отримання цільового хірального спирту, де використовують каталітичну КІЛЬКІСТЬ хіральної добавки CXFMA З 1 а перша кіралі ііа добавка, лр>га добавка, Циклізація аміноспирту 3, для отримання 1,4дипдро-2Н-3,1-бензоксазин-2-ону, 4, описується в приведеній нижче схемі 4 Реакцію можна провес Y представляє OR або Сі і R предсіаЕмиє АІШЯ або арил і можна виділити, коли R представляє аякп 4 (ОМР-266) Мається на увазі, що наступні приклади є пояснювальними для даного винаходу Ці приклади надані для ілюстрації винаходу в прикладах і не повинні тлумачитися як обмеження обсягу винахоДУ Приклад 1 11 Кетон 1а (1R,2S)-N- піролідшілнорефедрин Циклоп ропілацетилен n-BuLi (2,5M в гексані) МеОН (4.94М в толуолі) ZnMe2 (2,ОМ в толуолі) Толуол 1М лимонна кислота 56258 FW 323,58 205,30 66,10 64,06 12 г 4,48 9,85 2,64 мл 16 9,72 24 80 45 32,01 У сухий толуол (40мл) завантажують (1R, 2S)N-піролідинілнорефедрин (9,85г, 48ммоль) і диметилцинк (2,ОМ в толуолі) в атмосфері азоту Суміш перемішують протягом 1 год Додають метанол (9,72мл, 48ммоль) Через 0,5 год суміш переносять в заздалегідь отриману суспензію пбутиллітію (2,5М, 16мл) і циклопропілацетилену (2,64г, 40ммоль) в толуолі (40мл) через канюлю Через 0,5 год додають розчин кетон 1а (4,48г, 20ммоль) Суміш перемішують протягом 7 год Водна обробка і кристалізація дає 4,8г білого твердого продукту (вихід виділеного продукту 83% і енантюмерний надлишок 83%) Приклад 2 CFNH, По методиці, описаній в приведеному вище прикладі 1, з використанням першої хіральної добавки, вказаної нижче, замість (1R, 2S)-Nпіролідинілнорефедрину були отримані наступні виходи і знантюмерні надлишки зразків Перша хіральна добав- Вихід Енантюмерний ка зразка надлишок N-метилефедрин 90 83 Ефедрин 94 28,2 N.N95 10,4 дибензилнорефедрин Норефедрин 25,5 41,6 Діетилтартрат 26,2 -4 Піролідинметанол ЗО 16,8 (1R, 2R)- псевдоефед63,3 29,8 рин Цинхонін 90 -11,2 (1S,2S)-N28,6 -43 метил псевдоефед рин Приклад З надлишки Друга добавка ЕЮН і-РЮН CF3CO2H мМоль 20 48 40 40 48 48 Еквів 1 2,4 2 2 2,4 2,4 Енантюмерний надлишок 55 69 76,2 Приклад 4 с ХхN, H 1а a он 3 По методиці, описаній в приведеному вище прикладі 1, з використанням першої хіральної добавки, (1R, 2S)-1 N-піролідинілнорефедрину, пбутилмагнійхлориду замість п-бутиллітію і другої добавки, вказаної нижче, з проведенням реакції при кімнатній температурі був отриманий хіральний аміноспирт з наступним % енантюмерним надлишком Енанті омерний надлишок МеОН 87 t-BuOH 89,8 (СН3)зССН2ОН 95,6 (СН3)зССН2ОН 94* (СНз)зССН(СН3)ОН 89 РпзСОН 74,4 СІзССНзОН 96 F3CCH2OH 95,7 СН2=СНСН2ОН 90 РпСНзОН 89 (CH3)2NCH2CH2OH 78,2 4- г\ІО2-фенол 89 СН3СО2Н 82 CF3CO2H 89,4 (СН3)ССО2Н 71,6 * Температура реакції 40°С Друга добавка Приклад 5 По методиці, описаній в приведеному вище прикладі 1, з використанням в якості першої хіральної добавки (1R, 23)-І\І-піролідинілнорефедрииу з іншими добавками, вказаними нижче, замість метанолу, були отримані наступні % енантюмерні 1а З По методиці, описаній в приведеному вище прикладі 4, з використанням (1S,2S)-Nметилефедрину в якості першої хіральної добавки 56258 14 13 замість (1R, 23)-І\І-піролідиніл норефедрину і льтруванням і промивають гептаном (ЗОмл), отри(СНзЬССЬЬОН в якості другої добавки був отримуючи 22,62г (вихід 94%, 96% и (енантюмерний маний хіральний аміноспирт з енантюмерним наднадлишок) сполуки 3 у вигляді білого твердого лишком 65,8% продукту Приклад 6 Приклад 8 По методиці, описаній в приведеному вище прикладі 4, з використанням металу, вказаного нижче, замість ЛІТІЮ, були отримані наступні виходи і енантюмерні надлишки зразків м ВИХІД зразка МдСІ МдВг МдІ 96 95 76 6 Енантюмерний надлишок 87 53 6 50 6 Приклад 7 1а Матеріали КІЛЬКІСТЬ мМоль Кетон 1а (1R, 2S)Nпіролідинілнорефедрин Циклопропілацетилен 2 n-BuMgCI (2,0М в ТГФ) Неопентиловий спирт (99%) ZnMe2 (2,ОМ в толуолі) ТГФ 1М лимонна кислота 18,63г 83 Мол вага 323,58 24,64г 120 205,30 6,70г 50мл 100 100 66,10 7,12г 80 88,15 50мл ЮОмл 200мл 100 У висушену в сушильній шафі колбу завантажують висушений ситами ТГФ (ЮОмл) і (1R, 2S)-Nпіролідинілнорефедрин (24,64г, 120ммоль) в атмосфері азоту Суміш охолоджують до -20°С і досить повільно для підтримки температури нижче 0°С додають діметилцинк (2,ОМ в толуолі, 50мл, ЮОммоль) Потім через ЗОхв при кімнатній температурі додають неопентиловий спирт (7,12г, 80ммоль) Суміш нагрівають при 60°С протягом 1 год і охолоджують до кімнатної температури У ІНШІЙ сухій колбі розчин хлормагнійциклопропілацетиліду отримують реакцією циклопропілацетилену (6,70г, ЮОммоль) і п-бутилмагнійхлориду (2,ОМ в ТГФ, 50мл, ЮОммоль) Розчин потім переносять до цинкового реагенту через канюлю Через 20хв додають кетоанілін 1а (18,63г, 8,33ммоль) Через 7 год реакційну суміш розбавляють гексаном (ЮОмл) і гасять 1 п-лимонною кислотою (200мл) Два шари розділяють Водний шар зберігають для виділення норефедрину Органічний шар концентрують до ~ 50мл і додають толуол (ЮОмл) Розчин знов концентрують до ~ 50мл для видалення всього ТГФ Повільно додають гептан (80мл) Твердий продукт збирають фі 1а Матеріали 3 Мол КІЛЬКІСТЬ мМоль вага 9 32г 41 7 323,58 Кетон 1а (1R, 2S)N12 32г піролідинілнорефедрин Циклопропілацетилен 2 3 31г n-BuMgCI (2,0М в ТГФ) 25мл Неопентиловий спирт 3 56г (99%) ZnMe2 (2,ОМ в толуолі) 25мл ТГФ 50мл 1М лимонна кислота ЮОмл 60 205,30 50 50 66,10 40 88,15 50 У висушену в сушильній шафі колбу завантажують висушений ситами ТГФ (50мл) і (1R, 2S) -Nпіролідинілнорефедрин (12,32г, бОммоль) в атмосфері азоту Суміш охолоджують до -20°С і досить повільно для підтримки температури нижче за 0°С додають диметилцинк (2,ОМ в толуолі, 25мл, 50ммоль) Потім через ЗОхв при температурі навколишнього середовища додають неопентиловий спирт (3,56г, 40ммоль) Суміш нагрівають при 60°С протягом 1 год і охолоджують до кімнатної температури У ІНШІЙ сухій колбі розчин хлормагнійциклопропілацетиліду отримують реакцією циклопропілацетилену (3,31 г, 50ммоль) і пбутилмагнійхлориду (2,ОМ в ТГФ, 25мл, 50ммоль) Розчин потім переносять до цинкового реагенту через канюлю Через 20хв розчин охолоджують до 0°С і додають кетоанілін 1а (9,32г, 41,7ммоль) Реакційну суміш розбавляють гексаном (50мл) і гасять 1 N лимонною кислотою (ЮОмл) через 48 год Два шари розділяють Водний шар зберігають для виділення норефедрину Органічний шар концентрують до ~ 25мл і додають толуол (50мл) Розчин знов концентрують до ~ 25мл для видалення всього ТГФ Повільно додають гептан (35мл) Твердий продукт збирають фільтруванням і промивають гептаном (Юмл), отримуючи 11,3г (вихід 94%, >99% її) сполуки 3 у вигляді білого твердого продукту 1 НЯМР(СВСІ3, 300МГц) 57,52 (1Н), 7,12 (1Н), 6,61 (1Н), 4,70 (1Н), 4,39 (2 Н), 1,39 (1 Н) і 0,85 (4 Н), 13С ЯМР (CDCI3, 75,5МГц) 5 143,21, 130,44, 130,04, 123,94, 123,93 (к), 121,11, 120,81, 93,51, 74,80 (к), 70,58, 88,59 і -0,85 Приклад 9 Q pi / NH, 15 56258 Матеріали КІЛЬКІСТЬ Кетон 1а (1R, 2S)Nпіролідинілнорефедрин Циклоп ропілацетилен n-BuMgCI (2,0М в ТГФ) Трифторетанол (99%) ZnEt2 (0.892M в гексані) ТГФ 30% К2СО3 30% лимонна кислота Толуол (для кристалізації, 2мл/г 4) Гептан (для кристалізації, 4мл/г 4) 1,00кг Мол мМоль Вага 4,47 223,58 1,35 кг 6,58 205,30 361,9г 2,68л 429,5г 6,02л 9,36л 550мл 2,0л 5,47 5,37 4,29 5,37 66,10 100,04 2,6л 5,2л До розчину трифторетанол у і (1R, 2S)-Nпіролідинілнорефедрину в ТГФ (9л) в атмосфері азоту досить повільно для підтримки температури нижче за 30°С додають розчин діетилцинку в гексані при 0°С Суміш перемішують при кімнатній температурі протягом 0,5 ~ 1 год У ІНШІЙ сухій колбі розчин хлормагнійциклопропілацетиліду отримують таким чином до нерозбавленого циклопропілацетилену при 0°С досить повільно для підтримки внутрішньої температури
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for enhancing the purity of 2r-[1-hydroxy-1-trifluoromethyl-3-сусlорrоруlрrоруn-2-уl]-4-chloroaniline
Назва патенту російськоюСпособ повышения оптической чистоты 2r-[1-гидрокси-1-трифторметил-3-циклопропилпропин-2-ил]- 4-хлоранилина
МПК / Мітки
МПК: C07C 213/00, C07C 215/00
Мітки: чистоти, оптично, підвищення, 2r-[1-гідрокси-1-трифторметил-3-циклопропілпропін-2-іл]-4-хлораніліну, спосіб
Код посилання
<a href="https://ua.patents.su/11-56258-sposib-pidvishhennya-optichno-chistoti-2r-1-gidroksi-1-triftormetil-3-ciklopropilpropin-2-il-4-khloranilinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб підвищення оптичної чистоти 2r-[1-гідрокси-1-трифторметил-3-циклопропілпропін-2-іл]-4-хлораніліну</a>
Попередній патент: Спосіб лікування неадекватної визивної поведінки
Наступний патент: Протез колінного суглоба
Випадковий патент: Спосіб діагностики антифосфоліпідного синдрому












