Ефіри 10(1-гідроксиетил)-11-оксо-азатрицикло [7.2.0.0] ундец-2-єн-2-карбонової кислоти та спосіб їх одержання
Номер патенту: 26567
Опубліковано: 11.10.1999
Автори: УРСІНІ Антонелла, ПЕРБОНІ Альчиде, Россі Тіно, Гавірачі Джованні, Тарція Джорджо
Формула / Реферат
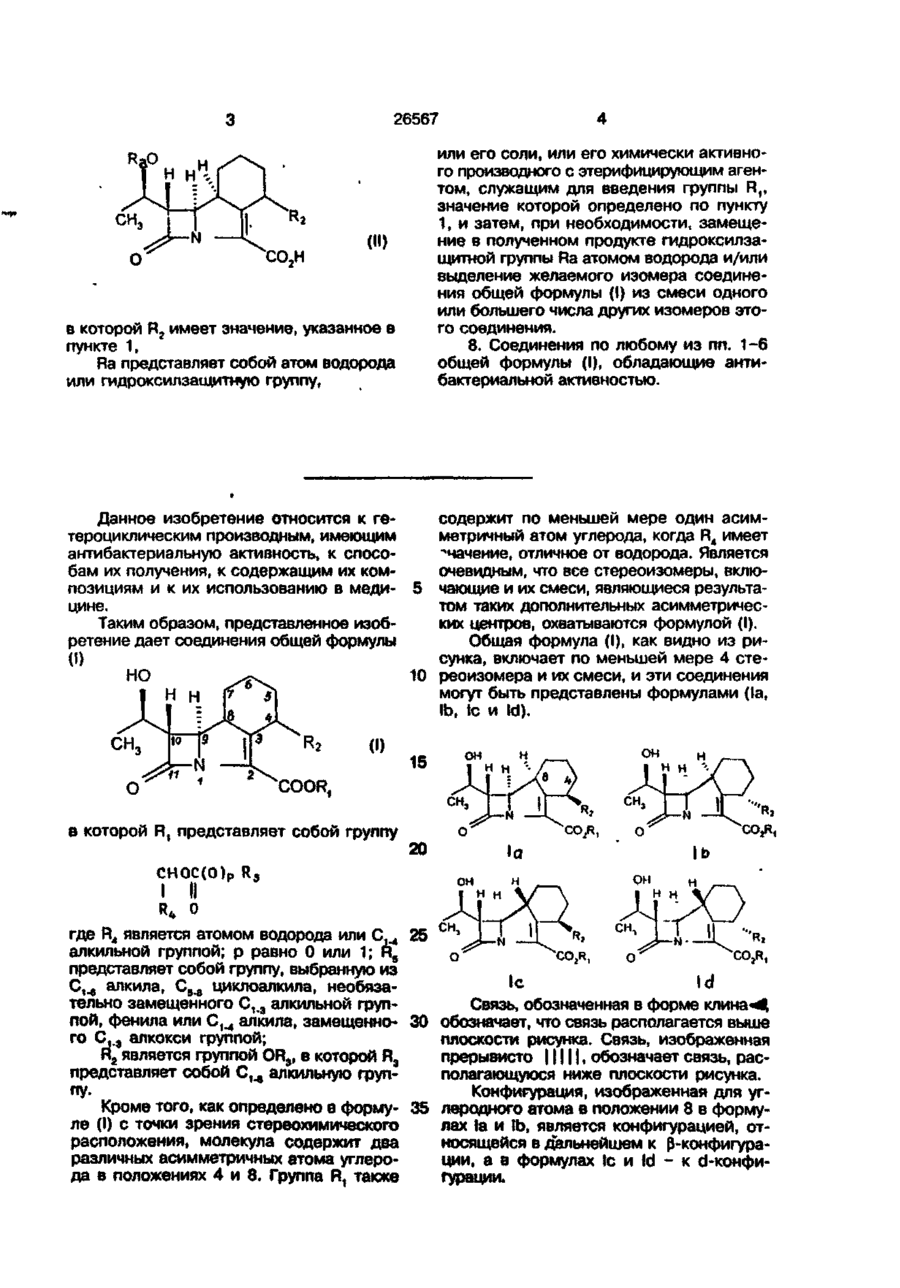
1. Эфиры 10(1-гидроксиэтил)-11-окco-1-азатрицикло[7.2.0.0<3,8>]ундец-2-ен-2-карбоновой кислоты общей формулы (l)
где R1 представляет собой группу
в которой R4 является атомом водорода или C1 - 4 алкильной группой; p = 0 или 1; R5 представляет собой группу, выбранную из C1 - 6 алкила, C5 - 6 циклоалкила, необязательно замещенного C1 - 3 алкильной группой, фенила или C1 - 4 алкила, замещенного C1 - 3 алкоксигруппой;
R2 представляет собой метокси.
2. Соединения по п.1, где R4 представляет собой водород или метильную группу.
3. Соединения по п.1 или 2, где R5 представляет собой метил, этил, изопропил, трет-бутил, 1-метокси-1-метилэтил, фенил, циклогексил или 4-этилциклогексил.
4. Соединения по п.1, где R4 представляет собой атом водорода или метил; R5-группа, выбранная из C1 - 4 алкила, C5 - 6 циклоалкила, необязательно замещенного C1 - 2 алкильной группой, фенила или C1 - 4 алкила, замещенного метоксигруппой.
5. Пивалоилоксиметиловый, 1-пивалоилоксиэтиловый, ацетоксиметиловый, 1-ацетоксиэтиловый, 1-метокси-1-метилэтилкарбонилоксиметиловый, 1-(1-метокси-1-метилэтилкарбонилокси)этиловый, 1-бензоилоксиэтиловый, 1-изопропоксикарбонилоксиэтиловый, циклогексилоксикарбонилоксиметиловый или 1-(4-этилциклогексилоксикарбонилокси)этиловый эфиры (4S,8S,9R,10S,12R)-4-мeтокси-10-(1-гидроксиэтил)-11-оксо-1-азатрицикло[7.2.0.0<3,8>]ундец-2-ен-2-карбоновой кислоты.
6. 1-Циклогексилоксикарбонилоксиэтил (4S,8S,9R,10S,12R)-4-метокси-10-(1-гидроксиэтил)-11-оксо-1-азатрицикло(7.2.0.0<3,8>]ундец-2-ен-2-карбоксилат.
7. Способ получения соединений общей формулы (l), отличающийся тем, что он предусматривает взаимодействие соединения общей формулы (ll)
в которой R2 имеет значение, указанное в пункте 1,
Ra представляет собой атом водорода или гидроксилзащитную группу,
или его соли, или его химически активного производного с этерифицирующим агентом, служащим для введения группы R1, значение которой определено по пункту 1, и затем, при необходимости, замещение в полученном продукте гидроксилзащитной группы Ra атомом водорода и/или выделение желаемого изомера соединения общей формулы (l) из смеси одного или большего числа других изомеров этого соединения.
8. Соединения по любому из пп.1 - 6 общей формулы (l), обладающие антибактериальной активностью.
Текст
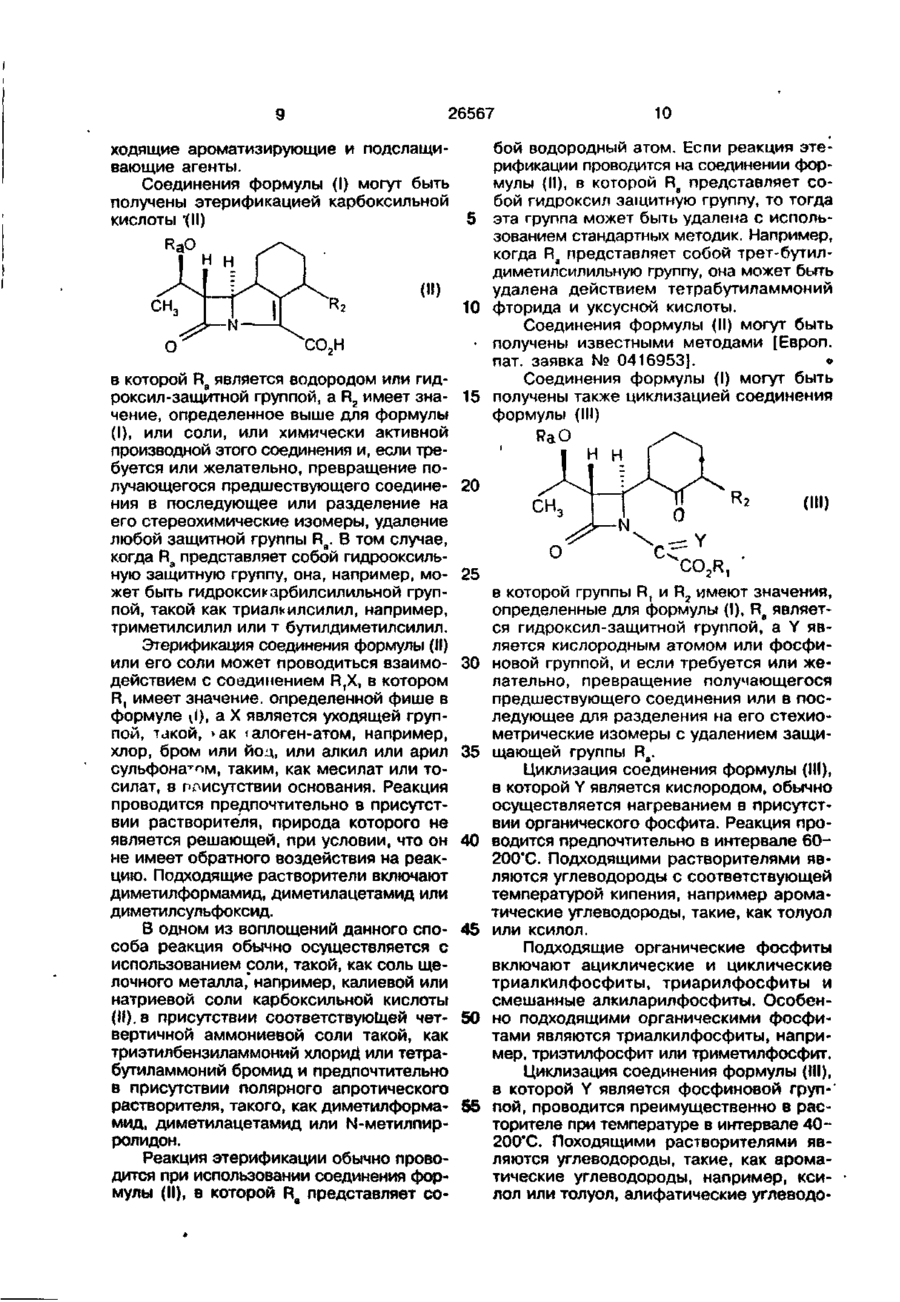
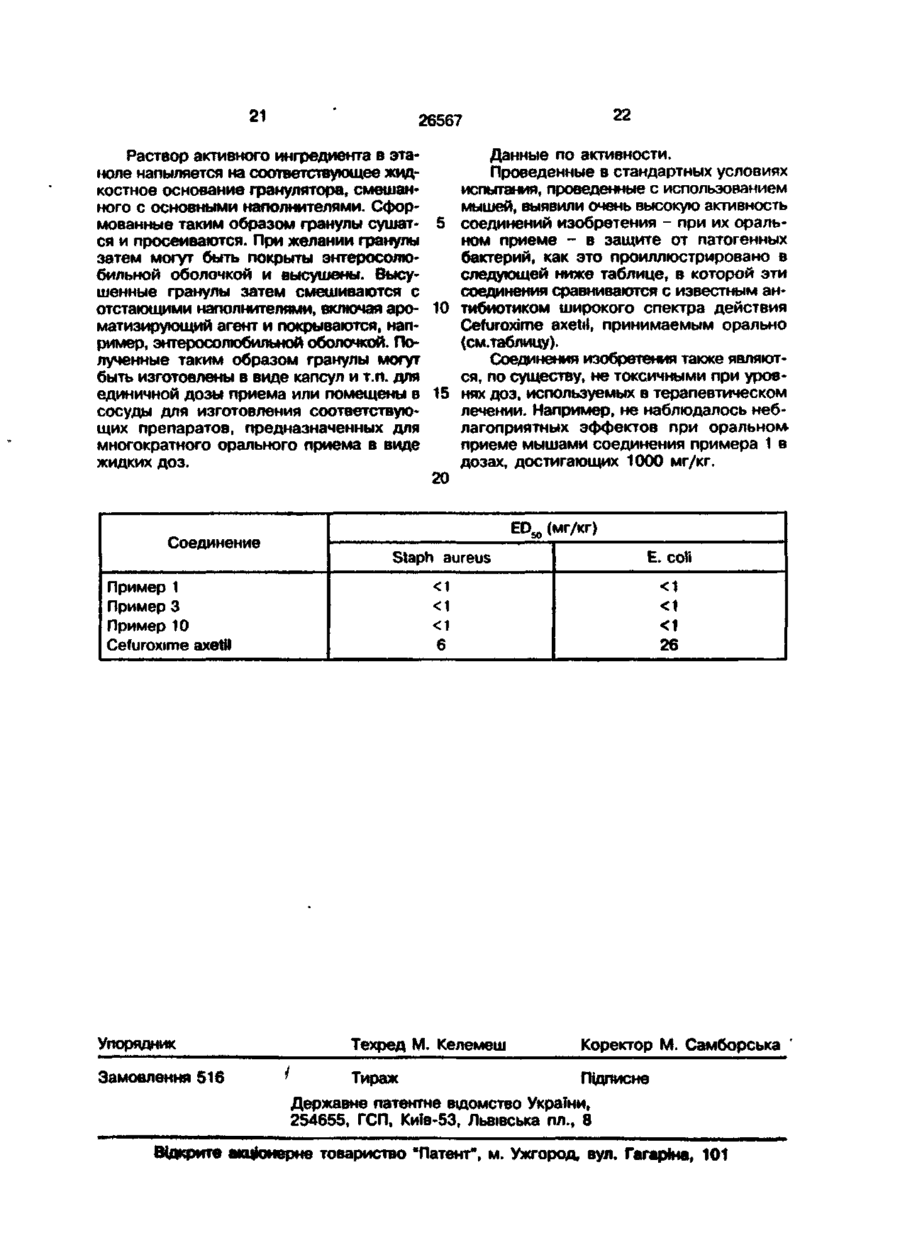
1. Эфиры 10(1-гидроксиэтил)-11-оксо-1 -азатрицикло[7.2.0.0]ундец-2-ен2-карбоновой кислоты общей формулы (I) R: (О где R, представляет собой группу -сн О (О)р О в которой R4 является атомом водорода или С ь 4 алкильной группой; р = 0 или 1; Rs представляет собой группу, выбранную ИЗ С,,в алкила, С5.в циклоалкила, необязательно замещенного C t 3 алкильной груп пой, фенила или С 1 4 алкила, замещенного С,.3 алкоксигруппой; R2 представляет собой метокси. 2. Соединения по п. 1, где R4 представляет собой водород или метильную группу. 3. Соединения по п. 1 или 2, где R5 представляет собой метил, этил, изопропил, трет-бутил, 1-метокси-1-метилэтил, фенил, циклогексил или 4-этилциклогексил. 4. Соединения по п. 1, где R4 представляет собой атом водорода или метил; R5группа, выбранная из С 1 4 алкила, С5.б циклоалкила, необязательно замещенного СУ2 алкильной группой, фенила или С,.4 алкила, замещенного метоксигруппой. 5. Пивалоилоксиметиловый, 1пивалоилоксиэтиловый, ацетоксиметиловый, 1 -ацетоксиэтиловый, 1 -метокси-1 метилэтилкарбонилоксиметиловый, 1 -(1 метокси-1 -метилэтилкарбонилокси)этиловый, 1-бензоилоксиэтиловый, 1-изопропоксикарбонилоксиэтиловый, циклогексилоксикарбонилоксиметиловый или 1-(4этилциклогексилоксикарбонилокси)этиловый эфиры (4S, 8S, 9R, 10S, 12R)-4-Meтокси-10-( 1 -гидроксиэтил)-11 -оксо-1 азатрицикло[7.2.0.0]ундец-2-ен-2карбоновой кислоты. 6. 1 -Циклогексилоксикарбонилоксиэтил (4S, 8S, 9R, 10S, 12R)-4-MeTOKCH-10-(1гидроксиэтил)-11-оксо-1-азатрицикло[7.2.0.0]ундец-2-ен-2-карбоксилат. 7. Способ получения соединений об-, щей формулы (I), о т л и ч а ю щ и й с я тем, что он предусматривает взаимодействие соединения общей формулы (II) с > KJ с* о о 4 26567 или его соли, или его химически активного производного с этерифицирующим агентом, служащим для введения группы R,, значение которой определено по пункту 1, и затем, при необходимости, замещение в полученном продукте гидроксилзащитной группы Ra атомом водорода и/или выделение желаемого изомера соединения общей формулы (I) из смеси одного или большего числа других изомеров этого соединения. 8. Соединения по любому из пп. 1-6 общей формулы (I), обладающие антибактериальной активностью. (II) в которой R2 имеет значение, указанное в пункте 1, Ra представляет собой атом водорода или гидроксилзащитную группу, Данное изобретение относится к гетероциклическим производным, имеющим антибактериальную активность, к способам их получения, к содержащим их композициям и к их использованию в медицине. Таким образом, представленное изобретение дает соединения общей формулы (I) (I) содержит по меньшей мере один асимметричный атом углерода, когда R4 имеет "чачение, отличное от водорода. Является очевидным, что все стереоизомеры, включающие и их смеси, являющиеся результатом таких дополнительных асимметрических центров, охватываются формулой (I). Общая формула (I), как видно из рисунка, включает по меньшей мере 4 сте10 реоизомера и их смеси, и эти соединения могут быть представлены формулами (la, Ib, Ic и Id). 15 OH H COOR, в которой R, представляет собой группу СИОС(0) Р I II 20 R. JTJQ где R4 является атомом водорода или С,^ алкильной группой; р равно 0 или 1; R5 CO R, CO R, о представляет собой группу, выбранную из С 1>в ал кила, С 5 8 циклоалкила, необязательно замещенного С 1 3 алкильной групСвязь, обозначенная в форме клина ^ пой, фенила или С,.4 алкила, замещенно- 30 обозначает, что связь располагается выше го С,., алкокси группой; плоскости рисунка. Связь, изображенная н 2 является группой 0R 3 , в которой R3 прерывисто П Н ) , обозначает связь, распредставляет собой С,., алкильную групполагающуюся ниже плоскости рисунка. пу. Конфигурация, изображенная для угКроме того, как определено в форму- 35 дородного атома в положении 8 в формуле (I) с точки зрения стереохимического лах 1а и Ib, является конфигурацией, отрасположения, молекула содержит два носящейся в дальнейшем к р-конфигураразличных асимметричных атома углероции, а в формулах Ic и Id - к d-конфида в положениях 4 и 8. Группа R, также гурации. 4 2 2 26567 Конфигурация, изображенная для углеродного атома в положении 4 в формулах Ib и Id является конфигурацией, относящейся в дальнейшем к а-конфигурации, а в формулах 1а и ic - к р-конфигурации. Вообще, в индивидуальных соединениях, названных ниже, р-конфигурация в положении 8 соответствует S-изомеру, а р-конфигурация в положении 4 - R-изомеру. а-конфигурация в положении 8 соответствует R-изомеру, а-конфигурация в положении 4 соответствует S-изомеру. Расположение R или S конфигурации в положениях 4 и 8 соответствует правилам Calur Ingddamt Pnleg Expenenta, 1956, 12, 81. Использованный в работе термин алкил относится к алкильной группе с прямой или разветвленной цепью. Когда R4 представляет собой С, 4 алкильную группу, он может быть, например, метилом, этилом, пропилом, изопропилом или бутилом. В том случае, когда R5 является алкильной группой, он обычно представляет собой С 1 4 алкильную группу такую, как метил, этил, изопропил или т-бутил. В том случае, когда R5 является С 1 4 алкильной группой, замещенной С, э алкокси, он может быть, например, метилом, этилом, пропилом или изобутилом, замещенным метоксигруппой. В том случае, когда R5 представляет собой циклоалкил, необязательно замещенный С,_3 алкилом, он может быть, например, циклопентильной, циклогексильной, циклогептильной плі-, циклооктильной группой, замещенной метильной или этильной группой. Предпочтительным классом соединений формулы (I) являются соединения, представляющие собой р-кон фигурацию в положении 8. Внутри этого класса особенно предпочтительными являются соединения, имеющие а-конфигурацию в положении 4. Другим предпочтительным классом соединений формулы (I) являются соединения, в которых R4 является водородом, метилом, пропилом или изопропилом, в •особенности водородом или метилом. Еще одним предпочтительным классом соединений формулы (I) являются такие соединения, в которых R5 представляет собой Схм алкильную группу, такую, как метил, этил, изопропил или т-бутил; С Ь 4 алкильную группу, замещенную метокси, такую, как 1-метокси-1-метилэтил; фенильную; или С 5 ^ циклоалкильную груп 5 10 15 20 25 30 35 40 45 50 55 пу, такую, как циклопентил или циклогексил, необязательно замещенную метильной или этильной группой, например как этил цикл ore кси л. Другим предпочтительным классом соединений, соответствующих изобретению, являются также соединения формулы (І), в которых R2 является этокси или метокси группой. Особенно предпочтительной группой эфиров, соответствующих изобретению, являются такие эфиры, в которых R4 является атомом водорода или метильной груп*» пой, р равно 0 или 1, a R5 представляет собой метильную. этильную, изопролильную, т-бутильную, 1-метокси-1-метилэтильную, фенильную, циклогексильную или 4этилциклогексильную группу. Особенно предпочтительной группой соединений изобретения являются такие, в которых углеродный атом в положении 8 характеризуется р-конфигурацией, а углеродный атом в положении 4-а-конфигурацией; R4 является атомом водорода или метильной группой; R5 представляет собой Сил алкил, С 5 6 циклоалкил, необязательно замещенный С, 2 алкильной группой, фенил или С 1 4 алкил, замещенный метоксилом; р равно 0 или 1, a R2 является метоксилом. Конкретными предпочтительными соединениями являются эфиры (4S, 8S, 9R, 10S, 12R)-4-MeTOKcn-10-( 1 -гидроксиэтил)11 -оксо-1 -азатрицикло{7.2.0.0 3 8 ]ундек-2ен-2 карбоксильной кислоты такие, как пивал оилоксиметиловый, 1 -пивалоилоксиотиловый, ацетоксиметиловый, 1-ацетоксиэтиловый, 1 -метокси-1 -метилэтилкарбонилоксиметиловый, 1 -(1 -метокси-метияэтилкарбонилокси) этиловый , 1бензоилоксиэтиловый-1-изопропоксикарбонилоксиэтиловый, циклогексилоксикарбонилоксиметиловый, 1 -(4-этилциклогексилоксикарбонилокси) этиловый илиболее предпочтительно-1-циклогексилоксикарбонилоксиэтиловый эфир. Соединения, соответствующие изобретению, при оральном приеме выявляют высокий уровень антибактериальной активности по отношению к большому разнообразию патогенных микроорганизмов и обладают очень высокой устойчивостью ко всем р-лактамазам. Соединения изобретения являются также относительно стабильными в отношении почечной дегидропептидазы. Было установлено, что соединения изобретения выявляют значительный уровень активности против штаммов Staphylococcus aureus. Streptococcus 26567 faecalis, Streptococcus pneumonias, Escherichia coli, KlebsieHa pneumoniae, Proteus mirabilis, Citrobacter freundii, Pseudomonas aeruginosa, Clostridiurn perfingens, Bacteriodes fragilis and Morganella morganii. Соединения изобретения, таким образом, могут использоваться для лечения ряда болезней, вызванных патогенными бактериями, существующими у человека и у животных. Следовательно, в соответствии с другим аспектом представленного изобретения, мы представляем соединение формулы (I) для использования в лечении или профилактике общих бактериальных инфекций у человека или животных. В соответствии с другим аспектом изобретения мы предоставляем использование соединения формулы (I) для производства терапевтических агентов с целью лечения общих бактериальных инфекций, существующих у человека и животных. В соответствии с еще одним аспектом изобретения, мы предоставляем метод лечения человека или нечеловекообразных животных, включающих борьбу с бактериальными инфекциями, который состоит в приеме эффективного количества соединения формулы (I). Для специалиста в данной области понятно, что имеющиеся при этом ссылки на воздействие распространяются на профилактику, а также и на лечение установленных инфекций и симптомов. Далее, существенно, что количество соединения изобретения, требуемое для использования его при лечении, будет варьироваться в зависимости от условий воздействия, возраста и условий пациента и, в конечном счете, будет раздельно выбрано соответствующим врачом или ветеринаром. Однако, обычно, применяемые дозы для лечения взрослого человека лежат в интервале 200-2000 мг в день, например, 1000 мг в день. Необходимая доза обычно принимается в виде единичной дозы или в виде раздельных доз, принимаемых через соответствующие интервалы, например в виде двух, трех, четырех или большего числа суб-доз в день. Хотя для использования в терапии возможен прием соединения изобретения в виде непереработанного химического препарата, предпочтительным является прием активного ингредиента в виде фармацевтического состава. Изобретение, таким образом, далее, дает фармацевтическую композицию для 5 10 15 20 25 30 35 40 45 50 55 8 орального приема, включающую соединение формулы (I) вместе с одним или большим числом фармацевтически приемлемых носителей его и, необязательно, другими терапевтическими и/или профелатическими ингредиентами. Носитель(и) должны быть "приемлемы1"' с точки зрения их совместимости с другими ингредиентами композиции и невредными для того, кто их принимает. В соответствии с изобретением, фармацевтические композиции могут, например, быть в виде таблеток или капсул, приготовленных стандартными методами с фармацевтически приемлемыми наполнителями такими, как связующие агенты (например, предварительно желатинированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза), наполнители (например, крахмал, лактоза, микрокристаллическая целлюлоза или фосфат кальция), смазывающие вещества {например, стеарат магния, гидоогенизированное растительное масло, тальк, двуокись кремния, полиэтиленгликоли)> дисинтегранты (например, картофельный крахмал или натриевый крахмальный гликолят) или увлажняющие агенты (например, натрий лаурилсульфат). При необходимости могут использоваться также вещества, помогающие течению, например, двуокись кремния. Таблетки могут приготавливаться с покрытием с использованием для этого хорошо известных в данной области приемов. Жидкие составы для орального приема могут приготавливаться, например, в виде растворов, сиропов или суспензий, или они могут быть приготовлены в виде сухого продукта или для разведения водой или другим подходящим разбавителем перед использованием для приема, или в виде жидкости для непосредственного приема и последующего смывания водой или другой подходящей жидкостью. Такие жидкие составы могут быть изготовлены с использованием стандартных методов с применением приемлемых добавок, таких, как суспензирующие агенты (например, сорбитололовый сироп, метилцеллюлоза или гидрогенизированные пищевые жиры и масла, такие, как касторовое масло), эмульгирующие или загущающие аогенты (например, лецитин, стеарат алюминия или акация), неводных растворителей (например, миндальное масло, кокосовое масло, синтетические сложноэфирные масла или этиловый спирт), консервирующие вещества (например, метил- или бутил-п-гидроксибензоаты или сорбиновая кислота) и под 26567 10 бой водородный атом. Ее пи реакция этерификации проводится на соединении формулы (И), в которой Ra представляет собой гидроксил защитную группу, то тогда 5 эта группа может быть удалена с использованием стандартных методик. Например, FUO когда Ra представляет собой трет-бутилдиметилсилильную группу, она может быть удалена действием тетрабутиламмоний (И) 10 фторида и уксусной кислоты. Соединения формулы (II) могут быть • получены известными методами [Европ. СО2Н пат. заявка № 0416953]. » Соединения формулы (I) могут быть в которой Ra является водородом или гидроксил-защитной группой, a R2 имеет зна- 15 получены также циклизацией соединения чение, определенное выше для формулы формулы (III) (I), или соли, или химически активной RaO производной этого соединения и, если треН Н буется или желательно, превращение получающегося предшествующего соедине- 20 ния в последующее или разделение на (Ш) его стереохимические изомеры, удаление любой защитной группы Ra. В том случае, когда Ra представляет собой гидрооксильную защитную группу, она, например, мо- 25 жет быть гидроксикарбилсилильной групв которой группы R, и R2 имеют значения, пой, такой как триал*илсилил, например, определенные для формулы (I), Ra являеттриметилсилил или т бутилдиметилсилил. ся гидроксил-защитной группой, a Y является кислородным атомом или фосфиЭтерификация соединения формулы (II) или его соли может проводиться взаимо- 30 новой группой, и если требуется или жедействием с соединением RtX, в котором лательно, превращение получающегося R, имеет значение, определенной фише в предшествующего соединения или в посформуле \i), a X является уходящей групледующее для разделения на его стехиопой, такой, *ак талоген-атом, например, метрические изомеры с удалением защихлор, бром или йод, или алкил или арил 35 щающей группы Ra. сульфоналом, таким, как месилат или тоЦиклизация соединения формулы (III), силат, в присутствии основания. Реакция в которой Y является кислородом, обычно проводится предпочтительно в присутстосуществляется нагреванием в присутствии растворителя, природа которого не вии органического фосфита. Реакция проявляется решающей, при условии, что он 40 водится предпочтительно в интервале 6 0 не имеет обратного воздействия на реак200'С. Подходящими растворителями явцию. Подходящие растворители включают ляются углеводороды с соответствующей диметилформамид, диметилацетамид или температурой кипения, например аромадиметилсульфоксид. тические углеводороды, такие, как толуол В одном из воплощений данного спо- 45 или ксилол. соба реакция обычно осуществляется с Подходящие органические фосфиты использованием соли, такой, как соль щевключают ациклические и циклические лочного металла,* например, калиевой или триал килфосфиты, триарилфосфиты и натриевой соли карбоксильной кислоты смешанные алкиларилфосфиты. Особен(II). в присутствии соответствующей чет- 50 но подходящими органическими фосфивертичной аммониевой соли такой, как тами являются триалкилфосфиты, напритриэтилбензиламмоний хлориД или тетрамер, триэтилфосфит или триметилфосфит. бутиламмоний бромид и предпочтительно Циклизация соединения формулы (III), в присутствии полярного апротического в которой Y является фосфиновой груп-' растворителя, такого, как диметилформа- 55 пой, проводится преимущественно в расмид, диметилацетамид или N-метилпирторителе при температуре в интервале 4 0 ролидон. 200*С. Походящими растворителями явРеакция этерификации обычно проволяются углеводороды, такие, как аромадится при использовании соединения фортические углеводороды, например, ксимулы (И), в которой Ra представляет солол или толуол, алифатические углеводоходящие ароматизирующие и подслащивающие агенты. Соединения формулы (I) могут быть получены этерификацией карбоксильной кислоты *(Н) 12 26567 11 і натрием; ксилол был дважды перегнан роды и галогенированные углеводороды, над пятиокисью фосфора и этилацетат такие, как дихлорметан, хлороформ и был высушен над активированными молетрихлорэтан. Примерами подходящих фоскулярными ситами. финовых групп являются триарилфосфиПромежуточное соединение 1. (Винины, например, трифенилфосфин или триал- 5 ловый эфир 2-метокси-2-метил) пропиокил фосфины, например, три-т-бутилфосновой кислоты. фин. К 2-метокси-2-метилпропионовой кисГидроксил защитная группа может лоте (1,5 г) в атмосфере азота добавлябыть удалена хорошо известными стандартными методами, такими, как описан- 10 лись ацетат ртути (II) (0,162 г), ацетат палладия (0,0285 г), гидроокись калия ные в работе [Защитные группы в орга(0,067 г) и винилацетат (1,2 г). Получаюнической химии/Под ред. YIW McOmie (пещийся раствор нагревался в течение 4 ч чатные труды пленума, 1973). С. 46-119}. при 50"С. Затем к реакционной смеси Например, когда Ra является трет-бутилдиметилсилильной группой, она может 15 добавлялся дополнительно винилацетат быть удалена действием тетрабутиламмо(2,4 г) и смесь нагревалась в течение 16 ний фторида и уксусной кислоты. Этот ч при 50'С. процесс обычно проводится в растворитеПосле охлаждения до 20*С добавлялле, таком, как тетрагидрофуран. ся этиловый эфир (15 мл) и смесь фильтАналогично, когда Ra является 20 ровалась через тампон, а затем экстрагировалась диэтиловым эфиром (2 х 70 трихлорэтоксикарбонильной группой, она мл). Органическая фаза промывалась растможет быть удалена цинком и уксусной вором хлористого кальция (150 мл) и выкислотой. сушивалась над безводным сульфатом натСоединения формулы (!!!) могут быть получены с использованием методов, ана- 25 рия с образованием сырого озаглавленного соединения в виде "пылевого" желлогичных описанным в Европ. патент, заявтого масла (0,7 г); ТСХ циклогексан/ ке № 0416953 для получения родственных этилацетат 8:2 Rf = 0,7; ИК (CDCI3) v по строению соединений. (см*1): 1749 (С=О эфир) 1640 (С=С); Для того, чтобы можно было более глубоко понять изобретение, даются сле- 30 'Н-ЯМР (300 МГц; CDCI3) (ppm): 7,30 (м), дующие примеры - только в качестве ил* 4,983 (дд), 3,297 (с), 1,464 (с). люстрации. Промежуточное соединение 3. 1В приготовлениях 1 примерах, если 4 Хлорэтиловый эфир (2-метокси-2-метил) не указано особо: пропионовой кислоты. Точки плавления (т.пл.) определены 35 В раствор промежуточного соединена приборе для определения точки плавния I (2,7 г) в этилацетате (50 мл) в ления Gallenkamp и не корректируются. течение часа при 0"С барботировали безВсе температуры выражаются в *С. водный хлористый водород, затем, в течеИнфракрасные спектры были опредение 10 мин продували азот. Растворитель лены в растворах хлороформа - dl на 40 выпаривали, а остаток очищали перегонприборе ГГ-ІК. Протоновые магнитные рекой (90*С/15 мм Нд) с получением озагзонансные спектры ('Н-ЯМР) записывалавленного соединения в виде бесцветнолись при 300 МГц в виде растворов в го масла (2,t г) ТСХ циклогексан/этилахлороформе-1. Химические смещения выцетат 9:1. Rf-0,9; ражаются в частях на миллион (8) по от- 45 ИК (CDC!3) vmw (см-') : 1755 (С=0 ношению к тетраметилсилану, использоЭфир); ванному в качестве внутреннего стандар'Н-ЯМР (CDCL; 300 МГц) (ч./млн): 6,58 та, и обозначаются в виде синглетов (с), (кв), 3,296 (с), 1,837 (д), 1,442 (с). дублетов (д), двойных дублетов (дд) или Промежуточное соединение 3. (1-Хлормультиплетов (м). 50 2-метил) пропилметил карбонат. Хроматографирование проводилось чеРаствор 1-хлор-2-метилпропил хлоррез силикагель (Merk AG, Дармштадт, Герформиат (1,71 г) в сухом дихлорметане (5 мания). мл) добавлялся по каплям к раствору меРастворы сушились над безводным танола (0,83 мл) в сухом дихлорметане (5 сульфатом натрия* "Бензин" обозначает 55 мл) при 0#С в атмосфере азота, при пепетролейный эфир, т.кил. 40-60'С. ремешивании. Метиленхлорид был дважды перегнан Затем добавлялся раствор пиридина над гидридом кальция; тетрагидрофуран (0,80 мл) в сухом дихлорметане (10 мл) был дважды перегнан над натрием; этии реакционная смесь перемешивалась в ловый эфир был дважды перегнан над течение 18 ч при 20*С. 13 26567 Смесь разбавлялась дихлорметаном (950 мл), промывалась раствором хлористого кальция (3 х 40 мл), сушилась над безводным сульфатом натрия и концентрировалась в токе азота при низкой 5 температуре, образуя сырьевое озаглавленное соединение в виде бесцветного Т масла с количественным выходом. Н-ЯМР (300 МГц, CDCf3) : 6,18 (д), 3,86 (с), 2,282,12 (м), 1,08 (д), 1,06 (д) мил.д. 10 Промежуточное соединение 4. 1Хлорэтил-4-этилциклогексил карбонат. Раствор 1-хлорэтил хлорформиата (5,46 г) в сухом дихлорметане (20 мл) при 0*С в атмосфере азота по каплям добав- 15 лялся к перемешиваемому раствору 4этилциклогексанола (5 г) в сухом дихлорметане (20 мл) в присутствии ЗА молекулярных сит. К реакционной смеси по каплям добавлялся раствор пиридина (3 г) в 20 сухом дихлорметане (20 мл) - в течение 20 мин при 0"С, после чего реакционная смесь нагревалась до 20*С, перемешивалась в течение 20 ч, промывалась раствором хлористого кальция (2 х 50 мл) и 25 сушилась. Растворитель удалялся под вакуумом, а остаток очищался, давая озаглавленное соединение в виде бесцветного масла (7,9 г; т.кип. 130*/мбар; т.с.х. циклогексан/этилацетат 9/1 R, = 0,88; ИК 30 (CDCy, v (см 1 ): 1757 (С=0); 'Н-ЯМР (300 МГц, CDCL): 6,43 (кв), 6,42 (кв), 4,93 (уш.с), 4,59 ( ), 2,00-1,88 (уш.с.), 1,881,78 (м), 1,83 (д), 1,82
ДивитисяДодаткова інформація
Автори англійськоюRossi Tino, Gaviracci Giovanni, Tarcia Giorgio
Автори російськоюРосси Тино, Гавирачи Джованни, Тарция Джорджо
МПК / Мітки
МПК: A61K 31/40, A61P 31/04, C07D 477/00, A61K 31/397, C07D 487/04, A61K 31/407
Мітки: 10(1-гідроксиетил)-11-оксо-азатрицикло, ундец-2-єн-2-карбонової, спосіб, ефіри, 7.2.0.0, кислоти, одержання
Код посилання
<a href="https://ua.patents.su/12-26567-efiri-101-gidroksietil-11-okso-azatriciklo-7200-undec-2-ehn-2-karbonovo-kisloti-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Ефіри 10(1-гідроксиетил)-11-оксо-азатрицикло [7.2.0.0] ундец-2-єн-2-карбонової кислоти та спосіб їх одержання</a>
Попередній патент: Спосіб виконання охолоджувальних порожнин у каталізаторних шарах
Наступний патент: Спосіб отримання 3,4-дигідрокси-5-нітробензальдегіду
Випадковий патент: Спосіб виконання лампектомії з регіонарною лімфатичною дисекцією у хворих на рак молочної залози з локалізацією у верхніх квадрантах