Похідні глюкопіранозилоксибензилбензолу і лікарські композиції, що їх містять
Номер патенту: 73606
Опубліковано: 15.08.2005
Автори: Фудзікура Хідекі, Фусімі Нобухіко, Татані Казуйа, Нісімура Тосіхіро, Ісадзі Масайукі
Формула / Реферат
1. Похідне глюкопіранозилоксибензилбензолу, представлене загальною формулою:
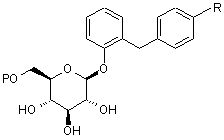 ,
,
де P являє собою групу, утворюючу проліки; і R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою, або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою.
2. Похідне глюкопіранозилоксибензилбензолу за п. 1, представлене загальною формулою:
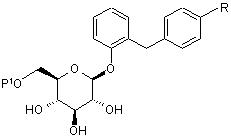 ,
,
де R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою, або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою; і Р1 являє собою нижчу ацильну групу, нижчу ацильну групу, заміщену нижчою алкоксигрупою, нижчу ацильну групу, заміщену нижчою алкоксикарбонільною групою, нижчу алкоксикарбонільну групу або нижчу алкоксикарбонільну групу, заміщену нижчою алкоксигрупою.
3. Похідне глюкопіранозилоксибензилбензолу за п. 2, представлене загальною формулою:
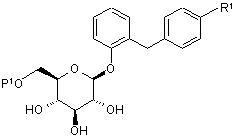 ,
,
де R1 являє собою нижчу алкільну групу або нижчу алкоксигрупу; і Р1 являє собою нижчу ацильну групу, нижчу ацильну групу, заміщену нижчою алкоксигрупою, нижчу ацильну групу, заміщену нижчою алкоксикарбонільною групою, нижчу алкоксикарбонільну групу або нижчу алкоксикарбонільну групу, заміщену нижчою алкоксигрупою.
4. Похідне глюкопіранозилоксибензилбензолу за п. 2, представлене загальною формулою:
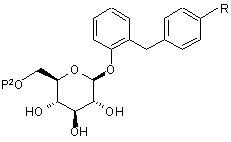 ,
,
де R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою, або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою; і Р2 являє собою нижчу ацильну групу або нижчу алкоксикарбонільну групу.
5. Похідне глюкопіранозилоксибензилбензолу за п. 3 або 4, представлене загальною формулою:
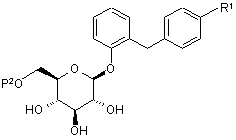 ,
,
де R1 являє собою нижчу алкільну групу або нижчу алкоксигрупу; і Р2 являє собою нижчу ацильну групу або нижчу алкоксикарбонільну групу.
6. Похідне глюкопіранозилоксибензилбензолу за п. 5, представлене загальною формулою:
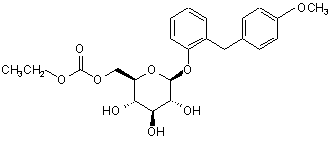 .
.
7. Похідне глюкопіранозилоксибензилбензолу за п. 5, представлене загальною формулою:
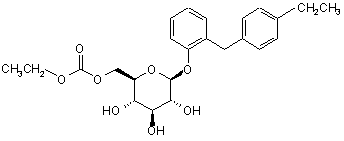 .
.
8. Фармацевтична композиція, що містить як активний інгредієнт похідне глюкопіранозилоксибензилбензолу за пп. 1-7.
9. Фармацевтична композиція за п. 8, де композиція є інгібітором SGLT2 людини.
10. Фармацевтична композиція за п. 9, де композиція є засобом для профілактики або лікування захворювання, пов'язаного з гіперглікемією.
11. Фармацевтична композиція за п. 10, де захворюванням, пов'язаним з гіперглікемією, є цукровий діабет або ускладнення цукрового діабету.
12. Фармацевтична композиція за п. 10, де захворюванням, пов'язаним з гіперглікемією, є ожиріння.
13. Фармацевтична композиція за пп. 8-12, де композиція представлена в формі для перорального застосування.
14. Спосіб профілактики або лікування захворювання, пов'язаного з гіперглікемією, при якому вводять терапевтично ефективну кількість похідного глюкопіранозилоксибензилбензолу за пп. 1-7.
15. Застосування похідного глюкопіранозилоксибензилбензолу за пп. 1-7 для виробництва фармацевтичної композиції для профілактики або лікування захворювання, пов'язаного з гіперглікемією.
Текст
Даний винахід відноситься до похідних глюкопіранозилоксибензилбензолу, які застосовуються як лікарські засоби, і до фармацевтичних композицій, що їх містять. Більш конкретно, даний винахід відноситься до похідних глюкопіранозилоксибензилбензолу, які застосовуються як засоби для профілактики або лікування захворювання, пов'язаного з гіперглікемією, такого як цукровий діабет, ускладнень цукрового діабету або ожиріння, представлених загальною формулою: де Ρ являє собою групу, створюючу проліки; і R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою, з яких похідні глюкопіранозилоксибензилбензолу, що володіють інгібуючою активністю по відношенню до SGLT2 людини, представлені загальною формулою: де R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою, є активними формами, і відноситься до утримуючих їх фармацевтичних композицій. Цукровий діабет є одним із захворювань, пов'язаних із способом життя з передумовами у вигляді неправильного харчування і недостатньою фізичною активністю. Отже, для лікування хворих цукровим діабетом застосовують дієту і фізичні вправи. Більш того в тому випадку, якщо достатній контроль за ним і безперервний ефект ускладнений, одночасно проводиться медикаментозне лікування. У цей час як протидіабетичні засоби застосовуються бігуаніди, сульфонілсечовини і засоби для зниження резистентності до інсуліну. Однак для бігуанідів і сульфонілсечовин зрідка спостерігаються побічні ефекти, такі як молочнокислий ацидоз і гіпоглікемія, відповідно. У випадку застосування засобів для зниження резистентності до інсуліну, зрідка спостерігаються побічні ефекти, такі як набряки, і це також приводить до посилення ожиріння. Тому, для розв'язання цих проблем було потрібно розробити протидіабетичні засоби з новим механізмом дії. В останні роки велася активна розробка нового типу протидіабетичних засобів, що посилюють виведення глюкози з сечею і що знижують вміст глюкози в крові шляхом запобігання реабсорбції надлишку глюкози в нирках [J.Clin.Invest, Vol.79, pp.1510-1515 (1987)]. Додатково повідомлялося, що в сегменті S1 проксимальних ниркових канальців міститься SGLT2 (котранспортер Na+ глюкози 2), що бере участь головним чином в реабсорбції відфільтрованої клубочком глюкози [J.Clin. Invest., Vol.93, pp.397-404 (1994)]. Відповідно, інгібування активності SGLT2 людини запобігає реабсорбції надлишку глюкози в нирках, згодом посилюючи виведення надлишку глюкози з сечею і нормалізуючи вміст глюкози в крові. Тому, була потрібна швидка розробка протидіабетичних засобів, що володіють високою інгібуючою активністю по відношенню до SGLT2 людини і діючих по новому механізму. Крім того, оскільки такі агенти сприяють виведенню надлишку глюкози з сечею і, отже, зниженню накопичення глюкози в організмі, також передбачається їх профілактична активність при ожирінні. Автори даного винаходу цілеспрямовано займалися вишук уванням сполук, що володіють інгібуючою активністю по відношенню до SGLT2 людини. У результаті було показано, що сполуки, представлені вище загальною формулою І, перетворюються in vivo в їх активні форми, похідні глюкопіранозилоксибензилбензолу, представлені вище загальною формулою II, і володіють, як згадано нижче, відмінною інгібуючою активністю по відношенню до SGLT2 людини, утворюючи тим самим основу даного винаходу. Даний винахід відноситься до наступних похідних глюкопіранозилоксибензилбензолу, що володіють інгібуючою активністю по відношенню до SGLT2 людини in vivo і що володіють відмінним гіпоглікемічним ефектом за рахунок виведення надлишку глюкози з сечею шляхом запобігання реабсорбції глюкозі в нирках, і до утримуючих їх фармацевтичних композицій. Таким чином, даний винахід відноситься до похідного глюкопіранозилоксибензилбензолу, представленого загальною формулою: де Ρ являє собою групу, утворюючу проліки; і R являє собою нижчу алкільну групу, нижчу алкоксигрупу, нижчу алкілтіогрупу, нижчу алкільну групу, заміщену нижчою алкоксигрупою, нижчу алкоксигрупу, заміщену нижчою алкоксигрупою або нижчу алкілтіогрупу, заміщену нижчою алкоксигрупою. Даний винахід відноситься до фармацевтичної композиції, що включає як активний інгредієнтпохідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою І. Даний винахід відноситься до інгібітору SGLT2 людини, що включає як активний інгредієнт похідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою І. Даний винахід відноситься до засобу для профілактики або лікування захворювання, пов'язаного з гіперглікемією, що включає як активний інгредієнт похідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою І. Даний винахід відноситься до способу профілактики або лікування захворювання, пов'язаного з гіперглікемією, що включає введення терапевтично ефективної кількості похідного глюкопіранозилоксибензилбензолу, представленого вище загальною формулою І. Даний винахід відноситься до застосування похідного глюкопіранозилоксибензилбензолу, представленого вище загальною формулою І, для виробництва фармацевтичної композиції для профілактики або лікування захворювання, пов'язаного з гіперглікемією. У даному винаході термін "проліки" означає сполуку, яка перетворюється в похідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою II, як його активна форма in vi vo. Як приклади груп, утворюючі проліки, представлені звичайно гідроксизахисні групи, що застосовуються як проліки, такі як нижча ацильна група, нижча ацильна група, заміщена нижчою алкоксигрупою, нижча ацильна група, заміщена нижчою алкоксикарбонільною групою, нижча алкоксикарбонільна група і нижча алкоксикарбонільна група, заміщена нижчою алкоксигрупою. Також в даному винаході термін "нижча алкільна група" означає алкільну групу, що містить від 1 до 6 атомів вуглецю з нерозгалуженим або розгалуженим ланцюгом, таку як метильну груп у, етильну груп у, пропільну групу, ізопропільну груп у, бутильну гр упу, ізобутильну груп у, втор-бутильну груп у, трет-бутильну груп у, пентильну гр упу, ізопентильну груп у, ізопентильну гр упу, трет-пентильну гр упу, гексильну груп у, і тому подібне; термін "нижча алкоксигрупа" означає алкоксигрупу, що містить від 1 до 6 атомів вуглецю з нерозгалуженим або розгалуженим ланцюгом, таку як метоксигрупу, етоксигруп у, пропоксигрупу, ізопропоксигрупу, бутоксигрупу, ізобутоксигрупу, втор-бутоксигрупу, трет-бутоксигрупу, пентилоксигрупу, ізопентилоксигрупу, неопентилоксигрупу, трет-пентилоксигрупу, гексилоксигрупу, і тому подібне, і термін "нижча алкілтіогрупа" означає алкілтіогрупу, що містить від 1 до 6 атомів вуглецю з нерозгалуженим або розгалуженим ланцюгом, таку як метилтіогрупу, етилтіогр упу, пропілтіогрупу, ізопропілтіогрупу, бутилтіогруп у, ізобутилтіогрупу, втор-бутилтіогруп у, трет-бутилтіогрупу, пентилтіогруп у, ізопентилтіогрупу, неопентилтіогрупу, трет-пентилтіогрупу, гексилтіогрупу, і тому подібне. Термін "нижча алкільна група, заміщена нижчою алкоксигрупою" означає вказану вище нижчу алкільну груп у, заміщену вказаною вище нижчою алкоксигрупою; термін "нижча алкоксигрупа, заміщена нижчою алкоксигрупою" означає вказану вище нижчу алкоксигрупу, заміщену вказаною вище нижчою алкоксигрупою; і термін нижча алкілтіогрупа, заміщена нижчою алкоксигрупою" означає вказану вище нижчу алкілтіогрупу, заміщену вказаною вище нижчої алкоксигрупою. Термін "нижча ацильна група" означає ацильну групу, що містить від 2 до 7 атомів вуглецю з нерозгалуженим, розгалуженим ланцюгом або циклічну ацильну групу, таку як ацетильну груп у, пропіонільну групу, бутирильну груп у, ізобутирильну гр упу, півалоїльну груп у, гексаноїльну гр упу і циклогексилкарбонільну гр упу; і термін "нижча ацильна група, заміщена нижчою алкоксигрупою" означає вказану ви ще нижчу ацильну груп у, заміщену вказаною вище нижчою алкоксигрупою. Термін "нижча алкоксикарбонільна група" означає алкоксикарбонільну групу, що містить від 2 до 7 атомів вуглецю з нерозгалуженим, розгалуженим ланцюгом або циклічну алкоксикарбонільну груп у, таку як метоксикарбонільна група, етоксикарбонільна група, ізопропілоксикарбонільна група, ізобутилоксикарбонільна група і циклогексилоксикарбонільна група; термін "нижча ацильна група, заміщена нижчою алкоксикарбонільною групою" означає вказану вище нижчу ацильну груп у, заміщену вказаною вище нижчою алкоксикарбонільною групою, такою як 3(етоксикарбоніл)пропіонильною групою; і термін "нижча алкоксикарбонільна група, заміщена нижчою алкоксигрупою" означає вказану вище нижчу алкоксикарбонільну гр упу, заміщену вказаною вище нижчою алкоксигрупою, такою як 2-метоксіетоксикарбонільною групою. У заміснику R переважними є нижча алкільна група і нижча алкоксигрупа, більш переважними є алкільна група, що містить від 1 до 4 атомів вуглецю з нерозгалуженим або розгалуженим ланцюгом і алкоксигрупа, що містить від 1 до 3 атомів вуглецю з нерозгалуженим або розгалуженим ланцюгом, і найбільш переважними є етильна група і метоксигрупа. У заміснику Ρ переважними є нижча ацильна група і нижча алкоксикарбонільна група. Як нижча ацильна група переважна є та, що містить від 4 до 6 атомів вуглецю ацильна група з нерозгалуженим або розгалуженим ланцюгом, і більш переважними є бутирильна група і гексаноїльна група. Як нижча алкоксикарбонільна група переважна є та, що містить від 2 до 5 атомів вуглецю алкоксикарбонільна група з нерозгалуженим або розгалуженим ланцюгом, і більш переважними є метоксикарбонільна група і етоксикарбонільна група. Сполуки відповідно до даного винаходу можуть бути одержані шляхом введення звичайним способом гідроксизахисної групи, придатної для звичайного застосування в проліках, в гідроксигрупу похідного глюкопіранозилоксибензилбензолу, представленого вище загальною формулою II. Наприклад, сполуки відповідно до даного винаходу, представлені вище загальною формулою І, можуть бути одержані із застосуванням похідного глюкопіранозилоксибензилбензолу, представленого вище загальною формулою II, відповідно до наступної методики: де X являє собою групу, що відходить, таку як атом брому і атом хлору; і R і Ρ мають ті ж самі значення, що і вказані вище. Проліки, представлені вище загальною формулою І, можуть бути одержані шляхом захисту гідроксигрупи похідного глюкопіранозилоксибензилбензолу, представленого вище загальною формулою II, захисним реагентом, представленим вище загальною формулою III, в присутності основи, такої як піридин, триетиламін, Ν,Ν-діізопропілетиламін, піколін, лутидин, колідин, хінуклідин, 1,2,2,6,6-пентаметилпіперидин або 1,4діазабіцикло[2.2.2]октан, в інертному розчиннику або за відсутності будь-якого розчинника. Як приклади розчинників, що застосовуються можуть бути представлені дихлорметан, ацетонітрил, етилацетат, діізопропіловий ефір, хлороформ, тетрагідрофуран, 1,2-диметоксіетан, 1,4-діоксан, ацетон, трет-бутанол, суміш цих розчинників, і тому подібне. Температура реакції звичайно складає від -40°С до температури перегонки, а час реакції звичайно складає від 30 хвилин до 2 діб, в залежності від початкових матеріалів, що застосовуються, розчинника і температури реакції. Наприклад, сполуки відповідно до даного винаходу, представлені вище загальною формулою II, що застосовуються як сировина в згаданому вище способі одержання, можуть бути одержані у відповідності до наступної методики: де М являє собою гідроксизахисну гр упу; X являє собою групу, що відходить, таку як трихлорацетоімідоїлоксигрупу, ацетоксигрупу, атом брому або атом фтору; один з Υ і Ζ являє собою MgBr, MgCl, Mgl або атом літію, тоді як інші являють собою формільну групу; і R має ті ж самі значення, що і вказані вище. Процес 1 Сполука, представлена вище загальною формулою VI, може бути одержана шляхом конденсування похідного бензальдегіду, представленого вище загальною формулою IV, з реактивом Грін'яра або з літієвим реагентом, представленим вище загальною формулою V, або шляхом конденсування реактиву Грін'яра або літієвого реагенту, представленого вище загальною формулою IV, з похідним бензальдегіду, представленим вище загальною формулою V, в інертному розчиннику. Як приклади розчинників, що застосовуються можуть бути представлені тетрагідрофуран, діетиловий ефір, суміш цих розчинників, і тому подібне. Температура реакції звичайно складає від -78°С до температури перегонки, а час реакції звичайно складає від 10 хвилин до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Процес 2 Сполука, представлена вище загальною формулою VII, може бути одержана шляхом окислення сполуки, представленої вище загальною формулою VI, із застосуванням реактиву Десса-Мартіна в інертному розчиннику. Як приклади розчинників, що застосовуються можуть бути представлені дихлорметан, хлороформ, ацетонітрил, суміш цих розчинників, і тому подібне. Температура реакції звичайно складає від 0°С до температури перегонки, а час реакції звичайно складає від 1 години до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Процес 3 Сполука, представлена вище загальною формулою VIII, може бути одержана шляхом каталітичного гідрування сполуки, представленої вище загальною формулою VI, із застосуванням паладієвогокаталізатора, такого як паладій-вуглецевого порошку, в присутності або за відсутності кислоти, такої як соляна кислота, в інертному розчиннику, і видалення захисної групи звичайним шляхом, якщо це потрібно. Як приклади розчинників, що застосовуються при каталітичному гідруванні можуть бути представлені метанол, етанол, тетрагідрофуран, етилацетат, оцтова кислота, ізопропанол, суміш цих розчинників, і тому подібне. Температура реакції звичайно складає від кімнатної температури до температури перегонки, а час реакції звичайно складає від 30 хвилин до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Сполука, представлена вище загальною формулою VIII, може бути звичайним способом перетворена в ц сіль, таку як натрієва сіль або калієва сіль. Процес 4 Сполука, представлена вище загальною формулою VIII, може бути одержана шляхом видалення звичайним способом захисної групи Μ сполуки, представленої вище загальною формулою VII, конденсуючи одержану речовину з метилхлороформатом в присутності основи, такої як триетиламін, діізопропілетиламін або 4-(Ν,N-диметиламіно)піридин в інертному розчиннику і відновлюючи одержану карбонатну сполуку із застосуванням відновника, такого як боргідрид натрію. Як приклади розчинників, що застосовуються в реакції конденсації можуть бути представлені тетрагідрофуран, дихлорметан, ацетонітрил, етилацетат, діетиловий ефір, суміш цих розчинників, і тому подібне. Температура реакції звичайно складає від 0°С до температури перегонки, а час реакції звичайно складає від 30 хвилин до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Як приклад розчинника, що застосовується в реакції відновлення може бути представлена суміш тетрагідрофурану і води, і тому подібне. Температура реакції звичайно складає від 0°С до температури перегонки, а час реакції звичайно складає від 1 години до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Сполука, представлена вище загальною формулою VIII, може бути звичайним способом перетворена в її сіль, таку як натрієва сіль або калієва сіль. Процес 5 Глюкозид, представлений вище загальною формулою X, може бути одержаний шляхом глікозилювання похідного бензилфенолу, представленого вище загальною формулою VIII, або його солі, із застосуванням глікозил-донору, представленого вище загальною формулою IX, такого як 2,3,4,6-тетра-О-ацетил-1-Отрихлорацетоімідоїл-a-О-глюкопіраноза, 1,2,3,4,6-пента-О-ацетил-b-D-глюкопіраноза, 2,3,4,6-тетра-O-ацетилa-D-глюкопіранозилбромід і 2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозилфторид в присутності активуючого реагенту, такого як комплекс трифториду бору і діетилового ефіру, трифторметансульфонату срібла, хлориду олова(IV) або триметилсилілтрифторметансульфонату в інертному розчиннику. Як приклади розчинників, що застосовуються можуть бути представлені дихлорметан, толуол, ацетонітрил, нітрометан, етилацетат, діетиловий ефір, хлороформ, суміш ци х розчинників, і тому подібне. Температура реакції звичайно складає від -30°С до температури перегонки, а час реакції звичайно складає від 10 хвилин до 1 доби, в залежності від сировини, що застосовується, розчинника і температури реакції. Процес 6 Для видалення гідроксизахисних груп похідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою II, може бути одержане шляхом лужного гідролізу глюкозиду, представленого вище загальною формулою X. Як приклади розчинників, що застосовуються можуть бути представлені вода, метанол, етанол, тетрагідрофуран, суміш ци х розчинників, і тому подібне, а як лужні реагенти можуть застосовуватися гідроксид натрію, метоксид натрію, етоксид натрію, і тому подібне. Температура обробки звичайно складає від 0°С до температури перегонки, а час обробки звичайно складає від 30 хвилин до 6 годин, в залежності від сировини, що застосовується, розчинника і температури обробки. Сполуки відповідно до даного винаходу, одержані за допомогою описаного вище способу одержання, можуть бути виділені і очищені шляхом традиційних способів розділення, таких як фракційна перекристалізація, очищення за допомогою хроматографії, екстракція розчинником і екстракція твердою фазою. Проліки відповідно до даного винаходу, представлені вище загальною формулою І, включають їх гідрати і їх сольвати з фармацевтично прийнятними розчинниками, такими як етанол. Проліки відповідно до даного винаходу, представлені вище загальною формулою І, перетворюється в похідне глюкопіранозилоксибензилбензолу, представлене вище загальною формулою II, як його активна форма in vivo і може володіти відмінною інгібуючою активністю по відношенню до SGLT2 людини. Додатково, проліки відповідно до даного винаходу, представлені вище загальною формулою І, володіють поліпшеним всмоктуванням при пероральному введенні, і фармацевтичні композиції, що включають проліки як активний інгредієнт, є придатними у вигляді препаратів для перорального застосування. Тому, проліки відповідно до даного винаходу є особливо корисними як засоби для профілактики або лікування захворювання, пов'язаного з гіперглікемією, такого як цукровий діабет, ускладнень цукрового діабету, ожиріння, і тому подібного. У випадку використання в практиці фармацевтичних композицій відповідно до даного винаходу в залежності від їх застосування застосовуються різні дозовані форми. Як приклади дозованих форм можуть бути представлені порошки, гранули, дрібні гранули, сухі сиропи, таблетки, капсули, ін'єкційні розчини, розчини, мазі, свічки, припарки, і тому подібне, які вводяться перорально або парентерально. У залежності від їх дозованих форм дані фармацевтичні композиції можуть бути одержані шляхом змішування або шляхом розбавлення і розчинення з різними фармацевтичними добавками, такими як наповнювачі, розпушувачі, зв'язувальні речовини, мастила, розріджувачі, буферні розчини, агенти, що забезпечують ізотонічність, антисептики, зволожувачі, емульгатори, диспергуючі агенти, стабілізатори, допоміжні розчинювальні засоби, і тому подібне, і приготування сумішей відповідно до фармацевтично традиційних способів в залежності від їх дозованих форм. У випадку використання в практиці фармацевтичних композицій відповідно до даного винаходу дозування сполуки відповідно до даного винаходу як активного інгредієнта визначається відповідним чином в залежності від віку, статі, маси тіла, ступеня вираженості симптомів і лікування кожного пацієнта, і приблизно знаходиться в діапазоні від 0,1 до 1000мг на добу для дорослої людини у випадку перорального введення і приблизно в діапазоні від 0,01 до 300мг на добу для дорослої людини у випадку парентерального введення, а денна доза може бути однократною або розділеною на декілька прийомів протягом доби і вводитися відповідним чином. ПРИКЛАДИ Даний винахід додатково більш детально ілюструється за допомогою наступних посилальних прикладів, прикладів і прикладів випробувань. Однак даний винахід цим не обмежується. Посилальний приклад 1 2-(4-ізобутилбензил)фенол Реактив Грін'яра одержували звичайним способом з 2-бензилокси-1-бромбензолу (0,20г), магнію (0,026г), каталітичної кількості йоду і тетрагідрофурану (1мл). Одержаний реактив Грін'яра додавали до розчину 4ізобутилбензальдегіду (0,16г) в тетрагідрофурані (2мл) і перемішували суміш при кімнатній температурі протягом 30 хвилин. Реакційну суміш очищали методом колонкової хроматографії на амінопропіловому силікагелі (елюент: тетрагідрофуран) з одержанням сполуки дифенілметанолу (0,23г). Одержану сполуку дифенілметанолу розчиняли в етанолі (3мл) і концентрованій соляній кислоті (0,1мл). До розчину додавали каталітичну кількість 10% паладій-вуглецевого порошку і перемішували суміш в атмосфері водню при кімнатній температурі протягом ночі. Каталізатор видаляли шляхом фільтрації і концентрували фільтрат при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: дихлорметан/гексан =1/1) з одержанням 2-(4-ізобутилбензил)фенолу (0,1г). 1 H-ЯМР (CDCl3) δ ppm: 0,89 (6Н, д, J=6,6Гц), 1,75-1,90 (1Н, м), 2,43 (2H, д, J=7,2Гц), 3,97 (2Н, с), 4,66 (1H, с), 6,75-6,85 (1Н, м), 6,85-6,95 (1Н, м), 7,00-7,20 (6Н, м). Посилальний приклад 2 2-(4-ізопропоксибензил)фенол Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 1, використовуючи 4-ізопропоксибензальдегід замість 4-ізобутил бензальдегіду. 1 H-ЯМР (CDCl3) δ ppm: 1,31 (6Н, д, J=6,1Гц), 3,93 (2Н, с), 4,50 (1H, гептет, J=6,1Гц), 4,72 (1H, с), 6,75-6,85 (3Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (4H, м). Посилальний приклад 3 2-(4-етоксибензил)фенол Реактив Грін'яра одержували звичайним способом з 1-бром-4-етоксибензолу (1,5г), магнію (0,19г), каталітичної кількості йоду і тетрагідрофурану (2мл). До одержаного розчину реактиву Грін'яра по краплях додавали розчин 2-бензилоксибензальдегіду (1,1г) в тетрагідрофурані (15мл), і перемішували суміш при кімнатній температурі протягом 30 хвилин. До реакційної суміші додавали насичений водний розчин хлориду амонію (10мл) і воду (20мл) і екстрагували суміш етилацетатом (100мл). Екстракт промивали водою (20мл) і насиченим сольовим розчином (20мл) і сушили над безводним сульфатом натрію. Після цього розчинник випаровували при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =5/1) з одержанням сполуки дифеніл метанолу (1,7г). Одержану сполуку дифенілметанолу (1,7г) розчиняли в метанолі (25мл). До розчину додавали концентровану соляну кислоту (0,42мл) і каталітичну кількість 10% паладій-вуглецевого порошку, і перемішували суміш в атмосфері водню при кімнатній температурі протягом 18 годин. Каталізатор видаляли шляхом фільтрації і концентрували фільтрат при зниженому тиску. До залишку додавали етилацетат (100мл) і промивали розчин насиченим водним розчином гідрокарбонату натрію (30мл) і насиченим сольовим розчином (30мл). Органічний шар сушили над безводним сульфатом натрію і випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =8/1) з одержанням 2-(4етоксибензил)фенолу (0,85г). 1 H-ЯМР (CDCl3) δ ppm: 1,39 (3Н, т, J=7,1Гц), 3,93 (2H, с), 4,00 (2Н, кв, J=7,1Гц), 4,72 (1Н, с), 6,75-6,85 (3Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (4Н, м). Посилальний приклад 4 2-(4-етилтіобензил)фенол Реактив Грін'яра одержували звичайним способом з 1-бром-4-етилтіобензолу (1,1г), магнію (0,12г), каталітичної кількості йоду і тетрагідрофурану (5мл). До одержаного розчину реактиву Грін'яра додавали розчин 2-(метоксиметокси)бензальдегіду (0,56г) в тетрагідрофурані (12мл), і перемішували суміш при 65°С протягом 10 хвилин. Після охолоджування до температури навколишнього середовища до реакційної суміші додавали насичений водний розчин хлориду амонію (5мл) і воду (20мл) і екстрагували суміш етилацетатом (80мл). Екстракт промивали водою (20мл) і насиченим сольовим розчином (20мл), сушили над безводним сульфатом натрію, потім випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =4/1) з одержанням сполуки дифенілметанолу (0,91г). Одержану сполуку дифенілметанолу (0,90г)розчиняли в дихлорметані (15мл). До розчину додавали реактив Десса-Мартіна (1,1,1-трис(ацетилокси)-1,1-дигідро-1,2-бензйодоксол-3-(1Н)-он) (1,5г) і перемішували суміш при 25°С протягом 26 годин. До реакційної суміші додавали діетиловий ефір (75мл) і водний розчин гідроксиду натрію (1моль/л, 30мл), енергійно перемішували суміш і відділяли органічний шар. Органічний шар промивали водним розчином гідроксиду натрію (1моль/л, 30мл), водою (30мл, тричі) і насиченим сольовим розчином (30мл), сушили над безводним сульфатом натрію і випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =15/1-9/1) з одержанням кетонової сполуки (0,82г). Суміш одержаної кетонової сполуки (0,81г), моногідрату пара-толуолсульфонової кислоти (0,1г) і метанолу (14мл) перемішували при 60°С протягом 4 годин. Після охолоджування до температури навколишнього середовища реакційну суміш концентрували при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =15/1) з одержанням сполуки зі знятим захистом (0,69г). Одержану сполуку із знятим захистом (0,68г) розчиняли в тетрагідрофурані (11мл), додавали до розчину триетиламін (0,41мл) і метилхлороформат (0,22мл), і перемішували суміш при 25°С протягом 1 години. Потім до реакційної суміші додатково додавали триетиламін (0,11мл) і метилхлороформат (0,061мл), і перемішували суміш протягом 30 хвилин. Реакційну суміш фільтрували і концентрували фільтрат при зниженому тиску. Залишок розчиняли в тетрагідрофурані (14мл) і воді (7мл), додавали до розчину боргідрид натрію (0,40г) і перемішували суміш при 25°С протягом 7 годин. До реакційної суміші по краплях додавали соляну кислоту (1моль/л, 15мл) і екстрагували суміш етилацетатом (75мл). Екстракт промивали водою (20мл), насиченим водним розчином гідрокарбонату натрію (20мл) і насиченим сольовим розчином (20мл), сушили над безводним сульфатом натрію і випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: гексан/етилацетат =8/1) з одержанням 2-(4-етилтіобензил)фенолу (0,62г). 1 H-ЯМР (CDCl3) δ ppm: 1,29 (3Н, т, J=7,3Гц), 2,90 (2H, кв, J=7,3Гц), 3,96 (2Н, с), 4,62 (1Н, с), 6,75-6,80 (1Н, м), 6,85-6,95 (1Н, м), 7,05-7,20 (4Н, м), 7,20-7,30 (2Н, м). Посилальний приклад 5 2-(4-метоксибензил) феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид До розчину 2-(4-метоксибензил)фенолу (46мг) і 2,3,4,6-тетра-О-ацетил-1-O-трихлорацетоімідоїл-a-Dглюкопіранози (0,13г) в ди хлорметані (2мл) додавали комплекс трифториду бору і діетилового ефіру (0,033мл) і перемішували суміш при кімнатній температурі протягом 1 години. Реакційну суміш очищалиметодом колонкової хроматографії на амінопропіловому силікагелі (елюент:дихлорметан) з одержанням 2-(4метоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозиду (0,11г). 1 H-ЯМР (CDCl3) δ ppm: 1,91 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,08 (3Н, с), 3,77 (3Н, с), 3,80-3,95 (3Н, м), 4,17 (1Н, дд, J=2,5, 12,2Гц), 4,29 (1H, дд, J=5,5, 12,2Гц), 5,11 (1H, д, J=7,5Гц), 5,10-5,25 (1H, м), 5,25-5,40 (2H, м), 6,75-6,85 (2Н, м), 6,957,10 (5Н, м), 7,10-7,25 (1Н,м). Посилальний приклад 6 2-(4-метилбензил)феніл-2,3,4, 6-тетра-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 5, використовуючи 2-(4-метилбензил)фенол замість 2-(4-метоксибензил)фенолу. 1 H-ЯМР (CDCl3) δ ppm: 1,89 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 2,30 (3Н, с), 3,80-3,95 (3Н, м), 4,17 (1Н, дд, J=2,5, 12,3Гц), 4,28 (1H, дд, J=5,5, 12,3Гц), 5,11 (1H, д, J=7,5Гц), 5,10-5,25 (1H, м), 5,25-5,40 (2Н, м), 6,90-7,20 (8Н, м). Посилальний приклад 7 2-(4-етилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 5, використовуючи 2-(4-етилбензил) фенол замість 2-(4-метоксибензил)фенолу. 1 H-ЯМР (CDCl3) δ ppm: 1,20 (3Н, т, J=7,6Гц), 1,87 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,08 (3Н, с), 2,60 (2Н, кв, J=7,6Гц), 3,80-4,00 (3Н, м), 4,18 (1Н, дд, J=2,3, 12,2Гц), 4,28 (1Н, дд, J=5,4, 12,2Гц), 5,11 (1Н, д, J=7,5Гц), 5,10-5,25 (1Н, м), 5,25-5,40 (2Н, м), 6,90-7,25 (8Н, м). Посилальний приклад 8 2-(4-ізобутилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 5, використовуючи 2-(4-ізобутилбензил)фенол замість 2-(4-метоксибензил)фенолу. 1 H-ЯМР (CDCl3) δ ppm: 0,88 (6Н, д, J=6,6Гц), 1,75-1,90 (1Н, м), 1,87 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,08 (3Н, с), 2,42 (2Н, д, J=7,2Гц), 3,80-3,95 (3Н, м), 4,18 (1Н, дд, J=2,4, 12,3Гц), 4,29 (1H, дд, J=5,5, 12,3Гц), 5,11 (1Н, д, J=7,6Гц), 5,105,25 (1Н, м), 5,25-5,40 (2Н, м), 6,90-7,25 (8Н, м). Посилальний приклад 9 2-(4-етоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 5, використовуючи 2-(4-етоксибензил)фенол замість 2-(4-метоксибензил)фенолу. 1 H-ЯМР (CDCl3) δ ppm: 1,39 (3Н, т, J=7,0Гц), 1,91 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,07 (3Н, с), 3,80-3,95 (3Н, м), 3,99 (2Н, кв, J=7,0Гц), 4,18 (1Н, дд, J=2,5, 12,3Гц), 4,28 (1Н, дд, J=5,6, 12,3Гц), 5,10 (1Н, д, J=7,7Гц), 5,15-5,25 (1Н, м), 5,255,40 (2Н, м), 6,75-6,85 (2Н, м), 6,95-7,10 (5Н, м), 7,10-7,20 (1Н, м). Посилальний приклад 10 2-(4-ізопропоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 5, використовуючи 2-(4-ізопропоксибензил)фенол замість 2-(4-метоксибензил)фенолу. 1 H-ЯМР (CDCl3) δ ppm: 1,30 (6Н, д, J=6,0Гц), 1,90 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,08 (3Н, с), 3,80-3,90 (3Н, м), 4,18 (1Н, дд, J=2,3, 12,3Гц), 4,28 (1H, дд, J=5,5, 12,3Гц), 4,48 (1H, гептет, J=6,0Гц), 5,10 (1H, д, J=7,7Гц), 5,10-5,25 (1Н, м), 5,25-5,40 (2Н, м), 6,70-6,85 (2Н, м), 6,90-7,10 (5Н, м), 7,10-7,20 (1Н, м). Посилальний приклад 11 2-(4-метоксибензил) феніл-b-D-глюкопіранозид Метоксид натрію (28% розчин в метанолі; 0,12мл) додавали до розчину 2-(4-метоксибензил)феніл-2,3,4,6тетра-О-ацетил-b-D-глюкопіранозиду (0,11г) в метанолі (4мл), і перемішували суміш при кімнатній температурі протягом 30 хвилин. Випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: дихлорметан/метанол =10/1) з одержанням 2-(4-метоксибензил)феніл-bD-глюкопіранозиду (65мг). 1 H-ЯМР (CD3OD) δ ppm: 3,35-3,55 (4Н, м), 3,69 (1H, дд, J=5, 1, 12,1Гц), 3,73 (3Н, с), 3,80-4,00 (2Н, м), 4,03 (1Н, д, J=15,1Гц), 4,91 (1H, д, J=7,4Гц), 6,75-6,85 (2Н, м), 6,85-6,95 (1H, м), 6,95-7,10 (1H, м), 7,10-7,20 (4Н, м). Посилальний приклад 12 2-(4-метилбензил)феніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 11, використовуючи 2-(4-метилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид замість 2-(4метоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозиду. 1 Н-ЯМР (CD3OD) δ ppm: 2,27 (3Н, с), 3,35-3,55 (4Н, м), 3,69 (1H, дд, 3=5,2, 12,0Гц), 3,80-3,90 (1Н, м), 3,94 (1Н, д, J=15,0Гц), 4,05 (1H, д, J=15,0Гц), 4,85-4,95 (1Н, м), 6,85-6,95 (1Н, м), 6,95-7,20 (7Н, м). Посилальний приклад 13 2-(4-етилбензил)феніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 11, використовуючи 2-(4-етилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид замість 2-(4метоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозиду. 1 H-ЯМР (CD3OD) δ ppm: 1,15-1,25 (3Н, м), 2,50-2,65 (2Н, м), 3,35-3,55 (4Н, м), 3,65-3,75 (1Н, м), 3,80-4,00 (2Н, м), 4,06 (1Н, д, J=14,9Гц), 4,85-5,00 (1Н, м), 6,85-7,00 (1Н, м), 7,00-7,20 (7Н, м). Посилальний приклад 14 2-(4-ізобутилбензил)феніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 11, використовуючи 2-(4-ізобутилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид замість 2-(4метоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозиду. 1 H-ЯМР (CD3OD) δ ppm: 0,80-0,95 (6Н, м), 1,70-1,90 (1H, м), 2,41 (2H, д, J=7,1Гц), 3,30-3,55 (4Н, м), 3,60-3,75 (1Н, м), 3,80-3,95 (1Н, м), 3,95 (1H, д, J-15,0Гц), 4,06 (1Н, д, J=15,0Гц), 4,85-4,95 (1H, м), 6,80-7,20 (8Н, м). Посилальний приклад 15 2-(4-етоксибензил)феніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 11, використовуючи 2-(4-етоксилбензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозид замість 2-(4метоксибензил)феніл-2,3,4,6-тетра-О-ацетил-b-D-глюкопіранозиду. 1 H-ЯМР (CD3OD) δ ppm: 1,35 (3Н, т, J=6,8Гц), 3,35-3,55 (4H, м), 3,60-3,75 (1Н, м), 3,80-4,10 (5Н, м), 4,90 (1H, д, J=7,1Гц), 6,70-6,85 (2Н, м), 6,85-6,95 (1Н, м), 7,00-7,20 (5Н, м). Посилальний приклад 16 2-(4-ізопропоксибензил)феніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в посилальному прикладі 11, використовуючи 2-(4-ізопропоксилбензил)феніл-2,3,4,6-тетра-O-ацетил-b-D-глюкопіранозид замість 2-(4метоксибензил)феніл-2,3,4,6-тетра-O-ацетил-b-D-глюкопіранозиду. 1 H-ЯМР (CD3OD) δ ppm: 1,27 (6Н, д, J=6,0Гц), 3,35-3,55 (4Н, м), 3,69 (1H, дд, J=5,4, 12,1Гц), 3,88 (1Н, дд, J=2,0, 12,1Гц), 3,91 (1Н, д, J=15,0Гц), 4,02 (1Н, д, J=15,0Гц), 4,51 (1Н, гептет, J=6,0Гц), 4,91 (1Н, д, J=7,7Гц), 6,70-6,85 (2Н, м), 6,85-6,95 (1H, м), 7,00-7,10 (1H, м), 7,10-7,20 (4Н,м). Посилальний приклад 17 2-(4-етилтіобензил)феніл-b-D-глюкопіранозид До розчину 2-(4-етилтіобензил)фенолу (0,51г) і 1,2,3,4,6-пента-О-ацетил-b-D-глюкопіранози (2,4г) в толуолі (6,3мл) і дихлорметані (2,7мл) додавали комплекс трифториду бору і діетилового ефір у (0,78мл), і перемішували суміш при кімнатній температурі протягом 9 годин. До реакційної суміші додавали етилацетат (70мл) і насичений водний розчин гідрокарбонату натрію (25мл) і відділяли органічний шар. Органічний шар промивали насиченим сольовим розчином (25мл), сушили над безводним сульфатом натрію і випаровували розчинник при зниженому тиску. Залишок розчиняли в метанолі (10,5мл), додавали до розчину метоксид натрію (28% розчин в метанолі; 0,08мл) і перемішували суміш при 25°С протягом 18 годин. До реакційної суміші додавали етилацетат (75мл) і воду (20мл) і відділяли органічний шар. Органічний шар промивали насиченим сольовим розчином (20мл), сушили над безводним сульфатом натрію і випаровували розчинник при зниженому тиску. Залишок очищали методом колонкової хроматографії на силікагелі (елюент: дихлорметан/метанол =10/1). Випаровували розчинник при зниженому тиску, додавали до залишку діетиловий ефір і збирали одержаний осадок шляхом фільтрації. Одержану безбарвну тверду речовину промивали діетиловим ефіром і сушили при зниженому тиску з одержанням 2-(4-етилтіобензил)феніл-b-Dглюкопіранозиду (0,51г). 1 H-ЯМР (CD3OD) δ ppm: 1,24 (3Н, т, J=7,3Гц), 2,88 (2H, кв, J=7,3Гц), 3,35-3,55 (4Н, м), 3,69 (1Н, дд, J=5,0, 12,2Гц), 3,88 (1Н, дд, J=2,0, 12,2Гц), 3,95 (1H, д, J=15,1Гц), 4,08 (1Н, д, J=15,1Гц), 4,91 (1H, д, J=7,3Гц), 6,85-7,00 (1Н, м), 7,00-7,10 (1H, м), 7,10-7,30 (6Н, м). Приклад 1 2-(4-метоксибензил)феніл-6-О-етоксикарбоніл-b-D-глюкопіранозид До розчину 2-(4-метоксибензил)феніл-b-D-глюкопіранозиду (0,075г) в 2,4,6-триметилпіридині (2мл) додавали етилхлороформат (0,04мл) при кімнатній температурі. Після перемішування суміші при кімнатній температурі протягом 16 годин до неї додавали насичений водний розчин лимонної кислоти і екстрагували суміш етилацетатом. Екстракт промивали водою, сушили над безводним сульфатом магнію і випаровували розчинник при зниженому тиску. Залишок очищали методом препаративної тонкошарової хроматографії на силікагелі (елюент: дихлорметан/метанол =10/1) з одержанням аморфного 2-(4-метоксибензил)феніл-6-Оетоксикарбоніл-b-D-глюкопіранозиду (0,032г). 1 H-ЯМР (CD3OD) δ ppm: 1,23 (3Η, т, J=7,1Гц), 3,30-3,65 (4H, м), 3,74 (3Н, с), 3,93 (1Н, Д, J=15,1Гц), 4,02 (1Н, д, J=15,1Гц), 4,05-4,20 (2Н, м), 4,29 (1Н, дд, J=6,4, 11,7Гц), 4,45 (1Н, дд, J=2,2, 11,7Гц), 4,89 (1Н, д, J=7,4Гц), 6,75-6,85 (2Н, м), 6,857,05 (2Н, м), 7,05-7,2 (4Н, м). Приклад 2 2-(4-метоксибензил)феніл-6-О-метоксикарбоніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 1, використовуючи метилхлороформат замість етилхлороформату. 1 H-ЯМР (CD3OD) δ ppm: 3,30-3,65 (4Н, м), 3,71 (3Н, с), 3,74 (3Н, с), 3,93 (1H, д, J=15,1Гц), 4,01 (1H, д, J=15,1Гц), 4,30 (1Н, дд, J=6,4, 11,7Гц), 4,45 (1Н, дд, J=2,1, 11,7Гц), 4,89 (1Н, д, J=7,4Гц), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 3 2-(4-метоксибензил)феніл-6-О-[2-(метокси)етилоксикарбоніл]-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 1, використовуючи 2(метокси)етилхлороформат замість етилхлороформату. 1 H-ЯМР (CD3OD) δ ppm: 3,30-3,65 (9Н, м), 3,74 (3Н, с), 3,92 (1Н, Д, J=15,1Гц), 4,02 (1H, д, J=15,1Гц), 4,10-4,25 (2H, м), 4,30 (1H, дд, J=6,3, 11,7), 4,47 (1H, дд, J-2,1, 11,7Гц), 4,89 (1H, д, J=7,4Гц), 6,70-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 4 2-(4-метоксибензил)феніл-6-O-гексаноїл-b-D-глюкопіранозид До розчину 2-(4-метоксибензил)феніл-b-D-глюкопіранозиду (0,1г) в 2,4,6-триметилпіридині (2мл) додавали гексаноїлхлорид (0,072г) при 0°C і перемішували суміш протягом 3 годин. До реакційної суміші додавали 10% водний розчин лимонної кислоти і екстрагували суміш етилацетатом. Органічний шар промивали 10% водним розчином лимонної кислоти і насиченим сольовим розчином. Органічний шар сушили над безводним сульфатом магнію і випаровували розчинник при зниженому тиску. Залишок очищали методом препаративної тонкошарової хроматографії на силікагелі (елюент: дихлорметан/метанол =10/1) з одержанням 2-(4метоксибензил)феніл-6-О-гексаноїл-b-D-глюкопіранозиду (0,03г). 1 H-ЯМР (CD3OD) δ ppm: 0,80-0,95 (3Н, м), 1,20-1,35 (4Н, м), 1,50-1,65 (2Н, м), 2,25-2,35 (2Н, м), 3,30-3,65 (4Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,01 (Ш, Д, J=15,1Гц), 4,22 (Ш, дд, J=6,7, 11,8Гц), 4,42 (1Н, дд, J=2,2, 11,8Гц), 4,85-4,95 (1Н, м), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 5 2-(4-метоксибензил)феніл-6-O-пропіоніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 4, використовуючи пропіонілхлорид замість гексаноїлхлориду. 1 H-ЯМР (CD3OD) δ ppm: 1,08 (3Н, τ, J=7,6Гц), 2,25-2,40 (2H, м), 3,30-3,55 (3Н, м), 3,55-3,65 (1Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,01 (1Н, д, J=15,1Гц), 4,23 (1H, дд, J=6,7, 11,8Гц), 4,40 (1Н, дд, J=2,1, 11,8Гц), 4,85-4,95 (1Н, м), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 6 2-(4-метоксибензил)феніл-6-О-бутирил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 4, використовуючи бутирилхлорид замість гексаноїлхлориду. 1 H-ЯМР (CD3OD) δ ppm: 0,90 (3Н, т, J=7,4Гц), 1,50-1,70 (2H, м), 2,20-2,35 (2Н, м), 3,30-3,65 (4Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,01 (1Н, д, J=15,1Гц), 4,22 (1Н, дд, J=6,7, 11,8Гц), 4,42 (1Н, дд, J=2,2, 11,8Гц), 4,85-4,95 (1Н, м), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 7 2-(4-метоксибензил)феніл-6-О-ацетил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 4, використовуючи ацетилхлорид замість гексаноїлхлориду. 1 H-ЯМР (CD3OD) δ ppm: 2,02 (3Н, с), 3,30-3,65 (4Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,01 (1Н, д, J=15,1Гц), 4,24 (1Н, дд, J=6,5, 11,9Гц), 4,38 (1Н, дд, J=2,2, 11,9Гц), 4,85-4,95 (1Н, м), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 8 2-(4-метоксибензил)феніл-6-О-ізобутирил-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 4, використовуючи ізобутирилхлорид замість гексаноїлхлориду. 1 H-ЯМР (CD3OD) δ ppm: 1,11 (3Н, д, J=7,0Гц), 1,12 (3Н, д, J=7,0Гц), 2,45-2,60 (1Н, м), 3,30-3,65 (4H, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,00 (1Н, д, J=15,1Гц), 4,19 (1Н, дд, J=6,9, 11,8Гц), 4,43 (1Н, дд, J=2,1, 11,8Гц), 4,85-4,95 (1Н, м), 6,75-6,85 (2Н, м), 6,85-7,05 (2Н, м), 7,05-7,20 (4Н, м). Приклад 9 2-(4-метоксибензил)феніл-6-О-етилсукциніл-b-D-глюкопіранозид Вказану в заголовку сполуку одержували способом, схожим з описаним в прикладі 4, використовуючи етилсукцинілхлорид замість гексаноїлхлориду. 1 H-ЯМР (CD3OD) δ ppm: 1,19 (3Н, т, J=7,1Гц), 2,50-2,70 (4H, м), 3,30-3,65 (4Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,02 (1Н, д, J=15,1Гц), 4,08 (2Н, кв, J=7,1Гц), 4,22 (1Н, дд, J=6,7, 11,8Гц), 4,44 (1Н, дд, J=2,1, 11,8Гц), 4,85-4,95 (1Н, м), 6,75-7,25 (8Н, м). Приклад 10 2-(4-метоксибензил) феніл-6-О-ізопропілоксикарбоніл-b-D-глюкопіранозид До розчину ізопропанолу (0,12г) в 2,4,6-триметилпіридині (2мл) додавали трифосген (0,022г) при 0°С і перемішували суміш протягом 1 години. Після цього до реакційної суміші додавали 2-(4-метоксибензил)фенілb-D-глюкопіранозид (0,075г) і перемішували суміш при кімнатній температурі протягом ночі. До реакційної суміші додавали 10% водний розчин лимонної кислоти і екстрагували суміш етилацетатом. Органічний шар промивали 10% водним розчином лимонної кислоти і водою, сушили над сульфатом магнію і випаровували розчинник при зниженому тиску. Залишок очищали методом препаративної тонкошарової хроматографії на силікагелі (елюент: дихлорметан/метанол =10/1) з одержанням 2-(4-метоксибензил)феніл-6-Оізопропілоксикарбоніл-b-D-глюкопіранозиду (0,024г). 1 H- ЯМР (CD3 OD) δ ppm: 1,21 (3Н, д, J=6,3Гц), 1,23 (3Н, д, J=6,3Гц), 3,30-3,65 (4Н, м), 3,74 (3Н, с), 3,93 (1Н, д, J=15,1Гц), 4,02 (1Н, д, J=15,1Гц), 4,28 (1Н, дд, J=6,4, 11,7Гц), 4,43 (1Н, дд, J=2,2, 11,7Гц), 4,70-4,85 (1Н, м), 4,85-4,95 (1Н, м), 6,75-7,20 (8Н, м). Приклади 11-22 Сполуки в таблиці 1 одержували способами, схожими з описаними в прикладах 1 або 2, використовуючи сполуку, одержану в посилальних прикладах 12-17. Таблиця 1 Приклад 11 12 13 14 15 16 17 18 19 20 21 22 R метил метил етил етил ізобутил ізобутил етокси етокси ізопропіл ізопропіл етилтіо етилтіо Ρ етоксикарбоніл метоксикарбоніл етоксикарбоніл метоксикарбоніл етоксикарбоніл метоксикарбоніл етоксикарбоніл метоксикарбоніл етоксикарбоніл метоксикарбоніл етоксикарбоніл метоксикарбоніл Приклад випробувань 1 Аналіз ефекту інгібування активності SGLT2 людини 1) Конструювання плазмідного вектора, що експресує SGLT2 людини Одержання бібліотеки кДНК для ПЛР-ампліфікації здійснювали методом зворотної транскрипції загальної РНК з нирки людини (Ori gene) з oligo dT як праймером, використовуючи SUPERSCRIPT Preamplification System (Gibco-BRL: LIFE TECHNOLOGIES). Фрагмент ДНК, що кодує SGLT2 людини, ампліфікували за допомогою ПЛР із застосуванням ДНК-полімерази Pfu (Stratagene), в якій описана вище бібліотека кДНК нирки людини застосовувалася як матриця, а наступні олігонуклеотиди 0702F і 0712R, представлені як послідовності з номерами 1 і 2, відповідно, використовувалися як праймери. Ампліфікований фрагмент ДНК зшивали з вектором для клонування pCR-Blunt (Invitrogen) відповідно до стандартної методики. Компетентну клітину, Escherichia coli HB101 (Toyobo), трансформували звичайним способом і проводили вибір трансформантів на LB-arapi, що містить 50мкг/мл канаміцину. Після екстракції і очищення плазмідної ДНК з одного з трансформантів за допомогою ПЛР із застосуванням ДНК-полімерази Pfu проводили ампліфікацію кодуючого SGLT2 людини фрагмента ДНК, використовуючи наступні олігонуклеотиди 0714F і 0715R, представлені як послідовності з номерами 3 і 4, відповідно, як праймери. Ампліфікований фрагмент ДНК розщеплювали за допомогою рестриктаз Xho І і Hind III і потім очищували за допомогою Wizard Purification System (Promega). Одержаний очищений фрагмент ДНК вставляли у відповідні мультиклонуючі сайти вектора для експресії злитого білка pcDNA3.1 (-) Myc/His-B (Invitrogen). Компетентну клітину, Escherichia coli HB101 (Toyobo), трансформували звичайним способом і проводили вибір трансформантів на LB-arapi, що містить 100мкг/мл ампіциліну. Після екстракції і очищення плазмідної ДНК з одного з трансформантів аналізували послідовність фрагмента ДНК, вставленого в м ультиклонуючі сайти pcDNA3.1 (-) Myc/His-B. Даний клон містив одну заміну (кодуюча ізолейцин-433 АТС була заміщена GTC) в порівнянні з SGLT2 людини, як було показано Wellset al [Am. J.Ph ysiol., Vol.263, рр.459-465 (1992)]. Після цього був одержаний клон, в якому ізолейцин-433 був заміщений валіном. Даний плазмідний вектор, що експресує SGLT2 людини, в якому пептид, представлений як послідовність з номером 5, пришитий до карбоксильного кінцевого залишку аланіну, був позначений як KL29. 2) Одержання клітин, транзієнтно експресуючих SGLT2 людини Клітини COS-7 (RIKEN CELL BANK RCB0539) трансфікували кодуючою SGLT2 людини плазмідою KL29 методом електропорації. Електропорацію здійснювали за допомогою GENE PULSER II (Bio-Rad Laboratories) в наступних умовах: 0,29кВ, 975мкФ, 2´106 клітин лінії COS-7 і 20мкг KL29 в 500мкл середовища ОРТ І-МЕМ І (Gibco-BRL: LIFE TECHNOLOGIES) в типовій 0,4см кюветі. Після перенесення гена клітини збирали шляхом центрифугування і ресуспендували в середовищі ОРТІMEM I (1мл/кювету). У кожну ямку 96-ямкового планшета додавали 125мкл цих клітинної суспензії. Після культивування при 37°C в присутності 5% СО2 в кожну ямку додавали 125мкл середовища DMEM, що містить 10% фетальної бичачої сироватки (Sanko Jyunyaku), 100одиниць/мл натрійпеніциліну G (Gibco-BRL: LIFE TECHNOLOGIES) і 100мкг/мл сульфати стрептоміцину (Gibco-BRL: LIFE TECHNOLOGIES). Після культивування протягом подальшої доби дані клітини використовувалися для вимірювання інгібуючої активності відносно споживання метил-a-D-глюкопіранозиду. 3) Вимірювання інгібуючої активності відносно споживання метил-a-D-глюкопіранозиду Після розчинення сполуки, що тестується, в диметилсульфоксиді і розбавлення забезпечуючим поглинання буферним розчином (буферний розчин зі значенням рН=7,4, що містить 140мМ хлориду натрію, 2мМ хлориду калію, 1мМ хлориду кальцію, 1мМ хлориду магнію, 5мМ метил-a-D-глюкопіранозиду, 10мМ 2-[4(2-гідроксіетил)-1-піперазиніл]етансульфонової кислоти і 5мМ трис(гідроксиметил)амінометану), кожний розріджувач був використаний як тестовий зразок для вимірювання інгібуючої активності. Після видалення середовища з суспензії клітин COS-7, транзієнтно експресуючих SGLT2 людини, в кожну ямку додавали 200мкл буферного розчину для попередньої обробки (буферний розчин зі значенням рН=7,4, що містить 140мМ холінхлориду, 2мМ хлориду калію, 1мМ хлориду кальцію, 1мМ хлориду магнію, 10мМ 2-[4-(2пдроксіетил)-1-пшеразиніл]етансульфоновоі кислоти і 5мм трис(гідроксиметил)амінометану) і інкубували клітини при 37°С протягом 10 хвилин. Після видалення буферного розчину для попередньої обробки знов додавали 200мкл того самого буферного розчину і інкубували клітини при 37°С протягом 10 хвилин. Буферний розчин для вимірювань приготовляли шляхом додання 7мкл метил-a-D-(U-14С)глюкопіранозиду (Amersham Pharmacia Biotech) до 525мкл одержаного тестового зразка. Для контролю приготовляли буферний розчин без сполуки, що тестується. Для визначення початкового рівня споживання за відсутності сполуки, що тестується, і натрію схожим шляхом приготовляли буферний розчин для визначення початкового рівня споживання, який містив 140мМ холінхлориду замість хлориду натрію. Після видалення буферного розчину для попередньо обробки в кожну ямку додавали 75мкл буфер у для вимірювання і інкубували клітини при 37°С протягом 2 годин. Після видалення буферного розчину для вимірювання в кожну ямку додавали і негайно видаляли 200мкл промивального буферного розчину (буферний розчин зі значенням рН=7,4, що містить 140мМ холінхлориду, 2мМ хлориду калію, 1мМ хлориду кальцію, 1мМ хлориду магнію, 10мМ метил-a-Dглюкопіранозиду, 10мМ 2-[4-(2-гідроксіетил)-1-піперазиніл]етансульфонової кислоти і 5мМ трис(гідроксиметил)амінометану). Після додаткового двократного промивання клітини солюбілізували шляхом додавання в кожну ямку 75мкл 0,2н гідроксиду натрію. Після перенесення лізату клітин в PicoPlate (Packard) і додання 150мкл MicroScint-40 (Packard) вимірювали радіоактивність за допомогою мікроплашкового сцинтиляційного лічильника TopCount (Packard). За 100% різниці в споживанні приймали величину різниці радіоактивності між початковим рівнем споживання і контролем, і потім, виходячи з кривої залежності інгібування від концентрації, методом найменших квадратів розраховували концентрації, при яких інгібувалося 50% споживання (значення ІС50). Результати представлені в наступній таблиці 2. Таблиця 2 Сполука, що тестується Посилальний приклад 11 Посилальний приклад 12 Посилальний приклад 13 Посилальний приклад 14 Посилальний приклад 15 Посилальний приклад 16 Посилальний приклад 17 Значення ІС 50 (нм) 350 450 140 500 330 370 110 Приклад випробувань 2 Аналіз абсорбційної здатності при пероральному введенні 1) Приготування зразків для вимірювання концентрації ліків після внутрішньовенної ін'єкції в хвостову вен у Як експериментальні тварини використовувалися щури SD (CLEA JAPAN, INC., самці, у віці 5 тижнів, 140170г), які протягом ночі не отримували корму. Для приготування 3,3мг/мл розчину 60мг сполуки, що тестується, суспендували або розчиняли в 1,8мл етанолу і потім розчиняли шляхом додання 7,2мл поліетиленгліколю 400 і 9мл сольового розчину. Щурів зважували і потім внутрішньовенно вводили розчин сполуки, що тестується, в дозі 3мл/кг (10мг/кг) в хвостову вену щурів, що не зазнали наркозу. Вн утрішньовенну ін'єкцію в хвіст здійснювали із застосуванням ін'єкційної голки 26G і шприца на 1мл. Відбір проб крові здійснювали через 2, 5, 10, 20, 30, 60 і 120 хвилин після внутрішньовенної ін'єкції в хвосто ву вену. Кров центрифугували і використовували плазму як зразок для вимірювання концентрації ліків в крові. 2) Приготування зразків для вимірювання концентрації ліків після перорального введення Як експериментальні тварини використовувалися щури SD (CLEA JAPAN, INC., самці, у віці 5 тижнів, 140170г), що не отримували протягом ночі корму. Сполуку, що тестується суспендували або розчиняли в 0,5% розчині натрійкарбоксиметилцелюлози в концентрації 1мг/мл активної форми. Після зважування щурів перорально вводили рідину, що містить описану вище сполуку, що тестується, в дозі 10мл/кг (10мг/кг у вигляді активної форми). Пероральне введення здійснювали за допомогою шлункової трубки для щурів і шприца на 2,5мл. Відбір крові здійснювали через 15, 30, 60, 120 і 240 хвилин після перорального введення. Кров центрифугували і використовували плазму як зразок для вимірювання концентрації ліків в крові. 3) Вимірювання концентрації ліків Як внутрішній стандарт до 0,1мл плазми, одержаної в описаних вище п унктах 1) і 2), додавали 1мкг 2-(4етоксибензил)феніл-b-D-глюкопіранозиду, описаного в посилальному прикладі 15, і потім витягували білки шляхом додання 1мл метанолу. Після центрифугування метанольну фазу упарювали досуха під струменем азоту. Залишок розчиняли в 300мкл рухомої фази і наносили аліквоту розчину (30мкл) для ВЕРХ. Концентрацію ліків в плазмі аналізували за допомогою методу ВЕРХ в наступних умовах. Колонка: Inertsil ODS-2 (4,6´250мм) Рухома фаза: Ацетонітрил/10мМ фосфатний буферний розчин (рН=3,0)=25:75(об./об.) Температура колонки: 50°С Швидкість потоку: 1,0мл/хвилина Довжина хвилі вимірювання: УФ 232нм Після додання 1мкг описаного в посилальному прикладі 15 2-(4-етоксибензил)феніл-b-D-глюкопіранозиду як внутрішній стандарт і кожної концентрації (1,0, 0,5, 0,2, 0,1, 0,05 і 0,02мкг) описаного в посилальному прикладі 11 2-(4-метоксибензил)феніл-b-D-глюкопіранозиду до 0,1мл чистої плазми, проводили схожі з описаними вище маніпуляції і потім будували стандартну криву. Після внутрішньовенної ін'єкції в хвосто ву вену і перорального введення, виходячи з одержаних методом ВЕРХ концентрацій в плазмі в кожний момент часу за допомогою WinNonlin Standard (Pharsight Corporation) визначали площу під кривою часової залежності концентрації сполуки, що тестується, в плазмі крові і потім розраховували біологічну доступність (%) за формулою таким чином. Біологічна доступність (%)= [(площа під кривою часової залежності концентрації сполуки, що тестується, в плазмі крові після перорального введення)/(площа під кривою часової залежності концентрації сполуки, що тестується, в плазмі крові після внутрішньовенної ін'єкції в хвостову вен у)] ´100 Результати представлені в наступній таблиці 3. Таблиця 3 Сполука, що тестується Приклад 1 Приклад 4 Посилальний приклад 11 Біологічна доступність (%) 46 61 15 Приклад випробувань 3 Аналіз ефекту полегшення виведення глюкози з сечею Як експериментальні тварини використовувалися щури SD (SLC Inc., самці, у віці 8 тижнів, 270-320г), що не отримували корму. Сполуку, що тестується суспендували в 0,5% розчині карбоксиметилу і приготовляли 0,3, 1 і 3мг/мл суспензії. Після зважування щурів перорально вводили суспензію, що тестується в дозі 10мл/кг (3, 10 і 30мг/кг). Для контролю перорально вводили тільки 0,5% розчин натрійкарбоксиметилцелюлози в дозі 10мл/кг. Пероральне введення здійснювали за допомогою шлункової трубки для щурів і шприца на 2,5мл. Кількість тварин в групі становила 5 або 6. Сечу збирали в камеру для дослідження метаболізму після закінчення перорального введення. Сечу збирали через 24 години після перорального введення. Після закінчення збору сечі реєстрували об'єм сечі і вимірювали концентрацію глюкози в сечі. Концентрацію глюкози вимірювали за допомогою набору для лабораторного тестування Glucose B-Test WAKO (Wako Pure Chemical Industries, Ltd.). Кількість глюкози, що виділяється за 24 години з сечею на 200 г маси тіла розраховували виходячи з об'єму сечі, концентрації глюкози в сечі і маси тіла. Результати представлені в наступній таблиці 4. Таблиця 4 Сполука, що Доза тестується (мг/кг) Приклад 1 3 10 30 Кількість глюкози, що в иділяється з сечею (мг/24 години ´200г маси тіла) 52 239 513 Приклад випробувань 4 Тест на гостр у токсичність Мишей ICR у віці 4 тижнів (CLEA JAPAN, INC., 22-28г, 5 тварин в кожній групі) годували протягом 4 годин і перорально вводили 60мг/мл суспензію сполуки, що тестується, в 0,5% розчині карбоксиметилцелюлози в дозі 10мл/кг (600мг/кг). Як показано в наступній таблиці 5 через 24 годин після введення летального ефекту не спостерігалося. Таблиця 5 Сполука, що тестується Приклад 1 Число в мерлих тварин 0/5 Промислова застосовність Похідні глюкопіранозилоксибензилбензолу відповідно до даного винаходу, представлені вище загальною формулою І, володіють поліпшеним всмоктуванням при пероральному введенні і можуть володіти відмінною інгібуючою активністю по відношенню до SGLT2 людини шляхом перетворення в похідні глюкопіранозилоксибензилбензолу, представлені вище загальною формулою II, як їх активні форми in vivo після перорального введення. Даний винахід відноситься до засобів для профілактики або лікування захворювання, пов'язаного з гіперглікемією, такого як цукровий діабет, ускладнень цукрового діабету, ожиріння, і тому подібне, які також прийнятні у ви гляді препаративних форм для перорального застосування.
ДивитисяДодаткова інформація
Назва патенту англійськоюGlucopyranosyloxybenzylbenzene derivatives and medicinal compositions containing them
Назва патенту російськоюПроизводные глюкопиранозилоксибензилбензола и лекарственные композиции, которые их содержат
МПК / Мітки
МПК: A61P 43/00, A61K 31/7034, A61P 3/04, A61P 3/10, C07H 15/203
Мітки: глюкопіранозилоксибензилбензолу, похідні, композиції, лікарські, містять
Код посилання
<a href="https://ua.patents.su/12-73606-pokhidni-glyukopiranoziloksibenzilbenzolu-i-likarski-kompozici-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Похідні глюкопіранозилоксибензилбензолу і лікарські композиції, що їх містять</a>
Попередній патент: Електропривід змінного струму
Наступний патент: Спосіб годівлі перепелів
Випадковий патент: Спосіб профілактики післяопераційних ускладнень












