Гідроксііндоли, їх застосування як інгібіторів фосфодіестерази-4 та спосіб їх одержання
Номер патенту: 80567
Опубліковано: 10.10.2007
Автори: Егерланд Уте, Гаспаріч Антьє, Кусс Хільдегард, Гьофген Норберт, Гартенгауер Хельга, Рундфельдт Кріс
Формула / Реферат
1. Сполуки загальної формули 1
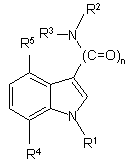 ,
,
де
n - 1 або 2, і
R1 є
(і) -С1-С10-алкіл нормальної або розгалуженої будови, факультативно заміщений одним або кількома з таких замісників: моно-, бі- або трициклічні насичені або моно- або поліненасичені 3-14-членні карбоцикли, причому ці карбоциклічні замісники, у свою чергу, є заміщеними одним або кількома замісниками NO2 та можуть бути факультативно заміщені одним або кількома з таких замісників: С1-С6-алкіл, -ОН, -NH2, -NHC1-С6-алкіл, -N(С1-С6-алкіл)2, -NO2, -CN, -F, -Сl, -Вr, -І, -O-С1-С6-алкіл, -S-С1-С6-алкіл, -SO3Н, - SO2-С1-С6-алкіл, -OSO2-С1-С6-алкіл, -СООН, -(СО)С1-С5-алкіл, -O(СО)С1-С5-алкіл, причому ці алкільні групи при згаданих карбоциклічних замісниках, у свою чергу, можуть бути факультативно заміщені одним або кількома з таких замісників: -ОН, -SH, -NH2, -F, -Сl, -Вr, -І, -SO3Н, -СООН;
R2 та R3
(і) кожний, незалежно від іншого, є атом водню або С1-С5-алкіл, факультативно заміщений одним або кількома з таких замісників: -ОН, -SH, -NH2, -NHC1-С6-алкіл, -N(C1-C6-алкіл)2, -NO2, -CN, -F, -Сl, -Вr, -І, -О-С1-С6-алкіл, -S-С1-С6-алкіл, -феніл, -піридил,
- феніл,
факультативно заміщений одним або кількома з таких замісників: -С1-С3-алкіл, -ОН, -SH, -NH2, -NHC1-С3-алкіл, -N(С1-С3-алкіл)2, -NO2, -CN, -СООН, -СООС1-С3-алкіл, -F, -Сl, -Вr, -І, -O-С1-С3-алкіл, -S-C1-С3-алкіл, -O(СО)С1-С3-алкіл,
- піридил,
факультативно заміщений одним або кількома з таких замісників: С1-С3-алкіл, -ОН, -SH, -NO2, -CN, -СООН, -СООС1-С3-алкіл, -F, -Сl, -Вr, -І, -O-С1-С3-алкіл, -S-С1-С3-алкіл, -O(СО)С1-С3-алкіл,
причому тільки один із замісників R2 та R3 може бути атомом водню, і алкільні групи при згаданих карбоциклічних та гетероциклічних замісниках, у свою чергу, можуть бути факультативно заміщені одним або кількома з таких замісників: -ОН, -SH, -NH2, -F, -Сl, -Вr, -І, -SO3Н, -СООН, -(СО)С1-С5-алкіл або -O(СО)С1-С5-алкіл; або
(іі) NR2R3 спільно утворюють насичений або ненасичений п'яти- або шестичленний цикл, який може містити до 3 гетероатомів, серед яких перевагу віддають N, О та S, факультативно заміщені одним або кількома з таких замісників: -С1-С3-алкіл, -ОН, -SH, -NO2, -CN, -СООН, -СООС1-С3-алкіл, -F, -Сl, -Вr, -І, -O-С1-С3-алкіл, -S-С1-С3-алкіл та -O(СО)С1-С3-алкіл;
R4 та R5 є -Н або -ОН, причому щонайменше один із цих двох замісників має бути -ОН;
або солі таких сполук формули 1.
2. Сполуки за п. 1 з асиметричним атомом вуглецю у D-формі або в L-формі, або у формі D,L-сумішей, а також, у випадку наявності кількох асиметричних атомів вуглецю, у діастереомерних формах.
3. Сполуки за п. 1 або п. 2, причому n=2.
4. Сполуки за одним із пп. 1-3, причому R4 є -ОН, а R5 є -Н.
5. Сполуки за одним з пп. 1-4, причому -NR2R3 є феніламіногрупа або піридиламіногрупа, заміщена одним або кількома атомами галогенів.
6. Сполуки за одним з пп. 1-4, причому R1 є заміщений бензильний залишок.
7. Сполуки за п. 6, причому згаданий бензильний залишок має щонайменше один замісник при бензильному циклі в орто-положенні.
8. Сполука за одним із пп. 1-7:
амід N-(3,5-дихлорпіридин-4-іл)-[1-(3-нітробензил)-7-гідроксііндол-3-іл]-гліоксилової кислоти,
та її фізіологічно прийнятні солі.
9. Спосіб одержання сполук за п. 1, де n=1, який відрізняється тим, що індол-3-карбонові кислоти формули 2
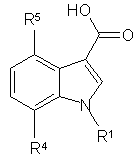 2
2
дією хлорангідридів кислот перетворюють в аналогічні хлорангідриди індол-3-карбонових кислот формули 3
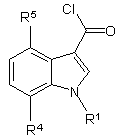 3,
3,
які шляхом проведення реакції з первинними або вторинними амінами перетворюють у відповідні аміди і шляхом відщеплення захисної групи одержують у вільній формі сполуки формули 1, де n=1.
10. Спосіб за п. 9, який відрізняється тим, що як хлорангідриди кислот для синтезу хлорангідридів індол-3-карбонових кислот формули 3
 3
3
застосовують тіонілхлорид або оксалілхлорид.
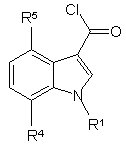
11. Спосіб за п. 9 або п. 10, який відрізняється тим, що реакцію хлорангідридів індол-3-карбонових кислот формули 3
 3
3
з первинними або вторинними амінами проводять у присутності допоміжної основи, за варіантом, якому віддають перевагу, у присутності надлишку аміну, з яким проводять реакцію, третинного аміну, наприклад, піридину або триетиламіну, а також неорганічних основ, за варіантом, якому віддають перевагу, гідроксидів або гідридів лужних металів.
12. Спосіб одержання сполук формули 1 за п. 1, де n=2, який відрізняється тим, що індоли формули 4
 4
4
дією оксалілхлориду перетворюють в аналогічні хлорангідриди індол-3-ілгліоксилових кислот формули 5
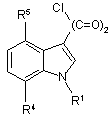 5,
5,
які шляхом проведення реакції з первинними або вторинними амінами перетворюють у відповідні аміди і шляхом відщеплення захисної групи одержують у вільній формі сполуки формули 1, де n=2.
13. Спосіб за п. 12, який відрізняється тим, що реакцію хлорангідридів індол-3-ілгліоксилових кислот формули 5
 5
5
з первинними або вторинними амінами проводять у присутності допоміжної основи, за варіантом, якому віддають перевагу, у присутності надлишку аміну, з яким проводять реакцію, третинного аміну, наприклад, піридину або триетиламіну, а також неорганічних основ, за варіантом, якому віддають перевагу, гідроксидів або гідридів лужних металів.
14. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, при яких терапевтично корисним є інгібування фосфодіестерази-4.
15. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, пов'язаних із впливом еозинофілів.
16. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, пов'язаних із впливом нейтрофілів.
17. Лікарський засіб, який містить одну або кілька сполук за пп. 1-8, а також звичайні фізіологічно прийнятні носії та/або розріджувачі або допоміжні речовини.
18. Спосіб виготовлення лікарського засобу за п. 17, який відрізняється тим, що одну або кілька сполук за одним із пп. 1-8 переробляють спільно зі звичайно уживаними фармацевтичними носіями та/або розріджувачами або іншими допоміжними речовинами у фармацевтичні препарати або, відповідно, надають їм форму, придатну для терапевтичного застосування.
19. Застосування сполук за одним із пп. 1-8 та/або лікарського засобу за п. 17 в комбінації одна/один з одною/одним або в комбінації з іншими фармацевтично активними речовинами.
Текст
1. Сполуки загальної формули 1 2 (19) 1 3 80567 4. Сполуки за одним із пп. 1-3, причому R4 є -ОН, а R5 є -Н. 5. Сполуки за одним з пп. 1-4, причому -NR2R3 є феніламіногрупа або піридиламіногрупа, заміщена одним або кількома атомами галогенів. 6. Сполуки за одним з пп. 1-4, причому R 1 є заміщений бензильний залишок. 7. Сполуки за п. 6, причому згаданий бензильний залишок має щонайменше один замісник при бензильному циклі в орто-положенні. 8. Сполука за одним із пп. 1-7: амід N-(3,5-дихлорпіридин-4-іл)-[1-(3-нітробензил)7-гідроксііндол-3-іл]-гліоксилової кислоти, та її фізіологічно прийнятні солі. 9. Спосіб одержання сполук за п. 1, де n=1, який відрізняє ться тим, що індол-3-карбонові кислоти формули 2 R5 HO O N 4 11. Спосіб за п. 9 або п. 10, який відрізняється тим, що реакцію хлорангідридів індол-3карбонових кислот формули 3 Cl R5 O N R1 R4 3 з первинними або вторинними амінами проводять у присутності допоміжної основи, за варіантом, якому віддають перевагу, у присутності надлишку аміну, з яким проводять реакцію, третинного аміну, наприклад, піридину або триетиламіну, а також неорганічних основ, за варіантом, якому віддають перевагу, гідроксидів або гідридів лужних металів. 12. Спосіб одержання сполук формули 1 за п. 1, де n=2, який відрізняється тим, що індоли формули 4 R5 R1 R4 2 дією хлорангідридів кислот перетворюють в аналогічні хлорангідриди індол-3-карбонових кислот формули 3 R5 Cl O N R1 R4 3, які шляхом проведення реакції з первинними або вторинними амінами перетворюють у відповідні аміди і шляхом відщеплення захисної групи одержують у вільній формі сполуки формули 1, де n=1. 10. Спосіб за п. 9, який відрізняється тим, що як хлорангідриди кислот для синтезу хлорангідридів індол-3-карбонових кислот формули 3 R5 N Cl O R1 R4 4 дією оксалілхлориду перетворюють в аналогічні хлорангідриди індол-3-ілгліоксилових кислот формули 5 Cl R5 (C=O)2 N R1 R4 5, які шляхом проведення реакції з первинними або вторинними амінами перетворюють у відповідні аміди і шляхом відщеплення захисної групи одержують у вільній формі сполуки формули 1, де n=2. 13. Спосіб за п. 12, який відрізняється тим, що реакцію хлорангідридів індол-3-ілгліоксилових кислот формули 5 Cl R5 (C=O)2 N R4 R1 3 застосовують тіонілхлорид або оксалілхлорид. N R4 R1 5 5 80567 6 з первинними або вторинними амінами проводять у присутності допоміжної основи, за варіантом, якому віддають перевагу, у присутності надлишку аміну, з яким проводять реакцію, третинного аміну, наприклад, піридину або триетиламіну, а також неорганічних основ, за варіантом, якому віддають перевагу, гідроксидів або гідридів лужних металів. 14. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, при яких терапевтично корисним є інгібування фосфодіестерази-4. 15. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, пов'язаних із впливом еозинофілів. 16. Застосування сполук за одним із пп. 1-8 як терапевтично активних речовин для виготовлення лікарських засобів для лікування захворювань, пов'язаних із впливом нейтрофілів. 17. Лікарський засіб, який містить одну або кілька сполук за пп. 1-8, а також звичайні фізіологічно прийнятні носії та/або розріджувачі або допоміжні речовини. 18. Спосіб виготовлення лікарського засобу за п. 17, який відрізняється тим, що одну або кілька сполук за одним із пп. 1-8 переробляють спільно зі звичайно уживаними фармацевтичними носіями та/або розріджувачами або іншими допоміжними речовинами у фармацевтичні препарати або, відповідно, надають їм форму, придатну для терапевтичного застосування. 19. Застосування сполук за одним із пп. 1-8 та/або лікарського засобу за п. 17 в комбінації одна/один з одною/одним або в комбінації з іншими фармацевтично активними речовинами. Цей винахід стосується заміщених 4- або/та 7гідроксііндолів, способів їх одержання, фармацевтичних препаратів, які містять ці сполуки, а також фармацевтичного застосування цих сполук, які є інгібіторами фосфодіестерази-4, як активних речовин для лікування захворювань, на які можна вплинути шляхом інгібування активності фосфодіестерази-4 в імунокомпетентних клітинах (наприклад, макрофагах та лімфоцитах) під впливом сполук за цим винаходом. Активування рецепторів клітинної мембрани трансмітерами спричиняє активацію систем "вторинних месенджерів". Під впливом аденілатциклази з AMP та GMP синтезуються відповідно активний циклічний AMP (cAMP) та циклічний GMP (cGMP). Під впливом цих сполук відбувається, наприклад, релаксація клітин гладких м'язів або інгібування вивільнення або синтезу медіаторів у запальних клітинах. Розклад "вторинних месенджерів" сАМР та cGMP відбувається під впливом фосфодіестераз (PDE). На даний час відомі 11 груп (сімейств) ферментів PDE (PDE1-11), які розрізнюються за специфічністю до субстрату (до сАМР, cGMP або до обох сполук) та з залежністю від інших субстратів (наприклад, від кальмодуліну). Ці ізоферменти виконують в організмі різні функції та експресуються різною мірою в окремих типах клітин [див. Бейво та ін., "Множинні фосфодіестерази циклічних нуклеотидів" BeavoJA. et al., Моl. Pharmacol. 1994, 46:399-405; Холл, "Інгібітори фосфодіестераз, селективні до ізоферментів: потенціальне клінічне застосування" - Hall I.P. Br. J. Clin. Pharmacol. 1993, 35: 1-7]. Внаслідок інгібування різних типів ізоферментів PDE відбувається нагромадження сАМР або cGMP у клітинах, яке можна використати з терапевтичною метою [Торфі та ін., "Нові інгібітори фосфодіестераз для терапії астми" - Torphy T.J. et al., Drug News and Perspectives 1993, 6: 203-214]. У клітинах, які відіграють важливу роль при запаленні (лімфоцитах, соскоподібних клітинах, еозинофільних гранулоцитах, макрофагах) переважаючим типом серед ізоферментів PDE є тип 4 [Торфі та Андем, "Інгібітори фосфодіестераз: нові можливості для терапії астми" - Torphy T.J., Undem B.J., Thorax 1991, 46:512-523]. Тому інгібування PDE-4 відповідними інгібіторами розглядається як важливий захід при лікуванні численних захворювань алергічного походження [Шудт та ін., "Інгібітори фосфодіестераз" - Schudt et al., Phosphodiesterase Inhibitors, Acad. Press London, 1996]. Важливою властивістю інгібіторів фосфодіестерази-4 є інгібування вивільнення αфактора некрозу пухлин (TNF-α) із запальних клітин. TNF-α є важливим запальним цитокіном, який впливає на численні біологічні процеси. TNFα вивільнюється, наприклад, з активованих макрофагів, активованих Т-лімфоцитів, соскоподібних клітин, базофілів, фібробластів, ендотеліальних клітин та астроцитів у мозку. Він викликає ефект аутоактивації нейтрофілів, еозинофілів, фібробластів та ендотеліальних клітин, внаслідок чого вивільнюються різноманітні медіатори, що руйнують клітини. У моноцитах, макрофагах та Т-лімфоцитах TNF-α обумовлює посилене продукування інших запальних цитокінів, наприклад, GM-CSF (фактор стимуляції колоній гранулоцитів-макрофагів) або інтерлейкіну-8. Внаслідок стимулювання запалення та катаболічного впливу TNF-α відіграє вирішальну роль при численних захворюваннях, наприклад, при запаленнях дихальних шля хів, запаленнях суглобів, ендотоксичному шоку, відторгненні тканин, СНІД та багатьох інших захворюваннях імунологічного походження. Таким чином, інгібітори фосфодіестерази-4 є придатними також для лікування таких захворювань, пов'язаних зі впливом TNF-α. 7 80567 Хронічні обструктивні легеневі захворювання (COPD) дуже поширені серед населення, і мають також значний вплив на економіку. Наприклад, у розвинутих країнах захворювання групи COPD обумовлюють приблизно 10-15% загальних витрат на охорону здоров'я, і у США приблизно 25% усіх смертних випадків пов'язано з такими захворюваннями [Норман, "COPD: Нові розробки та терапевтичні можливості" - Norman P., Drug News and Perspectives 11(7), 431-437, 1998]. Проте слід зазначити, що на момент смерті більшість пацієнтів має вік понад 55 років [Нольте, "Хронічний бронхіт - поширене захворювання багатофакторного походження" - Nolte D., Atemw.Lungenkrkh. 20(5), 260-267, 1994]. За оцінками ВОЗ, у найближчі роки COPD посядуть третє місце серед причин смерті за частотою. Клінічна картина хронічних обструктивни х легеневих захворювань (COPD) охоплює різноманітні клінічні картини хронічних бронхітоподібних захворювань із симптомами кашлю та виділення мокротиння, а також прогресивного та незворотного погіршення функції легенів (особливо вражається функція видихання). Перебіг захворювання є епізодичним, і часто ускладнюється бактеріальними інфекціями [Реннард, "COPD: огляд визначень, епідеміологія та фактори впливу на розвиток" - Rennard S.I., Chest, 113(4) Suppl., 235S-241S, 1998]. На протязі захворювання функція легенів постійно погіршується, поступово розвивається емфізема легенів, і у пацієнтів ясно спостерігається задишка. Це захворювання явно впливає на якість життя пацієнтів (задишка, низька витривалість до фізичних навантажень) і значно скорочує очікувану тривалість життя. До основних факторів ризику, окрім факторів довкілля, є куріння [Куммер, "Астма та COPD" - Kummer R, Atemw.-Lungenkrkh. 20(5), 299-302, 1994; Реннард - див. вищезгадане посилання], і тому чоловіків захворювання уражає явно частіше, ніж жінок. Проте у майбутньому слід очікувати зсуву цієї картини внаслідок змін у життєвих звичках та зростання кількості жінок, які курять. Сучасна терапія спрямована тільки на полегшення симптомів без впливу на причини розвитку захворювання. Застосування бета-2агоністів (наприклад, сальметеролу), у відповідних випадках у комбінації з мускаринергічними антагоністами (наприклад, з іпратропіумом), покращує функцію легенів внаслідок розширення бронхів і використовується у широких масштабах (Норман, див. вищезазначене посилання). Значну роль у розвитку COPD відіграють бактеріальні інфекції, які доводиться лікувати антибіотиками [Уїлсон, "Роль інфекцій при COPD" - Wilson R., Chest, 113(4) SuppL, 242S-248S, 1998; Гроссман, "Цінність антибіотиків та наслідки терапії антибіотиками при ускладненнях COPD" Grossman R.F., Chest, 113(4) SuppL, 249S-255S, 1998]. Терапія цього захворювання на даний час є ще незадовільною, особливо з точки зору постійного погіршення функції легенів. Нові терапевтичні підходи, спрямовані проти медіаторів запалення, протеаз або адгезивних сполук, 8 можуть бути дуже перспективними [Барнс, "Хронічне обструктивне захворювання: нові можливості для розроблення ліків" - Barnes P.J., TiPS 10(19), 415-423, 1998]. Незалежно від бактеріальних інфекцій, які ускладнюють захворювання, у бронхах можна виявити хронічне запалення, на яке впливають нейтрофільні гранулоцити. Вважається, що за структурні зміни в дихальних шляха х (емфізему) відповідальними є, поряд з іншими факторами, медіатори та ферменти, які вивільнюються нейтрофільними гранулоцитами. Таким чином, інгібування активності нейтрофільних гранулоцитів є раціональним підходом до профілактики або уповільнення розвитку COPD (погіршення параметрів функції легенів). Важливим стимулятором активації гранулоцитів є запальний цитокін TNF-α (фактор некрозу пухлин). Так, відомо, що TNF-α стимулює утворення кисеньвмісних радикалів у нейтрофільних гранулоцитах [Йєрсманн та ін., "Посилення індукованого ліпополісахаридами продукування кисеньвмісних радикалів у нейтрофілах під впливом TNF-α " - Jersmann H.P.A. et al., Infection and Immunity, 4, 1744-1747, 1998]. Інгібітори PDE-4 здатні з високою ефективністю інгібувати вивільнення TNF-α з різноманітних клітин і, таким чином, пригнічувати активність нейтрофільних гранулоцитів. Неспецифічний інгібітор PDE-4 пентоксифілін здатен інгібувати як утворення кисеньвмісних радикалів, так і фагоцитозну здатність нейтрофільних гранулоцитів [Веніш та ін., "Вплив пентоксифіліну in vitro на продукування реакційноздатного кисню та фагоцитозну здатність нейтрофілів за даними цитометрії в потоці" Wenisch С. et al., Clin. Drug Invest., 13(2): 99-104, 1997]. На цей час відомі різноманітні інгібітори PDE4. У першу чергу мова йде про похідні ксантину, аналоги роліпраму або похідні нітраквазону [огляд подано у роботі Карлссона та Альдоса "Інгібітори фосфодіестерази-4 для лікування астми" Karlsson J.-A., Aldos D., Exp. Opin. Ther. Patents 1997, 7: 989-1003]. Жодну з цих сполук до цього часу не вдалося ввести у клінічну практику. Довелося констатувати, що відомі інгібітори PDE-4 виявляють побічні впливи, наприклад, нудоту та блювання, яким до цього часу не вдавалося ефективно протидіяти. Тому необхідним є віднайдення нових інгібіторів PDE-4 з покращеним терапевтичним діапазоном. Аміди індол-3-ілгліоксилової кислоти та способи їх одержання вже багаторазово описані. У всіх випадках індоли, не заміщені у положенні 3, синтезовані шляхом заміщення наявних на ринку індолів у положенні 1, шляхом реакції з галогенангідридами щавлевої кислоти перетворюють у галогенангідриди індол-3ілгліоксилової кислоти, які потім шляхом реакції з аміаком або з первинними чи вторинними амінами перетворюють у відповідні аміди індол-3ілгліоксилової кислоти (Схема 1). 9 80567 Х=галоген Так, [у патентах США №2,825,734 та №3,188,313] описано різноманітні аміди індол-3ілгліоксилової кислоти, одержані за Схемою 1. Ці сполуки застосовують як проміжні продукти для одержання похідних індолу, які утворюються при відновленні. Аміди індол-3-ілгліоксилової кислоти описано також [у патенті США №3,642,803]. [У журналі Farmaco 22 (1967), 229-244], описано одержання амідів 5-метоксііндол-Зілгліоксилової кислоти. В цьому разі застосовану похідну індолу також вводять у реакцію з оксалілхлоридом, і одержаний хлорангідрид індол3-ілгліоксилової кислоти вводять у реакцію з аміном. Крім того, аміди індол-3-ілгліоксилової кислоти та способи їх одержання розкрито [в патенті США №6,008,231]. За цим патентом також використовують представлені на Схемі 1 стадії та умови реакцій. Похідні 4- або 7-гідроксііндолів не описані. Заміщені аміди 5-гідроксііндоліл-гліоксилової кислоти та 6-гідроксі-індоліл-гліоксилової кислоти, а також способи їх одержання та їх застосування як інгібіторів PDE-4 вперше описано [у заявці на патент DE 198 18 964 А1]. Проте похідні 4- або 7-гідроксііндолів, їх одержання та застосування не описані. Цей винахід стосується заміщених гідроксііндолів загальної формули 1 де n може дорівнювати 1 або 2, і (і) –С1-С10-алкіл нормальної або розгалуженої будови, факультативно заміщений одним або кількома такими замісниками: -ОН, -SH, -NH2, -NHС1-С6алкіл, -N(С1-С6-алкіл)2, -NHС6-С14-арил, -N(C6-C14арил)2, -N(С1-С6-алкіл)(C6-C14-apил), -NO2, -CN, -F, -Cl, -Br, -I, -O-С1-С6-алкіл, -О-С6-С14-арил, -S-С1-С6алкіл, -S-C6-C14-арил, -SO3H, -SO2С1-С6-алкіл, SО2-С6-С14-арил, -ОSО 2-С1-С6-алкіл, -ОSО2-С6-С14арил, -СООН, -(СО)С1-С5-алкіл, -О(СО)С1-С5-алкіл, моно- бі- або трициклічними насиченими або моно- або поліненасиченими 3-14-членними карбоциклами, моно,- бі- або трициклічними насиченими або моно- або поліненасиченими 515-членними гетероциклами, які містять 1-6 10 гетероатомів, серед яких перевагу віддають Ν, Ο та S, причому С6-С14-арили та карбоциклічні та гетероциклічні замісники, у свою чергу, можуть бути факультативно заміщені одним або кількома такими замісниками: С1-С6-алкіл, -ОН, -NH2, NHС1-С6-алкіл, -N(С1-С6-алкіл)2, -NO2, -CN, -F, -СІ, Вr, -І, -О-С1-С6-алкіл, -S-С1-С6-алкіл, -SO3H, -SО2С1-С6-алкіл, -ОSО2-С1-С6-алкіл, -СООН, -(СО)С1С5-алкіл, -О(СО)С1-С5-алкіл, і причому алкільні групи при згаданих карбоциклічних та гетероциклічних замісниках, у свою чергу, можуть бути факультативно заміщені одним або кількома такими замісниками: -ОН, -SH, -NH2, -F, -Cl, -Br, -I, -SO 3H, -СООН; або (іі) моно- або поліненасичений -С2-С10-алкеніл нормальної або розгалуженої будови, факультативно заміщений одним або кількома такими замісниками: -ОН, -SH, -NH2, -NHС1-С6алкіл, -N(С1-С6-алкіл)2, -NHС1-С6-арил, -N(C6-C14арил)2, -N(С1-С6-алкіл)(С6-С14-арил), -NO2, -CN, -F, -СІ, -Вr, -І, -О-С1-С6-алкіл, -О-С6-С14-арил, -S-C1-С6алкіл, -S-С6-С14-арил, -SO3H, -SO2-С1-С6-алкіл, SО2-С6-С14-арил, -ОSО 2-С1-С6-алкіл, -ОSО2-С6-С14арил, -СООН, -(СО)С1-С5-алкіл, -О(СО)С1-С5-алкіл, моно,- бі- або трициклічними насиченими або моно- або поліненасиченими 3-14-членними карбоциклами, моно,- бі- або трициклічними насиченими або моно- або поліненасиченими 515-членними гетероциклами, які містять 1-6 гетероатомів, серед яких перевагу віддають Ν, Ο та S, причому С6-С14-арили та карбоциклічні та гетероциклічні замісники, у свою чергу, можуть бути факультативно заміщені одним або кількома такими замісниками: С1-С6-алкіл, -ОН, -NH2, NHС1-С6-алкіл, -N(С1-С6-алкіл)2, -NO2 , -CN, -F, -Cl, Вr, -І, -О-С1-С6-алкіл, -S-С1-С6-алкіл, -SO3H, -SО2С1-С6-алкіл, -ОSО2-С1-С6-алкіл, -СООН, -(СО)С1C5-алкіл, -О(СО)С1-С5-алкіл, і причому алкільні групи при згаданих карбоциклічних та гетероциклічних замісниках, у свою чергу, можуть бути факультативно заміщені одним або кількома такими замісниками: -ОН, -SH, -NH2, -F, -СІ, -Вr, -І, -SO 3H, -СООН; R2 та R3 (і) кожний, незалежно від іншого, є атом водню або С1-С5-алкіл, факультативно заміщений одним або кількома такими замісниками: -ОН, -SH, -NH2, -NНС1-С6алкіл, -N(С1-С6-алкіл)2, -NO2, -CN, -F, -СІ, -Вr, -І, -ОС1-С6-алкіл, -S-С1-С6-алкіл, -феніл, -піридил, -феніл, факультативно заміщений одним або кількома такими замісниками: -С1-C3-алкіл, -ОН, -SH, -NH2, NНС1-C3-алкіл, -N(С1-C3-алкіл)2, -NO2, -CN, -СООН, -СООС 1-C3-алкіл, -F, -СІ, -Вr, -І, -O-С1-С3-алкіл, -SС1г-C3-алкіл, -О(СО)С1-С3-алкіл, -піридил, факультативно заміщений одним або кількома такими замісниками: С1-C3-алкіл, -ОН, -SH, -NO 2, CN, -СООН, -СООС1-C3-алкіл, -F, -СІ, -Вr, -І, -О-С1C3-алкіл, -S-С1-C3-алкіл, -О(СО)С1-C3-алкіл, причому тільки один із замісників R2 та R3 може бути атомом водню і 11 80567 причому алкільні групи при згаданих карбоциклічних та гетероциклічних замісниках, у свою чергу, можуть бути факультативно заміщені одним або кількома такими замісниками: -ОН, -SH, -NH2, -F, -СІ, -Br, -I, -SO 3H, -СООН, -(СО)С 1-C5алкіл або -О(СО)С1-C5-алкіл, або (іі) NR2R3 спільно утворюють насичений або ненасичений п'яти- або шестичленний цикл, який може містити до 3 гетероатомів, серед яких перевагу віддають Ν, Ο та S, факультативно заміщені одним або кількома такими замісниками: -С1-C3-алкіл, -ОН, -SH, -NO2, -CN, -СООН, -COOС1C3-алкіл, -F, -СІ, -Вr, -І, -О-С1-C3-алкіл, -S-С1-C3алкіл або -О(СО)С1-C3-алкіл, R4 та R5 є -Н або -ОН, причому щонайменше один із цих дво х замісників має бути -ОН. За варіантами, яким віддають перевагу, n у сполуках формули 1 має значення 2. Далі, за варіантами, яким віддають перевагу, R4 має значення ОН, a R5 має значення Н. NR2R3 за варіантами, яким віддають перевагу, означає феніламіногрупу або піридиламіногрупу, заміщену одним або кількома атомами галогенів, наприклад, F, СІ, Вr, І. Доцільно, якщо R1 є заміщеним бензильним залишком, причому замісник при фенільному циклі за варіантами, яким віддають перевагу, стоїть в орто-положенні відносно метиленової групи бензильного залишку. Особлива перевага віддається також сполукам, вказаним в експериментальних прикладах. Далі, винахід стосується фізіологічно толерантних солей сполук формули 1. Фізіологічно толерантні солі одержують звичайним способом, шляхом нейтралізації основ неорганічними або органічними кислотами або нейтралізації кислот неорганічними або органічними основами. Прикладами неорганічних кислот є хлористоводнева кислота, сірчана кислота, фосфорна кислота або бромистоводнева кислота, а прикладами органічних кислот є, наприклад, карбонові, сульфонові кислоти та сульфінові кислоти, наприклад, оцтова кислота, винна кислота, молочна кислота, пропіонова кислота, гліколева кислота, малонова кислота, малеїнова кислота, фумарова кислота, дубильна кислота, бурштинова кислота, альгінова кислота, бензойна кислота, 2-феноксибензойна кислота, 2ацетоксибензойна кислота, корична кислота, мигдалева кислота, лимонна кислота, яблучна кислота, саліцилова кислота, 3-аміносаліцилова кислота, аскорбінова кислота, ембонова кислота, нікотинова кислота, ізонікотинова кислота, щавлева кислота, амінокислоти, метансульфонова кислота, етансульфонова кислота, 2-гідроксіетансульфонова кислота, етан-1,2-дисульфонова кислота, бензолсульфонова кислота, 4метилбензолсульфонова кислота або нафталін-2сульфонова кислота. Прикладами неорганічних основ є гідроксид натрію, гідроксид калію, аміак, а прикладами органічних основ є аміни, причому перевагу віддають третинним амінам, таким, як, наприклад, триметиламін, триетиламін, піридин, Ν,Ν-диметиланілін, хінолін, ізохінолін, α-піколін, βпіколін, g-піколін, хінальдин або піримідин. 12 Крім того, фізіологічно толерантні солі сполук формули І можна одержати шляхом перетворення похідних, які містять третинні аміногрупи, у четвертинні амонієві солі відомим способом із застосуванням кватернізаційних реагентів. Кватернізаційними реагентами можуть бути, наприклад, алкілгалогени, такі, як метилйодид, етилбромід та н-пропілхлорид, але також арилалкілгалогени, наприклад, бензилхлорид або 2-фенілетилбромід. Крім того, цей винахід стосується D-форм, Lформ та D,L-сумішей сполук формули І, які містять асиметричний атом вуглецю, а також, у випадку присутності кількох асиметричних атомів вуглецю, діастереомерних форм. Сполуки формули 1, які містять асиметричні атоми вуглецю і одержуються, як правило, у формі рацематів, можна відомими способами, наприклад, за допомогою оптично активної кислоти, розділити на оптичні ізомери. Можливо також із початку синтезу застосовувати оптично активну вихідну речовину, причому як кінцевий продукт утворюється відповідна оптично активна або діастереомерна сполука. У сполуках за цим винаходом виявлено фармацевтично важливі властивості, які можуть бути використані з терапевтичною метою. Сполуки формули І можна застосовувати поодинці, в комбінаціях двох або більше сполук або у комбінаціях з іншими активними речовинами. Сполуки за цим винаходом є інгібіторами фосфодіестерази-4. Тому предмет винаходу пов'язаний з тим фактом, що сполуки формули 1, а також фармацевтичні препарати, що містять ці сполуки або їхні солі, можна застосовувати для лікування захворювань, при яких корисним є інгібування фосфодіестерази-4. До таких захворювань належать, наприклад, запалення суглобів, в тому числі артрит та ревматоїдний артрит, а також інші захворювання типу артритів, наприклад, ревматоїдний спондиліт та остеоартрит. До інших можливостей застосування належить лікування пацієнтів, які страждають на остеопороз, сепсис, септичний шок, грам-негативний сепсис, синдром токсичного шоку, синдром задишки, астму або інші хронічні легеневі захворювання, наприклад, COPD, захворювання, пов'язані з резорбцією кісток або з реакцією на відторгнення трансплантатів, або на інші автоімунні захворювання, наприклад, червоний вовчак, розсіяний склероз, гломерулонефрит або увеїт, інсуліно-залежний цукровий діабет, а також на хронічну демієлінізацію. Крім того, сполуки за цим винаходом можна застосовувати для лікування інфекцій, наприклад, вірусних та паразитарних інфекцій, наприклад, для лікування малярії, лейшманіозу, зумовленої інфекцією лихоманки, зумовлених інфекцією м'язових болів, СНІД та кахексії, а також неалергічного риніту. Сполуки за цим винаходом можна застосовувати також як бронходилятори та для профілактики астми. Крім того, сполуки формули І є інгібіторами нагромадження еозинофілів та їх активності. 13 80567 Відповідно, сполуки за цим винаходом можна застосовувати також при захворюваннях, в яких певну роль відіграють еозинофіли. До таких захворювань належать, наприклад, запальні захворювання дихальних шляхів, наприклад, бронхіальна астма,алергічний риніт, алергічний кон'юнктивіт, атопічний дерматит, екземи, алергічний ангіїт, опосередковані еозинофілами запалення, наприклад, еозинофільний фасціїт, еозинофільна пневмонія та синдром PIE (легенева інфільтрація з еозинофілією), уртикарія, виразковий коліт, хвороба Крона та проліферативні шкірні захворювання, наприклад, псоріаз або кератоз. Крім того, предмет цього винаходу пов'язаний з тим, що сполуки формули І та їхні солі здатні інгібувати індуковану ліпополісахаридами (LPS) легеневу інфільтрацію нейтрофілів у пацюків in vi vo. Виявлені фармакологічно важливі властивості свідчать, що сполуки формули 1 та їхні солі, а також фармацевтичні препарати, що містять ці сполуки або їхні солі, можна застосовувати з терапевтичною метою для лікування хронічних обструктивних легеневих захворювань. Крім того, сполуки за цим винаходом мають нейропротекторні властивості і можуть застосовуватися для лікування захворювань, при яких корисною є нейропротекція. До таких захворювань належать, наприклад, вікова деменція (хвороба Альцгеймера), втрата пам'яті, хвороба Паркінсона, депресії, нервові напади та переміжна кульгавість. До інших можливостей застосування сполук за цим винаходом належать профілактика та лікування захворювань простати, наприклад, доброякісної гіперплазії простати, полакіурії, ніктурії, а також для лікування нетримання сечі, колік, спричинених каменями у сечовому міхурі, та сексуальних дисфункцій у чоловіків та жінок. Нарешті, сполуки за цим винаходом можна застосовувати для попередження виникнення залежності від лікарських засобів при систематичному вживанні аналгетиків, наприклад, морфіну, а також для обмеження розвитку звикання при систематичному вживанні цих аналгетиків. Для виготовлення лікарських засобів застосовують ефективні дози сполук за цим винаходом або їхніх солей спільно зі звичайними допоміжними речовинами, носіями та домішками. Дози активних речовин можуть варіювати залежно від способу введення в організм, віку та маси тіла пацієнта, типу та тяжкості захворювання, що підлягає лікуванню, та аналогічних факторів. Добова доза може застосовуватися у формі одиничної дози або може бути розділена на дві або кілька часткових доз і становить, як правило, 0,001-100мг. Особливу перевагу віддають добовим дозам у межах від 0,1мг до 50мг. Як лікарські форми можна застосовувати препарати для перорального, парентерального, внутрішньовенного, черезшкірного, місцевого, інгіляційного та назального введення. Особливу перевагу віддають препаратам сполук за цим 14 винаходом для місцевого, інгіляційного та назального введення. Для застосування придатні звичайні форми галенових препаратів, наприклад, таблетки, драже, капсули, порошки для диспергування, грануляти, водні розчини, суспензії на водній або олійній основі, сиропи, соки або краплі. Тверді лікарські форми можуть містити інертні наповнювачі та носії, якими є, наприклад, карбонат кальцію, фосфат кальцію, фосфат натрію, лактоза, крохмаль, маніт, альгінати, желатин, гуарова камедь, стеарат магнію або алюмінію, метилцелюлоза, тальк, високодисперсні кремнієві кислоти, силіконова олія, високомолекулярні жирні кислоти (наприклад, стеаринова кислота), желатин, агар-агар або жири та олії тваринного або рослинного походження, тверді високомолекулярні полімери (наприклад, поліетиленгліколь); препарати для перорального застосування можуть додатково містити за потребою смакові домішки та/або підсолоджувані. Рідкі лікарські форми можуть бути стерилізованими та/або містити в разі потреби допоміжні речовини, наприклад, консерванти, стабілізатори, загусники, пенетранти, емульгатори, агенти, що сприяють розтіканню, солюбілізатори, солі, цукор або цукроспирти для регулювання осмотичного тиску або як буферні сполуки та/або регулятори в'язкості. Такими домішками є, наприклад, тартратні та цитратні буфери, етанол, комплексоутворювачі (наприклад, етилендіамінтетраоцтова кислота та її нетоксичні солі). Для регулювання в'язкості можна використовува ти високомолекулярні полімери, до яких належать, наприклад, рідкий поліетиленоксид, мікрокристалічні целюлози, карбоксиметилцелюлози, полівінілпіролідони, декстрани або желатини. Твердими носіями є, наприклад, крохмаль, лактоза, маніт, метилцелюлоза, тальк, високодисперсні кремнієві кислоти, високомолекулярні жирні кислоти (наприклад, стеаринова кислота), желатин, агарагар, фосфат кальцію, стеарат магнію, тверді високомолекулярні полімери (наприклад, поліетиленгліколь). Суспензії на олійнійоснові для парентерального або місцевого застосування можуть містити природні, синтетичні або напівсинтетичні олії, якими є, наприклад, рідкі складні ефіри жирних кислот з 8-22 атомами вуглецю у ланцюгу жирної кислоти, наприклад, пальмітинової, лауринової, тридеканової, маргаринової, стеаринової, арахінової, міристинової, бегенової, пентадеканової, лінолевої, елаідинової, брасидинової, ерукової або олеїнової кислоти, естерифіковані одно-, -дво- або трьохатомними спиртами з 1-6 атомами вуглецю, якими є, наприклад, метанол, етанол, пропанол, бутанол, пентанол або їхні ізомери, гліколь або гліцерин. До таких складних ефірів жирних кислот належать, наприклад, наявні на ринку мігліоли, ізопропілміристат, ізопропілпальмітат, ізопропілстеарат, ПЕГ-6-капринова кислота, складні ефіри каприлової та капринової кислот із насиченими жирними спиртами, 15 80567 поліоксіетиленглікольтриолеати, етилолеат, воскоподібні складні ефіри жирних кислот, наприклад, штучний жир куприкової залози качок, ізопропіловий складний ефір жирних кислот кокосової олії, олеїловий складний ефір олеїнової кислоти, дециловий складний ефір олеїнової кислоти, етиловий складний ефір молочної кислоти, дибутилфталат, діізопропіловий складний ефір адипінової кислоти, складні ефіри поліолів із жирними кислотами тощо. Для цієї мети придатними є також силіконові олії різної в'язкості або жирні спирти, наприклад, ізотридециловий спирт, 2-октилдодеканол, цетилстеариловий спирт або олеїловий спирт, жирні кислоти, наприклад, олеїнова кислота. Крім того, можна застосовувати природні олії, якими є, наприклад, рицинова олія, мигдалева олія, оливкова олія, кунжутна олія, бавовняна олія, арахісова олія або соєва олія. Як розчинники, гелеутворювачі та солюбілізатори можна застосовувати воду або розчинники, що змішуються з водою. До них належать спирти, наприклад, етанол або ізопропіловий спирт, бензиловий спирт, 2октилдодеканол, поліетиленгліколі, фталати, адипінати, пропіленгліколь, гліцерин, ди- або трипропіленгліколь, воски, метилцелозольв, целозольв, складні ефіри, морфолін, діоксан, диметилсульфоксид, диметилформамід, тетрагідрофуран, циклогексанон тощо. Як плівкоутворювачі можна застосовувати прості ефіри целюлози, які розчиняються або набухають як у воді, так і в органічних розчинниках, наприклад, гідроксипропілметилцелюлозу, метилцелюлозу, етилцелюлозу або розчинні різновиди крохмалю. Можливі також змішані форми між гелеутворювачами та плівкоутворювачами. У цьому зв'язку слід згадати передусім іонні макромолекули, прикладами яких є натрієва карбоксиметилцелюлоза, поліакрилова кислота, поліметакрилова кислота та їхні солі, натрійамілопектин-напівгліколят, альгінова кислота або пропіленглікольальгінат у формі натрієвої солі, гуміарабік, ксантанова камедь, гуарова камедь або карагінан. Прикладами подальших допоміжних речовин для лікарських препаратів є гліцерин, парафіни різної в'язкості, триетаноламін, колаген, алантоїн, новантизолова кислота. Для виготовлення лікарських препаратів можуть виявитися необхідними також поверхневоактивні речовини, емульгатори або змочувачі, наприклад, лаурилсульфат натрію, сульфа ти простих ефірів жирних спиртів, динатрій-N-лаурилβ-імінодипропіонат, поліоксіетилована рицинова олія або сорбітан-моноолеат, сорбітанмоностеарат, полісорбати (наприклад, Твій (Tween)), цетиловий спирт, лецитин, гліцеринмоностеарат, поліоксіетилен-стеарат, полігліколевий простий ефір алкілфенолу, хлорид цетилтриметиламонію або моноетаноламінові солі моно/діалкілполігліколь-складний ефірортофосфорної кислоти. При виготовленні бажаних препаратів можна застосовувати також стабілізатори для стабілізації емульсій, наприклад, монтморілоніти або колоїдні кремнієві кислоти, 16 або агенти, що запобігають розкладу активної речовини, наприклад, антиоксиданти, як-от токофероли або бутилгідроксіанізол, або консерванти, наприклад, складні ефіри п-гідроксибензойної кислоти. Препарати для парентерального застосування можуть виготовлятися у формі окремих дозованих одиниць, наприклад, ампул або флаконів. Перевагу віддають застосуванню розчинів активних речовин, за варіантом, якому віддають перевагу, водних розчинів і, передусім, ізотонічних розчинів, але застосовуються також суспензії. Ці препарати для ін'єкцій можна виготовляти у формі готових препаратів або підготовляти для застосування шляхом змішування активної сполуки, наприклад, ліофілізованої, факультативно з домішками твердих носіїв, із бажаним розчинником або середовищем для суспендування безпосередньо перед застосуванням. Препарати для назального застосування можна виготовляти у формі олійних розчинів або суспензій на водній чи олійній основі. Вони можуть бути виго товлені також у формі ліофілізатів, які перед застосуванням змішують із бажаним розчинником або середовищем для суспендування. Виготовлення, фасування та герметизацію препаратів виконують у відомих антимікробних та асептичних умовах. Крім того, винахід стосується способів одержання сполук за цим винаходом. Згідно з винаходом, сполуки загальної формули 1, де R1, R2, R3, R4, R5 відповідають поданим вище визначенням і n=1 1 одержують шляхом перетворення карбонових кислот формули 2 індол-3 2 з тим самим значенням R1, де R4 та R5 є -Н, -OR6, причому щонайменше один з останніх дво х замісників має бути гр упою OR6, і R6 є захисна або відщеплювана група, зокрема, алкіл, циклоалкіл, арилалкіл, арил, гетероарил, ацил, алкоксикарбоніл, арилоксикарбоніл, амінокарбоніл, N-заміщений амінокарбоніл, силіл, сульфоніл, а також комплексоутворююча група, наприклад, сполука борної кислоти, фосфорної кислоти, а також 17 80567 ковалентно або координаційно зв'язаний метал, наприклад, цинк, алюміній або мідь, відомим способом за допомогою хлорангідридів кислот, серед яких перевагу віддають тіонілхлориду або оксалілхлориду, спочатку в аналогічні хлорангідриди індол-3карбонових кислот формули 3. 3 З виділених хлорангідридів індол-3карбонових кислот формули 3 потім одержують шляхом проведення реакції з первинними або вторинними амінами сполуки загальної формули І, де R1, R2, R3 відповідають поданим вище визначенням і n=1, а значення R4 та R5 відповідають визначенням, поданим при описі формул 2 і 3. Перевагу віддають проведенню реакції у присутності допоміжної основи. Як допоміжні основи можна застосовувати надлишок аміну, з яким проводять реакцію, третинний амін, за варіантом, якому віддають перевагу, піридин або триетиламін, а також неорганічні основи, за варіантом, якому віддають перевагу, гідроксиди або гідриди лужних металів. Сполуки формули 1 за цим винаходом одержують у вільній формі шляхом відщеплення присутньої у замісниках R4 та/або R5 6 відщеплюваної групи R . Для відщеплення замісника -R6 використовують як кислоти, так і основи, наприклад, бромистоводневу, хлористоводневу або йодистоводневу кислоти чи відповідно гідроксид натрію, гідроксид калію, а також карбонат натрію або калію, а також активуючі кислоти Льюїса, наприклад, АІСІ3, BF3, ВВr 3 або LiCl. Реакція відщеплення відбувається у відсутності або у присутності додаткових активаторів, наприклад, етан-1,2-дитіолу або бензилмеркаптану, а також шляхом розщеплення простого ефіру за допомогою водню при підвищеному або нормальному тиску у присутності відповідних каталізаторів, наприклад, паладієвих або іридієвих каталізаторів. За цим винаходом, сполуки загальної формули І, де R1, R 2, R3 відповідають поданим вище визначенням і n=2 1 одержують формули 4 шляхом перетворення індолів 18 4 з тим самим значенням R1, де R4 та R5 є -Н, -OR6, причому щонайменше один з останніх дво х замісників має бути гр упою OR6, і R6 є захисна або відщеплювана група, зокрема, алкіл, циклоалкіл, арилалкіл, арил, гетероарил, ацил, алкоксикарбоніл, арилоксикарбоніл, амінокарбоніл, N-заміщений амінокарбоніл, силіл, сульфоніл, а також комплексоутворююча група, наприклад, сполука борної кислоти, фосфорної кислоти, а також ковалентно або координаційно зв'язаний метал, наприклад, цинк, алюміній або мідь, відомим способом шляхом ацилювання оксалілхлоридом спочатку в аналогічні хлорангідриди індол-3-іл-гліоксилових кислот формули 5. 5 З виділених хлорангідридів індол-3-ілгліоксилових кислот формули 5 потім одержують шляхом проведення реакції з первинними або вторинними амінами сполуки загальної формули 1, де R1, R2, R3 відповідають поданим вище визначенням і n=2, а значення R4 та R5 відповідають визначенням, поданим при описі формул 4 і 5. Перевагу віддають проведенню реакції у присутності допоміжної основи. Як допоміжні основи можна застосовувати надлишок аміну, з яким проводять реакцію, третинний амін, за варіантом, якому віддають перевагу, піридин або триетиламін, а також неорганічні основи, за варіантом, якому віддають перевагу, гідроксиди або гідриди лужних металів. Сполуки формули І за цим винаходом одержують у вільній формі шляхом відщеплення присутньої у замісниках R4 та/або R5 6 відщеплюваної групи R . Для відщеплення замісника -R6 використовують як кислоти, так і основи, наприклад, бромистоводневу, хлористоводневу або йодистоводневу кислоти чи відповідно гідроксид натрію, гідроксид калію, а також карбонат натрію або калію, а також активуючі кислоти Льюїса, наприклад, АІСІ3, BF3, ВВr 3 або LiCl. Реакція відщеплення відбувається у відсутності або у присутності додаткових активаторів, наприклад, етан-1,2-дитіолу або бензилмеркаптану, а також шляхом розщеплення простого ефіру за допомогою водню при підвищеному або нормальному тиску у присутності відповідних каталізаторів, наприклад, паладієвих або іридієвих каталізаторів. 19 80567 Приклади Приклад 1: Одержання аміду N-(3,5дихлорпіридин-4-іл)-[1-(4-фторбензил)-4гідроксііндол-3-іл]-карбонової кислоти Цей приклад ілюструє спосіб одержання сполук за цим винаходом формули І, де n=1. 3,22г 4-бензилокси-1-(4-фторбензил)-індол-3карбонової кислоти (8,6ммоль) суспендували у 15мл дихлорметану. При охолодженні водою додавали 1,8мл оксалілхлориду (17,4ммоль). Реакційну суміш перемішували протягом 8 год. При цьому випадав в осад кристалічний хлорангідрид 4-бензилокси-1-(4-фторбензил)індол-3-карбонової кислоти. Продукт відділяли і розчиняли у 18мл тетрагідрофурану (THF). 1,14г гідриду натрію (60%) суспендували у 21мл THF. При перемішуванні при температурі приблизно 10°С додавали краплями розчин 1,5г 4аміно-3,5-дихлорпіридину (8,6ммоль) у 21мл THF. Приблизно через 15хв. додавали до реакційної суміші краплями попередньо приготований розчин хлорангідриду 4-бензилокси-1-(4-фторбензил)індол-3-карбонової кислоти. Потім суміш нагрівали зі зворотним холодильником протягом 3год. Після охолодження додавали до реакційної суміші 36мл етилового складного ефіру оцтової кислоти та 36мл води. Розділяли фази, і промивали органічну фазу водою. Розчинник видаляли дистиляцією, залишок перекристалізовували з етанолу і сушили. Одержаний таким чином амід N-(3,5дихлорпіридин-4-іл)-[4-бензилокси-1-(4фторбензил)-4-гідроксііндол-3-іл]-карбонової кислоти розчиняли в 100мл дихлорметану. Нагрівали розчин до кипіння, і додавали краплями розчин 1мл ВВr3 у 10мл дихлорметану. Після цього суміш нагрівали зі зворотним холодильником при перемішуванні протягом 3год. Після охолодження до 10°С додавали 100мл 1Μ розчину NaHCO3, причому досягалося значення рН 8-9. При цьому слід підтримувати температуру нижче за 20°С. Перемішували суміш ще протягом 3год. Продукт, що кристалізувався, відділяли фільтруванням із відсмоктуванням, промивали водою і сушили. Неочищений продукт перекристалізовували з етанолу. Вихід: 1,4г (37,8% теоретичного). Т.пл. Приклад 2: Одержання аміду N-(3,5дихлорпіридин-4-іл)-[1-(4-хлорбензил)-7гідроксішдол-3-іл]-гліоксилової кислоти Цей приклад ілюструє спосіб одержання сполук за цим винаходом формули 1, де n=2. 5,9г 7-бензилокси-1-(4-хлорбензил)-індолу (17ммоль) розчиняли у 50мл третбутилметилового простого ефіру. При температурі 0°С додавали краплями при перемішуванні розчин 2,6мл оксалілхлориду (30ммоль) у 10мл третбутилметилового простого ефіру. Потім суміш нагрівали зі зворотним холодильником протягом 2 год. Видаляли розчинник дистиляцією у вакуумі. Одержаний хлорангідрид 7-бензилокси-1-(4хлорбензил)-індол-3-іл-гліоксилової кислоти у вигляді твердого залишку суспендували у 50мл тетрагідрофурану (THF). 20 До суспензії 2,7г гідриду натрію у 80мл THF при температурі -5°С додавали краплями розчин 2,77г 4-аміно-3,5-дихлорпіридину (17ммоль) у 20мл THF. Суміші давали нагрітися при перемішуванні до 20°С протягом 1год. Потім додавали краплями при температурі приблизно 0°С попередньо приготовану суспензію хлорангідриду 7-бензилокси-1-(4-хлорбензил)індол-3-іл-гліоксилової кислоти. Після цього реакційну суміш нагрівали зі зворотним холодильником протягом 4 год. Видаляли розчинник у вакуумі. Одержаний залишок розмішували у 50мл етилового складного ефіру оцтової кислоти та 50мл води. Розділяли фази. Органічну фаз у промивали водою. Розчинник видаляли дистиляцією у вакуумі. Залишок перекристалізовували з ізопропанолу. Одержаний таким чином амід N-(3,5дихлорпіридин-4-іл)-[7-бензилокси-1-(4хлорбензил)-індол-3-іл]-гліоксилової кислоти розчиняли в 100мл дихлорметану. Нагрівали розчин до кипіння і додавали краплями розчин 1мл ВВr3 у 10мл дихлорметану. Після цього «суміш нагрівали зі зворотним холодильником при перемішуванні протягом 3год. Після охолодження до 10°С додавали 100мл 1Μ розчину NaHCO3, причому досягалося значення рН 8-9. При цьому слід підтримувати температур у нижче 20°С. Перемішували суміш ще протягом 3год. Продукт, що кристалізувався, відділяли фільтруванням із відсмоктуванням, промивали водою і сушили. Неочищений продукт перекристалізовували з етанолу. Вихід: 3,8г (47,5% теоретичного). Т.пл. 245-247°С. Приклад 3: Одержання інших сполук Застосовуючи описаний вище спосіб, можна одержати численні інші сполуки формули 1. Деякі з них вказано нижче як приклади. 1 Сполука 1 2 3 4 5 6 7 8 9 10 11 12 13 14 -R1 4-фторбензил4-хлорбензил4-хлорбензил4-фторбензил4-фторбензил2-фторбензил3-нітробензил2,6-дифторбензил2,4-дифторбензил2-хлорбензил2,6-дихлорбензил2-метилбензил2,6-диметилбензил n-гексил -NR2R3 3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно3,5-дихлор-4-піридиламіно 21 15 16 17 18 19 20 21 22 23 24 25 26 27 ізобутилциклопропілметил4-фторбкензил2-фторбензил2-фторбензил4-піридилметил4-фторбензил4-гідроксибензил2-хлор-6-фторбензил2-трифторметил-бензил2-фторбензил2-фторбензил2-карбоксибензил 80567 22 сліпих пробах) визначали Η присутності243-245 у 100мкМ 3,5-дихлор-4-піридиламіно-ОН 2 роліпраму, 3,5-дихлор-4-піридиламіно- і одержані значення 2віднімали від -ОН Η 225-227 результатів випробувань. Η Інкубаційні суміші для 2,6-дихлорфеніламіно-ОН 2 222-224 випробування PDE-4 містили 100мкМ cGMP для 2,6-дихлорфеніламіно-ОН Η 2 228-231 4-піридиламіно-запобігання можливого забруднення PDE-3. -ОН Η 2 309-312 Для сполук -ОН цим Ηвинаходом визначені за 3,5-дихлор-4-піридиламіно2 296-299 значення ІС50 стосовно Η інгібування PDE-4 до піперидил-ОН 2 301-304 лежать у межах -ОН 10-9 Ηдо 10-5 М. Значення від 3,5-дихлор-4-піридиламіно2 225-227 коефіцієнта типів 282-285-5 PDE-3, 3,5-дихлор-4-піридиламіно- селективності відносно 2 -ОН Η та -7 становлять від 100 до 10000. 3,5-дихлор-4-піридиламіно-ОН Η 2 293-296 Приклади результатів випробувань інгібування N-метил-4-піридиламіно- деяких-ОН Η 2 PDE-4 для сполук подано нижче у 298-301 таблиці: 2,6-диметил-4-піридил-аміно-ОН Η 2 293-295 3,5-дихлор-4-піридиламіно- Інгібування PDE-4, IC 2 [мкмоль/л] -ОН Η 305-308 Сполука Сполуки за цим винаходом є сильними інгібіторами фосфодіестерази-4. їхній терапевтичний потенціал можна оцінити, наприклад, шляхом визначення ступеня інгібування астматичної реакції пізньої фази (еозинофілії) in vivo, a також інгібування індукованої LPS нейтрофіли у пацюків. Приклад 4: Інгібування фосфодіестерази-4 Активність PDE-4 визначали з використанням препаратів ферменту з поліморфно-ядерних лімфоцитів (PMNL) людини. Людську кров (світлі шари кров'яних згустків) стабілізували цитратом для запобігання згортанню. Шляхом центрифугування при 700´g протягом 20хв. при кімнатній температурі (RT) відділяли від еритроцитів та лейкоцитів збагачену тромбоцитами плазму у вигляді надосадової рідини. PMNL для визначення PDE-4 виділяли шляхом осадження декстраном із подальшим градієнтним центрифугуванням із застосуванням Ficoll-Paque. Після дворазового промивання клітин залишкові еритроцити лізували доданням 10мл гіпотонічного буфера (155мМ NH4Cl, 10мМ NaHCO3, 0,1мМ EDTA, рН7,4) на протязі 6хв. при 4°С. PMNL, які залишалися ще інтактними, промивали ще двічі PBS і лізували за допомогою ультразвуку. Надосадову рідину після центрифугування протягом 1год. при 48000´g і температурі 4°С, яка містила цитозольну фракцію PDE-4, використовували для визначення PDE-4. Активність фосфодіестерази визначали модифікованим методом фірми Amersham Pharmacia Biotech за процедурою випробування SPA (сцинтиляційним випробуванням спорідненості). Реакційні суміші містили буфер (50мМ Трис-НСl, р 7,4, 5мМ MgCl2, 100мкМ cGMP), випробовувані інгібітори у різних концентраціях та відповідний препарат ферменту. Реакцію ініціювали доданням субстрату - 0,5мкМ [3Н]сАМР. Кінцевий об'єм сумішей становив 100 мкл. Випробовувані речовини додавали у формі вихідних розчинів у DMSO. Об'ємна концентрація DMSO у реакційних сумішах становила 1%. Такі концентрації DMSO не впливають на активність PDE. Після ініціювання реакції доданням субстрату проби інкубували при 37°С протягом 30хв. Доданням визначеної кількості гранул для SPA реакцію припиняли, і через 1год. вимірювали радіоактивність проб за допомогою беталічильника. Неспецифічну активність ферменту (у 50 2 4 5 6 7 8 15 16 17 22 0,002 0,938 0,015 0,001 0,002 0,002 0,020 0,030 0,141 0,003 Приклад 5: Інгібування пізньої фази еозинофілі! через 48год. після інгаляційної провокації овальбуміном у активно сенсибілізованих норвезьких бури х пацюків Інгібування легеневої інфільтрації еозинофілів під впливом сполук за цим винаходом випробовували на самцях норвезьких бурих пацюків із масою тіла 200-250г, активно сенсибілізованих до овальбуміну (OVA). Сенсибілізацію виконували шляхом підшкірних ін'єкцій кожній тварині у 1-й, 14-й та 21-й дні досліду суспензії 10мкг OVA з 20мг гідроксиду алюмінію як підсилювача у 0,5мл фізіологічного сольового розчину. Крім того, у ті самі моменти часу тваринам вприскували внутрішньоочеревинно по 0,25мл розведеної вакцини Bordetella pertussis. На 28-й день досліду тварин поодинці вміщували у плексигласові бокси місткістю 1л, з'єднані з пристроєм для експозиції голови та носа. Тварин піддавали впливу аерозолю 1,0% суспензії овальбуміну (провокація алергеном). Аерозоль овальбуміну одержували за допомогою розпилювача, що працював на стисненому повітрі (0,2МПа) (Bird micro nebulizer, виріб фірми Palm Springs, CA USA). Тривалість експозиції становила 1год., причому контрольних тварин піддавали впливу аерозолю 0,9% розчину хлориду натрію також протягом 1год. Через 48год. після провокації алергеном мала місце масивна імміграція еозинофільних гранулоцитів у легені тварин. У цей момент часу тварин анастезували надлишковою дозою етилуретану (1,5г/кг маси тіла внутрішньоочеревинно) і виконували бронхоальвеолярне промивання (BAL) балансованим розчином Ганка (Hank) (3´4мл). Потім за допомогою автоматичного приладу для диференціації клітин (Bayer Diagnostics Technicon HIE) визначали загальну кількість клітин та 23 80567 кількість еозинофільних гранулоцитів у зібраній промивній рідині після BAL. Для кожної тварини розраховували кількість еозинофілів (EOS) у рідині після BAL у мільйонах на тварину: EOS/мкл´ кількість рідини BAL(мл)=EOS/тварину. У кожному досліді обробляли паралельно дві контрольні групи (оброблення розпиленим фізіологічним розчином та оброблення розпиленим розчином OVA). Ступінь інгібування еозинофілів (у процентах) для дослідної групи тварин, які одержували випробовуван у речовину, розраховували за формулою {[(OVAC-SC)-(OVAD-SC)]/(OVAC-SC)}´100%=% інгібування (SC - тварини контрольної групи, оброблені носієм і провоковані 0,9% розчином хлориду натрію; OVAC - тварини контрольної групи, оброблені носієм і провоковані 1,0% суспензією овальбуміну; OVAD - тварини дослідної групи, оброблені випробовуваною речовиною і провоковані 1,0% суспензією овальбуміну). Випробовувані сполуки вводили тваринам внутрішньоочеревинно або перорально у формі суспензії в 10% поліетиленгліколі-300 та 0,5% 5гідроксі-етилцелюлозі за 2год. до провокації алергеном. Контрольним групам вводили носій способом, який відповідав способу введення випробовуваної сполуки. Сполуки за цим винаходом інгібують еозинофілію пізньої фази після внутрішньоочеревинного введення у дозі 10мг/кг на 30-100%, а після перорального введення у дозі 30мг/кг - на 30-75%. Таким чином, сполуки за цим винаходом особливо придатні для виготовлення лікарських засобів для лікування захворювань, які пов'язані зі впливом еозинофілів. Приклад 6: Інгібування індукованої ліпополісахаридами (LPS) легеневої нейтрофіли у пацюків Льюїса Інгібування легеневої інфільтрації нейтрофілів під впливом сполук за цим винаходом випробовували на самцях пацюків Льюїса з масою тіла 250-300г. В день досліду тварин поодинці вміщували у плексигласові бокси місткістю 1л, з'єднані з пристроєм для експозиції голови та носа. Тварин піддавали впливу аерозолю суспензії ліпополісахаридів (100мкг LPS/мл 0,1% розчину гідроксиламіну) у PBS (провокація LPS). Аерозоль LPS/гідроксиламіну одержували за допомогою розпилювача, що працював на стисненому повітрі (0,2МПа) (Bird micro nebulizer, виріб фірми Palm Springs, CA USA). Тривалість експозиції становила 40хв., причому контрольних тварин піддавали впливу аерозолю 0,1% розчину гідроксиламіну також протягом 40хв. Через 6год. після провокації LPS мала місце максимальна масивна імміграція нейтроофільних гранулоцитів у легені тварин. У цей момент часу тварин анастезували надлишковою дозою етилуретану (1,5г/кг маси тіла внутрішньоочеревинно), і виконували бронхоальвеолярне промивання (BAL) балансованим розчином Ганка (Hank) (3´4мл). 24 Потім за допомогою автоматичного приладу для диференціації клітин (Bayer Diagnostics Technicon HIE) визначали загальну кількість клітин та кількість нейтрофільних гранулоцитів у зібраній промивній рідині після BAL. Для кожної тварини розраховували кількість нейтрофілів (NEUTRO) у рідині після BAL у мільйонах на тварину: NEUTRO/мкл´кількість рідини BAL(мл)=NEUTRO/тварину. У кожному досліді обробляли паралельно дві контрольні групи (оброблення розпиленим розчином гідроксиламіну в PBS та оброблення розпиленим розчином 100мкг LPS/мл 0,1% розчину гідроксиламіну у PBS). Ступінь інгібування нейтрофілів (у процентах) для дослідної групи тварин, які одержували випробовувану речовину, розраховували за формулою {[(LPSC-SC)-(LPSD-SC)]/(LPSC-SC)}´100%=% інгібування SC - тварини контрольної групи, оброблені носієм і провоковані 0,1% розчином гідроксиламіну; LPSC - тварини контрольної групи, оброблені носієм і провоковані LPS (100мкг/мл 0,1% розчину гідроксиламіну); LPSD - тварини дослідної групи, оброблені випробовуваною речовиною і провоковані LPS (100мкг/мл 0,1% розчину гідроксиламіну). Випробовувані сполуки вводили тваринам у формі суспензії в 10% поліетиленгліколі-300 та 0,5% 5-гідроксіетилцелюлозі за 2год. до провокації LPS. Контрольним групам вводили носій способом, який відповідав способу введення випробовуваної сполуки. Сполуки за цим винаходом інгібують нейтрофілію після перорального введення у дозі 1мг/кг на 30-90% і тому особливо придатні для виготовлення лікарських засобів для лікування захворювань, які пов'язані зі впливом нейтрофілів.
ДивитисяДодаткова інформація
Назва патенту англійськоюThe hydroxyindoles, their use as inhibitors of phosphodiesterase-4 and method for production thereof
Автори англійськоюKUSS HILDEGARD, Egerland, Ute, Hartenhauer Khelha, Hasparich
Назва патенту російськоюГидроксииндолы, их применение как ингибиторов фосфодиэстеразы-4 и способ их получения
Автори російськоюКусс Хильдегард, Гартенгауер Хельга, Гаспарич
МПК / Мітки
МПК: A61P 11/00, C07D 209/22, C07D 209/42
Мітки: інгібіторів, фосфодіестерази-4, спосіб, застосування, одержання, гідроксііндоли
Код посилання
<a href="https://ua.patents.su/12-80567-gidroksiindoli-kh-zastosuvannya-yak-ingibitoriv-fosfodiesterazi-4-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Гідроксііндоли, їх застосування як інгібіторів фосфодіестерази-4 та спосіб їх одержання</a>
Попередній патент: Вітродвигун
Наступний патент: Заглибний теплообмінний апарат енергетичної установки морського технічного засобу
Випадковий патент: Спосіб друкування малюнків на канві для вишивання












