Аміди антранілової кислоти та їх застосування як інгібіторів vegf рецептора тирозинкінази, спосіб їх одержання, фармацевтична композиція на їх основі
Формула / Реферат
1. Амід антранілової кислоти формули І
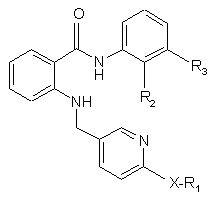 , (I)
, (I)
де R1 представляє Н або нижчий алкіл, R2 представляє Н або нижчий алкіл, R3 представляє перфторований нижчий алкіл, і Х є О або S, або його N-оксид або таутомер, або сіль такого аміду антранілової кислоти, його N-оксиду або його таутомеру.
2. Амід антранілової кислоти формули І за п. 1, який відрізняється тим, що R1 представляє Н або нижчий алкіл, R2 представляє Н або нижчий алкіл, R3 представляє трифторометил, і Х є О, або його N-оксид або таутомер, або сіль такого аміду антранілової кислоти, його N-оксиду або його таутомеру.
3. Амід антранілової кислоти формули І за п. 1, який відрізняється тим, що R1 представляє Н або метил, R2 представляє Н або метил, R3 представляє трифторометил, і Х є О, або його таутомер, або сіль такого аміду антранілової кислоти або його таутомеру.
4. Амід антранілової кислоти формули І за п. 1 вибраний з гідрохлоридної солі 2-[[6-метокси-3-піридил]метил]аміно-N-[3-(трифторометил)феніл]бензаміду, 2-[[6-метокси-3-піридил]метил]аміно-N-[2-метил-3-(трифторометил)феніл]бензаміду, 2-[[(1,6-дигідро-6-оксо-3-піридил)метил]аміно]-N-[3-(трифторометил)феніл]бензаміду і 2-[[(1,6-дигідро-6-оксо-3-піридил)метил]аміно]-N-[2-метил-3-(трифторометил)феніл]-бензаміду, або його N-оксид або таутомер, або сіль такого аміду антранілової кислоти, його N-оксиду або його таутомеру.
5. Амід антранілової кислоти формули I за будь-яким з пп. з 1 по 4 або його N-оксид або таутомер, або фармацевтичнo прийнятна сіль такої сполуки для застосування у лікуванні організму людини або тварин.
6. Застосування аміду антранілової кислоти формули І, де радикали та символи мають значення, визначені у п. 1, або його N-оксиду або таутомеру, або фармацевтичнo прийнятної солі такої сполуки, для одержання фармацевтичного продукту для лікування неопластичної хвороби.
7. Застосування аміду антранілової кислоти формули І, де радикали та символи мають значення, визначені у п. 1, або його N-оксиду або таутомеру, або фармацевтичнo прийнятної солі такої сполуки, для одержання фармацевтичного продукту для лікування ретинопатії або вікової дегенерації жовтої плями.
8. Спосіб лікування неопластичної хвороби, що реагує на інгібування активності VEGF-рецепторної тирозинкінази, що передбачає введення аміду антранілової кислоти формули І або його N-оксиду або його таутомеру, або фармацевтичнo прийнятної солі такого аміду антранілової кислоти, його N-оксиду або його таутомеру, де радикали та символи мають значення, визначені у п. 1, у кількості, ефективній проти вищезгаданої хвороби, теплокровній тварині, яка потребує такого лікування.
9. Фармацевтична композиція, яка містить амід антранілової кислоти формули І за будь-яким з пп. з 1 по 4, або його N-оксид або таутомер, або фармацевтичнo прийнятну сіль такої сполуки, або її гідрат або сольват, та принаймні один фармацевтичнo прийнятний носій.
10. Спосіб одержання аміду антранілової кислоти формули І
 , (I)
, (I)
де R1 представляє нижчий алкіл, і решта символів R2 та R3 є такими, як визначено у п. 1, який відрізняється тим, що сполуку формули II
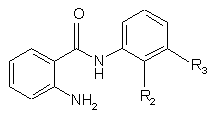 , (II)
, (II)
де R2 та R3 є такими, як визначено для сполуки формули І, піддають реакції з карбонільною сполукою формули III
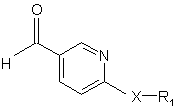 , (III)
, (III)
де Х представляє О або S, і R1 є нижчим алкілом, у присутності відновника, де вихідні сполуки формули II та III також можуть бути присутні з функціональними групами у захищеній формі, якщо необхідно, і/або у формі солей, за умови наявності солеутворювальної групи та можливості реакції у формі солі, де будь-які захисні групи у захищеній похідній сполуки формули І є видаленими, і, якщо потрібно, доступну сполуку формули І перетворюють на іншу сполуку формули І або її N-оксид, вільну сполуку формули І перетворюють на сіль, доступну сіль сполуки формули І перетворюють на вільну сполуку або іншу сіль і/або суміш ізомерних сполук формули І відокремлюють в окремі ізомери.
Текст
1. Амід антранілової кислоти формули І C2 2 (19) 1 3 77446 для застосування у лікуванні організму людини або тварин. 6. Застосування аміду антранілової кислоти формули І, де радикали та символи мають значення, визначені у п.1, або його N-оксиду або таутомеру, або фармацевтичнo прийнятної солі такої сполуки, для одержання фармацевтичного продукту для лікування неопластичної хвороби. 7. Застосування аміду антранілової кислоти формули І, де радикали та символи мають значення, визначені у п.1, або його N-оксиду або таутомеру, або фармацевтичнo прийнятної солі такої сполуки, для одержання фармацевтичного продукту для лікування ретинопатії або вікової дегенерації жовтої плями. 8. Спосіб лікування неопластичної хвороби, що реагує на інгібування активності VEGFрецепторної тирозинкінази, що передбачає введення аміду антранілової кислоти формули І або його N-оксиду або його таутомеру, або фармацевтичнo прийнятної солі такого аміду антранілової кислоти, його N-оксиду або його таутомеру, де радикали та символи мають значення, визначені у п.1, у кількості, ефективній проти вищезгаданої хвороби, теплокровній тварині, яка потребує такого лікування. 9. Фармацевтична композиція, яка містить амід антранілової кислоти формули І за будь-яким з пп. з 1 по 4, або його N-оксид або таутомер, або фармацевтичнo прийнятну сіль такої сполуки, або її гідрат або сольват, та принаймні один фармацевтичнo прийнятний носій. 10. Спосіб одержання аміду антранілової кислоти формули І O N H NH 4 де R1 представляє нижчий алкіл, і решта символів R2 та R3 є такими, як визначено у п. 1, який відрізняється тим, що сполуку формули II O N H R3 (II) R2 NH2 , де R2 та R3 є такими, як визначено для сполуки формули І, піддають реакції з карбонільною сполукою формули III O H N (III) X R1 , де Х представляє О або S, і R1 є нижчим алкілом, у присутності відновника, де вихідні сполуки формули II та III також можуть бути присутні з функціональними групами у захищеній формі, якщо необхідно, і/або у формі солей, за умови наявності солеутворювальної групи та можливості реакції у формі солі, де будь-які захисні групи у захищеній похідній сполуки формули І є видаленими, і, якщо потрібно, доступну сполуку формули І перетворюють на іншу сполуку формули І або її N-оксид, вільну сполуку формули І перетворюють на сіль, доступну сіль сполуки формули І перетворюють на вільну сполуку або іншу сіль і/або суміш ізомерних сполук формули І відокремлюють в окремі ізомери. R3 R2 (I) N X-R1 , Винахід стосується нових похідних амідів антранілової кислоти, способів їх одержання, їх застосування у процесі лікування організму людини або тварин, їх застосування — окремо або в комбінації з однією або кількома іншими фармацевтично активними сполуками — для лікування, головним чином, неопластичної хвороби, такої як пухлинна хвороба, ретинопатії та вікової дегенерації жовтої плями; способу лікування такої хвороби у тварин, зокрема, у людини, та застосування такої сполуки — окремо або в комбінації з однією або кількома іншими фармацевтично активними сполуками — для виробництва фармацевтичної композиції (медикаменту) для лікування неопластичної хвороби, ретинопатії або вікової дегенерації жовтої плями. Відомо, що деякі хвороби пов’язані з дерегульованим ангіогенезом, наприклад, хвороби, викликані очною неоваскуляризацією, такі як ретинопатія (включаючи діабетичну ретинопатію), вікова дегенерація жовтої плями, псоріаз, гемангіобластома, гемангіома, артеріосклероз, запальні хвороби, такі як ревматоїдні або ревматичні запальні хвороби, зокрема, артрит, такий як ревматоїдний артрит, або інші хронічні запальні порушення, такі як хронічна астма, артеріальний або посттрансплантаційний атеросклероз, ендометріоз, і особливо, неопластичні хвороби, наприклад, так звані солідні пухлини та рідкі пухлини (такі як лейкемія). Центральне місце у мережі, яка регулює ріст і диференціацію судинної системи та її компонентів під час ембріонального розвитку, нормального росту та багатьох патологічних аномалій та хво 5 роб, посідає ангіогенний фактор, відомий як "Судинний ендотеліальний фактор росту" (VGEF), димерний, дисульфідно зв’язаний 46 кДа глікопротеїн, разом з його клітинними рецепторами [Breier G. et al. // Trends in Cell Biology. – 1996. – 6. P. 454-456]. VEGF-рецептори є трансмембранними рецепторними тирозинкіназами. Відомі різні типи VEGFрецепторів, наприклад, VEGFR-1, VEGFR-2 та VEGFR-3. Багато з людських пухлин, зокрема, гліоми та карциноми, мають високий рівень експресії VEGF та його рецепторів. Звідси виникла гіпотеза, згідно з якою VEGF, який вивільнюється клітинами пухлин, може стимулювати ріст кровоносних капілярів та проліферацію ендотелію пухлин паракринним шляхом, а отже, через поліпшене кровопостачання, прискорює ріст пухлин. Пряме свідчення ролі VEGF як фактора ангіогенезу пухлин in vivo було отримано за результатами досліджень, у яких активність VEGF інгібувалася антитілами. Ангіогенез вважають абсолютною передумовою для пухлин, які виростають до розмірів, які перевищують максимальний діаметр приблизно 12мм; до цієї межі кисень та поживні речовини можуть постачатися до пухлинних клітин шляхом дифузії. Три основні механізми відіграють важливу роль в активності інгібіторів ангіогенезу проти пухлин: 1) інгібування росту судин, головним чином, капілярів, у васкуляризовані пухлини, в результаті чого чистий ріст пухлин припиняється завдяки балансові, який досягається між апоптозом та проліферацією; 2) запобігання міграції пухлинних клітин завдяки відсутності кровотоку до пухлин і з них; і 3) інгібування проліферації ендотеліальних клітин, таким чином, уникаючи ефекту стимуляції паракринного росту, який справляється на навколишню тканину ендотеліальними клітинами, які зазвичай вкривають судини. У [WO, 00/27820] описано сполуки, які належать до класу амідів антранілової кислоти, про які відомо, що ці сполуки інгібують активність VEGFрецепторної тирозинкінази, ріст пухлин та залежну від VEGFl проліферацію клітин. Несподівано було виявлено, що описані нижче похідні амідів антранілової кислоти формули I мають сприятливі фармакологічні властивості і інгібують, наприклад, активність VEGF-рецепторної тирозинкінази, ріст пухлин та залежну від VEGFl проліферацію клітин. Похідні амідів антранілової кислоти формули I є придатними, наприклад, для застосування у лікуванні хвороб, головним чином, хвороб, для лікування та профілактики яких сприятливий вплив виявляє інгібування ангіогенезу та/або VEGFрецепторної тирозинкінази. Винахід стосується амідів антранілової кислоти формули I, їх N-оксидів та таутомерів, а також солей таких амідів антранілової кислоти, їх Nоксидів та їх таутомерів. 77446 6 (I) кіл; де: R1 - представляє H або нижчий алкіл; R2 - представляє H або нижчий алкіл; R3 - представляє перфторований нижчий ал X - O або S. Вжиті вище та нижче загальні терміни в оптимальному варіанті у контексті опису мають нижченаведені значення, якщо не вказано іншого: "Нижчий" означає радикал, який має щонайбільше 7, краще — щонайбільше 4 атомів вуглецю, причому дані радикали є або лінійними, або розгалуженими з одним або кількома відгалуженнями. Якщо вжито форму множини для сполук, солей і т.ін., це також означає одну сполуку, сіль і т.ін. Будь-які асиметричні атоми вуглецю (наприклад, у сполуках формули I, де R9 є нижчим алкілом) можуть бути присутні у (R)-, (S)- або (R,S)конфігурації, в оптимальному варіанті — у (R)- або (S)-конфігурації. Таким чином, сполуки можуть бути присутні у формі сумішей ізомерів або чистих ізомерів, в оптимальному варіанті — як енантіомер-чисті діастереомери. Винахід також стосується можливих таутомерів сполук формули I. Вжитий авторами термін "таутомери" стосується, зокрема, сполук формули I, де R1 представляє H, і X є O або S, і ці сполуки також, певною мірою, якщо не повністю, існують у показаній нижче таутомерній формі (I - таутомер), де інші радикали та символи мають визначені авторами значення. (I - Таутомер) В оптимальному варіанті втілення алкіл має не більше 12 атомів вуглецю і, як правило, є нижчим алкілом. Нижчий алкіл в оптимальному варіанті є алкілом, що має від 1 до 7 включно, в оптимальному варіанті — від 1 до 4 включно, і є лінійним або розгалуженим; в оптимальному варіанті нижчий алкіл є бутилом, таким як n-бутил, втор-бутил, ізобутил, трет-бутил, пропілом, таким як n-пропіл або ізопропіл, етилом або, в оптимальному варіанті — метилом. Вжитий авторами термін "перфторований нижчий алкіл" означає алкільний радикал, у якому всі атоми водню заміщено атомами фтору. Галоген є, як правило, фтором, хлором, бромом або йодом, краще — фтором, хлором або бромом. 7 Такі солі утворюються, наприклад, як кислі адиційні солі, в оптимальному варіанті — з органічними або неорганічними кислотами, зі сполук формули I з атомом азоту основи, які є особливо фармацевтично прийнятними солями. Прийнятними неорганічними кислотами є, наприклад, галоїдоводневі кислоти, такі як соляна кислота, сірчана кислота, або фосфорна кислота. Прийнятними органічними кислотами є, наприклад, карбонова, фосфонова, сульфонова або сульфамінова кислоти, наприклад, оцтова кислота, пропіонова кислота, каприлова кислота, капринова кислота, додеканова кислота, гліколева кислота, молочна кислота, фумарова кислота, бурштинова кислота, адипінова кислота, пімелінова кислота, суберинова кислота, азелаїнова кислота, яблучна кислота, винна кислота, лимонна кислота, амінокислоти, такі як глутамінова кислота або аспарагінова кислота, малеїнова кислота, гідрокси-малеїнова кислота, метилмалеїнова кислота, циклогексанкарбонова кислота, адамантанкарбонова кислота, бензойна кислота, саліцилова кислота, 4аміносаліцилова кислота, фталева кислота, фенілоцтова кислота, мигдалева кислота, корична кислота, метан- або етан-сульфонова кислота, 2гідроксіетансульфонова кислота, етан-1,2дисульфонова кислота, бензолсульфонова кислота, 2-нафталінсульфонова кислота, 1,5-нафталіндисульфонова кислота, 2-, 3або 4метилбензолсульфонова кислота, метилсірчана кислота, етилсірчана кислота, додецилсірчана кислота, N-циклогексилсульфамінова кислота, Nметил-, N-етил- або N-пропіл-сульфамінова кислота, або інші органічні протонні кислоти, такі як аскорбінова кислота. Для виділення та очищення також можна застосовувати фармацевтично неприйнятні солі, наприклад, пікрати або перхлорати. Для терапевтичного застосування, використовують лише фармацевтично прийнятні солі або вільні сполуки (у відповідних випадках — у формі фармацевтичних композицій), і тому їм віддають перевагу. З огляду на близьку спорідненість між новими сполуками у вільній формі та сполуками у формі солей, включаючи солі, які можуть бути використані як проміжні сполуки, наприклад, при очищенні або виявленні нових сполук, будь-яке посилання на вільні сполуки, яке міститься вище або нижче, слід розуміти також як посилання на відповідні солі, які можуть бути прийнятними і доцільними. Сполуки формули I та їх N-оксиди мають цінні фармакологічні властивості, як описано вище та нижче. Ефективність сполук згідно з винаходом як інгібіторів активності VEGF-рецепторної тирозинкінази може бути продемонстрована таким чином: Випробування активності щодо VEGFрецепторної тирозинкінази. Випробування здійснюють, застосовуючи Flt-1 VEGF-рецепторну тирозинкіназу. Детальна процедура є такою: 30мкл розчину кінази (10нг кіназного домену Flt-1 [Shibuya et al. // Oncogene. – 1990. – 5. - P. - 519524]) у 20мM Tris . HCI, pH 7,5, 3мM дихлориду марганцю (MnCI2), 3мM хлориду магнію (MgCI2), 10мкM ванадату натрію, 0,25мг/мл поліетиленглі 77446 8 колю (PEG) 20000, 1мM дитіотреїтолу та 3мкг/мкл полі(Glu,Tyr) 4:1 (Sigma, Buchs, Швейцарія), 8мкM [33P]-ATP (0,2мкКі), 1% диметилсульфоксиду та від 0 до 100мкM випробуваної сполуки інкубують разом протягом 10хв. при кімнатній температурі. Після цього реакцію припиняють шляхом додавання 10мкл 0,25M етилендіамінтетраацетату (EDTA), pH 7. Застосовуючи багатоканальний розподільник (LAB SYSTEMS, USA), аліквотну кількість 20мкл наносять на PVDF (=полівінілдифторидну) мембрану Immobilon P (Millipore, USA), пропускають через трубопровід мікротитрувального фільтра Millipore, сполучений з вакуумом. Після повного видалення рідини мембрану послідовно промивають 4 рази у ванні, що містить 0,5% фосфорної кислоти (H3PO4) і один раз етанолом, інкубують протягом 10хв. щоразу зі збовтуванням, потім закріплюють на Hewlett Packard TopCount Manifold і вимірюють радіоактивність після додавання 10мкл Microscint® (рідини для -сцинтиляційного лічильника). Значення IC50 визначають шляхом аналізу лінійної регресії відсотка інгібування для кожної сполуки у трьох концентраціях (як правило 0,01, 0,1 та 1мкмоль). Значення IC50, які можуть бути виявлені для сполук формули I, тримаються у межах від 0,001 до 1мкM, в оптимальному варіанті — у межах від 0,001 до 0,1мкM. Протипухлинна ефективність сполук винаходу може бути продемонстрована in vivo таким чином: In vivo активність у моделях мишей без шерстного покриву з ксенотрансплантатами: самиць мишей без шерстного покриву BALB/c віком 8-12 тижнів (Novartis Animal Farm, Sisseln, Швейцарія) тримають у стерильних умовах з водою та їжею ad libitum. Утворення пухлин викликають або шляхом підшкірної ін’єкції мишам пухлинних клітин (наприклад, лінії клітин карциноми передміхурової залози Du 145 [ATCC No. HTB 81; Cancer Research. 1978. - 37. – P. 4049-58]), або шляхом пересадження фрагментів пухлин (приблизно 25мг) підшкірно у лівий бочок миші, застосовуючи голку троакар 13 розміру під анестезією Forene® (Abbott, Швейцарія). Лікування випробуваною сполукою розпочинають, коли пухлина досягає середнього об’єму 100мм3. Ріст пухлин вимірюють від двох до трьох разів на тиждень і через 24год. після останнього застосування шляхом визначення довжини двох перпендикулярних осей. Об’єми пухлин розраховують згідно з опублікованими способами [Evans et al. // Brit. J. Cancer. - 1982. - 45. – P. 466468]. Протипухлинну ефективність визначають як середнє збільшення об’єму пухлин підданих лікуванню тварин, ділене на середнє збільшення об’єму пухлин нелікованих (контрольних) тварин і, після множення на 100, виражають як T/C%. Регресію пухлини (виражену в %) вказують як найменший середній об’єм пухлин відносно середнього об’єму пухлин на початку лікування. Випробувану сполуку вводять щоденно. В альтернативному варіанті таким самим способом також застосовують інші лінії клітин, наприклад: - лінію клітин аденокарциноми молочної залози MCF-7 [ATCC No. HTB 22; J. Natl. Cancer Inst.. (Bethesda). – 1973. – 51. – P. 1409-1416]; 9 - лінію клітин аденокарциноми молочної залози MDA-MB 468 [ATCC No. HTB 132; In Vitro. – 1978. – 14. – P. 911-915]; - лінію клітин аденокарциноми молочної залози MDA-MB 231 [ATCC No. HTB 26; J. Natl. Cancer Inst. (Bethesda). – 1974. – 53. – P. 661-674]; - лінію клітин карциноми товстої кишки Colo 205 [ATCC No. CCL 222; Cancer Res. – 1978. – 38. – P. 1345-1355]; - лінію клітин карциноми товстої кишки HCT 116 [ATCC No. CCL 247; Cancer Res. – 1981. – 41. – P. 1751-1756]; - лінію клітин карциноми передміхурової залози DU 145 [ATCC No. HTB 81; Cancer Res. – 1978. – 37. – P. 4049-4058]); - лінію клітин карциноми передміхурової залози PC-3 [ATCC No. CRL 1435; Cancer Res. – 1980. – 40. – P. 524-534]. Інгібування викликаного VEGF автофосфорилування KDR-рецептора може бути підтверджене ще одним in vitro експериментом у клітинах: трансфіковані клітини CHO, які постійно експресують VEGF-рецептор людини (KDR), висівають у повному культуральному середовищі (з 10% ембріональної телячої сироватки = FCS) у 6-лункових планшетах для культур клітин і інкубують при 37°C в атмосфері 5% CO2, доки не спостерігається приблизно 80% конфлюентності. Сполуки, які підлягають випробуванню, після цього розводять у культуральному середовищі (без FCS, з 0,1% альбуміну сироватки великої рогатої худоби) і додають до клітин. (Контрольні зразки включають середовище без випробуваних сполук). Після двогодинного інкубування при 37°C додають рекомбінантний VEGF; кінцева концентрація VEGF становить 20нг/мл). Після додаткового п’ятихвилинного інкубування при 37°C клітини двічі промивають крижаним PBS (фосфатно-буферним розсолом) і відразу розчиняють у 100мкл лізисного буфера на лунку. Лізати після цього центрифугують для видалення ядер клітин і визначають концентрацію білка у надосадовій рідині, застосовуючи комплект для аналізу серійного виробництва (BIORAD). Лізати після цього відразу використовують або, у разі необхідності, зберігають при -20°C. Аналіз сендвіч-ELISA здійснюють для вимірювання фосфорилування KDR-рецептора: моноклональне антитіло до KDR [наприклад, Mab 1495.12.14; одержане H. Towbin] іммобілізують на чорних ELISA-планшетах (OptiPlate™ HTRF-96 від Packard). Планшети після цього промивають і решту вільних сайтів зв’язування білка насичують 1% BSA у PBS. Лізати клітин (20мкг білка на лунку) після цього інкубують у цих планшетах до наступного дня при 4°C разом з антитілом проти фосфотирозину, з’єднаним з лужною фосфатазою (PY20:AP від Transduction Laboratories). Планшети знову промивають і після цього демонструють зв’язування антитіла проти фосфотирозину з захопленим фосфорилованим рецептором, застосовуючи люмінесцентний AP-субстрат (CDP-Star, готовий до застосування, з Emerald II; TROPIX). Люмінесценцію вимірюють у сцинтиляційному лічильнику Packard Top Count Microplate Scintillation Counter (Top Count). Різниця між сигналом позити 77446 10 вного контролю (стимульованим VEGF) та сигналом негативного контролю (не стимульованим VEGF) відповідає викликаному VEGF фосфорилуванню KDR-рецептора (=100%). Активність випробуваних речовин розраховують як % інгібування викликаного VEGF фосфорилування KDRрецептора, причому концентрацію речовини, яка викликає половину максимального інгібування, визначають як ED50 (ефективна доза для 50% інгібування). Сполука формули I або її N-оксид різною мірою інгібує й інші тирозинкінази, які беруть участь у трансдукції сигналу і опосередковуються трофічними факторами, наприклад, кінази з групи Src, головним чином, c-Src кіназу, Lck та Fyn; а також кінази групи EGF, наприклад, c-erbB2 кіназу (HER2), c-erbB3 кіназу c-erbB4 кіназу; рецепторну кіназу інсуліноподібного фактора росту (IGF-1 кіназу), головним чином, кінази, що належать до групи PDGF-рецепторних тирозинкіназ, такі як PDGFрецепторна кіназа, CSF-1-рецепторна кіназа, Kitрецепторна кіназа та VEGF-рецепторна кіназа; а також серин/треонін кінази, усі з яких відіграють свою роль у регуляції росту та трансформації у клітинах ссавців, включаючи клітини людини. За результатами цих досліджень сполука формули I згідно з винаходом виявляє терапевтичну ефективність, зокрема, проти порушень, які залежать від протеїнкінази, головним чином, проліферативних хвороб. Корисність сполуки формули I у лікуванні артриту як типової запальної ревматичної або ревматоїдної хвороби може бути продемонстрована таким чином: Загальновідому модель щура з ад’ювантним артритом [Pearson // Proc. Soc. Exp. Biol. - 1956. – 91. – P. 95-101] використовують для випробування протиартритної активності сполук формули I або їх солей. Ад’ювантний артрит лікують, застосовуючи два різні режими дозування: або (i) починаючи з часу імунізації ад’ювантом (профілактичне дозування); або з 15 дня після виникнення артритичної реакції (терапевтичне дозування). В оптимальному варіанті застосовують режим терапевтичного дозування. Для порівняння інгібітор циклооксигенази2, такий як 5-бромо-2-(4-фторофеніл)-3-[4(метилсульфоніл)феніл]тіофен або диклофенак, вводять в окремій групі. Отже, самцям щурів Вістара (5 тварин на групу, масою приблизно 200г, отриманих від Iffa Credo, Франція) роблять i.d. (внутрішньошкірну) ін’єкцію в основу хвоста, застосовуючи 0,1мл мінеральної олії, що містить 0,6мг ліофілізованої умертвленої під дією високої температури бактерії Mycobacterium tuberculosis. Щурів лікують випробуваною сполукою (3, 10 або 30мг/кг перорально раз на день) або дають наповнювач (воду) з 15 дня по 22 день (режим терапевтичного дозування). Наприкінці експерименту набрякання заплюсневих суглобів вимірюють за допомогою штангенциркуля. Відсоток інгібування набрякання лап розраховують шляхом порівняння з артритичними тваринами, які отримували наповнювач (0% інгібування) та нормальними тваринами, які отримували наповнювач (100% інгібування). 11 За результатами цих досліджень сполука формули I несподівано виявилася придатною для лікування запальних (головним чином, ревматичних або ревматоїдних) хвороб. Завдяки їхній ефективності як інгібіторів активності VEGF-рецепторної тирозинкінази, сполуки формули I, насамперед, інгібують ріст кровоносних судин, а отже є ефективними, наприклад, проти багатьох хвороб, пов’язаних з дерегульованим ангіогенезом, головним чином, хвороб, викликаних очною неоваскуляризацією, зокрема, ретинопатій, таких як діабетична ретинопатія або вікова дегенерація жовтої плями, псоріазу, гемангіобластоми, такої як гемангіома, проліферативних порушень мезангіальних клітин, таких як хронічні або гострі хвороби нирок, наприклад, діабетична нефропатія, злоякісного нефросклерозу, синдромів тромботичної мікроангіопатії або відторгнення трансплантатів, або запальної хвороби нирок, такої як гломерулонефрит, зокрема, мезангіопроліферативний гломерулонефрит, гемолітично-уремічного синдрому, діабетичної нефропатії, гіпертензивного нефросклерозу, атероми, артеріального рестенозу, аутоімунних хвороб, гострого запалення, фібротичних порушень (наприклад, цирозу печінки), діабету, ендометріоз, хронічна астма, артеріальний або посттрансплантаційний атеросклероз, нейродегенеративних порушень, особливо, неопластичних хвороб, таких як лейкемія, зокрема, гостра лімфобластна лейкемія, гостра мієлоїдна лейкемія та хронічна мієлоїдна лейкемія, та інших "рідких пухлин", зокрема, тих, що експресують ckit, KDR або flt-1, та солідних пухлин, зокрема, раку молочної залози, раку товстої кишки, раку легенів (головним чином, дрібноклітинного раку легенів), раку передміхурової залози або саркоми Капоші. Сполука формули I (або їх N-оксид) інгібує ріст пухлин і є особливо придатною для запобігання метастатичному поширенню пухлин та ростові мікрометастазів. Сполуку формули I вводять окремо або в комбінації з одним або кількома терапевтичними засобами, можлива комбінована терапія має форму незмінних комбінацій або введення сполуки згідно з винаходом та одного або кількох інших терапевтичних засобів, які можуть чергуватися або вводитися незалежно один від одного, або комбінованого введення незмінних комбінацій та одного або кількох інших терапевтичних засобів. Сполуку формули I паралельно або додатково вводять для протипухлинної терапії у комбінації з хіміотерапією, радіотерапією, імунотерапією, хірургічним втручанням, або з їх комбінацією. Довготривала терапія є так само можливою, як і ад’ювантна терапія у контексті методології лікування, як було описано вище. До інших можливих способів лікування належить терапія для підтримання стану пацієнта після регресії пухлини, або навіть хіміопрофілактична терапія, наприклад, у підданих ризикові пацієнтів. Терапевтичними засобами для можливого комбінування є, головним чином, одна або кілька цитостатичних або цитотоксичних сполук, наприклад, хіміотерапевтичний засіб або кілька засобів, вибраних з групи, яка, крім іншого, включає інгібі 77446 12 тор біосинтезу поліаміну, інгібітор протеїнкінази, головним чином, серин/треонін протеїнкінази, такої як протеїнкіназа C, або тирозин протеїнкінази, такої як рецепторна тирозинкіназа фактора росту епідермісу, цитокіну, регулятора негативного росту, такого як TGF-B або IFN-B, інгібітор ароматази, інгібітор взаємодії SH2 домену з фосфорилованим білком, антиестрогени, інгібітори топоізомерази I, інгібітори топоізомерази II, активні агенти мікротрубочок, алкілуючі агенти, протипухлинні антиметаболіти, сполуки платини, інші антиангіогенні сполуки, агоністи гонадореліну, антиандрогени, бісфосфонати та трастузумаб. У групах оптимальних сполук формули I та їх N-оксидів, згаданих нижче, можуть бути використані замісники зі згаданих вище загальних визначень, наприклад, для заміни більш загальних визначень більш конкретними визначеннями або визначеннями, які характеризуються тим, що їм віддають перевагу; Крім того, винахід стосується застосування сполуки формули I, у якій радикали та символи мають визначені вище значення, або її N-оксиду або фармацевтично прийнятної солі для одержання фармацевтичного продукту для лікування ретинопатії або вікової дегенерації жовтої плями. Крім того, винахід стосується способу лікування неопластичної хвороби, що реагує на інгібування активності VEGF-рецепторної тирозинкінази, включаючи введення сполуки формули I або її Nоксиду або фармацевтично прийнятної солі, у якій радикали та символи мають визначені вище значення, у кількості, ефективній проти вищезгаданої хвороби, теплокровній тварині, яка потребує такого лікування. Крім того, винахід стосується способу лікування ретинопатії або вікової дегенерації жовтої плями, включаючи введення сполуки формули I або її N-оксиду або фармацевтично прийнятної солі, у якій радикали та символи мають визначені вище значення, у кількості, ефективній проти вищезгаданих хвороб, теплокровній тварині, яка потребує такого лікування. Винахід стосується, зокрема, сполуки формули I, де: R1 - представляє H або нижчий алкіл, R2 - представляє H або нижчий алкіл, R3 - представляє трифторометил, і X є O, її N-оксиду або таутомеру, та солі такої сполуки, її N-оксиду або її таутомеру. В оптимальному варіанті винахід стосується, зокрема, сполуки формули I, де: R1 - представляє H або метил, R2 - представляє H або метил, R3 - представляє трифторометил, і X є O, її таутомеру та солі такої сполуки або її таутомеру. Більш конкретно, перевагу віддають таким сполукам формули I: гідрохлоридна сіль 2-[[6-метокси-3піридил]метил]аміно-N-[3(трифторометил)феніл]бензаміду, 13 77446 2-[[6-метокси-3-піридил]метил]аміно-N-[2метил-3-(трифторометил)феніл] бензамід, 2-[[(1,6-дигідро-6-оксо-3-піридил)метил]аміно]N-[3-(трифторометил) феніл]бензамід і 2-[[(1,6-дигідро-6-оксо-3-піридил)метил]аміно]N-[2-метил-3-(трифторометил)феніл]-бензамід та їх таутомерам, або солі такої сполуки або її таутомерові. Сполуку згідно з винаходом одержують способами, які, хоча раніше й не застосовувалися для нових сполук згідно з даним винаходом, є відомими per se, зокрема, процес, який характеризується тим, що для синтезу сполуки формули I, де R1 представляє нижчий алкіл, і решта символів R2 та R3 є такими, як визначено для сполуки формули I, сполуку формули II (II) де R2 та R3 є такими, як визначено для сполуки формули I, піддають реакції з карбонільною сполукою формули III (III) де X представляє O або S, і R1 є нижчим алкілом, у присутності відновника, де вихідні сполуки формули II та III також можуть бути присутні з функціональними групами у захищеній формі, якщо необхідно, і/або у формі солей, за умови наявності солеутворювальної групи та можливості реакції у формі солі; де будь-які захисні групи у захищеній похідній сполуки формули I є видаленими; і, якщо потрібно, доступну сполуку формули I перетворюють на іншу сполуку формули I або її Nоксид, вільну сполуку формули I перетворюють на сіль, доступну сіль сполуки формули I перетворюють на вільну сполуку або іншу сіль і/або суміш ізомерних сполук формули I відокремлюють в окремі ізомери. Детальний опис відновного алкілування У представленому нижче детальному описі процесу R1, R2, R3 та X є такими, як визначено для сполук формули I, якщо не вказано іншого. Карбонільна сполука формули III також може бути присутня у формі реактивної похідної; однак перевагу віддають вільному альдегідові або кетонові. Реактивними похідними сполук формули III є, наприклад, відповідні бісульфітні адукти або, головним чином, напівацеталі, ацеталі, напівкеталі або кеталі сполук формули III зі спиртами, наприклад, нижчими алканолами; або тіоацеталі або тіокеталі сполук формули III з меркаптанами, наприклад, нижчими алкансульфідами. Відновне алкілування в оптимальному варіанті здійснюють з гідрогенізацією у присутності каталізатора, як правило, каталізатора з благородного металу, такого як платина або паладій, який в оптимальному варіанті зв’язується з матеріалом но 14 сія, таким як вугілля, або каталізатора з важкого металу, такого як нікелевий каталізатор Ренея, в умовах нормального тиску або тиску від 0,1 до 10MПа, або з відновленням за допомогою комплексних гідридів, таких як борогідриди, зокрема, ціаноборогідриди лужних металів, наприклад, ціаноборогідриду натрію, у присутності придатної кислоти, в оптимальному варіанті — відносно слабких кислот, таких як нижчі алканкарбонові кислоти, зокрема, оцтової кислоти або сульфонової кислоти, такої як p-толуолсульфонова кислота; у традиційних розчинниках, наприклад, спиртах, таких як метанол або етанол, або етерах, наприклад, циклічних етерах, таких як тетрагідрофуран, у присутності або за відсутності води. Захисні групи Якщо одна або кілька інших функціональних груп, наприклад, карбокси, гідрокси, аміно, або меркапто, є або мають бути заміщеними у сполуці формул II або III, бо вони не повинні брати участі у реакції, вони є групами, які зазвичай застосовують у синтезі пептидних сполук, а також цефалоспоринів та пеніцилінів, а також похідних нуклеїнових кислот та цукрів. Захисні групи можуть бути присутніми вже у попередниках і повинні захищати відповідні функціональні групи від небажаних вторинних реакцій, таких як ацилювання, етерифікація, естерифікація, окиснення, сольволіз, та інших подібних реакцій. Характерним для захисних груп є те, що вони легко, тобто без небажаних вторинних реакцій, піддаються видаленню, як правило, через сольволіз, відновлення, фотоліз або ферментну активність, наприклад, за умов, аналогічних фізіологічним умовам, і те, що вони є відсутніми у кінцевих продуктах. Спеціалісти знають або можуть легко визначити, які захисні групи є придатними для реакцій, згаданих вище та нижче. Захист таких функціональних груп такими захисними групами, самі захисні групи та реакції для їх видалення описано, наприклад, у стандартних джерелах для посилання [McOmie J.F.W. Protective Groups in Organic Chemistry. - London and New York: Plenum Press, 1973; Greene T.W. Protective Groups in Organic Synthesis. - New York: Wiley, 1981; The Peptides. Volume 3. Ed. E.Gross and J.Meienhofer. - London and New York: Academic Press, 1981; Houben Weyl. Methoden der organischen Chemie. 4th ed. Volume 15/I. – Stuttgart: Georg Thieme Verlag, 1974; Jakubke H.-D., Jescheit H. Aminosäuren, Peptide, Proteine. - Weinheim, Deerfield Beach and Basel: Verlag Chemie, 1982; Jochen Lehmann. Chemie der Kohlenhydrate: Monosaccharide und Derivate. – Stuttgart: Georg Thieme Verlag, 1974. Додаткові етапи процесу Солі сполуки формули I із солеутворювальною групою одержують способом, який є відомим per se. Кислі адиційні солі сполук формули I, таким чином, можуть бути одержані шляхом обробки кислотою або відповідним аніонообмінним реагентом. Сіль з двома молекулами кислоти (наприклад, дигалогенід сполуки формули I) також може бути перетворена на сіль з однією молекулою кислоти на сполуку (наприклад, моногалогенід); це 15 можна зробити шляхом нагрівання до розплавлення, або, наприклад, шляхом нагрівання у формі твердої речовини під високим вакуумом при підвищеній температурі, наприклад, від 130 C до 170 C, причому одна молекула кислоти витісняється в одній молекулі сполуки формули I. Солі зазвичай перетворюють на вільні сполуки, наприклад, шляхом обробки відповідними основними агентами, наприклад, карбонатами лужних металів, гідрокарбонатами лужних металів або гідроксидами лужних металів, як правило, карбонатом калію або гідроксидом натрію. Амід антранілової кислоти формули I, де R1 представляє нижчий алкіл, і решта символів R2 та R3 є такими, як визначено для сполуки формули I, одержаний шляхом реакції сполук формули II та формули III, піддають подальшій реакції згідно з представленим нижче способом, забезпечуючи амід антранілової кислоти формули I, де R1 представляє H. Амід антранілової кислоти формули I, де R1 представляє нижчий алкіл, обробляють триметилсиліл йодидом протягом приблизно 2035год. при температурі 45-70°C у придатному розчиннику, наприклад, галогенованому алкані, такому як хлороформ, з необов’язковою подальшою обробкою метанолом. Загальні умови процесу Усі описані авторами етапи процесу здійснюють за відомих умов реакції, в оптимальному варіанті — за конкретно вказаних умов, за відсутності або, зазвичай, у присутності розчинників або розріджувачів, в оптимальному варіанті - таких, що є інертними щодо застосованих реагентів і здатними їх розчиняти, за відсутності або у присутності каталізаторів, конденсуючих агентів або нейтралізуючих агентів, наприклад, іонообмінників, як правило, катіонообмінників, наприклад, у формі H+, залежно від типу реакції та/або реагентів при зниженій, нормальній або підвищеній температурі, наприклад, у межах від -100°C до приблизно 190°C, в оптимальному варіанті - від приблизно 80°C до приблизно 150°C, наприклад, від -80°C до -60°C, при кімнатній температурі, від -20°C до 40°C або при температурі кипіння застосованого розчинника, в умовах атмосферного тиску або у закритій посудині, у відповідному разі - під тиском і/або в інертній атмосфері, наприклад, в атмосфері аргону або азоту. Солі можуть бути присутні в усіх вихідних сполуках та перехідних сполуках, якщо вони містять солетворні групи. Солі також можуть бути присутні під час реакції таких сполук, за умови, що це не перешкоджатиме реакції. До розчинників, з-поміж яких можна вибрати придатні для даної реакції, належать, наприклад, вода, естери, як правило, нижчі алкіли-нижчі алканоати, наприклад, діетилацетат, етери, як правило, аліфатичні етери, наприклад, діетиловий етер, або циклічні етери, наприклад, тетрагідрофуран, рідкі ароматичні вуглеводні, як правило, бензол або толуол, спирти, як правило, метанол, етанол або 1- або 2-пропанол, нітрили, як правило, ацетонітрил, галогеновані вуглеводні, як правило, дихлорометан, аміди кислот, як правило, диметилформамід, основи, як правило, гетероциклічні 77446 16 азотисті основи, наприклад, піридин, карбонові кислоти, як правило, нижчі алканкарбонові кислоти, наприклад, оцтова кислота, ангідриди карбонової кислоти, як правило, ангідриди нижчих алканових кислот, наприклад, оцтовий ангідрид, циклічні, лінійні або розгалужені вуглеводні, як правило, циклогексан, гексан або ізопентан, або суміші цих розчинників, наприклад, водні розчини, якщо іншого не вказано в описі процесу. Такі суміші розчинників також застосовують при обробці, наприклад, шляхом хроматографії або розподілу. Сполуки формули I, включаючи їх солі, також можуть бути одержані у формі гідратів, або їх кристали можуть включати, наприклад, розчинник, який застосовують для кристалізації (присутні як сольвати). В оптимальному варіанті втілення сполуку формули I одержують згідно або аналогічно процесам та етапам процесів, визначеним у прикладах. Дозування активного інгредієнта залежить від різних чинників, включаючи тип, вид, вік, масу, стать та медичний стан пацієнта; тяжкості стану, який підлягає лікуванню; шляху введення; ниркової та печінкової функції пацієнта та конкретної застосованої сполуки. Лікар, клініцист або ветеринар звичайної кваліфікації може легко визначити і прописати ефективну кількість медикаменту, необхідну для запобігання, протидії або припинення прогресування стану. Оптимальна точність у досягненні концентрації медикаменту у межах, які забезпечують ефективність без токсичності, вимагає режиму, який ґрунтується на кінетиці доступності медикаменту у заданих місцях. При цьому слід враховувати розподіл, рівновагу та видалення медикаменту. Винахід також стосується фармацевтичних композицій, які включають ефективну кількість, тобто ефективну для лікування одного з вищезгаданих порушень кількість аміду антранілової кислоти формули I або його N-оксиду або таутомеру разом з фармацевтично прийнятними носіями, які є придатними для місцевого, ентерального, наприклад, перорального або ректального, або парентерального введення, і можуть бути неорганічними або органічними, твердими або рідкими. Для перорального введення застосовують, головним чином, таблетки або желатинові капсули, які включають активний інгредієнт разом з розріджувачами, такими як лактоза, декстроза, маніт та/або гліцерин, і/або мастилами та/або поліетиленгліколь. Таблетки також можуть включати зв’язувальні речовини, наприклад, алюмосилікат магнію, крохмалі, такі як кукурудзяний, пшеничний або рисовий крохмаль, желатин, метилцелюлозу, натрійкарбоксиметилцелюлозу та/або полівінілпіролідон, і, якщо потрібно, дезінтегратори, такі як крохмалі, агар, альгінова кислота або її сіль, така як альгінат натрію, і/або шипучі суміші, або адсорбенти, барвники, ароматизатори та підсолоджувачі. Також можна використовувати фармакологічно активні сполуки згідно з даним винаходом у формі композицій для парентерального введення або у формі розчинів для інфузій. Фармацевтичні композиції можуть бути стерилізовані і/або можуть включати наповнювачі, наприклад, консерванти, 17 77446 стабілізатори, зволожувачі та/або емульгатори, солюбілізатори, солі для регулювання осмотичного тиску та/або буфери. Дані фармацевтичні композиції, які можуть, у разі потреби, включати інші фармакологічно активні речовини, одержують відомими способами, наприклад, шляхом традиційного змішування, гранулювання, конфекціонування, розчинення або ліофілізації, і вони включають приблизно від 1% до 95%, краще — від приблизно 1% до приблизно 20%, активного(их) інгредієнта(ів). Крім того, винахід стосується фармацевтичної композиції для лікування пухлин у теплокровних тварин, включаючи людину, композиція включає протипухлинно ефективну дозу сполуки формули I, як було описано вище, або фармацевтично прийнятну сіль такої сполуки разом з фармацевтичним носієм. Крім того, даний винахід забезпечує амід антранілової кислоти формули I або його N-оксид або таутомер, або фармацевтично прийнятну сіль такої сполуки для застосування в лікуванні організму людини або тварин. Даний винахід також стосується застосування аміду антранілової кислоти формули I або його Nоксиду або таутомеру, або фармацевтично прийнятної солі такої сполуки, для одержання фармацевтичного продукту для лікування неопластичної хвороби, ретинопатії або вікової дегенерації жовтої плями. Крім того, даний винахід пропонує спосіб лікування неопластичної хвороби, що реагує на інгібування активності VEGF-рецепторної тирозинкінази, включаючи введення аміду антранілової кислоти формули I або його N-оксиду або таутомеру, або фармацевтично прийнятної солі такого аміду антранілової кислоти, його N-оксиду або його таутомеру, у кількості, ефективній проти вищезгаданої хвороби, теплокровній тварині, яка потребує такого лікування. Вихідні матеріали Нові вихідні матеріали та/або проміжні сполуки, а також способи їх одержання, так само є предметом цього винаходу. В оптимальному варіанті втілення використовують такі вихідні матеріали і вибирають такі умови реакції, які дозволяють одержувати оптимальні сполуки. Вихідні матеріали формули III, IV та V є відомими, серійно виробляються або синтезуються аналогічно або згідно з відомими спеціалістам способами. Наприклад, сполуку формули II одержують шляхом відновлення нітросполуки формули IV, (IV) де R2 та R3 мають значення, вказані для формули I. Відновлення в оптимальному варіанті відбувається у присутності відповідного відновника, такого як хлорид олова (ll) або водень, у присутності придатного каталізатора, такого як нікелевий каталізатор Ренея (у цьому разі краще використовувати, 18 наприклад, водень під тиском (2-20)х105Па) або PtO2, у придатному розчиннику, наприклад, спирті, такому як метанол. Температура реакції в оптимальному варіанті становить від 0°C до 80°C, краще від 15°C до 30°C. Нітросполуку формули IV одержують шляхом реакції активованої похідної кислоти формули VI, (VI) де Y є галогеном або іншою придатною відщеплюваною групою, з аміном формули V, (V) де R2 та R3 є такими, як визначено для формули I, наприклад, у присутності зв’язувального агента, такого як дициклогексилкарбодиімід, при температурі від 0°C до 50°C, в оптимальному варіанті — при кімнатній температурі. Всі інші вихідні матеріали є відомими, можуть бути одержані відомими способами або виробляються серійно; зокрема, вони можуть бути одержані з застосуванням способів, описаних у прикладах. При одержанні вихідних матеріалів існуючі функціональні групи, які не беруть участі у реакції, у разі необхідності мають бути захищені. Оптимальні захисні групи, їх введення та їх видалення описано у розділі "захисні групи" або у прикладах. Всі інші вихідні матеріали є відомими, можуть бути одержані відомими способами або виробляються серійно; зокрема, вони можуть бути одержані з застосуванням способів, описаних у прикладах. Представлені нижче приклади служать для пояснення винаходу, не обмежуючи його обсягу. Температуру виражено у градусах за Цельсієм (°C). Якщо не вказано іншого, реакції відбуваються при кімнатній температурі. Приклади Приклад 1 (для посилання) Одержання 2-[[6-метокси-3піридилlметил]аміно-N-[4-бромо-3(трифторометил)феніл]бензаміду (не заявлений) Ціаноборогідриду натрію (8,80г 95%, 133ммоль) порціями протягом 30хв. додають до перемішуваної суміші оцтової кислоти (3,8мл), 6метокси-3-піридинкарбоксальдегіду (Fluka, Buchs, Швейцарія; 7,80г, 57ммоль) та 2-аміно-N-(4-бромо3-трифторометилфеніл)-бензаміду (етап 1.2; 13,65г, 38ммоль) у метанолі (380мл) при 25°C. Суміш перемішують протягом 16год. Розчинник випарюють під зниженим тиском для одержання залишку, який обробляють насиченим водним розчином гідрокарбонату натрію (500мл) і екстрагують дихлорометаном (3x150мл). Комбіновані екстракти висушують (Na2SO4), фільтрують і розчинник випарюють під зниженим тиском для одержання необробленого продукту, який очищають шляхом 19 колонкової хроматографії на силікагелі, елюент 5% етилацетат у дихлорометані і рекристалізують з діетилового етеру - гексану для одержання названої сполуки у вигляді бежевої кристалічної твердої речовини; т. пл. 101-103°C. Етап 1.1: 2-нітро-N-(4-бромо-3-трифторометилфеніл)бензамід Розчин 3-аміно-6-бромобензотрифториду (Fluka, Buchs, Швейцарія; 24,0г, 100ммоль) в етилацетаті (240мл) додають до перемішуваного водного розчину гідроксиду натрію (110мл 1M) при кімнатній температурі. До перемішуваного розчину після цього по краплях протягом 30хв. додають розчин 2-нітробензоілхлориду (Fluka, Buchs, Швейцарія; 14,5мл, 110ммоль) в етилацетаті (150мл). Одержану в результаті суміш після цього перемішують протягом 30хв. при навколишній температурі. Суміш екстрагують етилацетатом (3x100мл) і комбіновані екстракти послідовно промивають соляною кислотою (2x100 мл 2M), водою (2x100мл), насиченим водним розчином гідрокарбонату натрію (2x100мл) та насиченим водним розчином хлориду натрію (1x100мл), висушують (MgSO4), фільтрують і розчинник випарюють під зниженим тиском для одержання необробленого продукту, який очищають шляхом рекристалізації з етилацетату-гексану для одержання названої сполуки у вигляді бежевої кристалічної твердої речовини; т. пл. 157-158°C. Етап 1.2: 2-аміно-N-(4-бромо-3-трифторометилфеніл)бензамід Розчин 2-нітро-N-(4-бромо-3-трифторометилфеніл)бензаміду (проміжна сполука з етапу 1.1; 32г, 82ммоль) у метанолі (1000мл) гідрогенізують в умовах атмосферного тиску над нікелевим каталізатором Ренея (6г) при 21°C. Розрахована кількість водню поглинається через 7год. Суміш фільтрують і розчинник випарюють під зниженим тиском для одержання необробленого продукту, який очищають шляхом рекристалізації з діетилового етеру - гексану для одержання названої сполуки у вигляді безбарвної кристалічної твердої речовини; т. пл. 142-144°C. Приклад 2 Одержання гідрохлоридної солі 2-[[6-метокси3-піридил]метил]аміно-N-[3(трифторометил)феніл]бензаміду Названу сполуку одержують способом, аналогічним описаному у прикладі 1, використовуючи проміжну сполуку з етапу 2.2 та 6-метокси-3піридинкарбоксальдегід (Fluka, Buchs, Швейцарія); т. пл. 133-135°C. Етап 2.1: 2-нітро-N-[3(трифторометил)феніл]бензамід Названу сполуку одержують аналогічно етапові 1.1, використовуючи 3-(трифторометил)бензоламін (Aldrich, Buchs, Швейцарія); т. пл. 134 135°C. Етап 2.2: 2-аміно-N-[(3-трифторометил) феніл)бензамід Названу сполуку одержують аналогічно етапові 1.2, використовуючи 2-нітро-N-[(3-трифторометил)феніл)бензамід (етап 2.1); т. пл. 132-133°C. Приклад 3 77446 20 Одержання 2-[[6-метокси-3-піридил]метил] аміно-N-[2-метил-3-(трифторометил)феніл]бензаміду Названу сполуку одержують способом, аналогічним описаному у прикладі 1, використовуючи проміжну сполуку з етапу 3.2 та 6-метокси-3піридинкарбоксальдегід (Aldrich, Buchs, Швейцарія); т. пл. 134-135°C. Етап 3.1: 2-нітро-N-[2-метил-3-(трифторометил)феніл]бензамід Названу сполуку одержують аналогічно етапові 1.1, використовуючи 2-метил-3-(трифторометил)бензоламін (Fluorochem, Derbyshire, Англія); т. пл. 188-189°C. Етап 3.2: 2-аміно-N-[2-метил-(3-трифторометил)феніл)бензамід Названу сполуку одержують аналогічно етапові 1.2, використовуючи 2-нітро-N-[2-метил-3(трифторометил)феніл]бензамід (етап 2.1); т. пл. 128-129°C. Приклад 4 (для посилання) Одержання 2-[[(1,6-Дигідро-6-оксо-3піридил)метил]аміно]-N-[4-пропініл-3(трифторометил)феніл]бензаміду (не заявлений) Суміш 2-[[6-метокси-3-піридил]метил]аміно-N[4-(1-пропініл)-3-(трифторометил)-феніл]бензаміду (етап 4.1; 1,10г, 2,5ммоль) та триметилсиліл йодиду (Fluka, Buchs, Швейцарія; 1,0мл, 7,5ммоль) у хлороформі (30мл) перемішують при 60°C протягом 16год. в атмосфері аргону. Охолоджену суміш після цього обробляють метанолом (2мл) і перемішують при кімнатній температурі протягом 10хв. Розчинник випарюють під зниженим тиском, залишок обробляють водним розчином аміаку (100мл 5%) і екстрагують етилацетатом (3x100мл). Комбіновані екстракти промивають насиченим водним розчином хлориду натрію (50мл), висушують (MgSO4), фільтрують і розчинник випарюють під зниженим тиском для одержання необробленого продукту, який очищають шляхом колонкової хроматографії на силікагелі, елюент етилацетат, і рекристалізують з гарячого етилацетату-гексану для одержання названої сполуки у вигляді безбарвної кристалічної твердої речовини; т. пл. 208212°C. Етап 4.1: 2-[[6-метокси-3-піридил]метил]аміноN-[4-(1-пропініл)-3-(трифторометил)феніл]бензамід Перемішуваний розчин 2-[[6-метокси-3піридил]метил]аміно-N-[4-бромо-3(трифторометил)-феніл]бензаміду (Приклад для посилання 1; 3,98г, 8,3ммоль) у сухому толуолі (200мл) продувають аргоном протягом 20хв. при 25°C. Після цього додають трибутил-1пропінілстанан (4,1г 80%, 9,96ммоль) та тетракіс(трифенілфосфін)паладію (0) (260мг) і одержану в результаті суміш нагрівають при 100°C протягом 17год. в атмосфері аргону. Суміш після цього охолоджують, обробляють водним розчином гідроксиду натрію (85мл 0,1M) і продувають повітрям протягом 2год. Одержану в результаті суміш екстрагують етилацетатом (3x100мл). Органічні фази послідовно промивають водою (2x40мл) та насиченим водним розчином хлориду натрію (1x40мл), висушують (Na2SO4), фільтрують і розчинник ви 21 77446 парюють під зниженим тиском для одержання необробленого продукту, який очищають шляхом колонкової хроматографії на силікагелі, елюент 33% етилацетат у гексані, і рекристалізують з діетилового етеру-гексану для одержання названої сполуки у вигляді блідо-жовтої кристалічної твердої речовини; т. пл. 123-124°C. Приклад 5 Одержання 2-[[(1,6-дигідро-6-оксо-3піридил)метил]аміно]-N-[3-(трифторометил)феніл]бензаміду Названу сполуку одержують способом, аналогічним описаному у прикладі 4, використовуючи 2[[6-метокси-3-піридил]метил]аміно-N-[3(трифторометил)феніл]бензамід (приклад 2); т. пл. 171-172°C. Приклад 6 Одержання 2-[[(1,6-дигідро-6-оксо-3піридил)метил]аміно]-N-[2-метил-3(трифторометил)-феніл]бензаміду Названу сполуку одержують способом, аналогічним описаному у прикладі 8, використовуючи 2 Комп’ютерна верстка В. Сердюк 22 [[6-метокси-3-піридил]метил]аміно-N-[2-метил-3(трифторометил)феніл]бензамід (приклад 3); т. пл. 191-192°C. Приклад 7 Одержання м’яких капсул 5000 м’яких желатинових капсул, кожна з яких включає як активний інгредієнт 0,05г однієї зі сполук формули I згаданих у попередніх прикладах, одержують таким чином: Склад: Активний інгредієнт, г 250 Лаурогліколь, літри 2 Процес одержання: Пульверизований активний інгредієнт суспендують у Lauroglykol® (пропіленгліколь лаурат, Gattefosse S.A., Saint Priest, Франція) і подрібнюють за допомогою вологого розпилювача для одержання частинок розміром приблизно 1-3мкм. Порції суміші по 0,419г після цього розфасовують у м’які желатинові капсули, застосовуючи машину для заповнення капсул. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП ―Український інститут промислової власності‖, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAnthranilic acid amides and their use as inhibitors of vegf receptor tyrosine kinase, process for their preparation, pharmaceutical composition
Автори англійськоюFuret Pascal
Назва патенту російськоюАмиды антраниловой кислоты и их применение в качестве ингибиторов тирозинкиназы vegf рецептора, способ их получения, фармацевтическая композиция на их основе
Автори російськоюФуре Паскаль
МПК / Мітки
МПК: A61P 11/06, A61P 27/02, A61P 35/00, A61P 17/06, A61P 9/14, C07D 213/70, A61P 43/00, A61P 29/00, A61P 15/00, A61K 31/44, A61P 19/02, A61K 31/4412, C07D 213/64, A61P 35/02, A61P 9/10
Мітки: рецептора, основі, застосування, одержання, інгібіторів, аміди, спосіб, фармацевтична, антранілової, тирозинкінази, кислоти, композиція
Код посилання
<a href="https://ua.patents.su/11-77446-amidi-antranilovo-kisloti-ta-kh-zastosuvannya-yak-ingibitoriv-vegf-receptora-tirozinkinazi-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Аміди антранілової кислоти та їх застосування як інгібіторів vegf рецептора тирозинкінази, спосіб їх одержання, фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб та конструктивний вузол з’єднування на плаву частин залізобетонного понтона плавучого дока
Наступний патент: Спосіб вимірювання параметрів геометричних фігур в геодезичній високоточній лінійно-кутовій мережі
Випадковий патент: Турбодетандерний агрегат












