Спосіб одержання інгібіторів фосфодіестерази-4
Номер патенту: 79518
Опубліковано: 25.06.2007
Автори: Сохейлі Араш, Меррі Джеррі Ентоні, Албанез-Уолкер Дженніфер, Спрінгфілд Шон А.
Формула / Реферат
1. Спосіб одержання сполуки формули IX або IХа:
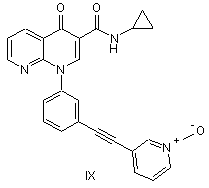
 ,
,
який відрізняється тим, що включає
стадію С: взаємодію в розчиннику А сполуки формули Va
 , (Va)
, (Va)
де R1 вибраний з С1-С8-алкілу і розчинник А вибраний з диметиламіноацетаміду, диметилформаміду, ацетонітрилу, ДМСО, метилацетаміду, простих ефірів або їх сумішей;
зі сполукою формули VII або формули VІІa
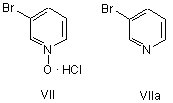
у присутності паладієвого каталізатора і фосфінового ліганду, та амінної основи з одержанням сполуки формули VIII або формули VІІІa
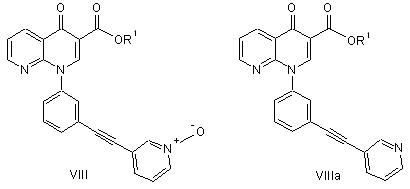 ;
;
стадію D: взаємодію сполуки формули VIII або VІІІa з циклопропіламіном в розчиннику В, що вибраний з С1-С4-алканолу, трифторетанолу або їх суміші, або ацетонітрилу.
2. Спосіб за п. 1, який відрізняється тим, що фосфіновий ліганд вибирають з Р(С1-С6-алкіл)3.
3. Спосіб за п. 1, який відрізняється тим, що паладієвий каталізатор вибирають з групи: Р(трет-бутил)3-Рd-Р(трет-бутил)3, [РdСl(аліл)]2, Рd2(дба)3 і [Р(трет-бутил)3РdВr]2.
4. Спосіб за п. 1, який відрізняється тим, що молярне співвідношення сполуки формули Va і сполуки формули VII або VIIa вибирають приблизно від 1:1,5 до 1,5:1.
5. Спосіб за п. 1, який відрізняється тим, що співвідношення молярних еквівалентів амінної основи на моль сполуки формули VII або VІІa вибирають від 2:1 до 3,5:1.
6. Спосіб за п. 1, який відрізняється тим, що молярне співвідношення паладієвого каталізатора і сполуки формули Va вибирають від 0,05:1 до 0,10:1.
7. Спосіб за п. 1, який відрізняється тим, що стадію С проводять при температурі від 40 до 70 °С.
8. Спосіб за п. 1, який відрізняється тим, що стадію D проводять у присутності каталізатора.
9. Спосіб за п. 8, який відрізняється тим, що каталізатор вибирають з бутилфосфіту (ВuО)3Р і хлориду магнію.
10. Спосіб за п. 1, який відрізняється тим, що молярне співвідношення циклопропіламіну і сполуки формули VIII або VІІІa вибирають як принаймні 1:1.
11. Спосіб за п. 1, який відрізняється тим, що стадію D проводять при температурі від 40 до 60 °С.
12. Спосіб за п. 1, який відрізняється тим, що стадію С і стадію D проводять в одному реакторі без очищення або виділення продукту стадії С до переходу до стадії D.
13. Спосіб за п. 1, який відрізняється тим, що додатково включає змішування сполуки формули IX або IХа з розчинником перетворення для перекристалізації сполуки формули IX або IХа, причому розчинник перетворення вибирають з сухого етанолу, метанолу, N-метилпіролідинону, трифторетанолу, метил-трет-бутилового ефіру або їх сумішей.
14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що сполуки формули IX або IХа перекристалізовують у такій кількості розчинника, яка достатня для суспендування сполук формули IX або IХа.
15. Спосіб за п. 14, який відрізняється тим, що вказаний розчинник вибирають з диметилформаміду, диметилацетаміду, N-метилпіролідинону і С1-С4-алканолу.
16. Спосіб за п. 15, який відрізняється тим, що вказаний розчинник містить воду в кількості менше 5 %.
Текст
1. Спосіб одержання сполуки формули IX або IХа: 3 79518 4 8. Спосіб за п.1, який відрізняється тим, що або IХа з розчинником перетворення для перекристадію D проводять у присутності каталізатора. сталізації сполуки формули IX або IХа, причому 9. Спосіб за п.8, який відрізняється тим, що карозчинник перетворення вибирають з сухого е таталізатор вибирають з бутилфосфіту (ВuО)3Р і нолу, метанолу, N-метилпіролідинону, трифторехлориду магнію. танолу, метил-трет-бутилового ефіру або їх сумі10. Спосіб за п.1, який відрізняється тим, що мошей. лярне співвідношення циклопропіламіну і сполуки 14. Спосіб за будь-яким з попередніх пунктів, який формули VIII або VІІІa вибирають як принаймні відрізняє ться тим, що сполуки формули IX або 1:1. IХа перекристалізовують у такій кількості розчин11. Спосіб за п.1, який відрізняється тим, що ника, яка достатня для суспендування сполук фостадію D проводять при температурі від 40 до рмули IX або IХа. 60°С. 15. Спосіб за п.14, який відрізняється тим, що 12. Спосіб за п.1, який відрізняється тим, що вказаний розчинник вибирають з диметилформастадію С і стадію D проводять в одному реакторі міду, диметилацетаміду, N-метилпіролідинону і С 1без очищення або виділення продукту стадії С до С4-алканолу. переходу до стадії D. 16. Спосіб за п.15, який відрізняється тим, що 13. Спосіб за п.1, який відрізняється тим, що довказаний розчинник містить воду в кількості менше датково включає змішування сполуки формули IX 5%. Даний винахід відноситься до способу одержання інгібіторів фосфодіестерази-4. Зокрема, даний винахід відноситься до способу одержання сполук, які є заміщеними біарилом 1,8нафтиридин-4(1Н)-онами. Гормони являють собою сполуки, які різним чином впливають на клітинну активність. У багатьох відношеннях, гормони є месенджерами для ініціації певних клітинних відповідей і активності. Однак, багато які ефекти, викликані гормонами, не є результатом дії тільки самого гормону. Навпаки, гормон спочатку зв'язується ' рецептором, тим самим ініціюючи виділення другої сполуки, яка продовжує вплив на клітинну активність. У випадку такого сценарію, гормон відомий як первинний месенджер, а друга сполука називається вторинним месенджером. Циклічний аденозинмонофосфат (аденозин 3',5'-циклічний монофосфат, "цАМФ" або "циклічний АМФ") відомий як вторинний месенджер для гормонів, що включають епінефрин, глюкагон, кальцитонін, кортикотропін, ліпотропін, лютеїнізуючий гормон, норепінефрин, паратиреоїдний гормон, тиреоїд-стимулюючий гормон і вазопресин. Таким чином, цАМФ опосередковує клітинну відповідь на гормони. Циклічний АМФ також опосередковує клітинну відповідь на різні нейротрансмітери. Фосфодіестерази ("ФДЕ") являють собою сімейство ферментів, які беруть участь в метаболізмі 3", 5'-циклічних нуклеотидів, перетворюючи їх в 5'нуклеозидмонофосфати, тим самим обмежуючи активність цМФ як вторинного месенджера. Певна фосфодіестераза, фосфодіестераза-4 ("ФДЕ4", також відома як "ФДЕ-IV"), яка має високу спорідненість і специфічність до цАМФ, ФДЕ тип у IV, особливо цікава як потенційна мішень для розробки нових протиастматичних і протизапальних сполук. Відомо, що ФДЕ4 існує у вигляді, принаймні, чотирьох ізоферментів, кожний з яких кодується окремим геном. Вважають, що всі чотири відомих ФДЕ4 генних продукти грають різні ролі в алергічних і/або запальних реакціях. Таким чином, вважають, що інгібування ФДЕ4, особливо специфічних ізоформ ФДЕ4, які викликають небажані реакції, може сприятливо впливати на симптоми алергії і запалення. Було б бажано одержати нові сполуки і композиції, яку інгібують активність ФДЕ4. Основною проблемою застосування інгібіторів ФДЕ4 є побічний ефект у вигляді блювоти, який спостерігається при прийомі декількох варіантів сполук, [як описано у С Burnouf et al., ("Burnouf), Ann. Rep. In Med. Chem., 33: 91-109 (1998). У В. Hughes et al., Br. J. Pharmacol., 118:1183-1191 (1996); MJ. Perry et al. Cell Biochem. Biophys., 29: 113-132 (1998); S.B. Christensen et al., J. Med. Chem., 41:821-835 (1998) і Burnouf] описані небажані ефекти різної міри тяжкості, що викликаються різними сполуками. Як [описано у M.D.Houslay et al., Ad v. In Pharmacol., 44:225-342 (1998) і D. Spina et al., Adv. In Pharmacol., 44:33-89 (1998)], існує величезний інтерес, і проводяться численні дослідження терапевтичних інгібіторів ФДЕ4. У публікації [міжнародної заявки WO 9422852] описані хіноліни як інгібітори ФДЕ4. У публікації [міжнародної заявки WO 9907704] описані похідні 1-арил-1,8-нафтиридин-4-ону як інгібітори ФДЕ4. В [А.Н. Cook et al., J. Chem. Soc, 413-417 (1943)] описані гамма-піридилхіноліни. Інші хінолінові сполуки [описані у Kei Manabe et al., J. Org. Chem., 58 (24): 6692-6700 (1993); Kei manabe et al., J. Am. Chem. Soc, 115 (12):5324-5325 (1993) і Kei Manabe et al., J. Am. Chem. Soc, 114 (17):69406941 (1992)]. Сполуки, які включають кільцеві системи, описані у різних дослідників як ефективні при різних видах терапії і при інших застосуваннях. Наприклад, [в публікації міжнародної заявки WO 98/25883] описані кетобензаміди як інгібітори кальпаїну, в п ублікації [європейського патенту ЕР 811610 і патентів США №№5679712, 5693672 і 5747541] описані заміщені бензоїлгуанідинові блокатори натрієвих каналів, [в патенті США №5736297] описані кільцеві системи, що застосовуються як фоточутлива композиція. У [патентах США №№5491147, 5608070, 5622977, 5739144, 5776958, 5780477, 5786354, 5798373, 5849770, 5859034, 5866593, 5891896 і публікації міжнародної заявки WO 95/35283] описані інгібітори ФДЕ4, які являють собою похідні 5 79518 6 тризаміщеного арилу або гетероарилфенілу. У нормальних тканин. [патенті США №5580888] описані інгібітори ФДЕ4, В одному варіанті одержання сполук формули які являють собою похідні стирилу. У [патенті США IX може починатись з одержання проміжної сполу№5550137] описані інгібітори ФДЕ4, які являють ки формули V: собою похідні феніламінокарбонілу. У [патенті США №5340827] описані інгібітори ФДЕ4, які являють собою сполуки феноксикарбоксаміду. У [паV тенті США №5780478] описані інгібітори ФДЕ4, які являють собою похідні тетразаміщеного фенілу. У публікації [міжнародної заявки WO 96/00215] опиде сані похідні заміщеного оксиму, що застосовують-OR1 є прийнятною відхідною групою, такою як ся як інгібітори ФДЕ4. У [патенті США №5633257] описані у стандартних текстах, таких як: [Protective описані інгібітори ФДЕ4, які являють собою сполуGroups in Organic Synthesis, 2nd edition, by ки цикло(алкіл і алкеніл)феніл-алкеніл(арил і гетеTheodora W. Greene and Peter GM. Wust (1991) і роарил)у. Protecting Group, автор Philip J, Kocienski (1994)]. В одному аспекті, даний винахід відноситься Наприклад, R1 може бути необов'язково С 1до однореакторного способу одержання проміжних 8алкілом, арилом, гетероарилом, де замісники сполук формули V, які застосовують при одержанвибирають з групи, що включає арил, С1-8алкіл; ні інгібіторів фосфодіестерази-4: R3 є С1-8алкілом, арилом або гетероарилом, необов'язково моно-, ди-, три- або тетразаміщеним галогеном, В(ОН)2,-ОСН, арилом, гетероариV лом, С1-10алкілом, алкокси, кетоном, спиртом, трифлатом, мезилатом, амідом, складним ефіром, кетоном, ацеталем, фосфатом, стананом, силілом, В Іншому аспекті, даний винахід відноситься B(OR)2, де R є С1-8алкілом або арилом; до способу одержання сполук формули IX і форщо включає: мули ІХа, які є інгібіторами фосфодіестерази-4: Стадію А: взаємодія, в ненуклеофільному розчиннику, сполуки формули II: II Показано, що інгібітори фосфодіестерази-4 є корисними при лікуванні ссавців, наприклад, від астми, хронічного бронхіту, хронічного обструктивного захворювання легень (ХОЗЛ), еозинофільної гранульоми, псоріазу та інших доброякісних або злоякісних проліферативних захворювань шкіри, ендотоксичного шоку (і пов'язаних з ним станів, таких як ламініт і коліки у коней), септичного шоку, виразкового коліту, хвороби Крона, реперфузійного пошкодження міокарда і мозку, запального артриту, остеопорозу, хронічного гломерулонефриту, атопічного дерматиту, кропивниці, респіраторного дистрес-синдрому у дорослих, респіраторного дистрес-синдрому у дітей, хронічного обструктивного захворювання легень у тварин, не цукрового діабету, алергічного риніту, алергічного кон'юнктивіту, весняного кон'юнктивіту, артеріального рестенозу, атеросклерозу, нейрогенного запалення, болю, кашлю, ревматоїдного артриту, анкілозуючого спондиліту, відторгнення трансплантатів і захворювання "трансплантат проти хазяїна", гіперсекреції шлункової кислоти, викликаного бактеріями, грибами або вірусами сепсису або септичного шоку, запальної і цитокінопосередкованої хронічної дегенерації тканин, остеоартриту, раку, кахексії, втрати м'язової тканини, депресії, погіршення пам'яті, монополярної депресії, гострих і хронічних нейродегенеративних захворювань із запальними явищами, хвороби Паркінсона, хвороби Альцгеймера, пошкодження спинного мозку, травм голови, розсіяного склерозу, росту пухлини і ракової інвазії де R2 кожний незалежно є С1-8алкілом, необов'язково моно- або дизаміщеним С 1-8алкілом, таким як метил або етил, або арилом, таким як феніл або гетероарил; зі сполукою формули І у присутності основи: I де R4 є бромом або хлором, з одержанням сполуки формули III III і Стадію В: взаємодія, в ненуклеофільному розчиннику, сполуки формули III з аміносполукою формули IV IV у присутності основи з одержанням сполуки формули V. Визначення ненуклеофільного розчинника на стадії В таке ж, як подане вище для стадії А. Також, визначення основи на стадії В таке ж, як описане вище для стадії А. На стадії Амолярне співвідношення основи до сполуки формули І може варіюватись від близько 12:1 до близько 3:1. Звичайно застосовують спів 7 79518 8 відношення 8:1. Співвідношення нижче 3:1 може R3 є С1-8алкілом, арилом або гетероарилом, викликати тримеризацію аміноакрилату з одернеобов'язково моно-, ди-, три- або тетразаміщежанням 1,3,5-трикарбоксибензолу.молярне співним галогеном, В(ОН)2,-СºСН (алкіном), арилом, відношення сполуки формули І до сполуки формугетероарилом, С1-10алкілом, алкокси, кетоном, ли II може варіюватись від 1:1 до 1:3, звичайно спиртом, трифлатом, мезилатом, амідом, складскладає близько 1:1,5. Взаємодія на стадії А може ним ефіром, кетоном, ацеталем, фосфатом, стапроводитись при температурі від 25 до 100°С; звинаном, силілом, B(OR)2, де R є С1-8алкілом або чайно використовують інтервал від 40 до близько арилом; 60°С, і продовжують реакцію до практично повного що включає: завершення протягом від 2 до 18 годин; звичайно Стадію А: взаємодія, в ненуклеофільному розвід 6 до 12 годин. Взаємодію на стадії В проводять чиннику, сполуки формули II: як описано вище. В даному варіанті є підваріант, в якому: R1 необов'язково є С 1-8алкілом, арилом, гетеII роарилом, де замісники вибирають з групи, що включає арил, С1-8алкіл; R є метилом, етилом або фенілом; де R3 є С1-8алкілом, арилом або гетероарилом, R2 кожний незалежно є С1-8алкілом, необов'язнеобов'язково моно-, ди-, три- або тетразаміщеково моно- або дизаміщеним С 1-8алкілом, таким як ним галогеном, В(ОН)2,-CºСН, арилом, гетероариметил або етил, або арилом або гетероарилом; зі лом; сполукою формули І у присутності основи: В даному варіанті є підваріант, в якому: 1 R є метилом або етилом; R2 є метилом; I R3 є фенілом, заміщеним галогеном, В(ОН)2,СºСН. де В даному варіанті є підваріант, в якому: ненукR4 є бромом або хлором, з одержанням сполулеофільний розчинник вибирають з диметилфорки формули III маміду, диметилацетаміду, тетрагідрофурану, етилацетату, ацетонітрилу, толуолу, бензолу, діоксану, метиленхлориду. У вказаному вище підваріанті є підваріант, в III якому ненуклеофільним розчинником є ацетонітрил. У даному варіанті є підваріант, в якому основу і вибирають з карбонату натрію або калію, триетиСтадію В: взаємодія, в ненуклеофільному розламіну, діетиламіну і основи Хеніга. чиннику, сполуки формули III з аміносполукою фоВ даному варіанті є підваріант в якому основу рмули IV вибирають з карбонату натрію або триетиламіну. IV В даному варіанті є підваріант в якомумолярне у присутності основи з одержанням сполуки співвідношення сполуки формули IV до сполуки формули V. В даному варіанті є підваріант, в якоформули III складає від близько 2:1 до 1:2. му: У вказаному вище підваріанті є підваріант, в R1 необов'язково є С 1-8алкілом, арилом, гетеякомумолярне співвідношення сполуки формули роарилом, де замісники вибирають з групи, що IV до сполуки формули III складає близько 1:1. включає арил, С1-8алкіл; В даному варіанті є підваріант в якомумолярне R2 є метилом, етилом або фенілом; співвідношення основи до сполуки формули IV R3 є С1-8алкілом, арилом або гетероарилом, становить, принаймні, 1:1. необов'язково моно-, ди-, три- або тетразаміщеУ вказаному вище підваріанті є підваріант, в ним галогеном, В(ОН)2,-CºСН, арилом, гетероариякомумолярне співвідношення основи до сполуки лом; формули IV складає близько 1:1. В даному другому варіанті є підваріант, в якоВ даному варіанті є підваріант в якому взаєму: модію проводять при температурі від близько 20 R4 є хлором. до 100°С. В даному другому варіанті є підваріант, в якоУ вказаному вище підваріанті є підваріант, в му: якому реакцію проводять при температурі від блиR1 є метилом або етилом; зько 40 до близько 50°С. R2 є метилом; У другому варіанті представлений спосіб одеR3 є фенілом, заміщеним галогеном, В(ОН)2,ржання сполуки формули V СºСН. В даному другому варіанті є підваріант, в, V якому: ненуклеофільний розчинник вибирають з диметилформаміду, диметилацетаміду, тетрагідрофурану, етилацетату, ацетонітрилу, толуолу, де бензолу, діоксану, метиленхлориду. -OR1 є прийнятною відхідною групою; У вказаному вище підваріанті є підваріант, в 9 79518 10 якому ненуклеофільним розчинником є ацетонітрил. В даному другому варіанті є підваріант в якому основу вибирають з карбонату натрію або калію, Va триетиламіну, діетиламіну і основи Хеніга. В даному варіанті є підваріант в якому основу вибирають з карбонату натрію або триетиламіну. В даному другому варіанті є підваріант стадії де А, в якомумолярне співвідношення основи в спо-OR1 є прийнятною відхідною групою, такою як луці формули І складає від близько 12:1 до близьописана в стандартних текстах, таких як: ко 3:1. [Protective Groups in Organic Synthesis, 2nd edition, У вказаному вище підваріанті є підваріант стаby Theodora W. Greene and Peter G.M. Wuts (1991) дії А, в якомумолярне співвідношення основи в і Protecting Groups, by Philip J. Kocienski (1994)]. сполуці формули І складає від близько 8:1 до блиНаприклад, R1 може бути необов'язково С 1зько 3:1. 8алкілом, ар илом, гетероарилом, де замісники В даному другому варіанті є підваріант стадії вибирають з групи, що включає арил, С1-8алкіл; А, в якомумолярне співвідношення сполуки форзі сполукою формули VII або VIla мули І до сполуки формули II складає від близько 1:1 до 1:3. В даному другому варіанті є підваріант стадії А, в якому реакцію проводять при температурі від близько 25 до 100°С. В даному другому варіанті є підваріант стадії А, в якому реакцію проводять при температурі від у присутності паладієвого каталізатора і фосблизько 40 до близько 60°С. фінового ліганду, в амінній основі, з одержанням В даному другому варіанті є підваріант стадії сполуки формули VIII або VIIIa. В, в якомумолярне співвідношення сполуки формули IV до сполуки формули III складає від близько 2:1 до 1:2. У вказаному вище підваріанті є підваріант стадії В, в якомумолярне співвідношення сполуки формули IV до сполуки формули III складає близько 1:1. В даному другому варіанті є підваріант стадії В, в якомумолярне співвідношення основи до сполуки формули IV складає близько 1:1 або більше. У вказаному вище підваріанті є підваріант стаПереважною сполукою формули Va, формули дії В, в якомумолярне співвідношення основи до VIII і Vllla, відповідно, є наступні сполуки: сполуки формули IV складає близько 1:1. В даному другому варіанті є підваріант стадії В, в якому реакцію проводять при температурі від близько 20 до 100°С. У вказаному вище підваріанті є підваріант стадії В, в якому реакцію проводять при температурі від близько 40 до 50°С. В даному другому варіанті є підваріант, в якоДля цілей даного винаходу розчинник А вибиму взаємодію на стадії А і взаємодію на стадії В рають з групи, що включає диметиламіноацетамід, проводять в одному реакторі без очищення або виділення продукту стадії А перед переходом на диметилформамід, ацетонітрил, ДМСО, метилацетамід, прості ефіри або їх суміші. Для цілей стадію В. даного винаходу, фосфіновий ліганд вибирають з В іншому варіанті, даний винахід відноситься групи, що включає Р(С 1-6алкіл)3, такий як Р(третдо способу одержання інгібітору фосфодіестеразибутил) 3, Р(Су) 3 і Р(трет-бутил)2(бі феніл). Для цілей 4 формул IX і ІХа: даного винаходу, паладієвий каталізатор включає каталізатор Фу (наприклад, Р(трет-бутил) 3-РdР(трет-бутил)3, [РdСl(алкіл)]2, Рd2(дба)3 і [Р(третбутил) 3РdВr]2 (каталізатор Джонсона-Маттей). Для цілей даного винаходу амінна основа являє собою утруднену амінну основу, таку як трет-аміламін, трет-бутиламін, ізопропіламін або діізопропіламін. На стадії Смолярне співвідношення сполуки формули Va до сполуки формули VII або Vlla може що включає варіюватись в широкому діапазоні, але, оптимальСтадію С: взаємодія, в розчиннику А, сполуки но, складає від близько 1:1,5 до 1,5:1, звичайно формули Va приблизно 1:1. Як основне правило, бажаним є, принаймні, 1молярний еквівалент основи намоль 11 79518 12 сполуки формули Va плюс 1молярний еквівалент Cross-Coupling Reactions; Diederich, F and Stang, P. основи намолярний еквівалент сполуки формули eds; Wiley-VCH; Weinheim, Germany, 1998, розділ VII або Vila. Зменшення даного співвідношення Chem. Int. Ed. 1998, 37, №24, стор. 3387-3388; знижує вихід. Таким чином, у представленій вище Wolfe, J. Singer, R., Yang, B. and Buchwald, S., J. реакції співвідношення амінної основи до сполуки Am. Chem. Soc, 1999, 121, стор. 9550-9561.) споформули Va може бути 1,2:1 або більше, але звилук формули Va і формули VII утворюється не мечайно буває від 2:1 до 3,5:1.молярне співвіднонше 10% димеру сполуки формули Va у продукті. шення паладію до сполуки формули V складає від У Hermann, et al [Eur. J. Chem 2000, 3679-3681] 0,05:1 до 0,10:1. Якщо застосовується, наприклад, описано, що якщо паладієвий каталізатор вибра[РdСl(аліл)]2, який містить двамоля паладію наний правильно, необхідність застосування міді моль каталізатора, співвідношення буде від відпадає. Двома такими каталізаторами є P(Cy)30,025:1 до 0,05:1.молярне співвідношення фосфіPd-P(Cy)3 і Р(трет-бутил)3-Pd-Р(трет-бутил)3 (катанового ліганду до паладію звичайно складає від лізатор Фу). Такі каталізатори вимагають особли3:1 до 5:1, часто приблизно 4:1. вого ставлення. Навпаки, каталізатори відповідно Реакція може проводитись при температурі від до даного винаходу одержують in situ реакцією 25 до 125°С, звичайно при температурі від 40 до стійкого джерела паладію (такого як [Рd(аліл)Сl]2) 70°С, і проходить доти, доки реакція практично не зі стійким комерційно доступним заздалегідь упазавершиться. Присутність кисню мінімізується кованим лігандом (таким як 10% мас. три-(третпродуванням реакційної посудини газоподібним бутил)фосфін в гексані). Більш того, завдяки одеазотом перед додаванням реагентів. ржанню каталізатора in situ, даний винахід забезПродукт зі стадії С охолоджують до темперапечує відповідне співвідношення ліганду/паладію, тури від 0 до близько 5°С. Потім до продукту зі звичайно недоступне при застосуванні комерційстадії С додають 3-6 об'ємів антирозчинника на них продуктів. об'єм розчинника для осадження сполуки формули Стадія D: взаємодія, в розчиннику В, сполуки VIII або Vllla. Для цілей даного винаходу, антирозформули VIII з циклопропіламіном, необов'язково чинник визначений як не реакційноздатний розу присутності фосфіту або іншого каталізатора. чинник, в якому сполука формули VIII або VIIIa Для цілей даного винаходу, розчинник В вивипадає в осад. значений як такий, що включає алканольний розСуспензію, що містить осаджену сполуку форчинник, такий як С1-4алканольні розчинники метамули VIII або VIIIa, фільтрують або центрифугунол, етанол, пропаноли і бутаноли, і ють. Осад на фільтрі або в центрифузі, що містить трифторетанол, або їх суміші. Також може застосполуку формули VIII або VIIIa, повторно суспенсовува тись ацетонітрил. Для цілей даного винаходують або безпосередньо промивають ізобутаноду, каталізатор включає бутилфосфіт (ВuО)3Р), лом або ізопропанолом для видалення залишкопіридин-N-оксиди, триалкілортоацетат, хлорид вого паладію. Наприклад, осад на фільтрі, що цинку, хлорид магнію, трифлат магнію, трифлат містить сполуку формули VIII або VIIIa, може бути скандію, трифлат лантану, трифла т ітербію, дихпромитий in situ (наприклад, на фільтрувальному лорид титаноцену або дихлорид цирконоцену. пресі) від 40 до 60 об'ємами ізобутанолу на одиНеобхідно зазначити, що для цілей даного винаницю ваги сухої сполуки формули VIII або Vllla. ходу термін "каталізатор" означає реагент, який Як альтернатива, залишковий паладій може прискорює реакцію, навіть будучи присутнім в бібути видалений повторним розчиненням сполуки льших, ніж класичні "каталітичні" кількості. формули І в C1-6алканольному розчиннику (такому Молярне співвідношення циклопропіламіну до як метанол, етанол або пропанол) і обробкою сусполуки формули VII або VIIIa звичайно складає спензії, що містить сполуку формули IX або ІХа, більше 1:1, часто 1,1:1 або більше. Зменшення активованого вугіллям, таким як Darco G-60 або вказаного співвідношення знижує вихід. СпіввідEcosorb. Потім суспензію фільтрують для виданошення каталізатора до сполуки формули VIII лення активованого вугілля. Очевидно, що зручно або VIIIa звичайно складає від 0,025:1 до 0,075:1, підвищувати розчинність продукту в алканольному часто близько 0,05:1 або, можливо, від 0,10:1 до розчиннику за допомогою нагрівання алканолу 1:1 або більш. При застосуванні хлориду магнію, (наприклад, до температури від 25 до 70°С) або типове співвідношення каталізатора до сполуки до, або після контакту з продуктом. Звичайно суформули VIII або VIIIa складає від 0,9:1 до 1:1,5. спензію витримують в теплому стані протягом від Реакцію можна провести при температурі від 40 до 1 до 6 годин і фільтрують ще теплою. близько 60°С, звичайно при температурі 55-60°С, і Функціонально, повне перетворення, що досяїї проводять доти, доки взаємодія практично не гається на стадії С, є таким же, як і в типовій реакзавершиться. Присутність кисню мінімізується ції поєднання по Соногаширі. Як така, стадія С є продуванням реакційної посудини газоподібним ефективним одностадійним методом поєднання азотом перед додаванням реагентів. Для одералкіну з арилгалогенідом. З іншого боку, стадія С жання оптимальних результатів бажано провести відрізняється від реакції поєднання по Соногаширі стадію D при Kf, що дорівнює або нижче у декількох важливих напрямах. Наприклад, реак3000ч/млн. ція поєднання по Соногаширі звичайно вимагає Продукт зі стадії D охолоджують до темперазастосування мідного, цинкового, магнієвого або тури від 0 до близько 30°С, звичайно до кімнатної цирконієвого реагенту в доповнення до паладієвотемператури. Потім розчинник замінюють антиго каталізатора. Переважною є мідь. Однак автори розчинником (антирозчинник В), наприклад, випаданого винаходу виявили, що при поєднанні по рюванням розчинника з подальшим додаванням Санагаширі (Sonogashira, K in Metal-Catalyzed надлишку антирозчинника. Для цілей даного вина 13 79518 14 ходу, антирозчинник В визначений як розчинник у вання шкіри, ендотоксичний шок (і пов'язані з ним продукті реакції (в цьому випадку, сполуці формустани, такі як ламініт і коліки у коней), септичний ли IX), 3-6 об'ємів антирозчинника на об'єм розшок, виразковий коліт, хвороба Крона, реперфучинника додають до продукту зі стадії С для осазійне пошкодження міокарда і мозку, запальний дження сполуки формули VIII або VIIIa. Для цілей артрит, остеопороз, хронічний гломерулонефрит, даного винаходу, антирозчинник визначений як не атонічний дерматит, кропивниця, респіраторний реакційноздатний розчинник, в якому осаджується дистрес-синдром у дорослих, респіраторний диссполука формули VIII або VIIIa. трес-синдром у дітей, хронічне обструктивне заДля видалення домішок суспензію, що містить хворювання легень у тварин, не нукровий діабет, осаджену сполуку формули VIII або VIIIa, промиалергічний риніт, алергічний кон'юнктивіт, веснявають розчинником, таким як вода, ацетонітрил, ний кон'юнктивіт, артеріальний рестеноз, атероізопропілацетат, етилацетат, тетрагідрофуран, склероз, нейрогенне запалення, біль, кашель, реетанол, пропаноли і бутаноли. Потім розчинник вматоїдний артрит, анкілозуючий спондиліт, видаляють, наприклад, фільтрацією і вакуумним відторгнення трансплантатів і захворювання сушінням. Фільтрована сполука формули VIII або "трансплантат проти хазяїна", гіперсекреція шлунVIIIa може бути змішана з розчинником перетвокової кислоти, викликаний бактеріями, грибами рення, таким як сухий етанол, метанол, трифтореабо вірусами сепсис або септичний шок, запальна танол, N-метилпіролідинон, метил-трет-бутиловий і цитокінопосередкована хронічна дегенерація ткаефір або їх суміші, необов'язково нагріта і витринин, остеоартрит, рак, кахексія, втрата м'язової мана при температурі від 40 до 50°С, доти, доки, тканини, депресія, погіршення пам'яті, монополярпринаймні, 95% сполуки формули VIII або VIIIa не на депресія, гострі і хронічні нейродегенеративні прийме бажану форму. Потім розчинник перетвозахворювання із запальними явищами, хвороба рення видаляють, наприклад, фільтрацією або Паркінсона, хвороба Альцгеймера, пошкодження центрифугуванням, і одержаний продукт сушать у спинного мозку, травма голови, розсіяний склероз, вакуумі. Необхідної кількості розчинника перетвозростання пухлини і ракова інвазія нормальних рення повинно вистачати для суспендування або тканин, які реагують на інгібування ФДЕ4, або, розчинення сполуки формули VIII або VIIIa. альтернативно, від 0,05мг до близько 7г на пацієнТермін "арил", якщо не указано інакше, вклюта на день. Наприклад, запалення можна ефектичає системи з множиною кілець, а також системи з вно лікувати введенням від близько 0,01мг до 50мг одним кільцем, такі як, наприклад, феніл або нафсполуки на кілограм маси тіла на день, або, альтетил. рнативно, від близько 0,5мг до близько 2,5г на Термін "гетеро", якщо не указано інакше, пацієнта на день. Далі зрозуміло, що інгібуючі включає один або більше О, S або N атомів. НаФДЕ4 сполуки відповідно до даного винаходу моприклад, гетероциклоалкіл і гетероарил включажуть вводитись в профілактично ефективній кільють системи кілець, які містять один або більше О, кості для профілактики вказаних вище станів. S або N атомів в кільці, включаючи суміші цих Кількість активного інгредієнту, яка може бути атомів. Гетероатоми замінюють атоми вуглецю в об'єднана з носієм для одержання стандартних кільці. Таким чином, наприклад, гетероциклікарських форм, варіюється в залежності від підлоС5алкіл являє собою 5-членне кільце, що міслягаючого лікуванню пацієнта і способу ведення. тить від 5 до 0 атомів вуглецю. Наприклад, препаративні форми для пероральноПриклади гетероарилу включають, наприклад, го введення людині можуть містити від близько піридиніл, хіяолініл, ізохінолініл, піридазиніл, піри0,5мг до близько 5г активного агента, об'єднаного мідиніл, піразиніл, хіноксалініл, фурил, бензофуз відповідною і зручною кількістю носія, яка може рил, дибензофурил, тієніл, бензотієніл, піроліл, варіюватись від близько 5 до близько 95% від заіндоліл, піразоліл, індазоліл, оксазоліл, ізоксазогальної маси композиції. Стандартні лікарські фоліл, тіазоліл, ізотіазоліл, імідазоліл, бензімідазоліл, рми звичайно містять від близько 0,01мг до близьоксадіазоліл, тіадіазоліл, триазоліл, тетразоліл. ко 1000мг активного інгредієнту, звичайно 0,01, Сполуки, описані вище, можуть включати один 0,05мг, 0,25мг, 1мг, 5мг, 25мг, 50мг, 100мг, 200мг, або більше центрів асиметрії і, таким чином, мо300мг, 400мг, 500мг, 600мг, 800мг або 1000мг. жуть мати діастереомери і оптичні ізомери. Даний Зрозуміло, що певний рівень дозування для винахід включає все ці можливі діастереомери, а певного пацієнта буде залежати від таких фактотакож їх рацемічні суміші, їх практично чисті роздірів, як вік, маса тіла, загальний стан здоров'я, лені енантіомери, всі можливі геометричні ізомери стать, дієта, час введення, спосіб введення, швиді їх солі. кість виведення, поєднання лікарських засобів і Здійснення даного винаходу ілюстроване притяжкість певного підлягаючого лікуванню захворюкладами інгібіторів фосфодіестерази-4, які можуть вання. бути одержані із застосуванням даного винаходу. Представлені нижче приклади призначені для Дозування від близько 0,001мг/кг до близько ілюстрації деяких переважних варіантів даного 140мг/кг маси тіла на день застосовується при винаходу і не обмежують даний винахід. лікуванні таких станів, як астма, хронічний бронхіт, Сполуки відповідно до даного винаходу мохронічне обструктивне захворювання легень жуть бути одержані наступними методами. Заміс(ХОЗЛ), еозинофільна гранульома, псоріаз та інші ники такі ж, як в формулі І, якщо не указано інакдоброякісні або злоякісні проліферативні захворюше. 15 79518 16 Одержання проміжної сполуки формули V Етил-1-(3-ціанофеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 3-ціаноаніліном 3-броманілін, одержують вказаний в заголовку нафтиридон 3. 1 Н ЯМР (DMSO-d6) δ 1,27 (т, 3Н), 4,23 (кв., 2Н), 7,57 (дд, 1Н), 7,80 (т, 1Н), 7,96-8,04 (м, 2Н), 8,20 (т, 1Н), 8,61 (дд, 1Н), 8,86 (дд, 1Н), 8,70 (с, 1Н). Нафтиридон 4 Нафтиридон 1 Стадія 1: Етил-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат Суміш етил-2-хлорнікотиноїлацетату (комерційно доступний або одержаний за методикою, [описаною в J. Het. Chem., 30, 855, 1993] (1екв.), триетиламіну (4екв.) і етил 3,3диметиламіноакрилату (1,5екв.) в ацетонітрилі (0,5 м) кип'ятять зі зворотним холодильником протягом 3 год., о холоджують до температури 40-50°С і додають 3-броманілін (1екв.). Реакційну суміш кип'я тять зі зворотним холодильником протягом ночі, охолоджують до кімнатної температури, розбавляють водою (2 об'єми). Продукт виділяють фільтрацією і промивають водою, ефіром або ацетонітрилом-водою (1:1). 1 Н ЯМР (Ацетон-d6) δ 1,32 (т, 3Н), 4,29 (кв., 2Н), 7,54-7,63 (м, 2Н), 7,69 (дд, 1Н), 7,78 (дд, 1Н), 7,93 (с, 1Н), 8,66-8,71 (м, 3Н). Нафтиридон 2 Етил-1-(3-ацетиленілфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 3-ацетиленіланіліном 3-броманілін, одержують вказаний в заголовку нафтиридон 2. 1 Н ЯМР (CDCІ3) δ 1,42 (т, 3Н), 3,19 (с, 1Н), 4,20 (кв., 2H), 7,42-7,46 (м, 2Н), 7,53-7,59 (м, 2Н), 7,67 (дт, 1Н), 8,64 (дд, 1Н), 8,86 (с, 1Н), 8,83 (дд, 1Н). Нафтиридон 3 Етил-1-(4-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 4-броманіліном 3-броманілін, одержують вказаний в заголовку нафтиридон 4. 1 Н ЯМР (DMSO-d6) δ 1,26 (т, 3Н), 4,22 (кв., 2Н), 7,54-7,59 (м, 3Н), 7,78 (д, 2Н), 8,61 (дд, 1Н), 8,63 (с, 1Н), 8,68 (дд, 1H). Нафтиридон 5 Етил-1-(2-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 2-броманіліном 3-броманілін, одержують вказаний в заголовку нафтиридон 5. 1 Н ЯМР (DMSO-d6) δ 1,26 (т, 3Н), 4,23 (кв., 2Н), 7,53-7,62 (м, 3Н), 7,75 (дд, 1Н), 7,78 (дд, 1Н), 8,61 (с, 1H), 8,63 (дд, 1Н), 8,68 (дд, 1Н). Нафтиридон 6 Етил-1-(2-трет-бутилфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 1-бром-2-трет-бутилфеніланіліном 3броманілін, одержують вказаний в заголовку нафтиридон 6. 1 Н ЯМР (DMSO-d6) δ 1,08 (с, 9Н), 1,25 (т, 3Н), 4,22 (кв., 2Н), 7,30-7,40 (м, 2Н), 7,50-7,56 (м, 2Н), 7,73 (дд, 1Н), 8,59 (с, 1Н), 8,62 (дд, 1Н), 8,70 (дд, 1H). 17 79518 Нафтиридон 7 Етил-1-(3-фенілборна кислота)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою одержання нафтиридону 1, але замінюючи 3-амінофенілборною кислотою 3броманілін, одержують вказаний в заголовку нафтиридон 7. 1 Н ЯМР (DMSO-d6) δ 1,26 (т, 3Н), 4,22 (кв., 2Н), 7,56 (збіг триплетів, 2Н), 7,60 (д, 1Н), 7,87 (с, 1Н), 7,94 (д, 1Н), 8,24 (с, 2Н, обмінний), 8,61 (д, 1Н), 8,62 (с, 1Н), 8,68 (д, 1H). Сполуки інгібітори ФДЕ-4 Далі представлені приклади сполук інгібіторів ФДЕ-4, які можуть бути одержані за описаними нижче методиками. Необхідно відмітити, що номери s формул, які застосовують у схемах 1-12 і описах даних схем не треба змішувати з номерами формул, що застосовуються де-небудь ще в описі заявки. Сполуки у прикладах 1-13 одержують із застосуванням нафтиридону 1. Схема 1 У першому способі, описаному в схемі 1 нижче, відповідним чином заміщене похідне етил-2хлорнікотиноїлацетату формули II піддають взаємодії з 1,5 еквівалентами триетилортоформіату і 5 еквівалентами оцтового ангідриду при температурі 130°С, і після видалення летких компонентів неочищений 2-хлорнікотиноїлакрилат формули III відразу ж піддають взаємодії з 1,2 еквівалентами відповідним чином заміщеного галогенариламіну формули IV, такого як, наприклад, 3-броманілін, в галогенованому вугле водневому розчиннику, такому як метиленхлорид, при температурі від 0°С до кімнатної температури. Після необхідного для реакції проміжку часу, що варіюється від 2 до 24 годин, одержаний 3-ариламіноакрилат формули V одержують випарюванням розчинника і далі очищають хроматографією на силікагелі або кристалізацією з прийнятного розчинника. Альтернативно, сполука формули V може застосовуватись на наступній стадії без подальшого очищення. Циклізацію сполуки формули V до 1галогенарил-1,4-дигідро[1,8]нафтиридин-4-он карбоксилату формули VI проводять обробкою невеликим надлишком сильної основи, такої як гідрид лужного металу, наприклад, гідрид натрію, у відповідному розчиннику, такому як тетрагідрофуран, при вихідній температурі 0°С, нагріваючи до кімнатної температури, якщо це необхідне для завершення процесу. Продукт формули VI виділяють в неочищеній формі розбавленням великим об'ємом води з подальшою фільтрацією або екстрагуванням у відповідний органічний розчинник, такий як діетиловий ефір, етилацетат або галогенований вуглеводневий розчинник, такий як хлороформ або метиленхлорид. Продукт може бути далі очищений хроматографією на силікагелі, кристалізацією або тривалим перемішуванням у прийнятному розчиннику з подальшою фільтрацією. 18 Одержаний таким чином продукт формули VI може бути гідролізований до відповідного похідного карбонової кислоти в основних умовах, із застосуванням водного розчину лужної основи, такого як лужний карбонат або, переважно, гідроксид натрію або калію, з органічним співрозчинником, таким як тетрагідрофуран або первинний, вторинний або третинний алканол, такий як метанол або етанол, або їх суміш, при температурах від кімнатної температури до температури кипіння зі зворотним холодильником, протягом відповідного періоду часу. Одержану карбонову кислоту виділяють в неочищеній формі з подальшим підкисленням із застосуванням водного розчину неорганічної кислоти, такої як соляна, сірчана або подібні кислоти, і фільтрацією або екстрагуванням у відповідний органічний розчинник, такий як діетиловий ефір, етилацетат або галогенований вуглеводневий розчинник, такий як хлороформ або метиленхлорид. Далі продукт може бути очищений хроматографією на силікагелі, кристалізацією або тривалим перемішуванням у відповідному розчиннику з подальшою фільтрацією. Потім карбонову кислоту перетворюють у відповідний аналог первинного, вторинного або третинного аміду формули VII за будь-якою загальною методикою, добре відомою фахівцеві в галузі органічної хімії, переважно через первинне перетворення у змішаний ангідрид обробкою невеликим надлишком, наприклад, 1,25 еквіваленти, відповідного алкілхлорформіату, такого як етил- або ізобутилхлорформіат, у присутності більшого надлишку, наприклад, 2,5 еквіваленти, третинного органічного аміну, такого як триетиламін або Ν,Νдіізопропілетиламін, в органічному розчиннику, такому як тетрагідрофуран, при низькій температурі, переважно 0°С, протягом від 30 хвилин до 3 годин. Потім додають надлишок, звичайно 5 або більше еквівалентів, відповідну первинного або вторинного аміну або водного розчину гідроксиду амонію, і одержану реакційну суміш витримують при температурі від 0°С до кімнатної температури протягом відповідного періоду часу, звичайно 1-24 години. Потім бажаний амід формули VII виділяють в неочищеній формі осадженням водою і фільтрацією або екстрагуванням у відповідний органічний розчинник, такий як діетиловий ефір, етилацетат або галогенований вуглеводневий розчинник, такий як хлороформ або метиленхлорид. Далі продукт може бути очищений хроматографією на силікагелі, кристалізацією або тривалим перемішуванням у відповідному розчиннику з подальшою фільтрацією. Якщо амідна група являє собою 2,6-дихлорпіридин-4-іл, застосовують іншу методику, в якій аніон 4-аміно-3,5-дихлорпіридину утвориться при низькій температурі, переважно при 0°С, з використанням сильного лужного гідриду, такого як гідрид натрію, в розчиннику, такому як тетрагідрофуран, і його піддають взаємодії з хлорангідридом карбонової кислоти (після гідролізу складного ефіру формули VI), одержаним за відповідною відомою методикою, звичайно з оксалілхлориду, активованого каталітичною кількістю Ν,Ν-диметилформаміду в розчиннику, такому як тетрагідрофуран. 19 79518 20 Аміди загальної формули VII перетворюють в продукти формули І взаємодією з відповідним чином заміщеним арилом або гетероарилом борної кислоти або борного ефіру формули VIII у присутності каталізатора на основі перехідного металу, такого яктрансдибромбіс(трифенілфосфін)паладій (II) або [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладій (II), у відповідному розчиннику або суміші розчинників, переважно, 1:1 суміші толуолу і етанолу, у присутності надлишку водного розчину лужної основи, такої як карбонат натрію, при відповідній температурі, переважно від 50 до 100°С, протягом відповідного періоду часу, від 0,5 до 48 годин. Одержаний продукт реакції потім виділяють у неочищеній формі осадженням водою і фільтрацією або екстрагуванням у відповідний органічний розчинник, такий як діетиловий ефір, етилацетат або галогенований вуглеводневий розчинник, такий як хлороформ або метиленхлорид. Продукт далі може бути очищений хроматографією на силікагелі, кристалізацією або тривалим перемішуванням у відповідному розчиннику з подальшою фільтрацією. Сполуки формули І також можуть бути одержані взаємодією сполуки формули VII з відповідним чином заміщеним арил- або гетероарилтрибутилстананом формули IX із застосуванням каталізатора на основі перехідного металу, такого як транс-дибромбіс(трифенілфосфін)паладій (II) або [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладій (II), у присутності сполук міді (І), таких як йодид міді, у В альтернативному способі одержання сполук відповідному розчиннику, такому як Ν,Νформули І, показаному на схемі 2 нижче, амід фодиметилформамід, при температурі від 50 до рмули VII може бути перетворений у відповідний 100°С протягом від 2 до 24 годин. Виділення проборний ефір формули XI обробкою надлишком дукту реакції проводять як описано вище. диборпінаконового ефіру у присутності неорганічАльтернативно, складний ефір формули VI ної солі, такої як ацетат калію, у присутності катаможе бути перетворений у складний ефір формулізатора на основі перехідного металу, такого як ли X взаємодією з відповідним чином заміщеною транс-дибромбіс(трифенілфосфін)паладій (II) або борною кислотою або борним ефіром, або з відпо[1,1'-біс(дифенілфосфіно)фероцен]дихлорпаладій відним чином заміщеним похідним станану, в опи(II), в розчиннику, такому як Ν,Νсаних вище умовах, і складний ефір може бути диметилформамід, при температурі від 50 до гідролізований і перетворений в амід формули І. 100°С протягом від 1 до 48 годин. Борат формули Борні кислоти формули VIII або відповідний XI може бути виділений осадженням водою і фільборний ефір звичайно одержують з комерційних трацією або екстрагуванням у відповідний органічджерел. Якщо необхідно, вони можуть бути легко ний розчинник, такий як діетиловий ефір, етилацеодержані з відповідних галогенідів металуванням тат або галогенований вуглеводневий розчинник, н-бутиллітієм з подальшою взаємодією з триалкілтакий як хлороформ або метиленхлорид. Одержаборатом, або із застосуванням класичних методик ний продукт може бути далі очищений хроматогпоєднання, каталізованих перехідним металом, із рафією на силікагелі, кристалізацією або тривалим застосуванням диборпінаконового ефіру. Станани перемішуванням у відповідному розчиннику з поформули IX одержують з відповідних галогенідів, дальшою фільтрацією. спочатку металуванням із застосуванням нАльтернативно, борат формули XI може забутиллітію, потім додаванням хлориду трибутилостосовуватись in situ в реакційному середовищі лова. без виділення, і зазнавати взаємодії з невеликим лишком відповідним чином заміщеного арил- або гетероарилгалогеніду формули XII у присутності каталізатора на основі перехідного металу, таким як [1,1’біс(дифенілфосфіно)фероцен]дихлорпаладій (II), у відповідному розчиннику або суміші розчинників, переважно, 1:1 суміші толуолу і етанолу, у присутності надлишку водного розчину лужної основи, такої як карбонат натрію, при відповідній темпера 21 79518 22 турі, переважно від 50 до 100°С, протягом відповіповідним чином заміщену анілінборну кислоту фодного періоду часу від 0,5 до 48 годин. рмули XV піддають поєднанню з відповідним Продукт реакції формули І потім виділяють в чином заміщеним арил- або гетероарилгалогенінеочищеній формі осадженням водою і фільтрацідом формули XII у присутності каталізатора на єю або екстрагуванням у відповідний органічний основі перехідного металу як описано вище, з розчинник, такий як діетиловий ефір, етилацетат одержанням сполук формули XIII, що застосовуабо галогенований вуглеводневий розчинник, таються на схемі 3. кий як хлороформ або метиленхлорид. Одержаний продукт може бути далі очищений хроматографією на силікагелі, кристалізацією або тривалим перемішуванням у відповідному розчиннику з подальшою фільтрацією. У третьому способі, що застосовується для синтезу сполук формули І відповідно до даного винаходу (схема 3), проміжний нікотиноїлакрилат формули III піддають взаємодії з відповідним чином одержаним діарил- або гетероариламіном формули XIII в умовах, описаних вище, з одержанням сполуки формули XIV, яку циклізують взаємодією з сильною основою, такою як гідрид натрію, як описано вище, з одержанням складного ефіру формули X, який перетворюють у сполуку формули І шляхом гідролізу і утворення аміду, як описано вище. Похідні діарил- або гетероарилариламіну формули XIII одержують як показано на схемі 4. Від Бромпіридинові проміжні сполуки, заміщені в положенні 2 нуклеофілами на основі вуглецю формули XVII, в яких R8 вибирають з R2 груп, що мають зв'язок вуглець-вуглець з піридином, одержують як показано на схемі 5. Бром піридинові проміжні сполуки одержують з дигалогенідів формули XVI обробкою відповідним розчином реактиву Гріньяра, у присутності каталізатора на основі перехідного металу, такого як [1,1’біс(дифенілфосфіно)фероцен]дихлор-нікель (II), в розчиннику, такому як тетрагідрофуран, при температурі від-10°С до кімнатної температури, і одержану реакційну суміш обробляють за добре відомими методиками з одержанням бажаного продукту. Галопіридинові проміжні сполуки формули XVIII, з яких замісником в положенні 2 є алкоксигрупа OR9, одержують з дигалогенідів формули XVI заміщенням відповідним лужним алкоксидом, як показано на схемі 6. Реакцію проводять в розчиннику, такому як Ν,Ν-диметилформамід, при температурі від 0°С до кімнатної температури, і, при завершенні реакції, продукти виділяють і очищають класичними методами. Якщо необхідні проміжні сполуки формул XIX або XX, в яких замісником в положенні 2 є сульфід, сульфоксид або сульфон, їх одержують як описано на схемі 7. Відповідний дигалопіридин формули XVI піддають взаємодії з відповідним тіоалкоксидом, що звичайно одержується з відповідного тіолу або дисульфіду під дією сильної основи, такої як лужний гідрид або н-бутиллітій, в розчиннику, такому як Ν,Ν-диметилформамід або діетиловий ефір, при температурі від-78°С до кімнатної температури. При завершенні реакції продукти формули XIX виділяють і очищають класичними методами. Одержані таким чином продукти 23 79518 24 можуть бути окислені до відповідних сульфоксидів або сульфонів формули XX обробкою окислюваR7 і R8 можуть бути однаковими або різними, льним агентом, таким як оксон або органічна пероабо R7, або R8 може бути воднем. ксикислота. На схемі 10 показані методи синтезу сполук На схемі 7 R10 є Η або С 1-6алкілом. формули І, в яких R2 є заміщеним фенілом або гетероарилом. Проміжну сполуку формули І, в якому R2 є галогеном, піддають взаємодії з відповідним чином заміщеною борною кислотою або борним ефіром формули VII або трибутилстананом формули IX, використовуючи один з методів, описаних вище, з одержанням бажаного сполуки. Одержання галогенацилпіридинових проміжних сполук формули XXII, представлених на схемі 8, вимагає обробки галогенпіридинового ефіру формули XXI розчином відповідного реактиву Гріньяра, в розчиннику, такому як діетиловий ефір, при температурі від 0°С до кімнатної температури. Якщо реакцію проводять протягом більш тривалого періоду часу або при кип'ятінні зі зворотним холодильником, одержують галогенпіридинкарбінол формули XXIII. На схемах 8 і 9 R7 є С16 6алкілом і R є метилом або етилом. На схемі 9 показаний альтернативний спосіб синтезу певних галогенпіридинкарбінолів формули XXIII. Якщо 2,5-дибромпіридин обробляють нбутиллітієм в толуолі при температурі-78°С з подальшим додаванням відповідного кетону або альдегіду, з подальшим гасінням реакції при температурі-78°С, одержують карбінол формули XXIII, в якому карбінольна група займає положення 2 піридинового кільця. Якщо стадію металування здійснюють в діетиловому ефірі, той же процес дає проміжну сполуку формули XXIII, в якому карбінольна група займає положення 5 піридинового кільця. Різні подальші перетворення заздалегідь одержаних сполук формули І представлені на схемі 11. Якщо арильною групою є піридинова або хінолінова група, сполука може бути окислена до відповідного оксиду азоту обробкою відповідним окислювальним агентом, таким як мхлорпероксибензойна кислота або монопероксифталат магнію, в умовах, що застосовуються звичайно. Якщо одним або більше замісниками Аr групи є кетон, сполуку перетворюють в аналог оксиму обробкою гідроксиламіном в піридині як розчинником. Сульфідний замісник легко окислюється до відповідного сульфоксиду або сульфону при застосуванні відповідної кількості окислювача, такого як оксон або органічна пероксикислота. Перетворення 2-бензилоксипіридину у відповідний 2-піридон здійснюють обробкою трифтороцтовою кислотою в розчиннику, такому як метиленхлорид, при кімнатній температурі або при незначному нагріванні. Видалення третбутоксикарбонільної захисної групи з піперазинового кільця здійснюють взаємодією з трифтороцтовою кислотою в розчиннику, такому як 1,2дихлоретан при температурі кипіння зі зворотним холодильником. У прикладах, де замісник Аr є гідроксиметильною групою, він може бути перетворений в аналогічну галогенметильну гр упу із застосуванням тетрагалогенметану у присутності тризаміщеного фосфіну, такого як трифенілфосфін або дифос, в розчиннику, такому як метиленхлорид. Галогенід може бути заміщений відповідною натрієвою сіллю сульфінової кислоти з одержанням алкіл- або арилсульфонілметилового аналога. 25 79518 26 (NMO) у присутності каталітичної кількості дигідрату осмату калію. Перетворення 1-гідрокси-1-метилалкілового похідного, такого як сполука формули XXIV на схемі 12, в 1,2-дигідроксіалкілові аналоги формули XXVI здійснюють спочатку дегідратацією із застосуванням кислого каталізатора, наприклад, нагріванням у водній сірчаній кислоті, з одержанням проміжної 1-алкілвінілової сполуки формули XXV, яку перетворюють в бажаний діол формули XXVI дигідроксилуванням, використовуючи, наприклад, окислювач, такий як 4-метилморфолін N-оксид Приклади Приклади даного винаходу, представлені в наступній таблиці, відносяться до формули (І) 27 79518 28 29 79518 30 31 79518 32 33 79518 Приклад 1 N-Ізопропіл-1-[3-(3-ацетилфеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 1: Етил-3-(3-броманіліно)-2-(2хлорнікотиноїл)акрилат Суміш етил-2-хлорнікотиноїлацетату (41,1г, 180,5ммоль), триетилортоформіату (40,12г, 271ммоль) і оцтового ангідриду (92,05г, 902,5ммоль) нагрівають при температурі 130°С протягом 2,5 годин. Леткі компоненти відганяють, і залишок двічі спільно упарюють з ксилолом. Маслянистий залишок розчиняють в метиленхлориді (250мл) і повільно додають 3-броманілін (37,25г, 216,6ммоль). Одержаний розчин перемішують при кімнатній температурі протягом 18 годин і розчинник випарюють. Одержану неочищену сполуку застосовують як є на наступній стадії. Стадія 2: Етил-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат Неочищену сполуку зі стадії 1 розчиняють в тетрагідрофурані (500мл), розчин охолоджують до температури 0°С і порціями додають гідрид натрію (у вигляді 60% дисперсії в олії, 9,4г, 235ммоль). Після перемішування при температурі 0°С протягом 1 години, суміші дозволяють нагрітись до кімнатної температури. Через 2 години до суспензії додають воду (400мл), і нерозчинну тверду речовину фільтрують і рясно промивають водою. Коли вона висохне, тверду речовину перемішують в ефірі (150мл) при кімнатній температурі протягом 24 годин і фільтрують з одержанням вказаної в заголовку сполуки у вигляді кремової твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 1,32 (т, 3Н), 4,29 (кв, 2Н), 7,54-7,63 (м, 2Н), 7,69 (дд, 1Н), 7,78 (дд, 1Н), 7,93 (с, 1Н), 8,66-8,71 (м, 3Н). Стадія 3: 1-(3-Бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонова кислота Суспензію етил 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилату зі стадії 2 (52,5г, 140,7ммоль) в суміші тетрагідрофурану (400мл), метанолу (400мл) і IN водного гідроксиду натрію (280мл) нагрівають при температурі близько 50°С при перемішуванні протягом 20 хвилин. Після охолоджування суміш розбавляють водою (300мл) і додають IN водну НСl (325мл). Після перемішування протягом 45 хвилин осад фільтрують, добре промивають водою і сушать з одержанням вказаної в заголовку кислоти у вигляді кремової твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 7,65 (т, 1Н), 7,76 (м, 2Н), 7,84 (д, 1Н), 7,99 (с, 1Н), 8,87 (м, 2Н), 9,01 (с, 1H). Стадія 4: N-Ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід До суспензії 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти 34 зі стадії 3 (26,3г, 76ммоль) і триетиламіну (23,2г, 230ммоль) в тетрагідрофурані (1000мл) при температурі 0°С додають ізобутилхлорформіат (18,85г, 138ммоль). Після перемішування при температурі 0°С протягом 2 годин додають ізопропіламін (23г, 390ммоль) і суміші дозволяють нагрітись до кімнатної температури і перемішують протягом ночі. Потім суміш розподіляють між етилацетатом і водою, органічну фазу, сушать і випарюють до твердої речовини, яку перемішують в ефірі при кімнатній температурі протягом 3 годин і фільтрують з одержанням N-ізопропіл-1-(3бромфеніл)-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксаміду у вигляді білої твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 1,25 (д, 6Н), 4,17 (м, 1Н), 7,59-7,63 (м, 2Н), 7,70 (д, 1Н), 7,80 (д, 1Н), 7,94 (с, 1Н), 8,73 (м, 1Н), 8,78 (д, 1Н), 8,85 (с, 1Н), 9,61 (уш., ΝΗ). Стадія 5: N-Ізопропіл-1-[3-(3ацетилфеніл)феніл]-1,4-дигідро[1,8]нафтиридин-4он-3-карбоксамід Суміш N-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду зі стадії 4,3-ацетилфенілборної кислоти (1,2екв.), транс-дибромбіс(трифенілфосфін)паладію (II) (0,05екв.), толуолу (6мл/ммоль), етанолу (2мл/ммоль) і 2М водного карбонату натрію (8екв.) кип'ятять зі зворотним холодильником протягом 1 години в атмосфері азоту. Суміш розбавляють етилацетатом і органічну фаз у промивають водою і насиченим розчином солі, сушать і випарюють. Неочищений продукт піддають хроматографії на силікагелі, елююючи градієнтом 20-40% ефіру в метиленхлориді з одержанням продукту Νізопропіл-1-[3-(3-ацетилфеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 1,29 (д, 6Н), 2,65 (с, 3Н), 4,28 (м, 1Н), 7,47 (м, 2Н), 7,55 (т, 1Н), 7,65 (м, 2Н), 7,80 (м, 2Н), 7,95 (дд, 1Н), 8,19 (уш.с, 1Н), 8,70 (дд, 1Н), 8,81 (дд, 1Н), 9,05 (с, 1Н), 9,65 (уш, ΝΗ). Приклад 2 N-(2,6-Дихлорпіридин-4-іл)-1-[3-(3ацетилфеніл)(феніл]-1,4-дигідро[1,8]-нафтиридин4-он-3-карбоксамід Стадія 1: Аніон 4-аміно-3,5-дихлорпіридину Суспензію гідриду натрію у вигляді 60% дисперсії в олії (360мг, 9ммоль) в тетрагідрофурані (15мл) охолоджують до температури 0°С. Повільно додають розчин 4-аміно-3,5-дихлорпіридину (978мг, 6ммоль) в тетрагідрофурані (15мл). Одержану суміш витримують при температурі 0°С протягом 2,5 годин. Стадія 2: Хлорангідрид 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти Суспензію 1-(3-бромфеніл)-1,4 35 79518 36 дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти Приклад 4 зі стадії 3 прикладу 1 (690мг, 2ммоль) в тетрагідN-Ізопропіл-1-[3-(4-ацетилфеніл)феніл]-1,4рофурані (12мл) охолоджують до температури 0°С дигідро[1,8]нафтиридин-4-он-3-карбоксамід і додають оксалілхлорид (381мг, 3ммоль) з подальшим додаванням 2 крапель Ν,Νдиметилформаміду. Потім одержану суміш перемішують при кімнатній температурі протягом 1 години, потім кип'ятять зі зворотним холодильником протягом 45 хвилин і охолоджують до кімнатної температури. Стадія 3: N-(2,6-Дихлорпіридин-4-іл)-1-(3бромфеніл)-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід Суміш зі стадії 2 у вигляді коричневої суспензії За методикою стадії 5 прикладу 1, але замідодають через шприц до холодної суспензії зі станюючи 4-ацетилфенілборною кислотою 3дії 1. Одержану суміш перемішують при кімнатній ацетилфенілборну кислоту, одержують вказану в температурі протягом 18 годин, гасять водним заголовку сполуку у вигляді твердої речовини. 1 насиченим розчином хлориду t амонію і розподіН ЯМР (Ацетон-d6) δ 1,25 (д, 6Н), 2,61 (с, 3Н), ляють між етилацетатом і водою. Неочищений 4,17 (м, 1Н), 7,59 (м, 1Н), 7,70 (д, 1Н), 7,76 (т, 1Н), продукт після випарювання органічної фази розти7,92 (д, 2Н), 7,97 (д, 1Н), 8,07-8,10 (м, 3Н), 8,72 рають з ефіром (50мл) і фільтрують з одержанням (уш.с, 1Н), 8,78 (дд, 1Н), 8,92 (с, 1Н) 9,65 (уш., ΝΗ). N-(2,6-дихлорпіридин-4-іл)-1-(3-бромфеніл)-1,4Приклад 5 дигідро[1,8]-нафтиридин-4-он-3-карбоксаміду у N-ізопропіл-1-[3-(2-метилфеніл)феніл]-1,4вигляді бежевої твердої речовини. дигідро[1,8]нафтиридин-4-он-3-карбоксамід 1 Н ЯМР (Ацетон-d6) δ 7,61-7,70 (м, 2Н), 7,76 (д, 1Н), 7,81 (д, 1Н), 8,00 (с, 1Н), 8,62 (с, 2Н), 8,80 (уш.с, 1Н), 8,86 (д, 1Н), 8,99 (с, 1H) 12,1 (уш., ΝΗ). Стадія 4: N-(2,6-Дихлорпіридин-4-іл)-1-[3-(3ацетилфеніл)феніл]-1,4-дигідро-[1,8]нафтиридин4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але замінюючи N-(2,6-дихлорпіридин-4-іл)-1-(3бромфеніл)-1,4-дигідро[1,8]нафтиридин-4-он-3За методикою стадії 5 прикладу 1, але замікарбоксамідом зі стадії 3 N-ізопропіл-1-(3нюючи 2-метилфенілборною кислотою 3бромфеніл)-1,4-дигідро[1,8]нафтиридин-4-он-3ацетилфенілборну кислоту, одержують вказану в карбоксамід, одержують N-(2,6-дихлорпіридин-4заголовку сполуку у вигляді твердої речовини. 1 іл)-1-[3-(3-ацетилфеніл)феніл]-1,4Н ЯМР (Ацетон-d6) δ 1,24 (д, 6Н), 2,35 (с, 3Н), дигідро[1,8]нафтиридин-4-он-3-карбоксамід у ви4,17 (м, 1Н), 7,27-7,34 (м, 4Н), 7,56-7,60 (м, 2Н), гляді твердої речовини. 7,65 (м, 2Н), 7,70 (т, 1Н), 8,74 (м, 1Н), 8,78 (дд, 1Н), 1 Н ЯМР (CDCІ3) δ 2,65 (с, 3Н), 7,47 (д, 1Н), 8,92 (с, 1Н) 9,64 (уш., ΝΗ). 7,50-7,60 (м, 2Н), 7,70 (м, 2Н), 7,82 (д, 2Н), 7,98 (д, Приклад 6 1Н), 8,20 (с, 1Н), 8,55 (с, 2Н), 8,75 (уш.с, 1Н), 8,92 N-Ізопропіл-N-метил-1-[3-(4(дд, 1Н), 9,14 (с, 1Н) 12,08 (уш., ΝΗ). ацетилфеніл)феніл]-1,4-дигідро[1,8]нафтиридин-4Приклад 3 он-3-карбоксамід N-ізопропіл-1-[3-(4-н-пропілфеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але замінюючи 4-н-пропілфенілборною кислотою 3ацетилфенілборну кислоту, одержують вказану в заголовку сполуку у вигляді білої твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 0,93 (т, 3Н), 1,24 (д, 6Н), 1,65 (м, 2Н), 2,62 (т, 2Н), 4,18 (м, 1Н), 7,31 (д, 2Н), 7,58-7,61 (м, 2Н), 7,68-7,72 (м, 3Н), 7,87 (д, 1Н), 7,95 (с, 1Н), 8,72 (м, 1Н), 8,78 (дд, 1Н), 8,92 (с, 1Н), 9,66 (уш., ΝΗ). Стадія 1: N-Ізопропіл-N-метил-1-(3бромфеніл)-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксамід За методикою прикладу 1, стадія 4, але замінюючи N-iзопропіл-N-метиламіном ізопропіламін, одержують N-ізопропіл-N-метил-1-(3-бромфеніл)1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід у вигляді жовтої твердої речовини. 1 Н ЯМР (Ацетон-d6) (існує у вигляді двох ротамерів аміду) 6 1,18 (м, 6Н), 2,85 (с, 3Н), 4,05 (м, 0,5 Н), 4,84 (м, 0,5 Н), 7,49-7,64 (м, 3Н), 7,72 (д, 1Н), 7,86 (с, 1Н), 8,14 (с, 1Н), 8,65 (д,2Н). 37 79518 38 Стадія 2: N-Ізопропіл-N-метил-1-[3-(4ацетилфеніл)феніл]-1,4-дигідро[1,8]-нафтиридин4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але замінюючи N-ізопропіл-N-метил-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамідом зі стадії 1 N-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід, і замінюючи 4-ацетилфенілборною кислотою 3-ацетил фенілборну кислоту одержують N-ізопропіл-NСтадія 1: N-трет-Бутил-1-(3-бромфеніл)-1,4метил-1-[3-(4-ацетилфеніл)феніл]-1,4-дигідро[1,8]дигідро[1,8]нафтиридин-4-он-3-карбоксамід нафтиридин-4-он-3-карбоксамід у вигляді білої За методикою прикладу 1, стадія 4, але замітвердої речовини. 1 нюючи трет-бутиламіном ізопропіламін, одержуH ЯМР (CDCI3) (існує у вигляді двох ротамеють N-трет-бутил-1-(3-бромфеніл)-1,4-дигідро[1,8]рів аміду) δ 1,23 (м, 6Н), 2,62 (с, 3Н), 4,00 (м, 0,5 нафтиридин-4-он-3-карбоксамід у вигляді жовтої Н), 4,92 (м, 0,5 Н), 7,38-7,55 (м, 2Н), 7,63-7,77 (м, твердої речовини. 5Н), 8,03 (д, 2Н), 8,14 (с, 0,5 Н), 8,21 (с, 0,5 Н), 8,65 1 Н ЯМР (Ацетон-d6) δ 1,44 (с, 9Н), 7,58-7,62 (м, (м, 1Н), 8,75-8,80 (м, 1H). 2Н), 7,70 (дд, 1Н), 7,78 (дд, 1Н), 7,93 (уш.с, 1Н), Приклад 7 8,72 (м, 1Н), 8,77 (дд, 1Н), 8,81 (с, 1Н) 9,73 (уш., N-ізопропіл-1-[3-(піридин-3-іл)феніл]-1,4ΝΗ). дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 2: N-трет-Бутил-1-[3-(4ацетилфеніл)феніл]-1,4-дигідро[1,8]-нафтиридин4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але замінюючи N-трет-бутил-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамідом зі стадії 1 N-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід, і замінюючи 4-ацетилфенілборною кислотою 3За методикою стадії 5 прикладу 1, але заміацетилфенілборну кислоту одержують N-третнюючи піридин-3-борної кислоти 1,3бутил-1-[3-(4-ацетилфеніл)феніл]-1,4пропандіоловим циклічним ефіром 3дигідро[1,8]нафтиридин-4-он-3-карбоксамід з виацетилфенілборну кислоту, і замінюючи [1,1’ходом 93% у вигляді білої твердої речовини. біс(дифенілфосфіно)фероцен]дихлорпаладієм (II) 1 Н ЯМР (Ацетон-d6) δ 1,45 (с, 9Н), 2,61 (с, 3Н), транс-дибромбіс(трифенілфосфін)паладій (II), 7,59 (м, 1Н), 7,69-7,72 (м, 1Н), 7,77 (т, 1Н), 7,92одержують вказану в заголовку сполуку у вигляді 7,99 (м, 3Н), 8,07-8,11 (м, 3Н), 8,72 (м, 1Н), 8,78 бежевої твердої речовини. 1 (дд, 1Н), 8,91 (с, 1Н), 9,79 (уш., ΝΗ). Н ЯМР (Ацетон-d6) δ 1,24 (д, 6Н), 4,17 (м, 1Н), Приклад 10 7,48 (м, 1Н), 7,60 (м, 1Н), 7,71 (дд, 1Н), 7,78 (т, 1Н), N-(2,6-Дихлорпіридин-4-іл)-1-[3-(піридин-37,95 (дд, 1Н), 8,05 (уш.с, 1Н), 8,15 (м, 1Н), 8,60 (м, іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-31Н), 8,72 (м, 1Н), 8,78 (дд, 1Н), 8,92 (с, 1Н), 8,99 карбоксамід (уш.с, 1Н), 9,65 (уш., ΝΗ). Приклад 8 N-ізопропіл-1-[3-(індол-5-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але заміg нюючи 5-індолілборною кислотою 3ацетилфенілборну кислоту, одержують вказану в заголовку сполуку у вигляді білуватої твердої речовини. 1 Н ЯМР (ДМСО-d6) δ 1,20 (д, 6Н), 4,10 (м, 1Н), 6,47 (с, 1Н), 7,38 (уш.с, 1Н), 7,46-7,52 (м, 3Н), 7,597,66 (м, 2Н), 7,87-7,93 (м, 3Н), 8,72-8,81 (м, 3Н), 9,67 (уш., NH), 11,2(yш.,NH). Приклад 9 N-трет-Бутил-1-[3-(4-ацетилфеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 4 прикладу 2, але замінюючи [1,1'біс(дифенілфосфіно)фероцен]дихлорпаладієм (II) транс-дибромбіс-(трифенілфосфін)паладій (II) і замінюючи піридин-3-борної кислоти 1,3пропандіоловим циклічним ефіром 3ацетилфенілборну кислоту, одержують вказану в заголовку сполуку у вигляді прозорої твердої речовини. 1 H ЯМР (Ацетон-d6) 6 7,48 (м, 1Н), 7,68 (м, 1Н), 7,77-7,82 (м, 2Н), 7,98 (м, 1Н), 8,12-8,17 (м, 2Н), 8,61 (м, 1Н), 8,62 (с, 2Н), 8,80 (м, 1Н), 8,88 (дд, 1Н), 8,99 (уш.с, 1Н), 9,06 (с, 1Н), 12,2 (уш., ΝΗ). Приклад 11 N-Ізопропіл-1-{3-[4-(4 39 79518 40 третбутилоксикарбонілпіперазин-1транс-дибромбіс-(трифенілфосфін)паладій (II) і іл)феніл]феніл}-1,4-дигідро[1,8]нафтиридин-4-онзамінюючи борною кислотою зі стадії 2 33-карбоксамід ацетилфенілборну кислоту одержують 4-третбутилоксикарбоніл-1-(3-бромфеніл)піперазинове похідне у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 1,30 (д, 6Н), 1,49 (с, 9Н), 3,18 (м, 4Н), 3,58 (м, 4Н), 4,29 (м, 1Н), 6,98 (д, 2Н), 7,32 (д, 1Н), 7,45 (м, 1Н), 7,53 (д, 2Н), 7,55-7,62 (м, 2Н), 7,72 (д, 1Н), 8,70 (м, 1Н), 8,82 (д, 1Н), 9,07 (с, 1Н), 9,68 (уш., ΝΗ). Приклад 12 N-Ізопропіл-1-[3-(хінолін-3-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-карбоксамід ї Стадія 1: 4-трет-Бутилоксикарбоніл-1-(3бромфеніл)піперазин До суспензії гідрохлорид 1-(4бромфеніл)піперазину (103,15г, 371,59ммоль) в ацетонітрилі (1,5л) при температурі 0°С в атмосфері азоту додають каталітичну кількість 4диметиламінопіридину (4,54г, 37,159ммоль) з подальшим додаванням триетиламіну (155мл, 1114,77ммоль) і ди-трет-бутилдикарбонату (121,65г, 557,385ммоль, розчинений в мінімальній кількості ацетонітрилу), і одержану реакційну суміш нагрівають до кімнатної температури і перемішують протягом 5,5 годин. Реакційну суміш фільтрують, додають етилацетат і органічну фазу промивають 10% водною лимонною кислотою, водою (2х) і насиченим розчином солі, потім сушать і випарюють з одержанням неочищеного продукту 4-трет-бутилоксикарбоніл-1-(3бромфеніл)піперазину, який застосовують як такий на наступній стадії. Стадія 2: 3-(4-третБутилоксикарбонілпіперазин-1-іл)-фенілборна кислота До 4-трет-бутилоксикарбоніл-1-(3бромфеніл)піперазину зі стадії 1 (118,30г, 346,9ммоль) в тетрагідрофурані/толуолі (1/1, 1,5л) при температурі -78°С в атмосфері азоту краплями додають н-бутиллітій (2,5М, 160мл, 398,9ммоль), і одержану реакційну суміш перемішують при температурі -78°С протягом 20 хвилин. Краплями додають триізопропілборат (96,1мл, 416,3ммоль), і реакційну суміш нагрівають до температури 0°С і перемішують протягом 2 годин. Додають водний насичений хлорид амонію (400мл), воду (100мл) і 1 еквівалент Н 3РО4 (20мл), і суміш перемішують протягом 15 хвилин, потім концентрують до об'єму приблизно 200мл (на цій стадії суміш стає голубуватою і утворюється осад). Суміш повільно розбавляють гептаном (800мл) і одержану суспензію перемішують протягом ночі. Суспензію фільтрують, тверду речовину промивають гептаном і сушать з одержанням вказаної в заголовку борної кислоти. Стадія 3: N-Ізопропіл-1-{3-[4-(4третбутилоксикарбонілпіперазин-1-іл)феніл]феніл}-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксамід За методикою стадії 5 прикладу 1, але замінюючи [1,1’біс(дифенілфосфіно)фероцен]дихлорпаладієм (II) За методикою стадії 5 прикладу 1, але замінюючи 3-хінолінборною кислотою 3-ацетил фенілборну кислоту, одержують вказану в заголовку сполуку у ви гляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 1,29 (д, 6Н), 4,29 (м, 1Н), 7,49 (м, 2Н), 7,61 (т, 1Н), 7,70-7,78 (м, 3Н), 7,867,92 (м, 2Н), 8,14 (д, 1Н), 8,36 (с, 1Н), 8,71 (м, 1Н), 8,84 (дд, 1Н), 9,10 (с, 1Н), 9, 19 (с, 1H) 9,67 (уш., ΝΗ). Приклад 13 N-Ізопропіл-1-[3-(піримідин-5-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-карбоксамід і За методикою стадії 5 прикладу 1, але замінюючи 5-піримідинборною кислотою 3ацетилфенілборну кислоту, одержують вказану в заголовку сполуку у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 1,28 (д, 6Н), 4,27 (м, 1Н), 7,48 (дд, 1Н), 7,52 (м, 1Н), 7,65 (с, 1Н), 7,74 (м, 2Н), 8,68 (м, 1Н), 8,72 (д, 1Н), 8,98 (с, 2Н), 9,03 (с, 1Н), 9,22 (с, 1Н) 9,62 (уш., ΝΗ). Приклад 14 N-Циклопропіл-1-[3-(піридин-3-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 1: N-Циклопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою прикладу 1, стадія 4, але замі 41 79518 42 нюючи циклопропіламіном ізопропіламін, одержу1,88 (т, 1Н), 3,03 (м, 1Н), 4,78 (д, 2Н), 7,43 (д, 1Н), ють N-циклопропіл-1-(3-бромфеніл)-1,47,46-7,52 (м, 3Н), 7,61-7,69 (м, 4Н), 7,80 (д, 1Н), дигідро[1,8]-нафтиридин-4-он-3-карбоксамід у ви8,73 (м, 1Н), 8,83 (дд, 1Н), 9,10 (с, 1Н), 9,82 (уш, гляді пухнастої твердої речовини. ΝΗ). 1 H ЯМР (Ацетон-d6) δ 0,59 (м, 2Н), 0,80 (м, 2Н), Приклад 17 2,96 (м, 1Н), 7,59-7,68 (м, 2Н), 7,72 (дд, 1Н), 7,82 N-Циклопропіл-1-[3-(піридин-4-іл)феніл]-1,4(дд, 1Н), 7,97 (с, 1Н), 8,72-8,81 (м, 2Н), 8,89 (с, 1Н) дигідро[1,8]нафтиридин-4-он-3-карбоксамід 9,70 (уш., ΝΗ). Стадія 2: N-Циклопропіл4-[3-(піридин-3іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід За методикою прикладу 7, але замінюючи Nциклопропіл-і-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамідом зі стадії 1 Ν-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід, одерЗа методикою стадії 5 прикладу 1, але заміжують Ν-циклопропіл-1-[3-(піридин-3-іл)феніл]-1,4нюючи N-циклопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід у видигідро[1,8]нафтиридин-4-он-3-карбоксамідом Nгляді кремової твердої речовини. ізопропіл-1-(3-бромфеніл)-1,41 H ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,78 (м, 2Н), дигідро[1,8]нафтиридин-4-он-3-карбоксамід, і замі2,91 (м, 1Н), 7,52 (м, 1Н), 7,63-7,69 (м, 2Н), 7,74 (т, нюючи 4-піридинборною кислотою 31Н), 7,97 (д, 1Н), 8,07 (уш.с, 1Н), 8,17 (д, 1Н), 8,61 ацетилфенілборну кислоту одержують вказану в (м, 1Н), 8,73 (дд, 1Н), 8,79 (м, 1Н), 8,85 (с, 1Н), 8,99 заголовку сполуку у вигляді білої твердої речови(уш.с, 1Н), 9,74 (уш, ΝΗ). ни. 1 Приклад 15 Н ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,77 (м, 2Н), N-Ізопропіл-1-[3-(5-метилтіопіридин-32,90 (м, 1Н), 7,64 (м, 1Н), 7,72-7,89 (м, 4Н), 8,03 (д, іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-31Н), 8,13 (с, 1Н), 8,66-8,78 (м, 4Н), 8,84 (с, 1Н) 9,72 карбоксамід (уш., ΝΗ). Приклад 18 N-Циклопропіл-1-[3-(4-етилтіофеніл)феніл]1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 5 прикладу 1, але замінюючи 5-метилтіопіридин-3-борною кислотою 3ацетилфенілборну кислоту, і замінюючи [1,1’біс(дифенілфосфіно)фероцен]дихлорпаладієм (II) транс-дибромбіс-(трифенілфосфін)паладій (II) одержують вказану в заголовку сполуку у вигляді твердої речовини. 1 H ЯМР (CDCІ3) 6 1,33 (д, 6Н), 2,60 (с, 3Н), 4,33 (м, 1Н), 7,48-7,54 (м, 2Н), 7,66 (м, 1Н), 7,73 (т, 1Н), 7,78-7,81 (м, 2Н), 8,55 (с, 1Н), 8,66 (с, 1Н), 8,74 (м, 1Н), 8,87 (д, 1Н), 9,09 (с, 1Н), 9,69 (уш., ΝΗ). Приклад 16 N-Циклопропіл-1-[3-(4гідроксиметилфеніл)феніл]-1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 2 прикладу 14, але замінюючи 4-гідроксиметилфенілборною кислотою піридин-3-борної кислоти 1,3-пропандіоловий циклічний ефір, одержують вказану в заголовку сполуку у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 0,71 (м, 2Н), 0,89 (м, 2Н), За методикою стадії 2 прикладу 14, але замінюючи 4-етилтіобензолборною кислотою піридин3-борної кислоти 1,3-пропандіоловий циклічний ефір, одержують вказану в заголовку сполуку у вигляді твердої речовини. 1 H ЯМР (CDCІ3) δ 0,72 (м, 2Н), 0,90 (м, 2Н), 1,48 (т, 3Н), 3,03 (м, 3Н), 7,42 (д, 3Н), 7,50 (м, 1Н), 7,57 (д, 2Н), 7,64 (с, 1Н), 7,68 (т, 1Н), 7,78 (д, 1Н), 8,75 (м, 1Н), 8,85 (д, 1Н), 9,10 (с, 1Н), 9,83 (уш., NH). Приклад 19 N-Циклопропіл-1-[3-(3-тієніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 2 прикладу 14, але замінюючи 3-тіофенборною кислотою піридин-3-борної кислоти 1,3-пропандіоловий циклічний ефір, одержують вказану в заголовку сполуку у вигляді твердої речовини. 43 79518 44 Н ЯМР (Ацетон-d6) δ 0,60 (м, 2Н), 0,79 (м, 1Н), Стадія 1: Етил 1-[3-(3-етоксифеніл)феніл]-1,42,96 (м, 1Н), 7,57-7,72 (м, 5Н), 7,92-7,98 (м, 2Н), дигідро[1,8]нафтиридин-4-он-3-карбоксилат 8,05 (с, 1Н), 8,74 (с, 1Н), 8,78 (д, 1Н), 8,93 (с, 1Н) За методикою стадії 5 прикладу 1, але замі9,74 (уш., ΝΗ). нюючи 1-(3-бромфеніл)-1,4Приклад 20 дигідро[1,8]нафтиридин-4-он-3-карбоксилатом зі N-Циклопропіл-1-[3-(4стадії 2 прикладу 1 N-ізопропіл-1-(3-бромфеніл)сульфамоїлфеніл)феніл]-1,41,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід, і дигідро[1,8]нафтиридин-4-он-3-карбоксамід замінюючи 3-етоксибензолборною кислотою 3ацетилбензолборну кислоту одержують сполуку етил 1-[3-(3-етоксифеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилату у вигляді твердої речовини. Стадія 2: 1-[3-(3-Етоксифеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбонова кислота За методикою стадії 3 прикладу 1, але замінюючи етил 1-[3-(3-етоксифеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилатом зі стадії 1 етил 1-(3-бромфеніл)-1,4Стадія 1: Пінаконовий ефір 4дигідро[1,8]нафтиридин-4-он-3-карбоксилат, одерсульфамоїлбензолборної кислоти жують сполуку 1-[3-(3-етоксифеніл)феніл]-1,4Суміш 4-бромбензолсульфонаміду, диборпінадигідро[1,8]нафтиридин-4-он-3-карбонової кислоконового ефіру (1,1екв.), ацетату калію (3,5екв. і ти, яку застосовують на наступній стадії без очи[1,1’-біс(дифенілфосфіно)фероцен]дихлорпаладію щення. (II) (0,05екв.) в Ν,Ν-диметилформаміді Стадія 3: N-Ізопропіл-1-[3-(3(4мл/ммоль) нагрівають при температурі 85°С проетоксифеніл)феніл]-1,4-дигідро[1,8]нафтиридин-4тягом 18 годин. Після гасіння насиченим водним он-3-карбоксамід розчином хлориду амонію, суміш розподіляють між Суміш 1-[3-(3-етоксифеніл)феніл]-1,4-дигідро етилацетатом і водою, і продукт з органічної фази [1,8] нафтиридин-4-он-3-карбонової кислоти зі піддають хроматографії на силікагелі, елююючи стадії 2 і тіонілхлориду (4екв.) в тетрагідрофурані сумішшю 1:1 етилацетату і гексану з одержанням (10мл/ммоль) кип'ятять зі зворотним холодильни4-сульфамоїлбензолборної кислоти пінаконового ком протягом 45 хвилин, потім випарюють. Залиефіру у вигляді твердої речовини. шок розчиняють в тому ж об'ємі тетрагідрофурану, Стадія 2: N-Циклопропіл1-[3-(4додають ізопропіламін (5екв.) і суміш перемішують сульфамоїлфеніл)феніл]-1,4-дигідро[1,8]при кімнатній температурі протягом 18 годин. Піснафтиридин-4-он-3-карбоксамід ля гасіння насиченим водним розчином хлориду Суміш N-циклопропіл-1-(3-бромфеніл)-1,4амонію, одержану суміш розподіляють між етиладигідро[1,8]нафтиридин-4-он-3-карбоксаміду, боцетатом і водою, і продукт з органічної фази підрату зі стадії 1 (1,2екв.) ацетату паладію (0,1екв.), дають хроматографії на силікагелі, елююючи 10% трифенілфосфіну (0,35екв.) і 2М водного карбонаефіром в метиленхлориді з одержанням Nту натрію (3,5екв.) в н-пропанолі (10мл/ммоль) ізопропіл-1-[3-(3-етоксифеніл)феніл]-1,4перемішують при температурі 85°С протягом 1 дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигодини. Після охолоджування суміш гасять насигляді твердої речовини. 1 ченим водним розчином хлориду амонію і розподіН ЯМР (CDCІ3) δ 1,29 (д, 6Н), 1,42 (т, 3Н), 4,08 ляють між етилацетатом і водою, і продукт з орга(кв., 2Н), 4,28 (м, 1Н), 6,91 (д, 1Н), 7,12 (с, 1Н), 7,18 нічної фази піддають хроматографії на силікагелі, (д, 1Н), 7,34 (т, 1Н), 7,40 (д, 1Н), 7,46 (м, 1Н), 7,60елююючи сумішшю 1:5:4 етанолу, етилацетату і 7,65 (м, 2Н), 7,75 (д, 1Н), 8,71 (уш.с, 1Н), 8,82 (дд, метиленхлориду з одержанням N-циклопропіл-11Н), 9,08 (с, 1Н), 9,70 (уш., ΝΗ). [3-(4-сульфамоїлфеніл)феніл]-1,4Приклад 22 дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у виN-Ізопропіл-1-[3-(4-метилтіофсніл)феніл]-1,4гляді твердої речовини. дигідро[1,8]нафтиридин-4-он-3-карбоксамід 1 Н ЯМР (Ацетон-d6) δ 0,62 (м, 2Н), 0,82 (м, 2Н), 2,98 (м, 1Н), 6,66 (уш., ΝΗ2), 7,64 (м, 1Н), 7,74 (м, 1Н), 7,80 (т, 1Н), 7,97-8,05 (м, 5Н), 8,10 (м, 1Н), 8,76 (м, 1Н), 8,81 (дд, 1Н), 8,97 (с, 1Н), 9,77 (уш., ΝΗ). Приклад 21 N-Ізопропіл-1-[3-(3-етоксифеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід 1 Стадія 1: Етил 1-[3-(4-метилтіофеніл)феніл]1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксилат За методикою стадії 5 прикладу 1, але замінюючи 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилатом зі стадії 2 прикладу 1 N-ізопропіл-1-(3-бромфеніл) 45 79518 46 1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід, і 1Н), 7,92 (д, 1Н), 7,97 (д, 1Н), 8,02 (с, 1Н), 8,33 (с, замінюючи 4-метилтіобензолборною кислотою 31Н), 8,73 (м, 1Н), 8,78 (дд, 1Н), 8,90 (с, 1Н), 9,65 ацетилбензолборну кислоту одержують сполуку (yin.,NH). етил 1-[3-(4-метилтіофеніл)феніл]-1,4Приклад 24 , дигідро[1,8]нафтиридин-4-он-3-карбоксилату у N-ізопропіл-1-[3-(5-карбоетоксипіридин-3вигляді твердої речовини. іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3Стадія 2: 1-[3-(4-Метилтіофеніл)феніл]-1,4карбоксамід дигідро[1,8]нафтиридин-4-он-3-карбонова кислота За методикою стадії 3 прикладу 1, але замінюючи етил 1-[3-(4-метилтіофеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилатом зі стадії 1 етил 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксилат, одержують сполуку 1-[3-(4-метилтіофеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти у вигляді твердої речовини. За методикою прикладу 23, але замінюючи NСтадія 3: N-Ізопропіл-1-[3-(4ізопропіл-1-(3-бромфеніл)-1,4метилтіофеніл)феніл]-1,4-дигідро[1,8]дигідро[1,8]нафтиридин-4-он-3-карбоксамідом 5'нафтиридин-4-он-3-карбоксамід бром-2'-гідроксиацетофенон, і замінюючи 5За методикою стадії 3 прикладу 21, але замібромнікотинатом N-iзопропіл-1-(3-бромфеніл)-1,4нюючи 1-[3-(4-метилтіофеніл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід, одердигідро[1,8]нафтиридин-4-он-3-карбоновою кисложують вказану в заголовку сполуку у вигляді бежетою 1-[3-(3-етоксифеніл)феніл]-1,4вої твердої речовини. дигідро[1,8]нафтиридин-4-он-3-карбонову кислоту 1 Н ЯМР (CDCІ3) δ 1,29 (д, 6Н), 1,40 (т, 3Н), 4,28 одержують N-ізопропіл-1-[3-(4(м, 1Н), 4,42 (кв., 2Н), 7,45-7,51 (м, 2Н), 7,68 (с, метилтіофеніл)феніл]-1,4-дигідро[1,8]нафтиридин1Н), 7,71 (т, 1Н), 7,80 (д, 1Н), 8,49 (с, 1Н), 8,59 (м, 4-он-3-карбоксаміду у вигляді білої твердої речо1Н), 8,82 (д, 1Н), 9,03 (с, 1Н), 9,07 (с, 1Н), 9,23 (с, вини. 1 1Н) 9,64 (уш., ΝΗ). Н ЯМP (Ацетон-d6) δ 1,24 (д, 6Н), 2,52 (с, 3Н), Приклад 25 4,18 (м, 1Н), 7,37 (д, 2Н), 7,58-7,62 (м, 2Н), 7,69N-ізопропіл-1-(3-[5-(1-гідрокси-17,73 (м, 3Н), 7,87 (д, 1Н), 7,96 (с, 1Н), 8,72 (м, 1Н), метилетил)піридин-3-іл]-феніл}-1,48,78 (дд, 1Н), 8,91 (с, 1Н), 9,65 (уш., NH). дигідро[1,8]нафтиридин-4-он-3-карбоксамід Приклад 23 N-Ізопропіл-1-[3-(3-ацетил-4гідроксифеніл)феніл]-1,4-дигідро[1,8]-нафтиридин4-он-3-карбоксамід Суміш 5'-бром-2'-гідроксіацетофенону, диборпінаконового ефіру (1,25екв.), ацетату калію (3екв.) і [1,1’біс(дифенілфосфіно)фероцен]дихлорпаладію (II) (0,05екв.) в Ν,Ν-диметилформаміді (10мл/ммоль) перемішують при температурі 80°С протягом 3 годин і охолоджують. Додають розчин N-ізопропіл1-(3-бромфеніл)-1,4-дигідро[1,8]нафтиридин- 4-он3-карбоксаміду з прикладу 1, стадія 4 (0,75екв.) в Ν,Ν-диметилформаміді (7мл/ммоль), [1,1’біс(дифенілфосфіно)фероцен]-дихлорпаладію (II) (0,05екв.) і 2М водного карбонату натрію (8,5екв.), і одержану суміш перемішують при температурі 80°С протягом 2,5 годин. Охолоджену суміш розподіляють між етилацетатом і водою, і продукт з органічної фази піддають хроматографії на силікагелі, елююючи 60% етилацетатом в гексані з одержанням вказаної в заголовку сполуки у вигляді блідо-жовтої твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 1,24 (д, 6Н), 2,75 (с, 3Н), 4,19 (м, 1Н), 7,06 (д, 1Н), 7,59-7,63 (м, 2Н), 7,72 (т, Стадія 1: 3-Бром-5-(1-гідрокси-1метилетил)піридин До розчину етил 5-бромнікотинату (1,02г, 4,4ммоль) в діетиловому ефірі (15мл) при температурі-30°С додають 3М розчин метилмагній броміду (4мл, 12ммоль) в ефірі. Одержану суспензію потім кип'ятять зі зворотним холодильником протягом 2 годин, потім охолоджують і гасять надлишком 0,5Μ водного одноосновного фосфату натрію і розподіляють між простим ефіром і водою. Продукт з органічної фази піддають хроматографії на силікагелі, елююючи 2:1:2 сумішшю ефіру, пентану і насиченого амонієм метиленхлориду, з одержанням сполуки 3-бром-5-(1-гідрокси-1метилетил)піридину у вигляді жовтої олії. Стадія 2: N-iзoпpoпiл-1-{3-[5-(1-гiдpoкcи-1мeтилeтил)пipидин-3-iл]-фeнiл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою прикладу 24, але замінюючи 3бром-5-(1-гідрокси-1-метилетил)піридином зі стадії 1 етил 5-бромнікотинат, одержують вказану в заголовку сполуку у вигляді жовтої піни. 1 Н ЯМР (CDCІ3) δ 1,28 (д, 6Н), 1,62 (с, 6Н), 2,52 (уш.с, 1Н), 4,25 (м, 1Н), 7,41-7,48 (м, 2Н), 7,60 47 79518 48 7,68 (м, 2Н), 7,75 (д, 1Н), 8,05 (с, 1Н), 8,67-8,71 (м, амонієм метиленхлориду, з одержанням сполуки 3Н), 8,80 (дд, 1Н), 9,03 (с, 1H) 9, 66 (уш., ΝΗ). 3-ацетил-5-бромпіридину. Ця методика також дає Приклад 26 3-бром-5-(1-гідрокси-1-метилетил)піридин, , опиN-ізопропіл-1-{3-[6-(2-метилпропіл)піридин-3саний у прикладі 25. іл]-феніл}-1,4-дигідро[1,8]-нафтиридин-4-он-3Стадія 2: N-ізопропіл-1-[3-(5-ацетилпіридин-3карбоксамід іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід За методикою прикладу 23, але замінюючи 3ацетил-5-бромпіридином зі стадії 1 етил 5бромнікотинат, одержують сполуку Ν-ізопропіл-1[3-(5-ацетилпіридин-3-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді білої твердої речовини. 1 Н ЯМР (CDCІ3) δ 1,29 (д, 6Н), 2,69 (с, 3Н), 4,28 (м, 1Н), 7,48 (дд, 1Н), 7,51 (д, 1Н), 7,69 (с, 1Н), Стадія 1: 5-Бром-2-(2-метилпропіл)піридин 7,72 (т, 1Н), 7,80 (д, 1Н), 8,42 (с, 1Н), 8,69 (м, 1Н), До розчину 2,5-дибромпіридину (4,5г, 8,82 (д, 1Н), 9,05 (с, 2Н), 9,17 (с, 1Н), 9,63 (уш., 19ммоль) в тетрагідрофурані (50мл) додають [1,1’ΝΗ). біс(дифенілфосфіно)фероцен]дихлорнікель (II) Приклад 28 (103мг, 0,19ммоль) і одержану суміш охолоджують N-ізопропіл-1-[3-(6-метилпіридин-3-іл)феніл]до температури -10°С. Повільно додають 2М роз1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід чин броміду ізобутилмагнію в ефірі (12,4мл, 24,7ммоль), і суміш перемішують при температурі від -10 до 10°С протягом 3,5 годин. Після гасіння насиченим водним розчином хлориду амонію, суміш розподіляють між простим ефіром і водою, і продукт з органічної фази піддають хроматографії на силікагелі, елююючи 10% ефіром в пентані з одержанням сполуки 5-бром-2-(2метилпропіл)піридину у вигляді леткої олії. Стадія 1: 5-Бром-2-метилпіридин Стадія 2: N-ізопропіл-1-(3-[6-(2За методикою стадії 1 прикладу 26, але заміметилпропіл)піридин-3-іл]феніл}-1,4нюючи хлоридом метилмагнію бромід ізобутилмадигідро[1,8]нафтиридин-4-он-3-карбоксамід гнію, одержують сполуку 5-бром-2-метилпіридину За методикою прикладу 24, але замінюючи 5у вигляді твердої речовини. бром-2-(2-метилпропіл)-піридином зі стадії 1 етил Стадія 2: N-ізопропіл-1-[3-(6-метилпіридин-35-бромнікотинат, одержують сполуку N-ізопропіліл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-31-{3-[6-(2-метилпропіл)піридин-3-іл]феніл}-1,4карбоксамід дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у виЗа методикою прикладу 24, але замінюючи 5гляді білої твердої речовини. 1 бром-2-метилпіридином зі стадії 1 етил 5Н ЯМР (CDCІ3) δ 0,92 (д, 6Н), 1,28 (д, 6Н), бромнікотинат, одержують сполуку N-ізопропіл-12,10 (м, 1Н), 2,69 (д, 2Н), 4,28 (м, 1Н), 7,19 (д, 1Н), [3-(6-метилпіридин-3-іл)феніл]-1,47,40-7,47 (м, 2Н), 7,60 (с, 1Н), 7,64 (т, 1Н), 7,73 (д, дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви1Н), 7,79 (дд, 1Н), 8,68 (м, 1Н), 8,77-8,83 (м, 2Н), гляді твердої речовини. 9,05 (с, 1Н), 9,66 (уш., ΝΗ). 1 Н ЯМР (CDCІ3) δ 1,32 (д, 6Н), 2,63 (м, 3Н), Приклад 27 4,30 (м, 1Н), 7,25 (д, 1Н), 7,45-7,51 (м, 2Н), 7,63 (с, N-Ізопропіл-1-[3-(5-ацетилпіридин-3-іл)феніл]1Н), 7,69 (т, 1Н), 7,77 (д, 1Н), 7,82 (дд, 1Н), 7,82 1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід (дд, 1Н), 8,72 (м, 1Н), 8,78 (с, 1Н), 8,85 (д, 1Н), 9,08 (с, 1Н), 9,68 (уш., ΝΗ). Приклад 29 N-Циклопропіл-1-[3-(1-оксидопіримідин-5іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід Стадія 1: 3-Ацетил-5-бромпіридин До розчину етил 5-бромнікотинату (3,9г, 16,9ммоль) в ефірі (50мл) при температурі 0°С додають 3М розчин броміду метилмагнію (16,9мл, 50,8ммоль). Одержану густу суспензію повільно нагрівають до кімнатної температури, і після 1,5 годин її повільно виливають в надлишок 1М водного одноосновного фосфату натрію. Суміш розподіляють між ефіром і водою, і продукт з органічної фази піддають хроматографії на силікагелі, елююючи 1:1:2 сумішшю е фіру, пентану і насиченого Стадія 1: 5-Бром-1-оксидопіримідин До 5-бромпіримідину (2,05г, 12,9ммоль) в метиленхлориді (25мл) додають мхлорпероксибензойну кислоту (чистота близько 70%, 3,17г, 12,9ммоль), і одержану суміш перемі 49 79518 50 шують при кімнатній температурі протягом 5 днів. одержанням сполуки 5-бром-2-(1-гідрокси-1Додають гідроксид кальцію (1г) і через 10 хвилин метилетил)піридину N-оксиду у вигляді білої тверсуміш фільтрують через целіт. Продукт випарюдої речовини. вання фільтрату піддають хроматографії на силіСтадія 3: 1-(3-Бромфеніл)-1,4кагелі, елююючи етилацетатом з одержанням сподигідро[1,8]нафтиридин-4-он-3-карбоксамід луки 5-бром-1-оксидопіримідину у вигляді білої За методикою стадії 4 прикладу 1, але замітвердої речовини. нюючи 28% водним гідроксидом амонію ізопропіСтадія 2: N-Циклопропіл-1-[3-(1ламін одержують сполуку 1-(3-бромфеніл)-1,4оксидопіримідинил-5-іл)феніл]-1,4-дигідродигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви[1,8]нафтиридин-4-он-3-карбоксамід гляді твердої речовини. За методикою прикладу 24, але замінюючи 5Стадія 4: 1-{3-[6-(1-Гідрокси-1-метилетил)-1бром-1-оксидопіримідином зі стадії 1 етил 5оксидопіридин-3-іл]-феніл}-1,4бромнікотинат, і замінюючи N-циклопропіл-1-(3дигідро[1.8]нафтиридин-4-он-3-карбоксамід бромфеніл)-1,4-дигідро[1,8]нафтиридин-4-он-3За методикою прикладу 24, але замінюючи 5карбоксамідом N-ізопропіл-1-(3-бромфеніл)-1,4бром-2-(1-гідрокси-1-метилетил)піридин Nдигідро[1,8]нафтиридин-4-он-3-карбоксамід одероксидом зі стадії 2 вище етил 5-бромнікотинат, і жують сполуку N-циклопропіл-1-[3-(1замінюючи 1-(3-бромфеніл)-1,4оксидопіримідиніл-5-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамідом Nдигідро[1,8]нафтиридин-4-он-3-карбоксаміду у виізопропіл-1-(3-бромфеніл)-1,4гляді білої твердої речовини. дигідро[1,8]нафтиридин-4-он-3-карбоксамід одер1 Н ЯМР (CDCІ3) δ 0,66 (м, 2Н), 0,84 (м, 2Н), жують сполуку 1-{3-[6-(1-гідрокси-1-метилетил)-12,97 (м, 1Н), 7,48 (м, 1Н), 7,58 (д, 1Н), 7,65 (с, 1Н), оксидопіридин-3-іл]-феніл}-1,47,71 (д, 1Н), 7,77 (т, 1Н), 8,46 (с, 1Н), 8,60 (с, 1Н), дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви8,68 (уш.с, 1Н), 8,81 (дд, 1Н), 8,98 (с, 1Н), 9,02 (с, гляді твердої речовини. 1 1Н), 9,72 (уш, ΝΗ). Н ЯМР (CDCІ3) δ 1,76 (с, 6Н), 5 ,83 (уш., 1H, Приклад 30 ΝΗ), 7,50 (д, 1Н), 7,55 (м, 1Н), 7,57-7,62 (м, 2Н), 1-(3-[6-(1-Гідрокси-1-метилетил)-17,65 (м, 2Н), 7,72-7,78 (м, 2Н), 8,55 (с, 1Н, ОН), оксидопіридин-3-іл]-феніл}-1,4-дигідро8,75 (м, 1Н), 8,90 (дд, 1Н), 9,08 (с, 1Н), 9,52 (уш., [1,8]нафтиридин-4-он-3-карбоксамід 1Н, ΝΗ). Приклад 31 N-ізопропіл-1-{3-[4-(піридин-3-іл)феніл]феніл}1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 1: 5-Бром-2-(1-гідрокси-1метилетил)піридин До суспензії 2,5-дибромпіридину в толуолі (12мл/ммоль), охолодженої до температури-78°С, додають н-бутиллітій 2,5М в гексані (1,05екв.), і одержану суміш перемішують на холоді протягом 2,5 годин. Додають ацетон (2екв.) і перемішування продовжують протягом 1,5 годин. Після гасіння насиченим водним розчином хлориду амонію, суміш нагрівають до кімнатної температури і розподіляють між етилацетатом і водою. Продукт з органічної фази піддають хроматографії на силікагелі, елююючи 20% етилацетатом в гексані з одержанням сполуки 5-бром-2-(1-гідрокси-1метилетил)піридину у вигляді сиропу. Стадія 2: 5-Бром-2-(1-гідрокси-1метилетил)піридин N-оксид До розчину 5-бром-2-(1-гідрокси-1метилетил)піридину зі стадії 1 в метиленхлориді (5мл/ммоль) при кімнатній температурі додають мхлорпероксибензойну кислоту 70% (1,1екв.), і одержану суміш перемішують при кімнатній температурі протягом 18 годин. Додають надлишок гідроксиду кальцію і через 5 хвилин суміш фільтрують через шар целіту. Неочищений продукт випарювання фільтрату піддають хроматографії на силікагелі, елююючи 80% етилацетатом в гексані з Стадія 1: N-Ізопропіл-1-[3-(4,4,5,5-тетраметил1,3,2-діоксаборолан-2-іл)-феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід Суміш N-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду зі стадії 4 прикладу 1, диборпінаконовий ефір (1,1екв.), ацетат калію (3,5екв.) і [1,1’біс(дифенілфосфіно)фероцен]дихлорпаладію (II) (0,05екв.) в Ν,Ν-диметилформаміді (5мл/ммоль) перемішують при температурі 85°С протягом 18 годин. Додають ще диборпінаконовий ефір (0,4екв.) і паладієвий каталізатор (0,05екв.), і нагрівання і перемішування продовжують ще 24 години. Після охолоджування суміш розподіляють між етилацетатом і водою, і неочищений продукт з органічної фази піддають хроматографії на силікагелі, елююючи 1:1 сумішшю етилацетату і гексану. Потім продукт перемішують в гексані при кімнатній температурі протягом декількох годин, і фільтрують з одержанням сполуки N-ізопропіл-1-[3(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)феніл]-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксаміду у вигляді білої твердої речовини. Стадія 2: 3-(4-Бромфеніл)піридин Суміш піридин-3-борної кислоти 1,3 51 79518 52 пропандіолового циклічного ефіру, 4кту випарювання органічної фази додають тетрагібромйодбензолу (1,1екв.), [1,1’дрофуран (80мл), метанол (20мл), оксон (17г) і біс(дифенілфосфіно)фероцен]дихлорпаладію (II) достатню кількість насиченого водного бікарбона(0,05екв.) і 2М водного карбонату натрію (5екв.) в ту натрію для одержання злегка основного сереΝ,Ν-диметилформаміді (2мл/ммоль) перемішують довища. Після перемішування протягом 4 годин при температурі 85°С протягом 4 годин. Після гапри кімнатній температурі додають надлишок ЇМ сіння насиченим водним розчином хлориду амонію водного метабісульфіту натрію, органічні розчинсуміш розподіляють між етилацетатом і водою, і ники, і залишок розподіляють між етилацетатом і неочищений продукт з органічної фази піддають водою. Неочищений продукт з органічної фази хроматографії на силікагелі, елююючи 1:9 сумішперемішують в невеликому об'ємі етилацетату і шю етилацетату і гексану з одержанням сполуки 3фільтрують з одержанням сполуки 3-бром-5(4-бромфеніл)піридину у вигляді твердої речовини. метилсульфонілпіридину у вигляді твердої речоСтадія 3: N-ізопропіл-1-{3-[4-(піридин-3вини. іл)феніл]феніл}1,4-дигідро[1,8]-нафтиридин-4-онСтадія 3: N-Циклопропіл-1-[3-(53-карбоксамід метилсульфонілпіридин-3-іл)феніл]-1,4Суміш борату зі стадії 1, 3-(4дигідро[1,8]нафтиридин-4-он-3-карбоксамід бромфеніл)піридину зі стадії 2 (1,5екв.), [1,1’За методикою стадії 3 прикладу 31, але замібіс(дифенілфосфіно)фероцен]дихлорпаладію (II) нюючи 3-бром-5-метилсульфонілпіридином зі ста(0,05екв.) і 2М водного карбонату натрію (5екв.) в дії 2 вище за 3-(4-бромфеніл)піридин, і замінюючи Ν,Ν-диметилформаміді (7мл/ммоль) перемішують N-циклопропіл-1-[3-(4,4,5,5-тетраметил-1,3,2при температурі 85°С протягом 1 години. Після діоксаборолан-2-іл)феніл]-1,4охолоджування суміш розподіляють між етилацедигідро[1,8]нафтиридин-4-он-3-карбоксамідом зі татом і водою. Неочищений продукт з органічної стадії 1 N-ізопропіл-1-[3-(4,4,5,5-тетраметил-1,3,2фази піддають хроматографії на силікагелі, елюдіоксаборолан-2-іл)феніл]-1,4-дигідроюючи 7:3 сумішшю е тилацетату і метиленхлориду [1,8]нафтиридин-4-он-3-карбоксамід, одержують з одержанням сполуки N-ізопропіл-1-{3-[4-(піридинсполуку N-циклопропіл-1-[3-(53-іл)феніл]феніл}-1,4-дигідро[1,8]нафтиридин-4метилсульфонілпіридин-3-іл)феніл]-1,4он-3-карбоксаміду у вигляді твердої речовини. дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви1 H ЯМР (CDCІ3) δ 1,30 (д, 6Н), 4,25 (м, 1Н), гляді твердої речовини. 1 7,35 (м, 1Н), 7,39-7,48 (м, 2Н), 7,60-7,75 (м, 6Н), Н ЯМР (CDCІ3) δ 0,71 (м, 2Н), 0,90 (м, 2Н), 7,80 (д, 1Н), 7,90 (д, 1Н), 8,58 (д, 1Н), 8,70 (м, 1Н), 3,03 (м, 1Н), 3,21 (с, 3Н), 7,53 (м, 1Н), 7,60 (д, 1Н), 8,82 (д, 1Н), 8,88 (с, 1Н), 9,08 (с, 1Н), 9,68 (уш., 7,74 (с, 1Н), 7,80 (т, 1Н), 7,86 (д, 1Н), 8,45 (м, 1Н), ΝΗ). 8,74 (м, 1Н), 8,86 (д, 1Н), 9,09 (с, 1Н), 9,20 (д, 2Н), Приклад 32 9,78 (уш., ΝΗ). N-Циклопропіл-1-[3-(5Приклад 33 метилсульфонілпіридин-3-іл)феніл]-1,4N-Циклопропіл-1-{3-[4-(1-гідрокси-1дигідро[1,8]-нафтиридин-4-он-3-карбоксамід метилетил)-1-оксидопіридин-2-іл]феніл-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 1: N-Циклопропіл-1-[3-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)феніл]-1.4дигідро[1,8]нафтиридин-4-он-3-к'арбоксамід За методикою стадії 1 прикладу 31, але замінюючи N-циклопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамідом зі стадії 1 прикладу 14 N-ізопропіл-1-(3-бромфеніл)1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід, одержують сполуку N-циклопропіл-1-[3-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)феніл]-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді білої твердої речовини. Стадія 2: 3-Бром-5-метилсульфонілпіридин До 3,5-дибромпіридину (2,96г, 12,5ммоль) в діетиловому ефірі (70мл) при температурі-78°С додають н-бутиллітій 1,6М в гексанах (8,6мл, 13,7ммоль), і одержану суміш перемішують на холоді протягом 3 годин. Додають диметилдисульфід (1,12мл, 12,5ммоль) і суміш нагрівають до кімнатної температури, потім розподіляють між простим ефіром і водою. До неочищенного проду Стадія 1: Метил 2-бромизонікотинат До розчину 2-бромизонікотинової кислоти [Chem. Pharm. Bull., 38:2446 (1990)] (2,0г) в тетрагідрофурані (100мл) додають надлишок ефірного діазометану, і одержану суміш перемішують при кімнатній температурі протягом 1 години. Суміш випарюють, і продукт піддають хроматографії па силікагелі, елююючи 1:3 сумішшю етилацетату і гексану з одержанням метилового ефіру 2бромізонікотинової кислоти у вигляді безбарвної рідини. Стадія 2: 2-Бром-4-(1-гідрокси-1метилетил)піридин За методикою стадії 1 прикладу 25, але замінюючи метил 2-бромизонікотинатом зі стадії 1 етил 5-бромнікотинат, одержують сполуку 2-бром4-(1-гідрокси-1-метилетил)піридину у вигляді білої твердої речовини. 53 79518 54 Стадія 3: 2-Бром-4-(1-гідрокси-19,12 (с, 1Н), 9,82 (уш., ΝΗ). метилетил)піридин-N-оксид Приклад 35 За методикою стадії 2 прикладу 30, але заміN-Циклопропіл-1-(3-[3-(1-гідрокси-1нюючи 2-бром-4-(1-гідрокси-1метилетил)піридин-4-іл]феніл)-1,4метилетил)піридином зі стадії 2 5-бром-2-(1дигідро[1,8]нафтиридин-4-он-3-карбоксамід гідрокси-1-метилетил)піридин, одержують сполуку 2-бром-4-(1-гідрокси-1-метилетил)піридин-Nоксиду у вигляді білої твердої речовини. Стадія 4: N-Циклопропіл-1-{3-[4-(1-гідрокси-1метилетил)-1-оксидопіридин-2-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але. замінюючи 2-бром-4-(1-гідрокси-1-метилетил)піридинN-оксидом зі стадії 3 3-бром-5Стадія 1: 4-Бром-2-( 1-гідрокси-1метилсульфонілпіридин, одержують сполуку Nметилетил)піридин циклопропіл-1-{3-[4-(1-гідрокси-1-метилетил)-1За методикою стадій 1-2 прикладу 33, але заоксидопіридин-2-іл]феніл}-1,4мінюючи 4-бромпіколіновою кислотою [Aust. J. дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у виChem. 24:390 (1971)] 2-бромізонікотинову кислоту гляді бежевої твердої речовини. на стадії 1, одержують сполуку 4-бром-2-(11 Н ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,79 (м, 2Н), гідрокси-1-метилетил)піридину у вигляді білої тве1,45 (с, 6Н), 2,90 (м, 1Н), 5,35 (с, 1H, ОН), 7,48 (м, рдої речовини. 1Н), 7,64 (м, 1Н), 7,72 (м, 3Н), 8,11 (м, 2Н), 8,30 (д, Стадія 2: N-Циклопропіл-1-{3-[3-(1-гідрокси-11Н), 8,72 (дд, 1Н), 8,78 (м, 1Н), 8,82 (с, 1Н), 9,72 метилетил)піридин-4-іл]-феніл}-1,4(уш., ΝΗ). дигідро[1,8]нафтиридин-4-он-3-карбоксамід Приклад 34 За методикою стадії 3 прикладу 32, але заміN-Циклопропіл-1-(3-[5-(1-гідрокси-1нюючи 4-бром-2-(1-гідрокси-1метилетил)піридин-2-іл]феніл}-1,4метилетил)піридином зі стадії 1 3-бром-5дигідро[1,8]нафтиридин-4-он-3-карбоксамід метилсульфонілпіридин, одержують сполуку Nциклопропіл-1-{3-[3-(1-гідрокси-1метилетил)тридин-4-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді бежевої твердої речовини. 1 Н ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,78 (м, 2Н), 1,48 (с, 6Н), 2,91 (м, 1Н), 5,27 (с, 1Н, ОН), 7,62-7,66 (м, 2Н), 7,72 7,79 (м, 2Н), 8,01 (м, 1Н), 8,10 (с, 1Н), 8,58 (д, 1Н), 8,73-8,79 (м, 2Н), 8,84 (с, 1Н), 9,73 (уш., ΝΗ). Стадія 1: 2-Бром-5-(1-гідрокси-1Приклад 36 метилетил)піридин Синтез N-циклопропіл-1-(3-[3-(1-гідрокси-1Розчин 2,5-дибромпіридину в діетиловому метилетил)-1-оксидопіридин-4-іл]феніл}-1,4ефірі (5мл/ммоль) охолоджують до температуридигідро[1,8]нафтиридин-4-он-3-карбоксаміду 78°С і повільно додають н-бутиллітій 2, 5М в гексанах (1,05екв.). Через 2 години вистоювання на холоді, додають ацетон (1,3екв.) і перемішування продовжують протягом 1 години. Одержану суміш гасять насиченим водним розчином хлориду амонію, нагрівають до кімнатної температури і розподіляють між ефіром і водою. Неочищений продукт з органічної фази розтирають з 1:1 ефіромтексаСтадія 1: 4-Бром-2-(1-гідрокси-1ном і фільтрують з одержанням сполуки 2-бром-5(1-гідрокси-1-метилетил)піридину у вигляді твердої метилетил)піридин-N-оксид речовини. За методикою стадії 2 прикладу 30, але заміСтадія 2: N-Циклопропіл-1-{3-[5-(1-гідрокси-1нюючи 4-бром-2-(1-гідрокси-1-метилетил)піридин зі стадії 1 прикладу 35 5-бром-2-(1-гідрокси-1метилетил)піридин-2-іл]феніл}-1,4метилетил)піридин, одержують сполуку 4-бром-2дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але замі(1-гідрокси-1-метилетил)піридин-N-оксиду у виглянюючи 2-бром-5-(1-гідрокси-1ді білої твердої речовини. метилетил)піридином зі стадії 1 3-бром-5Стадія 2: N-циклопропіл-1-|3-[3-(1-гідрокси-1метилетил)-1-оксидопіридин-4-іл]феніл}-1,4метилсульфонілпіридин, одержують сполуку Nдигідро[1,8]нафтиридин-4-он-3-карбоксамід циклопропіл-1-{3-[5-(1-гідрокси-1метилетил)піридин-2-іл]феніл}-1,4За методикою стадії 3 прикладу 32, але замідигідро[1,8]нафтиридин-4-он-3-карбоксаміду у винюючи 4-бром-2-(1-гідрокси-1-метилетил)піридингляді твердої речовини. N-оксидом зі стадії 1 3-бром-51 метилсульфонілпіридин, одержують сполуку NН ЯМР (CDCІ3) δ 0,71 (м, 2Н), 0,90 (м, 2Н), циклопропіл-1-{3-[3-(1-гідрокси-1-метилетил)-11,68 (с, 6Н), 1,85 (с, 1Н, ОН), 3,04 (м, 1Н), 7,45-7,52 (м, 2Н), 7,71 (т, 1Н), 7,79 (д, 1Н), 7,95 (дд, 1Н), 8,16 оксидопіридин-4-іл]феніл}-1,4(с, 1Н), 8,20 (д, 1Н), 8,72 (м, 1Н), 8,80-8,87 (м, 2Н), дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви 55 79518 56 гляді бежевої твердої речовини. 1 Н ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,78 (м, 2Н), 1,62 (с, 6Н), 2,90 (м, 1Н), 6,99 (с, 1Н, ОН), 7,65-7,84 (м, 4Н), 7,94 (с, 1Н), 8,03 (дд, 1Н), 8,15 (с, 1Н), 8,38 (д, 1Н), 8,73-8,78 (м, 2Н), 8,83 (с, 1Н), 9,73 (уш., ΝΗ). Приклад 37 N-Циклопропіл-1-[3-(6Стадія 1: 5-Бром-2-метоксипіридин ізопропілсульфонілпіридин-3-іл)феніл}-1,4-дигідроДо розчину 2,5-дибромпіридину (6,95г, [1,8]нафтиридин-4-он-3-карбоксамід 29ммоль) в Ν,Ν-диметилформаміді (5мл) додають метанол (3,56мл) і 1М трет-бутоксид калію (32,3мл), і одержану суміш перемішують при кімнатній температурі протягом 18 годин. Одержану суспензію гасять насиченим водним розчином хлориду амонію і розподіляють між етилацетатом і водою. Неочищений продукт з органічної фази піддають хроматографії на силікагелі, елююючи 1:9 сумішшю е фіру і гексану, з одержанням сполуки 5-бром-2-метоксипіридину у вигляді олії. Стадія 1: 5-Бром-2-ізопропілтіопіридин Стадія 2: N-Циклопропіл-1-[3-(6До суміші 2,5-дибромпіридину (2,07г, метоксипіридин-3-іл)феніл]-1,4-дигідро[1,8]8,73ммоль) і 2-пропантіолу (0,97мл, 10,4ммоль) в нафтиридин-4-он-3-карбоксамід Ν,Ν-диметилформаміді (20мл) при температурі За методикою стадії 3 прикладу 32, але замі0°С порціями додають гідрид натрію, 60% диспернюючи 5-бром-2-метоксипіридином зі стадії 1 3сію в олії (450мг, 11,3ммоль). Одержану суміш бром-5-метилсульфонілпіридин, одержують , споперемішують при кімнатній температурі протягом 1 луку N-циклопропіл-1-[3-(6-метоксипіридин-3години, потім розподіляють між ефіром і водою. іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3Неочищений продукт з органічної фази піддають карбоксаміду у вигляді твердої речовини. хроматографії на силікагелі, елююючи 10% етила1 Н ЯМР (CDCІ3) δ 0,71 (м, 2Н), 0,89 (м, 2Н), цетатом в гексані, з одержанням сполуки 5-бром3,00 (м, 1Н), 4,00 (с, 3Н), 6,85 (д, 1Н), 7,44 (д, 1Н), 2-ізопропілтіопіридину у вигляді твердої речовини. 7,50 (м, 1Н), 7,62 (с, 1Н), 7,68 (т, 1Н), 7,73 (д, 1Н), Стадія 2: 5-Бром-2-ізопропілсульфонілпіридин 7,83 (дд, 1Н), 8,44 (с, 1Н), 8,73 (м, 1Н), 8,85 (дд, До розчину 5-бром-2-ізопропілтіопіридину зі 1Н), 9,10 (с, 1Н), 9,82 (уш., ΝΗ). стадії 1 (2,03г, 8,75ммоль) в тетрагідрофурані Приклад 39 (50мл) і метанолі (25мл) при температурі 0°С доN-Циклопропіл-1-[3-(6-метилпіридин-3дають оксон (15,8г, 25,8ммоль) і потім насичений іл)феніл]-1,4-дигвдро[1,8]-нафтиридин-4-он-3водний бікарбонат натрію (25мл). Одержану суміш карбоксамід перемішують при кімнатній температурі протягом 6 годин. Суміш гасять водним бікарбонатом натрію і розподіляють між етилацетатом і водою. Неочищений продукт з органічної фази піддають хроматографії на силікагелі, елююючи 20% етилацетатом в гексані, з одержанням сполуки 5-бром-2ізопропілсульфонілпіридину у вигляді білої твердої речовини. Стадія 3: N-Циклопропіл-1-[3-(6За методикою стадії 3 прикладу 32, але заміізопропілсульфонілпіридин-3-іл)феніл]-1,4нюючи 5-бром-2-метилпіридином зі стадії 1 придигідро[1,8]нафтиридин-4-он-3-карбоксамід кладу 28 3-бром-5-метилсульфонілпіридин, одерЗа методикою стадії 3 прикладу 32, але заміжують вказану в заголовку сполуку у вигляді нюючи 5-бром-2-ізопропілсулфонілпіридином зі твердої речовини. 1 стадії 2 3-бром-5-метилсульфонілпіридин, одерН ЯМР (CDCІ3) δ 0,72 (м, 2Н), 0,90 (м, 2Н), жують сполуку N-циклопропіл-1-[3-(62,65 (с, 3Н), 3,03 (м, 1Н), 7,28 (д, 1Н), 7,45-7,53 (м, ізопропілсульфонілпіридин-3-іл)феніл]-1,42Н), 7,66 (с, 1Н), 7,72 (т, 1Н), 7,80 (д, 1Н), 7,84 (дд, дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у ви1Н), 7,83 (м, 1Н), 8,80 (с, 1Н), 8,86 (дд, 1Н), 9,11 (с, гляді твердої речовини. 1Н), 9,82 (уш, ΝΗ). 1 Н ЯМР (CDCІ3) δ 0,70 (м, 2Н), 0,89 (м, 2Η), Приклад 40 1,39 (д, 6Н), 3,00 (м, 1Н), 3,82 (м, 1Н), 7,51 (м, 1Н), N-Циклопропіл-1-{3-(6-(2,2,27,60 (д, 1Н), 7,72 (с, 1Н), 7,80 (т, 1Н), 7,83 (д, 1Н), трифторетокси)піридин-3-іл]феніл}-1,48,15-8,24 (м, 2Н), 8,72 (м, 1Н), 8,86 (дд, 1Н), 9,03 дигідро[1,8]нафтиридин-4-он-3-карбоксамід (с, 1Н), 9,10 (с, 1Н), 9,82 (уш., ΝΗ). Приклад 38 N-Циклопропіл-1-[3-(6-метокситридин-3іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід 57 79518 Стадія 1: 5-Бром-2-(2,2,2трифторетокси)піридин За методикою стадії 1 прикладу 38, але замінюючи 2,2,2-трифторетанолом метанол, при нагріванні при температурі 70°С протягом 18 годин одержують сполуку 5-бром-2-(2,2,2трифторетокси)піридину у вигляді олії. Стадія 2: N-Циклопропіл-1-(3-[6-(2,2,2трифторетокси)піридин-3-іл]Феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але замінюючи 5-бром-2-(2,2,2-трифторетокси)піридином зі стадії 1 3-бром-5-метилсульфонілпіридин, одержують сполуку N-циклопропіл-1-{3-[6-(2,2,2трифторетокси)піридин-3-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 0,72 (м, 2Н), 0,90 (м, 2Н), 3,03 (м, 1Н), 4,85 (кв., 2Н), 7,00 (д, 1Н), 7,43-7,53 (м, 2Н), 7,62 (с, 1Н), 7,69-7,78 (м, 2Н), 7,92 (дд, 1Н), 8,42 (с, 1Н), 8,73 (м, 1Н), 8,85 (дд, 1Н), 9,10 (с, 1Н), 9,80 (уш, ΝΗ). Приклад 41 N-Циклопропіл-1-[3-('5-бромпіридин-3іл)феніл]-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксамід За методикою стадії 3 прикладу 32, але замінюючи 3,5-дибромпіридином 3-бром-5метилсульфонілпіридин, одержують вказану в заголовку сполуку у вигляді білої твердої речовини. 1 Н ЯМР (ДМСО-d6) δ 0,58 (м, 2Н), 0,79 (м, 2Н), 2,90 (м, 1Н), 7,65 (м, 1Н), 7,71-7,77 (м, 2Н), 8,03 (д, 1Н), 8,14 (с, 1Н), 8,49 (с, 1Н), 8,74 (уш.с, 1Н), 8,79 (уш.с, 1Н), 8,86 (с, 1Н), 9,01 (с, 1Н), 9,73 (уш., ΝΗ). Приклад 42 N-Циклопропіл-1-[3-(6-бензилоксипіридин-3іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксамід Стадія 1: 2-Бензилокси-5-бромпіридин 58 Суміш 2,5-дибромпіридину, бензилового спирту (1,3екв.), гранул гідроксиду калію (2,4екв.) і дибензо-18-крауна-6 (0,05екв.) в толуолі (4мл/ммоль) кип'ятять зі зворотним холодильником з одночасним азеотропним видаленням води, протягом 3 годин. Після випарювання толуолу одержану суміш розподіляють між хлороформом і водою. Неочищений продукт з органічної фази перекристалізовують з ефіру-гексану з одержанням сполуки 2бензилокси-5-бромпіридину у вигляді твердої речовини. Стадія 2: N-Циклопропіл-1-[3-(6бензилоксипіридин-3-іл)феніл]-1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але замінюючи 2-бензилокси-5-бромпіридином зі стадії 1 3бром-5-метилсульфонілпіридин, одержують сполуку N-циклопропіл-1-[3-(6-бензилоксипіридин-3іл)феніл]-1,4-дигідро[1,8]-нафтиридин-4-он-3карбоксаміду у вигляді білої твердої речовини. 1 Н ЯМР (ДМСО-d6) δ 0,57 (м, 2Н), 0,79 (м, 2Н), 2,91 (м, 1Н), 5,42 (с, 2Н), 7,00 (д, 1Н), 7,32-7,48 (м, 5Н), 7,61-7,72 (м, 3Н), 7,90 (д, 1Н), 7,99 (с, 1Н), 8,14 (д, 1Н), 8,59 (с, 1Н), 8,73-8,84 (м, 3Н), 9,73 (уш., ΝΗ). Приклад 43 N-Циклопропіл-1-(3-[6дициклопропіл(гідрокси)метил-1-океидопіридин-3іл]феніл}-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксамід Стадія 1: 5-Бром-2дициклопропіл(гідрокси)метилпіридин-N-оксид За методикою стадій 1 і 2 прикладу 30, але замінюючи дициклопропіл-кетон ацетон на стадії 1, одержують сполуку 5-бром-2дициклопропіл(гідрокси)-метилпіридин-N-оксиду у вигляді твердої речовини. Стадія 2: N-Циклопропіл-1-(3-[6дициклопропіл(гідрокси)метил-1-оксидопіридин-3іл]феніл}-1,4-дигідро[1,8]нафтиридин-4-он-3карбоксамід За методикою стадії 3 прикладу 32, але замінюючи 5-бром-2дициклопропіл(гідрокси)метилпіридин-N-оксидом зі стадії 1 3-1-{3-[6-дициклопропіл(гідрокси)метил1-оксидопіридин-3-іл]феніл}-1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді білої твердої речовини. 1 Н ЯМР (CDCІ3) δ 0,52 (м, 4Н), 0,70 (м, 4Н), 0,76 (м, 2Н), 0,89 (м, 2Н), 1,35 (м, 2Н), 3,02 (м, 1Н), 7,52 (м, 1Н), 7,58 (м, 1Н), 7,62 (дд, 1Н), 7,68 (с, 1Н), 7,73-7,80 (м, 3Н), 8,15 (уш., 1H, ОН), 8,49 (с, 1Н), 8,72 (м, 1Н), 8,85 (дд, 1Н), 9,09 (с, 1Н), 9,78 (уш., ΝΗ). Приклад 44 N-Циклопропіл-1-{3-[5-(1-гідрокси-1метилетил)-1-оксидопіридин-2-іл]феніл}-1,4 59 дигідро[1,8]нафтиридин-4-он-3-карбоксамід 79518 Стадія 1: 2-Бром-5-(1-гідрокси-1метилетил)піридин-N-оксид За методикою стадії 2 прикладу 30, але замінюючи 2-бром-5-(1-гідрокси-1метилетил)піридином зі стадії 1 прикладу 34 5бром-2-(1-гідрокси-1-метилетил)піридин, одержують сполуку 2-бром-5-(1-гідрокси-1метилетил)піридин-N-оксиду у ви гляді білої твердої речовини. Стадія 2: N-Циклопропіл-1-{3-[5-(1-гідрокси-1метилетил)-1-оксидопіридин-2-іл]феніл}-1,4дигідро [1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але замінюючи 2-бром-5-(1-гідрокси-1-метилетил)піридинN-оксидом зі стадії 1 3-бром-5метилсульфонілпіридин, одержують сполуку Nциклопропіл-1-{3-[5-(1-гідрокси-1-метилетил)-1оксидопіридин-2-іл]феніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 0,69 (м, 2Н), 0,88 (м, 2Н), 1,63 (с, 6Н), 2,20 (с, 1Н, ОН), 2,98 (м, 1Н), 7,38-7,49 (м, 3Н), 7,52 (д, 1Н), 7,70 (т, 1Н), 7,98-8,04 (м, 2Н), 8,50 (с, 1Н), 8,69 (м, 1Н), 8,80 (дд, 1Н), 9,08 (с, 1Н), 9,75 (уш., ΝΗ). Приклад 45 Циклопропіл-1-(3-[6-(1-гідрокси-1метилетил)піридин-3-іл]феніл}1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 3 прикладу 32, але· замінюючи 5-бром-2-(1-гідрокси-1метилетил)піридином зі стадії 1 прикладу 30 3бром-5-метилсульфонілпіридин, одержують вказану в заголовку сполуку у вигляді твердої речовини. 1 Н ЯМР (CDCІ3) δ 0,72 (м, 2Н), 0,90 (м, 2Н), 1,62 (с, 6Н), 3,02 (м, 1Н), 4,85 (с, 1H, ОН), 7,48-7,53 (м, 3Н), 7,68 (с, 1Н), 7,73 (т, 1Н), 7,80 (д, 1Н), 7,95 (дд, 1Н), 8,72 (м, 1Н), 8,81 (с, 1Н), 8,86 (дд, 1Н), 9,10 (с, 1Н), 9,78 (уш., ΝΗ). Приклад 46 N-Ізобутил-1-{3-[6-(1-гідрокси-1метилетил)піридин-3-іл]феніл}-1,4-дигідро[1,8]нафтиридин-4-он-3-карбоксамід 60 Стадія 1: 5-(3-Амінофеніл)-2-(1-гідрокси-1метилетил)піридин За методикою стадії 5 прикладу 1, але замінюючи 3-амінофенілборною кислотою 3ацетилфенілборну кислоту, і замінюючи 5-бром-2(1-гідрокси-1-метилетил)піридином зі стадії 1 прикладу 30 N-ізопропіл-1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід, одержують сполуку 5-(3-амінофеніл)-2-(1-гідрокси-1метилетил)піридин у вигляді твердої речовини. Стадія 2: 1-{3-[6-(1-Гідрокси-1метилетил)піридин-3-іл]феніл}1,4-дигідро[1,8]нафтиридин-4-он-3-карбонова кислота За методикою стадій 1-3 прикладу 1, але замінюючи 5-(3-амінофеніл)-2-(1-гідрокси-1метилетил) піридином 3-броманілін зі стадії 1 на першій стадії, одержують сполуку 1-{3-[6-(1гідрокси-1-метилетил)піридин-3-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти у вигляді твердої речовини. Стадія 3: N-Ізобутил-1-{3-[6-(1-гідрокси-1метилетил)піридин-3-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід За методикою стадії 4 прикладу 1, але замінюючи кислотою зі стадії 2 1-(3-бромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонову кислоту, і замінюючи ізобутиламіном ізопропіламін, одержують сполуку N-ізобутил-1-{3-[6-(1-гідрокси-1метилетил)піридин-3-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксаміду у вигляді кремової твердої речовини. 1 Н ЯМР (Ацетон-d6) δ 0,98 (д, 6Н), 1,53 (с, 6Н), 1,88 (м, 1Н), 3,26 (т, 2Η), 4,66 (с, 1Н, ОН), 7,60 (м, 1Н), 7,69 (д, 1Н), 7,76-7,79 (м, 2Н), 7,95 (д, 1Н), 8,05 (с, 1Н), 8,16 (дд, 1Н), 8,73 (м, 1Н), 8,79 (дд, 1Н), 8,90 (с, 1Н), 8,94 (с, 1Н), 9,83 (уш, ΝΗ). Приклад 47 N-Циклопропіл-1-(5-бром-3-[6-(1-гідрокси-1метилетил)піридин-3-іл]феніл}-1,4дигідро[1,8]нафтиридин-4-он-3-карбоксамід Стадія 1: 1-(3,5-Дибромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонова кислота За методикою стадій 1-3 прикладу 1, але замінюючи 3,5-диброманіліном 3-броманілін на стадії 1, одержують сполуку 1-(3,5-дибромфеніл)-1,4дигідро[1,8]нафтиридин-4-он-3-карбонової кислоти у вигляді бежевої твердої речовини. Стадія 2: N-Циклопропіл-1-(3.5-дибромфеніл)
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of phosphodiesterase-4 inhibitors
Назва патенту російськоюСпособ получения ингибиторов фосфодиэстеразы-4
МПК / Мітки
МПК: C07D 471/04
Мітки: фосфодіестерази-4, спосіб, одержання, інгібіторів
Код посилання
<a href="https://ua.patents.su/41-79518-sposib-oderzhannya-ingibitoriv-fosfodiesterazi-4.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання інгібіторів фосфодіестерази-4</a>
Попередній патент: Гумова суміш
Наступний патент: Платформа жниварки і підбирача зернозбирального комбайна
Випадковий патент: Спосіб переробки вторинної алюмінієвмісної сировини












