Сполуки 4-оксо-4,6,7,8-тетрагідропіроло[1,2-a]піразин-6-карбоксаміду, спосіб їх одержання і фармацевтична композиція, яка їх містить
Номер патенту: 83638
Опубліковано: 11.08.2008
Автори: Рюпен Ален, Пармантьє Жан-Жиль, ГЛОАНЕК Філіп, Де Нантей Гійом, Бенуат Ален, Валлє Марі-Оділь, Верберен Тоні
Формула / Реферат
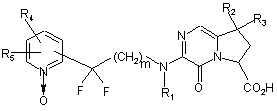
1. Сполука формули (І):
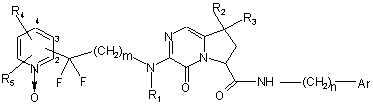 , (I)
, (I)
де:
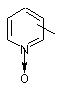 являє собою 1-оксидопіридильну групу, заміщену залишком молекули в будь-якому з положень 2, 3 і 4,
являє собою 1-оксидопіридильну групу, заміщену залишком молекули в будь-якому з положень 2, 3 і 4,
m і n, які можуть бути однаковими або відрізнятись, кожний являє собою ціле число від 1 до 3,
R1 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу,
R2 і R3, які можуть бути однаковими або відрізнятись, кожний являє собою атом або групу, що вибирають з атомів водню і галогену і груп лінійного або розгалуженого (С1-С6)алкілу, гідрокси, лінійного або розгалуженого (С1-С6)ацилокси і лінійного або розгалуженого (С1-С6)алкокси, або разом утворюють, з атомом вуглецю, який їх несе, циклоалкан, що має від 3 до 6 атомів вуглецю,
R4 і R5 кожний являє собою атом водню, або є сусідніми і разом утворюють, з атомами вуглецю, які їх несуть, бензокільце,
Аr являє собою арильну або гетероарильну групу,
та її енантіомери і адитивні солі з фармацевтично прийнятною кислотою,
"арильна група", як повинно бути зрозумілим, означає феніл, біфеніліл або нафтил, кожна з яких груп необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з:
галогену,
лінійного або розгалуженого (С1-С6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-С6)алкільними групами,
лінійного або розгалуженого (С1-С6)алкокси,
гідрокси,
тригало-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою,
аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами,
карбоксиметокси,
і карбамоїлметокси, необов'язково N-заміщеного однією або двома групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, гідроксі-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкільної групи, в якій алкокси і алкільна частини кожна є лінійним або розгалуженим С1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-С6,
і "гетероарильна група", як повинно бути зрозумілим, означає моно- або біциклічну ароматичну групу, яка має від 5 до 12 кільцевих членів і містить один, два або три гетероатоми, які вибирають з кисню, азоту і сірки, і повинно бути зрозумілим, що гетероарил може бути необов'язково заміщеним однією або більше однаковими або різними групами, які вибирають з:
галогену,
лінійного або розгалуженого (С1-С6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-Сб)алкільними групами,
гідрокси,
оксо,
лінійного або розгалуженого (С1-С6)алкокси,
тригало-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою,
аміно, необов'язково N-заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами,
карбоксиметокси,
і карбамоїлметокси, необов'язково N-заміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, гідроксі-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим С1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-С6.
2. Сполука формули (І) за п. 1, де конфігурація асиметричного центра в альфа-положенні відносно аміду являє собою (S).
3. Сполука формули (І) за пп. 1 або 2, де m являє собою 1, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
4. Сполука формули (І) за будь-яким з пп. 1-3, де n являє собою 1, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
5. Сполука формули (І) за будь-яким з пп. 1-4, де R1 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
6. Сполука формули (І) за будь-яким з пп. 1-5, де R2 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
7. Сполука формули (І) за будь-яким з пп. 1-6, де R3 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
8. Сполука формули (І) за будь-яким з пп. 1-7, де R4 і R5 кожний являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
9. Сполука формули (І) за будь-яким з пп. 1-7, де R4 і R5 є сусідніми і разом утворюють, з атомами вуглецю, які їх несуть, бензокільце, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
10. Сполука формули (І) за будь-яким з пп. 1-9, де Аr являє собою фенільну, тієнільну або піридильну групу, кожна з цих груп незаміщена або заміщена однією або більше однаковими або різними групами, які вибирають з:
галогену,
лінійного або розгалуженого (С1-С6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама по собі необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-С6)алкільними групами,
лінійного або розгалуженого (С1-С6)алкокси,
гідрокси,
тригало-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою,
аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1-С6)алкільними групами,
карбоксиметокси,
і карбамоїлметокси, необов'язково N-заміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, гідроксі-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим С1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-С6,
її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
11. Сполука формули (І) за п. 10, де Аr являє собою фенільну групу, незаміщену або заміщену одним або більше однаковими або різними атомами галогену, які вибирають з фтору і хлору, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою.
12. Сполука формули (І) за п. 1, вибрана з групи:
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2-фторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер;
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2,6-дифторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер;
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2-хлорбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер;
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2,5-дифторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер;
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2,3-дифторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер і
3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}-N-(2,3,6-трифторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер.
13. Спосіб одержання сполук формули (І) за п. 1, в якому сполуку формули (II):
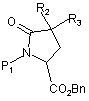 , (II)
, (II)
де R2 і R3 є такими ж, як визначено для формули (І), Р1 являє собою захисну групу для аміно функції і Вn являє собою бензильну групу,
відновлюють, при використанні відновлювального агента, з одержанням сполуки формули (III):
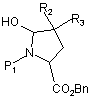 , (III)
, (III)
де R2, R3, P1 і Вn є такими ж, як визначено вище,
гідроксифункцію яких перетворюють в метокси- і потім в ціанофункцію шляхом звичайних реакцій органічної хімії з одержанням після зняття захисту амінофункції сполуки формули (IV):
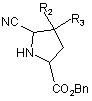 , (IV)
, (IV)
де R2, R3 і Вn є такими ж, як визначено вище,
яку піддають реакції з оксалілхлоридом з одержанням сполуки формули (V):
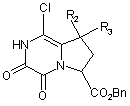 , (V)
, (V)
де R2, R3 і Вn є такими ж, як визначено вище,
яку піддають реакції каталітичної гідрогенізації з одержанням сполуки формули (VI):
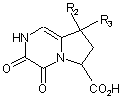 , (VI)
, (VI)
де R2 і R3 є такими ж, як визначено вище,
яку етерифікують з утворенням сполуки формули (VII):
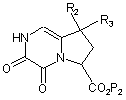 , (VII)
, (VII)
де R2 і R3 є такими ж, як визначено вище, і Р2 являє собою лінійну або розгалужену (С1-С6)алкільну групу,
яку піддають реакції з агентом бромування з одержанням сполуки формули (VIII):
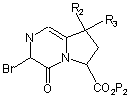 , (VIII)
, (VIII)
де R2, R3 і Р2 є такими ж, як визначено вище,
яку піддають реакції з 2-меркаптоіпридином з одержанням сполуки формули (IX):
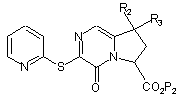 , (IX)
, (IX)
де R2, R3 і Р2 є такими ж, як визначено вище,
яку піддають реакції з N-оксидом формули (X):
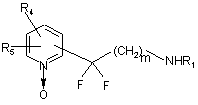 , (X)
, (X)
де m, R1, R4 і R5 є такими ж, як визначено для формули (І),
з одержанням сполуки формули (XI):
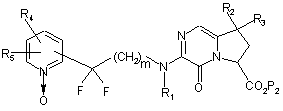 , (XI)
, (XI)
де m, R1, R2, R3, R4, R5 і Р2 є такими ж, як визначено вище,
для кислотної функції якої знімають захист з одержанням сполуки формули (XII):
 , (XII)
, (XII)
де m, R1, R2, R3, R4 і R5 є такими ж, як визначено вище,
яку піддають реакції зі сполукою формули (XIII):
![]() , (ХIII)
, (ХIII)
де n і Аr є такими ж, як визначено для формули (І),
у присутності зв'язувального агента з одержанням сполуки формули (І).
14. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-12 у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними носіями.
15. Застосування сполук формули (І) за будь-яким з пп. 1-12 для виробництва ліків для застосування як інгібіторів тромбіну.
16. Застосування сполук формули (І) за будь-яким з пп. 1-12 для виробництва ліків для застосування у лікуванні стабільної або нестабільної стенокардії, розладів тромботичного походження і/або розладів, які викликають тромботичні ускладнення, у лікуванні або запобіганні інфаркту міокарда і венозного або артеріального тромбозів, і у лікуванні ускладнень судинних і серцево-судинних хвороб, таких як атеросклероз, артеріїт, венозне захворювання, і у лікуванні будь-яких розладів, включаючи утворення і/або активність тромбіну.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 83638 С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкільної групи, в якій алкокси і алкільна частини кожна є лінійним або розгалуженим С 1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С 1-С6, і "гетероарильна група", як повинно бути зрозумілим, означає моно- або біциклічну ароматичну груп у, яка має від 5 до 12 кільцевих членів і містить один, два або три гетероатоми, які вибирають з кисню, азоту і сірки, і повинно бути зрозумілим, що гетероарил може бути необов'язково заміщеним однією або більше однаковими або різними групами, які вибирають з: галогену, лінійного або розгалуженого (С1-С6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-Сб )алкільними групами, гідрокси, оксо, лінійного або розгалуженого (С1-С6)алкокси, тригало-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, аміно, необов'язково N-заміщеного однією або двома лінійними або розгалуженими (С1С6)алкільними групами, карбоксиметокси, і карбамоїлметокси, необов'язково N-заміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, гідроксі-(С1С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим С1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-С6. 2. Сполука формули (І) за п. 1, де конфігурація асиметричного центра в альфа-положенні відносно аміду являє собою (S). 3. Сполука формули (І) за пп. 1 або 2, де m являє собою 1, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 4. Сполука формули (І) за будь-яким з пп. 1-3, де n являє собою 1, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 5. Сполука формули (І) за будь-яким з пп. 1-4, де R1 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 6. Сполука формули (І) за будь-яким з пп. 1-5, де R2 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 7. Сполука формули (І) за будь-яким з пп. 1-6, де R3 являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 8. Сполука формули (І) за будь-яким з пп. 1-7, де R4 і R5 кожний являє собою атом водню, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 9. Сполука формули (І) за будь-яким з пп. 1-7, де R4 і R5 є сусідніми і разом утворюють, з атомами 4 вуглецю, які їх несуть, бензокільце, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 10. Сполука формули (І) за будь-яким з пп. 1-9, де Аr являє собою фенільну, тієнільну або піридильну груп у, кожна з цих груп незаміщена або заміщена однією або більше однаковими або різними групами, які вибирають з: галогену, лінійного або розгалуженого (С1-С6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама по собі необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-С6)алкільними групами, лінійного або розгалуженого (С1-С6)алкокси, гідрокси, тригало-(С1-С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1С6)алкільними групами, карбоксиметокси, і карбамоїлметокси, необов'язково N-заміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-С6)алкілу, гідроксі-(С1С6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим С1-С6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-С6, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 11. Сполука формули (І) за п. 10, де Аr являє собою фенільну груп у, незаміщену або заміщену одним або більше однаковими або різними атомами галогену, які вибирають з фтору і хлору, її енантіомери і її адитивні солі з фармацевтично прийнятною кислотою. 12. Сполука формули (І) за п. 1, вибрана з групи: 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2-фторбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2,6-дифторбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2-хлорбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2,5-дифторбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2,3-дифторбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер і 3-{[2,2-дифтор-2-(1-оксидо-2-піридил)етил]аміно}N-(2,3,6-трифторбензил)-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід і його (6S) енантіомер. 5 83638 6 13. Спосіб одержання сполук формули (І) за п. 1, в якому сполуку формули (II): R2 O R3 , (II) де R2 і R3 є такими ж, як визначено для формули (І), Р 1 являє собою захисну гр упу для аміно функції і Вn являє собою бензильну груп у, відновлюють, при використанні відновлювального агента, з одержанням сполуки формули (III): R2 HO CO2P2 , (VIII) де R2, R3 і Р 2 є такими ж, як визначено вище, яку піддають реакції з 2-меркаптоіпридином з одержанням сполуки формули (IX): R2 R3 N N N S CO2P2 O R3 , (IX) де R2, R3 і Р 2 є такими ж, як визначено вище, яку піддають реакції з N-оксидом формули (X): N P1 N O CO2 Bn R3 N Br N P1 R2 R4 CO2Bn , (III) де R2, R3, P1 і Вn є такими ж, як визначено вище, гідроксифункцію яких перетворюють в метокси- і потім в ціанофункцію шляхом звичайних реакцій органічної хімії з одержанням після зняття захисту амінофункції сполуки формули (IV): R2 NC R3 R5 (CH2) m N O F NHR1 F , (X) де m, R1, R4 і R5 є такими ж, як визначено для формули (І), з одержанням сполуки формули (XI): R2 R4 HN R3 N R5 , (IV) де R2, R3 і Вn є такими ж, як визначено вище, яку піддають реакції з оксалілхлоридом з одержанням сполуки формули (V): Cl R2 R3 O CO2Bn , (V) де R2, R3 і Вn є такими ж, як визначено вище, яку піддають реакції каталітичної гідрогенізації з одержанням сполуки формули (VI): R2 R3 HN N O R2 CO2H R2 R5 R3 HN N CO2P2 , (VII) де R2 і R3 є такими ж, як визначено вище, і Р2 являє собою лінійну або розгалужену (С1-С6)алкільну груп у, яку піддають реакції з агентом бромування з одержанням сполуки формули (VIII): (CH2) m N N O R3 F F R1 N O CO2 H , (XII) де m, R1, R2, R3, R4 і R5 є такими ж, як визначено вище, яку піддають реакції зі сполукою формули (XIII): H 2N , (VI) де R2 і R3 є такими ж, як визначено вище, яку етерифікують з утворенням сполуки формули (VII): O CO2 P2 O R1 N O O F R4 N O F N , (XI) де m, R1, R2, R3, R4, R5 і Р2 є такими ж, як визначено вище, для кислотної функції якої знімають захист з одержанням сполуки формули (XII): HN O (CH 2) m N N CO2Bn CH 2 n Ar , (ХIII) де n і Аr є такими ж, як визначено для формули (І), у присутності зв'язувального агента з одержанням сполуки формули (І). 14. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-12 у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними носіями. 15. Застосування сполук формули (І) за будь-яким з пп. 1-12 для виробництва ліків для застосування як інгібіторів тромбіну. 16. Застосування сполук формули (І) за будь-яким з пп. 1-12 для виробництва ліків для застосування у лікуванні стабільної або нестабільної стенокардії, розладів тромботичного походження і/або роз 7 ладів, які викликають тромботичні ускладнення, у лікуванні або запобіганні інфаркту міокарда і венозного або артеріального тромбозів, і у лікуванні ускладнень судинних і серцево-судинних хвороб, 83638 Даний винахід відноситься до нових сполук 4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксаміду, способу їх одержання, фармацевтичних композицій, які їх містять, і до їх застосування як інгібіторів тромбіну. Тромбін являє собою ключовий ензим для коагуляції і відіграє центральну роль в патології венозних і артеріальних тромбозів, особливо беручи до ува ги його відмічену здатність викликати автоампліфікацію каскаду коагуляції [F. Toti et al., Sang, Thrombose, Vaisseaux 1992, 4, 483-494 і Т.М. Reilly et al., Blood Coagulation and Fibrinolysis 1992, 3, 513-517]. Пряме і специфічне інгібування тромбіну є більш ефективним і спричиняє менше ризику кровотечі, ніж лікування гепарином. В даний момент існують прямі інгібітори тромбіну, але недоліком таких пептидних речовин є те, що вони не є активними при введенні оральним шляхом. Пептидоміметичні сполуки, які мають оральну антитромботичну активність, вже були розкриті в літературі. Вони включають, наприклад, сполуки боронової кислоти, розкриті в описах патентних заявок [EP 293 881, EP 471 651, EP 615 978 i EP 792 883], і сполуки, розкриті в описах патентних заявок [WO 94 29336, WO 95 23609 i EР 1 069 132]. Задачею даного винаходу було одержати нові інгібітори тромбіну, активні при введенні оральним шляхом, які одночасно є добре абсорбованими, сильнодіючими, селективними і надійними у використанні. У цьому відношенні, важливо одержати сполуки, які представляють мінімальний ризик взаємодії з їжею або ліками. Більш конкретно, даний винахід відноситься до сполук формули (І): де: являє собою 1-оксидопіридильну груп у, заміщену залишком молекули в будь-якому з положень 2, 3 і 4, - m і n, які можуть бути однаковими або відрізнятись, кожний являє собою ціле число від 1 до 3, - R1 являє собою атом водню або лінійну або розгалужену (С1-C6)алкільну гр упу, 8 таких як атеросклероз, артеріїт, венозне захворювання, і у лікуванні будь-яких розладів, включаючи утворення і/або активність тромбіну. - R2 і R3, які можуть бути однаковими або відрізнятись, кожний являє собою атом або групу, яку вибирають з атомів водню і галогену і груп лінійного або розгалуженого (С1-C6)алкілу, гідрокси, лінійного або розгалуженого (C1-С6)ацилокси і лінійного або розгалуженого (С1-С6)алкокси, або разом утворюють, з атомом вуглецю, який їх несе, циклоалкан, що має від 3 до 6 атомів вуглецю, - R4 і R5 кожний являє собою атом водню, або є сусідніми і разом утворюють, з атомами вуглецю, які їх несуть, бензо кільце, - Ar являє собою арильну або гетероарильну груп у, до їх енантіомерів і адитивних солей з фармацевтично прийнятною кислотою. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфонова кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота, камфорна кислота і т.д. "Арильна група", як повинно бути зрозумілим, означає феніл, біфеніліл або нафтил, кожна з яких гр уп необов'язково заміщена однією або більше однаковими або різними групами, які вибирають з: - галогену, - лінійного або розгалуженого (С1-C6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-C6)алкільними групами, - лінійного або розгалуженого (С1-C6)алкокси, - гідрокси, - тригало-(С1-C6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, - аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1C6)алкільними групами, - карбоксиметокси, - і карбамоїлметокси, необов'язково Nзаміщеного однією або двома групами, які вибирають з лінійного або розгалуженого (С1C6)алкілу, гідроксі-(С1-C6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкільної групи, в якій алкокси і алкільна частини кожна є лінійним або розгалуженим С 1C6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-C6. 9 "Гетероарильна група", як повинно бути зрозумілим, означає моно- або біциклічну ароматичну гр уп у, яка має від 5 до 12 кільцевих членів і містить один, два або три гетероатоми, які вибирають з кисню, азоту і сірки, і повинно бути зрозумілим, що гетероарил може бути необов'язково заміщеним однією або більше однаковими або різними групами, які вибирають з: - галогену, - лінійного або розгалуженого (С1-C6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама необов'язково заміщеною однією або двома лінійними або розгалуженими (С1-C6)алкільними групами, - гідрокси, - оксо, - лінійного або розгалуженого (С1-C6)алкокси, - тригало-(С1-C6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, - аміно, необов'язково N-заміщеного однією або двома лінійними або розгалуженими (С1C6)алкільними групами, - карбоксиметокси, - і карбамоїлметокси, необов'язково Nзаміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-C6)алкілу, пдрокси-(С1-C6)алкіл у, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим С 1-C6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим С1-C6. Серед гетероарильних груп можуть бути згадані, без будь-якого обмеження, групи тієнілу, піридилу, фурилу, піролілу, імідазолілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піримідинілу, піразинілу, піридазинілу, індолілу, бензофурилу і хінолілу. m переважно дорівнює 1. n переважно дорівнює 1. R1, R2 і R3 кожний переважно являє собою атом водню. Переважне втілення винаходу відноситься до сполук формули (І), де R4 і R5 кожний являє собою атом водню. Інше переважне втілення винаходу відноситься до сполук формули (І), де R4 і R5 є сусідніми і разом утворюють, з атомами вуглецю, які їх несуть, бензо кільце. Група Ar переважно являє собою фенільну, тієнільну або піридильну групу, кожна з цих груп незаміщена або заміщена однією або більше однаковими або різними групами, які вибирають з: - галогену, - лінійного або розгалуженого (С1-C6)алкілу, необов'язково заміщеного гідрокси, карбокси або карбамоїльною групою, карбамоїльна група є сама по собі необов'язково заміщеною однією або двома лінійними або розгалуженими (С1C6)алкільними групами, - лінійного або розгалуженого (С1-C6)алкокси, - гідрокси, 83638 10 - тригало-(С1-C6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, - аміно, необов'язково заміщеного однією або двома лінійними або розгалуженими (С1C6)алкільними групами, - карбоксиметокси, - і карбамоїлметокси, необов'язково Nзаміщеного однією або двома групами, вибраними з лінійного або розгалуженого (С1-C6)алкілу, гідроксі-(С1-C6)алкілу, в якому алкільна частина може бути лінійною або розгалуженою, алкоксіалкілу, в якому алкокси і алкільна частина кожна є лінійним або розгалуженим C1-C6, і піридилалкілу, в якому алкільна частина є лінійним або розгалуженим C1-C6. Більш переважно, Ar являє собою фенільну груп у, незаміщену або заміщену одним або більше однаковими або різними атомами галогену, які вибирають з фтору і хлору. Переважні сполуки формули (І) являють собою наступні: 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,6-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-хлорбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,5-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер; 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,3-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер, і 3-{[2,2-дифтор-2-(1-оксидо-2тридил)етил]аміно}-N-(2,3,6-трифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід, і його (6S) енантіомер. Винахід відноситься також до способу одержання сполук формули (І), який відрізняється тим, що сполуку формули (II): де R2 і Яз є такими ж, як визначено для формули (І), P1 являє собою захисну груп у для аміно функції і Bn являє собою бензильну груп у, відновлюють, при використанні відновлювального агента, з тим, щоб одержати сполуку формули (III): 11 де R2, R3, P1 і Bn є такими ж, як визначено вище, гідрокси функцію яких перетворюють в метокси і потім в ціано функцію шляхом звичайних реакцій органічної хімії з тим, щоб одержати, після зняття захисту аміно функції, сполуки формули (IV): 83638 12 де R2, R3 і P2 є такими ж, як визначено вище, яку піддають реакції з N-оксидом формули (X): де m, R1, R4 і R5 є такими ж, як визначено для формули (І), з тим, щоб одержати сполуку формули (XI): де R2, R3 і Bn є такими ж, як визначено вище, яку піддають реакції з оксаліл хлоридом, для одержання сполуки формули (V): де m, R1, R2, R3, R4, R5 і Р2 є такими ж, як визначено вище, для кислотної функції якої знімають захист з тим, щоб одержати сполуку формули (XII): де R2, R3 і Bn є такими ж, як визначено вище, яку піддають реакції каталітичної гідрогенізації, для одержання сполуки формули (VI): де m, R1, R2, R3, R4 і R5 є такими ж, як визначено вище, яку піддають реакції зі сполукою формули (XIII): де R2 і R3 є такими ж, як визначено вище, яку етерифікують для утворення сполуки формули (VII): де R2 і R3 є такими ж, як визначено вище, і P2 являє собою лінійну або розгалужену (С1C6)алкільну груп у, яку піддають реакції з агентом бромування з тим, щоб одержати сполуку формули (VIII): де R2, R3 і P 2 є такими ж, як визначено вище, яку піддають реакції з 2-меркаптоіпридином, для одержання сполуки формули (IX): де n і Ar є такими ж, як визначено для формули (І), у присутності зв'язувального агента з тим, щоб одержати сполуку формули (I). Адитивні солі сполук формули (І) одержують реакцією сполуки з фармацевтично прийнятною кислотою. Сполуки формули (І) мають асиметричний центр і тому можуть існувати у формі рацемічної суміші або в оптично активній формі. Оптично активні сполуки формули (І) можуть бути одержані, наприклад, за допомогою використання відповідної оптично активної сполуки формули (II) як вихідного матеріалу або відокремленням відповідної рацемічної суміші формули (І), наприклад хіральною ВЕРХ хроматографією. Переважними сполуками формули (І) є ті сполуки, де конфігурація асиметричного центра в альфа положенні по відношенню до аміду являє собою (S). Сполуки формули (II) одержують реакцією бензилування відповідних кислот. Сполуки за даним винаходом володіють особливо цінними фармакологічними властивостями. 13 Вони є сильнодіючими інгібіторами тромбіну, які є активними при оральному введенні. Такі властивості роблять їх корисними у лікуванні стабільної або нестабільної стенокардії, розладів тромботичного походження і/або які викликають тромботичні ускладнення, у лікуванні або запобіганні інфаркту міокарду і венозного або артеріального тромбозів, і у лікуванні ускладнень судинних і серцево-судинних хвороб, таких як атеросклероз, артериїт, венозне захворювання, і у лікуванні будь-яких розладів, включаючи утворення і/або активність тромбіну. Вони можуть також використовува тись у терапевтичному поєднанні з тромболітичними засобами. Винахід також відноситься до фармацевтичних композицій, які містять як активний інгредієнт сполуку формули (І) разом з одним або більше прийнятним інертним, нетоксичним ексципієнтом. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно ті, які придатні для орального, парентерального (внутрішньовенного або підшкірного) або назального введення, таблетки або драже, під'язикові таблетки, желатинові капсули, коржики, супозиторії, креми, мазі, шкірні гелі, препарати для ін'єкцій, суспензії, придатні для пиття і т.д. Корисне дозування може бути пристосоване відповідно до природи і тяжкості розладу, шля ху введення і віку і ваги пацієнта. Дозування змінюється від 1 до 500 мг на день за одне або більше введень. Наступні Приклади ілюструють винахід. Вихідні матеріали, які використовують, являють собою відомі продукти або їх одержують відповідно до відомих методик. Структури сполук, які описуються у Прикладах, були визначені відповідно до звичайних спектрофотометричних методик (інфрачервоний ЯМР, мас-спектрометрія). Приклад 1: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Стадія А: Бензил N-трет-бутоксикарбоніл-3оксопролінат При 0°С додають 11ммол диметиламінопіридину і 11ммол ди-трет-бутил дикарбонату до 10ммол бензил 5-оксопролінату (спосіб одержання якого описаний E. Campaigne et al. [J. Heterocycl. Chem. 1975, 12, 391]) у розчині в дихлорметані. Після перемішування протягом 24 годин при температурі навколишнього середовища, реакційну суміш промивають і потім сушать і випаровують, для одержання очікуваного продукту у формі в'язкої олії. Стадія В: Бензил N-трет-бутоксикарбоніл-5гідроксипролінат В атмосфері аргону і при -78°C додають 18ммол 1M розчину гідриду діізобутилалюмінію в гексані до 10ммол сполуки, одержаної на попередній Стадії у розчині в тетрагідрофурані. Після перемішування протягом 20 хвилин при -78°С додають насичений водний розчин хлориду амонію, з наступним водним 10% розчином карбона 83638 14 ту натрію. Після перемішування протягом ночі при температурі навколишнього середовища, реакційну суміш фільтрують і фільтрат випаровують і виливають в дихлорметан. Органічну фазу промивають, суша ть і потім випаровують. Залишок очищують хроматографією на силікагелі, використовуючи суміш 95/5 дихлорметан/етилацетат як елюент. Очікуваний продукт одержують у формі жовтої олії. Стадія С: Бензил N-трет-бутоксикарбоніл-5метоксипролінат 0,1% розчин пара-толуолсульфонової кислоти в безводному метанолі (88мл) додають до 10ммол сполуки, одержаної на попередній Стадії. Після перемішування протягом ½ години, додають водний 10% розчин карбонату натрію і продукт екстрагують дихлорметаном. Очікуваний продукт одержують у формі злегка жовтої олії. Стадія D: Бензил 5-ціанопролінату гідрохлорид При -40°C і в атмосфері аргону додають 5% об./об. розчин тетрагідрохлориду олова в безводному дихлорметані (7,1мл) і потім триметилсиліл ціанід (20,6 ммол) до 10ммол сполуки, одержаної на попередній Стадії. Після перемішування протягом 2 годин при -40°C, додають водний 10% розчин карбонату натрію, водну фазу екстрагують дихлорметаном і органічну фаз у промивають, суша ть і потім випаровують. Одержаний залишок очищують хроматографією на силікагелі, використовуючи суміш 95/5 дихлорметан/етилацетат як елюент. Одержану жовту олію розчиняють в етилацетаті і потім пропускають потік газу HCl протягом 30 хвилин при 0°C. Після перемішування протягом ночі при температурі навколишнього середовища, утворений осад відфільтровують, промивають етилацетатом і сушать у вакуумі, використовуючи ексикатор. Стадія E: Бензил 1-хлор-3,4-діоксо2,3,4,6,7,8-гексагідропіроло[1,2-а]піразин-6карбоксилат При 0°C додають оксаліл хлорид (144мл) до 200г сполуки, одержаної на попередній Стадії у розчині в толуолі. Суміш потім доводять до температури навколишнього середовища і перемішують протягом 15 годин, і потім випаровують розчинник. Одержаний залишок очищують хроматографією на силікагелі, використовуючи суміш 9/1 дихлорметан/метанол як елюент, для одержання очікуваного продукту. Стадія F: 3,4-Діоксо-2,3,4,6,7,8гексагідрошроло[1,2-а]піразин-6-карбонова кислота 3г сполуки, одержаної на попередній Стадії, розчиняють у 50мл етанолу і потім додають 1,43мл триетиламіну, з наступним додаванням 0,5г паладію-на-вуглеці. Суміш потім вміщують в атмосферу водню при температурі навколишнього середовища і атмосферному тиску протягом 5 годин. Після видалення каталізатора фільтруванням, розчинник випаровують, для одержання очікуваного продукту. Стадія G: Етил 3,4-діоксо-2,3,4,6,7,8гексагідропіроло[1,2-а]піразин-6-карбоксилат 15 11,83мл триметилсиліл хлориду додають краплями, при 0°C, до суспензії 1,83г сполуки, одержаної на попередній Стадії, в 20мл безводного етанолу. Реакційну суміш потім перемішують при температурі навколишнього середовища протягом 15 годин. Розчинник випаровують і залишок додають в дихлорметан. Органічну фазу промивають, сушать, фільтрують і випаровують, і потім сирий продукт очищають хроматографією на силікагелі (елюент: дихлорметан/етанол 95/5), для одержання очікуваного продукту. Стадія H: Етил 3-бром-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксилат Додають 34,7г двохосновного фосфату натрію (Na2HPO4) в 90мл дихлоретану і потім 100г оксиброміду фосфор у (POBr 3) в 340мл дихлоретану до 73г сполуки, одержаної на попередній Стадії, суспендованої в 400мл дихлоретану. Реакційну суміш потім нагрівають при 50°C протягом 16 годин, пізніше охолоджують до 0°C, використовуючи ванну з води і льоду, і додають 650мл 10% розчину карбонату натрію. Органічну фазу промивають водою, потім водні фази об'єднують і екстрагують ізопропіл ацетатом. Об'єднані органічні фази концентрують до 160мл, і потім додають 160мл ізопропіл ацетату і суміш знову концентрують до 160мл. Пізніше суміш розміщують у ванні при 50°C і додають 250мл н-гептану протягом 1 години. Після наступної години при 50°C, одержаний осад одержаний відфільтровують, промивають 1/3 сумішшю ізопропіл ацетату і нгептану, і висушують для одержання очікуваного продукту. Стадія І: Етил 4-оксо-3-(2-піридилтіо)-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксилат 34,3г 2-меркаптопіридину додають трьома порціями, з 20 хвилинними інтервалами, до 80,5г сполуки, одержаної на попередній Стадії, у розчині в 410мл ацетонітрилу. Додавання є екзотермічним і температура реакційної суміші підвищується до 35°С. Суміш стає гомогенною. Після перемішування протягом 1 години 45 хвилин розчинник випаровують і залишок додають в етилацетат і у воду. Органічну фазу промивають, сушать, фільтрують і випаровують досуха. Одержаний залишок очищують колонковою хроматографією (дихлорметан/етанол 98/2 потім 95/5), для одержання очікуваного продукту у формі оранжевої олії, яка повільно кристалізується. Стадія J: Етил 3- {[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксилат 2,78г 2,2-дифтор-2-(1-оксидо-2піридил)етанаміну і потім 1,5г хлориду цинку додають до 4,6г сполуки, одержаної на попередній Стадії, суспендованої в 30мл ацетонітрилу. С уміш потім нагрівають зі зворотним холодильником протягом 15 годин. Реакційна суміш стає прозорою. Розчинник потім випаровують і залишок додають до дихлорметану. Органічну фазу промивають, сушать, фільтрують і випаровують, і одержаний залишок очищують хроматографією на силікагелі (елюент: дихлорметан/ізопропанол 9/1) для одержання очікуваного продукту. 83638 16 Стадія K: 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]кислота-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбонова кислота 2 еквіваленти IN розчину гідроксиду натрію додають до 9г сполуки, одержаної на попередній Стадії, у розчині в 100мл діоксану і 20мл води. Після витримування протягом 24 годин при температурі навколишнього середовища, проводять ацилювання з використанням 2 еквівалентів 1N хлористоводневої кислоти, і потім реакційну суміш випаровують. Залишок додають двічі в 30мл толуолу і суша ть, одержуючи очікуваний продукт у формі білої твердої речовини. Стадія L: 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід 3г сполуки, одержаної на попередній Стадії, піддають реакції з 1,18г 2-фторбензиламіну у присутності 3,57г 1-[біс(диметиламіно)метилен]1H-1,2,3-триазоло[4,5-b]піридиній 3-оксид гексафтор фосфату (H ATU) і 1,64мл діізопропілетиламіну в 60мл диметилформаміду. Після перемішування протягом 15 годин при температурі навколишнього середовища, розчинник випаровують і одержаний залишок додають в етилацетат і у воду. Органічну фазу промивають, сушать і потім випаровують, і залишок очищують хроматографією на силікагелі, для одержання очікуваного продукту у формі рацемічної суміші. Елементарний мікроаналіз: Підраховано: Знайдено: %С 57,52 57,63 %Н 4,39 4,18 %N 15,24 15,05 Приклад 2: (6R)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Рацемічну суміш Прикладу 1 відокремлюють препаративною хроматографією хіральної фази ВЕРХ (колонка Chiralpak AD, елюент: ацетонітрил/ізопропанол/діетил амін 500/500/1). Очікуваний продукт являє собою перший з енантіомерів, одержаних таким чином. Приклад 3: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Рацемічну суміш Прикладу 1 відокремлюють препаративною хроматографією хіральної фази ВЕРХ (колонка Chiralpak AD, елюент: ацетонітрил/ізопропанол/діетиламін 500/500/1). Очікуваний продукт являє собою перший з енантіомерів, одержаних таким чином. Індекс обертання: αD=-116,07° (метанол, 20°C, с=1,4) Приклад 4: (6R)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-{2-[2-(етиламіно)-2оксоетокси]бензил}-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід 17 83638 Очікуваний продукт одержують відповідно до процедури, описаної у Прикладі 1, заміщуючи 2фторбензиламін на 2-[2-(амінометил)фенокси]-Nетилацетамід на Стадії L, з наступним відокремленням рацемічної суміші, одержаної таким чином, препаративною хіральною хроматографією ВЕРХ (колонка Chiralpak AD, елюент: ацетонітрил/ізопропанол/діетиламін 500/500/1). Очікуваний продукт являє собою перший з енантіомерів, одержаних таким чином. Елементарний мікроаналіз: Підраховано: Знайдено: %С 57,56 58,11 %Н 5,20 5,15 %N 15,49 15,55 Індекс обертання: αD=+ 93,1° (метанол, 200C, с=0,7) Приклад 5: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-І2-{2-(етиламіно)-2окоетокси]бензил}-4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6-карбоксамід Очікуваний продукт являє собою другий з енантіомерів, відокремлених у Прикладі 4. Індекс обертання: αD=- 98,8° (метанол, 20°C, с=0,8) Приклад 6: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,4-дифтобензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2,4-дифторбензиламін на Стадії L. Мас-спектрометрія ESI (ацетонітрил/вода): [М+Н]+=478,15. Приклад 7: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,6-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламін на 2,6-дифторбензиламін на Стадії L. Точка плавлення: 227 - 228°С Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,35 55,04 %Н 4,01 4,04 %N 14,67 14,28 Приклад 8: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2-хлорбензил)-4-оксо4,6,7,8-тетрагідропіроло [1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2-хлорбензиламін на Стадії L. Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,53 55,32 %Н 4,24 4,33 %N 14,72 14,33 %Сl 7,45 7,73 18 Приклад 9: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(3,4-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 3,4-дифторбензиламін на Стадії L. Точка плавлення: 204°C Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,35 55,07 %Н 4,01 3,92 %N 14,67 14,40 Приклад 10: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,5-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензилаіну на 2,5-дифторбензиламін на Стадії L. Точка плавлення: 189°C Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,35 55,95 %Н 4,01 4,41 %N 14,67 14,13 Приклад 11: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,6-дихлорбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2,6-дихлорбензиламін на Стадії L. Точка плавлення: 122°C Елементарний мікроаналіз: Підраховано: Знайдено: %С 51,78 52,23 %Н 3,75 3,73 %N 13,72 13,66 %Сl 13,89 14,06 Приклад 12: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно)-N-(2-хлор-6-фторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2-хлор-6-фторбензиламін на Стадії L. Точка плавлення: 221°C Елементарний мікроаналіз: %С %Н %N %Сl Підраховано: 53,50 3,88 14,18 7,18 Знайдено: 53,93 3,97 14,06 7,28 Приклад 13: 3-{[2,2-Дифтор-2-(1-оксидо2ниридил)етил]аміно}-N-(2,3-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2 19 83638 фторбензиламіну на 2,3-дифторбензиламін на Стадії L. Точка плавлення: 142°C Елементарний мікроаналіз: Підраховано: Знайдено: %С 53,35 55,34 %Н 4,01 4,26 %N 14,67 14,42 Приклад 14: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(3,5-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 3,5-дифторбензиламін на Стадії L. Точка плавлення: 218 - 219°С Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,35 54,72 %Н 4,01 3,82 %N 14,67 14,40 Приклад 15: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-N-[2-(2-oкco-2-{[2-(2пipидил)eтил]aмiнo}eтoкcи)бeнзил]-4,6,7,8тeтpaгiдропіроло[1,2-а]піразин-6карбоксамідгідрохлорид Стадія А: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-N-[2-(2-оксо-2-{[2-(2піридил)етил]аміно}етокси)бензил]-4,6,7,8тетрагідропіроло[1,2-а]-піразин-6-карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2-[2-(амінометил)фенокси]N-[2-(2-піридил)етил]ацетамід на Стадії L. Стадія В: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-N-[2-(2-оксо-2-{[2-(2піридил)етил]аміно}етокси)бензил]-4,6,7,8тетрагідропіроло[1,2-а]піразин-6карбоксамідгідрохлорид Очікуваний продукт одержують ацилюванням сполуки, одержаної на попередній Стадії, використовуючи хлористоводневу кислоту. Елементарний мікроаналіз: Підраховано: Знайдено: %С 56,75 57,22 %Н 4,92 4,85 %N 14,94 14,87 %Сl 5,40 5,82 Приклад 16: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2,6-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші Прикладу 7 на хіральній колонці ВЕРХ. Індекс обертання: αD=-118,46° (метанол, 20°C, с=0,95) Приклад 17: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2,5-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід 20 Очікуваний продукт одержують відокремленням рацемічної суміші Прикладу 10 на хіральній колонці ВЕРХ. Індекс обертання: αD=- 89,65° (метанол, 20°C, с=0,57) Приклад 18: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2-хлор-6-фторбензил)4-оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші Прикладу 12 на хіральній колонці ВЕРХ. Індекс обертання: αD=-101,49° (метанол, 20°C, с=1,3) Приклад 19: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно)-N-(2,3-дифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші Прикладу 13 на хіральній колонці ВЕРХ. Індекс обертання: αD=-102,06° (метанол, 20°C, с=0,8) Приклад 20: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2-хлорбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші Прикладу 8 на хіральній колонці ВЕРХ. Індекс обертання: αD=-105,65° (метанол, 20°C, с=0,85) Приклад 21: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2,3,6-трифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Стадія А: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,3,6-трифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 2,3,6-трифторбензиламін на Стадії L. Стадія В: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-(2,3,6-трифторбензил)-4оксо-4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші, одержаної на попередній Стадії, на хіральній колонці ВЕРХ. Індекс обертання: αD=-118,25° (метанол, 20°C, с=1) Приклад 22: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-бензил-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксаміду гідрохлорид Стадія А: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-бензил-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на бензиламін на Стадії L. 21 83638 Стадія В: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-бензил-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші, одержаної на попередній Стадії, на хіральній колонці ВЕРХ. Стадія C: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-N-бензил-4-оксо-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід гідрохлорид Очікуваний продукт одержують ацилюванням сполуки, одержаної на попередній Стадії, використовуючи хлористоводневу кислоту. Елементарний мікроаналіз: Підраховано: Знайдено: %С 55,29 54,84 %Н 4,64 4,81 %N 14,65 14,16 %Сl 7,42 7,16 Приклад 23: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(3-тієнілметил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксаміду гідрохлорид Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 22, із заміною бензил аміну на 3-тієнілметиламін на Стадії А. Елементарний мікроаналіз: Підраховано: Знайдено: %С 49,64 49,09 %Н 4,17 4,17 %N 14,47 14,14 %Сl 7,33 8,16 %S 6,63 6,59 Приклад 24: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-N-(2-тієнілметил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксаміду гідрохлорид Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 22, із заміною бензиламіну на 2-тієнілметиламін на Стадії А. Елементарний мікроаналіз: Підраховано: Знайдено: %С 49,64 50,61 %Н 4,17 4,12 %N 14,47 14,35 %Сl 7,33 7,98 %S 6,63 6,65 Приклад 25: (6S)-3-{[(2,2-Дифтор-2-(1-оксидо4-піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Стадія A: 3-{[2,2-Дифтор-2-(1-оксидо-4піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2,2дифтор-2-(1-оксидо-2-піридил)етанаміну на 2,2дифтор-2-(1-оксидо-4-піридил)етанамін на Стадії J. Стадія В: (6S)-3-{[2,2-Дифтор-2-(1-оксидо-4піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші, одержаної на у вищезазначеній Стадії, на хіральній колонці ВЕРХ. 22 Елементарний мікроаналіз: Підраховано: Знайдено: %С 57,52 57,73 %Н 4,39 4,61 %N 15,24 15,05 Приклад 26: (6S)-3-{[2,2-Дифтор-2-(1-оксидо3-піридил)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло [1,2-а] піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики Прикладу 25, із заміною 2,2-дифтор-2(1-оксидо-4-піридил)етанаміну на 2,2-дифтор-2(1-оксидо-3-піридил)етанамін на Стадії А. Елементарний мікроаналіз: Підраховано: Знайдено: %С 57,52 57,34 %Н 4,39 4,49 %N 15,24 14,99 Приклад 27: 3-{[2,2-Дифтор-2-(1-оксидо-2піридил)етил]аміно}-8,8-диметил-N-(2фторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2а]піразин-6-карбоксамід Очікуваний продукт одержують відповідно до методики Прикладу 1, із заміною бензил 5оксопролінату на бензил 4,4-диметил-5-оксо-2піролідин-карбоксилат на Стадії А. Приклад 28; (6R)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-8,8-диметил-N-(2фторбензил)-4-оксо-4,6,7,8-тетрагідропіроло[1,2а]піразин-6-карбоксамід Рацемічну суміш Прикладу 27 відокремлюють препаративною хроматографією хіральної фази ВЕРХ. Очікуваний продукт являє собою перший з енантіомерів, одержаних таким чином. Елементарний мікроаналіз: Підраховано: Знайдено: %С 59,13 58,88 %Н 4,96 4,99 %N 14,37 14,08 Приклад 29: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-8,8-диметил-N-(2фторбензил)-4-оксо-4,6,7,8-тетрагідроруггоІо[1,2а]піразин-6-карбоксамід Рацемічну суміш Прикладу 27 відокремлюють препаративною хроматографією хіральної фази ВЕРХ. Очікуваний продукт являє собою другий з енантіомерів, одержаних таким чином. Елементарний мікроаналіз: Підраховано: Знайдено: %С 59,13 58,92 %Н 4,96 4,93 %N 14,37 14,14 Приклад 30: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-піридил)етил]аміно}-4-оксо-N[(5-оксо-4,5дигідро-1Н-1,2,4-триазол-3-іл)метил]-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід Стадія А: 3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-N-[(5-оксо-4,5-дигідро 23 83638 1Н-1,2,4-триазол-3-іл)метил]-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2фторбензиламіну на 5-(амінометил)-2,4-дигідро3Н-1,2,4-триазол-3-он на Стадії L. Стадія В: (6S)-3-{[2,2-дифтор-2-(1-оксидо-2піридил)етил]аміно}-4-оксо-N-[(5-оксо-4,5-дигідро1H-1,2,4-триазол-3-іл)метил]-4,6,7,8тетрагідропіроло[1,2-а]піразин-6-карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші, одержаної на попередній Стадії, на хіральній колонці ВЕРХ. Елементарний мікроаналіз: Підраховано: Знайдено: %С 48,22 48,61 %Н 4,05 4,34 %N 24,99 24,56 Приклад 31: (6S)-3-{[2,2-Дифтор-2-(1-оксидо2-хінолініл)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Стадія А: 3-{[2,2-дифтор-2-(1-оксидо-2хінолініл)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відповідно до методики, описаної у Прикладі 1, із заміною 2,2дифтор-2-(1-оксидо-2-піридил)етанаміну на 2,2дифтор-2-(1-оксидо-2-хінолініл)етанамін на Стадії J. Стадія В: (6S)-3-{[2,2-дифтор-2-(1-оксидо-2хінолініл)етил]аміно}-N-(2-фторбензил)-4-оксо4,6,7,8-тетрагідропіроло[1,2-а]піразин-6карбоксамід Очікуваний продукт одержують відокремленням рацемічної суміші, одержаної на попередній Стадії, на хіральній колонці ВЕРХ. Елементарний мікроаналіз: Підраховано: Знайдено: %С 61,29 61,65 %Н 4,35 4,51 %N 13,75 13,50 Фармакологічні дослідження сполук за даним винаходом Комп’ютерна в ерстка Т. Чепелев а 24 Приклад 32: Інгібування тромбіну і серинових протеаз фібринолізу Для in vitro визначення активності інгібування продуктів за даним винаходом на людському тромбіні (Sigma, специфічна активність 3230 UNIH/мг), очищений людський фібриноген (4мМ, Stago) (Fg) додавали до визначеної кількості тромбіну (0,7нМ), що заздалегідь був інкубований з або без інгібітора, який повинен бути випробуваним (20°C, 10 хвилин). Інгібітори, ензими і субстрати розбавляли в тому ж буфері (0,01мМ фосфатний буфер, рН7,4, що містить 0,12M хлорид натрію і 0,05% альбумін бичачої сироватки) і потім розміщували на полістироловому мікротитраційному планшеті в об'ємі 50мкл. Фібрин, утворений тромбіном, вимірювали, використовуючи спектрофотометр при 405нм після 10 - 15 хвилинної реакції при 20°C. Наведена нижче таблиця представляє в нМ концентрацію сполук, яка інгібує 50% ензиматичної активності (ІС50) тромбіну, у порівнянні з контролем без продукту. Одержані результати показують, що сполуки винаходу є сильними інгібіторами активності людського тромбіну на людському фібриногені. Таблиця Приклад 1 3 8 15 21 24 31 IC50 (н М) 28 16 38 1,4 11 60 8,4 Приклад 33: Фармацевтична композиція Склад для одержання 1000 таблеток, кожна з яких містить дозу 10мг: Сполука Прикладу 3 10г гідроксипропiл целюлоза 2г пшеничний крохмаль 10г лактоза 100г стеарат магнію 3г тальк 3g. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-oxo-4,6,7,8-tetrahydro-pyrrolo[1,2-a]pyrazine-6-carboxamide compounds, process for the preparation thereof and pharmaceutical composition containing thereof
Автори англійськоюDe Nanteuil Guillaume, Gloanec Philippe, Parmentier Jean-Gilles, Benoist Alain, Rupin Alain, Vallez Marie-Odile, Verbeuren Tony
Назва патенту російськоюСоединения 4-оксо-4,6,7,8-тетрагидропирроло[1,2-a]пиразин-6-карбоксамида, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюГлоанек Филип, Пармантье Жан-Жиль, Бенуат Ален, Рюпен Ален, Валле Мари-Одиль, Верберен Тоне
МПК / Мітки
МПК: A61K 31/519, A61P 7/02, C07D 487/04, C12N 9/74, A61P 43/00, A61P 9/02, C12Q 1/56, A61P 9/00
Мітки: яка, 4-оксо-4,6,7,8-тетрагідропіроло[1,2-a]піразин-6-карбоксаміду, містить, фармацевтична, спосіб, сполуки, композиція, одержання
Код посилання
<a href="https://ua.patents.su/12-83638-spoluki-4-okso-4678-tetragidropirolo12-apirazin-6-karboksamidu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Сполуки 4-оксо-4,6,7,8-тетрагідропіроло[1,2-a]піразин-6-карбоксаміду, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Регулятор тиску газу
Наступний патент: Електропривід
Випадковий патент: Генератор випадкових чисел












