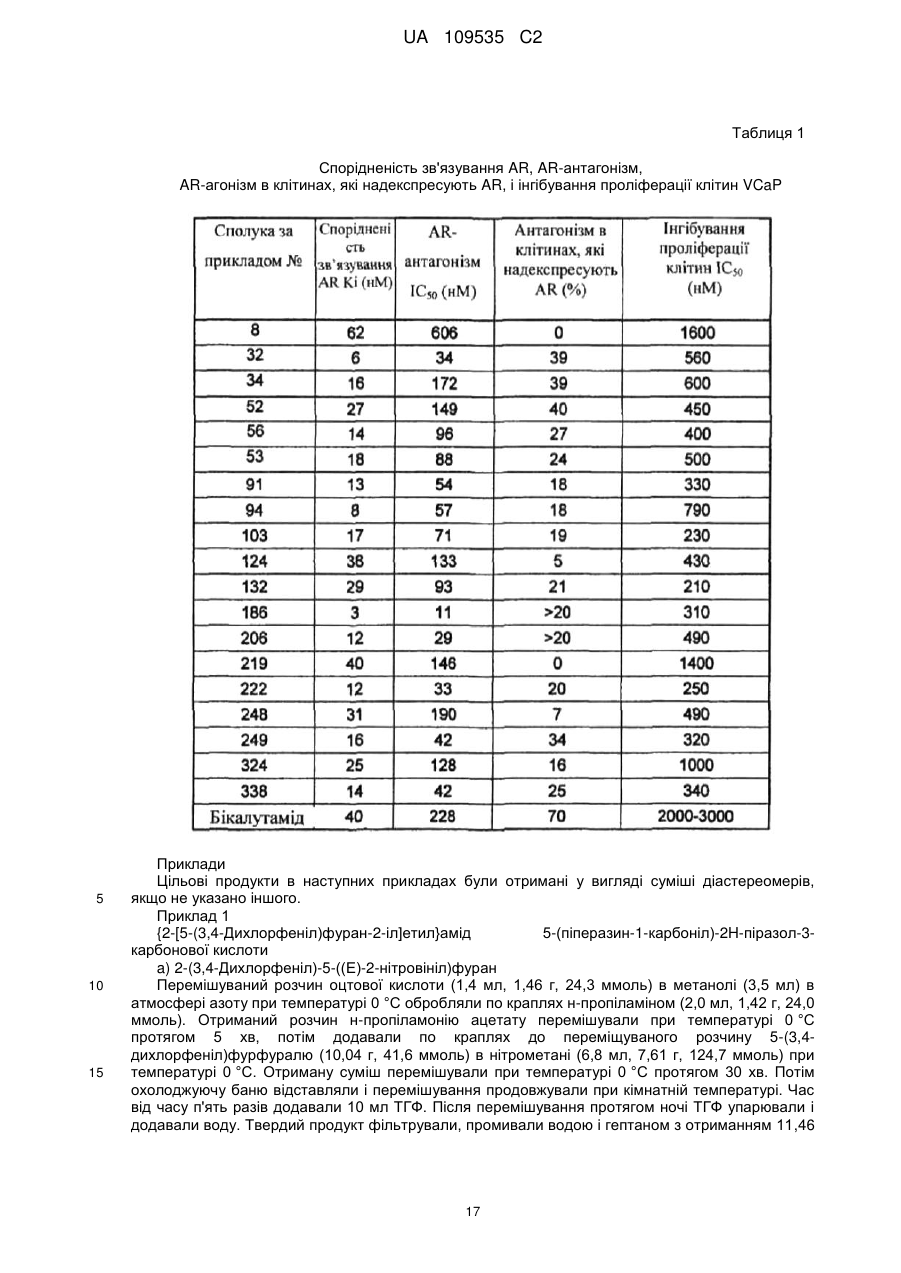
Гетероциклічні карбоксаміди, які модулюють андрогенові рецептори, фармацевтична композиція на їх основі та спосіб лікування захворювань
Номер патенту: 109535
Опубліковано: 10.09.2015
Автори: Кар'ялайнен Ар'я, Хеглунд Ііса, Вольфарт Герд, Раску Сірпа, Хольм Патрік, Кнууттіла Піа, Сало Харрі, Весалайнен Аннііна, Термякангас Оллі
Формула / Реферат
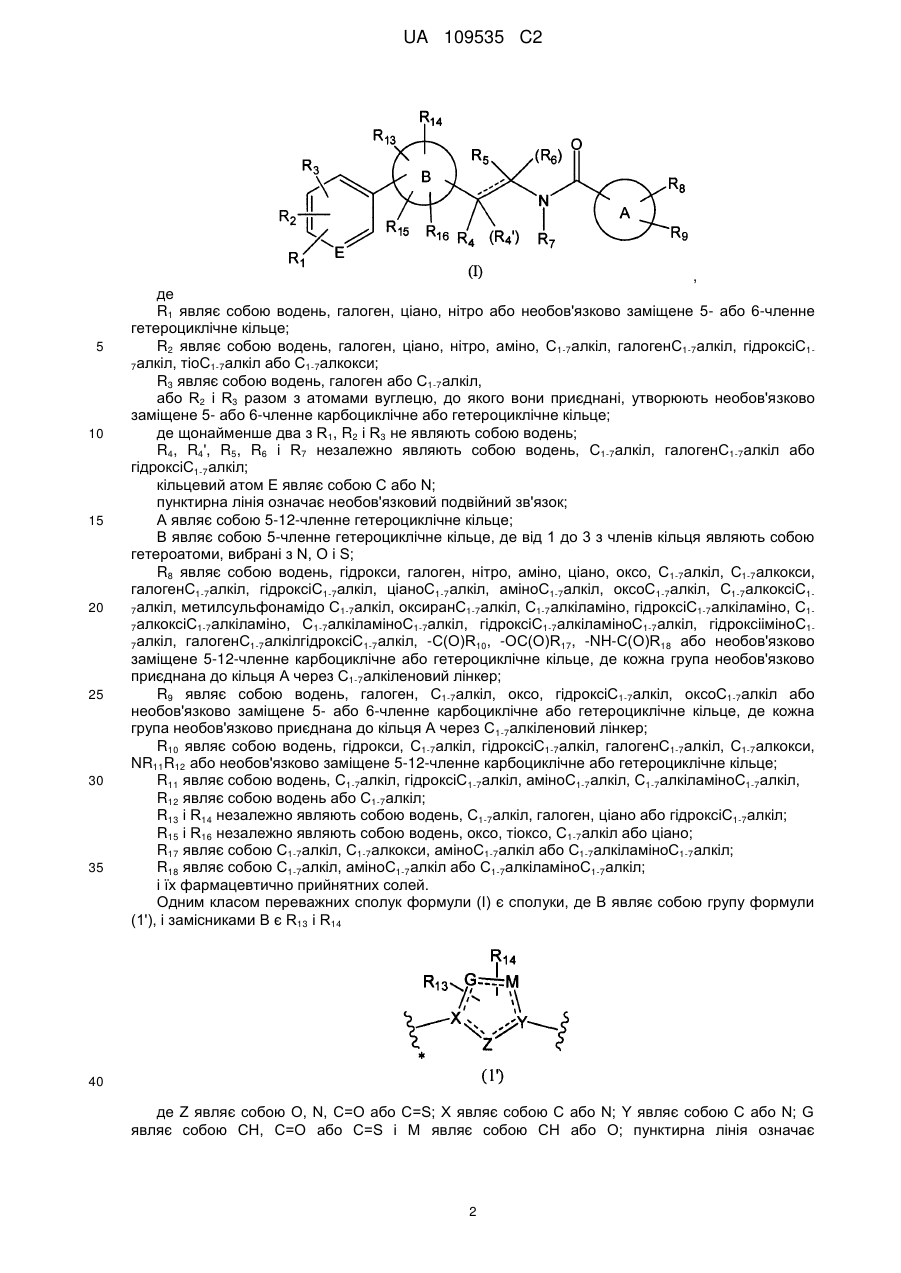
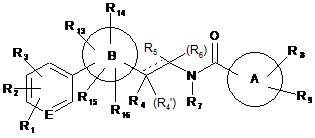
1. Сполука формули (І)
 , (I)
, (I)
де
R1 являє собою водень, галоген, ціано, нітро або 5- або 6-членне гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
R2 являє собою водень, галоген, ціано, нітро, аміно, С1-7алкіл, галогенС1-7алкіл, гідроксіС1-7алкіл, тіоС1-7алкіл або С1-7алкокси;
R3 являє собою водень, галоген або С1-7алкіл,
або R2 і R3 разом з атомами вуглецю, до яких вони приєднані, утворюють 5- або 6-членне карбоциклічне або гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
де щонайменше два з R1, R2 і R3 не являють собою водень;
R4, R4', R5, R6 і R7 незалежно являють собою водень, С1-7алкіл, галогенС1-7алкіл або гідроксіС1-7алкіл;
кільцевий атом Е являє собою С або N;
пунктирна лінія означає необов'язковий подвійний зв'язок;
А являє собою 5-12-членне гетероциклічне кільце, яке має 1-4 гетероатоми, вибрані з N, О і S;
В являє собою 5-членне гетероциклічне кільце, де від 1 до 3 з членів кільця являють собою гетероатоми, вибрані з N, О і S;
R8 являє собою водень, гідрокси, галоген, нітро, аміно, ціано, оксо, С1-7алкіл, С1-7алкокси, галогенС1-7алкіл, гідроксіС1-7алкіл, ціаноС1-7алкіл, аміноС1-7алкіл, оксоС1-7алкіл, С1-7алкоксіС1-7алкіл, метилсульфонамідоС1-7алкіл, оксиранС1-7алкіл, С1-7алкіламіно, гідроксіС1-7алкіламіно, С1-7алкоксіС1-7алкіламіно, С1-7алкіламіноС1-7алкіл, гідроксіС1-7алкіламіноС1-7алкіл, гідроксііміноС1-7алкіл, галогенС1-7алкілгідроксіС1-7алкіл, -C(O)R10, -OC(O)R17, -NH-C(O)R18 або 5-12-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-4 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу; де кожна група необов'язково приєднана до кільця А через С1-7алкіленовий лінкер;
R9 являє собою водень, галоген, С1-7алкіл, оксо, гідроксіС1-7алкіл, оксоС1-7алкіл або 5- або 6-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу, де кожна група необов'язково приєднана до кільця А через С1-7алкіленовий лінкер;
R10 являє собою водень, гідрокси, С1-7алкіл, гідроксіС1-7алкіл, галогенС1-7алкіл, С1-7алкокси, NR11R12 або 5-12-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-4 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
R11 являє собою водень, С1-7алкіл, гідроксіС1-7алкіл, аміноС1-7алкіл, С1-7алкіламіноС1-7алкіл,
R12 являє собою водень або С1-7алкіл;
R13 і R14 незалежно являють собою водень, С1-7алкіл, галоген, ціано або гідроксіС1-7алкіл;
R15 і R16 незалежно являють собою водень, оксо, тіоксо, С1-7алкіл або ціано;
R17 являє собою С1-7алкіл, С1-7алкокси, аміноС1-7алкіл або С1-7алкіламіноС1-7алкіл;
R18 являє собою С1-7алкіл, аміноС1-7алкіл або С1-7алкіламіноС1-7алкіл; і її фармацевтично прийнятні солі.
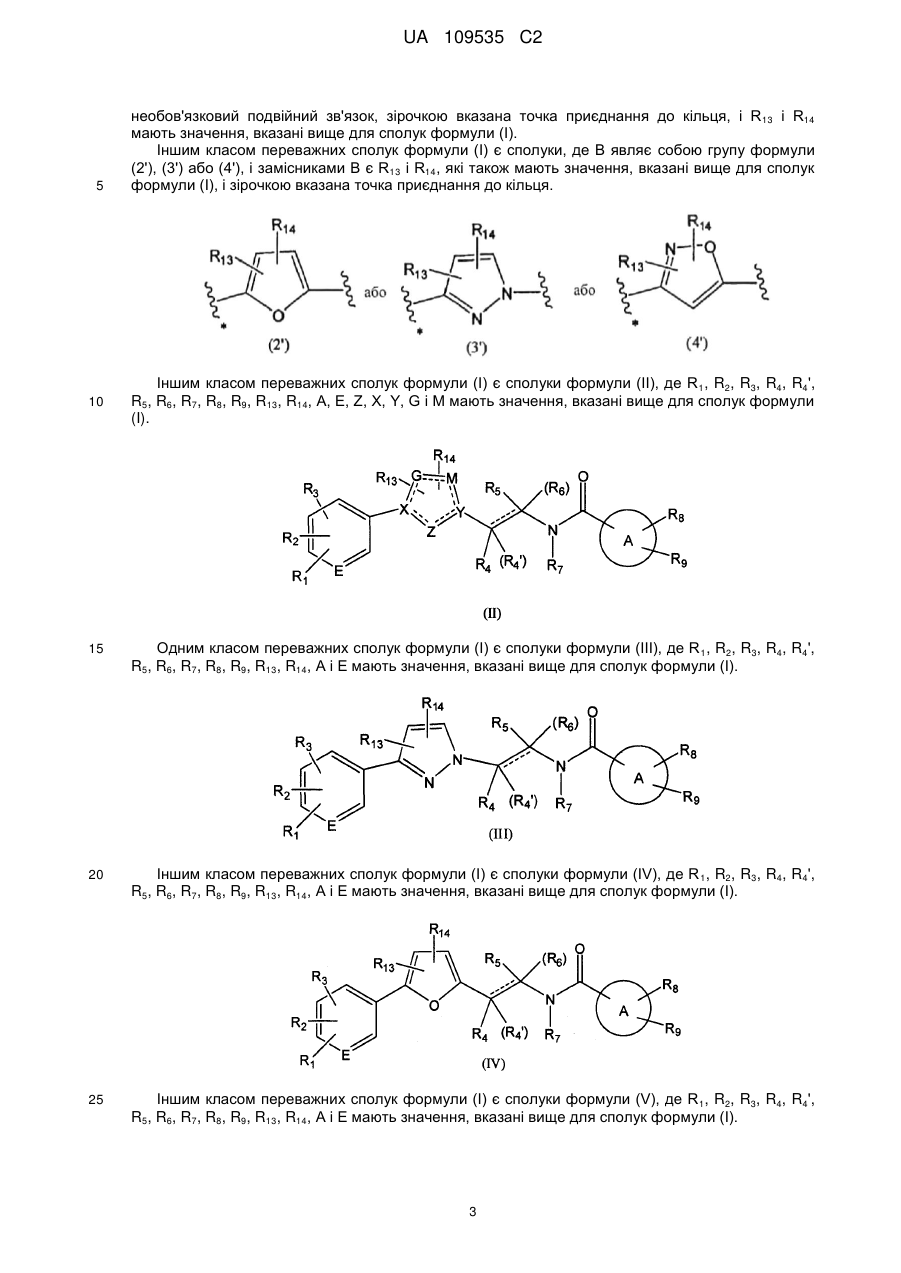
2. Сполука за п. 1, де В являє собою
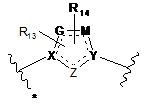 , (1')
, (1')
де Z являє собою О, N, С=О або C=S;
X являє собою С або N;
Y являє собою С або N;
G являє собою СН, С=О або C=S;
М являє собою СН або О;
R13 і R14 незалежно являють собою водень, С1-7алкіл, галоген, ціано або гідроксіС1-7алкіл;
пунктирна лінія означає необов'язковий подвійний зв'язок, і зірочкою вказана точка приєднання до кільця.
3. Сполука за п. 1 або 2, де В являє собою групу формули (2'), (3') або (4')
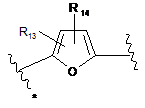 або
або
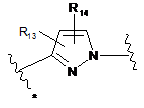 , або
, або
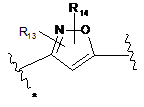 ,
,
(2')
(3')
(4')
де
R13 і R14 незалежно являють собою водень, С1-7алкіл, галоген, ціано або гідроксіС1-7алкіл; і
зірочкою вказана точка приєднання до кільця.
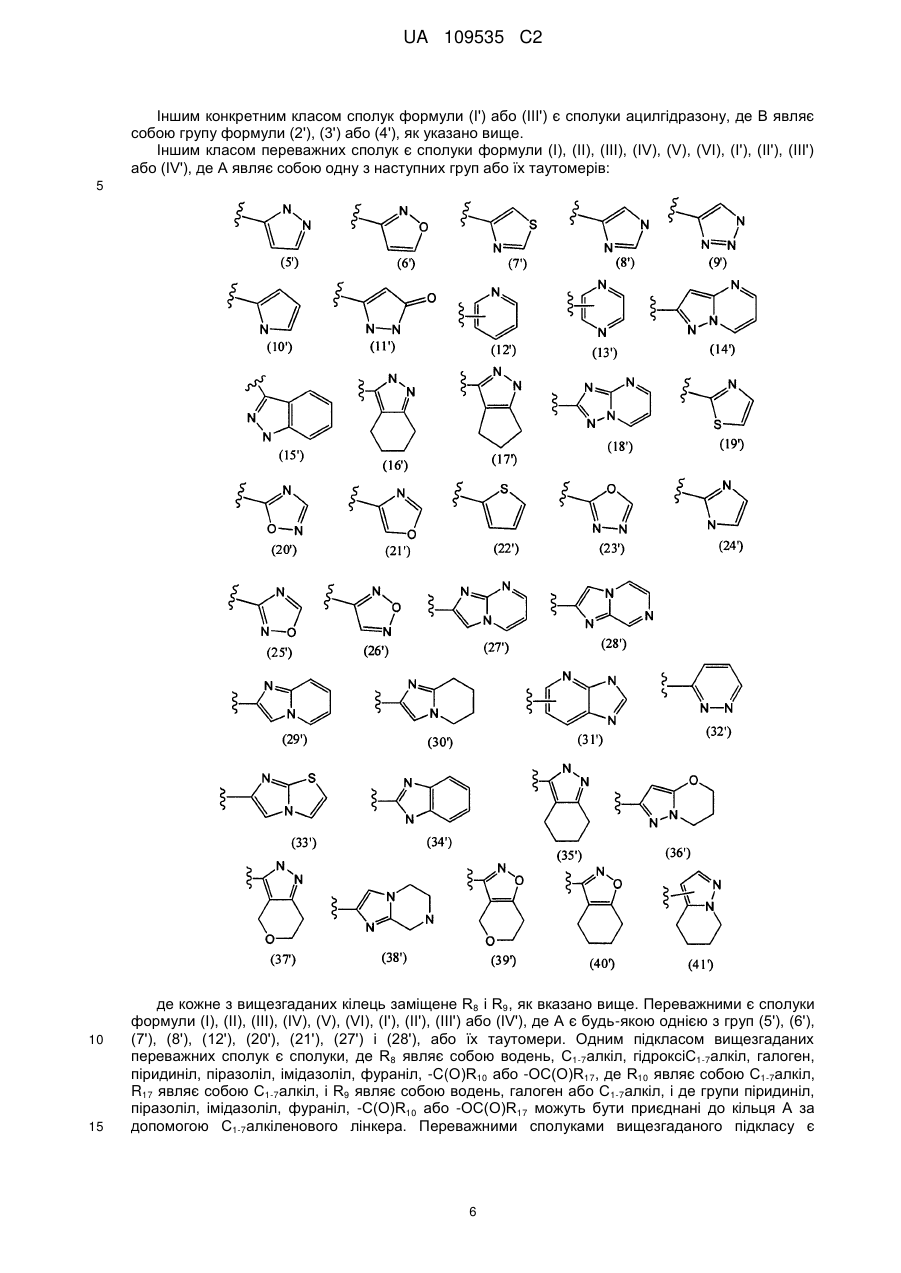
4. Сполука за будь-яким з пп. 1-3, де кільце А являє собою одну з наступних груп або їх таутомерів
 ,
,
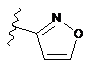 ,
,
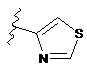 ,
,
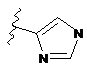 ,
,
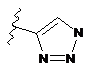 ,
,
(5')
(6')
(7')
(8')
(9')
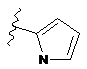 ,
,
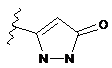 ,
,
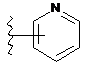 ,
,
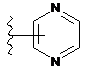 ,
,
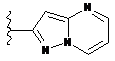 ,
,
(10')
(11')
(12')
(13')
(14')
 ,
,
 ,
,
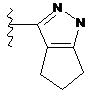 ,
,
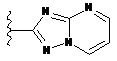 ,
,
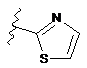 ,
,
(15')
(16')
(17')
(18')
(19')
 ,
,
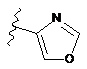 ,
,
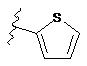 ,
,
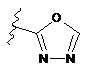 ,
,
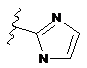 ,
,
(20')
(21')
(22')
(23')
(24')
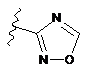 ,
,
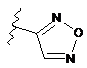 ,
,
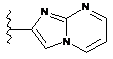 ,
,
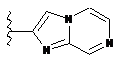 ,
,
(25')
(26')
(27')
(28')
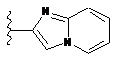 ,
,
 ,
,
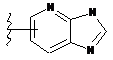 ,
,
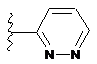 ,
,
(29')
(30')
(31')
(32')
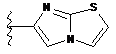 ,
,
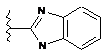 ,
,
 ,
,
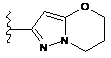 ,
,
(33')
(34')
(35')
(36')
 ,
,
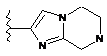 ,
,
 ,
,
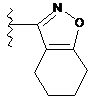 ,
,
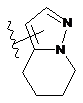 .
.
(37')
(38')
(39')
(40')
(41')
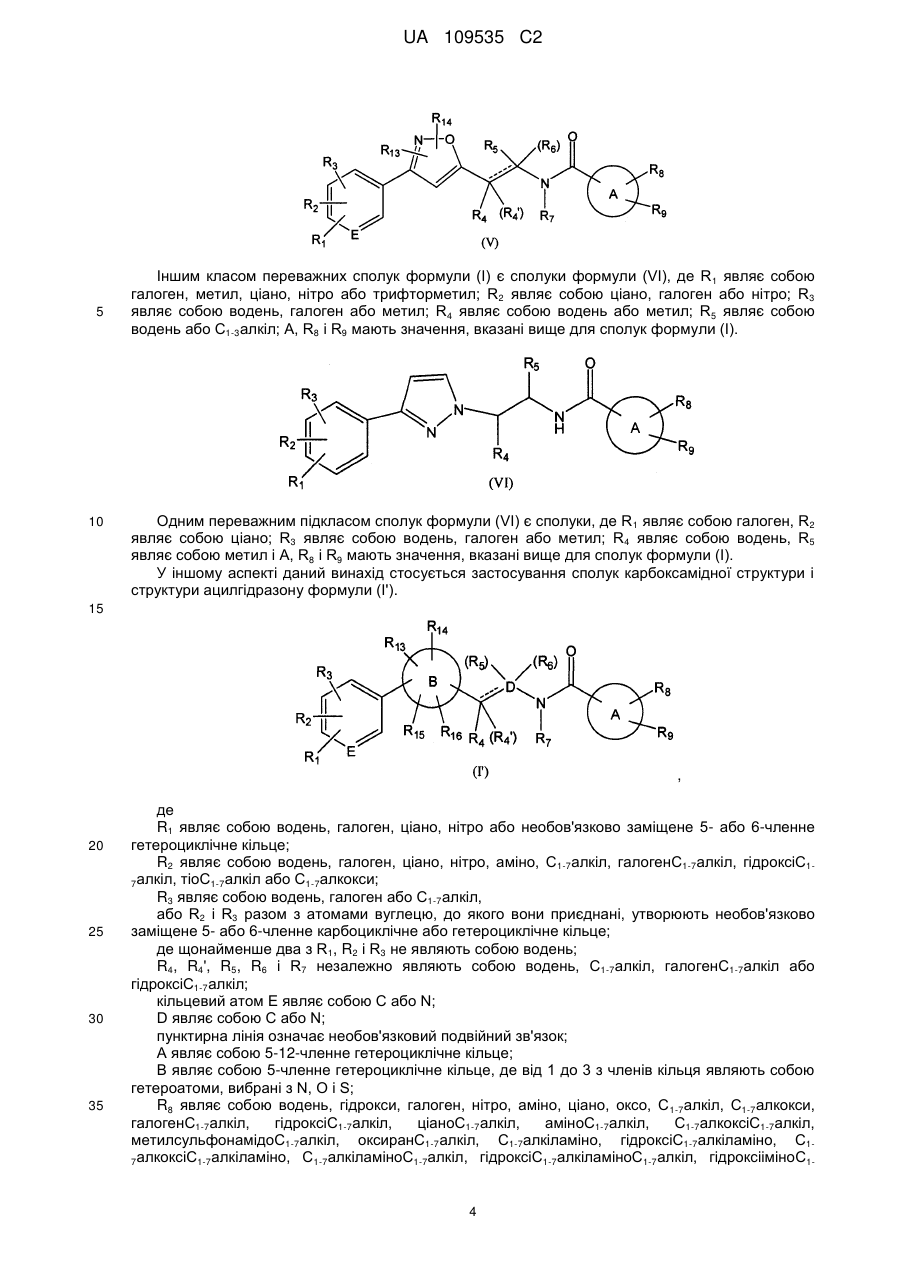
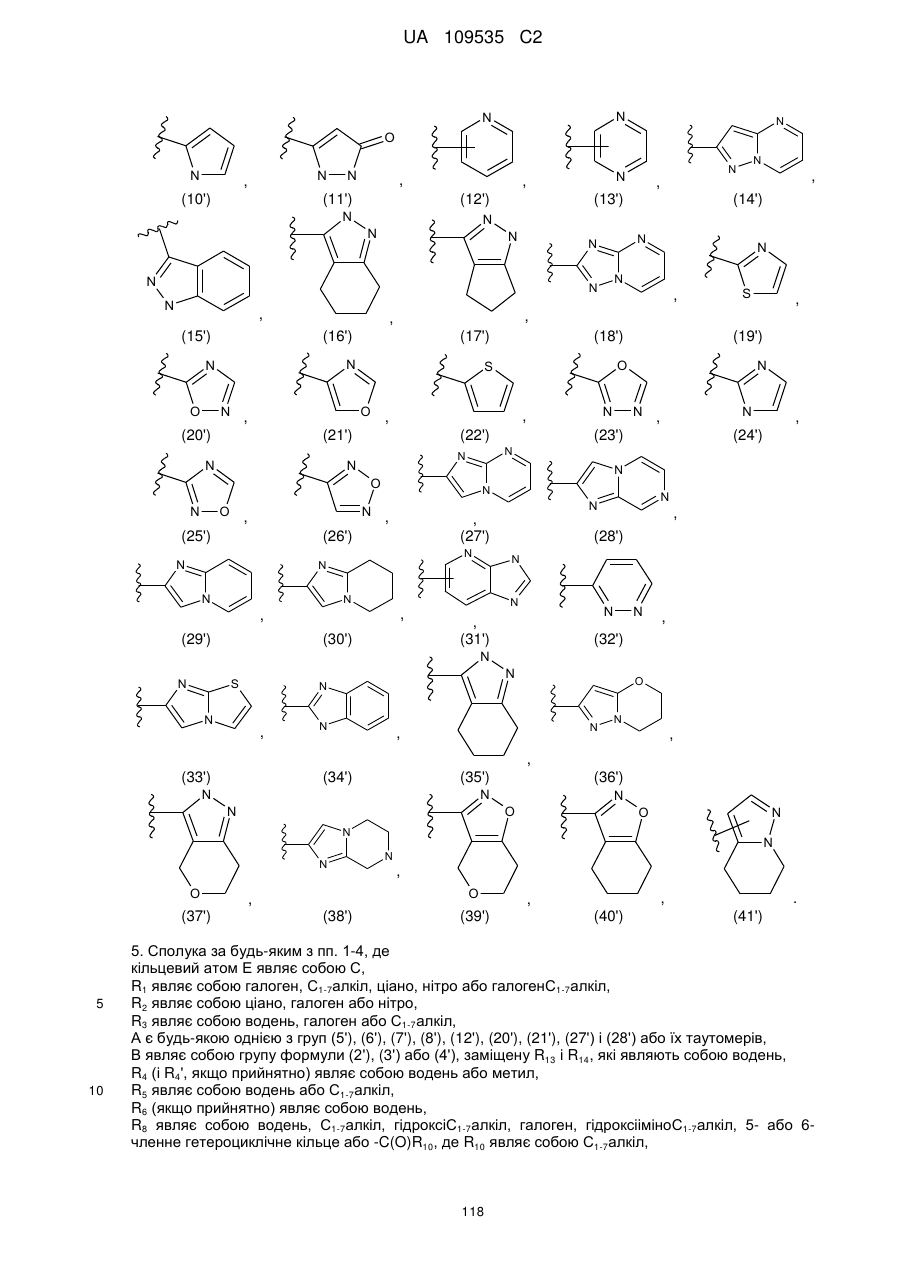
5. Сполука за будь-яким з пп. 1-4, де
кільцевий атом Е являє собою С,
R1 являє собою галоген, С1-7алкіл, ціано, нітро або галогенС1-7алкіл,
R2 являє собою ціано, галоген або нітро,
R3 являє собою водень, галоген або С1-7алкіл,
А є будь-якою однією з груп (5'), (6'), (7'), (8'), (12'), (20'), (21'), (27') і (28') або їх таутомерів,
В являє собою групу формули (2'), (3') або (4'), заміщену R13 і R14, які являють собою водень,
R4 (і R4', якщо прийнятно) являє собою водень або метил,
R5 являє собою водень або С1-7алкіл,
R6 (якщо прийнятно) являє собою водень,
R8 являє собою водень, С1-7алкіл, гідроксіС1-7алкіл, галоген, гідроксііміноС1-7алкіл, 5- або 6-членне гетероциклічне кільце або -C(O)R10, де R10 являє собою С1-7алкіл,
R9 являє собою водень, галоген або С1-7алкіл.
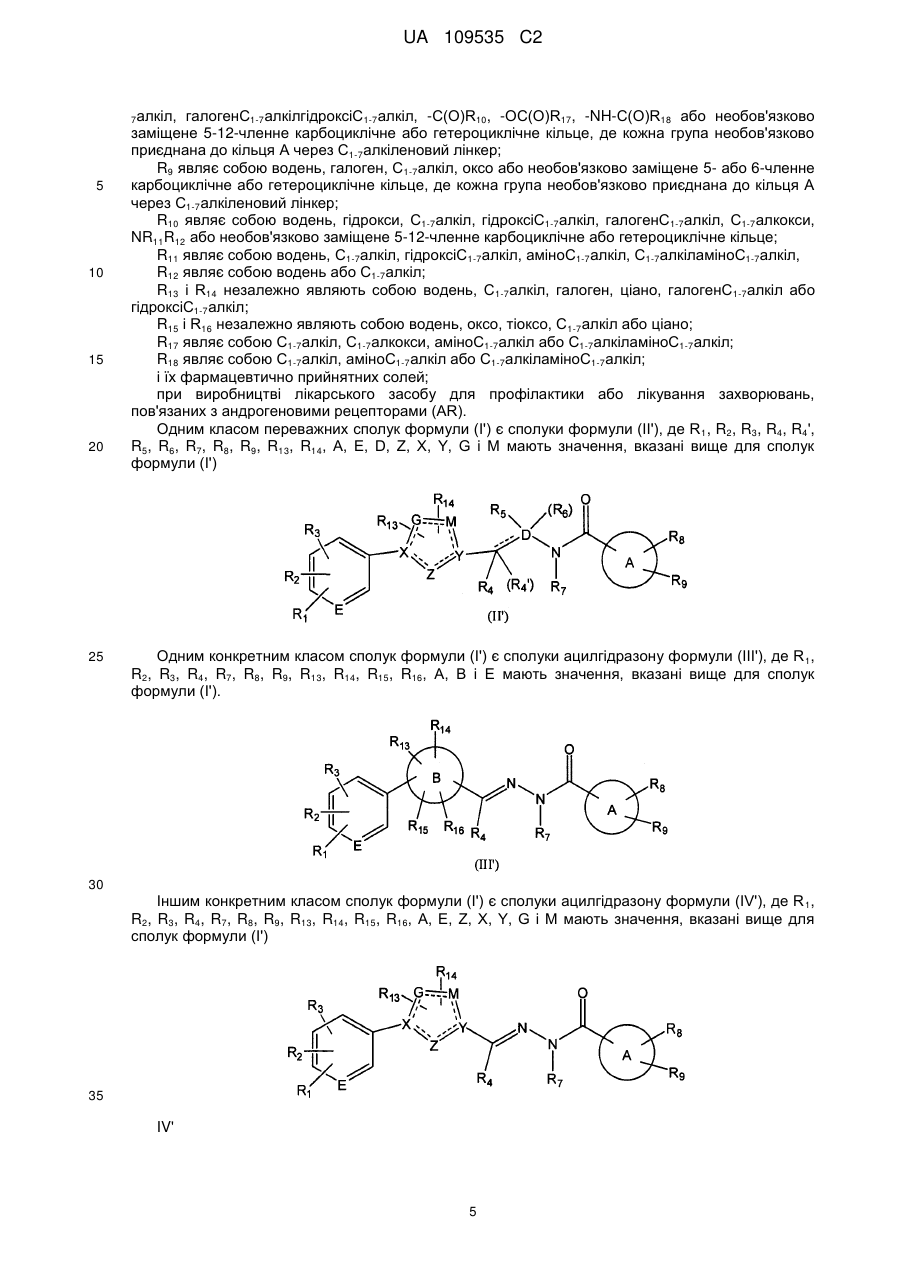
6. Сполука за будь-яким з пп. 1-5, представлена формулою (IV)
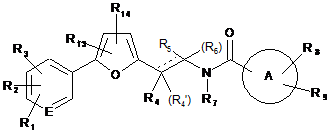 , (IV)
, (IV)
де
R1 являє собою галоген, метил, ціано, нітро або трифторметил,
R2 являє собою ціано, галоген або нітро;
R3 являє собою водень, галоген або метил; і
R4 являє собою водень або метил;
R5 являє собою водень або С1-3алкіл.
7. Сполука за п. 6, де R1 являє собою галоген, R2 являєсобою ціано, R3 являє собою водень, галоген або метил, R4 являє собою водень і R5 являє собою метил.
8. Застосування сполуки формули (I')
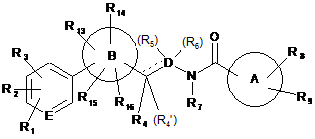 , (I')
, (I')
де
R1 являє собою водень, галоген, ціано, нітро або 5- або 6-членне гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
R2 являє собою водень, галоген, ціано, нітро, аміно, С1-7алкіл, галогенС1-7алкіл, гідроксіС1-7алкіл, тіоС1-7алкіл або С1-7алкокси;
R3 являє собою водень, галоген або С1-7алкіл,
або R2 і R3 разом з атомами вуглецю, до якого вони приєднані, утворюють 5- або 6-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
де щонайменше два з R1, R2 і R3 не являють собою водень;
R4, R4', R5, R6 і R7 незалежно являють собою водень, С1-7алкіл, галогенС1-7алкіл або гідроксіС1-7алкіл;
кільцевий атом Е являє собою С або N;
D являє собою С або N;
пунктирна лінія означає необов'язковий подвійний зв'язок;
А являє собою 5-12-членне гетероциклічне кільце, яке має 1-4 гетероатоми, вибрані з N, О і S;
В являє собою 5-членне гетероциклічне кільце, де від 1 до 3 з членів кільця являють собою гетероатоми, вибрані з N, О і S;
R8 являє собою водень, гідрокси, галоген, нітро, аміно, ціано, оксо, С1-7алкіл, С1-7алкокси, галогенС1-7алкіл, гідроксіС1-7алкіл, ціаноС1-7алкіл, аміноС1-7алкіл, С1-7алкоксіС1-7алкіл, метилсульфонамідоС1-7алкіл, оксиранС1-7алкіл, С1-7алкіламіно, гідроксіС1-7алкіламіно, С1-7алкоксіС1-7алкіламіно, С1-7алкіламіноС1-7алкіл, гідроксіС1-7алкіламіноС1-7алкіл, гідроксііміноС1-7алкіл, галогенС1-7алкілгідроксіС1-7алкіл, -C(O)R10, -OC(O)R17, -NH-C(O)R18 або 5-12-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу; де кожна група необов'язково приєднана до кільця А через С1-7алкіленовий лінкер;
R9 являє собою водень, галоген, С1-7алкіл, оксо або 5- або 6-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-3 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу, де кожна група приєднана до кільця А через С1-7алкіленовий лінкер;
R10 являє собою водень, гідрокси, С1-7алкіл, гідроксіС1-7алкіл, галогенС1-7алкіл, С1-7алкокси, NR11R12 або 5-12-членне карбоциклічне кільце або гетероциклічне кільце, яке має 1-4 гетероатоми, вибрані з N, О і S, і заміщене 1-3 замісниками, вибраними з галогену, С1-7алкілу, гідроксіС1-7алкілу, С1-7ацилу, піридинілу, морфолінілу і бензилу;
R11 являє собою водень, С1-7алкіл, гідроксіС1-7алкіл, аміноС1-7алкіл, С1-7алкіламіноС1-7алкіл,
R12 являє собою водень або С1-7алкіл;
R13 і R14 незалежно являють собою водень, С1-7алкіл, галоген, ціано, галогенС1-7алкіл або гідроксіС1-7алкіл;
R15 і R16 незалежно являють собою водень, оксо, тіоксо, С1-7алкіл або ціано;
R17 являє собою С1-7алкіл, С1-7алкокси, аміноС1-7алкіл або С1-7алкіламіноС1-7алкіл;
R18 являє собою С1-7алкіл, аміноС1-7алкіл або С1-7алкіламіноС1-7алкіл;
і її фармацевтично прийнятних солей при виробництві лікарського засобу для профілактики або лікування захворювань, пов'язаних з рецепторами андрогенів (AR).
9. Фармацевтична композиція, що містить сполуку за п. 1 разом з фармацевтично прийнятним носієм.
10. Спосіб лікування або профілактики пов'язаних з андрогеновими рецепторами станів, що включає введення суб'єкту, при необхідності цього, терапевтично ефективної кількості сполуки за п. 1.
11. Спосіб за п. 10, де пов'язаний з андрогеновими рецепторами стан являє собою рак простати.
12. Спосіб лікування або профілактики пов'язаних з андрогеновими рецепторами станів, що включає введення суб'єкту, при необхідності цього, терапевтично ефективної кількості сполуки формули (I'), як указано в п. 8.
13. Спосіб за п. 12, де пов'язаний з андрогеновими рецепторами стан являє собою рак простати.
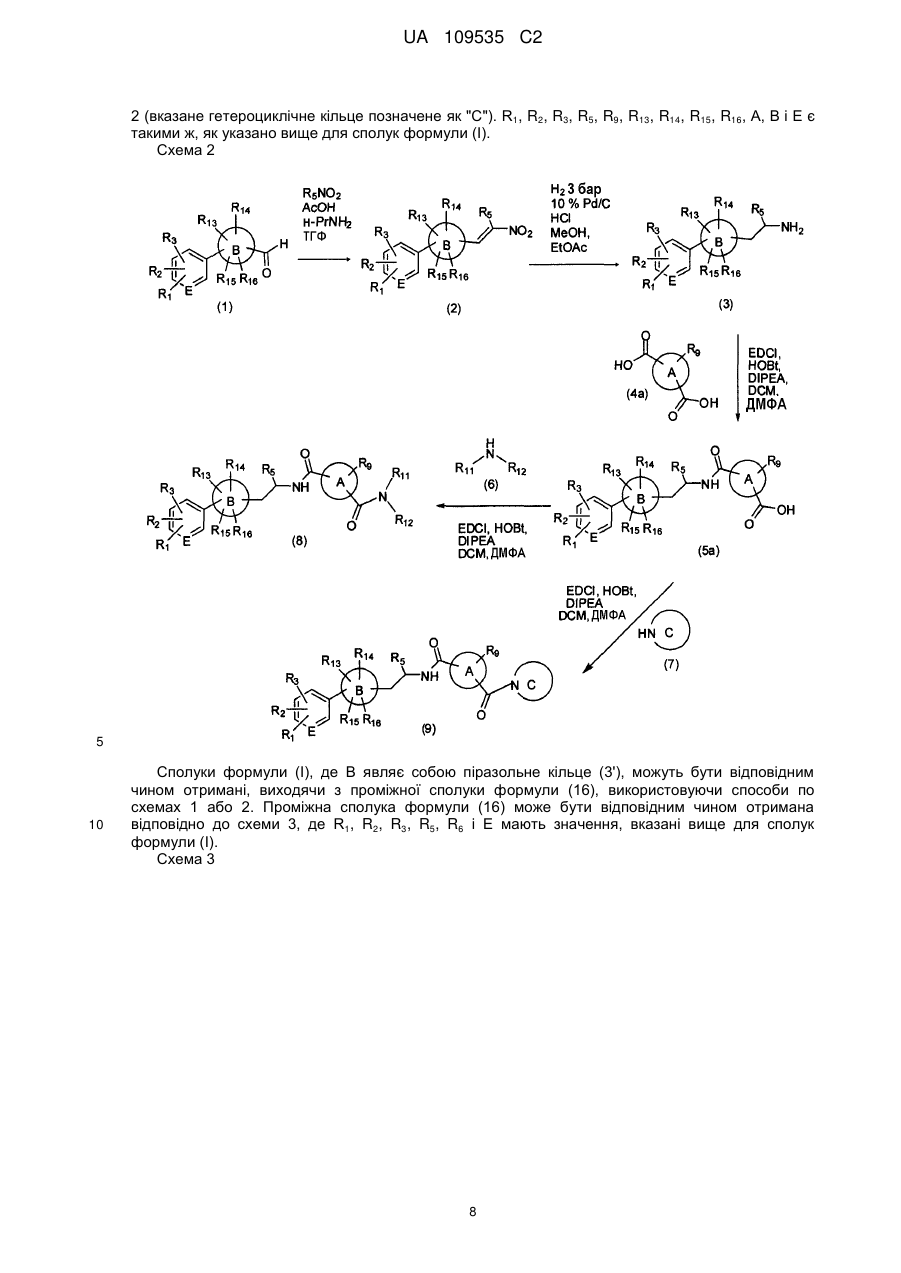
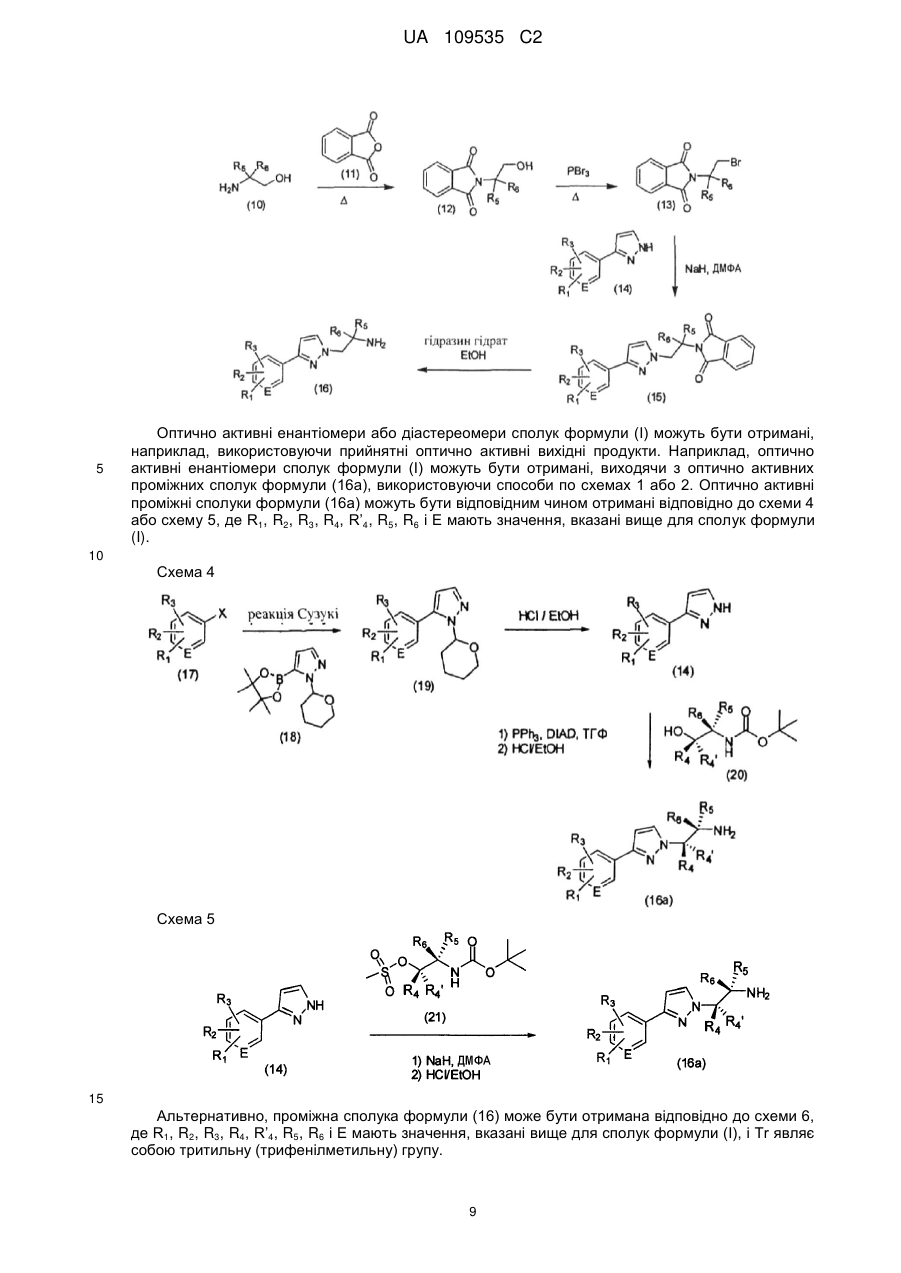
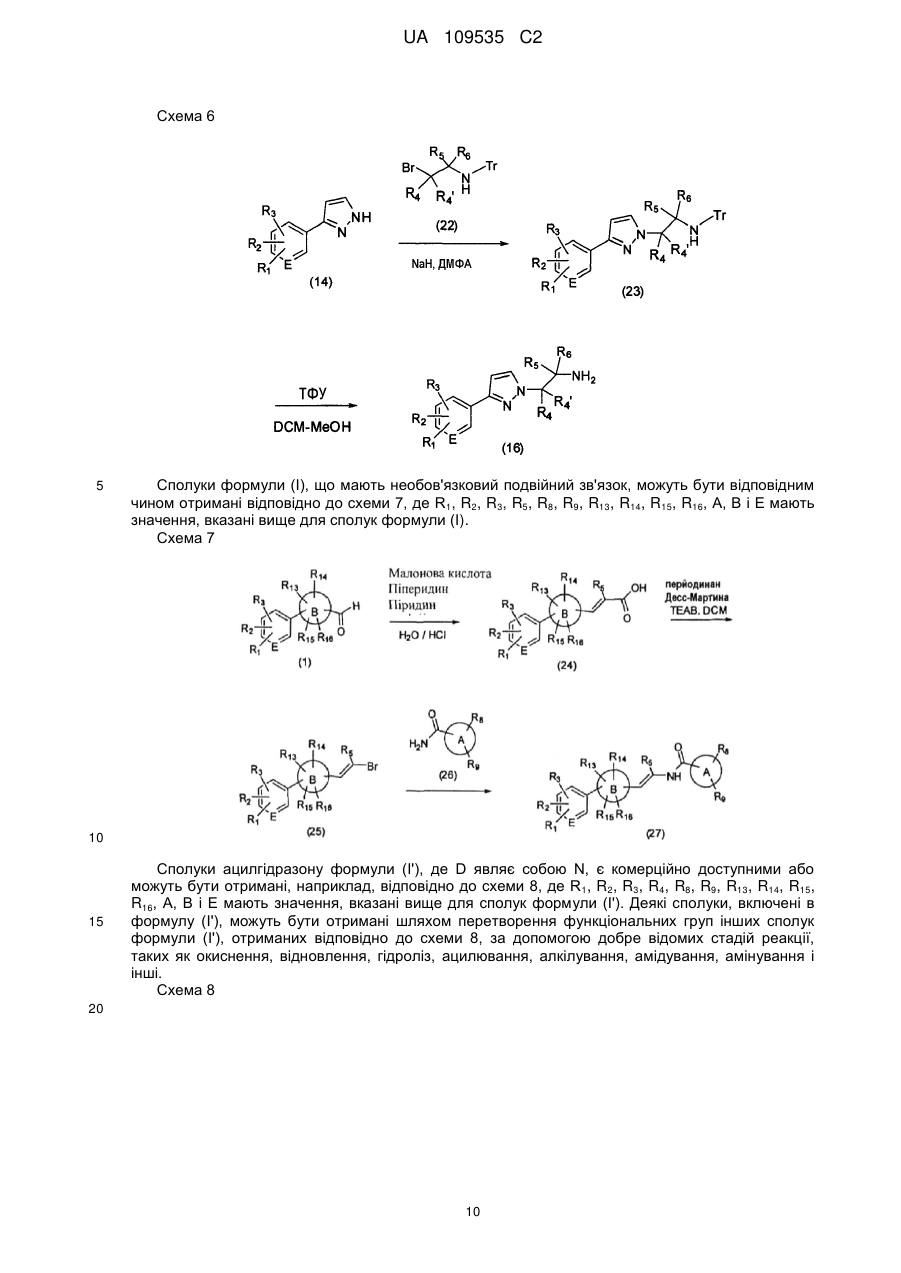
Текст
Реферат: Описані сполуки формули (І) R 14 R 13 R3 B R5 O (R6) N R2 R 15 R1 E R 16 R 4 (R4') R 7 R8 A R9 , (I) де R1-R16, А, В і Е мають значення, вказані в формулі винаходу, і фармацевтично прийнятні солі і їх складні ефіри. Сполуки формули (І) мають корисність як тканиноселективні модулятори андрогенових рецепторів (SARM) і, зокрема, можуть використовуватися як лікарські засоби для лікування раку простати і інших пов'язаних з AR станів і захворювань, де бажаним є антагонізм AR. UA 109535 C2 5 10 15 20 25 30 35 40 45 50 Галузь техніки Даний винахід стосується фармацевтично активних сполук і їх фармацевтично прийнятних солей і складних ефірів, що використовуються для лікування станів і захворювань, пов'язаних з ядерними рецепторами, особливо стероїдними рецепторами, і, зокрема, андрогеновими рецепторами (AR), і фармацевтичних композицій, що містять такі сполуки. Зокрема, винахід стосується нестероїдних сполук, що мають структуру карбоксаміду і ацетилгідразону, які можуть використовуватися як тканина-селективні модулятори андрогенових рецепторів (SARM). Сполуки за винаходом, які мають активністю антагоніста AR, можна використовувати для лікування пацієнтів, які потребують терапії із застосуванням антагоніста андрогенових рецепторів. Зокрема, AR-антагоністи за винаходом використовуються для лікування або профілактики раку, зокрема, раку, пов'язаного з AR, такого як рак простати, і інших захворювань, при яких бажаний AR-антагонізм. Рівень техніки У останні роки зріс інтерес до розробки нестероїдних модуляторів стероїдних рецепторів для терапевтичного застосування. Було показано, що нестероїдні ліганди можуть досягати кращої рецепторної селективності і кращих фізико-хімічних, фармакокінетичних і фармакологічних властивостей. Що стосується андрогенових рецепторів (AR), то в цей час нестероїдні антагоністи (антиандрогени) клінічно використовуються для перешкоди небажаній дії надмірної кількості андрогенів. Андрогени, діючи через AR, є вельми важливими в процесі ініціювання і розвитку раку простати. Таким чином, лікування запущеної стадії раку простати включає андроген-абляційні методи лікування, такі як хірургічна кастрація або гормональний вплив з використанням агоністів гонадотропін-вивільняючого гормону (GnRH), антиандрогенів або того і іншого. Хоча такі методи лікування спочатку приводять до регресії захворювання, зрештою, у всіх пацієнтів розвивається пізня стадія резистентності до кастрації, яка несприйнятлива до прийнятих в даний час методів лікування. Резистентний до кастрації рак простати (CRPC) пов'язаний з підвищеними рівнями AR. Перше покоління антиандрогенів, таких як бікалутамід, виявляє агоністичні властивості в клітинах, створених способами генної інженерії для експресії вищих рівнів AR. Було показано, що in vitro і in vivo підвищена експресія AR надавала резистентності клітинним лініям раку простати до антиандрогенної терапії. Для розв'язання проблеми резистентності для лікування CRPC може бути використане друге покоління антиандрогенів, які підтримують антагонізм в клітинах, експресуючих надмірну кількість AR. Нестероїдні антагоністи андрогенових рецепторів були описані раніше, наприклад, в патентних публікаціях EP 100172, EP 1790640, США 6087509, США 6673799, США 7271188, WO 03/057669, WO 2004/099188, WO 2006/133567, WO 2008/124000, WO 2009/028543 і WO 2009/055053. Споріднені сполуки, що мають структуру карбоксаміду, були описані в WO 2008/062878. Суть винаходу Було виявлено, що сполуки формули (I) або (I') є могутніми модуляторами андрогенових рецепторів (AR), зокрема, антагоністами AR. Сполуки формули (I) або (I') показують незвичайно високу спорідненість і високу антагоністичну активність відносно андрогенових рецепторів. Також в клітинах, які надекспресують AR ("клітини, надекспресуючі AR"), сполуки за винаходом мають антагонізмом AR, від високої міри до повної, показуючи тільки мінімальний агонізм. Сполуки за винаходом також ефективно інгібують проліферацію ліній клітин раку передміхурової залози. Крім того, сполуки за винаходом мають знижену здатність взаємновпливу лікарський засіб-лікарський засіб, сприятливий набір характеристик безпеки і достатню водорозчинність. Таким чином, сполуки за винаходом можуть бути використані, зокрема, як лікарські засоби при лікуванні раку простати і інших AR пов'язаних станів і захворювань, де необхідний ARантагонізм. Даний винахід стосується нових сполук карбоксамідної структури формули (I) 1 UA 109535 C2 5 10 15 20 25 30 35 , де R1 являє собою водень, галоген, ціано, нітро або необов'язково заміщене 5- або 6-членне гетероциклічне кільце; R2 являє собою водень, галоген, ціано, нітро, аміно, C1-7алкіл, галогенC1-7алкіл, гідроксіC17алкіл, тіоC1-7алкіл або C1-7алкокси; R3 являє собою водень, галоген або C1-7алкіл, або R2 і R3 разом з атомами вуглецю, до якого вони приєднані, утворюють необов'язково заміщене 5- або 6-членне карбоциклічне або гетероциклічне кільце; де щонайменше два з R1, R2 і R3 не являють собою водень; R4, R4', R5, R6 і R7 незалежно являють собою водень, C1-7алкіл, галогенC1-7алкіл або гідроксіC1-7алкіл; кільцевий атом Е являє собою С або N; пунктирна лінія означає необов'язковий подвійний зв'язок; А являє собою 5-12-членне гетероциклічне кільце; В являє собою 5-членне гетероциклічне кільце, де від 1 до 3 з членів кільця являють собою гетероатоми, вибрані з N, О і S; R8 являє собою водень, гідрокси, галоген, нітро, аміно, ціано, оксо, C 1-7алкіл, C1-7алкокси, галогенC1-7алкіл, гідроксіC1-7алкіл, ціаноC1-7алкіл, аміноC1-7алкіл, оксоC1-7алкіл, C1-7алкоксіC17алкіл, метилсульфонамідо C1-7алкіл, оксиранC1-7алкіл, C1-7алкіламіно, гідроксіC1-7алкіламіно, C17алкоксіC1-7алкіламіно, C 1-7алкіламіноC1-7алкіл, гідроксіC1-7алкіламіноC1-7алкіл, гідроксііміноC17алкіл, галогенC1-7алкілгідроксіC1-7алкіл, -C(О)R10, -OC(О)R17, -NH-C(О)R18 або необов'язково заміщене 5-12-членне карбоциклічне або гетероциклічне кільце, де кожна група необов'язково приєднана до кільця А через C1-7алкіленовий лінкер; R9 являє собою водень, галоген, C1-7алкіл, оксо, гідроксіC1-7алкіл, оксоC1-7алкіл або необов'язково заміщене 5- або 6-членне карбоциклічне або гетероциклічне кільце, де кожна група необов'язково приєднана до кільця А через C 1-7алкіленовий лінкер; R10 являє собою водень, гідрокси, C1-7алкіл, гідроксіC1-7алкіл, галогенC1-7алкіл, C1-7алкокси, NR11R12 або необов'язково заміщене 5-12-членне карбоциклічне або гетероциклічне кільце; R11 являє собою водень, C1-7алкіл, гідроксіC1-7алкіл, аміноC1-7алкіл, C1-7алкіламіноC1-7алкіл, R12 являє собою водень або C1-7алкіл; R13 і R14 незалежно являють собою водень, C1-7алкіл, галоген, ціано або гідроксіC1-7алкіл; R15 і R16 незалежно являють собою водень, оксо, тіоксо, C1-7алкіл або ціано; R17 являє собою C1-7алкіл, C1-7алкокси, аміноC1-7алкіл або C1-7алкіламіноC1-7алкіл; R18 являє собою C1-7алкіл, аміноC1-7алкіл або C1-7алкіламіноC1-7алкіл; і їх фармацевтично прийнятних солей. Одним класом переважних сполук формули (I) є сполуки, де В являє собою групу формули (1'), і замісниками В є R13 і R14 40 де Z являє собою О, N, С=О або С=S; X являє собою С або N; Y являє собою С або N; G являє собою CH, С=О або С=S і M являє собою CH або О; пунктирна лінія означає 2 UA 109535 C2 5 10 необов'язковий подвійний зв'язок, зірочкою вказана точка приєднання до кільця, і R 13 і R14 мають значення, вказані вище для сполук формули (I). Іншим класом переважних сполук формули (I) є сполуки, де В являє собою групу формули (2'), (3') або (4'), і замісниками В є R13 і R14, які також мають значення, вказані вище для сполук формули (I), і зірочкою вказана точка приєднання до кільця. Іншим класом переважних сполук формули (I) є сполуки формули (II), де R 1, R2, R3, R4, R4', R5, R6, R7, R8, R9, R13, R14, А, Е, Z, X, Y, G і M мають значення, вказані вище для сполук формули (I). 15 Одним класом переважних сполук формули (I) є сполуки формули (III), де R 1, R2, R3, R4, R4', R5, R6, R7, R8, R9, R13, R14, А і Е мають значення, вказані вище для сполук формули (I). 20 Іншим класом переважних сполук формули (I) є сполуки формули (IV), де R 1, R2, R3, R4, R4', R5, R6, R7, R8, R9, R13, R14, А і Е мають значення, вказані вище для сполук формули (I). 25 Іншим класом переважних сполук формули (I) є сполуки формули (V), де R 1, R2, R3, R4, R4', R5, R6, R7, R8, R9, R13, R14, А і Е мають значення, вказані вище для сполук формули (I). 3 UA 109535 C2 5 10 Іншим класом переважних сполук формули (I) є сполуки формули (VI), де R 1 являє собою галоген, метил, ціано, нітро або трифторметил; R2 являє собою ціано, галоген або нітро; R3 являє собою водень, галоген або метил; R4 являє собою водень або метил; R5 являє собою водень або C1-3алкіл; А, R8 і R9 мають значення, вказані вище для сполук формули (I). Одним переважним підкласом сполук формули (VI) є сполуки, де R 1 являє собою галоген, R2 являє собою ціано; R3 являє собою водень, галоген або метил; R4 являє собою водень, R5 являє собою метил і А, R8 і R9 мають значення, вказані вище для сполук формули (I). У іншому аспекті даний винахід стосується застосування сполук карбоксамідної структури і структури ацилгідразону формули (I'). 15 , 20 25 30 35 де R1 являє собою водень, галоген, ціано, нітро або необов'язково заміщене 5- або 6-членне гетероциклічне кільце; R2 являє собою водень, галоген, ціано, нітро, аміно, C1-7алкіл, галогенC1-7алкіл, гідроксіC17алкіл, тіоC1-7алкіл або C1-7алкокси; R3 являє собою водень, галоген або C1-7алкіл, або R2 і R3 разом з атомами вуглецю, до якого вони приєднані, утворюють необов'язково заміщене 5- або 6-членне карбоциклічне або гетероциклічне кільце; де щонайменше два з R1, R2 і R3 не являють собою водень; R4, R4', R5, R6 і R7 незалежно являють собою водень, C1-7алкіл, галогенC1-7алкіл або гідроксіC1-7алкіл; кільцевий атом Е являє собою С або N; D являє собою С або N; пунктирна лінія означає необов'язковий подвійний зв'язок; А являє собою 5-12-членне гетероциклічне кільце; В являє собою 5-членне гетероциклічне кільце, де від 1 до 3 з членів кільця являють собою гетероатоми, вибрані з N, О і S; R8 являє собою водень, гідрокси, галоген, нітро, аміно, ціано, оксо, C 1-7алкіл, C1-7алкокси, галогенC1-7алкіл, гідроксіC1-7алкіл, ціаноC1-7алкіл, аміноC1-7алкіл, C1-7алкоксіC1-7алкіл, метилсульфонамідоC1-7алкіл, оксиранC1-7алкіл, C1-7алкіламіно, гідроксіC1-7алкіламіно, C17алкоксіC1-7алкіламіно, C 1-7алкіламіноC1-7алкіл, гідроксіC1-7алкіламіноC1-7алкіл, гідроксііміноC1 4 UA 109535 C2 7алкіл, 5 10 15 20 25 галогенC1-7алкілгідроксіC1-7алкіл, -C(О)R10, -OC(О)R17, -NH-C(О)R18 або необов'язково заміщене 5-12-членне карбоциклічне або гетероциклічне кільце, де кожна група необов'язково приєднана до кільця А через C1-7алкіленовий лінкер; R9 являє собою водень, галоген, C1-7алкіл, оксо або необов'язково заміщене 5- або 6-членне карбоциклічне або гетероциклічне кільце, де кожна група необов'язково приєднана до кільця А через C1-7алкіленовий лінкер; R10 являє собою водень, гідрокси, C1-7алкіл, гідроксіC1-7алкіл, галогенC1-7алкіл, C1-7алкокси, NR11R12 або необов'язково заміщене 5-12-членне карбоциклічне або гетероциклічне кільце; R11 являє собою водень, C1-7алкіл, гідроксіC1-7алкіл, аміноC1-7алкіл, C1-7алкіламіноC1-7алкіл, R12 являє собою водень або C1-7алкіл; R13 і R14 незалежно являють собою водень, C1-7алкіл, галоген, ціано, галогенC1-7алкіл або гідроксіC1-7алкіл; R15 і R16 незалежно являють собою водень, оксо, тіоксо, C1-7алкіл або ціано; R17 являє собою C1-7алкіл, C1-7алкокси, аміноC1-7алкіл або C1-7алкіламіноC1-7алкіл; R18 являє собою C1-7алкіл, аміноC1-7алкіл або C1-7алкіламіноC1-7алкіл; і їх фармацевтично прийнятних солей; при виробництві лікарського засобу для профілактики або лікування захворювань, пов'язаних з андрогеновими рецепторами (AR). Одним класом переважних сполук формули (I') є сполуки формули (II'), де R 1, R2, R3, R4, R4', R5, R6, R7, R8, R9, R13, R14, А, Е, D, Z, X, Y, G і M мають значення, вказані вище для сполук формули (I') Одним конкретним класом сполук формули (I') є сполуки ацилгідразону формули (III'), де R 1, R2, R3, R4, R7, R8, R9, R13, R14, R15, R16, А, В і Е мають значення, вказані вище для сполук формули (I'). 30 Іншим конкретним класом сполук формули (I') є сполуки ацилгідразону формули (IV'), де R 1, R2, R3, R4, R7, R8, R9, R13, R14, R15, R16, А, Е, Z, X, Y, G і M мають значення, вказані вище для сполук формули (I') 35 IV' 5 UA 109535 C2 Іншим конкретним класом сполук формули (I') або (III') є сполуки ацилгідразону, де В являє собою групу формули (2'), (3') або (4'), як указано вище. Іншим класом переважних сполук є сполуки формули (I), (II), (III), (IV), (V), (VI), (I'), (II'), (III') або (IV'), де А являє собою одну з наступних груп або їх таутомерів: 5 10 15 де кожне з вищезгаданих кілець заміщене R8 і R9, як вказано вище. Переважними є сполуки формули (I), (II), (III), (IV), (V), (VI), (I'), (II'), (III') або (IV'), де А є будь-якою однією з груп (5'), (6'), (7'), (8'), (12'), (20'), (21'), (27') і (28'), або їх таутомери. Одним підкласом вищезгаданих переважних сполук є сполуки, де R8 являє собою водень, C1-7алкіл, гідроксіC1-7алкіл, галоген, піридиніл, піразоліл, імідазоліл, фураніл, -C(О)R10 або -OC(О)R17, де R10 являє собою C1-7алкіл, R17 являє собою C1-7алкіл, і R9 являє собою водень, галоген або C1-7алкіл, і де групи піридиніл, піразоліл, імідазоліл, фураніл, -C(О)R10 або -OC(О)R17 можуть бути приєднані до кільця А за допомогою C1-7алкіленового лінкера. Переважними сполуками вищезгаданого підкласу є 6 UA 109535 C2 5 10 15 20 25 30 сполуки, де R1 являє собою галоген, R2 являє собою ціано; R3 являє собою водень, галоген або метил; R4 являє собою водень, R5 являє собою метил. Ще одним класом переважних сполук є сполуки формули (I), (I') або (III'), де кільцевий атом Е являє собою С, R1 являє собою галоген, C1-7алкіл, ціано, нітро або галогенC1-7алкіл, R2 являє собою ціано, галоген або нітро, R3 являє собою водень, галоген або C1-7алкіл, А є будь-якою однією з груп (5'), (6'), (7'), (8'), (12'), (20'), (21'), (27') і (28') або їх таутомером, В являє собою групу формули (2'), (3') або (4'), заміщену R13 і R14, які являють собою водень, R4 (і R4', якщо прийнятно) являє собою водень або метил, R5 являє собою водень або C1-7алкіл, R6 (якщо прийнятно) являє собою водень, R8 являє собою водень, C1-7алкіл, гідроксіC1-7алкіл, галоген, гідроксііміноC1-7алкіл, 5- або 6членне гетероциклічне кільце або -C(О)R10, де R10 являє собою C1-7алкіл, і R9 являє собою водень, галоген або C1-7алкіл. Даний винахід стосується далі способу лікування або профілактики станів, пов'язаних з андрогенними рецепторами (AR), що включає введення суб'єкту, при необхідності цього, терапевтично ефективної кількості сполуки формули (I) або (I'). Наприклад, пов'язаний з AR стан, який необхідно піддати лікуванню, являє собою рак, зокрема, пов'язаний з AR рак, такий як рак простати, легку простатичну гіперплазію, андрогенну плішивість і акне. Відповідно до одного варіанту здійснення винаходу стан, пов'язаний з AR, який необхідно піддати лікуванню, являє собою стійкий до кастрації раку простати (CRPC). Даний винахід стосується також фармацевтичної композиції, що містить сполуку формули (I) разом з фармацевтично прийнятним носієм. Докладний опис винаходу Сполуки за винаходом можуть бути отримані шляхом різних шляхів синтезу аналогічно способам, відомим з літератури, використовуючи прийнятні вихідні продукти. Наприклад, сполуки формули (I), де R4, R4', R6 і R7 являють собою водень, і R1, R2, R3, R5, R8, R9, R13, R14, R15, R16, А, В і Е мають значення, вказані вище для сполук формули (I), можуть бути отримані, наприклад, аналогічно або відповідно до реакційної схеми 1. Деякі сполуки, що входять в формулу (I), можуть бути отримані шляхом перетворення функціональних груп інших сполук формули (I), отриманих згідно з схемою 1, за допомогою добре відомих стадій реакції, таких як окиснення, відновлення, гідроліз, ацилування, алкілування, амідування, амінування і інші. Схема 1 35 40 Сполуки формули (I), де R8 являє собою -C(О)R10 і R10 являє собою NR11R12 або необов'язково заміщене 5-12-членне гетероциклічне кільце, приєднане до карбонільного вуглецю через кільцевий атом N, можуть бути відповідним чином отримані відповідно до схеми 7 UA 109535 C2 2 (вказане гетероциклічне кільце позначене як "С"). R1, R2, R3, R5, R9, R13, R14, R15, R16, А, В і Е є такими ж, як указано вище для сполук формули (I). Схема 2 5 10 Сполуки формули (I), де В являє собою піразольне кільце (3'), можуть бути відповідним чином отримані, виходячи з проміжної сполуки формули (16), використовуючи способи по схемах 1 або 2. Проміжна сполука формули (16) може бути відповідним чином отримана відповідно до схеми 3, де R1, R2, R3, R5, R6 і Е мають значення, вказані вище для сполук формули (I). Схема 3 8 UA 109535 C2 5 Оптично активні енантіомери або діастереомери сполук формули (I) можуть бути отримані, наприклад, використовуючи прийнятні оптично активні вихідні продукти. Наприклад, оптично активні енантіомери сполук формули (I) можуть бути отримані, виходячи з оптично активних проміжних сполук формули (16a), використовуючи способи по схемах 1 або 2. Оптично активні проміжні сполуки формули (16a) можуть бути відповідним чином отримані відповідно до схеми 4 або схему 5, де R1, R2, R3, R4, R’4, R5, R6 і Е мають значення, вказані вище для сполук формули (I). 10 Схема 4 Схема 5 15 Альтернативно, проміжна сполука формули (16) може бути отримана відповідно до схеми 6, де R1, R2, R3, R4, R’4, R5, R6 і Е мають значення, вказані вище для сполук формули (I), і Tr являє собою тритильну (трифенілметильну) групу. 9 UA 109535 C2 Схема 6 5 Сполуки формули (I), що мають необов'язковий подвійний зв'язок, можуть бути відповідним чином отримані відповідно до схеми 7, де R1, R2, R3, R5, R8, R9, R13, R14, R15, R16, А, В і Е мають значення, вказані вище для сполук формули (I). Схема 7 10 15 Сполуки ацилгідразону формули (I'), де D являє собою N, є комерційно доступними або можуть бути отримані, наприклад, відповідно до схеми 8, де R 1, R2, R3, R4, R8, R9, R13, R14, R15, R16, А, В і Е мають значення, вказані вище для сполук формули (I'). Деякі сполуки, включені в формулу (I'), можуть бути отримані шляхом перетворення функціональних груп інших сполук формули (I'), отриманих відповідно до схеми 8, за допомогою добре відомих стадій реакції, таких як окиснення, відновлення, гідроліз, ацилювання, алкілування, амідування, амінування і інші. Схема 8 20 10 UA 109535 C2 5 10 15 20 25 30 35 40 Вихідні речовини у вищезгаданих схемах є комерційно доступними або можуть бути отримані відповідно до відомих способів. Фармацевтично прийнятні солі, наприклад, солі, отримані додаванням як органічних, так і неорганічних кислот, добре відомі в галузі фармацевтичних препаратів. Необмежуючі приклади цих солей включають хлориди, броміди, сульфати, нітрат, фосфати, сульфонати, формати, тартрати, малеати, цитрати, бензоати, саліцилати і аскорбати. Фармацевтично прийнятні складні ефіри, у разі застосування, можуть бути отримані добре відомими способами, використовуючи фармацевтично прийнятні кислоти, що звичайно використовуються в галузі фармацевтичних препаратів і зберігають фармакологічні властивості вільної форми. Необмежуючі приклади цих складних ефірів включають складні ефіри аліфатичних або ароматичних спиртів, наприклад, метиловий, етиловий, пропіловий, ізопропіловий, бутиловий, ізобутиловий, втор-бутиловий, трет-бутиловий складні ефіри. Фосфатні і карбонатні ефіри, також включені в об'єм даного винаходу. Визначення приведеної вище формули (I) включає всі можливі ізотопи і стереоізомери сполук, включаючи геометричні ізомери, наприклад, Z- і Е-ізомери (цис- і транс-ізомери), і оптичні ізомери, наприклад, діастереомери і енантіомери, і всі складні ефіри проліків, наприклад, фосфатні і карбонатні ефіри. Крім того, винахід включає в свій об'єм як окремі ізомери, так будь-яку їх суміш, наприклад, рацемічні суміші. У одному з варіантів здійснення термін "ізомер" включає оптичні ізомери сполук за винаходом. Фахівцеві в даній галузі зрозуміло, що сполуки за даним винаходом містять щонайменше один хіральний центр. Відповідно, сполуки за винаходом можуть існувати у вигляді оптично активних або рацимічних форм. Потрібно врахувати, що даний винахід включає будь-яку рацимічну або оптично активну форму або їх суміші. У одному з варіантів здійснення сполуки за винаходом являють собою чисті (R)-ізомери. У іншому варіанті здійснення сполуки за винаходом являють собою чисті (S)-ізомери. У іншому варіанті здійснення, сполуки за винаходом являють собою суміш (R)-і (S)-ізомерів. У іншому варіанті здійснення сполуки за винаходом являють собою рацимічну суміш (R)-і (S)-ізомерів в однакових кількостях. Сполуки за винаходом можуть містити два хіральних центри. У цьому випадку, відповідно до одного з варіантів здійснення винаходу сполуки за винаходом являють собою чисті діастереомери. Відповідно до іншого варіанту здійснення винаходу, сполуки за винаходом являють собою суміш декількох діастереомерів. Окремі ізомери можуть бути отримані, використовуючи відповідні ізомерні форми вихідної речовини, або вони можуть бути розділені після отримання кінцевої сполуки відповідно до звичайних способів розділення. Для виділення оптичних ізомерів, наприклад, енантіомерів або діастереомерів, з їх сумішей, можуть бути використані звичайні способи виділення, наприклад, фракційна кристалізація. Терміни, які тут використовуються, мають наступні значення: Термін "галоген", як тут використовується, сам по собі або у вигляді частини іншої групи стосується хлору, брому, фтору або йоду. 11 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "C1-7алкіл ", як тут використовується, сам по собі або у вигляді частини іншої групи стосується насиченого або ненасиченого прямого, розгалуженого або циклічного ланцюжкового радикала, що має від 1 до 7 атомів вуглецю. Репрезентативні приклади C 1-7алкілу включають, але цим не обмежуються, метил, етил, етеніл, н-пропіл, ізопропіл, пропеніл, н-бутил, ізобутил, втор-бутил, трет-бутил, н-пентил, ізопентил, неопентил, н-гексил, циклопентил, циклогексил і тому подібне. Термін "C1-7алкіленовий лінкер" означає насичений або ненасичений прямий, розгалужений або циклічний C1-7алкільний ланцюг, який зв'язує разом дві групи. Прикладами C 1-7алкіленового лінкера є метиленовий (-CH2-) і етиленовий (-CH2-CH2-) ланцюжки. Термін "гідрокси", як тут використовується, сам по собі або у вигляді частини іншої групи стосується групи -OH. Термін "ціано", як тут використовується, сам по собі або у вигляді частини іншої групи стосується групи -CN. Термін "гідроксіC1-7алкіл", як тут використовується, стосується щонайменше однієї гідрокси групи, як тут визначено, приєднаної до основної частини молекули через C 1-7алкільну групу, як тут визначено. Репрезентативні приклади гідроксіC1-7алкілу включають, але цим не обмежуються, гідроксиметил, 2,2-дигідроксіетил, 1-гідроксіетил, 3-гідроксипропіл, 1гідроксипропіл, 1-метил-1-гідроксіетил, 1-метил-1-гідроксипропіл і тому подібне. Термін "галогенC1-7алкіл", як тут використовується, стосується щонайменше одного галогену, як тут визначеного, приєднаного до основної частини молекули через C 1-7алкільну групу, як тут визначено. Репрезентативні приклади галогенC 1-7алкілу включають, але цим не обмежуються, фторметил, дифторметил, трифторметил, 2-хлоретил, 3-бромпропіл і тому подібне. Термін "C1-7алкокси", як тут використовується, сам по собі або у вигляді частини іншої групи стосується -O-C1-7алкілу, де C1-7алкіл має визначені тут значення. Репрезентативні приклади C 17алкокси включають, але цим не обмежуються, метокси, етокси, пропокси, бутокси, ізобутокси, втор-бутокси, трет-бутокси і тому подібне. Термін "тіоC1-7алкіл", як тут використовується, стосується -S-C1-7алкілу, де C1-7алкіл має визначені тут значення. Репрезентативні приклади тіоC1-7алкілу включають, але цим не обмежуються, тіометил (-SCH3), тіоетил і тому подібне. Термін "оксо" означає групу з подвійним зв'язком (=О), приєднану як замісник. Термін "тіоксо" означає групу з подвійним зв'язком (=S), приєднану як замісник. Термін "аміно", як тут використовується, сам по собі або у вигляді частини іншої групи стосується -NH2 групи. Термін "C1-7 ацил", як тут використовується, сам по собі або у вигляді частини іншої групи стосується C1-7алкілкарбонільної групи, і його приклади включають ацетил, пропаноїл, ізопропаноїл, бутаноїл, втор-бутаноїл, трет-бутаноїл і пентаноїл. Термін "аміноC1-7алкіл", як тут використовується, стосується щонайменше однієї аміногрупи, як тут визначено, приєднаної до основної частини молекули через C 1-7алкільну групу, як тут визначено. Репрезентативні приклади аміноC1-7алкілу включають, але цим не обмежуються, амінометил, 2-аміноетил, 1-аміноетил, 2,2-діаміноетил, 3-амінопропіл, 2-амінопропіл, 4амінобутил, 1-метил-1-аміноетил і тому подібне. Термін "C1-7алкіламіно", як тут використовується, сам по собі або у вигляді частини іншої групи стосується однієї або двох C1-7алкіл групи(груп), як тут визначено, приєднаної до основної частини молекули через аміногрупу, як тут визначено. Репрезентативні приклади C 1-7алкіламіно включають, але цим не обмежуються, метиламіно, етиламіно, пропіламіно, бутиламіно, диметиламіно, діетиламіно, N-етил-N-метиламіно і тому подібне. Термін "C1-7алкіламіноC1-7алкіл", як тут використовується, стосується C1-7алкіламіногрупи, як тут визначено, приєднаної до основної частини молекули через C 1-7алкільну групу, як тут визначено. Репрезентативні приклади C1-7алкіламіноC1-7алкілу включають, але цим не обмежуються, N, N-диметиламінометил, N, N-діетиламінометил, N-метиламіноетил, Nметиламінопропіл, N-етил-N-метиламінометил і тому подібне. Термін "гідроксіC1-7алкіламіноC1-7алкіл", як тут використовується, стосується гідроксіC 17алкіламіногрупи, як тут визначено, приєднаної до основної частини молекули через C 1групу, як тут визначено. Репрезентативні приклади C1-7алкіламіноC1-7алкілу 7алкільну включають, але цим не обмежуються, N-гідроксиметиламіноетил, N-етил-Nгідроксиметиламінометил і тому подібне. Термін "C1-7алкоксіC1-7алкіл", як тут використовується, стосується щонайменше однієї C 1алкоксигрупи, як тут визначено, приєднаної до основної частини молекули через C 1-7алкільну 7 групу, як тут визначено. Репрезентативні приклади C 1-7алкоксіC1-7алкілу включають, але цим не 12 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 обмежуються, метоксиметил, етоксиметил, 2-метоксіетил, 2-етоксіетил, 3,3-диметоксипропіл, 2,4-диметоксибутил і тому подібне. Термін "іміноC1-7алкіл ", як тут використовується, стосується щонайменше однієї іміногрупи (=NH), приєднаної до основної частини молекули через C1-7алкільну групу, як тут визначено. Термін "гідроксііміноC1-7алкіл ", як тут використовується, стосується =N-OH групи, приєднаної до основної частини молекули через C1-7алкільну групу, як тут визначено. Термін "5- або 6-членне гетероциклічне кільце" як тут використовується, стосується насиченого, частково насиченого або ароматичного кільця з 5 або 6 кільцевими атомами, з яких 1-3 атома являють собою гетероатоми, вибрані з групи, що складається з N, О і S. Репрезентативні приклади 5- або 6-членного гетероциклічного кільця включають, але цим не обмежуються, піразолільне, фуранільне, піперазинільне, піперидинільне, піридинільне кільця і тому подібне. Термін "5- або 6-членне карбоциклічне кільце", як тут використовується, стосується насиченого, частково насиченого або ароматичного кільця з 5 або 6 атомами кільця, що складається тільки з атомів вуглецю. Репрезентативні приклади 5- або 6-членного карбоциклічного кільця включають, але цим не обмежуються, фенільне і циклогексильне кільця і тому подібне. Термін "5-12-членне гетероциклічне кільце", як тут використовується, стосується моноциклічного або біциклічного насиченого, частково насиченого або ароматичного кільця з 512 кільцевими атомами, з яких 1-4 атома являють собою гетероатоми, вибрані з групи, що містить N, О і S. Репрезентативні приклади 5-12-членного гетероциклічного кільця включають, але цим не обмежуються, піразолільне, фуранільне, піперазинільне, піперидинільне, піридинільне, морфолінільне, піразинільне, індазолільне, імідазолільне, піразоло[1,5a]піримідинільне, ізоксазолільне і тіазолільне кільця і тому подібне. Термін "5-12-членне карбоциклічне кільце", як тут використовується, стосується насиченого, частково насиченого або ароматичного кільця з 5-12 кільцевими атомами, що складаються тільки з атомів вуглецю. Репрезентативні приклади 5-12-членного карбоциклічного кільця включають, але цим не обмежуються, фенільне, нафтильне і циклогексильне кільця і тому подібне. Термін "необов'язково заміщений", як тут використовується, в зв'язку з різними залишками, стосується галоген замісників, таких як фтор, хлор, бром, йод, або замісників C1-7алкіл, гідрокси, аміно, галогенC1-7алкіл, гідроксіC1-7алкіл, C1-7алкокси, C1-C7ацил, C1-7алкіламіно, аміноC1-7алкіл, метилсульфоніл, нітро, ціано, тіол або 5- або 6-членне карбоциклічне або гетероциклічне кільце. Переважними замісниками є галоген, C1-7алкіл, гідроксіC1-7алкіл, C1-C7ацил, піридиніл, морфолініл і бензил замісники. "Необов'язково заміщені" групи можуть містити від 1 до 3, переважно 1 або 2, найбільш переважно 1, вищезгаданих замісників. Приклади переважних сполук формули (I) включають N-(2-(5-(3,4-дихлорфеніл)фуран-2-іл)етил)-3-(морфолін-4-карбоніл)-1H-піразол-5карбоксамід; (S/R)-N-(1-(5-(3,4-дихлорфеніл)фуран-2-іл)пропан-2-іл)-3-(піридин-4-іл)-1H-піразол-5карбоксамід; (S)-N-(1-(3-(4-ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(фуран-2-іл)-1H-піразол-5карбоксамід; (S)-3-ацетил-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол-5карбоксамід; N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-(1-метил-1H-піразол-4-іл)ізоксазол-3карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-5-(1-метил-1H-піразол-4іл)ізоксазол-3-карбоксамід; N-(2-(3-(3,4-диціанофеніл)-1H-піразол-1-іл)етил)-3-(піридин-3-іл)-1H-піразол-5-карбоксамід; (R)-3-ацетил-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол-5карбоксамід; N-((S)-1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(1-гідроксіетил)-1H-піразол5-карбоксамід; (S)-2-аміно-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)тіазол-4-карбоксамід; (R)-3-ацетил-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)бутан-2-іл)-1H-піразол-5карбоксамід; (R)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)тіазол-4-карбоксамід; 13 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(піридин-3-іл)-1H-піразол-5карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)тіазол-4-карбоксамід; N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-3-(фуран-2-іл)-1H-піразол-5-карбоксамід; 3-трет-бутил-N-(1-(5-(4-ціано-3-(трифторметил)феніл)фуран-2-іл)пропан-2-іл)-1H-піразол-5карбоксамід; 3-трет-бутил-N-(2-(5-(3-хлор-4-ціано-2-метилфеніл)фуран-2-іл)етил)-1H-піразол-5карбоксамід; N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-(піридин-3-іл)-1H-піразол-3карбоксамід; (S)-5-ацетил-N-(1-(3-(4-ціано-3,5-дифторфеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол-3карбоксамід; (R)-N-(1-(3-(4-ціано-3-(трифторметил)феніл)-1H-піразол-1-іл)пропан-2-іл)-3-(фуран-2-іл)-1Hпіразол-5-карбоксамід; (S)-3-ацетил-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол5-карбоксамід; N-((S)-1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(1-гідроксіетил)-1Hпіразол-5-карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-5-метилізоксазол-3карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)тіазол-4-карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-5-(трифторметил)-1Hпіразол-3-карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(фуран-2-іл)-1Hпіразол-5-карбоксамід; (R)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-5-(піридин-3-іл)-1Hпіразол-3-карбоксамід; (R)-N-(1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(фуран-2-іл)-1Hпіразол-5-карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-5-(2-метилтіазол-4-іл)-1Hпіразол-3-карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-3-метил-1,2,4-оксадіазол-5карбоксамід; (R)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-2морфолінотіазол-4карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-2-(1H-піразол-4-іл)тіазол-4карбоксамід; (S)-N-{1-[3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл]пропан-2-іл}-2-метил-1H-імідазол-4карбоксамід; N-((S)-1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-5-(1-гідроксіетил)ізоксазол-3карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-3-етил-1,2,4-оксадіазол-5карбоксамід; N-((S)-1-(3-(3-хлор-4-ціано-2-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-2-(1гідроксіетил)тіазол-4-карбоксамід; (R)-N-(2-(3-(4-ціано-3,5-дифторфеніл)-1H-піразол-1-іл)пропіл)-2-(ціанометил)тіазол-4карбоксамід; (S)-N-{1-[3-(3-хлор-4-ціано-5-фторфеніл)-1H-піразол-1-іл]пропан-2-іл}-2-метил-1H-імідазол-4карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціано-5-фторфеніл)-1H-піразол-1-іл)пропан-2-іл)імідазо[1,2-a]піримідин2-карбоксамід; (S)-3-ацетил-N-(2-(3-(4-ціано-3,5-дифторфеніл)-1H-піразол-1-іл)пропіл)-1H-піразол-5карбоксамід; (S)-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-2,4,6,7-тетрагідропірано[4,3c]піразол-3-карбоксамід. Сполуки за винаходом можуть бути введені пацієнту в терапевтично ефективних кількостях, звичайно в діапазоні від близько 0,1 до близько 5000 мг, переважно від близько 1 до близько 2000 мг в день, залежно від віку, ваги, етнічної групи, стану пацієнта, захворювання, що піддається лікуванню, способу введення і використовуваного андрогенового (AR) модулятора. Сполуки за винаходом можуть бути представлені у вигляді лікарських форм, використовуючи 14 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 методи, відомі в даній галузі. Вони можуть вводитися пацієнту в чистому вигляді або в поєднанні з прийнятними фармацевтичними наповнювачами в формі таблеток, гранул, капсул, свічок, емульсій, суспензій або розчинів. Вибір відповідних інгредієнтів для композиції є звичайною роботою для рядового фахівця в даній галузі. Очевидно, що прийнятні носії, розчинники, утворюючі гель інгредієнти, утворюючі дисперсію інгредієнти, антиоксиданти, барвники, підсолоджувачі, змочувальні речовини і інші інгредієнти, що звичайно використовуються в даній галузі техніки, також можуть бути використані. Композиції, що містять активні сполуки, можуть бути введені ентерально або парентерально, але пероральний спосіб введення є переважним. Вміст активної сполуки в композиції складає від близько 0,5 до 100 %, переважно від близько 1 до близько 85 % від маси всієї композиції. Даний винахід буде описаний більш детально за допомогою наступних прикладів. Приклади приведені тільки з метою ілюстрації і не обмежують об'єм винаходу, визначеного в пунктах формули винаходу. Експерименти Експеримент 1 Вимірювали спорідненість AR зв'язування (Ki) досліджуваної сполуки. AR-антагонізм досліджуваної сполуки вимірювали як IC50 значення (нМ) для AR людини в клітинах hAR/HEK293. AR-агонізм досліджуваної сполуки в надекспресуючих AR клітинах hAR/HEK293 вимірювали в % тестостерон-індукованій AR активності при концентрації 10 мкM. Вимірювали значення IC50 досліджуваної сполуки для інгібування міболерон-індукованої VCaP клітинної проліферації. Як контрольну сполуку у вимірюваннях використовували бікалутамід. Способи Дослідження зв'язування андрогенового рецептора Спорідненість зв'язування досліджуваних сполук з андрогеновим рецептором (AR) вивчали на цитозольних лізатах, отриманих з вентральних простат кастрованих щурів, за допомогою аналізу конкурентного зв'язування (Schilling K. and Liao S., The Prostate, 1984; 5(6):581-588). Цитозольні препарати і 1 нМ [3H]міболерону інкубували з підвищеними концентраціями досліджуваних сполук. Для визначення неспецифічного зв'язування виконували паралельні інкубації, використовуючи надмірну кількість неміченого тестостерону. Після інкубації зв'язані і вільні стероїди розділяли обробкою суспензією декстран-покритого вугільного пилу. Радіоактивність зв'язування визначали підрахунком фракції супернатанту в сцинтиляційній рідині. Радіоактивність вимірювали, використовуючи лічильник Microbeta. Всі точки даних визначали чотири рази по чотири. Сталу дисоціації [3H]міболерону для андрогенового рецептора щурів визначали за допомогою аналізу здатності поглинаючого зв'язування, що проводиться на вентральних простатах кастрованих щурів, по суті, як описано (Isomaa V. et al., Endocrinology, 1982; 111(3):833-843). Аналіз даних Для аналізу здатності поглинаючого зв'язування використовували рівняння зв'язування однієї ділянки (гіпербола) B X Специфічне зв'язування = max , Kd X де Bmax = максимальне специфічне зв'язування Kd = рівноважна константа дисоціації X = концентрація радіоліганду Рівноважну сталої дисоціації (Ki) підраховували, використовуючи рівняння Ченга-Прусова: , де [радіоліганд] = концентрація вільного радіоліганду Kd = стала дисоціації радіоліганду для рецептора IC50=IC50 значення, виміряне в дослідженні конкурентного радіолігандного зв'язування AR антагонізм Антагонізм досліджуваних сполук відносно AR вимірювали за допомогою аналізу репортерного гена в ембріональних клітинах нирки людини (HEK293), стабільно трансфікованих вектором експресії, що кодує повнорозмірний AR людини і конструкцію андроген 15 UA 109535 C2 5 10 15 20 25 сприйнятливого репортерного гена люциферази (hAR/HEK293 клітини). Для визначення антагонізму відносно hAR клітини обробляли одночасно підвищеними концентраціями сполуки і субмаксимальною концентрацією тестостерону (звичайно 0,45 нМ). Кінцева концентрація DMSO становила 1 %. Всі досліджувані сполуки досліджували з трикратним повтором. Клітини інкубували протягом 24 годин перед вимірюванням люциферазної активності, використовуючи (Luciferase Assay System, Promega Corporation). Агонізм досліджуваних сполук в клітинах, надекспресуючих AR, вимірювали за допомогою аналізу репортерного гена в клітинах HEK293, стабільно трансфікованих вектором експресії, що кодує повнорозмірний AR людини і конструкцію андроген-сприйнятливого репортерного гена люциферази. Для дослідження агонізму в клітинах, надекспресуючих AR, виділяли клон, що експресує високі рівні андрогенового рецептора (в 5 разів вищі, ніж рівні AR в клітинах ARHEK293). Для визначення агонізму клітини обробляли підвищеними концентраціями досліджуваної сполуки. Кінцева концентрація ДМСО становила 1 %. Досліджувангі сполуки досліджували з трикратним повтором і люциферазну активність визначали вищеописаним способом. Дослідження клітинної проліферації Здатність досліджуваних сполук пригнічувати ріст ракових клітин простати вивчали шляхом вимірювання інгібування клітинної проліферації, використовуючи лінію андроген-сприйнятливих клітин раку простати VCaP. Клітини висіювали при щільності 50000 клітин/ямка в 96-ямковий планшет у прийнятному культуральному середовищі (вільне від фенолроту середовище RPMI1640 з додаванням 10 % обробленого активованим вугіллям FBS і 4 мM глутамаксу + 100 МЕ пеніциліну, 100 МЕ стрептоміцину). Клітини залишали, щоб вони могли прилипнути до планшета, на 2-3 дні і потім обробляли досліджуваними сполуками в присутності міболерону (концентрація, здатна спричиняти субмаксимальне підвищення клітинної проліферації, звичайно 0,1 нМ) протягом 4-5 днів. Клітинну проліферацію вимірювали, використовуючи WST-1 Cell Proliferation Assay (Roche). 16 UA 109535 C2 Таблиця 1 Спорідненість зв'язування AR, AR-антагонізм, AR-агонізм в клітинах, які надекспресують AR, і інгібування проліферації клітин VCaP 5 10 15 Приклади Цільові продукти в наступних прикладах були отримані у вигляді суміші діастереомерів, якщо не указано іншого. Приклад 1 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-(піперазин-1-карбоніл)-2H-піразол-3карбонової кислоти a) 2-(3,4-Дихлорфеніл)-5-((Е)-2-нітровініл)фуран Перемішуваний розчин оцтової кислоти (1,4 мл, 1,46 г, 24,3 ммоль) в метанолі (3,5 мл) в атмосфері азоту при температурі 0 °C обробляли по краплях н-пропіламіном (2,0 мл, 1,42 г, 24,0 ммоль). Отриманий розчин н-пропіламонію ацетату перемішували при температурі 0 °C протягом 5 хв, потім додавали по краплях до переміщуваного розчину 5-(3,4дихлорфеніл)фурфуралю (10,04 г, 41,6 ммоль) в нітрометані (6,8 мл, 7,61 г, 124,7 ммоль) при температурі 0 °C. Отриману суміш перемішували при температурі 0 °C протягом 30 хв. Потім охолоджуючу баню відставляли і перемішування продовжували при кімнатній температурі. Час від часу п'ять разів додавали 10 мл ТГФ. Після перемішування протягом ночі ТГФ упарювали і додавали воду. Твердий продукт фільтрували, промивали водою і гептаном з отриманням 11,46 17 UA 109535 C2 1 5 10 15 20 25 30 35 40 45 50 55 г 2-(3,4-дихлорфеніл)-5-((Е)-2-нітровініл)фурану. H ЯМР (400 МГц, ДМСО-d6): 7,38 (1H, д), 7,43 (1H, д), 7,76 (1H, д), 7,95 (1H, дд), 8,03 (1H, д), 8,19 (1H, д), 8,31 (1H, д). b) Гідрохлорид 2-[5-(3,4-дихлорфеніл)фуран-2-іл]етиламіну 2-(3,4-Дихлорфеніл)-5-((Е)-2-нітровініл)фуран (5,73 г, 20,2 ммоль) розчиняли в суміші сухого метанолу (90 мл) і сухого етилацетату (70 мл). Потім додавали 14,3 мл суміші 10 % мас. HClметанол і 2,4 г 10 % паладію-на-вуглеці. 2-(3,4-Дихлорфеніл)-5-((Е)-2-нітровініл)фуран гідрували при тиску 3 атм. при кімнатній температурі протягом 4 годин. Каталізатор видаляли за допомогою фільтрації через Celite®. Видалення розчинника при зниженому тиску давало сирий продукт, який очищали за допомогою флеш-хроматографії на силікагелі, використовуючи суміш 1 CH2Cl2/MeOH (98:2-80:20) як градієнтний елюент. H ЯМР (400 МГц, ДМСО-d6): 3,04 (2H, м), 3,14 (2H, м), 6,43 (1H, д), 7,07 (1H, д), 7,67 (2H, с), 7,93 (1H, с), 8,19 (3H, ушир. с). c) 5-{2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонова кислота Моногідрат 3,5-піразолдикарбонової кислоти (8,02 г, 46,1 ммоль) розчиняли в суміші сухого ДМФА (35 мл), сухого DCM (35 мл) і DIPEA (7,9 мл). При кімнатній температурі додавали гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (EDCI, 3,37 г, 17,6 ммоль), HOBt (2,28 г, 16,9 ммоль) і DIPEA (3 мл, 2,23 г, 17,3 ммоль). Розчин перемішували протягом 10 хв. Потім до розчину при кімнатній температурі додавали по краплях гідрохлорид 2-[5-(3,4дихлорфеніл)фуран-2-іл]етиламіну (3,46 г, 11,8 ммоль), розчинений в суміші сухого DCM (35 мл) і DIPEA (2,0 мл, 1,48 г, 11,5 ммоль). Після перемішування протягом ночі додавали воду. Продукт екстрагували етилацетатом. Органічну фазу промивали водою, сушили і упарювали. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи DCM як елюент. Продукт 1 розтирали з гарячим метанолом. H ЯМР (400 МГц, ДМСО-d6): 2,95 (2H, т), 3,56 (2H, м), 6,33 (1H, д), 7,01 (1H, д), приблизно 7,03 (1H, ушир. с), 7,61 (1H, спотворений дд), 7,63 (1H, спотворений д), 7,83 (1H, д), приблизно 8,45 (1H, ушир. с), приблизно 14,05 (1H, ушир. с). d) {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-(піперазин-1-карбоніл)-2H-піразол-3карбонової кислоти 5-{2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонову кислоту (0,30 г, 0,76 ммоль) розчиняли в суміші сухого ДМФА (3 мл) і сухому DCM (3 мл). При кімнатній температурі додавали EDCI (0,22 г, 1,2 ммоль), HOBt (0,16 г, 1,2 ммоль) і DIPEA (0,2 мл, 0,15 г, 1,2 ммоль). Після перемішування протягом 15 хв до розчину при кімнатній температурі додавали по краплях піперазин (0,10 г, 1,2 ммоль) в сухому DCM (2 мл). Потім розчин перемішували протягом ночі. Додавали воду і продукт екстрагували етилацетатом. Органічну фазу перемішували з насиченим сольовим розчином і водою, сушили і упарювали. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи CH2Cl2-MeOH як градієнтний елюент (95:5-50:50). Потім очищали також за допомогою флеш-хроматографії, 1 використовуючи CH2Cl2-MeOH (9:1) як елюент. H ЯМР (400 МГц, CDCl3): 2,94 (4H, м), 3,01 (2H, т), 3,77 (2H, кв), приблизно 3,8 (4H, м), 6,20 (1H, д), 6,58 (1H, д), 7,02 (1H, с), 7,21 (1H, ушир. с), 7,40 (1H, спотворений д), 7,43 (1H, спотворений дд), 7,75 (1H, д). Приклад 2 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-[4-(2-гідроксіетил)піперидин-1-карбоніл]-2Hпіразол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в попередньому прикладі, виходячи з 5-{2-[5(3,4-дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 4-піперидин етанолу. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш 1 CH2Cl2-MeOH як градієнтний елюент (100:0-95:5). H ЯМР (400 МГц, CDCl3): 1,27 (3H, м), 1,57 (2H, м), 1,85 (3H, м), 2,81 (1H, м), 3,01 (2H, т), приблизно 3,21 (1H, м), 3,76 (4H, м), приблизно 4,41 (1H, м), приблизно 4,67 (1H, м), 6,20 (1H, д), 6,59 (1H, д), 7,02 (1H, с), 7,29 (1H, ушир. с), 7,40 (1H, спотворений д), 7,43 (1H, спотворений дд), 7,75 (1H, д), 11,4 (1H, ушир. с). Приклад 3 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-(4-гідроксипіперидин-1-карбоніл)-2H-піразол3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 4гідроксипіперидину. Сирий продукт очищали за допомогою флеш-хроматографії, 1 використовуючи суміш CH2Cl2-MeOH (95:5) як елюент. H ЯМР (400 МГц, CDCl3): 1,62 (1H, д), 1,65 (2H, м), 1,95 (2H, м), 3,00 (2H, т), приблизно 3,57 (2H, м), 3,77 (2H, кв), приблизно 4,1 (3H, м), 6,20 (1H, д), 6,58 (1H, д), 7,03 (1H, с), приблизно 7,6 (1H, ушир. с), 7,40 (1H, спотворений д), 7,43 (1H, спотворений дд), 7,74 (1H, д), 11,6 (1H, ушир. с). Приклад 4 18 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-[4-(2-гідроксіетил)піперазин-1-карбоніл]-2Hпіразол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 1-(2гідроксіетил)піперазину. Сирий продукт очищали за допомогою флеш-хроматографії, 1 використовуючи суміш CH2Cl2-MeOH як градієнтний елюент (100:0-90:10). H ЯМР (400 МГц, ДМСО-d6): 2,40-2,44 (6H, м), 2,95 (2H, т), приблизно 3,5-3,7 (6H, м), приблизно 3,82 (2H, м), 4,41 (1H, т), 6,33 (1H, д), 7,01 (1H, д), приблизно 7,05 (1H, ушир. с), 7,59 (1H, спотворений дд), 7,63 (1H, спотворений д), 7,84 (1H, д), приблизно 8,59 (1H, ушир. с), 13,9 (1H, ушир. с). Приклад 5 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-(4-ацетилпіперазин-1-карбоніл)-2H-піразол-3карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 1-ацетилпіперазину. Сирий продукт розтирали в CH2Cl2 при кімнатній температурі з отриманням цільового продукту. 1 H ЯМР (400 МГц, CDCl3): 2,15 (3H, с), 3,01 (2H, т), 3,58 (2H, м), 3,72 (2H, м), 3,78 (2H, кв), 3,84 (4H, м), 6,21 (1H, д), 6,59 (1H, д), 7,04 (1H, с), приблизно 7,28 (1H, ушир. с), 7,41 (2H, м), 7,74 (1H, с), 11,35 (1H, ушир. с). Приклад 6 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-(4-морфолін-4-ілпіперидин-1-карбоніл)-2Hпіразол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 4морфолінопіперидину. Сирий продукт очищали за допомогою флеш-хроматографії, 1 використовуючи суміш CH2Cl2-MeOH як градієнтний елюент (100:0-96:4). H ЯМР (400 МГц, ДМСО-d6): приблизно 1,32 (2H, м), приблизно 1,82 (2H, м), 2,45-2,47 (5H, м), приблизно 2,78 (1H, м), 2,95 (2H, т), приблизно 3,11 (1H, м), 3,55-3,57 (6H, м), приблизно 4,45 (1H, м), 6,34 (1H, д), 7,02 (1H, д), приблизно 7,03 (1H, ушир. с), 7,59 (1H, спотворений дд), 7,63 (1H, спотворений д), 7,84 (1H, д), 8,6 (1H, ушир. с), 13,9 (1H, ушир. с). Приклад 7 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-[4-(1-гідроксіетил)піперидин-1-карбоніл]-2Hпіразол-3-карбонової кислоти карбонової кислоти a) 1-(Піридин-4-іл)етанол До переміщуваного розчину 4-ацетилпіридину (2,50 г, 20,6 ммоль) в метанолі (25 мл) додавали по частинах боргідрид натрію (1,56 г, 41,2 ммоль). Після перемішування протягом ночі при кімнатній температурі додавали воду і суміш упарювали досуха у вакуумі. Продукт обробляли етилацетатом. Розчинник упарювали з отриманням 2,53 г вказаної в заголовку 1 сполуки. H ЯМР (400 МГц, ДМСО-d6): 1,32 (3H, д), 4,69-4,75 (1H, м), 5,38 (1H, д), 7,34 (2H, д), 8,49 (2H, д). b) 1-(Піперидин-4-іл)етанол 1-(Піридин-4-іл)етанол (2,53 г, 20,5 ммоль) розчиняли в оцтовій кислоті (20 мл) і гідрували при кімнатній температурі в присутності оксиду платини(IV) (0,19 г) при тиску 1 атм. Каталізатор видаляли шляхом фільтрації через Celite®, і фільтрат концентрували у вакуумі з отриманням сирого 1-(піридин-4-іл)етанолу у вигляді ацетатної солі, яку розтирали в етилацетаті. Водний розчин ацетатної солі підлужнювали (pH>10) гідроксидом натрію і 1-(піридин-4-іл)етанолом як 1 основа і екстрагували етилацетатом. Екстракти концентрували у вакуумі. H ЯМР (400 МГц, ДМСО-d6): 1,00 (3H, д), 0,94-1,11 (2H, м), 1,14-1,23 (1H, м), 1,44 (1H, м), 1,66 (1H, м), 2,37 (2H, м), 2,91 (2H, м), 3,30 (1H, квінтет), 4,23 (1H, ушир. с). c) {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-[4-(1-гідроксіетил)піперидин-1-карбоніл]2H-піразол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти і 1-(піперидин-4іл)етанолу. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш 1 CH2Cl2-MeOH як градієнтний елюент (100:0-90:10). H ЯМР (400 МГц, CDCl3): 1,22 (3H, д), 1,301,41 (3H, м), 1,62 (1H, м), 1,77 (1H, м), 2,00 (1H, м), приблизно 2,78 (1H, м), 3,01 (2H, т), приблизно 3,18 (1H, м), приблизно 3,64 (1H, м), 3,77 (2H, кв), приблизно 4,48 (1H, м), приблизно 4,75 (1H, м), 6,20 (1H, д), 6,58 (1H, д), 7,02 (1H, с), приблизно 7,28 (1H, ушир. с), 7,40 (1H, спотворений д), 7,43 (1H, спотворений дд), 7,75 (1H, д), 11,44 (1H, ушир. с). Приклад 8 19 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етил)-3-(морфолін-4-карбоніл)-1H-піразол-5карбоксамід Вказану в заголовку сполуку отримували як в прикладі 1, виходячи з морфоліну і 5-{2-[5-(3,4дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти. Сирий продукт очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: суміш 0-10 % MeOH/DCM; 2-а колонка С-18 RP, елюент: суміш 0-100 % MeCN/вода) з 1 отриманням 505 мг (17 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,95 (т, 1H), 3,56 (кв, 1H), 3,62 (ушир. с, 6H), 3,90 (ушир. с, 2H), 6,34 (д, 1H), 7,02 (д, 1H), 7,08 (с, 1H), 7,62 (м, 2H), 7,85 (д, 1H), 8,61 (с, 1H), 13,94 (с, 1H). Приклад 9 N-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етил)-3-(4-метилпіперазин-1-карбоніл)-1H-піразол-5карбоксамід Вказану в заголовку сполуки синтезували як в прикладі 1, виходячи з 1-метилпіперазину і 5{2-[5-(3,4-дихлорфеніл)фуран-2-іл]етилкарбамоїл}-1H-піразол-3-карбонової кислоти. Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент 0-10 % MeOH/DCM) і кристалізували з суміші DCM/гептан з отриманням 1,06 г (35 %) 1 вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,19 (с, 3H), 2,33 (ушир. с, 4H), 2,95 (т, 2H), 3,56 (кв, 2H), 3,62 (ушир. с, 2H), 3,85 (ушир. с, 2H), 6,34 (д, 1H), 7,02 (д, 1H), 7,07 (ушир. с, 1H), 7,60 (дд, 1H), 7,63 (д, 1H), 7,84 (д, 1H), 8,61 (с, 1H), 13,92 (с, 1H). Приклад 10 5-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етилкарбамоїл)піразин-2-карбонова кислота Піразин-2,5-дикарбонову кислоту (0,58 г; 3,42 ммоль), безводний HOBt (0,69 г; 5,13 ммоль) і гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,98 г; 5,13 ммоль) додавали до 5 мл DCM. Гідрохлорид 2-(5-(3,4-дихлорфеніл)фуран-2-іл)етанаміну (1,0 г; 3,42 ммоль) і DIPEA (0,89 мл; 5,13 ммоль) розчиняли в 5 мл DCM і додавали по краплях до попередньої суміші. Реакційну суміш перемішували протягом ночі, після чого додавали піразин-2,5-дикарбонову кислоту (0,58 г; 1,59 ммоль) і DIPEA (0,60 мл; 3,42 ммоль), і суміш знову перемішували протягом 5 годин. Для доведення реакції до завершення знову додавали безводний HOBt (0,69 г; 5,13 ммоль), гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,98 г; 5,13 ммоль) і DIPEA (0,89 мл; 5,13 ммоль). Після перемішування протягом ночі суміш розбавляли 20 мл DCM і промивали 3×10 мл води. Органічну фазу сушили над Na2SO4, фільтрували і використовували як таку без додаткового очищення. Приклад 11 N-2-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етил)-N-5-(2-гідроксіетил)піразин-2,5-дикарбоксамід 5-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етилкарбамоїл)піразин-2-карбонову кислоту (0,12 г; 0,30 ммоль), безводний HOBt (0,15 г; 1,1 ммоль), гідрохлорид 1-(3-диметиламінопропіл)-3етилкарбодііміду (0,085 г; 0,44 ммоль) і DIPEA (0,077 мл; 0,44 ммоль) розчиняли в 2,5 мл DCM. До цього розчину додавали 2-аміноетанол (0,018 мл; 0,3 мл) в 2,5 мл DCM, і суміш перемішували протягом ночі. Суміш розбавляли 10 мл DCM і промивали 3×5 мл води. Водні фази потім екстрагували EtOAc, органічну фазу сушили над Na 2SO4, фільтрували і упарювали досуха. Продукт очищали за допомогою флеш-хроматографії. Об'єднані фракції давали 6 мг 1 продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 3,01 (т, 2H), 3,38-3,43 (м, 2H), 3,52-3,57 (м, 2H), 3,643,69 (м, 2H), 4,81 (т, 1H), 6,36 (д, 1H), 7,02 (д, 1H), 7,58-7,64 (м, 2H), 7,80 (д, 1H), 8,91-8,94 (т, 1H), 9,19 (д, 1H), 9,21 (д, 1H), 9,26-9,29 (т, 1H). Приклад 12 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1,5-диметил-1H-піразол-3-карбонової кислоти 1,5-Диметил-1H-піразол-3-карбонову кислоту (100 мг, 0,71 ммоль) розчиняли в сухому ДМФА (2 мл). При кімнатній температурі додавали EDCl (205 мг, 1,1 ммоль), HOBt (145 мг, 1,1 ммоль) і DIPEA (0,19 мл, 141 мг,1,1 ммоль). Розчин перемішували протягом 30 хв. Потім до розчину при кімнатній температурі додавали гідрохлорид 2-[5-(3,4-дихлорфеніл)фуран-2іл]етиламіну (313 мг, 1,1 ммоль), розчинений в суміші сухого ДМФА (4 мл) і DIPEA (0,19 мл, 141 мг, 1,1 ммоль). Після перемішування протягом ночі додавали воду. Продукт екстрагували етилацетатом. Органічну фазу промивали водою, сушили і упарювали. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш CH2Cl2-MeOH як градієнтний елюент (100:0-95:5). Додаткове очищення здійснювали також за допомогою флеш-хроматографії, використовуючи суміш CH2Cl2-MeOH як градієнтний елюент (100:0-99,7:0,3). Продукт розтирали 1 в суміші гептан-CH2Cl2 при кімнатній температурі. H ЯМР (400 МГц, ДМСО-d6): 2,26 (3H, с), 2,92 (2H, т), 3,52 (2H, м), 3,76 (3H, с), 6,31 (1H, д), 6,38 (1H, с), 7,01 (1H, д), 7,60 (1H, спотворений дд), 7,64 (1H, спотворений д), 7,83 (1H, д), 8,09 (1H, т). Приклад 13 20 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-фуран-2-іл-1-феніл-1H-піразол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 12, виходячи з 5-(2-фурил)-1-феніл1H-піразол-3-карбонової кислоти і гідрохлориду 2-[5-(3,4-дихлорфеніл)фуран-2-іл]етиламіну. Сирий продукт двічі очищали за допомогою флеш-хроматографії, використовуючи спочатку суміш CH2Cl2-MeOH як градієнтний елюент (100:0-99:1). Потім здійснювали додаткове очищення 1 за допомогою флеш-хроматографії, використовуючи суміш гептан/EtOAc (8:2) як елюент. H ЯМР (400 МГц, ДМСО-d6): 2,96 (2H, т), 3,58 (2H, м), 6,16 (1H, д), 6,34 (1H, д), 6,51 (1H, дд), 7,01 (1H, д), 7,07 (1H, с), 7,45-7,48 (2H, м), 7,54-7,56 (4H, м), 7,61 (1H, спотворений дд), 7,73 (1H, д), 7,84 (1H, д), 8,49 (1H, т, 3J=5,9 Гц). Приклад 14 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1-метил-1H-індазол-3-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 12, виходячи з N-метиліндазол-3карбонової кислоти і гідрохлориду 2-[5-(3,4-дихлорфеніл)фуран-2-іл]етиламіну. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш гептан/EtOAc як 1 градієнтний елюент (9:1-8:2). H ЯМР (400 МГц, ДМСО-d6): 3,00 (2H, т), 3,64 (2H, м), 4,12 (3H, с), 6,36 (1H, д), 7,01 (1H, д), 7,26 (1H, м), 7,46 (1H, м), 7,600 (1H, с), 7,602 (1H, с), 7,72 (1H, д), 7,83 (1H, с), 8,16 (1H, д), 8,48 (1H, т). Приклад 15 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1H-імідазол-4-карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 12, виходячи з 4-імідазолкарбонової кислоти і гідрохлориду 2-[5-(3,4-дихлорфеніл)фуран-2-іл]етиламіну. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш CH2Cl2/MeOH як градієнтний елюент 1 (100:0-99,6:0,4). Продукт розтирали в етилацетаті. H ЯМР (400 МГц, ДМСО-d6): 2,93 (2H, т), 3,55 (2H, м), 6,33 (1H, д), 7,01 (1H, д), 7,59 (1H, с), 7,63 (2H, с), 7,71 (1H, с), 7,87 (1H, с), 8,05 (1H, ушир. с), 12,43 (1H, ушир. с). Приклад 16 Гідрохлорид {2-[5-(3,4-дихлорфеніл)фуран-2-іл]етил}аміду 2-Метил-1H-імідазол-4карбонової кислоти Вказану в заголовку сполуку отримували як в прикладі 12, виходячи з 2-метил-1H-імідазол4-карбонової кислоти і гідрохлориду 2-[5-(3,4-дихлорфеніл)фуран-2-іл]етиламіну. Сирий продукт очищали за допомогою флеш-хроматографії, використовуючи суміш CH2Cl2/MeOH як градієнтний елюент (100:0-97:3). Продукт розчиняли в DCM, додавали етилацетат, насичений хлористим воднем, і продукт, що випав в осад, фільтрували у вигляді гідрохлоридної солі. 1 Перекристалізація з суміші MeOH/EtOAc. HCl сіль: H ЯМР (400 МГц, MeOH-d4): 2,62 (3H, с), 3,02 (1H, т), 3,69 (1H, т), 6,26 (1H, д), 6,76 (1H, д), 7,49 (1H, спотворений д), 6,53 (1H, спотворений дд), 7,71 (1H, д), 7,82 (1H, с). Приклад 17 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1H-індазол-3-карбонової кислоти a) (Е)-2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етенамін До перемішуваного розчину 5-(3,4-дихлорфеніл)фурфуралю (1,18 г, 4,89 ммоль) в оцтовій кислоті (30 мл) додавали нітрометан (0,535 мл, 9,78 ммоль) і ацетат амонію (1,13 г, 14,7 ммоль). Реакційну суміш нагрівали при температурі 80 °C протягом 4,5 годин. Охолоджену реакційну суміш виливали в крижану воду (30 мл) і отриманим таким чином осад фільтрували, промивали 1 водою і сушили у вакуумі з отриманням 1,15 г (83 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 7,37 (д, 1H), 7,43 (д, 1H), 7,76 (д, 1H), 7,95 (дд, 1H), 8,03 (д, 1H), 8,19 (д, 1H), 8,31 (д, 1H). b) 2-(5-(3,4-дихлорфеніл)фуран-2-іл)етанамін До суспензії літійалюмінійгідриду (0,939 г, 24,8 ммоль) в ТГФ (20 мл) в атмосфері азоту при температурі 0 °C повільно додавали розчин (Е)-2-(5-(3,4-дихлорфеніл)фуран-2-іл)етенаміну в ТГФ (20 мл). Реакційну суміш перемішували при кімнатній температурі протягом 1 години. До суміші повільно додавали трохи метанолу, потім додавали воду. Суміш упарювали і твердий залишок екстрагували EtOAc (3(). Об'єднані EtOAc фракції промивали 2M розчином NaOH і насиченим сольовим розчином. Органічну фазу сушили над Na 2SO4, упарювали і очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 10-20 % 1 MeOH/DCM) з отриманням 227 мг (11 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6ДМСО): δ 2,74 (т, 2H), 2,85 (т, 2H), 6,29 (д, 1H), 7,03 (д, 1H), 7,62 (дд, 1H), 7,63 (д, 1H), 7,88 (д, 1H). c) {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1H-індазол-3-карбонової кислоти 21 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 Індазол-3-карбонову кислоту (30 мг; 0,182 ммоль), DCC (56 мг, 0,273 ммоль) і DMAP (2 мг) розчиняли в суміші DCM:ДМФА (1:1, 4 мл). Додавали 2-(5-(3,4-дихлорфеніл)фуран-2-іл)етанамін (46 мг, 0,182 ммоль) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Додавали DCM (30 мл), і органічний шар промивали водою (3×15 мл). Об'єднані органічні фази сушили над Na2SO4, упарювали і очищали за допомогою хроматографії (колонка з діоксидом кремнію, елюент: суміш 1 % MeOH/DCM) з отриманням 25 мг (34 %) вказаної в заголовку 1 сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 3,00 (т, 2H), 3,63 (кв, 2H), 6,37 (д, 1H), 7,02 (д, 1H), 7,23 (т, 1H), 7,41 (т, 1H), 7,60 (д, 1H), 7,61 (д, 2H), 7,85 (д, 1H), 8,16 (д, 1H), 8,54 (д, 1H), 13,56 (с, 1H). Приклад 18 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 5-трет-бутил-2H -піразол-3-карбонової кислоти Вказану в заголовку сполуки синтезували як в прикладі 17, виходячи з 5-трет-бутил-2H піразол-3-карбонової кислоти і 2-(5-(3,4-дихлорфеніл)фуран-2-іл)етанаміну. Сирий продукт очищали за допомогою хроматографії (колонка з діоксидом кремнію, елюент: суміш 3 % 1 MeOH/DCM) з отриманням 53 мг (33 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6ДМСО): δ 1,27 (с, 9H), 2,97 (т, 2H), 3,54 (кв, 2H), 6,33 (м, 1H), 6,39 (ушир. с, 1H), 7,02 (д, 1H), 7,62 (м, 2H), 7,86 (д, 1H), 8,20 (с, 1H), 12,88 (с, 1H). Приклад 19 3-трет-бутил-N-(1-(5-(3,4-дихлорфеніл)фуран-2-іл)пропан-2-іл)-1H-піразол-5-карбоксамід a) (Е)-1-(5-(3,4-Дихлорфеніл)фуран-2-іл)проп-1-ен-2-амін До перемішуваного розчину 5-(3,4-дихлорфеніл)фурфуралю (1,21 г, 5,0 ммоль) в оцтовій кислоті (15 мл) додавали нітроетан (0,720 мл, 10,0 ммоль) і ацетат амонію (1,16 г, 15,0 ммоль). Суміш перемішували при температурі 80 °C протягом ночі. Реакційну суміш виливали в крижану воду. Осад, що утворився, фільтрували, промивали водою і сушили у вакуумі з отриманням 1,38 1 г (93 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,62 (с, 3H), 7,37 (д, 1H), 7,46 (д, 1H), 7,79 (м, 2H), 7,98 (с, 1H), 8,09 (д, 1H). b) Гідрохлорид 1-(5-(3,4-дихлорфеніл)фуран-2-іл)пропан-2-аміну До розчину (Е)-1-(5-(3,4-Дихлорфеніл)фуран-2-іл)проп-1-ен-2-аміну (2,72 г, 9,12 ммоль) в MeOH (135 мл), EtOAc (100 мл) і 6,5 % HCl (гас) в MeOH (32 мл) додавали 10 % Pd/С (1,09 г). Суміш гідрували під тиском (3,3 бар, апарат Парра для гідрування) протягом 7 годин. Реакційну суміш фільтрували через целіт, упарювали і очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 5-20 % MeOH/DCM) з отриманням 0,811 г (29 %) 1 вказаної в заголовку сполуки у вигляді HCl солі. H-ЯМР (400 МГц; d6-ДМСО): δ 1,21 (д, 3H), 2,90 (дд, 1H), 3,04 (дд, 1H), 3,55 (кв, 1H), 6,44 (д, 1H), 7,09 (д, 1H), 7,68 (м, 2H), 7,93 (м, 1H). c) 3-Трет-бутил-N-(1-(5-(3,4-дихлорфеніл)фуран-2-іл)пропан-2-іл)-1H-піразол-5-карбоксамід 5-трет-бутил-2H-піразол-3-карбонову кислоту (94 мг; 0,55 ммоль) розчиняли в суміші DCM:ДМФА (4:1, 5 мл). Додавали DCC (172 мг; 0,83 ммоль). 1-(5-(3,4-Дихлорфеніл)фуран-2іл)пропан-2-амін (149 мг; 0,55 ммоль) розчиняли в 2 мл DCM і TEA (77 мкл, 0,55 ммоль) і отриманий розчин додавали в реакційну суміш. Реакційну суміш перемішували протягом ночі при кімнатній температурі. Потім додавали DCM (50 мл), і органічну фазу промивали водою (2×30 мл). Органічну фазу сушили над Na2SO4, упарювали і очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: 7,5-100 % EtOAc/гептан; 2-а колонки з діоксидом кремнію, елюент: суміш 0-5 % MeOH/DCM) з отриманням 35 мг (15 %) 1 вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 1,19 (д, 3H), 1,27 (с, 9H), 2,88 (дд, 1H), 2,98 (дд, 1H), 4,33 (квінтет, 1H), 6,29 (д, 1H), 6,33 (с, 1H), 7,00 (д, 1H), 7,60 (м, 2H), 7,83 (д, 1H), 7,89 (д, 1H), 12,84 (с, 1H). Приклад 20 N-(2-(5-(3,4-Дихлорфеніл)фуран-2-іл)етил)-3-(піридин-4-іл)-1H-піразол-5-карбоксамід До перемішуваного розчину 5-піридин-4-іл-4H-піразол-3-карбонової кислоти (1,78 г, 9,42 ммоль) в DCM (10 мл) додавали DIPEA (2,46 мл, 14,1 ммоль), EDCI (2,71 г, 9,42 ммоль) і HOBt (1,91, 14,1 ммоль). Гідрохлорид 2-(5-(3,4-дихлорфеніл)фуран-2-іл)етанаміну (2,75 г, 9,42 ммоль) розчиняли в DCM (15 мл) і DIPEA (1,64 мл, 9,42 ммоль). Отриманий розчин додавали в реакційну суміш, перемішували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли DCM і промивали насиченим водним розчином NaHCO 3 і водою. Органічну фазу сушили над Na2SO4, упарювали і очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент 0-15 % MeOH/DCM). Продукт, що містить фракції, збирали, упарювали і кристалізовували з DCM і перекристалізовували з суміші 2 % MeOH/DCM і гептану. 1 Таким чином отримували 1,18 г (29 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6ДМСО): δ 2,97 (т, 2H), 3,59 (кв, 2H), 6,35 (д, 1H), 7,03 (д, 1H), 7,33 (с, 1H), 7,62 (д, 2H), 7,75 (м, 2H), 7,84 (т, 1H), 8,57 (ушир. с, 1H), 8,63 (м, 2H), 13,95 (с, 1H). Приклад 21 22 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 3-трет-Бутил-N-(2-(5-(3,4-диціанофеніл)фуран-2-іл)етил)-1H-піразол-5-карбоксамід До перемішуваного розчину {2-[5-(3,4-дихлорфеніл)фуран-2-іл]етил}аміду 5-трет-бутил-2H піразол-3-карбонової кислоти за прикладом 18 (128 мг, 0,315 ммоль) в суміші ДМФА/вода (99:1, 1 мл) додавали ціанід цинку (81 мг, 0,693 ммоль), S-Phos (26 мг, 0,063 ммоль) і Pd2(dba)3 (23 мг, 0,025 ммоль). Реакційну суміш нагрівали за допомогою мікрохвильового реактора при температурі 150 °C протягом 40 хв. Додавали 1,0 M розчин NaOH (20 мл), і суміш екстрагували EtOAc (3×20 мл). Об'єднані органічні фази сушили над Na 2SO4, упарювали і очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію: елюент 0-100 % EtOAc/гептан; 2-а колонки С-18 RP: елюент 0-100 % MeCN/вода) з отриманням 25 мг (20 %) 1 вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 1,27 (с, 9H), 2,96 (т, 2H), 3,57 (кв, 2H), 6,35 (ушир. с, 1H), 6,44 (д, 1H), 7,31 (д, 1H), 8,07 (дд, 1H), 8,11 (д, 1H), 8,19 (ушир. с, 1H), 8,38 (д, 1H), 12,87 (ушир. с, 1H). Приклад 22 N-(2-(5-(3,4-дихлорфеніл)фуран-2-іл)етил)-3-метил-1H-піразол-5-карбоксамід Вказану в заголовку сполуку отримували, слідуючи способу за прикладом 20, виходячи з 3метил-1H-піразол-5-карбонової кислоти і гідрохлориду 2-(5-(3,4-дихлорфеніл)фуран-2іл)етанаміну. Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 0-100 % EtOAc/гептан) з отриманням 301 мг (28 %) вказаної в 1 заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,25 (с, 3H), 2,92 (т, 2H), 3,53 (кв, 2H), 6,32 (д, 1H), 6,34 (с, 1H), 7,01 (д, 1H), 7,63 (м, 2H), 7,85 (с, 1H), 8,16 (т, 1H), 13,86 (с, 1H). Приклад 23 N-(2-(5-(3,4-Диціанофеніл)фуран-2-іл)етил)-3-метил-1H-піразол-5-карбоксамід Вказану в заголовку сполуку отримували як в прикладі 21, але виходячи з N-(2-(5-(3,4дихлорфеніл)фуран-2-іл)етил)-3-метил-1H-піразол-5-карбоксаміду. Сирий продукт очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: суміш 0-10 % MeOH/DCM; 2-а колонка С-18 RP, елюент: суміш 0-100 % MeCN/вода) з отриманням 45 мг 1 (16 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,24 (с, 3H), 2,96 (т, 2H), 3,55 (кв, 2H), 6,35 (с, 1H), 6,43 (д, 1H), 7,31 (д, 1H), 8,07 (дд, 1H), 8,12 (д, 1H), 8,20 (ушир. с, 1H), 8,34 (д, 1H), 12,87 (с, 1H). Приклад 24 (S/R)-N-(1-(5-(3,4-Дихлорфеніл)фуран-2-іл)пропан-2-іл)-3-метил-1H-піразол-5-карбоксамід Вказану в заголовку сполуку отримували у вигляді рацемату, слідуючи способу за прикладом 19, але виходячи з 3-метил-1H-піразол-5-карбонової кислоти і гідрохлориду 1-(5-(3,4дихлорфеніл)фуран-2-іл)пропан-2-аміну. Таким чином отримували 79 мг (32 %) вказаної в заголовку сполуки. Енантіомери розділяли за допомогою хроматографії (SFC Minigram, Mettler Toledo) з отриманням 16 мг одного (оптична чистота 98,8 %) (= Сполука 24A) і 16 мг іншого (оптична чистота 98,3 %) (= Сполука 24B) енантіомера. Абсолютну конфігурацію розділених енантіомерів не визначали. 1 Сполука 24A: H-ЯМР (400 МГц; CDCl3): δ 1,26 (д, 3H), 2,34 (с, 3H), 2,91 (дд, 1H), 3,01 (дд, 1H), 4,52 (м, 1H), 6,20 (д, 1H), 6,56 (с, 1H), 6,57 (д, 1H), 7,12 (д, 1H), 7,38 (д, 1H), 7,41 (дд, 1H), 7,78 (д, 1H), 10,26 (с, 1H). 1 Сполука 24B: H-ЯМР (400 МГц; CDCl3): δ 1,26 (д, 3H), 2,34 (с, 3H), 2,91 (дд, 1H), 3,01 (дд, 1H), 4,52 (м, 1H), 6,20 (д, 1H), 6,56 (с, 1H), 6,57 (д, 1H), 7,12 (д, 1H), 7,38 (д, 1H), 7,41 (дд, 1H), 7,78 (д, 1H), 10,31 (с, 1H). Приклад 25 (S/R)-N-(1-(5-(3,4-Дихлорфеніл)фуран-2-іл)пропан-2-іл)-3-(піридин-4-іл)-1H-піразол-5карбоксамід Вказану в заголовку сполуку отримували у вигляді рацемату, слідуючи способу за прикладом 19, але виходячи з 5-піридин-4-іл-4H -піразол-3-карбонової кислоти і гідрохлориду 1(5-(3,4-дихлорфеніл)фуран-2-іл)пропан-2-аміну. Таким чином отримували 90 мг (31 %) вказаної в заголовку сполуки. Енантіомери розділяли за допомогою хроматографії (SFC Minigram, Mettler Toledo) з отриманням 16 мг одного (оптична чистота 100 %) (= Сполука 25A) і 11 мг іншого (оптична чистота 100 %) (= Сполука 25B) енантіомера. Абсолютну конфігурацію розділених енантіомерів не визначали. 1 Сполука 25A: H-ЯМР (400 МГц; d6-ДМСО): δ 1,24 (д, 3H), 2,95 (м, 2H), 4,35 (м, 1H), 6,31 (д, 1H), 7,00 (д, 1H), 7,35 (с, 1H), 7,58 (с, 2H), 7,73 (м, 2H), 7,93 (с, 1H), 8,33 (ушир. с, 1H), 8,63 (д, 2H), 13,88 (с, 1H). 1 Сполука 25B: H-ЯМР (400 МГц; d6-ДМСО): δ 1,24 (д, 3H), 2,95 (м, 2H), 4,35 (м, 1H), 6,31 (д, 1H), 7,00 (д, 1H), 7,35 (с, 1H), 7,58 (с, 2H), 7,73 (м, 2H), 7,79 (с, 1H), 8,33 (ушир. с, 1H), 8,63 (д, 2H), 13,88 (с, 1H). 23 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 26 {2-[5-(3,4-Дихлорфеніл)фуран-2-іл]етил}амід 1-(піридин-2-іл)-1H-Імідазол-4-карбонової кислоти Вказану в заголовку сполуки синтезували з {2-[5-(3,4-дихлорфеніл)фуран-2-іл]етил}аміду 1Hімідазол-4-карбонової кислоти за прикладом 15 і 2-бромпіридина за способом, описаному A. K. Verma et al. Тетраhedron Lett. 48 (2007) 4207. Очищення за допомогою флеш-хроматографії, використовуючи суміш CH2Cl2/MeOH як градієнтний елюент (100:0-99,9:0,1) давала продукт, 1 який розтирали в EtOAc при кімнатній температурі з отриманням бажаного продукту. H ЯМР (400 МГц, ДМСО-d6): 2,96 (2H, т), 3,59 (2H, м), 6,35 (1H, д), 7,03 (1H, д), 7,44 (1H, м), 7,63 (2H, с), 7,84 (1H, с), 7,95 (1H, спотворений д), 8,05 (1H, м), 8,33 (1H, т), 8,43 (1H, д), 8,54 (1H, м), 8,64 (1H, д, 4J=1,1 Гц). Приклад 27 N-(2-(3-(3,4-Дихлорфеніл)-1H-піразол-1-іл)етил)-3-метил-1H-піразол-5-карбоксамід a) 2-(2-(3-(3,4-Дихлорфеніл)-1H-піразол-1-іл)етил)ізоіндолін-1,3-діон До охолодженої (0 °C) суспензії гідриду натрію (96 мг, 2,4 ммоль) в ДМФА (1,0 мл) додавали 3-(3,4-дихлорфеніл)-1H-піразол (0,426 г, 2,0 ммоль) у вигляді розчину в ДМФА (2,0 мл). Реакційну суміш перемішували при кімнатній температурі протягом 45 хв. До охолодженої (0 °C) реакційної суміші додавали N-(2-брометил)фталімід (0,610 г, 2,4 ммоль) у вигляді розчину в ДМФА (1,0 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Додавали воду (100 мл), і суміш екстрагували DCM (3×50 мл). Об'єднані органічні фази сушили над Na2SO4 і очищали за допомогою хроматографії (CombiFlash, С-18 RP колонка, елюент: 1 суміш 0-100 % MeCN/вода) з отриманням 0,155 г (20 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 3,98 (т, 2H), 4,26 (т, 2H), 6,74 (д, 1H), 7,45 (дд, 1H), 7,50 (д, 1H), 7,55 (д, 1H), 7,82 (м, 5H). b) 2-(3-(3,4-Дихлорфеніл)-1H-піразол-1-іл)етанамін До перемішуваного розчину 2-(2-(3-(3,4-дихлорфеніл)-1H-піразол-1-іл)етил)ізоіндолін-1,3діону (155 мг, 0,40 ммоль) в EtOH (4,0 мл) додавали гідразингідрат (0,194 мл, 4,0 ммоль). Реакційну суміш кип'ятили із зворотним холодильником протягом 1 години і залишали охолоджуватися до кімнатної температури. Додавали воду (20 мл) і суміш екстрагували DCM (3×20 мл). Об'єднані органічні фази сушили над Na2SO4 і упарювали з отриманням кількісного виходу вказаної в заголовку сполуки (102 мг, 100 %). Продукт використовували на наступній стадії без аналізу.) c) N-(2-(3-(3,4-Дихлорфеніл)-1H-піразол-1-іл)етил)-3-метил-1H-піразол-5-карбоксамід До перемішуваного розчину 3-метил-1H-піразол-5-карбонової кислоти (104 мг, 0,83 ммоль) в DCM (2,0 мл) додавали DIPEA (0,144 мл, 0,83 ммоль), EDCI (159 мг, 0,83 ммоль) і HOBt (112 мг, 0,83 ммоль). Через 10 хв в реакційну суміш додавали 2-(3-(3,4-дихлорфеніл)-1H-піразол-1іл)етанамін (102 мг, 0,40 ммоль) у вигляді розчину в DCM (2,0 мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш розбавляли DCM і промивали насиченим водним розчином NaHCO3 і водою. Органічну фазу сушили над Na2SO4, упарювали і очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: суміш 0-10 % MeOH/DCM; 2-а колонка С-18 RP, елюент: суміш 0-100 % 1 MeCN/вода) з отриманням 65 мг (45 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6ДМСО): δ 2,24 (с, 3H), 3,64 (кв, 2H), 4,31 (т, 2H), 6,36 (с, 1H), 6,81 (д, 1H), 7,65 (д, 1H), 7,77 (д, 1H), 7,80 (дд, 1H), 8,00 (д, 1H), 8,23 (с, 1H), 12,88 (с, 1H). Приклад 28 N-(2-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)етил)-3-(піридин-4-іл)-1H-піразол-5карбоксамід a) 2-Метил-4-(1H-піразол-3-іла)бензонітрил Вказану в заголовку сполуки синтезували, слідуючи способу за прикладом 34(b), але виходячи з 4-бром-2-метилбензонітрилу і 1-(тетрагідро-2H-піран-2-іл)-5-(4,4,5,5-тетраметил1 1,3,2-діоксаборолан-2-іл)-1H-піразолу. H-ЯМР (400 МГц; CDCl3): δ 2,60 (с, 3H), 6,69 (д, 1H), 7,64 (м, 2H), 7,70 (д, 1H), 7,78 (с, 1H), 10,47 (ушир. с, 1H). b) 4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)етил)-1H-піразол-3-іл)-2-метилбензонітрил 2-метил-4-(1H-піразол-3-іла)бензонітрил (0,949 г, 5,2 ммоль) піддавали взаємодії з N-(2брометил)фталімідом (1,58 г, 6,2 ммоль), слідуючи способу за прикладом 27(a). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-100 % EtOAc/гептан) з отриманням 0,590 г (32 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,36 (с, 3H), 3,99 (т, 2H), 4,44 (т, 2H), 6,76 (д, 1H), 7,44 (с, 1H), 7,46 (м, 1H), 7,62 (д, 1H), 7,83 (м, 5H). c) 4-(1-(2-Аміноетил)-1H-піразол-3-іл)-2-метилбензонітрил 24 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)етил)-1H-піразол-3-іл)-2-метилбензонітрил (0,590 г, 1,66 ммоль) обробляли гідразингідратом, слідуючи способу за прикладом 27(b). Таким чином 1 отримували 362 мг (96 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,52 (с, 3H), 2,95 (т, 2H), 4,13 (т, 2H), 6,84 (д, 1H), 7,77 (м, 2H), 7,82 (д, 1H), 7,89 (м, 1H). d) N-(2-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)етил)-3-(піридин-4-іл)-1H-піразол-5карбоксамід Вказану в заголовку сполуки синтезували, виходячи з 5-піридин-4-іл-4H -піразол-3карбонової кислоти (303 мг, 1,60 ммоль) і 4-(1-(2-аміноетил)-1H-піразол-3-іл)-2метилбензонітрилу (362 мг, 1,60 ммоль), слідуючи способу за прикладом 34(d). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-20 % MeOH/DCM) з отриманням 44 мг (6 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,49 (с, 3H), 3,71 (кв, 2H), 4,37 (т, 2H), 6,84 (д, 1H), 7,31 (с, 1H), 7,74 (м, 2H), 7,70 (с, 1H), 7,79 (дд, 1H), 7,83 (д, 1H), 7,88 (с, 1H), 8,55 (ушир. с, 1H), 8,63 (м, 2H), 13,99 (с, 1H). Приклад 29 (S)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(піридин-4-іл)-1H-піразол5-карбоксамід a) (S)-4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)пропіл)-1H-піразол-3-іл)-2-метилбензонітрил 2-метил-4-(1H-піразол-3-іла)бензонітрил (2,35 г, 12,2 ммоль) піддавали взаємодії з (S)-2-(1бромпропан-2-іл)ізоіндолін-1,3-діоном (3,61 г, 13,5 ммоль), слідуючи способу за прикладом 27(a). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 0-100 % EtOAc/гептан) з отриманням 1,15 г (25 %) вказаної в заголовку 1 сполуки. H-ЯМР (400 МГц; CDCl3): δ 1,59 (д, 3H), 2,47 (с, 3H), 4,41 (м, 1H), 4,83 (м, 2H), 6,46 (д, 1H), 7,39 (м, 2H), 7,47 (м, 2H), 7,69 (м, 2H), 7,78 (м, 2H). b) (S)-4-(1-(2-амінопропіл)-1H-піразол-3-іл)-2-метилбензонітрил (S)-4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)пропіл)-1H-піразол-3-іл)-2-метилбензонітрил (481 мг, 1,3 ммоль) обробляли гідразингідратом, слідуючи способу за прикладом 27(b). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-20 % MeOH/DCM) з отриманням 59 мг (19 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 0,96 (д, 3H), 2,52 (с, 3H), 3,23 (м, 1H), 4,00 (м, 2H), 6,85 (д, 1H), 7,77 (м, 2H), 7,81 (д, 1H), 7,89 (м, 1H). c) (S)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(піридин-4-іл)-1Hпіразол-5-карбоксамід Вказану в заголовку сполуки синтезували, виходячи з 5-піридин-4-іл-4H -піразол-3карбонової кислоти (47 мг, 0,25 ммоль) і (S)-4-(1-(2-амінопропіл)-1H-піразол-3-іл)-2метилбензонітрилу (59 мг, 0,25 ммоль), слідуючи способу за прикладом 34(d). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-20 % MeOH/DCM) з отриманням 41 мг (40 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; MeOD): δ 1,24 (д, 3H), 2,52 (с, 3H), 4,32 (м, 2H), 4,53 (м, 1H), 6,59 (д, 1H), 7,15 (м, 1H), 7,36 (с, 2H), 7,53 (д, 1H), 7,58 (м, 2H), 7,70 (м, 2H), 8,53 (ушир. с, 1H), 8,56 (д, 1H). Приклад 30 (R)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(піридин-4-іл)-1H-піразол5-карбоксамід a) (R)-2-(1-Гідроксипропан-2-іл)ізоіндолін-1,3-діон D-Аланінол (3,90 мл, 50 ммоль) і ангідрид фталевої кислоти (7,41 г, 50 ммоль) нагрівали при температурі 160 °C протягом 30 хв. У охолоджену реакційну суміш додавали крижану воду і DCM. Органічну фазу збирали, і водну фазу екстрагували DCM. Об'єднані органічні фази 1 сушили над Na2SO4 і упарювали з отриманням 8,75 г (85 %) вказаної в заголовку сполуки. HЯМР (400 МГц; d6-ДМСО): δ 1,32 (д, 3H), 3,54 (м, 1H), 3,84 (м, 1H), 4,26 (м, 1H), 4,91 (м, 1H), 7,84 (м, 4H). b) (R)-2-(1-Бромпропан-2-іл)ізоіндолін-1,3-діон (R)-2-(1-гідроксипропан-2-іл)ізоіндолін-1,3-діон (8,75 г, 43 ммоль) і трибромід фосфору (2,73 мл, 29 ммоль) нагрівали при температурі 175 °C протягом 50 хв. У охолоджену реакційну суміш додавали лід (50 мл). Отриманим таким чином осад фільтрували, промивали водою і сушили у 1 вакуумі з отриманням 11,1 г (97 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 1,50 (д, 3H), 3,85 (м, 1H), 4,01 (м, 1H), 4,49 (м, 1H), 7,88 (м, 4H). c) (R)-4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)пропіл)-1H-піразол-3-іл)-2-метилбензонітрил 2-Метил-4-(1H-піразол-3-іла)бензонітрил (2,23 г, 12,2 ммоль) піддавали взаємодії з (R)-2-(1бромпропан-2-іл)ізоіндолін-1,3-діоном (3,92 г, 14,6 ммоль), слідуючи способу за прикладом 27(a). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом 25 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 60 кремнію, елюент: суміш 0-100 % EtOAc/гептан) з отриманням 0,753 г (17 %) вказаної в заголовку сполуки. Продукт використовували на наступній стадії без аналізу. d) (R)-4-(1-(2-амінопропіл)-1H-піразол-3-іл)-2-метилбензонітрил (R)-4-(1-(2-(1,3-Діоксоізоіндолін-2-іл)пропіл)-1H-піразол-3-іл)-2-метилбензонітрил (753 мг, 2,0 ммоль) обробляли гідразингідратом, слідуючи способу за прикладом 27(b). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-20 % MeOH/DCM) з отриманням 82 мг (17 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 0,96 (д, 3H), 2,52 (с, 3H), 3,22 (м, 1H), 3,99 (м, 2H), 6,84 (д, 1H), 7,77 (м, 2H), 7,81 (д, 1H), 7,89 (м, 1H). e) (R)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(піридин-4-іл)-1Hпіразол-5-карбоксамід Вказану в заголовку сполуку синтезували, виходячи з 5-піридин-4-іл-4H -піразол-3карбонової кислоти (13 мг, 0,069 ммоль) і (R)-4-(1-(2-амінопропіл)-1H-піразол-3-іл)-2метилбензонітрилу (17 мг, 0,071 ммоль), слідуючи способу за прикладом 34(d). Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 1 0-20 % MeOH/DCM) з отриманням 19 мг (67 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 1,17 (д, 3H), 2,48 (с, 3H), 4,31 (м, 2H), 4,47 (м, 1H), 6,82 (д, 1H), 7,31 (с, 1H), 7,75 (м, 4H), 7,81 (д, 1H), 7,85 (с, 1H), 8,40 (д, 1H), 8,63 (м, 2H), 13,92 (ушир. с, 1H). Приклад 31 N-(2-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)етил)-3-метил-1H-піразол-5-карбоксамід Вказану в заголовку сполуки синтезували, слідуючи способу за прикладом 28(d), виходячи з 3-метил-1H-піразол-5-карбонової кислоти. Сирий продукт очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: суміш 0-15 % MeOH/DCM; 2-а колонка С18 RP, елюент: суміш 0-100 % MeCN/вода) з отриманням 39 мг (42 %) вказаної в заголовку 1 сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 2,24 (с, 3H), 2,52 (с, 3H), 3,65 (кв, 2H), 4,33 (т, 2H), 6,36 (с, 1H), 6,83 (д, 1H), 7,79 (м, 3H), 7,88 (с, 1H), 8,24 (ушир. с, 1H), 12,85 (ушир. с, 1H). Приклад 32 (S)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(фуран-2-іл)-1H-піразол-5карбоксамід Вказану в заголовку сполуки синтезували, слідуючи способу за прикладом 29, але замінюючи 5-піридин-4-іл-4H-піразол-3-карбонову кислоту на 5-(2-фурил)-4H-піразол-3карбонову кислоту. Сирий продукт очищали за допомогою хроматографії (CombiFlash, колонка з діоксидом кремнію, елюент: суміш 0-100 % EtOAc/гептан) з отриманням 39 мг (75 %) вказаної в 1 заголовку сполуки. H-ЯМР (400 МГц; d6-ДМСО): δ 1,14 (д, 3H), 2,49 (с, 3H), 4,30 (м, 2H), 4,45 (м, 1H), 6,61 (м, 1H), 6,80 (с, 1H), 6,82 (д, 1H), 6,91 (с, 1H), 7,76 (м, 3H), 7,80 (д, 1H), 7,85 (с, 1H), 8,36 (д, 1H), 13,69 (с, 1H). Приклад 33 (R)-N-(1-(3-(4-Ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2-іл)-3-(морфолін-4-карбоніл)-1Hпіразол-5-карбоксамід Вказану в заголовку сполуки синтезували, слідуючи способу за прикладом 30, але замінюючи 5-піридин-4-іл-4H-піразол-3-карбонову кислоту на 3,5-піразолдикарбонову кислоту. Отриману таким чином (R)-5-(1-(3-(4-ціано-3-метилфеніл)-1H-піразол-1-іл)пропан-2ілкарбамоїл)-1H-піразол-3-карбонову кислоту конденсували з морфоліном згідно з способом синтезу {2-[5-(3,4-дихлорфеніл)фуран-2-іл]етил}аміду 5-(піперазин-1-карбоніл)-2H-піразол-3карбонової кислоти, приклад 1, але замінюючи піперазин на морфолін. Сирий продукт очищали за допомогою хроматографії (CombiFlash, 1-а колонки з діоксидом кремнію, елюент: суміш 010 % MeOH/DCM; 2-а колонка С-18 RP, елюент: суміш 0-100 % MeCN/вода) з отриманням 24 мг 1 (45 %) вказаної в заголовку сполуки. H-ЯМР (400 МГц; CDCl3): δ 1,25 (д, 3H), 2,60 (с, 3H), 3,79 (м, 8H), 4,29 (дд, 1H), 4,42 (дд, 1H), 4,60 (м, 1H), 6,61 (д, 1H), 7,02 (с, 1H), 7,47 (д, 1H), 7,63 (м, 2H), 7,72 (д, 1H), 7,79 (с, 1H), 11,09 (с, 1H). Приклад 34 (S)-3-ацетил-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол-5карбоксамід a) 2-хлор-4-(1-(тетрагідро-2H-піран-2-іл)-1H-піразол-5-іл)бензонітрил 1-(Тетрагідро-2H-піран-2-іл)-5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2-іл)-1H-піразол (6,5 г; 23,28 ммоль) і 4-бром-2-хлорбензонітрил (4 г; 18,48 ммоль) розчиняли в ТГФ (65 мл). До цієї суміші додавали хлорид біс(трифенілфосфін)паладію(II) (0,65 г; 0,92 ммоль), карбонат натрію (4,7 г; 44,3 ммоль) і 18 мл води, і реакційну суміш перемішували при температурі 35 °C протягом 2,5 годин. Розчинники відганяли майже досуха і додавали воду (48 мл). Через 30 хв перемішування продукт, що випав в осад фільтрували і до осаду додавали 32 мл етанолу. 26 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 Суспензію перемішували протягом 15 хв при кімнатній температурі і 30 хв при температурі 1 10 °C, потім фільтрували з отриманням 3,7 г продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 1,63-1,54 (м, 3H), 1,84-1,80 (м, 1H), 1,97-1,94 (м, 1H), 2,39-2,35 (м, 1H), 3,63-3,57 (м, 1H), 3,99 (м, 1H), 5,325,27 (м, 1H), 6,72 (д, 1H), 7,65 (д, 1H), 7,72 (м, 1H), 7,92 (д, 1H), 8,14 (д, 1H). b) 2-хлор-4-(1H-піразол-5-іл)бензонітрил 2-хлор-4-(1-(тетрагідро-2H-піран-2-іл)-1H-піразол-5-іл)бензонітрил (3,67 г; 12,75 ммоль) в атмосфері азоту додавали до 8 мл етанолу. Повільно додавали 15,5 мл ~10 % HCl (гас) в EtOH і температуру підвищували до 30 °C при перемішуванні суміші протягом 1 години. Температуру потім знижували до -10 °C і суміш знову перемішували протягом 30 хв, після чого продукт випадав у вигляді осаду HCl солі, і фільтрували і два рази промивали 2 мл етанолу. Продукт сушили у вакуумі при температурі +40 °C. Вихід 2,8 м. У суміш 8 мл води і 14 мл MeOH в атмосфері азоту додавали гідрохлорид 2-хлор-4-(1H-піразол-5-іл)бензонітрилу (2,8 г; 11,47 ммоль). До суміші додавали 50 %-й гідроксид натрію (1,5 мл; 28,7 ммоль), підтримуючи температуру в процесі додавання нижче за 25 °C. Суміш перемішували протягом 2 годин, осад фільтрували і два рази промивали 3 мл теплуватої води. Продукт сушили у вакуумі при 1 температурі при температурі +40 °C. Вихід 1,97 м. H-ЯМР (400 МГц; d6-ДМСО): δ 6,99 (т, 1H), 7,89 (м, 1H), 7,99 (д, 2H), 8,15 (с, 1H), 13,27 (с, 1H). c) (S)-4-(1-(2-амінопропіл)-1H-піразол-3-іл)-2-хлорбензонітрил 2-хлор-4-(1H-піразол-3-іл)бензонітрил (4,00 г; 19,64 ммоль), (S)-трет-бутил-1-гідроксипропан2-іл карбамат (3,79 г; 21,61 ммоль) і трифенілфосфін розчиняли в сухому ТГФ в атмосфері азоту і перемішували. Додавали по краплях діізопропілазодикарбоксилат (7,74 мл; 39,3 ммоль), і реакційну колбу охолоджували на крижаній бані. Реакційну суміш перемішували при кімнатній температурі протягом ночі (18 годин) і упарювали досуха. Для видалення захисної Boc групи до залишку після упарювання додавали 200 мл розчину 10 % HCl/EtOH, перемішували протягом 20 годин при кімнатній температурі і упарювали досуха. До залишку після упарювання додавали 100 мл води і промивали 3×120 мл DCM для видалення залишків реагентів. pH водної фази встановлювали таким, що дорівнює ~12, шляхом додавання 2M розчину NaOH, промивали 3×80 мл DCM, і органічну фазу сушили над Na2SO4. Органічну фазу фільтрували і упарювали з отриманням 2,605 г вказаної в заголовку сполуки. d) (S)-3-ацетил-N-(1-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)пропан-2-іл)-1H-піразол-5карбоксамід 3-ацетил-1H-піразол-5-карбонову кислоту (0,59 г; 3,84 ммоль) і DIPEA (1,0 мл; 5,75 ммоль) розчиняли в 4 мл сухого DCM. Додавали при кімнатній температурі безводний HOBt (0,78 г; 5,75 ммоль) і EDCI (1,10 г; 5,75 ммоль). У 4 мл DCM розчиняли (S)-4-(1-(2-амінопропіл)-1H-піразол-3іл)-2-хлорбензонітрил (1,00 г; 3,84 ммоль) і реакційну суміш перемішували протягом ночі при кімнатній температурі. Додавали 40 мл DCM і органічний шар промивали 3×15 мл води. Об'єднані водні фази промивали 2×20 мл DCM. Обидві органічні фази сушили над Na 2SO4, фільтрували і упарювали досуха. Обидві фракції сирого продукту об'єднували і очищали за допомогою CombiFlash (2 % MeOH в DCM). Продукт об'єднували і упарювали з отриманням 497 1 мг продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 1,16 (д, 3H, J=6,7 Гц), 2,49 (с, 3H), 4,31 (м, 2H), 4,46 (септет, 1H, J=6,7 Гц), 6,93 (д, 1H, J=2,4 Гц), 7,31 (с, 1H), 7,81 (д, 1H, J=2,4 Гц), 7,92 (д, 1H, J=7,9 Гц), 7,97 (д, 1H, J=8,1 Гц), 8,03 (д, 1H, J=1,3 Гц), 8,48 (д, 1H, J=8,5 Гц), 14,16 (с, 1H). Приклад 35 N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-(морфолін-4-карбоніл)піразин-2карбоксамід a) 4-(1-(2-Аміноетил)-1H-піразол-3-іл)-2-хлорбензонітрил Вказану в заголовку сполуку отримували, слідуючи способу за прикладом 34(с), виходячи з 2,3 г гідрохлориду 2-хлор-4-(1H-піразол-5-іл)бензонітрилу, 1,7 мл DIPEA і 1,7 г трет-бутил 21 гідроксіетилкарбамату, отримуючи 2,08 г продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 1,56 (с, 2H), 2,97 (т, 2H), 4,13-4,17 (т, 2H), 6,97 (с, 1H), 7,87 (д, 1H), 7,93-8,02 (м, 2H), 8,10 (д, 1H). b) 5-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етилкарбамоїл)піразин-2-карбонова кислота Піразин-2,5-дикарбонову кислоту (0,53 г; 3,18 ммоль), безводний HOBt (0,43 г; 3,18 ммоль), гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,61 г; 3,18 ммоль) і DIPEA (0,55 мл; 3,18 ммоль) розчиняли в 5 мл сухого DCM. У 5 мл сухого DCM розчиняли 4-(1-(2-аміноетил)-1Hпіразол-3-іл)-2-хлорбензонітрил (0,6 г; 2,12 ммоль) і DIPEA (0,55 мл; 3,18 ммоль) і додавали по краплях до попередньої суміші. Реакційну суміш перемішували протягом ночі, після чого додавали піразин-2,5-дикарбонову кислоту (0,27 г; 1,59 ммоль), безводний HOBt (0,52 г; 3,81 ммоль), гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,41 г; 2,12 ммоль) і DIPEA (0,37 мл; 2,12 ммоль) для доведення реакції до завершення. Через 2,5 години суміш 27 UA 109535 C2 5 10 15 20 25 30 35 40 45 50 55 розбавляли 20 мл DCM. Після додавання 10 мл води продукт осаджували у вигляді осаду і фільтрували, отримуючи 0,42 г сирих продукти, які використовували без додаткового очищення. c) N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-(морфолін-4-карбоніл)піразин-2карбоксамід 5-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етилкарбамоїл)піразин-2-карбонову кислоту (0,11 г; 0,29 ммоль), гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,083 г; 0,43 ммоль), безводний HOBt (0,058 г; 0,43 ммоль), DIPEA (0,075 мл; 0,43 ммоль) і морфолін (0,025 г; 0,29 ммоль) розчиняли в 5 мл сухого DCM і перемішували протягом ночі. Розчин розбавляли 10 мл DCM і промивали 3×5 мл води. Об'єднані водні фази екстрагували за допомогою 2×5 мл DCM, і об'єднані органічні фази сушили над Na2SO4, фільтрували і упарювали досуха. Продукт очищали, використовуючи флеш-хроматографію і суміш DCM/MeOH як градієнтний елюент. 1 Вихід 0,06 м. H-ЯМР (400 МГц; d6-ДМСО): δ 3,45 (т, 2H), 3,56 (т, 2H), 3,69 (с, 4H), 3,76-3,80 (м, 2H), 4,42 (т, 2H), 6,97 (д, 1H), 7,87 (д, 1H), 7,94-8,01 (м, 2H), 8,01 (с, 1H), 8,93 (д, 1H), 9,13 (с, 1H), 9,22-9,25 (т, 1H). Приклад 36 N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-оксо-1-феніл-2,5-дигідро-1H-піразол-3карбоксамід a) Метил 5-оксо-1-феніл-2,5-дигідро-1H-піразол-3-карбоксилат Фенілгідразин (0,5 г; 4,62 ммоль), диметиловий ефір ацетилендикарбонової кислоти (0,66 г; 4,62 ммоль) і сіль піридин і 4-толуолсульфонової кислоти (1,16 г; 4,62 ммоль) розчиняли в 7 мл сухого ТГФ в атмосфері азоту, і розчин перемішували протягом 2 годин при кімнатній температурі, після чого додавали 7 мл 10 % розчину HCl (гас) в EtOAc, і суміш нагрівали при температурі 67 °C протягом 5 годин. Реакційну суміш упарювали досуха і до залишку додавали 6 мл DCM. Органічну фазу промивали 8 мл води, і об'єднані водні фази екстрагували за допомогою 2×6 мл DCM. Об'єднані органічні фази промивали один раз 12 мл води, сушили над Na2SO4, фільтрували і упарювали досуха з отриманням 0,35 г продукту, який використовували як такий без додаткового очищення. b) 5-Оксо-1-феніл-2,5-дигідро-1H-піразол-3-карбонова кислота Метил 5-оксо-1-феніл-2,5-дигідро-1H-піразол-3-карбоксилат (0,35 г; 1,60 ммоль) в 5 мл 2M розчину NaOH нагрівали при температурі 60 °C протягом 2 годин, після чого реакційну суміш підкисляли 1,5 мл концентрованої HCl, що спричиняло утворення продукту у вигляді осаду 1 жовтого кольору. Фільтрування давало 0,18 г продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 5,97 (с, 1H), 7,33-7,37 (м, 1H), 7,48-7,52 (м, 2H), 7,74 (м, 2H). c) N-(2-(3-(3-хлор-4-ціанофеніл)-1H-піразол-1-іл)етил)-5-оксо-1-феніл-2,5-дигідро-1H-піразол3-карбоксамід 5-Оксо-1-феніл-2,5-дигідро-1H-піразол-3-карбонову кислоту (0,05 г; 0,24 ммоль), HOBt (0,049 г; 0,37 ммоль) і гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодііміду (0,07 г; 0,37 ммоль) додавали до 2,5 мл DCM. До цієї суміші додавали по краплях 4-(1-(2-аміноетил)-1H-піразол-3іл)-2-хлорбензонітрил (0,06 г; 0,24 ммоль) і DIPEA (0,064 мл; 0,37 ммоль), і суміш перемішували протягом ночі, після чого додавали 10 мл DCM. Суміш промивали 3×5 мл води, і об'єднані водні фази екстрагували за допомогою 2×5 мл DCM. Об'єднані органічні шари сушили над Na 2SO4, фільтрували і упарювали досуха. Продукт очищали за допомогою флеш-хроматографії, використовуючи суміш DCM/MeOH як градієнтний елюент. Об'єднані фракції давали 18 мг 1 продукту. H-ЯМР (400 МГц; d6-ДМСО): δ 1,23 (с, 1H), 3,65-3,70 (м, 2H), 4,37 (т, 2H), 5,83 (с, 1H), 6,97 (д, 1H), 7,31-7,35 (т, 1H), 7,45-7,49 (т, 2H), 7,76 (д, 2H), 7,85-7,89 (м, 2H), 7,94-7,96 (м, 1H), 8,09 (д, 1H), 8,28 (м, 1H). Приклад 37 3-Метил-N-(2-(3-(8-нітроізохінолін-5-іл)-1H-піразол-1-іл)етил)-1H-піразол-5-карбоксамід a) 8-Нітро-5-(1-(тетрагідро-2H-піран-2-іл)-1H-піразол-5-іл)ізохінолін Вказану в заголовку сполуку отримували, слідуючи способу за прикладом 34(a), виходячи з 1 0,5 г 5-бром-8-нітроізохіноліну. Вихід 0,49 м. H-ЯМР (400 МГц; d6-ДМСО): δ 1,43-1,51 (м, 3H), 1,80-1,89 (м, 2H), 2,32-2,33 (м, 1H), 3,25-3,27 (м, 1H), 3,76-3,78 (м, 1H), 5,06 (д, 1H), 6,65 (д, 1H), 6,68 (д, 1H), 7,78 (д, 1H), 8,02 (д, 1H), 8,54 (д, 1H), 8,72 (д, 1H), 9,84 (с, 1H). b) 8-Нітро-5-(1H-піразол-5-іл)ізохінолін Вказану в заголовку сполуку синтезували, виходячи з 8-нітро-5-(1-(тетрагідро-2H-піран-2-іл)1 1H-піразол-5-іл)ізохіноліну (0,49 г), слідуючи способу за прикладом 34(b). Вихід 0,35 м. H-ЯМР (400 МГц; d6-ДМСО): δ 6,92 (д, 1H), 8,00 (ушир. с, 1H), 8,18 (д, 1H), 8,48 (д, 1H), 8,75 (д, 1H), 8,87 (ушир. с, 1H), 9,84 (с, 1H), 13,50 (ушир. с, 1H). c) 2-(3-(Ізохінолін-5-іл)-1H-піразол-1-іл)етанамін 28
ДивитисяДодаткова інформація
Автори англійськоюWohlfahrt, Gerd, Tormakangas, Olli, Salo, Harri, Hoglung, Lisa, Karjalainen, Arja, Knuuttila, Pia, Holm, Patrik, Rasku, Sirpa, Vesalainen, Anniina
Автори російськоюВольфарт Герд, Термякангас Олли, Сало Харри, Хеглунд Ииса, Карьялайнен Арья, Кнууттила Пиа, Хольм Патрик, Раску Сирпа, Весалайнен Анниина
МПК / Мітки
МПК: A61K 31/5377, C07D 401/12, A61K 31/497, C07D 405/12, A61K 31/42, C07D 413/12, C07D 231/14, A61K 31/416, A61K 31/44, C07D 403/12, A61K 31/438, C07D 417/12, A61K 31/4523, A61P 35/00
Мітки: гетероциклічні, спосіб, композиція, фармацевтична, лікування, основі, захворювань, рецептори, андрогенові, модулюють, карбоксаміди
Код посилання
<a href="https://ua.patents.su/122-109535-geterociklichni-karboksamidi-yaki-modulyuyut-androgenovi-receptori-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-likuvannya-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Гетероциклічні карбоксаміди, які модулюють андрогенові рецептори, фармацевтична композиція на їх основі та спосіб лікування захворювань</a>
Попередній патент: Співкристали трамадолу і коксибів
Наступний патент: Спосіб та пристрій для конденсації пари металів та інших речовин
Випадковий патент: Багатопостова установка для складання та розбирання колісних транспортних засобів