Похідні окса- та тіадіазолу, спосіб їх одержання (варіанти), фармацевтична композиція
Номер патенту: 61068
Опубліковано: 17.11.2003
Автори: Басс Роберт Джон, Вуд Ентоні, Маккензі Александр Родерік
Формула / Реферат
1. Соединение формулы
, (I)
где R1 представляет собой С1-С6алкил, гало(С1-С6алкил), C3-С7циклоалкил, С2-С6алкинил, гидрокси(С2-С6алкинил), (С1-С4алкокси)(С2-С6алкинил), арил, арил(С1-С4алкил), гетероарил или гетероарил(С1-С4алкил);
R2 представляет собой Н или С1-С4алкил;
R3 представляет собой арил, гетероарил, 2,3-дигидробензофуранил или С4-С7циклоалкил;
Х = О или S; а
Y представляет собой прямую связь, -СН2-, -(СН2)2- или –СН2О-;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором арильная группа представляет собой фенил или нафтил, каждый из которых необязательно имеет до трех заместителей и независимо выбран из С1-С4алкила, С1-С4алкоксила, гидроксила, галогена и трифторметила.
3. Соединение по п. 2, в котором арильную группу выбирают из фенила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из С1-С4алкила, С1-С4алкоксила, гидроксила, галогена и трифторметила; а также нафтила.
4. Соединение по п. 3, в котором арильная группа представляет собой фенил, фторфенил, дихлорфенил, гидроксифенил, метоксифенил или нафтил.
5. Соединение по любому из предшествующих пунктов, в которых гетероарильная группа представляет собой тиенил, пиридил, тиазолил, бензотиазолил, тиадиазолил, пиразолил или пиримидинил, каждый из которых необязательно замещен одним или двумя заместителями и независимо выбран из С1-С4алкила, С1-C4алкоксила, гидроксила и галогена.
6. Соединение по п. 5, в котором гетероарильная группа представляет собой тиенил, пиридил, тиазолил или бензотиазолил.
7. Соединение по любому из предшествующих пунктов, в которых R1 представляет собой С1-С6алкил, пентафторэтил, C4-C6циклоалкил, этинил, -CC-CH2OH, -CC-(СН2)4-OH; фенильную группу, необязательно замещенную одним или двумя заместителями, каждый из которых независимо выбран из галогена, С1-C4алкила, С1-С4алкоксила и гидроксила; нафтил или гетероциклическую группу, выбранную из тиенила, пиридила, тиазолила и бензотиазолила, каждый из которых необязательно замещен галогеном, С1-С4алкилом, С1-С4алкоксилом или гидроксилом.
8. Соединение по любому из предшествующих пунктов, в которых R2 представляет собой Н или СН3.
9. Соединение по любому из предшествующих пунктов, в которых R3 представляет собой фенил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена, С1-С4алкила, С1-С4алкоксила и гидроксила; 2,3-дигидробензофуранил; С4-С7циклоалкил или тиенил.
10. Соединение по любому из предшествующих пунктов, в которых Х = О.
11. Соединение по любому из предшествующих пунктов, в которых Y представляет собой прямую связь, -СН2- или -СН2О-.
12. Соединение по п. 1, представляющее собой 3-(1-циклобутил-1-фенил-1-гидроксиметил)-5-[4-(1-бензилпиперидинил)]-1,2,4-оксадиазол или (+)-3-(1-циклобутил-1-фенил-1-гидроксиметил)-5-[4-(1-бензилпиперидинил)]-1,2,4-оксадиазол.
13. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по любому из предшествующих пунктов и фармацевтически приемлемый разбавитель или носитель.
14. Соединение формулы (II)
,(II)
где X, Y, R2 и R3 имеют значения, указанные в п. 1.
15. Способ получения соединения формулы (1) по п. 1 или его фармацевтически приемлемой соли, отличающийся тем, что проводят реакцию соединения формулы (II) по п. 14 с реактивом Гриньяра, литийорганическим или церийорганическим соединением формулы:
R1MgHal, R1Li или R1-CeCl2,
где Hal = Cl или Br , а R1 имеет значения, указанные в п. 1, в органическом растворителе; при этом указанный способ также необязательно включает превращение продукта формулы (I) в фармацевтически приемлемую соль.
16. Способ по п. 15, отличающийся тем, что используют реагент формулы R1MgBr или R1Li, при этом R1 имеет значения, указанные в п. 15.
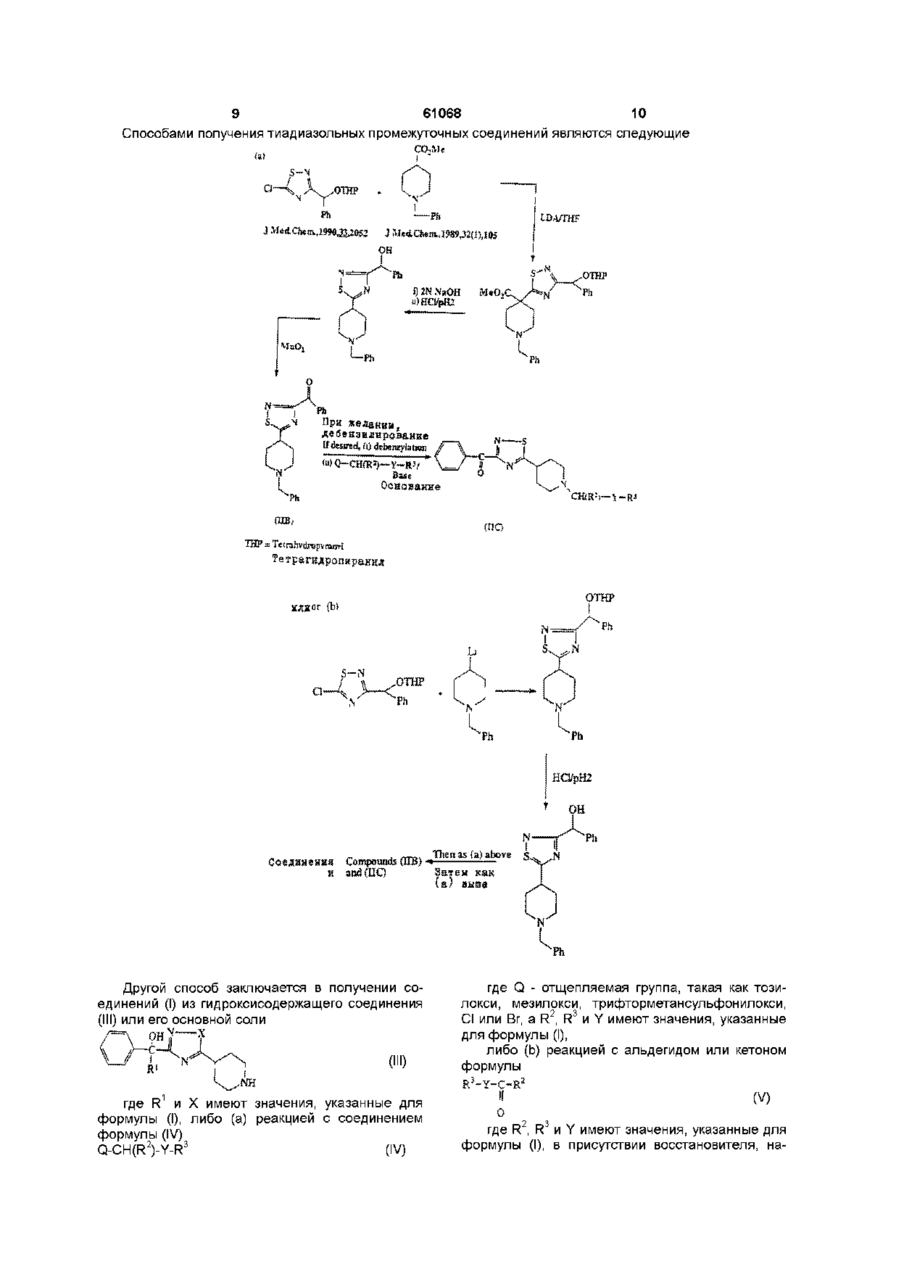
17. Способ получения соединения формулы (I) по п. 1 или его фармацевтически приемлемой соли, отличающийся тем, что проводят реакцию соединения формулы (III) или его основной соли
, (III)
где R1 и Х имеют значения, указанные в п. 1,
либо (а) с соединением формулы (IV):
Q-CH(R2)-Y-R3, (IV)
где Q - отщепляемая группа, a R2, R3 и Y имеют значения, указанные в п. 1;
либо (b) с альдегидом или кетоном формулы
, (V)
где R2, R3 и Y имеют значения, указанные в п. 1, в присутствии восстановителя и в органическом растворителе; при этом указанный способ также необязательно включает превращение продукта формулы (1) в фармацевтически приемлемую соль.
18. Способ по п. 17, отличающийся тем, что отщепляемая группа представляет собой тозилокси, мезилокси, трифторметансульфонилокси, Сl или Br и в котором восстановитель представляет собой триацетоксиборгидрид или цианоборгидрид натрия.
19. Способ по п. 17 или 18, отличающийся тем, что в (а) используют свободное основание соединения (III) и реакцию проводят в присутствии акцептора кислоты.
20. Способ по п. 19, отличающийся тем, что акцептор кислоты представляет собой бикарбонат натрия или этилдиизопропиламин.
21. Способ по любому из пп. 15 - 20, отличающийся тем, что получают соединения по любому из пп. 2 - 12.
22. Способ по п. 15 получения соединения 3-(1-циклобутил-1-фенил-1-гидроксиметил)-5-[4-(1-бензилпиперидинил)]-1,2,4-оксадиазола, отличающийся тем, что бромид циклобутилмагния подвергают взаимодействию с 3-бензоил-5-[4-(1-бензилпиперидинил)]-1,2,4-оксадиазолом, необязательно с последующим разделением указанного соединения на его (+) и (-) энантиомеры.
23. Способ по п. 22, отличающийся тем, что разделение осуществляют с помощью ЖХВР.
Текст
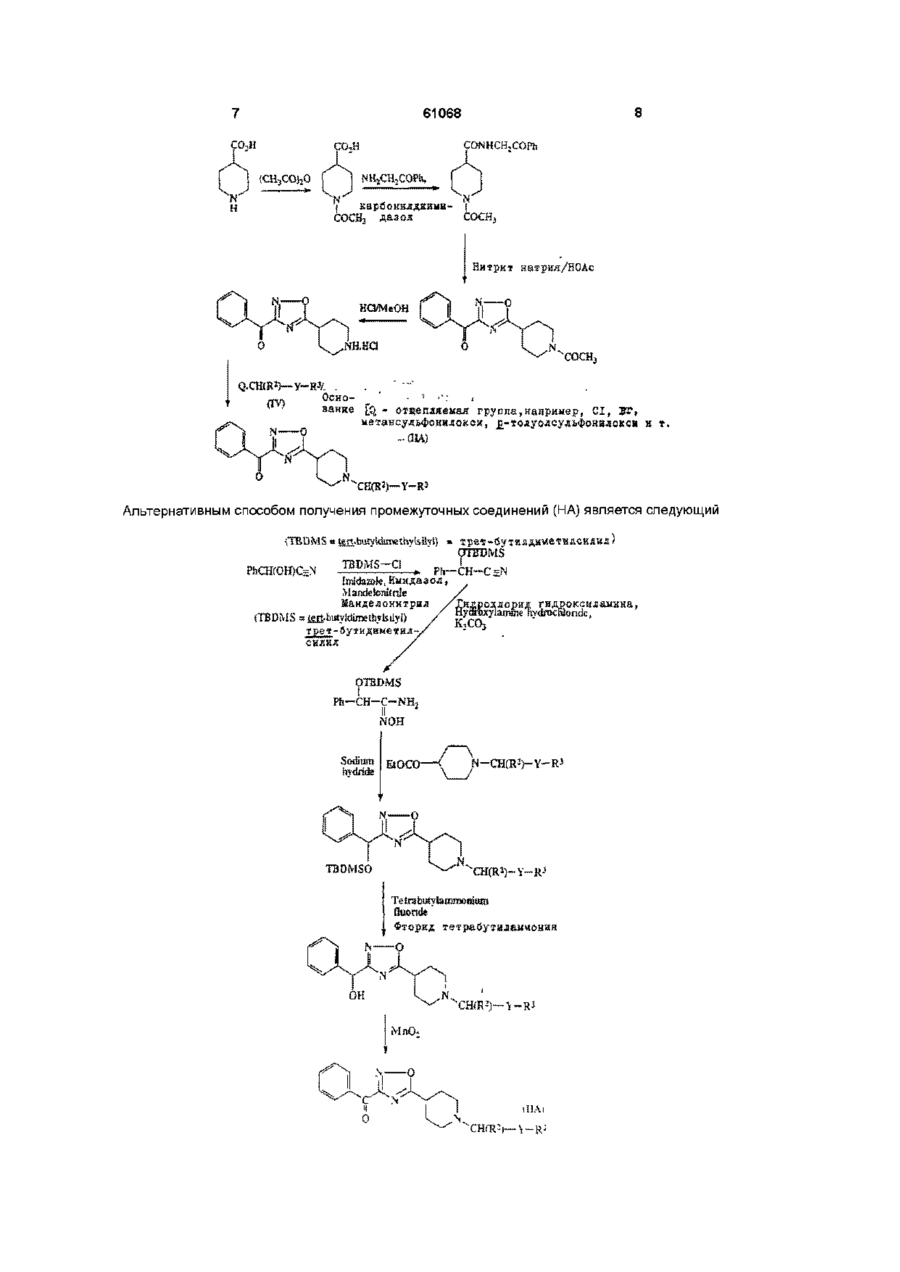
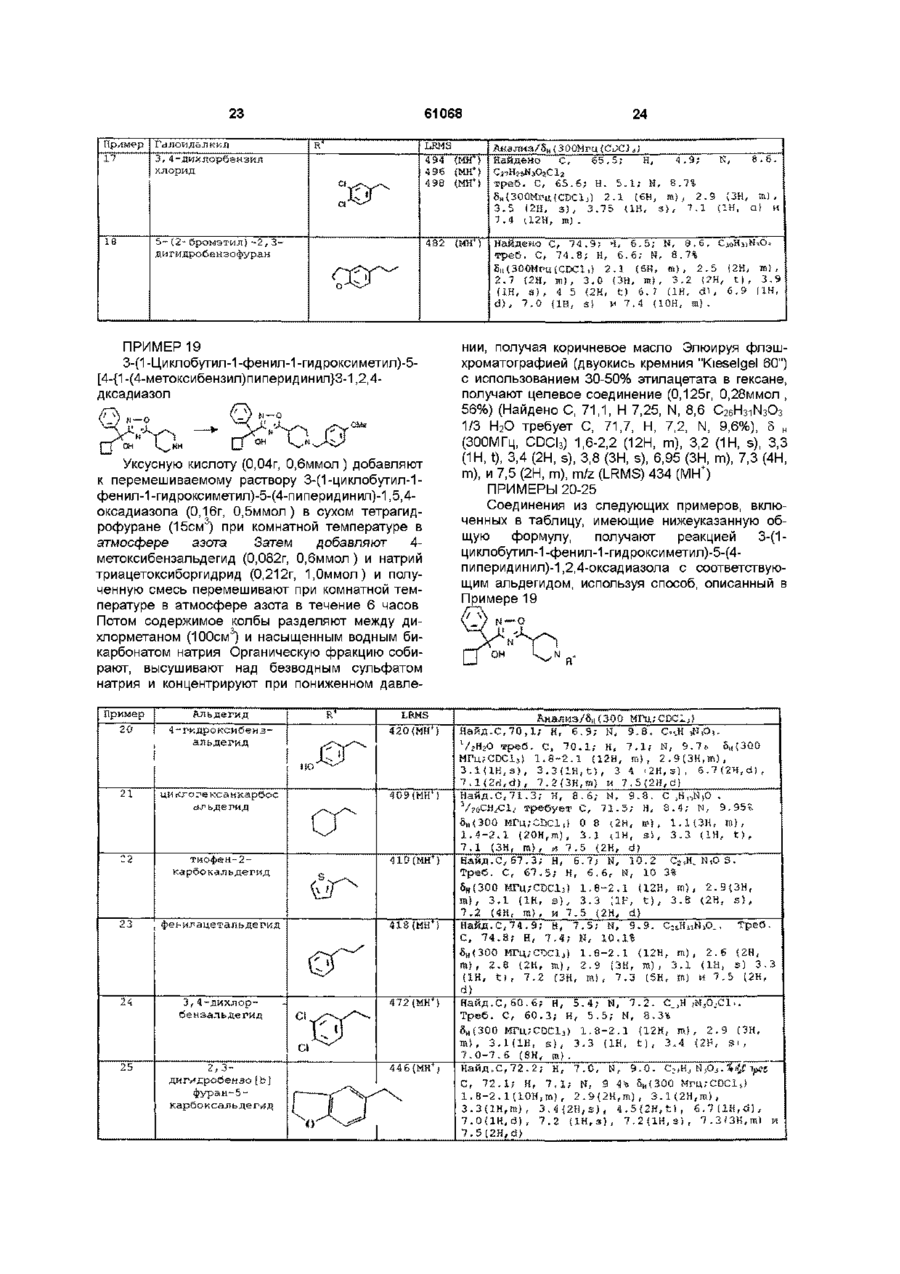
1 Соединение формулы 'X 1 где R представляет собой Сі-Сєалкил, гало(Сг Сєалкил), Сз-Суциклоалкил, С2-Сєалкинил, гидрокси(С2-Сєалкинил), (Сі-С4алкокси)(С2-Сбалкинил), арил, арил(Сі-С4алкил), гетероарил или гетероарил(Сі-С4алкил), R2 представляет собой Н или Сі-С4алкил, R3 представляет собой арил, гетероарил, 2,3дигидробензофуранил или С4-С7Циклоалкил, X = О или S, а Y представляет собой прямую связь, -СН2-, (СН2)2- или -СН2О-, или его фармацевтически приемлемая соль 2 Соединение по п 1, в котором арильная группа представляет собой фенил или нафтил, каждый из которых необязательно имеет до трех заместителей и независимо выбран из СгС4алкила, С г С4алкоксила, гидроксила, галогена и трифторметила 3 Соединение по п 2, в котором арильную группу выбирают из фенила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из СгС4алкила, С г С4алкоксила, гидроксила, галогена и трифторметила, а также нафтила 4 Соединение по п 3, в котором арильная группа представляет собой фенил, фторфенил, дихлорфенил, гидроксифенил, метоксифенил или нафтил 5 Соединение по любому из предшествующих пунктов, в которых гетероарильная группа представляет собой тиенил, пиридил, тиазолил, бензотиазолил, тиадиазолил, пиразолил или пиримидинил, каждый из которых необязательно замещен одним или двумя заместителями и независимо выбран из Сі-С4алкила, Сі-С4алкоксила, гидроксила и галогена 6 Соединение по п 5, в котором гетероарил ьная группа представляет собой тиенил, пиридил, тиазолил или бензотиазолил 7 Соединение по любому из предшествующих пунктов, в которых R1 представляет собой С г Сбалкил, пентафторэтил, С4-СбЦиклоалкил, этинил, -С = С-СН2ОН, -С = С-(СН2)4-ОН, фенильную группу, необязательно замещенную одним или двумя заместителями, каждый из которых независимо выбран из галогена, СгС4алкила, С г С4алкоксила и гидроксила, нафтил или гетероциклическую группу, выбранную из тиенила, пиридила, тиазолила и бензотиазолила, каждый из которых необязательно замещен галогеном, С г С4алкилом, Сі-С4алкоксилом или гидроксилом 8 Соединение по любому из предшествующих пунктов, в которых R2 представляет собой Н или СНз 9 Соединение по любому из предшествующих пунктов, в которых R3 представляет собой фенил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена, Сі-С4алкила, Сі-С4алкоксила и гидроксила, 2,3-дигидробензофуранил, С4Суциклоалкил или тиенил 10 Соединение по любому из предшествующих пунктов, в которых X = О 11 Соединение по любому из предшествующих пунктов, в которых Y представляет собой прямую связь, -СН2- или -СН2О12 Соединение по п 1, представляющее собой 3(1 -циклобутил-1 -фенил-1 -гидроксиметил)-5-[4-(1 бензилпиперидинил)]-1,2,4-оксадиазол или (+)-3(1 -циклобутил-1 -фенил-1 -гидроксиметил)-5-[4-(1 бензил пиперидинил)]-1,2,4-оксадиазол О 00 (О О (О 61068 13 Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по любому из предшествующих пунктов и фармацевтически приемлемый разбавитель или носитель 14 Соединение формулы W 2 3 где X, Y, R и R имеют значения, указанные в п 1 15 Способ получения соединения формулы (1) по п 1 или его фармацевтически приемлемой соли, отличающийся тем, что проводят реакцию соединения формулы (II) по п 14 с реактивом Гриньяра, литийорганическим или церийорганическим соединением формулы 1 1 1 R MgHal, R Li или R -CeCI2, 1 где Hal = СІ или Br , a R имеет значения, указанные в п 1, в органическом растворителе, при этом указанный способ также необязательно включает превращение продукта формулы (І) в фармацевтически приемлемую соль 16 Способ по п15, отличающийся тем, что используют реагент формулы R1MgBr или R1Li, при этом R1 имеет значения, указанные в п 15 17 Способ получения соединения формулы (I) по п 1 или его фармацевтически приемлемой соли, отличающийся тем, что проводят реакцию соединения формулы (III) или его основной соли . (Ill) где R и X имеют значения, указанные в п 1, либо (а) с соединением формулы (IV) Q-CH(R2)-Y-R , (IV) Данное изобретение относится к замещенным производным оксадиазола и тиадиазола Соединениями по данному изобретению являются антагонисты мускаринового рецептора, селективные по отношению к мускариновым сайтам гладкой мускулатуры через сердечные мускариновые сайты и не обладающие какой-либо существенной антигистаминной активностью Указанные соединения могут быть использованы в лечении заболеваний, связанных с изменением подвижности и/или тонусом гладкой мускулатуры, которые могут быть, например, обнаружены в кишечнике, трахее и мочевом пузыре Такие заболевания включают синдром раздраженной толстой кишки (слизистый колит), дивертикулит, недержание мочи, пищеводную ахалазию и хроническую обструкцию дыхательных путей Указанные соединения также могут быть использованы в качестве энхансеров распознавания 4 2 3 где Q - отщепляемая группа, a R , R и Y имеют значения, указанные в п 1, либо (Ь) с альдегидом или кетоном формулы 1 3 _ у _£ ^ р 2 5 *> о .00 где R , R и Y имеют значения, указанные в п 1, в присутствии восстановителя и в органическом растворителе, при этом указанный способ также необязательно включает превращение продукта формулы (1) в фармацевтически приемлемую соль 18 Способ по п 17, отличающийся тем, что отщепляемая группа представляет собой тозилокси, мезилокси, трифторметансульфонилокси, CI или Вг и в котором восстановитель представляет собой триацетоксиборгидрид или цианоборгидрид натрия 19 Способ по п 17 или 18, отличающийся тем, что в (а) используют свободное основание соединения (III) и реакцию проводят в присутствии акцептора кислоты 20 Способ по п 19, отличающийся тем, что акцептор кислоты представляет собой бикарбонат натрия или этилдиизопропиламин 21 Способ по любому из пп 15-20, отличающийся тем, что получают соединения по любому из пп2-12 22 Способ по п 15 получения соединения 3-(1циклобутил-1 -фенил-1 -гидроксиметил)-5-[4-(1 бензил пиперидинил)]-1,2,4-оксадиазола, отличающийся тем, что бромид циклобути л магния подвергают взаимодействию с 3-бензоил-5-[4-(1бензилпиперидинил)]-1,2,4-оксадиазолом, необязательно с последующим разделением указанного соединения на его (+) и (-) энантиомеры 23 Способ по п 22, отличающийся тем, что разделение осуществляют с помощью ЖХВР и, таким образом, для лечения заболеваний, вызывающих ухудшение памяти, таких как болезнь Альцгеймера и возрастные расстройства памяти В соответствии с данным изобретением предлагаются соединения формулы R» (I) R1 где R представляет собой Сі-Сєалкил, гало(СгСбалкил), Сз-Суциклоалкил, Сг-Сбалкинил, гидрокси-(С2-Сбалкинил), (СгС4алкокси)-(С2Сбалкинил), арил, арил-(Сі-С4алкил), гетероарил или гетероарил-(Сі-С4 алкил), R2 представляет собой Н или СгС4алкил, R3 представляет собой арил, гетероарил, 2,3дигидробензофуранил или С4-С7Циклоалкил, 1 X = О или S, а Y представляет собой прямую связь, -СН2-, -(СН2)2 или -СН2О-, и их фармацевтически приемлемые соли Под "гало" подразумеваются хлор, бром, фтор или йод Предпочтительными арильными группами являются фенил и нафтил, каждый из которых необязательно имеет до трех заместителей и независимо выбран из Сі-С4алкила, Сі-С4алкоксила, гидроксила, галогена и трифторметила Более предпочтительно, арильные группы выбирают из фенила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из СгС4алкила, d С4алкоксила, гидроксила, галогена и трифторметила, а также нафтила Наиболее предпочтительно, арильная группа представляет собой фенил, фторфенил, дихлорфенил, гидроксифенил, метоксифенил или нафтил Предпочтительными гетероарильными группами являются тиенил, пиридил, тиазолил, бензотиазолил, тиадиазолил, пиразолил и пиримидинил, каждый из которых необязательно замещен одним или двумя заместителями и независимо выбран из Сі-С4алкила, Сі-С4алкоксила, гидроксила и галогена Более предпочтительными гетероарильными группами являются тиенил, пиридил, тиазолил и бензотиазолил Предпочтительными алкильными группами являются метил и этил Предпочтительными алкоксильными группами являются метоксил и этоксил Предпочтительными галогенными группами являются хлор, бром и фтор Предпочтительными циклоалкильными группами являются циклобутил, циклопентил и циклогексил, особенно циклобутил Предпочтительной алкинильной группой является этинил Предпочтительными гидрокси-(С2-Сбалкинил) группами являются НО-СН2С=С- и НО-(СН2)4С=С- Предпочтительными галоалкильными группами являются трифторметил и пентафторэтил 61068 нения, такие как гидрохлориды, гидробромиды, гидрофториды, сульфаты или бисульфаты, фосфаты или фосфаты водорода, ацетаты, безилаты, цитраты, фумараты, глюконаты, лактаты, малеаты, мезилаты, сукцинаты и тартраты Более подробный список фармацевтически приемлемых солей приведен, например, в Journal of Pharmaceutical Sciences, т 66, №1, январь 1977г, стр 1-19 Эти соли могут быть получены обычным способом, например, путем смешивания раствора свободного основания и кислоты в подходящем растворителе, например, этаноле, и восстановления кислой соли присоединения либо в виде осадка, либо путем выпаривания раствора R1 предпочтительно представляет собой С-і-Сє ал кил, пентафторэтил, С4-СбЦиклоалкил, этинил, -С=С-СН2ОН, -С=С-(СН2)4ОН, фенильную группу, необязательно замещенную одним или двумя заместителями, каждый из которых независимо выбран из галогена, Сі-С4алкила, Сі-С4алкоксила и гидроксила, нафтил или гетероциклическую группу, выбранную из тиенила, пиридила, тиазолила и бензотиазолила, каждый из которых необязательно замещен галогеном, СгС4ал килом, dС4алкоксилом или гидроксилом R2 предпочтительно представляет собой Н или СНз R3 предпочтительно представляет собой либо фенил, необязательно замещенный одним или двумя заместителями, каждый из которых независимо выбран из галогена, СгС4алкила, d С4алкоксила и гидроксила, 2,3-дигидробензофуранил, С4-С7- циклоалкил, либо тиенил X предпочтительно представляет собой О Y предпочтительно представляет собой прямую связь, -СН2- или -СН2ОФармацевтически приемлемые соли соединения формулы (I) включают кислые соли присоеди Соединения (I) могут содержать один или более оптически активных центров, и данное изобретение включает как разделенные, так и неразделенные формы Разделенные формы могут быть получены обычными способами, например, жидкостной хроматографией высокого разрешения с использованием хиральной неподвижной фазы, или химическим растворением через образование подходящих солей или производных Один способ получения соединений (I) включает кетоны (II) V e i l где X, Y, R2 и R3 имеют значения, указанные для формулы (I), реакцией с реактивом Гриньяра, литийорганическим или церийорганическим реактивом формулы R1MgHal, R1Li или R1-CeCI2 где Hal представляет собой CI или Вг, в подходящем органическом растворителе При использовании литийорганического или церийорганического реагента реакцию обычно проводят при низкой температуре, т е при 0°С или ниже, предпочтительно, приблизительно при -78°С Предпочтительным органическим растворителем является тетрагидрофуран Предпочтительными реактивами Гриньяра являются бромиды магния Реактивы Гриньяра могут быть получены на месте, например, путем добавления галогенида формулы R1Hal по каплям к суспензии подвергаемого вращению магния в органическом растворителе, таком как диэтиловый эфир, со скоростью, достаточной для поддержания дефлегмации После перемешивания приблизительно в течение 30 минут при комнатной температуре полученный раствор, содержащий реактив Гриньяра, по каплям добавляют к раствору кетона (II) в подходящем органическом растворителе, обычно при температуре от 0° до -20°С Продукт может быть выделен из реакционной смеси обычным способом Новые промежуточные соединения (II) также входят в объем данного изобретения Промежуточные соединения (II), в которых Х=О, получают обычными способами, например, следующими 7 61068 COM C N C , Oh O H HC P со,н (CH3COj20 I i NHjCHXOPh, N карбоннлдЕймн- і СОСНз дазол COCHj Нитрит натрия/НОАс ^ N О НО/МеОН N, О NH.HCI 'СОСН, 1 Q-CffiR )—У-І№. Оско- _ • - ' •: , • аанке LQ - оїщеплдемая группа,например, СІ, Вї, метансудьфокнлокси, ^-толуолсудьфонидоксн н т. О k ,N. Альтернативным способом получения промежуточных соединений (НА) является следующий ;TBDM5 = tfin.buiYldm«thyl5iiyS) * треї-бутилди«єтилсилил) OTB'DMS PhCH(OH)C=N гидроксиламнна, .ydrucHiondc, Манделонитрил (TBDMS =igjj-biityidimethylsilyf) силил O1BDMS Ph—CH-C-NH 2 NOH , Фторид тетрабутнламчоняя , CHfK'i 9 61068 10 Способами получения тиадиазольных промежуточных соединений являются следующие Ph При желании, дебенэиднрование If ifesjred, (і) debenzyfatten —— : / -—«• Є \ V—С N 'l S • Base OGHossHae ШВ, CHiR:*— Ї ШО Teinhvdropvrauvf Тетрапирапираянл ЯЛ2СГ (bi S-N a Соединения и • i * „OTHP j ^гm^ Then as {a) above Сопгфошиіз (ПБ) -* згмЗШО Затеы как (а) выше ( ) Другой способ заключается в получении соединений (I) из гидроксисодержащего соединения (III) или его основной соли он -с ю 1 •X N H где R и X имеют значения, указанные для формулы (I), либо (а) реакцией с соединением формулы (IV) Q-CH(R2)-Y-R3 (IV) где Q - отщепляемая группа, такая как тозилокси, мезилокси, трифторметансульфонилокси, CI или Br, a R2, R3 и Y имеют значения, указанные для формулы (I), либо (Ь) реакцией с альдегидом или кетоном формулы IT-Y-C-R2 (V) О где R , R и Y имеют значения, указанные для формулы (І), в присутствии восстановителя, на 12 11 61068 пример, триацетоксиборгидрида или цианоборАффинность соединения к другим холинергигидрида натрия, в подходящем органическом расческим сайтам определяют с использованием творителе, например, тетрагидрофуране, и, обычмыши после внутривенного или внутрибрюшинноно, при комнатной температуре го введения Таким образом определяют дозу, вызывающую удвоение размера зрачка, а также При использовании в (а) свободного основадозу, ингибирующую слюноотделение и тремор на ния соединения (III), реакцию обычно проводят в 50% в ответ на внутривенный оксотреморин присутствии акцептора кислоты, такого как бикарбонат натрия или этилдиизопропиламин Пероральные дозировки соединений, вводимых человеку с целью лечения или профилактики Соединения формулы (III) могут быть получезаболеваний, связанных с изменением подвижноны путем удаления бензильной группы, в которой 2 3 сти и/или тонусом гладкой мускулатуры, таких как -CH(R )-Y-R представляет собой бензил, из сосиндром раздраженной толстой кишки, дивертикуединений формулы (III), обычно реакцией с подлит, недержание мочи, пищеводная ахалазия и ходящим хлорформиатом, например, а-хлорэтилхроническая обструкция дыхательных путей, хлорформиатом, в подходящем органическом обычно составляют от 3,5 до 350мг в сутки для растворителе, например, дихлорметане или топациента среднего возраста (70кг) Таким обралуоле, и, предпочтительно, с дефлегмацией зом, для обычного взрослого пациента индивидуСелективность соединений (I) как антагониальные таблетки или капсулы обычно содержат от стов мускаринового рецептора может быть опре1 до 250мг активного соединения в подходящем, делена следующим образом фармацевтически приемлемом наполнителе или Самцов морских свинок умерщвляют и удаляносителе для разового или многократного введеют подвздошную кишку, трахею, мочевой пузырь и ния (один или несколько раз в сутки) По необхоправое предсердие, которые суспендируют в фидимости, дозировки для внутривенного введения зиологическом солевом растворе при остаточном обычно составляют от 0,35 до 35мг на одну дозу напряжении 1г при 32°С, насыщаемом 95% Ог и На практике врач определяет необходимую дози5% СОг Сокращения подвздошной кишки, мочеровку, наиболее подходящую каждому отдельнового пузыря и трахеи записывают с помощью изому пациенту, которая варьируется в зависимости тонического (подвздошная кишка) или изометриот возраста, веса и реакции данного пациента ческого (мочевой пузырь и трахея) датчика ЧасВышеуказанные дозировки предназначены для тоту сокращений спонтанно бьющегося правого средних случаев, однако, безусловно, могут быть предсердия определяют исходя из изометрически отдельные случаи, требующие более высокой или записанных сокращений низкой дозировки, которые также входят в объем Кривые, соответствующие дозам ацетилхолиданного изобретения на (подвздошная кишка) или карбахола (трахея, мочевой пузырь и правое предсердие), определяЛюдям соединения формулы (I) могут быть ют на основании 1-5-минутного контакта агониста введены в чистом виде, однако обычно их вводят для каждой дозы до получения максимальной рев смеси с фармацевтическим носителем, выбранакции Ванну для органов осушают и вновь наполным с учетом предполагаемого способа введения няют физиологическим солевым раствором, сои обычной фармацевтической практики Напридержащим наименьшую дозу тест-соединения мер, они могут быть введены перорально в виде Тест-соединению дают возможность уравноветаблеток, содержащих такие наполнители, как ситься с тканями в течение 20 минут и повторяют крахмал или лактоза, в виде капсул или яйцеклекривую, соответствующую дозе агониста, до полуток в чистом виде или в смеси с наполнителями, чения максимальной реакции Ванну для органов либо в виде эликсиров либо суспензий, содержаосушают и вновь наполняют физиологическим щих корригенты или красители Они могут быть солевым раствором, содержащим вторую конценвведены с помощью инъекции парентерально, трацию тест-соединения, и повторяют вышеопинапример, внутривенно, внутримышечно или подсанную процедуру Обычно на каждой ткани опрекожно В случае парентерального введения, лучделяют 4 концентрации тест-соединения ше всего использовать их в виде стерильного водного раствора, который может содержать друОпределяют концентрацию тест-соединения, гие вещества, например, соли или глюкозу для вызывающую удвоение концентрации агониста, обеспечения изотоничности раствора с кровью для получения первоначальной реакции (величина рА2 - Arunlakshana and Schild (1959), Brit J Следующий аспект данного изобретения преPharmacol , 14, 48-58) Используя вышеописанные дусматривает фармацевтическую композицию, аналитические приборы, определяют селективвключающую соединение формулы (I) или его ность ткани по отношению к антагонистам мускафармацевтически приемлемую соль вместе с ринового рецептора фармацевтически приемлемым разбавителем или носителем Активность против сужения бронхов, а также Данное изобретение также включает испольсокращения кишечника или мочевого пузыря, вызование соединения формулы (I) или его фармазванных агонистом, по сравнению с изменениями цевтически приемлемой соли в качестве лекарстчастоты сердечных сокращений определяют с венного препарата, в частности, для лечения неиспользованием собаки под наркозом Пероральдержания мочи или синдрома раздраженной толную активность устанавливают с использованием стой кишки собаки, находящейся в сознании, определяя действие соединения на, например, частоту сердечДалее данное изобретение включает испольных сокращений, диаметр зрачка и перистальтику зование соединения формулы (I) или его фармакишечника цевтически приемлемой соли для получения ле 14 13 61068 карственного препарата, используемого при лечературе в атмосфере азота в течение 2 часов Донии заболеваний, связанных с изменением подбавляют а-аминоацетофенон гидрохлорид (21 Ог, 3 вижности и/или тонусом гладкой мускулатуры, 1,22мол ), а затем триэтиламин (170см , 1,22мол ), таких как синдром раздраженной толстой кишки, вызывая небольшую экзотермическую реакцию дивертикул ит, недержание мочи, пищеводная Полученную смесь перемешивают при комнатной ахалазия и хроническая обструкция дыхательных температуре в течение ночи в атмосфере азота путей Содержимое колбы затем промывают водной соляной кислотой (2л, 2М) и деионизируют водой Далее данное изобретение включает все но(2x1 л), высушивают над безводным сульфатом вые промежуточные соединения, приводимые в натрия и концентрируют при пониженном давледанном описании нии, получая целевое соединение в виде твердого Синтез соединений формулы (I) и некоторых оранжевого вещества (ЗООг, 1,04мол , 79%) Rf промежуточных соединений проиллюстрирован в 0,15 (95 5 СН 2 СІ 2 Ме0Н), т пл 161-162°С, 5Н нижеследующих Примерах и Препаратах, соот(300МГц, CDCI3) 1,7 (2Н, т ) , 1,9 (2Н, т ) , 2,1 (ЗН, ветственно s), 2,5 (1Н, т ) , 2,7 (1Н, t), 3,1 (1Н, t), 3,9 (1Н, d), 4,6 Чистота соединений определялась обычным (1Н, d), 4,8 (2Н, d), 6,6 (1Н, s), 7,5 (2Н, т ) , 7,6 (1Н, способом при помощи тонкослойной хроматограт ) , и 7,9 (2Н, d) фии с использованием пластинок Merck Kieselgel 60 F254 Спектры 1Н ядерного магнитного резонанПРЕПАРАТ 3 са (nmr) записывались с использованием спектро3-Бензоил-5-(4-(1 -ацетилпиперидинил)}-1,2,4метров Bruker АС-300 и Vanan Unity 300 и во всех оксадиазол случаях соответствовали предлагаемым структурам Химические сдвиги приводятся в частях на миллион (5) вниз по полю от тетраметилсилана с использованием обычных стандартных сокращений для обозначения основных пиков, например, синглет (s), дублет (d), дублет дублетов (dd), триплет (t), квартет (q), мультиплет (т) и широкий (Ь) 1-Ацетилпиперидин-4-(2-оксо-2LRMS означает масс-спектр низкого разрешения фенилэтил)карбоксамид 294г, 1,02мол) раствоКомнатная температура означает 20-25°С ряют в ледяной уксусной кислоте (1,5л) при осторожном нагревании Затем по каплям в течение 2 ПРЕПАРАТ 1 часов добавляют раствор нитрита натрия (100г) в 1-Ацетилпиперидин-4-карбоновая кислота деионизированной воде (120см3) при осторожном оон 0 он охлаждении на водно-ледяной бане Полученную реакционную смесь перемешивают при комнатной температуре в течение 144 часов, продолжая доN H бавлять нитрит натрия (ЮОг) и деионизированную воду (120см ) каждые 48 часов Содержимое колПиперидин-4-карбоновую кислоту (208г, бы затем продувают азотом и концентрируют при 1,63мол) растворяют в уксусном ангидриде и попониженном давлении, получая твердый остаток, лученный раствор нагревают при дефлегмации в который растворяют в дихлорметане (2,5л) и поатмосфере азота в течение 48 часов Содержиследовательно промывают деионизированной мому колбы дают возможность охладиться, а заводой (500см3), водным гидроксидом натрия тем концентрируют при пониженном давлении, 3 (200см , 10% вес/об) и деионизированной водой получая бледно-желтое масло, застывающее че(500см3) Полученную органическую фракцию вырез некоторое время После рекристаллизации из сушивают над безводным сульфатом натрия и пропан-2-ола получают целевое соединение в концентрируют при пониженном давлении, полувиде твердого беловатого вещества (160г, чая целевое соединение в виде бледно-желтого 0,94мол , 58%), т пл 164-166°С (ІРА-зтилацетат), твердого вещества (231 г, 0,77мол , 77%), Rf 0,26 5Н (300МГц, CDCI3) 1,7 (2Н, т ) , 2,0 (2Н, т ) , 2,2 (ЗН, (95 5 СН 2 СІ 2 Ме0Н), т, пл 97-100°С, 5 н (300МГц s), 2,6 (1Н, т ) , 2,85 (1Н, т ) , 3,2 (1Н, т ) , 3,8 (1Н, CDCI3) 1,9 (2Н, т ) , 2,1 (ЗН, s), 2,2 (2Н, т ) , 2,9 (1Н, т ) , и4,4(1Н, т ) t), 3,3 (2Н, т ) , 3,9 (1Н, d), 4,5 (1Н, d), 7,5 (2Н, t), 7,6 ПРЕПАРАТ 2 (1Н, t), и 8,2 (2Н, d), m/z (LRMS) 322 (Mna+), 317 1-Ацетилпиперидин-4-(2-оксо-2(MNH4+) и 300 (MH+) фенилэтил)карбоксамид ПРЕПАРАТ 4 О . ^ ОМ 3-Бензоил-5-(4-пиперидинил)-1,2,4-оксадиазол гидрохлорид сн. с^сн, Карбонилдиимидазол (GDI) (212,Or, 1,31 мол) добавляют порциями перемешиваемую суспензию 1-ацетилпиперидин-4-карбоновой кислоты (200,Ог, 1,17мол ) в сухом дихлорметане в атмосфере азота при комнатной температуре (следует обращать внимание на выделение СО2) Полученный раствор затем перемешивают при комнатной темпе N Hi H C 3-Бензоил-5-{4-(1-ацетилпиперидинил)}-1,2,4оксидиазол (230г, 0,77мол) растворяют в метаноле, насыщенном НСІ (2,5л) и нагревают при дефлегмации в течение 24 часов Затем содержимому колбы дают возможность охладиться и добавляют концентрированную соляную кислоту 15 61068 16 3 (10см ) Реакционную смесь затем нагревают при (77г, 0,31 мол , 82%), 5Н (300МГц, CDCI3) 0,1 (ЗН, s), дефлегмации еще в течение 20 часов, после чего 0,2 (ЗН, s), 1,0 (9Н, s), 5,5 (1Н, s), и 7,4 (5Н, т ) ТСХ не показывает остатков исходных материаПРЕПАРАТ 7 лов Содержимое колбы затем охлаждают в бане а-третсо льдом и ацетоном, получая твердое белое веБутилдиметилсилоксибензиламидоксим щество, которое фильтруют и промывают этилOB M TD S CB M TO S ацетатом для получения целевого соединения (175г, 0,58мол , 75%), т пл 224-227°С, 5Н (300МГц, CDCI2) 2,1 (2Н, т ) , 2,3 (2Н, т ) , 3,1 (2Н, Твердый карбонат калия (54г, 0,39мол) дот ) , (3,3 2Н, т ) , 3,6 (1Н, т ) , 7,6 (2Н, т ) , 7,8 (1Н, т ) , бавляют к смеси 2-трет+ и 9,1 (1Н, s), m/z (LRMS) 258 (МН ) бутилдиметилсилоксифенилацетонитрила (45г, ПРЕПАРАТ 5 0,18мол) и гидроксиламина гидрохлорида (25г, 3 3-Бензоил-5-4-(1 -бензилпиперидинил)-1,2,4О.Збмол) в этаноле (450см ) и полученную смесь оксадиазол нагревают при дефлегмации в атмосфере азота в течение 2 часов Затем содержимое колбы охлажJ —О fr>i N— 0 дают и концентрируют при пониженном давлении Полученный остаток разделяют между дихлорметаном (3x150см3) и деионизированной водой 3 Бензил бромид (67см , 0,56мол) добавляют к (100см3) Затем объединенные органические смеси 3-бензоил-5-(4-пиперидинил)-1,2,4фракции промывают рассолом (100см3), высушиоксадиазол гидрохлорида (165г, 0,56мол) и твервают над безводным сульфатом магния и концендого карбоната калия (194г, 1,40мол) в бутан-2трируют при пониженном давлении, получая цеоне (1,6л) Затем содержимое колбы перемешилевое соединение в виде твердого желтого вещевают при комнатной температуре в атмосфере ства (53,2г. 0,18мол, 100%) 5Н (300МГц, CDCI3) азота в течение 48 часов Затем добавляют деио0,1 (ЗН, s), 0,2 (ЗН, s), 1,0 (9Н, s), 4,8 (2Н, bs), 5,3 низированную воду (1,3л) и смесь энергично пе(1Н, bs), 7,3 (ЗН, т ) и 7,5 (2Н, т ) ремешивают в течение 1 часа Органический слой ПРЕПАРАТ 8 собирают, а оставшуюся водную фракцию экстра3-(а-трет-Бугилдиметилсилоксибензил)-5-{4гируют этилацетатом (500см3) Затем объединен(1 -бензилпиперидинил)}-1,2,4-оксадиазол ные органические фракции высушивают над безводным сульфатом натрия и концентрируют, получая бледно-желтое масло Элюируя флэшхроматографией (1кг двуокиси кремния "Kieselgel 60") с использованием 8% метанола в дихлормеа-треттане, получают бесцветное масло, которое подБутилдиметилсилоксибензиламидоксим (53,2г, вергают азеотропии толуолом для получения це0,18мол) растворяют в тетрагидрофуране левого соединения в виде твердого белого веще3 (400см ) и добавляют Юг, измельченных и просества (177г, 0,51мол, 91%) Rf 0,6 (95 5 янных через сито 4А Полученную смесь нагреваСН 2 СІ 2 Ме0Н), т пл 67-69°С, 5н (300МГц, CDCI3) ют при дефлегмации в атмосфере азота в течение 2,1 (6Н, т ) , 2,9 (2Н, d), 3,1 (1Н, т ) , 3,6 (2Н, s), 7,3 15 минут, а затем охлаждают в ледяной бане По (5Н, т ) , 7,5 (2Н, t), 7,7 (1Н, t), и 8,3 (2Н, d), m/z порциям добавляют гидрид натрия (8,0г, 60% дис+ (LMRS) 348 (МН ) персия, 0,2мол) и содержимому колбы дают возможность медленно нагреться до комнатной темПРЕПАРАТ 6 пературы так, чтобы контролировать шипучесть 2-третКогда выделение водорода прекратится, по капБутилдиметилсилоксифенилацетонитрил лям добавляют раствор этил N-бензилпиперидинон ОТ80МЗ 4-карбоксилата (45г, 0,18мол) в тетрагидрофуране (125см3) Содержимое колбы перемешивают при комнатной температуре в течение 30 минут, а Манделонитрил (50г, 0,38мол) и имидазол затем нагревают при дефлегмации в атмосфере (64г, 0,94мол) растворяют в диметилформамиде азота в течение 1,5 часов После охлаждения ре(100см3) и полученный раствор охлаждают в водакционную смесь разделяют между этилацетатом но-ледяной бане Затем в течение 20 минут по (2х200см3) и деионизированной водой (200см3) порциям добавляют трет-бутилдиметилсилил Затем объединенные органические фракции прохлорид (68г, 0,45мол) Содержимое колбы нагремывают рассолом (100см3), высушивают над безвают до 35°С и перемешивают при этой темпераводным сульфатом магния и концентрируют при туре в течение 18 часов Затем реакционную пониженном давлении, получая целевое соединесмесь охлаждают и разделяют между этилацетание в виде желтовато-коричневого масла (62г, том (3x100см3) и деионизированной водой 0,13мол , 72%), 5Н (300МГц, CDCI3) 0,1 (ЗН, s), 0,2 (100см ) Объединенные органические фракции (ЗН, s), 1,0 (9Н, s), 2,0 (6Н, т ) , 2,9 (ЗН, т ) , 3,5 (2Н, затем промывают рассолом (100см3), высушивают s), 6,0 (1Н, s), 7,3 (8Н, т ) и 7,5 (2Н, т ) над безводным сульфатом магния и концентрируПРЕПАРАТ 9 ют при пониженном давлении, получая сырой 3-(а-гидроксибензил)-5-{4-(1 продукт в виде желтого масла Элюируя флэшбензил пиперидинил)}-1,2,4-оксадиазол хроматографией (600г двуокиси кремния "Kieselgel 60" с использованием 20% дихлорметана в пентане, получают целевое соединение в виде масла 61068 18 Затем содержимое колбы охлаждают, концентрируют при пониженном давлении и разделяют ме3 жду дихлорметаном (100см ) и насыщенным водTD S 3 M0 3 ным бикарбонатом натрия (50см ) Органическую ;> Тетрабутил аммоний фторид (237см , 1М в фракцию высушивают над безводным сульфатом тетрагидрофуране] добавляют по каплям к перенатрия, а затем концентрируют при пониженном мешиваемому раствору 3-(а-третдавлении Элюируя флэш-хроматографией (25г бутилдиметилсилоксибензил)-5-{4-(1двуокиси кремния "Kieselgel 60") с использованибензилпиперидинил)}-1,2,4-оксадиазола (62г, ем 5-15% метанола в дихлорметане, получают 3 0,13мол) в тетрагидрофуране (200см ) при 0°С целевое соединение в виде белой пены (0,68г, Затем полученному раствору дают возможность 2,0ммол , 80%), Rf 0,05 (90 10 CH2CI2 МеОН), 5Н нагреться до комнатной температуры и переме(300МГц, CDCI3) 1,9 (2Н, ш), 2,2 (2Н, ш), 2,8 (2Н, t), шивают еще 30 минут Содержимое колбы разде3,1 (1Н, ш), 3,3 (2Н, ш), 4,2 (1Н, Ь), и 7,4 (ЮН, ш), 3 + ляют между этилацетатом (Зх200см ) и деионизиm/z (LRMS) 336 (МН ) 3 рованной водой (200см ), а объединенные органи3 ПРЕПАРАТ 12 ческие фракции промывают рассолом (100см ) , 3-(1 -Циклобутил-1 -фенил-1 -гидроксиметил)-5высушивают над безводным сульфатом магния и (4-пиперидинил)-1,2,4-оксадиазол концентрируют при пониженном давлении, получая целевое соединение в виде твердого желтого вещества (45,Ог) (Найдено С, 70,5, Н, 6,5, N 11,8 C21H23N3O2 1/2 Н2О требует С, 70,4, Н, 6,8, N 11,7%, 5Н (300МГц, CDCI3) 2,0 (6Н, ш), 2,9 (4Н, ш), 3,5 (2Н, s), 5,9 (1Н, d) , и 7,3 (ЮН, m), m/z (LRMS) а-Хлорэтилхлорформат (3,30г, 23,0ммол) по 350 (МН+) каплям добавляют к перемешиваемому раствору 3-(1 -циклобутил-1 -фенил-1 -гидроксиметил)-5-{4ПРЕПАРАТ 10 (1 -бензилпиперидинил)}-1,2,4-оксадиазола (8,52г, 3-Бензоил-5-4-(1 -бензилпиперидинил)-1,2,421,0ммол ) в сухом толуоле (100см3) Затем полуоксадиазол ченный раствор нагревают при дефлегмации в атмосфере азота в течение 90 минут Содержимому колбы дают возможность охладиться, и реакционную смесь концентрируют при пониженном Двуокись марганца (206г, 2,37мол ) добавляют давлении Полученный остаток растворяют в мепо порциям к механически перемешиваемому растаноле (50см3) и нагревают при дефлегмации в твору 3-(а-гидроксибензил)-5-{4-(1течение 40 минут Затем содержимое колбы охбензилпиперидинил)}-1,2,4-оксидиазола (45, Ог, лаждают, концентрируют при пониженном давле0,19мол) в сухом тетрагидрофуране (300см ) при нии и разделяют между дихлорметаном (100см3) и комнатной температуре на протяжении 2 часов насыщенным водным бикарбонатом натрия Полученную смесь затем перемешивают при ком(50см3) Органическую фракцию высушивают над натной температуре в течение 45 минут, фильтбезводным сульфатом натрия, а затем концентрируют через прокладку "Arbocel" и концентрируют руют при пониженном давлении Элюируя флэшпри пониженном давлении, получая твердое клейхроматографией (25г двуокиси кремния "Kieselgel кое вещество Этот остаток вновь растворяют в 60") с использованием 5-15% метанола в дихлорминимальном количестве горячего диизопропилометане, получают целевое соединение в виде вого эфира, полученный раствор фильтруют, а белой пены (1,63г, 5,2ммол , 23%), 5Н (300МГц, затем охлаждают в водно-ледяной бане для полуCDCI3) 1,7 (6Н, т ) , 2,0 (4Н, т ) , 2,7 (4Н, т ) , 3,1 (1Н, чения целевого соединения в виде бежевого крит ) , 3,2 (2Н, т ) , 3,3 (1Н, т ) , 7,3 (ЗН, т ) , и 7,5 (2Н, + сталлического твердого вещества (26г, 75ммол , d), m/z (LRMS) 315 (МН ) 58%) Этот материал во всех отношениях идентичен материалу, полученному в соответствии с ПРИМЕР 1 Препаратом 5 3-(1,1 -Дифенил-1 -гидроксиметил)-5-4-(1 безилпиперидинил)-1,2,4-оксадиазол ПРЕПАРАТИ 3-(1,1-Дифенил-1-гид роксиметил)-5-(4пиперидинил)-1,2,4-оксадиазол а-Хлорэтилхлорформат (0,27см , 2,5ммол) добавляют по каплям к перемешиваемому раствору 3-(1,1 -дифенил-1 -гидроксиметил)-5-{4-(1 бензилпиперидинил)}-1,2,4-оксадиазола (1,00г, 2,30ммол) в сухом дихлорметане (10см3) при 0°С в атмосфере азота Полученный раствор перемешивают при 0°С в течение 40 минут, а затем концентрируют при пониженном давлении Полученный остаток растворяют в метаноле (20см3) и нагревают при дефлегмации в течение 40 минут Фениллитий (5,0см , 1,8М в циклогексане, 9,0ммол) добавляют по каплям к перемешиваемому раствору 3-бензоил-5-{4-(1-бензилпиперидинил)}-1,2,4-оксадиазола (3,0г, 8,6ммол) в сухом тетрагидрофуране (40см ) при -78°С в атмосфере азота Затем полученному раствору дают возможность нагреться до комнатной температуры в течение двух часов и разделяют между этилацетатом (Зх50см3) и рассолом (20см3) Объединенные органические фракции высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении Элюируя флэшхроматографией (ЗОг двуокиси кремния "Kieselgel 20 19 61068 60") с использованием 35% этилацетата в гексане, при -78°С, и полученный раствор перемешивают при -78°С в течение 10 минут для получения 2получают целевое соединение (2,9 г, 6,8 ммол , тиениллития Затем одной порцией добавляют 76%) Rf 0,8 (этилацетат), (Найдено С, 75,45, Н, раствор 3-бензоил-5-{4-(1-бензил пиперидинил )}6,4, N, 9,8 C27H27N3O2 1/2 Н2О требует С, 75,4, Н, 1,2,4-оксадиазола (1,0г, 2,9ммол) в сухом тетра6,45, N, 9,8%), 5Н (300МГц, CDCI3) 2,0 (6Н, т ) , 2,9 3 гидрофуране (10см ), и полученную смесь пере(2Н, т ) , 3,5 (2Н, s), 3,7 (1Н, s) и 7,3 (15Н, т ) , m/z + мешивают при -78°С в течение часа Охлаждаю(LRMS) 426 (МН ) щую баню удаляют и содержимому колбы дают ПРИМЕР 2 возможность нагреться до комнатной температу3-(1 -пБутил-1 -фенил-1 -гидроксиметил)-5-4-(1 ры в течение часа Затем реакционную смесь разбензил пиперидинил)-1,2,4-оксадиазол 3 деляют между этилацетатом (Зх50см ) и рассолом 3 (20см ) Объединенные органические фракции высушивают над безводным сульфатом натрия и концентрируют при пониженном давлении ЭлюиЦелевое соединение получают способом, руя флэш-хроматографией (ЗОг двуокиси кремния описанным в Примере 1, однако используя для "Kieselgel 60") с использованием 40% зтилацетата получения целевого соединения бутиллитии (2,5М в гексане, получают целевое соединение (0,83г, в гексане, 1,1молэкв) вместо фениллития (Най1,9ммол, 66%) (Найдено С, 68,6, Н, 5,9, N, 9,5 дено С, 73,5, Н, 7,8, N, 10,0 C25H31N3O, требует С, C25H25N3O2B 1/4 Н2О требует С, 68,9, Н, 5,9, N, 74,0, Н, 7,7, 10,4%), 5Н (300МГц, CDCI3) 0,8 (ЗН, т ) , 9,6%), 5Н (300МГц, CDCI3) 2,1 (6Н, т ) , 2,9 (ЗН, т ) , 1,3 (4Н, т ) , 2,1 (8Н, т ) , 2,9 (ЗН, т ) , 3,2 (1Н, s), 3,5 3,5 (2Н, s), 3,95 (1Н, s), 6,9 (2Н, т ) , 7,3 (9Н, т ) , и (2Н, т ) , 7,3 (8Н, т ) , и 7,5 (2Н, d) , m/z (LRMS) 406 7,5 (2Н, т ) , m/z (LRMS) 432 (МН+) + (МН ) ПРИМЕРЫ 4-9 ПРИМЕРЗ Соединения из нижеследующих примеров, 3-{1 -(2-Тиенил)-1 -фенил-1 -гидроксиметил}-5включенных в таблицу, имеющие указанную об{4-(1-бензилпиперидинил)}-1,2,4-оксадиазол щую формулу, получают реакцией З-бензоил-5-4(1-бензилпиперидинил)-1,2,4-оксадиазола с соответствующим соединением органолития, используя способ, описанный в Примере 3, 3 п-Бутиллитий (1,3см , 2,5М в гексане, 3,25ммол) добавляют по каплям к перемешиваемому раствору тиофена (0 Зсм3, З.Оммол ) в сухом тетрагидрофуране (30см ) в атмосфере азота Примео Предшественник LM K S 4 2-бромпмрид^н & 5 4-5ромпиридин С ё 427(МН+1 433 (МН+) бензотиазол 8 484 (МН+) пропаагиловыи спирт. 4 04 (МН1) НО^/У 9 5-гексин-)-ол он Акализ/5 н і300 Mru,;CDClt) Н а й д . С , 7 2 . 2 ; Н, 6 . 2 ; Н, 1 2 . 9 . C ^ N j O - . . 1/4ЩО т р е б . С, 7 2 . 5 ; Н, 6 . 2 ; N, 13.0-4 6 Н (300 М Г Ц ; С І Х Ц І ) 2.С (6H f т), 2.913Н, Го), 3.5 (2Н, э ) , ЬЛЬ ЦЯ, s), 7 . 3 (8Н/ т ) , 7.45 (ЗН, шЗ, 7-7 (IH, t ) и 8 6 (1Н, а) Н а й д . С , 7 3 . 3 ; ft, 6 , 1 ; N, 1 3 . 2 . C; 6 H : 6 N 4 O : . требует С, 7 3 . 2 ; Н, 6 . 1 , N, 1 3 Л * 5ri(300MrujCDCl,| 2.0 (6Н, т ) , 2.9(ЗН, т ) , 3.5 (2Н, s ) , 4,0 ПН, s ) , 7 . 3 (12Н, т ) , и 8.5 (2Н, d) Н а й д . С ( 6 б Л ; Н, 5 . 5 ; N, 1 2 . 8 . C-jH ,Ы4О^З. 1 / 4 Н О т р е Э . С, 66-0; Н, 5 . 6 5 ; N, 12.8Я 5,нЗОО MrujCDClj) 2.0 (6Н, т ) , 2 . 9 ( З Н , т ) , 3.5 (2Н, s ) , 4 8 (IH, s i , 7 3 (SH, т ї , 7 . 6 (2Н, d ) , и 7.8 (1Н, d) Найд.С,6.9; Н, 5 . 8 , N, 1 1 , 1 , С яН„,М^О,3 т р е б . С, 6 9 . 7 ; Н, 5 . 4 ; N, 11.6» 5 Р (300 MPUiCDCljl 2.0 (6Н, га), 2 , 9 ( З Н , т) , 3.5 (2Н, S ) , 5.0 (1Н, S ) , 7 . 3 (ЮН, -л), 7 • > (2Н, d ) , 7.B5 (IH, d) и 3.05 (ЗН, d) И а й д С , 6 9 . 1 ; Н, 6 . 2 ; N, 9 . 7 . С ,Н .н.О„ 3/4Н.О т р е б . С, 69 1; И, 6 . 4 , И, 10.14 5Р(ЗОО МГц;СОС15) 2 . 0 (6Н7 ю ь 2 . 9 ( З Н , if j , 3.5 (?Н, s ) , 4.4 (2Н,
ДивитисяДодаткова інформація
Назва патенту англійськоюOxa and thiadiazole, a method for preparation thereof (variants), a pharmaceutical composition
Автори англійськоюWood Anthony
Назва патенту російськоюПроизводные окса- и тиадиазола, способ их получения (варианты), фармацевтическая композиция
Автори російськоюВуд Энтони
МПК / Мітки
МПК: C07D 417/04, A61P 25/28, A61K 31/454, C07D 413/04, A61P 25/00, C07D 413/14, C07D 417/14, A61K 31/445
Мітки: одержання, композиція, окса, спосіб, похідні, тіадіазолу, варіанти, фармацевтична
Код посилання
<a href="https://ua.patents.su/13-61068-pokhidni-oksa-ta-tiadiazolu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Похідні окса- та тіадіазолу, спосіб їх одержання (варіанти), фармацевтична композиція</a>
Попередній патент: Лікарський препарат для профілактики та лікування тканин пародонта
Наступний патент: Похідні 1(2н) хінолінкарбонової кислоти, спосіб їх одержання та спосіб одержання речовин з антибіотичними властивостями
Випадковий патент: Дозована форма з модифікованим вивільненням фебуксостату (варіанти)