Нуклеозиди з біциклічною цукровою складовою, олігонуклеотид та антивірусна фармацевтична композиція
Формула / Реферат
1. Нуклеозиди з біциклічною цукровою складовою, які мають загальну формулу
,
де Z являє собою метилен,
R1 є незалежно вибраним з групи, що містить аденін, цитозин, гуанін, гіпоксантин, урацил, тимін;
R2, R3 є незалежно вибраними з групи, що містить Н, ОН, DMTO, TBDMSO, ВnО, ТНРО, АсО, BzO, OP(NiPr2)O(CH2)2CN, ОРО3Н, дифосфат, трифосфат; R2 та R3 разом можуть бути PhCHO2, TIPDSO2 або DTBSO2.
2. Олігонуклеотид, що містить, принаймні, один мономер за п. 1.
3. Антивірусна фармацевтична композиція, яка містить активний початок та принаймні один фармацевтичнo прийнятний носій або розріджувач, яка відрізняється тим, що як активне начало вона містить сполуку за п. 1 у терапевтичнo ефективній кількості.
4. Фармацевтична композиція за п. 3, яка відрізняється тим, що вона має активність проти вірусу, що є вибраним з групи, яка складається з вірусу імунодефіциту людини (HIV) та вірусу гепатиту В (HBV).
5. Фармацевтична композиція за п. 3, яка відрізняється тим, що вона має активність проти вірусу імунодефіциту людини (HIV).
6. Фармацевтична композиція за п. 3, яка відрізняється тим, що вона має активність проти вірусу гепатиту В (HBV).
Текст
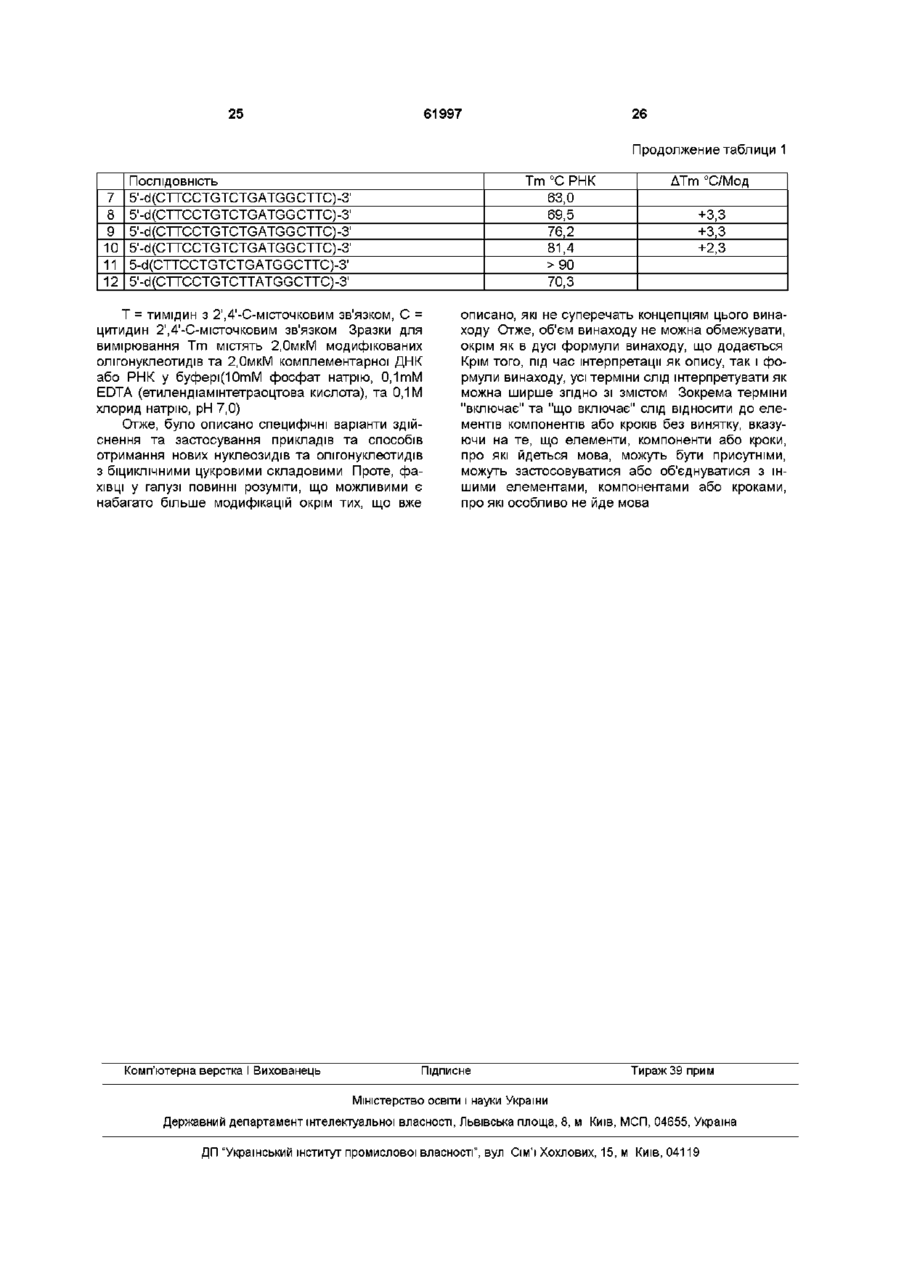
1 Нуклеозиди з біциклічною цукровою складовою, які мають загальну формулу де Z являє собою метилен, Ri є незалежно вибраним з групи, що містить аденін, цитозин, гуанін, гіпоксантин, урацил, тимін, F?2, R3 є незалежно вибраними з групи, що містить Н, ОН, DMTO, TBDMSO, ВпО, ТНРО, АсО, BzO, OP(NiPr2)O(CH2)2CN, OPO3H, дифосфат, трифосфат, R2 та R3 разом можуть бути РгіСНОг, TIPDSO2 або DTBSO2 2 Олігонуклеотид, що містить, принаймні, один мономер за п 1 3 Антивірусна фармацевтична композиція, яка містить активний початок та принаймні один фармацевтично прийнятний носій або розріджувач, яка відрізняється тим, що як активне начало вона містить сполуку за п 1 у терапевтично ефективній КІЛЬКОСТІ 4 Фармацевтична композиція за п 3, яка відрізняється тим, що вона має активність проти вірусу, що є вибраним з групи, яка складається з вірусу імунодефіциту людини (HIV) та вірусу гепатиту В (HBV) 5 Фармацевтична композиція за п 3, яка відрізняється тим, що вона має активність проти вірусу імунодефіциту людини (HIV) 6 Фармацевтична композиція за п 3, яка відрізняється тим, що вона має активність проти вірусу гепатиту В (HBV) q 1 O> Нуклеозидні та нуклеотидні аналоги давно застосовують як фармацевтичні інгредієнти проти численних вірусів та видів раку У теперішній час ряд нуклеозидних та нуклеотидних аналогів випробують у КЛІНІЧНИХ умовах для лікування декількох захворювань У КЛІТИНІ нуклеозиди та нуклеотиди фосфорилюються або далі фосфорилюються до ВІДПОВІДНИХ нуклеозидних трифосфатів Нуклеозидні трифосфати є інгібіторами ДНК- та РНК-полімераз Нуклеозидні трифосфати також можна включати у ДНК або РНК, що стає перешкодою для подовження ДНК або РНК Активні нуклеозидні аналоги взагалі легко фосфорилюються у КЛІТИНІ - мішені ВІДПОВІДНІ нуклеозидні трифосфати мають високий афінітет до каталітичних ділянок полімераз та конкурують з природними нуклеозидними трифосфатами як субстрат полімераз Певні нуклеозидні аналоги діють на нуклеозидному або монофосфатному рівні Однією групою перспективних нуклеозидних аналогів є нуклеозиди із конформаційно замкненими цукровими складовими Повідомлялося, ЩО певні конформаційно замкнені карбоциклічні нуклеозидні аналоги демонстрували сильну активність проти HCMV, HSV(Bipycy простого герпесу) та EBV(Bipycy Епштейна-Барда) [Siddiqui et al Nucleosides Nucleotides 1996, 15, 235 - 250, Marquez et al J Med Chem 1996, 39, 3739 - 3747] Повідомлялося, що конформаційно замкнений карбоциклічний AZT 5'трифосфат є рівносильним інгібітором зворотної транскриптази HIV(BIJl) [Marquez el al J Am Chem Soc 1998, 120, 2780 - 2789] Також приготу (О 61997 вали ІНШІ нуклеозиди з біциклічними цукровими складовими, проте у них не визначили ніякої активності або про активність не повідомлялося [Chao et al Tetrahedron 1997, 53, 1957 -1970, Okabe et al Tetrahedron left 1989, 30, 2203 - 2206, Hong, el al Tetrahedron Lett 1998, 39, 225 - 228] Очікується, що сприятливі конформаційно замкнені нуклеозиди позитивно впливатимуть на антисмислові олігонуклеотиди Олігонуклеотиди, як можливі антисмислові терапевтичні засоби, визначили та досліджували протягом двох десятиріч Олігонуклеотиди є здатними формувати подвійну або потрійну спіраль з комплементарною ДНК або РНК та мають здатність уціляти специфічні ПОСЛІДОВНОСТІ у вірусному та раковому геномі Специфічне зв'язування олігонуклеотидів з мішенями ДНК або РНК, які є предметом зацікавленості, може шактивувати функцію, пов'язану з ДНК або РНК, таку як реплікація, транскрипція та трансляція Отже, можна припинити вірусні цикли або раковий процес, не впливаючи при цьому на нормальні цикли клітин Через те, що природні олігонуклеотиди є лабільними до клітинних та зовнішньоклітинних нуклеаз, багато зусиль докладали стосовно дослідження олігонуклеотидних модифікацій, особливо модифікацій, спрямованих на підвищення СТІЙКОСТІ до нуклеази та афінітету зв'язування Продемонстрували, що олігонуклеотиди, що мають певні біциклічні нуклеозиди, мають підвищену СТІЙКІСТЬ ДО нуклеази [Leumann et al Bioorg Med Chem Letts 1995, 5, 1231 - 4, Altmann et al Tetrahedron Lett 1994, 35, 2331 - 2334, 7625 - 7628] Нещодавно синтезували та включили в олігонуклеотиди 2'О,4'-С-метиленрибонуклеозиди, що мають замкнену З'-ендо цукрову складку Дослідження гібридизації демонструють, що конформаційно замкнені нуклеозиди можуть суттєво підвищити гібридизацію модифікованих олігонуклеотидів з комплементарною РНК та ДНК [Obika et al Tetrahedron Lett 1997, 38, 8735 - 8738, Koshkm et al Tetrahedron 1998, 54, 3607 - 3630] Отже, існує необхідність у нових конформаційно замкнених нуклеозидах з біциклічними цукровими складовими Ці нові нуклеозиди повинні бути корисними у лікуванні вірусних, ракових та інших захворювань Крім того, олігонуклеотиди, що складаються з цих нових модифікованих нуклеозидів, повинні мати необхідну СТІЙКІСТЬ ДО КЛІТИННИХ нуклеаз та сильний афінітет зв'язування з нуклеїновими кислотами - мішенями Отже, ці олігонуклеотиди повинні бути потенційно корисними утерапм та діагностиці Описано конформаційно замкнені біциклічні цукрові нуклеозиди, що мають звичайну геометричну форму, та способи одержання конформаційно замкнених біциклічних цукрових нуклеозидів Пропонуються нуклеозиди, що мають біциклічні цукрові складові, та олігонуклеотиди, що включають наступну формулу де X, Y та Z є незалежно обраними з групи О, S, CH2, NR, С=О, С=СН2 або нічого, де R є обраним з групи водню, алкілу, алкенілу, алкінілу, ацилу, Ri є обраним з групи аденіну, цитозину, гуаніну, гіпоксантину, урацилу, тиміну, гетероциклів, Н, ОСНз, ОАс, галогену, сульфонату, R2, R3 є незалежно обраними з групи Н, ОН, DMTO, TBDMSO, ВпО, ТНРО, АсО, BzO, OP(NiPr2)O(CH2)2CN, ОРО3Н, РО3Н, дифосфату, трифосфату, R2 та R3 разом можуть бути PhCHO2, TIPDSO2 або DTBSO2 Передбачається, що описані тут нові нуклеозиди будуть корисними у лікуванні вірусних, ракових та інших захворювань Олігонуклеотиди, що складаються з цих модифікованих нуклеозидів, мають бажану фізіологічну СТІЙКІСТЬ та афінітет зв'язування, що дозволяє застосовувати їх у лікуванні та діагностиці Запропоновано інформаційно замкнені нуклеозиди, що мають З'-ендо цукрову складку, та способи їх приготування Способи приготування біциклічних нуклеозидних аналогів, про які повідомлялося раніше, не можна застосовувати до нових нуклеозидних аналогів, які описано тут Описані аналоги є наслідком успішного зв'язування між позиціями С2' та С4' рибози у нуклеозидних аналогах Скорочення, що застосовуються тут, позначають "Ас" - ацетил, "Вп" - бензил, "Bz" - бензоїл, "DMT" - диметокситритил, "ТНР" - тетрапдропіраніл, "TBDMS" - t-бутилдиметилсиліл, "TIPDS" - тетраїзопропілдисиліл та "DTBS" - ди^-бутил)силіл Синтез похідних рибофуранози з 2,4місточковим зв'язком 1-а-Метиларабшозу 1, яку було приготовлено згідно зі способом, надрукованим у Tejima et al J Org Chem 1963, 28, 2999 - 3003, захистили І.ІДЗ-тетраїзопропілдисилоксаніломЛІРЗ) у 03 та 05 і отримали 2, яку перетворили у кетон З шляхом обробки DMSO/DCC/TFA (ДМСО/ДСС/ТФА) Внаслідок наступної реакції Віттига та видалення TIPS отримали дуже гарний вихід алкену 4 Сполуку 4 захистили tбутилдиметилсилілом(ТВЗ) у 05 та бензилом(Вп) у 03 і отримали 5 Гідроборування 5 виконували за допомогою 9-BBN і отримали ВІДМІННИЙ ВИХІД виключно похідної 6 2-деокси-2-пдроксиметилу Похідна 6 2-деокси-2-пдроксиметилу зазнала тритилювання 4,4'-О-диметокситритил(0МТ) хлоридом, потім видалили TBS тетрабутиламонійфторидом(ТВАР) 1 отримали 7 Схема 1 ОМо TIPS ,н ВпО CM, Сполуку 7 окиснювали і отримали альдегід 8, який обробляли формальдегідом та гідроксидом натрію, внаслідок чого отримали ВІДМІННИЙ ВИХІД похідної 9 4-пдроксиметилу Внаслідок мезилювання 9 та наступного видалення DMT отримали 10 Внаслідок циклізації, яку виконували NaH у THF, та наступного видалення мезилу отримали біциклічний цукор 11 Обробка сполуки 11 ацетанпдридом у присутності DMAP дозволила отримати 12, в той час як обробка ацетанпдридом/оцтовою кислотою у присутності сірчаної кислоти дозволила отримати 13, у якій ацетокси у С1 має зворотну орієнтацію(і-р) порівняно з метокси 11 Схема 2 61997 метоксиду натрію з наступним пдрогенолізом отримали аналоги інозину 20 та 21, ВІДПОВІДНО > 1 X ІЮ 1 8 X - NH2 BnO W3~| Ч/ ОДс HO-1 0 / V/ *—OOMT ВнО *— ODMT 0 7 ОМе 19 X 20 X = OH 21 X = OH Внаслідок конденсації 13 з силілованим N ацетилгуаніном отримали похідну 22 а-гуанозину як головний продукт(30%), невелику КІЛЬКІСТЬ різомеру та І\І7-з'єднаних продуктів Внаслідок обробки похідної а-гуанозину аміаком у метанолі з наступним пдрогенолізом отримали біциклічний агуанозин 23 Синтез біциклонуклеозидів з 2',4'-місточковим зв'язком Біциклонуклеозиди, що мають цукрову складову з 2',4'-місточковим зв'язком, синтезували з конденсацій силілованих нуклеозидних основ БІЦИКЛІЧНІ цукри зображено нижче Внаслідок конденсації 13 з біс(триметилсиліл)тимшом отримали ВІДМІННИЙ вихід продукту 14, а-аномеру Обробка 14 ВСІз видалила одночасно ацетил та бензил, внаслідок чого отримали біциклічний а-тимідин 15 ВяО НО U IS Внаслідок конденсації 13 з 6-хлоро-9триметилсилілпурином отримали суміш а- та рпуринових нуклеозидів, 16 та 1/(співвідношення а р, від 1 1 до 2 3), які можна відокремити шляхом хроматографії Як описано вище, внаслідок реакцій конденсації отримали або виключно а-нуклеозид, або суміш а- та р-нуклеозидів, без переваги щодо раномерів Для того, щоб підвищити вихід рнуклеозидів, досліджували різні умови конденсації Температура має незначний вплив на співвідношення а-та р-аномерів Проте, зв'язувальний реагент та функціональна група на С1 цукру демонстрували значний вплив на співвідношення а- та рнуклеозидів Внаслідок конденсації 12 з біс- або три(триметилсиліл)піримідинами у присутності хлориду олова(І\/) отримали гарні виходи рнуклеозидів як головних продуктів Отже, реакція 12 з силілованим тиміном дозволила отримати похідну 24 тимідину у співвідношенні р а, що становило ~ 4 1 Внаслідок конденсації 12 з силілованим урацилом та N -бензоілцитозином отримали Внаслідок обробки 17 та 16 аміаком у метанолі з наступним пдрогенолізом отримали аналоги аденозину 18 та 19, ВІДПОВІДНО Пдрогеноліз потребував велику КІЛЬКІСТЬ каталізатору, а також збільшену тривалість реакції через підвищену стеричну перешкоду на цукровій складовій Внаслідок обробки 17 та 16 меркаптоетанолом у присутності ВІДПОВІДНІ нуклеозиди 25 та 26, ВІДПОВІДНО, у співвідношенні р а, що становило ~ 9 1 в обох реакціях Обробка 24 - 26 трихлоридом бору дозволила отримати піримідинові біциклонуклеозиди 27 - 29, ВІДПОВІДНО У випадку похідної цитидину, бензоільну групу 29 видалили шляхом обробки аміаком і отримали ЗО Альтернативний спосіб(не зображено) для приготування ЗО починався з 28, яку ацетилювали на 03' та 05' з наступною реакцією з триазолом та наступною обробкою аміаком 61997 8 біциклічного а-тимідину 15 після оптимізації геометри становить 37°, і згідно з цим спостерігали, що константа взаємодії становила 3,9Гц у протонному X ЯМР Кут закручування Н1'-С1'-С2'-Н2' у біциклічному р-тимідині 27 становив 96° після оптимізації геометри, та, як і сподівалися, не спостерігали ніякої взаємодії між Н1' та Н2' Дійсно, протон на С1' в усіх виміряних р-біциклонуклеозидах є єдиним піком Навпаки, в усіх виміряних аВвО біциклонуклеозидах протон на С1' є дуплетом з константою взаємодії ~ 4,0Гц 27 X = OH, Y = Me 24 X = ОН Y ~ Me Стереохімічні розподіли біциклонуклеозидів 25X = OH,Y=H 28 X = OH, Y = H далі підтвердилися рентгенівськими кристалічними 26 X = NBBz, Y = H структурами біциклічних ТИМІДИНІВ 15 та 27 Рибо30 X = NH, Y = H зне кільце цукрової складової дюксабіцикло[3,2,1]октану в обох сполуках приймає звичайну Також досліджували конденсацію 12 з силілоСЗ'-ендо цукрову складку, проте кільце, що склаваними пуринами, разом з якими застосовували дається з шести членів у цукровій складовій, прихлорид олову(І\/) як зв'язувальний реагент На ймає форму стільця Тимшова основа в обох сповідміну від реакції з піримідинами, внаслідок конлуках має антиорієнтацію денсації силілованого 6-хлорпурину з 12 отримали Синтез фосфорамідитів біциклонуклеозидів з не лише а- та р-нуклеозиди 16 та 17, а також і N72,4-місточковим зв'язком зв'язувальний продукт(не показано) Подібним БІЦИКЛІЧНИЙ р-тимідин 27, біциклічний p-N4чином, внаслідок конденсації силілованого N2бензоілцитидин 29 та біциклічний p-N4ацетилгуаншу з 12 отримали суміш трьох продук7 ацетилцитидин 29 захистили за допомогою DMT, a тів І\І -зв'язаний р-нуклеозид 31(42%), бажаний рпотім перетворили у ВІДПОВІДНІ фосфорамідити, нуклеозид 32(10%) та а-нуклеозид 22(6%) Проте, ВІДПОВІДНО Через стеричну перешкоду зросла внаслідок нагрівання з силілованим N2тривалість реакції ацетилгуаніном у присутності триметилсилілтрифлату, N -зв'язаний продукт 31 частково перетворився у №-зв'язані а- та р-біциклонуклеозиди 22(~ 22%) та 32(~ 25%) Виділений 32 зазнав таких самих обробок, що і 22, внаслідок чого отримали біциклічний р-гуанозин 33 При цьому способі отримали помірний вихід ЗО НІЇЛс 34 X = ОН Y = Me 37 X = ОН, У = Me 35 X = NHAc Y - Н ВвО Стереохімічні розподіли похідної 11 2,6дюксабіцикло[3,2,1]октану та біциклонуклеозидів, створених шляхом конденсації біциклічних цукрів з силілованими нуклеозидними основами, можна розподілити шляхом протонного ядерного магнітного резонансу(ЯМР) з використанням ядерного ефекту Оверхаузера Згідно з моделлю "стрижень - куля" система жорсткого кільця дюксабіцикло[3,2,1]октану примушує протони(Н1' та Н2') на С1' та С2' а-біциклонуклеозидів стати майже паралельними, у той час коли Н1' та Н2' у рбіциклонуклеозидах спрямовуються у протилежні боки Наприклад, кут закручування Н1'-С1'-С2'-Н2' Приклади Способи синтезу, які застосовують для приготування описаних сполук, також можна застосовувати для того, щоб синтезувати ІНШІ сполуки з формули винаходу Цей винахід включає, проте не обмежується ними, сполуки, виготовлені згідно з описом наступних прикладів Числа у круглих дужках після назв сполук у прикладах відповідають номерам структур у розділі докладного опису Приклад 1 Приготування 1-а-метил-3,5-О-(1,1,3,3тетраізопропіл-1,3-дисилоксандпл)-Орибофуранози(2) а-Метиларабшозу приготували за способом, надрукованим у Tejima, S , Fletcher, Jr H G J Org Chem 1963, 28, 2999 - 3003, та відокремили від и р-аномеру(менша КІЛЬКІСТЬ продукту) шляхом хроматографії на дюксиді кремнію До перемішаного розчину а-метиларабшози(19,27г, 119,9ммоль) у безводному піридині(200мл) при 0°С додали 1,3дихлоро-1,1,3,3-тетраізопропілдисилоксан(38,4мл, 119,9ммоль) Стриманий розчин перемішували при 0°С протягом 1 години, а потім при кімнатній температурі протягом 1,5 години Розчин охолодили до 0°С і додали воду(20мл) Суміш перемішу 61997 10 THF(180Mn) Отриманий розчин залишили на 1 годину при кімнатній температурі THF випарили, а залишок зазнав хроматографії на дюксиді кремнію 10% ЕЮН в метиленхлориді, внаслідок чого отримали 14,6г(88%) сполуки, вказаної у заголовку, у вигляді сиропу Приклад 5 Приготування 3-О-бензил-5-О-(1> бутилдиметилсиліл)-2-деокси-2-метилен-1-аметил-О-рибофуранози(5) Розчин 2-деокси-2-метилен-1-а-метил-Орибофуранози(13,7г, 85,5ммоль) та TBDMSС1 (13,5г, 89,6ммоль) у безводному піридині(130мл) настоювали при кімнатній температурі протягом 15 годин Після охолодження до 0°С та додавання води(2мл) отриману суміш перемішували при кімнатній температурі протягом 1 години, концентрували до половини об'єму, розвели ЕЮАс, промили соляним розчином, висушили(Ма23О4) та концентрували до сухості Ретельно висушений сирий продукт розчинили у THF(70Mn) та додали до перемішаної суміші NaH(60% у мінеральному маслі, 5,6г, 140ммоль) в THF(350Mn) при 0°С Після перемішування протягом 40 хвилин при кімнатній температурі додали бензилбромід(10,75мл, 90,5ммоль) Реакційну суміш перемішували протягом 4 годин та охолоджували до 0°С, а потім повільно додавали воду(2мл) і потім 10% АсОН у воді, доки рН не становив 7 Суміш розвели ЕЮАс, промили соляним розчином, потім розвели бікарбонатом натрію, висушиnn(Na2SO4) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 0 10% ЕЮ Ас у гексанах отримали 23,8г(76%) вказаної у заголовку сполуки у вигляді безбарвної рідиПриклад З ни, f H ЯМР (CDCI3) 5 0,01 (s, ЗН, S1CH3), 0,02(s, ЗН, Приготування 2-деокси-2-метилен-1-а-метилSiCH3), 0,85(s, 9Н, t-Bu), 3,41 (s, ЗН, ОСНз), 3,603,5-О-(1,1,3,3-тетраізопропіл-1,3-дисилоксандмл)3,72(m, 2Н, Н5а, H5b), 4,20(dd, J = 8,7Гц, 4,5Гц, 1Н, D-рибофуранози НЗ), 4,57, 4,66(АВ, J = 12,0Гц, 2Н, Bn), 5,22(t, J = До перемішаної суспензії метилтрифенілфос1,2Гц, 1Н, Н1), 5,38(t, J = 1,5Гц, 1Н, Н2а'), 5,43(m, J фонійброміду(21,5г, 60,1 ммоль) у безводному = 1,2Гц, 1Н, Н2Ь), 7,23-7,37(т, 5Н, Вп), Обчислено ефірі(1380мл) при кімнатній температурі в атмосдля C20H32O4S1 С, 65,89, Н, 8,85 Знайдено С, фері аргону додали розчин t-пентоксиду на65,92, Н, 9,22 трію(5,97г, 54,0ммоль) у безводному бензолі(50мл) Отриману блідожовту суміш Приклад 6 перемішували при кімнатній температурі протягом Приготування 3-О-бензил-5-О-(1> 6 годин та охолоджували до -10°С, потім додали бутилдиметилсиліл)-2-деокси-2-пдроксиметил-1-арозчин 2-С,2-О-дидепдро-а-метил-3,5-О-(1,1,3,3метил-О-рибофуранози(б) тетраізопропіл-1,3-дисилоксандмл)-ОДо перемішаного розчину 3-О-бензил-5-О-(1> рибофуранози(12,1г, 30,1 ммоль) в ефірі(35мл) бутилдиметилсиліл)-2-деокси-2-метилен-1-аРеакційну суміш перемішували при -10°С протягом метил-О-рибофуранози(5,28г, 14,50ммоль) в ат1 години, ДВІЧІ промили соляним розчином, висумосфері аргону додали 9-BBN(0,5M в THF, 87мл) LUHnn(Na2SO4) та концентрували Внаслідок хроОтриманий розчин перемішували при температурі матографії на дюксиді кремнію 5% ЕЮАс у гексанавколишнього середовища протягом 1 години, нах отримали 11,0г(91%) вказаної у заголовку потім при 40°С протягом ночі, охолодили до кімна1 сполуки у вигляді безбарвного сиропу, Н ЯМР тної температури та перенесли до колби, що міс(CDCI3) 5 1,00-1,12(171, 28Н, TIPDS), 3,45(s, ЗН, тила перборат тетрапдрат натрію(13,39г, ОСНз), 3,73(dt, J = 9,0Гц, 3,0Гц, 1Н, Н4), 4,02, 87ммоль) у воді(85мл) та етанолі(85мл) Отриману 4,03(2s, 2Н, Н5), 4,62(dt, J = 9,0Гц, 2,7Гц, 1Н, НЗ), суміш інтенсивно перемішували при 50°С протя5,27(т, 1Н, Н1), 5,32-5,36(т, 2Н, Н21) гом 4 годин, охолодили до 0°С, нейтралізували АсОН до рН 8 та концентрували до невеликого Приклад 4 об'єму Об'єм, що залишився, розвели воПриготування 2-деокси-2-метилен-1-а-метилдою(20мл) та екстрагували тричі метиленхлориО-рибофуранози(4) дом Комбінований органічний шар ДВІЧІ промили До перемішаного розчину 2-деокси-2-метиленсоляним розчином, висушили(Ма23О4) та концент1 -а-метил-3,5-О-(1,1,3,3-тетраізопропіл-1,3рували до сухості Внаслідок хроматографії на дисилоксандмл)-О-рибофуранози(35,0г, дюксиді кремнію ЕЮАс-гексанами(1 2) отримали 87,1 ммоль) у THF(200Mn) додали 1,0М TBAF у вали протягом 10 хвилин і розвели ЕЮАс Водний шар екстрагували ЕЮАс Комбінований органічний шар висушили^агЭС^) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 15% ЕЮАс у гексанах отримали 42,7г(88%) вказаної у заголовку сполуки у вигляді безбарвного сиропу Приклад 2 Приготування 2-С,2-О-дидепдро-а-метил-3,5О-(1,1,3,3-тетраізопропіл-1,3-дисилоксандмл)-Орибофуранози(З) До перемішаного розчину 1-а-метил-3,5-О(1,1,3,3-тетраізопропіл-1,3-дисилоксандмл)-Орибофуранози(42,6г, 104,9ммоль) та ДСС(43,4г, 209,8ммоль) у безводному ДМСО(250мл) та ефірі(ЮОмл) при 0°С в атмосфері аргону додали розчин трифторооцтової кислоти(4,04мл, 52,5ммоль) та піридину(8,44мл, 105ммоль) в ДМСО(ЗОмл) Отриману в результаті реакції суміш нагрівали до кімнатної температури, перемішували протягом 5 годин, а потім охолоджували до 0°С Додали щавлеву кислоту(21,3г, 236ммоль) в метанолі(бОмл), а потім додали воду(ЗОмл) Отриману суміш перемішували при кімнатній температурі протягом 1 години, а осад відфільтрували та ретельно промивали гексанами Фільтрат потім розвели гексанами, промили п'ять разів водою, висушили(Ма23О4) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 2% МеОН у метиленхлориді-гексанах(1 2) отримали 37,6г(89%) вказаної у заголовку сполуки у вигляді безбарвного сиропу, 1Н ЯМР (CDCI3) 6 1,00-1,12(171, 28Н, TIPDS), 3,47(s, ЗН, ОСНз), 4,05-4,19(171, ЗН, Н4, Н5а, Н5Ь), 4,51 (dd, J = 9,3Гц, 1,5Гц, 1Н, НЗ), 4,89(t, J = 1,5Гц, 1Н, Н1) 12 11 61997 5,17г(93%) зазначеної в заголовку сполуки у ви14,08ммоль) та формальдепду(37% у воді, 85мл) у 1 гляді безбарвного сиропу, Н ЯМР (CDCI3) 5 0,03(s, дюксані(420мл) при 0°С додавали краплями вод6Н, SiCHs), 0,87(s, 9Н, t-бутил), 2,34-2,43(m, 1Н, ний розчин NaOH(2,0M, 210мл) протягом 15 хвиН2), 3,39(s, ЗН, ОСНз), 3,48(dd, J = 10,5Гц, 6,0Гц, лин Отриманий каламутний розчин перемішували 1Н, Н5а), 3,60(dd, J = 10,5Гц, 3,6Гц, 1Н, Н5Ь), при кімнатній температурі протягом 2 днів, доки він 1 3,88(d, J = 7,2Гц, 2Н, Н2 ), 3,98(dd, J = 7,2Гц, 2,7Гц, не став прозорим розчином Після охолодження до 1Н, НЗ), 4,17(т, 1Н, Н4), 4,44, 4,66(АВ, J = 12,3Гц, 0°С розчин нейтралізували 10% оцтовою кислотою 2Н, Bn), 4,95(d, J = 5,4Гц, 1Н, Н1), 7,23-7,36(m, 5H, до рН 8, концентрували до невеликого об'єму, Вп), Обчислено для C20H34O5S1 С, 62,79, Н, 8,96, розвели водою(ЮОмл) та тричі екстрагували меЗнайдено С, 62,92, Н, 9,21 тиленхлоридом Комбінований органічний шар промили соляним розчином, висушили(Ма23О4) та Приклад 7 концентрували до сухості Внаслідок хроматограПриготування 3-О-бензил-2-деокси-2-(4,4'фії на дюксиді кремнію 4 - 5% етанолом у метидиметокситритилоксиметил)-1-а-метил-Оленхлориді отримали 8,11г(94%) вказаної в загорибофуранози(7) 1 ловку сполуки у вигляді білої піни, Н ЯМР (CDCI3) Розчин 3-О-бензил-5-О-(1:-бутилдиметилсиліл)1 1 5 2,46-2,57(т, 1Н, Н2), 3,23-3,73(т, 9Н, Н5, Н4 , Н2 2-деокси-2-пдроксиметил-1-а-метил-ООСНз), 3,79(d, J = 1,8Гц, 6Н, DMT), 4,14(d, J = рибофуранози(6,60г, 17,28ммоль) та DMT-CI(7,03r, 6,9Гц, 1Н, НЗ), 4,43, 4,47(АВ, J = 12Гц, 2Н, Вп), 20,74ммоль) у безводному піридині(50мл) настою4,97(d, J = 4,8Гц, 1Н, Н1), 6,77-6,85(т, 4Н, DMT), вали при кімнатній температурі протягом ночі, і 7,11-7,46(171, 14Н, Bn, DMT) реакцію загасили шляхом додавання води(8мл) Отриманий розчин настоювався протягом 10 хвиПриклад 10 лин, потім його розвели ЕЮ Ас, тричі промили соПриготування 3-О-бензил-2-деокси-2ляним розчином, висушили(Ма23О4) та концентрупдроксиметил-5-О-мезил-4-мезилоксиметил-1-авали, внаслідок чого отримали сирий продукт 9, метил-О-рибофуранози(10) який розчинили у THF(52Mn) Додали TBAF(1,0M у До перемішаного розчину З-О-бензил-2THF, 26мл), та отриманий розчин настоювався при деокси-2-(4,4'-диметокситритилоксиметил)-4-Скімнатній температурі протягом ЗО хвилин Випапдроксиметил-1-а-метил-О-рибофуранози(7,80г, рили THF, а залишок піддали хроматографії на 13,0ммоль) у безводному піридині(бОмл) при 0°С в дюксиді кремнію ЕЮАс-гексаном(1 1), внаслідок атмосфері аргону додавали краплями метансульчого отримали 9,28г(94%) вказаної в заголовку фонілхлорид(3,03мл, ЗЭммоль) Отриману реаксполуки у вигляді білої піни, 1Н ЯМР (CDCI3) 5 ційну суміш перемішували при кімнатній темпера2,33-2,42(т, 1Н, Н2), 3,26-3,63(т, 7Н, Н5а, Н5Ь, турі протягом 45 хвилин, охолоджували до 0°С і Н2а', Н2Ь', ОСНз), 3,79(d, J = 1,2Гц, 6Н, DMT), розвели шляхом додавання води(5мл) Отриману 3,91 (dd, J = 7,5Гц, 2,4Гц, 1Н, НЗ), 4,13(т, 1Н, Н4), суміш перемішували при кімнатній температурі 4,41, 4,50(АВ, J = 12,9Гц, 2Н, Bn), 5,05(d, J = 5,1 Гц, протягом 15 хвилин, розвели ЕЮАс, тричі промили 1Н, Н1), 6,78-6,85(т, 4Н, DMT), 7,14-7,47(т, 14Н, соляним розчином, висушили(Ма23О4) та концентBn, DMT), Обчислено для С35Нз8О7 С, 73,66, Н, рували, внаслідок чого отримали сирий продукт у 6,71 Знайдено С, 73,57, Н, 6,76 вигляді білої піни, який розчинили у АсОН-воді(80 20, 400мл) Отриманий розчин настоювали при Приклад 8 кімнатній температурі протягом 2 годин, його розПриготування 3-О-бензил-2-деокси-2-(4,4'вели водою(200мл) і концентрували до приблизно диметокситритилоксиметил)-5-С,5-О-дидепдро-1чверті об'єму Додали воду(ЮОмл) і суміш концена-метил-О-рибофуранози(8) трували до сухості Внаслідок хроматографії на До перемішаного розчину З-О-бензил-2дюксиді кремнію ЕЮАс-гексанами(3 1-1 0) деокси-2-(4,4'-диметокситритилоксиметил)-1-аотримали 5,32г(90%) вказаної в заголовку сполуки метил-О-рибофуранози(9,18г, 16,16ммоль) та у вигляді напівтвердої речовини, 1Н ЯМР (CDCI3) 5 ДСС(10,0г, 48,49ммоль) у безводному 2,43-2,54(т 1Н, Н2), 3,01 (s ЗН, OMs) 3,03(s, ЗН, ДМСО(бОмл) при 10°С додали розчин трифторооOMs), 3,41 (s, ЗН, ОСНз), 3,81 (d, J = 4,8Гц, 2Н, Н21), цтової кислоти(0,622мл, 8,08ммоль) та піриди4,01, 4,04(АВ, J = 10,5Гц, 2Н, Н41), 4,21 (d, J = 7,5Гц, ну(1,95мл, 24,24ммоль) в ДМСО(15мл) Отриману 1Н, НЗ), 4,30, 4,50(АВ, J = 1,8Гц, 2Н, Н5), 4,56, реакційну суміш перемішували при 10°С протягом 4,63(АВ, J = 12,0Гц, 2Н, Bn), 4,99(d, J = 5,1 Гц, 1Н, 1 години, при кімнатній температурі протягом 6 Н1), 7,30-7,42(т, 5Н, Вп), Обчислено для годин, а потім охолодили до 0°С Після додавання C17H27O10S2 С, 44,82, Н, 5,97, Знайдено С, 44,68, води(8мл) суміш перемішували протягом ночі та Н, 6,00 розвели ЕЮАс Осад відфільтрували та ретельно промили соляним розчином, висушили(Ма23О4) та Приклад 11 концентрували до сухості Внаслідок хроматограПриготування (1S,3S,4R,8S)-8-6eH3nnoKCH-1фії на дюксиді кремнію ЕЮАс-гексанами(1 1) пдроксиметил-З-метокси-2,6отримали 8,26г(90%) вказаної в заголовку сполуки дюксабіцикло[3,2,1]октану(11) у вигляді білої піни До перемішаної суміші NaH(60% у мінеральПриклад 9 ному маслі, 1,83г, 22,90ммоль) у безводному THF(200Mn) додали розчин 3-О-бензил-2-деокси-2Приготування 3-О-бензил-2-деокси-2-(4,4'пдроксиметил-5-О-мезил-4-мезилоксиметил-1-адиметокситритилоксиметил)-4-С-пдроксиметил-1метил-О-рибофуранози(5,20г, 11,45ммоль) в а-метил-О-рибофуранози(9) THF(30Mn) Отриману реакційну суміш перемішуДо перемішаного розчину З-О-бензил-2вали при 55°С протягом 42 годин і загасили реакдеокси-2-(4,4'-диметокситритилоксиметил)-5-С,5цію шляхом додавання води при 0°С THF випароО-дидепдро-1-а-метил-О-рибофуранози(8,0г, 13 вували і додавали водний NaOH(0,5M, 250мл) Отриману суміш нагрівали у колбі зі зворотним холодильником протягом 24 годин, охолоджували до 0°С, нейтралізували розведеною соляною кислотою до рН 8, екстрагували 4 рази метиленхлоридом Комбінований органічний шар висушиnn(Na2SO4) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію ЕЮАс-гексанами(2 1 - 1 0) отримали 3,16г(98%) вказаної в заголовку сполуки у вигляді безбарвного сиропу, 1 Н ЯМР (CDCI 3 ) 5 2,32(m, 1Н, Н2), 3,41 (d, J = 11,4Гц, 1Н, Н4а'), 3,46-3,60(т, 2Н, 5Н, Н5, ОСНз), 3,91 (d, J =11,1 Гц, 1Н, H4b'), 3,92(dd, J = 10,8Гц, 2,4Гц, 1Н, Н2а'), 4,01 (d, J = 5,4Гц, 1Н, НЗ), 4,04(d, J = 10,5Гц, 1Н, Н2Ь'), 4,58, 4,64(АВ, J = 12,0Гц, Bn), 5,07(d, J = 3,9Гц, 1Н, Н1), 7,28-7,40(т, 5Н, Вп) Приклад 12 Приготування (1 R,3S,4R,8S)^eTOKCHMeTnn-8бензилокси-З-метокси-2,6дюксабіцикло[3,2,1]октану(12) Розчин(1 R,3S,4R,8S)-8-6eH3nnoKCH-1 пдроксиметил-З-метокси-2,6дюксабіцикло[3,2,1]октану(1,60г, 5,71ммоль), ацетанпдриду(1,08мл, 11,42ммоль) та DMAP(2,09r, 17,13ммоль) у безводному метиленхлориді(Юмл) перемішували при кімнатній температурі протягом 2 годин, охолоджували до 0°С та розвели метанолом(4мл) Суміш перемішували при кімнатній температурі протягом 15 хвилин, розвели метиленхлоридом, промили соляним розчином, а потім 10% NaHCO3, висушили^агЗСч) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію етилацетатом-гексанами(1 1) отримали 1,82г(99%) вказаної в заголовку сполуки у вигляді безбарвного сиропу, 1 Н ЯМР (CDCI 3 ) 5 2,02(s, ЗН, ОАс), 2,33(т, 1Н, Н2), 3,50(d, J = 10,8Гц 1Н, Н4а 1 ), 3,57(s, ЗН, ОСНз), 3,86-4,04(m, 5H, Н2а', Н2Ь', НЗ, Н4Ь', Н5а), 4,14(d, J = 12,0Гц, 1Н, Н5Ь), 4,50, 4,64(АВ, J = 12,0Гц, 1Н, Bn), 5,09(d, J = 3,9Гц, 1Н, Н1), 7,29-7,42(т, 5Н, Вп), Обчислено для Сі 7 Н 2 2О 6 С, 63,34, Н, 6,88, Знайдено С, 63,41, Н, 6,94 Приклад 13 Приготування (1R,3S,4R,8S)-3-a4eTOKCH-1ацетоксиметил-8-бензилокси-2,6дюксабіцикло[3,2,1]октану(13) До перемішаного розчину (1S,3S,4R,8S)-8бензилокси-1-пдроксиметил-3-метокси-2,6дюксабіцикло[3,2,1]октану(600мг, 2,14ммоль) у суміші оцтової кислоти(б.Омл) та ацетанпдриду(0,6мл) при 0°С додавали краплями концентровану сірчану кислоту(57мкл, 1,07ммоль) Отриману реакційну суміш перемішували при 0°С протягом 10 хвилин, а потім при кімнатній температурі протягом 2 годин Після охолодження до 0°С розчин розвели ЕЮ Ас, тричі промили соляним розчином, а потім 10% бікарбонатом натрію, висушили(Ма23О4) та концентрували до сухості Внаслідок хроматографії на дюксиді кремнію ЕЮАс-гексанами(2 3) отримали 696мг(93%) вказаної в заголовку сполуки(р-аномер) та 31мг(3%) а-аномеру, обидві сполуки мали вигляд безбарвного сиропу, [З-Аномер затверднув після знаходження при кімнатній температурі протягом днів, точка плавлення(т п л ) 55 - 58°С, 1 Н ЯМР (CDCI 3 ) 5 2,03(s, ЗН, ОАс), 2,08(5, ЗН, ОАс), 2,36-2,39(т, 61997 14 1Н, Н2), 3,49(d, J = 10,8Гц, Н4а'), 3,73(d, J = 11,1 Гц, 2,7Гц, 1Н, Н2а'), 3,89(d, J = 11,1 Гц, 1Н, H4b'), 4,01 (d, J = 11,1 Гц, 1Н, H2b'), 4,03(d, J = 9,3Гц, 1Н, H5a), 4,14(d, J = 5,1 Гц, 1H, НЗ), 4,55(d, J = 9,6Гц, 1H, H5b), 4,55, 4,64(AB, J = 11,7Гц, 2Н, Bn), 6,39(s, 1H, H1), 7,29-7,42(m, 5H, Bn), Обчислено для Ci 8 H 2 2O 7 С, 61,70, H, 6,33, Знайдено С, 61,74, Н, 6,46 Приклад 14 Приготування (1R,3S,4R,8S)-1^eTOKCHMeTnn8-бензилокси-3-(тимш-1-іл)-2,6дюксабіцикло[3,2,1]октану(14) Суміш тимшу(189мг, 1,5ммоль) та безводного сульфату амонію(15мг) в HMDS(6Mn) нагрівали у колбі зі зворотним холодильником протягом ночі Після видалення HMDS залишок випаровували безводним m-ксилолом, висушували в умовах вакууму протягом ЗО хвилин і розчинили у розчин н і R,3S,4R,8S)-3^eTOKCH-1 -ацетоксиметил-8бензилокси-2,6-дюксабіцикло[3,2,1]октану (306мг, 0,87ммоль) в 1,2-дихлороетані(5мл) До цього перемішаного розчину в атмосфері аргону додали краплями триметилсилілтрифлат(0,38мл) в 1,2дихлороетані(2мл) Отриманий розчин нагрівали у колбі зі зворотним холодильником протягом 2 годин, охолодили до 0°С, розвели хлороформом та нейтралізували 10% ЫаНСОз(10мл) ВІДДІЛИЛИ органічний шар та водний шар ДВІЧІ екстрагували хлороформом Комбінований органічний шар висушили (Na2SO4) та концентрували до сухості Внаслідок кристалізації з ЕЮАс-СНгСЬ отримали вказану в заголовку сполуку(303мг, 83%) у вигляді безбарвної твердої речовини, т пл 1 9 8 - 2 0 0 ° С , 1 Н ЯМР (CDCI 3 ) б 1,94(d, J = 1,2Гц, 1Н, АгСН 3 ), 2,04(s, ЗН, ОАс), 2,93(т, 1Н, Н21), 3,50(dd, J = 11,8Гц, 2,1 Гц, 1Н, Н2а"), 3,59(d, J = 11,4Гц, 1Н, Н4а"), 4,016(d, J = 11,7Гц, 1Н, H4b"), 4,022(d, J = 12,6Гц, 1Н, Н5а'), 4,09(d, J = 12,0Гц, 1Н, H2b"), 4,11(d, J = 4,5Гц, 1Н, НЗ1), 4,27(d, J = 12,6Гц, 1Н, Н5Ь'), 4,53, 4,70(АВ, J = 11,7Гц, 2Н, Bn), 5,88(d, J = 3,6Гц, 1Н, НГ), 7,30-7,42(т, 5Н, Вп), 7,74 (d, J = 1,5Гц, 1Н, Н6), 8,79(s, 1H, NH), Обчислено для C21H24N2O7 C, 60,57, Н, 5,81, N, 6,73, Знайдено С, 60,55, Н, 5,84, N, 6,69 Приклад 15 Приготування (1S.3S 4R,8S)-8-riflpoKCH-1пдроксиметил-3-(тимш-1-іл)-2,6дюксабіцикло[3,2,1]октану(15) До розчину (1R,3S,4R,8S)-1^eTOKCHMeTnn-8бензилокси-3-(тимш-1 -іл)-2,6дюксабіцикло[3,2,1]октану у безводному метиленхлориді(Змл) при 10°С додали трихлорид бору(1,0М в СН2СІ2, бмл) Отриману реакційну суміш перемішували протягом ночі при 15°С з підвищенням до кімнатної температури та охолодили до 0°С Метанол(1,5мл) додавали краплями і отриману суміш перемішували при 0°С протягом 15 хвилин, а потім додали триетиламш(2мл) Розчинник випаровували, а осад ретельно екстрагували теплим ацетоном Ацетоновий розчин висушиnn(Na2SO4) і концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 10% метанолом у хлороформі отримали 99мг сполуки 20 у вигляді білої піни Після кристалізації з ацетону отримали 95мг(93%) вказаної в заголовку сполуки у вигляді безбарвної твердої речовини,т пл 225 - 226°С, 1 Н 15 ЯМР (ДМСО-de) 5 1,76(d, J = 0,9Гц, 1Н, ArCH 3 ), 2,45(171, 1Н, Н21), 3,25(dd, J = 11,4Гц, 2,1 Гц, 1Н, Н2а"), 3,32-3,52(т, 2Н, Н51), 3,53(d, J = 11,4Гц, 1Н, Н4а"), 3,72(d, J = 11,1 Гц, 1Н, H4b"), 3,93(d, J = 11,1 Гц, 1Н, Н2Ь"), 4,16(т, 1Н, НЗ1), 4,84(t, J = 6,0Гц, 1Н, ОН), 5,74(d, J = 4,2Гц, 1Н, НГ), 5,84(d, J = 3,9Гц, 1Н, ОН), 7,76(d, J = 1,2Гц, 1Н, Н6), 11,32(s, 1Н, NH), MS m/z 285(MH + ), Обчислено для Ci 2 Hi6N 2 O6, С, 50,70, Н, 5,67, N, 9,85, Знайдено С, 50,85, Н, 5,68, N, 9,75 Приклад 16 Приготування (1R,3R,4R,8S)-1^eTOKCHMeTnn8-бензилокси-3-(6-хлорпурин-9-іл)-2,6діоксабіцикло[3,2,1]октану(17) та (1R,3S,4R,8S)-1ацетоксиметил-8-бензилокси-3-(6-хлорпурин-9-іл)2,6-дюксабіцикло[3,2,1]октану(16) Суміш 6-хлорпурину(246мг, 1,6ммоль) та HMDS(8,0Mn) нагрівали у колбі зі зворотним холодильником в атмосфері аргону протягом 2 годин HMDS випаровували, а залишок висушували в умовах вакууму протягом ЗО хвилин, а потім розчинили у po34HHi(1R,3S,4R,8S)-3^eTOKCH-1ацетоксиметил-8-бензилокси-2,6дюксабіцикло[3,2,1]октану(302мг, 0,83ммоль) у безводному 1,2-дихлороетані(5,0мл), потім додали триметилсилілтрифлат(0,38мл, 2,25ммоль) в 1,2дихлороетані(2,0мл) Отриманий розчин нагрівали у колбі зі зворотним холодильником в атмосфері аргону протягом 45 хвилин Кінцева стадія обробки була такою самою, як описано раніше Після хроматографії на ДІОКСИДІ кремнію ЕЮАс-гексанами(1 1) отримали (1R,3S,4R,8S)-1^eTOKCHMeTnn-8бензилокси-3-(6-хлорпурин-9-іл)-2,6дюксабіцикло[3,2,1]октан(122мг, а-аномер) та (1 R,3R,4R,8S)-1 -ацетоксиметил-8-бензилокси-3-(6хлорпурин-9-іл)-2,6-дюксабіцикло[3,2,1]октан (157мг, (3-аномер), обидва мали вигляд безбарвної твердої речовини Загальний вихід становив 75% а-ізомер 1 Н ЯМР (CDCI 3 ) 5 2,05(s, ЗН, ОАс), 2,89(т, 1Н, Н21), 3,23(dd, J = 12,0Гц, 2,4Гц, 1Н, H2a"), 3,72(d, J = 11,7Гц, Н4а"), 4,09(d, J = 12,3Гц, 2Н, Н4", Н5а'), 4,13(d, J = 13,2Гц, 1Н, H2b"), 4,24(d, J = 4,8Гц, НЗ1), 4,29(d, J = 12,3Гц, 1Н, Н5Ь'), 4,60, 4,74(АВ, J = 11,7Гц, 2Н, Bn), 6,50(d, J = 4,2Гц, 1Н, НГ), 7,32-7,44(т, 5Н, Bn), 8,69(s, 1Н, Н8), 8,78(s, 1Н, Н2) [3-ізомер т пл 124 - 125°С(ЕЮАсгексани), 1 Н ЯМР (CDCI 3 ) 5 2,05(s, ЗН, ОАс), 2,90(т, 1Н, Н21), 3,55(d, J = 11,1 Гц, Н4а"), 3,954,03(m, 2Н, Н2а", H4b"), 4,18-4,24(m, ЗН, Н51 H2b"), 4,32(d, J = 4,8Гц, НЗ1), 4,47, 4,63(AB, J = 11,7Гц, 2Н, Bn), 6,52(s, 1H, НГ), 7,24-7,35(m, 5H, Bn), 8,40(s, 1H, H8), 8,72(s, 1H, H2), Обчислено для C21H21N4O5CI С, 56,70, H, 4,76, N, 12,59, Знайдено С, 56,36, Н, 4,56, N, 12,37 Приклад 17 Приготування (1R,3S,4R,8S)-1^eTOKCHMeTnn3-(І\І 2 -ацетилгуанін-9-іл)-8-бензилокси-2,6дюксабіцикло[3,2,1]октану(22) Суміш N -ацетилгуаншу(193мг, 1,0ммоль) та сульфату амонію(20мг) в піридині(1,0мл) та HMDS(5,0Mn) нагрівали у колбі зі зворотним холодильником протягом 3 годин в атмосфері аргону Отриманий прозорий розчин концентрували та випарювали разом з ксилолом(10мл, висушений натрієм) Залишок висушували в умовах вакууму при 50°С протягом 1 години та розчинили у розчи 61997 16 ні(Ш,33^,83)-3-ацетокси-1-ацетоксиметил-8бензилокси-2,6-дюксабіцикло[3,2,1]октану(175мг, 0,5ммоль) у безводному 1,2-дихлороетані(5,0мл), потім додавали триметилсилілтрифлат(0,27мл, 1,5ммоль) у 1,2-дихлороетані(1,0мл) Отриманий розчин перемішували при кімнатній температурі в атмосфері аргону протягом ЗО хвилин, потім нагрівали при 70 - 75°С протягом 2 годин, охолоджували до 0°С та нейтралізували 10% бікарбонатом натрію(Юмл) Отриману суміш перемішували протягом 15 хвилин і відокремили органічний шар Водний шар ДВІЧІ екстрагували хлороформом Комбінований органічний шар висушили(Ма23О4) і концентрували до сухості Внаслідок хроматографії на ДІОКСИДІ кремнію 10% етанолом у СНСІзЕЮАс(1 1) отримали вказану в заголовку сполуку(72мг, 30%) у вигляді безбарвної твердої речовини, т пл 249°С(розклад, ЕЮАс), Н ЯМР (CDCI 3 ) 5 2,01 (s, ЗН, ОАс), 2,29(s, ЗН, NAc), 2,75(m, 1Н, Н21), 3,29(dd, J = 11,7Гц, 1,8Гц, 1Н, Н2а"), 3,66(d, J = 11,4Гц, 1Н, Н4а"), 4,03(d, J = 11,4Гц, 1Н, H4b"), 4,05(d, J = 11,7Гц, 1Н, H2b"), 4,70(d, J = 12,3Гц, 1Н, Н5а'), 4,13(d, J = 4,8Гц, НЗ1), 4,23(d, J = 12,3Гц, 1Н, Н5,1), 4,53, 4,67(АВ, J = 11,7Гц, 2Н, Вп), 6,17 (d, J = 4,2Гц, 1Н, НГ), 7,28-7,40(m, 5H, Вп), 8,32 (s, 1Н, Н8), 9,80(s, 1H, NH), 12,12(s, 1H, NH) Приклад 18 Приготування (1S,3R,4R,8S)-3-(afleHiH-9-in)-8пдрокси-1-пдроксиметил-2,6дюксабіцикло[3,2,1]октану(18) Розчин (1R,3R,4R,8S)-1-a4eTOKCHMe™>8бензилокси-3-(6-хлорпурин-9-іл)-2,6дюксабіцикло[3,2,1]октану(100мг, 0,225ммоль) у суміші дюксану(20мл) та 30% водного гідроксиду амонію(20мл) нагрівали у сталевій бомбі при 100°С протягом 16 годин Розчинники випаровували, а залишок розчинили у метанолі, потім додали 20% гідроксид паладію на вупллі(~ 50% води, 3 х 250мг додавали кожного дня) Гідрогеноліз здійснювали при кімнатній температурі в атмосфері водню 55 фунтів на кв дюйм(рБі) (379,2кПа) протягом 4 днів Каталізатор відфільтрували та промили метанолом Комбінований розчин метанолу концентрували, а після хроматографії залишку на ДІОКСИДІ кремнію 20% метанолом у метиленхлориді отримали вказану в заголовку сполуку(39мг, 59%) у вигляді безбарвної твердої речовини, яку викристалізували з метанолу, т пл 250°С(розклад), 1 Н ЯМР (flMCO-d 6 + D 2 O) 5 2,53(m, 1Н, Н21), 3,33(d, J = 11,1 Гц, 1Н, Н2а"), 3,40(d, J = 12,3Гц, 1Н, Н5а'), 3,50(d, J = 12,6Гц, 1Н, H5b'), 3,69-3,76(m, 2H, H2b", H4a"), 4,05(d, J = 10,2Гц, H4b"), 4,45(d, J = 5,1Гц, 1H, НЗ1), 6,26(s, 1H, НГ), 7,28(т, 2Н, NH 2 ), 8,12(s 1Н, Н8), 8,33(s, 1H, Н 2 ), MS 294(MH + ), Обчислено для C12H15N5O4 С 49,14, Н, 5,16, N, 23,88, Знайдено С, 49,01, Н, 4,97, N, 23,92 Приклад 19 Приготування (1 S,3S,4R,8S)-3-(afleHiH-9-in)-8пдрокси-1-пдроксиметил-2,6дюксабіцикло[3,2,1]октану(19) Внаслідок подібної процедури, яку описано у прикладі 18, з (1R,3S,4R,8S)-1^eTOKCHMeTnn-8бензилокси-3-(6-хлорпурин-9-іл)-2,6дюксабіцикло[3,2,1]октану(100мг) отримали вказану у заголовку сполуку(43мг, 65%) у вигляді безба 17 рвної твердої речовини 1 Н ЯМР (CD3OD) 5 2,71(171, 1Н, Н21), 3,13(dd, J = 11,7Гц, 2,4Гц, 1Н, Н2а"), 3,57(d, J = 12,6Гц, 1Н, Н5а'), 3,64(d, J = 11,1 Гц, Н4а"), 3,68(d, J = 12,3Гц, 1Н, H5b'), 3,96(d, J = 11,1 Гц, 1Н, H4b"), 4,14(d, J = 11,7Гц, 1Н, H2b"), 6,39(d, J = 4,2Гц, 1H, H11), 8,04(s, 1H, H8), 8,44(s, 1H, H2), MS m/z 294(MH + ) Приклад 20 Приготування (1S,3R,4R,8S)-8-riflpoKCH-1пдроксиметил-3-(ппоксантин-9-іл)-2,6дюксабіцикло[3,2,1]октану(20) До розчину (1R,3R,4R,8S)-1^eTOKCHMeTnn-8бензилокси-3-(6-хлорпурин-9-іл)-2,6дюксабіцикло[3,2,1]октану(150мг, 0,34ммоль) та меркаптоетанолу(0,19мл, 2,7ммоль) в метанолі(20мл) додали метоксид натрію(0,37мл 5,4М у метанолі, 2,0ммоль) Отриманий розчин нагрівали у колбі зі зворотним холодильником протягом 6 годин, охолоджували до кімнатної температури, нейтралізували 10% АсОН до рН 7 Метанол випаровували, а залишок розвели 1,0М МаНСОз(15мл), потім екстрагували 10% метанолом у хлороформі, доки водна фаза не містила продукт Комбінований органічний шар висушили(Ма23О4) і концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 10 15% метанолом у хлороформі отримали 109мг(84%) похідної шозину(не показано) у вигляді безбарвної твердої речовини 100мг(0,26ммоль) цієї речовини розчинили у метанолі, потім додали 20% гідроксид паладію на вупллі(50% води, 600мг) Гідрогеноліз здійснювали при кімнатній температурі в атмосфері водню 50рзі(344,7кПа) протягом 3 днів Каталізатор фільтрували та промили метанолом Комбінований розчин метанолу концентрували, а після хроматографії залишку на дюксиді кремнію 20 - 25% метанолом у метиленхлориді отримали 61мг(61%) вказаної в заголовку сполуки у вигляді безбарвної твердої речовини, яку викристалізували з метанол-етил ацетату, т пл 228°С(розклад), 1 Н ЯМР (flMCO-d 6 ) 5 2,52(ш, 1Н, Н21), 3,30-3,55(т, ЗН, Н51 Н4а"), 3,69(dd, J = 11,1 Гц, 2,7Гц, 1Н, Н2а"), 3,73(d, J = 10,8Гц, H4b"), 4,05(d, J = 10,8Гц, 1H, H2b"), 4,40(m, 1H, H2b"), 5,03(t, J = 6,0Гц, 1H, ОН), 5,74(d, J = 4,2Гц, 1Н, OH), 6,24(s, 1Н, НГ), 8,06(s, 1Н, Н8), 8,30(s 1H, Н2), 12,40(s, 1H, NH), MS m/z 295(MH + ) Приклад 21 Приготування (1S,3S,4R,8S)-8-riflpoKCH-1пдроксиметил-3-(ппоксантин-9-іл)-2,6дюксабіцикло[3,2,1]октану(21) До розчину (1R,3S,4R,8S)-1^eTOKCHMeTnn-8бензилокси-3-(6-хлорпурин-9-іл)-2,6дюксабіцикло[3,2,1]октану(120мг, 0,27ммоль), меркаптоетанолу(0,15мл, 2,1ммоль) у метанолі(16мл) додали метоксид натрію(1,62ммоль, 0,30мл, 5,4М в метанолі) Після подібної процедури, яку описано у прикладі 20, отримали 37мг(47%) вказаної у заголовку сполуки у вигляді гігроскопічної твердої речовини, 1 Н ЯМР (ДМСО-de) 5 2,52(ш, 1Н, Н21), 3,06(dd, J = 11,7Гц, 2,4Гц, 1Н, Н2а"), 3,34-3,53(т, 2Н, Н51), 3,56(d, J = 11,1 Гц, 1Н, Н4а"), 3,79(d, J = 11,4Гц, 1Н, H4b"), 3,98(d, J = 11,4Гц, 1Н, H2b"), 4,31 (d, J = 4,5Гц, 1H, НЗ), 4,89(br, 1Н, ОН), 5,99(br, 1H, OH), 6,28(d, J = 4,2Гц, 1H, НГ), 8,03(s, 1Н, Н8), 8,27(5, 1Н, Н2), 12,30(br, 1H, NH) 61997 18 Приклад 22 Приготування (1S,3S,4R,8S)-3-(ryaHiH-9-in)-8пдрокси 1-пдроксиметил-2,6дюксабіцикло[3,2,1]октану(23) Після подібної процедури, яку описано в прикладі 18, з (1R,3S,4R,8S)-1-a4eTOKCHMe™>3-(N 2 ацетилгуанш-9-іл)-8-бензилокси-2,6-дюксабіцикло[3,2,1]октану(100мг) отримали вказану у заголовку сполуку(41мг, 66%) у вигляді не зовсім білої твердої речовини 1 Н ЯМР (ДМСО-de + D 2 O) 5 2,42(ш, 1Н, Н21), 3,15(dd, J = 11,4Гц, 2,1Гц, 1Н, Н2а"), 3,34(d, J = 11,4Гц, 1Н, Н5а'), 3,47(d, J = 12,6Гц, 1Н, Н5Ь'), 3,51 (d, J = 12,0Гц, 1Н, Н4а"), 3,77(d, J = 10,8Гц, 1Н, H4b"), 3,98(d, J = 11,7Гц, 1Н, Н2Ь"), 4,23(d, J = 4,8Гц, 1Н, НЗ), 4,80(br, 1Н, ОН), 5,90(br, 1Н, ОН), 6,05(d, J = 4,2Гц, 1Н, НГ), 6,52(br, 2H, NH 2 ), 7,93(s, 1Н, Н8), 12,30(br, 1H, NH), MS m/z 310(МН + ) Приклад 23 Приготування (1R,3R,4R,8S)-1^eTOKCHMeTnn8-бензилокси-3-(тимш-1-іл)-2,6дюксабіцикло[3,2,1]октану(24) Реакцію здійснювали за подібною процедурою, яку описано для прикладу 14, за тим винятком, що реагентом взаємодії був хлорид олова(І\/) (0,45мл), а цукровим субстратом був (1 R,3S,4R,8S)-1 -ацетоксиметил-8-бензилокси-Зметокси-2,6-дюксабіцикло[3,2,1]октан(202мг, О.бЗммоль) Після хроматографії на дюксиді кремнію 5% ЕЮН в СН2СІ2 отримали суміш(233мг, 89%) вказаної в заголовку сполуки(В-аномер) та и а-аномеру(співвідношення В а становило ~ 4 1) у вигляді безбарвної твердої речовини 1 Н ЯМР (CDCI3) В-аномеру(зі спектру суміші а- та Ваномерів) 5 1,93(d, J = 0,9Гц, 1Н, АгСНз), 2,05(s, ЗН, ОАс), 2,66(т, 1Н, Н21), 3,48(d, J = 11,1 Гц, Н4а"), 3,86-4,12(171, 5Н, Н2а", Н2Ь", НЗ1, Н4Ь", Н5а'), 4,26(d, J = 12,6Гц, H5b'), 4,44, 4,64(АВ, J = 11,4Гц, 2Н, Вп), 6,06(5, 1Н, НГ), 7,26-7,42(т, 5Н, Вп), 7,59(d, J = 1,2Гц, 1Н, Н6), 8,94(s, 1H, NH) Приклад 24 Приготування (1R,3R,4R,8S)-1^eTOKCHMeTnn8-бензилокси-3-(урацил-1-іл)-2,6дюксабіцикло[3,2,1]октану(25) За подібною процедурою, яку описано в прикладі 23, після хроматографії на дюксиді кремнію 5% ЕЮН у метиленхлориді з (1R,3S,4R,8S)-1ацетоксиметил-8-бензилокси-3-метокси-2,6дюксабіцикло[3,2,1]октану(230мг, 0,71ммоль) та силілованого урацилу(2,0ммоль) отримали суміш(267мг, 87%) вказаної у заголовку сполуки та и а-аномеру(співвідношення В а становило ~ 9 1) у вигляді безбарвної твердої речовини Вказану у заголовку сполуку(В-аномер) частково відокремили шляхом хроматографії на дюксиді кремнію, т пл 145 - 147°С(ЕЮАс-гексани), 1 Н ЯМР (CDCI 3 ) 5 2,02(s, ЗН, ОАс), 2,67(т, 1Н, Н21), 3,49(d, J = 11,4Гц, 1Н, Н4а"), 3,86-3,97(т, ЗН, Н2а", НЗ1, Н4Ь"), 4,08(d, J = 12,3Гц, 1Н, Н5а'), 4,09(d, J = 10,5Гц, 1Н, H2b"), 4,25(d, J = 12,3Гц, 1Н, Н5Ь'), 4,44, 4,64(АВ, J = 11,7Гц, 2Н, Вп), 6,05(5, 1Н, НГ), 7,26-7,40(т, 5Н, Вп), 5,69(d, J = 8,1Гц, 1Н, Н5), 7,79(d, J = 8,4Гц, 1Н, Н6), 8,92(5, 1Н, NH), Обчислено для C20H22N2O7 C, 59,69, Н, 5,51, N, 6,96, Знайдено С, 59,45, Н, 5,56, N, 6,91 Приклад 25 19 Приготування (1R,3R,4R,8S)-1-ai_(eTOKCHMeTHn8-бензилокси-3-(І\І 4 -бензоілцитозин-1-іл)-2,6дюксабіцикло[3,2,1]оісгану(26) За подібною процедурою, яку описано в прикладі 23, після хроматографії на дюксиді кремнію з 5% ЕЮН у метиленхлориді з реакції (1 R,3S,4R,8S)-1 -ацетоксиметил-8-бензилокси-Зметокси-2,6-дюксабіцикло[3,2,1]октану(645мг, 2,0ммоль) з силілованим N4бензоілцитозином(4,0ммоль) отримали 910мг(90%) вказаної в заголовку сполуки(раномер) у вигляді безбарвної твердої речовини, т пл 173 - 174°С(ЕЮАс), 1 Н ЯМР (CDCI 3 ) 5 2,07(s, ЗН, ОАс), 2,83(т, 1Н, Н21), 3,51 (d, J = 11,1 Гц, Н4а"), 3,86(d, и = 5,4Гц, 1Н, НЗ1), 3,97(d, J = 11,1 Гц, 1Н, H4b"), 3,99-4,13(т, ЗН, Н2а", Н2Ь", Н5а'), 4,27(d, J = 12,3Гц, 1Н, Н5Ь'), 4,38, 4,61 (АВ, J = 11,4Гц, 2Н, Bn), 6,15(s, 1Н, НГ), 7,24-7,38(т, 5Н, Вп), 7,50-7,66(т, 4Н, Н5, Bz), 7 , 9 0 ( т , 2Н, Bz), 8,28(d, J = 7,5Гц, 1Н, Н6), 8,84(br, 1H, NH), Обчислено для C27H27N3O7 С, 64,15, Н, 5,38, N, 8,31, Знайдено С, 64,10, Н, 5,20, N, 8,43 Приклад 26 Приготування (1S,3R,4R,8S)-8-riflpoKCH-1пдроксиметил-3-(тимш-1-іл)-2,6дюксабіцикло[3,2,1]октану(27) До розчину суміші (1R,3R,4R,8S)-1ацетоксиметил-8-бензилокси-3-(тимш-1-іл)-2,6дюксабіцикло[3,2,1]октану та и а-аномеру(~ 4 1, 200мг, 0,48ммоль) у безводному метиленхлориді(4мл) при 0°С додали трихлорид бору(1,0М в СН2СН2, 8мл) Отриману реакційну суміш перемішували при кімнатній температурі протягом 8 годин, при 15°С протягом ночі, а потім охолодили до 0°С Метанол(5,Омл) додавали краплями, потім додавали 1,0М NaOMe у МеОН до рН 8 Розчин відокремили, а осад ретельно екстрагували 20% метанолом у метиленхлориді Комбінований фільтрат висушили(Ма23О4) і концентрували до сухості Внаслідок хроматографії на дюксиді кремнію 10 - 15% метанолом у етилацетаті отримали вказану у заголовку сполуку(78мг), суміш вказаної в заголовку сполуки та її а-аномеру(24мг), та ааномер(23мг) Усі вони мали вигляд безбарвної твердої речовини Загальний вихід становив 9 1 % Після кристалізації вказаної в заголовку сполуки з метанол-етил ацетату отримали кристалічну тверду речовину, т пл 217 - 218°С, 1 Н ЯМР (flMCO-d 6 ) 5 1,75(d, J = 1,2Гц, 1Н, АгСНз), 2,24(т, 1Н, Н21), 3,20(d, J = 10,8Гц 1Н, Н4а"), 3,33-3,58(т, ЗН, Н2а", Н51), 3,66(d, J = 10,8Гц, H4b"), 3,97(d, J = 10,5Гц, 1H, H2b"), 4,14(т, 1Н, НЗ1), 5,24(t, J = 5,1Гц, 1Н, ОН), 5,67(d, J = 2,4Гц, 1Н, ОН), 5,82(s, 1H, НГ), 7,95(d, J = 0,9Гц, 1Н, Н6), 11,32(s, 1Н, NH), MS m/z 285(МН + ), Обчислено для Ci2Hi6N 2 O 6 С, 50,70, Н, 5,67, N, 9,85, Знайдено С, 50,65, Н, 5,57, N, 9,73 Приклад 27 Приготування (1S,3R,4R,8S)-8-riflpoKCH-1пдроксиметил-3-(урацил-1-іл)-2,6дюксабіцикло[3,2,1]октану(28) За подібною процедурою, яку описано в прикладі 26, після хроматографії на дюксиді кремнію 10% метанолом у метиленхлориді з (1 R,3R,4R,8S)-1 -ацетоксиметил-8-бензилокси-З(урацил-1-іл)-2,6-дюксабіцикло[3,2,1]октану(215мг, 0,53ммоль) отримали 110мг(76%) вказаної в заго 61997 20 ловку сполуки у вигляді білої твердої речовини Вказана у заголовку сполука була забрудненою невеликою КІЛЬКІСТЮ її а-аномеру Вказану у заголовку чисту сполуку отримали після перекристалізації з ацетон-етил ацетату, т пл 218 - 219°С, 1 Н ЯМР (ацетон-de) 5 2,42(т, 1Н, Н21), 3,27(d, J = 10,8Гц, 1Н, Н4а"), 3,58-3,72(т, ЗН, Н2а", Н51), 3,83(d, J = 10,8Гц, 1Н, H4b"), 4,13(d, J = 10,5Гц, 1Н, HH2b"), 4,37(t, J = 5,1 Гц, 1Н, ОН), 4 , 4 2 ( т , 1Н, НЗ1), 4,88(d, J = 3,9Гц, 1Н, ОН), 5,52(d, J = 7,8Гц, 1Н, Н5), 5,95(s, 1Н, НГ), 8,17(d, J = 7,8Гц, 1Н, Н6), 10,02(5, 1Н, NH), M S m / z 2 7 1 ( M H + ) , Обчислено для C11H14N2O6 С, 48,89, Н, 5,22, N, 10,37, Знайдено С, 48,60, Н, 5,64, N, 10,21 Приклад 28 Приготування (1S,3R,4R,8S)-3-0-1HTO3HH-1-UI) 8-пдрокси-і -пдроксиметил-2,6дюксабіцикло[3,2,1]октану(30) За подібною процедурою, яку описано в прикладі 26, після хроматографії на дюксиді кремнію 10% МеОН у метиленхлориді з (1R,3R,4R,8S)-1ацетоксиметил-8-бензилокси-3-(І\І 4 бензоілцитозин-1-іл)-2,6-дюксабіцикло[3,2,1]октану отримали 364мг(65%) (1S,3R,4R,8S)3-(І\І 4 -бензоілцитозин-1 -іл)-8-пдрокси-1 пдроксиметил-2,6-дюксабіцикло[3,2,1]октану(760мг) 120мг(0,32ммоль) цієї сполуки розчинили у насиченому розчині аміаку у метанолі і розчин перемішували при кімнатній температурі протягом 24 годин Аміак та етанол випаровували, а залишок розчинили у воді, потім ретельно екстрагували хлороформом(5 разів), а потім толуолом(2 рази) Воду випаровували, а після кристалізації з метанолу отримали 62мг вказаної у заголовку сполуки(45мг кристалічної твердої речовини та 17мг некристалічної твердої речовини), т пл 250°С(розклад), 1 Н ЯМР (CD 3 OD) 5 2,33(m, 1Н, Н21), 3,31 (d, J = 11,1 Гц, 1Н, Н4а"), 3,57(d, J = 12,3Гц, 1Н, Н5а'), 3,65(d, J = 12,3Гц, 1Н, Н5Ь'), 3,78 (dd, J = 10,5Гц, 2,7Гц, Н2а"), 3,84(d, J =11,1 Гц, 1Н, H4b"), 4,14(d, J =10,5Гц, 1Н, Н2Ь"), 4,20(d, J = 5,1 Гц, 1Н, НЗ1), 5,86(d, J = 7,5Гц, 1Н, Н5), 5,96(5, 1Н, НГ), 8,22(d, J = 7,8Гц, 1Н, Н6), MS m/z 270(МН + ), Обчислено для C11H15N3O5 С, 49,07, Н, 5,62, N, 15,61, Знайдено С, 48,93, Н, 5,55, N, 15,64 Подібним способом приготували (1S.3R, 4R,8S)-3-(N 4 -aцeтилцитoзин-1 -іл)-8-пдрокси-1 пдроксиметил-2,6-дюксабіцикло[3,2,1]октан Альтернативний спосіб Суміш (1 S,3R,4R,8S)-8-riflpoKCH-1 пдроксиметил-3-(урацил-1-іл)-2,6дюксабіцикло[3,2,1]октану(170мг, О.бЗммоль), ацетанпдриду(2,16мл, 20,1ммоль)та піридину(0,29мл, 3,5ммоль) у безводному DMF(2,5Mn) перемішували при кімнатній температурі протягом ночі, розвели метиленхлоридом, промили соляним розчином та 10% NaHCO 3 , висушили(Ма 2 ЗО 4 ), концентрували до сухості Внаслідок хроматографії на дюксиді кремнію етилацетатомгексанами(21) отримали 117мг(77%) 3 і ,5 і діацетилової похідної (1S,3R,4R,8S)-8^eTOKCH-1ацетоксиметил-3-(урацил-1-іл)-2,6-дюксабіцикл о[3,2,1]октану (урацил-1-іл)-2,6-дюксабіцикло[3,2,1]октан(175мг, 22 21 61997 0,58ммоль) розчинили у безводному піридисульфоксид) (0,54мл) та суміш нагрівали у колбі зі ні(1,5мл) і отриманий розчин охолоджували до 0°С зворотним холодильником протягом іще двох днів в атмосфері аргону, потім додали 4-хлорфенілПісля кінцевої обробки, такої як описано для придихлорфосфат(0,29мл, 1,75ммоль) Отриманий кладу 29, отримали після хроматографії на дюксирозчин нагрівали до кімнатної температури і переді кремнію 5% етанолом у хлороформі 104мг(28%) несли до пробірки, закритої мембраною, яка міспочаткового матеріалу без змін, 91мг(25%) вказатила 1,2,4-триазол(120мг, 1,75ммоль) Реакційну ної в заголовку сполуки та 80мг(22%) а-аномеру суміш перемішували при кімнатній температурі вказаної у заголовку сполуки Усі мали вигляд біпротягом 3 днів, розвели СН2СІ2, промили солялої твердої речовини Сполука вказана у заголов1 ним розчином та 5% ЫаНСОз, висушили^агЭС^) і ку т пл 128 - 131 °С (СНзСІ-ЕЮАс), Н ЯМР 3 концентрували до сухості Залишок розчинили у (CDCI ) 5 2,02(5, ЗН, ОАс), 2,30(s, ЗН, NAc), 2,67(m, 1 дюксані(7мл) та 30% гідроксиді амонію(Юмл) 1Н, Н2 ), 3,50(d, J = 10,8Гц, 1Н, Н4а"), 3,78(dd, J = Розчин витримували при кімнатній температурі 10,8Гц, 2,7Гц, 1Н, Н2а"), 3,99(d, J = 10,8Гц, H4b"), протягом 16 годин і розчинники випаровувалися 4,12(d, J = 12,3Гц, 1H, Н5а'), 4,14(d, J = 10,8Гц, 1Н, Після хроматографії залишку на дюксиді кремнію H2b"), 4,27(d, J = 12,3Гц, 1H, H5b'), 4,33(d, J = 1 Et3N-Me0H-CHCl3(5 ЗО 65) отримали 74мг(55%) 5,1 Гц, 1H, НЗ ), 4,49, 4,62(АВ, J = 11,7Гц, 2Н, Вп), сполуки, вказаної у заголовку, у вигляді блідо6,25(s,1H, НГ), 7,26-7,38(m, 5H, Вп), 7,83(s, 1H, жовтої твердої речовини Н8), 9,0(5, 1Н, NH), 11,95(s, 1H, NH), MS m/z 310(МН+), Обчислено для C23H25N5O8 С, 55,31, Н, Приклад 29 5,05, N, 14,02, Знайдено С, 55,70, Н, 5,00, N, Приготування (1R,3R,4R,8s)-1^eTOKCHMeTnn13,95 2 3-(І\І -ацетилгуанін-7-іл)-8-бензилокси-2,6дюксабіцикло[3,2,1]октану(31) Приклад 31 Силіловану основу з І\І2-ацетилгуаншу(386мг, Приготування (1S,3R,4R,8S)-3-(ryaHiH-9-in)-82,0ммоль) приготували за способом, який описано пдрокси-1-пдроксиметил-2,6для прикладу 17, та розчинили у розчидюксабіцикло[3,2,1]октану(33) нні R,3S,4R,8S)-1-ацетоксиметил-8-бензилокси-ЗЗа подібною процедурою, яку описано для метокси-2,6-дюксабіцикло[3,2,1]октану(477мг, прикладу 22, після хроматографії з (1R,3R,4R,8S)1,48ммоль) у безводному 1,2-дихлороетані(10мл) 1-ацетоксиметил-3-(Г^2-ацетилгуанш-9-іл)-8Потім додали хлорид олова(І\/) (0,75мл) у 1,2бензилокси-2,6-дюксабіцикло[3,2,1]октану(180мг) дихлороетані(2,0мл) Отриману суміш нагрівали у отримали 52мг(45%) вказаної у заголовку сполуки колбі зі зворотним холодильником протягом 3 гоу вигляді безбарвної твердої речовини Після кридин, потім при 70°С протягом ночі та охолоджувасталізації з води - етанолу(9 1) отримали кристали до 0°С Суміш нейтралізували 2,ОМ карбонатом лічну тверду речовину, т пл 258°С(розклад), 1Н натрію, фільтрували крізь броунмілерит, ретельно ЯМРЩМСО) 5 2,45(т, 1Н, Н21), 3,31 (d, J = 10,8Гц, екстрагували хлороформом Комбінований фільт1Н, Н4а"), 3,36-3,50(т, 2Н, Н5а', H5b'), 3,60(dd, J = рат висушили(Ма23О4) та концентрували до сухо10,2Гц, 2,7Гц, 1Н, Н2а"), 3,1(d, J = 11,1 Гц, H4b"), сті Внаслідок хроматографії на дюксиді кремнію 4,03(d, J = 10,5Гц, 1H, H2b"), 4,36(m, 1H, H31), 5% ЕЮН у хлороформі отримали 297мг(42%) вка4,95(t, J = 5,7Гц, 1Н, OH), 5,70(d, J = 3,9Гц, 1Н, заної у заголовку сполуки, 73мг(10%) №-зв'язаного OH), 6,06(s, 1H, НГ), 6,55(br, 2H, NH2), 7,90(s, 1H, [3-аномеру вказаної у заголовку сполуки та H8), 10,68(s, 1H, NH), MSm/z310(MH + ) 46мг(6%) №-зв'язаного а-аномеру Усі вони мали Приклад 32 вигляд білої твердої речовини Сполука, вказана у Приготування (1S,3R,4R,8S)-8-riflpoKCH-1-(4,4'1 заголовку т пл 176 - 178°С (СНзСІ-ЕЮАс), Н диметокситритилоксиметил)-3-(^-ацетилцитозинЯМР (CDCI3) 5 2,09(s, ЗН, ОАс), 2,40(s, 3H, NAc), іл)-2,6-дюксабіцикло[3,2,1]октану(35) 2,78(m, 1Н, Н21), 3,53(d, J = 11,4Гц, 1Н, Н4а"), Розчин (1 S,3R,4R,8S)-8-riflpoKCH-1 3,99(d, J = 11,1 Гц, H4b"), 4,03 - 4,18(m, 4H, H2a", 1 пдроксиметил-3-(^-ацетилцитозин-іл)-2,6H2b", НЗ , Н5а'), 4,26(d, J = 12,6Гц, 1Н, H5b'), 4,39, дюксабіцикло[3,2,1]октану(200мг, 0,64ммоль) та 4,58(АВ, J = 11,7Гц, 2Н, Bn), 6,62(s, 1H, НГ), 7,22 4,4'-диметокситритилхлориду(548мг, 0,61ммоль) в 7,40(т, 5Н, Вп), 8,21 (s, 1Н, Н8), 10,60(s, 1H, NH), безводному піридині(7мл) залишили при кімнатній 12,34(s, 1H, NH), Обчислено для C23H251N5O8 С, температурі на ніч, розвели етилацетатом, проми55,31, Н, 5,05, N, 14,02, Знайдено С, 55,35, Н, ли соляним розчином та 10% NaHCO3, висушили 4,83, N, 13,80 над сульфатом натрію та концентрували Після хроматографії на дюксиді кремнію 10% етанолом у Приклад 30 хлороформі отримали 342мг(87%) вказаної у загоПриготування (1R,3R,4R,8S)-1^eTOKCHMeTnnловку сполуки у вигляді безбарвної піни 3-(І\І2-ацетилгуанін-9-іл)-8-бензилокси-2,6дюксабіцикло[3,2,1]октану(32) Подібним способом приготували Таку саме КІЛЬКІСТЬ силілованого N2(1 S,3R,4R,8S)-8-riflpoKCH-1 -(4,4іацетилгуаншу, як описано для прикладу 29, розчидиметокситритилоксиметил)-3-^4-бензоілнили у розчині (1Р,ЗР,4Р,83)-1-ацетоксиметил-3цитозин-1-іл)-2,6-дюксабіцикло[3,2,1]октан(36) та (І\І2-ацетилгуанін-7-іл)-8-бензилокси-2,6(1 S,3R,4R,8S)-8-riflpoKCH-1 -(4,4ідюксабіцикло[3,2,1]октану(370мг, 0,76ммоль) у диметокситритилоксиметил)-3-(тимш-іл)-2,6безводному 1,2-дихлороетані(10мл) та додали дюксабіцикло[3,2,1]октан(34) триметилсилілтрифлат(0,54мл, З.Оммоль) в 1,2Приклад 33 дихлороетані(Змл) Отриманий розчин нагрівали у Приготування (1S,3R,4R,8S)-8-riflpoKCH-1-(4,4'колбі зі зворотним холодильником протягом ночі диметокситритилоксиметил)-3-(^-ацетилцитозинДодали додатковий ТМЗОТІХтетраметиленіл)-2,6-дюксабіцикло[3,2,1]октан 8-О-(2-ціаноетил 61997 24 23 г\І,г\І-діізопропілфосфорамідит) (38) Для прикладу наводиться наступний перелік До перемішаного розчину (1S,3R,4R,8S)-8синтезованих послідовностей 4 пдрокси-1-(4,4'-диметокситритилоксиметил)-3-(М f ацетил-цитозин-іл)-2,6S-dfATCTCTCCGCTTCCTTTC)-3' дюксабіцикло[3,2,1]октану(320мг, 0,52ммоль) та 5'-с!(АТСТСТССОСТТССТТТС)-3' дмзопропілетиламіну(0,36мл, 2,08ммоль) у безводному дихлорометані(бмл) при 0°С в атмосфері 5'-с1{АТСТСТССССТТССТТТС)-3' аргону додавали краплями 2-ціаноетил-ІЧ,МS'-dfATCTCTCCGCTTCCTTTC)^' дмзопропілхлорофосфорамідит(0,23мл, 1,04ммоль) Отриманий розчин перемішували при 5'-d(ATCTCTGCGCTTCCTTTC)-3температурі навколишнього середовища протягом 4 годин, охолодили льодом, розвели етилацета5 -d(CTTCCTGTCTGATGGCTTC)-3' том, промили холодним 10% ЫаНСОз, висушили S'-dtCTTCCTGTCTGATGGCTTq-S' над сульфатом натрію та концентрували при кімнатній температурі Після хроматографії на дюк5'-d(CTTCCTGTCTGATGGCTTC)-3' сиді кремнію 5% триетиламіном та 5% ацетоном у 5'-d(CTTCCTGTCTGATGGCTTC}-3' метиленхлориді отримали 376мг(89%) вказаної у заголовку сполуки у вигляді безбарвної піни 5 -d(CTTCCTQTCTGATGGCTTC)~3 Подібним способом приготували (1 S,3R,4R,8S)-8-riflpoKCH-1 -(4,4ідиметокситритилоксиметил)-3-(І\І4-бензоілцитозин-1-іл)-2,6-дюксабіцикло[3,2,1]октан 8-О-(2ціаноетил-г\І,г\І-діізопропілфосфорамідит) (39) та (1 S,3R,4R,8S)-8-riflpoKCH-1 -(4,4ідиметокситритилоксиметил)-3-(тимш-1-іл)-2,6діоксабіцикло[3,2,1]октан-8-О-(2-ціаноетил-М,г\Ідмзопропілфосфорамідит) (37) Приклад 34 Приготування олігонуклеотидів, що містять 2,4-біциклонуклеотиди Цей приклад ілюструє застосування біциклонуклеозидних фосфорамідитів 37 - 39 для синтезу олігонуклеотидів, що містять біциклонуклеозиди з 2'-С,4'-С-місточковим зв'язком У цьому прикладі олігонуклеотиди синтезували шляхом застосування фосфорамідитного способу Модифіковані олігонуклеотиди синтезували згідно за стандартними процедурами(протокол для синтезатору АВІ 394 від Perkm-Elmer, 1994) затим винятком, що застосовували більш концентрований розчин та подовжений час взаємодії Розчин для модифікованих фосфорамідитів був 0,1 ЗМ, тобто був на 30% більш концентрованим, ніж розчини для немодифікованих фосфорамідитів(0,1М) Час взаємодії для модифікованих фосфорамідитів дорівнював 10 хвилинам, а для немодифікованих фосфорамідитів-5 хвилин поряд з модифікованими Виходи взаємодії для модифікованих фосфорамідитів можна порівнювати з немодифікованими(98 99%) Модифіковані ODN очистили шляхом рідинної хроматографії високого розрізнення(НРІ_С) з оберненою фазою та характеризували за допомогою мас-спектрометри ^^(CTTCCTGTCTGATGGCTTC)-? A, C, G та T = немодифікований деоксирибонуклеозид T = тимідин з 2',4'-С-місточковим зв'язком С = деоксицитидин з 2',4'-С-місточковим зв'язком Приклад 35 Властивості гібридизації олігонуклеотидів, що містять біциклонуклеотиди з 2'-С,4'-С-місточковим зв'язком Гібридизацію модифікованих олігонуклеотидів з комплементарної ДНК та РНК досліджували шляхом вимірювання термодинамічного плавлення [Wang et al Nucleosides Nucleotides 1997, 16, 445] Як видно з таблиці 1, модифікації значно підсилюють гібридизацію з РНК Для послідовностей, що містять біциклічний тимідин Т, підвищення значень Т т становить 2,2 - 3,3 градусів для однієї модифікації ПОСЛІДОВНОСТІ, ЩО МІСТЯТЬ біциклічний цитидин С, також мають більш високі значення Т т порівняно з немодифікованими олігонуклеотидами, на 2,4° вище для модифікації з ПОСЛІДОВНІСТЮ 4 та на 1,9° вище для модифікації з ПОСЛІДОВНІСТЮ 5 ПОСЛІДОВНІСТЬ 12 містить помилково спарений нуклеозид(С у середині ПОСЛІДОВНОСТІ заміщується Т), має значення Т т на одинадцять градусів нижче, ніж ПОСЛІДОВНІСТЬ 10, що вказує на специфічність ПОСЛІДОВНОСТІ Для послідовностей, у яких усі Т та С заміщуються Т та С, значення Тт(> 90°) підвищилися далі, так що не можна було отримати точні значення у вимірювальній системі Таблиця 1 Дані гібридизації олігонуклеотидів, що містять біциклонуклеозиди з 2'-С,4'-С-місточковим зв'язком ПОСЛІДОВНІСТЬ 1 2 3 4 5 6 5'-d(ATCTCTCCGCTTCCTTTC)-3' 5'-d(ATCTCTCCGCTTCCTTTC)-3' 5'-d(ATCTCTCCGCTTCCTTTC)-3' 5'-d(ATCTCTCCGCTTCCTTTC)-3' 5'-d(ATCTCTCCGCTTCCTTTC)-3' 5'-d(ATCTCTCCGCTTCCTTTC)-3' Tm °С РНК 64,4 78,1 -82 71,7 77,5 >90 ДТт °С/Мод +2,8 +2,2 +2,4 +1,9 25 61997 26 Продолжение таблици 1 Tm °С РНК 63,0 69,5 76,2 81,4 >90 70,3 ПОСЛІДОВНІСТЬ 7 8 9 10 11 12 5'-d(CTTCCTGTCTGATGGCTTC)-3' 5'-d(CTTCCTGTCTGATGGCTTC)-3' 5'-d(CTTCCTGTCTGATGGCTTC)-3' 5'-d(CTTCCTGTCTGATGGCTTC)-3' 5-d(CTTCCTGTCTGATGGCTTC)-3' 5'-d(CTTCCTGTCTTATGGCTTC)-3' T = тимідин з 2',4'-С-місточковим зв'язком, С = цитидин 2',4'-С-місточковим зв'язком Зразки для вимірювання Tm містять 2,0мкМ модифікованих олігонуклеотидів та 2,0мкМ комплементарної ДНК або РНК у буфері(10тМ фосфат натрію, 0,1 т М EDTA (етилендіамінтетраоцтова кислота), та 0,1 М хлорид натрію, рН 7,0) Отже, було описано специфічні варіанти здійснення та застосування прикладів та способів отримання нових нуклеозидів та олігонуклеотидів з біциклічними цукровими складовими Проте, фахівці у галузі повинні розуміти, що можливими є набагато більше модифікацій окрім тих, що вже Комп'ютерна верстка І Вихованець ДТт °С/Мод +3,3 +3,3 +2,3 описано, які не суперечать концепціям цього винаходу Отже, об'єм винаходу не можна обмежувати, окрім як в дусі формули винаходу, що додається Крім того, під час інтерпретації як опису, так і формули винаходу, усі терміни слід інтерпретувати як можна ширше згідно зі змістом Зокрема терміни "включає" та "що включає" слід відносити до елементів компонентів або кроків без винятку, вказуючи на те, що елементи, компоненти або кроки, про які йдеться мова, можуть бути присутніми, можуть застосовуватися або об'єднуватися з іншими елементами, компонентами або кроками, про які особливо не йде мова Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюNucleosides with bicyclic sugar constituent, oligonucleotide and antiviral pharmaceutical composition
Назва патенту російськоюНуклеозиды с бициклической сахарной составляющей, олигонуклеотид и антивирусная фармацевтическая композиция
МПК / Мітки
МПК: C07H 19/20, C07H 21/00, C07H 19/10, C07H 19/06, C07H 19/04, C07G 3/00, C07H 19/16
Мітки: біциклічною, цукровою, композиція, складовою, олігонуклеотид, антивірусна, нуклеозиди, фармацевтична
Код посилання
<a href="https://ua.patents.su/13-61997-nukleozidi-z-biciklichnoyu-cukrovoyu-skladovoyu-oligonukleotid-ta-antivirusna-farmacevtichna-kompoziciya.html" target="_blank" rel="follow" title="База патентів України">Нуклеозиди з біциклічною цукровою складовою, олігонуклеотид та антивірусна фармацевтична композиція</a>
Попередній патент: Діелектричний смуговий фільтр
Наступний патент: Різьбове з’єднання
Випадковий патент: Порошковий дріт для дугового зварювання високолегованих хромонікелевих сталей вольфрамовим електродом у середовищі інертних газів