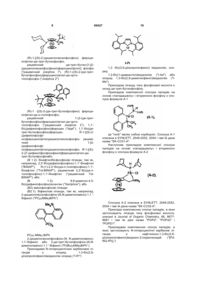
Спосіб одержання похідних аніліну та проміжна сполука
Номер патенту: 89427
Опубліковано: 25.01.2010
Автори: Тоблер Ханс, Вальтер Харальд, Еренфройнд Йозеф, Корсі Камілла
Формула / Реферат
1.Спосіб одержання сполуки формули І
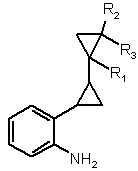 , (І)
, (І)
де R1, R2 і R3 являють собою, кожний незалежно від інших, водень або С1-С4-алкіл, який включає в себе
а) реакцію сполуки формули (II)
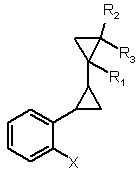 , (ІІ)
, (ІІ)
де R1, R2 і R3 мають значення, вказані для формули І, і X являє собою бром або хлор,
зі сполукою формули IIІ
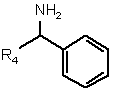 , (ІІІ)
, (ІІІ)
де R4 являє собою водень або С1-С4-алкіл,
в присутності основи і каталітичних кількостей щонайменше однієї комплексної сполуки паладію з утворенням сполуки формули IV
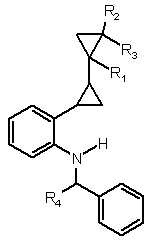 , (IV)
, (IV)
де R1, R2 і R3 мають значення, вказані для формули І, і R4 має значення, вказані для формули III; і
b) перетворення вказаної сполуки із застосуванням відновлювального агента на сполуку формули І.
2. Спосіб за п. 1, де X являє собою хлор.
3. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з монодентатного третинного фосфінового ліганду, бідентатного третинного фосфінового ліганду і N-гетероциклічного карбенового ліганду.
4. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з три-трет-бутилфосфіну, тетрафторборату три-трет-бутилфосфонію, трис-орто-толілфосфіну, трисциклогексилфосфіну, 2-ди-трет-бутилфосфіно-1,1'-бісфенілу, 2-дициклогексилфосфіно-2',4',6'-триізопропіл-1, 1'-бісфенілу, (R)(-)-ди-трет-бутил-[1-[(S)-2-(дициклогексилфосфініл)фероценіл]етил]фосфіну, рацемічного ди-трет-бутил-[1-[2-(дициклогексилфосфініл)фероценіл]етил]фосфіну, (R)-1-((S)-2-(ди-трет-бутилфосфіно)фероценіл)етил-ди-орто-толілфосфіну, рацемічного 1-(2-(ди-трет-бутилфосфіно)фероценіл)етил-ди-орто-толілфосфіну,1,1'-біс(дифенілфосфіно)фероцену, 1,1'-біс(ди-трет-бутилфосфіно)фероцену, R-1-[(S)-2-(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, рацемічного 1-[2-(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, 2,2'-біс(дифенілфосфіно)-1,1'-бінафтилу, R-(+)-2,2'-біс(ди-п-толілфосфіно)-1,1'-бінафтилу, рацемічного 2,2'-біс(ди-п-толілфосфіно)-1,1'-бінафтилу, 9,9-диметил-4,5-біс(дифенілфосфіно)ксантену, 2-дициклогексилфосфіно-(N,N-диметиламіно)-1,1'-біфенілу, хлориду 1,3-біс-(2,6-діізопропілфеніл)імідазолію, хлориду 1,2-біс-(1-адамантил)імідазолію, трет-бутил-ди-1-адамантилфосфіну, R-1-[(S)-2-(2'-дифенілфосфінофеніл)фероценіл]етил-ди-трет-бутилфосфіну, 2-ди-трет-бутилфосфіно-(N,N-диметиламіно)-1,1'-біфенілу і хлориду 1,3-біс(2,6-метилфеніл)імідазолію, або де комплексною сполукою паладію є сполука формули А-3
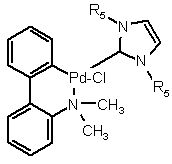 , (А-3)
, (А-3)
де R5 являє собою 2,6-діізопропілфеніл або 2,4,6-триметилфеніл.
5. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з три-трет-бутилфосфіну, тетрафторборату три-трет-бутилфосфонію, 2-дициклогексилфосфіно-(N,N-диметиламіно)-1,1'-біфенілу і хлориду 1,3-біс(2,6-діізопропілфеніл)імідазолію.
6. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з 2-дициклогексилфосфіно-(N,N-диметиламіно)-1, 1'-біфенілу і хлориду 1,3-біс(2,6-діізопропілфеніл)імідазолію.
7. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше хлорид 1,3-біс(2,6-діізопропілфеніл)імідазолію.
8. Спосіб за п. 5, де комплексною сполукою паладію є сполука, вибрана з нафтохінон-1,3-біс(2,6-діізопропілфеніл)імідазол-2-іліденпаладію, дивінілтетраметилсилоксан-1,3-біс(2,6-діізопропілфеніл)імідазол-2-іліденпаладію, 1,3-біс(2,6-діізопропілфеніл)імідазол-2-іліденпаладійдихлориду і 1,3-біс(2,6-діізопропілфеніл)імідазол-2-іліденпаладійдіацетату.
9. Спосіб за п. 5, де комплексною сполукою паладію є нафтохінон-1,3-біс(2,6-діізопропілфеніл)імідазол-2-іліденпаладій.
10. Спосіб за п. 5, де ліганд застосовують у відношенні від 0,01 мол. % до 0,5 мол. % відносно сполуки формули II.
11. Сполука формули IV
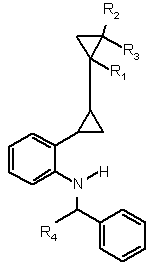 , (IV)
, (IV)
де R1, R2, R3 і R4 являють собою, кожний незалежно від інших, водень або С1-С4-алкіл.
12. Сполука формули IV за п. 11, де R4 являє собою водень.
Текст
1.Спосіб одержання сполуки формули І R2 2 R3 R1 X , (ІІ) де R1, R2 і R3 мають значення, вказані для формули І, і X являє собою бром або хлор, зі сполукою формули IIІ (11) , (IV) де R1, R2 і R3 мають значення, вказані для формули І, і R4 має значення, вказані для формули III; і b) перетворення вказаної сполуки із застосуванням відновлювального агента на сполуку формули І. 2. Спосіб за п. 1, де X являє собою хлор. 3. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з монодентатного третинного фосфінового ліганду, бідентатного третинного фосфінового ліганду і N-гетероциклічного карбенового ліганду. 4. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з три-трет-бутилфосфіну, тетрафторборату три-трет-бутилфосфонію, трис-орто-толілфосфіну, трисциклогексилфосфіну, 2-ди-третбутилфосфіно-1,1'-бісфенілу, 2дициклогексилфосфіно-2',4',6'-триізопропіл-1, 1'бісфенілу, (R)(-)-ди-трет-бутил-[1-[(S)-2(дициклогексилфосфініл)фероценіл]етил]фосфіну, UA , (І) де R1, R2 і R3 являють собою, кожний незалежно від інших, водень або С1-С4-алкіл, який включає в себе а) реакцію сполуки формули (II) R2 (19) NH2 89427 R4 3 89427 рацемічного ди-трет-бутил-[1-[2(дициклогексилфосфініл)фероценіл]етил]фосфіну, (R)-1-((S)-2-(ди-третбутилфосфіно)фероценіл)етил-ди-ортотолілфосфіну, рацемічного 1-(2-(ди-третбутилфосфіно)фероценіл)етил-ди-ортотолілфосфіну,1,1'-біс(дифенілфосфіно)фероцену, 1,1'-біс(ди-трет-бутилфосфіно)фероцену, R-1-[(S)2(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, рацемічного 1-[2(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, 2,2'біс(дифенілфосфіно)-1,1'-бінафтилу, R-(+)-2,2'біс(ди-п-толілфосфіно)-1,1'-бінафтилу, рацемічного 2,2'-біс(ди-п-толілфосфіно)-1,1'-бінафтилу, 9,9диметил-4,5-біс(дифенілфосфіно)ксантену, 2дициклогексилфосфіно-(N,N-диметиламіно)-1,1'біфенілу, хлориду 1,3-біс-(2,6діізопропілфеніл)імідазолію, хлориду 1,2-біс-(1адамантил)імідазолію, трет-бутил-ди-1адамантилфосфіну, R-1-[(S)-2-(2'дифенілфосфінофеніл)фероценіл]етил-ди-третбутилфосфіну, 2-ди-трет-бутилфосфіно-(N,Nдиметиламіно)-1,1'-біфенілу і хлориду 1,3-біс(2,6метилфеніл)імідазолію, або де комплексною сполукою паладію є сполука формули А-3 R5 N 4 біфенілу і хлориду 1,3-біс(2,6діізопропілфеніл)імідазолію. 6. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з 2-дициклогексилфосфіно-(N,Nдиметиламіно)-1, 1'-біфенілу і хлориду 1,3-біс(2,6діізопропілфеніл)імідазолію. 7. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше хлорид 1,3-біс(2,6діізопропілфеніл)імідазолію. 8. Спосіб за п. 5, де комплексною сполукою паладію є сполука, вибрана з нафтохінон-1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладію, дивінілтетраметилсилоксан-1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладію, 1,3біс(2,6-діізопропілфеніл)імідазол-2іліденпаладійдихлориду і 1,3-біс(2,6діізопропілфеніл)імідазол-2іліденпаладійдіацетату. 9. Спосіб за п. 5, де комплексною сполукою паладію є нафтохінон-1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладій. 10. Спосіб за п. 5, де ліганд застосовують у відношенні від 0,01 мол. % до 0,5 мол. % відносно сполуки формули II. 11. Сполука формули IV R2 R3 R1 N Pd-Cl N CH3 R5 CH3 N , (А-3) де R5 являє собою 2,6-діізопропілфеніл або 2,4,6триметилфеніл. 5. Спосіб за п. 2, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з три-трет-бутилфосфіну, тетрафторборату три-трет-бутилфосфонію, 2дициклогексилфосфіно-(N,N-диметиламіно)-1,1' Даний винахід стосується способу амінування орто-біциклопропілзаміщених галогенбензолів, а також проміжних сполук даного способу. Орто-біциклопропілзаміщені первинні аніліни, такі як, наприклад, 2-біциклопропіл-2-ілфеніламін, є цінними проміжними сполуками для отримання фунгіцидів, таких як фунгіциди, описані, наприклад, в WO 03/074491. У загальному випадку аніліни можна отримати з галогенбензолів за допомогою каталізованих паладієм реакцій перехресного поєднання. Такі каталізованиі паладієм реакції перехресного поєднання описані в наступних статтях: Handbook of Organopalladium Chemistry for Organic Synthesis, Vol. 1, 1051-1096, 2002; Journal of Organometallic H R4 , (IV) де R1, R2, R3 і R4 являють собою, кожний незалежно від інших, водень або С1-С4-алкіл. 12. Сполука формули IV за п. 11, де R4 являє собою водень. Chemistry, 576, 125-146, 1999 і Journal of Organometallic Chemistry, 653, 69-82, 2002. Основний недолік каталізованого паладієм перехресного поєднання полягає в тому, що безпосереднє отримання первинних анілінів неможливе. Тому при застосуванні каталізованого паладієм перехресного поєднання первинні аніліни повинні бути отримані з відповідних галогенбензолів методиками синтезу, що включають в себе щонайменше дві стадії. Такий двостадійний спосіб отримання ортобіциклопропілзаміщених первинних анілінів із застосуванням імінів як нуклеофілів описаний в WO 03/074491 (див. схему 1). 5 Згідно з WO 03/074491, заміщені 2-(2галогенфеніл)циклопропани формули (А), де Hal являє собою бром або йод, і R3 являє собою, inter alia, заміщений або незаміщений циклопропіл, амінують в двостадійній реакції з отриманням відповідних 2-(2-амінофеніл)циклопропанів (С). Для цієї мети спочатку додають бензофенонїмін, третбутанолят натрію, трис(дибензиліденацетон)дипаладій (Pd2dba3) і рацемічний 2,2'-біс(дифенілфосфін)-1,1’-бінафтил ("BINAP"). У другій стадії реакції іміни (В), що утворилися піддають реакції, наприклад, з гідроксиламіном і ацетатом натрію з утворенням відповідних 2-(2-амінофеніл)біциклопропанів (С). Як додатковий ліганд паладію в WO 03/074491 запропонований 1,1’-біс(дифенілфосфіно)фероцен(‘’dppf’’). Ця методика реакції описана в WO 03/074491 виключно для бром- або йодбензолів, але не для хлорбензолів. Виявлено, що методика реакції, описана в WO 03/074491, погано підходить для імінування менш реакційноздатних, але які мають велику економічну ціну 2-(2хлорфеніл)циклопропанів з високими виходами. Методика реакції, описана в WO 03/074491 для отримання первинних анілінів, не є придатною для отримання у великих масштабах ортобіциклопропілзаміщених первинних анілінів внаслідок високої вартості бензофеноніміну. Метою даного винаходу, відповідно до цього, є забезпечення нового способу отримання ортобіциклопропілзаміщених первинних анілінів, який позбавлений вищезгаданих нестач відомого способу, і робить можливим отримання вказаних сполук при економічно прийнятній вартості і легко здійсненим способом з високими виходами і з хорошою якістю продукту. Відповідно даний винахід стосується способу отримання сполук формули І 89427 6 де R1, R2 і R3 являють собою, кожний незалежно від інших, водень або С1-С4алкіл, причому даний спосіб включає в себе а) реакцію сполуки формули II де R1,R2 і R3 мають значення, вказані для формули І, і X являє собою бром або хлор, із сполукою формули III де R4 являє собою водень або С1-С4алкіл, в присутності основи і каталітичної кількості щонайменше однієї комплексної сполуки паладію з утворенням сполуки формули IV де R1, R2, R3 і R4 являють собою, кожний незалежно від інших, водень або С1-С4алкіл; і b) перетворення вказаної сполуки із застосуванням відновлювального агента на сполуку формули І. Сполуки формули І існують в різних стереоізомерних формах, які описуються формулами II, III, ІIIII і IIV. 7 Спосіб згідно з винаходом включає в себе отримання цих стереоізомерних форм формул II, III, ІIII і IIV, де R1, R2 і R3 мають значення, вказані для формули I, і отримання сумішей цих стереоізомерних форм в будь-якому відношенні. Спосіб згідно з винаходом є переважно придатним для отримання сполук формули І, де R1 являє собою водень або С1-С4алкіл і R2 і R3 являють собою водень. Спосіб згідно з винаходом є переважно придатним для отримання сполук формули І, де R1 являє собою водень або метил і R2 і Rз являють собою водень. Спосіб згідно з винаходом є особливо придатним для отримання сполук формули І, де R1, R2 і R3 являють собою водень. У способі згідно з винаходом переважно застосовують сполуки формули II, де X являє собою бром. У способі згідно з винаходом переважно застосовують сполуки формули II, де X являє собою хлор. Стадія а) способу Комплексні сполуки паладію, які застосовують в стадії (а) способу отримують із сполукипопередника сполуки паладію і щонайменше одного придатного ліганду. У стадії (а) способу комплексні сполуки паладію переважно присутні в розчиненій формі у вигляді комплексів паладій-ліганд. У контексті даного винаходу зрозуміло, що комплексні сполуки включають в себе сполуки, що складаються з циклічних органічних сполук паладію, так званих «паладациклів», і вторинних фосфінов. Комплексні сполуки паладію можна застосовувати у вигляді вже утворених комплексних сполук в стадії (а) способу або вони утворюються in situ в стадії (а) способу. Для утворення комплексних сполук паладію сполуку-попередник сполуки паладію піддають взаємодії щонайменше з одним придатним лігандом. У разі неповної реакції може бути випадок, в якому невеликі кількості сполуки-попередника 89427 8 сполуки паладію або ліганду не розчиняються в реакційній суміші. Придатними сполуками-попередниками сполуки паладію є ацетат паладію, дихлорид паладію, розчин дихлориду паладію, паладій2(дибензиліденацетон)3 або паладій(дибензиліденацетон)2, паладійтетракис(трифенілфосфін), паладій на вугіллі, паладійдихлорбіс(бензонітрил), паладій(трис-третбутилфосфін)2 або суміш паладій2(дибензиліденацетону)3 і паладій(трис-третбутилфосфіну)2. Придатними лігандами є третинні фосфінові ліганди, N-гетероциклічні карбенові ліганди або ліганди типу фосфінових кислот. У контексті даного винаходу третинні фосфінові ліганди поділяють на монодентатні третинні фосфінові ліганди і бідентатні третинні фосфінові ліганди. Зрозуміло, що «монодентатний ліганд» є лігандом, здатним займати одне місце координації паладіевого центра. Зрозуміло, що «бідентатний ліганд» є лігандом, здатним займати два місця координації паладіевого центра і відповідно цьому здатним хелатувати атом паладію або іон паладію. Прикладами третинних фосфінових лігандів є (A) монодентатні третинні фосфінові ліганди: три-трет-бутилфосфін, тетрафторборат тритрет-бутилфосфонію ("P(tBu)3HBF4"), трис-ортотолілфосфін ("Ρ(οΤol)3"), трисциклогексилфосфін ("Р(Су)3"), 2-ди-трет-бутилфосфіно-1,1'-бісфеніл ("P(tBu)2BiPh"), 2-дициклогексилфосфіно-1,1’бісфеніл ("P(Cy)2BiPh") або 2дициклогексилфосфіно-2',4',6'-триізопропіл-1,1 'бісфеніл ("x-Phos"), трет-бутил-ді-1адамантилфосфін ("P(tBu)(Adam)2"); або (B) бідентатні третинні фосфінові ліганди: (В1) біфосфінові ліганди: (В1.1): фероценілбіфосфінові ліганди, такі як, наприклад, R(-)-ди-трет-бутил-[1-[(S)-2(дициклогексилфосфініл)фероценіл]етил]фосфін ("Josiphos 1") 9 (R)-1-[(S)-2-(дициклогексилфосфіно) фероценіл]етил-ди-трет-бутилфосфін, рацемічний ди-трет-бутил-[1-[2(дициклогексилфосфінил)фероценіл]етил] фосфін ("рацемічний Josiphos I"), (R)-1-((S)-2-(ди-третбутилфосфіно)фероценіл)етил-ди-ортотолілфосфін ("Josiphos 2") (R)-1 -[(S)-2-(ди-трет-бутилфосфіно) фероценіл]етил-ди-о-толілфосфін, рацемічний 1-(2-(ди-третбутилфосфіно)фероценіл)етил-ди-ортотолілфосфін ("рацемічний Josiphos 2"), 1,1’біс(дифенілфосфіно)фероцен ("dppf’’), 1,1’-біс(дитрет-бутилфосфіно)фероцен, R-1-[(S)-2(дифенілфосфіно)фероценіл]етилдициклогексилфосфін, рацемічний 1-[2(дифенілфосфіно)фероценіл]етилдициклогексилфосфін, R-1-[(S)2-(2'-дифенілфосфінофеніл]фероценіл)етил-дитрет-бутилфосфінабо (В 1.2): бінафтилбісфосфінові ліганди, такі як, наприклад, 2,2'-біс(дифенілфосфіно)-1,1’-бінафтил ("BINAP"), R-(+)-2,2'-бic(ди-п-тoлiлфocфiнo)-1,1’бінафтил ("Tol-BINAP"), рацемічний 2,2'-біс(ди-птолілфосфіно)-1,1’-бінафтил ("рацемічний TolBINAP"); або (В 1.3): 9,9-диметил-4,5біс(дифенілфосфіно)ксантен ("Xantphos"); або (В2) амінофосфінові ліганди: (В2.1): біфенілові ліганди, такі як, наприклад, 2-дициклогексилфосфіно-(Ν,Ν-диметиламіно)-1,1 'біфеніл ("PCy2NMe2BiPh") PCy2-NMe2-BiPh 2-дициклогексилфосфіно-(N, N-диметиламіно)1,1’-біфеніл або 2-ди-трет-бутилфосфіно-(N,Nдиметиламіно)-1,1 '-біфеніл ("P(tBu)2NMe2BiPh’’). Прикладами N-гетероциклічних карбенових лігандів є хлорид 1,3-біс(2,6діізопропілфеніл)імідазолію хлорид ("І-Рr") 89427 10 1,3 -біс(2,6-діізопропілфеніл) імідазолію, хлорид 1,2-біс(1-адамантил)імідазолію ("І-Ad") або хлорид 1,3-біс(2,6-диметилфеніл)імідазолію ("ІМе"). Прикладом ліганду типу фосфінової кислоти є оксид ди-трет-бутилфосфіну. Прикладом комплексної сполуки паладію на основі «паладациклу» і вторинного фосфіну є сполука формули А-1 де "norb" являє собою норборніл. Сполука А-1 описана в SYNLETT, 2549-2552, 2004 і там їй дана назва "SK-CC01-A". Наступним прикладом комплексної сполуки паладію на основі «паладациклу» і вторинного фосфіну є сполука формули А-2 Сполука А-2 описана в SYNLETT, 2549-2552, 2004 і там їй дана назва "SK-СС02-А". Приклади комплексних сполук паладію, в яких застосовують ліганди типу фосфінової кислоти, описані в Journal of Organic Chemistry, 66, 86778681 і там їм дані назви "POPd", "POPd2" і "POPD1". Прикладами комплексних сполук паладію, в яких застосовують N-гетероциклічні карбенові ліганди, є нафтохінон-1,3-біс(2,6дiiзoпpoпiлфeнiл)iмiдaзoл-2-iлiдeнпaлaдiй ("[PdNQ-IPr]2") 11 нафтохінон-1,3 -біс-(2,6діізопропілфеніл)імідазол-2-іліденпаладій, дивінілтетраметилсилоксан-1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладій ("PdVTS-IPr") дивінілтетраметилсилоксан-1,3-біс-(2,6діізопропілфеніл)імідазол-2-іліденпаладій, 1,3-біс(2,6-діізопропілфеніл)імідазол-2іліденпаладійдихлорид ("Pd-CI-ІРr"), 1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладійдіацетат ("Pd-OAc-ІРr"), аліл-1,3-біс(2,6діізопропілфеніл)імідазол-2-іліденпаладійхлорид ("Pd-AI-СІ-IPr") або сполука формули А-3 де R5 являє собою 2,6-діізопропілфеніл або 2,4,6-триметилфеніл. [Pd-NQ-IPr]2, Pd-VTS-IPr, PdCI-IPr і Pd-AI-CI-IPr описані в Organic Letters, 4, 2229-2231, 2002 і в SYNLETT, 275-278, 2005. Сполука формули А-3 описана в Organic Letters, 5, 1479-1482, 2003. У способі згідно з винаходом можна застосовувати одну комплексну сполуку паладію або суміш комплексних сполук паладію. При отриманні комплексної сполуки паладію перевага віддається застосуванню як сполукипопередника ацетату паладію, паладій2(дибензиліденацетону)3, паладію(дибензиліденацетону)2, розчину дихлориду паладію або суміші паладій2(дибензиліденацетону)3 і паладій(трис-трет 89427 12 бутилфосфіну)2. Особлива перевага віддається застосуванню ацетату паладію або дихлориду паладію. Для отримання комплексної сполуки паладію застосовують щонайменше один ліганд. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з монодентатного третинного фосфінового ліганду, бідентатного третинного фосфінового ліганду і Nгетероциклічного карбенового ліганду. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з N-гетероциклічного карбенового ліганду, монодентатного третинного фосфінового ліганду і бідентатного третинного фосфінового ліганду, який вибраний з фероценілбіфосфінового ліганду, бінафтилбісфосфінового ліганду та амінофосфінового ліганду. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, Ρ(οΤοI)3, P(Cy)3, P(tBu)2BiPh, P(Cy)2BiPh, x-Phos, P(tBu)(Adam)2, Josiphos 1, рацемічного Josiphos 1, Josiphos 2, рацемічного Josiphos 2, dppf, 1,1’-біс(ди-третбутилфосфіно)фероцену, R-1 -[(S)-2(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, рацемічного 1-[2(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну, R-1[(S)-2-(2'-дифенілфосфінофеніл]фероценіл)етилди-трет-бутилфосфіну, BINAP, Tol-BINAP, рацемічного Tol-BINAP, Xantphos, PCy2NMe2BiPh, P(tBu)2NMe2BiPh, I-Pr, I-Ad і І-Ме або комплексної сполуки паладію формули А-3, де R5 являє собою 2,6-діізопропілфеніл або 2,4,6-триметилфеніл. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, P(tBu)2BiPh, P(Cy)2BiPh, x-Phos, Josiphos 1, рацемічного Josiphos 1, Josiphos 2, рацемічного Josiphos 2, PCy2NMe2BiPh і I-Pr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, P(tBu)2BiPh, P(Cy)2BiPh, x-Phos, PCy2NMe2BiPh і I-Pr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, PCy2NMe2BiPh і I-Pr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд три-трет-бутилфосфін або P(tBu)3HBF4. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд PCy2NMe2BiPh. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд ІРr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонай 13 менше один ліганд, вибраний з Josiphos 1, рацемічного Josiphos 1. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд рацемічний Josiphos 1. У способі, згідно з винаходом, комплексні сполуки паладію, сполуки-попередники сполук паладію і/або ліганди застосовують в каталітичних кількостях. Комплексні сполуки паладію застосовують переважно у відношенні від 1:10 до 1:10000 відносно сполук формули II, особливо у відношенні від 1:100 до 1:1000. Сполуки-попередники сполук паладію застосовують переважно у відношенні від 1:10 до 1:10000 відносно сполук формули II, особливо у відношенні від 1:100 до 1:1000. Ліганди застосовують переважно у відношенні від 1:10 до 1:10000 відносно сполук формули II, особливо у відношенні від 1:100 до 1:1000. У реакції згідно з винаходом перевага віддається застосуванню як сполуки формули III сполуки формули III, в якій R4 являє собою водень (бензиламін). Сполуку формули III переважно застосовують в еквімолярній кількості або в надлишку відносно сполук формули II. Придатними кількостями сполук формули III для цієї реакції є, наприклад, 1-3 еквіваленти, особливо 1-2 еквіваленти. Придатними основами є, наприклад, алкоголяти, наприклад, трет-бутанолят натрію, третбутанолят калію, метанолят натрію або етанолят натрію, або неорганічні основи, такі як карбонати, наприклад, К2СО3, Nа2СО3 або Cs2CO3, гідроксиди, наприклад, NaOH або КОН, або фосфати, наприклад, К3РО4; перевага віддається алкоголятам і особлива перевага віддається трет-бутаноляту натрію. Коли як основу застосовують NaOH або КОН, можна застосовувати міжфазний каталізатор, такий як, наприклад, бромід цетилтриметиламонію. Придатними кількостями основи для цієї реакції є, наприклад, 1-3 еквіваленти, особливо 1-2 еквіваленти. Реакцію згідно з винаходом можна провести в інертному розчиннику. В одному варіанті здійснення винаходу реакцію згідно з винаходом проводять в інертному розчиннику. Придатними розчинниками є, наприклад, сполука формули V де R являє собою С1-С6алкіл, переважно, метил; диметоксіетан; трет-бутилметиловий простий ефір; пентан; гексан; циклогексан; тетрагідрофуран; діоксан; толуол; ксилол або триметилбензоли, такі як, наприклад, мезитилен; а також їх суміші. Переважним розчинником є диметоксіетан або ксилол. У цьому варіанті здійснення інертний розчинник переважно є безводним. У наступному варіанті здійснення винаходу реакцію проводять без розчинника. У цьому варіа 89427 14 нті здійснення сполуки формули III переважно застосовують в надлишку відносно сполук формули II. Реакцію згідно з винаходом проводять при температурі навколишнього середовища або при підвищеній температурі, переважно при температурному діапазоні від 50°С до 180°С, особливо в температурному діапазоні від 50°С до 100°С. Реакцію згідно з винаходом можна провести при нормальному, підвищеному або зниженому тиску. В одному варіанті здійснення реакцію згідно з винаходом проводять при нормальному тиску. Час реакції згідно з винаходом зазвичай буває від 1 до 48 годин, переважно від 4 до 30 годин, особливо від 4 до 18 годин. Реакцію згідно з винаходом можна провести в атмосфері інертного газу. Як інертний газ застосовують, наприклад, азот або аргон. В одному варіанті здійснення реакції згідно з винаходом реакцію проводять в атмосфері азоту. Стадія b) способу Придатним відновлювальним агентом для стадії b) способу є, наприклад, водень в присутності металевого каталізатора. Кількостями відновлювального агента, придатними для даної реакції, є, наприклад, 1-5 еквівалентів, особливо 1-1,3 еквіваленти. Придатними металевими каталізаторами є, наприклад, паладієві каталізатори, такі як, наприклад, каталізатори паладій на вугіллі або родієві каталізатори; особлива перевага віддається паладієвим каталізаторам. Кількостями металевого каталізатора, придатними для даної реакції, є каталітичні кількості, такі як, наприклад, 0,001-0,5 еквіваленти, особливо 0,01-0,1 еквіваленти. Реакцію переважно проводять в присутності інертного розчинника. Придатними розчинниками є, наприклад, спирти, наприклад, метанол, етанол, пропанол або ізопропанол, або апротонні розчинники, наприклад, тетрагідрофуран, третбутилметиловий простий ефір, діоксан, етилацетат або диметоксіетан, а також їх суміші; особлива перевага віддається тетрагідрофурану. Температури зазвичай бувають від 0°С до 80°С; перевага віддається діапазону від 0°С до 25°С; особлива перевага віддається проведенню даної реакції при температурі навколишнього середовища. Час реакції для даної реакції зазвичай буває від 1 до 48 годин, переважно, від 1 до 6 годин. Реакцію згідно з винаходом можна провести при нормальному, підвищеному або зниженому тиску. В одному варіанті здійснення реакцію згідно з винаходом проводять при нормальному тиску. Якщо вибрані придатні умови реакції, сполуку формули IV, отримана в стадії а) реакції, можна безпосередньо піддати реакції з утворенням сполуки формули І без виділення проміжних сполук. Спосіб, згідно з винаходом, є особливо придатним для отримання сполук формули І, де R1 R2 і R3 являють собою, кожний незалежно від інших, водень або С1-С4алкіл, a) реакцією сполуки формули II, де R1 R2 і R3 являють собою, кожний незалежно від інших, во 15 89427 16 день або С1-С4алкіл і X являє собою хлор, з бензиламіном в присутності трет-бутаноляту натрію і каталітичних кількостей щонайменше однієї комплексної сполуки паладію, де комплексна сполука паладію включає в себе щонайменше один ліганд, вибраний з три-трет-бутилфосфіну, тетрафторборату три-трет-бутилфосфонію, 2дициклогексилфосфіно-(N,N-диметиламіно)-1,1’біфенілу і хлориду 1,3-біс(2,6діізопропілфеніл)імідазолію, з утворенням сполуки формули IV, де R1, R2, R3 і R4 являють собою, кожний незалежно від інших, водень або С1-С4алкіл, і b) перетворенням останньої сполуки на сполуку формули І із застосуванням водню в присутності металевого каталізатора. Сполуки формули І, де R1 являє собою водень або метил і R2 і R3 являють собою водень, є особливо придатними для даного варіанту здійснення. Сполуки формули І, де R1 R2 і R3 являють собою водень, є дуже особливо придатними для даного варіанту здійснення. Сполуки формули II, де X являє собою бром, є зазвичай відомими і їх можна отримати згідно з способами, описаними в WO 03/074491. Сполуки формули II, де X являє собою хлор, можна отримати способом, аналогічним способам, описаним в WO 03/074491 для придатних сполук формули II, де X являє собою бром. Наприклад, сполуки формули II, де R1 R2 і R3 являють собою водень і X являє собою хлор (сполука № В1), можна отримати, як показано на схемі реакцій 1 і як пояснюється прикладами А1-А3, які наведені нижче. Приклад отримання A1: отримання 3-(2хлорфеніл)-1-циклопропілпропенону 67 г 30% розчину гідроксиду натрію змішують з 350 мл води і 97,5 г (1,1 моль) циклопропілметилкетону і суміші нагрівають до 90°С з перемішуванням. До суміші, яка утворилася, по краплях додають 143,5 г (1 моль) 2-хлорбензальдегіду і перемішування проводять протягом 5 годин. Під час перемішування через 2 години і через ще 3 години в кожному випадку додають 2 мл циклопропілметилкетону. Після загального часу реакції 6 годин проводять охолоджування до 50°С. Реакційну суміш фільтрують і фази розділяють. Органічну фазу концентрують. Отримують 188,6 г 3-(2хлорфеніл)-1-циклопропілпропенону в формі жовтого масла. 1 НЯМР (CDCl3): 0,95-1,04 (м, 2Н); 1,16-1,23 (м, 2Н); 2,29-2,37 (м, 1Н); 6,83 (д, J = 15 Гц); 7,27-7,35 (м, 2Н); 7,40-7,47 (м, 1H); 8,03 (д, J = 15 Гц). Приклад отримання А2: отримання 5-(2хлорфеніл)-3-циклопропіл-4,5-дигідро-1Н-піразолу 250 г етанолу додають до 188,6 г 3-(2хлорфеніл)-1-циклопропілпропенону (1 моль), отриманого згідно А1. По краплях при 20°С з перемішуванням додають 53 г (1,05 моль) гідразингідрату. Реакційну суміш перемішують при 70°С протягом 2 годин. Реакційну суміш потім охолоджують до 50°С. Додають суміш 5,5 г дигідрату щавлевої кислоти (0,044 моль) і 20 г етанолу, внаслідок чого відбувається осадження твердої речовини. Реакційну суміш охолоджують до 25°С і фільтрують через фільтр зі спеченого скла з відсмоктування і промивають 50 г етанолу. Отримують жовтий фільтрат, який концентрують упарюванням із застосуванням роторного випарника при 60°С і тиску до 20 мбар з утворенням жовтого масла. Отримують 201,5 г ізомерної суміші, що має як основний компонент 5-(2-хлорфеніл)-3циклопропіл-4,5-дигідро-Ш-піразол, в формі жовтого масла. Приклад отримання A3: синтез 2-(2хлорфеніл)біциклопропілу До розчину 50 г (0,36 моль) карбонату калію в 600 г етиленгліколю додають при 190°С протягом 2 годин 201,5 г 5-(2-хлорфеніл)-3-циклопропіл-4,5дигідро-1H-піразолу, отриманого, як описано в прикладі А2. Перемішування потім проводять протягом 2 годин при 190°С. Закінчення реакції визначають за припиненням виділення газу. Реакційну суміш потім охолоджують до 100°С, після чого відбувається розділення фаз і верхню фазу, фазу продукту, відділяють. Отримують 158 г 2-(2хлорфеніл)біциклопропілу як неочищений продукт, який можна додатково очистити, наприклад, дистиляцією. 1 НЯМР (CDCl3): 0,0-1,13 (м, 8Н); 1,95-2,02 (м, 0,63 Н, транс-ізомер) і 2,14-2,22 (м, 0,37 Н, цисізомер); 6,88-6,94 (м); 7,05-7,24 (м); 7,31-7,42 (м). Комплексні сполуки паладію, сполукипопередника сполуки паладію і ліганди, що застосовуються в стадії (а) способу, є зазвичай відомими і в більшій частині є комерційно доступними. Сполуки формули IV є цінними проміжними сполуки для отримання сполук формули І і були спеціально розроблені для даного способу згідно з винаходом. Даний винахід відповідно до цього відноситься також до них. Даний винахід буде пояснюватися більш детально із застосуванням нижченаведених прикладів. Приклад Р1: отримання бензил(2біциклопропіл-2-ілфеніл)аміну 17 З г 2-(2-хлорфеніл)біциклопропілу (15,6 ммоль, транс/цис-відношення приблизно 2:1), 2,5 г бензиламіну (23,4 ммоль), 2,4 г трет-бутаноляту натрію (25 ммоль), 35 мг ацетату Pd(II) (0,16 ммоль) і 60 мг ІІ(-)-ди-трет-бутил-[1-[(S)-2(дициклогексилфосфаніл)фероценіл]етил]фосфіну (0,11 ммоль) розчиняють в 30 мл диметоксіетану. Реакційну суміш нагрівають для кип'ятіння із зворотним холодильником розчинника і перемішують протягом 24 годин. Після охолоджування додають етилацетат і органічну фазу промивають водою. Розчинник видаляють із застосуванням вакууму, що створюється водоструминним насосом, і залишок сушать. Продукт очищають колонковою хроматографією на силікагелі (елюент:етилацетат/гексан, 1:15). Отримують 3,58 г бензил(2-біциклопропіл-2-ілфеніл)аміну (87% від теоретичної кількості) у формі коричневого масла (транс/цис-відношення приблизно 2:1). Приклад Р2: отримання бензил(2біциклопропіл-2-ілфеніл)аміну 3,7 г 2-(2бромфеніл)біциклопропілу (15,6 ммоль, транс/цисвідношення приблизно 3:1), 2,0 г бензиламіну (18,7 ммоль), 2,1 г трет-бутаноляту натрію (21,8 ммоль), 3,5 мг ацетату Pd(II) (0,016 ммоль) і 8,6 мг R(-)-дитрет-бутил-[1-[(S)-2(дициклогексилфосфаніл)фероценіл]етил]фосфіну (0,016 ммоль) розчиняють в 30 мл диметоксіетану. Реакційну суміш нагрівають до 70°С і перемішують 89427 18 протягом 24 годин. Після охолоджування додають етилацетат. Органічну фазу промивають водою. Розчинник видаляють із застосуванням вакууму, що створюється водоструминним насосом, і залишок сушать. Продукт очищають колонковою хроматографією на силікагелі (елюент: етилацетат/гексан, 1:15). Отримують 3,47 г бензил(2біциклопропіл-2-ілфеніл)аміну (84% від теоретичної кількості) в формі коричневого масла (транс/цис-відношення приблизно 3:1). Приклад Р3: отримання 2-біциклопропіл-2ілфеніламіну 1 г бензил(2-біциклопропіл-2ілфеніл)аміну (3,8 ммоль, транс/цис-відношення приблизно 3:1) розчиняють в 15 мл абсолютного тетрагідрофурану. Потім додають 50 мг Pd (5%) на активованому вугіллі. Гідрування потім проводять з перемішуванням протягом 1 години при кімнатній температурі. Після завершення реакції каталізатор відділяють фільтруванням і розчинник видаляють із застосуванням вакууму, що створюється водоструминним насосом. Продукт очищають хроматографією на силікагелі (елюент:етилацетат/гексан, 1:15). Отримують 0,61 г 2-біциклопропіл-2ілфеніламіну (92% від теоретичної кількості) у формі коричнюватого масла (транс/цис-відношення приблизно 3:1). З застосуванням вказаних вище прикладів можна отримати нижченаведені сполуки формули І. Нижченаведені сполуки формули II є придатними для застосування в способі згідно з винаходом. 19 89427 20 Придатні проміжні сполуки для отримання сполук формули І описані в таблиці 3. Внаслідок надання даного винаходу можна амінувати орто-біциклопропілзаміщені галогенбензоли з високими виходами і з невеликими витратами. Вихідні сполуки способу даного винаходу характеризуються тим, що є легко доступними і лег ко піддаються обробці і, крім того, вони є економічно вигідними. У переважному варіанті здійснення способу згідно з винаходом паладій, що застосовується в способі, рециркулюють. Даний варіант здійснення складає варіант способу згідно з винаходом, який 21 89427 22 являє собою особливий інтерес з економічної точки зору. У переважному варіанті здійснення винаходу застосовують сполуку формули II, в яких X являє собою хлор. Вихідні сполуки даного переважного варіанту здійснення способу винаходу характеризуються тим, що є особливо легко доступними і особливо економічно вигідними. Даний варіант здійснення складає варіант способу згідно з винаходом, який являє собою особливий інтерес з економічної точки зору. Відомо, однак, що в умовах каталізованого паладієм перехресного поєднання даний клас вихідних сполук, деактивовані хлорбензольні субстрати, особливо важко амінувати внаслідок дуже низької реакційної здатності хлорної відхідної групи в порівнянні з деактивованими бромбензольними субстратами. Крім того, вихід зазвичай додатково знижується при застосуванні первинного алкіламіну, який є нуклеофілом, що має атом водню в β-положенні, такого як, наприклад, сполука формули III. Це є результатом, по-перше, додаткової реакції βелімінування в нуклеофілі алкіламіні з утворенням іміну, причому з арилгалогенідного субстрату утворюється незаміщений арил. По-друге, при застосуванні первинних амінів, що є нуклеофілами, необхідно також брати до уваги подальшу реакцію додаткового амінування у вторинний арил амін, який може знизити вихід необхідних первинних амінів. Амінування деактивованих, електронзбагачених хлорбензольних субстратів первинними алкіламіновими нуклеофілами, які мають атом водню в β-положенні, тому розглядають як дуже важке внаслідок зниженої реакційної здатності і внаслідок додаткових і подальших реакцій. Ці труднощі вказуються, наприклад, в наведених вище як посилання сумарних статтях. Несподівано було виявлено, що комплексні сполуки паладію, що мають щонайменше один ліганд, вибраний з N-гетероциклічного карбенового ліганду, монодентатного третинного фосфінового ліганду і бідентатного третинного фосфінового ліганду, який вибраний з фероценілбіфосфінового ліганду і амінофосфінового ліганду, є особливо придатними для амінування сполук формули II, де X являє собою хлор. З цієї причини для отримання комплексної сполуки паладію перевага віддається застосуванню щонайменше одного ліганду, вибраного з Νгетероциклічного карбенового ліганду, монодентатного третинного фосфінового ліганду і бідентатного третинного фосфінового ліганду, який вибраний з фероценілбіфосфінового ліганду і амінофосфінового ліганду. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, P(tBu)2BiPh, P(Cy)2BiPh, x-Phos, Josiphos 1, рацемічного Josiphos 1, Josiphos 2, рацемічного Josiphos 2, PCy2NMe2BiPh і I-Pr. У таблицях 4 і 5 описані виходи реакції амінування хлорбензолів. Таблиця 4: виходи реакції амінування хлорбензолів Готують суміш 100 мг 2-(2хлорфеніл)біциклопропілу (0,5 ммоль), 0,085 мл бензиламіну (0,78 ммоль), 8 мг трет-бутаноляту натрію (0,83 ммоль), 1,2 мг ацетату Pd(II) (0,005 ммоль, 1 мол.%) і 0,0035 ммоль (0,69 мол.%) ліганду. Додають 3 мл диметоксіетану і перемішування суміші проводять при 90°С протягом 16 годин. Після охолоджування додають 2,5 мл етилацетату і 3 мл води і органічну фазу екстрагують. Ідентичність продукту реакції бензил(2-біциклопропіл-2ілфеніл)аміну і його вихід визначають за допомогою газової хроматографії. Таблиця 5: виходи реакції амінування хлорбензолів Готують суміш 100 мг 2-(2хлорфеніл)біциклопропілу (0,5 ммоль), 0,085 мл бензиламіну (0,78 ммоль), 8 мг трет-бутаноляту натрію (0,83 ммоль) і комплексної солуки паладію в необхідній для комплексної сполуки паладію концентрації. Комплексні сполуки паладію отримують із застосуванням способів, відомих з літе ратури, і додають у вигляді вже утворених комплексних сполук паладію безпосередньо до реакційної суміші. Додають 3 мл диметоксіетану і переміщування проводять при 90°С протягом 16 годин. Після охолоджування додають 2,5 мл етилацетату і 3 мл води і органічну фазу екстрагують. Ідентичність продукту реакції, бензил(2-біциклопропіл-2ілфеніл)аміну, і його вихід визначають за допомогою газової хроматографії. 23 В особливо переважному варіанті здійснення винаходу тут застосовують комплексні сполуки паладію, що мають щонайменше один ліганд, вибраний з N-гетероциклічного карбенового ліганду, монодентатного третинного фосфінового ліганду і бідентатного третинного фосфінового ліганду. У цьому особливо переважному варіанті здійснення винаходу сполуки формули II, в яких X являє собою хлор, можна піддати реакції з невеликими кількостями комплексних сполук паладію при підтримці високих виходів. Внаслідок цього вартість каталізатора істотно знижується. Відповідно до цього, даний варіант здійснення складає варіант способу згідно з винаходом, який являє собою особливий інтерес з економічної точки зору. Цей особливо переважний варіант здійснення даного винаходу робить можливим застосування лігандів у відношенні від 1:10000 до 1:200 відносно сполук формули II (або від 0,01 мол.% до 0,5 мол.% у відношенні до сполук формули II) при підтримці високих виходів. У Angewandte Chemie International Edition, 44, 1371-1375, 2005, описано, що Josiphos 1 є придатним як ліганд для реакцій орто-метилзаміщених хлорбензолів при застосуванні ліганду в діапазоні від 1:1000 до 1:10000 відносно сполук формули II. У цій публікації описані виходи 97% при застосуванні Josiphos 1 у відношенні 1:1000 відносно сполук формули II і 98% при застосуванні Josiphos 1 у відношенні 1:10000. Вказані реакції проводили в Таблиця 7: виходи реакції амінування із зменшеною кількістю ліганду Готують суміш 100 мг 2(2-хлорфеніл)біциклопропілу (0,5 ммоль), 0,085 мл бензиламіну (0,78 ммоль), 8 мг трет-бутаноляту натрію (0,83 ммоль) і комплексної сполуки паладію в концентрації, необхідній для комплексної сполуки паладію. Комплексні сполуки паладію отримують із застосуванням способів, відомих з літератури, і додають у вигляді вже утворених комплексних сполук паладію безпосередньо до реакційної суміші. Додають 3 мл диметоксіетану і перемішування проводять при 90°С протягом 16 годин. Після охолоджування додають 2,5 мл етилацетату і 3 мл води і органічну фазу екстрагують. Ідентичність продукту реакції, бензил(2-біциклопропіл-2ілфеніл)аміну, і його вихід визначають за допомогою газової хроматографії. 89427 24 ящику для маніпулювання з рукавичками для рук в атмосфері азоту. Проведення реакції в ящику з рукавичками вказує на дуже чутливі реагенти/каталізатори. Для операцій отримання у великих масштабах, що зазвичай необхідно в агрохімії, способи, що проводяться в ящику з рукавичками, не відносяться до економічно придатних способів отримання. Крім того, виявлено, що ця вказана властивість ліганду Josiphos 1, яка була виявлена в способі, що проводиться в ящику з рукавичками, не може бути легко перенесена від ортометилзаміщених хлорбензолів до ортобіциклопропілзаміщених хлорбензолів. Замість цього було виявлено при застосуванні Josiphos 1, навіть при кількостях ліганду 1:700 відносно сполук формули II, що вихід знижується до 39% (див. таблицю 6). Аналогічні виходи виявлені також при застосуванні Josiphos 2. Несподівано було виявлено, що деякі комплексні сполуки паладію є особливо придатними для цього варіанту здійснення даного винаходу (див. таблиці 6 і 7). Таблиця 6: виходи реакції амінування із зменшеною кількістю ліганду Готують суміш 100 мг 2(2-хлорфеніл)біциклопропілу (0,5 ммоль), 0,085 мл бензиламіну (0,78 ммоль), 8 мг трет-бутаноляту натрію (0,83 ммоль), 0,24 мг ацетату Pd(II) (0,001 ммоль, 0,2 мол.%) і 0,0007 ммоль (0,14 мол.%) ліганду. Додають 3 мл диметоксіетану і перемішування суміші проводять при 90°С протягом 16 годин. Після охолоджування додають 2,5 мл етилацетату і 3 мл води і органічну фазу екстрагують. Ідентичність продукту реакції, бензил(2біциклопрогал-2-ілфеніл)аміну, і його вихід визначають за допомогою газової хроматографії. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з три-третбутилфосфіну, P(tBu)3HBF4, PCy2NMe2BiPh і І-Рr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе щонайменше один ліганд, вибраний з PCy2NMe2BiPh і ІРr. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд три-трет-бутилфосфін або Р(tBu)3НВF4. Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд PCy2NMe2BiPh. 25 89427 Перевага віддається застосуванню комплексних сполук паладію, які включають в себе ліганд ІРr. Перевага віддається застосуванню сполуки, вибраної з Pd-AI-CI-I-Pr, Pd-VTS-I-Pr і [Pd-NQ-I-Pr]2 як комплексної сполуки паладію. Перевага віддається застосуванню [Pd-NQ-IPr]2 або Pd-VTS-(I-Pr) як комплексні" сполуки паладію. Перевага віддається застосуванню [Pd-NQ-IPr]2 як комплексної сполуки паладію. У даному особливо переважно варіанті здійснення ліганди застосовують переважно у відношенні від 1:10000 до 1:200 відносно сполук формули II, особливо у відношенні від 1:1000 до 1:200 і дуже особливо у відношенні від 1:700 до 1:500. Орто-біциклопропілзаміщені аніліни, отримані способом згідно з винаходом, можна застосовувати при отриманні фунгіцидів, таких як описані, наприклад, в WO 03/074491. Під час отримання аніліну формули І, де R1 R2 і R3 являють собою водень (сполука № А1), із застосуванням способу згідно з винаходом можуть бути утворені побічні продукти формули ІА (сполука № СІ) і формули IB і відповідно до цього можуть також бути присутнім в деяких кількостях як домішки в необхідному кінцевому продукті: Комп’ютерна верстка І. Скворцова 26 Побічний продукт ΙΑ утворюється при проведенні стадії а) реакції; побічний продукт IB може бути утворений при проведенні стадії b) реакції. Коли анілін № А1, отриманий згідно з винаходом, застосовують при отриманні фунгіциду IС способами, такими як описані, наприклад, в WO 03/074491, в необхідному фунгіциді формули IС, отже, можуть бути присутніми домішки ID і IE: Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preperation of aniline derivatives and intermediate
Автори англійськоюWalter Harald, Corsi Camilla, Ehrenfreund Josef, Tobler Hans
Назва патенту російськоюСпособ получения производных анилина и промежуточное соединение
Автори російськоюВальтер Харальд, Корси Камилла, Эренфройнд Йозеф, Тоблер Ханс
МПК / Мітки
МПК: C07C 209/10, C07C 209/62, C07C 211/48, C07C 211/45
Мітки: одержання, проміжна, сполука, похідних, аніліну, спосіб
Код посилання
<a href="https://ua.patents.su/13-89427-sposib-oderzhannya-pokhidnikh-anilinu-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних аніліну та проміжна сполука</a>
Попередній патент: Фільтр для очистки води
Наступний патент: Малошумна система кріплення бучко, кацберг рейки до шпали
Випадковий патент: Газогенератор