Тетрациклічні сполуки, спосіб їх одержання і фармацевтичні композиції, які їх містять
Номер патенту: 96125
Опубліковано: 10.10.2011
Автори: Пуатеван Крістоф, Пегліон Жан-Луі, Брокко Морісетт, Міллан Марк
Формула / Реферат
1. Сполука формули І, відносної конфігурації транс:
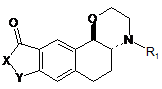 , І
, І
в якій:
- Х являє собою атом кисню або NR2-групу,
- Y являє собою групу, яку вибирають з -СН2-, -(СН2)2- і -СН=СН-,
- R1 і R2, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, С3-С8циклоалкілу і циклоалкілалкілу, де алкільна частина являє собою С1-С6 і є лінійною або розгалуженою і циклоалкільна частина являє собою С3-C8,
в рацемічній формі або у формі оптичних ізомерів,
або її адитивні солі з фармацевтично прийнятною кислотою і її гідрати.
2. Сполука формули І за п. 1, де R1 являє собою алкільну групу.
3. Сполука формули І за пп. 1 або 2, де Х являє собою NR2-групу.
4. Сполука формули І за будь-яким з пп. 1-3, де Y являє собою СН2-групу.
5. Сполука формули І за п. 1, яку вибирають з:
- (4aRS,11bRS)-4-пропіл-3,4,4a,5,6,8,9,11b-октагідроізоіндоло[5,6-h][1,4]бензоксазин-10(2Н)-ону або його енантіомерів і адитивних солей з фармацевтично прийнятною кислотою;
- (4aR,11bR)-4-пропіл-2,3,4,4а,5,6,8,11b-октагідро-10Н-фуро[3',4':6,7]нафто-[1,2-b][1,4]оксазин-10-ону або його адитивних солей з фармацевтично прийнятною кислотою;
- (4аR,12bR)-4-пропіл-3,4,4а,5,6,8,9,12b-октагідро-2Н,11Н-пірано[4',3':6,7]-нафто[1,2-b][1,4]оксазин-11-ону або його адитивних солей з фармацевтично прийнятною кислотою;
- (4аR,12bR)-4-пропіл-2,3,4,4а,5,6,8,9,10,12b-декагідро-11Н-ізохіно[6,7-h][1,4]-бензоксазин-11-ону або його адитивних солей з фармацевтично прийнятною кислотою і
- (4аR,12bR)-4-пропіл-2,3,4,4а,5,6,10,12b-октагідро-11Н-ізохіно[6,7-h][1,4]-бензоксазин-11-ону або його адитивних солей з фармацевтично прийнятною кислотою.
6. Спосіб одержання сполуки формули І за п. 1, починаючи зі сполуки формули II, відносної конфігурації транс:
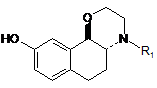 , ІІ
, ІІ
де R1 є таким же, як визначено для формули І,
яку піддають реакції з трифторметансульфоновим ангідридом у присутності піридину для одержання сполуки формули III:
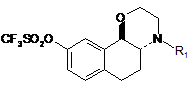 , III
, III
в якій R1 є таким же, як визначено в п. 1,
яку піддають реакції з ціанідом цинку і тетракис(трифенілфосфін)паладієм(0) в диметилформаміді у гарячому стані для одержання сполуки формули IV:
 , IV
, IV
в якій r1 є таким же, як визначено в п. 1,
яку обробляють сумішшю хлористоводневої кислоти і оцтової кислоти зі зворотним холодильником для одержання сполуки формули V:
 , V
, V
в якій R1 є таким же, як визначено в п. 1,
яку потім перетворюють у сполуку формули І за допомогою звичайних реакцій органічної хімії.
7. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-5 в комбінації з одним або більше інертними, нетоксичними, фармацевтично прийнятними наповнювачами або носіями.
8. Застосування сполуки формули І за п. 1 для одержання лікарських засобів для застосування у лікуванні розладів центральної нервової системи, що залучають допамінергічну систему.
9. Застосування сполуки формули І за п. 1 для одержання лікарських засобів для застосування у нейрозахисті або лікуванні хвороби Паркінсона, гіперпролактинемії, статевої дисфункції, депресії, тривоги, хвороби Альцгеймера або інших нейродегенеративних розладів, таких як церебральні напади.
10. Фармацевтична композиція за п. 7 для застосування у лікуванні розладів центральної нервової системи, що залучають допамінергічну систему.
11. Фармацевтична композиція за п. 7 для застосування у нейрозахисті або лікуванні хвороби Паркінсона, гіперпролактинемії, статевої дисфункції, депресії, тривоги, хвороби Альцгеймера або інших нейродегенеративних розладів, таких як церебральні напади.
Текст
1. Сполука формули І, відносної конфігурації транс: 2 (19) 1 3 O N N R1 , IV в якій R1 є таким же, як визначено в п. 1, яку обробляють сумішшю хлористоводневої кислоти і оцтової кислоти зі зворотним холодильником для одержання сполуки формули V: O HO O N R1 ,V в якій R1 є таким же, як визначено в п. 1, яку потім перетворюють у сполуку формули І за допомогою звичайних реакцій органічної хімії. 7. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-5 в комбінації з одним або більше інертними, нетоксичними, фармацевтично прийнятними наповнювачами або носіями. Даний винахід стосується нових тетрациклічних сполук, способу їх одержання і фармацевтичних композицій, які їх містять. Більш конкретно, винахід стосується сполук формули І, відносної конфігурації транс: в якій: * X являє собою атом кисню або NR2-групу, * Υ являє собою групу, яку вибирають з -СН2-, (СН2)2- і -СН=СН-, * R1 і R2, які можуть бути однаковими або відрізнятись, кожний являє собою атом водню або групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, С3-С8циклоалкілу і циклоалкілалкілу, де алкільна частина являє собою С1-С6 і є лінійною або розгалуженою і циклоалкілоалкільна частина являє собою С3-С8, в рацемічній формі або у формі оптичних ізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою і їх гідратів. С3-С8циклоалкільна група означає 3-8-членну моноциклічну насичену вуглеводневу групу. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, бензолсульфонова кислота, камфорна кислота і дибензоїлвинна кислота. 96125 4 8. Застосування сполуки формули І за п. 1 для одержання лікарських засобів для застосування у лікуванні розладів центральної нервової системи, що залучають допамінергічну систему. 9. Застосування сполуки формули І за п. 1 для одержання лікарських засобів для застосування у нейрозахисті або лікуванні хвороби Паркінсона, гіперпролактинемії, статевої дисфункції, депресії, тривоги, хвороби Альцгеймера або інших нейродегенеративних розладів, таких як церебральні напади. 10. Фармацевтична композиція за п. 7 для застосування у лікуванні розладів центральної нервової системи, що залучають допамінергічну систему. 11. Фармацевтична композиція за п. 7 для застосування у нейрозахисті або лікуванні хвороби Паркінсона, гіперпролактинемії, статевої дисфункції, депресії, тривоги, хвороби Альцгеймера або інших нейродегенеративних розладів, таких як церебральні напади. Один аспект даного винаходу стосується сполук формули І, в якій R1 являє собою алкільну групу, особливо пропільну групу. Інший аспект даного винаходу стосується сполук формули І, в якій X являє собою NR2-групу, особливо NH-групу. Інший аспект даного винаходу стосується сполук формули І, в якій Υ являє собою СН2-групу. Інший аспект даного винаходу стосується наступних сполук формули І: - (4aRS, 11bRS)-4-пропіл-3,4,4a, 5,6,8,9,11bоктагідроізоіндоло[5,6-h][1,4]бензоксазин-10(2Н)он, а також його енантіомери і адитивні солі з фармацевтично прийнятною кислотою; - (4aR, 11bR)-4-пропіл-2,3,4,4а, 5,6,8,11bоктагідро-10Н-фуро[3',4':6,7]нафто-[1,2b][1,4]оксазин-10-он, а також його адитивні солі з фармацевтично прийнятною кислотою; -(4aR, 12bR)-4-пpoпiл-3,4,4a,5,6,8,9,12boктaгiдpo-2H, 11H-пipaнo[4’,3':6,7]-нaфтo[1, 2b][1,4]оксазин-11-он, а також його адитивні солі з фармацевтично прийнятною кислотою; -(4aR, 12bR)-4-пропіл-2,3,4,4a, 5,6,8,9,10,12bдекагідро-11H-ізохіно[6,7-h][1,4]-бензоксазин-11он, а також його адитивні солі з фармацевтично прийнятною кислотою і - (4aR, 12bR)-4-пропіл-2,3,4,4a, 5,6,10,12bоктагідро-11Н-ізохіно[6,7-h] [1,4]-бензоксазин-11он, а також його адитивні солі з фармацевтично прийнятною кислотою. Сполуки формули І діють як потужні допамінергічні ліганди. Допамінергічні сполуки широко використовують у терапії завдяки їх переважним впливам на психіатричні і неврологічні розлади і, допоміжно, на серцевосудинні розлади. П'ять підтипів допамінергічних рецепторів (від D1 до D5) були клоновані і охарактеризовані на сьогоднішній день. Переважна більшість лікарсь 5 ких засобів в цьому класі на даний момент діють на допамінергічну систему за допомогою їх дії на підтип D2 або як блокатори (або антагоністи) або як активатори (або агоністи). Ці лікарські засоби мають численні побічні ефекти: дискінезія, гіперпролактинемія і аменорея - у випадку першого, і серцево-судинні і блювотні ефекти - у випадку останнього. На відміну від рецепторів D2, концентрація рецепторів D3 є дуже низькою у ніграстріарному ядрі і в лактотропних клітинах (Pharmacol Ther.2001,90(2-3), 231-59;CNS Neural Disord Dmg Targets2006,5(1), 25-43). З іншого боку, так само як і для рецепторів D2, концентрація рецепторів D3 є дуже високою в лімбічній системі (Pharmacol Ther.2001,90(2-3), 231-59;CNS Neural Disord Drug Targets2006,5(1), 25-43). Ця значна різниця в місцезнаходженні цих двох підтипів рецепторів спонукає до пошуку нових лікарських засобів, які діють переважно на підтип D3, що повинно супроводжуватись мінімізацією побічних ефектів, які звичайно пов'язані з підтипом D2, як згадано тут вище (Pharmacol Ther.2001,90(2-3), 231-59;J Pharmacol Exp Ther.2004,309(3), 936-50;J Pharmacol Exp Ther.2004,309(3), 921-35;CNS Ncurol Disord Drug Targets2006,5(1), 25-43). Дизаміщені транс-3,4,4а, 5,6,10b-гексагідро2Н-нафт[1,2-b]-1,4-оксазини були описані як допамінергічні ліганди в описі патенту ЕР 0899267. Сполуки за даним винаходом поводять себе як переважні ліганди рецепторів D3, з меншою афінністю до рецептора D2. Ця характеристика робить сполуки за даним винаходом особливо корисними завдяки тому факту, що вони проявляють низький рівень побічних ефектів. Ряд досліджень підтвердив їх механізм дії і значення їх застосування у лікуванні численних розладів центральної нервової системи. Зокрема, сполуки за даним винаходом проявляють їх активність у дослідженні активації пресинаптичного допамінергічного ауторецептора, в тесті примусового плавання, у дослідженні ультразвукової вокалізації і у дослідженні на обертання на 6-OH-DA-ушкоджених щурах. Ці результати дозволяють запропонувати продукти даного винаходу для нейрозахисту і для лікування розладів центральної нервової системи, що залучають допамінергічну систему, таких як хвороба Паркінсона (Pharmacol Ther.2001,90(2-3), 231-59;J Pharmacol Exp Ther. 2004,309(3), 93650;CNS Neural Disord Drug Targets2006,5(1), 2543), гіперпролактинемія (Pharmacol Ther.2001,90(23), 231-59;Curr Opin Obstet Gynecol.1993,5(3), 3607), статева дисфункція (Physiol Behav.2004,Vol83,291-307;J Neurosci.1999,Vol 19,456-463), депресія (Pharmacol Ther.2006,110(2), 135-370;J Pharmacol Exp Ther.2004,309(3). 936-50), тривога (Prog Neurobiol.2003,70(2), 83-244;J Pharmacol Exp Ther.2004,309(3). 936-50), хвороба Альцгеймера та інші нейродегенеративні розлади, такі як церебральні напади (Eur J Neurosci. 2005,22(10), 2422-30;Glia.2005,52(4), 336-43;J Neurosci.2006,26(27), 7272-80;Brain1999,122(Pt8), 1449-68); J Neurosci Res.2002,67(4), 494-500). 96125 6 Даний винахід стосується також способу одержання сполук формули І, починаючи зі сполукиформули II, відносної конфігурації транс: де R1 є таким же, як визначено для формули І, яку піддають реакції з трифторметансульфоновим ангідридом у присутності піридину для одержання сполуки формули III: в якій R1 є таким же, як визначено тут вище, яку піддають реакції з ціанідом цинку і тетракис(трифенілфосфін)паладієм(0) в диметилформаміді у гарячому стані для одержання сполуки формули IV: в якій R1 є таким же, як визначено тут вище, яку обробляють сумішшю хлористоводневої кислоти і оцтової кислоти зі зворотним холодильникомдля одержання сполуки формули V: в якій R1 є таким же, як визначено тут вище, яку потім перетворюють у сполуку формули І за допомогою звичайних реакції органічної хімії. З метою прикладу, сполуки формули І, в якій X являс собою NH і Υ являє собою СН2, можуть бути одержані шляхом реакції сполуки формули V з діетиламіном у звичайних умовахамідування для одержання сполуки формули VI: в якій R1 є таким же, як визначено тут вище, яку піддають реакції з фенілціанатом в умовах заміщення металом водню, безпосередньо з'єднаного з вуглецевим атомом в ортоположенні, для одержання сполуки формули VII: в якій R1 є таким же, як визначено тут вище, яку відновлюють за допомогою звичайного відновлювального агента, такого як, наприклад, нікель Ренея, для одержання сполуки формули VIII: 7 96125 8 аміном формули NH2R’2 для одержання сполук формули Іс, окремого випадку сполук формули І: в якій R1 є таким же, як визначено тут вище, яку циклізують у присутності органічної сполуки літію, такої як трет-бутиллітій, для одержання сполук формули Іа, окремого випадку сполук формули І: ще. в якій R1 є таким же, як визначено тут вище. Сполуки формули І, в якій X являє собою О і Υ являє собою СН2, можуть бути одержані шляхом реакції сполуки формули VI з диметилформамідом, в умовах заміщення металом водню, безпосередньо з'єднаного з вуглецевим атомом в ортоположенні, для одержання сполуки формули IX: в якій R1 є таким же, як визначено тут вище, яку відновлюють за допомогою селективного відновлювального агента, такого як боргідрид натрію, для одержання сполуки формули X: в якій R1 і R2 є такими ж як визначено тут ви Сполуки формули І, в якій X являє собою NH і Υ являє собою -(СН2)2-, можуть бути одержані шляхом реакції сполуки формули X з галогенуючим агентом, таким як тіонілхлорид або тіонілбромід, або сполуки формули CG4 у присутності РРh3, в якій G являє собою атом хлору, брому або йоду, для одержання сполуки формули XI: в якій R1 є таким же, як визначено тут вище, і G являє собою атом хлору, брому або йоду, яку піддають реакції з ціануючим агентом, таким як ціанід тетрабутиламонію, ціанід натрію або ціанід калію, для одержання сполуки формули XII: в якій R1 є таким же, як визначено тут вище, яку відновлюють за допомогою звичайного відновлювального агента, такого як нікель Ренея, для одержання сполуки формули XIII: в якій R1 є таким же, як визначено тут вище, яку циклізують у присутності органічної або неорганічної кислоти, такої як хлористоводнева кислота, для одержання сполуки формули ІЬ, окремого випадку сполук формули І: в якій R1 є таким же, як визначено тут вище. Сполуки формули І, в якій X являє собою NR'2групу, в якій R'2 являє собою групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, С3С8циклоалкілу і циклоалкілалкілу, де алкільна частина являє собою С1-С6 і є лінійною або розгалуженою і циклоалкільна частина являє собою С3-C8, і Υ являє собою СН2-групу, можуть бути одержані шляхом реакції сполуки формули Іb з первинним в якій R1 є таким же, як визначено тут вище, яку циклізують за допомогою органічної сполуки літію, такої як трет-бутиллітій, для одержання сполуки формули Id, окремого випадку сполук формули І: в якій R1 є таким же, як визначено тут вище. 9 Сполуки формули І, в якій X являє собою О і Υ являє собою -(СH2)2-, можуть бути одержані шляхом реакції сполуки формули VI з брометанолом у присутності n-бутиллітію в умовах заміщення металом водню, безпосередньо з'єднаного з вуглецевим атомом в ортоположенні, для одержання сполуки формули XIV: в якій R1 є таким же, як визначено тут вище, яку циклізують за допомогою органічної або неорганічної кислоти, такої як хлористоводнева кислота, для одержання сполуки формули Іе, окремого випадку сполук формули І: в якій R1 є таким же, як визначено тут вище. Сполуки формули І, в якій X являє собою NR'2-групу, в якій R'2 являє собою групу, яку вибирають з лінійного або розгалуженого С1-С6алкілу, С3-С8циклоалкілу і циклоалкілалкілу, де алкільна частина являє собою С1-С6 і є лінійною або розгалуженою і циклоалкільна частина являє собою С3С8, і Υ являє собою -(СH2)2-групу, можуть бути одержані шляхом реакції сполуки формули Іе з первинним аміном формули ΝΗ2R'2 для одержання сполук формули If, окремого випадку сполук формули І: в якій R1 i R'2 є такими ж, як визначено тут вище. Сполуки формули І, в якій X являє собою NH і Υ являє собою СН=СН, можуть бути одержані шляхом реакції сполуки формули V з хлоруючим агентом, таким як тіонілхлорид, для одержання сполуки формули XV: в якій R1 є таким же, як визначено тут вище, яку піддають реакції з гідрохлоридом метоксиламіну у присутності основи, такої як карбонат калію або карбонат натрію, для одержання сполуки формули XVI: 96125 10 в якій R1 є таким же, як визначено тут вище, яку піддають реакції з метилйодидом в умовах заміщення металом водню, безпосередньо з'єднаного з вуглецевим атомом в ортоположенні, для одержання сполуки формули XVII: в якій R1 є таким же, як визначено тут вище, яку піддають реакції з диметилформамідом у присутності органічної сполуки літію, такої як вторбутиллітій для одержання сполуки формули XVIII: в якій R1 є таким же, як визначено тут вище, яку піддають реакції з хлоридом титану(III) для одержання сполуки формули Ig, окремого випадку сполук формули І: в якій R1 є таким же, як визначено тут вище. Вихідні сполуки формули II одержують відповідно до методик, розкритих в літературі, починаючи з відомих речовин. (4aRS, 11bRS) або (4aRS, 10bRS) ізомер означає рацемічну суміш енантіомерів, які мають абсолютні конфігурації (4aR, 11bR) і (4aS, 11bS) або (4aR, 10bR) і (4aS, 10bS), відповідно. Оптично активні форми сполук формули І одержують, або починаючи з оптично активних форм вихідних сполук формули II, або шляхом розкладання рацемічних форм сполук формули І відповідно до способів, відомих з літератури. Сполуки даного винаходу являють собою допамінергічні ліганди. Вони є корисними як лікарські засоби у лікуванні розладів центральної нервової системи, що залучають допамінергічну систему, таких як хвороба Паркінсона, гіперпролактинемія, статева дисфункція, депресія, тривога, хвороба Альцгеймера та інші нейродегенеративні розлади, такі як церебральні напади. Даний винахід стосується також фармацевтичних композицій, які містять як активний інгредієнт сполуку формули І або її адитивну сіль з фармацевтично прийнятною кислотою, в комбінації з одним або більше інертними, нетоксичними, фармацевтично прийнятними наповнювачами або носіями. 11 Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно ті, які придатні для орального введення, парентерального (внутрішньовенного, внутрішньом'язового або підшкірного), під- або черезшкірного, назального, ректального, перлінгвального, очного або респіраторного введення, і особливо таблетки або драже, під'язикові таблетки, желатинові капсули, капсули, супозиторії, креми, мазі, шкірні гелі, препарати, придатні для ін'єкцій або пиття, аерозолі, очні краплі і краплі для носа. Корисне дозування змінюється відповідно до віку і ваги пацієнта, шляху введення, природи і тяжкості розладу і застосування будь-якого пов'язаного лікування і знаходиться в діапазоні від 0,5 до 500 мг на день за одне або більше введень. Наступні приклади ілюструють даний винахід. Структури сполук, які описують у Прикладах, були визначені відповідно до звичайної спектрофотометричної методики (інфрачервоний, ядерний магнітний резонанс, мас-спектрометрія). Приклад 1: (4aRS,11bRS)-4-пропіл-3,4,4a, 5,6.8,9,11b-октагідроізоіндоло-[5,6b][1,4]бензоксазин-10(2Н)-он і його гідрохлорид Стадія A: (4aRS,10bRS)-N,N-діетил-4-пропіл3,4,4a,5,6,10b-гексагідро-2Н-нафто[1,2-b] [1,4]оксазин-9-карбоксамід До 51 г (163 ммоль) гідрохлориду транс(4aRS,10bRS)-4-пропіл-3,4,4a, 5,6,10b-гексагідро2Н-нафто-[1,2-b][1,4]оксазин-9-карбонової кислоти (одержують відповідно до методики, яку розкрито в описі патенту ЕР 0899267), суспендованого в метиленхлориді (815 мл), додають, підряд, діетиламін (18,3 мл, 177 ммоль, 1,09 екв.), Обензотриазол-і-іл-Ν,Ν,Ν',Ν'-тетраметилуроній тетрафторборату (TBTU) (57 г, 177 ммоль, 1,07 екв.) і потім триетиламін (56 мл, 402 ммоль, 2,4 екв.). Одержаний розчин перемішують при температурі навколишнього середовища протягом 20 годин і потім реакційну суміш обробляють у 1N розчині гідроксиду натрію (425 мл). Органічну фазу відокремлюють, промивають насиченим розчином NaCl, висушують над сульфатом магнію і потім концентрують у вакуумі. Залишок, який одержують, очищують флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/еталон (90/5). Очікуваний продукт збирають у формі масла. -1 ІЧ:1629 см . 1 Н-ЯМР 300 МГц (CDCІ3): 7,60; 7,25; 7,10; 4,30; 4,10; 3,95; 3,7-3,15; 3,00-2,75; 2,50; 2,4-2,2; 1,7-1,4; 1,35-1,00; 0,95. Стадія В: (4aRS, 10bRS)-N,N-дieтил-8-цiaнo-4пpoпiл-3,4,4a, 5,6,10b-гeкcaгiдpo-2H-нафто [1,2-b] [1,4] оксазин-9-карбоксамід Амід, одержаний на вищезазначеній Стадії А (12 г, 36 ммоль), розчинений в тетрагідрофурані (220 мл), додають до розчину, який охолоджують до -78 °C, s-BuLi (1,3M) в гексані (40 мл) і Ν,Ν,Ν',Ν'тетраметилетилендіамін (TMEDA) (8,2 мл) в тетрагідрофурані (240 мл), підтримуючи внутрішню температуру нижче -65 °C. Одержану суміш переміщують протягом 1 години 30 хвилин при температурі -70 °C. Додають фенілціанат (PhOCN) (12 г), підтримуючи внутрішню температуру нижче 96125 12 -65 °C. Суміш перемішують протягом 5 хвилин при -65 °C, і температуру реакційної суміші потім повертають назад до температури навколишнього середовища протягом 1 години 30 хвилин і потім перемішують при температурі навколишнього середовища протягом 1 години. Суміш гідролізують, використовуючи 10 % розчин води в тетрагідрофурані, екстрагують етиловим ефіром, висушують і концентрують. Залишок, який одержують, очищують флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (95/5). Очікуваний продукт одержують у формі масла. -1 -1 ІЧ:2228 см , 1632 см . 1 Н-ЯМР 300 МГц (CPCІ3): 7,65; 7,40; 4,30; 4,05; 3,90; 3,60; 3,25; 3,05-2,75; 2,50-2,15; 1,8-1,4; 1,15;0,95. Стадія С: (4аRS,10bRS)-8-(аміномeтил)-N,Nдіетил-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто [1,2-b] [1,4] оксазин-9-карбоксамід Нітрил, який одержують на вищезазначеній Стадії, (0,61 г, 1,7 ммоль), розчинений в метанолі (60 мл), обробляють воднем під тиском 4 бар у присутності нікелю Ренея (1 г), при 60 °C протягом 4 годин. Після повернення до температури навколишнього середовища, каталізатор відфільтровують, фільтрат потім концентрують. Залишок, який одержують, очищують флеш-хроматографісю на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол/аміак (90/10/1). Очікуваний продукт одержують у формі аморфної твердої речовини. -1 -1 ІЧ:3388-3314 см ,1626 см . 1 Н-ЯМР 300 МГц (CDCІ3): 7,35, с, 1Н; 7,10, с, 1H;4,30, д, 1H;4,05, дд, 1Н; 3,90, дт, 1Н; 3,75, с, 211;3,55, кв., 2Н; 3,20, кв., 1Н; 2,85, м, 1Н; 2,90, м, 2Н; 2,80, м, 1Н; 2,30, м, 1Н; 2,30, м, 1Н; 1,55, м, 1Н; 1,50, м, 2Н; 1,30,т, 3Н; 1,05, т, 3Н; 0,90, т, 3Н. Стадія D: (4аRS,11bRS)-4-пропіл-3,4,4а, 5,6,8,9,11b-октагідроізоіндоло[5,6-h][1,4]бензоксазин-10(2Н)-он і його гідрохлорид Розчин трет-бутиллітію (1,5М в пентані) (10 мл) додають до розчину аміну (1,8 г), одержаного на вищезазначеній Стадії, в тетрагідрофурані (200 мл). Одержану суміш перемішують протягом 15 хвилин при -75 °C і протягом 20 хвилин при -40 °C і потім гідролізують, використовуючи 10 % розчин води в тетрагідрофурані. Після розділення у присутності метиленхлориду, висушування і концентрування під зниженим тиском, очікуваний продукт виділяють у формі твердої речовини білого кольору, гідрохлорид якої кристалізують з метанолу. -1 -1 ІЧ:1691 см ,3183 см . 1 Н-ЯМР 300 МГц (CDCІ3): 8,09, с, 1Н; 7,16, с, 1H;6,68, нерозділений пік, 1Н; 4,38, м, 1Н; 4,35, д, 1Н; 4,09, м, 1Н; 3,95, тд, 1Н; 3,00, м, 2Н; 2,89, д, 1Н; 2,82, м, 1Н; 2,46, тд, 1Н; 2,29, м, 3Н; 1,64, м, 1Н; 1,53, м, 2Н; 0,92, т, 3Н. Приклад 2: (4aR, 11bR)-4-пропіл3,4,4,5,6,8,9,11b-октагідроізоіндоло[5,6-b][1,4]бензоксазин-10(2Н)-он і його гідрохлорид 700 мг продукту, одержаного на Стадії D Прикладу 1, розміщують на колонці Chiralcel® OD і розділяють ВЕРХ, використовуючи 200:1 суміш ізопропанолу і трифтороцтової кислоти як рухому 13 фазу. Очікуваний продукт с першим, що повинен елююватися. Після обробки гідроксидом натрію і потім 2М ефірним хлористоводневим розчином одержують гідрохлорид очікуваного продукту. Точка плавлення: 287-291 °C. Оптичне обертання: розчинник = метанол, конц.=1 %, темп.=20 °C, λ.=589нм, D=+52,4. Приклад 3: (4aS, 11bR)-4-пропіл-3,4,4а, 5,6,8,9,11b-октагідроізоіндоло[5,6-h][1,4]бензоксазин-10(2Н)-он і його гідрохлорид Другий продукт, елюйований у Прикладі 2, відповідає очікуваному продукту. Після обробки гідроксидом натрію і потім 2М ефірним хлористоводневим розчином одержують гідрохлорид очікуваного продукту. Точка плавлення: 302-308 °C. Оптичне обертання: розчинник = метанол, конц.=1 %, темп.=20 °C, λ.=589 нм, D=-53,9. Приклад 4: (4aR,11bR)-4-пропіл-2,3,4,4а, 5,6,8,11b-октагідро-10Н-фуро-[3',4':6,7]нафто[1,2b][1,4]оксазин-10-он і його гідрохлорид Стадія A: (4aR, 10bR)-N,N-діетил-4-пропіл3,4,4а,5,6,10b-гексагідро-2Н-нафто [1,2-b] [1,4] оксазин-9-карбоксамід (4aR, 10bR)-N, N-діетил-4-пропіл-3,4,4a, 5,6,10b-гексагідро-2Н-нафто [1,2-b] - [1,4] оксазин9-карбонової кислоти гідрохлорид (аD=+90,6, при 20 °C, 1 % концентрація в метанолі) обробляють як на Стадії А Прикладу 1 для одержання очікуваного продукту. Стадія В: (4aR, 10bR)-N, N-дieтил-8-фopмiл-4пpoпiл-3,4,4а, 5,6,10b-гексагідро-2Н-нафто- [1,2-b] [1,4] оксазин-9-карбоксамід Амід, який одержують на вищезазначеній Стадії (2 г, 6,05 ммоль), розчинений в тетрагідрофурані (10 мл), додають до розчину, який охолоджують до -78 °C, s-BuLi (1,3M, 7,86 мл) і Ν,Ν,Ν',Ν'тетраметилетилендіамін (TMEDA) (1,2 мл, 7,9 ммоль) в тетрагідрофурані (25 мл), в той же час підтримуючи температуру нижче -65 °C всюди. Одержану суміш перемішують протягом 1 години 30 хвилин, і потім додають Ν,Ν-диметилформамід (1мл), підтримуючи внутрішню температуру нижче -65 °C. Суміш перемішують протягом 5 хвилин при -65 °C; температуру реакційної суміші потім повертають до температури навколишнього середовища протягом 1 години 30 хвилин і перемішують протягом 1 години при цій же температурі. Після гідролізу, використовуючи 10 % розчин води в тетрагідрофурані, екстрагування етиловим ефіром, висушування і концентрування, залишок, який одержують, очищують флеш-хроматографією на силікагелі, використовуючи суміш метиленхлорид/етанол (елюент: 95/5). Очікуваний продукт збирають у формі масла. -1 -1 ІЧ:2940-1696 см ,1628 см . 1 Н-ЯМР 300 МГц (CDCІ3): 9,90, с, 1Н; 7,70, с, 1Н; 6,30, с, 1Н; 4,25, д, 1Н; 4,00, м, 1Н; 3,80, м, 1Н; 3,45, кв., 2H;3,00, кв., 2Н; 3,00-2,70, м, 4Н; 2,35 96125 14 2,05, м, 4Н; 1,45, м, 3Н; 1,20, т, ЗН; 0,90, т, 3Н; 0,85, т, 3Н. Стадія С: (4aR,11bR)-4-пропіл2,3,4,4a,5,6,8,11b-октагідро-10Н-фуро[3',4':6,7]нафто-[1,2-b][1,4]оксазин-10-он і його гідрохлорид Альдегід, який одержують на вищезазначеній Стадії (3,5 г), розчиняють в метанолі (35 мл). Розчин, охолоджений до 0 °C, обробляють з боргідридом натрію (0,45 г). Реакційну суміш перемішують протягом 20 годин, супроводжуючи поверненням до температури навколишнього середовища. Реакційну суміш охолоджують до 0 °C; потім додають 6N розчин хлористоводневої кислоти (7 мл). Одержану суміш нагрівають зі зворотним холодильником протягом 20 годин. Після повернення до температури навколишнього середовища, гідрохлорид очікуваного продукту виділяють і перекристалізовують з метанолу. Точка плавлення: 268-271 °C. -1 -1 -1 ІЧ:2780 см ,2140 см ,1746 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 11,90, м, 1Н; 7,80, с, 1Н; 7,50, с, 1Н; 5,40, с, 2Н; 5,10, д, 1Н; 4,25, м, 2Н; 3,60, м, 1Н; 3,45-3,15, м, 3Н; 3,15-2,95, м, 3Н; 2,55, м, 1Н; 2,10, м, 1Н; 1,75 (секст.), 2Н; 0,95 (т), 3Н. Приклад 5: (4aR, 12bR)-4-пропіл3,4,4,5,6,8,9,12b-октагідро-2H, 11H-пірано[4',3':6,7]нафто[1,2-6][1,4]оксазин-11-он і його гідрохлорид Стадія А: (4aR, 10bR)-8-(2-гiдpoкcieтил)-N, Nдieтил-4-пpoпiл-3,4,4a, 5,6,10b-гeкcaгiдpo-2Ннафто [1,2-b] [1,4]оксазин-9-карбоксамід Амід, одержаний на Стадії А Прикладу 4 (5 г, 15 мМ), розчинений в тетрагідрофурані (60 мл), додають до розчину, охолодженого до -78 °C, sBirLi (1,3 Μ) в гексані (14,7 мл) і Ν,Ν,Ν',Ν'тетраметилетилендіаміну (TMEDA) (3 мл) в тетрагідрофурані (65 мл), підтримуючи внутрішню температуру нижче -65 °C. Одержану суміш перемішують протягом 30 хвилин при температурі -70 °C. Розчин літійованого брометанолу [одержаного з брометанолу і n-BuLi (2,5М в гексані) в тетрагідрофурані] переносять за допомогою канюлі, підтримуючи внутрішню температуру нижче -65 °C. Суміш перемішують протягом 5 хвилин при -65 °C; температуру реакційної суміші повертають до температури навколишнього середовища протягом 1 години 30 хвилин і перемішування продовжують протягом ще 1 години. Проводять гідроліз, використовуючи 10 % розчин води в тетрагідрофурані, екстрагування метиленхлоридом, висушування і концентрування. Залишок, який одержують, очищують за допомогою флеш-хроматографії на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (90/10). Очікуваний продукт виділяють у формі масла. -1 -1 IЧ: 3600-3090 см ,1621 см . 1H-ЯМР 300 МГц (DMSO-d6): 7,10, с, 1H; 7,00, с, 1H;4,60, τ, 1H; 4,15, д, 1H; 3,95, д, 1Н; 3,75, т, 1Н; 3,50, м, 2Н; 3,40, м, 2Н; 3,05, м, 2Н; 2,80, м, 2Н; 2,60, м, 2Н; 2,30-2,00, м, 5Н; 1,55-1,35, м, 4Н; 1,15, т, 3Н; 0,95, т, 3Н; 0,85, т, 3Н. Стадія В: (4aR,12bR)-4-пропіл3,4,4a,5,6,8,9,12b-октагідро-2Н, 11Н-пірано 15 [4',3':6,7]нафто[1,2-b][1,4]оксазин-11-он і його гідро хлорид 6N розчин хлористоводневої кислоти (2,1 мл) додають при температурі навколишнього середовища до розчину продукту, одержаного на вищезазначеній Стадії (1,08 г, 2,88 ммоль), в метанолі (9 мл). Одержану суміш нагрівають зі зворотним холодильником протягом 20 годин. Після повернення до температури навколишнього середовища, фільтрування утвореного осаду дозволяє одержати гідрохлорид очікуваного продукту. Точка плавлення: 275-279 °C. -1 -1 -1 ІЧ:2401 см ,1712 см ,1620 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 11,50, м, 1Н; 8,00, с, 1Н; 7,21, с, 1Н; 4,95, дд, 1Н; 4,50, т, 2Н; 4,25, д, 2Н; 3,60, м, 1Н; 3,28, м, 3Н; 3,05, м, 5Н; 2,50, м, 1Н; 2,00, м, 1Н; 1,75, м, 2Н; 1,00, т, 3Н. Приклад 6: (4аR, 12bR)-4-пропіл2,3,4,4,5,6,8,9,10,12b-декагідро-11H-ізохіно[6,7h][1,4]бензоксазин-11-один і його гідрохлорид Стадія А: (4аR, 10bR)-8-гідроксиметил-N, Nдіетил-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто [1,2-b] [1,4]оксазин-9-карбоксамід Альдегід, який одержують на Стадії В Прикладу 4 (0,85 г, 2,4 ммоль), розчиняють в метанолі (10 мл). Розчин, охолоджений до 0 °C, обробляють боргідридом натрію (0,16 г, 4,23 ммоль). Реакційну суміш перемішують протягом 20 годин, з поверненням до температури навколишнього середовища. Метанол випаровують у вакуумі. Залишок вміщують у воду і метиленхлорид. Після відокремлення, висушування і концентрування одержаний залишок очищують флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (95/5). Очікуваний продукт одержують у формі масла. -1 -1 ІЧ:3600-3070 см ;1627 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 7,20, с, 1Н; 7,10, с, 1H;5,10, т, 1Н; 4,35, д, 1H;4,20, д, 1Н; 4,00, м, 1Н; 3,80, м, 1Н; 3,40, кв., 2H;3,10, кв., 2Н; 2,80, м, 4Н; 2,40-2,00, м, 4Н; 1,45, м, 3Н; 1,10, т, 3Н; 0,95, т, 3Н; 0,85, т, 3Н. Стадія В: (4aR, 10bR)-8-хлорметил-N, Nдіетил-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто [1,2-b] [1,4] оксазин-9-карбоксамід Спирт, який одержують на вищезазначеній Стадії А, розчинений в толуолі, обробляють тіонілхлоридом (0,4 мл). Суміш перемішують при температурі навколишнього середовища протягом 20 годин. Толуол випаровують у вакуумі. Залишок вміщують у воду і метилен хлорид. Після відокремлення, промивання водним розчином бікарбонату натрію і висушування одержують очікувану сполуку у формі масла. -1 ІЧ:1627 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 7,25, с, 1Н; 7,20, с, 1H;4,65, д, 1H;4,20, д, 1Н; 4,00, дд, 1Н; 3,80, тд, 1Н; 3,45, кв., 2Н; 3,10, кв., 2Н; 2,90-2,70, м, 4Н; 2,40-2,05, м, 4Н; 1,6-1,35, м, 3Н; 1,25, т, 3Н; 1,00, т, 3Н;0,90, т, 3Н. Стадія С: (4аR, 10bR)-8-ціанометил-N, Nдіетил-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто [1,2-b] [1,4] оксазин-9-карбоксамід Сполуку, одержану на вищезазначеній Стадії (0,64 г, 1,68 ммоль), розчиняють в тетрагідрофурані (15 мл), обробляють тетрабутиламонійціані 96125 16 дом (0,8 г, 2,98 ммоль) протягом 20 годин. Суміш концентрують у вакуумі. Залишок додають у воду і метиленхлорид. Після відокремлення, висушування і потім концентрування одержують очікуваний нітрил у формі масла. -1 ІЧ:1628 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 7,20,2с, 2Н; 4,20, д, 1Н; 4,00, дд, 1Н; 3,80, м+с, 3Н; 3,45, кв., 2Н; 3,10, кв., 2Н; 2,90-2,70, м, 411;2,35-2,05, м, 4Н; 1,55-1,35, м, 3Н; 1,15, т, 3Н; 1,00, т, 3Н; 0,85, т, 3Н. Стадія D: (4аR, 10bR)-8-(2-аміноетил)-N, Nдіетил-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто [1,2-b] [1,4] оксазин-9-карбоксамід Сполуку, одержану на вищезазначеній Стадії (2,7 г, 7,3 ммоль), розчинену в метанолі (250 мл), обробляють воднем під тиском 4 бар у присутності нікелю Ренея (1 г), при 60 °C, протягом 4 годин. Після повернення до температури навколишнього середовища, каталізатор відфільтровують; фільтрат потім концентрують. Залишок, який одержують, очищують флеш-хроматографісю на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол/аміак (90/10/1). Очікуваний продукт виділяють у формі аморфної твердої речовини. -1 -1 ІЧ:3360-3310 см ,1626 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 7,10, с, 1Н; 7,00, с, 1H;4,20, д, 1Н; 4,00, м, 1H;3,80, м, 1Н; 3,45, кв., 2H;3,10, кв., 2Н; 2,9-2,7, м, 4Н; 2,50, м, 2Н; 2,42,05, м, 4Н; 1,6-1,3, м, 3Н; 1,20, т, 3Н; 1,00, т, 3Н; 0,90, т, 3Н. Стадія Ε: (4аR,12bR)-4-пропіл-2,3,4,4а, 5,6,8,9,10,12b-декагідро-11Н-ізохіно[6,7-h][1,4]бензоксазин-11-он і гідрохлорид 1,5М розчин трет-бутиллітію в пентані (1,9 мл, 3,21 ммоль) додають до розчину аміну, який одержують на вищезазначеній Стадії (0,40 г), в тетрагідрофурані (45 мл). Одержану суміш перемішують протягом 10 хвилин при -78 °C, і потім протягом 20 хвилин при -40 °C. Суміш гідролізують, використовуючи 10 % розчин води в тетрагідрофурані. Після відокремлення у присутності метиленхлориду, висушування і концентрування під зниженим тиском, залишок, який одержують, очищують флешхроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (90/10). Очікуваний продукт виділяють у формі аморфної твердої речовини, гідрохлорид якої кристалізують з етилацетату. Точка плавлення: 263-265 °C. -1 ІЧ:1666 см . 1 Н-ЯМР (DMSO-d6): 7,90, с, 1Н; 7,10, с, 1Н; 5,00, д, 1Н; 4,25, м, 2Н; 3,60, м, 1Н; 3,4-3,15, м, 5Н; 3,00, м, 3Н; 2,85, м, 2Н; 2,50, м, 2Н; 2,00, м, 1Н; 1,75, м, 2Н; 1,00, т, 3Н. Приклад 7: (4aR,11bR)-9-метил-4-пропіл3,4,4а, 5,6,8,9,11b-октагідроізоіндоло[5,6Ь][1,4]бензоксазин-10(1H)-он і його гідрохлорид Продукт Прикладу 4 (1 г, 3,08 ммоль), розчинений у 40 % водному розчині метиламіну (10 мл), нагрівають в автоклаві протягом 16 годин при 120 °C. Після повернення до температури навколишнього середовища суміш екстрагують метиленхлоридом; органічну фазу висушують над MgSO4. Концентрування дає залишок, який очищують 17 флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (95/5). Очікуваний продукт одержують у формі твердої речовини білого кольору, гідрохлорид якої кристалізують з ацетонітрилу. Точка плавлення: 240-245 °C. -1 ІЧ:1692 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 8,00, с, 1Н; 7,10, с, 1Н; 4,35, д, 1H;4,30, с, 2H;4,10, м, 1Н; 3,95, м, 1Н; 3,20, с, 3Н; 3,00, м, 2Н; 2,90, м, 1Н; 2,85, м, 1Н; 2,50, м, 1Н; 2,30, м, 3Н; 1,7-1,4, м, 3Н; 0,90, т, 3Н. Приклад 8: (4aR, 12bR)-4-пропіл-2,3,4,4а, 5,6,10,12b-октагідро-1Н-ізохіно-[6,7b][1,4]бензоксазин-11-он і його гідрохлорид Стадія А: (4аR, 10bR)-9-(4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Н-нафто[1,2b][1,4]оксазин)карбонової кислоти хлорид 3,6 мл (41,7 ммоль) тіоніл хлориду додають краплями до (4aR, 10bR)-4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Ннафто[1,2-b][1,4]оксазин-9-карбонової кислоти (10 г, 32 ммоль), суспендованої у безводному толуолі (100 мл) і диметилформаміді (0,15 мл). Одержану суміш нагрівають зі зворотним холодильником протягом 1 години. Після повернення до температури навколишнього середовища, суміш фільтрують; твердий залишок промивають толуолом. Тверду речовину висушують до постійної ваги в печі у вакуумі у присутності Р2О5 для одержання очікуваного продукту. -1 -1 -1 ІЧ:2457 см ,1753 см ,814-775 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 8,05 (с) 1Н; 7,80 (дд) 1H;7,30 (д) 1H;5,05 (д) 1Н; 4,30 (м) 2H;3,60 (д) 1Н; 3,50 (NH) 1Н; 3,30 (м) 3Н; 3,00 (м) 3Н; 2,50 (м) 1Н; 2,10 (м) 1Н; 1,75 (м) 2Н; 0,95 (т) 3Н. Стадія В: (4аR, 10bR)-9-(4-пропіл-3,4,4а, 5,6,10b-гексагідро-2Н-нафто[1,2b][1,4]оксазин)карбонової кислоти метоксиметиламід 2,62 г (31,3 ммоль) метоксиламіну гідрохлориду додають до суміші карбонату калію (13 г, 94 ммоль) у воді (31 мл) і етилацетаті (62 мл). До суміші, охолодженої до 0 °C, додають, частинами, кислотний хлорид Стадії А (10,35 г, 31,3 ммоль), підтримуючи температуру нижче 5 °C. Суміш перемішують протягом 2 годин при 0 °C. Після додавання етилацетату і води і повернення до температури навколишнього середовища, суміш відокремлюють; органічну фазу промивають водою, висушують над сульфатом магнію і потім концентрують у вакуумі для одержання очікуваного продукту у формі твердої речовини. Точка плавлення: 147-152 °C. -1 -1 -1 ІЧ:3194 см ,2870 см ,2803-2767 см ,1650 см 1 -1 -1 ,1272-1126 см ,834-760 см . 1 Н-ЯМР 300 МГц (DMSO-d6): 11,60 (с) 1Н; 7,82 (с) 1Н; 7,55 (дд) 1H;7,18 (д) 1H;4,20 (д) 1H;4,00 (дд) 1H;3,80 (тд) 1H;2,7 до 3,00 (м) 3Н; 2,30 (м) 2Н; 2,05 до 2,2 (м) 2Н; 1,45 (м) 3Н; 0,88 (т) 3Н. Стадія С: (4aR, 12bR)-10-метокси-4-пропіл2,3,4,4а, 5,6,10,12b-октагідро-11Н-ізохіно[6,7-h] [1,4]бензоксазин-11 -он Розчин аміду, одержаний на Стадії В (4 г, 13,14 ммоль), в тетрагідрофурані (40 мл) додають до розчину, охолодженого до -78 °C, s-BuLi (24 мл, 31,53 мМ) і Ν,Ν,Ν',Ν'-тетраметилетилендіаміну (TMEDA) (4,8 мл, 31,53 ммоль) в тетрагідрофурані 96125 18 (90 мл), підтримуючи температуру нижче -70 °C. Температуру реакційної суміші повертають до температури -20 °C і потім перемішують протягом 45 хвилин при середній температурі -10 °C. Суміш знову охолоджують до -78 °C і додають метилйодид (0,9 мл, 14,45 мл). Температуру повертають до 0 °C і потім до температури навколишнього середовища. Проводять гідроліз, використовуючи насичений розчин хлориду амонію. Після додавання етилового ефіру, суміш відокремлюють; органічну фазу промивають водою, висушують над сульфатом магнію і потім концентрують у вакуумі. Розчин s-BuLi (21,4 мл, 27,8 ммоль) додають до розчину одержаного залишку (4,04 г) в тетрагідрофурані (83 мл). Проводять охолодження до 78 °C і перемішування протягом 2 годин при цій же температурі. Підтримуючи температуру нижче 70 °C, диметилформамід (1,13 мл, 14,6 ммоль) додають до суміші, яку перемішують протягом 10 хвилин при цій температурі, перед тим як її повертають до температури навколишнього середовища. Проводять гідроліз, використовуючи насичений розчин хлориду амонію. Після додавання етилового ефіру, суміш відокремлюють; органічну фазу промивають водою, висушують над сульфатом магнію і потім концентрують у вакуумі. Залишок вміщують у тетрагідрофуран (330 мл), додають концентровану хлористоводневу кислоту (13,5 мл) і суміш перемішують протягом 1 години при температурі навколишнього середовища. Після обробки розчином концентрованого гідроксиду натрію, екстрагування етилацетатом і промивання водою і розчином хлориду натрію, органічну фазу висушують над сульфатом магнію і потім концентрують у вакуумі. Залишок, який одержують, очищують флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (95/5). Очікуваний продукт виділяють у формі твердої речовини бежевого кольору. Точка плавлення: 142-145 °C. 1 H-ЯМР 300 МГц (DMSO-d6): 8,65,7,25,7,22,6,35,4,47,4,12-4,03,4,05,3,00 м.ч. Стадія D: (4аR, 12bR)-4-пропіл-2,3,4,4а, 5,6,10,12b-октагідро-1H-ізохіно[6,7-h][1,4]бензоксазин-11-он і його гідрохлорид 15 % розчин ТіСl3 у воді (7,6 мл) додають до розчину сполуки Стадії С (1,1 г, 3,35 ммоль) в етанолі (3,3 мл). Реакційну суміш нагрівають при 45 °C протягом 24 годин. Нагрівання продовжують протягом 6 днів з щоденним додаванням 15 % ТіСl3 розчину (3,5 мл). Після повернення до температури навколишнього середовища суміш обробляють водою (30 мл) і льодом (30 г) і потім підлуговують при рН 1314, використовуючи 35 % розчин гідроксиду натрію. Чорну суспензію обробляють потоком стисненого повітря доти, доки вона повністю не знебарвиться. Після екстрагування метиленхлоридом, висушування і концентрування, залишок, який одержують, очищують флеш-хроматографією на силікагелі, використовуючи елюентну суміш метиленхлорид/етанол (95/5). Очікуваний продукт виділяють у формі твердої речовини білого кольору, гідрохлорид якої кристалізують з ацетонітрилу. Точка плавлення: 200-203 °C. 19 -1 96125 -1 -1 ІЧ:3457 см ,3162 см ,1632 см . 1 H-ЯМР 400 МГц (DMSO-d6): 11,10 (м) 2Н; 8,25 (с) 1H; 7,40 (с) 1Н; 7,10 (т) 1H; 6,40 (д) 1H; 4,95 (д) 1H; 4,25 (м) 2Н; 3,60 (д) 1Н; 3,3-3,0 (2м) 2Н; 3,0,52,00 (2м) 4Н; 1,70 (м) 2Н; 0,95 (т) 3Н. Фармакологічні дослідження Приклад 9: Дослідження зв'язування людських рецепторів D2 і D3 * Клітинна культура Клітини СНО (Яєчник Китайського Хом'яка) стійко трансфекують геном, кодуючим людський рецептор допаміну D3, відповідно до способів, відомих з літератури. Природні клітини позбавлені ферменту DHFR (дигідрофолатредуктаза). Клітини культурують в інкубаторі при 37 °C у вологій атмосфері 5 % СО3, 95 % повітря. Трансфекції проводять, використовуючи Ліпофектин (Gibco). Клітини СНО, котрансфековані людським рецептором D2, і ген стійкості до флеоміцину вибирають за їх стійкість до присутності вказаного антибіотика у культуральному середовищі. Клітини, трансфековані людським рецептором D3, селектують в середовищі, що не має гіпоксантин/тимідин, у присутності метотрексату. Склад використаного культурального середовища є наступним: для CHO-D2,DMEM (модифіковане способом Дульбекко середовище Ігла), доповнене 10 % фетальною телячою сироваткою і гіпоксантином/тимідином; і для CHOD3,DMEM, доповнене 10 % діалізованою фетальною сироваткою. Клітини збирають при скупченні і потім одержують мембрани. * Одержання мембран Через декілька хвилин у присутності 0,2 % трипсину клітини збирають і центрифугують при 2000g протягом 5 хвилин. Клітинну масу, повторно суспендовану в 10 мМ Tris-HCl буфері рН 7,5, який містить 5 мМ MgSO4, потім гомогенізують, використовуючи Polytron®. Гомогенат центрифугують при 50000g протягом 15 хвилин, і осад повторно суспендують слабким руйнуванням ультразвуком в інкубаційному буфері, який має склад: 50 мМ Tris 20 HCl рН 7,5, який містить 120 мМ NaCl, 5 мМ КСl,2 мМ СаСl2, 5 мМ MgCl2. Мембрани потім розділяють на аліквоти і зберігають при -80 °C, до дня дослідження. * Дослідження зв'язування Інкубацію проводять в пропіленових трубах в кінцевому об'ємі 400 мкл, що містить: 125 100 мкл [ І]-йодсульприду (Amersham), при 0,1 нМ і 0,2 нМ для рецепторів D2 і D3, відповідно, 100 мкл буфера (всі труби), або 100 мкл 10 мкМ раклоприду (неспецифічне зв'язування), або 100 мкл сполуки, 200 мкл мембранного препарату, який містить рецептори D2 або D3 в буфері, до якого було додано 0,2 % BSA (бичачий сироватковий альбумін). Межі концентрацій кожної сполуки включають щонайменше сім точок, визначених тричі. Кожний експеримент повторюють щонайменше двічі. Інкубацію, яка триває протягом тридцяти хвилин при 30 °C, припиняють швидким фільтруванням через апарат Brandle, з наступними трьома послідовними промиваннями Tris-HCl буфером рН 7,4, що містить 120 мМ NaCl. Фільтри збирають і потім піддають зчитуванню, використовуючи гамма-зчитувач. * Аналіз результатів Значення ІС30, яке відображає концентрацію, що продукує 50 % інгібування зв'язування радіоліганду, підраховують за допомогою нелінійної регресії (Prism Graph method). Значення Кi отримують з формули Ki=IC50/CI+b/Kd), де L являє собою концентрацію 125 [ І]-йодосульприду, який використовують у дослідженні, і Kd являє собою його константу дисоціації. Результати виражені у формі рКi (pKi =-logKi ). Для людських рецепторів D2 і D3 значення Kd дорівнюють 0,5 нМ і 1,31 нМ, відповідно. * Результати Сполука Приклад 1 Приклад 2 Приклад 4 Приклад 5 Приклад 6 Приклад 8 Приклад 10: Активація пресинаптичного допамінергічного рецептора. Дослідження на єдину позаклітинну електричну активність * Принцип Введення допамінергічного агоніста зменшує частоту нейронних розрядів залежним від дози чином. Цей ефект повністю змінюють за допомогою галоперидолу, допамінового антагоніста. * Спосіб Щурів анестезують, використовуючи хлоральгідрат (400 мк/кг, інтраперитонеально) і вміщують в стереотаксичний апарат (Unimecanique, Франція) після катетеризації стегнової вени. Рівень анесте рКi hD3 8,1 8,4 8,1 6,9 7,4 7,7 hD2 5,9 6,1 5,7 5,8 6,1 5,9 зії підтримують шляхом інтраперитонеального введення хлоральгідрату кожну годину; ректальну температуру підтримують на рівні 37±1 °C за допомогою ковдри, що підігрівається, з регульованою температурою. Вольфрамовий мікроелектрод (10 ΜΩ, 1 мкм) подають, використовуючи електронний мікропривід (Unimecanique, Франція), в зону черевної покришки (АР: -5,5 / брегма: L:0,7; Н: 7,0-8,5 / пахіменінкс; Paxinos і Watson Atlas, 1986). Потенціали допамінергічних клітин розпізнають за їх морфологією (трифазні потенціали +/-/+, тривалість більша, ніж 3 мілісекунди), ритмом їх розряду, регулярним або ривками амплітуди, що змен 21 96125 шується, і частотою їх розряду, яка складає від 2 до 8 Гц. Для реєстрації застосовують одну клітину на тварину. Після періоду 5 хвилин (основна активність) і початкової ін'єкції носія (дистильована вода, до якої додають декілька крапель розбавленої молочної кислоти; рН доводять до 5, використовуючи 1N NaOH), продукти за даним винаходом вводять внутрішньовенно в кумулятивно збільшуваних дозах з інтервалами у 2-3 хвилини. * Аналіз результатів Збирання даних виконують за допомогою системи програмного забезпечення Spike2 (Cambridge Electronic Design, England). Частоту розрядів вимірюють протягом однієї хвилини при максимальній зміні між кожною ін'єкцією і виражають як відносну зміну, виражену у процентах, відносно основної активності (виводять середню величину протягом 5 хвилин, перед першою обробкою), яку визначають як 100 %. Вплив продуктів статистично оцінюють за допомогою дисперсійного аналізу на повторюваних вимірюваннях, з наступним тестом Даннета для порівняння впливів різних доз з впливом носія (дистильована вода). * Результати З метою прикладу, наступна Таблиця показує впливи продукту Прикладу 2 Приклад 2 - доза Частота розрядів неймг/кг внутрішньовенно ронів носій (0) 102,6=0,9 0,125 91,8±5,2 0,25 79,9±5,9* 0,5 66,3±5,9* 1,0 42,0±7,3* 2,0 10,8±8,7* 4,0 2,3±2,3* 8,0 0,0±0,0* Індивідуальні значення (n=5) = середнє значення ± стандартна помилка середнього. *=р
ДивитисяДодаткова інформація
Назва патенту англійськоюTetracyclic compounds, method of preparing them, pharmaceutical compositions containing them
Автори англійськоюPeglion Jean-Louis, Poitevin Christophe, Millan Mark, Brocco Mauricette
Назва патенту російськоюТетрациклические соединения, способ их получения и фармацевтические композиции, которые их содержат
Автори російськоюПеглион Жан-Луи, Пуатеван Кристоф, Миллан Марк, Брокко Морисетт
МПК / Мітки
МПК: C12P 29/00, C07C 235/00, A61K 31/65
Мітки: одержання, тетрациклічні, сполуки, спосіб, композиції, фармацевтичні, містять
Код посилання
<a href="https://ua.patents.su/13-96125-tetraciklichni-spoluki-sposib-kh-oderzhannya-i-farmacevtichni-kompozici-yaki-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Тетрациклічні сполуки, спосіб їх одержання і фармацевтичні композиції, які їх містять</a>
Попередній патент: Фармацевтичний пінний склад, який включає іміквімод
Наступний патент: Сполука для інгібування активності rho кінази, фармацевтична композиція, що містить таку сполуку, та спосіб інгібування активності rho кінази
Випадковий патент: Стійка для телевізора

















