Сполуки бензимідазолу, фармацевтичні композиції, що містять ці сполуки, та спосіб лікування чутливих до позитивної модуляції гамк-рецепторних комплексів розладів цнс
Номер патенту: 54393
Опубліковано: 17.03.2003
Автори: САСАКІ Тосіро, УСІРОДА Осаму, ФУКУДА Йосімаса, Ветьєн Франк, ТЕУБЕР Лене
Формула / Реферат
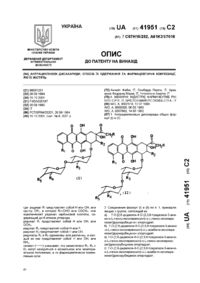
1. Сполука формули:
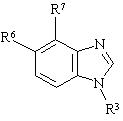
або її фармацевтично придатна сіль чи оксид, де R3 -
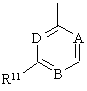 ,
,
де кожний А, В та D - СН, або один чи два з А, В та D - N, а інші - СН;
R11 - феніл, бензимідазол або моноциклічний гетероарил, кожний з яких може бути заміщеним одним або більше замісниками, вибраними з алкілу, алкоксилу, фенілу, галогену, СF3, аміно-, нітро-, ціано-, ацильної, ациламіногруп, фенілу, а також моноциклічного гетероарилу, а
один з R6 та R7 - гідроген, інший - фураніл чи ізооксазоліл, кожний з яких може бути заміщеним один або більше раз замісниками, вибраними з галогену, алкілу, алкоксилу та фенілу.
2. Сполука за п. 1, яка відрізняється тим, що це:
1-(3-(1-імідазоліл)феніл)-5-(3-фураніл)бензимідазол
1-(3-(2-метил-1-імідазоліл)феніл)-5-(3-фураніл)бензимідазол
1-(3-(5-піримідиніл)феніл)-5-(3-фураніл)бензимідазол
або їх фармацевтично придатна сіль чи оксид.
3. Сполука за п. 1, яка відрізняється тим, що це:
1-(3-(2-(диметиламіно)піримід-5-ил)феніл)-5-(3-фураніл)бензимідазол
1-(3-(1-піроліл)феніл)-5-(3-фураніл)бензимідазол
1-(3-(2-амінопіримід-5-ил)феніл)-5-(2-фураніл)бензимідазол
1-(3-(2-(диметиламінопіримід-5-ил)феніл)-5-(2-фураніл)бензимідазол
1-(3-(1-піроліл)феніл)-5-(2-фураніл)бензимідазол
1-(3-(1-імідазоліл)феніл)-5-(2-фураніл)бензимідазол
1 -(3-(2-амінопіримід-5-ил)феніл)-5-(3-фураніл)бензимідазол
1-(4-(1-імідазоліл)піримід-6-ил)-5-(3-фураніл)бензимідазол
1-(2-(1-імідазоліл)піримід-6-ил)-5-(3-фураніл)бензимідазол
1 -(3-(2-тіазоліл)феніл)-5-(3-фураніл)-бензимідазол
1 -(3-(2-метилтіазол-4-іл)феніл)-5-(3-фураніл)-бензимідазол
1 -(3-(1 -піразоліл)феніл)-5-(3-фураніл)-бензимідазол
1-(3-(2-піридил)феніл)-5-(2-фураніл)-бензимідазол
1-(3-(3-фураніл)феніл)-5-(3-фураніл)-бензимідазол
1-(3-(3-(2-піридил)оксадіазол-5-іл)феніл)-5-(3-фураніл)-бензимідазол
1-(3-(3-циклопропілоксадіазол-5-іл)феніл)-5-(3-фураніл)-бензимідазол
5-(3-ізоксазоліл)-1 -(3-(4-піримідиніл)феніл)бензимідазол
5-(3-ізоксазоліл)-1 -(3-(2-тіазоліл)феніл)бензимідазол
5-(3-ізоксазоліл)-1-(3-(1-імідазоліл)феніл)бензимідазол
5-(3-ізоксазоліл)-1 -(3-(3-піридил)феніл)бензимідазол
5-(5-ізоксазоліл)-1 -(3-(4-піримідиніл)феніл)бензимідазол
5-(5-ізоксазоліл)-1-(3-(2-тіазоліл)феніл)бензимідазол або
5-(5-ізоксазоліл)-1-(3-(3-піридил)феніл)бензимідазол
або їх фармацевтично придатна сіль чи оксид.
4. Фармацевтична композиція, яка містить ефективну кількість сполуки за будь-яким з пп. 1-3, або її фармацевтично придатна сіль приєднання чи оксид разом з фармацевтично придатним носієм або розріджувачем.
5. Спосіб лікування чутливих до позитивної модуляції ГАМКА-рецепторних комплексів розладів центральної нервової системи чи захворювань живих організмів тварин, включаючи людські, що включає застосування при необхідності такими живими організмами тварин, включаючи людські, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-3.
6. Спосіб за п. 5, який відрізняється тим, що його використовують для лікування розладів чи захворювань, чутливих до позитивної модуляції ГАМКА-рецепторних комплексів.
7. Спосіб за п. 5, який відрізняється тим, що його використовують для лікування тривожних станів, розладів сну, пам'яті, епілепсії або іншого конвульсійного розладу.
8. Спосіб за п. 5, який відрізняється тим, що активний інгредієнт застосовують у формі фармацевтичної композиції, в якій він знаходиться разом з фармацевтично придатним носієм або розріджувачем.
Текст
1 Сполука формули R7 або и фармацевтично придатна сіль чи оксид, де R3 де кожний А, В та D - СН, або один чи два з А, В та D- N, а ІНШІ -СН, R11 - феніл, бензимідазол або моноциклічний гетероарил, кожний з яких може бути заміщеним одним або більше замісниками, вибраними з алкілу, алкоксилу, фенілу, галогену, CF3, аміно-, нітро-, ціано-, ацильної, ациламшогруп, фенілу, а також моноциклічного гетероарилу, а один з R6 та R7 - гідроген, інший - фураніл чи ізооксазоліл, кожний з яких може бути заміщеним один або більше раз замісниками, вибраними з галогену, алкілу, алкоксилу та фенілу 2 Сполука за п 1, яка відрізняється тим, що це 1 -(3-(1 -імідазоліл)феніл)-5-(3фураніл)бензимідазол 1 -(3-(2-метил-1 -імідазоліл)феніл)-5-(3фураніл)бензимідазол 1-(3-(5-піримідиніл)феніл)-5-(3фураніл)бензимідазол або їх фармацевтично придатна сіль чи оксид З Сполука за п 1, яка відрізняється тим, що це 1-(3-(2-(диметиламшо)піримід-5-ил)феніл)-5-(3фураніл)бензимідазол 1 -(3-(1 -пірол іл)феніл)-5-(3-фураніл)бензимідазол 1-(3-(2-амшопіримід-5-ил)феніл)-5-(2фураніл)бензимідазол 1-(3-(2-(диметиламшопіримід-5-ил)феніл)-5-(2фураніл)бензимідазол 1 -(3-(1 -пірол іл)феніл)-5-(2-фураніл)бензимідазол 1 -(3-(1 -імідазоліл)феніл)-5-(2фураніл)бензимідазол 1 -(3-(2-амшопіримід-5-ил)феніл)-5-(3фураніл)бензимідазол 1 -(4-(1 -імідазоліл)піримід-6-ил)-5-(3фураніл)бензимідазол 1 -(2-(1 -імідазоліл)піримід-6-ил)-5-(3фураніл)бензимідазол 1 -(3-(2-тіазоліл)феніл)-5-(3-фураніл)-бензимідазол 1 -(3-(2-метилтіазол-4-іл)феніл)-5-(3-фураніл)бензимідазол 1 -(3-0 -піразоліл)феніл)-5-(3-фураніл)бензимідазол 1-(3-(2-піридил)феніл)-5-(2-фураніл)-бензимідазол 1-(3-(3-фураніл)феніл)-5-(3-фураніл)-бензимідазол 1-(3-(3-(2-піридил)оксадіазол-5-іл)феніл)-5-(3фураніл)-бензимідазол 1-(3-(3-циклопропілоксадіазол-5-іл)феніл)-5-(3фураніл)-бензимідазол 5-(3-ізоксазоліл)-1 -(3-(4піримідиніл)феніл)бензимідазол 5-(3-ізоксазоліл)-1 -(3-(2тіазоліл)феніл)бензимідазол 5-(3-ізоксазоліл)-1 -(3-(1 імідазоліл)феніл)бензимідазол 5-(3-ізоксазоліл)-1 -(3-(3піридил)феніл)бензимідазол 5-(5-ізоксазоліл)-1 -(3-(4піримідиніл)феніл)бензимідазол 5-(5-ізоксазоліл)-1 -(3-(2тіазоліл)феніл)бензимідазол або 5-(5-ізоксазоліл)-1 -(3-(3піридил)феніл)бензимідазол або їх фармацевтично придатна сіль чи оксид О со о> со ю 54393 4 Фармацевтична композиція, яка містить ефективну КІЛЬКІСТЬ сполуки за будь-яким з пп 1-3, або її фармацевтично придатна сіль приєднання чи оксид разом з фармацевтично придатним носієм або розріджувачем 5 Спосіб лікування чутливих до позитивної модуляції ГАМКд-рецепторних комплексів розладів центральної нервової системи чи захворювань живих організмів тварин, включаючи людські, що включає застосування при необхідності такими живими організмами тварин, включаючи людські, терапевтично ефективної КІЛЬКОСТІ сполуки за будь-яким з пп 1-3 6 Спосіб за п 5, який відрізняється тим, що його використовують для лікування розладів чи захворювань, чутливих до позитивної модуляції ГАМКдрецепторних комплексів 7 Спосіб за п 5, який відрізняється тим, що його використовують для лікування тривожних станів, розладів сну, пам'яті, епілепсії або іншого конвульсійного розладу 8 Спосіб за п 5, який відрізняється тим, що активний інгредієнт застосовують у формі фармацевтичної композиції, в якій він знаходиться разом з фармацевтично придатним носієм або розріджувачем Винахід стосується нових сполук бензімідазолу, фармацевтичних композицій, що містять ці сполуки, способам лікування ними, а також способам одержання таких сполук бензімідазолу Нові сполуки корисні при лікуванні таких захворювань та розладів центральної нервової системи, чутливих до модуляції ГАМКд-рецепторными комплексам, як наприклад, неспокою, розладів сну, пам'яті, або епілептичних чи інших конвульсійних розладів Рецептори на гамаамшомасляну кислоту (ГАМК), ГАМКд-рецептори є найбільш поширеними інгібуючими рецепторами у мозку ссавців ГАМКдрецептори мають структуру мкромолекулярного гетеропентамера (комбінації а, р та у/5 протеїнових субодиниць) Деякі підтипи таких ГАМКдрецепторів описані у практиці сучасної молекулярної біологи Кожний ГАМКд-рецепторний комплекс включає канал для ІОНІВ хлора, який регулює переніс цих ІОНІВ через мембрану нейрона, та набір розпізнаючих ділянок для таких невеликих модулюючих молекул, як бензодіазепінів, барбітуратів, пікротоксинів та деяких стероїдів При взаємодії ГАМК з його рецептором відкривається іонний канал, зростає переніс хлориду, мембрана пперполяризується і клітина стає менш чутливою до збудження Цей індукований ГАМК іонний переніс може регулюватися різноманітними агентами, у т ч взаємодіючими з рецепторами бензодіазепіна чи розпізнаючими ділянками вожуючу дію Часткові агоністи характеризують як сполуки транквілізуючої дії, але без або зі зниженням релаксуючої м'язи, снотворної та заспокоюючої дм, у той час як зворотні агоністи вважають корисними як підсилювачі розумової ДІЯЛЬНОСТІ За останнє десятиріччя було синтезовано ряд сполук, що належать до різних типів і мають спорідненість до рецепторів бензодіазепіна Однак, хоч ділянки рецептора бензодіазепіна все ще вважають дуже привабливими для біологічної взаємодії з центральной) нервовою системою (далі - ЦНС) для лікування різноманітних розладів та захворювань, майже всі раніше синтезовані сполуки, ДІЮЧІ на ці ділянки рецепторів, були при КЛІНІЧНИХ випробуваннях визнані непридатними внаслідо небажаних побічних ефектів Згідно З винаходом запропоновано нові сполуки бензімідазола, що взаємодіють з рецептором бензодіазепіна ГАМКд-рецепторного комплекса Сполуки згідно з винаходом є корисними модуляторами ГАМКд-рецепторних комплексів Задачей винаходу є запропонувати нові сполуки бензімідазола та їх фармацевтичне придатні солі з кислотами, що корисні при лікуванні розладів, захворювань або нездужань центральної нервової системи, які чутливі до модуляції ГАМКдрецепторних комплексів, особливо, їх позитивної модуляції Другою задачею винаходу є фармацевтичні рецептури, що містять нові сполуки бензімідазола, корисні для вищеозначеної мети Іншою задачею винаходу є новий спосіб лікування з використанням нових сполук бензімідазола Подальшею задачею є спосіб виготовлення нових фармацевтичних рецептур Додаткові задачі будуть ясні з нижченаданого Агенти що приєднуються або взаємодіють з модулюючими ділянками таких ГАМК-рецепторних комплексів, як наприклад, рецептори бензодіазепіна, можуть мати або підсилюючий вплив на дію ГАМК, наприклад, позитивне модулювання дії рецептора (агоністи, часткові агоністи), послаблюючий вплив на дію ГАМК, наприклад, негативне модулювання дії рецептора (зворотні агоністи, частково зворотні агоністи), або вони можуть блокувати вплив агоністівта зворотних агоністів вслід конкурентного блокування (антагоністи або ліганди, позбавлені внутрішньої активності) Агоністи звичайно виявляють релаксуючу м'язи, снотворну, заспокоюючу, транквілізуючу та/або анти конвульсій ну дію, у той час як зворотні агоністи виявляють проконвульсивну, антип'янку, стри опису, а ІНШІ ВІДОМІ спеціалісту Винахід разом з іншим включає нижченадане, одне або у сполученні Сполуку, що має формулу або и фармацевтично придатна сіль чи оксид, 54393 fleR де кожний А, Вта D- CH, або один чи два з А, Вта D- N, а ІНШІ - СН, R11 - феніл, бензімідазол або моноциклічний гетероарил, кожний з яких може бути заміщеним одним або більше замісниками, вибраними з алкіла, алкоксила, галогена, CF3, аліно-, нітро-, ціано-, ацильної, ациламшогруп, феніла, а також моноциклічного героарила а один з R6 та R - гідроген, інший - фураніл чи ізооксазоліл, кожний з яких може бути заміщеним один або більше раз замісниками, вибраними з галогена, алкіла, алкоксила та феніла, вищезазначена сполука, якою є 1 -(3-(1 -мідазоліл)феніл)-5-(3фураніл)бензімідазол, 1 -(3-(2-летил-1 -імідазоліл)феніл)-5-(3фураніл)бензімідазол, 1-(3-(5-піримідиніл)феніл)-5-(3фураніл)бензімідазол, або їх фармацевтичне придатна сіль чи оксид, фармацевтична рецептура, що включає ефективну КІЛЬКІСТЬ будь-якої з вищеозначених сполук або їх фармацевтичне придатної солі чи оксиду разом з щонайменше одним фармацевтичне придатним носієм або розбавителем, використання будь-якої з вищеозначених сполук для виготовлення ЛІКІВ для лікування у живих істот, включаючи людину, розладів або захворювань, чутливих до позитивної модуляції ГАМКдрецептори их комплексів центральної нервової системи, використання будь-якої з вищеозначених сполук для виготовлення ЛІКІВ для лікування у живих істот, включаючи людину, розладів або захворювань, чутливих до позитивної модуляції ГАМКдрецептор них комплексів центральної нервової системи, використання будь-якої з вищеозначених сполук для виготовлення ЛІКІВ для лікування розладів або захворювань, вибраних з неспокою, розладів сну, пам'яті, епілепсії та будь-яких інших конвульсивних розладів, спосіб лікування у живих істот, включаючи людину, розладів або захворювань, чутливих до позитивної модуляції ГАМКд-рецепторних комплексів центральної нервової системи що включає застосування кожною живою істотою, включаючи людину, при и потребі у цьому терапевтичне ефективної КІЛЬКОСТІ будь-якої з вищеозначених сполук вищеозначений спосіб для лікування розладів або захворювань, чутливих до позитивної модуляції ГАМКд-рецепторних комплексів центральної нервової системи, вищеозначений спосіб для лікування неспокою, розладів сну, пам'яті, епілепсії та будь-яких інших конвульсивних розладів, а також вищеозиачений спосіб, в якому активний інгредієнт застосовують у формі фармацевтичної рецептури, в якій він знаходиться разом з фармацевтичне придатним носієм або р избавителем Галогеном є флуор, хлор, бром або юд Під алкюм розуміють групу, що містить прямий або розгалужений ланцюг з 1 - 8 атомів карбона, або циклоалкіл з 3 - 7 атомами карбона, яка включає, але без обмеження, мети, етил, пропіл, ізопропіл, бутил, ізобутил, т-бутил, пентил, гексил, циклопропіл, циклобутил, циклопентил, циклогексил, бажаними є метил, етил, пропіл, ізопропіл, тбутил Під алкоксилом розуміють -О-алкіл, де алкіл позначено вище Під ацилом розуміють -(С=О)-Н або -(С=О)алкіл, де алкіл позначено вище Під ациламшогрупою розуміють ацил-NH-, де ацил позначено вище Під аміногрупою розуміють -ІЧНг, -NH-алкіл, або -І\І-(алкіл)2, де алкіл позначено вище Моноцилічний гетероарил - 5- або 6-членна моноциклічна гетероциклічна група Такі моноцикЛІЧНІ гетероциклічні групи включають, наприклад, оксазол-2-іл, оксазол-4-іл, оксазол-5-іл, ізоксазол3-іл, ізоксазол-4-іл, ізоксазол-5-іл, тіазол-2-іл, тіазол-4-іл, тіазол-5-іл, ізотіазол-3-іл, ізотіазол-4-іл, ізотіазол-5-іл, 1,2,4-оксадіазол-З-іл, 1,2,4оксадіаюл-5-іл, 1,2,4-тіадіазол-З-іл, 1,2,4-тіадіазол5-іл, 1,2,5-оксадіазол-З-іл, 1,2,5-оксадіаззл-4-іл, 1,2,5-тіадіазол-З-іл, 1,2,5-тіадіазол-4-іл, 1імідозаліл, 2-імідозаліл, 4-мідозаліл, 1-піроліл, 2піроліл, 3-піроліл, 2-фураніл, 3-фураніл, 2-ТІЄНІЛ, 3ТІЄНІЛ, 2-піридил, 3-піридил, 4-піридил, 2-піримідил, 4-піримідил, 5-піримідил, 3-піридазиніл, 4піридазиніл, 2-піразиніл, 1-піразоліл, 2-піразоліл та 4-піразоліл Приклади фармацевтичне придатних солей з кислотами включають солі таких неорганічних та органічних кислот, як наприклад, пдрохлоридна, пдробромідна, фосфатна, нітратна, перхлоратна, сульфатна, лимонна, молочна, винна, малеїнова, фумарова, міндальна, бензойна, аскорбінова, корична, бе н зол сул ьфо нова, метансульфонова, стеаринова, янтарна, глутамінова, гліколева, толуолп-сульфонова, мурашина, малонова, нафталш-2сульфонова, саліцилова та оцтова Інші так кислоти, як щавелева кислота не є фармацевтичне придатними, але можуть бути корисними в якості проміжних сполук при одержанні сполук згідно з винаходом та к фармацевтичне придатних солей з кислотами Такі солі одержують у спосіб, добр- відомий спеціалістам Сполуки згідно з винаходом можуть бути сольватованими або ні такими фармацевтичне придатними розчинниками, як вода, етанол тощо Взагалі, згідно з задачею винаходу сольватовані та несольватовані форми вважають еквівалентними Деякі зі сполук згідно з винаходом бувають (+) та (-) а також рацемічної форми Рацемічні фоми можна розділити на оптичні антиподи у ВІДОМІ способи, наприклад, відділенням їх діастереоізомерних солей з оптично активними кислотами з наступним вивільненням оптично активних амінів обробкою основами Інші способи розділення рацематів на оптичні антиподи базуються на хроматографії на оптично активноиу носи Рацемічні сполуки згідно з винаходом, отже, можна розділити на їх оптичні антиподи, наприклад, фракційною кристалізацією d 54393 або Цтартратів, млнделатів або камфорсульфонатів) Сполуки згідно з винаходом також можна розділ/Іти у вигляді їх діастереоізомерних амідів, отриманих реакцією з такими оптично активними активованими карбоновими кислотами, як похідними від (+) чи (-) фенілаланіне (+) чи (-) фенілгліцина, (+) чи (-) камфанової кислоти, або утворенням діастереоізомерних карбаматів реакцією з оптично активними хлороформіатами чи подібними їм Можна використовувати і додаткові ВІДОМІ І очевидні навіть пересічним спеціалістам способи розділення оптичних ізомерів Ці способи розглянуті J Jaques, A Collet, SWiun у "Enantiomers, Racemates and Resolutions", JOhn Wiley fnd Sons, New York (1981) Сполуки згідно з винаходом можуть бути отриманими різними шляхами Сполуки згідно з винаходом та їх фармацевтичне придатні ПОХІДНІ можуть бути отриманими також будь-якими відомими спеціалістам способами одержання сполук аналогічної будови, як це нижчевказане у прикладах Фіг 1 - 6 описують способи виготовлення сполук згідно з винаходом, в яких R6 -фураніл або ізоксазоліл, a R7 - гідроген Сполуки згідно з винаходом, в яких R7 - фураніл або ізяксазоліл, a R6 гідроген, можна одержати аналогічно ВИХІДНІ матеріали для здійснення описаного згідно з винаходом способа ВІДОМІ, або можуть 5ути одержаними з комерційне придатних хімікатів Продукті описаних тут реакцій ізолювали такими звичайними прийомами, як екстракція, кристалізація, дистиляція, хроматографія тощо 4-амшомасляна кислота (ГАМК) є головним інгібітором нейропровідності, показано, що во іа впливає як на центральну, так і периферійну нервову систему Зараз ВІДОМІ два типи ГАМКрецепторів - ГАМКд та ГАМ КБ-рецептор и Нещодавні дослідження з молекулярної біологи продемонстрували, що ГАМКд- рецептор и можна розділити Ні кілька підрецепторів, пов'язаних з селективною та або частковою фармаколопчноо дією, що спостерігають з деякими лігандами бензодіазепінових рецепторів, яка протилежна неселективній дії, яку спостерігають для таких класичних лігандів беьзодіазепшових рецепторів, як наприклад, діазепам Активація ГАМК-рецепторів призводить до змін мембранного потенціалу (пперполяризації) ГАМКд-рецептори тт зв'язані з переносом хлоридів через сполучені та об'єднані хлоридні канали, у той час, як активація ГАМКБрецепторі в побічно впливає на калійові та кальційові канали так же добре, як модифікує другий зв'язуючий продукт Розпізнаючі ГАМКд ділянки можна активувати ГАМК, мускімолом та, наприклад, ізогувасином, але не такими сіоністами ГАМКд, як наприклад, баклофен Модульована розпізнаюча ГАМКд ділянка на ДІЛЯНЦІ бензодіазепінового рецептора може бути помічена 3 Н-флунітразепамом Таким чином, спорідненість різних потенційних лігандів до ділянок бензодіазепінових рецепторів може бути визначена за здат3 ностю тестуємих сполук заміщувати Нфлунітразепам 8 Тканинні препарати Препарати готували при 0 - 4°С, якщо не позначено інше 150 - 200г кори мозку самців пацюків Wistar гомогенізували 5 - 10с у 20мл Tns-HCI (ЗОмМ, рН7,4) у гомогенізаторі UltraTurrax, Суспензію центрифугували при 27000д 15хв і три1- промивали осад буфером, центрифугуючи при 27000д 15хв Промитий осад гомогенізували у 20мл буфера та шкубували на водяній бані при 37°С ЗОхв для видалення власної ГАМК, а потім центрифугували Юхв при 27000д Далі осад гомогенізували у буфері і центрифугували Юхв при 27000д Отриманий осад ресуспендували у ЗОмл буфера і препарат заморожували і зберігали при -20°С Аналіз Препарат мембран розтоплювали і центрифугували Юхв при 2°С і 27000д Отриманий осад ресуспендували у 50мл Tns-цитрата, рН7,1 (500г буфера на 1г вихідної тканини) і використовували далі для визначення зв'язування По 0,5мл тканинного препарату додавали до 25мл тестуємого розчину, змішували з 25ші 3Н-ФНЗ (кінцева концентрація 1нМ) і шкубували 40хв при 2°С Неспецифічне зв'язування визначали, використовуючи клоназепам (кінцева концентрація 1нМ) Після інкубації до зразків додавали по 5мл охолодженого льодом буфера, переносили на Whatman GF/C скляні вакуумні фільтри і негайно промивали 5мл охолодженого льодом буфера Визначення радіоактивності на фільтрах проводили звичайно - підрахунком сцинтиляцій у рідині За специфічне зв'язування приймали різницю між загальним та неспецифічним Визначаємі величини розраховували як IKso (концентрація у нМ) тестуємої речовини, що інгібує специфічне зв'язування Н-ФНЗ на 50% Результати випробування вибраних сполук згідно з винаходом ясні з нижченаведеної таблииці Таблиця Тестуєма сполука (нМ) 1 -(3-(1 -імідазоліл)феніл)-5-(3фураніл)бензімідазол 1 -(3-(2-метил-1 -імідазоліл)феніл)-5-(3фураніл)бензімідазол ІК50 0,4 0,4 При можливості, для застосування у терапії сполука згідно з винаходом може бути використаною без домішок, однак бажана наявність активних інгредієнтів у вигляді фармацевтичної рецептури Згідно винаходом запропоновано фармацевтичну рецептуру, яка містить сполуку згідно с винаходом або и фармацевтично придатну сіль або похідне разом з одним чи більше фармацевтично придатними носіями та, по вибору, іншими терапевтичними та/? бо профілактичними інгредієнтами Носій(ї) повинен бути "придатним" з точки зору сумісності з іншими інгредієнтами рецептури та не зашкоджувати реципієнту Фармацевтичні рецептури включають придатні для орального, ректального, назального, локального (у т ч ротового та під'язичного), вапнального або парентерального (у т ч внутрішньо м'язового, підшкірного та внутрішньовенного) вживання, або 54393 10 ють активний компонент йоге диспергуванням при перемішуванні Розплавлену гомогеновану суміш далі виливають у форму придатного розміру і стверджують охолодженням Рецептури, придатні для вапнального застосування можна виготовити як песарм тампони, креми, гелі, пасти, піни або аерозолі, що на додаток до активного інгредієнту містять такі носи, що добре ВІДОМІ спеціалістам РІДКІ рецептури включають розчини, суспензії та емульсії, наприклад у водному або водно- пропіленгліколевому розчині Наприклад, рідкі рецептури для парентеральної ін'єкції можуть бути виготовленими на базі водно-пропіленгліколевого розчину Сполуки згідно з винаходом можна виготовити для парентерального застосування (наприклад, ін'єкції, у Т Ч болюсної ін'єкції або подовженого вливання) у вигляді одиничних доз у формі ампул, попередньо заповнених шприців, інфузій невеликого об'єму або / тарі багатократного використання з додаванням презервантів Рецептури можуть f л~и суспензіями, розчинами або емульсіями у маслі або водному середовищі і місти и такі формоутСполуки згідно з винаходом можна застосовуворюючі засоби, як суспендуючі, стабілізуючі вати у широкому наборі доз для орального та пата/або диспергуючі 3 іншого боку, активний інгрерентерального вживання Спеціалістам ясно, що дієнт може бути порошком, отриманим перед винижченадані дози можуть включати як активний користає ям у асептичних умовах зі стерильної компонент сполуку згідно з винаходом або фарматвердої речовини, або люфілізованим з розчину цевтично придатну сіль сполуки згідно з винаходля поєднання з придатним середовищем, напридом клад стерильною апірогенною водою Фармацевтично придатні носи для виготовлення з сполук згідно з винаходом фармацевтичВодні, придатні для орального застосування них рецептур можуть бути твердими чи рідкими розчини можна приготувати розчиненням активноТверді форми препаратів включають порошки го компонента у воді з додаванням при бажанні таблетки, облатки, капсули (у т ч крохмальні), придатних барвників, смакових, загущуючих та драже, супозиторії та дисперсні гранули стабілізуючих засобів Твердій носій може складатися з однієї чи біВодні, придатні для орального застосування льше речовин, що можуть також слугувати розрісуспензії можна приготувати диспергуванням акджувачами, смаковими добавками, солюбілізатотивного компонента у воді з такими загущуючими рами, змащувачами, суспендуючіми, зв'язуючими, матеріалами, як натуральна або синтетична капрезервуючими, дезштегруючими таблетки засомедь, смоли, метилцелюлоза, натрій карбоксимебами, або капсульюючим матеріалом тилцелюлоза та ІНШІ, добре ВІДОМІ спеціалістам суспендуючі агенти У порошках носій є дрібно розмеленою речовиною у суміші з дрібно розмеленим активним Також включеними є тверді рецептури, що компонентом безпосередньо перед застосуванням можуть бути перетворені у рідкі композиції для орального приУ таблетках активний компонент у придатній йому Такі рідкі форми включають розчини, супропорції змішано з носієм, що має необхідні спензії та емульсії Ці рецептури можуть містити зв'язуючі властивості, і суміші надано бажаних на додаток до активного інгредієнта барвники, форми та розміру смакові, загущуючі, стабілізуючі, буферні, штучні Бажане, щоб порошки та таблетки містили від та натуральні підсолоджуючі, діспергуючі, солюбіодного до семідесяти процентів активної сполуки лізуючі засоби тощо Придатними носіями є карбонат та стеарат магнія, тальк, цукор, лактоза, пептин, декстрин, крохмаль, Для місцевого нанесення на епідерміс сполуки желатин, трагакант, метилцелюлоза, натрій карбозгідно з винаходом можуть бути застосованими у ксиметил целюлоза, низькоплавкий воск, масло формі мазей, кремів, примочок, або як трансдеркакао тощо Термін "препарат" включає рецептуру мальні бляшки Мазі та креми и можна виготовляз активною сполукою та капсулюючим матеріалом ти на водній або масляній основі з додаванням в якості носія, що утворює капсулу, в якій активний придатних загущуючих та/або желюючих засобів компонент разом з носіями або без них оточено Примочки можна виготовляти на водній або маспоєднаним і ним носієм Те ж відноситься до облаляній основі, звичайно вони містять один чи більток та таблеток Таблетки, порошки, облатки капше емульгуючих, стабілізуючих, диспергуючих, сули та драже можна застосувати як тверді форми суспендуючих, загущуючих чи забарвлюючих задля орального прийому собів При виготовленні супозиторієв спочатку плавРецетури, придатні для місцевого застосуванлять такий легкоплавкий воск, як суміш гліцеридів ня у роті, включають таблетки, що містять актівний жирних кислот або масло какао, а далі гомогенізуагент у смаковій основі, звичайно сахарозі з гуміау формі, придатній для застосування у формі інгаляцій або інжекції Сполук згідно з винаходом разом зі звичайним підтримувачем, носієм чи розріджувачем можуть, таким чином, бути виготовленими у формі фармацевтичних рецептур та їх одиничних доз, і застосованими у такому твердому стані, як таблетки чи заповнені капсули, або рідкому - у вигляді розчинів, суспензій, емульсій, елексирів або заповнених ними капсул - для орадьного вживання, у формі супозиторієв для ректального зживання, або у формі стерильних розчинів для ІН'ЄКЦІЙ при парентеральному (включаючи підшкірне) вживанні Такі фармацевтичні рецептури та їх одиничні дози можуть включати звичайні інгредієнти у звичайних пропорціях, разом або без додаткових активних сполук чи складових частин, а такі одиничні дози можуть містити будь яку придатну КІЛЬКІСТЬ активного інгредієнта ВІДПОВІДНО рівню призначеної добової дози Рецептури, що містять один (1)мг активного інгредієнта або, ширше, від 0,01 до ЮОмг на таблетку, можуть ВІДПОВІДНО представляти одиничну дозу 12 11 54393 рабіком чи трагакантом, пастилки містять активний вожних станів, розладів сну та пам'яті, а також інгредієнт у такій інертній основі, як желатин та інших розладів, чутливих до модуляції ГАМКдгліцерин, а ю сахароза та гуміарабік, а полоскання рецепторів ВІДПОВІДНО, сполуки згідно з винаходля рота містять активний інгредієнт у тт эидатнодом можна застосовувати особам, включаючи люму рідкому носи дину, при необхідності лікування, полегшення або ліквідації розладу або захворювання, пов'язаного з Розчини або суспензії вводять безпосередньо ГАМКд- рецепторами Особливо це відноситься до у носову порожнину ВІДПОВІДНИМИ засобами, наконвульсій, тривожних станів, розладів сну та паприклад, капельницею, пипеткою або у розпилем'яті ному стані Рецептури можуть буті запропонованими у одиничному або багатократному дозуванні Придатними добовими дозами є 0,01 - ЮОмг, В останньому випадку для прийому придатного 0,1 - 50мг, а особливо 0,1 - 30мг, в залежності, як попередньо визначеного об'єму розчину або сузвичайно, від застосованого способу лікування, спензії пацієнтом можуть бути застосовані крапеформи прийому, визначення, проти чого спрямольниці або піпетки У випадку розпилювання їх ваний прийом, та маси приймаючого, а крім того, можна застосовувати засобами дозованого розпивибору та досвіду лікаря або ветеринара лення під тиском Нижченадані приклади ілюструють винахід, однак не обмежують його Сполуки згідно з винаЗастосування у дихальний тракт може також ходом, виготовлені, як у нижченаведених приклабути здійсненим за допомогою аерозольних рецедах, представлені у таблицях 1 - 2 на с 35-36 птур, в яких активний інгредієнт застосовують в упаковках під тиском з таким придатним пропелеПриклад 1 нтом, як хлорфлуоркарбон (ХФК), наприклад, дих4-флуор-1 -юд-3-нітробензол (1 с) Суспензію лордифторметан, трихлорфлуорметан, або дих100г (0,64 моль) 4-флуор-З-нітроанілша у 500мл лортетрафлуоретан, дюксид карбона та ІНШІ концентрованої соляноіі кислоти охолодили до придатні гази Аерозоль звичайно може містити 20°С При перемішуванні додали розчин 48,6г (0,7 такі ПАР, як лецитин Дозу ЛІКІВ можна регулювати моль) нітрита натрія у ЮОмл води, підтримуючи дозуючим клапаном температуру нижче -15°С, суміш після цього перемішували 45хв при -20°С -(-15°С) До утвореного З іншою боку, активні інгредієнти можна засторозчину додавали розчин 132,8г (0,8 моль) юдиду совувати як сухі порошки, наприклад, у формі покалія у 260мл води так, щоб температура не перерошкоподібної суміші сполуки у такій придатній вищувала 0°С Розчин перемішували до припипорошкоподібній основі, як лактоза, крохмаль, та нення вивільнення азоту 200мл 0,1 М водного такі його ПОХІДНІ, як пдроксипропілметилцелюлоза сульфіта натрія додавали до суміші і екстрагували та полівшілпіролідін (ПВП) Звичайно порошкові и діетиловим етером Етерний екстракт ДВІЧІ проноси утворюють гель у носовій порожнині Порошмивали 0,1 М розчином пдроксида натрія, охолокові рецептури можуть бути представлені у формі дженим льодом, та ДВІЧІ розсолом, а далі сушили одиничних доз, наприклад, у капсулах чи патросульфатом магнія, концентрували та очищали на нах, наприклад, з желатину, або у пузирковій упахроматографічній колонці з силікагелем, викорисковці, з якої порошок може бути застосованим затовуючи як елюент суміш етилацетат/петролейний собами інгаляції етер 1 9 1с виділяли у вигляді масла, яке кристаУ рецептурах, призначених для прийому у дилізували у холодильнику Вихід - 132,6г (78%) хальні шляхи, включаючи штраназальні рецептури, розмір часок сполуки малий, порядка, наприПриклад 2 клад, 5 мікрон чи менше Частки такого розміру 3-(5-піримідил)анілш (2Ь) Суспензію 15г можуть бути отримані відомими спеціалістам спо(94,3ммоль) 5-бромпіримідина, 19,3г (104ммоль) собами, наприклад, мікронізацією напівсульфата 3-амшофенілбороновоі кислоти, 39,6г (472ммоль) пдрокарбоната натрія та 1г тетПри бажанні можна застосовувати рецептури, ракіс(трифенілфосфш)паладія(0) у суміші 75мл що підтримують вивільнення активного інгредієнводи та 150мл діметоксіетана нагрівали до 80°С та під током азота впродовж ночі Після охолодження Фармацевтичні рецептури бажані у вигляді суміш виливали у воду з льодом, відфільтровуваодиничних доз, при цьому рецептура розділяється ли осад, промивали його водою, сушили та одерна одиничні дози, що містять придатну КІЛЬКІСТЬ жували 15г (93%) 2Ь Температура плавління 164 активного компонента Одиничні дози можна паку165°С вати, упаковка вміщує такі дискретні КІЛЬКОСТІ препарату, як таблетки, капсули та порошки у склянПриклад З ках або ампулах Одинична доза може також бути 3-(1-імідазоліл)анілш (2d), Суміш 90г (0,36 капсулою, таблеткою, облаткою, драже, або скламоль) 1-юд-З-нітробензола, 54г (0,79 моль) імідадатися з кількох таких одиниць в упакованому визола, 54г (0,39 моль) карбоната каліята 1г високогляді дисперсної МІДІ нагрівали до 200°С Розплав 2 години перемішували під шаром азота Протягом Бажаними композиціями є таблетки та капсули реакції пару води затримували молекулярними для орального, а рідини для внутрішньовенного ситами, розташованими між реакційним сосудом застосування та конденсором Після закінчення реакції суміш Сполуки згідно з винаходом особливо корисні охолоджували до 100°С та додавали воду Суміш при лікуванні розладів або захворювань організмів охолоджували до кімнатної температури, сирий тварин, що обумовлено їх спорідненістю до діляпродукт відфільтровували та сушили Перекристанок ГАМКд-рецепторів, що зв'язують бензодіазепін лізацією з 200 - 250мл толуола одержували 54,2г Ці властивості роблять сполуки згідно з винаходом (79%) З-(і-імідазоліл) нітробензола Температура особливо корисними при лікуванні конвульсій, три 14 13 54393 плавління 101 - 102°С вали крізь гофрований фільтрувальний папір Шари розділяли і водну фазу екстрагували один До розчину 51,6г (0,27 моль) 3-(1раз етилацетатом Комбіновані органічні фази суімідазоліл)нітробензола у 500мл оцтової кислоти шили сульфатом натрія та випарювали досуха додали паладійовий каталізатор (5г 5% Pd на акЗалишок розтирали з сумішшю етилацетивованому вугіллі) і суміш пдрогенували під тистат/петролейний етер 1 1, одержуючи 5,26г (74%) ком (Рстанд 4 бар) поки не перестане поглинатися кристалів (2п) Температура плавління 115,5 водень Суміш фільтрували крізь броунмілерит, 117°С фільтрат випарювали досуха і отримували 40,4г (93%) (2d) у вигляді світлокоричневого масла І\І-ацетил-3-(2-метилімідазол-1-іл)анілін (2j) 11г (63,6ммоль) 3-(2-метилімідазол-1-іл)аніліна |\|-ацетил-3-(1-імідазоліл)анілін (2е) 5,88г порціями додавали ЮОмл оцтового анпдрида при (37ммоль) 2d перемішували з ЗОмл оцтового анпзвичайній температурі Після перемішування продрида при звичайній температурі 1 год Суміш витягом 1 год суміш виливали у ЗООмл води Отриливали у воду з льодом і підлуговували додаванманий розчин охолоджували на льодяній бані і ням 12М гідроксиду натрія Продукт підлужували додаванням 12М водного гідроксиду відфільтровували, промивали водою і сушили, натрія Продукт відфільтровували, промивали воотримуючи 6,34г (85%) (2е) Температура плавліндою і сушили, отримуючи 12,3г (97%) (2j) Темпеня 181 -183°С ратура плавління 238 - 240°С Приклад 4 3-(2-піридил)анілін (2f) До розчину 12,7г Приклад 6 (63,5ммоль) 2-(3-нітрофеніл)піридина (виготовле1-(3-нітрофеніл)пірол Суміш 15г (0,11 моль) 3ного як описано у J Chem Soc 1958, р 1759) у нітроаніліна 42мл (0,33 моль) диметокситетрапдабсолютному етанолі додавали паладійовий катарофурану та каталітичну КІЛЬКІСТЬ ТСК у 150мл лізатор (1,3г 5% Pd на активованому вугіллі) і сусухого толуола нагрівали зі зворотним холодильміш пдрогенували під звичайним тиском поки не ником 2 год Після охолодження суміш концентруперестане поглинатися водень Суміш фільтрувавали під зниженим тиском і залишок очищали на ли крізь броунмілерит, фільтрат концентрували під хроматографічній колонці з силікагелем, викорисзниженим тиском, та очищали на хроматографічтовуючи як елюент суміш етилацетат/петролейний ній колонці з силікагелем, використовуючи як елюетер 1 1 , і отримували 16г (78%) продукта Темпеент суміш етилацетат/петролейний етер 1 9 і ратура плавління 265 - 70°С отримували 9,5г (88%) (2f) у вигляді світлокорич3-(1 -піроліл)анілш До суспензії 16г невого масла (85,1ммоль) вищенаведеного продукта у ЮОмл льодяної оцтової кислоти додали паладійовий ка5-(3-фураніл)-2-(3-карбоксифеніл)амшоанілш талізатор (1,5г 5% Pd на активованому вугіллі) і (13г) було отримано аналогічно з 12г (приклад 21) суміш пдрогенували під тиском (РСТанд 4 бар), поки Для хроматографічної обробки як елюент було не перестане поглинатися водень Суміш фільтрувикористано етилацетат Вихід 9 1 % Температура вали крізь броунмілерит і фільтрат випарювали плавління 211 -212°С досуха Одержаний сирий продукт використовуваПриклад 5 ли у наступній операції без очистки 2-(диметиламшо)піримідин Розчин 5г (43,65ммоль) 2-хлорпіримідина у 50мл сухого ТГФ ІЧ-ацетил-3-(1 -піроліл)анілш (2к) До вищеознасичували газуватим диметиламіном Суміш при наченого продукта додавали 40мл оцтового анпдзвичайній температурі перемішували 1 год, з нарида при звичайній температурі і перемішували ступним випарюванням розчинника Залишок розпротягом ночі Суміш виливали у воду Сирий проподіляли між водою та етилацетатом Водну фазу дукт відфільтровували, промивали водою і сушиекстрагували етилацетатом Поєднану органічну ли Перекристалізовували з суміші вода/етанол фазу сушили сульфатом натрія і випарювали, З 2, отримуючи 9,93г (58%) чистого (2к) Темпераотримуючи 5,07г (94%) продукта у вигляді коричтура плавління 134 - 136°С невого масла Приклад 7 5-бром-2-(диметиламшо)піримідин 5,07г 3-(2-амінопіримід-5-ил)анілш (21) Суміш 5,4г (41,22ммоль) вищеозначеного продукта розчинили (25ммоль) 2-(ацетамшо)-5-бромпіримідина, 5,58г у льодяній оцтовій кислоті (25мл) та додали (ЗОммоль) напівсульфата 3-амшофенілбороновоі 2,15мл (41,95ммоль) брома Суміш при звичайній кислоти, 10,4г (75ммоль) карбоната калія, 9мл температурі перемішували 1 год , виливали у воду (0,13ммоль) 1,3-пропандюла та 0,5г тетраз льодом і підлуговували додаванням 10М гідрокіс(трифенілфосфш)паладія(0) у суміші 25мл води ксиду натрія Продукт відфільтровували, промивата 50мл диметоксіетана перемішували при 80°С ли водою і сушили, отримуючи 4,72г (57%) продукпід струмом азота протягом ночі Після охолота Температура плавління 162 - 164°С дження суміш влили у воду з льодом Продукт (деацетильований у реакції") відфільтровували, 3-(2-(диметиламіно)-5-піридиніл)анілш (2п) промивали водою та сушили з утворенням 4,19г Суміш 6,76г (33,17ммоль 5-бром-221 (90%) Температура плавління 171 - 172°С (диметиламшо)піримідина, 7,4г (39,78ммоль) напівсульфата 3-амшофенілбороновоі кислоти, Приклад 8 13,73г (99,49ммоль) карбоната калія, 12мл г\І-ацетил-М-(3-(1-імідазолІл)феніл)-2-нггро-4(166ммоль) 1-3-пропандюла та 0,2г тетраюданілін (6с) Розчин 2е з прикладу 3 (30г, 0,15 кіс(трифенілфосфш)паладія(0) у суміші ЗОмл води моль) у 200мл сухого ДМФ охолодили до 0°С під та 60мл діметоксіетана нагрівали до 80°С під тошаром азоту Порціями додавали 7,2г 60% суспенком азота впродовж ночі Після охолодження сузії гідриду натрія у мінеральному маслі Після міш розбавляли водою та етилацетатом і фільтруприпинення виділення водню додавали розчин 1с 16 15 54393 з прикладу 1 (52г, 0,19 моль) у 50мл ДМФ Суміш (приклад 2) Вихід 79%, температура плавління перемішували при 120°С 5 годин та залишали на 214-217°С ніч при температурі довкілля Реакційну суміш виг\І-(3-(2-піридил)феніл)-4-іод-2-нгфоанілін (6f) ливали у 4 об'єми води та відфільтровували сирий отримували аналогічно з 1с (приклад 1) та 2f (припродукт 3 використанням суміші етилацететат з клад 4) Вихід 40%, температура плавління 195 петролейним етером (3 17) в якості елюєнта очи196°С щали продукт на силікагелі, отримуючи 6с як масПриклад 11 ло (7г, 25%) |\|-(3-(1-імідазоліл)феніл)4-(3-фураніл)-2нітроанілін (7с) Суміш 17г (38ммоль) 6с з приклаПриклад 9 ду 8, 5,6г (50ммоль) 3-фуранілбороновоі кислоти, г\І-(3-(2-метил-1-імідазоліл)феніл)-2-нггро-415,7г (0,11 моль) карбоната калія, 14мл (0,17 юданілін (6j) До розчину 2j з прикладу 5 (2г, моль) 1,3-пропандюла та 0,5г тетракіс (трифеніл9,3ммоль) у 20мл сухого І\І-метил-2-піролідону фосфш)паладія (0) у суміші 60мл води та 120мл додавали порціями 0,37г 60% суспензії гідриду диметоксіетана нагрівали зі зворотним холодильнатрія у мінеральному маслі при 0°С Суміш переником під струмом азота протягом ночі Після охомішували 1 годину, останні ЗОхв при кімнатній лодження суміш влили у 800мл води та перемішутемпературі Додавали 1с з прикладу 1 (2,67г, вали при 0°С поки не завершилося випадіння Юммоль) і температуру збільшували до 40 - 50 °С маслянистих кристалів Сирий продукт (суміш ацепротягом ночі Після охолодження суміш виливали тильованого та дезацетильованого) відфільтрувау 4 об'єми води та екстрагували дихлорметаном ли та розчинили у 200мл диметоксіетану Додали Органічну фазу екстрагували 4М соляною кисло114мл 1М розчину пдроксида натрія і перемішуватою Кислий екстракт охолоджували на льоді, підли суміш протягом ночі при температурі довкілля луговували додаванням 12М гідроксиду натрія та Суміш вилили у 500мл води, продукт відфільтруекстрагували дихлорметаном Органічну фазу сували, промили водою та висушили Вихід 77%, шили сульфатом магнія та випарювали досуха температура плавління 147 - 149°С Залишок екстрагували сумішшю 1 1 дихлорметану з діетиловим етером Екстракт концентрували під І\І-(3-П-імідазоліл)феніл)4-(2-фураніл)-2зниженим тиском та розчиняли залишок у 60мл нітроанілін (7о) отримували аналогічно з 6с (придиметоксіетану Додавали 28мл 1М гідроксиду клад 8) та 2-фуранілбороновоі кислоти) Вихід натрія та перемішували суміш при температурі 77%, температура плавління 147 - 149°С довкілля протягом ночі Приклад 12 Суміш виливали у 200мл води і додавали при г\І-(3-(2-метилімідазол-1-іл)феніл)-4-(3перемішуванні невеликий об'єм етанолу Продукт фураніл)-2-нітроанілін (7j) Суміш 1г (2,38ммоль) 6j відфільтровували промивали водою та сушили, з прикладу 9, 0,4г (3,57ммоль) 3-фуранілбороновоі отримуючи 2г 6j (51%) Температура плавління 135 кислоти, 1 г (7,25ммоль) карбоната калія, 0,9мл -136°С (11,2ммоль) 1,3-пропандюла та 50мг тетракіс(трифенілфосфш)паладія(0) у суміші З,5мл води N-(3-(1 -піроліл )феніл)-2-нітро-4-юданілш (6к) та 7мл диметоксіетана нагрівали зі зворотним хоотримували аналогічно з 1с (приклад 1) та 2к (прилодильником під струмом азота протягом 4 годин клад 6) Вихід 30%, температура плавління 116 Після охолодження суміш влили у ЗОмл води і екс118°С трагували етилацетатом Органічну фазу сушили Приклад 10 сульфатом магнія і концентрували під зниженим Гідрофлуорид І\І-(3-(2-(диметиламіно)-піримідтиском Залишок очищали на колонці з силікаге5-ил)Феніл)-2-нітро-4-юданілша (6п) Суміш 1с з лем, використовуючи як елюент суміш етанола з прикладу 1 (Зг, 11,2ммоль) і 2п з прикладу 5 (2,4г, етилацетатом (1 4) Отримано маслоподібний 11,2ммоль) у Юмл сухого І\І-метил-2-піролідону продукт з виходом 93% перемішували під шаром азоту при 120 - 135°С 6 годин Суміш охолоджували до кімнатної темпераг\І-(3-(2-(диметиламшо)піримід-5-ил)феніл)-4тури та продовжували перемішування протягом (3-фураніл)-2-нітроанілш (7п) отримували аналогіночі До отриманої суспензії додавали воду Прочно з 6п (приклад 10) Вихід 87%, температура дукт відвільтровували сушили та промивали етиплавління 181 - 182°С лацетатом отримуючи 6п (3,46г, 64%) Темпераг\І-(3-(2-(диметиламшо)піримід-5-ил)феніл)-4тура плавління 202 - 203°С (2-фураніл)-2-нітроанілш (7т) отримували аналогічно з 6 т (приклад 10) та 2-фуранілбороновоі Гідрофлуорид І\І-(3-(2-амінопіримід-5кислоти Вихід 89%, температура плавління 160 ил)феніл)-2-нітро-4-юданілша (61) отримували 161 °С аналогічно з 1с (приклад 1) та 21 (приклад 7) Вихід 79%, температура плавління 236 - 238°С N-(3-(1 -піроліл )феніл)-4-(3-фурант)-2N-(3-(1 -піразоліл)Феніл)-4-юд-2-нітроанілш (6т) нітроанілін (7п) отримували аналогічно з 6п (приотримували аналогічно з 1с (приклад 1) та 2 т клад 9) та 3-фуранілбороновоі кислоти Вихід 86%, (приклад 16) Основу було вивільнено обробкою температура плавління 129 -131 °С розчином карбонату натрія Вихід 23%, темпераN-(3-(1-пірол іл)фент)-4-(2-фураніл)-2тура плавління 165 - 166°С нітроанілін (7к) отримували аналогічно з 6к (приклад 9) та 2-фуранілбороновоі кислоти Вихід 83%, г\І-(3-(2-метилтіазол-4-іл)Феніл)-4-юд-2виділено як коричнево-червоне масло нітроанілін (6п) отримували аналогічно з 1с (приклад 1) та 2п (приклад 17) Вихід 32%, температуг\І-(3-(2-амшопіримід-5-ил)феніл)-4-(3-6ураніл)ра плавління 137 - 138°С 2-нітроанілш(7І) отримували аналогічно з 61 (приклад 10) та 3-фуранілбороновоі кислоти Вихід г\І-(3-(5-піримідил)Феніл)-4-іод-2-нгфоанілін КІЛЬКІСНИЙ, температура плавління 185 - 186°С (6Ь) отримували аналогічно з 1с (приклад 1) та 2Ь 17 54393 г\І-(3-(2-амшопіримід-5-ил)феніл)-4-(2фураніл)-2-нітроанілін (7р) отримували аналогічно з 6р (приклад 10) та 2-фуранілбороновоі кислоти Вихід КІЛЬКІСНИЙ, температура плавління 178 180°С 1-(3-(5-піримідил)феніл)-5-(3-фураніл)бензимідазол (9Ь) отримували аналогічно з 11Ь (приклад 15) та 3-фуранілбороновоі кислоти Для хроматографічної очистки використали як елюент суміш діхлорметана та метанола (191) Вихід 48%, температура плавління 216 - 218°С 1-(3-(2-метилтіазол-4-іл)феніл)-5-(3-фураніл)бензимідазол (9N) отримували аналогічно з 11 п (приклад 15) та 3-фуранілбороновоі кислоти Для хроматографічної очистки використали як елюент суміш етилацетата та петролейного етера (1 1) Вихід 73%, температура плавління 136-138°С 1 -(3-( 1 -піразоліл)феніл)-5-(3-фураніл)бензимідазол (9М) отримували аналогічно з 11т (приклад 15) та 3-фуранілбороновоі кислоти Вихід 64%, температура плавління 170 - 173°С 1-(3-(2-піридил)феніл)-5-(2-фураніл)бензимідазол (9f) отримували аналогічно з 11f (приклад 15) та 2-фуранілбороновоі кислоти Вихід 42%, температура плавління 135 - 136°С 1-(3-(3-фураніл)феніл)-5-(3-фураніл)бензимідазол (9q) отримували аналогічно з 14q (приклад 15) Вихід~15%, температура плавління 170-173°С г\І-(2-(1-імідазоліл)піридш-6-іл)-4-(3-фураніл)-2нітроанілін (16с) отримували аналогічно з 16а (приклад 25), виключаючи хроматографічну обробку Продукт КІЛЬКІСНО кристалізовався при додаванні води, температура плавління 173 - 174°С Приклад 13 І\І-(3-(1-імідазоліл)феніл)-2-аміно-4-(3фураніл)-анілш (8с) До розчину 13г (37,6ммоль) 7с з прикладу 11 у 25мл етанола додавали 6,03г (ИЗммоль) хлориду амонія та 27,05г (ИЗммоль) дев'яти вод гого пдрата сульфіда натрія Суміш нагрівали зі зворотним холодильником 1 годину Після охолодження суміш виливали у 700мл води Продукт відфільтровували, промивали водою і сушили на повітрі отримавши 8,7г 8с з виходом 73% Температура плавління 188 - 189°С г\І-(3-(2-імідазол-1-іл)феніл)-2-амшо-4-(3фураніл)-анілш (8j) отримували аналогічно з 7j (приклад 12) Вихід КІЛЬКІСНИЙ, температура плавління 98 - 99°С N-(3-(1-пірол іл)феніл)-2-амшо-4-(3-фураніл)анілін (8к) отримували аналогічно з 7к (приклад 12) Вихід 80%, температура плавління 194 195°С І\І-(3-(1-імідазоліл)феніл)-2-аміно-4-(2фураніл)-анілш (8о) отримували аналогічно з 7о (приклад 11) Вихід 94%, температура плавління 191 -194°С N-(3-(1-пірол іл)феніл)-2-амшо-4-(2-фураніл)анілін (8п) отримували аналогічно з 7п (приклад 12) Вихід 77%, температура плавління 163 164°С г\І-(3-(2-(диметиламшо)піримід-5-ил)феніл)-2амшо-4-(3-фураніл)-анілш (8h) отримували аналогічно з 7п (приклад 12) Виділено як масло г\І-(3-(2-(диметиламшо)піримід-5-ил)Феніл)-2аміно-4-(2-фураніл)-анілш (8т) отримували анало 18 пчно з 7 т (приклад 12) Виділено як масло г\І-(3-(1-піразоліл)феніл)-2-аміно-4-юданілін (10т) отримували аналогічно з 6 т (приклад 10) Вихід 75%, температура плавління 134 - 135°С г\І-(3-(5-піримідил)феніл)-2-аміно-4-юданілін (10Ь) отримували аналогічно з 6Ь (приклад 10) Вихід 82%, температура плавління 166 - 169°С г\І-(3-(2-піридил)феніл)-2-аміно-4-юданілін (1 Of) отримували аналогічно з 6f (приклад 10) Продукт було використано безпосередньо для наступної переробки, див приклад 15 І\І-(3-(2-метилтіазол-4-іл)феніл)-2-аміно-4юданілін (10п) отримували аналогічно з 6п (приклад 10) Вихід 73%, температура плавління 151 152°С І\І-(3-бромфеніл)-2-аміно-4-(3-фураніл)-анілін у суміші з І\І-(3-іодфеніл)-2-аміно-4-(3-Фураніл)аніліном (13q) отримували аналогічно з 12q (приклад 20) Суміш виділено як масло Вихід ~ 76%% г\І-(3-(2-тіазоліл)феніл)-2-аміно-4-нггроанілін (20t) отримували аналогічно з 19t (приклад 27) Вихід 96%, температура плавління 146 - 159°С Приклад 14 г\І-(3-(амінопіримід-5-ил)феніл)-2-амшо-4-(2фураніл)-анілш (81) До суспензії 0,87г (2,33ммоль) 7р з прикладу 12 у Юмл етанола додали 0,1г паладієвого каталізатора (5% Pd на активованому вугіллі) і гідрували суміш при звичайному тиску поки не перестав поглинатися водень Суміш фільтрували крізь броунмілерит, який послідовно промивали етанолом та ДМФ Фільтрат випарювали під зниженим тиском і залишок розтирали з водою Продукт відфільтровували, промивали водою та сушили на повітрі, отримавши 0,5г (63%) 81 Температура плавління 211 -212°С г\І-(3-(амінопіримід-5-ил)феніл)-2-амшо-4-(3фураніл)-анілш (8р) 71 (приклад 12) гідрували, як вищеописано Вихід 8р 43%, температура плавління 208 - 209°С Приклад 15 1 -(3-(1 -імідазоліл)феніл)-5-(3фураніл)бензимідазол (9с) Розчин 8,7г (27,5ммоль) 8с з прикладу 13 у ЮОмл мурашиної кислоти нагрівали зі зворотним холодильником ЗО хвилин Після охолодження суміш вилили у 500мл води і зробили лужною додаванням 12М розчину гідроксиду натрія Сирий продукт відфільтрували, промили водою та висушили на повітрі Розчин сирого продукта у суміші 200мл етанола та 400мл дихлорметана обробили активованим вугіллям зі зворотним холодильником ЗО хвилин Суміш фільтрували крізь броунмілерит, фільтрат випарювали під зниженим тиском до початку появи осаду Осадження було завершено на льодяній бані Продукт відфільтровували та сушили Вихід 7,5г 84%, температура плавління 203 - 204°С 1-(3-(2-(диметиламшо)піримід-5-ил)феніл)-5(З-фураніл)бензимідазол (9п) отримували аналогічно з 8п (приклад 13) Очистку було проведено хроматографією на колонці з силікагелем з використанням в якості елюєнта суміші дихлорметана та ацетона (9 1) Вихід 32% (з 7п), температура плавління 183 - 184°С 1-(3-(2-метилімідазол-5-ил)феніл)-5-(3фураніл)бензимідазол (9j) отримували аналогічно з 8j (приклад 13) Очистку було проведено хрома 19 54393 тографією на колонці з силікагелем з використанням в якості елюєнта суміші етилацетата та метанола (9 1) Вихід 32% (з 7h), температура плавління 183-184°С 1 -(3-(1 -пірол іл)Феніл)-5-(3фураніл)бензимідазол (9к) отримували аналогічно з 8к (приклад 13) Очистку було проведено хроматографією на колонці з силікагелем з використанням в якості елюєнта суміші етилацетата та петролейного етера (1 1) Вихід 42% (з 7п), температура плавління 144 - 145°С 1-(3-(2-амшопіримід-5-ил)феніл)-5-(2фураніл)бензимідазол (91) отримували аналогічно з 81 (приклад 14) Очистку було проведено хроматографією на колонці з силікагелем з використанням в якості елюєнта суміші етилацетата та метанола (9 1) Вихід 11% , температура плавління 220 - 222°С 1-(3-(2-(диметиламшопіримід-5-ил)феніл)-5-(2фураніл)бензимідазол (9т) отримували аналогічно з 8 т (приклад 13) Очистку було проведено хроматографією на колонці з силікагелем з використанням в якості елюєнта суміші етилацетата та петролейного етера (1 1) Вихід 42% (з 7 т ) температура плавління 170 - 172°С 1 -(3-(1 -піроліл)феніл)-5-(2фураніл)бензимідазол (9п) отримували аналогічно з 8п (приклад 13) Очистку було проведено як для 9 т Вихід 53%, температура плавління 137 139°С 1 -(3-(1 -імідазоліл)феніл)-5-(2фураніл)бензимідазол (9о) отримували аналогічно з 8о (приклад 13) Очистку було проведено як для 9с Вихід 46%, температура плавління 175 - 177°С 1-(3-(2-амшопіримід-5-ил)феніл)-5-(3фураніл)бензимідазол (9р) отримували аналогічно з 8р (приклад 14) Очистку було проведено як для 91 Вихід 5% , температура плавління 222 - 223°С 1-(3-(5-піримідил)феніл)-5-юдбензимідазол (11Ь) отримували аналогічно з 19Ь (приклад 13) Продукт було використано без подальшої очистки Вихід 91% , температура плавління 197 - 199°С 1-(3-(2-метилтіазол-4-іл)феніл)-5юдбензимідазол (11 п) отримували аналогічно з 10п (приклад 13) Вихід 98%, температура плавління 163- 164°С 1 -(3-(1 -піразоліл)феніл)-5-юдбензимідазол (11т) отримували аналогічно з 10т (приклад 13) Вихід 86%, температура плавління 209 - 211 °С 1-(3-(2-піридил)феніл)-5-юдбензимідазол (11f) отримували аналогічно з 10f (приклад 13) Вихід 53%, температура плавлікня 157 - 158°С 1-(3-бромфеніл)-5-(3-фураніл)бензимідазол у суміші з 1 -(3-юдфеніл-5-(3фураніл)бензимідазолом 14q) отримували аналогічно з 13q (приклад 13) Сирий продукт було використано без очистки (приклад 12) Вихід 47% 1 -(4-(1 -імідазоліл)піримід-6-ил)-5-(3фураніл)бензимідазол (18Ь) отримували аналогічно з 17Ь (приклад 26) Вихід 27% (з 16Ь), температура плавління 294 - 296°С 1 -(2-(1 -імідазоліл)піримід-6-ил)-5-(3~ фураніл)бензимідазол (18с) отримували аналогічно з 17с (приклад 26) Продукт виділяли екстракцією та кристалізацією з етилацетату Вихід 29%, температура плавління 170 - 173°С 20 1 -(3-(2-тіазоліл)феніл)-5нггробензимідазол(2И:) отримували аналогічно з 20t (приклад 13) Вихід КІЛЬКІСНИЙ, температура плавління 251 - 260°С Приклад 16 1 -(З-нітрофеніл)піразол Суміш 18,7г (75ммоль) 1-юд-З-нітробензола, 7,66г (ИЗммоль) піразола, 11,2г (81ммоль) карбоната калія та каталітичної КІЛЬКОСТІ юдида купрума та мідної бронзи у 50мл сухого І\І-метил-2-піролідона нагрівали до 180°С 4,5 години Після охолодження суміш фільтрували крізь броунмілерит Фільтрат виливали у 700мл льодяної води, продукт відфільтровували, промивали водою і сушили, отримуючи 13,57г продукта з виходом 96% Температура плавління 85 -87°С 3-(1-піразоліл)анілш (2т) Суспензію 5,5г (34,6ммоль) 3-(1 -тразоліл)-нітробензола у 50мл концентрованої соляної кислоти нагрівали зі зворотним холодильником Порціями додавали 24,2г (0,11 моль) дипдрату хлориду станума, продовжуючи нагрівання зі зворотним холодильником ще півгодини Після охолодження осад відфільтровували і розчиняли у 200мл води Одержаний розчин охолоджували на льодяній бані, робили лужним додаванням 12М розчину гідроксиду натрія та екстрагували етилацетатом Екстракт промивали розсолом, сушили над сульфатом натрія і випарювали, одержуючи продукт у вигляді коричневатого масла Вихід 3,9г (71%) 1-(3-(2-тіазоліл)феніл)-5-амшобензимідазол (22t) отримували аналогічно з 211 (приклад 15) Виділяли ЯК масло Вихід, (65%) Приклад 17 3-(2-метилтіазол-4-іл)анілш (2п) Суміш 5г (20,5ммоль) 2-бром-3'-нітроацетофенона та 1,4г (18,6ммоль) тюацетаміда у 50мл льодяної оцтової кислоти нагрівали зі зворотним холодильником протягом ночі Після охолодження осад відфільтровували і промивали водою та сушили, отримуючи 3,47г (85%) 2-метил-4-(3-нітрофеніл)тіазола Температура плавління 87 - 88°С Продукт пдрогенували як у прикладі 4, КІЛЬКІСНО одержуючи 2п Температура плавління 80 81 °С Приклад 18 г\І-ацетил-4-бром-2-нггроанілін (1d) Розчин 20г (93,4ммоль) 4-бромацетаніліда у метансульфоновій кислоті охолодили до 10°С Додали 12,6мл концентрованої нітратної кислоти і перемішували суміш при 40°С 2 години Суміш вилили у воду з льодом Продукт відфільтровували, промивали водою та сушили Вихід 23,59г (97%) Температура плавління 99 - 100°С 4-бром-2-нітроанілш (1f) Суміш 3,5г (13,5ммоль) 1d, 100мл диметоксиетана та 50мл 1М розчину гідроксиду натрія нагрівали до 80°С 1 годину Суміш вилили у воду з льодом Продукт відфільтровували, промивали водою та сушили Вихід 2,77Г (94%) Температура плавління 109 110°С Приклад 19 г\І-ацетил-4-(3-фураніл)-2-нггроанілін (1е) Суміш 8,5г (32,8ммоль) 1d з прикладу 18, 3,67г (32,8ммоль) 3-фуранілбороновоі кислоти, 13,8г (0,16 моль) пдрокарбоната натрія та 0,5г тетра 21 кіс(трифенілфосфш)паладія(0) у суміші 40мл води та 80мл диметоксіетану нагрівали до 80°С протягом ночі під струмом азоту Після охолодження суміш вилили у воду та екстрагували етилацетатом Органічну фазу промили розсолом, висущили сульфатом та концентрували під зниженим тиском (*) Залишок розчиняли у 40мл диметоксіетану, додавали 78мл 1М розчину гідроксиду натрія та перемішували суміш при температурі довкілля протягом ночі Суміш виливали у воду та розчин підкислювали додаванням розбавленої соляної кислоти Осад відвільтровували, промивали водою та сушили, отримуючи 5,09г 1е (76%) Температура плавління 152 - 154°С 1-(3-(2-тіазоліл)феніл)-5-(3-фураніл)бензимідазол (9t) отримували аналогічно з 23t (приклад 28) до (*) Залишок елюювали крізь силікагель сумішшю етилацетатат з петролейним етером (1 1) Вихід 9% Температура плавління 102 105°С Приклад 20 г\І-(3-бромфеніл)-4-(3-фураніл)-2-нггроанілін у суміші з І\І-(3-юдфеніл)-4-(3-фураніл)-2нітроаніліном (12q) Суміш 2,65мл (20,8ммоль) 1бром-3-юдбензола, 4г (19,6ммоль) (1е) з прикладу 19, 2,93г (21,2ммоль) карбоната калія та каталітичної КІЛЬКОСТІ мідної бронзи у сухому ІЧ-метил-2піролідоні нагрівали до 180°С протягом ночі Після охолодження суміш виливали у воду, додавали етилацетат та фільтрували суміш крізь броунмілерит Фази відокремлювали та водну фазу ДВІЧІ екстрагували етилацетатом Комбінований органічний екстракт сушили над сульфатом натрія і видяляли розчинник при зниженому тиску Залишок очищали на силікагелевій колонці з етилацетатом та петролейним етером (1 9) в якості елюєнта Суміш продуктів 12q виділяли у вигляді 1,44г червоного масла, яке використали безпосередньо у наступному синтезі (див приклад 13) Приклад 21 І\І-(3-карбоксифеніл)-4-(3-фураніл)-2нітроанілін (12г) Суміш 5г (24,5ммоль) (1е) з прикладу 19, 6,69мл (27ммоль) 3-юдбензойноі кислоти, 3,79г (27,5ммоль) карбоната калія та каталітичної КІЛЬКОСТІ мідної бронзи у ЗОмл сухого Nметил-2-піролідону нагрівали до 180°С протягом ночі Після охолодження додавали воду, і ДВІЧІ промивали суміш етилацетатом Водну фазу підкислювали розбавленою соляною кислотою і відфільтровували маслянистий осад, який екстрагували етилацетатом, і екстракт очищали на силікагелевій колонці з етилацетатом та петролейним етером (1 1) в якості елюєнта Вихід 2,65г (32%) Температура плавління 203 - 205°С Приклад 22 1-(3-карбоксифеніл)-5-(3-фураніл)бензимідазол (14г) До 2,4г (8,16ммоль) 13г з прикладу 4 додавали 25мл мурашиної кислоти і перемішували суміш при 80°С 1,5 години Охолоджену суміш вилили у воду з льодом Осад відфільтровували, промивали метанолом та сушили, одержавши 0,89г 14г (40%) Температура плавління 272 - 274°С 1-(3-(3-(2-піридил)оксадіазол-5-іл)феніл)-5-(3фураніл)-бензимідазол (9г) Розчин 0,43г (1,41ммоль) 14г у Юмл сухого тетрапдрофурана 54393 22 нагріли зі зворотним холодильником під шаром азоту Додали 0,4г (2,48ммоль) карбонілдимідазола і продовжували нагрівати зі зворотним холодильником 3 години Додали 0,48г (3,54ммоль) 2(оксимімідо)піридина і нагрівали зі зворотним холодильником протягом ночі Після охолодження розчинник видаляли випаровуванням і осад розподіляли між водою та етилацетатом Органічну фазу сушили сульфатом натрія та випарювали досуха Осад розчиняли у 15мл толуола, додавали каталітичну КІЛЬКІСТЬ ПТСК та нагрівали зі зворотним холодильником протягом ночі Розчинник випарювали при зниженому тиску і залишок очищали на хроматографічній силікагелевій колонці з етилацетатом та петролейним етером (1 1) в якості елюєнта Вихід 9Г 0,16Г (28%) Температура плавління 183- 186°С 1-(3-(3-циклопропілоксааіазол-5-іл)феніл)-5-(3фураніл)-бензимідазол (9s) отримували аналогічно з і 4г та циклопропілоксиміміда Вихід 19% Температура плавління 144 - 146°С Приклад 23 2-хлор-6-П-імідазоліл)піридин 15а) Суміш 5г (33,78ммоль) 2,6-дихлорпіридину, 2,3г (33,78ммоль) імідазолу та 4,66г (33,78ммоль) карбоната калія у 50мл ДМФ нагрівали до 85°С протягом ночі Охолоджену суміш виливали у воду з льодом і відфільтровували непрореагувавші ВИХІДНІ продукти Фільтрат підкислювали розбавленою соляною кислотою та екстрагували етилацетатом Водну фазу підлуговували додаванням 10М розчину гідроксиду натрія та екстрагували етилацетатом Органічний екстракт сушили сульфатом натрія, концентрували при зниженому тиску і елюювали крізь силікагель етилацетатом та метанолом (9 1) Після випаровування розчинника одержано 0,16г 15а (28%) Температура плавління 71 -73°С Приклад 24 4-хлор-6-(1-імідазоліл)піримідин (15Ь) Суміш 5г (33,56ммоль) 2,6-дихлорпіримідину, 2,3г (33,56ммоль) імідазолу та 4,63г (33,56ммоль) карбоната калія у 50мл ДМФ перемішували при кімнатній температурі протягом ночі Суміш розбавляли чотирма об'ємами води та екстрагували дихлорметаном Органічний екстракт концентрували при зниженому тиску і елюювали крізь силікагель етилацетатом та метанолом (9 1) Після випаровування розчинника та розтирання залишка у суміші діетилового та петролейного етерів (1 1) одержано 4,07г 15Ь (67%) Температура плавління 198 200°С Приклад 25 І\І-(2-(1-імідазоліл )піридин-6-іл)-4-бром-2нітроанілін (16а) До розчину 2,7г (12,5ммоль) 1f з прикладу 18 у 25мл сухого ДМФ додали 0,5г 60% суспензії гідриду натрія у мінеральному маслі і перемішували суміш ЗО хвилин Додавали 2,25г (12,5ммоль) 15а з прикладу 23 і суміш нагрівали при 100°С протягом ночі Охолоджену суміш виливали у воду з льодом і відфільтровували осад, який сушили і знов розчиняли у етилацетаті Фільрат екстрагували етилацетатом Комбіновані розчини продукта концентрували та очищали на хроматографічній силікагелевій колонці з етилацетатом та метанолом (9 1) як елюентом 23 Після випаровування розчинника та розтирання залишку суміші діетилового та петролейного етерів (1 1) одержано 0,93г 16а (21%) Температура плавління 194 - 195°С І\І-(4-(1-імідазоліл)піримід-6-ил)-4-(3-фураніл)2-нітроанілш (16Ь) отримували аналогічно з 15Ьта 1е Як елюент використовували для хроматографічної обробки етилацетат Вихід 23% Температура плавління 198 - 200°С Приклад 26 І\І-(4-(1-імідазоліл)піримід-6-ил)-2-аміно-4-(3фураніл)-анілш (17Ь) Суспензію 0,23г (1,1 ммол) 16Ь (приклад 25) у суміші етанола та дихлорметана пдрогенували при температурі довкілля, використовуючи нікель Ренея (50% шлам у воді) в якості каталізатора Після закінчення поглинання водню суміш фільтрували крізь броунміле-рит, фільтрат випаровували та отримували 17Ь як масло, яке використовували без очистки І\І-(2-(1-імідазоліл)пірид-6-ил)-2-аміно-4-(3(фураніл)-анілш (17с) Суспензію 0,9г (2,6 ммол) 16с (приклад 12) у 50мл суміші етанола та дихлорметана (4 1) пдрогенували при температурі довкілля, використовуючи 0,15г паладійового каталізатора (5% на активованому вугіллі) Після закінчення поглинання водню суміш фільтрували крізь броунмілерит, фільтрат випаровували та отримували 17с як масло, яке використовували без очистки Приклад 27 г\І-(3-(2-тіазоліл)феніл)-2 4-динітроанілш (19t) Суміш 1,14мл (9,1ммоль) 2,4динітрофлуорбензолу, 1,6г (9,1ммоль) 2t з прикладу 2, 1,51г (10,9ммоль) карбоната калія у Юмл сухого І\І-метил-2-піролідону нагрівали до 80°С протягом 2 годин Охолоджену суміш виливали у воду з льодом Осад відфільтровували, промивали водою та сушили, отримуючи 3,05г (98%) Температура плавління 197 - 203°С Приклад 28 1 -(3-(2-тіазоліл)феніл)-5-юдбензимідазол (23t) Суспензію 0,85г (2,91ммоль) 22t з прикладу 16 у соляній кислоті охолодили до -5°С По краплям додавали розчин у Змл води 0,22г (3,2ммоль) нітрита натрія, підтримуючи температуру нижче 0°С Далі суміш перемішували при (-5-0)°С 20 хвилин Додавали розчин у Змл води 0,6г (3,64ммоль) юдида калія і суміш перемішували при температурі довкілля протягом ночі До реакційної суміші додавали водний сульфіт натрія поки не зникне юдне забарвлення Отриману суміш екстрагували етилацетаттом Органічну фазу промивали водним карбонатом натрія, сушили сульфатом натрія і фільтрували через силікагель Фільтрат випарювали досуха, одержуючи 23t Вихід 23% Плавиться з розкладанням при 175°С Приклад 29 г\І-(3-іодфеніл)-4-ціано-2-нггроанілін (29) До розчину 1,82г (Юммоль) 4-хлор-Знітробензонітрилу у 25мл сухого ДМФ додавали 1,54мл (11ммоль) тріетиламшу та 1,2г (Юммоль) 3-юданіліна і нагрівали суміш до 80-100°С протягом ночі Охолоджену суміш виливали у чотири об'єми води з льодом Осад відфільтровували, промивали водою та сушили Сирий продукт промивали гарячим етанолом, отримуючи 2,1г (58%) 54393 24 титульної сполуки Температура плавління 211 212°С Приклад ЗО 2-аміно-(г\І-(3-юдфеніл)-4-ціаноанілін (ЗО) До суспензії 2,1г (5,75ммоль) 29 у 50мл метанолу додавали 0,92г (17,25ммоль) хлориду амонія та 4,14г (17,25ммоль) дев'ятиводного сульфіду натрія і нагрівали суміш зі зворотним холодильником 1,5 години Охолоджену суміш виливали у 200мл води з льодом Осад відфільтровували, промивали водою та сушили, отримуючи 1,8г (93%) титульної сполуки Температура плавління 170 - 172°С Приклад 31 5-ціано-1-(3-юдфеніл)-бензимідазол (31) Суспензію 1,8г (5,36ммоль) ЗО у 20мл мурашиної кислоти нагрівали до 80 - 100°С 1,5 години Гарячу реакційну суміш фільтрували крізь бавовняний тампон у ЮОмл води з льодом Осад відфільтровували, промивали водою та сушили Сирий продукт розчиняли у дихлорметані та висаджували в осад додаванням петролейного етера Продукт відфільтровували та сушили, отримуючи 1,38г (75%) титульної сполуки Температура плавління 177-179°С Приклад 32 5-ціано-1-(3-(3-піридил)феніл)-бензимідазол (32а) Суміш 4г (11,6ммоль) 31, 2,04г (13,9ммоль) 3-піридилборану, 4,8г (34,8ммоль) гідрокарбонате натрія та 0,2г тетракіс(трифенілфосфш)паладія(0) у суміші 20мл води та диметоксіетану нагрівали до 80°С протягом ночі під струмом азоту Після охолодження отриману суспензію вилили у воду і сирий продукт відфільтрували, промили водою та висушили Очистку провели на хроматографічній силікагелевій колонці з етилацетатом та метанолом (9 1) в якості елюєнта Вихід титульної сполуки 2,46г (72%) Температура плавління 191 193°С Приклад 33 2-трибутилстаніл(тіазол) (33) До розчину 0,71мл (Юммоль) тіазола у 20мл сухого ТГФ по краплям додавали 6,9мл (11ммоль) 1,6М бутиллітія у гексані під шаром аргона при -78°С Реакційну суміш перемішували при -78°С 0,5 години і додали по краплям 3,1мл (11ммоль) ВизЭпС! Після перемішуваня при -78°С протягом 1 години і 1 години при кімнатній температурі суміш концентрували, розтирали з 50мл води та тричі по ЮОмл екстрагували діетилетером Екстракт промивали розсолом, сушили і концентрували під зниженим тиском, отримуючи з КІЛЬКІСНИМ виходом 3,7г 33 у вигляді безбарвного масла Приклад 34 5-ацетил-1-(3-(2-тіазоліл)феніл)бензимідазол (34) До розчину 3,6г (9,7ммоль) 33 у 20мл сухого ТГФ додавали 1,5г (4,8ммоль) 5-ацетил-1-(3бромфеніл)бензимідазола та 340мг (0,48ммоль) (PPh)2PdCl2 під шаром аргона Реакційну суміш перемішували при 80°С 24 години у герметичному сосуді Після охолодження суміш концентрували, розтирали з ЮОмл води та тричі по 200мл екстрагували дихлорметаном Екстракт промивали розсолом, сушили і концентрували під зниженим тиском Залишок промивали етером, отримуючи 1,5г (89%) 34 у вигляді кристалів 5-ацетил-1-(3-бромфеніл)бензимідазол було 25 54393 отримано як далі описано 4-ацетил-2-нітроанілш 26,5г (11,94ммоль) N(4-ацетил-2-нітрофеніл)ацетаміда було доданої 50мл суміші води та концентрованої сірчаної кислоти (1 2) Через 15 хвилин суміш вилили у воду Продукт відфільтрували, промили водою та висушили І\І-(3-бромфеніл)-4-ацетил-2-нггроанілін Суміш 3,41г (18,94ммоль) 4-ацетил-2-нітроаніліна, 4,6мл (38,06ммоль) 1,3-дибромбензола, 2,62г (19ммоль) карбоната калія та каталітичної КІЛЬКОСТІ МІДНОЇ бронзи нагрівали до 180°С і перемішували під струмом азоту протягом 2 діб Після охолодження твердий реакційний брикет екстрагували сумішшю дихлорметана та метанола (9 1) Екстракт концентрували під зниженим тиском Залишок екстрагували етилацетатом Екстракт концентрували під зниженим тиском і залишок елюювали крізь силікагель сумішшю петролейного етера та етилацетате (4 1), отримуючи 0,67г (10,6%) чистого продукта Температура плавління 142- 144°С 5-ацетил-1-(3-бромфеніл)бензимідазол 9,0г (26,63ммоль) І\І-(3-бромфеніл)-4-ацетил-2нітроаніліна суспендували у ЮОмл 99% етанола Додали нікель Ренея і суміш гідрували при звичайному тиску 20 годин Додали хлороформ Суміш профільтрували крізь броунмілерит і випарили у вакуумі, отримавшій 8,03г масла, до якого додали 80мл мурашиної кислоти, і суміш нагрівали до 80°С протягом 1,5 години Надлишок мурашиної кислоти видалили у вакуумі Залишок перемішали з водою та розчин підлуговували додаванням гідроксиду натрія Продукт було відфільтровано, промито водою і висушено Приклад 35 5-ціано-1-(3-(2-тіазоліл)феніл)бензимідазол (35) було синтезовано як у прикладі 34 використовуючи замість 5-ацетил-1 -(3бромфеніл)бензимідазола 2,0г (5,9ммоль) 31,100мг (0,14ммоль) (PPh)2PdCI2 та 3,6г (9,7ммоль) 2-(трибутилстаніл)тіазолу Реакцією було отримано 1,5г (86%) 5-ціано-1-(3-(2тіазоліл)феніл)бензимідазола Приклад 36 4-(3-нітрофеніл)піримідин (36) Суміш 10,0г (64ммоль) 4-фенілпіримідина та ЗЗмл концентрованої N2804 додали до суміші 22мл концентрованої H2SO4 та 16мл концентрованої НМОз при 0°С Отриману суміш перемішували при 0°С 2 години, виливали на розколотий лід та екстрагували дихлорметаном Екстракт промивали 5% розчином у воді Nah-ІССз, сушили MgSC^ і концентрували під зниженим тиском Залишок розтирали з ізопропанолом і осад відфільтровували і сушили під зниженим тиском, отримуючи 6,4г (50%) 36 Приклад 37 4-(3-амшофеніл)піримідин (371 До суспензії 6,3г (Зіммоль) 36 у суміші 60мл МеОН та ЗОмл ТГФ додали ЗООмг 5% паладія на активованому вугіллі, суміш гідрували при звичайному тиску 1 годину, фільтрували і концентрували при зниженому тиску Залишок очищали на хроматографічній силікагелевій колонці з етилацетатом та гексаном (1 3) в якості елюєнта з отриманням 5,1г (96%) 37 Приклад 38 26 г\І-(3-(4-піримідил)феніл)-4-ціано-2-нггроанілін (38) До суміші 5,5г (ЗОммоль) 37 та 5,1г (ЗОммоль) 4-хлор-З-нітробензонітрила у 120мл ТГФ додали 2,3г 50% суспензії пдрида натрія у мінеральному маслі Після перемішування протягом 2 діб при кімнатній температурі суміш виливали у воду та екстрагували дихлорметаном Екстракт концентрували під зниженим тиском і розтирали залишок з діетиловим етером, одержуючи 9,2г (96%) кристалічного 38 Приклад 39 І\І-(3-(4-піримідил)феніл)-4-ціано-2-аміноанілін (39) було синтезовано як описано у прикладі 37, використовуючи замість 4-(3нітрофеніл)піримідина 9,2г (29ммоль) 38 та 600г каталізатора Реакцією було КІЛЬКІСНО отримано 8,3г 38, Приклад 40 5-ціано-1-(3-(4піримідиніл)феніл)бензимідазол(40) Суміш 3,0г (Юммоль) 39 та 20мл мурашиної кислоти перемішували при 110°С 1 годину і концентрували у вакуумі Залишок розподіляли поміж 5% водним розчином МаНСОз та СН2СІ2 Органічну фазу сушили сульфатом магнія і видаляли розчинник випарюванням Залишок розтирали з етилацетатом, одержуючи 2,6г (85%) кристалічного 40 Приклад 41 5-форміл-1-(3-(4піримідиніл)феніл)бензимідазол (41 а) 2,2г нікеля Ренея було додано до розчину 3,9г 40 у суміші 48мл мурашиної кислоти та 18мл води Суміш перемішували при 100°С протягом 0,5 години під аргоном Після охолодження суміш профільтрували Фільтрат концентрували і розподіляли поміж 1М водним розчином NaHCO2 та етилацетатом Етилацетатний екстракт промивали розсолом, сушили та концентрували під зниженим тиском, одержуючи 2,7г (69%) кристалічного 41а 5-форміл-1 -(3-(2-тіазоліл)феніл)бензимідазол (41Ь) отримували аналогічно з 35, 5-форміл-1 -(3-(1 імідазоліл)феніл)бензимідазол (41с) отримували аналогічно з 32Ь 5-форміл-1-(3-(3-пюидил)Феніл)бензимідазол (41 d) отримували аналогічно з 32а Приклад 42 Оксим 5-форміл-1 -(3-(4піримідиніл)феніл)бензимідазола (42а) 2,7г 41а додавали до суміші ЮОмл етанола, 1,9г NbbOH.HCI (3 еквіваленти) та 1,3мл тріетила-мша (1 еквівалент) Суміш перемішували 1 годину при 60°С, охолодили до 0°С, відфільтрували осад, промили його водою і висушили під зниженим тиском, отримавши 2,2г (77%) 42а Оксим 5-форміл-1 -(3-(2тіазоліл)феніл)бензимідазола (42Ь) отримували аналогічно з 41Ь, Оксим 5-Форміл-1 -(3-(1 імідазоліл)феніл)бензимідазола (42с) отримували аналогічно з 41с, Оксим 5-форміл-1 -(3-(3піридил)феніл)бензимідазола (42d) отримували аналогічно з 41 d Приклад 43 5-(3-ізоксазоліл)-1 -(3-(4 27 піримідиніл)феніл)бензимідазол (43а) Суміш 2,1г 42а та 1,1г (1,2 еквівалента) N-хлорсукциніміда у 100мл ДМФ перемішували при 60°С протягом 0,5 години під аргоном При охолодженні льодом до реакційної суміші додали 25мл вшілброміда, далі по краплям протягом 1 години додавали 4,8мл (5 еквівалентів) тріетиламша у 15мл ДМФ Суміш перемішували при 0°С 3 години і при кімнатній температурі протягом ночі, потім вилили у воду і екстрагували етилацетатом Органічну фазу промили розсолом, висушили та концентрували під зниженим тиском Залишок очищали на хроматографічній силікагелевій колонці з дихлормета-ном та метанолом (ЗО 1) в якості елюєнта з отриманням 1,5г (64%) 5-(3-ізоксазоліл)-1-(3-(4піримідиніл)феніл)бензимідазола Температура плавління 214 - 215°С 5-(3-ізоксазоліл)-1 -(3-(2тіазоліл)феніл)бензимідазол (43Ь) отримували аналогічно з 42Ь температура плавління 157 158°С 5-(3-ізоксазоліл)-1 -(3-(1 імідазоліл)феніл)бензимідазол (43с) отримували аналогічно з 42с температура плавління 230 234°С 5-(3-ізоксазоліл)-1 -(3-(3піридил)Феніл)бензимідазол (43d) отримували аналогічно з 42d, температура плавління 208 210°С Приклад 44 5-ацетил-1 -(3-(3-піридил)феніл)бензимідазол (44а) 4-флуор-З-нітроацетофенон 200мл концентрованої сульфатної кислоти охолодили до 5°С і додали 20мл (154,76ммоль) 4-флуорацетофенона, не підіймаючи температуру вище 10°С Суміш охолодили до 0 - 5°С і порціями протягом 2 годин додавали 25г (247,146ммоль) нітрату калія, підтримуючи температуру 0 - 5°С Далі суміш при цій температурі перемішували ще 2 години, виливали на 600г льоду і відфільтровували сирий продукт Очищенням на хроматографічній силікагелевій колонці з етилацетатом та петролейним етером (1 9) в якості елюєнта отримували 18,19г (60%) чистого 4-флуор-З-нітроацетофенона 3-(3-піридил)нітробензол До 8,53г (54ммоль%) 3-бромпіридина у 180мл ди-метилового етера етиленгліколя додавали 10г (59,95ммоль) 3нітрофенілборонової кислоти, 90мл 1М водного карбоната калія та 0,5г (0,43ммоль) тетракіс(трифенілфосфш)паладія Суміш обережно гріли зі зворотним холодильником протягом ночі під струмом азоту Після охолодження суміш профільтрували і до фільтрату додали 600мл води Осад відфільтрували і промили водою Цей сирий продукт розчинили у 400мл гарячої води з додаванням 25мл 4М соляної кислоти Суміш фільтрували гарячою Фільтрат охолоджували на льодяній бані і осаджували чистий 3-(3-піридил)нітробензол додаванням 12М NaOH Вихід 9,14г (85%) 3-(3-піридил)анілін 9,1г (45,5ммоль) 3-(3піридил)нітробензола у 125мл етанола гідрували при звичайному тиску 1,75 години, використовуючи нікель Ренея як каталізатор Фільтрацією отриманого розчину крізь броунмілерит з наступним випарюванням розчинника КІЛЬКІСНО отримано 3 54393 28 (З-піридил)анілш 4-ацетил-2-нггро-г\І-(3-(3-піридил)феніл)анілін Суміш 5г (27,3ммоль) 4-флуор-Знітроацетофенона та 4,62г (27,2ммоль) 3-(3піридил)анілша у Юмл сухого ІЧ-метил-2піролідона нагрівали до 40 - 50°С протягом ночі Отриману тверду реакційну суміш суспендували у 50мл води та підлуговували 1М МаНСОз Продукт відфільтровували, промивали водою та сушили, отримуючи 7,68г (85%) 4-ацетил-2-нггро-г\І-(3-(3піридил)феніл)аніліна 5-ацетил-2-(3-(3-піридил)феніл)аміноанілш 2г (бммоль) 4-ацетил-2-нггро-г\І-(3-(3піридил)феніл)аніліна суспендували у суміші 50мл етанола та 10мл дихлорэтана та гідрували при звичайному тиску, використовуючи як каталізатор 5% паладій на активованому вугіллі Фільтрацією отриманого розчину крізь броунмілерит з наступним випарюванням розчинника одержали масло, яке після розтирання з сумішшю діетилового та петролейного етерів (1 1) дала 1,46г (80%) чистого 5-ацетил-2-(3-(3-піридил)феніл)аміноанілша 5-ацетил-1-(3-(3-піридил)феніл)бензимідазол 5г (16,5ммоль) 5-ацетил-2-(3-(3піридил)феніл)аміноанілша у 50мл мурашиної кислоти перемішували 1,5 години при 90°С Охолоджену реакційну суміш підлуговували 12 М NaOH 5-ацетил-1-(3-(3-піридил)феніл)бензимідазол відфільтровували, промивали водою та сушили Вихід КІЛЬКІСНИЙ, температура плавління 195 - 97°С 5-ацетил-1-(3-(4піримідиніл)феніл)бензимідазол (44Ь) Приклад 45 5-(5-ізоксазоліл)-1 -(3-(4піримідиніл)феніл)бензимідазол (45а) було отримано так 5-(3-диметиламшо-1 -оксо-2-пропен-1 -іл)-1 -(3(4-піримідиніл)феніл)бензимідазол 314мг (44Ь) реагували з 1,5мл диметилацеталя ДМФ у Змл ДМФ протягом 5 годин при 120°С під шаром аргона Після охолодження суміш вилили у воду та екстрагували етилацетатом Органічну фазу промили розсолом, висушили та концентрували під зниженим тиском Залишок очищали на хроматографічній силікагелевій колонці з дихлорметаном та метанолом (ЗО 1) в якості елюєнта з отриманням 320мг (87%) 5-(3-диметиламшо-1-оксо-2пропен-1-іл)-1-(3-(4піримідиніл)феніл)бензимідазола 5-(5-ізоксазоліл)-1 -(3-(4піримідиніл)феніл)бензимідазол Суміш 307мг5-(3диметиламшо-1 -оксо-2-пропен-1 -іл)-1 -(3-(4піримідиніл)феніл)бензимідазола та 135мг (2,5 еквіваленти) у 14мл метанола перемішували протягом 2 годин при 80°С Після охолодження суміш вилили у воду та екстрагували етилацетатом Органічну фазу промили розсолом, висушили та концентрували під зниженим тиском Залишок очищали хроматографічне (дихлорметан та метанол (40 1, по об'єму) в якості елюєнта) з отриманням 226мг (80%) 5-(5-ізоксазоліл)-1-(3-(4піримідиніл)феніл)бензимідазола 5-(5-ізоксазоліл)-1 -(3-(2тіазоліл)Феніл)бензимідазол (45Ь) було отримано аналогічно з 34 температура плавління 186 29 54393 5-(5-ізоксазоліл)-1-(3-(3піридил)феніл)бензимідазол (45с) було отримано аналогічно з 44а, температура плавління 218 ЗО 219°С Сполуки, отримані у вищенаведених прикладах представлено у наступних таблицях 1 та 2 Таблиця 1 № спол 9с 9h 9] 9k 9І 9m 9n 9o 9p 9b 9N 9M 9f 9q 9r 9s 9t 18b 18c D Ar 1-імідазоліл 2 - (диметиламшо)-5-піримідил 2-метил-1-імідазоліл 1-піроліл 2-амшо-5-піримідил 2-(диметиламшо)-5-піримідил 1-піроліл 1-імідазоліл 2-амшо-5-піримідил 5-піримідил 2-метил-4-тіазоліл 1-піразоліл 2-піридил 3-фураніл 3-(2-піридил)-оксадіазол-5-іл З-циклопропілоксадіазол-5-іл 2-тіазоліл 1-імідазоліл 1-імідазоліл Таблиця 2 ізоксазол-заміщ Т пл (С°) Приклад ділянка 5-піримідил 3 214-215 43 3-піридил 3 208-210 43 2-тіазоліл 3 157-158 43 1 -імідазоліл 3 230 - 234 43 2-тіазоліл 5 186-188 45 3-піридил 5 218-219 45 Аг А в фуранзаміщ ділянка СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН N СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН N СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН СН N СН 3 3 3 3 2 2 2 2 3 3 3 3 2 3 3 3 3 3 3 Тпл (С°) 203 - 204 183-184 105-107 144-145 220 - 222 170-172 137-139 175-177 222 - 223 216-218 136-138 170-173 135-136 149-150 183-186 144-146 102-105 294 - 296 170-173 Прикл 15 15 15 15 15 15 15 15 15 12 12 12 12 12 22 22 19 15 15 54393 31 32 NHX •v^^^NPt .n В и В .О кислота Л R11* ""В X - гідроген чи ацетил , А, 8, D, та R11 визначено у формулі винаходе а каталізатор -тетракіс{трифенілфосфін)паладій(0). 33 54393 34 NO, NO, NH A . V NO, К ^ r v . ^NH, ВІДНОВЛ. NH • A ^ ^ ^ N H « a A Мурашина кислота NH D 1 A В В О Фуранїлборонова кислота Каталіз. > ^ D A R" А В, D, R В позначено у формулі винаходу, а каталізатор Тетракіс(трифенілфосфін)паладій(0) n" в 35 36 Hal фуранілборонова Г Г кислота NO. NHAc NO. Катал. NH, NHAc NH» Y B' 1) Y - галоген кислот al, каталіз. 2JY-COOH А, і, та R11 позначено у формулі винаходу, Hal - галоген, Y - r ІЛОГЄН або карбоксил, fl°-алкіл.феніл.або гетероарил, D, A, 8, та Я позначено у формулі винаходу. Підписано до друку 03 04 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole compounds, pharmaceutical composition containing them, and a method for treatment of gaba-receptor complex of central nervous system disorders sensitive to positive modulation
Автори англійськоюTeuber Lene, Wotjen Frank
Назва патенту російськоюСоединения бензимидазола, фармацевтические композиции, содержащие эти соединения и способ лечения чувствительных к положительной модуляции гамк-рецепторных комплексов расстройств цнс
Автори російськоюТеубер Лене, Ветьен Франк
МПК / Мітки
МПК: A61K 31/4439, C07D 405/14, A61K 31/4184, A61P 25/08, A61P 25/20, A61K 31/44, A61P 25/22, C07D 409/10, C07D 417/14, A61P 25/28, C07D 403/14, C07D 235/06, A61P 25/00, C07D 401/14, C07D 413/14, A61K 31/443, A61K 31/4427, A61K 31/505, C07D 403/10, C07D 405/10, A61K 31/506, A61K 31/501, C07D 417/10, A61K 31/415, C07D 401/10, C07D 521/00, A61P 43/00
Мітки: спосіб, фармацевтичні, сполуки, бензимідазолу, позитивної, модуляції, містять, комплексів, чутливих, розладів, лікування, композиції, гамк-рецепторних, цнс
Код посилання
<a href="https://ua.patents.su/21-54393-spoluki-benzimidazolu-farmacevtichni-kompozici-shho-mistyat-ci-spoluki-ta-sposib-likuvannya-chutlivikh-do-pozitivno-modulyaci-gamk-receptornikh-kompleksiv-rozladiv-cns.html" target="_blank" rel="follow" title="База патентів України">Сполуки бензимідазолу, фармацевтичні композиції, що містять ці сполуки, та спосіб лікування чутливих до позитивної модуляції гамк-рецепторних комплексів розладів цнс</a>
Попередній патент: Фармацевтична композиція та спосіб запобігання чи лікування віл-інфекції у ссавця
Наступний патент: Засіб “комплар” у формі супозиторіїв для лікування деструктивно-запальних процесів в товстій кишці
Випадковий патент: Верстат-гексапод