Кристали інгібітора натрій-водневого обміну 1 типу, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та спосіб зменшення пошкодження тканини
Номер патенту: 72002
Опубліковано: 17.01.2005
Автори: Оррілл Сьюзан Лі, Бростром Лайл Робінсон, Лі Зенг Джейн, Шах Бхарат Кіріткумар, Коннолі Терренс Джозеф
Формула / Реферат
1. Кристалічна форма солі, що має формулу І
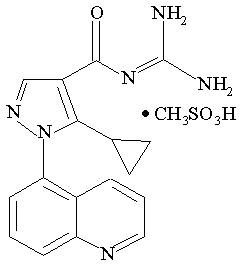 I.
I.
2. Кристалічна сполука, яка являє собою мономезилат N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину.
3. Кристалічна сполука за п. 1, яка являє собою безводний мономезилат N-(5-циклопропіл-1-хінолін-5-іл-1Η-піразол-4-карбоніл)гуанідину.
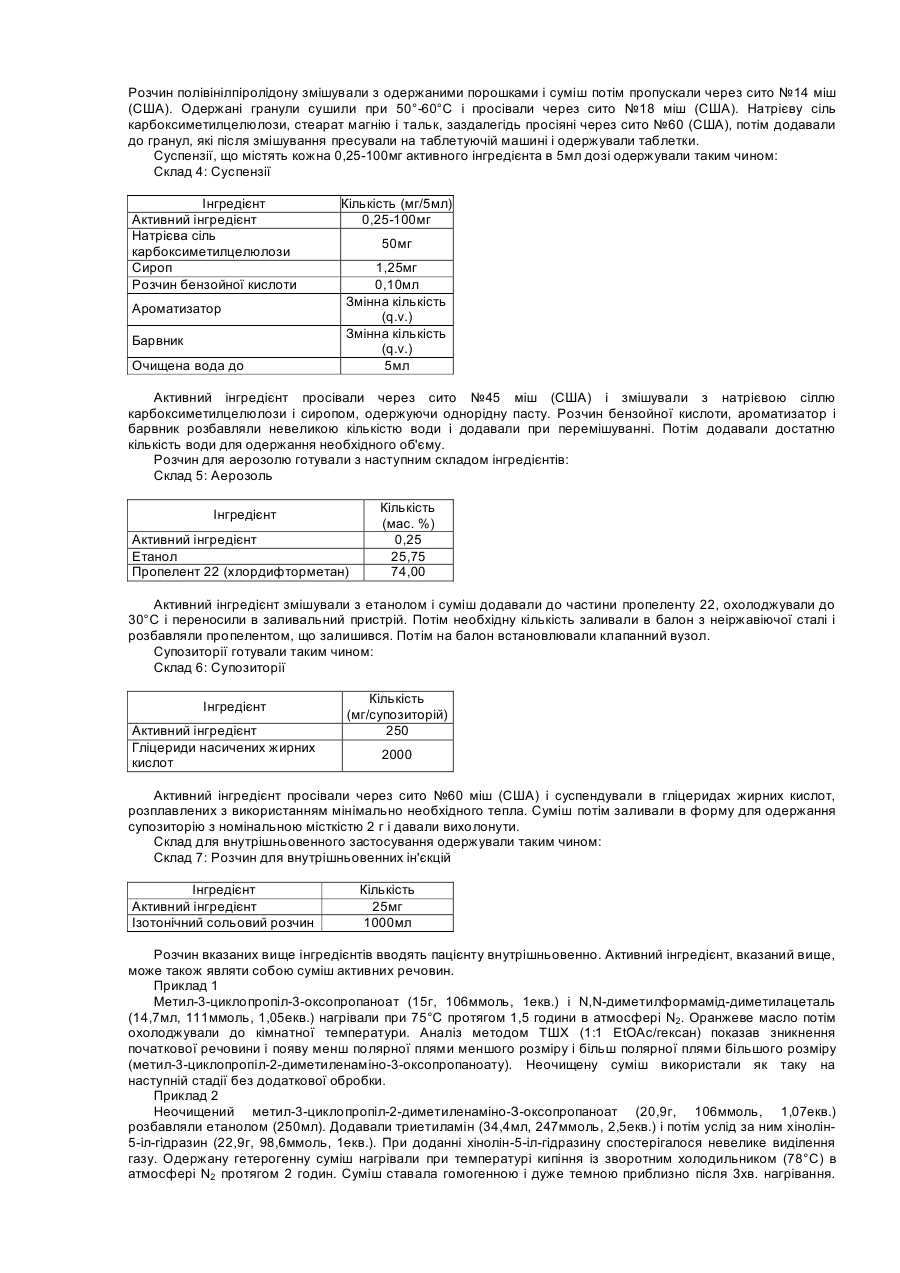
4. Кристалічна сполука за п. 1, яка являє собою безводний мономезилат N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину (форма D), що має наступну рентгенограму
Форма D
Анод: Сu - довжина хвилі 1: 1,54056, довжина хвилі 2: 1,54439 (відносна інтенсивність: 0,500)
Інтервал #1 - об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 с; згладжена ширина піка 0,300; поріг 1,0
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
![]()
27,24671
2,8
5,99091
6,0
4,00874
26,0
23,73093
2,2
5,63525
25,5
3,92839
6,2
16,16249
100,0
5,47164
11,5
3,69629
10,3
13,22989
1,7
5,27699
39,9
3,60428
7,4
11,97180
1,5
5,17064
18,3
3,55640
23,3
8,70523
1,2
5,03666
22,4
3,47039
9,6
8,06940
6,9
4,81802
24,0
3,40872
12,2
7,82513
7,2
4,46748
17,0
3,35011
12,3
7,25205
8,4
4,17294
62,7
3,26503
3,6
6,70670
10,2
4,06613
10,7
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
3,21953
5,2
2,58367
2,4
3,13686
4,7
2,55540
2,3
3,09315
2,5
2,51395
3,1
2,98181
10,2
2,46750
2,4
2,91078
4,2
2,40342
2,1
2,85527
3,6
2,36976
2,5
2,73317
3,4
2,33468
4,3
2,68209
5,6
2,30520
2,6
2,64423
2,6
2,26652
1,5.
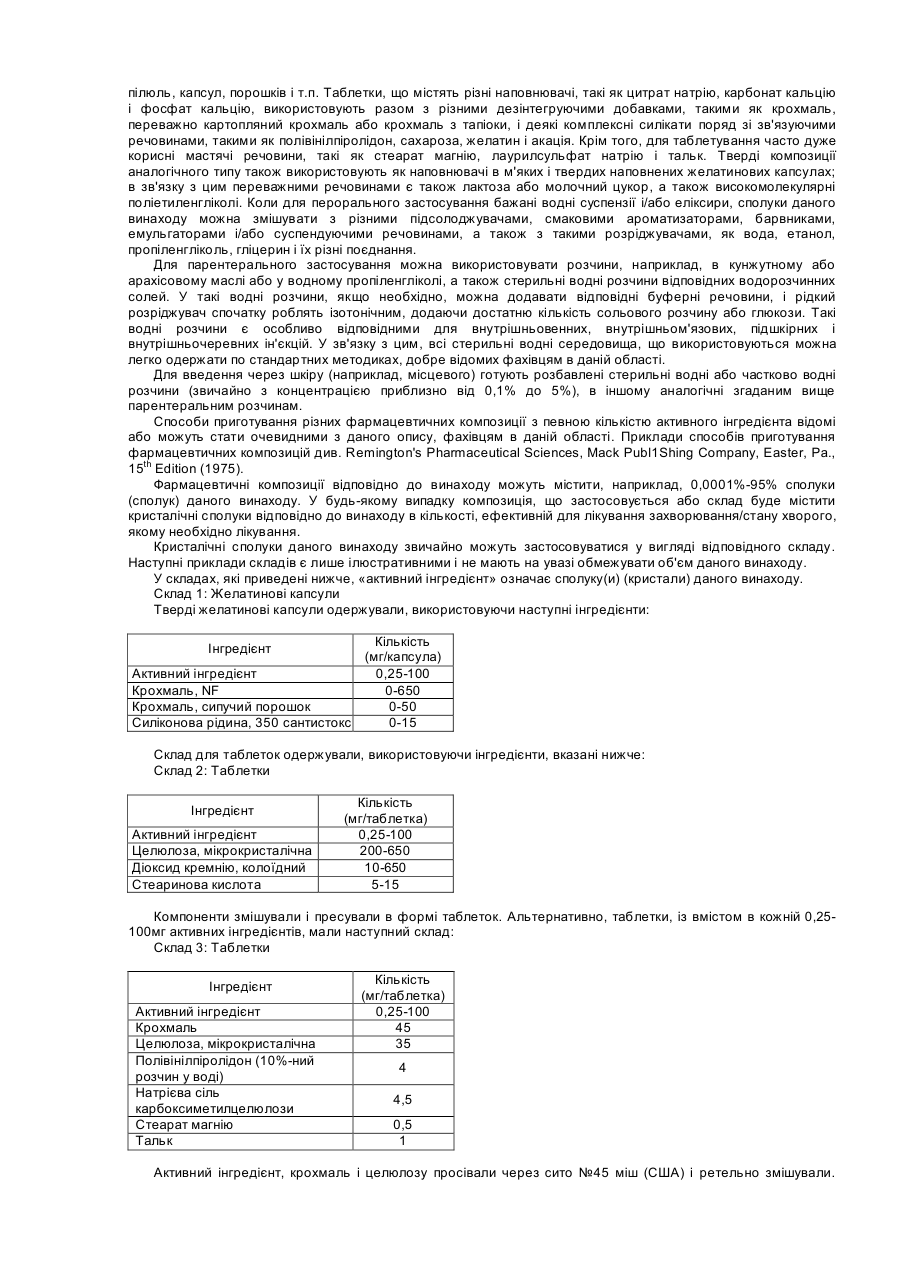
5. Кристалічна сполука за п. 1, яка являє собою безводний мономезилат N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину (форма А), що має наступну рентгенограму
Форма А
Анод: Сu - довжина хвилі 1: 1,54056, довжина хвилі 2: 1,5443 (відносна інтенсивність: 0,500)
Інтервал #1 - об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 с; згладжена ширина піка 0,300; поріг 1,0
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
![]()
12,78805
75,6
5,98486
14,5
4,40968
9,1
10,11984
0,9
5,74817
7,7
4,26077
35,9
9,54998
1,0
5,44162
25,8
3,99060
100,0
8,48106
10,5
5,17467
6,2
3,70101
9,6
8,06059
32,3
4,88694
19,8
3,56895
10,0
7,40035
3,7
4,80505
6,4
3,45647
18,9
6,90891
9,9
4,71329
12,3
3,39599
4,3
6,78458
7,1
4,64163
8,3
3,28501
14,3
6,39441
37,1
4,47485
17,2
3,19673
8.2
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
3,13360
28,1
2,64749
3,2
3,05819
7,2
2,58618
5,7
2,98863
6,2
2,55874
3,4
2,92559
4,5
2,51058
3,5
2,90063
3,7
2,44154
3,9
2,87377
3,5
2,37704
2,5
2,80412
3,0
2,31951
3,9
2,67941
5,6
2,29666
3,1.
6. Кристалічна сполука за п. 1, яка являє собою напівгідрат мономезилату N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину.
7. Спосіб одержання кристалічної сполуки за п. 4, який включає змішування ацетонового розчину N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину і N-метилпіролідону з метансульфокислотою при температурі від приблизно 30°С до приблизно 60°С і подальше охолоджування до температури від приблизно кімнатної температури до приблизно 35°С.
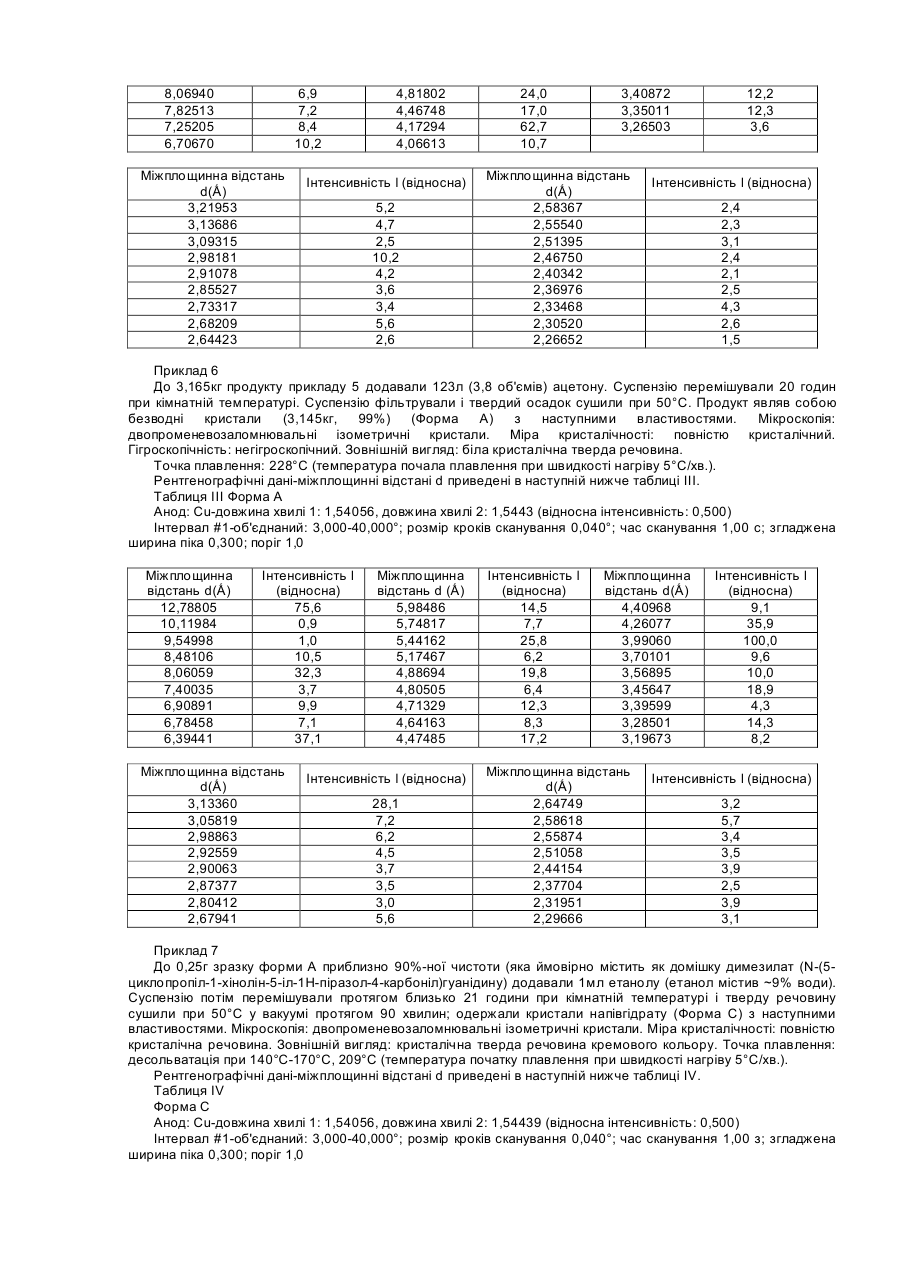
8. Спосіб одержання кристалічної сполуки за п. 5, що включає повторне суспендування безводної кристалічної сполуки форми (D) в ацетоні при температурі від приблизно 20°С до приблизно 25°С, в якому вказана безводна кристалічна сполука форми D має наступну рентгенограму:
Форма D
Анод: Сu - довжина хвилі 1: 1,54056, довжина хвилі 2: 1,54439 (відносна інтенсивність: 0,500)
Інтервал #1 - об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 с; згладжена ширина піка 0,300; поріг 1,0
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
![]()
27,24671
2,8
5,99091
6,0
4,00874
26,0
23,73093
2,2
5,63525
25,5
3,92839
6,2
16,16249
100,0
5,47164
11,5
3,69629
10,3
13,22989
1,7
5,27699
39,9
3,60428
7,4
11,97180
1,5
5,17064
18,3
3,55640
23,3
8,70523
1,2
5,03666
22,4
3,47039
9,6
8,06940
6,9
4,81802
24,0
3,40872
12,2
7,82513
7,2
4,46748
17,0
3,35011
12,3
7,25205
8,4
4,17294
62,7
3,26503
3,6
6,70670
10,2
4,06613
10,7
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
3,21953
5,2
2,58367
2,4
3,13686
4,7
2,55540
2,3
3,09315
2,5
2,51395
3,1
2,98181
10,2
2,46750
2,4
2,91078
4,2
2,40342
2,1
2,85527
3,6
2,36976
2,5
2,73317
3,4
2,33468
4,3
2,68209
5,6
2,30520
2,6
2,64423
2,6
2,26652
1,5.
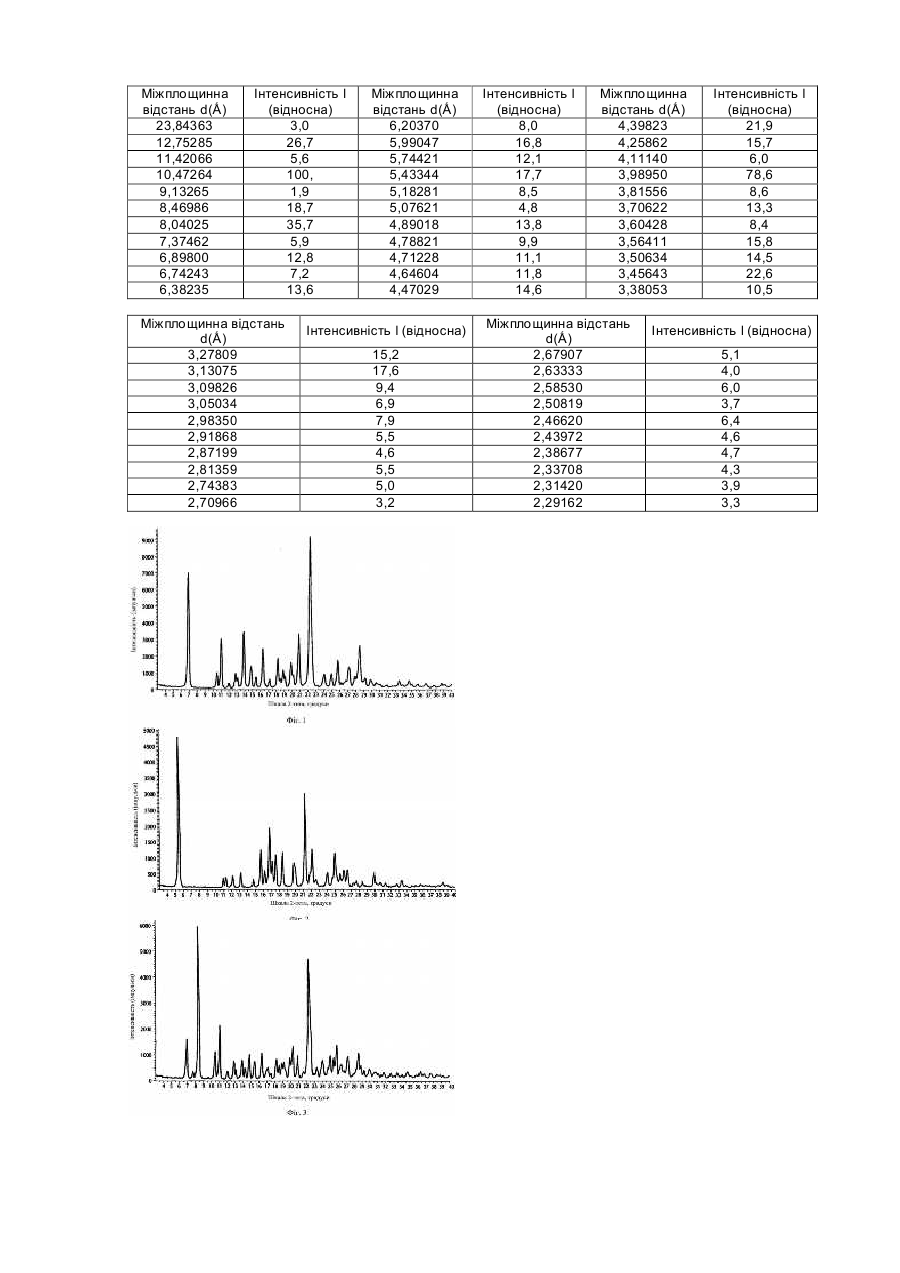
9. Спосіб одержання кристалічної сполуки за п. 6, що включає повторне суспендування безводної кристалічної сполуки форми А в етанолі або суміші ізопропанол/вода при температурі від приблизно 20°С до приблизно 25°С, в якому вказана безводна кристалічна сполука форми А має наступну рентгенограму
Форма А
Анод: Сu - довжина хвилі 1: 1,54056, довжина хвилі 2: 1,5443 (відносна інтенсивність: 0,500)
Інтервал #1 - об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 с; згладжена ширина піка 0,300; поріг 1,0
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
![]()
12,78805
75,6
5,98486
14,5
4,40968
9,1
10,11984
0,9
5,74817
7,7
4,26077
35,9
9,54998
1,0
5,44162
25,8
3,99060
100,0
8,48106
10,5
5,17467
6,2
3,70101
9,6
8,06059
32,3
4,88694
19,8
3,56895
10,0
7,40035
3,7
4,80505
6,4
3,45647
18,9
6,90891
9,9
4,71329
12,3
3,39599
4,3
6,78458
7,1
4,64163
8,3
3,28501
14,3
6,39441
37,1
4,47485
17,2
3,19673
8,2
Міжплощинна відстань
Інтенсивність 1 (відносна)
Міжплощинна відстань
Інтенсивність 1 (відносна)
![]()
![]()
3,13360
28,1
2,64749
3,2
3,05819
7,2
2,58618
5,7
2,98863
6,2
2,55874
3,4
2,92559
4,5
2,51058
3,5
2,90063
3,7
2,44154
3,9
2,87377
3,5
2,37704
2,5
2,80412
3,0
2,31951
3,9
2,67941
5,6
2,29666
3,1.
10. Спосіб за п. 9, в якому інтервал концентрацій складає від приблизно 85 % до приблизно 95 % етанолу і від приблизно 5 % до приблизно 15 % води.
11. Напівгідрат мономезилату N-[5-циклопропіл-1-(хінолін-5-іл)-1Н-піразол-4-карбоніл]гуанідину.
12. Спосіб зменшення пошкодження тканини внаслідок ішемії або гіпоксії, що включає введення ссавцеві, потребуючому такого лікування, терапевтичнo ефективної кількості фармацевтичної композиції, де вказана композиція містить кристалічну сполуку за п. 1 і фармацевтичнo прийнятний носій, розчинник або розріджувач.
13. Спосіб за п. 12, в якому тканина являє собою тканину серця, мозку, печінки, нирки, легенів, кишки, скелетного м'яза, селезінки, підшлункової залози, нерва, спинного мозку, сітчатки, судинну або інтестинальну тканину.
14. Спосіб за п. 13, в якому кількість кристалічної сполуки формули І складає від приблизно 0,01 мг/кг на добу до приблизно 10 мг/кг на добу.
15. Спосіб за п. 14, в якому ссавцем є людина жіночої або чоловічої статі.
16. Спосіб за п. 15, в якому вказана тканина являє собою тканину серця.
17. Спосіб за п. 15, в якому вказана тканина являє собою тканину мозку.
18. Спосіб за п. 15, в якому вказана тканина являє собою тканину печінки.
19. Спосіб за п. 15, в якому вказана тканина являє собою тканину нирок.
20. Спосіб за п. 15, в якому вказана тканина являє собою тканину легких.
21. Спосіб за п. 15, в якому вказана тканина являє собою тканину кишок.
22. Спосіб за п. 15, в якому вказана тканина являє собою тканину скелетних м'язів.
23. Спосіб за п. 15, в якому вказана тканина являє собою тканину селезінки.
24. Спосіб за п. 15, в якому вказана тканина являє собою тканину підшлункової залози.
25. Спосіб за п. 15, в якому вказана тканина представляє собою тканину сітчатки.
26. Спосіб за п. 15, в якому сполуки застосовують профілактично.
27. Спосіб за п. 15, в якому фармацевтичну композицію вводять перед хірургічною операцією.
28. Спосіб за п. 15, в якому фармацевтичну композицію вводять перед хірургічною операцією на серці.
29. Спосіб за п. 15, в якому фармацевтичну композицію вводять під час хірургічної операції.
30. Спосіб за п. 15, в якому фармацевтичну композицію вводять під час хірургічної операції на серці.
31. Спосіб за п. 15, в якому фармацевтичну композицію вводять в межах двадцяти чотирьох годин після хірургічної операції.
32. Спосіб за п. 15, в якому фармацевтичну композицію вводять в межах двадцяти чотирьох годин після хірургічної операції на серці.
33. Спосіб за п. 15, в якому пошкодження тканини внаслідок ішемії є ішемічним пошкодженням і відбувається під час трансплантації органу.
34. Спосіб за п. 15, в якому фармацевтичну композицію вводять, щоб запобігти ішемічному пошкодженню міокарда при операції.
35. Фармацевтична композиція, яка містить терапевтично ефективну кількість кристалічної сполуки за п. 1 і фармацевтично прийнятний носій, розчинник або розріджувач.
36. Фармацевтична композиція для зменшення пошкодження тканини внаслідок ішемії або гіпоксії, яка містить терапевтично ефективну кількість кристалічної сполуки за п. 1 і фармацевтично прийнятний носій, розчинник або розріджувач.
37. Спосіб за п. 15, в якому фармацевтичну композицію вводять до, під час і після хірургічної операції.
38. Спосіб за п. 15, в якому фармацевтичну композицію вводять до, під час і після хірургічної операції на серці.
Текст
Даний винахід відноситься до інгібіторів натрій-водневого обміну 1 типу (NHE-1) і особливо до кристалів таких інгібіторів. Ішемічне пошкодження міокарда може відбуватися в амбулаторних хворих, а також в умовах, пов'язаних з операцією, і може привести до раптової смерті, до розвитку інфаркту міокарда або до застійної серцевої недостатності. Існує незадоволена потреба в лікарських препаратах, які запобігають або зводять до мінімуму ішемічне пошкодження міокарда, особливо інфаркт міокарда, пов'язані з операцією. Така терапія повинна бути попереджувальною, щоб зберегти життя і зменшити необхідність в госпіталізації, підвищити якість життя і скоротити загальні витрати на медичну допомогу хворим з високим ризиком. Фармакологічний захист серця може зменшити частоту випадків виникнення і розвитку інфаркту міокарда і дисфункції міокарда, виникаючих в умовах проведення хірургічної операції (періоперативно). Крім зменшення пошкодження міокарда і поліпшення постішемічної функції міокарда у пацієнтів з ішемічною хворобою серця, захист серця може також знизити частоту випадків серцевих захворювань і смертність внаслідок інфаркту міокарда і дисфункції міокарда у пацієнтів «групи ризику» (старше за 65 років, що не переносять фізичного навантаження, із захворюваннями аорти, хворих діабетом і гіпертензією), яким потрібна хірургічна операція не на серці. Механізм(и), відповідальний(і) за пошкодження міокарда, ті, що спостерігаються після ішемії і реперфузії не повністю зрозумілі. У різних публікаціях описане застосування похідних гуанідину для лікування, наприклад, аритмії. У недавно опублікованій Міжнародній заявці РСТЛВ99/00206, опублікованої 2 вересня 1999р. як WO99/43663, основний зміст якої включений в дану заявку як посилання, описані різні інгібітори NHE-1, в тому числі [5-циклопропіл-1-(хінолін-5-іл)-1H-піразол-4-карбоніл]гуанідин. У публікації, крім того, указано, що «переважними солями безпосередньо попередньої сполуки є моно-або димезилати». У Міжнародній заявці PCT/JP97/04650, опублікованій 25 червня 1998р. описані похідні N-[(заміщений п'ятичленний гетероарил)]гуанідину, які, як указано, застосовні як інгібітори обміну Na+/H+ і отже, ефективні для лікування різних захворювань, таких як гіпертензія, аритмія, стенокардія, інфаркт міокарда, артеріосклероз і ускладнення при діабеті. Таким чином, очевидна необхідність постійного пошуку в даній області сполук для лікування ішемії міокарда, виникаючій в зв'язку з операцією, і відповідно нових кристалічних форм таких сполук. Даний винахід направлений на кристалічну сполуку формули І Альтернативно, приведена вище сіль називається мономезилат N-(5-циклопропіл-1-хінолін-5-іл-1Hпіразол-4-карбоніл)гуанідину. Інший аспект даного винаходу направлений на безводну кристалічну форму солі формули І. Ще один аспект даного винаходу направлений на безводну кристалічну форму А солі формули І, що має рентгенографічні міжплощінні відстані d, приведені нижче в таблиці III. Ще один аспект даного винаходу направлений на безводну кристалічну форму А солі формули І, що має порошкову рентгенограму, показану на фігурі 1. Ще один аспект даного винаходу направлений на безводну кристалічну форму D солі формули І, що має рентгенографічні міжплощинні відстані d, приведені нижче в таблиці II. Ще один аспект даного винаходу направлений на безводну кристалічну форму D солі формули І, що має порошкову рентгенограму, показану на фігурі 2. Ще один аспект даного винаходу направлений на напівгідратну кристалічну форму солі формули І, що переважно має рентгенівські міжплощинні відстані d, приведені нижче в таблиці IV. Ще один аспект даного винаходу направлений на напівгідратну кристалічну форму солі формули І, що має порошкову рентгенограму, показану на фігурі 3. У тексті даної заявки, в тому числі в описаних далі способах, фармацевтичних композиціях, комбінаціях і наборах вживається вираз «кристал формули І» («кристалічна сполука формули І»). Хоча зрозуміло, що якщо кристал знаходиться в розчині, кристалічна форма відсутня (на відміну, наприклад, від сухої композиції для таблетки), однак приведені нижче способи, фармацевтичні композиції, комбінації і набори включають способи або композиції, в яких використовуються такі «кристали» (наприклад, застосування розчину для внутрішньовенного введення, приготованого з таких кристалів). Інший аспект даного винаходу являє собою спосіб лікування ссавців (наприклад, людини), що мають захворювання або що знаходяться в стані, які залежать від NHE-1, шляхом введення ссавцеві терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб зменшення пошкодження тканини (наприклад, попередження пошкодження тканини, включаючи захист тканини) внаслідок ішемії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі), потребуючому такого лікування, терапевтично ефективної кількості кристалічної сполуки формули І. Переважними ішемічними тканинами, що розглядаються по окремості або як група тканин, є ішемічні тканини серця, мозку, печінки, нирок, легенів, кишок, скелетних м'язів, селезінки, підшлункової залози, нерва, спинного мозку, сітчатки ока, кровоносні судини або кишкова тканина. Особливо переважною ішемічною тканиною є тканина серця. Особливо переважно, щоб кристалічну сполуку вводили для запобігання ішемічному пошкодженню міокарда, пов'язаного з операцією. Переважно, кристали даного винаходу застосовують профілактично. Ішемічне пошкодження може мати місце при трансплантації органу, або в органі, або у пацієнта. Переважно кристали даного винаходу вводять до, під час і/або незабаром після хірургічної операції на серці або хірургічній операції не на серці. В одному аспекті даного винаходу кристалічну сполуку формули І застосовують локально. Переважна доза кристалічної сполуки формули І складає приблизно від 0,001 до 100мг/кг на добу, особливо переважна доза кристалічної сполуки формули І складає приблизно від 0,01 до 50мг/кг на добу. Інший аспект даного винаходу направлений на спосіб зменшення пошкодження тканини серця (наприклад, запобігання, в основному, пошкодженню тканини шляхом стимулювання захисту тканини) під час хірургічної операції (наприклад, операції шунтування коронарної артерії (CABG), операцій на судинах,) ангіопластики для збільшення просвіту коронарних судин (РТСА), трансплантації органів, або інших операцій не на серці), що включає введення ссавцям (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб зменшення пошкодження серцевої тканини (наприклад, запобігання, в основному, пошкодженню тканини шляхом стимулювання захисту тканини) у пацієнтів з тими, що продовжуються випадками порушення серцевого кровообігу (синдроми гострої коронарної недостатності, наприклад, інфаркт міокарда або нестабільна стенокардія) або мозкового кровообігу (наприклад, інсульт), що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб, що постійно застосовується, зменшення пошкодження серцевої тканини (наприклад, запобігання, в основному, пошкодженню тканини шляхом стимулювання захисту тканини) у пацієнтів з діагностованою коронарною хворобою серця (наприклад, раніше перенесений інфаркт міокарда або нестабільна стенокардія) або у пацієнтів з високим ризиком інфаркту міокарда (наприклад, вік >65 років і наявність двох або більше чинників ризику для коронарної хвороби серця), що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб запобігання ішемічному пошкодженню, що включає постійне пероральне введення ссавцеві, потребуючому такого лікування, терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування серцево-судинних захворювань, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування артеріосклерозу, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування гіпертензії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування аритмії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування стенокардії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування гіпертрофії серця, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування захворювань нирок, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування ускладнень при діабеті, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування рестенозу, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування захворювань, пов'язаних з проліферацією клітин, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування онкологічних захворювань, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування фіброзних захворювань, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування гломерулярного нефросклерозу, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування гіпертрофії або гіперплазії органів, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування фіброзу легенів, що включають введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування порушень мозкового кровообігу, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування зупинки серця (myocardial stunning), що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули Т. Ще один аспект даного винаходу направлений на спосіб лікування дисфункції міокарда, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Ще один аспект даного винаходу направлений на спосіб лікування захворювань мозкових судин, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) терапевтично ефективної кількості кристалічної сполуки формули І. Даний винахід, крім того, направлений на фармацевтичні композиції, які містять терапевтично ефективну кількість кристалічної сполуки формули І і фармацевтично прийнятний носій, розчинник або розріджувач. Даний винахід також направлений на фармацевтичні композиції для зменшення пошкодження тканини, виникаючого внаслідок ішемії, які містять терапевтично ефективну кількість кристалічної сполуки формули І і фармацевтично прийнятний носій, розчинник або розріджувач. Ще одним аспектом даного винаходу є комбінації кристалічної сполуки формули І і інших сполук, як описано нижче. Ще один аспект даного винаходу направлений на терапевтично ефективні кількості фармацевтичної композиції, що містить кристалічне сполуки формули І і серцево-судинний засіб, і на застосування такої композиції для зменшення пошкодження внаслідок ішемії тканини у ссавців (наприклад, у людини чоловічої або жіночої статі). Ще одним аспектом даного винаходу є спосіб зменшення пошкодження тканини (наприклад, запобігання, в основному, пошкодження тканини шляхом стимулювання захисту тканини), яке є результатом або може бути результатом ішемії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) a. кристалічної сполуки формули І; і b. серцево-судинного засобу, де кількості першої і другої сполук дають терапевтичний ефект. Ще одним аспектом даного винаходу є набір, що містить: a. кристалічну сполуку формули І і фармацевтично прийнятний носій, розчинник або розріджувач в першій дозованій лікарській формі; b. серцево-судинний засіб і фармацевтично прийнятний носій, розчинник або розріджувач у другій дозованій лікарській формі; і c. засоби для вмісту в них вказаних першої і другої дозованих лікарських форм, де кількості першої і другої сполук дають терапевтичний ефект. У вказаних вище комбінованих композиціях, способах комбінування і наборах переважними серцевосудинними засобами є, наприклад, b-блокатори (наприклад, ацебутолол, атенолол, бопіндолол, лабетолол, мепіндолол, надолол, окспренол, піндолол, пропранолол, соталол), блокатори кальцієвих каналів (наприклад, амплодипін, ніфедипін, нізолдипін, нітрендипін, верапаміл), речовини, що відкривають калієві канали, аденозин, агоністи аденозину, інгібітори АСЕ (каптоприл, еналаприл), нітрат (наприклад, динітроизосорбід, 5мононітроізосорбід, тринітрогліцерин), діуретики (наприклад, гідрохлортіазид, індапамід, піретанід, ксипамід), глікозиди (наприклад, дигоксин, метилдигоксин), тромболітики (наприклад, tPA), інгібітори тромбоцитів (наприклад, реопро), аспірин, дипіридамол, хлорид калію, клонідин, празозин або агоністи рецептора аденозина А3. Даний винахід, крім того, направлений на фармацевтичну комбіновану композицію, що містить терапевтично ефективну кількість композиції, що містить першу сполуку, причому вказана перша сполука являє собою кристалічну сполуку формули І; друга сполука, причому вказана друга сполука являє собою інгібітор фосфорилази глікогену; і/або, необов'язково, фармацевтичний носій, розчинник або розріджувач. Ще один аспект даного винаходу являє собою спосіб зменшення пошкодження тканини (наприклад, запобігання в основному пошкодженню тканини шляхом стимулювання захисту тканини), яке є результатом або могло бути результатом ішемії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) a. першої сполуки, причому вказана перша сполука являє собою кристалічну сполуку формули І; b. другої сполуки, причому вказана друга сполука являє собою інгібітор фосфорилази глікогену, де кількості першої і другої сполуки дають терапевтичний ефект. Ще одним аспектом даного винаходу є набір, що містить: a. кристалічну сполуку формули І і фармацевтично прийнятний носій, розчинник або розріджувач в першій дозованій лікарській формі; b. інгібітор фосфорилази глікогену і фармацевтично прийнятний носій, розчинник або розріджувач у другій дозованій лікарській формі; і с засоби для вміщування в них вказаних першої і другої дозованих лікарських форм, де кількості першої і другої сполук дають терапевтичний ефект. У описаних вище комбінованих композиціях, способах комбінування і наборах переважними інгібіторами фосфорилази глікогену є наступні сполуки: [(1S)-((R)-гідроксидиметилкарбамоїл-метил)-2-фенілетил]-амід 5-хлор-1Н-індол-2-карбонової кислоти, {(1S)-[(R)-гідрокси-(метоксиметилкарбамоїл)-метил]-2-феніл-етил}-амід5,6-дихлор-1Н-індол-2-карбонової кислоти, {(1S)-[(R)-гідрокси-(метоксиметилкарбамоїл)-метил]-2-фенілетил}-амід5-хлор-1Н-індол-2-карбонової кислоти, ((1S)-{(R)-гідрокси-[(2-гідроксіетил)-метилкарбамоїл]-метил}-2-фенілетил)-амід5-хлор-1Н-індол-2карбонової кислоти, {(1S)-[(R)-гідрокси-(метилпіридин-2-іл-карбамоїл)-метил]-2-фенілетил}-амід5-хлор-1H-індол-2-карбонової кислоти, ((lS)-{(R)-гiдpoкcи-[мeтил-(2-пipiдин-2-iл-eтил)-кapбaмoїл]-мeтил}-2-фенілетил)-амід5-хлор-1H-індол-2карбоновоїкислоти, [(1S)-бензил-(2R)-гідрокси-3-(4-метилпіперазин-1-іл)-3-оксопропіл]-амідгідрохлорид5-хлор-1H-індол-2карбонової кислоти, [(1S)-бензил-(2R)-гідрокси-3-(3-гідроксіазетидин-1-іл)-3-оксопропіл]-амід5-хлор-1H-індол-2-карбонової кислоти, ((1S)-бензил-(2R)-гідрокси-3-ізоксазолідин-2-іл-3-оксопропіл)-амід5-хлор-1H-індол-2-карбонової кислоти, ((1S)-бензил-(2R)-гідрокси-3-[1,2]оксазинан-2-іл-3-оксопропіл)-амід5-хлор-1Н-індол-2-карбонової кислоти, [(1S)-бензил-(2R)-гідрокси-3-((3S)-гідроксипіролідин-1-іл)-3-оксопропіл]-амід5-хлор-1Н-індол-2-карбонової кислоти, [(1S)-бензил-3-((3S,4S)-дигідроксипіролідин-1-іл)-(2R)-гідрокси-3-оксопропіл]-амід5-хлор-1H-індол-2карбонової кислоти, [(1S)-бензил-3-((3R,4S)-дигідроксипіролідин-1-іл)-(2R)-гідрокси-3-оксопропіл]-амід5-хлор-1Н-індол-2карбонової кислоти, ((1S)-бензил-(2R)-гідрокси-3-морфолін-4-іл-3-оксопропіл)-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-бензил-2-(3-гідроксиімінопіролідін-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [2-(цис-3,4-дигідроксипіролідин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [2-((3S,4S)-дигідроксипіролідин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-бензил-2-(цис-3,4-дигідроксипіролідин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [2-(1,1-діоксотіазолідин-3-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, (2-оксо-2-тіазолідин-3-іл-етил)амід5-хлор-1Η-індол-2-карбонової кислоти, [(1S)-(4-фторбензил)-2-(4-гідроксипіперидин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-бензил-2-((3RS)-гідроксипіперидин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [2-оксо-2-((1RS)-оксо-1-тіазолідин-3-іл)-етил]-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-(2-фторбензил)-2-(4-гідроксипіперидин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-бензил-2-((3S,4S)-дигідроксипіролідин-1-іл)-2-оксоетил]-амід5-хлор-1H-індол-2-карбонової кислоти, [(1S)-бензил-2-(3-гідроксиазетидин-1-іл)-2-оксоетил]-амід5-хлор-1Η-індол-2-карбонової кислоти, [(1S)-бензил-2-(3-гідроксиіміноазетидин-1-іл)-2-оксоетил]-амід5-хлор-1Н-індол-2-карбонової кислоти і [(1S)-бензил-2-(4-гідроксіімінопіперидин-1-іл)-2-оксоетил]-амід5-хлор-1Н-індол-2-карбонової кислоти. Даний винахід, крім того, направлений на фармацевтичну комбіновану композицію, що містить терапевтично ефективну кількість композиції, що містить: першу сполуку, причому вказана перша сполука являє собою кристали формули І; другу сполуку, причому вказана друга сполука являє собою інгібітор альдозоредуктази; і/або, необов'язково, фармацевтично прийнятний носій, розчинник або розріджувач. Ще одним аспектом даного винаходу є спосіб зменшення пошкодження тканин (наприклад, запобігання в основному пошкодженню тканин шляхом стимулювання захисту тканини), яке є результатом або могло бути результатом ішемії, що включає введення ссавцеві (наприклад, людині жіночої або чоловічої статі) a. першої сполуки, причому вказана перша сполука являє собою кристалічну сполуку формули І; b. другої сполуки, причому вказана друга сполука являє собою інгібітор альдозоредуктази, де кількості першої і другої сполук дають терапевтичний ефект. Ще одним аспектом даного винаходу є набір, що містить: a. кристалічну сполуку формули І і фармацевтично прийнятний носій, розчинник або розріджувач в першій дозованій лікарській формі; b. інгібітор альдозоредуктази і фармацевтично прийнятний носій, розчинник або розріджувач у другій дозованій лікарській формі; і с. засоби для вміщування в них вказаних першої і другої дозованих лікарських форм, де кількості першої і другої сполук, що містяться дають терапевтичний ефект. В описаних вище комбінованих композиціях, способах комбінування і наборах переважним інгібітором альдозоредуктази є зополрестат: 3,4-дигідро-4-оксо-3-[[5-ірифторметил-2-бензотіазоліл]метил]-1фталазиноцтова кислота. Даний винахід також направлений на фармацевтичні композиції, які містять терапевтично ефективну кількість кристалічної сполуки формули І і фармацевтично прийнятний носій, розріджувач або наповнювач. Даний винахід також направлений на фармацевтичні композиції для зменшення пошкодження тканини внаслідок ішемії, які містять терапевтично ефективну кількість кристалічної сполуки формули І і фармацевтично прийнятний носій, розріджувач або наповнювач. Термін «зменшення» означає часткове запобігання або запобігання, яке, хоч і більше того, яке могло бути у випадку, якщо не застосовувати ніякої сполуки або застосовувати плацебо, але менше 100%, крім в основному повного запобігання. Термін «пошкодження внаслідок ішемії», що використовується в даному описі, відноситься до станів, безпосередньо пов'язаних із зменшенням притоку крові до тканини, наприклад через тромб або закупорку кровоносних судин, які забезпечують кров'ю тканину, що приводить, крім іншого, до зниження надходження кисню в таку тканину, погіршує функціональні властивості тканини і викликає дисфункцію і/або некроз тканини. У інших випадках, коли струм крові і кровопостачання органу можуть бути достатніми в кількісному відношенні, може поменшувати здатність крові переносити кисень, або погіршується середовище, в якому відбувається кровопостачання органу, наприклад в середовищі з недостатністю кисню, так що знижується надходження кисню в тканину, що спричиняє погіршення властивостей тканини, дисфункцію тканини і/або некроз тканини. Термін «лікування», «лікувати», що використовується в даному описі, включає в себе попереджуюче (наприклад, профілактичне) або паліативне лікування. «Фармацевтично прийнятний» означає, що носій, розріджувач, наповнювачі і/або сіль повинні бути сумісні з іншими інгредієнтами рецептури і не бути шкідливими для того, хто їх приймає. Вирази, що використовуються в даному описі, "інертний в реакції розчинник" і «інертний розчинник» вказують на розчинник або суміш розчинників, які не взаємодіють з початковими речовинами, реагентами, проміжними продуктами або кінцевими продуктами таким чином, щоб вони впливали негативним чином на вихід бажаного продукту. Визначено, що сполука даного винаходу може існувати в формі сполуки, міченого радіоізотопом, тобто сполука може містити один або більше атомів, що мають атомну масу або масове число, відмінну від атомної маси або масового числа атомів, що звичайно є в природі. Радіоізотоп водню, вуглеводу, фосфору, фтору і хлору включають 3Н, 14С, 32Р, 35S, 18F і 36Сl, відповідно. Сполука даного винаходу, яка містить такий радіоізотоп і/або інший радіоізотоп інших атомів, знаходиться в межах об'єму даного винаходу. Радіоізотопи тритій, тобто 3 Н і вуглець-14, тобто 14С, особливо переважні внаслідок легкості їх одержання і детектування. Мічену радіоізотопом сполуку формули І звичайно можна одержати способами, добре відомими фахівцями в даній області техніки. Такі мічені радіоізотопами сполуки можна зручно одержувати по методиках, описаних в схемах і/або прикладах, приведених нижче, шляхом заміни не міченого радіоізотопами реагенту на легко доступний мічений радіоізотопами реагент. Інші ознаки і переваги винаходу будуть очевидні з докладного опису і формули винаходу. На Фіг.1 представлена характерна порошкова рентгенограма, що показує, що форма А безводного мономезилату N-(5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл)гуанідину є кристалічною. (Вертикальна вісь: інтенсивність (імпульсів в секунду); горизонтальна вісь: кут два тети (градуси)). На Фіг.2 представлена характерна порошкова рентгенограма, що показує, що форма D безводного мономезилату N-(5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл)гуанідину є кристалічною. (Вертикальна вісь: інтенсивність (імпульсів в секунду); горизонтальна вісь: кут два тети (градуси)). На Фіг.3 представлена характерна порошкова рентгенограма форми С-напівгідрату мономезилату N-(5циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл)гуанідину. (Вертикальна вісь: інтенсивність (імпульси в секунду); горизонтальна вісь: кут два тети (градуси)). Загалом, кристалічні сполуки даного винаходу можуть бути одержані способами, аналогічними способам, відомим в хімічній технології, особливо в світлі приведеного тут опису. Деякі способи одержання кристалічних сполук даного винаходу є наступними ознаками винаходу і ілюструються наступною нижче реакційною схемою. Інші способи описані в експериментальній частині. Згідно з схемою І проводять реакцію сполуки формули II з надлишком сполуки формули III (Ν,Νдиметиламід диметилацеталь), необов'язково в присутності кислотного каталізатора, такого як птолуолсульфокислота, в чистих умовах, без розчинника при температурі від приблизно 50°С до приблизно 110°С протягом від приблизно однієї до приблизно п'яти годин, переважно при температурі від приблизно 70°С до приблизно 80°С протягом від приблизно однієї до приблизно двох годин, і в результаті одержують сполуку формули IV. Цю реакцію можна також провести в етилацетаті. Сполуку формули IV циклізують із сполукою формули V в інертному розчиннику, такому як етанол, переважно, в присутності основи-аміну, такого як триетиламін, при температурі від приблизно 50°С до приблизно температури кипіння із зворотним холодильником (78°С) протягом від приблизно 1 години до приблизно чотирьох годин і одержують сполуку піразолу формули VI. Дану реакцію можна також провести в етилацетаті і метанолі. Піразол формули VI гідролізують в присутності основи, такої як гідроксид натрію, в розчиннику, такому як метанол, зручніше, при кімнатній температурі або, переважно, при підвищеній температурі (наприклад при температурі кипіння із зворотним холодильником) протягом приблизно від однієї години до п'яти годин і одержують кислоту формули VII. Звичайно кислоту формули VII піддають конденсації (поєднанню) з гуанідином в присутності відповідного конденсуючого агента. Відповідним конденсуючим агентом є речовина, яка перетворює карбонову кислоту в реакційноздатну сполуку, яка утворює амідний зв'язок при реакції з аміном. Конденсуючим агентом може бути реагент, з яким така конденсація здійснюється в одностадійному процесі при змішуванні карбонової кислоти і гуанідину. Типовими конденсуючими реагентами є гідрохлорид 1(3-диметиламінопропіл)-3-етилкарбодііміду/гідроксибензотриазол (EDC/HOBT), дициклогексилкарбодіімід/гідроксибензотриазол (НОВТ), 2-етокси-1-етоксикарбоніл-1,2-дигідрохінолін (EEDQ) і діетилфосфорилціанід. Конденсацію здійснюють в інертному розчиннику, переважно в апротонному розчиннику, при температурі від приблизно -20°С до приблизно 50°С протягом від приблизно 1 до приблизно 48 годин, в присутності надлишку гуанідину як основи. Типовими розчинниками є ацетонітрил, дихлорметан, диметилформамід і хлороформ або їх суміші. Конденсуючий агент може бути реагентом, який перетворює карбонову кислоту в активований проміжний продукт, який виділяють і/або одержують на першій стадії і піддають реакції з гуанідином на другій стадії. Прикладами таких конденсуючих агентів і активованих проміжних продуктів є тіонілхлорид або оксалілхлорид, утворюючі хлорангідрид кислоти, ціанурфторид, утворюючий фторангідрид кислоти, або алкілхлорформіат, такий як ізобутил-або ізопропенілхлорформіат, або пропанфосфоновий ангідрид (ангідрид пропанфосфонової кислоти, РРА) (з третинним аміном як основа), утворюючий змішаний ангідрид карбонової кислоти або карбонілдіімідазол, утворюючий ацилімідазол. Якщо конденсуючим агентом є оксалілхлорид, доцільно використати невелику кількість диметилформаміду як співрозчинника з іншим розчинником (таким, як дихлорметан), щоб каталізувати утворення хлорангідриду кислоти. Одержане активоване похідне кислоти можна конденсувати шляхом змішування з проміжним продуктом у відповідному розчиннику разом з відповідною основою. Відповідними поєднаннями розчинник/основа є, наприклад, дихлорметан, диметилформамід або ацетонітрил, або їх суміші в присутності надлишку гуанідину як основи. Іншими відповідними поєднаннями розчинник/основа є вода або (С1-С5)-спирт або їх суміш, разом з співрозчинником, таким як дихлорметан, тетрагідрофуран або діоксан, і основа, така як гідроксид натрію, калію або літію в кількості, достатній, щоб зв'язати кислоту, що виділяється в ході реакції. Застосування таких конденсуючих агентів і правильний вибір розчинників і температур відомі фахівцям в даній області або їх можна легко визначити з літератури. Вказані і інші типові умови, що використовуються при конденсації карбонових кислот, описані в керівництві Houben-Weyl, Vol.XV, part II, E.Wunsch, Ed., G. Theime Verlag, 1974, Stuttgart; M. Bodansky, Principles of Peptide Synthes1S, Springer-Verlag, Berlin 1984; і The Peptides, Analysis, Synthesis and Biology (ed. E. Gross and J.Meienhofer), vols 1-5 (Academic Press, NY 1979-1983). У переважному варіанті здійснення винаходу, кислоту формули VII активують надлишком тіонілхлориду (наприклад, від 3 до 6еквівалентів) в апротонному розчиннику, такому як толуол, при температурі від приблизно 60°С до приблизно 90°С протягом приблизно від п'ятнадцяти хвилин до двох годин, переважно, при температурі приблизно 75°С протягом приблизно від однієї до двох годин. Одержаний активований хлорангідрид кислоти формули VIII в безводному тетрагідрофурані змішують з надлишком гуанідину гідрохлориду і з водним розчином неорганічної основи (наприклад, гідроксиду натрію) в безводному тетрагідрофурані при температурі від приблизно -20°С до приблизно 10°С, витримують від приблизно однієї години до приблизно трьох годин, нагрівають до кімнатної температури протягом останньої години, і одержують сполуку формули IX. Сполуку формули IX змішують з метансульфоновою кислотою в апротонному розчиннику, переважно в суміші ацетону і 1-метил-2-піролідону, що переважно містить приблизно від 90% до 60% ацетону, і інше 1метил-2-піролідон, витримують при температурі від приблизно 40°С до приблизно 80°С протягом від приблизно 10 хвилин до приблизно 1 години і потім перемішують при температурі приблизно від 20°С до 30°С протягом приблизно від 3 годин до 6 годин, переважно, при температурі близько кімнатної протягом приблизно 5 годин за відсутності світла. Переважно, тверді речовини повторно суспендують в ацетоні протягом приблизно від 6 до 18 годин. Одержання солі можна також провести в тетрагідрофурані. При такому виборі розчинника переважно провести повторне суспендування в 95%-ному етанолі. Початкові речовини і реагенти для описаних вище сполук також легко доступні або можуть бути легко синтезовані фахівцями в даній області з використанням звичайних методів органічного синтезу. Наприклад, багато які сполуки, використані тут, є родинними природним сполукам, або одержані з природних сполук, які представляють великий науковий інтерес і комерційну цінність, і, відповідно до цього, багато які такі сполуки є в продажу або описані в літературі, або їх легко одержати з інших загальнодоступних речовин за допомогою методів, які описані в літературі. Безводну кристалічну форму (D) сполуки даного винаходу можна одержати, проводячи взаємодію ацетонового розчину N-(5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл) гуанідину і N-метилпіролідону з метансульфокислотою при температурі від приблизно 30°С до приблизно 60°С, переважно, близько 50°С, протягом від приблизно 1 до приблизно 10 годин, звичайно з подальшим охолоджуванням при перемішуванні до температури приблизно 5°С, переважно, менше за 10°С. Альтернативними розчинниками є органічні розчинники, такі як метанол, етанол і ізопропанол. Як прийнято, продукт фільтрують і сушать при 55°С-60°С протягом від 24 до 72 годин доти, поки вміст розчинника, що визначається газохроматографічно, не стане меншим або рівним 0,5%. Безводну кристалічну форму (А) сполуки даного винаходу можна одержати із згаданої вище кристалічної форми D шляхом повторного суспендування (тобто змішування суспензії частково розчиненої речовини) в ацетоні при температурі від приблизно 20°С до приблизно 25°С, переважно, приблизно при кімнатній температурі, при перемішуванні протягом від приблизно 2 годин до приблизно 24 годин, звичайно з подальшою сушкою при температурі приблизно від 30°С до 60°С. Альтернативними розчинниками є інертні розчинники, такі як ацетонітрил, етилацетат і тетрагідрофуран. Напівгідратну кристалічну форму (С) сполуки даного винаходу можна одержати з форми А 90%-ної чистоти (яка ймовірно містить як домішку димезилат N-(5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4карбоніл)гуанідину) шляхом повторного суспендування в етанолі або в суміші ізопропанол/вода при температурі від приблизно 20°С до приблизно 25°С, переважно, при кімнатній температурі протягом від приблизно 2 годин до приблизно 24 годин, переважно, при перемішуванні. Звичайно суміш містить від приблизно 85% до приблизно 95% етанолу і від приблизно 5% до приблизно 15% води. Переважно відношення етанолу до води дорівнює 91%:9%. Альтернативними розчинниками є суміші органічних розчинників, таких як ацетонітрил, ацетон, тетрагідрофуран, етилацетат, з водою, що містять від 5 до 10% води. У наступній таблиці приведені важливі властивості чотирьох форм мономезилату М-(5-циклопропіл-1хінолін-5-іл-1H-піразол-4-карбоніл)гуанідину: аморфної, двох безводних кристалічних форм (А і D) і напівгідратної кристалічної форми. Таблиця 1 Форма Точка плавлення (початок плавлення) Аморфна А; приклад 228°С Характерні особливості Примітка Аморфний порошок Ізометричні Найбільш кристали стабільна 6 безводна форма D; Стабільна Ізометричні 215°С приклад безводна кристали 5 форма Напівгідрат, С; 140-170°С при Ізометричні приклад (десольватація) дегідратації кристали 209°С 7 перетворюєтьс я в форму D Фахівці в даній області знають, що сіль формули І може існувати в декількох таутомерних формах. Всі такі таутомерні форми розглядаються як частина даного винаходу. Наприклад, всі таутомерні форми карбонілгуанідинової групи в молекулі солі формули І включені в даний винахід. Будь-який інгібітор альдозоредуктази можна використати як другу сполуку (активний агент) даного винаходу для комбінованої терапії. Термін «інгібітор альдозоредуктази» відноситься до сполук, яка інгібують біоконверсію глюкози в сорбіт, що каталізується ферментом альдозоредуктозою. Таке інгібування легко можуть визначити фахівці в даній області за допомогою стандартних аналізів (J.Malone, Diabetes, 29:861-864, 1980. "Red Cell Sorbitol, an Indicator of Diabetic Control"). Цілий ряд різних інгібіторів альдозоредуктази відомий фахівцям в даній області. Можна використати кількість інгібітору альдозоредуктази, яка ефективна для дії даного винаходу. Звичайно ефективна доза інгібіторів альдозоредуктази у винаході знаходиться в межах від приблизно 0,1мг/кг на добу до 100мг/кг на добу в єдиній або розділених дозах, переважно, від 0,1мг/кг на добу до 20мг/кг на добу в єдиній або розділених дозах. Будь-який інгібітор фосфорилази глікогену можна використати як другу сполуку даного винаходу. Термін «інгібітор фосфорилази глікогену» відноситься до речовини або агента або до будь-якої комбінації речовин і/або агентів, які зменшують, сповільнюють або усувають ферментативну дію фосфорилази глікогену. Відома в цей час ферментативна дія фосфорилази глікогену полягає в розщепленні глікогену за допомогою каталізу оборотної реакції макромолекули глікогену з неорганічним фосфатом з утворенням глюкоза-1-фосфату і макромолекули глікогену, яка на один глюкозний залишок коротше, ніж початкова макромолекула глікогену (в напрямі глікогенолізу). Така дія легко визначається фахівцями в даній області за допомогою стандартних аналізів. Цілий ряд таких сполук описаний в наступних опублікованих міжнародних заявках: міжнародні публікації W096/39384 і W096/39385. Однак фахівцям в даній області можуть бути відомі і інші інгібітори фосфорилази глікогену. Звичайно ефективні дози інгібітору фосфорилази глікогену для фармацевтичних комбінованих композицій даного винаходу, наприклад, комбінованих композицій, активних в зменшенні ішемічного пошкодження, що містять сполуки, які є інгібіторами фосфорилази глікогену, знаходяться в інтервалі від 0,005 до 50мг/кг на добу, переважно, від 0,01 до 25мг/кг на добу і, найбільш переважно, від 0,1 до 15мг/кг на добу. Фахівцям в даній області може бути відомо, що інші серцево-судинні засоби, наприклад, b-блокатори (ацебутолол, атенолол, бопіндолол, лабетолол, мепіндолол, надолол, окспренол, піндолол, пропранолол, соталол), блокатори кальцієвих каналів (наприклад, амплодипін, ніфедипін, нізолдипін, нітрендипін, верапаміл), інгібітори АСЕ (наприклад, каптоприл, еналаприл), нітрат (наприклад, динітроізосорбід, 5мононітроізосорбід, тринітрогліцерин), діуретики (наприклад, гідрохлортіазид, індапамід, піретанід, ксипамід), глікозиди (наприклад, дигоксин, метилдигоксин), тромболітики (наприклад, tPA), інгібітори тромбоцитів (наприклад, реопро), аспірин, дипіридамол, хлорид калію, клонідин, празозин, інгібітори альдозоредуктази (наприклад, зополрестат) і агоністи рецептора аденозину А3 можуть бути використані разом з кристалічними сполуками даного винаходу.) Кристалічні сполуки даного винаходу інгібують транспортну систему з обміном натрій/протон (Na+/H+), і, отже, їх можна використати як терапевтичний або профілактичний засіб для захворювань, викликаних прискоренням обміну натрій/протон (Na+/H+) в транспортній системі, наприклад, серцево-судинних захворювань [наприклад, артеріосклерозу, гіпертензії, аритмії (наприклад, ішемічної аритмії, аритмії, викликаної інфарктом міокарда, аритмії після РТСА або після тромболізу, і т.д.), стенокардії, гіпертрофії серця, інфаркту міокарда, серцевої недостатності (наприклад, застійної серцевої недостатності, гострої серцевої недостатності, гіпертрофії серця і т.д.), рестенозу після РТСА, шоку (наприклад, геморагічного шоку, ендотоксинового шоку і т.д.)], захворювань нирок (наприклад, цукрового діабету, діабетичної нефропатії, ішемічної гострої ниркової недостатності і т.д.), порушень роботи органів, пов'язаних з ішемією або з ішемічної реперфузією [(наприклад, порушень, пов'язаних з ішемічною реперфузією серцевого м'яза, гострої ниркової недостатності, або порушень, викликаних хірургічними операціями, такими як шунтування коронарної артерії (CABG), операції на судинах, трансплантація органів, операції не на серці або ангіопластика для збільшення просвіту коронарної артерії (РТСА)], порушень мозкового кровообігу (наприклад, ішемічного інсульту, геморагічного інсульту і т.д.) мозкових ішемічних порушень (наприклад, порушень, пов'язаних з інфарктом мозку, порушень, що є ускладненнями після крововиливу в мозок, або набряку мозку). Кристалічні сполуки даного винаходу можна використати як засіб для захисту міокарда під час операції шунтування коронарної артерії (CABG), операції на судинах, ангіопластики для збільшення просвіту коронарної артерії (РТСА), трансплантації органів або хірургічних операцій не на серці. Переважно, кристалічні сполуки даного винаходу можна використати як засоби для захисту міокарда до, під час і після хірургічних операцій шунтування коронарної артерії (CABG), операцій на судинах, ангіопластики, для збільшення просвіту коронарної артерії (РТСА), трансплантації органів або хірургічних операцій не на серці. Переважно, кристалічні сполуки даного винаходу можна використати як засоби для захисту міокарда у пацієнтів, що поступають з серцевими (гострі коронарні синдроми, наприклад, інфаркт міокарда або нестабільна стенокардія) або мозковими ішемічними порушеннями, що продовжуються (наприклад, інсульт). Переважно, кристалічні сполуки даного винаходу можна використати як засоби для постійного захисту міокарда у пацієнтів з діагностованою коронарною хворобою серця (наприклад, попередній інфаркт міокарда або нестабільна стенокардія) або у пацієнтів, з високим ризиком інфаркту міокарда (наприклад, вік більше за 65 років і наявність двох або більше чинників ризику для коронарної хвороби серця). Крім того, кристали даного винаходу примітні тим, що володіють сильною інгібуючою дією на проліферацію клітин, наприклад, на проліферацію фібробластів і клітин гладких м'язів кровоносних судин. З цієї причини кристали даного винаходу є цінним терапевтичним засобом для використання при захворюваннях, первинною або вторинною причиною яких є проліферація клітин, і тому можуть бути використані як антіатеросклеротичні засоби, і як засоби проти пізніх ускладнень при діабеті, ракових захворювань, фіброзних захворювань, таких як фіброз легенів, фіброз печінки або фіброз нирок, гломерулярний нефросклероз, гіпертрофія або гіперплазія органів, особливо, гіперплазія або гіпертрофія простати, фіброз легенів, ускладнення при діабеті або структура, що є рецидивом після РСТА, або захворювання, викликані пошкодженням ендотеліальних клітин. Корисність кристалічних сполук даного винаходу як лікарських засобів при лікуванні захворювань, таких як детально описані тут захворювання, у ссавців (наприклад, людини), наприклад, захист міокарда під час хірургічної операції, або захист міокарда у пацієнтів з серцевими або мозковими ішемічними порушеннями, що постійно повторюються, або постійний захист серця у пацієнтів з діагностованою коронарною хворобою серця, продемонстрований шляхом визначення активності кристалічних сполук даного винаходу в звичайних преклінічних випробуваннях на захист серця (cardioprotection) [див. випробування in vivo в роботі Klein, Η. et al., Circulation, 92:912-917 (1995); випробування на ізольованому серці в роботі Scholz, W. et al., Cardiovascular Research, 29:260-268 (1995); випробування на протиаритмійну активність в роботі Yasutake Μ. et al., Am. J.Physiol., 36:H2430-H2440 (1994); аналіз методом ЯМР в роботі Koike et al., J.Thorac. Cardiovasc. Surg. 112:765-775 (1996). Такі випробування також забезпечують засоби, за допомогою яких активність кристалічних сполук даного винаходу можна порівнювати з активністю інших відомих кристалічних сполук. Результати таких порівнянь можна використати для визначення величини доз для ссавців, в тому числі людини, при лікуванні таких захворювань. Введення кристалічних сполук даного винаходу можна здійснювати будь-яким способом, який дає можливість доставити кристалічні сполуки даного винаходу переважно в бажану тканину (наприклад, в тканині печінки і/або серця). Такими способами є способи застосування пер орально, парентерально, інтрадуоденально і т.д. Звичайно кристалічні сполуки даного винаходу застосовують у вигляді однократної дози (наприклад, один раз на добу) або декількох доз, або за допомогою постійного вливання, наприклад, в ізотонічному фізіологічному розчині. Кристалічні сполуки даного винаходу можна застосовувати, наприклад для зменшення або мінімізації пошкодження безпосередньо в будь-якій тканині, яка може зазнавати ішемічної/реперфузійної поразки (наприклад, тканини серця, мозку, легенів, нирок, печінки, кишечнику, скелетних м'язів, сітчатки) внаслідок ішемічного приступу (наприклад, інфаркту міокарда). Тому активну сполуку корисно використати профілактично, щоб попередити, тобто ослабити або затримати (профілактично або в майбутньому) пошкодження тканини (наприклад, тканини міокарда) у пацієнтів, які схильні до ризику ішемії (наприклад, ішемії міокарда). Звичайно кристалічні сполуки даного винаходу застосовують перорально або парентерально (наприклад, внутрішньовенно, внутрішньом'язово, підшкірно або інтрамедулярно). Місцеве застосування також може бути показане, наприклад, коли хворий страждає від шлунково-кишкових порушень, або завжди, коли лікарський засіб краще усього наносити на поверхню тканини або органу, як визначає лікуючий лікар. Кількість і час прийому кристалічних сполук, що застосовуються, звичайно, буде залежати від індивідуальних особливостей хворого, якому призначено лікування, від важкості хвороби, від способу застосування і від рішення лікаря, що виписує ліки. Таким чином, внаслідок відмінностей між пацієнтами, дози, приведені нижче, служать для загального керівництва, і лікар може визначати дози ліків, щоб забезпечити лікування, яке лікар вважає відповідним для пацієнта. При розгляді бажаної інтенсивності лікування, лікар повинен зважувати різні чинники, такі як вік пацієнта, наявність попередніх захворювань, а також наявність інших захворювань (наприклад, серцево-судинного захворювання). Так, наприклад, при одному способі застосування, кристалічні сполуки даного винаходу можна застосовувати безпосередньо перед операцією на серці (наприклад, протягом двадцяти чотирьох годин перед операцією), під час і після операції на серці (наприклад, протягом двадцяти чотирьох годин після операції), коли існує ризик ішемії міокарда. В особливо переважному способі проводять вливання з ударною дозою від приблизно 1мг до приблизно 300мг протягом від приблизно 1 хвилини до приблизно 1 години перед операцією і потім постійне вливання від приблизно 1мг/кг на добу до приблизно 100мг/кг на добу в час, що залишився до операції, під час операції і в післяопераційний період, включаючи, наприклад, приблизно від 2 до 7 діб післяопераційного лікування. Сполуки даного винаходу можна також застосовувати постійно кожний день. Використовують таку кількість кристалічних сполук даного винаходу, яка ефективна для захисту від ішемії. Переважна доза кристалічних сполук даного винаходу складає приблизно від 0,001 до 100мг/кг на добу. Особливо переважна доза кристалічних сполук даного винаходу складає приблизно від 0,01 до 50мг/кг на добу. Кристалічні сполуки даного винаходу звичайно застосовують у вигляді фармацевтичної композиції, що містить, принаймні, одну з кристалічних сполук даного винаходу з фармацевтично прийнятним розчинником або розріджувачем. Таким чином, кристалічні сполуки даного винаходу можна застосовувати індивідуально або спільно в будь-якій звичайній лікарській формі для перорального, парентерального, ректального введення або введення через шкіру. Для перорального введення фармацевтична композиція може мати форму розчинів, суспензій, таблеток, пілюль, капсул, порошків і т.п. Таблетки, що містять різні наповнювачі, такі як цитрат натрію, карбонат кальцію і фосфат кальцію, використовують разом з різними дезінтегруючими добавками, такими як крохмаль, переважно картопляний крохмаль або крохмаль з тапіоки, і деякі комплексні силікати поряд зі зв'язуючими речовинами, такими як полівінілпіролідон, сахароза, желатин і акація. Крім того, для таблетування часто дуже корисні мастячі речовини, такі як стеарат магнію, лаурилсульфат натрію і тальк. Тверді композиції аналогічного типу також використовують як наповнювачі в м'яких і твердих наповнених желатинових капсулах; в зв'язку з цим переважними речовинами є також лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі. Коли для перорального застосування бажані водні суспензії і/або еліксири, сполуки даного винаходу можна змішувати з різними підсолоджувачами, смаковими ароматизаторами, барвниками, емульгаторами і/або суспендуючими речовинами, а також з такими розріджувачами, як вода, етанол, пропіленгліколь, гліцерин і їх різні поєднання. Для парентерального застосування можна використовувати розчини, наприклад, в кунжутному або арахісовому маслі або у водному пропіленгліколі, а також стерильні водні розчини відповідних водорозчинних солей. У такі водні розчини, якщо необхідно, можна додавати відповідні буферні речовини, і рідкий розріджувач спочатку роблять ізотонічним, додаючи достатню кількість сольового розчину або глюкози. Такі водні розчини є особливо відповідними для внутрішньовенних, внутрішньом'язових, підшкірних і внутрішньочеревних ін'єкцій. У зв'язку з цим, всі стерильні водні середовища, що використовуються можна легко одержати по стандартних методиках, добре відомих фахівцям в даній області. Для введення через шкіру (наприклад, місцевого) готують розбавлені стерильні водні або частково водні розчини (звичайно з концентрацією приблизно від 0,1% до 5%), в іншому аналогічні згаданим вище парентеральним розчинам. Способи приготування різних фармацевтичних композиції з певною кількістю активного інгредієнта відомі або можуть стати очевидними з даного опису, фахівцям в даній області. Приклади способів приготування фармацевтичних композицій див. Remington's Pharmaceutical Sciences, Mack Publ1Shing Company, Easter, Pa., 15th Edition (1975). Фармацевтичні композиції відповідно до винаходу можуть містити, наприклад, 0,0001%-95% сполуки (сполук) даного винаходу. У будь-якому випадку композиція, що застосовується або склад буде містити кристалічні сполуки відповідно до винаходу в кількості, ефективній для лікування захворювання/стану хворого, якому необхідно лікування. Кристалічні сполуки даного винаходу звичайно можуть застосовуватися у вигляді відповідного складу. Наступні приклади складів є лише ілюстративними і не мають на увазі обмежувати об'єм даного винаходу. У складах, які приведені нижче, «активний інгредієнт» означає сполуку(и) (кристали) даного винаходу. Склад 1: Желатинові капсули Тверді желатинові капсули одержували, використовуючи наступні інгредієнти: Кількість (мг/капсула) Активний інгредієнт 0,25-100 Крохмаль, NF 0-650 Крохмаль, сипучий порошок 0-50 Силіконова рідина, 350 сантистокс 0-15 Інгредієнт Склад для таблеток одержували, використовуючи інгредієнти, вказані нижче: Склад 2: Таблетки Інгредієнт Активний інгредієнт Целюлоза, мікрокристалічна Діоксид кремнію, колоїдний Стеаринова кислота Кількість (мг/таблетка) 0,25-100 200-650 10-650 5-15 Компоненти змішували і пресували в формі таблеток. Альтернативно, таблетки, із вмістом в кожній 0,25100мг активних інгредієнтів, мали наступний склад: Склад 3: Таблетки Інгредієнт Активний інгредієнт Крохмаль Целюлоза, мікрокристалічна Полівінілпіролідон (10%-ний розчин у воді) Натрієва сіль карбоксиметилцелюлози Стеарат магнію Тальк Кількість (мг/таблетка) 0,25-100 45 35 4 4,5 0,5 1 Активний інгредієнт, крохмаль і целюлозу просівали через сито №45 міш (США) і ретельно змішували. Розчин полівінілпіролідону змішували з одержаними порошками і суміш потім пропускали через сито №14 міш (США). Одержані гранули сушили при 50°-60°С і просівали через сито №18 міш (США). Натрієву сіль карбоксиметилцелюлози, стеарат магнію і тальк, заздалегідь просіяні через сито №60 (США), потім додавали до гранул, які після змішування пресували на таблетуючій машині і одержували таблетки. Суспензії, що містять кожна 0,25-100мг активного інгредієнта в 5мл дозі одержували таким чином: Склад 4: Суспензії Інгредієнт Активний інгредієнт Натрієва сіль карбоксиметилцелюлози Сироп Розчин бензойної кислоти Ароматизатор Барвник Очищена вода до Кількість (мг/5мл) 0,25-100мг 50мг 1,25мг 0,10мл Змінна кількість (q.v.) Змінна кількість (q.v.) 5мл Активний інгредієнт просівали через сито №45 міш (США) і змішували з натрієвою сіллю карбоксиметилцелюлози і сиропом, одержуючи однорідну пасту. Розчин бензойної кислоти, ароматизатор і барвник розбавляли невеликою кількістю води і додавали при перемішуванні. Потім додавали достатню кількість води для одержання необхідного об'єму. Розчин для аерозолю готували з наступним складом інгредієнтів: Склад 5: Аерозоль Інгредієнт Активний інгредієнт Етанол Пропелент 22 (хлордифторметан) Кількість (мас. %) 0,25 25,75 74,00 Активний інгредієнт змішували з етанолом і суміш додавали до частини пропеленту 22, охолоджували до 30°С і переносили в заливальний пристрій. Потім необхідну кількість заливали в балон з неіржавіючої сталі і розбавляли пропелентом, що залишився. Потім на балон встановлювали клапанний вузол. Супозиторії готували таким чином: Склад 6: Супозиторії Інгредієнт Активний інгредієнт Гліцериди насичених жирних кислот Кількість (мг/супозиторій) 250 2000 Активний інгредієнт просівали через сито №60 міш (США) і суспендували в гліцеридах жирних кислот, розплавлених з використанням мінімально необхідного тепла. Суміш потім заливали в форму для одержання супозиторію з номінальною місткістю 2 г і давали вихолонути. Склад для внутрішньовенного застосування одержували таким чином: Склад 7: Розчин для внутрішньовенних ін'єкцій Інгредієнт Активний інгредієнт Ізотонічний сольовий розчин Кількість 25мг 1000мл Розчин вказаних вище інгредієнтів вводять пацієнту внутрішньовенно. Активний інгредієнт, вказаний вище, може також являти собою суміш активних речовин. Приклад 1 Метил-3-циклопропіл-3-оксопропаноат (15г, 106ммоль, 1екв.) і Ν,Ν-диметилформамід-диметилацеталь (14,7мл, 111ммоль, 1,05екв.) нагрівали при 75°С протягом 1,5 години в атмосфері N2. Оранжеве масло потім охолоджували до кімнатної температури. Аналіз методом ТШХ (1:1 EtOАс/гексан) показав зникнення початкової речовини і появу менш полярної плями меншого розміру і більш полярної плями більшого розміру (метил-3-циклопропіл-2-диметиленаміно-3-оксопропаноату). Неочищену суміш використали як таку на наступній стадії без додаткової обробки. Приклад 2 Неочищений метил-3-циклопропіл-2-диметиленаміно-З-оксопропаноат (20,9г, 106ммоль, 1,07екв.) розбавляли етанолом (250мл). Додавали триетиламін (34,4мл, 247ммоль, 2,5екв.) і потім услід за ним хінолін5-іл-гідразин (22,9г, 98,6ммоль, 1екв.). При доданні хінолін-5-іл-гідразину спостерігалося невелике виділення газу. Одержану гетерогенну суміш нагрівали при температурі кипіння із зворотним холодильником (78°С) в атмосфері N2 протягом 2 годин. Суміш ставала гомогенною і дуже темною приблизно після 3хв. нагрівання. Суміш потім охолоджували до кімнатної температури. Аналіз методом ТШХ (1:1 EtOАс/гексан) показав наявність трохи менш полярної плями (метиловий ефір 5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбонової кислоти). Мас-спектр (АРСІ) також показав утворення бажаного продукту. Потім реакційну суміш концентрували. До залишку додавали EtOАс (300мл) і 0,1н НСl (400мл). Емульсію, що утворилася перемішували 10 хв. при кімнатній температурі і потім фільтрували через шар целіту для видалення твердих речовин. Одержану двофазну суміш розділяли. Водний шар екстрагували EtOАс (2x300мл). Об'єднані органічні шари промивали 0,1н НСl (2x300мл), потім сушили над сульфатом натрію і концентрували. До залишку додавали гарячий ізопропіловий ефір (80мл). Каламутний розчин перемішували протягом 2хв. Потім додавали гексан (125мл). Суміш залишали на ніч для грануляції твердих речовин. Тверді речовини збирали шляхом фільтрування і одержували продукт метиловий ефір 5-циклопропіл-1-хінолін-5-іл-1Н-піразол-4карбонової кислоти у вигляді оранжево-жовтого порошку (20,8г, 72% з двох стадій). Приклад 3 До розчину метилового ефіру 5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбонової кислоти (20г, 68,2ммоль, 1екв.) в МеОН (120мл) додавали 2н NaOH (54,5мл, 109ммоль, 1,6екв.). Одержаний розчин кип'ятили із зворотним холодильником (65°С) протягом 1,5 години в атмосфері N2 і потім давали вихолонути до кімнатної температури. Аналіз методом ТШХ (1:1 EtOАс/гексан) показав зникнення початкової речовини. Метанол видаляли у вакуумі при м'якому нагріванні (35°С) в роторному випарнику. Лужний водний шар потім промивали EtOАс (2x100мл). Після цього лужний водний шар повільно підкисляли до рН 1-2 концентрованою НСl. При підкисленні продукт випадав в осадок. Суспензію перемішували при кімнатній температурі протягом 0,5 годин, потім тверду речовину відділяли фільтруванням. Тверду речовину промивали 1н НСl (2x25мл) і сушили; одержали кислоту у вигляді блідо-коричневої твердої речовини (18,8г, 99%). Приклад 4 До суспензії 5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбонової кислоти (25г, 89,5ммоль, 1екв.) в толуолі (250мл) при перемішуванні додавали тіонілхлорид (32,6мл, 448ммоль, 5екв.). Одержану суспензію нагрівали при 75°С протягом 1,5 годин в атмосфері N2. Реакційна суміш весь час залишалася гетерогенною. Твердий хлорангідрид кислоти виділяли фільтруванням. Жовтувато-коричневий твердий продукт промивали толуолом (3x50мл) і сушили у вакуумі. Суспензію хлорангідриду кислоти в ТГФ (250мл) охолоджували до 0°С. Додавали розчин гідрохлориду гуанідину (17,1г, 179ммоль, 2екв.) і 2н NaOH (224мл, 448ммоль, 5екв.) з краплинної лійки протягом 5-10хв. в атмосфері N2. Реакційна суміш при доданні лужного водного розчину гуанідину ставала гомогенною і двофазної. Суміш перемішували при 0°С при повільному нагріванні до кімнатної температури протягом 1 години і потім ще протягом 1 години при кімнатній температурі. Аналіз методом ТШХ (4:1 дихлорметан/метанол) показав присутність більш полярної плями (N-(5-циоопропіл-1-хінолін-5-іл-1Н-піразол4-карбоніл)гуанідину) і слідів початкової кислоти. ТГФ видаляли у вакуумі при слабому нагріванні (3 5°С), що приводило до осадження продукту. Водний шар перемішували при кімнатній температурі протягом 1 години, щоб гранулювати продукт. Тверду речовину виділяли фільтруванням, промивали водою (2x50мл) і сушили. Колір продукту змінювався в різних дослідах від майже білого до середньо-коричневого. Даний продукт був середньо-коричневим. Після повторного суспендування в МеОН (125мл) протягом 30хв. одержали бажаний продукт-(N-(5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл)гуанідин (22,6г, вихід 79%) у вигляді речовини слабого жовтувато-коричневого кольору. Приклад 5 N-(5-Циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл) гуанідин (3,08кг, 9,61ммоль, 1екв.) суспендували в ацетоні (30,8кг). Додавали 1-метил-2-піролідон (12,3кг) для одержання гомогенного розчину. Додаткові 4,8кг ацетону використали для подальшої промивки (особливо після фільтрування). Реакційний розчин нагрівали до 50°С. Додавали розчин метансульфокислоти (0,83кг, 8,65 моль, 0,9екв.) в ацетоні (8,3кг), підтримуючи температуру нижче за 55°С. Одержану суспензію перемішували при 50°С протягом 1-2 годин, потім охолоджували і фільтрували. Осадок на фільтрі промивали ацетоном і потім сушили; одержали мономезилат (N-(5-циклопропіл-1-хінолін-5-іл-1H-піразол-4-карбоніл)гуанідину (3,24кг, 81%) у вигляді майже білої твердої речовини. Продукт потім сушили у вакуумі і одержали безводні кристали, що мають наступні властивості (форма D). Дані мікроскопії: двопроменевозаломнювальні пластинки/ізометричні кристали. Міра кристалічності: повністю кристалічні. Гігроскопічність: негігроскопічні. Зовнішній вигляд: майже біла кристалічна тверда речовина. Точка плавлення: 215°С (температура початку плавлення при швидкості нагріву 5°С/хв.). Рентгенографічні дані-величини міжплощинних відстаней приведені в наступній нижче таблиці II. Таблиця II Форма D Анод: Сu-довжина хвилі 1: 1,54056, довжина хвилі 2: 1,5443 (відносна інтенсивність: 0,500) Інтервал #1-об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00с; згладжена ширина піка 0,300; поріг 1,0 Міжплощинна відстань d(Ấ) 27,24671 23,73093 16,16249 13,22989 11,97180 8,70523 Інтенсивність l (відносна) 2,8 2,2 100,0 1,7 1,5 1,2 Міжплощинна відстань d (Ấ) 5,99091 5,63525 5,47164 5,27699 5,17064 5,03666 Інтенсивність l (відносна) 6,0 25,5 11,5 39,9 18,3 22,4 Міжплощинна відстань d(Ấ) 4,00874 3,92839 3,69629 3,60428 3,55640 3,47039 Інтенсивність l (відносна) 26,0 6,2 10,3 7,4 23,3 9,6 8,06940 7,82513 7,25205 6,70670 6,9 7,2 8,4 10,2 Міжплощинна відстань d(Ấ) 3,21953 3,13686 3,09315 2,98181 2,91078 2,85527 2,73317 2,68209 2,64423 4,81802 4,46748 4,17294 4,06613 Інтенсивність l (відносна) 5,2 4,7 2,5 10,2 4,2 3,6 3,4 5,6 2,6 24,0 17,0 62,7 10,7 3,40872 3,35011 3,26503 Міжплощинна відстань d(Ấ) 2,58367 2,55540 2,51395 2,46750 2,40342 2,36976 2,33468 2,30520 2,26652 12,2 12,3 3,6 Інтенсивність l (відносна) 2,4 2,3 3,1 2,4 2,1 2,5 4,3 2,6 1,5 Приклад 6 До 3,165кг продукту прикладу 5 додавали 123л (3,8 об'ємів) ацетону. Суспензію перемішували 20 годин при кімнатній температурі. Суспензію фільтрували і твердий осадок сушили при 50°С. Продукт являв собою безводні кристали (3,145кг, 99%) (Форма А) з наступними властивостями. Мікроскопія: двопроменевозаломнювальні ізометричні кристали. Міра кристалічності: повністю кристалічний. Гігроскопічність: негігроскопічний. Зовнішній вигляд: біла кристалічна тверда речовина. Точка плавлення: 228°С (температура почала плавлення при швидкості нагріву 5°С/хв.). Рентгенографічні дані-міжплощинні відстані d приведені в наступній нижче таблиці III. Таблиця III Форма А Анод: Сu-довжина хвилі 1: 1,54056, довжина хвилі 2: 1,5443 (відносна інтенсивність: 0,500) Інтервал #1-об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 с; згладжена ширина піка 0,300; поріг 1,0 Міжплощинна відстань d(Ấ) 12,78805 10,11984 9,54998 8,48106 8,06059 7,40035 6,90891 6,78458 6,39441 Інтенсивність l (відносна) 75,6 0,9 1,0 10,5 32,3 3,7 9,9 7,1 37,1 Міжплощинна відстань d(Ấ) 3,13360 3,05819 2,98863 2,92559 2,90063 2,87377 2,80412 2,67941 Міжплощинна відстань d (Ấ) 5,98486 5,74817 5,44162 5,17467 4,88694 4,80505 4,71329 4,64163 4,47485 Інтенсивність l (відносна) 28,1 7,2 6,2 4,5 3,7 3,5 3,0 5,6 Інтенсивність l (відносна) 14,5 7,7 25,8 6,2 19,8 6,4 12,3 8,3 17,2 Міжплощинна відстань d(Ấ) 4,40968 4,26077 3,99060 3,70101 3,56895 3,45647 3,39599 3,28501 3,19673 Міжплощинна відстань d(Ấ) 2,64749 2,58618 2,55874 2,51058 2,44154 2,37704 2,31951 2,29666 Інтенсивність l (відносна) 9,1 35,9 100,0 9,6 10,0 18,9 4,3 14,3 8,2 Інтенсивність l (відносна) 3,2 5,7 3,4 3,5 3,9 2,5 3,9 3,1 Приклад 7 До 0,25г зразку форми А приблизно 90%-ної чистоти (яка ймовірно містить як домішку димезилат (N-(5циклопропіл-1-хінолін-5-іл-1Н-піразол-4-карбоніл)гуанідину) додавали 1мл етанолу (етанол містив ~9% води). Суспензію потім перемішували протягом близько 21 години при кімнатній температурі і тверду речовину сушили при 50°С у вакуумі протягом 90 хвилин; одержали кристали напівгідрату (Форма С) з наступними властивостями. Мікроскопія: двопроменевозаломнювальні ізометричні кристали. Міра кристалічності: повністю кристалічна речовина. Зовнішній вигляд: кристалічна тверда речовина кремового кольору. Точка плавлення: десольватація при 140°С-170°С, 209°С (температура початку плавлення при швидкості нагріву 5°С/хв.). Рентгенографічні дані-міжплощинні відстані d приведені в наступній нижче таблиці IV. Таблиця IV Форма С Анод: Сu-довжина хвилі 1: 1,54056, довжина хвилі 2: 1,54439 (відносна інтенсивність: 0,500) Інтервал #1-об'єднаний: 3,000-40,000°; розмір кроків сканування 0,040°; час сканування 1,00 з; згладжена ширина піка 0,300; поріг 1,0 Міжплощинна відстань d(Ấ) 23,84363 12,75285 11,42066 10,47264 9,13265 8,46986 8,04025 7,37462 6,89800 6,74243 6,38235 Інтенсивність l (відносна) 3,0 26,7 5,6 100, 1,9 18,7 35,7 5,9 12,8 7,2 13,6 Міжплощинна відстань d(Ấ) 3,27809 3,13075 3,09826 3,05034 2,98350 2,91868 2,87199 2,81359 2,74383 2,70966 Міжплощинна відстань d(Ấ) 6,20370 5,99047 5,74421 5,43344 5,18281 5,07621 4,89018 4,78821 4,71228 4,64604 4,47029 Інтенсивність l (відносна) 15,2 17,6 9,4 6,9 7,9 5,5 4,6 5,5 5,0 3,2 Інтенсивність l (відносна) 8,0 16,8 12,1 17,7 8,5 4,8 13,8 9,9 11,1 11,8 14,6 Міжплощинна відстань d(Ấ) 4,39823 4,25862 4,11140 3,98950 3,81556 3,70622 3,60428 3,56411 3,50634 3,45643 3,38053 Міжплощинна відстань d(Ấ) 2,67907 2,63333 2,58530 2,50819 2,46620 2,43972 2,38677 2,33708 2,31420 2,29162 Інтенсивність l (відносна) 21,9 15,7 6,0 78,6 8,6 13,3 8,4 15,8 14,5 22,6 10,5 Інтенсивність l (відносна) 5,1 4,0 6,0 3,7 6,4 4,6 4,7 4,3 3,9 3,3
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors crystals of sodium-hydrogen exchange of 1 type, a method for the preparation thereof (variants), a pharmaceuticalcomposition based thereon and a method for the reduction of tissue damage
Назва патенту російськоюКристаллы ингибитора натрий-водородного обмена 1 типа, способ их получения (варианты), фармацевтическая композиция на их основе и способ уменьшения повреждения ткани
МПК / Мітки
МПК: A61P 43/00, A61P 39/00, A61P 35/00, C07D 401/04, A61K 31/4709, A61P 13/08, A61P 3/10, A61P 11/00, B01D 9/02, A61P 41/00, A61P 9/10
Мітки: пошкодження, одержання, основі, типу, композиція, натрій-водневого, тканини, спосіб, фармацевтична, варіанти, кристали, зменшення, обміну, інгібітора
Код посилання
<a href="https://ua.patents.su/14-72002-kristali-ingibitora-natrijj-vodnevogo-obminu-1-tipu-sposib-kh-oderzhannya-varianti-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-zmenshennya-poshkodzhennya-tkanini.html" target="_blank" rel="follow" title="База патентів України">Кристали інгібітора натрій-водневого обміну 1 типу, спосіб їх одержання (варіанти), фармацевтична композиція на їх основі та спосіб зменшення пошкодження тканини</a>
Попередній патент: Косметичний пристрій
Наступний патент: Каталізатор для очищення газоподібних викидів, що містять пил
Випадковий патент: Фуркальний вимірювальний зонд